"ŻYWNOŚĆ, TECHNOLOGIA, JAKOŚĆ" 1(2),1995. Krystyna Palka STRUKTURALNE PODSTAWY TEKSTURY MIĘSA WPROWADZENIE STRUKTURA MIĘŚNIA
|
|
|
- Sabina Przybylska
- 7 lat temu
- Przeglądów:
Transkrypt
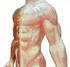
1 "ŻYWNOŚĆ, TECHNOLOGIA, JAKOŚĆ" 1(2),1995 Krystyna Palka STRUKTURALNE PODSTAWY TEKSTURY MIĘSA WPROWADZENIE K ruchość m ięsa jest jednym z najważniejszych wyróżników jakościowych w ocenie konsumenckiej, często decydującym o zaakceptowaniu mięsa jako produktu żywnościowego (9). Badania nad teksturą mięsa są prowadzone od wielu lat w różnych aspektach. Wyniki ocen subiektywnych są porównywane z wynikami obiektywnych badań instrumentalnych. Wszystkie definicje tekstury akcentują jej związek ze strukturą produktu. Na przykład jedna z definicji określa teksturę jako "zbiór właściwości wynikających z natury elementów struktury produktu żywnościowego i ich wzajemnego uporządkowania oraz sposobu w jaki są one odbierane i rejestrowane przez aparat zmysłowy człowieka" (40). Najszerzej akceptowana teoria utrzymuje, że skurcz miofibrylarny i wewnątrzmięśniowa tkanka łączna są podstawowymi czynnikami determinującymi fizyczne właściwości tkanki mięśniowej (20). W nowszych badaniach zwraca się uwagę, że także woda wewnątrztkankowa (13) i cytoszkielet mięśniowy (26,43) mogą mieć istotny wpływ na teksturę mięsa. Badania strukturalne dotyczą zwykle rozmieszczenia i wzajemnego uporządkowania elementów składowych oraz zmian w przestrzennym uporządkowaniu pod wpływem określonych zabiegów technologicznych. STRUKTURA MIĘŚNIA Mięsień szkieletowy zawiera w swym składzie około 75% wody, a w suchej masie około 70% białka, 10% tłuszczu, 3% polisacharydów i 5% soli (2). Struktura mięśnia jest bardzo złożona i zawiera około 15 głównych białek (37), tłuszcz, tkankę łączną, naczynia krwionośne i tkankę nerwową. Białka kurczliwe Mięsień otoczony omięsną zewnętrzną (epimysium), składa się z wiązek włókien mięśniowych pokrytych omięsną wewnętrzną (perymysium). Indywidualne włókna (komórki) mięśniowe otoczone endomysium mają średnicę w zakresie um oraz długość od kilku do 30 cm (4). Na średnicę włókien mięśniowych wpływa wiek zwierzęcia, praca, płeć, rasa, gatunek, sposób żywienia oraz rodzaj mięśnia. Włókna są zbudowane z delikatnych fibrylarnych elementów kurczliwych - miofibryli, które zajmują ponad 80% objętości komórki. Dr inż. Krystyna Palka, Katedra Przetwórstwa Produktów Zwierzęcych, Akademia Rolnicza w Krakowie.
2 "STRUKTURALNE PODSTAWY TEKSTURY M IĘSA" 9 Na przekroju włókna może być około 1000 miofibrylł o średnicy 1-2 um każdy (19).W mikroskopie fazowym miofibryle objawiają się jako występujące na przemian jasne i ciemne prążki. Prążkowanie powstaje wskutek obecności dwóch rodzajów filamentów - grubych (15 nm x 1.5 um) w prążkach A i cienkich (7 nm x 0.5 um) w prążkach I. W środku prążka A występuje linia M, a przez środek prążka I biegnie linia (dysk) Z. Podstawowym składnikiem filamentów grubych jest miozyna, a filamentów cienkich aktyna, tropomiozyna i troponina. Występuje poprzeczna periodyczność fibryli, a powtarzające się segmenty - sarkomery - są oddzielone przez dysk Z. Długości sarkomerów zależą od stanu skurczu mięśnia. W wypoczętym mięśniu Psoas ssaków długość ta wynosi około 2.6 um (4). Podczas skurczu mięśnia długość sarkomerów zmienia się o około 10-15% (2). Na przekroju poprzecznym miofibryli ułożenie filamentów jest heksagonalne, sześć cienkich otacza jeden gruby. Na kruchość mięsa może mieć wpływ rozmiar włókien, rozmiar wiązek włókien oraz ich rozciągliwość (45). Cytoszkielet mięśniowy Termin "cytoszkielet" oznacza system wewnątrzkomórkowych struktur, które utrzymują kształt komórki, łączą organelle między sobą i z błoną komórkową (19). Najważniejsze białka cytoszkieletowe to: konektyna (titina) i nebulina, które stabilizują filamenty i są zakotwiczone w dysku Z, oraz desmina i synemina, łączące miofibryle ze sobą i innymi strukturami komórkowymi, zlokalizowane peryferyjnie w stosunku do linii Z. Linia Z w dużym powiększeniu ma strukturę zygzakowatą, w której są zakotwiczone cienkie filamenty (48). Inną miofibrylarną strukturą są linie N, zlokalizowane w paśmie I, równoległe do linii Z. Są one prawdopodobnie zbudowane z białek o dużych ciężarach cząsteczkowych (29). Locker i wsp. (26, 27, 28) opisali morfologię tzw. filamentów G (ang. gap - filaments) i przedstawili model ich połączenia. Według tego modelu każdy filament G tworzy rdzeń w filamencie A symetrycznie względem linii Z. Jest prawdopodobne, że filamenty G są zbudowane z nebuliny i titiny. Strukturalne składniki miofibryli są zanurzone w sarkoplazmie. Wpływ białek sarkoplazmatycznych na kruchość mięsa może być związany z aktywnością proteolityczną niektórych z nich oraz ich obecnością w wycieku cieplnym (24). Tkanka łączna Tkanka łączna zawiera kolagenowe, elastynowe i retikulinowe włókna osadzone w amorficznej substancji podstawowej. Tkanka łączna mięsa jest funkcjonalnie rozdzielona w epimysium, perymysium i endomysium. Błony te są zbudowane głównie z kolagenu oraz niewielkich ilości elastyny. Są one elementem podtrzymującym i na końcu mięśnia przechodzą w ścięgna (2). Ogólna zawartość kolagenu w suchej masie większości mięśni jest niska i wynosi około 2-6% (25). Kolagen tworzy silne, nierozciągliwe włókna wokół wszystkich mięśni i struktury te są związane z tzw. "podstawową" twardością mięsa, natomiast wpływ elastyny ze względu na jej dużą rozciągliwość i bardzo małą ilość w mięśniu uważa się za nieistotny (2). Podstawową strukturalną jednostką kolagenu jest tropokolagen (280 nm x 1.5 nm; c.cząst ), zbudowany z trzech polipeptydowych łańcuchów o helikalnej strukturze, zwiniętych w kształt liny i ustabilizowanych
3 10 KRYSTYNA PALKA wewnątrzcząsteczkowymi wiązaniami sieciującymi (31). Jednostki tropokolagenu łączą się w formę włókien o charakterystycznym prążkowaniu co 67 nm. które są stabilizowane przez wiązania zewnątrzcząsteczkowe. Perymysium jest zbudowane z wielu warstw włókien kolagenowych ułożonych krzyżowo. Poszczególne warstwy działają prawdopodobnie indywidualnie i nie są ze sobą połączone. Przeciętna średnica włókien perymysium wynosi nm. Tworzą one wiązki o średnicy nm. Endomysium jest strukturą bardziej złożoną zawierającą błonę podstawową otoczoną matrycą bardzo delikatnych włókien kolagenowych o średnicy nm. Włókna endomysium nie tworzą wiązek. Amorficzna błona podstawowa jest bardzo cienka (10-20 nm) (3). Jest kilka typów genetycznych kolagenu, które mają różną strukturę. Typ I tworzy duże, silne włókna, podczas gdy typ III tworzy włókna cieńsze, często połączone z tkankami elastycznymi, typ IV nie tworzy włókien, a raczej sieć, a typ V prawdopodobnie bardzo delikatne włókna. Kolagen typu I i III wchodzi w skład epimysium, typ I i III i V znajduje się w perymysium, a typ I, III, IV i V w endomysium. Względne proporcje poszczególnych typów kolagenu w epi-, pery- i endomysium różnych mięśni są bardzo różne (3). WYBRANE CZYNNIKI DETERMINUJĄCE STRUKTURĘ I TEKSTURĘ MIĘSA Wiek zwierzęcia Istnieje zależność pomiędzy wiekiem ubijanego zwierzęcia i twardością mięsa - mięso pochodzące ze zwierząt starszych jest zwykle twardsze. Jest to prawdopodobnie związane z przemianami zachodzącymi wraz z wiekiem w strukturze kolagenu. Elementy kurczliwe nie mogą być odpowiedzialne za te zmiany ponieważ czas ich metabolicznej odbudowy (ang. turnover) jest krótki i wynosi około 12 dni. Natomiast kolagen ma bardzo długi czas metabolicznej odbudowy, co pozwala na usieciowanie i stabilizację wiązań (8). Usieciowanie kolagenu perymysium i endomysium koresponduje bardzo dobrze z teksturalną jakością mięsa (3). Zatem raczej "jakość" kolagenu niż jego ogólna zawartość jest ważnym czynnikiem wpływającym na kruchość mięsa. Pojęcie "jakość" obejmuje: typ kolagenu obecny na różnych poziomach struktury mięśnia, stabilność cieplną zewnątrzcząsteczkowych wiązań sieciujących, ogólne usieciowanie w kolagenowej matrycy mięśnia, rozmiar włókien i wiązek włókien kolagenowych oraz zmiany w kolagenie podczas kondycjonowania (3, 23). Wszystkie te parametry są ściśle związane z wiekiem zwierzęcia. Większość bydła jest ubijana po przekroczeniu pierwszego roku życia, kiedy to ciepłolabilne wiązania sieciujące kolagenu są zastępowane przez trwałe, ciepłostabilne wiązania (41). Kolagen z optymalną ilością wiązań sieciujących jest niezbędny do uzyskania akceptowanej przez konsumenta tekstury mięsa; zbyt mała ilość wiązań sieciujących powoduje dezintegrację struktury, a zbyt duże usieciowanie powoduje, że mięso jest twarde (2).
4 "STRUKTURALNE PODSTAWY TEKSTURY MIĘSA 11 Zmiany poubojowe W mięśniach post mortem zachodzą dwie najważniejsze zmiany: interakcja pomiędzy grubymi i cienkimi filamentami i lokalne zmiany konformacyjne w miozynie i aktynie. Konsekwencją tych zmian jest nierozciągliwość i stan napięcia w mięśniach - rigormortis, który wpływa na teksturę mięsa (24). Twardość mięsa jest związana ze stopniem skrócenia sarkomerów. Jeżeli warunki bezpośrednio post mortem zapobiegają skróceniu chłodniczemu (ang. cold shortening), wtedy główny udział w oporze na cięcie będzie miała tkanka łączna. Jeżeli warunki sprzyjają większym zmianom w miofibrylach, udział tkanki łącznej w twardości nie będzie tak istotny z powodu skróconego składnika aktomiozynowego (31, 32). W badaniach stwierdzono, że skrócenie wynoszące około 50% w temp. 0 C obniżało się do około 10% w zakresie temp C i znowu wzrastało przy około 20 C (30). W zrelaksowanym mięśniu długość sarkomerów wynosi około um. Kiedy zmniejszy się do około um twardość mięsa po ogrzewaniu wzrasta i osiąga maksimum przy długości um (wzrost twardości może być 3-4-krotny). Przy długości sarkomerów poniżej 1.2 um następuje uszkodzenie struktury i twardość maleje (42). Zatem zarówno czynniki przyżyciowe jak i skrócenie mięśni post mortem mają bardzo istotny wpływ na twardość mięsa. Skróceniu chłodniczemu zapobiega się przez zawieszanie tusz powodujące rozciąganie mięśni lub przez elektrostymulację (30, 34, 46). Najważniejsze jest jednak umiejętne schładzanie tusz po uboju. Gdy czas półchłodzenia (czas w którym różnica temperatur mięsa ciepłego z uboju i czynnika chłodniczego zmniejszy się o połowę) jest krótszy niż 8 godzin, istnieje ryzyko skrócenia chłodniczego mięśni (38). Dojrzewanie mięsa jest następnym bardzo istotnym etapem, który ma wpływ na mechaniczne właściwości mięśnia (4). Mięso dojrzewa zwykle w warunkach chłodniczych (1-6 C) przez określony czas.w tym czasie zachodzi naturalna proteoliza niektórych białek mięśniowych pod wpływem endogennych proteaz. Enzymy w największym stopniu włączone w te przemiany to CAF (ang. calcium activated factor - proteaza aktywowana wapniem) oraz katepsyny szczególnie B i D (16). W czasie dojrzewania mięsa następuje degradacja niektórych białek cytoszkieletowych oraz osłabienie połączeń pomiędzy dyskiem Z i filamentami (1, 14, 15, 17). Według niektórych autorów (36) dysk Z jest kluczowym punktem, w którym zachodzą przemiany w czasie dojrzewania mięsa. Wyniki badań nad degradacją aktyny miozyny i konektyny nie są jednomyślne (16, 33, 39, 47). Rola filamentów G w kształtowaniu kruchości mięsa nie jest jeszcze ustalona (42). Różne białka mięśniowe są degradowane po różnym czasie przechowywania w warunkach chłodniczych (44). Strukturalna degradacja linii Z powoduje fragmentację miofibryli, która przejawia się obecnością z fragmentów złożonych z 1-4 sarkomerów po homogenizacji mięśnia (21). Są doniesienia o dobrej korelacji indeksu fragmentacji w 60. godzinie postmortem z kruchością steków z polędwicy bydlęcej (12, 35). Nie jest wykluczone działanie niektórych katepsyn na kolagen (3,25).
5 12 KRYSTYNA PALKA Ogrzewanie Podczas ogrzewania tkanki mięśniowej zachodzą progresywne zmiany fizykochemiczne. Wpływ temperatury ogrzewania na morfologię jest niewielki do 50 C. Skurcz białek mięśniowych następuje w 50 C. W 60 C obserwuje się zanik struktury linii M, początek dezintegracji, koagulację cienkich i grubych filamentów i dalszy skurcz białek miofibrylarnych, a w 70 C ewidentną fragmentację miofibryli. W zakresie C następuje coraz większa dezintegracja filamentów cienkich. W 90 C struktura staje się amorficzna ale sarkomery mogą być identyfikowane (10, 22, 24). Pierwsza zmiana w długości włókien mięśniowych w temperaturze> 40 C jest przypisywana zmianom w miofibrylach, druga> 55 C skurczowi tkanki łącznej, a trzecia >70 C interakcji powyższych zmian. Straty cieplne i zmiany w poprzecznym przekroju włókien są większe w próbkach mięśnia skurczonego, natomiast zmiany w długości są większe w mięśniach rozciągniętych. Tłumaczy się to różnicami w przestrzennej orientacji tkanki łącznej (7). Siła cięcia zmienia się nieznacznie przy ogrzewaniu mięsa do 50 C, obniża się w 54 C i osiąga minimum w temperaturze C (6). Stabilność cieplna białek mięśniowych w zakresie temperatur C jest różna. Białkiem najbardziej labilnym jest -aktynina, która staje nierozpuszczalna w temperaturze 50 C. Ciężkie i lekkie łańcuchy miozyny denaturują w 55 C, aktyna w zakresie C, a tropomiozyna i troponina powyżej 80 C (5, 11). Białka sarkoplazmatyczne wykazujące aktywność proteolityczną mogą odgrywać rolę tenderyzującą w mięsie podczas ogrzewania, aż do momentu ich koagulacji w temperaturze około 65 C (24). Zmiany denaturacyjne w titinie obserwuje się w temperaturze 73 C (18), a nebulina wytrzymuje ogrzewanie do 80 C (26). Skurcz tkanki łącznej endomysium następuje w zakresie temperatur C, granulacja sarkolemmy w 60 C, a degradacja włókien kolagenowych w perymysium w temperaturze C (10, 22,24). Według Bailey a (3) twardnienie mięsa po ogrzaniu do temperatury w zakresie C jest związane z denaturacją białek miofibrylarnych. W obrazie mikroskopowym objawia się to poprzecznym skurczem włókien wewnątrz endomysium, które w tej temperaturze pozostaje niezmienione. Może to być połączone z niewielkim wyciekiem soku mięsnego. Następny wzrost twardości obserwowany w zakresie C połączony ze znacznym skurczem i wyciekiem soku jest interpretowany zmianami w kolagenie wewnątrzmięśniowym, którego włókna denaturując w temperaturze około 65 C kurczą się do 1/4 długości. Rozmiar skurczu i w konsekwencji generowane napięcie (twardość) zależy głównie od wieku tkanki. Przy ogrzewaniu w zakresie temperatur C zachodzi dalszy skurcz i odwodnienie zdenaturowanego kompleksu aktomiozynowego oraz żelatynizacja kolagenu. Te dwa główne składniki strukturalne mięsa mają różny wpływ na jego kruchość po ogrzewaniu. Cieplnie indukowane zmiany tkanki łącznej mają wpływ tenderyzujący, a zmiany w białkach miofibrylarnych wpływ utwardzający (24).Kruchość mięsa jest także zależna od ph i od zdolności utrzymywania wody w strukturze tkankowej. Podczas ogrzewania mięsa o wysokiej wodochłonności obserwuje się mniejszy wyciek cieplny i lepszą kruchość.
6 "STRUKTURALNE PODSTAWY TEKSTURY M IĘSA" 13 PODSUMOWANIE - Struktura mięsa w najprostszej formie jest zbiorem równoległych włókien zbudowanych z elementów fibrylarnych, związanych siatką tkanki łącznej. - Tekstura mięsa wydaje się być determinowana przede wszystkim stanem białek miofibrylarnych i podstawowego białka tkanki łącznej kolagenu. Wpływ na tę właściwość mają także białka cytoszkieletowe i zdolność utrzymywania wody w strukturze tkankowej. - Wiek ubijanego zwierzęcia oraz zmiany zachodzące w mięśniu podczas stężenia pośmiertnego, dojrzewania i ogrzewania istotnie modyfikują składniki tkankowe oraz teksturę mięsa. LITERATURA 1. Andereon T. J, Panish JR F.C (1989). Postmortem degradation of titin and nebulin of beefsteaks varying in tenderness. J. Food So. 54, Bailey A J., (1972). The basis of meat texture. J. S i Food Agric 23, Baiky A J., Light ND. (1989). Connective tissue in meat and meat products. ELsewierAppL Sci, London. 4. Bechtel P. J. (1986). Muscle as food Acad Press. Inc NYoifc 5. Bouton P. E, Harris P. V. (1983). Changes in tenderness of meat cooked at G J. Food ScL 46, 47S47& 6. Bouton P. E, Harris P. V. (1972) The effects of cooking temperature and time on some mechanical propertksofmcal J. Food Sci 37, Bouton P. E, Harris P. V, Shorthose W. R (1976). Dimensional changes in meat during cooking. J. Text Stud. 7, & Bouton P. E, Harris P. V, Shorthose W. R (1975). Changes in shear parameters of meat associated with structural changes produced by aging and myofibrillar contraction J. Food ScL 4Q Cassens R G, Carpenter C E, Eddinger T. J. (1984). An analyse of mkiostructuialf^is which influence the useofmusdeas food Food Microstructurc. 3,1-7. IQ Cheng C S, Parrish JR F. C (1976). Scanning electron microscopy of bovine muscle: Effect of heating on ultrastructure. J. Food ScL 41, L Cheng C S, Panish JR F. C (1979). Heat-induced changes in myofibrillar proteins of bovine Longissimus musde. J. Food ScL 44, Cole JR A. B., Davis G. W. (1981). Influence of postmortem aging period on the fragmentation index of bovine Longissimus muscle. J. Food Sci. 46,
7 14 KRYSTYNA PALKA 13. Currie R. W., Wolfe F. H. (1980). Rigor related changes in mechanical propertiesand extracellular space in beef muscle. Meat Sci. 4, Davey C. L., Digkson M. R. (1970). Studies in meat tenderness. 8. Ultrastructural changes during aging. J. Food Sci. 35, Davey C. L., Gilbert K. V. (1969). Studies in meat tenderness. 7. Changes in the fine structure of meat during aging. J. Food Sci. 34, Elgasim E. A. et. al. (1985). The combined effects of the calcium activated factor and cathepsin D on skeletal muscle. Food Micro structure. 4, Fritz J. D., Greaser M. L. (1991). Changes in titin and nebulin in postmortem bovine muscle revealed by gel electrophoresisig, western blotting and immunofluorescence microscopy. J. Food Sci. 56, Fritz J. D., Dietich L. J., Greaser M. L. (1992). Cooking effects on titin in fresh and processed beef products. J. Muscle Foods. 3, Greaser M. L. (1991). Overwiew of the muscle cell cytoskeleton. Recip. Meat Conf. Proc. 44, Harris P. V. (1976). Structural and other aspects of meat tenderness J. Texture Stud. 2, Hattori A., Takahashi K. (1979). Studies on the post-mortem fragmentation of myofibrils. J. Biochem. 85, Jones S. B., Carrol R. J., Cavanaugh J. R. (1977). Structural changes in heated bovine muscle: A scanning electron microscope study. J. Food Sci. 42, Kołczak T., Palka K., Zarzycki A. (1992). Wpływ kolagenu śródmięśniowego na kruchość i inne cechy sensoryczne mięśni bydła. Acta Agr. Etg. Silv. Ser. Zoot. 30, Laakkonen E. (1973). Factors affecting tenderness during heating of meat. Adv. in Food Res. Chichester C.O., Mrak E. M., Stewart G. F. (eds). Acad. Press, N. York, V. 20, Light N. D. (1987). The role of collagen in determining the texture of meat. Adv. Meat Res. Pearson A. M., Dutson T. R., Baillgey A. J. (eds). Ann Anvi Book, Van Nostrand Reinhold Comp. N. York, V. 4, Locker R. H. (1984). The role of gap filaments in muscle and in meat. Food Microstructure. 3,17-32.
8 "STRUKTURALNE PODSTAWY TEKSTURY M IĘSA" Locker R. H., Leet N. G. (1975). Histology of highly-stretched beef muscle - I. J. Ultrastruct. Res. 52, Locker R. H., Leet N. G. (1976). Histology of highly-stretched beef muscle - IV. J. Ultrastruct. Res. 56, Locker R. H., Wild D. J. C. (1984). The N-lines of skeletal muscle. J. Ultrastruct. Res. 88, Locker R. H. et. al. (1975). New concept in meat processing. Adv. Food Res. Chichester C. O., Mrak E. M., Stewart G. F. (eds). Acad. Press, N. York. V. 21, Marsh B. B. Leet N.G. (1977). Symposium - The basis of quality in muscle foods. The basis of tenderness in muscle foods. J. Food Sci. 42, Marsh B. B. (1966). Studies in meat tenderness. 3. The effects of cold shortening on tenderness. J. Food Sci. 31, Maruyama K. et. al. (1981). Connectin, an elastic protein of muscle Effect of proteolytic enzymes in situ. J. Biochem. 89, Newbold R. P., Harris P. V. (1972). The effect of pre-rigor changes on meat tenderness. A review. J. Food Sci. 37, Olson D. G., Parrisch JR F. C. (1977). Relationship of myofibril fragmentation index to measures of beef steak tenderness. J. Food Sci. 42, Robson R. M. et. al. (1984). Role of new cytoskeletal elements in maintenance of muscle integrity. J. Food Biochem. 8, Robson R. M., Huiatt T. W., Parrish JR F. C. (1991). Biochemical and structural properities of titin, nebulin and intermediate filaments in muscle. Recip. Meat. Conf. Proc. 44, Rosset R. (1982). Chilling, freezing and thawing. In Meat Microbiology. Brown M. H. (ed). Appl. Science Publ. Ltd. London & N. York. 39. Samejima K., Wolfe F. H. (1976). Degradation of myofibrillar protein components during postmortem aging of chicken muscle. J. Food Sci. 41, Sherman P. (1970). Industrial rheology. Acad. Press. N. York. 41. Shimokomaki M., Elsden D. F., Bailey A. J. (1972). Meat tenderness: Age related changes in bovine intra-muscular collagen. J. Food Sci.37,
9 16 KRYSTYNA PALKA 42. Shorthose W. R., Harris P. V. (1992). Meat: Texture and rheology. Encyklopedia od Food Sci. and Technol. Hui Y. H. (ed). A. Wiley-Intersci. Publ. John Wiley & Sons, Inc. N. York. V. 3, Stanley D. W. (1983). A review of the muscle cell cytoskeleton and its possible relation to the texture and sarcolemma emptying. Food Microstructure. 2, Suh-Fon Hwann, Bandman E. (1989). Studies of desmin and a-actinin degradationn in bovine Semitendinosus muscle. J. Food Sci. 54, Surmacka-Szcześniak A., Weiss_Forgenson K. (1965). Methods of meat texture measurement viewed from the background of factors affecting tenderness. Adv. Food Res. Chichester C. O., Mrak E. M., Stewart G. F. (arads). Acad. Press, N. York. V. 14, Van Laack R. L. J. M., Smmulders F. J. M. (1989). The effect of electrical stimulation, time of boning and high temperature conditioning on sensory quality traits of porcine Longissimus dorsi muscle. Meat Sci. 25, Wolfe F. H., Samejima K. (1976). Further studies of postmortem aging effects on chicken actomyosin. J. Food Sci. 41, Yamaguchi M. et. al. (1986). Current concept of muscle ultrastructure with emphasis on Z-line architekture. Food Microstructure. 5,
ZYWNOSC ECHNOLOGIA JAKOŚĆ
 - =ł - S ' POLSKIE TOWARZYSTWO TECHNOLOGÓW ŻYWNOŚCI ODDZIAŁ MAŁOPOLSKI ZYWNOSC ECHNOLOGIA JAKOŚĆ Kraków 1995 SPIS TREŚCI: TERESA FORTUNA "SKROBIE MODYFIKOWANE W PRODUKCJI ŻYWNOŚCI" KRYSTYNA PALKA "STRUKTURALNE
- =ł - S ' POLSKIE TOWARZYSTWO TECHNOLOGÓW ŻYWNOŚCI ODDZIAŁ MAŁOPOLSKI ZYWNOSC ECHNOLOGIA JAKOŚĆ Kraków 1995 SPIS TREŚCI: TERESA FORTUNA "SKROBIE MODYFIKOWANE W PRODUKCJI ŻYWNOŚCI" KRYSTYNA PALKA "STRUKTURALNE
Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie
 Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
WYBRANE BIAŁKA CYTOSZKIELETOW E I ICH ROLA W KSZTAŁTOW ANIU W ŁAŚCIW OŚCI FUNKCJONALNYCH TKANKI M IĘŚNIOW EJ. Streszczenie
 Żywność. Technologia. Jakość 3(12), 1997 EDWARD POSPIECH, BOŻENA GRZEŚ WYBRANE BIAŁKA CYTOSZKIELETOW E I ICH ROLA W KSZTAŁTOW ANIU W ŁAŚCIW OŚCI FUNKCJONALNYCH TKANKI M IĘŚNIOW EJ Streszczenie W pracy
Żywność. Technologia. Jakość 3(12), 1997 EDWARD POSPIECH, BOŻENA GRZEŚ WYBRANE BIAŁKA CYTOSZKIELETOW E I ICH ROLA W KSZTAŁTOW ANIU W ŁAŚCIW OŚCI FUNKCJONALNYCH TKANKI M IĘŚNIOW EJ Streszczenie W pracy
Mięśnie. dr Magdalena Markowska
 Mięśnie dr Magdalena Markowska Zjawisko ruchu 1) Jako możliwość przemieszczania przestrzennego mięśnie poprzecznie prążkowane 2) Pompa serce 3) Jako podstawa do utrzymywania czynności życiowych mięśnie
Mięśnie dr Magdalena Markowska Zjawisko ruchu 1) Jako możliwość przemieszczania przestrzennego mięśnie poprzecznie prążkowane 2) Pompa serce 3) Jako podstawa do utrzymywania czynności życiowych mięśnie
Ruch i mięśnie. dr Magdalena Markowska
 Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
MIĘŚNIE Czynności i fizjologia mięśni
 Biomechanika sportu MIĘŚNIE Czynności i fizjologia mięśni CZYNNOŚCI MIĘŚNIA W opisie czynności mięśnia i siły przez niego wyzwolonej odwołujemy się do towarzyszącej temu zmianie jego długości. Zmiana długości
Biomechanika sportu MIĘŚNIE Czynności i fizjologia mięśni CZYNNOŚCI MIĘŚNIA W opisie czynności mięśnia i siły przez niego wyzwolonej odwołujemy się do towarzyszącej temu zmianie jego długości. Zmiana długości
Ruch i mięśnie. dr Magdalena Markowska
 Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Tkanka mięśniowa. pobudliwość kurczliwość
 Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
POLSKIE TOWARZYSTWO TECHNOLOGÓW ŻYWNOŚCI. v->. Mr " * ...K W YDAW CA ODDZIAŁ MAŁOPOLSKI ZYW ECHNO AKO
 POLSKIE TOWARZYSTWO TECHNOLOGÓW ŻYWNOŚCI W YDAW CA ODDZIAŁ MAŁOPOLSKI v->. Mr " *...K ZYW ECHNO AKO Kraków 1997 ŻYWNOŚĆ. TECHNOLOGIA. JAKOŚĆ Kwartalnik naukowy SPIS TREŚCI Od Redakcji...3 EDWARD POSPIECH,
POLSKIE TOWARZYSTWO TECHNOLOGÓW ŻYWNOŚCI W YDAW CA ODDZIAŁ MAŁOPOLSKI v->. Mr " *...K ZYW ECHNO AKO Kraków 1997 ŻYWNOŚĆ. TECHNOLOGIA. JAKOŚĆ Kwartalnik naukowy SPIS TREŚCI Od Redakcji...3 EDWARD POSPIECH,
Tkanka nerwowa. neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające)
 Tkanka nerwowa neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające) Sygnalizacja w komórkach nerwowych 100 tys. wejść informacyjnych przyjmowanie sygnału przewodzenie
Tkanka nerwowa neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające) Sygnalizacja w komórkach nerwowych 100 tys. wejść informacyjnych przyjmowanie sygnału przewodzenie
Czynniki poubojowe kształtujące jakość wieprzowiny
 22 maszyny i technologie Czynniki poubojowe kształtujące jakość wieprzowiny Parametrami charakteryzującymi jakość mięsa, w tym również wieprzowego są jego cechy sensoryczne, właściwości technologiczne
22 maszyny i technologie Czynniki poubojowe kształtujące jakość wieprzowiny Parametrami charakteryzującymi jakość mięsa, w tym również wieprzowego są jego cechy sensoryczne, właściwości technologiczne
Tkanka mięśniowa. pobudliwość kurczliwość
 Tkanka mięśniowa troponina tropomiozyna Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) białka pomocnicze łańcuchy lekkie miozyna 2 miozyna 2 pobudliwość kurczliwość
Tkanka mięśniowa troponina tropomiozyna Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) białka pomocnicze łańcuchy lekkie miozyna 2 miozyna 2 pobudliwość kurczliwość
Zmiany winkuliny i desminy w mięsie młodego bydła poddanym peklowaniu i ich wpływ na jego właściwości
 Roczniki Instytutu Przemysłu Mięsnego i Tłuszczowego T. XXXIX 2002 Bożena Grześ, Edward Pospiech Zmiany winkuliny i desminy w mięsie młodego bydła poddanym peklowaniu i ich wpływ na jego właściwości Słowa
Roczniki Instytutu Przemysłu Mięsnego i Tłuszczowego T. XXXIX 2002 Bożena Grześ, Edward Pospiech Zmiany winkuliny i desminy w mięsie młodego bydła poddanym peklowaniu i ich wpływ na jego właściwości Słowa
Podział tkanki mięśniowej. Tkanka mięśniowa. Poprzecznie prążkowana
 Tkanka mięśniowa Podział tkanki mięśniowej Tkanka mięśniowa Poprzecznie prążkowana Gładka Szkieletowa Sercowa Szkieletowe Mięsień sercowy Mięśnie gładkie Cytoplazma z miofibryllami sarkoplazma SER siateczka
Tkanka mięśniowa Podział tkanki mięśniowej Tkanka mięśniowa Poprzecznie prążkowana Gładka Szkieletowa Sercowa Szkieletowe Mięsień sercowy Mięśnie gładkie Cytoplazma z miofibryllami sarkoplazma SER siateczka
Podział tkanki mięśniowej. Tkanka mięśniowa. Poprzecznie prążkowana
 Tkanka mięśniowa Podział tkanki mięśniowej Włókna mięśniowe Tkanka mięśniowa Komórki Komórki Poprzecznie prążkowana Gładka Szkieletowa Sercowa Szkieletowe Mięsień sercowy Mięśnie gładkie Cytoplazma z miofibryllami
Tkanka mięśniowa Podział tkanki mięśniowej Włókna mięśniowe Tkanka mięśniowa Komórki Komórki Poprzecznie prążkowana Gładka Szkieletowa Sercowa Szkieletowe Mięsień sercowy Mięśnie gładkie Cytoplazma z miofibryllami
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
ANNALES. Zbigniew J. Dolatowski, Joanna Twarda, Małgorzata Dudek. Zmiany uwodnienia mięsa podczas dojrzewania
 ANNALES UNIVERSITATIS VOL. LIX, Nr MARIAE LUBLIN * CURIE- S K Ł O D O W S K A POLONIA SECTIO E 200 Zakład Przetwórstwa Surowców Pochodzenia Zwierzęcego, Akademia Rolnicza w Lublinie ul. Doświadczalna,
ANNALES UNIVERSITATIS VOL. LIX, Nr MARIAE LUBLIN * CURIE- S K Ł O D O W S K A POLONIA SECTIO E 200 Zakład Przetwórstwa Surowców Pochodzenia Zwierzęcego, Akademia Rolnicza w Lublinie ul. Doświadczalna,
Tkanka mięśniowa. pobudliwość kurczliwość
 Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
II. Analiza sensoryczna w ocenie jakości produktów spożywczych
 SPIS TREŚCI Wprowadzenie 11 I. Jakość żywności, systemy zarządzania jakością i klasyfikacja żywności 13 1. Wstęp 13 2. Określenia jakości 14 3. Systemy zapewniające prawidłową jakość produktów spożywczych
SPIS TREŚCI Wprowadzenie 11 I. Jakość żywności, systemy zarządzania jakością i klasyfikacja żywności 13 1. Wstęp 13 2. Określenia jakości 14 3. Systemy zapewniające prawidłową jakość produktów spożywczych
SYLABUS PRZEDMIOTU. Założenia i cele przedmiotu
 SYLABUS PRZEDMIOTU Nazwa przedmiotu: TOWAROZNAWSTWO SUROWCÓW I PRODUKTÓW ZWIERZĘCYCH Katedra/Wydział: Katedra Hodowli Małych Ssaków i Surowców Zwierzęcych Wydział Hodowli i Biologii Zwierząt Kierownik
SYLABUS PRZEDMIOTU Nazwa przedmiotu: TOWAROZNAWSTWO SUROWCÓW I PRODUKTÓW ZWIERZĘCYCH Katedra/Wydział: Katedra Hodowli Małych Ssaków i Surowców Zwierzęcych Wydział Hodowli i Biologii Zwierząt Kierownik
ZWIĄZEK KOLAGENU Z WYBRANYMI PARAMETRAMI TECHNOLOGICZNYMI MIĘSA CIELĘCEGO
 ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2010, 4 (71), 50 62 PIOTR DOMARADZKI, PIOTR SKAŁECKI, MARIUSZ FLOREK, ZYGMUNT LITWIŃCZUK ZWIĄZEK KOLAGENU Z WYBRANYMI PARAMETRAMI TECHNOLOGICZNYMI MIĘSA CIELĘCEGO S
ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2010, 4 (71), 50 62 PIOTR DOMARADZKI, PIOTR SKAŁECKI, MARIUSZ FLOREK, ZYGMUNT LITWIŃCZUK ZWIĄZEK KOLAGENU Z WYBRANYMI PARAMETRAMI TECHNOLOGICZNYMI MIĘSA CIELĘCEGO S
CZASOPISMO NAUKOWO-KULTURALNE
 ISSN 1895-4421 EPISTEME CZASOPISMO NAUKOWO-KULTURALNE KRAKÓW Nr 21/2013, t. II Piotr DOMARADZKI Mariusz FLOREK Anna LITWIŃCZUK EPISTEME 21/2013, t. II s. 177 185 ISSN 1895-2241 ZAWARTOŚĆ KOLAGENU OGÓLNEGO
ISSN 1895-4421 EPISTEME CZASOPISMO NAUKOWO-KULTURALNE KRAKÓW Nr 21/2013, t. II Piotr DOMARADZKI Mariusz FLOREK Anna LITWIŃCZUK EPISTEME 21/2013, t. II s. 177 185 ISSN 1895-2241 ZAWARTOŚĆ KOLAGENU OGÓLNEGO
Układ ruchu, skóra Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka.
 Układ ruchu, skóra Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
Układ ruchu, skóra Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
Temat: Przegląd i budowa tkanek zwierzęcych.
 Temat: Przegląd i budowa tkanek zwierzęcych. 1. Czym jest tkanka? To zespół komórek o podobnej budowie, które wypełniają w organizmie określone funkcje. Tkanki tworzą różne narządy, a te układy narządów.
Temat: Przegląd i budowa tkanek zwierzęcych. 1. Czym jest tkanka? To zespół komórek o podobnej budowie, które wypełniają w organizmie określone funkcje. Tkanki tworzą różne narządy, a te układy narządów.
6.1. MI ånie POPRZECZNIE PR ØKOWANE SZKIELETOWE
 TKANKA MI åniowa 6 Wywodzi się z mezodermy zorganizowanej w miotomy. Proces różnicowania polega przede wszystkim na tworzeniu wydłużonych komórek zdolnych do wytwarzania białek kurczliwych. Na podstawie
TKANKA MI åniowa 6 Wywodzi się z mezodermy zorganizowanej w miotomy. Proces różnicowania polega przede wszystkim na tworzeniu wydłużonych komórek zdolnych do wytwarzania białek kurczliwych. Na podstawie
SYLABUS PRZEDMIOTU. Założenia i cele przedmiotu
 SYLABUS PRZEDMIOTU Nazwa przedmiotu: TOWAROZNAWSTWO SUROWCÓW I PRODUKTÓW POCHODZENIA ZWIERZĘCEGO Katedra/Wydział: Katedra Hodowli Małych Ssaków i Surowców Zwierzęcych Wydział Hodowli i Biologii Zwierząt
SYLABUS PRZEDMIOTU Nazwa przedmiotu: TOWAROZNAWSTWO SUROWCÓW I PRODUKTÓW POCHODZENIA ZWIERZĘCEGO Katedra/Wydział: Katedra Hodowli Małych Ssaków i Surowców Zwierzęcych Wydział Hodowli i Biologii Zwierząt
Układ ruchu Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka.
 Układ ruchu Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
Układ ruchu Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
UKŁAD RUCHU (UKŁAD KOSTNY, UKŁAD MIĘŚNIOWY)
 Zadanie 1. (2 pkt). Na rysunku przedstawiono szkielet kończyny dolnej (wraz z częścią kości miednicznej) i kość krzyżową człowieka. a) Uzupełnij opis rysunku ( ) o nazwy wskazanych kości. b) Wybierz z
Zadanie 1. (2 pkt). Na rysunku przedstawiono szkielet kończyny dolnej (wraz z częścią kości miednicznej) i kość krzyżową człowieka. a) Uzupełnij opis rysunku ( ) o nazwy wskazanych kości. b) Wybierz z
SPEKTROSKOPIA MRJ BIAŁEK MIĘŚNIOWYCH
 SPEKTROSKOPIA MRJ BIAŁEK MIĘŚNIOWYCH Genowefa Ślósarek Zakład Biofizyki Molekularnej, Instytut Fizyki Uniwersytet im. A Mickiewicza ul Umultowska 85, 61-614 Poznań Badania podstawowe nad mięśniami prowadzone
SPEKTROSKOPIA MRJ BIAŁEK MIĘŚNIOWYCH Genowefa Ślósarek Zakład Biofizyki Molekularnej, Instytut Fizyki Uniwersytet im. A Mickiewicza ul Umultowska 85, 61-614 Poznań Badania podstawowe nad mięśniami prowadzone
ZASTOSOWANIE MD-TISSUE W TERAPII ANTI-AGING
 Starzenie się skóry jest rezultatem wpływu wielu czynników biologicznych, biochemicznych i genetycznych na indywidualne jednostki. Jednocześnie wpływ czynników zewnętrznych chemicznych i fizycznych determinują
Starzenie się skóry jest rezultatem wpływu wielu czynników biologicznych, biochemicznych i genetycznych na indywidualne jednostki. Jednocześnie wpływ czynników zewnętrznych chemicznych i fizycznych determinują
SYLABUS PRZEDMIOTU. Założenia i cele przedmiotu
 SYLABUS PRZEDMIOTU Nazwa przedmiotu: TOWAROZNAWSTWO SUROWCÓW I PRODUKTÓW POCHODZENIA ZWIERZĘCEGO Katedra/Wydział: Katedra Hodowli Małych Ssaków i Surowców Zwierzęcych Wydział Hodowli i Biologii Zwierząt
SYLABUS PRZEDMIOTU Nazwa przedmiotu: TOWAROZNAWSTWO SUROWCÓW I PRODUKTÓW POCHODZENIA ZWIERZĘCEGO Katedra/Wydział: Katedra Hodowli Małych Ssaków i Surowców Zwierzęcych Wydział Hodowli i Biologii Zwierząt
Tkanka mięśniowa. pobudliwość kurczliwość
 Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski
 biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
SKŁAD CHEMICZNY, ROZPUSZCZALNOŚĆ KOLAGENU ŚRÓDMIĘŚNIOWEGO I TEKSTURA WYBRANYCH MIĘŚNI WOŁOWYCH
 ŻYWNOŚĆ. Nauka. Technologia. Jakość, 011, 4 (77), 103 116 MARZENA ZAJĄC, ANETA MIDURA, KRYSTYNA PALKA, EWELINA WĘSIERSKA, KRZYSZTOF KRZYSZTOFORSKI SKŁAD CHEMICZNY, ROZPUSZCZALNOŚĆ KOLAGENU ŚRÓDMIĘŚNIOWEGO
ŻYWNOŚĆ. Nauka. Technologia. Jakość, 011, 4 (77), 103 116 MARZENA ZAJĄC, ANETA MIDURA, KRYSTYNA PALKA, EWELINA WĘSIERSKA, KRZYSZTOF KRZYSZTOFORSKI SKŁAD CHEMICZNY, ROZPUSZCZALNOŚĆ KOLAGENU ŚRÓDMIĘŚNIOWEGO
PIOTR DOMARADZKI, ZYGMUNT LITWIŃCZUK, ANNA LITWIŃCZUK, MARIUSZ FLOREK
 ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2016, 4 (107), 37 52 DOI: 10.15193/zntj/2016/107/136 PIOTR DOMARADZKI, ZYGMUNT LITWIŃCZUK, ANNA LITWIŃCZUK, MARIUSZ FLOREK ZMIANY TEKSTURY I WŁAŚCIWOŚCI SENSORYCZNYCH
ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2016, 4 (107), 37 52 DOI: 10.15193/zntj/2016/107/136 PIOTR DOMARADZKI, ZYGMUNT LITWIŃCZUK, ANNA LITWIŃCZUK, MARIUSZ FLOREK ZMIANY TEKSTURY I WŁAŚCIWOŚCI SENSORYCZNYCH
Wpływ techniki rozmrażania na odwracalność zmian jakościowych w produkcie żywnościowym
 POLITECHNIKA GDAŃSKA WYDZIAŁ MECHANICZNY Wpływ techniki rozmrażania na odwracalność zmian jakościowych w produkcie żywnościowym Andrzej Domian SUCHiKL Sem IX GDAŃSK 2011 SPIS TREŚCI 1. Definicja i cel
POLITECHNIKA GDAŃSKA WYDZIAŁ MECHANICZNY Wpływ techniki rozmrażania na odwracalność zmian jakościowych w produkcie żywnościowym Andrzej Domian SUCHiKL Sem IX GDAŃSK 2011 SPIS TREŚCI 1. Definicja i cel
SYLABUS PRZEDMIOTU. Założenia i cele przedmiotu
 SYLABUS PRZEDMIOTU Nazwa przedmiotu: TOWAROZNAWSTWO SUROWCÓW I PRODUKTÓW ZWIERZĘCYCH Katedra/Wydział: Katedra Surowców Pochodzenia Zwierzęcego Wydział Hodowli i Biologii Zwierząt Kierownik przedmiotu:
SYLABUS PRZEDMIOTU Nazwa przedmiotu: TOWAROZNAWSTWO SUROWCÓW I PRODUKTÓW ZWIERZĘCYCH Katedra/Wydział: Katedra Surowców Pochodzenia Zwierzęcego Wydział Hodowli i Biologii Zwierząt Kierownik przedmiotu:
ZASTOSOWANIE TECHNIKI MIKROSKOPOWEJ DO OCENY STRUKTURY MIĘSA WOŁOWEGO PRZEZ POMIAR DŁUGOŚCI SARKOMERÓW
 Dominika Guzek 1, Krzysztof Głąbski 2, Dominika Głąbska 3, Grzegorz Pogorzelski 1, Jerzy Barszczewski 4, Agnieszka Wierzbicka 1 ZASTOSOWANIE TECHNIKI MIKROSKOPOWEJ DO OCENY STRUKTURY MIĘSA WOŁOWEGO PRZEZ
Dominika Guzek 1, Krzysztof Głąbski 2, Dominika Głąbska 3, Grzegorz Pogorzelski 1, Jerzy Barszczewski 4, Agnieszka Wierzbicka 1 ZASTOSOWANIE TECHNIKI MIKROSKOPOWEJ DO OCENY STRUKTURY MIĘSA WOŁOWEGO PRZEZ
Budowa i rola części czynnej układu ruchu
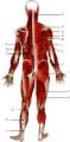 Budowa i rola części czynnej układu ruchu Układ ruchu Ze względu na budowę i właściwości układ ruchu można podzielić na: część czynną układ mięśniowy część bierną układ szkieletowy Dzięki współdziałaniu
Budowa i rola części czynnej układu ruchu Układ ruchu Ze względu na budowę i właściwości układ ruchu można podzielić na: część czynną układ mięśniowy część bierną układ szkieletowy Dzięki współdziałaniu
ZRÓŻNICOWANIE WYBRANYCH WYRÓŻNIKÓW JAKOŚCI MIĘSA ŚWIŃ Z TUCZU UKIERUNKOWANEGO I STANDARDOWEGO. WYNIKI WSTĘPNE *
 NAUKI INŻYNIERSKIE I TECHNOLOGIE 4(11) 2013 ENGINEERING SCIENCES AND TECHNOLOGIES ISSN 2080-5985 Dominika Guzek, Iwona Wojtasik-Kalinowska, Agnieszka Wierzbicka Samodzielny Zakład Techniki w Żywieniu,
NAUKI INŻYNIERSKIE I TECHNOLOGIE 4(11) 2013 ENGINEERING SCIENCES AND TECHNOLOGIES ISSN 2080-5985 Dominika Guzek, Iwona Wojtasik-Kalinowska, Agnieszka Wierzbicka Samodzielny Zakład Techniki w Żywieniu,
ZMIANY UDZIAŁU BIAŁEK W WYCIEKU WIRÓWKOWYM Z MIĘSA BUHAJKÓW RÓŻNYCH RAS I W RÓŻNYM WIEKU, W CZASIE DOJRZEWANIA WOŁOWINY
 ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2014, 3 (94), 78 91 DOI: 10.15193/zntj/2014/94/078-091 EWA IWAŃSKA, BOŻENA GRZEŚ, EDWARD POSPIECH, BEATA MIKOŁAJCZAK, ANITA SPYCHAJ ZMIANY UDZIAŁU BIAŁEK W WYCIEKU
ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2014, 3 (94), 78 91 DOI: 10.15193/zntj/2014/94/078-091 EWA IWAŃSKA, BOŻENA GRZEŚ, EDWARD POSPIECH, BEATA MIKOŁAJCZAK, ANITA SPYCHAJ ZMIANY UDZIAŁU BIAŁEK W WYCIEKU
WPŁYW ELEKTROSTYMULACJI WYSOKONAPIĘCIOWEJ I RODZAJU MIĘŚNIA NA KRUCHOŚĆ PASTRAMI WOŁOWEGO
 WPŁYW ELEKTROSTYMULACJI WYSOKONAPIĘCIOWEJ I RODZAJU MIĘŚNIA NA KRUCHOŚĆ PASTRAMI WOŁOWEGO Ryszard Żywica, Joanna K. Banach Uniwersytet Warmińsko-Mazurski w Olsztynie, Katedra Towaroznawstwa Przemysłowego,
WPŁYW ELEKTROSTYMULACJI WYSOKONAPIĘCIOWEJ I RODZAJU MIĘŚNIA NA KRUCHOŚĆ PASTRAMI WOŁOWEGO Ryszard Żywica, Joanna K. Banach Uniwersytet Warmińsko-Mazurski w Olsztynie, Katedra Towaroznawstwa Przemysłowego,
Tkanka mięśniowa. pobudliwość kurczliwość
 Tkanka mięśniowa troponina tropomiozyna Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) białka pomocnicze łańcuchy lekkie miozyna 2 miozyna 2 pobudliwość kurczliwość
Tkanka mięśniowa troponina tropomiozyna Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) białka pomocnicze łańcuchy lekkie miozyna 2 miozyna 2 pobudliwość kurczliwość
Budowa tkanki korzeni buraków cukrowych
 Cukier z buraków jest od dawna pozyskiwany na drodze dyfuzji. Jako materiał zapasowy rośliny dwuletniej znajduje się w tkance korzenia (rys.). Budowa tkanki korzeni buraków cukrowych W korzeniu wyróżnia
Cukier z buraków jest od dawna pozyskiwany na drodze dyfuzji. Jako materiał zapasowy rośliny dwuletniej znajduje się w tkance korzenia (rys.). Budowa tkanki korzeni buraków cukrowych W korzeniu wyróżnia
TEKSTURA MIĘŚNIA LONGISSIMUS THORACIS ET LUMBORUM, MIESZAŃCÓW BYDŁA RAS MIĘSNYCH, PODDAWANEGO DOJRZEWANIU METODĄ MOKRĄ
 Acta Agrophysica, 2012, 19(3), 631-640 TEKSTURA MIĘŚNIA LONGISSIMUS THORACIS ET LUMBORUM, MIESZAŃCÓW BYDŁA RAS MIĘSNYCH, PODDAWANEGO DOJRZEWANIU METODĄ MOKRĄ Jacek Niedźwiedź, Halina Ostoja, Marek Cierach
Acta Agrophysica, 2012, 19(3), 631-640 TEKSTURA MIĘŚNIA LONGISSIMUS THORACIS ET LUMBORUM, MIESZAŃCÓW BYDŁA RAS MIĘSNYCH, PODDAWANEGO DOJRZEWANIU METODĄ MOKRĄ Jacek Niedźwiedź, Halina Ostoja, Marek Cierach
Tkanka mięśniowa. pobudliwość kurczliwość
 Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Poubojowe przemiany mięsa: Przemiany węglowodanów:
 Poubojowe przemiany mięsa: Przemiany węglowodanów: - beztlenowy metabolizm glikogenu do kwasu mlekowego -zakwaszenie mięsa z ph 7.3 7.5 do ph 5.4 (zakwaszenie końcowe) - unieczynnienie enzymów glikolitycznych
Poubojowe przemiany mięsa: Przemiany węglowodanów: - beztlenowy metabolizm glikogenu do kwasu mlekowego -zakwaszenie mięsa z ph 7.3 7.5 do ph 5.4 (zakwaszenie końcowe) - unieczynnienie enzymów glikolitycznych
Filamenty aktynowe ORGANIZACJA CYTOPLAZMY. komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe
 Filamenty aktynowe ORGANIZACJA CYTOPLAZMY komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe Cytoszkielet aktynowy G-aktyna 370 aminokwasów 42 43 kda izoformy:
Filamenty aktynowe ORGANIZACJA CYTOPLAZMY komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe Cytoszkielet aktynowy G-aktyna 370 aminokwasów 42 43 kda izoformy:
Wpływ procesu poubojowego dojrzewania mięsa wieprzowego na zmiany profilu białek i kruchość
 458 Praca oryginalna DOI: 10.21521/mw.5530 Original paper Wpływ procesu poubojowego dojrzewania mięsa wieprzowego na zmiany profilu białek i kruchość EWA IWAŃSKA, BEATA MIKOŁAJCZAK, BOŻENA GRZEŚ, EDWARD
458 Praca oryginalna DOI: 10.21521/mw.5530 Original paper Wpływ procesu poubojowego dojrzewania mięsa wieprzowego na zmiany profilu białek i kruchość EWA IWAŃSKA, BEATA MIKOŁAJCZAK, BOŻENA GRZEŚ, EDWARD
ZMIANY TEKSTURY PRZETWORÓW MIĘSNYCH PRZECHOWYWANYCH W ATMOSFERZE MODYFIKOWANEJ
 InŜynieria Rolnicza 7/2006 Marek Cierach, Małgorzata Stasiewicz Katedra Technologii i Chemii Mięsa, Uniwersytet Warmińsko-Mazurski w Olsztynie ZMIANY TEKSTURY PRZETWORÓW MIĘSNYCH PRZECHOWYWANYCH W ATMOSFERZE
InŜynieria Rolnicza 7/2006 Marek Cierach, Małgorzata Stasiewicz Katedra Technologii i Chemii Mięsa, Uniwersytet Warmińsko-Mazurski w Olsztynie ZMIANY TEKSTURY PRZETWORÓW MIĘSNYCH PRZECHOWYWANYCH W ATMOSFERZE
WPŁYW DZIAŁANIA SOLI WAPNIOWYCH NA STRUKTURĘ MIĘSA WOŁOWEGO. Halina Ostoja, Marek Cierach
 Acta Agrophysica, 2008, 11(2), 465-474 WPŁYW DZIAŁANIA SOLI WAPNIOWYCH NA STRUKTURĘ MIĘSA WOŁOWEGO Halina Ostoja, Marek Cierach Katedra Technologii i Chemii Mięsa, Uniwersytet Warmińsko-Mazurski Pl. Cieszyński
Acta Agrophysica, 2008, 11(2), 465-474 WPŁYW DZIAŁANIA SOLI WAPNIOWYCH NA STRUKTURĘ MIĘSA WOŁOWEGO Halina Ostoja, Marek Cierach Katedra Technologii i Chemii Mięsa, Uniwersytet Warmińsko-Mazurski Pl. Cieszyński
ANALIZA WPŁYWU WYBRANYCH CZYNNIKÓW STRUKTUROTWÓRCZYCH NA JAKOŚĆ WYROBÓW DWURODNYCH
 Inżynieria Rolnicza 5(93)/2007 ANALIZA WPŁYWU WYBRANYCH CZYNNIKÓW STRUKTUROTWÓRCZYCH NA JAKOŚĆ WYROBÓW DWURODNYCH Agnieszka Wierzbicka, Andrzej Półtorak Zakład Techniki w Żywieniu, Szkoła Główna Gospodarstwa
Inżynieria Rolnicza 5(93)/2007 ANALIZA WPŁYWU WYBRANYCH CZYNNIKÓW STRUKTUROTWÓRCZYCH NA JAKOŚĆ WYROBÓW DWURODNYCH Agnieszka Wierzbicka, Andrzej Półtorak Zakład Techniki w Żywieniu, Szkoła Główna Gospodarstwa
Tkanka łączna. komórki bogata macierz
 Tkanka łączna komórki bogata macierz (przenosi siły mechaniczne) Funkcje spaja róŝne typy innych tkanek zapewnia podporę narządom, ochrania wraŝliwe części organizmu transport substancji odŝywczych i produktów
Tkanka łączna komórki bogata macierz (przenosi siły mechaniczne) Funkcje spaja róŝne typy innych tkanek zapewnia podporę narządom, ochrania wraŝliwe części organizmu transport substancji odŝywczych i produktów
Tkanka mięśniowa. Bogdan Walkowiak. Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka. 7 listopada 2014 Biofizyka 1
 Wykład 5 Tkanka mięśniowa Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka 7 listopada 2014 Biofizyka 1 Trzy typy mięśni Mięśnie szkieletowe (Poprzecznie prążkowane)
Wykład 5 Tkanka mięśniowa Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka 7 listopada 2014 Biofizyka 1 Trzy typy mięśni Mięśnie szkieletowe (Poprzecznie prążkowane)
Właściwości mechaniczne tkanki buraczanej - rodzaje, sposoby pomiaru i znaczenie w technologii cukru
 Właściwości mechaniczne tkanki buraczanej - rodzaje, sposoby pomiaru i znaczenie w technologii cukru Gruska Radosław, Wawro Stanisław Politechnika Łódzka Instytut Chemicznej Technologii Żywności Zakład
Właściwości mechaniczne tkanki buraczanej - rodzaje, sposoby pomiaru i znaczenie w technologii cukru Gruska Radosław, Wawro Stanisław Politechnika Łódzka Instytut Chemicznej Technologii Żywności Zakład
Predykcjajakości sensorycznej wołowiny we Francji
 Predykcjajakości sensorycznej wołowiny we Francji Isabelle LEGRAND S. CHRIKI, L. JOURNAUX, J.F. HOCQUETTE, B. PICARD, D. PETHICK, R. POLKINGHORNE 18 th October2012 1 Jakość sensoryczna wołowiny Wielka
Predykcjajakości sensorycznej wołowiny we Francji Isabelle LEGRAND S. CHRIKI, L. JOURNAUX, J.F. HOCQUETTE, B. PICARD, D. PETHICK, R. POLKINGHORNE 18 th October2012 1 Jakość sensoryczna wołowiny Wielka
ZAMRAŻANIE PODSTAWY CZ.2
 METODY PRZECHOWYWANIA I UTRWALANIA BIOPRODUKTÓW ZAMRAŻANIE PODSTAWY CZ.2 Opracował: dr S. Wierzba Katedra Biotechnologii i Biologii Molekularnej Uniwersytetu Opolskiego Odmienność procesów zamrażania produktów
METODY PRZECHOWYWANIA I UTRWALANIA BIOPRODUKTÓW ZAMRAŻANIE PODSTAWY CZ.2 Opracował: dr S. Wierzba Katedra Biotechnologii i Biologii Molekularnej Uniwersytetu Opolskiego Odmienność procesów zamrażania produktów
WŁAŚCIWOŚCI MIOFIBRYLI SONIFIKOWANEGO MIĘSA WIEPRZOWEGO O OBNIŻONEJ JAKOŚCI
 ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2009, 1 (62), 140 149 AGNIESZKA LATOCH WŁAŚCIWOŚCI MIOFIBRYLI SONIFIKOWANEGO MIĘSA WIEPRZOWEGO O OBNIŻONEJ JAKOŚCI S t r e s z c z e n i e Celem badań było określenie
ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2009, 1 (62), 140 149 AGNIESZKA LATOCH WŁAŚCIWOŚCI MIOFIBRYLI SONIFIKOWANEGO MIĘSA WIEPRZOWEGO O OBNIŻONEJ JAKOŚCI S t r e s z c z e n i e Celem badań było określenie
UKŁAD MIĘŚNIOWY. Slajd 1. Slajd 2. Slajd 3 MIOLOGIA OGÓLNA BUDOWA MIĘŚNIA
 Slajd 1 Slajd 2 Slajd 3 MIOLOGIA OGÓLNA UKŁAD MIĘŚNIOWY Mięśnie tworzą czynny narząd ruchu. Zbudowane są z tkanki mięśniowej poprzecznie prążkowanej sterowanej przez ośrodkowy układ nerwowy. Ze względu
Slajd 1 Slajd 2 Slajd 3 MIOLOGIA OGÓLNA UKŁAD MIĘŚNIOWY Mięśnie tworzą czynny narząd ruchu. Zbudowane są z tkanki mięśniowej poprzecznie prążkowanej sterowanej przez ośrodkowy układ nerwowy. Ze względu
Budowa i funkcje komórek nerwowych
 Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Mięso indycze i jego walory odżywcze
 OID (278) 11/2014 Mięso indycze i jego walory odżywcze Mięso indycze budzi coraz większe zainteresowanie konsumentów ze względu na aspekt zdrowotny i przetwórczy, jego spożycie ulega zmianom z tendencją
OID (278) 11/2014 Mięso indycze i jego walory odżywcze Mięso indycze budzi coraz większe zainteresowanie konsumentów ze względu na aspekt zdrowotny i przetwórczy, jego spożycie ulega zmianom z tendencją
- oznaczenia naukowo-badawcze. - jedna z podstawowych technik. - oznaczenia laboratoryjnodiagnostyczne. Elektroforeza. badawczych.
 Elektroforeza - jedna z podstawowych technik badawczych - oznaczenia naukowo-badawcze - oznaczenia laboratoryjnodiagnostyczne Annals of the New York Academy of Sciences 928:54-64 (2001) 2001 New York
Elektroforeza - jedna z podstawowych technik badawczych - oznaczenia naukowo-badawcze - oznaczenia laboratoryjnodiagnostyczne Annals of the New York Academy of Sciences 928:54-64 (2001) 2001 New York
CYTOSZKIELET CYTOSZKIELET
 CYTOSZKIELET Sieć włókienek białkowych; struktura wysoce dynamiczna Filamenty aktynowe Filamenty pośrednie Mikrotubule Fibroblast CYTOSZKIELET 1 CYTOSZKIELET 7nm 10nm 25nm Filamenty pośrednie ich średnica
CYTOSZKIELET Sieć włókienek białkowych; struktura wysoce dynamiczna Filamenty aktynowe Filamenty pośrednie Mikrotubule Fibroblast CYTOSZKIELET 1 CYTOSZKIELET 7nm 10nm 25nm Filamenty pośrednie ich średnica
JAKOŚĆ WOŁOWINY. S t r e s z c z e n i e
 ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2008, 1 (56), 5 22 TADEUSZ KOŁCZAK JAKOŚĆ WOŁOWINY S t r e s z c z e n i e Głównym przeznaczeniem użytkowym wołowiny jest mięso kulinarne. W ocenie konsumenckiej jakość
ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2008, 1 (56), 5 22 TADEUSZ KOŁCZAK JAKOŚĆ WOŁOWINY S t r e s z c z e n i e Głównym przeznaczeniem użytkowym wołowiny jest mięso kulinarne. W ocenie konsumenckiej jakość
WPŁYW OBRÓBKI CIEPLNEJ W ŚRODOWISKU PARY WODNEJ NA TEKSTURĘ, SOCZYSTOŚĆ I ROZPUSZCZALNOŚĆ BIAŁEK KOLAGENOWYCH WOŁOWEGO MIĘŚNIA PODGRZEBIENIOWEGO
 ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2010, 6 (73), 209 218 EWA DĄBROWKA, MONIKA MODZELEWKA-KAPITUŁA, ALEKANDRA KWIATKOWKA, BARBARA JANKOWKA, MAREK CIERACH WPŁYW OBRÓBKI CIEPLNEJ W ŚRODOWIKU PARY WODNEJ
ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2010, 6 (73), 209 218 EWA DĄBROWKA, MONIKA MODZELEWKA-KAPITUŁA, ALEKANDRA KWIATKOWKA, BARBARA JANKOWKA, MAREK CIERACH WPŁYW OBRÓBKI CIEPLNEJ W ŚRODOWIKU PARY WODNEJ
OCENA WPŁYWU PH KOŃCOWEGO NA JAKOŚĆ SENSORYCZNĄ POLĘDWICY SOPOCKIEJ
 OCENA WPŁYWU PH KOŃCOWEGO NA JAKOŚĆ SENSORYCZNĄ POLĘDWICY SOPOCKIEJ Jakub Krawczyk, Katarzyna Nowicka, Ewa Górska, Danuta Jaworska, Wiesław Przybylski Szkoła Główna Gospodarstwa Wiejskiego Wydział Nauk
OCENA WPŁYWU PH KOŃCOWEGO NA JAKOŚĆ SENSORYCZNĄ POLĘDWICY SOPOCKIEJ Jakub Krawczyk, Katarzyna Nowicka, Ewa Górska, Danuta Jaworska, Wiesław Przybylski Szkoła Główna Gospodarstwa Wiejskiego Wydział Nauk
Wpływ dojrzewania na kruchość mięsa - hipotezy tenderyzacji. Wstęp
 Wpływ dojrzewania na kruchość mięsa - hipotezy tenderyzacji. Piotr Domaradzki, Anna Litwińczuk Uniwersytet Przyrodniczy w Lublinie, Wydział Biologii i Hodowli Zwierząt, Katedra Towaroznawstwa i Przetwórstwa
Wpływ dojrzewania na kruchość mięsa - hipotezy tenderyzacji. Piotr Domaradzki, Anna Litwińczuk Uniwersytet Przyrodniczy w Lublinie, Wydział Biologii i Hodowli Zwierząt, Katedra Towaroznawstwa i Przetwórstwa
SPIS TREŚCI PRZEDMOWA... 7
 SPIS TREŚCI PRZEDMOWA... 7 Część I SUROWCE ZWIERZĘCE I ICH JAKOŚĆ Rozdział 1. WPROWADZENIE... 15 Rozdział 2. CHARAKTERYSTYKA ZWIERZĄT RZEŹNYCH... 22 Rozdział 3. PRODUKCJA RZEŹNIANA... 52 Rozdział 4. MIĘSO
SPIS TREŚCI PRZEDMOWA... 7 Część I SUROWCE ZWIERZĘCE I ICH JAKOŚĆ Rozdział 1. WPROWADZENIE... 15 Rozdział 2. CHARAKTERYSTYKA ZWIERZĄT RZEŹNYCH... 22 Rozdział 3. PRODUKCJA RZEŹNIANA... 52 Rozdział 4. MIĘSO
dr hab. Ewa Tomaszewska prof. UP Lublin, r. Recenzja Rozprawy doktorskiej pani mgr inż. Magdaleny Górskiej
 dr hab. Ewa Tomaszewska prof. UP Lublin, 07.12.2018 r. Katedra Fizjologii Zwierząt Wydział Medycyny Weterynaryjnej Uniwersytet Przyrodniczy w Lublinie Recenzja Rozprawy doktorskiej pani mgr inż. Magdaleny
dr hab. Ewa Tomaszewska prof. UP Lublin, 07.12.2018 r. Katedra Fizjologii Zwierząt Wydział Medycyny Weterynaryjnej Uniwersytet Przyrodniczy w Lublinie Recenzja Rozprawy doktorskiej pani mgr inż. Magdaleny
Biologiczne mechanizmy zachowania - fizjologia. zajecia 2 :
 Biologiczne mechanizmy zachowania - fizjologia zajecia 2 : 15.10.15 Kontakt: michaladammichalowski@gmail.com https://mmichalowskiuwr.wordpress.com/ I gr 08:30 10:00 II gr 10:15 11:45 III gr 12:00 13:30
Biologiczne mechanizmy zachowania - fizjologia zajecia 2 : 15.10.15 Kontakt: michaladammichalowski@gmail.com https://mmichalowskiuwr.wordpress.com/ I gr 08:30 10:00 II gr 10:15 11:45 III gr 12:00 13:30
Zmiany właściwości fizykochemicznych mięśni szkieletowych czterech kategorii bydła rzeźnego w okresie 12-dniowego dojrzewania próżniowego*
 Roczniki Naukowe Polskiego Towarzystwa Zootechnicznego, t. 10 (2014), nr 4, 125-140 Zmiany właściwości fizykochemicznych mięśni szkieletowych czterech kategorii bydła rzeźnego w okresie 12-dniowego dojrzewania
Roczniki Naukowe Polskiego Towarzystwa Zootechnicznego, t. 10 (2014), nr 4, 125-140 Zmiany właściwości fizykochemicznych mięśni szkieletowych czterech kategorii bydła rzeźnego w okresie 12-dniowego dojrzewania
ROLA DYSTROFINY W KSZTAŁTOWANIU JAKOŚCI MIĘSA POST MORTEM
 ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2016, 4 (107), 5 14 DOI: 10.15193/zntj/2016/107/133 MAGDALENA GÓRSKA ROLA DYSTROFINY W KSZTAŁTOWANIU JAKOŚCI MIĘSA POST MORTEM S t r e s z c z e n i e Na jakość mięsa
ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2016, 4 (107), 5 14 DOI: 10.15193/zntj/2016/107/133 MAGDALENA GÓRSKA ROLA DYSTROFINY W KSZTAŁTOWANIU JAKOŚCI MIĘSA POST MORTEM S t r e s z c z e n i e Na jakość mięsa
DNA musi współdziałać z białkami!
 DNA musi współdziałać z białkami! Specyficzność oddziaływań między DNA a białkami wiążącymi DNA zależy od: zmian konformacyjnych wzdłuż cząsteczki DNA zróżnicowania struktury DNA wynikającego z sekwencji
DNA musi współdziałać z białkami! Specyficzność oddziaływań między DNA a białkami wiążącymi DNA zależy od: zmian konformacyjnych wzdłuż cząsteczki DNA zróżnicowania struktury DNA wynikającego z sekwencji
Składniki cytoszkieletu. Szkielet komórki
 Składniki cytoszkieletu. Szkielet komórki aktynowe pośrednie aktynowe pośrednie 1 Elementy cytoszkieletu aktynowe pośrednie aktynowe filamenty aktynowe inaczej mikrofilamenty filamenty utworzone z aktyny
Składniki cytoszkieletu. Szkielet komórki aktynowe pośrednie aktynowe pośrednie 1 Elementy cytoszkieletu aktynowe pośrednie aktynowe filamenty aktynowe inaczej mikrofilamenty filamenty utworzone z aktyny
ILONA KOŁODZIEJSKA, MARIA SADOWSKA, ZDZISŁAW E. SIKORSKI
 Żywność. Technologia. Ja ko ść 2(11), 1997 ILONA KOŁODZIEJSKA, MARIA SADOWSKA, ZDZISŁAW E. SIKORSKI TW ARDOŚĆ MIĘSA KALMARÓW ILLEXARGENTINUS PO OBRÓBCE CIEPLNEJ Streszczenie W obrębie partii pochodzącej
Żywność. Technologia. Ja ko ść 2(11), 1997 ILONA KOŁODZIEJSKA, MARIA SADOWSKA, ZDZISŁAW E. SIKORSKI TW ARDOŚĆ MIĘSA KALMARÓW ILLEXARGENTINUS PO OBRÓBCE CIEPLNEJ Streszczenie W obrębie partii pochodzącej
POLITECHNIKA GDAŃSKA WYDZIAŁ CHEMICZNY KATEDRA TECHNOLOGII POLIMERÓW
 POLITECHNIKA GDAŃSKA WYDZIAŁ CHEMICZNY KATEDRA TECHNOLOGII POLIMERÓW PRZETWÓRSTWO TWORZYW SZTUCZNYCH I GUMY Lab 8. Wyznaczanie optimum wulkanizacji mieszanek kauczukowych na reometrze Monsanto oraz analiza
POLITECHNIKA GDAŃSKA WYDZIAŁ CHEMICZNY KATEDRA TECHNOLOGII POLIMERÓW PRZETWÓRSTWO TWORZYW SZTUCZNYCH I GUMY Lab 8. Wyznaczanie optimum wulkanizacji mieszanek kauczukowych na reometrze Monsanto oraz analiza
Tkanka mięśniowa pobudliwość kurczliwość Miofilamenty nie kurczą się, lecz przesuwają względem siebie ( główki miozyny kroczą po aktynie)
 Tkanka mięśniowa Aparat kuczliwy: miofilamenty cienkie (aktyna i białka pomocnicze) miofilamenty grube (miozyna 2) pobudliwość kurczliwość Miofilamenty nie kurczą się, lecz przesuwają względem siebie (
Tkanka mięśniowa Aparat kuczliwy: miofilamenty cienkie (aktyna i białka pomocnicze) miofilamenty grube (miozyna 2) pobudliwość kurczliwość Miofilamenty nie kurczą się, lecz przesuwają względem siebie (
Budowa i rodzaje tkanek zwierzęcych
 Budowa i rodzaje tkanek zwierzęcych 1.WskaŜ prawidłową kolejność ukazującą stopniowe komplikowanie się budowy organizmów. A. komórka tkanka organizm narząd B. organizm narząd komórka tkanka C. komórka
Budowa i rodzaje tkanek zwierzęcych 1.WskaŜ prawidłową kolejność ukazującą stopniowe komplikowanie się budowy organizmów. A. komórka tkanka organizm narząd B. organizm narząd komórka tkanka C. komórka
Tkanka łączna. komórki bogata macierz
 Tkanka łączna komórki bogata macierz (przenosi siły mechaniczne) Funkcje spaja róŝne typy innych tkanek zapewnia podporę narządom, ochrania wraŝliwe części organizmu transport substancji odŝywczych i produktów
Tkanka łączna komórki bogata macierz (przenosi siły mechaniczne) Funkcje spaja róŝne typy innych tkanek zapewnia podporę narządom, ochrania wraŝliwe części organizmu transport substancji odŝywczych i produktów
WPŁYW STABILIZACJI TEKSTURY MIĘSNYCH MAS MIELONYCH NA MOśLIWOŚCI ZASTOSOWANIA ICH W WYTWARZANIU śywności WYGODNEJ
 Agnieszka Wierzbicka Zakład Techniki w śywieniu, Szkoła Główna Gospodarstwa Wiejskiego w Warszawie WPŁYW STABILIZACJI TEKSTURY MIĘSNYCH MAS MIELONYCH NA MOśLIWOŚCI ZASTOSOWANIA ICH W WYTWARZANIU śywności
Agnieszka Wierzbicka Zakład Techniki w śywieniu, Szkoła Główna Gospodarstwa Wiejskiego w Warszawie WPŁYW STABILIZACJI TEKSTURY MIĘSNYCH MAS MIELONYCH NA MOśLIWOŚCI ZASTOSOWANIA ICH W WYTWARZANIU śywności
Fizjologia wysiłku. Marta Kaczmarska, Anna Zielińska 30 XI 2015
 Fizjologia wysiłku Marta Kaczmarska, Anna Zielińska 30 XI 2015 Węglowodany (CHO) Węglowodany glikogen i glukoza są głównym źródłem energii dla skurczu mięśni podczas intensywnego wysiłku, a zmęczenie podczas
Fizjologia wysiłku Marta Kaczmarska, Anna Zielińska 30 XI 2015 Węglowodany (CHO) Węglowodany glikogen i glukoza są głównym źródłem energii dla skurczu mięśni podczas intensywnego wysiłku, a zmęczenie podczas
Statyka Cieczy i Gazów. Temat : Podstawy teorii kinetyczno-molekularnej budowy ciał
 Statyka Cieczy i Gazów Temat : Podstawy teorii kinetyczno-molekularnej budowy ciał 1. Podstawowe założenia teorii kinetyczno-molekularnej budowy ciał: Ciała zbudowane są z cząsteczek. Pomiędzy cząsteczkami
Statyka Cieczy i Gazów Temat : Podstawy teorii kinetyczno-molekularnej budowy ciał 1. Podstawowe założenia teorii kinetyczno-molekularnej budowy ciał: Ciała zbudowane są z cząsteczek. Pomiędzy cząsteczkami
CZYNNIKI WPŁYWAJĄCE NA JAKOŚĆ MIĘSA WIEPRZOWEGO FACTORS EFFECTING QUALITY OF PORK MEAT
 Jolanta Sienkiewicz *, Diana Lewandowska ** CZYNNIKI WPŁYWAJĄCE NA JAKOŚĆ MIĘSA WIEPRZOWEGO FACTORS EFFECTING QUALITY OF PORK MEAT Przez jakość mięsa rozumieć należy zespół wszystkich istotnych dla surowca
Jolanta Sienkiewicz *, Diana Lewandowska ** CZYNNIKI WPŁYWAJĄCE NA JAKOŚĆ MIĘSA WIEPRZOWEGO FACTORS EFFECTING QUALITY OF PORK MEAT Przez jakość mięsa rozumieć należy zespół wszystkich istotnych dla surowca
ZASTOSOWANIE INULINY JAKO ZAMIENNIKA TŁUSZCZU W ANALOGACH SERA TOPIONEGO. Bartosz Sołowiej
 ZASTOSOWANIE INULINY JAKO ZAMIENNIKA TŁUSZCZU W ANALOGACH SERA TOPIONEGO Bartosz Sołowiej Uniwersytet Przyrodniczy w Lublinie Wydział Nauk o Żywności i Biotechnologii Zakład Technologii Mleka i Hydrokoloidów
ZASTOSOWANIE INULINY JAKO ZAMIENNIKA TŁUSZCZU W ANALOGACH SERA TOPIONEGO Bartosz Sołowiej Uniwersytet Przyrodniczy w Lublinie Wydział Nauk o Żywności i Biotechnologii Zakład Technologii Mleka i Hydrokoloidów
Podstawowe zagadnienia z zakresu fizjologii wysiłku.
 Podstawowe zagadnienia z zakresu fizjologii wysiłku. Budowa mięśni szkieletowych: Tkanka mięśniowa szkieletowa nazywana także poprzecznie prążkowaną zbudowana jest z brzuśca, w którego skład wchodzą włókna
Podstawowe zagadnienia z zakresu fizjologii wysiłku. Budowa mięśni szkieletowych: Tkanka mięśniowa szkieletowa nazywana także poprzecznie prążkowaną zbudowana jest z brzuśca, w którego skład wchodzą włókna
Politechnika Gdańska
 Politechnika Gdańska Wydział Mechaniczny Katedra Energetyki i Aparatury Przemysłowej Seminarium z Współczesnych Technik Zamrażania Temat: 2. Własności termofizyczne produktów żywnościowych świeżych i po
Politechnika Gdańska Wydział Mechaniczny Katedra Energetyki i Aparatury Przemysłowej Seminarium z Współczesnych Technik Zamrażania Temat: 2. Własności termofizyczne produktów żywnościowych świeżych i po
Tkanki. Tkanki. Tkanka (gr. histos) zespół komórek (współpracujących ze sobą) o podobnej strukturze i funkcji. komórki. macierz zewnątrzkomórkowa
 Tkanki Tkanka (gr. histos) zespół komórek (współpracujących ze sobą) o podobnej strukturze i funkcji komórki Tkanki macierz zewnątrzkomórkowa komórki zwierzęce substancja międzykomórkowa protoplasty roślin
Tkanki Tkanka (gr. histos) zespół komórek (współpracujących ze sobą) o podobnej strukturze i funkcji komórki Tkanki macierz zewnątrzkomórkowa komórki zwierzęce substancja międzykomórkowa protoplasty roślin
WSPÓŁCZESNE TECHNIKI ZAMRAŻANIA (seminarium)
 WSPÓŁCZESNE TECHNIKI ZAMRAŻANIA (seminarium) Temat: Ocena jakościowa i ekonomiczna kriogenicznego ( szokowego ) zamrażania wybranych produktów żywnościowych. Wykonał: Szczepkowski Mariusz Wydział Mechaniczny
WSPÓŁCZESNE TECHNIKI ZAMRAŻANIA (seminarium) Temat: Ocena jakościowa i ekonomiczna kriogenicznego ( szokowego ) zamrażania wybranych produktów żywnościowych. Wykonał: Szczepkowski Mariusz Wydział Mechaniczny
WPŁYW WYSOKICH CIŚNIEŃ NA MIĘSO
 Żywność. Technologia. Jakość 4(13), 1997 WPŁYW WYSOKICH CIŚNIEŃ NA MIĘSO Wprowadzenie Zainteresowanie stosowaniem wysokich ciśnień rzędu 100-1000 MPa w biologii i przetwórstwie żywnościowym wzrasta z uwagi
Żywność. Technologia. Jakość 4(13), 1997 WPŁYW WYSOKICH CIŚNIEŃ NA MIĘSO Wprowadzenie Zainteresowanie stosowaniem wysokich ciśnień rzędu 100-1000 MPa w biologii i przetwórstwie żywnościowym wzrasta z uwagi
Czynniki wpływające na wydatek serów dojrzewających
 Czynniki wpływające na wydatek serów dojrzewających Wydatek sera - jest to ilość kilogramów sera otrzymana ze 100 kilogramów mleka Wrz = MS/Mm *100 gdzie : Ms masa sera w kg Mm masa mleka w kg Określenie
Czynniki wpływające na wydatek serów dojrzewających Wydatek sera - jest to ilość kilogramów sera otrzymana ze 100 kilogramów mleka Wrz = MS/Mm *100 gdzie : Ms masa sera w kg Mm masa mleka w kg Określenie
Temat: Budowa i działanie narządu wzroku.
 Temat: Budowa i działanie narządu wzroku. Oko jest narządem wzroku. Umożliwia ono rozróżnianie barw i widzenie przedmiotów znajdujących się w różnych odległościach. Oko jest umiejscowione w kostnym oczodole.
Temat: Budowa i działanie narządu wzroku. Oko jest narządem wzroku. Umożliwia ono rozróżnianie barw i widzenie przedmiotów znajdujących się w różnych odległościach. Oko jest umiejscowione w kostnym oczodole.
Starzenie skóry. Genetyczne. Środowiskowe
 ZAFFIRO Starzenie skóry Genetyczne Środowiskowe Zmiany zachodzące w procesie starzenia skóry Pogrubienie naskórka z zanikiem warstwy ziarnistej i kolczystej Zmniejszenie grubości skóry i tkanki podskórnej
ZAFFIRO Starzenie skóry Genetyczne Środowiskowe Zmiany zachodzące w procesie starzenia skóry Pogrubienie naskórka z zanikiem warstwy ziarnistej i kolczystej Zmniejszenie grubości skóry i tkanki podskórnej
Zdzisław Marek Zagrobelny Woźniewski W ro c ła w iu
 Zdzisław Zagrobelny Marek Woźniewski Wrocławiu Akademia Wychowania Fizycznego we Wrocławiu Zdzisław Z agrobelny M arek W oźeiewsm BIOMECHANIKA KLINICZNA część ogólna Wrocław 2007 Spis treści Podstawy biomfci
Zdzisław Zagrobelny Marek Woźniewski Wrocławiu Akademia Wychowania Fizycznego we Wrocławiu Zdzisław Z agrobelny M arek W oźeiewsm BIOMECHANIKA KLINICZNA część ogólna Wrocław 2007 Spis treści Podstawy biomfci
Naprężenia i odkształcenia spawalnicze
 Naprężenia i odkształcenia spawalnicze Cieplno-mechaniczne właściwości metali i stopów Parametrami, które określają stan mechaniczny metalu w różnych temperaturach, są: - moduł sprężystości podłużnej E,
Naprężenia i odkształcenia spawalnicze Cieplno-mechaniczne właściwości metali i stopów Parametrami, które określają stan mechaniczny metalu w różnych temperaturach, są: - moduł sprężystości podłużnej E,
APARATURA BADAWCZA I DYDAKTYCZNA
 APARATURA BADAWCZA I DYDAKTYCZNA Wpływ metod obróbki termicznej i temperatury wewnątrz mięśni na jakość sensoryczną mięsa kurcząt brojlerów ANNA AUGUSTYŃSKA-PREJSNAR, MAŁGORZATA ORMIAN, ZOFIA SOKOŁOWICZ
APARATURA BADAWCZA I DYDAKTYCZNA Wpływ metod obróbki termicznej i temperatury wewnątrz mięśni na jakość sensoryczną mięsa kurcząt brojlerów ANNA AUGUSTYŃSKA-PREJSNAR, MAŁGORZATA ORMIAN, ZOFIA SOKOŁOWICZ
Komórka eukariotyczna organizacja
 Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma podstawowa (cytozol) organelle cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma podstawowa (cytozol) organelle cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja
 Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma organelle podstawowa (cytozol) cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma organelle podstawowa (cytozol) cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Making the impossible possible: the metamorphosis of Polish Biology Olympiad
 Making the impossible possible: the metamorphosis of Polish Biology Olympiad Takao Ishikawa Faculty of Biology, University of Warsaw, Poland Performance of Polish students at IBO Gold Silver Bronze Merit
Making the impossible possible: the metamorphosis of Polish Biology Olympiad Takao Ishikawa Faculty of Biology, University of Warsaw, Poland Performance of Polish students at IBO Gold Silver Bronze Merit
MIKROSKOPIA METALOGRAFICZNA
 MIKROSKOPIA METALOGRAFICZNA WYKŁAD 3 Stopy żelazo - węgiel dr inż. Michał Szociński Spis zagadnień Ogólna charakterystyka żelaza Alotropowe odmiany żelaza Układ równowagi fazowej Fe Fe 3 C Przemiany podczas
MIKROSKOPIA METALOGRAFICZNA WYKŁAD 3 Stopy żelazo - węgiel dr inż. Michał Szociński Spis zagadnień Ogólna charakterystyka żelaza Alotropowe odmiany żelaza Układ równowagi fazowej Fe Fe 3 C Przemiany podczas
ROLA WAPNIA W FIZJOLOGII KOMÓRKI
 ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
