Chemia z bliska 2017
|
|
|
- Adam Pietrzak
- 8 lat temu
- Przeglądów:
Transkrypt
1 Polskie Towarzystwo Chemiczne ddział Gdański Chemia z bliska 2017 warsztaty przy stole laboratoryjnym i komputerze Materiały Barbara Becker Anna Mietlarek-Kropidłowska Andrzej kuniewski Agnieszka Pladzyk Gdańsk, 7 czerwca 2017
2 Komitet organizacyjny: prof. dr hab. inż. Barbara Becker (PG) dr hab. Dagmara Jacewicz (UG) dr hab. Wojciech Kamysz (GUMed) dr inż. Anna Mietlarek-Kropidłowska (PG) dr inż. Andrzej kuniewski (PG) dr Dariusz Wyrzykowski (UG) Sponsor: 2017 by Polskie Towarzystwo Chemiczne ddział Gdański ul. G. Narutowicza 11/ Gdańsk
3 Wprowadzenie prof. dr hab. inż. Barbara Becker Podobnie jak w roku 2016 kolejne spotkanie, któremu nadaliśmy nazwę Chemia z bliska ma aspekt bardzo praktyczny. Nie tylko dlatego, że biorą w nim udział uczniowie, także dlatego, że jest to forum, na którym poglądy mogą wymienić nauczyciele szkół ponadpodstawowych i nauczyciele akademiccy. Jest to przy tym spotkanie o charakterze roboczym, bo jak inaczej można kwalifikować formę warsztatów? Tegoroczne warsztaty zachowują w znacznym stopniu charakter jaki nadaliśmy im w roku ubiegłym. W znacznym, ale nie do końca. 150-lecie urodzin Marii Skłodowskiej-Curie w sposób naturalny ukierunkowało tematykę wykładu plenarnego. Żyjemy w świecie, który zawsze był choć trochę radioaktywny i warto o tym pamiętać. Dziś radioaktywność usiłujemy oswoić i wykorzystać tę właściwość części otaczającej nas materii, nie zawsze z dobrym skutkiem. Przeciętny zjadacz chleba może tego nie widzi, ale chemia stanowi bardzo istotny element naszego życia. Sami jesteśmy niesamowicie skomplikowanymi organizmami, które funkcjonują realizując nieprawdopodobną liczbę reakcji. Ale czy jedząc śniadanie mamy wrażenie, że dokonujemy szeregu przemian chemicznych? Prostota pewnych codziennych czynności, w rzeczywistości bardzo chemicznych, każe nam szukać inspiracji do prowadzonych warsztatów w życiu codziennym i najbliższym otoczeniu. Taka jest geneza panelu eksperymentalnego dla nauczycieli, gdzie wykorzystując witaminę C, lub wręcz zawierający ją sok owocowy, jodynę i wodę utlenioną z apteki można pokazać frapujące i, dla słabo zorientowanych, wręcz magiczne reakcje tzw. zegarowe. Nasuwa mi się w tym miejscu myśl o wielu uroczystościach szkolnych, akademii ku czci, itp. gdzie uczniowie prezentują swoje umiejętności np. śpiewu, tańca, gry czy deklamacji. Może czasem warto pokazać coś spoza tego kręgu, np. prostą, bardzo bezpieczną, ale też dość czarodziejską i bardzo medialną reakcję chemiczną? Wszyscy wiemy, że dużo osób, nie tylko uczniów, mówi, że chemii nie lubi, ale eksperymenty chemiczne jednak ogląda z dużym zaciekawieniem. A jeżeli czarodziejem będzie uczeń, przygotowany do czarów przez nauczyciela? Aspekt chemii związanej z życiem przyświecał nam też w przygotowaniu prostych, ale przydatnych zajęć dla uczniów. Tegoroczną nowością jest bowiem czynne zaangażowanie uczniów w panele eksperymentalne. Wybraliśmy to, co jest łatwe do wykonania, nie wymaga zaawansowanej wiedzy chemicznej i może być dostosowane do uczniów o różnym poziomie gimnazjum i liceum. Będzie okazja do poznania podstawowych właściwości chemicznych prostych jonów sześciu metali bloku d Cr, Mn, Fe, Co, Ni i Zn. Większość z nich tworzy barwne sole i wszystkie mają podstawową cechę wspólną są nam absolutnie niezbędne do życia, chociaż niekiedy w bardzo małych ilościach. Można będzie poeksperymentować i na końcu sprawdzić się w roli Sherlocka olmesa dokonując identyfikacji nieznanej próbki. Drugi panel warsztatowy, podobnie jak w roku ubiegłym, wykorzysta laboratoria komputerowe Wydziału Chemicznego PG. Mamy nadzieję, że zajęcia przy komputerach, a więc chemia trochę wirtualna, będą mogły pokazać to, czego w rzeczywistości łatwo nie da się zobaczyć, czy wyjaśnić na płaskiej i nieruchomej kartce papieru. Powszechność komputerów i dostęp do darmowego oprogramowania niewątpliwie stwarzają taką szansę. 1
4 Warsztaty komputerowe Izomeria optyczna dr inż. Andrzej kuniewski d kiedy tylko ludzie wytwarzali wino znana była osadzająca się w zbiornikach fermentacyjnych substancja nazywana kamieniem winnym (Ryc. 1). Dziś wiemy, że jest to słabo rozpuszczalny wodorowinian potasu KC446. Wolny kwas winowy 2C446 (Ryc. 2) został wyodrębniony z kamienia winnego ok. 800 roku przez arabskiego alchemika Dżabira Ibn ajjana. W 1832 roku francuski fizyk Jean Baptiste Biot zaobserwował, że kwas winowy i jego sole zmieniają kierunek polaryzacji światła. Francuski biolog i chemik Louis Pasteur w 1847 roku prowadząc badania nad kwasem winowym i jego solami zauważył, że analogiczne związki o identycznym składzie wytworzone metodami laboratoryjnymi (a nie pozyskane z procesu fermentacji) nie wykazują właściwości skręcania płaszczyzny światła spolaryzowanego. Zauważył on ponadto, że w przeciwieństwie do pochodzących z wina, kryształy otrzymane w laboratorium występują w dwóch formach, które są swoimi zwierciadlanymi odbiciami (Ryc. 3). Z kopciuszkową precyzją rozdzielił on te dwa rodzaje kryształów. Po rozdziale okazało się, że jedna frakcja skręcała światło spolaryzowane tak, jak znany wcześniej kwas winowy otrzymany z kamienia winnego, natomiast druga frakcja skręcała płaszczyznę polaryzacji o ten sam kąt, ale w przeciwnym kierunku. Pasteur zasugerował, że podobnie jak kryształy tak i cząsteczki samego związku muszą być swoimi nieidentycznymi lustrzanymi odbiciami podobnie jak prawa i lewa ręka. Tak narodziła się idea chiralności (gr. χειρ ręka ). Szybko zauważono, że wszystkie cząsteczki związków organicznych, w których do jednego atomu węgla przyłączone są cztery różne podstawniki wykazują czynność optyczną, o ile nie są zmieszane w równomolowym stosunku z cząsteczkami będącymi ich lustrzanym odbiciem (tzw. enancjomery) taką mieszaninę nie wykazującą czynności optycznej nazwano mieszaniną racemiczną. Z biegiem lat okazało się, że mogą istnieć cząsteczki z asymetrycznymi atomami węgla niewykazujące czynności optycznej, jak również cząsteczki wykazujące czynność optyczną bez asymetrycznych atomów węgla, ale to już opowieść na inną okazję Cel zajęć Celem warsztatów komputerowych jest zaznajomienie uczestników z wybranymi możliwościami pakietu ADC/ChemSketch w zakresie tworzenia wzorów i projekcji stereochemicznych, trójwymiarowej wizualizacji cząsteczek, określania konfiguracji bezwzględnej oraz tworzenia nazw prostych związków optycznie czynnych (aminokwasy, cukry). Zajęcia będą realizowane z wykorzystaniem pakietu chemicznego ADC/ChemSketch Bezpłatna wersja jest już zainstalowana na komputerach w pracowni, natomiast na własne potrzeby można program pobrać ze strony internetowej: 2 Ryc. 1. Kryształy wodorowinianu potasu na korku od wina [1]. Ryc. 2. Wzór strukturalny kwasu winowego. Ryc. 3. Pokrój kryształów kwasu winowego [1].
5 Ćwiczenie 1. Tworzenie wzorów stereostrukturalnych W niniejszym ćwiczeniu stworzymy wzory stereostrukturalne, które poza połączeniem atomów ilustrują ich ułożenie w przestrzeni. W myśl przyjętej konwencji pogrubiony klin informuje, że atom lub grupa atomów na jego poszerzonym końcu znajduje się ponad płaszczyzną rysunku. Natomiast atomy lub ich grupy znajdujące się pod płaszczyzną rysunku oznacza się przy pomocy przerywanej linii lub prążkowanego klina jednak w tym przypadku kierunek klina nie ma znaczenia (Ryc. 4). Ryc. 4. Trzy równoważne wzory ukazujące tetraedryczną geometrię cząsteczki metanu. Najpowszechniej stosowana jest reprezentacja pierwsza. Związki optycznie czynne izolowano początkowo z produktów naturalnych pochodzenia organicznego. Jest to spowodowane tym, że enzymy, które katalizują ich powstawanie w roślinach i zwierzętach są związkami chiralnymi. To, dlaczego tak jest, pozostaje do dziś niewyjaśnioną tajemnicą, choć istnieje kilka hipotez. Enzymy białkowe są biopolimerami zbudowanymi z α-aminokwasów połączonych wiązaniami peptydowymi: R 1 N R 2 N R 3 Ryc. 5. Wzór strukturalny fragmentu polipeptydu (białka, enzymu ). kazuje się, że 19 z 20 kanonicznych aminokwasów białkowych to związki optycznie czynne (patrz tabela na kolejnej stronie). Co więcej, wszystkie z biogennych aminokwasów mają takie samo przestrzenne rozmieszczenie grupy aminowej, karboksylowej, atomu wodoru i podstawnika nazywamy je L-aminokwasami. oznaczeniach D i L powiemy w ćwiczeniu 3. Zadania 1. Przećwicz obsługę programu ACD/ChemSketch w zakresie rysowania wiązań oraz modyfikacji etykiet atomów i grup funkcyjnych. 2. Wykonaj wzór strukturalny dla trzech wybranych przez siebie optycznie czynnych aminokwasów i przedstaw je analogicznie jak w tabeli na kolejnej stronie. Nie przejmuj się nierównymi długościami wiązań i kątami pomiędzy nimi. 3. Wiązania do grupy aminowej zamień na kliny przerywane. 4. Zaznacz pierwszą cząsteczkę i popraw jej wygląd przy użyciu narzędzia Clean Structure. Podobnie popraw wygląd pozostałych dwóch cząsteczek. Możesz też poprawić wszystkie cząsteczki na raz jeśli nie dokonasz zaznaczenia. 5. Przycisk Clean Structure możesz klikać po wielokroć (zwykle otrzymując kilka propozycji wyidealizowanej struktury zaznaczonej cząsteczki). 6. Zwróć uwagę, że czasem klin przerywany zamieniany jest na wypełniony i vice versa. Czy wiesz dlaczego, skoro geometria cząsteczki i jej czynność optyczna pozostają niezmienione? 3
6 glicyna G Gly L-alanina A Ala L-walina V Val L-leucyna L Leu L-izoleucyna I Ile L-metionina M Met L-fenyloalanina F Phe L-tyrozyna Y Tyr S L-seryna S Ser L-treonina T Thr L-cysteina C Cys L-prolina P Pro N S L-asparagina N Asn kwas L-asparaginowy D Asp L-glutamina Q Gln kwas L-glutaminowy E Glu N 2 N 2 L-lizyna K Lys L-arginina R Arg L-tryptofan W Trp L-histydyna is N N N N N 2 N 4
7 D-aldoheksozy: D-alloza D-altroza D-glukoza D-mannoza D-guloza D-idoza D-galaktoza D-taloza D-ketoheksozy: D-psikoza D-fruktoza D-sorboza D-tagatoza D-aldopentozy: D-arabinoza D-ksyloza D-liksoza D-ryboza D-ketopentozy: D-rybuloza D-ksyluloza 5
8 Ćwiczenie 2. Wizualizacja cząsteczek w 3D Program ACD/ChemSketch posiada moduł wizualizacji 3D, w którym możemy obracać cząsteczki w przestrzeni. W celu uzyskania trójwymiarowej struktury z dwuwymiarowego rysunku program wykorzystuje mechanikę molekularną. Jest to prosta metoda chemii obliczeniowej wykorzystująca do modelowania układów cząsteczkowych mechanikę klasyczną. Atomy w cząsteczkach traktowane są jak niewielkie kulki połączone sprężystymi wiązaniami (Rys. 6). Podejście takie wymaga małej mocy obliczeniowej, a co za tym idzie szybko pozwala uzyskać wynik. Proste metody mają jednak swoje wady. Zdarza się tak, że uzyskana geometria cząsteczki znacząco odbiega od rzeczywistej jest to szczególnie częste dla układów elastycznych, wielkocząsteczkowych. Możliwość wizualizacji i obracania cząsteczek w 3D na komputerze znakomicie ułatwia naukę i pracę osobom ze słabszą wyobraźnią przestrzenną bez konieczności konstruowania modeli z kosztownych elementów. Zadania Ryc. 6. Model cząsteczki formaldehydu w formie kulek połączonych sprężynkami. 1. Uruchom moduł 3D wybierając w menu ACD/Labs opcję 3D Viewer. Pojawi się czarne okno. Powróć do stworzonych przez siebie struktur wybierając zakładkę ChemSketch na dole ekranu (możesz również użyć skrótu klawiaturowego Alt+1). 2. Zaznacz wybraną cząsteczkę i wybierz opcję Copy to 3D (Alt+2). Zobaczysz wybraną cząsteczkę w module 3D, jednak gdy spróbujesz ją obrócić okaże się, że jest ona płaska. W celu uzyskania struktury przestrzennej wykorzystaj opcję 3D ptimization. 3. Sprawdź czy wygenerowana struktura ma sens chemiczny. Jeśli zauważysz jakieś anomalie może być potrzebna ponowna optymalizacja lub rozpoczęcie procesu od początku. 4. Wykorzystaj pasek menu do obracania struktury i zmiany jej reprezentacji. Eksperymentuj śmiało, to tylko komputer, więc nic nie wybuchnie ;) 5. W podobny sposób spróbuj zwizualizować trójwymiarowe struktury pozostałych dwóch cząsteczek aminokwasów bądź dowolnych innych. Ćwiczenie 3. Projekcja Fischera Celem przedstawienia przestrzennej budowy związku na płaskiej kartce papieru wykorzystuje się projekcje. Jedną z pierwszych była projekcja opracowana przez ermanna Emila Fischera w 1891 dla cząsteczek cukrów. Projekcję tę można wyobrazić sobie jako cień powstały na płaszczyźnie w wyniku prostopadłego oświetlenia cząsteczki ustawionej zgodnie z pewnymi zasadami (Ryc. 7). Najprostszą optycznie czynną cząsteczką węglowodanową jest aldehyd glicerynowy (Ryc. 8). Fischer przyjął, że grupa aldehydowa znajdzie się na górze rysunku, a enancjomer skręcający płaszczyznę światła spolaryzowanego w prawo będzie posiadał w projekcji grupę przy chiralnym atomie węgla po prawej stronie i określił go mianem izomeru D (łc. dexter prawy ). Izomer przeciwny został oznaczony jako L (łc. lævus lewy ). Wiązania wzdłuż łańcucha skierowane są pod, a wiązania prostopadłe nad płaszczyznę rysunku. 6 Ryc. 7. Wizualizacja projekcji Fischera [1]. C C 2 Ryc. 8. Cząsteczka aldehydu D-glicerynowego.
9 W przypadku cukrów, które posiadają więcej centrów asymetrii oznaczenie D/L odnosi się do konfiguracji na asymetrycznym atomie węgla najbardziej oddalonym od grupy karbonylowej. Co ciekawe, cukry syntezowane przez organizmy żywe, mają jednakową konfigurację na tym atomie węgla i jest ona taka sama jak w aldehydzie D-glicerynowym (podobnie wszystkie aminokwasy występują w formie L, co oznacza, że grupa aminowa znajduje się po lewej stronie w projekcji Fischera, jeśli grupa karboksylowa zostanie umieszczona u góry, a podstawnik na dole). Należy pamiętać, że projekcji Fischera nie wolno obracać, gdyż może to zmieni konfigurację asymetrycznych atomów, Diastereoizomery (czyli izomery optyczne niebędące swoimi odbiciami lustrzanymi) dla cukrów zawierających sześć (heksozy) oraz pięć (pentozy) atomów węgla w formie łańcuchowych aldehydów (aldozy) i ketonów (ketozy) zestawione zostały w tabelach na stronie 5. Zadania 1. Stwórz projekcję Fischera aldehydu D-glicerynowego, która powinna wyglądać tak, jak na rysunku po prawej (grupy funkcyjne możesz dodać jako całe etykiety lub rysując je w pełni strukturalnie). 2. Dokonaj optymalizacji 3D dla tej cząsteczki. Ponieważ pierwotny rysunek był płaski masz równe szanse na otrzymanie struktury izomeru D i L. 3. Sprawdź, jaki z izomerów wygenerował program, ustawiając cząsteczkę zgodnie z zaleceniami Fischera (grupa aldehydowa u góry, wiązania C C do tyłu, wiązania C i C do przodu). 4. W sytuacji gdyby wygenerowana struktura była enancjomerem L możesz ją łatwo zmienić klikając przycisk Mirror (odbija cząsteczkę w lustrze) lub wybierając opcję Invert Center i klikając w chiralny atom węgla (zmienia konfigurację na konkretnym atomie). W tym drugim przypadku może okazać się konieczna ponowna optymalizacja struktury. 5. Na podstawie tabel na stronie 5 spróbuj wykonać wzór Fishera dla wybranego przez siebie cukru. Dla ułatwienia możesz posłużyć się modułem 3D, który masz już opanowany. 6. Stwórz projekcję Fischera dla wybranego przez siebie L-aminokwasu (strona 4). Wykorzystaj poznane dotąd narzędzia. Ćwiczenie 4. Projekcja awortha Reakcja grupy karbonylowej aldehydów i ketonów z alkoholami prowadzi do powstawania odpowiednio hemiacetali i hemiketali (gr. χημι pół, ponieważ tylko jedna grupa jest przyłączana, choć w przypadku reakcji międzycząsteczkowych mogą przyłączyć się dwie). Tak się składa, że w cząsteczkach cukrów występują zarówno grupy karbonylowe, jak i hydroksylowe, zatem istnieje możliwość reakcji wewnątrzcząsteczkowej prowadzącej do powstania cyklicznych hemiacetali i hemiketali. Właściwości takie wykazują pentozy oraz heksozy tworząc pierścienie pięcio- (furanozy) i sześcioczłonowe (piranozy). Nazwy pochodzą od podstawowych pierścieni: C C 2 furan 2-piran Pierścienie te po nachyleniu i zamianie wiązań na kliny są podstawą projekcji awortha. W projekcjach tych, dla cukrów D, terminalna we wzorze linowym grupa C2 znajduje się w górnej części rysunku, a pozostałe są do niej dopasowane tak, aby zachować ich konfigurację. 7
10 W wyniku tworzenia się wiązania hemiacetalowego (hemiketalowego) powstaje nowe centrum stereogeniczne (chiralny atom węgla). W zależności od uwarunkowań może ono przyjąć jedną z dwóch konformacji, które zwykło się określać jako anomery α i β. Izomer α posiada grupę przy anomerycznym atomie węgla (oznaczonym poniżej gwiazdką) skierowaną przeciwnie do terminalnej grupy C2, co w przypadku cukrów D oznacza, że jest ona pod płaszczyzną pierścienia. C 2 C 2 α-d-glukopiranoza β-d-glukopiranoza C 2 C 2 C 2 C 2 α-d-fruktofuranoza β-d- fruktofuranoza Zadania 1. Dla wprawy stwórz projekcję awortha jednego z cukrów przedstawionych powyżej. 2. Następnie stwórz projekcje awortha dla dwóch wybranych przez siebie cukrów spośród tych, które zestawione zostały w tabelach na stronie 5. Ćwiczenie 5. kreślanie konfiguracji absolutnej i nazewnictwo Konwencja konfiguracji względnej D/L jest stosowana praktycznie tylko dla aminokwasów i cukrów. W latach 50. XX wieku naukowcy R. S. Cahn, C. K. Ingold i V. Prelog opracowali bardziej uniwersalny system nazywany konfiguracją absolutną R/S. (łc. rectus prawy, sinister lewy ). Aby określić konfigurację danego atomu należy ustalić pierwszeństwo podstawników: pierwszeństwie podstawnika decyduje liczba atomowa atomu, który jest bezpośrednio przyłączony do centrum chiralności. W wypadku izotopów, o pierwszeństwie decyduje większa liczba masowa. Jeśli podstawniki łączą się z centrum chiralności atomami tego samego pierwiastka, to bierze się pod uwagę kolejne atomy. Jeśli atom A jest połączony z B wiązaniem podwójnym, to traktuje się to wiązanie jako pojedyncze oraz do atomu A przyłącza się kolejny, wirtualny atom B, który dalej nie łączy się z innymi atomami. Jeśli podstawniki różnią się tylko rozmieszczeniem atomów to podstawnik R ma pierwszeństwo przed S, a Z ma pierwszeństwo przed E. Wolne pary elektronowe mają najniższe pierwszeństwo. 8
11 Cząsteczkę związku ustawia się następnie tak, aby podstawnik o najniższym pierwszeństwie znajdował się z tyłu i sprawdza się, czy podczas obracania grupy wraz ze wzrostem pierwszeństwa podstawników dokonuje się obrotu w prawo (izomer R), czy w lewo (izomer S) izomer R izomer S W programie ChemSketch istnieje również możliwość automatycznego określania geometrii, jak również nadawania nazw związkom optycznie czynnym (moduł ACD/Name). Zadania 1. kreśl konfigurację absolutną poniższych związków. W tym celu: a. Przerysuj wzory do programu ChemSketch b. Stwórz modele 3D (w razie potrzeby pamiętaj by zmienić konfigurację centrum stereogenicznego po optymalizacji 3D) c. kreśl pierwszeństwo podstawników i ustaw cząsteczkę zgodnie z zaleceniami CIP d. Przypisz centrom stereogenicznym odpowiednią konfigurację 2. kreśl konfigurację tych samych związków przy pomocy opcji Tools > Generate > Stereo Descriptors i sprawdź, czy wyniki się zgadzają. 3. Na koniec wygeneruj nazwy związków przy pomocy Tools > Generate > Name for structure, aby sprawdzić jak należy umieszczać deskryptory w nazwie. Nazwy zanotuj pod wzorami związków. Cl C C 2 9
12 Warsztaty laboratoryjne dla nauczycieli Chemiczny zegar jodowy dr hab. inż. Agnieszka Pladzyk Reakcje określane pojęciem zegarowych należą do grupy reakcji chemicznych, które polegają na równoległym zachodzeniu dwóch reakcji: szybkiej i wolnej, a ich efekt nie jest widoczny od razu po zmieszaniu substratów, ale dopiero po pewnym czasie. Przykładem jest tzw. zegar jodowy, często nazywany również reakcją arcourta od nazwiska jej twórcy angielskiego chemika Augustusa G. V. arcourta ( ). Reakcja polega na utlenianiu jodków do I2 i ich automatycznej redukcji przez tiosiarczany z powrotem do jodków w obecności skrobi pełniącej rolę wskaźnika. Do przeprowadzenia oryginalnej reakcji potrzebujemy 1% roztwór jodku potasu KI, 4% roztwór kwasu solnego Cl (może być nawet kwas octowy), 0,1% roztwór tiosiarczanu sodu Na2S23, wskaźnik skrobiowy (łyżeczka kleiku skrobiowego) oraz wodę utlenioną (roztwór nadtlenku wodoru 22 o stężeniu 3%). Po zmieszaniu wszystkich reagentów w podanej kolejności zaczynają zachodzić następujące procesy: 1. powolna reakcja utleniania jodków przez nadtlenek wodoru: 2 I I szybka reakcja tiosiarczanów z powstałym I2 prowadząca do powstania jodków I i tetrationianów S46 2 I2 + 2 S I + S46 2 Jony jodkowe są powoli utleniane przez nadtlenek wodoru do wolnego jodu I2, który bardzo szybko jest redukowany przez tiosiarczany, dlatego też nie reaguje ze skrobią. Mieszanina reakcyjna pozostaje bezbarwna aż do momentu zużycia tiosiarczanów. Gdy ich zabraknie, powstający w pierwszej reakcji pierwiastkowy jod w obecności skrobi spowoduje zabarwienie się mieszaniny na charakterystyczny ciemnoniebieski kolor. Dzieje się tak, gdyż skrobia, polimer zbudowany m. in. z cząsteczek wielocukru amylozy, tworzy kompleks z wolnym jodem, a dokładniej z jonem I3 tworzonym przez wolny jod I2 i jony jodkowe I (Ryc. 1). Ryc. 1. Schemat przedstawiający strukturę łańcucha skrobi złożonego z amylozy (po lewej) [1] i kompleksu skrobi z jonem I3 [2]. Reakcja arcourta może być modyfikowana poprzez zmianę stężenia reagentów czy temperatury mieszaniny, co dodatkowo pozwala zrozumieć jak wspomniane parametry wpływają na szybkość reakcji. Ponieważ substraty do tej klasycznej reakcji są tanie i stosunkowo łatwo dostępne, można ją przeprowadzić nawet w skromnie wyposażonym laboratorium szkolnym. Dostępną praktycznie dla każdego ucznia, domową wersją reakcji zegarowej jest ta wykorzystująca jako substraty jodynę, wodę utlenioną oraz witaminę C. Wszystkie trzy specyfiki są tanie i sprzedawane w aptece bez recepty. Mimo prostoty wykonania jest to reakcja niezwykle efektowna. 10
13 W przypadku domowej reakcji zegarowej reduktorem zamiast tiosiarczanu jest kwas L-askorbinowy (Ryc. 2), czyli witamina C, a źródłem jodu i jonów jodkowych jest jodyna (rozcieńczony roztwór I2 w 90% etanolu z dodatkiem jodku potasu). Jako utleniacz służy woda utleniona, czyli 3% roztwór nadtlenku wodoru w wodzie. Ryc. 2. Budowa cząsteczki kwasu L-askorbinowego i produktu jego utlenienia. Tak jak to ma miejsce w klasycznej reakcji arcourta z tiosiarczanami, jodki utleniane są przez wodę utlenioną do wolnego jodu (reakcja powolna). Powstały jod jest z kolei redukowany z powrotem do jodków przez kwas askorbinowy (reakcja szybka): 2 I + 22 I2 + 2 (wolno) I2 + C686 (wit. C) 2 I + C (szybko) Przy dostatecznej ilości nadtlenku wodoru koniec reakcji jest determinowany przez dostępność reduktora, jakim jest kwas askorbinowy. Całkowite zużycie kwasu askorbinowego uniemożliwia bowiem redukcję jodu do jodków i dzięki utrzymującej się obecności I2 pojawia się zabarwienie pochodzące od kompleksu ze skrobią. Tę samą reakcję możemy przeprowadzić z wykorzystaniem produktów zawierających witaminę C, np. wyciśnięty sok z cytryny (średnia zawartość witaminy C wynosi 53 mg/100 g soku wg USDA National Nutrient Database) czy inny sok owocowy. Część doświadczalna Wersja z witaminą C dczynniki: woda destylowana 60 ml witamina C (tabletka musująca 1000 mg) jodyna 3% (sprzedawana w aptekach) 3 ml nadtlenek wodoru (woda utleniona 3% sprzedawana w aptekach) 20 ml kleik skrobiowy (zawiesina mąki ziemniaczanej w wodzie) kilka ml Aparatura: zlewka o objętości 250 ml bagietka szklana mieszadło magnetyczne mieszadełko pis doświadczenia: Po rozpuszczeniu tabletki witaminy C w 60 ml wody destylowanej należy wziąć 20 ml tego roztworu i dodać 3 ml jodyny oraz ok. 1-2 ml roztworu skrobi. Całość należy dokładnie wymieszać bagietką szklaną lub przy użyciu mieszadła magnetycznego, a następnie dodać 20 ml 3% wody utlenionej i obserwować przebieg reakcji mierząc czas od dodania roztworu
14 Wersja z sokiem owocowym Do reakcji nadaje się sok owocowy o jasnej barwie, przebieg reakcji został sprawdzony dla soku pomarańczowego o zawartości co najmniej 30 mg/100 ml soku (informacja z etykiety). dczynniki: sok owocowy 140 ml jodyna 3% (sprzedawana w aptekach) 3 ml nadtlenek wodoru (woda utleniona 3% sprzedawana w aptekach) 20 ml kleik skrobiowy (zawiesina mąki ziemniaczanej w wodzie) kilka ml Aparatura: zlewka o objętości 250 ml bagietka szklana mieszadło magnetyczne mieszadełko pis doświadczenia: Do 140 ml soku należy dodać 3 ml jodyny i ok. 1-2 ml roztworu skrobi. Zamieszać i następnie dodać 20 ml 3 % wody utlenionej i obserwować przebieg reakcji. Czas zmiany barwy roztworu na niebieski zależy od zawartości witaminy C w soku i orientacyjnie wynosi 1-3 minut. Literatura 1. commons.wikimedia.org S. W. Wright, P. Reedy: J. Chem. Educ. 79 (2002)
15 Warsztaty laboratoryjne dla uczniów Wykryc niewidoczne, czyli analiza składu mieszaniny wybranych kationo w trzeciej grupy analitycznej dr inż. Anna Mietlarek-Kropidłowska Chemiczna analiza jakościowa umożliwia identyfikację składników związków chemicznych lub mieszanin. W tym celu wykonuje się reakcje chemiczne, w wyniku których wydzielają się osady trudno rozpuszczalnych związko w, powstają barwne związki lub wydzielają się gazy. Jedna z metod wykrywania kationów jest analiza chemiczna w roztworach. Właściwości jonów metali Cr, Mn, Fe, Co, Ni i Zn Pierwiastki, będące przedmiotem naszych zajęć, znajdziemy w bloku d układu okresowego, w 4 okresie. Wszystkie należą do grupy tzw. niezbędnych do życia. kreślamy je mianem pierwiastków: śladowych (Fe i Zn) w organizmie przeciętnego statystycznego człowieka znajdziemy kilka gramów ultraśladowych (Cr, Mn, Co i Ni) występują w organizmie ludzkim w ilościach miligramowych W ramach zajęć poznawać będziemy charakterystyczne reakcje jonów Cr 3+, Mn 2+, Fe 3+, Co 2+, Ni 2+ oraz Zn 2+. Warto zwrócić uwagę, że w grupie tej znajdują się jony amfoterycznych metali: Cr 3+ oraz Zn 2+. W roztworze mocnej zasady jony te przyjmują formę rozpuszczalnych jonów kompleksowych: [Zn()4] 2 oraz [Cr()4]. Zadanie 1. Wybrane reakcje Do dyspozycji uczestnicy mają dobrze rozpuszczalne w wodzie azotany(v) powyższych metali. Zauważmy, że w solach chromu i żelaza jony metali są trójwartościowe Cr(III) i Fe(III), zaś w przypadku pozostałych soli obecne są kationy dwuwartościowe, np. Co(II). Zadaniem uczestników zajęć jest wykonanie reakcji, w których do niewielkiej ilości roztworu każdej z badanych soli dodawane są małymi porcjami (najlepiej po kropli) następujące reagenty: 1. rozcieńczony roztwór wodny wodorotlenku sodu Na 2. rozcieńczony wodny roztwór amoniaku N3(aq) 3. rozcieńczony wodny roztwór siarkowodoru 2S 4. rozcieńczony wodny roztwór siarczku amonu (N4)2S otrzymany przez dodanie do próbki (3) wodnego roztworu amoniaku, zgodnie z zapisem reakcji: 2 N3 + 2S (N4)2S Po wykonaniu każdej reakcji, uczestnicy odpowiadają sobie na następujące pytania: Jaką barwę mają wyjściowe roztwory? Jak te barwy zmieniają się w trakcie reakcji? Czy wypada osad? Jaką barwę mają wypadające osady? Jak zachowują się te osady w trakcie dodania kolejnych porcji (kropel) odczynnika? 13
16 Uczestnicy zapisują swoje obserwacje w tabeli: Na N3(aq) 2S (N4)2S Fe(N3)3 Co(N3)2 Ni(N3)2 Mn(N3)2 Zn(N3)2 Cr(N3)3 14
17 Zadanie 2. Reakcje charakterystyczne Reakcje z odczynnikami wykorzystanymi w Zadaniu 1 nie zawsze umożliwiają jednoznaczną identyfikację danego jonu (zwłaszcza w mieszaninie). Z tego też względu w celu zweryfikowania składu mieszaniny, przeprowadza się analizę systematyczną lub reakcje charakterystyczne. Analiza wybiórcza polega na wykrywaniu poszczególnych jonów bez przeprowadzenia wstępnego rozdzielenia. Wykorzystuje się w tym przypadku tzw. reakcje specyficzne dla określonego jonu. Zadaniem uczestników zajęć jest wykonanie charakterystycznych reakcji, w których do niewielkiej ilości roztworu każdej z badanych soli dodawane są małymi porcjami (najlepiej po kropli) następujące reagenty, zgodnie z poniższą tabelą: Jon Metoda wykrywania Wynik Fe 3+ dodać kilka kropli roztworu rodanku potasu KSCN krwistoczerwone zabarwienie oznacza obecność jonów Fe 3+ Ni 2+ do próbki dodać nieco roztworu amoniaku N3(aq) (w przypadku mieszaniny kationów przesączyć), a następnie nawarstwić kilka kropli dimetyloglioksymu (dmg) różowe zabarwienie oznacza obecność jonów Ni 2+ Mn 2+ Co 2+ niedużą ilość analizowanej próbki zakwasić kwasem azotowym(v) N3, a następnie dodać szczyptę stałego bizmutanu(v) sodu NaBi3 do małej ilości próbki dodać kilka kropli roztworu rodanku potasu KSCN czy obecne są jony Fe 3+? TAK: dodać fluorku sodu NaF (przeprowadzamy w ten sposób jony Fe 3+ w trwały anion [FeF6] 3 ) do odbarwienia roztworu i następnie postępować jak opisano poniżej NIE: dodać nadmiar stałego rodanku amonu N4SCN i nieco alkoholu izoamylowego i wytrząsać energicznie zabarwienie roztworu na kolor filetoworóżowy świadczy o obecności jonów Mn 2+ szafirowe zabarwienie górnej warstwy alkoholowej wskazuje na obecność jonów Co 2+ Cr 3+ Zn 2+ dodać stały wodorotlenek sodu Na do odczynu wyraźnie zasadowego, a następnie 3 krople roztworu nadtlenku wodoru, gotować do rozkładu nadmiaru 22, przesączyć roztwór (I). Roztwór (I) zakwaszamy kwasem octowym i dzielimy na 2 części Do jednej części dodajemy roztwór octanu amonu C3CN4 i wprowadzamy kilka kropli roztworu soli ołowiu(ii) Do kolejnej części roztworu (I) dodajemy roztwór wody siarkowodorowej 2S(aq) już żółte zabarwienie roztworu (I) oznacza obecność jonów Cr 3+, utlenionych do Cr4 2. Wytrącenie żółtego osadu PbCr4 potwierdza obecność jonów zawierających atom chromu Wytrącenie białego osadu potwierdza obecność jonów Zn 2+ 15
18 Zadanie 3. Chemiczny detektyw, czyli wykryć niewidoczne Teraz kolej na Ciebie! d prowadzących zajęcia otrzymasz zlewkę z mieszaniną soli zawierających jony, które dzisiaj poznawałaś(eś), oznaczoną numerem (np. 1). Twoim zadaniem jest stwierdzenie, co znajduje się w probówce przy użyciu poznanych reakcji. Pamiętaj, że w mieszaninie mogą znajdować się sole: Fe(III), Co(II), Ni(II), Zn(II), Cr(III) oraz Mn(II). Przeprowadź doświadczenia i wykorzystaj informacje zdobyte podczas dzisiejszych zajęć. Wynik doświadczeń zapisz poniżej: Numer mojej mieszaniny: Wykryłam(em) następujące jony: Poniżej zapisz, jakie reakcje przeprowadziłeś(as) i jakie obserwacje pozwoliły Ci na stwierdzenie obecności (lub nieobecności) danych jonów: Pamiętaj! 16 Pozostaw miejsce pracy w takim stanie, jak je zastałaś(eś)! Dokładnie umyj sprzęt laboratoryjny, z którego korzystałaś(eś). Na końcu przepłucz szkło wodą destylowaną! Przed opuszczeniem pracowni dokładnie umyj ręce.
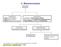
IZOMERIA Izomery - związki o takim samym składzie lecz różniące się budową
 IZMERIA Izomery - związki o takim samym składzie lecz różniące się budową TAK zy atomy są tak samo połączone? NIE izomery konstytucyjne stereoizomery zy odbicie lustrzane daje się nałożyć na cząsteczkę?
IZMERIA Izomery - związki o takim samym składzie lecz różniące się budową TAK zy atomy są tak samo połączone? NIE izomery konstytucyjne stereoizomery zy odbicie lustrzane daje się nałożyć na cząsteczkę?
Węglowodany (Cukry) Część 1. Związki wielofunkcyjne
 Węglowodany (Cukry) Część 1 Związki wielofunkcyjne Węglowodany - wiadomości ogólne - podział Monosacharydy - wiadomości ogólne - budowa strukturalna - izomeria Węglowodany (Cukry) Węglowodany wiadomości
Węglowodany (Cukry) Część 1 Związki wielofunkcyjne Węglowodany - wiadomości ogólne - podział Monosacharydy - wiadomości ogólne - budowa strukturalna - izomeria Węglowodany (Cukry) Węglowodany wiadomości
Węglowodany. Monosacharydy Oligosacharydy Polisacharydy. Skrobia Celuloza Glikogen. Aldopentozy (ryboza) Disacharydy. Ketopentozy (rybuloza)
 Cz. XXVIII-a Węglowodany - cukry - sacharydy: klasyfikacja, budowa, nazewnictwo i izomeria I. Definicja i klasyfikacja Węglowodany to polihydroksylowe aldehydy i ketony oraz ich pochodne Węglowodany Monosacharydy
Cz. XXVIII-a Węglowodany - cukry - sacharydy: klasyfikacja, budowa, nazewnictwo i izomeria I. Definicja i klasyfikacja Węglowodany to polihydroksylowe aldehydy i ketony oraz ich pochodne Węglowodany Monosacharydy
7-9. Stereoizomeria. izomery. konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych
 7-9. Stereoizomeria izomery konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych stereoizomery zbudowane z takich samych atomów atomy połączone w takiej samej sekwencji
7-9. Stereoizomeria izomery konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych stereoizomery zbudowane z takich samych atomów atomy połączone w takiej samej sekwencji
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
4. Stereoizomeria. izomery. konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych
 4. Stereoizomeria izomery konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych stereoizomery zbudowane z takich samych atomów atomy połączone w takiej samej sekwencji
4. Stereoizomeria izomery konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych stereoizomery zbudowane z takich samych atomów atomy połączone w takiej samej sekwencji
Protokół: Reakcje charakterystyczne cukrowców
 Protokół: Reakcje charakterystyczne cukrowców 1. Rekcja na obecność cukrów: próba Molischa z -naftolem Jest to najbardziej ogólna reakcja na cukrowce, tak wolne jak i związane. Ujemny jej wynik wyklucza
Protokół: Reakcje charakterystyczne cukrowców 1. Rekcja na obecność cukrów: próba Molischa z -naftolem Jest to najbardziej ogólna reakcja na cukrowce, tak wolne jak i związane. Ujemny jej wynik wyklucza
Węglowodany (Cukry) Część 2. Związki wielofunkcyjne
 Węglowodany (Cukry) Część 2 Związki wielofunkcyjne Monosacharydy Glukoza, Fruktoza: - wzory łańcuchowe, wzory Fishera, - właściwości fizyczne i chemiczne (zależności między budową a właściwościami) - funkcje
Węglowodany (Cukry) Część 2 Związki wielofunkcyjne Monosacharydy Glukoza, Fruktoza: - wzory łańcuchowe, wzory Fishera, - właściwości fizyczne i chemiczne (zależności między budową a właściwościami) - funkcje
Wielofunkcyjne związki organiczne poziom rozszerzony
 Wielofunkcyjne związki organiczne poziom rozszerzony Zadanie 1. (2 pkt) Źródło: KE 2010 (PR), zad. 29. Pewien dwufunkcyjny związek organiczny ma masę molową równą 90 g/mol. W jego cząsteczce stosunek liczby
Wielofunkcyjne związki organiczne poziom rozszerzony Zadanie 1. (2 pkt) Źródło: KE 2010 (PR), zad. 29. Pewien dwufunkcyjny związek organiczny ma masę molową równą 90 g/mol. W jego cząsteczce stosunek liczby
SCENARIUSZ ZAJĘĆ SZKOLNEGO KOŁA NAUKOWEGO Z PRZEDMIOTU BIOLOGIA PROWADZONEGO W RAMACH PROJEKTU AKADEMIA UCZNIOWSKA
 SCENARIUSZ ZAJĘĆ SZKOLNEGO KOŁA NAUKOWEGO Z PRZEDMIOTU BIOLOGIA PROWADZONEGO W RAMACH PROJEKTU AKADEMIA UCZNIOWSKA Temat lekcji Jaki owoc ma więcej witaminy C? Na podstawie pracy Anny Majcher oraz jej
SCENARIUSZ ZAJĘĆ SZKOLNEGO KOŁA NAUKOWEGO Z PRZEDMIOTU BIOLOGIA PROWADZONEGO W RAMACH PROJEKTU AKADEMIA UCZNIOWSKA Temat lekcji Jaki owoc ma więcej witaminy C? Na podstawie pracy Anny Majcher oraz jej
Ćwiczenie 4. Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne
 Klasyczna Analiza Jakościowa Organiczna, Ćw. 4 - Identyfikacja wybranych cukrów Ćwiczenie 4 Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne Zagadnienia teoretyczne: 1. Budowa
Klasyczna Analiza Jakościowa Organiczna, Ćw. 4 - Identyfikacja wybranych cukrów Ćwiczenie 4 Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne Zagadnienia teoretyczne: 1. Budowa
3b 2. przedstawione na poniższych schematach. Uzupełnij obserwacje i wnioski z nich wynikające oraz równanie zachodzącej reakcji.
 3b 2 PAWEŁ ZYCH IMIĘ I NAZWISKO: KLASA: GRUPA A 1. W celu zbadania właściwości sacharozy wykonano dwa doświadczenia, które zostały przedstawione na poniższych schematach. Uzupełnij obserwacje i wnioski
3b 2 PAWEŁ ZYCH IMIĘ I NAZWISKO: KLASA: GRUPA A 1. W celu zbadania właściwości sacharozy wykonano dwa doświadczenia, które zostały przedstawione na poniższych schematach. Uzupełnij obserwacje i wnioski
II ROK CHEMII GRUPA C1 Zadania na 17 stycznia 2011 r. Cukry odpowiedzi. 1. Zapisz wzory Fischera produktów reakcji D-glukozy z: a.
 16 stycznia 2011 roku II RK EMII GRUPA 1 Zadania na 17 stycznia 2011 r. ukry odpowiedzi 1. Zapisz wzory Fischera produktów reakcji D-glukozy z: a. Br 2 2 kwas D-glukonowy (ogólnie: kwas aldonowy) b. stęż.
16 stycznia 2011 roku II RK EMII GRUPA 1 Zadania na 17 stycznia 2011 r. ukry odpowiedzi 1. Zapisz wzory Fischera produktów reakcji D-glukozy z: a. Br 2 2 kwas D-glukonowy (ogólnie: kwas aldonowy) b. stęż.
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.
![Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.](/thumbs/100/143872318.jpg) Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
Pierwiastki bloku d. Zadanie 1.
 Zadanie 1. Zapisz równania reakcji tlenków chromu (II), (III), (VI) z kwasem solnym i zasadą sodową lub zaznacz, że reakcja nie zachodzi. Określ charakter chemiczny tlenków. Charakter chemiczny tlenków:
Zadanie 1. Zapisz równania reakcji tlenków chromu (II), (III), (VI) z kwasem solnym i zasadą sodową lub zaznacz, że reakcja nie zachodzi. Określ charakter chemiczny tlenków. Charakter chemiczny tlenków:
ĆWICZENIE I - BIAŁKA. Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi.
 ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
Chemia organiczna. Stereochemia. Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego
 Chemia organiczna Stereochemia Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego Chemia organiczna jest nauką, która zajmuje się poszukiwaniem zależności pomiędzy budową cząsteczki a właściwościami
Chemia organiczna Stereochemia Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego Chemia organiczna jest nauką, która zajmuje się poszukiwaniem zależności pomiędzy budową cząsteczki a właściwościami
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 7
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
Zadanie 4. (1 pkt) Uzupełnij schemat ilustrujący przebieg procesu fotosyntezy.
 Zadanie: 1 (1 pkt) Do probówki zawierającej świeżo wytrącony wodorotlenek miedzi (II) dodano roztwór glukozy, całość ogrzano. Jakie zmiany zaobserwowano w probówce po zakończeniu reakcji chemicznej? a)
Zadanie: 1 (1 pkt) Do probówki zawierającej świeżo wytrącony wodorotlenek miedzi (II) dodano roztwór glukozy, całość ogrzano. Jakie zmiany zaobserwowano w probówce po zakończeniu reakcji chemicznej? a)
Rozdział 9. Odpowiedzi i rozwiązania zadań. Chemia organiczna. Zdzisław Głowacki. Zakres podstawowy i rozszerzony
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 9 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Cukry Zadanie 9.1. Kolejno:
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 9 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Cukry Zadanie 9.1. Kolejno:
etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
 Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Kryteria oceniania z chemii kl VII
 Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
KLASA II Dział 6. WODOROTLENKI A ZASADY
 KLASA II Dział 6. WODOROTLENKI A ZASADY Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą definiuje wskaźnik; wyjaśnia pojęcie: wodorotlenek; wskazuje metale aktywne i mniej aktywne; wymienia
KLASA II Dział 6. WODOROTLENKI A ZASADY Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą definiuje wskaźnik; wyjaśnia pojęcie: wodorotlenek; wskazuje metale aktywne i mniej aktywne; wymienia
Skala słodkości cukrów Laktoza < maltoza < glukoza < sacharoza < fruktoza najsłodsza
 Źródła cukrów (węglowodanów) w produktach spożywczych: Warzywa i owoce (winogrona cukier gronowy glukoza) Produkty zbożowe: pieczywo, kasze, płatki śniadaniowe Funkcja węglowodanów w organizmie: Energetyczna:
Źródła cukrów (węglowodanów) w produktach spożywczych: Warzywa i owoce (winogrona cukier gronowy glukoza) Produkty zbożowe: pieczywo, kasze, płatki śniadaniowe Funkcja węglowodanów w organizmie: Energetyczna:
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
MECHANIZMY REAKCJI CHEMICZNYCH. REAKCJE CHARAKTERYSTYCZNE GRUP FUNKCYJNYCH ZWIĄZKÓW ORGANICZNYCH
 Ćwiczenie 2 semestr 2 MECHANIZMY REAKCJI CHEMICZNYCH. REAKCJE CHARAKTERYSTYCZNE GRUP FUNKCYJNYCH ZWIĄZKÓW ORGANICZNYCH Obowiązujące zagadnienia: Związki organiczne klasyfikacja, grupy funkcyjne, reakcje
Ćwiczenie 2 semestr 2 MECHANIZMY REAKCJI CHEMICZNYCH. REAKCJE CHARAKTERYSTYCZNE GRUP FUNKCYJNYCH ZWIĄZKÓW ORGANICZNYCH Obowiązujące zagadnienia: Związki organiczne klasyfikacja, grupy funkcyjne, reakcje
Instrukcja dla uczestnika. II etap Konkursu. U z u p e ł n i j s w o j e d a n e p r z e d r o z p o c z ę c i e m r o z w i ą z y w a n i a z a d a ń
 III edycja rok szkolny 2017/2018 Uzupełnia Organizator Konkursu Instrukcja dla uczestnika II etap Konkursu Liczba uzyskanych punktów 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś zawiera 12 stron.
III edycja rok szkolny 2017/2018 Uzupełnia Organizator Konkursu Instrukcja dla uczestnika II etap Konkursu Liczba uzyskanych punktów 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś zawiera 12 stron.
spektroskopia elektronowa (UV-vis)
 spektroskopia elektronowa (UV-vis) rodzaje przejść elektronowych Energia σ* π* 3 n 3 π σ σ σ* daleki nadfiolet (λ max < 200 nm) π π* bliski nadfiolet jednostki energii atomowa jednostka energii = energia
spektroskopia elektronowa (UV-vis) rodzaje przejść elektronowych Energia σ* π* 3 n 3 π σ σ σ* daleki nadfiolet (λ max < 200 nm) π π* bliski nadfiolet jednostki energii atomowa jednostka energii = energia
XLVII Olimpiada Chemiczna
 M P IA O L I D A 47 1954 2000 CH N A E M Z I C XLVII Olimpiada Chemiczna Etap III KOMITET GŁÓWNY OLIMPIADY CHEMICZNEJ Zadania laboratoryjne Zadanie 1 Analiza miareczkowa jest użyteczną metodą ilościową,
M P IA O L I D A 47 1954 2000 CH N A E M Z I C XLVII Olimpiada Chemiczna Etap III KOMITET GŁÓWNY OLIMPIADY CHEMICZNEJ Zadania laboratoryjne Zadanie 1 Analiza miareczkowa jest użyteczną metodą ilościową,
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II
 TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA
 MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Zadanie Odpowiedzi Uwagi a) za uzupełnienie tabeli: Symbol pierwiastka Konfiguracja elektronowa w stanie podstawowym Liczba elektronów walencyjnych S b) za uzupełnienie
MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Zadanie Odpowiedzi Uwagi a) za uzupełnienie tabeli: Symbol pierwiastka Konfiguracja elektronowa w stanie podstawowym Liczba elektronów walencyjnych S b) za uzupełnienie
Różnorodny świat izomerów powtórzenie wiadomości przed maturą
 Różnorodny świat izomerów powtórzenie wiadomości przed maturą Maria Kluz Klasa III, profil biologiczno-chemiczny i matematyczno-chemiczny 1 godzina lekcyjna, praca w grupie 16-osobowej. Cele edukacyjne:
Różnorodny świat izomerów powtórzenie wiadomości przed maturą Maria Kluz Klasa III, profil biologiczno-chemiczny i matematyczno-chemiczny 1 godzina lekcyjna, praca w grupie 16-osobowej. Cele edukacyjne:
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
46 i 47. Wstęp do chemii -aminokwasów
 46 i 47. Wstęp do chemii -aminokwasów Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2017/2018 1 21.1. Budowa ogólna -aminokwasów i klasyfikacja peptydów H 2 H H 2 R H R R 1 H
46 i 47. Wstęp do chemii -aminokwasów Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2017/2018 1 21.1. Budowa ogólna -aminokwasów i klasyfikacja peptydów H 2 H H 2 R H R R 1 H
Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020
 Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020 Ocenę niedostateczną otrzymuje uczeń, który nie opanował wymagań na ocenę dopuszczającą.
Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020 Ocenę niedostateczną otrzymuje uczeń, który nie opanował wymagań na ocenę dopuszczającą.
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego. II Etap - 18 stycznia 2016
 XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2015/2016
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 21 maja 2016 Im. Jana Kasprowicza INOWROCŁAW XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 21 maja 2016 Im. Jana Kasprowicza INOWROCŁAW XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II
 Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II Łączenie się atomów. Równania reakcji Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] Ocena dobra [1 + 2 + 3] Ocena bardzo dobra
Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II Łączenie się atomów. Równania reakcji Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] Ocena dobra [1 + 2 + 3] Ocena bardzo dobra
4. Rzutowy wzór Fischera rybozy przedstawia rysunek. Podaj wzory pierścieniowe α i β rybozy.
 1. Wśród podanych związków wskaż: aldozy i ketozy. 2. Zapisz wzory Fischera wszystkich aldotetroz należących do szeregu D. 3. Ustal, ile stereoizomerów posiada forma łańcuchowa aldopentozy. 4. Rzutowy
1. Wśród podanych związków wskaż: aldozy i ketozy. 2. Zapisz wzory Fischera wszystkich aldotetroz należących do szeregu D. 3. Ustal, ile stereoizomerów posiada forma łańcuchowa aldopentozy. 4. Rzutowy
LCH 1 Zajęcia nr 60 Diagnoza końcowa. Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach:
 LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 STOPIEŃ WOJEWÓDZKI 9 MARCA 2018 R.
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
21. Wstęp do chemii a-aminokwasów
 21. Wstęp do chemii a-aminokwasów Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2016/2017 1 21.1. Budowa ogólna a-aminokwasów i klasyfikacja peptydów H 2 N H kwas 2-aminooctowy
21. Wstęp do chemii a-aminokwasów Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2016/2017 1 21.1. Budowa ogólna a-aminokwasów i klasyfikacja peptydów H 2 N H kwas 2-aminooctowy
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
BADANIE WŁAŚCIWOŚCI FIZYKOCHEMICZNYCH AMINOKWASÓW
 BADANIE WŁAŚIWŚI FIZYKEMIZNY AMINKWASÓW IDENTYFIKAJA AMINKWASÓW BIAŁKA, JAK I WLNE AMINKWASY REAGUJĄ ZA PŚREDNITWEM GRUP: -N 2 I Z NINYDRYNĄ, DINITRFLURBENZENEM I KWASEM AZTWYM (III). WYSTĘPWANIE W STRUKTURZE
BADANIE WŁAŚIWŚI FIZYKEMIZNY AMINKWASÓW IDENTYFIKAJA AMINKWASÓW BIAŁKA, JAK I WLNE AMINKWASY REAGUJĄ ZA PŚREDNITWEM GRUP: -N 2 I Z NINYDRYNĄ, DINITRFLURBENZENEM I KWASEM AZTWYM (III). WYSTĘPWANIE W STRUKTURZE
Kuratorium Oświaty w Lublinie ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI
 Kuratorium Oświaty w Lublinie.. Imię i nazwisko ucznia Pełna nazwa szkoły Liczba punktów ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI Instrukcja dla ucznia
Kuratorium Oświaty w Lublinie.. Imię i nazwisko ucznia Pełna nazwa szkoły Liczba punktów ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI Instrukcja dla ucznia
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Struktura biomakromolekuł chemia biologiczna III rok
 truktura biomakromolekuł chemia biologiczna III rok jak są zbudowane białka? dlaczego białka są tak zbudowane? co z tego wynika? 508 13 604 liczba struktur dostępnych w Protein Data Bank wynosi aktualnie
truktura biomakromolekuł chemia biologiczna III rok jak są zbudowane białka? dlaczego białka są tak zbudowane? co z tego wynika? 508 13 604 liczba struktur dostępnych w Protein Data Bank wynosi aktualnie
Rozdział 6. Odpowiedzi i rozwiązania zadań. Chemia organiczna. Zdzisław Głowacki. Zakres podstawowy i rozszerzony
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje szkolne I stopień
 POUFNE Pieczątka szkoły 9 listopada 2015 r. Imię Czas pracy 60 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje szkolne I stopień Informacje: 1. Przeczytaj uważnie
POUFNE Pieczątka szkoły 9 listopada 2015 r. Imię Czas pracy 60 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje szkolne I stopień Informacje: 1. Przeczytaj uważnie
REAKCJE CHARAKTERYSTYCZNE WYBRANYCH KATIONÓW
 REAKCJE CHARAKTERYSTYCZNE WYBRANYCH KATIONÓW Chemia analityczna jest działem chemii zajmującym się ustalaniem składu jakościowego i ilościowego badanych substancji chemicznych. Analiza jakościowa bada
REAKCJE CHARAKTERYSTYCZNE WYBRANYCH KATIONÓW Chemia analityczna jest działem chemii zajmującym się ustalaniem składu jakościowego i ilościowego badanych substancji chemicznych. Analiza jakościowa bada
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab
 SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
Kuratorium Oświaty w Lublinie
 Kuratorium Oświaty w Lublinie KOD UCZNIA ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 ETAP WOJEWÓDZKI Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
Kuratorium Oświaty w Lublinie KOD UCZNIA ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 ETAP WOJEWÓDZKI Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
EGZAMIN MATURALNY Z CHEMII
 Miejsce na naklejkę z kodem (Wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO MCH-W1D1P-021 EGZAMIN MATURALNY Z CHEMII Instrukcja dla zdającego Czas pracy 90 minut 1. Proszę sprawdzić, czy arkusz
Miejsce na naklejkę z kodem (Wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO MCH-W1D1P-021 EGZAMIN MATURALNY Z CHEMII Instrukcja dla zdającego Czas pracy 90 minut 1. Proszę sprawdzić, czy arkusz
Szanowne koleżanki i koledzy nauczyciele chemii!
 Szanowne koleżanki i koledzy nauczyciele chemii! Chciałabym podzielić się z Wami moimi spostrzeżeniami dotyczącymi poziomu wiedzy z chemii uczniów rozpoczynających naukę w Liceum Ogólnokształcącym. Co
Szanowne koleżanki i koledzy nauczyciele chemii! Chciałabym podzielić się z Wami moimi spostrzeżeniami dotyczącymi poziomu wiedzy z chemii uczniów rozpoczynających naukę w Liceum Ogólnokształcącym. Co
Materiały do zajęć dokształcających z chemii organicznej
 hemia Warta Poznania - nowa JAKŚĆ studiowania -zwiększenie liczby absolwentów oraz atrakcyjności studiów na kierunku EMIA na Uniwersytecie im. A. Mickiewicza w Poznaniu Materiały do zajęć dokształcających
hemia Warta Poznania - nowa JAKŚĆ studiowania -zwiększenie liczby absolwentów oraz atrakcyjności studiów na kierunku EMIA na Uniwersytecie im. A. Mickiewicza w Poznaniu Materiały do zajęć dokształcających
CHEMIA 12. Wzorcem konfiguracji względnej H C * OH HO C * H (odmiany L i D) jest aldehyd glicerynowy CH 2 OH CH 2 OH
 INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 12 SACHARYDY. AMINOKWASY I BIAŁKA. IZOMERIA OPTYCZNA. IZOMERIA OPTYCZNA
INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 12 SACHARYDY. AMINOKWASY I BIAŁKA. IZOMERIA OPTYCZNA. IZOMERIA OPTYCZNA
Przegląd budowy i funkcji białek
 Przegląd budowy i funkcji białek Co piszą o białkach? Wyraz wprowadzony przez Jönsa J. Berzeliusa w 1883 r. w celu podkreślenia znaczenia tej grupy związków. Termin pochodzi od greckiego słowa proteios,
Przegląd budowy i funkcji białek Co piszą o białkach? Wyraz wprowadzony przez Jönsa J. Berzeliusa w 1883 r. w celu podkreślenia znaczenia tej grupy związków. Termin pochodzi od greckiego słowa proteios,
Izomeria cukrów prostych
 Izomeria cukrów prostych 1. Cele lekcji a) Wiadomości Uczeń zna: podział izomerii. pojęcia: konstytucja, konfiguracja, cząsteczka chiralna, centrum chiralności. b) Umiejętności Uczeń potrafi: wskazać w
Izomeria cukrów prostych 1. Cele lekcji a) Wiadomości Uczeń zna: podział izomerii. pojęcia: konstytucja, konfiguracja, cząsteczka chiralna, centrum chiralności. b) Umiejętności Uczeń potrafi: wskazać w
Piotr Chojnacki 1. Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą reakcji charakterystycznych.
 SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
Cukry - czy każdy cukier jest słodki? Wykrywanie skrobi.
 1 Cukry - czy każdy cukier jest słodki? Wykrywanie skrobi. Czas trwania zajęć: 45 minut Pojęcia kluczowe: - skrobia, - wielocukier, - glukoza, - rośliny Hipoteza sformułowana przez uczniów: 1. Istnieją
1 Cukry - czy każdy cukier jest słodki? Wykrywanie skrobi. Czas trwania zajęć: 45 minut Pojęcia kluczowe: - skrobia, - wielocukier, - glukoza, - rośliny Hipoteza sformułowana przez uczniów: 1. Istnieją
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII
 KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 12 marzec 2008 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III Numer zadania 1
KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 12 marzec 2008 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III Numer zadania 1
Zastosowanie metody Lowry ego do oznaczenia białka w cukrze białym
 Zastosowanie metody Lowry ego do oznaczenia białka w cukrze białym Dr inż. Bożena Wnuk Mgr inż. Anna Wysocka Seminarium Aktualne zagadnienia dotyczące jakości w przemyśle cukrowniczym Łódź 10 11 czerwca
Zastosowanie metody Lowry ego do oznaczenia białka w cukrze białym Dr inż. Bożena Wnuk Mgr inż. Anna Wysocka Seminarium Aktualne zagadnienia dotyczące jakości w przemyśle cukrowniczym Łódź 10 11 czerwca
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
pobrano z
 ODPOWIEDZI Zadanie 1. (2 pkt) 1. promienia atomowego, promienia jonowego 2. najwyższego stopnia utlenienia Zadanie 2. (1 pkt) 1. Pierwiastek I jest aktywnym metalem. Tworzy wodorek, w którym wodór przyjmuje
ODPOWIEDZI Zadanie 1. (2 pkt) 1. promienia atomowego, promienia jonowego 2. najwyższego stopnia utlenienia Zadanie 2. (1 pkt) 1. Pierwiastek I jest aktywnym metalem. Tworzy wodorek, w którym wodór przyjmuje
KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI
 6 KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z zagadnieniami katalizy homogenicznej i wykorzystanie reakcji tego typu do oznaczania śladowych ilości jonów Cu 2+. Zakres obowiązującego
6 KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z zagadnieniami katalizy homogenicznej i wykorzystanie reakcji tego typu do oznaczania śladowych ilości jonów Cu 2+. Zakres obowiązującego
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2016/2017 STOPIEŃ WOJEWÓDZKI 10 MARCA 2017R.
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2016/2017 10 MARCA 2017R. 1. Test konkursowy zawiera 12 zadań. Są to zadania otwarte, za które maksymalnie możesz
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2016/2017 10 MARCA 2017R. 1. Test konkursowy zawiera 12 zadań. Są to zadania otwarte, za które maksymalnie możesz
a) proces denaturacji białka następuje w probówce: b) proces zachodzący w probówce nr 1 nazywa się:
 Zadanie 1. (4 pkt) Zaprojektuj doświadczenie chemiczne, za pomocą którego można wykryć siarkę w związkach organicznych. a) opisz przebieg doświadczenia b) zapisz przewidywane spostrzeżenia c) napisz równanie
Zadanie 1. (4 pkt) Zaprojektuj doświadczenie chemiczne, za pomocą którego można wykryć siarkę w związkach organicznych. a) opisz przebieg doświadczenia b) zapisz przewidywane spostrzeżenia c) napisz równanie
BUDOWA I WŁAŚCIWOŚCI AMINOKWASÓW. 1.1. Aminokwasy białkowe
 BUDOWA I WŁAŚCIWOŚCI AMINOKWASÓW 1.1. Aminokwasy białkowe Aminokwasy są związkami organicznymi, zawierającymi co najmniej jedną grupę karboksylową COOH oraz co najmniej jedną grupę aminową NH 2. W zależności
BUDOWA I WŁAŚCIWOŚCI AMINOKWASÓW 1.1. Aminokwasy białkowe Aminokwasy są związkami organicznymi, zawierającymi co najmniej jedną grupę karboksylową COOH oraz co najmniej jedną grupę aminową NH 2. W zależności
CHEMIA. Wymagania szczegółowe. Wymagania ogólne
 CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
Ćwiczenia laboratoryjne 2
 Ćwiczenia laboratoryjne 2 Ćwiczenie 5: Wytrącanie siarczków grupy II Uwaga: Ćwiczenie wykonać w dwóch zespołach (grupach). A. Przygotuj w oddzielnych probówkach niewielką ilość roztworów zawierających
Ćwiczenia laboratoryjne 2 Ćwiczenie 5: Wytrącanie siarczków grupy II Uwaga: Ćwiczenie wykonać w dwóch zespołach (grupach). A. Przygotuj w oddzielnych probówkach niewielką ilość roztworów zawierających
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje wojewódzkie
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje wojewódzkie Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje wojewódzkie Zadanie
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013
 Kuratorium Oświaty w Lublinie Kod ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
Kuratorium Oświaty w Lublinie Kod ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
ĆWICZENIE 1. Aminokwasy
 ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
Węglowodory poziom podstawowy
 Węglowodory poziom podstawowy Zadanie 1. (2 pkt) Źródło: CKE 2010 (PP), zad. 19. W wyniku całkowitego spalenia 1 mola cząsteczek węglowodoru X powstały 2 mole cząsteczek wody i 3 mole cząsteczek tlenku
Węglowodory poziom podstawowy Zadanie 1. (2 pkt) Źródło: CKE 2010 (PP), zad. 19. W wyniku całkowitego spalenia 1 mola cząsteczek węglowodoru X powstały 2 mole cząsteczek wody i 3 mole cząsteczek tlenku
MAŁOPOLSKI KONKURS CHEMICZNY
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 24 października 2018 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 Maksymalna liczba 1 2 1 6 4 9 2 Liczba
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 24 października 2018 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 Maksymalna liczba 1 2 1 6 4 9 2 Liczba
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
ETAP II heksacyjanożelazian(iii) potasu, siarczan(vi) glinu i amonu (tzw. ałun glinowo-amonowy).
 ETAP II 04.0.006 Zadanie laboratoryjne W probówkach opisanych literami A i B masz roztwory popularnych odczynników stosowanych w analizie jakościowej, przy czym każda z tych probówek zawiera roztwór tylko
ETAP II 04.0.006 Zadanie laboratoryjne W probówkach opisanych literami A i B masz roztwory popularnych odczynników stosowanych w analizie jakościowej, przy czym każda z tych probówek zawiera roztwór tylko
Wymagania programowe na poszczególne oceny. Chemia Kl.1. I. Substancje chemiczne i ich przemiany
 Wymagania programowe na poszczególne oceny Chemia Kl.1 I. Substancje chemiczne i ich przemiany Ocena dopuszczająca [1] zna zasady bhp obowiązujące w pracowni chemicznej nazywa sprzęt i szkło laboratoryjne
Wymagania programowe na poszczególne oceny Chemia Kl.1 I. Substancje chemiczne i ich przemiany Ocena dopuszczająca [1] zna zasady bhp obowiązujące w pracowni chemicznej nazywa sprzęt i szkło laboratoryjne
MAŁOPOLSKI KONKURS CHEMICZNY
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu 8 października 2018 r. Etap I (szkolny) Wypełnia Szkolna
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu 8 października 2018 r. Etap I (szkolny) Wypełnia Szkolna
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA
 WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
Wymagania edukacyjne z chemii Klasa II WODOROTLENKI A ZASADY
 Wymagania edukacyjne z chemii Klasa II WODOROTLENKI A ZASADY Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą wymienia rodzaje wskaźników; sprawdza doświadczalnie działanie podaje przykłady
Wymagania edukacyjne z chemii Klasa II WODOROTLENKI A ZASADY Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą wymienia rodzaje wskaźników; sprawdza doświadczalnie działanie podaje przykłady
SCENARIUSZ ZAJĘĆ SZKOLNEGO KOŁA NAUKOWEGO Z PRZEDMIOTU BIOLOGIA PROWADZONEGO W RAMACH PROJEKTU AKADEMIA UCZNIOWSKA
 SCENARIUSZ ZAJĘĆ SZKOLNEGO KOŁA NAUKOWEGO Z PRZEDMIOTU BIOLOGIA PROWADZONEGO W RAMACH PROJEKTU AKADEMIA UCZNIOWSKA Temat lekcji Jaki wpływ na skrobię ma ślina i proszek do prania? Na podstawie pracy uczniów
SCENARIUSZ ZAJĘĆ SZKOLNEGO KOŁA NAUKOWEGO Z PRZEDMIOTU BIOLOGIA PROWADZONEGO W RAMACH PROJEKTU AKADEMIA UCZNIOWSKA Temat lekcji Jaki wpływ na skrobię ma ślina i proszek do prania? Na podstawie pracy uczniów
Związki nieorganiczne
 strona 1/8 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
strona 1/8 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
Weglowodany. Nazwa pochodzi od wzoru sumarycznego: C x (H 2. O) y
 Weglowodany Nazwa pochodzi od wzoru sumarycznego: C x ( 2 ) y wodziany węgla gólnie definiuje się je jako: polihydroksy aldehydy i polihydroksy ketony lub jako substancje, które w wyniku hydrolizy dają
Weglowodany Nazwa pochodzi od wzoru sumarycznego: C x ( 2 ) y wodziany węgla gólnie definiuje się je jako: polihydroksy aldehydy i polihydroksy ketony lub jako substancje, które w wyniku hydrolizy dają
III-A. Chemia wspomaga nasze zdrowie
 III-A. Chemia wspomaga nasze zdrowie III-A.1. POKAZ: Synteza aspiryny (kwas acetylosalicylowy) III-A.2. Badanie odczynu wodnych roztworów popularnych leków III-A.3. Reakcja leku na zgagę z kwasem solnym
III-A. Chemia wspomaga nasze zdrowie III-A.1. POKAZ: Synteza aspiryny (kwas acetylosalicylowy) III-A.2. Badanie odczynu wodnych roztworów popularnych leków III-A.3. Reakcja leku na zgagę z kwasem solnym
WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne. Z CHEMII W KLASIE III gimnazjum
 WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE III gimnazjum Program nauczania chemii w gimnazjum autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy
WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE III gimnazjum Program nauczania chemii w gimnazjum autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII
 KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 16.03. 2010 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III numer zadania numer
KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 16.03. 2010 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III numer zadania numer
Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.
![Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów. Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.](/thumbs/97/131732752.jpg) 2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
1.1. AMINOKWASY BIAŁKOWE
 1 ĆWICZENIE 1 BUDOWA I WŁAŚCIWOŚCI AMINOKWASÓW 1.1. AMINOKWASY BIAŁKOWE Aminokwasy są związkami organicznymi zawierającymi co najmniej jedną grupę karboksylową -COOH oraz co najmniej jedną grupę aminową
1 ĆWICZENIE 1 BUDOWA I WŁAŚCIWOŚCI AMINOKWASÓW 1.1. AMINOKWASY BIAŁKOWE Aminokwasy są związkami organicznymi zawierającymi co najmniej jedną grupę karboksylową -COOH oraz co najmniej jedną grupę aminową
Stereochemia Ułożenie atomów w przestrzeni
 Slajd 1 Stereochemia Ułożenie atomów w przestrzeni Slajd 2 Izomery Izomery to różne związki posiadające ten sam wzór sumaryczny izomery izomery konstytucyjne stereoizomery izomery cis-trans izomery zawierające
Slajd 1 Stereochemia Ułożenie atomów w przestrzeni Slajd 2 Izomery Izomery to różne związki posiadające ten sam wzór sumaryczny izomery izomery konstytucyjne stereoizomery izomery cis-trans izomery zawierające
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Reakcje charakterystyczne aminokwasów
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Reakcje charakterystyczne aminokwasów BIOCHEMIA STRUKTURALNA ĆWICZENIE 1 REAKCJE CHARAKTERYSTYCZNE AMINOKWASÓW A) REAKCJE OGÓLNE ZADANIE 1 WYKRYWANIE
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Reakcje charakterystyczne aminokwasów BIOCHEMIA STRUKTURALNA ĆWICZENIE 1 REAKCJE CHARAKTERYSTYCZNE AMINOKWASÓW A) REAKCJE OGÓLNE ZADANIE 1 WYKRYWANIE
Powodzenia!!! WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII III ETAP. Termin: r. Czas pracy: 90 minut. Liczba otrzymanych punktów
 KOD Ucznia WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII III ETAP Termin: 21.03.2006r. Czas pracy: 90 minut Numer zadania Liczba możliwych punktów 1 6 2 3 3 6 4 7 5 7 6 6 7 6 8 3 9 6 10 8 Razem 58 Liczba otrzymanych
KOD Ucznia WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII III ETAP Termin: 21.03.2006r. Czas pracy: 90 minut Numer zadania Liczba możliwych punktów 1 6 2 3 3 6 4 7 5 7 6 6 7 6 8 3 9 6 10 8 Razem 58 Liczba otrzymanych
WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE II gimnazjum
 WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE II gimnazjum Program nauczania chemii w gimnazjum autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy
WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE II gimnazjum Program nauczania chemii w gimnazjum autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy
Zadania laboratoryjne
 M P I O L I D 47 1954 2000 Zadania laboratoryjne CH N E M Z I C ZDNIE 1 Ustalenie nudowy kompleksu szczawianowego naliza miareczkowa jest użyteczną metodę ilościową, którą wykorzystasz do ustalenia budowy
M P I O L I D 47 1954 2000 Zadania laboratoryjne CH N E M Z I C ZDNIE 1 Ustalenie nudowy kompleksu szczawianowego naliza miareczkowa jest użyteczną metodę ilościową, którą wykorzystasz do ustalenia budowy
ALDEHYDY, KETONY. I. Wprowadzenie teoretyczne
 ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
Część I. TEST WYBORU 18 punktów
 Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
