Pierwiastek, który się utlenia jest reduktorem, natomiast pierwiastek, który się redukuje jest utleniaczem.
|
|
|
- Izabela Głowacka
- 8 lat temu
- Przeglądów:
Transkrypt
1 Równania redox - reakcje chemiczne, w których zachodzi jednocześnie utlenienie i redukcja pierwiastków chemicznych. Utlenienie proces, podczas którego pierwiastek ze stopnia niższego przechodzi na stopień wyższy, np wodór ze stopnia zerowego na stopień (+I), albo chlor ze stopnia (-I) na stopień zerowy. Jest to równoznaczne z tym, taki pierwiastek oddaje wtedy elektrony. Redukcja proces, podczas którego pierwiastek chemiczny zmienia swój stopień utlenienia z wyższego na niższy, np. chlor ze stopnia (+V) na stopień (-I) lub cynk z (+II) na stopień zerowy. Jest to równoznaczne z tym, że pierwiastek redukując się - przyjmuje elektrony. Stopień utlenienia formalna wartość ładunku atomu w związku chemicznym, przy założeniu, że wszystkie wiązania chemiczne w danej cząsteczce mają charakter wiązań jonowych Pierwiastek, który się utlenia jest reduktorem, natomiast pierwiastek, który się redukuje jest utleniaczem. Aby pojąć reakcje redoks podstawą jest znajomość stopni utlenienia, a dokładniej - trzeba wiedzieć jaki stopień przyjmuje dany pierwiastek w danym związku, większość dobierania stopni utlenienia jest czystą matematyką ;) Kilka uwag na ten temat: *tlen w związkach ma zawsze stopień utlenienia (-II) z wyjątkiem HO gdzie ma st utlenienia (-I) i z wyjątkiem OF gdzie ma st utlenienia (+II) *wodór w związkach ma zawsze stopień utlenienia (+I) z wyjątkiem wodorków metali grupy I i II gdzie ma stopień utlenienia (-I) * Atomy pierwiastków w stanie wolnym mają stopień utlenienia równy 0 (zero) (niezależnie od złożoności ich budowy) np. Na, O, F, N, P4, S8, w tych wszystkich przykładach stopień utlenienia wynosi zero * suma stopni utlenienia w związku musi być równa 0 * Suma stopni utlenienia pierwiastków tworzących jon, równa jest ładunkowi tego jonu, np. CO3- >> węgiel ma stopień utlenienia +IV, tlen II, a więc: (+IV)+3*(-II) = - * fluor we wszystkich połączeniach ma stopień utlenienia (-I) * metale grupy I w związkach mają zawsze stopień utlenienia (+I), a metale grupy II mają zawsze w związkach stopień utlenienia (+II) Jak uzupełniamy współczynniki w reakcjach redoks: 1. Ustalamy stopnie utlenienia każdego z pierwiastków w każdym związku: KOH Br KBrO3 KBr H O stopnie utlenienia: KOH : K( I ); O( II); H ( I ) Br (0) KBrO : K( I); Br ( V ); O( II) KBr : K( I ); Br( I ) 3 H O : H ( I ); O( II). Po ustaleniu stopni utlenienia, należy znaleźć w reakcji, gdzie i jakie pierwiastki zmieniają swoje stopnie utlenienia, tzn w których pierwiastkach stopień utlenienia jest inny przed reakcja (po lewej stronie równania) i po reakcji (po prawej stronie równania).
2 0 Br 10e Br Br W tym przypadku jest to cząsteczka bromu, która po reakcji (prawa strona równania) przyjmuje dwa różne stopnia utlenienia, wszystkie inne pierwiastki po obu stronach mają takie same stopnie. 3. Po odszukaniu takich pierwiastków układamy bilans redoks (przypominający nieco proporcję): 0 e Br V I po. skróceniu 5 na górze zachodzi utlenienia, na dole redukcja Brom w pierwszym przypadku zmienia swój stopień utlenienia z zerowego na +V, w tym celu musiał on odłączyć od siebie aż 10 elektronów (po 5 na każdy atom bromu, ponieważ jest to cząsteczka dwuatomowa, stąd ta liczba elektronów). Jeżeli więc dany pierwiastek pozbywa się elektronów, to zwiększa on swój stopień utlenienia i tym samym zachodzi utlenienie. W drugim przypadku brom zmienia stopień utlenienia z zerowego na I, w tym celu przyłącza do siebie elektrony, (po jednym elektronie na jeden atom bromu). Jeżeli więc pierwiastek przyłącza do siebie elektrony, to zmniejsza on swój stopień utlenienia i tym samym zachodzi redukcja. 4. Po ustaleniu ilości oddawanych i przyłączanych elektronów, należy na krzyż zapisać liczbę wymienionych elektronów (tak jak jest to wyżej) i po skróceniu (o ile jest to możliwe) wychodzą liczby które należy umieścić w reakcji redoks (współczynniki). Tym samym liczba 1 będzie odnosić się do ilości cząsteczek (moli) związku, w którym brom przyjmuje stopień utlenienia +V. Natomiast liczba 5 będzie odnosić się do ilości cząsteczek (moli) związku, w którym brom przyjmuje stopień utlenienia I. 5. Po ustaleniu i wpisaniu liczb 1 i 5, ustalamy już zwyczajnie resztę współczynników, aby lewa strona równania równała się prawej: reakcja po bilansie: 6KOH 3Br KBrO3 5KBr 3H O 6. Na koniec każdej reakcji należy ustalić co w danej reakcji jest reduktorem a co utleniaczem. W tym przypadku obie role spełnia brom, co jest jak najbardziej prawidłowe. utleniacz i reduktor jednocześnie to Br Nie zawsze jest tak, że utlenieniu i redukcji ulega ten sam pierwiastek! Dlatego też ważne jest ustalenie prawidłowych stopni utlenienia każdego z pierwiastków. Poniżej dołączam kilka innych przykładów: a) stopnie utlenienia lewa strona: Mn = +IV O = -II H = zero
3 stopnie utlenienia prawa strona: Mn = +II O = -II H = +I O = -II Mn(+IV) +e > Mn(+II) 1 H(0) -e > H(+I) 1 reakcja po bilansie: b) 3 CrO 3 I H Cr I H O stopnie utlenienia: lewa strona: >>> chrom(+vi), tlen(-ii) >> (-I) >> wodór(+i) Prawa strona: >> (+III) >> 0 >> wodór (+I), tlen(-ii) bilans Po bilansie: Kilka przykładów dla związków: Oblicz stopnie utlenienia pierwiastków w podanych cząsteczkach: a) Al(NO 3 ) 3 >> Al(+III); N(+V), O(-II) Ca 3 (PO 4 ) >> Ca(+II); P(+V); O(-II) HNO 3 >> H(+I); N(+V); O(-II) MgS >> Mg(+II); S(-II) b) HClO 4 >> H(+I); Cl(+VII); O(-II) SiO >> Si(+IV); O(-II) HBr >> H(+I); Br(-I) NaH >> Na(+I); (-I)
4 a) w pierwszym błąd ma być S + HNO₃ --> H₂SO₄ + H₂O + NO₂ ustalamy stopnie utlenienia: lewa strona równania: S ---> (0) HNO₃ --> H(+I); N(+V); O(-II) * tlen ma zawsze stopień utlenienia (-II) z wyjątkiem H₂O₂ gd₂e ma (-I) i prócz OF₂ gdzie ma (+II) * wodór ma zawsze stopień utlenienia (+I) prócz wodorków metali np. NaH gdzie ma (-I) * pierwiastki w stanie wolnym mają zawsze stopień utlenienia zero np, Cl₂, H₂, Zn, Ca, S, K, Fe, N₂ itp * suma stopni utlenienia w związku musi być równa zero czyli np HNO₃ = 1*(+1) + 1*(+5) + 3*(-) = (-6) = +6-6 = 0 czyli się zgadza prawa strona równania: H₂SO₄ ---> H(+I); O(-II); żeby obliczyć stopień utlenienia atomu centralnego czyli siarki nalezy to zrobić tak: mamy dwa wodory i 4 tleny i jedną siarke ich suma stopni utlenienia musi byc równa zero, czyli: *(+I)+1*(x)+4*(-II) = 0 x - to stopien siarki obliczamy dalej: + + +x + (-8) = x - 8 = 0 +x = 8- +x = 6 >> stopień utlenienia siarki w H₂SO₄ to (+VI) NO₂ ---> N(+IV); O(-II) teraz sprawdzamy jakie pierwiastki zmieniły swój stopień utlenienia jest to siarka i azot: siarka z (0) na (+VI) i azot z (+V) na (+IV) czyli siarka musiała oddać swoje elektrony żeby być na "plusie", a azot przyjął jeden elektron bo ma o jeden "plus" mniej zaisujemy S(0) -6e > S(+VI) N(+V) + 1e > N(+IV)
5 iloś wymienionych elektronów (czyli 6 i 1) zapisujemy na krzyż czyli: S(0) -6e > S(+VI) 1 N(+V) + 1e > N(+IV) 6 czyli przy siarce piszemy 1 a przy azocie 6 (z tym że jedynek w chemii się nie pisze) jezeli były by takie liczby które można podzielić tak aby były one mniejsze należy to zrobić (np jakby była 4 i 6 to można je podzielić na i wtedy mamy i 3) uzupełniamy reakcje: ki, azotu, wodoru S + 6HNO₃ --> H₂SO₄ + H₂O + 6NO₂ uzupełniamy tak aby liczba siarki, azotu, wodoru i na końcu tlenu była taka sama po obu stronach równania utleniaczem w takich reakcjach jest związek lub tez pierwiastek który się zredukował czyli zmniejszył swój stopień utlenienia, czyli taki który przyjął elektrony reduktorem jest związek lub pierwiastek, który się utlenił czyli zwiększył swój stopień utlenienia czyli oddał elektrony w tej reakcji: utleniacz to HNO₃ reduktor to S następne przykłądy robię analogicznie bez tego tłumaczenia jak powyżej: b) Fe +H₂SO₄->Fe₂(SO₄)₃ + H₂O+ SO₂ Fe ---> (0) H₂SO₄ ---> H(+I); O(-II); S(+VI) Fe₂(SO₄)₃ ---> Fe(+III); O(-II); S(+VI) SO₂ ---> S(+IV); O(-II)
6 Fe(+II) -1e -----> Fe(+III) S(+VI) +e ----> S(+IV) 1 Fe +4H₂SO₄->Fe₂(SO₄)₃ + 4H₂O+ SO₂ utleniacz to H₂SO₄ reduktor to Fe c)k₂cr₂o₇ +HCl -----> KCl +CrCl₃ +H₂O +Cl₂ K₂Cr₂O₇ ---> K(+I); O(-II); Cr(+VI) HCl ---> H(+I); Cl(-I) KCl ---> K(+I); Cl(-I) CrCl₃ ---> Cr(+III); Cl(-I) Cl₂ ---> stopień zerowy (0) Cr(+VI) +3e > Cr(+III) Cl(-I) -e > Cl(0) 3 K₂Cr₂O7 + 14HCl -----> KCl + CrCl₃ + 7H₂O + 3Cl₂ utleniacz to K₂Cr₂O₇ reduktor to HCl d) CuS + HNO₃ -----> CuO + S + NO + H₂O CuS ---> Cu(+II); S(-II) HNO₃ --> H(+I); N(+V); O(-II)
7 CuO ----> Cu(+II); O(-II) S --> stopień zerowy (0) NO ---> N(+II); O(-II) S(-II) -e -----> S(0) 3 N(+V) +3e ----> N(+II) 3CuS + HNO₃ -----> 3CuO + 3S + NO + H₂O utleniacz to HNO₃ reduktor to CuS e) NH4 + NO -----> N + HO NH₄ ---> N(-IV); H(+I) NO₂ ---> N(+IV); O(-II) N₂ ----> stopien zerowy (0) N(-IV) -8e ---> N₂(0) 8 N(+IV) +8e ----> N₂ (0) 8 te same liczby czyli "piszemy" jedynki NH₄ + NO₂ -----> N₂ + H₂O utleniacz to NO₂ reduktor to NH₄
8 F) Br- + SO₄- + H > Br₂ +SO₃ + H₂O przy jonach suma stopni utlenienia związków musi byc równa ładunkowi tego jonu, np OH mamy jeden tlen i jeden wodór a musi wyjść suma -1 czyli: 1*x + 1*(+1) = -1 x + 1 = -1-1 x = - >> stopień utlenienia tlenu w OH wynosi (-II) przy jonach typu S², stopień utlenienia jest równy temu ładunkowi czyli (-) wracam do przykładu: Br- ---> (-I) SO₄- ----> O(-II); S(+VI) (st siarki licze tak jak podałam w przykładzie dla OH ) H+ ---> (+I) Br₂ ---> stopien zerowy (0) SO₃ ---> O(-II); S(+VI) Br- + SO₄- + H > Br₂ +SO₃ + H₂O
Reakcje utleniania i redukcji
 Reakcje utleniania i redukcji Reguły ustalania stopni utlenienia 1. Pierwiastki w stanie wolnym (nie związane z atomem (atomami) innego pierwiastka ma stopień utlenienia równy (zero) 0 ; 0 Cu; 0 H 2 ;
Reakcje utleniania i redukcji Reguły ustalania stopni utlenienia 1. Pierwiastki w stanie wolnym (nie związane z atomem (atomami) innego pierwiastka ma stopień utlenienia równy (zero) 0 ; 0 Cu; 0 H 2 ;
W tej reakcji stopień utleniania żelaza wzrasta od 0 do III. Odwrotnie tlen zmniejszył stopień utlenienia z 0 na II.
 8 Utlenianie i redukcja Początkowo termin utlenianie odnosił się do reakcji pierwiastków lub związków chemicznych z tlenem, a termin redukcja stosowano do określenia usunięcia tlenu ze związku. Później,
8 Utlenianie i redukcja Początkowo termin utlenianie odnosił się do reakcji pierwiastków lub związków chemicznych z tlenem, a termin redukcja stosowano do określenia usunięcia tlenu ze związku. Później,
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 01/1 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 01/1 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
************************************************************
 As 2 S 3 + HNO 3 + H 2 O = H 3 AsO 4 + H 2 SO 4 + NO Zn + HNO 3 = Zn(NO 3 ) 2 + NH 4 NO 3 + H 2 O HClO 3 = ClO 2 + HClO 4 + H 2 O KNO 2 + KMnO 4 +? = KNO 3 + MnSO 4 +? Bi 2 S 3 + NO 3 = Bi 3+ + NO + S
As 2 S 3 + HNO 3 + H 2 O = H 3 AsO 4 + H 2 SO 4 + NO Zn + HNO 3 = Zn(NO 3 ) 2 + NH 4 NO 3 + H 2 O HClO 3 = ClO 2 + HClO 4 + H 2 O KNO 2 + KMnO 4 +? = KNO 3 + MnSO 4 +? Bi 2 S 3 + NO 3 = Bi 3+ + NO + S
2. REAKCJE UTLENIANIA I REDUKCJI
 2. REAKCJE UTLENIANIA I REDUKCJI Reakcje utleniania i redukcji zwane także procesami redoks charakteryzują się tym, że w czasie ich przebiegu następuje wymiana elektronowa między substratami reakcji. Oddawanie
2. REAKCJE UTLENIANIA I REDUKCJI Reakcje utleniania i redukcji zwane także procesami redoks charakteryzują się tym, że w czasie ich przebiegu następuje wymiana elektronowa między substratami reakcji. Oddawanie
Ważne pojęcia. Stopień utlenienia. Utleniacz. Reduktor. Utlenianie (dezelektronacja)
 Ważne pojęcia Stopień utlenienia Utleniacz Reduktor Utlenianie (dezelektronacja) Stopień utlenienia pierwiastka w dowolnym połączeniu chemicznym jest pojęciem umownym i określa ładunek, który istniałby
Ważne pojęcia Stopień utlenienia Utleniacz Reduktor Utlenianie (dezelektronacja) Stopień utlenienia pierwiastka w dowolnym połączeniu chemicznym jest pojęciem umownym i określa ładunek, który istniałby
Materiał powtórzeniowy - reakcje utlenienia i redukcji (redox - redoks ) z przykładowymi zadaniami
 Materiał powtórzeniowy - reakcje utlenienia i redukcji (redox - redoks ) z przykładowymi zadaniami I. Stopień utlenienia i reguły ustalania stopni utlenienia 1. Stopień utlenienia Stopień utlenienia pierwiastka
Materiał powtórzeniowy - reakcje utlenienia i redukcji (redox - redoks ) z przykładowymi zadaniami I. Stopień utlenienia i reguły ustalania stopni utlenienia 1. Stopień utlenienia Stopień utlenienia pierwiastka
I II I II III II. I. Wartościowość pierwiastków chemicznych. oznacza się cyfrą rzymską. tlenek żelaza (III) C IV O II 2
 I. Wartościowość pierwiastków chemicznych oznacza się cyfrą rzymską tlenek żelaza (III) C IV II 2 oznacza liczbę wiązań za pomocą, których atomy łączą się ze sobą H wodór jest I wartościowy od atomu wodoru
I. Wartościowość pierwiastków chemicznych oznacza się cyfrą rzymską tlenek żelaza (III) C IV II 2 oznacza liczbę wiązań za pomocą, których atomy łączą się ze sobą H wodór jest I wartościowy od atomu wodoru
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
Obliczenia stechiometryczne, bilansowanie równań reakcji redoks
 Obliczenia stechiometryczne, bilansowanie równań reakcji redoks Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Obliczenia stechiometryczne Podstawą
Obliczenia stechiometryczne, bilansowanie równań reakcji redoks Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Obliczenia stechiometryczne Podstawą
Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI
 Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI Zadanie 726 (1 pkt.) V/2006/A1 Konfigurację elektronową atomu glinu w stanie podstawowym można przedstawić następująco: 1s 2 2s 2 2p 6 3s 2 3p
Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI Zadanie 726 (1 pkt.) V/2006/A1 Konfigurację elektronową atomu glinu w stanie podstawowym można przedstawić następująco: 1s 2 2s 2 2p 6 3s 2 3p
Reakcje chemiczne. Typ reakcji Schemat Przykłady Reakcja syntezy
 Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
CHEMIA. Wymagania szczegółowe. Wymagania ogólne
 CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
MARATON WIEDZY CHEMIA CZ. II
 MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów
 Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów Dział: Reakcje chemiczne. Podstawy obliczeń chemicznych. Kl. I LO Nr programu DKOS-4015-33-02 Nr zad. Sprawdzane wiadomości iumiejętności
Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów Dział: Reakcje chemiczne. Podstawy obliczeń chemicznych. Kl. I LO Nr programu DKOS-4015-33-02 Nr zad. Sprawdzane wiadomości iumiejętności
BUDOWA ATOMU 1. Wymień 3 korzyści płynące z zastosowania pierwiastków promieniotwórczych. 2. Dokończ reakcję i nazwij powstałe pierwiastki:
 BUDOWA ATOMU 1. Wymień 3 korzyści płynące z zastosowania pierwiastków promieniotwórczych. 2. Dokończ reakcję i nazwij powstałe pierwiastki: 235 4 92 U + 2 He 198. 79 Au + ß - 3. Spośród atomów wybierz
BUDOWA ATOMU 1. Wymień 3 korzyści płynące z zastosowania pierwiastków promieniotwórczych. 2. Dokończ reakcję i nazwij powstałe pierwiastki: 235 4 92 U + 2 He 198. 79 Au + ß - 3. Spośród atomów wybierz
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II
 TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
TYPY REAKCJI CHEMICZNYCH
 TYPY REAKCJI CHEMICZNYCH Opracowanie: dr inż Krystyna Moskwa, dr hab. Barbara Stypuła, mgr Agnieszka Tąta Reakcje chemiczne to procesy, w czasie których substancje ulegają przemianom, prowadzącym do powstawania
TYPY REAKCJI CHEMICZNYCH Opracowanie: dr inż Krystyna Moskwa, dr hab. Barbara Stypuła, mgr Agnieszka Tąta Reakcje chemiczne to procesy, w czasie których substancje ulegają przemianom, prowadzącym do powstawania
Projekt Era inżyniera pewna lokata na przyszłość jest współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 TEMAT I WYBRANE WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH. STOPNIE UTLENIENIA. WIĄZANIA CHEMICZNE. WZORY SUMARYCZNE I STRUKTURALNE. TYPY REAKCJI CHEMICZNYCH. ILOŚCIOWA INTERPRETACJA WZORÓW I RÓWNAŃ CHEMICZNYCH
TEMAT I WYBRANE WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH. STOPNIE UTLENIENIA. WIĄZANIA CHEMICZNE. WZORY SUMARYCZNE I STRUKTURALNE. TYPY REAKCJI CHEMICZNYCH. ILOŚCIOWA INTERPRETACJA WZORÓW I RÓWNAŃ CHEMICZNYCH
Temat 2: Nazewnictwo związków chemicznych. Otrzymywanie i właściwości tlenków
 Zasada ogólna: We wzorze sumarycznym pierwiastki zapisujemy od metalu do niemetalu, natomiast odczytujemy nazwę zaczynając od niemetalu: MgO, CaS, NaF Nazwy związków chemicznych najczęściej tworzymy, korzystając
Zasada ogólna: We wzorze sumarycznym pierwiastki zapisujemy od metalu do niemetalu, natomiast odczytujemy nazwę zaczynając od niemetalu: MgO, CaS, NaF Nazwy związków chemicznych najczęściej tworzymy, korzystając
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Tlen. Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki
 Tlen Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki Ogólna charakterystyka tlenowców Tlenowce: obejmują pierwiastki
Tlen Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki Ogólna charakterystyka tlenowców Tlenowce: obejmują pierwiastki
Zadanie 1. (1 pkt). Informacja do zada 2. i 3. Zadanie 2. (1 pkt) { Zadania 2., 3. i 4 s dla poziomu rozszerzonego} zania zania Zadanie 3.
 2. ELEKTRONY W ATOMACH I CZĄSTECZKACH. A1 - POZIOM PODSTAWOWY. Zadanie 1. (1 pkt). Konfigurację elektronową 1s 2 2s 2 2p 6 3s 2 3p 6 mają atomy i jony: A. Mg 2+, Cl -, K +, B. Ar, S 2-, K +, C. Ar, Na
2. ELEKTRONY W ATOMACH I CZĄSTECZKACH. A1 - POZIOM PODSTAWOWY. Zadanie 1. (1 pkt). Konfigurację elektronową 1s 2 2s 2 2p 6 3s 2 3p 6 mają atomy i jony: A. Mg 2+, Cl -, K +, B. Ar, S 2-, K +, C. Ar, Na
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks
 Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Zn + S ZnS Utleniacz:... Reduktor:...
 Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
USTALANIE WZORÓW I NAZW SOLI
 USTALANIE WZORÓW I NAZW SOLI Spis treści Pojęcia podstawowe Wzór ogólny soli Znane kwasy, wartościowość reszt, nazewnictwo pochodzących od nich soli Wartościowość znanych metali Ustalanie wzorów sumarycznych
USTALANIE WZORÓW I NAZW SOLI Spis treści Pojęcia podstawowe Wzór ogólny soli Znane kwasy, wartościowość reszt, nazewnictwo pochodzących od nich soli Wartościowość znanych metali Ustalanie wzorów sumarycznych
( liczba oddanych elektronów)
 Reakcje utleniania i redukcji (redoks) (Miareczkowanie manganometryczne) Spis treści 1 Wstęp 1.1 Definicje reakcji redoks 1.2 Przykłady reakcji redoks 1.2.1 Reakcje utleniania 1.2.2 Reakcje redukcji 1.3
Reakcje utleniania i redukcji (redoks) (Miareczkowanie manganometryczne) Spis treści 1 Wstęp 1.1 Definicje reakcji redoks 1.2 Przykłady reakcji redoks 1.2.1 Reakcje utleniania 1.2.2 Reakcje redukcji 1.3
Chemia Grudzień Styczeń
 Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
Problemy do samodzielnego rozwiązania
 Problemy do samodzielnego rozwiązania 1. Napisz równania reakcji dysocjacji elektrolitycznej, uwzględniając w zapisie czy jest to dysocjacja mocnego elektrolitu, słabego elektrolitu, czy też dysocjacja
Problemy do samodzielnego rozwiązania 1. Napisz równania reakcji dysocjacji elektrolitycznej, uwzględniając w zapisie czy jest to dysocjacja mocnego elektrolitu, słabego elektrolitu, czy też dysocjacja
Reakcje chemiczne, związki kompleksowe
 201-11-15, związki kompleksowe Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów
201-11-15, związki kompleksowe Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów
Stechiometria w roztworach. Woda jako rozpuszczalnik
 Stechiometria w roztworach Woda jako rozpuszczalnik Właściwości wody - budowa cząsteczki kątowa - wiązania O-H O H kowalencyjne - cząsteczka polarna δ + H 2δ O 105 H δ + Rozpuszczanie + oddziaływanie polarnych
Stechiometria w roztworach Woda jako rozpuszczalnik Właściwości wody - budowa cząsteczki kątowa - wiązania O-H O H kowalencyjne - cząsteczka polarna δ + H 2δ O 105 H δ + Rozpuszczanie + oddziaływanie polarnych
Podstawa programowa nauczania chemii w zakresie rozszerzonym
 27 2 nauczania chemii w zakresie rozszerzonym A Z E Z s p d s p 4 + 3 + 2 3 sp sp 2 sp 3 s p DH DH K 28 2 2 2 2 2 2 2 4 3 2 29 2 2 2 2 2 2 2 2 2 2 2 2 2 4 30 2 4 a 2 62 Przypomnij sobie rodzaje tlenków
27 2 nauczania chemii w zakresie rozszerzonym A Z E Z s p d s p 4 + 3 + 2 3 sp sp 2 sp 3 s p DH DH K 28 2 2 2 2 2 2 2 4 3 2 29 2 2 2 2 2 2 2 2 2 2 2 2 2 4 30 2 4 a 2 62 Przypomnij sobie rodzaje tlenków
ARKUSZ PRÓBNEJ MATURY Z OPERONEM CHEMIA
 Miejsce na identyfikację szkoły ARKUSZ PRÓBNEJ MATURY Z OPERONEM CHEMIA POZIOM PODSTAWOWY LISTOPAD 2012 Instrukcja dla zdającego Czas pracy: 120 minut 1. Sprawdź, czy arkusz egzaminacyjny zawiera 10 stron
Miejsce na identyfikację szkoły ARKUSZ PRÓBNEJ MATURY Z OPERONEM CHEMIA POZIOM PODSTAWOWY LISTOPAD 2012 Instrukcja dla zdającego Czas pracy: 120 minut 1. Sprawdź, czy arkusz egzaminacyjny zawiera 10 stron
MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu
 MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu Etap III (wojewódzki) Materiały dla nauczycieli Rozwiązania zadań
MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu Etap III (wojewódzki) Materiały dla nauczycieli Rozwiązania zadań
Model odpowiedzi (w nawiasach podano elementy poprawne, ale niewymagane)
 MODEL ODPOWIEDZI I SCHEMAT OCENIANIA ARKUSZA EGZAMINACYJNEGO I Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Gdy do jednego polecenia
MODEL ODPOWIEDZI I SCHEMAT OCENIANIA ARKUSZA EGZAMINACYJNEGO I Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Gdy do jednego polecenia
Stechiometria w roztworach
 Stechiometria w roztworach Woda jako rozpuszczalnik Właściwości wody - budowa cząsteczki kątowa. k - wiązania O-H O H kowalencyjne. - cząsteczka polarna. δ H 2δ O 105 H δ Rozpuszczanie rozpuszczalnik (solvent)
Stechiometria w roztworach Woda jako rozpuszczalnik Właściwości wody - budowa cząsteczki kątowa. k - wiązania O-H O H kowalencyjne. - cząsteczka polarna. δ H 2δ O 105 H δ Rozpuszczanie rozpuszczalnik (solvent)
REAKCJE UTLENIANIA I REDUKCJI
 REAKCJE UTLENIANIA I REDUKCJI WSTĘP TEORETYCZNY Jednym z możliwych kryteriów klasyfikacji reakcji chemicznych jest wymiana elektronów między reagentami. Reakcje zachodzące z wymianą elektronów między reagującymi
REAKCJE UTLENIANIA I REDUKCJI WSTĘP TEORETYCZNY Jednym z możliwych kryteriów klasyfikacji reakcji chemicznych jest wymiana elektronów między reagentami. Reakcje zachodzące z wymianą elektronów między reagującymi
Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych
 Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych 1. Wielkości i jednostki stosowane do wyrażania ilości materii 1.1 Masa atomowa, cząsteczkowa, mol Masa atomowa Atomy mają
Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych 1. Wielkości i jednostki stosowane do wyrażania ilości materii 1.1 Masa atomowa, cząsteczkowa, mol Masa atomowa Atomy mają
Model odpowiedzi i schemat oceniania arkusza I
 Model odpowiedzi i schemat oceniania arkusza I Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Gdy do jednego polecenia zdający poda dwie
Model odpowiedzi i schemat oceniania arkusza I Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Gdy do jednego polecenia zdający poda dwie
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów
Obliczenia chemiczne. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM. Chemia Poziom podstawowy
 KRYTERIA CENIANIA DPWIEDZI Próbna Matura z PERNEM Chemia Poziom podstawowy Listopad 2012 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu ch
KRYTERIA CENIANIA DPWIEDZI Próbna Matura z PERNEM Chemia Poziom podstawowy Listopad 2012 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu ch
Związki chemiczne, wiązania chemiczne, reakcje
 Związki chemiczne, wiązania chemiczne, reakcje Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna
Związki chemiczne, wiązania chemiczne, reakcje Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM. Chemia Poziom rozszerzony
 KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Chemia Poziom rozszerzony Listopad 2014 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Chemia Poziom rozszerzony Listopad 2014 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM. Chemia Poziom podstawowy
 KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Chemia Poziom podstawowy Listopad 03 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Chemia Poziom podstawowy Listopad 03 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu
MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA
 Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Poziom podstawowy Odpowiedzi Uwagi Punktacja za czynność za zadanie Zadanie. a) za podanie symbolu
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Poziom podstawowy Odpowiedzi Uwagi Punktacja za czynność za zadanie Zadanie. a) za podanie symbolu
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu
 MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu Etap II (rejonowy) Materiały dla nauczycieli Rozwiązania zadań wraz
MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu Etap II (rejonowy) Materiały dla nauczycieli Rozwiązania zadań wraz
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Procentowa zawartość sodu (w molu tej soli są dwa mole sodu) wynosi:
 Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr.
 Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH
 WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY
 Próbny egzamin maturalny z chemii 00r. ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach.
Próbny egzamin maturalny z chemii 00r. ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach.
-wszystkie substancje (pierwiastki lub zw chem) które biorą udział w reakcji chemicznej nazywamy reagentami
 Zapis reakcji chemicznej co to są przemiany chemiczne oraz w jaki sposób możemy opisać zachodzące reakcje? wokół nas bezustannie zachodzą rozmaite przemiany przemiany podczas których powstaje nowa substancja,
Zapis reakcji chemicznej co to są przemiany chemiczne oraz w jaki sposób możemy opisać zachodzące reakcje? wokół nas bezustannie zachodzą rozmaite przemiany przemiany podczas których powstaje nowa substancja,
Przemiany substancji
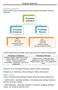 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Związki chemiczne, wiązania chemiczne, reakcje
 Związki chemiczne, wiązania chemiczne, reakcje Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna
Związki chemiczne, wiązania chemiczne, reakcje Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna
Arkusz zadań dla I roku Inżynierii Procesowej i Ochrony Środowiska Chemia II (semestr II)
 Arkusz zadań dla I roku Inżynierii Procesowej i Ochrony Środowiska Chemia II (semestr II) Reakcje w roztworach 1. Jaką objętość 20% roztworu kwasu solnego (o gęstości ρ = 1,10 g/cm 3 ) należy dodać do
Arkusz zadań dla I roku Inżynierii Procesowej i Ochrony Środowiska Chemia II (semestr II) Reakcje w roztworach 1. Jaką objętość 20% roztworu kwasu solnego (o gęstości ρ = 1,10 g/cm 3 ) należy dodać do
VII Podkarpacki Konkurs Chemiczny 2014/2015
 II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
Kuratorium Oświaty w Lublinie
 Kuratorium Oświaty w Lublinie ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 KOD UCZNIA ETAP OKRĘGOWY Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
Kuratorium Oświaty w Lublinie ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 KOD UCZNIA ETAP OKRĘGOWY Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
Szanowne koleżanki i koledzy nauczyciele chemii!
 Szanowne koleżanki i koledzy nauczyciele chemii! Chciałabym podzielić się z Wami moimi spostrzeżeniami dotyczącymi poziomu wiedzy z chemii uczniów rozpoczynających naukę w Liceum Ogólnokształcącym. Co
Szanowne koleżanki i koledzy nauczyciele chemii! Chciałabym podzielić się z Wami moimi spostrzeżeniami dotyczącymi poziomu wiedzy z chemii uczniów rozpoczynających naukę w Liceum Ogólnokształcącym. Co
Chemia Wydział SiMR, kierunek IPEiH I rok I stopnia studiów, semestr I. Chemia nieorganiczna. Stopień utlenienia. Stopień utlenienia.
 -- Chemia Wydział SiMR, kierunek IPEiH I rok I stopnia studiów, semestr I dr inż. Leszek Niedzicki Chemia nieorganiczna Drobina Drobiną nazywamy proste układy atomów tj.: atom (zwykle metalu np. Cu, Na,
-- Chemia Wydział SiMR, kierunek IPEiH I rok I stopnia studiów, semestr I dr inż. Leszek Niedzicki Chemia nieorganiczna Drobina Drobiną nazywamy proste układy atomów tj.: atom (zwykle metalu np. Cu, Na,
WYMAGANIA EDUKACYJNE Z CHEMII
 WYMAGANIA EDUKACYJNE Z CHEMII dla klasy I szkoły ponadpodstawowej realizującej chemię w zakresie rozszerzonym w liczbie 2 godzin tygodniowo (klasy 1L i 1M) II LICEUM OGÓLNOKSZTAŁCĄCE im. Króla Jana III
WYMAGANIA EDUKACYJNE Z CHEMII dla klasy I szkoły ponadpodstawowej realizującej chemię w zakresie rozszerzonym w liczbie 2 godzin tygodniowo (klasy 1L i 1M) II LICEUM OGÓLNOKSZTAŁCĄCE im. Króla Jana III
Tak zwane trudne równania redoksowe.
 Tak zwane trudne równania redoksowe. W poniższym rozdziale naszkicuję rozwiązania kilku równań redoksowych uważanych za super trudne (a okaże się, że przy opanowaniu podstaw metod wyliczania współczynników
Tak zwane trudne równania redoksowe. W poniższym rozdziale naszkicuję rozwiązania kilku równań redoksowych uważanych za super trudne (a okaże się, że przy opanowaniu podstaw metod wyliczania współczynników
Liczba cząsteczek w 1 molu. Liczba atomów w 1 molu. Masa molowa M
 Materiał powtórzeniowy do sprawdzianu - liczba Avogadro, mol, masa molowa, molowa objętość gazów, obliczenia stechiometryczne + zadania z rozwiązaniami I. Podstawowe definicje 1. Masa atomowa - masa atomu
Materiał powtórzeniowy do sprawdzianu - liczba Avogadro, mol, masa molowa, molowa objętość gazów, obliczenia stechiometryczne + zadania z rozwiązaniami I. Podstawowe definicje 1. Masa atomowa - masa atomu
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY
 Próbny egzamin maturalny z chemii 0r. ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach.
Próbny egzamin maturalny z chemii 0r. ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach.
Przykładowy zestaw zadań z chemii dla osób niewidomych Odpowiedzi i schemat punktowania poziom podstawowy
 ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY DLA NIEWIDOMYCH Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY DLA NIEWIDOMYCH Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania
Przykładowy zestaw zadań z chemii Odpowiedzi i schemat punktowania poziom podstawowy
 ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II
 TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
EGZAMIN MATURALNY Z CHEMII
 Miejsce na naklejkę z kodem (Wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO MCH-W1D1P-021 EGZAMIN MATURALNY Z CHEMII Instrukcja dla zdającego Czas pracy 90 minut 1. Proszę sprawdzić, czy arkusz
Miejsce na naklejkę z kodem (Wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO MCH-W1D1P-021 EGZAMIN MATURALNY Z CHEMII Instrukcja dla zdającego Czas pracy 90 minut 1. Proszę sprawdzić, czy arkusz
Wykład z Chemii Ogólnej i Nieorganicznej
 Wykład z Chemii Ogólnej i Nieorganicznej Część VI ELEMENTY ELEKTOCHEMII Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja Kopernika w Toruniu Prof. dr hab. n.chem. Piotr
Wykład z Chemii Ogólnej i Nieorganicznej Część VI ELEMENTY ELEKTOCHEMII Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja Kopernika w Toruniu Prof. dr hab. n.chem. Piotr
 PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
PRAKTIKUM Z CHEMII OGÓLNEJ
 PRAKTIKUM Z CHEMII OGÓLNEJ Dwiczenia laboratoryjne dla studentów I roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Optyka okularowa
PRAKTIKUM Z CHEMII OGÓLNEJ Dwiczenia laboratoryjne dla studentów I roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Optyka okularowa
ĆWICZENIE 10. Szereg napięciowy metali
 ĆWICZENIE 10 Szereg napięciowy metali Szereg napięciowy metali (szereg elektrochemiczny, szereg aktywności metali) obrazuje tendencję metali do oddawania elektronów (ich zdolności redukujących) i tworzenia
ĆWICZENIE 10 Szereg napięciowy metali Szereg napięciowy metali (szereg elektrochemiczny, szereg aktywności metali) obrazuje tendencję metali do oddawania elektronów (ich zdolności redukujących) i tworzenia
EGZAMIN MATURALNY Z CHEMII ARKUSZ ROZSZERZONY
 Egzamin maturalny z chemii EGZAMIN MATURALNY Z CHEMII ARKUSZ ROZSZERZONY Zadanie. ( pkt) Wiązanie koordynacyjne w cząsteczce NH BF znajduje się między atomami: Zadanie. (4 pkt) Oblicz stężenie procentowe
Egzamin maturalny z chemii EGZAMIN MATURALNY Z CHEMII ARKUSZ ROZSZERZONY Zadanie. ( pkt) Wiązanie koordynacyjne w cząsteczce NH BF znajduje się między atomami: Zadanie. (4 pkt) Oblicz stężenie procentowe
podstawami stechiometrii, czyli działu chemii zajmującymi są obliczeniami jest prawo zachowania masy oraz prawo stałości składu
 Podstawy obliczeń chemicznych podstawami stechiometrii, czyli działu chemii zajmującymi są obliczeniami jest prawo zachowania masy oraz prawo stałości składu prawo zachowania masy mówi, że w reakcji chemicznej
Podstawy obliczeń chemicznych podstawami stechiometrii, czyli działu chemii zajmującymi są obliczeniami jest prawo zachowania masy oraz prawo stałości składu prawo zachowania masy mówi, że w reakcji chemicznej
Wzory sumaryczne i strukturalne związków
 Wzory sumaryczne i strukturalne związków H S H 3 PO 4 SO CH 4 H SO 4 OHC H 5 NH Wzory sumaryczne i strukturalne związków H SO 4 CuSO 4 siarczanvi miedziii K SO 4 siarczanvi potasu Fe SO 4 3 siarczanvi
Wzory sumaryczne i strukturalne związków H S H 3 PO 4 SO CH 4 H SO 4 OHC H 5 NH Wzory sumaryczne i strukturalne związków H SO 4 CuSO 4 siarczanvi miedziii K SO 4 siarczanvi potasu Fe SO 4 3 siarczanvi
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
analogicznie: P g, K g, N g i Mg g.
 Zadanie 1 Obliczamy zawartość poszczególnych składników w 10 m 3 koncentratu: Ca: 46 g Ca - 1 dm 3 roztworu x g Ca - 10000 dm 3 roztworu x = 460000 g Ca analogicznie: P 170000 g, K 10000 g, N 110000 g
Zadanie 1 Obliczamy zawartość poszczególnych składników w 10 m 3 koncentratu: Ca: 46 g Ca - 1 dm 3 roztworu x g Ca - 10000 dm 3 roztworu x = 460000 g Ca analogicznie: P 170000 g, K 10000 g, N 110000 g
Przemiany/Reakcje chemiczne
 Przemiany/Reakcje chemiczne Przemiany/Reakcje chemiczne Reakcje chemiczne są to takie przemiany, w wyniku których z jednych substancji powstają inne substancje, o zupełnie odmiennych właściwościach fizycznych
Przemiany/Reakcje chemiczne Przemiany/Reakcje chemiczne Reakcje chemiczne są to takie przemiany, w wyniku których z jednych substancji powstają inne substancje, o zupełnie odmiennych właściwościach fizycznych
Elektrochemia. Reakcje redoks (utlenienia-redukcji) Stopień utlenienia
 --6. Reakcje redoks (reakcje utlenienia-redukcji) - stopień utlenienia - bilansowanie równań reakcji. Ogniwa (galwaniczne) - elektrody (półogniwa) lektrochemia - schemat (zapis) ogniwa - siła elektromotoryczna
--6. Reakcje redoks (reakcje utlenienia-redukcji) - stopień utlenienia - bilansowanie równań reakcji. Ogniwa (galwaniczne) - elektrody (półogniwa) lektrochemia - schemat (zapis) ogniwa - siła elektromotoryczna
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013
 Kuratorium Oświaty w Lublinie Kod ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
Kuratorium Oświaty w Lublinie Kod ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM. Chemia. Poziom rozszerzony. Listopad 2014
 Vademecum Chemia KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM nowa vademecum MATURA 205 CHEMIA zakres rozszerzony Chemia Poziom rozszerzony KOD WEWNĄTRZ Zacznij przygotowania do matury już dziś
Vademecum Chemia KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM nowa vademecum MATURA 205 CHEMIA zakres rozszerzony Chemia Poziom rozszerzony KOD WEWNĄTRZ Zacznij przygotowania do matury już dziś
EGZAMIN MATURALNY 2012 CHEMIA
 Centralna Komisja Egzaminacyjna EGZAMIN MATURALNY 2012 CHEMIA POZIOM PODSTAWOWY Kryteria oceniania odpowiedzi MAJ 2012 2 Egzamin maturalny z chemii Zadanie 1. (0-1) Obszar standardów Opis wymagań Zapisanie
Centralna Komisja Egzaminacyjna EGZAMIN MATURALNY 2012 CHEMIA POZIOM PODSTAWOWY Kryteria oceniania odpowiedzi MAJ 2012 2 Egzamin maturalny z chemii Zadanie 1. (0-1) Obszar standardów Opis wymagań Zapisanie
SCENARIUSZ LEKCJI prowadzonej pod kątem hospitacji diagnozującej w klasie pierwszej gimnazjum
 Literka.pl Atom i cząsteczka Data dodania: 2010-05-31 11:51:50 Autor: Anna Piwowarczyk Podsumowanie wiadomości o wewnętrznej budowie materii. SCENARIUSZ LEKCJI prowadzonej pod kątem hospitacji diagnozującej
Literka.pl Atom i cząsteczka Data dodania: 2010-05-31 11:51:50 Autor: Anna Piwowarczyk Podsumowanie wiadomości o wewnętrznej budowie materii. SCENARIUSZ LEKCJI prowadzonej pod kątem hospitacji diagnozującej
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
SPRAWOZDANIE do dwiczenia nr 7 Analiza jakościowa anionów I-VI grupy analitycznej oraz mieszaniny anionów I-VI grupy analitycznej.
 Obserwacje Imię i nazwisko:. Data:.. Kierunek studiów i nr grupy:.. próby:. Analiza systematyczna anionów* SPRAWOZDANIE 7 1. AgNO 3 Odczynnik/ środowisko Jony Cl Br I SCN [Fe(CN) 6 ] 4 [Fe(CN) 6 ] 3 2.
Obserwacje Imię i nazwisko:. Data:.. Kierunek studiów i nr grupy:.. próby:. Analiza systematyczna anionów* SPRAWOZDANIE 7 1. AgNO 3 Odczynnik/ środowisko Jony Cl Br I SCN [Fe(CN) 6 ] 4 [Fe(CN) 6 ] 3 2.
Budowa atomu. Wiązania chemiczne
 strona /6 Budowa atomu. Wiązania chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Budowa atomu; jądro i elektrony, składniki jądra, izotopy. Promieniotwórczość i
strona /6 Budowa atomu. Wiązania chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Budowa atomu; jądro i elektrony, składniki jądra, izotopy. Promieniotwórczość i
Zapis równań reakcji chemicznych oraz ich uzgadnianie
 Zapis równań reakcji chemicznych oraz ich uzgadnianie Równanie reakcji chemicznej jest symbolicznym zapisem reakcji przy uŝyciu symboli wzorów oraz odpowiednich współczynników i znaków. Obrazuje ono przebieg
Zapis równań reakcji chemicznych oraz ich uzgadnianie Równanie reakcji chemicznej jest symbolicznym zapisem reakcji przy uŝyciu symboli wzorów oraz odpowiednich współczynników i znaków. Obrazuje ono przebieg
Ćwiczenie 1. Badanie wypierania wodoru z wody za pomocą metali
 VII. Reakcje utlenienia i redukcji Zagadnienia Szereg napięciowy metali Przewidywanie przebiegu reakcji w oparciu o szereg napięciowy Stopnie utlenienie Utleniacz, reduktor, utlenianie, redukcja Reakcje
VII. Reakcje utlenienia i redukcji Zagadnienia Szereg napięciowy metali Przewidywanie przebiegu reakcji w oparciu o szereg napięciowy Stopnie utlenienie Utleniacz, reduktor, utlenianie, redukcja Reakcje
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
Wykład z Chemii Ogólnej
 Wykład z Chemii Ogólnej Część 2 Budowa materii: od atomów do układów molekularnych 2.3. WIĄZANIA CHEMICZNE i ODDZIAŁYWANIA Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja
Wykład z Chemii Ogólnej Część 2 Budowa materii: od atomów do układów molekularnych 2.3. WIĄZANIA CHEMICZNE i ODDZIAŁYWANIA Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja
pobrano z
 ODPOWIEDZI Zadanie 1. (2 pkt) 1. promienia atomowego, promienia jonowego 2. najwyższego stopnia utlenienia Zadanie 2. (1 pkt) 1. Pierwiastek I jest aktywnym metalem. Tworzy wodorek, w którym wodór przyjmuje
ODPOWIEDZI Zadanie 1. (2 pkt) 1. promienia atomowego, promienia jonowego 2. najwyższego stopnia utlenienia Zadanie 2. (1 pkt) 1. Pierwiastek I jest aktywnym metalem. Tworzy wodorek, w którym wodór przyjmuje
materia³ pobrano ze strony:
 materia³ pobrano ze strony: multimedialna platforma edukacyjna Miejsce na naklejkê z kodem (Wpisuje zdaj¹cy przed rozpoczêciem pracy) KD ZDAJ CEG dysleksja EGZAMIN MATURALNY Z CHEMII PZIM PDSTAWWY RZWI
materia³ pobrano ze strony: multimedialna platforma edukacyjna Miejsce na naklejkê z kodem (Wpisuje zdaj¹cy przed rozpoczêciem pracy) KD ZDAJ CEG dysleksja EGZAMIN MATURALNY Z CHEMII PZIM PDSTAWWY RZWI
Akademia Morska w Szczecinie. Laboratorium chemii technicznej. Ćwiczenie laboratoryjne Reakcje utlenienia i redukcji w roztworach
 Akademia Morska w Szczecinie Wydział Mechaniczny Katedra Fizyki i Chemii Laboratorium chemii technicznej Ćwiczenie laboratoryjne Reakcje utlenienia i redukcji w roztworach Opracowali: dr inż. Andrzej Kozłowski
Akademia Morska w Szczecinie Wydział Mechaniczny Katedra Fizyki i Chemii Laboratorium chemii technicznej Ćwiczenie laboratoryjne Reakcje utlenienia i redukcji w roztworach Opracowali: dr inż. Andrzej Kozłowski
MODEL ODPOWIEDZI I SCHEMAT OCENIANIA ARKUSZA EGZAMINACYJNEGO 2006
 MODEL ODPOWIEDZI I SCHEMAT OCENIANIA ARKUSZA EGZAMINACYJNEGO 006 Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania
MODEL ODPOWIEDZI I SCHEMAT OCENIANIA ARKUSZA EGZAMINACYJNEGO 006 Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania
