QUANTA Flash β2gp1 IgM Reagents Do diagnostyki In Vitro
|
|
|
- Lidia Kania
- 8 lat temu
- Przeglądów:
Transkrypt
1 QUANTA Flash β2gp1 IgM Reagents Do diagnostyki In Vitro Przeznaczenie W pełni zautomatyzowany test immunologiczny do półilościowego pomiaru przeciwciał IgM przeciwko β2 glikoproteinie-1 (β2gp1) w osoczu ludzkim z cytrynianem i surowicy w urządzeniu BIO-FLASH jako pomoc w diagnostyce zaburzeń płytkowych związanych z pierwotnym i wtórnym zespołem antyfosfolipidowym (APS), w przypadku wspólnego stosowania z innymi wynikami laboratoryjnymi i klinicznymi. Podsumowanie i wyjaśnienie testu Przeciwciała przeciwko β2 glikoproteinie-1 (ß2GP1) należą do heterogenicznej rodziny przeciwciał antyfosfolipidowych (apl), które są autoprzeciwciałami skierowanymi przeciwko fosfolipidom anionowym lub kompleksom białkowo-fosfolipidowym. Długotrwale podniesione poziomy przeciwciał apl wiążą się z poniesionym ryzykiem zakrzepicy naczyń oraz komplikacji położniczych. To powiązanie jest znane jako zespół antyfosfolipidowy (APS) wg klasyfikacji wprowadzonej przez Harrisa w 1987 r. 1. Badania mające na celu określenie przeciwciał IgM i IgG przeciwko ß2GP1, przeciwciał IgG i IgM przeciwko kardiolipinie (acl) oraz przeciwciał zwanych antykoagulantem tocznia są badaniami apl zdefiniowanymi w zaktualizowanej klasyfikacji przez Międzynarodowy komitet diagnostyki APS na zjeździe, który odbył się w 2006 r. w Sydney (Australia) 2,3. Badania przeciwko β2gp1 oraz acl zawierają ludzką β2 glikoproteinę- 1 (β2gp1) w fazie stałej. β2 glikoproteina-1, również nazywana apolipoproteiną H, jest występującą w osoczu glikoproteiną o ciężarze 44 kda o 5 domenach. Piąta domena zawiera zgrupowanie dodatnio naładowanych aminokwasów, które odpowiadają za wiązanie fosfolipidów anionowych. Mechanizm rozpoznawania przez przeciwciała antyfosfolipidów i-β2gp1 oraz acl przeciwciał β2gp1 jest nieznany. Powstały dwie główne teorie: pierwsza znana jako teoria dimeryzacji zakłada, że jedno przeciwciało musi wiązać dwa molekuły β2gp1, aby uzyskać podwyższoną awidność 4, a druga teoria ukrytych epitopów zakłada, że epitop wiążący antyfosfolipid przeciw β2gp1 i acl jest eksponowany tylko wtedy, gdy β2gp1 wiąże ujemnie naładowaną powierzchnię lub ujemne molekuły, takie jak kardiolipina 5,6. Ten epitop znajduje się w domenie I 7. Zasada badania Test QUANTA Flash β2 glikoproteiny-1 IgM jest chemiluminescencyjnym dwustopniowym testem immunologicznym z zastosowaniem cząstek magnetycznych pokrytych ludzką oczyszczoną β2gp1, która wychwytuje z próbki przeciwciała antyfosfolipidowe przeciwko β2gp1, jeśli w niej występują. Po inkubacji, magnetycznej separacji i etapie płukania, środek śledzący składający się z przeciwciała IgM przeciwludzkiego znakowanego izoluminolem, jest dodawany i może związać się z przechwyconymi cząstkami IgM przeciwko β2gp1. Po drugiej inkubacji, magnetycznej separacji oraz płukaniu, dodawane są odczynniki, które inicjują reakcję luminescencji, a wyemitowane światło jest mierzone jako względne jednostki światła (RLU) za pomocą systemu optycznego BIO-FLASH. Jednostki RLU są bezpośrednio proporcjonalne do stężenia anty-β2gp1 IgM w próbce. Test QUANTA Flash β2gp1 IgM wykorzystuje metodę redukcji danych dopasowania 4-parametrowej krzywej logistycznej (4PLC) w celu wygenerowania krzywej wzorcowej. Krzywa wzorcowa jest wstępnie zdefiniowana i uzależniona od serii oraz jest przechowywana w urządzeniu, wg kodu kreskowego wkładu. Dzięki pomiarowi kalibratorów wstępnie zdefiniowana krzywa wzorcowa jest przekształcana w nową, krzywą roboczą 4PLC zależną od urządzenia. Wartości stężenia kalibratorów są zawarte w kodach kreskowych probówki z kalibratorem. 1
2 Odczynniki Elementy składowe zestawu β2gp1 IgM: 1. Wkład z odczynnikiem QUANTA Flash β2gp1 IgM zawierający następujące odczynniki. Odczynniki znajdują się w buforze fosforanowym lub boranowym, zawierającym białko proste surowicy bydlęcej, ludzkie ß2GP1, mysie przeciwciała monoklonalne IgM, stabilizatory oraz konserwanty: a. 1 fiolka zawiesiny cząstki magnetycznej opłaszczonej oczyszczonym ludzkim ß2GP1. b. 1 fiolka buforu testowego. c. 1 fiolka środka śledzącego składającego się z ludzkiego przeciwciała IgM oznaczonego izoluminolem. d. 1 fiolka rozcieńczalnika do próbek używanego do regularnego wstępnego rozcieńczania próbki i automatycznego rozcieńczania w ponowieniu testu. 2. Fiolka z kalibratorem 1 ß2GP1 IgM, zawierająca: 1 x probówka 1 ml z kodem kreskowym i roztworem z przeciwciałami IgM przeciwko ß2GP1 w buforze fosforanowym zawierającym albuminę surowicy bydlęcej, stabilizatory i konserwanty. 3. Fiolka z kalibratorem 2 ß2GP1 IgM, zawierającym: 1 x probówka 1 ml z kodem kreskowym i roztworem z przeciwciałami IgM przeciwko ß2GP1 w buforze fosforanowym zawierającym albuminę surowicy bydlęcej, stabilizatory i konserwanty. Kalibratory są uzależnione od serii i nie można ich używać z innymi seriami odczynników. Ostrzeżenia i środki ostrożności 1. Materiał pochodzenia ludzkiego w tym produkcie został przetestowany zgodnie z metodami zatwierdzonymi przez FDA i stwierdzono brak reakcji dla antygenu powierzchniowego zapalenia wątroby typu B (HBsAg), przeciwciał przeciwko HCV oraz HIV1 i HIV2. Należy obchodzić się jak z potencjalnie zakaźnym materiałem Wszystkie odczynniki zawierają mniej niż 0,1% azydku sodu, który może tworzyć wybuchowe azydki w metalowych instalacjach kanalizacyjnych. Stosować odpowiednie procedury utylizacji. 3. Unikać kontaktu ze skórą i oczami (S 24/25). Nie wylewać do kanalizacji (S 29). Nosić odpowiednią odzież ochronną (S 36). 4. Środek szkodliwy w przypadku połknięcia (R 22). W razie połknięcia należy zwrócić się o pomoc medyczną (S 46). 5. Ten produkt jest przeznaczonych do zastosowań diagnostycznych in vitro. Warunki przechowywania Nieotwarte odczynniki oraz kalibratory są stabilne aż do daty ważności podanej na wkładzie i etykietach probówki, jeśli produkt jest przechowywany w temperaturze 2 8 C. Nie zamrażać. 1. Otwarte wkłady z odczynnikami należy przechowywać wewnątrz urządzenia. Oprogramowanie urządzenia BIO-FLASH monitoruje datę przydatności znajdującego się wewnątrz urządzenia wkładu oraz serii wkładu z odczynnikiem. System nie pozwala na użycie wkładu, którego termin ważności upłynął. 2. Kalibrator ß2GP1 IgM 1 i 2 stabilność w urządzeniu po otwarciu systemu BIO-FLASH wynosi 3,5 godziny. Aby zapewnić optymalną stabilność, należy wyjąć kalibratory z systemu od razu po kalibracji i przechowywać je w temperaturze 2 8 C, zamknięte, w oryginalnej fiolce. Pobieranie próbek Osocze: Dziewięć części świeżo pobranej krwi żylnej jest umieszczanych w jednej części trisodu cytrynianu. Więcej instrukcji dotyczących pobierania, obsługi i przechowywania próbek można znaleźć w dokumencie CLSI H21-A5 9. Rozmrażać próbki szybko w temperaturze 37 C. Po rozmrożeniu badanie musi być przeprowadzone w ciągu 2 godzin. Surowica: Po pobraniu surowica powinna być oddzielona od skrzepu. Należy postępować zgodnie z zaleceniami dokumentacji CLSI H18-A4 w zakresie warunków przechowywania próbek 10. Przed testowaniem wirować próbki zawierające widoczne cząstki. 2
3 Badanie Dostarczone materiały 1 Wkład z odczynnikiem QUANTA Flash β2gp1 IgM 1 Kalibrator QUANTA Flash β2gp1 IgM 1 1 Kalibrator QUANTA Flash β2gp1 IgM 2 Wymagane materiały nie dołączone do zestawu Urządzenie BIO-FLASH z obsługującym je komputerem Układ płuczący BIO-FLASH (nr części: ) Wyzwalacze BIO-FLASH (Numer części: ) Kuwetki BIO-FLASH (Numer części: ) Kontrole QUANTA Flash β2gp1 IgM (nr części: ) Stosowanie analizatora chemiluminescencyjnego BIO-FLASH 1. Szczegółowe instrukcje dotyczące pracy z analizatorem chemiluminescencyjnym i oprogramowaniem BIO-FLASH można znaleźć w podręczniku użytkownika dołączonym do systemu BIO-FLASH. Dodatkowe informacje i pomoc związaną z wykrywaniem i usuwaniem usterek w testach można uzyskać, kontaktując się z działem pomocy technicznej firmy INOVA Diagnostics, Inc. dostępnym pod adresem i numerem telefonu podanym na końcu tej instrukcji. 2. W celu opróżnienia zbiornika na odpady stałe należy otworzyć szufladkę na odpady. Wyjąć zbiornik na odpady stałe i zutylizować w odpowiedni sposób. Włożyć na powrót zbiornik na odpady stałe, zamknąć szufladkę na odpady i kliknąć Tak w oknie Opróżnij szufladkę na odpady. 3. Aby wymienić wyzwalacze, należy kliknąć przycisk Wykaz materiałów masowych F9 (na górze po prawej stronie). a. Na ekranie Materiały masowe wykaz kliknąć przycisk Wyzwalacze po lewej stronie. Pokaże się nowe okno zatytułowane Dodaj wyzwalacze Wyjmij stare butelki. b. Otworzyć i wyjąć szufladkę na odpady urządzenia BIO-FLASH. Zutylizować wszelkie kuwetki znajdujące się w szufladce na odpady. Kliknąć opcję Tak w oknie Opróżnij szufladkę na odpady. Wyjąć butelki z wyzwalaczami z uchwytów i kliknąć przycisk Dalej. Odkręcić stare butelki z wyzwalaczami i zastąpić je nowymi wyzwalaczami. Czynności należy wykonywać po kolei i odpowiednio dopasować oznaczone kolorem zakrętki (biały do białego, czerwony do czerwonego). c. Należy stosować się do instrukcji podanych w nowym oknie Dodaj wyzwalacze Dodaj butelkę z 2 wyzwalaczem. Po zaakceptowaniu kodu kreskowego, należy umieścić wyzwalacz 2 w uchwycie oznaczonym kolorem białym. Kliknąć przycisk Dalej. d. Należy stosować się do instrukcji podanych w oknie Dodaj wyzwalacze Dodaj butelkę z 1 wyzwalaczem. Po zaakceptowaniu kodu kreskowego należy umieścić wyzwalacz 1 w uchwycie oznaczonym kolorem czerwonym. Kliknąć Koniec. Włożyć z powrotem szufladkę na odpady i zamknąć ją. 4. Aby wymienić zbiornik układu płuczącego, należy kliknąć przycisk Wykaz materiałów masowych F9 (na górze po prawej stronie). Na ekranie Materiały masowe wykaz kliknąć przycisk układ płuczący. układ płuczący. W nowym oknie Dodaj układ płuczący Wyjmij butelki kliknąć Dalej. Należy stosować się do instrukcji podanych w owym oknie Dodaj układ płuczący Dodaj butelkę. Po zaakceptowaniu kodu kreskowego kliknąć Koniec, jeśli będzie to konieczne. 5. W celu opróżnienia pojemnika na odpady płynne, na ekranie Materiały masowe wykaz należy kliknąć przycisk Odpady płynne. Usunąć i zutylizować odpady płynne. Kliknąć przycisk Dalej. Po zaakceptowaniu kodu kreskowego należy kliknąć Koniec. 3
4 Sposób przygotowania Przygotowanie wkładu z odczynnikiem Za pierwszym razem, gdy ma być użyty wkład z odczynnikiem, należy wykonać poniższe czynności, aby prawidłowo zainstalować wkład w urządzeniu BIO-FLASH.Uwaga: Nie używać wkładu z odczynnikiem w przypadku zauważenia jakichkolwiek oznak uszkodzenia. Wkład QUANTA Flash β2gp1 IgM: Mikrocząstki osiadają podczas dostawy i przechowywania i wymagają wymieszania. 1. Za pierwszym razem, gdy używany jest wkład, należy delikatnie obrócić wkład 30 razy, unikając powstania piany. Sprawdzić, czy mikrocząstki utworzyły zawiesinę. Jeśli mikrocząstki nie utworzyły zawiesiny, należy kontynuować odwracanie wkładu, aż powstanie pełna zawiesina mikrocząstek. Jeśli nie uda się odtworzyć zawiesiny mikrocząstek, NIE WOLNO UŻYWAĆ WKŁADU. 2. Po utworzeniu zawiesiny mikrocząstek, umieścić wkład z odczynnikiem na stabilnej powierzchni, aby usunąć czerwony pasek zabezpieczający. Przytrzymać wkład z odczynnikiem w jednej dłoni. Drugą ręką zdecydowanym ruchem chwycić czerwony pasek zabezpieczający z tyłu wkładu z odczynnikiem i wyciągnąć go do końca. 3. Nacisnąć dwa paski po bokach przebijającej zatyczki (część szara) i nacisnąć w dół górną część wkładu z odczynnikiem, aż zatrzaśnie się we właściwej pozycji zablokowania. Paski nie powinny być widoczne. NIE WOLNO ODWRACAĆ OTWARTEGO WKŁADU.. 4. Umieścić ostrożnie wkład z odczynnikiem w dowolnym wolnym gnieździe karuzeli na odczynniki urządzenia BIO-FLASH. Po umieszczeniu wkładu w karuzeli na odczynniki w urządzeniu odbywa się dodatkowe okresowe mieszanie mikrocząsteczek. Kalibracja badania 1. Każda nowa seria wkładu z odczynnikiem musi musi byś skalibrowana przed pierwszym użyciem. Oprogramowanie nie zezwoli na wykorzystanie nowej serii, aż nie zostanie ona skalibrowana. Pełne instrukcje procedury można znaleźć w podręczniku użytkownika BIO-FLASH. 2. Kalibratory QUANTA Flash ß2GP1 IgM muszą być wymieszane przez delikatne wielokrotne odwracanie w celu zapewnienia homogeniczności kalibratora. Należy unikać powstawania piany. 3. Po zatwierdzeniu kalibracji skalibrowana seria wkładu z odczynnikiem jest gotowa do użycia. 4
5 Programowanie i badanie próbek 1. Nacisnąć przycisk Lista działań na górze ekranu i wybrać przycisk Statywy na dole. 2. Wybrać statyw z próbkami do badania, zaznaczając nazwę tego statywu na ekranie lub skanując kod kreskowy za pomocą ręcznego skanera kodów kreskowych. Zeskanować lub wpisać nazwę próbki, wybrać typ próbki, typ pojemnika (probówka/kubeczek) i wybrać IgM_β2GP1 z panelu testu. Powtórzyć te kroki dla wszystkich próbek. 3. Umieścić próbki w wybranych pozycjach na stojaku na próbki i umieścić stojak w karuzeli na próbki urządzenia. 4. Gdy wszystkie wymagane substancje znajdą się w urządzeniu, na górze ekranu pojawi się zielona ikona start. Aby rozpocząć badanie, należy nacisnąć ikonę start. Kontrola jakości Kontrole testu QUANTA Flash β2gp1 IgM (sprzedawane oddzielnie INOVA, nr produktu ) obejmują kontrole wysokiego i niskiego poziomu β2gp1 IgM. W broszurze z instrukcjami na temat QUANTA Flash β2gp1 IgM Controls znajdują się szczegółowe instrukcje dotyczące sposobu wprowadzania w oprogramowaniu wartości jednostek oraz standardowego odchylenia każdej kontroli, oraz informacje na temat procedury przeprowadzenia kontroli. Każde laboratorium powinno opracować własne średnie i standardowe odchylenie oraz powinno ustalić program kontroli jakości do monitorowania badań laboratoryjnych. Zaleca się przeprowadzanie kontroli raz na 8-godzinną zmianę, gdy używane jest badanie. W dokumencie Westgard et al można znaleźć informacje na temat identyfikacji i rozwiązywania problemów związanych z sytuacjami poza kontrolą 12. Identyfikowalność Zgłoszone wartości zostały ustalone na podstawie wielu serii badań z systemem BIO-FLASH, przy użyciu określonych serii odczynników oraz zgodnie z wewnętrznymi standardami. Zgodnie z zaleceniami Międzynarodowego komitetu diagnostyki APS, na zjeździe, który odbył się w Sydney 2, jednostki wewnętrznego standardu dla przeciwciał IgM przeciwko β2gp1 zostały zestawione z referencyjnym monoklonalne przeciwciałem EY2C9 13. Matryca próbek Dwadzieścia osiem próbek z cytrynianem/osoczem/surowicą zostało przeanalizowanych za pomocą badania β2gp1 IgG. Wartości stężenia zostały porównane przy pomocy regresji Passing i Bablok, przy użyciu wartości próbek osocza jako wartości referencyjnych (oś X) oraz współczynnika korelacji obliczonego za pomocą korelacji Pearsona. Nachylenie i przecięcie wyniosły odpowiednio 0,99 i 0,02, a korelacja (r) 0,996. Obliczanie wyników Dla każdej nowej serii testu QUANTA Flash β2gp1 IgM tworzona jest nowa 5-punktowa krzywa wzorcowa. Ta czteroparametryczna krzywa logarytmiczna zakodowana jest w kodzie paskowym każdego wkładu z odczynnikiem. Po skalibrowaniu wkładu z odczynnikiem do przekształcenia jednostek RLU na jednostki chemiluminescencji CU zostanie wykorzystana krzywa robocza właściwa dla urządzenia. Interpretacja wyników Test QUANTA Flash Assay może wykryć małe różnice w populacjach pacjentów. Każde laboratorium powinno ustalić własny normalny zakres na podstawie własnych kontroli i populacji pacjentów, zgodnie z indywidualnymi ustalonymi procedurami. Zalecane jest, aby wyniki raportowane przez laboratorium zawierały oświadczenie: Poniższe wyniki uzyskano przy zastosowaniu immunologicznego testu chemiluminescencji INOVA QUANTA Flash β2gp1 IgM. Nie można stosować zamiennie wartości uzyskanych przy zastosowaniu metod testowych innych producentów. Rzędu wielkości poziomów raportowanego autoprzeciwciała IgM nie można zawsze skorelować z mianem punktu końcowego. Uwaga: Urządzenie BIO-FLASH automatycznie uwzględnia różnice w roztworze pomiędzy próbkami osocza i surowicy. Zaraportowane wartości próbek surowicy nie muszą być poprawiane o współczynnik. Więcej informacji można znaleźć w podręczniku użytkownika BIO-FLASH. 5
6 Ograniczenia badania Ostatecznej diagnozy klinicznej nie można przygotować na podstawie pozytywnego wyniku β2gp1 IgM. Należy również uwzględnić wyniki kliniczne oraz historię pacjenta. Jeśli w przypadku obecności wskazań klinicznych zostanie stwierdzony wynik negatywny β2gp1 IgM, muszą zostać przeprowadzone inne badania apl, zgodnie z zaleceniami wg uaktualnionych kryteriów klasyfikacji Międzynarodowego komitetu w ramach diagnozy APS, na spotkaniu, które odbyło się w 2006 r 2. Wyniki ß2GP1 IgM w BIO-FLASH nie są modyfikowane przez hemoglobinę do 500 mg/dl, bilirubinę do 18 mg/dl, trójglicerydy do 1250 mg/dl, heparynę (LMW i niefrakcjonowaną) do 2 IU/ml oraz czynnik reumatoidalny (RF) do 500 IU/ml. W badaniach reaktywności krzyżowej 10 pozytywnych próbek każdego z następujących przypadków zostało przeprowadzonych przy użyciu badania QUANTA Flash ß2GP1 IgM: czynnik reumatoidalny, przeciwciała przeciwjądrowe (ANA) oraz kiła (wyniki pozytywne w przypadku szybkiego testu reaginowego w osoczu, RPR). To badanie nie zostało zatwierdzone do stosowania w przypadku populacji dziecięcej. Grupa pacjentów N n (pozytywne) % pozytywnych IgM przeciwko ß2GP1 RF ,0% ANA ,0% RPR ,0% Spodziewane wartości Badanie normalnego zakresu zostało przeprowadzone przy użyciu próbek dawców osocza z cytrynianem z banku krwi, od zdrowych dorosłych osób, które zostały wykonane przy użyciu odczynników QUANTA Flash ß2GP1 IgG oraz kalibratorów. Na podstawie zaleceń Międzynarodowego komitetu w Sydney 2, próg pozytywnych przeciwciał ß2GP1 IgM został ustanowiony na poziomie 99. percentyla. Układ N Normalny zakres górnego limitu (CU) BIO-FLASH ,0 W związku z występowaniem wielu zmiennych, które mogą wpływać na wyniki, każde laboratorium powinno ustanowić własny normalny zakres. Porównanie metody z zastosowaniem urządzenia predykatu Próbki używane w badaniach klinicznych, które mieściły się w porównywanym zakresie testowym metod, były mierzone w ramach badania Porównanie metody za pomocą dostępnego w handlu badania ELISA zatwierdzonego przez FDA. Procent pozytywnych, negatywnych i ogólna zgodność: Porównanie metody (N = 205) Badanie ELISA Procentowa zgodność (95% ufności) QUANTA Flash ß2GP1 IgM CIA Pozytywne Negatywne Łącznie Pozytywne Negatywne Łącznie Procentowa zgodność wyników pozytywnych = 63,3% (48,5%-77,3%) Procentowa zgodność wyników negatywnych = 96,8% (92,8%-99,0%) Procentowa zgodność wyników łącznie = 89,3% (84,2%-93,2%) Precyzja, korelacja i wyniki badania klinicznego zostały osiągnięte za pomocą swoistych serii odczynników i kontroli. 6
7 Swoistość i wrażliwość kliniczna Badanie wynikowe zostało przeprowadzone na 321 zamrożonych osoczach z cytrynianem. Te osocza pochodziły z 6 różnych grup, w tym również od wybranych osób zdiagnozowanych jako pierwotne APS (PAPS), wtórne APS (SAPS), toczeń rumieniowaty układowy (SLE), ale nie od APS ani SLE wg standardowych obiektywnych testów. Piątą grupą byli pacjenci ze schorzeniami sercowonaczyniowymiale nie zostali sklasyfikowani w poprzednich czterech grupach. Została również uwzględniona grupa zdrowych osób. Poniżej zsumowane wyniki opierają się na wartości granicznej 20 CU: Grupa pacjentów N n (pozytywne) % Pozytywne PAPS ,4% SAPS ,0% SLE ,7% Typu SLE 5 0 0,0% Inne ,7% Normalne ,0% Uwzględniając pozytywne wyniki w grupach pacjentów PAPS i SAPS jako rzeczywiście pozytywne czułość kliniczna, swoistość i ogólna zgodność procentowa wynosiły: Układ N Czułość (95% CI) Swoistość (95% CI) % Zgodność (95% CI) BIO-FLASH ,3% (20,3%-39,8%) 95,2% (91,6%-97,6%) 76,3% (71,3%-80,9%) Precyzja i powtarzalność Wszystkie przedstawione dane zostały uzyskane przy użyciu próbek osocza z cytrynianem. W ramach serii i łącznie (od serii do serii i od dnia do dnia) precyzja została ustalona w ramach wielu serii. BIO-FLASH Średnia (CU) CV% (w ramach serii) CV% (razem) Niska kontrola ß2GP1 IgM 4,32 3,4% 6,4% Wysoka kontrola ß2GP1 IgM 63,0 2,4% 4,3% Próbka osocza A β2gp1 IgM 11,0 3,6% 5,8% Próbka osocza B β2gp1 IgM 13,6 4,5% 8,3% Próbka osocza C β2gp1 IgM 16,3 2,7% 6,6% Próbka osocza D β2gp1 IgM 91,9 2,4% 5,7% Próbka osocza E β2gp1 IgM 302 3,0% 5,2% Próbka osocza F β2gp1 IgM 510 4,1% 6,0% Granice wykrywania, zakresy liniowe i raportowane Dolny limit wykrywania: Układ BIO-FLASH 1,1 CU Liniowość: Układ BIO-FLASH 1,1-841 CU Gdy zostanie uruchomiona funkcja ponownego przebiegu, urządzenie wykonuje automatyczne rozcieńczenie i koryguje końcowy rezultat przy współczynniku rozcieńczenia (20x), w ten sposób rozszerzając zakres testu do CU. Efekt prozone nie ma wpływu na badanie. Protokół badania obejmuje etap płukania po inkubacji próbki, który wyklucza efekt prozone. Próbki powyżej 841 CU przetestowane podczas badania klinicznego zainicjowały ponowny przebieg. 7
8 QUANTA Flash β2gp1 IgM Controls Do diagnostyki In Vitro Przeznaczenie Kontrole QUANTA Flash β2gp1 IgM są przeznaczone do celów kontroli jakości badań QUANTA Flash β2gp1 IgM przeprowadzanych przy użyciu urządzenia BIO-FLASH. Podsumowanie i zasada badania Przeciwciała przeciwko ß2 glikoproteinie-1 (ß2GP1) należą do heterogenicznej rodziny przeciwciał antyfosfolipidowych (apl), które są autoprzeciwciałami skierowanymi przeciwko fosfolipidom anionowym lub kompleksom białkowo-fosfolipidowym. Długotrwale podniesione poziomy przeciwciał apl wiążą się z poniesionym ryzykiem zakrzepicy naczyń oraz komplikacji położniczych. To powiązanie jest znane jako zespół antyfosfolipidowy (APS) wg klasyfikacji wprowadzonej przez Harrisa w 1987 r. 1. Badania mające na celu określenie przeciwciał IgM i IgG przeciwko ß2GP1, przeciwciał IgG i IgM przeciwko kardiolipinie (acl) oraz przeciwciał zwanych antykoagulantem tocznia są badaniami apl zdefiniowanymi w zaktualizowanej klasyfikacji przez Międzynarodowy komitet diagnostyki APS na zjeździe, który odbył się w 2006 r. w Sydney (Australia) 2,3. Niska i wysoka kontrola ß2GP1 IgM jest przygotowywana w ramach dedykowanego procesu i zawiera różne stężenia przeciwciał IgM przeciwko ludzkiej ß2glikoproteinie-1. Niska kontrola ß2GP1 IgM: Kontrola ma za zadanie posłużyć do oceny precyzji i dokładności testu przy normalnym poziomie przeciwciał IgM przeciwko ß2glikoproteinie-1 lub poziomie zbliżonym do poziomu granicznego. Wysoka kontrola ß2 GP1 IgM: Kontrola ma za zadanie ocenić precyzję i dokładność testu przy nieprawidłowych poziomach przeciwciał IgM przeciwko ß2GP1. W celu zapewnienia kompletnego programu kontroli jakości zalecane jest stosowanie obu kontroli. Odczynniki 1. iska kontrola przeciwciał IgM przeciwko ß2GP1 testu QUANTA Flash 3 x 1 ml, probówki z kodem kreskowym z roztworem z przeciwciałami IgM przeciwko ß2GP1 w buforze fosforanowym zawierającym albuminę surowicy bydlęcej, stabilizatory i konserwanty. 2. Wysoka kontrola przeciwciał IgM przeciwko ß2GP1 testu QUANTA Flash 3 x 1 ml, probówki z kodem kreskowym z roztworem z przeciwciałami IgM przeciwko ß2GP1 w buforze fosforanowym zawierającym albuminę surowicy bydlęcej, stabilizatory i konserwanty. Ostrzeżenia i środki ostrożności Materiał pochodzenia ludzkiego w tym produkcie został przetestowany zgodnie z metodami zatwierdzonymi przez FDA i stwierdzono brak reakcji dla antygenu powierzchniowego zapalenia wątroby typu B (HBsAg), przeciwciał przeciwko HCV oraz HIV1 i HIV2. Należy obchodzić się jak z potencjalnie zakaźnym materiałem 8. Unikać kontaktu ze skórą i oczami (S 24/25). Nie wylewać do kanalizacji (S 29). Nosić odpowiednią odzież ochronną (S 36). Ten produkt przeznaczony jest do zastosowań diagnostycznych in vitro. 8
9 Warunki przechowywania 1. Wszystkie nieotwarte kontrole przechowywać w temperaturze 2 8 C. Nie zamrażać. Odczynniki są stabilne do daty ważności, pod warunkiem, że są przechowywane i używane zgodnie z instrukcjami. 2. Te kontrole są przeznaczone do przeprowadzenia 15 kalibracji. Na etykiecie każdej probówki z kontrolą znajduje się szereg 15 pól, które można skreślać, aby śledzić ile razy kontrola została użyta. Całkowity czas przez jaki probówki z kontrolą mogą pozostawać otwarte w urządzeniu wynosi 2,5 godz. lub 10 minut na wykorzystanie. Jeśli kontrole pozostaną w urządzeniu otwarte dłużej niż 2,5 godz., wówczas należy je wyrzucić. Użytkowanie tej samej probówki z kontrolą ponad 15 razy i/lub przez czas dłuższy niż 2,5 godz. łącznie może doprowadzić do uzyskania błędnych wyników. 3. Aby zapewnić odpowiednią stabilność, należy usunąć kontrole z systemu natychmiast po zbadaniu próbki i należy przechowywać je w temperaturze 2-8 o C w zamkniętej oryginalnej fiolce. Badanie Tworzenie nowych materiałów QC do badania ß2GP1 IgM 1. Przed pierwszym użyciem kontroli QUANTA Flash badania ß2GP1 IgM w urządzeniu, do oprogramowania należy wprowadzić nazwę, serię, liczbę powieleń, datę przydatności do użycia, wartość (lub dawkę) oraz informację o docelowym odchyleniu standardowym. 2. Na ekranie Rejestr stanu urządzenia kliknąć przycisk strzałki Wybierz więcej opcji Ctrl-M ( ). Kliknąć przycisk Nowy materiał QC. 3. Do każdego zestawu kontroli dołączony jest arkusz z danymi dotyczącymi tej właśnie serii. W pierwszej kolejności należy wprowadzić do oprogramowania nazwę, numer serii i datę ważności. Następnie kliknąć przycisk Dodaj badanie. W nowym oknie należy zaznaczyć opcję Pokaż wszystkie badania. Wybrać badanie ß2GP1 IgM z listy i kliknąć opcję Dodaj. Na końcu należy wprowadzić docelową dawkę i docelowe odchylenie SD. Kliknąć opcję Zapisz. Procedurę tę należy przeprowadzić dla obu kontroli. Tworzenie nowej serii dla istniejących materiałów QC 1. Przed pierwszym użyciem nowej serii kontroli QUANTA Flash ß2GP1 IgM do oprogramowania należy wprowadzić imię, nazwisko, serię, datę przydatności do użycia, wartość (lub dawkę) oraz informację o docelowym odchyleniu standardowym. 2. Na ekranie Rejestr stanu urządzenia kliknąć przycisk strzałki Wybierz więcej opcji Ctrl-M ( ). Wybrać opcję QC Ctrl-F2. Zaznaczyć test IgM_ß2GP1 w kolumnie po lewej stronie. Następnie zaznaczyć odpowiedni materiał kontroli po prawej stronie ( ß2GP1ML, który odpowiada niskiej kontroli lub ß2GP1MH, który odpowiada wysokiej kontroli). Kliknąć przycisk Nowa seria QC. 3. Do każdego zestawu kontroli dołączony jest arkusz z danymi dotyczącymi tej właśnie serii. Wprowadzić informacje z tego arkusza do oprogramowania. Powinno to obejmować nazwę, numer serii, datę przydatności do użycia, docelową stężenie oraz docelowe odchylenie standardowe. W razie potrzeby kliknąć przycisk Dodaj badanie. W nowym oknie należy zaznaczyć opcję Pokaż wszystkie badania. Wybrać badanie ß2GP1 IgM z listy i kliknąć opcję Dodaj. Kliknąć opcję Zapisz. Procedurę tę należy przeprowadzić dla obu kontroli. 4. Zalecane jest, aby kontrole QUANTA Flash ß2GP1 IgM wykorzystywać jeden raz na każdą 8-godzinną zmianę, kiedy ma zostać użyty test. 5. Aby upewnić się, że kontrole są homogeniczne, należy każdą z nich wymieszać. Należy unikać powstawania piany, jako że pęcherzyki mogą zaburzać wykrywanie poziomu płynu przez urządzenie. Zdjąć zatyczkę z każdej probówki zawierającej kontrolę i umieścić obie z nich w stojaku na próbki, przy czym kody kreskowe muszą skierowane być przodem do szczelin w stojaku. Umieścić stojak na próbki w karuzeli na próbki urządzenia BIO-FLASH i zamknąć drzwi. Urządzenie odczyta kody kreskowe na probówkach zawierających kontrole i zidentyfikuje potrzebny wkład z odczynnikiem. Szczegółowe instrukcje dotyczące pracy z analizatorem chemiluminescencyjnym i oprogramowaniem BIO-FLASH można znaleźć w podręczniku użytkownika dołączonym do systemu BIO-FLASH. 9
10 Identyfikowalność Zgłoszone wartości zostały ustalone na podstawie wielu serii badań z systemem BIO-FLASH, przy użyciu określonych serii odczynników oraz zgodnie z wewnętrznymi standardami. Wyniki przeciwciał IgM przeciwko ß2GP1 są raportowane w jednostkach chemiluminescencji (CU). Te jednostki zostały określone przez przypisanie 20 CU do reakcji górnego limitu zakresu prawidłowości (ULNR) dla 250 osoczy z dodatkiem cytrynianu z banku krwi (99. percentyl). Zgodnie z zaleceniami Międzynarodowego komitetu diagnostyki APS, na zjeździe, który odbył się w Sydney 2, jednostki wewnętrznego standardu dla przeciwciał IgM przeciwko ß2GP1 zostały zestawione z referencyjnym monoklonalnym przeciwciałem EY2C9 13. Ograniczenia Te produkty są opracowywane jako kontrole do monitorowania działania badania QUANTA Flash przeciwciał IgM przeciwko ß2GP1. Te kontrole podlegają ograniczeniom systemu badań. Odchylenia mogą wskazywać na możliwe problemy z jednym lub kilkoma elementami w systemie testowym. 10
11 Piśmiennictwo 1. Harris EN: Syndrome in the black swan. Br.J. Rheumatol 1987, 26: Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, Derksen RH, de Groot PG, Koike T, Meroni PL, Reber G, Shoenfeld Y, Tincani A, Vlachoyiannopoulos PG, Krilis SA : International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost 2006, 4: Swadźba J, Iwaniec T, Szczeklik A, Musiał J: Revised classification criteria for antiphospholipid syndrome and the thrombotic risk in patients with autoimmune diseases. J Thromb Haemost 2007, 5: Lutters BC, Meijers JC, Derksen RH, Arnout J, de Groot PG: Dimers of beta 2-glycoprotein I mimic the in vitro effects of beta 2-glycoprotein-anti-beta 2-glycoprotein antibody complexes. J Biol Chem 2001, 276: Kuwana M, Matsuura E, Kobayashi K, Okazaki Y, Kaburaki J, Ikeda Y, Kawakami Y: Binding of ß2- glycoprotein-i to anionic phospholipids facilitates processing and presentation of a cryptic epitope that activates pathogenic autoreactive T-cells. Blood 2005, 105: Wang SX, Sun YT, Sui SF: Membrane-induced conformational change in human apolipoprotein H. Biochem J 2000, 348: de Laat B, Derksen RHWM, van Lummel M, Pennings MTT, de Groot PG: Pathogenic anti-ß2- glycoprotein-i antibodies recognize domain I of ß2-glycoprotein-I only after a conformational change. Blood 2006, 107: Richmond JY, McKinney RW eds.: Biosafety in Microbiological and Biomedical Laboratories. U.S. Dept. of Health and Human Services, Public Health Service, 4th Edition; CLSI: Collection, Transport and Processing of Blood Specimens for Testing Plasma-Based Coagulation and Molecular Hemostasis Assays; Approved Guideline-Fifth Edition. CLSI Document H21-A5. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, PA 19087, USA, CLSI: Procedures for the Handling and Processing of Blood Specimens; Approved Guideline- Third Edition. CLSI Document H18-A4. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, PA 19087, USA, Zucker S, Cathey MH, West B: Preparation of Quality Control Specimens for Coagulation. Am J Clin Pathol 1970, 53: Westgard JO, Barry PL: Cost-Effective Quality Control: Managing the Quality and Productivity of Analytical Process. AACC Press; Ichicawa K, Khamashta MA, Koike T, Matsuura E, Hughes GR: ß2 Glycoprotein-I reactivity of monoclonal anticardiolipin antibodies from patients with the antiphospholipid syndrome. Arthritis and Rheumatism 1994, 37:
12 Zastosowane symbole Diagnostyczne urządzenia medyczne In vitro Przed użyciem należy zapoznać się z instrukcją Ograniczenia temperaturowe Nie wykorzystywać ponownie Zagrożenia biologiczne Kod serii Numer katalogowy Użyć do Producent Autoryzowany przedstawiciel Zawiera ilość wystarczającą do przeprowadzenia < n > testów Kontrola Kalibrator 1 Kalibrator 2 Papierowe pudełko nadaje się recyklingu Tą stroną do góry QUANTA Flash jest znakiem handlowym firmy INOVA Diagnostics Inc. BIO-FLASH jest zastrzeżonym znakiem handlowym firmy Biokit S.A
13 Dystrybutor: INOVA Diagnostics, Inc Old Grove Road San Diego, CA Stany Zjednoczone Ameryki Pomoc techniczna (tylko na terenie Stanów Zjednoczonych i Kanady) : Pomoc techniczna (poza terenem Stanów Zjednoczonych) : support@inovadx.com Autoryzowani przedstawiciele na terenie Unii Europejskiej: Medical Technology Promedt Consulting GmbH Altenhofstrasse 80 D St. Ingbert, Niemcy Tel.: Faks.: POL Luty 2014 Wersja 2 13
QUANTA Flash acl IgG 701233 Reagents Do diagnostyki In Vitro
 QUANTA Flash acl IgG 701233 Reagents Do diagnostyki In Vitro Przeznaczenie W pełni zautomatyzowany test immunologiczny do półilościowego pomiaru przeciwciał IgG przeciwko anty-kardiolipina (acl) w osoczu
QUANTA Flash acl IgG 701233 Reagents Do diagnostyki In Vitro Przeznaczenie W pełni zautomatyzowany test immunologiczny do półilościowego pomiaru przeciwciał IgG przeciwko anty-kardiolipina (acl) w osoczu
QUANTA Flash Jo Do diagnostyki In Vitro TYLKO NA EKSPORT. NIE JEST PRZEZNACZONY DO SPRZEDAŻY W STANACH ZJEDNOCZONYCH.
 QUANTA Flash Jo-1 701163 Do diagnostyki In Vitro TYLKO NA EKSPORT. NIE JEST PRZEZNACZONY DO SPRZEDAŻY W STANACH ZJEDNOCZONYCH. Przeznaczenie QUANTA Flash Jo-1 to test chemiluminescencji (CIA) do półilościowego
QUANTA Flash Jo-1 701163 Do diagnostyki In Vitro TYLKO NA EKSPORT. NIE JEST PRZEZNACZONY DO SPRZEDAŻY W STANACH ZJEDNOCZONYCH. Przeznaczenie QUANTA Flash Jo-1 to test chemiluminescencji (CIA) do półilościowego
Do diagnostyki In Vitro PRZEZNACZONY TYLKO NA EKSPORT. NIE JEST PRZEZNACZONY DO SPRZEDAŻY W STANACH ZJEDNOCZONYCH.
 QUANTA Flash Odczynniki Scl-70 701158 Do diagnostyki In Vitro PRZEZNACZONY TYLKO NA EKSPORT. NIE JEST PRZEZNACZONY DO SPRZEDAŻY W STANACH ZJEDNOCZONYCH. Przeznaczenie QUANTA Flash Scl-70 to test chemiluminescencji
QUANTA Flash Odczynniki Scl-70 701158 Do diagnostyki In Vitro PRZEZNACZONY TYLKO NA EKSPORT. NIE JEST PRZEZNACZONY DO SPRZEDAŻY W STANACH ZJEDNOCZONYCH. Przeznaczenie QUANTA Flash Scl-70 to test chemiluminescencji
GBM QUANTA Flash Odczynniki Do diagnostyki In Vitro. Przeznaczenie. Podsumowanie i wyjaśnienie testu
 QUANTA Flash Odczynniki Do diagnostyki In Vitro Przeznaczenie GBM 701143 QUANTA Flash GBM to test chemiluminescencji (CIA) do półilościowego wykrywania autoprzeciwciał IgG przeciwko kłębuszkowej błonie
QUANTA Flash Odczynniki Do diagnostyki In Vitro Przeznaczenie GBM 701143 QUANTA Flash GBM to test chemiluminescencji (CIA) do półilościowego wykrywania autoprzeciwciał IgG przeciwko kłębuszkowej błonie
QUANTA Lite ACA Screen III Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite ACA Screen III 708620 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM ACA Screen III jest to immunoenzymatyczny test (ELISA) do półilościowego oznaczania przeciwciał
QUANTA Lite ACA Screen III 708620 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM ACA Screen III jest to immunoenzymatyczny test (ELISA) do półilościowego oznaczania przeciwciał
Test Immunoenzymatyczny DRG Kortyzol dostarcza materiałów do oznaczania kortyzolu w surowicy i osoczu.
 WSTĘP Test Immunoenzymatyczny DRG Kortyzol dostarcza materiałów do oznaczania kortyzolu w surowicy i osoczu. Test jest przeznaczony wyłącznie do stosowania ZASADA OZNACZENIA Ten test immunoenzymatyczny
WSTĘP Test Immunoenzymatyczny DRG Kortyzol dostarcza materiałów do oznaczania kortyzolu w surowicy i osoczu. Test jest przeznaczony wyłącznie do stosowania ZASADA OZNACZENIA Ten test immunoenzymatyczny
QUANTA Lite ACA IgA III Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite ACA IgA III 708635 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie Test QUANTA Lite TM ACA IgA III to test immunoenzymatyczny (ELISA) do półilościowego oznaczania przeciwciał IgA
QUANTA Lite ACA IgA III 708635 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie Test QUANTA Lite TM ACA IgA III to test immunoenzymatyczny (ELISA) do półilościowego oznaczania przeciwciał IgA
QUANTA Flash DGP Screen 701113 Do diagnostyki In Vitro
 QUANTA Flash DGP Screen 701113 Do diagnostyki In Vitro Przeznaczenie QUANTA Flash do badania przesiewowego DGP jest to test chemiluminescencji (CIA) do półilościowego wykrywania przeciwciał IgG i IgA przeciwko
QUANTA Flash DGP Screen 701113 Do diagnostyki In Vitro Przeznaczenie QUANTA Flash do badania przesiewowego DGP jest to test chemiluminescencji (CIA) do półilościowego wykrywania przeciwciał IgG i IgA przeciwko
QUANTA Lite ENA Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite ENA 5 708610 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM ENA 5 jest to immunoenzymatyczny test (ELISA) do półilościowego oznaczania przeciwciał przeciwko Sm,
QUANTA Lite ENA 5 708610 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM ENA 5 jest to immunoenzymatyczny test (ELISA) do półilościowego oznaczania przeciwciał przeciwko Sm,
(Akty o charakterze nieustawodawczym) DECYZJE
 19.7.2019 PL L 193/1 II (Akty o charakterze nieustawodawczym) DECYZJE DECYZJA WYKONAWCZA KOMISJI (UE) 2019/1244 z dnia 1 lipca 2019 r. zmieniająca decyzję 2002/364/WE w odniesieniu do wymogów dotyczących
19.7.2019 PL L 193/1 II (Akty o charakterze nieustawodawczym) DECYZJE DECYZJA WYKONAWCZA KOMISJI (UE) 2019/1244 z dnia 1 lipca 2019 r. zmieniająca decyzję 2002/364/WE w odniesieniu do wymogów dotyczących
QUANTA Flash h-ttg IgG Reagents Do diagnostyki In Vitro
 QUANTA Flash h-ttg IgG 701108 Reagents Do diagnostyki In Vitro Przeznaczenie QUANTA Flash h-ttg IgG jest to test chemiluminescencji (CIA) do półilościowego wykrywania przeciwciał IgG przeciwko ludzkiej
QUANTA Flash h-ttg IgG 701108 Reagents Do diagnostyki In Vitro Przeznaczenie QUANTA Flash h-ttg IgG jest to test chemiluminescencji (CIA) do półilościowego wykrywania przeciwciał IgG przeciwko ludzkiej
Samodzielny Publiczny Zespół... Zakładów Opieki Zdrowotnej w Kozienicach... ul. Al. Wł. Sikorskiego 10
 Załącznik nr 2 do SIWZ Wykonawca:... Samodzielny Publiczny Zespół... Zakładów Opieki Zdrowotnej w Kozienicach... ul. Al. Wł. Sikorskiego 10 tel.:/fax:... 26-900 Kozienice tel.:/fax: (48) 382 88 00/ (48)
Załącznik nr 2 do SIWZ Wykonawca:... Samodzielny Publiczny Zespół... Zakładów Opieki Zdrowotnej w Kozienicach... ul. Al. Wł. Sikorskiego 10 tel.:/fax:... 26-900 Kozienice tel.:/fax: (48) 382 88 00/ (48)
Parametry graniczne dla analizatora immunochemicznego. Tak. Tak. Tak. Tak. Tak. Tak
 Załącznik nr 5 Parametry graniczne dla analizatora immunochemicznego. L.p. Parametry graniczne analizatora immunochemicznego Warunek graniczny Parametr oferowany Wydzierżawienie na okres 3 lat 1 analizatora
Załącznik nr 5 Parametry graniczne dla analizatora immunochemicznego. L.p. Parametry graniczne analizatora immunochemicznego Warunek graniczny Parametr oferowany Wydzierżawienie na okres 3 lat 1 analizatora
QUANTA Flash RNP 701118 Do diagnostyki in vitro PRZEZNACZONY TYLKO NA EKSPORT. NIE JEST PRZEZNACZONY DO SPRZEDAŻY W STANACH ZJEDNOCZONYCH.
 QUANTA Flash RNP 701118 Do diagnostyki in vitro PRZEZNACZONY TYLKO NA EKSPORT. NIE JEST PRZEZNACZONY DO SPRZEDAŻY W STANACH ZJEDNOCZONYCH. Przeznaczenie QUANTA Flash RNP to test chemiluminescencji (CIA)
QUANTA Flash RNP 701118 Do diagnostyki in vitro PRZEZNACZONY TYLKO NA EKSPORT. NIE JEST PRZEZNACZONY DO SPRZEDAŻY W STANACH ZJEDNOCZONYCH. Przeznaczenie QUANTA Flash RNP to test chemiluminescencji (CIA)
ROTA-ADENO Virus Combo Test Device
 Kod produktu: 8.04.73.0.0020 ROTA-ADENO Virus Combo Test Device Tylko do diagnostyki in vitro Przechowywać w 2-30 C ZASTOSOWANIE Wykrywanie antygenów Rotawirusów i Adenowirusów w próbkach kału. WSTĘP Rotawirusy
Kod produktu: 8.04.73.0.0020 ROTA-ADENO Virus Combo Test Device Tylko do diagnostyki in vitro Przechowywać w 2-30 C ZASTOSOWANIE Wykrywanie antygenów Rotawirusów i Adenowirusów w próbkach kału. WSTĘP Rotawirusy
KOAGULOLOGIA. Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice.
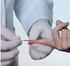 KOAGULOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
KOAGULOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
Ważna informacja dotycząca bezpieczeństwa stosowania
 ADVIA Centaur ADVIA Centaur XP ADVIA Centaur CP Ważna informacja dotycząca bezpieczeństwa stosowania 10819674, Zmiana A Wrzesień 2014 r. Informacja dotycząca Kalibratora E przeznaczonego do użytku z Systemami
ADVIA Centaur ADVIA Centaur XP ADVIA Centaur CP Ważna informacja dotycząca bezpieczeństwa stosowania 10819674, Zmiana A Wrzesień 2014 r. Informacja dotycząca Kalibratora E przeznaczonego do użytku z Systemami
QUANTA Lite RNP ELISA Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite RNP ELISA 708565 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie Test QUANTA Lite TM RNP ELISA to test immunoenzymatyczny (ELISA) do półilościowego wykrywania przeciwciał przeciwko
QUANTA Lite RNP ELISA 708565 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie Test QUANTA Lite TM RNP ELISA to test immunoenzymatyczny (ELISA) do półilościowego wykrywania przeciwciał przeciwko
ACCESS Immunoassay System. HIV combo QC4 & QC5. Do monitorowania wydajności testu Access HIV combo. B71116A - [PL] - 2015/01
![ACCESS Immunoassay System. HIV combo QC4 & QC5. Do monitorowania wydajności testu Access HIV combo. B71116A - [PL] - 2015/01 ACCESS Immunoassay System. HIV combo QC4 & QC5. Do monitorowania wydajności testu Access HIV combo. B71116A - [PL] - 2015/01](/thumbs/25/4516998.jpg) ACCESS Immunoassay System HIV combo QC4 & QC5 B22822 Do monitorowania wydajności testu Access HIV combo. - [PL] - 2015/01 Spis treści Access HIV combo QC4 & QC5 1 Przeznaczenie... 3 2 Podsumowanie i objaśnienie
ACCESS Immunoassay System HIV combo QC4 & QC5 B22822 Do monitorowania wydajności testu Access HIV combo. - [PL] - 2015/01 Spis treści Access HIV combo QC4 & QC5 1 Przeznaczenie... 3 2 Podsumowanie i objaśnienie
AE/ZP-27-03/16 Załącznik Nr 6
 AE/ZP--0/ Załącznik Nr Wymagania dla przedmiotu zamówienia oferowanego w Pakietach Nr - Lp Parametry wymagane Wymagania dla przedmiotu zamówienia oferowanego w Pakiecie Nr poz..... Surowica antyglobulinowa
AE/ZP--0/ Załącznik Nr Wymagania dla przedmiotu zamówienia oferowanego w Pakietach Nr - Lp Parametry wymagane Wymagania dla przedmiotu zamówienia oferowanego w Pakiecie Nr poz..... Surowica antyglobulinowa
Akademia wiedzy Synevo
 Akademia wiedzy Synevo 1 Ciąża w chorobach układowych tkanki łącznej dr n. med. Magdalena Szmyrka mgr Lucyna Korman Wrocław, 7 czerwca 2018 r. Autoprzeciwciała istotne w ciąży mgr Lucyna Korman Katedra
Akademia wiedzy Synevo 1 Ciąża w chorobach układowych tkanki łącznej dr n. med. Magdalena Szmyrka mgr Lucyna Korman Wrocław, 7 czerwca 2018 r. Autoprzeciwciała istotne w ciąży mgr Lucyna Korman Katedra
Czynnik V Leiden ( odporność na aktywne białko C ) 200
 AG.ZP 3320.64.17 OPIS PRZEDMIOTU ZAMÓWIENIA Odczynniki do badań koagulologicznych na Pracownię Koagulologii wraz z dzierżawą dwu analizatorów koagulologicznych : Lp. Odczynnik Ilość oznaczeń ( badane,
AG.ZP 3320.64.17 OPIS PRZEDMIOTU ZAMÓWIENIA Odczynniki do badań koagulologicznych na Pracownię Koagulologii wraz z dzierżawą dwu analizatorów koagulologicznych : Lp. Odczynnik Ilość oznaczeń ( badane,
QUANTA Lite RNA Pol III 704555 Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite RNA Pol III 704555 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM RNA Pol III ELISA to test immunoenzymatyczny (ELISA) do półilościowej detekcji przeciwciał IgG
QUANTA Lite RNA Pol III 704555 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM RNA Pol III ELISA to test immunoenzymatyczny (ELISA) do półilościowej detekcji przeciwciał IgG
SPEŁNIENIE DRUGIEGO KRYTERIUM OCENY OFERT
 PN/9OL/09/0 Załącznik nr 8 SPEŁNIENIE DRUGIEGO KRYTERIUM OCENY OFERT PRZEDMIOT ZAMÓWIENIA: dostawy odczynników. Kryterium jakości odczynników (pakiety nr: -, 0-, 7) Nr Nazwa Parametry oceniane Wartość
PN/9OL/09/0 Załącznik nr 8 SPEŁNIENIE DRUGIEGO KRYTERIUM OCENY OFERT PRZEDMIOT ZAMÓWIENIA: dostawy odczynników. Kryterium jakości odczynników (pakiety nr: -, 0-, 7) Nr Nazwa Parametry oceniane Wartość
Cena jedn. netto. A B C D E F G H 1. Paski do moczu 10-cio parametrowe z użyciem aparatu LABUREADER. Szt. 400 oznaczeń
 Sprawa nr 12/D/2010 PAKIET 1 Paski do badań moczu z użyciem aparatu LABUREADER podatku Wartość netto za ilość określoną w 1. Paski do moczu 10-cio parametrowe z użyciem aparatu LABUREADER Szt. 8 000 2.
Sprawa nr 12/D/2010 PAKIET 1 Paski do badań moczu z użyciem aparatu LABUREADER podatku Wartość netto za ilość określoną w 1. Paski do moczu 10-cio parametrowe z użyciem aparatu LABUREADER Szt. 8 000 2.
Opis przedmiotu zamówienia
 Załącznik Nr 1 do SIWZ na Dostawę odczynników do badań immunochemicznych wraz z dzierżawą 2 analizatorów na 24 miesiące na potrzeby Pro-Medica w Ełku Sp. z o.o. Opis przedmiotu zamówienia Parametry graniczne
Załącznik Nr 1 do SIWZ na Dostawę odczynników do badań immunochemicznych wraz z dzierżawą 2 analizatorów na 24 miesiące na potrzeby Pro-Medica w Ełku Sp. z o.o. Opis przedmiotu zamówienia Parametry graniczne
QUANTA Lite Scl-70 ELISA Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite Scl-70 ELISA 708580 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie Test ELISA QUANTA Lite TM Scl-70 to test immunoenzymatyczny (ELISA) do półilościowego wykrywania przeciwciał
QUANTA Lite Scl-70 ELISA 708580 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie Test ELISA QUANTA Lite TM Scl-70 to test immunoenzymatyczny (ELISA) do półilościowego wykrywania przeciwciał
QUANTA Flash DGP IgA Reagents Do diagnostyki In Vitro
 QUANTA Flash DGP IgA 701168 Reagents Do diagnostyki In Vitro Przeznaczenie QUANTA Flash DGP IgA to test chemiluminescencji (CIA) do półilościowego wykrywania przeciwciał IgA przeciw deamidowanemu peptydowi
QUANTA Flash DGP IgA 701168 Reagents Do diagnostyki In Vitro Przeznaczenie QUANTA Flash DGP IgA to test chemiluminescencji (CIA) do półilościowego wykrywania przeciwciał IgA przeciw deamidowanemu peptydowi
Dokładność i precyzja wydajności systemu Accu-Chek Active. Wprowadzenie. Metoda
 Dokładność i precyzja wydajności systemu Accu-Chek Active I. DOKŁADNOŚĆ Ocena dokładności systemu została przeprowadzona w odniesieniu do normy ISO 15197. Wprowadzenie Celem badania było określenie dokładności
Dokładność i precyzja wydajności systemu Accu-Chek Active I. DOKŁADNOŚĆ Ocena dokładności systemu została przeprowadzona w odniesieniu do normy ISO 15197. Wprowadzenie Celem badania było określenie dokładności
Wymagania dotyczące analizatora
 1. 2. DOSTAWA ODCZYNNIKÓW DO POSIADANEGO SYSTEMU DO BADAŃ IMMUNOTRANSFUZJOLOGICZNYCH MIKROMETODĄ KOLUMNOWĄ I METODĄ MIKROPŁYTKOWĄ NA OKRES 2 LAT WRAZ Z DZIERŻAWĄ AUTOMATYCZNEGO ANALIZATORA BACK- UP Warunki
1. 2. DOSTAWA ODCZYNNIKÓW DO POSIADANEGO SYSTEMU DO BADAŃ IMMUNOTRANSFUZJOLOGICZNYCH MIKROMETODĄ KOLUMNOWĄ I METODĄ MIKROPŁYTKOWĄ NA OKRES 2 LAT WRAZ Z DZIERŻAWĄ AUTOMATYCZNEGO ANALIZATORA BACK- UP Warunki
Podręcznik użytkownika
 Podręcznik użytkownika Moduł kliencki Kodak Asset Management Software Stan i ustawienia zasobów... 1 Menu Stan zasobów... 2 Menu Ustawienia zasobów... 3 Obsługa alertów... 7 Komunikaty zarządzania zasobami...
Podręcznik użytkownika Moduł kliencki Kodak Asset Management Software Stan i ustawienia zasobów... 1 Menu Stan zasobów... 2 Menu Ustawienia zasobów... 3 Obsługa alertów... 7 Komunikaty zarządzania zasobami...
Walidacja metod wykrywania, identyfikacji i ilościowego oznaczania GMO. Magdalena Żurawska-Zajfert Laboratorium Kontroli GMO IHAR-PIB
 Walidacja metod wykrywania, identyfikacji i ilościowego oznaczania GMO Magdalena Żurawska-Zajfert Laboratorium Kontroli GMO IHAR-PIB Walidacja Walidacja jest potwierdzeniem przez zbadanie i przedstawienie
Walidacja metod wykrywania, identyfikacji i ilościowego oznaczania GMO Magdalena Żurawska-Zajfert Laboratorium Kontroli GMO IHAR-PIB Walidacja Walidacja jest potwierdzeniem przez zbadanie i przedstawienie
NOVA Gel TM Scl-70 S Do diagnostyki in vitro
 NOVA Gel TM Scl-70 S 708470 Do diagnostyki in vitro Przeznaczenie NOVA Gel TM Scl-70 jest systemem testów podwójnej dyfuzji do badań przesiewowych i półilościowego określania przeciwciał przeciwko Scl-70,
NOVA Gel TM Scl-70 S 708470 Do diagnostyki in vitro Przeznaczenie NOVA Gel TM Scl-70 jest systemem testów podwójnej dyfuzji do badań przesiewowych i półilościowego określania przeciwciał przeciwko Scl-70,
ZP/220/106/17 Parametry wymagane dla zadania nr 1 załącznik nr 4 do formularza oferty PO MODYFIKACJI
 Zadanie nr 1 odczynniki do badań serologicznych UWAGA: wszystkie metodyki badań opracowane przez producentów powinny być zgodne z obowiązującymi przepisami. Lp. Nazwa PARAMETRY WYMAGANE TAK / NIE Reagujący
Zadanie nr 1 odczynniki do badań serologicznych UWAGA: wszystkie metodyki badań opracowane przez producentów powinny być zgodne z obowiązującymi przepisami. Lp. Nazwa PARAMETRY WYMAGANE TAK / NIE Reagujący
SZCZEGÓŁOWY OPIS PRZEDMIOTU ZAMÓWIENIA Część I
 Część I 1. API 20 E zastosowanie: identyfikacja Salmonella, Yersinia; opakowanie zawiera 25 pasków 2. Suspension Medium (5ml) zastosowanie: identyfikacja Salmonella; produkt płynny; składowe do zestawu
Część I 1. API 20 E zastosowanie: identyfikacja Salmonella, Yersinia; opakowanie zawiera 25 pasków 2. Suspension Medium (5ml) zastosowanie: identyfikacja Salmonella; produkt płynny; składowe do zestawu
QUANTA Lite Jo-1 ELISA Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite Jo-1 ELISA 708585 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM Jo-1 jest to immunoenzymatyczny test (ELISA) do półilościowego wykrywania przeciwciał przeciwko
QUANTA Lite Jo-1 ELISA 708585 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM Jo-1 jest to immunoenzymatyczny test (ELISA) do półilościowego wykrywania przeciwciał przeciwko
NOVA Gel Sm/RNP S Do diagnostyki in vitro
 NOVA Gel Sm/RNP S 708410 Do diagnostyki in vitro Przeznaczenie Test NOVA Gel TM Sm/RNP jest systemem testu podwójnej dyfuzji do badań przesiewowych oraz półilościowego oznaczania autoprzeciwciał przeciwko
NOVA Gel Sm/RNP S 708410 Do diagnostyki in vitro Przeznaczenie Test NOVA Gel TM Sm/RNP jest systemem testu podwójnej dyfuzji do badań przesiewowych oraz półilościowego oznaczania autoprzeciwciał przeciwko
QUANTA Lite CCP3 IgG ELISA 704535 Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite CCP3 IgG ELISA 704535 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite CCP3 IgG ELISA jest to immunoenzymatyczny test do półilościowego oznaczania przeciwciał IgG przeciwko
QUANTA Lite CCP3 IgG ELISA 704535 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite CCP3 IgG ELISA jest to immunoenzymatyczny test do półilościowego oznaczania przeciwciał IgG przeciwko
Dotyczy: postępowania o zamówienie publiczne w trybie przetargu nieograniczonego na dostawę odczynników do koaguologii wraz z dzierżawą analizatorów.
 Toruń, dnia 21.07.2015 r. SSM.DZP.200.57.2015 Dotyczy: postępowania o zamówienie publiczne w trybie przetargu nieograniczonego na dostawę do koaguologii wraz z dzierżawą analizatorów. W związku ze skierowanymi
Toruń, dnia 21.07.2015 r. SSM.DZP.200.57.2015 Dotyczy: postępowania o zamówienie publiczne w trybie przetargu nieograniczonego na dostawę do koaguologii wraz z dzierżawą analizatorów. W związku ze skierowanymi
Ulotka dołączona do opakowania: informacja dla użytkownika. Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych
 Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
VES TEC VACU TEC VACU CODE. Producent: DIESSE Diagnostica Senese Via delle Rose 10 53035 Monteriggioni (Siena) - Włochy
 PL 1/5 VES TEC VACU TEC VACU CODE Producent: DIESSE Diagnostica Senese Via delle Rose 10 53035 Monteriggioni (Siena) - Włochy Paragraf Zmiany wprowadzone w aktualnej wersji 1 6 8 PL 2/5 1. ZASTOSOWANIE
PL 1/5 VES TEC VACU TEC VACU CODE Producent: DIESSE Diagnostica Senese Via delle Rose 10 53035 Monteriggioni (Siena) - Włochy Paragraf Zmiany wprowadzone w aktualnej wersji 1 6 8 PL 2/5 1. ZASTOSOWANIE
Instrukcja obsługi Wkładka bębenkowa mechatroniczna DIGIT CB+BX
 Instrukcja obsługi Wkładka bębenkowa mechatroniczna DIGIT CB+BX Spis treści: 1. Parametry. 1 2. Lista elementów.. 2 3. Schemat techniczny.. 2 4. Odblokowywanie. 3 5. Ustawienie pochwytu zewnętrznego..
Instrukcja obsługi Wkładka bębenkowa mechatroniczna DIGIT CB+BX Spis treści: 1. Parametry. 1 2. Lista elementów.. 2 3. Schemat techniczny.. 2 4. Odblokowywanie. 3 5. Ustawienie pochwytu zewnętrznego..
DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM. Procedura szacowania niepewności
 DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Szacowanie niepewności oznaczania / pomiaru zawartości... metodą... Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Szacowanie niepewności oznaczania / pomiaru zawartości... metodą... Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
Ważna informacja dotycząca bezpieczeństwa stosowania
 System do klinicznych analiz chemicznych Dimension Ważna informacja dotycząca bezpieczeństwa stosowania DC-16-03.B.OUS Maj / czerwiec 2016 r. Wysokie odchylenie wyników oznaczeń aminotransferazy alaninowej
System do klinicznych analiz chemicznych Dimension Ważna informacja dotycząca bezpieczeństwa stosowania DC-16-03.B.OUS Maj / czerwiec 2016 r. Wysokie odchylenie wyników oznaczeń aminotransferazy alaninowej
Karty zewnętrzne Instrukcja obsługi
 Karty zewnętrzne Instrukcja obsługi Copyright 2009 Hewlett-Packard Development Company, L.P. Java jest znakiem towarowym w USA firmy Sun Microsystems, Inc. SD Logo jest znakiem towarowym jego prawnego
Karty zewnętrzne Instrukcja obsługi Copyright 2009 Hewlett-Packard Development Company, L.P. Java jest znakiem towarowym w USA firmy Sun Microsystems, Inc. SD Logo jest znakiem towarowym jego prawnego
QUANTA Lite β 2 GPI IgA ELISA Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite β 2 GPI IgA ELISA 708675 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM β 2 GPI IgA jest to test immunoenzymatyczny (ELISA) do półilościowego wykrywania przeciwciał
QUANTA Lite β 2 GPI IgA ELISA 708675 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM β 2 GPI IgA jest to test immunoenzymatyczny (ELISA) do półilościowego wykrywania przeciwciał
INSTRUKCJA OBSŁUGI V-TERMU LYONESS.
 INSTRUKCJA OBSŁUGI V-TERMU LYONESS Uruchomienie programu V-Term Lyoness jest interfejsem bazującym na stronie internetowej, który można uruchomić bezpośrednio w przeglądarce internetowej, bez potrzeby
INSTRUKCJA OBSŁUGI V-TERMU LYONESS Uruchomienie programu V-Term Lyoness jest interfejsem bazującym na stronie internetowej, który można uruchomić bezpośrednio w przeglądarce internetowej, bez potrzeby
Test DRG DHEA-S ELISA jest testem immunoenzymatycznym do ilościowego diagnostycznego oznaczania DHEA-S w surowicy i osoczu w warunkach in vitro.
 WSTĘP 1.1 Przeznaczenie Test DRG DHEA-S ELISA jest testem immunoenzymatycznym do ilościowego diagnostycznego oznaczania DHEA-S w surowicy i osoczu w warunkach in vitro. 1.2 Streszczenie i Wyjaśnienia Dehydroepiandrosteron
WSTĘP 1.1 Przeznaczenie Test DRG DHEA-S ELISA jest testem immunoenzymatycznym do ilościowego diagnostycznego oznaczania DHEA-S w surowicy i osoczu w warunkach in vitro. 1.2 Streszczenie i Wyjaśnienia Dehydroepiandrosteron
Karty zewnętrzne Instrukcja obsługi
 Karty zewnętrzne Instrukcja obsługi Copyright 2010 Hewlett-Packard Development Company, L.P. Java jest znakiem towarowym w USA firmy Sun Microsystems, Inc. SD Logo jest znakiem towarowym jego prawnego
Karty zewnętrzne Instrukcja obsługi Copyright 2010 Hewlett-Packard Development Company, L.P. Java jest znakiem towarowym w USA firmy Sun Microsystems, Inc. SD Logo jest znakiem towarowym jego prawnego
Środki ostrożności uwagi
 QUANTA Lite Do diagnostyki in vitro Złożoność CLIA: Wysoka dsdna SC ELISA 704650 Przeznaczenie Test ten jest przeznaczony do pomiaru in vitro ilości swoistych autoprzeciwciał IgG przeciwko dwuniciowemu
QUANTA Lite Do diagnostyki in vitro Złożoność CLIA: Wysoka dsdna SC ELISA 704650 Przeznaczenie Test ten jest przeznaczony do pomiaru in vitro ilości swoistych autoprzeciwciał IgG przeciwko dwuniciowemu
I. Odczynniki i materiały zużywalne
 Pak Nr 10 Dzierżawa analizatora do badań pilnych wraz z odczynnikami i aparatem zastępczym I. Odczynniki i materiały zużywalne L/ Nazwa odczynnika p Ilość oznaczeń na 3 lata oznacz. netto oznacz. brutto
Pak Nr 10 Dzierżawa analizatora do badań pilnych wraz z odczynnikami i aparatem zastępczym I. Odczynniki i materiały zużywalne L/ Nazwa odczynnika p Ilość oznaczeń na 3 lata oznacz. netto oznacz. brutto
dotyczy: postępowania o zamówienie publiczne w trybie przetargu nieograniczonego na dostawę odczynników do koagulologii wraz z dzierżawa analizatorów.
 Toruń, dn. 25.10.2013r. L.dz. SSM.DZP.200.170.2013 dotyczy: postępowania o zamówienie publiczne w trybie przetargu nieograniczonego na dostawę odczynników do koagulologii wraz z dzierżawa analizatorów.
Toruń, dn. 25.10.2013r. L.dz. SSM.DZP.200.170.2013 dotyczy: postępowania o zamówienie publiczne w trybie przetargu nieograniczonego na dostawę odczynników do koagulologii wraz z dzierżawa analizatorów.
Pytania i Odpowiedzi do Przetargu na Odczynniki Laboratoryjne
 Pytania i Odpowiedzi do Przetargu na Odczynniki Laboratoryjne Czy Zamawiający w Pakiecie nr 1, poz. 29 wymaga testu o czułości: 0,1 ng/ml ( w tabeli podano wartość 01 ng/ml brak przecinka)? Odp. Tak wymaga
Pytania i Odpowiedzi do Przetargu na Odczynniki Laboratoryjne Czy Zamawiający w Pakiecie nr 1, poz. 29 wymaga testu o czułości: 0,1 ng/ml ( w tabeli podano wartość 01 ng/ml brak przecinka)? Odp. Tak wymaga
Instrukcja dodawania pakietów z symbolami do programu MÓWik PRINT 2.0
 Instrukcja dodawania pakietów z symbolami do programu MÓWik PRINT 2.0 Wstęp Na stronie internetowej www.mowik.pl udostępnione są nieodpłatne pakiety symboli, które można używać w programie MÓWik PRINT
Instrukcja dodawania pakietów z symbolami do programu MÓWik PRINT 2.0 Wstęp Na stronie internetowej www.mowik.pl udostępnione są nieodpłatne pakiety symboli, które można używać w programie MÓWik PRINT
System CardioChek 2011 Ocena Kliniczna
 System CardioChek 2011 Ocena Kliniczna Ocena obejmuje: Pracownicze Centrum Sanatoryjne Atlanta, GA Targi Zdrowia Winter Park, FL Centrum Odnowy Biologicznej Torrance, CA Szpital Chrystusa Cincinnati, OH
System CardioChek 2011 Ocena Kliniczna Ocena obejmuje: Pracownicze Centrum Sanatoryjne Atlanta, GA Targi Zdrowia Winter Park, FL Centrum Odnowy Biologicznej Torrance, CA Szpital Chrystusa Cincinnati, OH
1.2. Zlecenie może być wystawione w formie elektronicznej z zachowaniem wymagań, o których mowa w poz. 1.1.
 Załączniki do rozporządzenia Ministra Zdrowia z dnia 2005 r. (poz. ) Załącznik Nr 1 Podstawowe standardy jakości w czynnościach laboratoryjnej diagnostyki medycznej, ocenie ich jakości i wartości diagnostycznej
Załączniki do rozporządzenia Ministra Zdrowia z dnia 2005 r. (poz. ) Załącznik Nr 1 Podstawowe standardy jakości w czynnościach laboratoryjnej diagnostyki medycznej, ocenie ich jakości i wartości diagnostycznej
QUANTA Lite Anti-C1q ELISA Tylko na eksport. Nie do sprzedaży w Stanach Zjednoczonych Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite Anti-C1q ELISA 704565 Tylko na eksport. Nie do sprzedaży w Stanach Zjednoczonych Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM Anti-C1q jest to immunoenzymatyczny
QUANTA Lite Anti-C1q ELISA 704565 Tylko na eksport. Nie do sprzedaży w Stanach Zjednoczonych Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM Anti-C1q jest to immunoenzymatyczny
QUANTA Lite Ribosome P ELISA 708600 Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite Ribosome P ELISA 708600 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM Ribosome P jest to immunoenzymatyczny test (ELISA) do półilościowego oznaczania przeciwciał
QUANTA Lite Ribosome P ELISA 708600 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM Ribosome P jest to immunoenzymatyczny test (ELISA) do półilościowego oznaczania przeciwciał
Procedura szacowania niepewności
 DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Stron 7 Załączniki Nr 1 Nr Nr 3 Stron Symbol procedury PN//xyz Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Stron 7 Załączniki Nr 1 Nr Nr 3 Stron Symbol procedury PN//xyz Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
FORMULARZ ASORTYMENTOWO CENOWY. VAT kolumnie D A B C D E F G H. Szt oznaczeń. PAKIET 1 Cena netto...zł + VAT:...% tj...zł., Cena brutto... zł.
 Sprawa PN/ 12/D/2012 Załącznik nr 1 do siwz UWAGA WYMOGI DLA WSZYSTKICH PAKIETÓW - DO OFERTY NALEŻY DOŁĄCZYĆ: 1. instrukcje w języku polskim, druk czytelny 2. karty charakterystyki dla odczynników zawierających
Sprawa PN/ 12/D/2012 Załącznik nr 1 do siwz UWAGA WYMOGI DLA WSZYSTKICH PAKIETÓW - DO OFERTY NALEŻY DOŁĄCZYĆ: 1. instrukcje w języku polskim, druk czytelny 2. karty charakterystyki dla odczynników zawierających
Mycoplasma pneumoniae IgG ELISA
 Instrukcja Użytkownika Mycoplasma pneumoniae IgG ELISA EIA-3499 96 wells DRG Instruments GmbH, Germany Frauenbergstr. 18, D-35039 Marburg Telefon: +49 (0)64 21-1 700 0, Fax: +49-(0)6 42 1-170 0 50 Internet:
Instrukcja Użytkownika Mycoplasma pneumoniae IgG ELISA EIA-3499 96 wells DRG Instruments GmbH, Germany Frauenbergstr. 18, D-35039 Marburg Telefon: +49 (0)64 21-1 700 0, Fax: +49-(0)6 42 1-170 0 50 Internet:
FORMULARZ ASORTYMENTOWO CENOWY. PAKIET I Paski do badań moczu z użyciem aparatu LABUREADER. VAT kolumnie D A B C D E F G H. Szt.
 UWAGA WYMOGI DLA WSZYSTKICH PAKIETÓW - DO OFERTY NALEŻY DOŁĄCZYĆ: 1. instrukcje w języku polskim, druk czytelny 2. karty charakterystyki dla odczynników zawierających substancje niebezpieczne PAKIET I
UWAGA WYMOGI DLA WSZYSTKICH PAKIETÓW - DO OFERTY NALEŻY DOŁĄCZYĆ: 1. instrukcje w języku polskim, druk czytelny 2. karty charakterystyki dla odczynników zawierających substancje niebezpieczne PAKIET I
NOVA Gel Sm/RNP T 708415 Do diagnostyki in vitro
 NOVA Gel Sm/RNP T 708415 Do diagnostyki in vitro Przeznaczenie NOVA Gel TM Sm/RNP jest systemem testów podwójnej dyfuzji do ustalania miana i półilościowego określania przeciwciał przeciwko Sm/RNP, ekstrahowalnemu
NOVA Gel Sm/RNP T 708415 Do diagnostyki in vitro Przeznaczenie NOVA Gel TM Sm/RNP jest systemem testów podwójnej dyfuzji do ustalania miana i półilościowego określania przeciwciał przeciwko Sm/RNP, ekstrahowalnemu
Zał Nr 1- Pak Nr 7- Analizator parametrów krytycznych 1 sztuka. Parametry oferowane. Parametry wymagane. Opis / Parametry wymagane
 Zał Nr 1- Pak Nr 7- Analizator parametrów krytycznych 1 sztuka Lp Opis / Parametry wymagane Parametry wymagane Parametry oferowane /podać zakresy lub opisać 1 Producent 2 Model 3 Rok produkcji min 2018
Zał Nr 1- Pak Nr 7- Analizator parametrów krytycznych 1 sztuka Lp Opis / Parametry wymagane Parametry wymagane Parametry oferowane /podać zakresy lub opisać 1 Producent 2 Model 3 Rok produkcji min 2018
QUANTA Lite CCP 3.1 IgG/IgA ELISA 704550 Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite CCP 3.1 IgG/IgA ELISA 704550 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM CCP 3.1 IgG/IgA ELISA jest półilościowym testem immunoabsorpcji enzymozależnej (immunoenzymatycznym)
QUANTA Lite CCP 3.1 IgG/IgA ELISA 704550 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM CCP 3.1 IgG/IgA ELISA jest półilościowym testem immunoabsorpcji enzymozależnej (immunoenzymatycznym)
Przewodnik dla użytkownika do systemu STUDIO
 Przewodnik dla użytkownika do systemu STUDIO Projekt egreen JOBS nr. 2013-1-PL1-LEO05-37623 Projekt egreen JOBS nr. 2013-1-PL1-LEO05-37623 Spis treści Flexilab 3 Wstęp 5 Wyjście z systemu 5 Korzystanie
Przewodnik dla użytkownika do systemu STUDIO Projekt egreen JOBS nr. 2013-1-PL1-LEO05-37623 Projekt egreen JOBS nr. 2013-1-PL1-LEO05-37623 Spis treści Flexilab 3 Wstęp 5 Wyjście z systemu 5 Korzystanie
Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów
 Załącznik nr 1 do SIWZ Nazwa i adres Wykonawcy Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów Przedmiot zamówienia; automatyczny system do diagnostyki molekularnej:
Załącznik nr 1 do SIWZ Nazwa i adres Wykonawcy Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów Przedmiot zamówienia; automatyczny system do diagnostyki molekularnej:
5.6.2 Laboratorium: Punkty przywracania
 5.6.2 Laboratorium: Punkty przywracania Wprowadzenie Wydrukuj i uzupełnij to laboratorium. W tym ćwiczeniu stworzysz punkt przywracania i przywrócisz swój komputer do tego punktu. Zalecany sprzęt Do tego
5.6.2 Laboratorium: Punkty przywracania Wprowadzenie Wydrukuj i uzupełnij to laboratorium. W tym ćwiczeniu stworzysz punkt przywracania i przywrócisz swój komputer do tego punktu. Zalecany sprzęt Do tego
ZAKŁAD DIAGNOSTYKI LABORATORYJNEJ I IMMUNOLOGII KLINICZNEJ WIEKU ROZOJOWEGO AM W WARSZAWIE.
 ZAKŁAD DIAGNOSTYKI LABORATORYJNEJ I IMMUNOLOGII KLINICZNEJ WIEKU ROZOJOWEGO AKADEMII MEDYCZNEJ W WARSZAWIE. ZAKŁAD DIAGNOSTYKI LABORATOTORYJNEJ WYDZIAŁU NAUKI O ZDROWIU AKADEMII MEDYCZNEJ W WARSZAWIE Przykładowe
ZAKŁAD DIAGNOSTYKI LABORATORYJNEJ I IMMUNOLOGII KLINICZNEJ WIEKU ROZOJOWEGO AKADEMII MEDYCZNEJ W WARSZAWIE. ZAKŁAD DIAGNOSTYKI LABORATOTORYJNEJ WYDZIAŁU NAUKI O ZDROWIU AKADEMII MEDYCZNEJ W WARSZAWIE Przykładowe
Genomic Mini AX Plant Spin
 Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Mycoplasma pneumoniae IgM ELISA
 Instrukcja Użytkownika Mycoplasma pneumoniae IgM ELISA EIA-3500 96 wells DRG Instruments GmbH, Germany Frauenbergstr. 18, D-35039 Marburg Telefon: +49 (0)64 21-1 700 0, Fax: +49-(0)6 42 1-170 0 50 Internet:
Instrukcja Użytkownika Mycoplasma pneumoniae IgM ELISA EIA-3500 96 wells DRG Instruments GmbH, Germany Frauenbergstr. 18, D-35039 Marburg Telefon: +49 (0)64 21-1 700 0, Fax: +49-(0)6 42 1-170 0 50 Internet:
Kontrola i zapewnienie jakości wyników
 Kontrola i zapewnienie jakości wyników Kontrola i zapewnienie jakości wyników QA : Quality Assurance QC : Quality Control Dobór systemu zapewnienia jakości wyników dla danego zadania fit for purpose Kontrola
Kontrola i zapewnienie jakości wyników Kontrola i zapewnienie jakości wyników QA : Quality Assurance QC : Quality Control Dobór systemu zapewnienia jakości wyników dla danego zadania fit for purpose Kontrola
Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH
 Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH 1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań wykonywanych przez PZH Poz. Badanie Rodzaj
Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH 1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań wykonywanych przez PZH Poz. Badanie Rodzaj
QUANTA Flash PR3 701138 Odczynniki Do diagnostyki In Vitro
 QUANTA Flash PR3 701138 Odczynniki Do diagnostyki In Vitro Przeznaczenie QUANTA Flash PR3 to test chemiluminescencji (CIA) do półilościowego wykrywania przeciwciał IgG przeciwko proteinazie (PR3) w surowicy
QUANTA Flash PR3 701138 Odczynniki Do diagnostyki In Vitro Przeznaczenie QUANTA Flash PR3 to test chemiluminescencji (CIA) do półilościowego wykrywania przeciwciał IgG przeciwko proteinazie (PR3) w surowicy
QUANTA Lite Gliadin IgG ELISA Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite Gliadin IgG ELISA 708650 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie Test QUANTA Lite TM IgG gliadyny to test immunoenzymatyczny (ELISA) do półilościowego oznaczania przeciwciał
QUANTA Lite Gliadin IgG ELISA 708650 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie Test QUANTA Lite TM IgG gliadyny to test immunoenzymatyczny (ELISA) do półilościowego oznaczania przeciwciał
Instructions for use. Skrócona instrukcja obsługi urządzenia Cyclops6-SA. Wyłącznie do użytku profesjonalnego. 067_v02 02/2017 (pl)
 Instructions for use Sanquin Reagents B.V. Plesmanlaan 125 1066 CX Amsterdam The Netherlands Cyclops6-SA 067_v02 02/2017 (pl) K7309 Phone: +31 20 5123599 Fax: +31 20 5123570 Reagents@sanquin.nl www.sanquin.org/reagents
Instructions for use Sanquin Reagents B.V. Plesmanlaan 125 1066 CX Amsterdam The Netherlands Cyclops6-SA 067_v02 02/2017 (pl) K7309 Phone: +31 20 5123599 Fax: +31 20 5123570 Reagents@sanquin.nl www.sanquin.org/reagents
Instrukcja obsługi Crocodile
 Instrukcja obsługi Crocodile 1. Crocodile gotowy do użytku Wyjąć Crocodile z opakowania, poluzować śruby (A) po bokach. Aby rozłożyć całkowicie ramę, należy rozsunąć koła przednie z tylnymi jednym płynnym
Instrukcja obsługi Crocodile 1. Crocodile gotowy do użytku Wyjąć Crocodile z opakowania, poluzować śruby (A) po bokach. Aby rozłożyć całkowicie ramę, należy rozsunąć koła przednie z tylnymi jednym płynnym
Pozostałe zapisy SIWZ nie ulegają zmianie.
 Znak sprawy: ZP/72/83/2017/PN/72 Dotyczy: Modyfikacji SIWZ Zabrze, 13.12.2017r. Dyrektor dr n. med. Dariusz Budziński ul. 3-go Maja 13-15 41-800 Zabrze SEKRETARIAT fax: (32) 370 45 22 sekretariat@szpital.zabrze.pl
Znak sprawy: ZP/72/83/2017/PN/72 Dotyczy: Modyfikacji SIWZ Zabrze, 13.12.2017r. Dyrektor dr n. med. Dariusz Budziński ul. 3-go Maja 13-15 41-800 Zabrze SEKRETARIAT fax: (32) 370 45 22 sekretariat@szpital.zabrze.pl
SEKCJA IDENTYFIKACJA PRODUKTU
 K A R T A C H A R A K T E R Y S T Y K I S U B S T A N C J I N I E B E Z P I E C Z N E J ECN: 435937 Data zmiany: 04/10/13 Wer. 0 PRZEZNACZONE TYLKO NA EKSPORT NIEPRZEZNACZONE DO SPRZEDAŻY W USA SEKCJA
K A R T A C H A R A K T E R Y S T Y K I S U B S T A N C J I N I E B E Z P I E C Z N E J ECN: 435937 Data zmiany: 04/10/13 Wer. 0 PRZEZNACZONE TYLKO NA EKSPORT NIEPRZEZNACZONE DO SPRZEDAŻY W USA SEKCJA
HEMATOLOGIA. Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice.
 HEMATOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi. Zdezynfekować
HEMATOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi. Zdezynfekować
IMMUNOCHEMIA. Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice.
 IMMUNOCHEMIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
IMMUNOCHEMIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
Kalkulator kalorii i wartości odżywczych by CTI. Instrukcja
 Kalkulator kalorii i wartości odżywczych by CTI Instrukcja Spis treści 1. Opis programu... 3 2. Logowanie... 4 3. Okno główne programu... 4 4. Tworzenie receptury, generowanie etykiety wartości odżywczych...
Kalkulator kalorii i wartości odżywczych by CTI Instrukcja Spis treści 1. Opis programu... 3 2. Logowanie... 4 3. Okno główne programu... 4 4. Tworzenie receptury, generowanie etykiety wartości odżywczych...
Wirus zapalenia wątroby typu B
 Wirus zapalenia wątroby typu B Kliniczne następstwa zakażenia odsetek procentowy wyzdrowienie przewlekłe zakażenie Noworodki: 10% 90% Dzieci 1 5 lat: 70% 30% Dzieci starsze oraz 90% 5% - 10% Dorośli Choroby
Wirus zapalenia wątroby typu B Kliniczne następstwa zakażenia odsetek procentowy wyzdrowienie przewlekłe zakażenie Noworodki: 10% 90% Dzieci 1 5 lat: 70% 30% Dzieci starsze oraz 90% 5% - 10% Dorośli Choroby
SZCZEGÓŁOWY OPIS PRZEDMIOTU OFERTY
 Numer postępowania: NA-ZP-250/07/09/16 Załącznik nr 1 do SIWZ (Pieczęć Wykonawcy) SZCZEGÓŁOWY OPIS PRZEDMIOTU OFERTY A.1 Dostawa jakościowych testów markerów wirusowych przenoszonych drogą krwi tj. testów
Numer postępowania: NA-ZP-250/07/09/16 Załącznik nr 1 do SIWZ (Pieczęć Wykonawcy) SZCZEGÓŁOWY OPIS PRZEDMIOTU OFERTY A.1 Dostawa jakościowych testów markerów wirusowych przenoszonych drogą krwi tj. testów
PASPORT Ręczny Czujnik Pracy Serca
 Instrukcja użytkownika 01 2-103 74 A PASPORT Ręczny Czujnik Pracy Serca PS-2186 2 1 Zestaw zawiera Numer części 1. Ręczny Czujnik Pracy Serca PS-2186 2. Uchwyty 648-10601 Kompatybilne interfejsy PASPORT
Instrukcja użytkownika 01 2-103 74 A PASPORT Ręczny Czujnik Pracy Serca PS-2186 2 1 Zestaw zawiera Numer części 1. Ręczny Czujnik Pracy Serca PS-2186 2. Uchwyty 648-10601 Kompatybilne interfejsy PASPORT
Obsługa Panelu Menadżera
 Obsługa Panelu Menadżera Wersja 3.59.305 4.04.2013 r. Panel Menadżera pozwala na dostęp do wybranych informacji systemu Streamsoft Prestiż, poprzez przeglądarkę internetową. Ponadto panel ten można obsługiwać
Obsługa Panelu Menadżera Wersja 3.59.305 4.04.2013 r. Panel Menadżera pozwala na dostęp do wybranych informacji systemu Streamsoft Prestiż, poprzez przeglądarkę internetową. Ponadto panel ten można obsługiwać
INSTRUKCJA DO OPROGRAMOWANIA KOMPUTEROWEGO
 INSTRUKCJA DO OPROGRAMOWANIA KOMPUTEROWEGO DLA LEKKIEJ PŁYTY DO BADAŃ DYNAMICZNYCH HMP LFG WYMAGANE MINIMALNE PARAMETRY TECHNICZNE: SPRZĘT: - urządzenie pomiarowe HMP LFG 4 lub HMP LFG Pro wraz z kablem
INSTRUKCJA DO OPROGRAMOWANIA KOMPUTEROWEGO DLA LEKKIEJ PŁYTY DO BADAŃ DYNAMICZNYCH HMP LFG WYMAGANE MINIMALNE PARAMETRY TECHNICZNE: SPRZĘT: - urządzenie pomiarowe HMP LFG 4 lub HMP LFG Pro wraz z kablem
Usługi Informatyczne "SZANSA" - Gabriela Ciszyńska-Matuszek ul. Świerkowa 25, Bielsko-Biała
 Usługi Informatyczne "SZANSA" - Gabriela Ciszyńska-Matuszek ul. Świerkowa 25, 43-305 Bielsko-Biała NIP 937-22-97-52 tel. +48 33 488 89 39 zwcad@zwcad.pl www.zwcad.pl Aplikacja do rysowania wykresów i oznaczania
Usługi Informatyczne "SZANSA" - Gabriela Ciszyńska-Matuszek ul. Świerkowa 25, 43-305 Bielsko-Biała NIP 937-22-97-52 tel. +48 33 488 89 39 zwcad@zwcad.pl www.zwcad.pl Aplikacja do rysowania wykresów i oznaczania
Podpis Wykonawcy lub osoby upoważnionej. VAT (%) Wartość brutto. Wielkość opakowania Nr katalogowy Producent
 1. Dzierżawa aparatu, dostawa odczynników, materiałów kontrolnych i kalibratorów oraz materiałów zużywalnych do immunochemicznych hormonów cyklu miesiączkowego, hormonów tarczycy, antygenów nowotworowych
1. Dzierżawa aparatu, dostawa odczynników, materiałów kontrolnych i kalibratorów oraz materiałów zużywalnych do immunochemicznych hormonów cyklu miesiączkowego, hormonów tarczycy, antygenów nowotworowych
DRG International, Inc., USA Fax: (973)
 1. WSTĘP 1.1. Zastosowanie Zestaw DRG Leptin ELISA jest testem immunoenzymatycznym do pomiaru leptyny w surowicy i osoczu. 2. ZASADA TESTU Zestaw DRG leptin ELISA jest testem immunoenzymatycznym stałej
1. WSTĘP 1.1. Zastosowanie Zestaw DRG Leptin ELISA jest testem immunoenzymatycznym do pomiaru leptyny w surowicy i osoczu. 2. ZASADA TESTU Zestaw DRG leptin ELISA jest testem immunoenzymatycznym stałej
QUANTA Lite RF IgG ELISA 708685 Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite RF IgG ELISA 708685 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM RF IgG jest to test immunoenzymatyczny (ELISA) do półilościowego wykrywania przeciwciał IgG czynnika
QUANTA Lite RF IgG ELISA 708685 Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie QUANTA Lite TM RF IgG jest to test immunoenzymatyczny (ELISA) do półilościowego wykrywania przeciwciał IgG czynnika
QUANTA Lite dsdna ELISA Test ELISA dwuniciowego DNA Do diagnostyki in vitro Złożoność CLIA: Wysoka
 QUANTA Lite dsdna ELISA 708510 Test ELISA dwuniciowego DNA Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie Test ELISA QUANTA Lite dsdna ELISA jest testem immunoenzymatycznym (ELISA) do półilościowego
QUANTA Lite dsdna ELISA 708510 Test ELISA dwuniciowego DNA Do diagnostyki in vitro Złożoność CLIA: Wysoka Przeznaczenie Test ELISA QUANTA Lite dsdna ELISA jest testem immunoenzymatycznym (ELISA) do półilościowego
xchekplus Przewodnik Użytkownika
 xchekplus Przewodnik Użytkownika Dodatek Charakterystyka ogólna Zmiana domyślnego hasła administratora Zarządzanie ochroną systemu Ręczne wprowadzanie danych Edytowanie wartości OD dołków Używanie funkcji
xchekplus Przewodnik Użytkownika Dodatek Charakterystyka ogólna Zmiana domyślnego hasła administratora Zarządzanie ochroną systemu Ręczne wprowadzanie danych Edytowanie wartości OD dołków Używanie funkcji
INSTRUKCJA STOSOWANIA
 Strona 1 z 6 INSTRUKCJA STOSOWANIA Zawiesiny pasożytów w formalinie PRZEZNACZENIE Zawiesiny pasożytów oferowane przez Microbiologics przeznaczone są do programów zapewnienia jakości tam, gdzie do przeprowadzenia
Strona 1 z 6 INSTRUKCJA STOSOWANIA Zawiesiny pasożytów w formalinie PRZEZNACZENIE Zawiesiny pasożytów oferowane przez Microbiologics przeznaczone są do programów zapewnienia jakości tam, gdzie do przeprowadzenia
Karty zewnętrzne Instrukcja obsługi
 Karty zewnętrzne Instrukcja obsługi Copyright 2008 Hewlett-Packard Development Company, L.P. Logo SD jest znakiem towarowym należącym do jego właściciela. Java jest zarejestrowanym w Stanach Zjednoczonych
Karty zewnętrzne Instrukcja obsługi Copyright 2008 Hewlett-Packard Development Company, L.P. Logo SD jest znakiem towarowym należącym do jego właściciela. Java jest zarejestrowanym w Stanach Zjednoczonych
IRISPen Air 7. Skrócona instrukcja obsługi. (ios)
 IRISPen Air 7 Skrócona instrukcja obsługi (ios) Niniejsza skrócona instrukcja obsługi pomaga w rozpoczęciu korzystania z urządzenia IRISPen TM Air 7. Zapoznaj się z nią przed przystąpieniem do użytkowania
IRISPen Air 7 Skrócona instrukcja obsługi (ios) Niniejsza skrócona instrukcja obsługi pomaga w rozpoczęciu korzystania z urządzenia IRISPen TM Air 7. Zapoznaj się z nią przed przystąpieniem do użytkowania
Grupa SuperTaniaApteka.pl Utworzono : 30 wrzesień 2016
 TESTY CIĄŻOWE I DIAGNOSTYCZNE > Model : 9048435 Producent : HYDREX PRZED.TECH.HANDL. Testy paskowe Insight BIAŁKO Test są przeznaczone do wykonania ogólnego badania moczu w warunkach domowych. Testy BIAŁKO
TESTY CIĄŻOWE I DIAGNOSTYCZNE > Model : 9048435 Producent : HYDREX PRZED.TECH.HANDL. Testy paskowe Insight BIAŁKO Test są przeznaczone do wykonania ogólnego badania moczu w warunkach domowych. Testy BIAŁKO
elaborat Podręcznik Użytkownika MARCEL S.A r. INTERNETOWA PLATFORMA PREZENTACJI WYNIKÓW PUBLIKACJA WYNIKÓW DLA PACJENTA INDYWIDUALNEGO
 elaborat INTERNETOWA PLATFORMA PREZENTACJI WYNIKÓW PUBLIKACJA WYNIKÓW DLA PACJENTA INDYWIDUALNEGO Podręcznik Użytkownika MARCEL S.A. 2018 r. Spis treści Zasady pracy......3 Logowanie Pacjenta do serwisu......3
elaborat INTERNETOWA PLATFORMA PREZENTACJI WYNIKÓW PUBLIKACJA WYNIKÓW DLA PACJENTA INDYWIDUALNEGO Podręcznik Użytkownika MARCEL S.A. 2018 r. Spis treści Zasady pracy......3 Logowanie Pacjenta do serwisu......3
Walidacja metod analitycznych Raport z walidacji
 Walidacja metod analitycznych Raport z walidacji Małgorzata Jakubowska Katedra Chemii Analitycznej WIMiC AGH Walidacja metod analitycznych (według ISO) to proces ustalania parametrów charakteryzujących
Walidacja metod analitycznych Raport z walidacji Małgorzata Jakubowska Katedra Chemii Analitycznej WIMiC AGH Walidacja metod analitycznych (według ISO) to proces ustalania parametrów charakteryzujących
Instrukcja obsługi ON!Track. Wersja mobilna 2.3 Wersja instrukcji 1.1
 Instrukcja obsługi ON!Track Wersja mobilna 2.3 Wersja instrukcji 1.1 Spis treści Czym jest ON!Track?... 2 Jak pobrać ON!Track ze sklepu App Store?... 3 Jak przejść do aplikacji mobilnej ON!Track?... 8
Instrukcja obsługi ON!Track Wersja mobilna 2.3 Wersja instrukcji 1.1 Spis treści Czym jest ON!Track?... 2 Jak pobrać ON!Track ze sklepu App Store?... 3 Jak przejść do aplikacji mobilnej ON!Track?... 8
