Stechiometria równań reakcji chemicznych, objętość gazów w warunkach odmiennych od warunków normalnych (0 o C 273K, 273hPa)
|
|
|
- Marek Krupa
- 9 lat temu
- Przeglądów:
Transkrypt
1 Karta pracy I/2a Stechiometria równań reakcji chemicznych, objętość gazów w warunkach odmiennych od warunków normalnych (0 o C 273K, 273hPa) I. Stechiometria równań reakcji chemicznych interpretacja równań reakcji 1. Równanie reakcji chemicznej zapis przebiegu reakcji chemicznej za pomocą symboli, wzorów i znaków. Dane jest równanie reakcji: Substraty reakcji Produkty reakcji Interpretacja 3 MgCO Al 3 Mg + Al 2 (CO 3 ) 3 3 cząsteczki + 2 cząsteczki 3 cząsteczki + 1 cząsteczka atomowocząsteczkowa 3 mole + 2 mole 3 mole + 1 mol molowa 3 84g g 3 24g g masowa reagentów 3 6, cz , cz. 3 6, cz. + 6, cz. liczby molekuł 3 mole g 3 6, cz g mieszana R e a g e n t y = substraty + produkty reakcji 2. Objętość molowa gazów - mol dowolnego gazu w warunkach normalnych 273K i 1013hPa zajmuje taką samą objętość 22,4dm 3 : V mol = 22,4dm 3 /mol, co jest jednoznaczne że w tej objętości i w tych warunkach znajduje się tyle samo cząsteczek/atomów dowolnego gazu, jest to liczba Avogadro N A = 6, /mol Dane jest równanie reakcji: Substraty reakcji Produkty reakcji Interpretacja Fe 2 O H 2 2 Fe + 3 H 2 O 1 cząsteczki + 3 cząsteczki 2 cząsteczki + 3 cząsteczka atomowocząsteczkowa 1 mol + 3 mole 2 mole + 3 mol molowa 160g + 3 2g 2 56g g masowa reagentów 1 6, cz , cz. 2 6, cz , cz. liczby molekuł 160g ,4dm g g masowoobjętościowa 1 6, cz ,4dm 3 2 mole g mieszana R e a g e n t y = substraty + produkty reakcji Uwaga: interpretacja mieszania jest przydatna, gdy w treści zadania do równania reakcji chemicznej dane dotyczące substratów i produktów reakcji są ujęte w różnych jednostkach miar przez co unika się kilkukrotnych przeliczeń, zaleca się zawsze dokonać interpretacji molowej.
2 3. Prawo zachowania masy dla każdej reakcji chemicznej masa wszystkich substratów jest równa masie wszystkich produktów, czyli taka sama masa substancji występuje przed i po przemianie chemicznej 2 Ag + I 2 2AgI 2 107g g = g 4. Prawo Gay-Lussaca (stałych stosunków objętościowych) w reakcjach chemicznych objętości reagentów gazowych, mierzone w tych samych warunkach ciśnienia i temperatury, pozostają do siebie w stosunkach licz naturalnych 3H 2 + N 2 2NH ,4dm ,4dm ,4dm 3 22,4 dm 3 + 7,466dm 3 14,933 dm 3 3 dm 3 + 1dm 3 2dm 3 3 : 1 : 2 Przykład: Oblicz, jaką objętość w warunkach normalnych zajmował tlenek węgla(ii) niezbędny do redukcji 0,25 mola tlenku żelaza(iii) oraz oblicz ile otrzymano cząsteczek tlenku węgla(iv) i gramów żelaza metalicznego jeżeli reakcja zaszła z wydajnością 100% wg równania: Fe 2 O CO 2 Fe + 3 CO 2 Interpretacja wynikająca z treści zadania: Fe 2 O CO 2 Fe + 3 CO 2 1mol + 3 mole 2 mole + 3 mole 1mol ,4dm g + 3 6, cz. Obliczenie objętości CO w warunkach normalnych: 1 mol Fe 2 O ,4dm 3 CO Obliczenie liczby cząsteczek CO 2 1 mol Fe 2 O , cz. CO 2 Obliczenie liczby gramów metalicznego żelaza 1 mol Fe 2 O g
3 5. Objętość gazów w warunkach różnych od warunków normalnych równanie Clapeyrona Gaz doskonały (hipotetyczny), dla którego przyjmuje się następujące założenia: Cząsteczki gazu nie oddziałują między sobą (oprócz chwili zderzenia) Cząsteczki gazu mają znikomo małą objętość, traktuje się je jako punkty materialne, Cząsteczki poruszają się chaotycznie od zderzenia do zderzenia, zderzenia są sprężyste Ciśnienie, objętość i temperaturę gazu doskonałego wiąże ze sobą równanie Clapeyrona (równanie stanu gazu doskonałego prawo gazu doskonałego) pv = nrt gdzie: p ciśnienie w [hpa] V objętość w [dm 3 ], n liczba moli gazu [mol], R stała gazowa R = 83,1 hpa dm 3 mol -1 K -1 (jeżeli p = [hpa]; hpa = 100Pa); R = 8,31 J K -1 mol -1 (jeżeli p = [Pa]); T temperatura w [K], T[K] = t( o C). Po podstawieniu za gazu do wzoru Clapeyrona można wyprowadzić wzór na masę molową Na podstawie równania Clapeyrona można wyznaczyć również gęstość gazu: Przykład 1 W nadmiarze wodnego roztworu NaOH całkowicie roztworzono 4,5g glinu. Powstający gaz zebrano do balonu, oblicz objętość otrzymanego gazu jeżeli temp. gazu wynosiła 65 o C a ciśnienie w balonie wynosiło 1300hPa a reakcja przebiegła wg równania: 6 NaOH + 2 Al + 6H 2 O 2 [Al(OH) 6 ]Na H 2 Interpretacja równania reakcji wynikająca z treści zadania: 6 NaOH + 2 Al + 6 H 2 O 2 [Al(OH) 6 ]Na H 2 6 moli + 2mole + 6 moli 2 mole + 3 mole 6 mol g + 6moli 2 mole + 3 mole Obliczenie moli wodoru w warunkach normalnych 54 g glinu mole wodoru 4,5g glinu x = n Podstawienie danych do wzoru Clapeyrona po przekształceniu: n = 0,35 mol, p = 1300hPa, T = o C = 338K,
4 Przykład 2 Acetylen na potrzeby przemysłowe otrzymuje się przez pirolizę metanu w temp o C i ciśnieniu normalnym. Oblicz, jaką objętość w m 3 zajmował metan w/w warunkach jeżeli w procesie otrzymany acetylen sprężono w butlach 50 butlach o pojemności 40 dm 3 pod ciśnieniem 1,5MPa, a każda z butli zawierała 5,5kg tego gazu. Reakcja przebiega wg równania : 2 CH 4 C 2 H H 2 Uwaga Dane techniczne butli nie mają przełożenia na zadanie z wyjątkiem, że każda z nich zwiera 5,5 kg acetylenu rozpuszczonego w acetonie. Obliczenie masy acetylenu 50 butli 5,5kg/butla = 275kg = g Obliczenie liczby moli acetylenu M = 2M C + 2M H = 2 12g/mol + 2 1g/mol = 26g/mol Obliczenie liczby moli metanu w warunkach normalnych z równania reakcji chemicznej 2 CH 4 C 2 H H 2 2 mole 1 mol + 3 mole 2 mole metanu mol acetylenu x moli acetylenu Obliczenie objętości metanu; w temp. T = o C = 1773K; p = 1013hPa Przykład 3: W nadmiarze kwasu siarkowego roztworzono całkowicie próbkę miedzi, zebrany gaz w warunkach standardowych (25 o C i 1013hPa) zajął objętość 1,12dm 3. Oblicz masę próbki miedzi, jeżeli reakcja przebiega wg równania Cu + 2 H 2 SO 4 CuSO 4 + SO 2 + 2H 2 O. Obliczenie moli SO 2 w warunkach standardowych: V = 1,12dm 3, p = 1013hPa, T = 298K Obliczenie masy próbki miedzi z równania reakcji Cu + 2 H 2 SO 4 CuSO 4 + SO H 2 O. 1 mol + 2 mole 1 mol + 1mol + 2 mole 64,5g + 2 mole 1 mol + 1mol + 2 mole 64,5g miedzi mol SO 2 x ,0458 mola
5 Karta pracy I/2b: Stechiometria równań reakcji chemicznych, objętość gazów Nazwisko i imię: / ocena Zad.1 W warunkach standardowych (25 o C i 1013hPa) w nadmiarze wody całkowicie roztworzono pewną próbkę wapnia. Reakcja przebiegła wg. równania: Ca + 2H 2 O Ca(OH) 2 + H 2 Oblicz: a) Liczbę gramów próbki wapnia jeżeli zebrany wodór w w/w warunkach zajmował objętość 2,5dm 3 b) Liczbę gramów otrzymanego wodorotlenku wapnia Ca(OH) 2 Zad.2 Tlen na potrzeby laboratoryjne można otrzymać w reakcji termicznego rozkładu manganianu(vii) potasu, związek ten poddano rozkładowi w temp. 200 o C i pod ciśnieniem standardowym. Reakcja przebiega wg równania: 2 KMnO 4 K 2 MnO 4 + MnO 2 + O 2. Oblicz: a) Liczbę gramów otrzymanego tlenku manganu(iv) jeżeli otrzymano 6, cząsteczek tlenu w w/w warunkach rozkładu, b) Liczbę gramów KMnO 4 jeżeli otrzymano w w/w warunkach 0,2 mola tlenu. Zad. 3 Butla turystyczna zawiera 2,5kg skroplonego butanu. Oblicz: a) Objętość w warunkach standardowych jaką zajmie powietrze atmosferyczne, w którym tlen stanowi 1/5 objętości (20% części objętościowych) niezbędną do całkowitego spalenia butanu w butli turystycznej jeżeli reakcja spalania butanu przebiega wg. równania: 2 C 4 H O 2 8 CO H 2 O. b) Ilość gramów glukozy, którą mogą wytworzyć rośliny w procesie fotosyntezy z CO 2 powstałego w wyniku spalenia w/w ilości butanu jeżeli reakcja przebiega wg równania: 6 CO H 2 O C 6 H 12 O O 2 c) Objętość w warunkach standardowych wydzielonego do atmosfery tlenu przez rośliny w procesie fotosyntezy z ppkt.b d) Oceń/wyznacz stosunek objętościowy tlenu zużytego do spalenia w/w butanu i tlenu powstałego w procesie fotosyntezy (ppkt. a i c) Zad. 4* W warunkach standardowych spalono pewną ilość metanu (CH 4 + 2O 2 CO 2 + 2H 2 O). Produkty spalania przepuszczono przez płuczkę wapienną [wodny roztwór Ca(OH) 2 ]. Otrzymany biały osad odsączono, wysuszono i zważono, masa produktu wyniosła 2,5g. Oblicz objętość spalonego metanu w w/w warunkach. Zad. 5 Oblicz, ile gramów chlorku baru musi zawierać wodny roztwór tej soli aby wytrąć z roztworu wszystkie jony kwasu ortofosforowego po rozpuszczeniu w wodzie 4,24g ortofosforanu(v) potasu, jeżeli reakcji przebiega wg równania; 3 BaCl K 3 PO 4 Ba 3 (PO 4 ) 2 + 6Cl K + [ 3 Ba PO 4 3- Ba 3 (PO 4 ) 2 ]
Kuratorium Oświaty w Lublinie
 Kuratorium Oświaty w Lublinie ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2014/2015 KOD UCZNIA ETAP OKRĘGOWY Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
Kuratorium Oświaty w Lublinie ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2014/2015 KOD UCZNIA ETAP OKRĘGOWY Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap wojewódzki rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap wojewódzki rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
PODSTAWY OBLICZEŃ CHEMICZNYCH DLA MECHANIKÓW
 PODSTAWY OBLICZEŃ CHEMICZNYCH DLA MECHANIKÓW Opracowanie: dr inż. Krystyna Moskwa, dr Wojciech Solarski 1. Termochemia. Każda reakcja chemiczna związana jest z wydzieleniem lub pochłonięciem energii, najczęściej
PODSTAWY OBLICZEŃ CHEMICZNYCH DLA MECHANIKÓW Opracowanie: dr inż. Krystyna Moskwa, dr Wojciech Solarski 1. Termochemia. Każda reakcja chemiczna związana jest z wydzieleniem lub pochłonięciem energii, najczęściej
Małopolski Konkurs Chemiczny dla Gimnazjalistów
 Małopolski Konkurs Chemiczny dla Gimnazjalistów Etap II (rejonowy) 5 stycznia 0 roku Materiały dla nauczycieli Odpowiedzi do zadań wraz z punktacją Uwagi ogólne: Za prawidłowe rozwiązania zadań inną metodą
Małopolski Konkurs Chemiczny dla Gimnazjalistów Etap II (rejonowy) 5 stycznia 0 roku Materiały dla nauczycieli Odpowiedzi do zadań wraz z punktacją Uwagi ogólne: Za prawidłowe rozwiązania zadań inną metodą
PODSTAWY OBLICZEŃ CHEMICZNYCH
 PODSTAWY OBLICZEŃ CHEMICZNYCH Opacowanie: d inż. Kystyna Moskwa, d Jadwiga Zawada 1. Chemiczne jednostki masy. W chemii stosuje się względne watości mas atomów i cząsteczek odniesione do 1/12 masy atomu
PODSTAWY OBLICZEŃ CHEMICZNYCH Opacowanie: d inż. Kystyna Moskwa, d Jadwiga Zawada 1. Chemiczne jednostki masy. W chemii stosuje się względne watości mas atomów i cząsteczek odniesione do 1/12 masy atomu
Gaz i jego parametry
 W1 30 Gaz doskonały Parametry gazu Równanie Clapeyrona Mieszaniny gazów Warunki normalne 1 Gazem doskonałym nazywamy gaz spełniaj niający następuj pujące warunki: - cząstki gazu zachowują się jako doskonale
W1 30 Gaz doskonały Parametry gazu Równanie Clapeyrona Mieszaniny gazów Warunki normalne 1 Gazem doskonałym nazywamy gaz spełniaj niający następuj pujące warunki: - cząstki gazu zachowują się jako doskonale
2.4. ZADANIA STECHIOMETRIA. 1. Ile moli stanowi:
 2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
18 TERMODYNAMIKA. PODSUMOWANIE
 Włodzimierz Wolczyński 18 TERMODYNAMIKA. PODSUMOWANIE Zadanie 1 Oto cykl pracy pewnego silnika termodynamicznego w układzie p(v). p [ 10 5 Pa] 5 A 4 3 2 1 0 C B 5 10 15 20 25 30 35 40 V [ dm 3 ] Sprawność
Włodzimierz Wolczyński 18 TERMODYNAMIKA. PODSUMOWANIE Zadanie 1 Oto cykl pracy pewnego silnika termodynamicznego w układzie p(v). p [ 10 5 Pa] 5 A 4 3 2 1 0 C B 5 10 15 20 25 30 35 40 V [ dm 3 ] Sprawność
Liczba cząsteczek w 1 molu. Liczba atomów w 1 molu. Masa molowa M
 Materiał powtórzeniowy do sprawdzianu - liczba Avogadro, mol, masa molowa, molowa objętość gazów, obliczenia stechiometryczne + zadania z rozwiązaniami I. Podstawowe definicje 1. Masa atomowa - masa atomu
Materiał powtórzeniowy do sprawdzianu - liczba Avogadro, mol, masa molowa, molowa objętość gazów, obliczenia stechiometryczne + zadania z rozwiązaniami I. Podstawowe definicje 1. Masa atomowa - masa atomu
dr Dariusz Wyrzykowski ćwiczenia rachunkowe semestr I
 Podstawowe prawa i pojęcia chemiczne. Fizyczne prawa gazowe. Zad. 1. Ile cząsteczek wody znajduje się w 0,12 mola uwodnionego azotanu(v) ceru Ce(NO 3 ) 2 6H 2 O? Zad. 2. W wyniku reakcji 40,12 g rtęci
Podstawowe prawa i pojęcia chemiczne. Fizyczne prawa gazowe. Zad. 1. Ile cząsteczek wody znajduje się w 0,12 mola uwodnionego azotanu(v) ceru Ce(NO 3 ) 2 6H 2 O? Zad. 2. W wyniku reakcji 40,12 g rtęci
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
Cz. I Stechiometria - Zadania do samodzielnego wykonania
 Cz. I Stechiometria - Zadania do samodzielnego wykonania A. Ustalenie wzoru rzeczywistego związku chemicznego na podstawie składu procentowego. Zadanie i metoda rozwiązania Ustal wzór rzeczywisty związku
Cz. I Stechiometria - Zadania do samodzielnego wykonania A. Ustalenie wzoru rzeczywistego związku chemicznego na podstawie składu procentowego. Zadanie i metoda rozwiązania Ustal wzór rzeczywisty związku
Opracował: dr inż. Tadeusz Lemek
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 2014/2015. Etap wojewódzki
 Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 04/05 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 04/05 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks
 Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
OBLICZENIA STECHIOMETRIA STECHIOMETRIA: INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH
 1 OBLICZENIA STECHIOMETRIA STECHIOMETRIA: INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH Np.: WYZNACZANIE ILOŚCI SUBSTRATÓW KONIECZNYCH DLA OTRZYMANIA OKREŚLONYCH ILOŚCI PRODUKTU PODSTAWY OBLICZEŃ CHEMICZNYCH
1 OBLICZENIA STECHIOMETRIA STECHIOMETRIA: INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH Np.: WYZNACZANIE ILOŚCI SUBSTRATÓW KONIECZNYCH DLA OTRZYMANIA OKREŚLONYCH ILOŚCI PRODUKTU PODSTAWY OBLICZEŃ CHEMICZNYCH
PODSTAWY STECHIOMETRII
 PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
AKADEMIA GÓRNICZO-HUTNICZA im. Stanisława Staszica w Krakowie OLIMPIADA O DIAMENTOWY INDEKS AGH 2017/18 CHEMIA - ETAP I
 Związki manganu i manganometria AKADEMIA GÓRNICZO-HUTNICZA 1. Spośród podanych grup wybierz tą, w której wszystkie związki lub jony można oznaczyć metodą manganometryczną: Odp. C 2 O 4 2-, H 2 O 2, Sn
Związki manganu i manganometria AKADEMIA GÓRNICZO-HUTNICZA 1. Spośród podanych grup wybierz tą, w której wszystkie związki lub jony można oznaczyć metodą manganometryczną: Odp. C 2 O 4 2-, H 2 O 2, Sn
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru
 1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
XII KONKURS CHEMICZNY DLA UCZNIÓW SZKÓŁ GIMNAZJALNYCH O PUCHAR DYREKTORA DRUGIEGO LICEUM OGÓLNOKSZTAŁCĄCEGO IM. Wł. BRONIEWSKIEGO W KOSZALINIE
 DRUGIE LICEUM OGÓLNOKSZTAŁCĄCE IM. Wł. BRONIEWSKIEGO W KOSZALINIE XII KONKURS CHEMICZNY DLA UCZNIÓW SZKÓŁ GIMNAZJALNYCH O PUCHAR DYREKTORA DRUGIEGO LICEUM OGÓLNOKSZTAŁCĄCEGO IM. Wł. BRONIEWSKIEGO W KOSZALINIE
DRUGIE LICEUM OGÓLNOKSZTAŁCĄCE IM. Wł. BRONIEWSKIEGO W KOSZALINIE XII KONKURS CHEMICZNY DLA UCZNIÓW SZKÓŁ GIMNAZJALNYCH O PUCHAR DYREKTORA DRUGIEGO LICEUM OGÓLNOKSZTAŁCĄCEGO IM. Wł. BRONIEWSKIEGO W KOSZALINIE
Jednostki Ukadu SI. Jednostki uzupełniające używane w układzie SI Kąt płaski radian rad Kąt bryłowy steradian sr
 Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
STĘŻENIA STĘŻENIE PROCENTOWE STĘŻENIE MOLOWE
 STĘŻENIA STĘŻENIE PROCENTOWE 1. Oblicz stężenie procentowe roztworu powstałego w wyniku rozpuszczenia 4g chlorku sodu w 15,6dag wody. 2. Ile gramów roztworu 15-procentowego można otrzymać mając do dyspozycji
STĘŻENIA STĘŻENIE PROCENTOWE 1. Oblicz stężenie procentowe roztworu powstałego w wyniku rozpuszczenia 4g chlorku sodu w 15,6dag wody. 2. Ile gramów roztworu 15-procentowego można otrzymać mając do dyspozycji
Sprawdzian wiadomości z przyrody w klasie VI WNIKAMY W GŁĄB MATERII
 Sprawdzian wiadomości z przyrody w klasie VI WNIKAMY W GŁĄB MATERII Objaśnienia do sprawdzianu Litera oznacza poziom wymagań: K-konieczny, P-podstawowy, R-rozszerzony, D- dopełniający. Cyfra oznacza numer
Sprawdzian wiadomości z przyrody w klasie VI WNIKAMY W GŁĄB MATERII Objaśnienia do sprawdzianu Litera oznacza poziom wymagań: K-konieczny, P-podstawowy, R-rozszerzony, D- dopełniający. Cyfra oznacza numer
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
DZIA 3. CZENIE SIÊ ATOMÓW
 DZIA 3. CZENIE SIÊ ATOMÓW 1./3 Wyjaœnij, w jaki sposób powstaje: a) wi¹zanie jonowe b) wi¹zanie atomowe 2./3 Na podstawie po³o enia w uk³adzie okresowym pierwiastków: chloru i litu ustal, ile elektronów
DZIA 3. CZENIE SIÊ ATOMÓW 1./3 Wyjaœnij, w jaki sposób powstaje: a) wi¹zanie jonowe b) wi¹zanie atomowe 2./3 Na podstawie po³o enia w uk³adzie okresowym pierwiastków: chloru i litu ustal, ile elektronów
Pompy odkamieniające. Zmiana kierunku automatyczna. Zmiana kierunku ręczna. Przepływ zgodnie ze wskazówkami zegara
 Pompy odkamieniające Dostępne modele występują z ręcznym i automatycznym przełączaniem Niszczą osady po obu stronach obiegu wody przez co proces odkamieniania następuje samoczynnie, nawet przy prawie całkowicie
Pompy odkamieniające Dostępne modele występują z ręcznym i automatycznym przełączaniem Niszczą osady po obu stronach obiegu wody przez co proces odkamieniania następuje samoczynnie, nawet przy prawie całkowicie
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
EGZAMIN MATURALNY Z CHEMII
 Miejsce na naklejkę z kodem szkoły dysleksja MCH-P1_1P-072 EGZAMIN MATURALNY Z CHEMII POZIOM PODSTAWOWY MAJ ROK 2007 Czas pracy 120 minut Instrukcja dla zdającego 1. Sprawdź, czy arkusz egzaminacyjny zawiera
Miejsce na naklejkę z kodem szkoły dysleksja MCH-P1_1P-072 EGZAMIN MATURALNY Z CHEMII POZIOM PODSTAWOWY MAJ ROK 2007 Czas pracy 120 minut Instrukcja dla zdającego 1. Sprawdź, czy arkusz egzaminacyjny zawiera
Właściwości materii - powtórzenie
 Przygotowano za pomocą programu Ciekawa fizyka. Bank zadań Copyright by Wydawnictwa Szkolne i Pedagogiczne sp. z o.o., Warszawa 2011 strona 1 Imię i nazwisko ucznia Data...... Klasa... Zadanie 1. Czy zjawisko
Przygotowano za pomocą programu Ciekawa fizyka. Bank zadań Copyright by Wydawnictwa Szkolne i Pedagogiczne sp. z o.o., Warszawa 2011 strona 1 Imię i nazwisko ucznia Data...... Klasa... Zadanie 1. Czy zjawisko
Sprawozdanie z reakcji charakterystycznych anionów.
 Sprawozdanie z reakcji charakterystycznych anionów. 1.Wykrywanie obecności jonu chlorkowego Cl: Cel: Celem ćwiczenia jest wykrycie jonu Cl za pomocą reakcji charakterystycznych. 1. Do probówki wlać ok.
Sprawozdanie z reakcji charakterystycznych anionów. 1.Wykrywanie obecności jonu chlorkowego Cl: Cel: Celem ćwiczenia jest wykrycie jonu Cl za pomocą reakcji charakterystycznych. 1. Do probówki wlać ok.
 PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
Chemia. Poziom podstawowy
 Chemia Poziom podstawowy 1. a) MgO, Al O, SiO, P O 10, SO ; b) Al O, SiO, P O 10, SO ; c) Al O, SiO, P O 10, MgO; d) Al O, SiO ; e) Al O, MgO. Tlenek glinu. Reakcje tlenków z: kwasem solnym: MgO + HCl
Chemia Poziom podstawowy 1. a) MgO, Al O, SiO, P O 10, SO ; b) Al O, SiO, P O 10, SO ; c) Al O, SiO, P O 10, MgO; d) Al O, SiO ; e) Al O, MgO. Tlenek glinu. Reakcje tlenków z: kwasem solnym: MgO + HCl
Od redakcji. Symbolem oznaczono zadania wykraczające poza zakres materiału omówionego w podręczniku Fizyka z plusem cz. 2.
 Od redakcji Niniejszy zbiór zadań powstał z myślą o tych wszystkich, dla których rozwiązanie zadania z fizyki nie polega wyłącznie na mechanicznym przekształceniu wzorów i podstawieniu do nich danych.
Od redakcji Niniejszy zbiór zadań powstał z myślą o tych wszystkich, dla których rozwiązanie zadania z fizyki nie polega wyłącznie na mechanicznym przekształceniu wzorów i podstawieniu do nich danych.
Przykładowe rozwiązania zadań obliczeniowych
 1 CHEMIA zbiór zadań matura 2018 tom I Przykładowe rozwiązania zadań obliczeniowych 2 Spis treści 1.Stechiometria chemiczna... 3 2.Struktura atomu... 13 4.Kinetyka i statyka chemiczna... 14 5.Roztwory
1 CHEMIA zbiór zadań matura 2018 tom I Przykładowe rozwiązania zadań obliczeniowych 2 Spis treści 1.Stechiometria chemiczna... 3 2.Struktura atomu... 13 4.Kinetyka i statyka chemiczna... 14 5.Roztwory
3. BADA IE WYDAJ OŚCI SPRĘŻARKI TŁOKOWEJ
 1.Wprowadzenie 3. BADA IE WYDAJ OŚCI SPRĘŻARKI TŁOKOWEJ Sprężarka jest podstawowym przykładem otwartego układu termodynamicznego. Jej zadaniem jest między innymi podwyższenie ciśnienia gazu w celu: uzyskanie
1.Wprowadzenie 3. BADA IE WYDAJ OŚCI SPRĘŻARKI TŁOKOWEJ Sprężarka jest podstawowym przykładem otwartego układu termodynamicznego. Jej zadaniem jest między innymi podwyższenie ciśnienia gazu w celu: uzyskanie
Techniczne nauki М.М.Zheplinska, A.S.Bessarab Narodowy uniwersytet spożywczych technologii, Кijow STOSOWANIE PARY WODNEJ SKRAPLANIA KAWITACJI
 Techniczne nauki М.М.Zheplinska, A.S.Bessarab Narodowy uniwersytet spożywczych technologii, Кijow STOSOWANIE PARY WODNEJ SKRAPLANIA KAWITACJI SKLAROWANEGO SOKU JABŁKOWEGO Skutecznym sposobem leczenia soku
Techniczne nauki М.М.Zheplinska, A.S.Bessarab Narodowy uniwersytet spożywczych technologii, Кijow STOSOWANIE PARY WODNEJ SKRAPLANIA KAWITACJI SKLAROWANEGO SOKU JABŁKOWEGO Skutecznym sposobem leczenia soku
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH
 WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
SPORZĄDZANIE ROZTWORÓW
 1. SPORZĄDZANIE ROZTWORÓW 1. Sporządzanie roztworu CuSO 4 o stęŝeniu procentowym StęŜeniem roztworu określa się ilość substancji (wyraŝoną w jednostkach masy lub objętości) zawartą w określonej jednostce
1. SPORZĄDZANIE ROZTWORÓW 1. Sporządzanie roztworu CuSO 4 o stęŝeniu procentowym StęŜeniem roztworu określa się ilość substancji (wyraŝoną w jednostkach masy lub objętości) zawartą w określonej jednostce
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
XIII Konkurs Chemiczny dla Uczniów Szkół Średnich Etap II rozwiązania zadań
 XIII Konkurs Chemiczny dla Uczniów Szkół Średnich Etap II rozwiązania zadań UWAGI OGÓLNE: Za błędy w obliczeniu masy molowej -50% pkt. Za duże błędy rachunkowe -50 % pkt. Jeśli zadanie składało się z kilku
XIII Konkurs Chemiczny dla Uczniów Szkół Średnich Etap II rozwiązania zadań UWAGI OGÓLNE: Za błędy w obliczeniu masy molowej -50% pkt. Za duże błędy rachunkowe -50 % pkt. Jeśli zadanie składało się z kilku
Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów
 Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów Dział: Reakcje chemiczne. Podstawy obliczeń chemicznych. Kl. I LO Nr programu DKOS-4015-33-02 Nr zad. Sprawdzane wiadomości iumiejętności
Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów Dział: Reakcje chemiczne. Podstawy obliczeń chemicznych. Kl. I LO Nr programu DKOS-4015-33-02 Nr zad. Sprawdzane wiadomości iumiejętności
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.
![Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.](/thumbs/100/143872318.jpg) Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
SPIS TREŚCI. Przedmowa... 11. 1. Wybrane zagadnienia z fizyki i chemii gazów... 13
 SPIS TREŚCI Spis treści Przedmowa... 11 1. Wybrane zagadnienia z fizyki i chemii gazów... 13 1.1. Charakterystyka termodynamiczna gazów... 13 1.1.1. Stany skupienia materii... 13 1.1.2. Charakterystyka
SPIS TREŚCI Spis treści Przedmowa... 11 1. Wybrane zagadnienia z fizyki i chemii gazów... 13 1.1. Charakterystyka termodynamiczna gazów... 13 1.1.1. Stany skupienia materii... 13 1.1.2. Charakterystyka
STECHIOMETRIA SPALANIA
 STECHIOMETRIA SPALANIA Mole i kilomole Masa atomowa pierwiastka to średnia ważona mas wszystkich jego naturalnych izotopów w stosunku do 1/12 masy izotopu węgla: 1/12 126 C ~ 1,66 10-27 kg Liczba Avogadra
STECHIOMETRIA SPALANIA Mole i kilomole Masa atomowa pierwiastka to średnia ważona mas wszystkich jego naturalnych izotopów w stosunku do 1/12 masy izotopu węgla: 1/12 126 C ~ 1,66 10-27 kg Liczba Avogadra
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY
 ODPOWIEDZI I SCEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdaj cy otrzymuje punkty tylko za poprawne rozwi zania, precyzyjnie odpowiadaj ce poleceniom zawartym w zadaniach. Odpowiedzi niezgodne z poleceniem (nie
ODPOWIEDZI I SCEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdaj cy otrzymuje punkty tylko za poprawne rozwi zania, precyzyjnie odpowiadaj ce poleceniom zawartym w zadaniach. Odpowiedzi niezgodne z poleceniem (nie
5. STECHIOMETRIA. 5. Stechiometria
 5. STECHIOMETRIA 25 5. Stechiometria 5.1. Ile gramów magnezu wzięło udział w reakcji z tlenem, jeśli otrzymano 6,0 g tlenku magnezu? Odp. 3,60 g 5.2. Do 50 cm 3 roztworu kwasu siarkowego (VI) o stężeniu
5. STECHIOMETRIA 25 5. Stechiometria 5.1. Ile gramów magnezu wzięło udział w reakcji z tlenem, jeśli otrzymano 6,0 g tlenku magnezu? Odp. 3,60 g 5.2. Do 50 cm 3 roztworu kwasu siarkowego (VI) o stężeniu
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap szkolny rok szkolny 2007/2008
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap szkolny rok szkolny 2007/2008 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap szkolny rok szkolny 2007/2008 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE
 PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
3. OBLICZENIA STECHIOMETRYCZNE.
 3. OBLICZENIA STECHIOMETRYCZNE. A1 POZIOM PODSTAWOWY OBLICZENIA DOTYCZĄCE MOLA DROBIN SUBSTANCJI CHEMICZNEJ Mol stanowi porcję drobin (atomów, jonów, cząsteczek, cząstek elementarnych) każdej substancji
3. OBLICZENIA STECHIOMETRYCZNE. A1 POZIOM PODSTAWOWY OBLICZENIA DOTYCZĄCE MOLA DROBIN SUBSTANCJI CHEMICZNEJ Mol stanowi porcję drobin (atomów, jonów, cząsteczek, cząstek elementarnych) każdej substancji
MARATON WIEDZY CHEMIA CZ. II
 MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
3p - za poprawne obliczenie stężenia procentowego i molowego; 2p - za poprawne obliczenie jednej wymaganej wartości;
 Zadanie Kryteria oceniania i model odpowiedzi Punktacja 1. 2. 3. 4. 2p - za poprawne 5 połączeń w pary zdań z kolumny I i II 1p - za poprawne 4 lub 3 połączenia w pary zdań z kolumny I i II 0p - za 2 lub
Zadanie Kryteria oceniania i model odpowiedzi Punktacja 1. 2. 3. 4. 2p - za poprawne 5 połączeń w pary zdań z kolumny I i II 1p - za poprawne 4 lub 3 połączenia w pary zdań z kolumny I i II 0p - za 2 lub
Chemia nieorganiczna Zadanie Poziom: rozszerzony Punkty
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Zadanie 1. (1 pkt.) W podanym zestawie tlenków podkreśl te, które reagują z mocnymi kwasami i zasadami a nie reagują z wodą: MnO2, ZnO, CrO3, FeO,
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Zadanie 1. (1 pkt.) W podanym zestawie tlenków podkreśl te, które reagują z mocnymi kwasami i zasadami a nie reagują z wodą: MnO2, ZnO, CrO3, FeO,
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
Przykładowe rozwiązania zadań obliczeniowych
 1 CHEMIA zbiór zadań matura 2018 tom II Przykładowe rozwiązania zadań obliczeniowych 2 Spis treści 1.Węglowodory... 3 2. Alkohole, fenole... 4 3. Estry i tłuszcze... 6 6. Związki organiczne zawierające
1 CHEMIA zbiór zadań matura 2018 tom II Przykładowe rozwiązania zadań obliczeniowych 2 Spis treści 1.Węglowodory... 3 2. Alkohole, fenole... 4 3. Estry i tłuszcze... 6 6. Związki organiczne zawierające
2. Charakterystyka gazów atmosferycznych stosowanych w spawalnictwie
 Przedmowa 1. Wybrane zagadnienia z fizyki i chemii gazów 1.1. Charakterystyka termodynamiczna gazów 1.1.1. Stany skupienia materii 1.1.2. Charakterystyka gazów 1.1.3. Charakterystyka plazmy 1.1.4. Stan
Przedmowa 1. Wybrane zagadnienia z fizyki i chemii gazów 1.1. Charakterystyka termodynamiczna gazów 1.1.1. Stany skupienia materii 1.1.2. Charakterystyka gazów 1.1.3. Charakterystyka plazmy 1.1.4. Stan
Elektrochemia - prawa elektrolizy Faraday a. Zadania
 Elektrochemia - prawa elektrolizy Faraday a Zadania I prawo Faraday a Masa substancji wydzielonej na elektrodach podczas elektrolizy jest proporcjonalna do natężenia prądu i czasu trwania elektrolizy q
Elektrochemia - prawa elektrolizy Faraday a Zadania I prawo Faraday a Masa substancji wydzielonej na elektrodach podczas elektrolizy jest proporcjonalna do natężenia prądu i czasu trwania elektrolizy q
Przemiany substancji
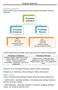 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
... Nazwisko, imię zawodnika; Klasa Liczba punktów. ... Nazwa szkoły, miejscowość. I Podkarpacki Konkurs Chemiczny 2008/09
 ......... Nazwisko, imię zawodnika; Klasa Liczba punktów KOPKCh... Nazwa szkoły, miejscowość I Podkarpacki Konkurs Chemiczny 2008/09 ETAP III 28.02.2009 r. Godz. 10.00-13.00 Zadanie 1 (10 pkt.) ( postaw
......... Nazwisko, imię zawodnika; Klasa Liczba punktów KOPKCh... Nazwa szkoły, miejscowość I Podkarpacki Konkurs Chemiczny 2008/09 ETAP III 28.02.2009 r. Godz. 10.00-13.00 Zadanie 1 (10 pkt.) ( postaw
STECHIOMETRIA SPALANIA
 STECHIOMETRIA SPALANIA Mole i kilomole Masa atomowa pierwiastka to średnia waŝona mas wszystkich jego naturalnych izotopów w stosunku do 1/12 masy izotopu węgla: 1/12 126 C ~ 1,66 10-27 kg Liczba Avogadra
STECHIOMETRIA SPALANIA Mole i kilomole Masa atomowa pierwiastka to średnia waŝona mas wszystkich jego naturalnych izotopów w stosunku do 1/12 masy izotopu węgla: 1/12 126 C ~ 1,66 10-27 kg Liczba Avogadra
IV Podkarpacki Konkurs Chemiczny 2011/12. ETAP II r. Godz Zadanie 1 (14 pkt.)
 IV Podkarpacki Konkurs Chemiczny 2011/12 KPKCh ETAP II 22.12.2011 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (14 pkt.) 1. Wskaż, która z chlorowcopochodnych
IV Podkarpacki Konkurs Chemiczny 2011/12 KPKCh ETAP II 22.12.2011 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (14 pkt.) 1. Wskaż, która z chlorowcopochodnych
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM. Chemia Poziom rozszerzony
 KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Chemia Poziom rozszerzony Listopad 01 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Chemia Poziom rozszerzony Listopad 01 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
ARMATURA GAZOWA. Słowo wstępne KATALOG PRODUKTÓW
 ARMATURA GAZOWA Słowo wstępne KATALOG PRODUKTÓW 1 Spis treści SPIS TREŚCI FM FMC FGM Filtry gazu...4 M16/RMO N.A. M16/RM N.A. Zawory odcinające normalnie otwarte...8 M16/RMO N.C. M16/RM N.C. Zawory odcinające
ARMATURA GAZOWA Słowo wstępne KATALOG PRODUKTÓW 1 Spis treści SPIS TREŚCI FM FMC FGM Filtry gazu...4 M16/RMO N.A. M16/RM N.A. Zawory odcinające normalnie otwarte...8 M16/RMO N.C. M16/RM N.C. Zawory odcinające
Materiały pomocnicze do przedmiotu Chemia I dla studentów studiów I stopnia Inżynierii Materiałowej
 Materiały pomocnicze do przedmiotu Chemia I dla studentów studiów I stopnia Inżynierii Materiałowej Opracowali: Jarosław Chojnacki i Łukasz Ponikiewski, Wydział Chemiczny, Politechnika Gdaoska, Gdaosk
Materiały pomocnicze do przedmiotu Chemia I dla studentów studiów I stopnia Inżynierii Materiałowej Opracowali: Jarosław Chojnacki i Łukasz Ponikiewski, Wydział Chemiczny, Politechnika Gdaoska, Gdaosk
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
WYDZIAŁ CHEMICZNY POLITECHNIKI WARSZAWSKIEJ ZAKŁAD TECHNOLOGII NIEORGANICZNEJ I CERAMIKI. Laboratorium PODSTAWY TECHNOLOGII CHEMICZNEJ
 WYDZIAŁ CHMICZNY POLITCHNIKI WARSZAWSKIJ ZAKŁAD TCHNOLOGII NIORGANICZNJ I CRAMIKI Laboratorium PODSTAWY TCHNOLOGII CHMICZNJ Instrukcja do ćwiczenia pt. OCZYSZCZANI POWITRZA Z LOTNYCH ZWIĄZKÓW ORGANICZNYCH
WYDZIAŁ CHMICZNY POLITCHNIKI WARSZAWSKIJ ZAKŁAD TCHNOLOGII NIORGANICZNJ I CRAMIKI Laboratorium PODSTAWY TCHNOLOGII CHMICZNJ Instrukcja do ćwiczenia pt. OCZYSZCZANI POWITRZA Z LOTNYCH ZWIĄZKÓW ORGANICZNYCH
Atom poziom rozszerzony
 Atom poziom rozszerzony Zadanie 1. (1 pkt) Źródło: CKE 010 (PR), zad. 1. Atomy pierwiastka X tworz jony X 3+, których konfiguracj elektronow mo na zapisa : 1s s p 6 3s 3p 6 3d 10 Uzupe nij poni sz tabel,
Atom poziom rozszerzony Zadanie 1. (1 pkt) Źródło: CKE 010 (PR), zad. 1. Atomy pierwiastka X tworz jony X 3+, których konfiguracj elektronow mo na zapisa : 1s s p 6 3s 3p 6 3d 10 Uzupe nij poni sz tabel,
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2015/2016
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2015/2016 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2015/2016 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych
 Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych 1. Wielkości i jednostki stosowane do wyrażania ilości materii 1.1 Masa atomowa, cząsteczkowa, mol Masa atomowa Atomy mają
Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych 1. Wielkości i jednostki stosowane do wyrażania ilości materii 1.1 Masa atomowa, cząsteczkowa, mol Masa atomowa Atomy mają
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
g % ,3%
 PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
dr inż. Marlena Gąsior-Głogowska 9 Lista 1
 dr inż. Marlena Gąsior-Głogowska 9 Lista 1 1. Ile atomów znajduje się w 0,25 mola amoniaku? 2. Ile atomów wodoru znajduje się w trzech molach metanu? 3. Która z próbek zawiera więcej atomów: mol wodoru
dr inż. Marlena Gąsior-Głogowska 9 Lista 1 1. Ile atomów znajduje się w 0,25 mola amoniaku? 2. Ile atomów wodoru znajduje się w trzech molach metanu? 3. Która z próbek zawiera więcej atomów: mol wodoru
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Temat: Czy świetlówki energooszczędne są oszczędne i sprzyjają ochronie środowiska? Imię i nazwisko
 Temat: Czy świetlówki energooszczędne są oszczędne i sprzyjają ochronie środowiska? Karta pracy III.. Imię i nazwisko klasa Celem nauki jest stawianie hipotez, a następnie ich weryfikacja, która w efekcie
Temat: Czy świetlówki energooszczędne są oszczędne i sprzyjają ochronie środowiska? Karta pracy III.. Imię i nazwisko klasa Celem nauki jest stawianie hipotez, a następnie ich weryfikacja, która w efekcie
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów. 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań Maksymalna liczba punktów 40. 90% 36 pkt. Uwaga! 1. Wszystkie
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań Maksymalna liczba punktów 40. 90% 36 pkt. Uwaga! 1. Wszystkie
Procentowa zawartość sodu (w molu tej soli są dwa mole sodu) wynosi:
 Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 2018/2019. Etap wojewódzki
 Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 08/09 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 08/09 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY
 Próbny egzamin maturalny z chemii 0r. ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach.
Próbny egzamin maturalny z chemii 0r. ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach.
PRÓBNY EGZAMIN MATURALNY Z CHEMII
 Miejsce na naklejkę z kodem szkoły dysleksja PRÓBNY EGZAMIN MATURALNY Z CEMII POZIOM PODSTAWOWY Czas pracy 120 minut Instrukcja dla zdającego 1. Sprawdź, czy arkusz egzaminacyjny zawiera 12 stron (zadania
Miejsce na naklejkę z kodem szkoły dysleksja PRÓBNY EGZAMIN MATURALNY Z CEMII POZIOM PODSTAWOWY Czas pracy 120 minut Instrukcja dla zdającego 1. Sprawdź, czy arkusz egzaminacyjny zawiera 12 stron (zadania
Olej rzepakowy, jako paliwo do silników z zapłonem samoczynnym
 Coraz częściej jako paliwo stosuje się biokomponenty powstałe z roślin oleistych. Nie mniej jednak właściwości fizykochemiczne oleju napędowego i oleju powstałego z roślin znacząco różnią się miedzy sobą.
Coraz częściej jako paliwo stosuje się biokomponenty powstałe z roślin oleistych. Nie mniej jednak właściwości fizykochemiczne oleju napędowego i oleju powstałego z roślin znacząco różnią się miedzy sobą.
Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne)
 Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne) Zadanie 7 (1 pkt) Uporządkuj podane ilości moli związków chemicznych według rosnącej liczby
Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne) Zadanie 7 (1 pkt) Uporządkuj podane ilości moli związków chemicznych według rosnącej liczby
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.mcs-przychodnia.pl
 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.mcs-przychodnia.pl Warszawa: Dostawa materiałów i wypełnień stomatologicznych dla Mazowieckiego
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.mcs-przychodnia.pl Warszawa: Dostawa materiałów i wypełnień stomatologicznych dla Mazowieckiego
XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019. ETAP I r. Godz Zadanie 1 (10 pkt)
 XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019 ETAP I 9.11.2018 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh 27 Zadanie 1 (10 pkt) 1. W atomie glinu ( 1Al)
XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019 ETAP I 9.11.2018 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh 27 Zadanie 1 (10 pkt) 1. W atomie glinu ( 1Al)
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY
 ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne z poleceniem
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne z poleceniem
WZÓR UMOWY UMOWA NR. z siedzibą w... NIP nr, REGON... wpisaną do Krajowego Rejestru Sądowego nr... w Sądzie...
 Załącznik nr 6 do SIWZ WZÓR UMOWY UMOWA NR zawarta w dniu pomiędzy: Prezesem Kasy Rolniczego Ubezpieczenia Społecznego z siedzibą w Warszawie, przy Al. Niepodległości 190, reprezentowanym przez: dyrektora
Załącznik nr 6 do SIWZ WZÓR UMOWY UMOWA NR zawarta w dniu pomiędzy: Prezesem Kasy Rolniczego Ubezpieczenia Społecznego z siedzibą w Warszawie, przy Al. Niepodległości 190, reprezentowanym przez: dyrektora
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 STOPIEŃ WOJEWÓDZKI 9 MARCA 2018 R.
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów możliwa
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów możliwa
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 2017/2018. Etap wojewódzki
 Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 07/08 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 07/08 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
Zadania dodatkowe z konwersatorium z podstaw chemii Semestr letni, rok akademicki 2012/2013
 Zadania dodatkowe z konwersatorium z podstaw chemii Semestr letni, rok akademicki 2012/2013 Gazy. Jednostki ciśnienia. Podstawowe prawa gazowe 1. Jakie ciśnienie będzie panowało w oponie napompowanej w
Zadania dodatkowe z konwersatorium z podstaw chemii Semestr letni, rok akademicki 2012/2013 Gazy. Jednostki ciśnienia. Podstawowe prawa gazowe 1. Jakie ciśnienie będzie panowało w oponie napompowanej w
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Spis treści. I. Wstęp... 11. II. Chemiczna analiza wody i ścieków... 12
 Spis treści I. Wstęp... 11 II. Chemiczna analiza wody i ścieków... 12 1. Zasadowość... 12 1.1. Wprowadzenie... 12 1.2. Oznaczanie zasadowości ogólnej metodą miareczkową wobec wskaźnika metylooranżu...
Spis treści I. Wstęp... 11 II. Chemiczna analiza wody i ścieków... 12 1. Zasadowość... 12 1.1. Wprowadzenie... 12 1.2. Oznaczanie zasadowości ogólnej metodą miareczkową wobec wskaźnika metylooranżu...
DE-WZP.261.11.2015.JJ.3 Warszawa, 2015-06-15
 DE-WZP.261.11.2015.JJ.3 Warszawa, 2015-06-15 Wykonawcy ubiegający się o udzielenie zamówienia Dotyczy: postępowania prowadzonego w trybie przetargu nieograniczonego na Usługę druku książek, nr postępowania
DE-WZP.261.11.2015.JJ.3 Warszawa, 2015-06-15 Wykonawcy ubiegający się o udzielenie zamówienia Dotyczy: postępowania prowadzonego w trybie przetargu nieograniczonego na Usługę druku książek, nr postępowania
