Ćwiczenie 1 Roztwory, rozpuszczalność, stężenia.
|
|
|
- Amelia Orzechowska
- 7 lat temu
- Przeglądów:
Transkrypt
1 Ćwiczenie 1 Roztwoy, ozpuszczalność, stężenia. Roztwoy są ieszaninai, składającyi się pzynajniej z dwóch składników. Jeden ze składników, użyty w nadiaze stanowi fazę dyspesyjną (fazę ozpaszającą), dugi fazę zdyspegowaną (fazę ozpaszaną). Podział oztwoów: a. oztwoy zeczywiste (właściwe): śednica cząsteczek substancji ozposzonej w ośodku ozpaszający jest w pzybliżeniu ówna śednicy ośodka ozpaszającego i wynosi od do Roztwoy właściwe stanowią układy hoogeniczne, w któych nie ożna wyodębnić składników np. ieszanina wody i cuku. b. oztwoy koloidalne: śednica cząsteczek substancji ozposzonej jest większa od śednicy cząsteczek ośodka ozpaszającego ; jej wielkość waha się w ganicach od 10-9 do c. zawiesiny: śednica cząsteczek substancji ozposzonej jest większa od śednicy cząsteczek ośodka ozpaszającego i wznosi powyżej Koloidy i zawiesiny zalicza się do układów heteogenicznych o ozdobnieniu akoskopowy. Roztwoy zeczywiste (właściwe). W oztwoach tych jedny ze składników jest ozpuszczalnik ( najczęściej woda, ale oże być użyty alkohol, ete, benzyna, aceton), a pozostałe składniki stanowią substancję ozposzoną Rozpuszczalność. echą chaakteystyczną dla każdej substancji jest ozpuszczalność. Rozpuszczalnością nazywa się aksyalną liczbę gaów substancji, któą ożna w danej tepeatuze i pod dany ciśnienie ozpuścić w 100 g ozpuszczalnika. Rozpuszczalność substancji jest ówna stężeniu oztwou nasyconego. Roztwó nasycony zawiea tyle substancji ozpuszczonej, ile oże jej aksyalnie zawieać twoząc twały układ w danej tepeatuze i pod dany ciśnienie. Roztwó nienasycony oztwó, w któy w danej tepeatuze ożna ozpuścić dodatkową ilość substancji. 1
2 Rozpuszczalność substancji zależy od : 1. odzaju ozpuszczanej substancji (substancje o budowie polanej lepiej się ozpuszczają w ozpuszczalnikach polanych, a substancje o budowie niepolanej lepiej ozpuszczają się w ozpuszczalnikach niepolanych), 2. odzaju ozpuszczalnika,. tepeatuy (ozpuszczalność ciał stałych w cieczach ośnie ze wzoste tepeatuy, ozpuszczalność gazów w cieczach aleje ze wzoste tepeatuy), 4. ciśnienia (ozpuszczalność gazów w cieczach ośnie ze wzoste ciśnienia). Z ozpuszczalnością związane jest pojęcie solwatacji otaczanie cząsteczek substancji ozpuszczonej cząsteczkai ozpuszczalnika. W pzypadku, kiedy ozpuszczalnikie jest woda ówi się o hydatacji. Różnice w ozpuszczalności wykozystuje się do oczyszczania substancji pzez kystalizację. Poces ozpuszczania jest pocese fizyczny, po usunięciu ozpuszczalnika uzyskujey tę saą substancję, któą upzednio ozpuszczaliśy. heicy opócz pocesu ozpuszczania wyóżniają jeszcze poces oztwazania. Poces oztwazania to eakcja cheiczna. Po wzuceniu opiłków żelaza do kwasu siakowego obsewujey oztwozenie się etalu w kwasie. Fe + H 2 SO 4 Fe SO 4 + H 2 Po zakończeniu pocesu i odpaowaniu ozpuszczalnika (kwasu) nie uzyskay etalicznego żelaza, lecz sól siaczan VI żelaza II. 2
3 Stężenia. Zawatość składnika w oztwoze ożna wyazić za poocą stężeń. Stężenie pocentowe oztwou % wyażone w pocentach asowych oznacza liczbę gaów substancji ozpuszczonej, zawatej w 100 g oztwou. Stężenie oztwou wyażone w pocentach objętościowych oznacza liczbę centyetów sześciennych substancji ozpuszczonej, zawatej w 100 c oztwou. s % 100% gdzie: s asa lub objętość substancji ozpuszczonej, asa lub objętość oztwou s + ozp ozp asa lub objętość ozpuszczalnika. Stężenie olowe oztwou oznacza liczbę oli substancji ozpuszczonej, zawatej w 1 d oztwou, wyaża się w ol d -. n ol V d gdzie: n - liczba oli substancji ozpuszczonej - asa substancji M - asa olowa substancji V - objętość oztwou [d ] n V M V Do okeślania stężeń składników oztwou stosuje się ównież ułaki olowe. Stężenie składnika oztwou wyażone w ułaku olowy jest to stosunek liczby oli tego składnika do suy liczby oli wszystkich składników oztwou. Dla oztwou wieloskładnikowego, o składnikach n 1, n 2.n i ułaek olowy X 1 składnika n 1 wynosi: X 1 n1 n + n n i Sua ułaków olowych wszystkich składników oztwou jest zawsze ówna jedności. Do pzeliczania stężeń olowego na pocentowe potzebna jest znajoość gęstości oztwou ( d ) d V
4 gdzie: - asa oztwou [ g lub kg ] V - objętość oztwou [ c lub d ] g kg d - gęstość oztwou[ lub ] c d M - asa olowa substancji % d 100% M % M 100% d Pzykłady obliczeń dla oztwoów pocentowych. Pzykład I Jakie jest stężenie pocentowe oztwou otzyanego pzez ozpuszczenie 40g soli w 200g wody? dane: s asa substancji 40g ozp. asa ozpuszczalnika 200g obliczyć: % sposób 1 Najpiew obliczay asę otzyanego oztwou. s + ozp 40g soli + 200g wody 240g Więc z popocji : w 240g oztwou jest 40g substancji z definicji % w 100g oztwou X g substancji 100g 40g x 240g 16,66 g subs tan cji Z definicji stężenia pocentowego ilość g substancji zawata w 100g oztwou wyaża stężenie tego oztwou. odp: Stężenie otzyanego oztwou wynosi 16,66% 4
5 sposób 2 Podstawiając do wzou z definicji stężenia pocentowego 40g *100% 200g + 40g s % ozp + s 16,66% odp: Stężenie otzyanego oztwou wynosi 16,66% Pzykład II Ile gaów kwasu salicylowego należy ozpuścić w etanolu, aby otzyać 250g 2% oztwou (tzw. spiytus salicylowy)? dane: % 2% asa oztwou 250g obliczyć: s asa substancji - kwasu salicylowego Sposób 1 Masę kwasu salicylowego obliczay z popocji: 250g oztwou stanowi 100% x g stanowi 2% 2g 250g x 5g 100% Należy odważyć 5 gaów kwasu salicylowego. Sposób 2 Kozystając z def. % s % 100% % po pzekształceniu tego wzou otzyujey s 100% 2% 250g s 5g 100% Należy odważyć 5 gaów kwasu salicylowego. 250 g oztwou 5 g substancji 245 g ozpuszczalnika Odp. Należy ozpuścić 5 g kwasu salicylowego w 245 g etanolu by otzyać 250 g etanolowego oztwou. 5
6 Pzykład III Ile gaów siaczanu iedzi należy odważyć do spoządzenia 150 gaów 5% oztwou tej soli? Najpiew należy zauważyć, że siaczan iedzi kystalizuje w postaci uwodnionej soli uso4 5H 2O 5-hydat siaczanu VI iedzi II dane: % 5% 150g obliczyć: s asa soli uwodnionej Z popocji obliczy asę uso 4 jaki a być w oztwoze 100g oztwou 5 g soli 150g oztwou x g soli 150g 5g x 7, 5 100g g soli bezwodnej Następnie obliczy z popocji, w jakiej ilości soli uwodnionej gaa soli bezwodnej. W ty celu obliczay asę olową. uso4 5H 2O znajduje się 7,5 M H 6,54 + 2,06 + (4 15,99) + 5 (2 1, ,99) 2 159, ,95 249,51 uso4 5 O M uso 4 159,56 z popocji 249,51g - 159,56g xg - 7,5g 7,5g 249,51g x 11, 7g 159,56g odp. Należy odważyć 11,7g soli uwodnionej (5-hydatu siaczanu VI iedzi II) 6
7 Pzykład IV Ile gaów sachaozy należy odważyć oaz jaką objętość wody należy odiezyć, aby spoządzić 00 c 15% oztwou? dane : % 15% V 15% 00c obliczyć : s asa substancji (sachaozy) V ozp objętość ozpuszczalnika (wody) Najpiew usiy obliczyć asę oztwou, czyli ile waży 00c 15% oztwou sachaozy V d 15% Gęstość sachaozy d 15% odczytay z odpowiednich tablic w Poadniku fizykocheiczny: d 15% 1,05916 g/c Stąd 00c * 1,05916 g/c 17,75 g Następnie z popocji obliczay: 100g oztwou - 15 g substancji 17,75g oztwou - x g 17,75g 15g x 47, 66g 100g Należy odważyć 47,66 g sachaozy. A ile wody? Skoo asa całego oztwou wynosi 17,75 g to oztwou - substancji ozpuszczalnika 17,75g 47,66g 270,09g Należy odważyć 270,09 g wody. W pzypadku cieczy zazwyczaj odiezay jej objętość należy więc obliczyć, jaką objętość ozpuszczalnika, w ty pzykładzie wody należy odiezyć. Pzekształcay podany wcześniej wzó: g V d 1g / c c H 2O d g / c V 270,09g 270, 09c 1g / c wody wody dh 2O odp. W celu spoządzenia 00 c 15% oztwou sachaozy należy odważyć 47,66g sachaozy i odiezyć 270,1 c wody. 7
8 Pzykłady obliczeń dla oztwoów olowych. Stężenie olowe oztwou okeśla ile oli substancji ozpuszczonej znajduje się w 1 d (1000 c ) oztwou. Okeślenie, że oztwó jest 2, olowy oznacza, że w 1000 c tego oztwou znajduje się 2, ola ozpuszczonej substancji. Ten sposób okeślania stężenia jest szczególnie pzydatny, gdyż uożliwia łatwe okeślanie stechioetycznych zależności poiędzy dwoa substancjai eagującyi w postaci oztwoów. 1. Ile gaów wodootlenku sodu (NaOH) znajduje się w 10 c 2,1 olowego oztwou? Najpiew obliczay asę olową NaOH : M NaOH 22,99g + 15,99g + 1,00g 9,98 g Z definicji oztwou olowego: 1 olowy oztwó to taki, gdy w 1000 c znajduje się 1 ol NaOH (9,98g). Kozystając z popocji 1-9,98g NaOH 2,1 - X g NaOH 92,5g NaOH c X - 10 c X 0,925g NaOH 2,1 9,98g x 92,5g NaOH w 1000 c 1 Odp. W 10 c 2,1 olowego oztwou znajduje się 0,925g NaOH. 2. W 250 c oztwou znajduje się 0,4904g kwasu siakowego. Obliczyć stężenie olowe tego kwasu. Obliczay asę olową H 2 SO 4 : M H 2 SO 4 2 1,00 + 2, ,99 98,08g w 250 c oztwou znajduje się 0,4904g H 2 SO 4, a zate w 1000c X g H 2 SO 4 0,4904g 1000c X 1,9616 gh 2SO 250c z def., gdy 98,08g H 2 SO 4 w 1000 c oztwou - to 1 olowy 1,9616g H 2 SO 4 w 1000 c oztwou - to X olowy 4 8
9 1,9616 1ol X 0,02 ola 98,08g / ol Stężenie olowe tego kwasu wynosi 0,02 ola. Ten sa wynik otzyuje się ównież, obliczając najpiew liczbę oli, któej odpowiada 0,4904g H 2 SO 4 98,08g - 1 ol 0,4904g - X oli 0,4909g X 0,005 ola 98,08g następnie z popocji 250 c oztwou zawiea 0,005 ola H 2 SO c oztwou zawiea X ola H 2 SO 4 X 0, c 0,02 ola 250c. Ile gaów sody kystalicznej Na 2 O 10 H 2 O ( 10-hydatu węglanu sodu) należy odważyć do spoządzenia 500 c oztwou o stężeniu 0,1 olowy? Obliczay asę cząsteczkową soli: M Na 2 O 10H 2 O 2 22, , , ( 2 1, ,99 ) 285,86g 285,86g substancji w 1000 c oztwou - to oztwó 1 olowy X g substancji w 1000 c oztwou - to oztwó 0,1 olowy 9 0,1 285,86 g X 28,29 g substancji w 1000 c 1 w 1000 c - 28,586g substancji w 500 c - X g substancji X 500c 28,586g 14,29 g substancji 1000c Odp. Należy odważyć 14,29 g Na 2 O 10 H 2 O by spoządzić 500 c 0,1 oztwou tej soli. 9
10 Spoządzanie oztwoów o zadany stężeniu pocentowy. Pzystępując do spoządzania oztwou o okeślony stężeniu należy najpiew wykonać stosowne obliczenia ilości substancji, któa a być ozpuszczona i ilość ozpuszczalnika koniecznego do spoządzenia danego oztwou. Następnie należy pzygotować naczynia, w któych będziey ozpuszczać. Zazwyczaj są to szklane kolby stożkowe lub zlewki, ale powinny być dobane pojenością tak, by pozwalały na swobodne ieszanie pzygotowanego oztwou. Obliczoną ilość substancji odważa się na wadze z dokładnością 0,01 g w naczyńku wagowy lub na szkiełku zegakowy, oczywiście upzednio zważony na tej saej wadze. W cylindze lub zlewce pzygotowujey obliczoną i odiezoną ilość ozpuszczalnika, któą użyjey do spoządzenia oztwou. Odważoną substancję pzenosiy ilościowo, tzn. pzepłukując kilkakotnie ałyi pocjai odiezonego ozpuszczalnika do pzygotowanego naczynia. Rozpuszczay substancję całkowicie, a następnie doleway esztę pzygotowanego ozpuszczalnika. ałość otzyanego oztwou dokładnie ieszay, ożna użyć szklanego pęcika. Jeśli oztwó a być pzechowywany to pzenosi (pzelewa) się go do zaykanych naczyń szklanych lub polietylenowych i opisuje. Opis, zazwyczaj na etykiecie butelki podaje infoację o zawatości tj. o odzaju oztwou, jego stężeniu i dacie spoządzenia oztwou. W atestowanych laboatoiach podawane jest także kto wykonał oztwó. Dokładność spoządzenia oztwou ożna spawdzić ieząc gęstość oztwou za poocą aeoetu i poównując z wielkościai podanyi w tabelach uwzględniając watość tepeatuy w waunkach dokonanego poiau. 10
11 Spoządzanie oztwoów o zadany stężeniu olowy. Pzed pzystąpienie do spoządzenia oztwou o zadany stężeniu olowy wykonujey stosowne obliczenia asy lub objętości substancji, któa posłuży do pzygotowania oztwou. Następnie pzygotowujey odpowiednie tzn. o okeślonej objętości naczynie iaowe. Najczęściej oztwoy spoządza się w kolbach iaowych. Są to szklane kolby płaskodenne z długii, wąskii szyjai zaykane dopasowany kokie. Na wydłużonej szyjce kolby iaowej zaznaczona jest keska oznaczająca dokładnie okeśloną objętość. Jeśli do spoządzenia oztwou o okeślony stężeniu olowy posłuży na substancja stała, to pzygotowujey tzw. naważkę. Najpiew ważyy naczyńko wagowe lub szkiełko zegakowe na wadze z dokładnością 0,0001 g. Następnie odważay obliczoną ilość substancji na tej saej wadze. Kolejna czynność polega na ilościowy pzeniesieniu odważonej substancji (naważki) do kolby iaowej. Uieszczay w szyjce lejek szklany i ałyi pocjai ozpuszczalnika pzenosiy substancję do kolby. Na koniec spłukujey naczyńko i lejek ozpuszczalnikie, wpowadzając w ten sposób esztki substancji do kolby. Dopowadzay do całkowitego ozpuszczenia substancji. Badzo ostożnie dopełniay do keski, dodając koplai, po szyjce kolby ozpuszczalnik do osiągnięcia enisku wklęsłego. Zaykay kolbę kokie i ponownie dokładnie ieszay. Tak pzygotowane oztwoy ogą służyć do oznaczeń ilościowych. Jeśli do spoządzania oztwou o okeślony stężeniu olowy używay substancji ciekłej lub oztwou o znany stężeniu to obliczoną ilość substancji odiezay odpowiednią pipetą. Pipety to szklane uki zakończone kapilaą, posiadające podziałkę lub keskę okeślającą pojeność danej pipety. Służy ona do dokładnego odiezania okeślonej objętości cieczy. Pzy taki spoządzaniu oztwou olowego, pzenosiy pipetą odiezoną ilość substancji do kolby iaowej. Dodajey pewną ilość ozpuszczalnika i dopowadzay do wyieszania się obu cieczy. Następnie analogicznie jak popzednio uzupełniając ozpuszczalnikie do keski (dolny enisk) wyznaczającej objętość kolby iaowej. Ponieważ pzy spoządzaniu oztwoów o ściśle okeślony stężeniu nie jesteśy w stanie ustzec się pewnych błędów np. błąd ważenia, błąd pzeniesienia itp., zeczywiste stężenie oztwou wyznacza się wykonując oznaczenie ilościowe analizą iaeczkową. Rozszezenie zagadnień pouszanych na ćwiczeniach znajduje się w skypcie : "Ćwiczenia z cheii dla studentów towaoznawstwa", E. Kondatowicz-Pietuszka., L. Ostasz., Wydawnictwo AE w Kakowie. 11
Opracowała: mgr inż. Ewelina Nowak
 Mateiały dydaktyczne na zajęcia wyównawcze z cheii dla studentów piewszego oku kieunku zaawianego Inżynieia Śodowiska w aach pojektu Ea inżyniea pewna lokata na pzyszłość Opacowała: g inż. Ewelina Nowak
Mateiały dydaktyczne na zajęcia wyównawcze z cheii dla studentów piewszego oku kieunku zaawianego Inżynieia Śodowiska w aach pojektu Ea inżyniea pewna lokata na pzyszłość Opacowała: g inż. Ewelina Nowak
Spis treści I. Ilościowe określenia składu roztworów strona II. Obliczenia podczas sporządzania roztworów
 Sps teśc I. Iloścowe okeślena składu oztwoów stona Ułaek wagowy (asowy ocent wagowy (asowy ocent objętoścowy Ułaek olowy 3 ocent olowy 3 Stężene olowe 3 Stężene pocentowe 3 Stężene noalne 4 Stężene olane
Sps teśc I. Iloścowe okeślena składu oztwoów stona Ułaek wagowy (asowy ocent wagowy (asowy ocent objętoścowy Ułaek olowy 3 ocent olowy 3 Stężene olowe 3 Stężene pocentowe 3 Stężene noalne 4 Stężene olane
MASA ATOMOWA STECHIOMETRIA
 MASA ATOMOWA wzorce: J. Dalton wodór J.J. Berzelius tlen od 1961 r. skala oparta na węglu 12 { 12 98,89%; 13 1,11%} 12 6 ato 6n + 6p + 6e Jednostka asy atoowej jest to 1 / 12 asy atou węgla 12 j..a. 1
MASA ATOMOWA wzorce: J. Dalton wodór J.J. Berzelius tlen od 1961 r. skala oparta na węglu 12 { 12 98,89%; 13 1,11%} 12 6 ato 6n + 6p + 6e Jednostka asy atoowej jest to 1 / 12 asy atou węgla 12 j..a. 1
MIANOWANE ROZTWORY KWASÓW I ZASAD, MIARECZKOWANIE JEDNA Z PODSTAWOWYCH TECHNIK W CHEMII ANALITYCZNEJ
 4 MIANOWANE ROZTWORY KWASÓW I ZASAD, MIARECZKOWANIE JEDNA Z PODSTAWOWYCH TECHNIK W CHEMII ANALITYCZNEJ CEL ĆWICZENIA Poznanie podstawowego sprzętu stosowanego w miareczkowaniu, sposoby przygotowywania
4 MIANOWANE ROZTWORY KWASÓW I ZASAD, MIARECZKOWANIE JEDNA Z PODSTAWOWYCH TECHNIK W CHEMII ANALITYCZNEJ CEL ĆWICZENIA Poznanie podstawowego sprzętu stosowanego w miareczkowaniu, sposoby przygotowywania
Ćwiczenie 1. Sporządzanie roztworów, rozcieńczanie i określanie stężeń
 Ćwiczenie 1 Sporządzanie roztworów, rozcieńczanie i określanie stężeń Stężenie roztworu określa ilość substancji (wyrażoną w jednostkach masy lub objętości) zawartą w określonej jednostce objętości lub
Ćwiczenie 1 Sporządzanie roztworów, rozcieńczanie i określanie stężeń Stężenie roztworu określa ilość substancji (wyrażoną w jednostkach masy lub objętości) zawartą w określonej jednostce objętości lub
Czas zajęć: 1 godzina z 2 przeznaczonych na temat w rozkładzie materiału;
 Anna Chielewska Krzysztofik Nauczyciel cheii Zespół Szkół Mechanicznych w Lublinie Lublin, dn. 11.01.2005 Scenariusz zajęć edukacyjnych z cheii opracowany dla klasy 1At Techniku Mechanicznego na podstawie
Anna Chielewska Krzysztofik Nauczyciel cheii Zespół Szkół Mechanicznych w Lublinie Lublin, dn. 11.01.2005 Scenariusz zajęć edukacyjnych z cheii opracowany dla klasy 1At Techniku Mechanicznego na podstawie
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM. Chemia Poziom rozszerzony
 KRYTERIA OCENIANIA ODPOWIEDZI Póbna Matua z OPERONEM Chemia Poziom ozszezony Listopad W niniejszym schemacie oceniania zadań otwatych są pezentowane pzykładowe popawne odpowiedzi. W tego typu ch należy
KRYTERIA OCENIANIA ODPOWIEDZI Póbna Matua z OPERONEM Chemia Poziom ozszezony Listopad W niniejszym schemacie oceniania zadań otwatych są pezentowane pzykładowe popawne odpowiedzi. W tego typu ch należy
WAGI I WAŻENIE. ROZTWORY
 Ćwiczenie 2 WAGI I WAŻENIE. ROZTWORY Obowiązujące zagadnienia: Dokładność, precyzja, odtwarzalność, powtarzalność pomiaru; Rzetelność, czułość wagi; Rodzaje błędów pomiarowych, błąd względny, bezwzględny
Ćwiczenie 2 WAGI I WAŻENIE. ROZTWORY Obowiązujące zagadnienia: Dokładność, precyzja, odtwarzalność, powtarzalność pomiaru; Rzetelność, czułość wagi; Rodzaje błędów pomiarowych, błąd względny, bezwzględny
Ćwiczenie 1. Technika ważenia oraz wyznaczanie błędów pomiarowych. Ćwiczenie 2. Sprawdzanie pojemności pipety
 II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
III A. Roztwory i reakcje zachodzące w roztworach wodnych
 III A. Roztwory i reakcje zachodzące w roztworach wodnych III-A Przygotowywanie roztworów o różnym stężeniu III-A.1. Przygotowanie naważki substancji III-A.2. Przygotowanie 70 g 10% roztworu NaCl III-A.3.
III A. Roztwory i reakcje zachodzące w roztworach wodnych III-A Przygotowywanie roztworów o różnym stężeniu III-A.1. Przygotowanie naważki substancji III-A.2. Przygotowanie 70 g 10% roztworu NaCl III-A.3.
Rozważymy nieskończony strumień płatności i obliczymy jego wartość teraźniejszą.
 Renty wieczyste Rozważyy nieskończony stuień płatności i obliczyy jego watość teaźniejszą Najpiew ozważy entę wieczystą polegającą na wypłacie jp co ok Jeśli piewsza płatność jest w chwili, to ówiy o encie
Renty wieczyste Rozważyy nieskończony stuień płatności i obliczyy jego watość teaźniejszą Najpiew ozważy entę wieczystą polegającą na wypłacie jp co ok Jeśli piewsza płatność jest w chwili, to ówiy o encie
PRACOWNIA ANALIZY ILOŚCIOWEJ. Analiza substancji biologicznie aktywnej w preparacie farmaceutycznym kwas acetylosalicylowy
 PRACOWNIA ANALIZY ILOŚCIOWEJ Analiza substancji biologicznie aktywnej w preparacie farmaceutycznym kwas acetylosalicylowy Ćwiczenie obejmuje: 1. Oznaczenie jakościowe kwasu acetylosalicylowego 2. Przygotowanie
PRACOWNIA ANALIZY ILOŚCIOWEJ Analiza substancji biologicznie aktywnej w preparacie farmaceutycznym kwas acetylosalicylowy Ćwiczenie obejmuje: 1. Oznaczenie jakościowe kwasu acetylosalicylowego 2. Przygotowanie
Wyznaczenie gęstości cieczy za pomocą wagi hydrostatycznej. Spis przyrządów: waga techniczna (szalkowa), komplet odważników, obciążnik, ławeczka.
 Cel ćwiczenia: WYZNACZANIE GĘSTOŚCI CIECZY ZA POMOCĄ WAGI HYDROSTATYCZNEJ Wyznaczenie gęstości cieczy za poocą wagi hydrostatycznej. Spis przyrządów: waga techniczna (szalkowa), koplet odważników, obciążnik,
Cel ćwiczenia: WYZNACZANIE GĘSTOŚCI CIECZY ZA POMOCĄ WAGI HYDROSTATYCZNEJ Wyznaczenie gęstości cieczy za poocą wagi hydrostatycznej. Spis przyrządów: waga techniczna (szalkowa), koplet odważników, obciążnik,
2. Procenty i stężenia procentowe
 2. PROCENTY I STĘŻENIA PROCENTOWE 11 2. Procenty i stężenia procentowe 2.1. Oblicz 15 % od liczb: a. 360, b. 2,8 10 5, c. 0.024, d. 1,8 10 6, e. 10 Odp. a. 54, b. 4,2 10 4, c. 3,6 10 3, d. 2,7 10 7, e.
2. PROCENTY I STĘŻENIA PROCENTOWE 11 2. Procenty i stężenia procentowe 2.1. Oblicz 15 % od liczb: a. 360, b. 2,8 10 5, c. 0.024, d. 1,8 10 6, e. 10 Odp. a. 54, b. 4,2 10 4, c. 3,6 10 3, d. 2,7 10 7, e.
PODSTAWOWE TECHNIKI PRACY LABORATORYJNEJ: WAŻENIE, SUSZENIE, STRĄCANIE OSADÓW, SĄCZENIE
 PODSTAWOWE TECHNIKI PRACY LABORATORYJNEJ: WAŻENIE, SUSZENIE, STRĄCANIE OSADÓW, SĄCZENIE CEL ĆWICZENIA Zapoznanie studenta z podstawowymi technikami pracy laboratoryjnej: ważeniem, strącaniem osadu, sączeniem
PODSTAWOWE TECHNIKI PRACY LABORATORYJNEJ: WAŻENIE, SUSZENIE, STRĄCANIE OSADÓW, SĄCZENIE CEL ĆWICZENIA Zapoznanie studenta z podstawowymi technikami pracy laboratoryjnej: ważeniem, strącaniem osadu, sączeniem
Energia kinetyczna i praca. Energia potencjalna
 negia kinetyczna i paca. negia potencjalna Wykład 4 Wocław Univesity of Technology 1 NRGIA KINTYCZNA I PRACA 5.XI.011 Paca Kto wykonał większą pacę? Hossein Rezazadeh Olimpiada w Atenach 004 WR Podzut
negia kinetyczna i paca. negia potencjalna Wykład 4 Wocław Univesity of Technology 1 NRGIA KINTYCZNA I PRACA 5.XI.011 Paca Kto wykonał większą pacę? Hossein Rezazadeh Olimpiada w Atenach 004 WR Podzut
Hydrostatyka. Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 Hydostatyka Pojekt współfinansowany pzez Unię Euopejską w aach Euopejskiego Funduszu Społecznego Hydostatyka Hydostatyka zajuje się opise echaniki płynów w stanie spoczynku. Płynai będziey nazywać tu zaówno
Hydostatyka Pojekt współfinansowany pzez Unię Euopejską w aach Euopejskiego Funduszu Społecznego Hydostatyka Hydostatyka zajuje się opise echaniki płynów w stanie spoczynku. Płynai będziey nazywać tu zaówno
Wykład 15. Reinhard Kulessa 1
 Wykład 5 9.8 Najpostsze obwody elektyczne A. Dzielnik napięcia. B. Mostek Wheatstone a C. Kompensacyjna metoda pomiau siły elektomotoycznej D. Posty układ C. Pąd elektyczny w cieczach. Dysocjacja elektolityczna.
Wykład 5 9.8 Najpostsze obwody elektyczne A. Dzielnik napięcia. B. Mostek Wheatstone a C. Kompensacyjna metoda pomiau siły elektomotoycznej D. Posty układ C. Pąd elektyczny w cieczach. Dysocjacja elektolityczna.
Otrzymywanie siarczanu(vi) amonu i żelaza(ii) soli Mohra (NH 4 ) 2 Fe(SO 4 ) 2 6H 2 O
 Otrzymywanie siarczanu(vi) amonu i żelaza(ii) soli Mohra (NH 4 ) 2 Fe(SO 4 ) 2 6H 2 O Odczynniki: stały Fe(SO) 4 7H 2 O, stały (NH 4 ) 2 SO 4, H 2 O dest. Sprzęt laboratoryjny: elektryczna płyta grzewcza,
Otrzymywanie siarczanu(vi) amonu i żelaza(ii) soli Mohra (NH 4 ) 2 Fe(SO 4 ) 2 6H 2 O Odczynniki: stały Fe(SO) 4 7H 2 O, stały (NH 4 ) 2 SO 4, H 2 O dest. Sprzęt laboratoryjny: elektryczna płyta grzewcza,
Synteza Cu(CH 3 COO) 2 H 2 O oraz (NH 4 ) 2 Ni(SO 4 ) 2 6H 2 O
 ĆWICZENIE 2 Synteza Cu(CH 3 COO) 2 H 2 O oraz (NH 4 ) 2 Ni(SO 4 ) 2 6H 2 O 1. Zakres materiału Podstawowe czynności w laboratorium chemicznym (ogrzewanie substancji, filtracja, ważenie substancji, itp.).
ĆWICZENIE 2 Synteza Cu(CH 3 COO) 2 H 2 O oraz (NH 4 ) 2 Ni(SO 4 ) 2 6H 2 O 1. Zakres materiału Podstawowe czynności w laboratorium chemicznym (ogrzewanie substancji, filtracja, ważenie substancji, itp.).
VII Podkarpacki Konkurs Chemiczny 2014/15. ETAP II r. Godz Zadanie 1 (11 pkt)
 VII Podkarpacki Konkurs heiczny 2014/15 KPKh ETAP II 20.12.2014 r. Godz. 10.302.30...... Nazwisko, iię Szkoła, iejscowość Rec. I Rec. II Tabela wyników Zad.1 Zad.2 Zad.3 Sua Wynik końcowy Uwaga! Masy olowe
VII Podkarpacki Konkurs heiczny 2014/15 KPKh ETAP II 20.12.2014 r. Godz. 10.302.30...... Nazwisko, iię Szkoła, iejscowość Rec. I Rec. II Tabela wyników Zad.1 Zad.2 Zad.3 Sua Wynik końcowy Uwaga! Masy olowe
Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 Zajęcia 3 Roztwory, typy roztworów, stężenie procentowe, molowe, objętościowe Pod pojęciem roztworu rozumiemy jednolite substancje składające się przynajmniej z dwóch składników. Jednolite tzn. takie które
Zajęcia 3 Roztwory, typy roztworów, stężenie procentowe, molowe, objętościowe Pod pojęciem roztworu rozumiemy jednolite substancje składające się przynajmniej z dwóch składników. Jednolite tzn. takie które
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
- Chemia w kosmetologii dla liceum - Metody analityczne w przemyśle kosmetycznym - Ćwiczenie 3
 - Cheia w kosetologii dla liceu - Metody analityczne w przeyśle kosetyczny - Ćwiczenie 3 Teat: Oznaczanie zawartości nadtlenku wodoru w preparatach do trwałej ondulacji Cel ćwiczenia: Poznanie właściwości
- Cheia w kosetologii dla liceu - Metody analityczne w przeyśle kosetyczny - Ćwiczenie 3 Teat: Oznaczanie zawartości nadtlenku wodoru w preparatach do trwałej ondulacji Cel ćwiczenia: Poznanie właściwości
Otrzymywanie siarczanu(vi) amonu i żelaza(ii) woda (1/6) soli Mohra (NH4)2Fe(SO4)2 6H2O
 Otrzymywanie siarczanu(vi) amonu i żelaza(ii) woda (1/6) soli Mohra (NH4)2Fe(SO4)2 6H2O Odczynniki: stały Fe(SO) 4 7H 2O, stały (NH 4) 2SO 4, H 2O dest. Sprzęt laboratoryjny: zlewki (50, 100 cm 3 ), cylinder
Otrzymywanie siarczanu(vi) amonu i żelaza(ii) woda (1/6) soli Mohra (NH4)2Fe(SO4)2 6H2O Odczynniki: stały Fe(SO) 4 7H 2O, stały (NH 4) 2SO 4, H 2O dest. Sprzęt laboratoryjny: zlewki (50, 100 cm 3 ), cylinder
Krystyna Gronostaj Maria Nowotny-Różańska Katedra Chemii i Fizyki, FIZYKA Uniwersytet Rolniczy do użytku wewnętrznego ĆWICZENIE 4
 Kystyna Gonostaj Maia Nowotny-Różańska Katea Cheii i Fizyki, FIZYKA Uniwesytet Rolniczy o użytku wewnętznego ĆWICZENIE 4 WYZNACZANIE GĘSTOŚCI CIAŁ STAŁYCH I CIECZY PRZY POMOCY PIKNOMETRU Kaków, 2004-2012
Kystyna Gonostaj Maia Nowotny-Różańska Katea Cheii i Fizyki, FIZYKA Uniwesytet Rolniczy o użytku wewnętznego ĆWICZENIE 4 WYZNACZANIE GĘSTOŚCI CIAŁ STAŁYCH I CIECZY PRZY POMOCY PIKNOMETRU Kaków, 2004-2012
Grawitacyjna energia potencjalna gdy U = 0 w nieskończoności. w funkcji r
 Wykład z fizyki Piot Posykiewicz 113 Ponieważ, ważne są tylko ziany enegii potencjalnej, ożey pzyjąć, że enegia potencjalna jest ówna zeo w dowolny położeniu. Powiezchnia iei oże być odpowiedni wyboe w
Wykład z fizyki Piot Posykiewicz 113 Ponieważ, ważne są tylko ziany enegii potencjalnej, ożey pzyjąć, że enegia potencjalna jest ówna zeo w dowolny położeniu. Powiezchnia iei oże być odpowiedni wyboe w
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru
 1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
Zadanie: 2 (1 pkt) Zmieszano 100 g 30% roztworu azotanu (V) sodu z 500 g wody. Oblicz Cp otrzymanego roztworu.
 Zadanie: 1 (1 pkt) Oblicz rozpuszczalność chlorowodoru (HCl) w wodzie, jeśli wiesz, że stężony kwas solny, czyli nasycony wodny roztwór chlorowodoru ma stężenie 36%. Zadanie: 2 (1 pkt) Zmieszano 100 g
Zadanie: 1 (1 pkt) Oblicz rozpuszczalność chlorowodoru (HCl) w wodzie, jeśli wiesz, że stężony kwas solny, czyli nasycony wodny roztwór chlorowodoru ma stężenie 36%. Zadanie: 2 (1 pkt) Zmieszano 100 g
Graf skierowany. Graf zależności dla struktur drzewiastych rozgrywających parametrycznie
 Gaf skieowany Gaf skieowany definiuje się jako upoządkowaną paę zbioów. Piewszy z nich zawiea wiezchołki gafu, a dugi składa się z kawędzi gafu, czyli upoządkowanych pa wiezchołków. Ruch po gafie możliwy
Gaf skieowany Gaf skieowany definiuje się jako upoządkowaną paę zbioów. Piewszy z nich zawiea wiezchołki gafu, a dugi składa się z kawędzi gafu, czyli upoządkowanych pa wiezchołków. Ruch po gafie możliwy
ĆWICZENIE 0 SPRAWDZANIE NACZYŃ MIAROWYCH
 ĆWICZENIE 0 HARMONOGRAM ZAJĘĆ LABORATORYJNYCH SPRAWDZANIE NACZYŃ MIAROWYCH Dział Nuer ćwiczenia 0. Ćwiczenia organizacyjne Sprawdzanie naczyń iarowych Tytuł ćwiczenia 1. Oznaczanie kwasowości i zasadowości
ĆWICZENIE 0 HARMONOGRAM ZAJĘĆ LABORATORYJNYCH SPRAWDZANIE NACZYŃ MIAROWYCH Dział Nuer ćwiczenia 0. Ćwiczenia organizacyjne Sprawdzanie naczyń iarowych Tytuł ćwiczenia 1. Oznaczanie kwasowości i zasadowości
ĆWICZENIE NR 2,3. Zakład Budownictwa Ogólnego
 Zakład Budownictwa Ogólnego ĆWICZENIE NR 2,3 Materiały kaienne - oznaczenie gęstości objętościowej i porowatości otwartej - oznaczenie gęstości i porowatości całkowitej Instrukcja z laboratoriu: Budownictwo
Zakład Budownictwa Ogólnego ĆWICZENIE NR 2,3 Materiały kaienne - oznaczenie gęstości objętościowej i porowatości otwartej - oznaczenie gęstości i porowatości całkowitej Instrukcja z laboratoriu: Budownictwo
CEL ĆWICZENIA Zapoznanie studentów z chemią 14 grupy pierwiastków układu okresowego
 16 SOLE KWASU WĘGLOWEGO CEL ĆWICZENIA Zapoznanie studentów z chemią 14 grupy pierwiastków układu okresowego Zakres obowiązującego materiału Węgiel i pierwiastki 14 grupy układu okresowego, ich związki
16 SOLE KWASU WĘGLOWEGO CEL ĆWICZENIA Zapoznanie studentów z chemią 14 grupy pierwiastków układu okresowego Zakres obowiązującego materiału Węgiel i pierwiastki 14 grupy układu okresowego, ich związki
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA
 Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Materiał powtórzeniowy do sprawdzianu - roztwory i sposoby wyrażania stężeń roztworów, rozcieńczanie i zatężanie roztworów, zadania z rozwiązaniami
 Materiał powtórzeniowy do sprawdzianu - roztwory i sposoby wyrażania stężeń roztworów, rozcieńczanie i zatężanie roztworów, zadania z rozwiązaniami I. Mieszaniny Mieszanina to układ przynajmniej dwuskładnikowy
Materiał powtórzeniowy do sprawdzianu - roztwory i sposoby wyrażania stężeń roztworów, rozcieńczanie i zatężanie roztworów, zadania z rozwiązaniami I. Mieszaniny Mieszanina to układ przynajmniej dwuskładnikowy
Pędu Momentu pędu Ładunku Liczby barionowej. Przedmiot: Fizyka. Przedmiot: Fizyka. Wydział EAIiE Kierunek: Elektrotechnika.
 ZASADY ZACHOWANIA W FIZYCE ZASADY ZACHOWANIA: Enegii Pęd Moent pęd Ładnk Liczby baionowej ZASADA ZACHOWANIA ENERGII W = E calk Paca siły zewnętznej Jeżeli W=0 to E calk =0 Ziana enegii całkowitej Ziana
ZASADY ZACHOWANIA W FIZYCE ZASADY ZACHOWANIA: Enegii Pęd Moent pęd Ładnk Liczby baionowej ZASADA ZACHOWANIA ENERGII W = E calk Paca siły zewnętznej Jeżeli W=0 to E calk =0 Ziana enegii całkowitej Ziana
ELEKTROLIZA. Oznaczenie równoważnika elektrochemicznego miedzi oraz stałej Faradaya.
 ELEKTROLIZA Cel ćwiczenia Oznaczenie równoważnika elektrocheicznego iedzi oraz stałej Faradaya. Zakres wyaganych wiadoości. Elektroliza i jej prawa.. Procesy elektrodowe. 3. Równoważniki cheiczne i elektrocheiczne.
ELEKTROLIZA Cel ćwiczenia Oznaczenie równoważnika elektrocheicznego iedzi oraz stałej Faradaya. Zakres wyaganych wiadoości. Elektroliza i jej prawa.. Procesy elektrodowe. 3. Równoważniki cheiczne i elektrocheiczne.
Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.
![Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów. Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.](/thumbs/97/131732752.jpg) 2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
METODY STATYCZNE Metody pomiaru twardości.
 METODY STATYCZNE Metody pomiau twadości. Opacował: XXXXXXXX studia inŝynieskie zaoczne wydział mechaniczny semest V Gdańsk 00. Cel ćwiczenia. Celem ćwiczenia jest zapoznanie się z metodami pomiaów twadości,
METODY STATYCZNE Metody pomiau twadości. Opacował: XXXXXXXX studia inŝynieskie zaoczne wydział mechaniczny semest V Gdańsk 00. Cel ćwiczenia. Celem ćwiczenia jest zapoznanie się z metodami pomiaów twadości,
PRACA MOC ENERGIA. Z uwagi na to, że praca jest iloczynem skalarnym jej wartość zależy również od kąta pomiędzy siłą F a przemieszczeniem r
 PRACA MOC ENERGIA Paca Pojęcie pacy używane jest zaówno w fizyce (w sposób ścisły) jak i w życiu codziennym (w sposób potoczny), jednak obie te definicje nie pokywają się Paca w sensie potocznym to każda
PRACA MOC ENERGIA Paca Pojęcie pacy używane jest zaówno w fizyce (w sposób ścisły) jak i w życiu codziennym (w sposób potoczny), jednak obie te definicje nie pokywają się Paca w sensie potocznym to każda
WYKŁAD 1. W przypadku zbiornika zawierającego gaz, stan układu jako całości jest opisany przez: temperaturę, ciśnienie i objętość.
 WYKŁAD 1 Pzedmiot badań temodynamiki. Jeśli chcemy opisać układ złożony z N cząstek, to możemy w amach mechaniki nieelatywistycznej dla każdej cząstki napisać ównanie uchu: 2 d i mi = Fi, z + Fi, j, i,
WYKŁAD 1 Pzedmiot badań temodynamiki. Jeśli chcemy opisać układ złożony z N cząstek, to możemy w amach mechaniki nieelatywistycznej dla każdej cząstki napisać ównanie uchu: 2 d i mi = Fi, z + Fi, j, i,
Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia. Zdolność do wykonywania pracy lub produkowania ciepła
 Jak miezyć i jak liczyć efekty cieplne eakcji? Enegia Zdolność do wykonywania pacy lub podukowania ciepła Paca objętościowa paca = siła odległość 06_73 P = F A W = F h N m = J P = F A Aea = A ciśnienie
Jak miezyć i jak liczyć efekty cieplne eakcji? Enegia Zdolność do wykonywania pacy lub podukowania ciepła Paca objętościowa paca = siła odległość 06_73 P = F A W = F h N m = J P = F A Aea = A ciśnienie
Rodzajowy rachunek kosztów Wycena zuŝycia materiałów
 Rodzajowy achunek kosztów (wycena zuŝycia mateiałów) Wycena zuŝycia mateiałów ZuŜycie mateiałów moŝe być miezone, wyceniane, dokumentowane i ewidencjonowane w óŝny sposób. Stosowane metody wywieają jednak
Rodzajowy achunek kosztów (wycena zuŝycia mateiałów) Wycena zuŝycia mateiałów ZuŜycie mateiałów moŝe być miezone, wyceniane, dokumentowane i ewidencjonowane w óŝny sposób. Stosowane metody wywieają jednak
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA
 Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Z roztworami za pan brat, nie tylko w laboratorium
 Z roztworami za pan brat, nie tylko w laboratorium Zajęcia realizowane metodą przewodniego tekstu Cel główny: Przygotowanie roztworów o określonym stężeniu. Treści kształcenia zajęć interdyscyplinarnych:
Z roztworami za pan brat, nie tylko w laboratorium Zajęcia realizowane metodą przewodniego tekstu Cel główny: Przygotowanie roztworów o określonym stężeniu. Treści kształcenia zajęć interdyscyplinarnych:
Materiały dodatkowe do zajęć z chemii dla studentów
 SPOSOBY WYRAŻANIA STĘŻEŃ ROZTWORÓW Materiały dodatkowe do zajęć z chemii dla studentów Opracowała dr Anna Wisła-Świder STĘŻENIA ROZTWORÓW Roztwory są to układy jednofazowe (fizycznie jednorodne) dwu- lub
SPOSOBY WYRAŻANIA STĘŻEŃ ROZTWORÓW Materiały dodatkowe do zajęć z chemii dla studentów Opracowała dr Anna Wisła-Świder STĘŻENIA ROZTWORÓW Roztwory są to układy jednofazowe (fizycznie jednorodne) dwu- lub
OBLICZENIA STECHIOMETRIA STECHIOMETRIA: INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH
 1 OBLICZENIA STECHIOMETRIA STECHIOMETRIA: INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH Np.: WYZNACZANIE ILOŚCI SUBSTRATÓW KONIECZNYCH DLA OTRZYMANIA OKREŚLONYCH ILOŚCI PRODUKTU PODSTAWY OBLICZEŃ CHEMICZNYCH
1 OBLICZENIA STECHIOMETRIA STECHIOMETRIA: INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH Np.: WYZNACZANIE ILOŚCI SUBSTRATÓW KONIECZNYCH DLA OTRZYMANIA OKREŚLONYCH ILOŚCI PRODUKTU PODSTAWY OBLICZEŃ CHEMICZNYCH
Układ Otoczenie Faza układu Składnik układu Układ dyspersyjny
 ROZTWORY - STĘŻENIA Chemia roztworów Układ wyodrębniony obszar materii oddzielony od otoczenia wyraźnymi granicami Otoczenie to wszystko co się znajduje poza układem Faza układu jednorodna pod względem
ROZTWORY - STĘŻENIA Chemia roztworów Układ wyodrębniony obszar materii oddzielony od otoczenia wyraźnymi granicami Otoczenie to wszystko co się znajduje poza układem Faza układu jednorodna pod względem
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje rejonowe II stopień
 POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
Dobór zmiennych objaśniających do liniowego modelu ekonometrycznego
 Dobó zmiennych objaśniających do liniowego modelu ekonometycznego Wstępnym zadaniem pzy budowie modelu ekonometycznego jest okeślenie zmiennych objaśniających. Kyteium wybou powinna być meytoyczna znajomość
Dobó zmiennych objaśniających do liniowego modelu ekonometycznego Wstępnym zadaniem pzy budowie modelu ekonometycznego jest okeślenie zmiennych objaśniających. Kyteium wybou powinna być meytoyczna znajomość
STECHIOMETRIA REAKCJI CHEMICZNYCH OBLICZENIA CHEMICZNE
 STECHIOMETRIA REAKCJI CHEMICZNYCH OBLICZENIA CHEMICZNE Jak wygląda Olipiada? Zawody Olipiady są czterostopniowe: Etap Wstępny - polega na saodzielny rozwiązywaniu zadań zaieszczonych w Inforatorze Olipiady,
STECHIOMETRIA REAKCJI CHEMICZNYCH OBLICZENIA CHEMICZNE Jak wygląda Olipiada? Zawody Olipiady są czterostopniowe: Etap Wstępny - polega na saodzielny rozwiązywaniu zadań zaieszczonych w Inforatorze Olipiady,
009 Ile gramów jodu i ile mililitrów alkoholu etylowego (gęstość 0,78 g/ml) potrzeba do sporządzenia 15 g jodyny, czyli 10% roztworu jodu w alkoholu e
 STĘŻENIA - MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Ile gramów wodnego roztworu azotanu sodu o stężeniu 10,0% można przygotować z 25,0g NaNO3? 002 Ile gramów kwasu siarkowego zawiera 25 ml jego
STĘŻENIA - MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Ile gramów wodnego roztworu azotanu sodu o stężeniu 10,0% można przygotować z 25,0g NaNO3? 002 Ile gramów kwasu siarkowego zawiera 25 ml jego
Opracował: dr inż. Tadeusz Lemek
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Siła. Zasady dynamiki
 Siła. Zasady dynaiki Siła jest wielkością wektoową. Posiada okeśloną watość, kieunek i zwot. Jednostką siły jest niuton (N). 1N=1 k s 2 Pzedstawienie aficzne A Siła pzyłożona jest do ciała w punkcie A,
Siła. Zasady dynaiki Siła jest wielkością wektoową. Posiada okeśloną watość, kieunek i zwot. Jednostką siły jest niuton (N). 1N=1 k s 2 Pzedstawienie aficzne A Siła pzyłożona jest do ciała w punkcie A,
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE
 PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
PODSTAWOWE TECHNIKI PRACY LABORATORYJNEJ: OCZYSZCZANIE SUBSTANCJI PRZEZ DESTYLACJĘ I EKSTRAKCJĘ
 3 PODSTAWOWE TECHNIKI PRACY LABORATORYJNEJ: OCZYSZCZANIE SUBSTANCJI PRZEZ DESTYLACJĘ I EKSTRAKCJĘ CEL ĆWICZENIA Zapoznanie studenta z metodami rozdziału mieszanin na drodze destylacji i ekstrakcji. Zakres
3 PODSTAWOWE TECHNIKI PRACY LABORATORYJNEJ: OCZYSZCZANIE SUBSTANCJI PRZEZ DESTYLACJĘ I EKSTRAKCJĘ CEL ĆWICZENIA Zapoznanie studenta z metodami rozdziału mieszanin na drodze destylacji i ekstrakcji. Zakres
K05 Instrukcja wykonania ćwiczenia
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego K05 Instrukcja wykonania ćwiczenia Wyznaczanie punktu izoelektrycznego żelatyny metodą wiskozymetryczną Zakres zagadnień obowiązujących do ćwiczenia 1. Układy
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego K05 Instrukcja wykonania ćwiczenia Wyznaczanie punktu izoelektrycznego żelatyny metodą wiskozymetryczną Zakres zagadnień obowiązujących do ćwiczenia 1. Układy
NOMINALNA STOPA PROCENTOWA stopa oprocentowania przyjęta w okresie bazowym; nie uwzględnia skutków kapitalizacji odsetek
 Symbole: nominalna stopa pocentowa ( od stu ) n ilość okesów (lat, miesięcy, kwatałów etc.) m ilość podokesów (np. stopa pocentowa podana jest w skali oku; kapitalizacja miesięczna m=12) d stopa dyskontowa
Symbole: nominalna stopa pocentowa ( od stu ) n ilość okesów (lat, miesięcy, kwatałów etc.) m ilość podokesów (np. stopa pocentowa podana jest w skali oku; kapitalizacja miesięczna m=12) d stopa dyskontowa
gdzie m w określa masę węglowodoru, a m r masę całego roztworu. Wyniki zanotować w tabeli. cpods
 Oznaczanie węglowodorów ropopochodnych w wodach i ściekach z zastosowanie techniki analizy fazy nadpowierzchniowej i chroatografii gazowej (Headspace-CG-MS) Wykonanie ćwiczenia Materiały, przyrządy i odczynniki:
Oznaczanie węglowodorów ropopochodnych w wodach i ściekach z zastosowanie techniki analizy fazy nadpowierzchniowej i chroatografii gazowej (Headspace-CG-MS) Wykonanie ćwiczenia Materiały, przyrządy i odczynniki:
WYZNACZANIE RÓWNOWAŻNIKA CHEMICZNEGO ORAZ MASY ATOMOWEJ MAGNEZU I CYNY
 14 WYZNACZANIE RÓWNOWAŻNIKA CHEMICZNEGO ORAZ MASY ATOMOWEJ MAGNEZU I CYNY CEL ĆWICZENIA: Wyznaczanie równoważnika chemicznego oraz masy atomowej magnezu i cyny na podstawie pomiaru objętości wodoru wydzielonego
14 WYZNACZANIE RÓWNOWAŻNIKA CHEMICZNEGO ORAZ MASY ATOMOWEJ MAGNEZU I CYNY CEL ĆWICZENIA: Wyznaczanie równoważnika chemicznego oraz masy atomowej magnezu i cyny na podstawie pomiaru objętości wodoru wydzielonego
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA
 Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2019 ZASADY OCENIANIA
 Układ graficzny CKE 2019 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie arkusza: A.60-01-19.01 Oznaczenie kwalifikacji: A.60 zadania: 01 Kod ośrodka Kod egzaminatora EGZAMIN POTWIERDZAJĄCY
Układ graficzny CKE 2019 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie arkusza: A.60-01-19.01 Oznaczenie kwalifikacji: A.60 zadania: 01 Kod ośrodka Kod egzaminatora EGZAMIN POTWIERDZAJĄCY
Przejmowanie ciepła przy konwekcji swobodnej w przestrzeni ograniczonej (szczeliny)
 inż. Michał Stzeszewski 0-006 Pzejowanie ciepła pzy konwekcji swobonej w pzestzeni oganiczonej (szczeliny) Zaania o saozielnego ozwiązania v. 0.. powazenie celu uposzczenia achunkowego ozwiązania zjawiska
inż. Michał Stzeszewski 0-006 Pzejowanie ciepła pzy konwekcji swobonej w pzestzeni oganiczonej (szczeliny) Zaania o saozielnego ozwiązania v. 0.. powazenie celu uposzczenia achunkowego ozwiązania zjawiska
WYZNACZANIE ROZMIARÓW
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 6 WYZNACZANIE ROZMIARÓW MAKROCZĄSTECZEK I. WSTĘP TEORETYCZNY Procesy zachodzące między atomami lub cząsteczkami w skali molekularnej
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 6 WYZNACZANIE ROZMIARÓW MAKROCZĄSTECZEK I. WSTĘP TEORETYCZNY Procesy zachodzące między atomami lub cząsteczkami w skali molekularnej
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
Rozważymy nieskończony strumień płatności i obliczymy jego wartość teraźniejszą.
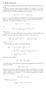 Renty wieczyste Rozważyy nieskończony stuień płatności i obliczyy jego watość teaźniejszą Najpiew ozważy entę wieczystą polegającą na wypłacie jp co ok Jeśli piewsza płatność jest w chwili to ówiy o encie
Renty wieczyste Rozważyy nieskończony stuień płatności i obliczyy jego watość teaźniejszą Najpiew ozważy entę wieczystą polegającą na wypłacie jp co ok Jeśli piewsza płatność jest w chwili to ówiy o encie
ĆWICZENIE 3 CIEPŁO ROZPUSZCZANIA I NEUTRALIZACJI
 ĆWICZENIE 3 CIEPŁO ROZPUSZCZANIA I NEUTRALIZACJI Przybory i odczynniki Kalorymetr NaOH w granulkach Mieszadło KOH w granulkach Cylinder miarowy 50 ml 4n HCl 4 Szkiełka zegarowe 4N HNO 3 Termometr (dokładność
ĆWICZENIE 3 CIEPŁO ROZPUSZCZANIA I NEUTRALIZACJI Przybory i odczynniki Kalorymetr NaOH w granulkach Mieszadło KOH w granulkach Cylinder miarowy 50 ml 4n HCl 4 Szkiełka zegarowe 4N HNO 3 Termometr (dokładność
ĆWICZENIE 5. KOPOLIMERYZACJA STYRENU Z BEZWODNIKIEM MALEINOWYM (polimeryzacja w roztworze)
 ĆWICZENIE 5 KOPOLIMERYZACJA STYRENU Z BEZWODNIKIEM MALEINOWYM (polimeryzacja w roztworze) Celem ćwiczenia jest zapoznanie studentów z metodą polimeryzacji w roztworze oraz badaniem składu powstałego kopolimeru.
ĆWICZENIE 5 KOPOLIMERYZACJA STYRENU Z BEZWODNIKIEM MALEINOWYM (polimeryzacja w roztworze) Celem ćwiczenia jest zapoznanie studentów z metodą polimeryzacji w roztworze oraz badaniem składu powstałego kopolimeru.
Regulamin BHP pracowni chemicznej. Pokaz szkła. Technika pracy laboratoryjnej
 I. Regulamin BHP pracowni chemicznej. Pokaz szkła. Technika pracy laboratoryjnej Zagadnienia Regulamin bezpieczeństwa i higiena pracy w laboratorium chemicznym Organizacja stanowiska pracy Ochrona przeciwpożarowa
I. Regulamin BHP pracowni chemicznej. Pokaz szkła. Technika pracy laboratoryjnej Zagadnienia Regulamin bezpieczeństwa i higiena pracy w laboratorium chemicznym Organizacja stanowiska pracy Ochrona przeciwpożarowa
Mechanika ogólna. Więzy z tarciem. Prawa tarcia statycznego Coulomba i Morena. Współczynnik tarcia. Tarcie statyczne i kinetyczne.
 Więzy z tacie Mechanika oólna Wykład n Zjawisko tacia. awa tacia. awa tacia statyczneo Couloba i Moena Siła tacia jest zawsze pzeciwna do występująceo lub ewentualneo uchu. Wielkość siły tacia jest niezależna
Więzy z tacie Mechanika oólna Wykład n Zjawisko tacia. awa tacia. awa tacia statyczneo Couloba i Moena Siła tacia jest zawsze pzeciwna do występująceo lub ewentualneo uchu. Wielkość siły tacia jest niezależna
Wykład 17. 13 Półprzewodniki
 Wykład 17 13 Półpzewodniki 13.1 Rodzaje półpzewodników 13.2 Złącze typu n-p 14 Pole magnetyczne 14.1 Podstawowe infomacje doświadczalne 14.2 Pąd elektyczny jako źódło pola magnetycznego Reinhad Kulessa
Wykład 17 13 Półpzewodniki 13.1 Rodzaje półpzewodników 13.2 Złącze typu n-p 14 Pole magnetyczne 14.1 Podstawowe infomacje doświadczalne 14.2 Pąd elektyczny jako źódło pola magnetycznego Reinhad Kulessa
MECHANIKA PŁYNÓW LABORATORIUM
 MECHANIKA PŁYNÓW LABORATORIUM Ćwiczenie nr 7 Waga hydrostatyczna, wypór. Cele ćwiczenia jest wyznaczenie gęstości ciał stałych za poocą wagi hydrostatycznej i porównanie tej etody z etodai, w których ierzona
MECHANIKA PŁYNÓW LABORATORIUM Ćwiczenie nr 7 Waga hydrostatyczna, wypór. Cele ćwiczenia jest wyznaczenie gęstości ciał stałych za poocą wagi hydrostatycznej i porównanie tej etody z etodai, w których ierzona
Wyznaczanie profilu prędkości płynu w rurociągu o przekroju kołowym
 1.Wpowadzenie Wyznaczanie pofilu pędkości płynu w uociągu o pzekoju kołowym Dla ustalonego, jednokieunkowego i uwastwionego pzepływu pzez uę o pzekoju kołowym ównanie Naviea-Stokesa upaszcza się do postaci
1.Wpowadzenie Wyznaczanie pofilu pędkości płynu w uociągu o pzekoju kołowym Dla ustalonego, jednokieunkowego i uwastwionego pzepływu pzez uę o pzekoju kołowym ównanie Naviea-Stokesa upaszcza się do postaci
Jednostki Ukadu SI. Jednostki uzupełniające używane w układzie SI Kąt płaski radian rad Kąt bryłowy steradian sr
 Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
Zakres wymagań z przedmiotu CHEMIA ANALITYCZNA dla II roku OML
 Zakres wymagań z przedmiotu CHEMIA ANALITYCZNA dla II roku OML Znajomości klasycznych metod analizy ilościowej: wagowej i objętościowej (redoksymetrii, alkacymetrii, argentometrii i kompleksometrii) Zagadnienia
Zakres wymagań z przedmiotu CHEMIA ANALITYCZNA dla II roku OML Znajomości klasycznych metod analizy ilościowej: wagowej i objętościowej (redoksymetrii, alkacymetrii, argentometrii i kompleksometrii) Zagadnienia
Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych Oznaczenie kwalifikacji: A.59 Numer zadania: 01
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2019 ZASADY OCENIANIA
 Układ graficzny CKE 2019 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2019 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Układ graficzny CKE 2019 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2019 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
ĆWICZENIE 4 OZNACZANIE TWARDOŚCI WODY. WPROWADZENIE
 Wydział Geodezji Górniczej i Inżynierii Środowiska I rok, Kierunek: Inżynieria Środowiska Przediot: Cheia Typ zajęć: Laboratoriu ĆWICZENIE 4 OZNACZANIE TWARDOŚCI WODY. WPROWADZENIE Twardość wody jest jej
Wydział Geodezji Górniczej i Inżynierii Środowiska I rok, Kierunek: Inżynieria Środowiska Przediot: Cheia Typ zajęć: Laboratoriu ĆWICZENIE 4 OZNACZANIE TWARDOŚCI WODY. WPROWADZENIE Twardość wody jest jej
Zadanie: 1 (1pkt) Zadanie: 2 (1 pkt)
 Zadanie: 1 (1pkt) Stężenie procentowe nasyconego roztworu azotanu (V) ołowiu (II) Pb(NO 3 ) 2 w temperaturze 20 0 C wynosi 37,5%. Rozpuszczalność tej soli w podanych warunkach określa wartość: a) 60g b)
Zadanie: 1 (1pkt) Stężenie procentowe nasyconego roztworu azotanu (V) ołowiu (II) Pb(NO 3 ) 2 w temperaturze 20 0 C wynosi 37,5%. Rozpuszczalność tej soli w podanych warunkach określa wartość: a) 60g b)
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2019 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 01
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 01
RÓWNOWAŻNIKI W REAKCJACH UTLENIAJĄCO- REDUKCYJNYCH
 8 RÓWNOWAŻNIKI W REAKCJACH UTLENIAJĄCO- REDUKCYJNYCH CEL ĆWICZENIA Wyznaczenie gramorównoważników chemicznych w procesach redoks na przykładzie KMnO 4 w środowisku kwaśnym, obojętnym i zasadowym z zastosowaniem
8 RÓWNOWAŻNIKI W REAKCJACH UTLENIAJĄCO- REDUKCYJNYCH CEL ĆWICZENIA Wyznaczenie gramorównoważników chemicznych w procesach redoks na przykładzie KMnO 4 w środowisku kwaśnym, obojętnym i zasadowym z zastosowaniem
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018. Eliminacje szkolne
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów ierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach rojektu Era inżyniera ewna lokata na rzyszłość Oracowała: mgr inż.
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów ierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach rojektu Era inżyniera ewna lokata na rzyszłość Oracowała: mgr inż.
Modelowanie przepływu cieczy przez ośrodki porowate Wykład III
 Modelowanie pzepływu cieczy pzez ośodki poowate Wykład III 6 Ogólne zasady ozwiązywania ównań hydodynamicznego modelu pzepływu. Metody ozwiązania ównania Laplace a. Wpowadzenie wielkości potencjału pędkości
Modelowanie pzepływu cieczy pzez ośodki poowate Wykład III 6 Ogólne zasady ozwiązywania ównań hydodynamicznego modelu pzepływu. Metody ozwiązania ównania Laplace a. Wpowadzenie wielkości potencjału pędkości
1. Ciało sztywne, na które nie działa moment siły pozostaje w spoczynku lub porusza się ruchem obrotowym jednostajnym.
 Wykład 3. Zasada zachowania momentu pędu. Dynamika punktu mateialnego i były sztywnej. Ruch obotowy i postępowy Większość ciał w pzyodzie to nie punkty mateialne ale ozciągłe ciała sztywne tj. obiekty,
Wykład 3. Zasada zachowania momentu pędu. Dynamika punktu mateialnego i były sztywnej. Ruch obotowy i postępowy Większość ciał w pzyodzie to nie punkty mateialne ale ozciągłe ciała sztywne tj. obiekty,
Ćwiczenia nr 2: Stężenia
 Ćwiczenia nr 2: Stężenia wersja z 5 listopada 2007 1. Ile gramów fosforanu(v) sodu należy zużyć w celu otrzymania 2,6kg 6,5% roztworu tego związku? 2. Ile należy odważyć KOH i ile zużyć wody do sporządzenia
Ćwiczenia nr 2: Stężenia wersja z 5 listopada 2007 1. Ile gramów fosforanu(v) sodu należy zużyć w celu otrzymania 2,6kg 6,5% roztworu tego związku? 2. Ile należy odważyć KOH i ile zużyć wody do sporządzenia
Zadanie: 1 (1 pkt) Oblicz stężenie molowe jonów OH w roztworze otrzymanym przez rozpuszczenie 12g NaOH w wodzie i rozcieńczonego do 250cm 3
 Zadanie: 1 (1 pkt) Oblicz stężenie molowe jonów OH w roztworze otrzymanym przez rozpuszczenie 12g NaOH w wodzie i rozcieńczonego do 250cm 3 Zadanie: 2 (1 pkt) Do 20cm 3 20% roztworu kwasu solnego o gęstości
Zadanie: 1 (1 pkt) Oblicz stężenie molowe jonów OH w roztworze otrzymanym przez rozpuszczenie 12g NaOH w wodzie i rozcieńczonego do 250cm 3 Zadanie: 2 (1 pkt) Do 20cm 3 20% roztworu kwasu solnego o gęstości
8. MANGANOMETRIA. 8. Manganometria
 8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
POLITECHNIKA WARSZAWSKA Wydział Budownictwa, Mechaniki i Petrochemii Instytut Inżynierii Mechanicznej
 PITECHNIKA WARSZAWSKA Wydział Budownictwa, Mechaniki i Petochemii Instytut Inżynieii Mechanicznej w Płocku Zakład Apaatuy Pzemysłowej ABRATRIUM TERMDYNAMIKI Instukcja stanowiskowa Temat: Analiza spalin
PITECHNIKA WARSZAWSKA Wydział Budownictwa, Mechaniki i Petochemii Instytut Inżynieii Mechanicznej w Płocku Zakład Apaatuy Pzemysłowej ABRATRIUM TERMDYNAMIKI Instukcja stanowiskowa Temat: Analiza spalin
POLITECHNIKA BIAŁOSTOCKA
 POLITECHNIKA BIAŁOSTOCKA KATEDRA ZARZĄDZANIA PRODUKCJĄ Instrukcja do zajęć laboratoryjnych z przedmiotu: Towaroznawstwo Kod przedmiotu: LS03282; LN03282 Ćwiczenie 1 WYZNACZANIE GĘSTOSCI CIECZY Autorzy:
POLITECHNIKA BIAŁOSTOCKA KATEDRA ZARZĄDZANIA PRODUKCJĄ Instrukcja do zajęć laboratoryjnych z przedmiotu: Towaroznawstwo Kod przedmiotu: LS03282; LN03282 Ćwiczenie 1 WYZNACZANIE GĘSTOSCI CIECZY Autorzy:
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
Pole magnetyczne. 5.1 Oddziaływanie pola magnetycznego na ładunki. przewodniki z prądem. 5.1.1 Podstawowe zjawiska magnetyczne
 Rozdział 5 Pole magnetyczne 5.1 Oddziaływanie pola magnetycznego na ładunki i pzewodniki z pądem 5.1.1 Podstawowe zjawiska magnetyczne W obecnym ozdziale ozpatzymy niektóe zagadnienia magnetostatyki. Magnetostatyką
Rozdział 5 Pole magnetyczne 5.1 Oddziaływanie pola magnetycznego na ładunki i pzewodniki z pądem 5.1.1 Podstawowe zjawiska magnetyczne W obecnym ozdziale ozpatzymy niektóe zagadnienia magnetostatyki. Magnetostatyką
Siła tarcia. Tarcie jest zawsze przeciwnie skierowane do kierunku ruchu (do prędkości). R. D. Knight, Physics for scientists and engineers
 Siła tacia Tacie jest zawsze pzeciwnie skieowane do kieunku uchu (do pędkości). P. G. Hewitt, Fizyka wokół nas, PWN R. D. Knight, Physics fo scientists and enginees Symulacja molekulanego modelu tacia
Siła tacia Tacie jest zawsze pzeciwnie skieowane do kieunku uchu (do pędkości). P. G. Hewitt, Fizyka wokół nas, PWN R. D. Knight, Physics fo scientists and enginees Symulacja molekulanego modelu tacia
1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH
 1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH 1.1. przygotowanie 20 g 20% roztworu KSCN w wodzie destylowanej 1.1.1. odważenie 4 g stałego KSCN w stożkowej kolbie ze szlifem 1.1.2. odważenie 16 g wody destylowanej
1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH 1.1. przygotowanie 20 g 20% roztworu KSCN w wodzie destylowanej 1.1.1. odważenie 4 g stałego KSCN w stożkowej kolbie ze szlifem 1.1.2. odważenie 16 g wody destylowanej
