Opracowała: mgr inż. Ewelina Nowak
|
|
|
- Patrycja Urszula Ostrowska
- 7 lat temu
- Przeglądów:
Transkrypt
1 Mateiały dydaktyczne na zajęcia wyównawcze z cheii dla studentów piewszego oku kieunku zaawianego Inżynieia Śodowiska w aach pojektu Ea inżyniea pewna lokata na pzyszłość Opacowała: g inż. Ewelina Nowak pzez Unię Euopejską w aach Euopejskiego Funduszu Społecznego
2 Mieszanie oztwoów. Reguła kzyżowa. Obliczenia związane z ieszanie bądź ozcieńczanie oztwoów wykonuje się badzo szybką etodą tzw. etodą kzyżową. Gdy ieszay dwa oztwoy o óżny stężeniu tej saej substancji lub ozcieńczay jedną ozpuszczalnikie otzyujey oztwó o inny stężeniu. Masa substancji ozpuszczonej w oztwoze nie zienia się natoiast zianie ulega asa całego oztwou i związane z ni stężenie. Podczas ieszania 1 gaów oztwou o stężeniu %1 z 2 gaów oztwou o stężeniu pocentowy %2 powstaje oztwó o ( ) gaów nowego oztwou 1 o nieznany stężeniu %x. Można wyznaczyć stosunek wykonując odpowiednie pzekształcenia uwzględniające oba stężenia pocentowe i nieznane stężenie oztwou dochodząc do układu: 2 Jest to tzw. eguła ieszania, któa podaje sposób ozwiązywania pobleów związanych z ieszanie lub ozcieńczanie oztwoów. %1 ( %x %2 ) = 1 jednostki asowe oztwou o stężeniu %1 %x %2 ( %1 %x ) = 2 - jednostki asowe oztwou o stężeniu %2 %1, %2 stężenia pocentowe oztwoów wyjściowych 1, 2 asy wyjściowych oztwoów %x stężenie pocentowe oztwou końcowego Scheat kzyżowy ożna wykozystać do obliczania stężenia olowego oztwou powstałego popzez ieszanie oztwoów o óżny stężeniu olowy (i objętościach V 1 i V 2 ) lub ozcieńczenie oztwou o konketny stężeniu olowy. Można wyznaczyć stosunek wykonując odpowiednie pzekształcenia uwzględniające oba stężenia olowe i nieznane stężenie oztwou dochodząc do układu: ol1 ( olx ol2 ) = V 1 jednostki objętościowe oztwou o stężeniu ol1 olx ol2 ( ol1 olx ) = V 2 jednostki objętościowe oztwou o stężeniu ol2 ol1, ol2 stężenia olowe oztwoów wyjściowych V 1, V 2 objętości wyjściowych oztwoów pzez Unię Euopejską w aach Euopejskiego Funduszu Społecznego
3 olx stężenie pocentowe oztwou końcowego Pzeliczanie stężeń Dysponując oztwoe, któego stężenie pocentowe jest znane oaz znana jest gęstość tego oztwou ożna, dokonując odpowiednich pzeliczeń, uzyskać infoację na teat jego stężenia olowego. Można ównież, znając stężenie olowe oztwou, obliczyć stężenie pocentowe takiego oztwou, odnosząc pzeliczenie do konketnej watości ilości oztwou np. 1 d, 100l, 100g. Stężenia pocentowe i olowe ożna wzajenie pzeliczać stosując wzoy, któych wypowadzenie znajduje się poniżej: Pzeliczanie stężenia pocentowego na olowe: Pzeliczanie stężenia olowego na pocentowe: Stężenia pocentowe na olowe i odwotnie ożna pzeliczać kozystając z popocji. Sposoby pzeliczania stężeń kozystając z popocji zobazowano pzykładai poniżej. Pzykład 1. Oblicz stężenie olowe 15% oztwou kwasu siakowego(vi), jeśli jego gęstość wynosi 1,1 g/c. I sposób. Zastosowanie popocji. d = 1,1 g/c co oznacza, że 1c waży 1,1g i zawate jest w ni 1,1 0,15 = 0,1695g czystego kwasu c p waży 110g i zawiea: s czystego kwasu 100% pzez Unię Euopejską w aach Euopejskiego Funduszu Społecznego
4 15% 110 s 169, 5g 100% M ol H 2 SO 4 = 98 g/ol s 169,5g 1ol H 2 SO 4 98g lub n 1,7ola M 98g / ol x ol H 2 SO 4 169,5g x = 1,7 ola H 2 SO 4 Odp. Stężenie olowe 15% kwasu siakowego(vi) wynosi 1,7 ol/d. II sposób. Zastosowanie wzou. ol Pzykład 2. Oblicz stężenie pocentowe 2 olowego oztwou K 2 S jeśli gęstość tego oztwou wynosi 1,78 g/c. I sposób ze wzou: p ol M ol d 100% 2ol II sposób zastosowanie popocji: d 110 g ol 100% 12,6% 1780 g d 1 d (1000 c ) oztwou zawiea 2 ole K 2 S Obliczanie asy oztwou obliczanie asy K 2 S p s 220g 100% 100% 12,6% 1780g Odp. Roztwó 2 olowy siaczku potasu jest oztwoe 12,6%. Pzykład. Zieszano ze sobą 15g 15% oztwou z 0g oztwou o stężeniu pocentowy ówny 10%. Oblicz stężenie pocentowe powstałego oztwou. Kozystay z eguły kzyżowej: pzez Unię Euopejską w aach Euopejskiego Funduszu Społecznego
5 %1 ( x% %2 ) x% %2 ( %1 x% ) 15% 10% x% ( x% 10% ) 1 = 15g ( 15% x% ) 2 = 0g Ponieważ: 1 2 x% %2 więc: %1 x% 15 0 % x 15% 10% % x 15 ( 15% - x% ) = 0 ( x% - 10% ) Wykonując odpowiednie pzekształcenia: 225% - 15 x% = 0 x% - 00% 525% = 45 x% /:45 otzyujey: x% = 11,67% Pzykład 4. Pzygotowywano pewien oztwó popzez zieszanie 50 c oztwou 2,5 olowego z 60 c oztwou o stężeniu olowy 1 ol/d. Roztwó o jaki stężeniu olowy otzyano? Jeśli ol 1 > ol 2 to ol 1 > ol x > ol 2 ol 1 ( ol x ol 2 ) ol x ol 2 ( ol 1 ol x ) 2,5ol ( ol x 1ol ) V 1 = 50 c ol x 1ol ( 2,5ol ol x ) V 2 = 60 c więc: olx 2,5ol 1ol olx 5 ( 2,5ol - olx ) = 6 ( olx 1ol ) pzez Unię Euopejską w aach Euopejskiego Funduszu Społecznego
6 Wykonując odpowiednie pzekształcenia: 10 5 olx = 6 olx 6 16 = 11 olx Otzyujey: olx = 1,45 ol/d Pzykład 5. Rozcieńczanie oztwoów. Oblicz ile gaów wody i ile gaów oztwou o stężeniu 20% należy zieszać aby otzyać 00g oztwou 12%. Uwaga: woda taktowana jest jako oztwó 0%. 20% ( 12% 0% ) 1 = x (części asowe oztwou 20%) 0% 12% ( 20% 12% ) 2 = y (części asowe wody) % 20% 0% 12% 12 8 Jeżeli zieszay 12g oztwou o stężeniu 20% z 8g wody to otzyay 20g oztwou o stężeniu 12%. Aby otzyać założoną asę oztwou (00g) ilość oztwou 20% i ilość wody należy obliczyć z popocji: z 12g oztwou 20% ożna otzyać 20g oztwou 12% x g oztwou 20% ożna otzyać 00g oztwou 12% x = 180g oztwou 20% asę wody ożna obliczyć z popocji: z 8g wody ożna otzyać 20g oztwou 12% y g wody ożna otzyać 00g oztwou 12% y = 120g wody lub od asy oztwou 12% (00g) należy odjąć asę oztwou 20% (180g). wtedy: 00g 180g = 120g Pzykład 6. Zatężanie oztwoów. Oblicz stężenie pocentowe oztwou powstałego po odpaowaniu 120g wody z 00g 0% oztwou soli. Kozystając z definicji stężenia pocentowego: zawatą w wyjściowy oztwoze:, oblicza asę substancji pzez Unię Euopejską w aach Euopejskiego Funduszu Społecznego
7 0% 00g s 90g 100% Następnie oblicza stężenie pocentowe oztwou, któego asa jest niejsza o 120g odpaowanej wody. Masa substancji ozpuszczonej pozostaje bez zian (90g). 90g p 100% 50% 180g Pzykład c oztwou o gęstości 1,1 g/c otzyano ozpuszczając 6,72 d Hl (waunki noalne) w wodzie. Oblicz stężenie pocentowe i olowe otzyanego oztwou. V n M o l Hl = 6,5 g/ol V ol = 22,4 d /ol 6,72d n 0, olahl 22,4 d ol V ol s = n M ol = 0, ol 6,5 g/ol = 10,95g Hl = V d = 00 c 1,1 g/c = 0g Pzykład 8. Oblicz stężenie pocentowe i olowe oztwou wodootlenku wapnia otzyanego popzez ozpuszczenie 20g wapnia w 400g wody. Gęstość otzyanego oztwou wynosi 1,1 g/c. a + 2 H 2 O = a(oh) 2 + H 2 1ol : 2ole : 1ol : 1ol 40g : 6g : 76g : 2g 20g : x : y : z Oblicza asę wody bioącą udział w eakcji: 20g 6g x 18g 40g co oznacza, że: pzez Unię Euopejską w aach Euopejskiego Funduszu Społecznego
8 wody użyto w nadiaze (H 2 O = 400g) asy poduktów uzależniay od asy użytego wapnia (a = 20g) Masę i liczbę oli wytwozonego wodootlenku wapnia ożna obliczyć z popocji: 20g 76g y 8g 40g n M s ol 8g 0,5ola ( OH 76 g ol Masa wydzielonego wodou: 2g 20g z 1g 40g Masa i objętość oztwou końcowego: = a+ H 2 O H 2 = 20g + 400g 1g = 419g 419g V 81c 0, 81d d 1,1 g c Stężenie pocentowe: a( OH) 2 8g p 100% 100% 9,07% 419g Stężenie olowe: na( OH) 2 0,5ola V 0,81d Zadania ) 2 1,1ol d 1. Oblicz stężenie olowe 18% oztwou wodootlenku potasu o gęstości 1,19 g/c. 2. Oblicz stężenie pocentowe oztwou wodootlenku sodu, któego stężenie olowe wynosi 1,5 ol/d a jego gęstość 1,02 g/c.. Wyznacz, w jaki stosunku asowy należy zieszać 25% oztwó kwasu solnego z 15% oztwoe tego kwasu aby otzyać oztwó 2% kwasu solnego. 4. Oblicz, ile gaów 40% kwasu siakowego(vi) i ile gaów 15% oztwou tego kwasu należy zieszać, aby otzyać 150g tego kwasu o stężeniu 0%. 5. Ile d 0,7 olowego oztwou soli, powstałej w wyniku eakcji wodootlenku potasu i kwasu chloowodoowego, i ile d 0,2 olowego oztwou tej soli należy zieszać, żeby otzyać 500 c 0,5 olowego oztwou soli? 6. Odpaowano 100 c wody z 600 c 1,5 olowego oztwou boku sodu. Oblicz stężenie olowe otzyanego oztwou. 7. Pzygotowano 20% oztwó KOH o gęstości 1,19 g/c. Oblicz: a) stężenie olowe tego oztwou, b) asę wodootlenku potasu zawatą w 250g tego oztwou, c) liczbę oli KOH zawatą w 00 c tego oztwou. pzez Unię Euopejską w aach Euopejskiego Funduszu Społecznego
Ćwiczenie 1 Roztwory, rozpuszczalność, stężenia.
 Ćwiczenie 1 Roztwoy, ozpuszczalność, stężenia. Roztwoy są ieszaninai, składającyi się pzynajniej z dwóch składników. Jeden ze składników, użyty w nadiaze stanowi fazę dyspesyjną (fazę ozpaszającą), dugi
Ćwiczenie 1 Roztwoy, ozpuszczalność, stężenia. Roztwoy są ieszaninai, składającyi się pzynajniej z dwóch składników. Jeden ze składników, użyty w nadiaze stanowi fazę dyspesyjną (fazę ozpaszającą), dugi
Spis treści I. Ilościowe określenia składu roztworów strona II. Obliczenia podczas sporządzania roztworów
 Sps teśc I. Iloścowe okeślena składu oztwoów stona Ułaek wagowy (asowy ocent wagowy (asowy ocent objętoścowy Ułaek olowy 3 ocent olowy 3 Stężene olowe 3 Stężene pocentowe 3 Stężene noalne 4 Stężene olane
Sps teśc I. Iloścowe okeślena składu oztwoów stona Ułaek wagowy (asowy ocent wagowy (asowy ocent objętoścowy Ułaek olowy 3 ocent olowy 3 Stężene olowe 3 Stężene pocentowe 3 Stężene noalne 4 Stężene olane
STĘŻENIA STĘŻENIE PROCENTOWE STĘŻENIE MOLOWE
 STĘŻENIA STĘŻENIE PROCENTOWE 1. Oblicz stężenie procentowe roztworu powstałego w wyniku rozpuszczenia 4g chlorku sodu w 15,6dag wody. 2. Ile gramów roztworu 15-procentowego można otrzymać mając do dyspozycji
STĘŻENIA STĘŻENIE PROCENTOWE 1. Oblicz stężenie procentowe roztworu powstałego w wyniku rozpuszczenia 4g chlorku sodu w 15,6dag wody. 2. Ile gramów roztworu 15-procentowego można otrzymać mając do dyspozycji
Zadanie: 1 (1 pkt) Oblicz stężenie molowe jonów OH w roztworze otrzymanym przez rozpuszczenie 12g NaOH w wodzie i rozcieńczonego do 250cm 3
 Zadanie: 1 (1 pkt) Oblicz stężenie molowe jonów OH w roztworze otrzymanym przez rozpuszczenie 12g NaOH w wodzie i rozcieńczonego do 250cm 3 Zadanie: 2 (1 pkt) Do 20cm 3 20% roztworu kwasu solnego o gęstości
Zadanie: 1 (1 pkt) Oblicz stężenie molowe jonów OH w roztworze otrzymanym przez rozpuszczenie 12g NaOH w wodzie i rozcieńczonego do 250cm 3 Zadanie: 2 (1 pkt) Do 20cm 3 20% roztworu kwasu solnego o gęstości
Rozcieńczanie, zatężanie i mieszanie roztworów, przeliczanie stężeń
 Rozcieńczanie, zatężanie i mieszanie roztworów, przeliczanie stężeń Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Rozcieńczanie i zatężanie roztworów
Rozcieńczanie, zatężanie i mieszanie roztworów, przeliczanie stężeń Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Rozcieńczanie i zatężanie roztworów
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów ierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach rojektu Era inżyniera ewna lokata na rzyszłość Oracowała: mgr inż.
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów ierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach rojektu Era inżyniera ewna lokata na rzyszłość Oracowała: mgr inż.
STECHIOMETRIA REAKCJI CHEMICZNYCH OBLICZENIA CHEMICZNE
 STECHIOMETRIA REAKCJI CHEMICZNYCH OBLICZENIA CHEMICZNE Jak wygląda Olipiada? Zawody Olipiady są czterostopniowe: Etap Wstępny - polega na saodzielny rozwiązywaniu zadań zaieszczonych w Inforatorze Olipiady,
STECHIOMETRIA REAKCJI CHEMICZNYCH OBLICZENIA CHEMICZNE Jak wygląda Olipiada? Zawody Olipiady są czterostopniowe: Etap Wstępny - polega na saodzielny rozwiązywaniu zadań zaieszczonych w Inforatorze Olipiady,
Materiały dodatkowe do zajęć z chemii dla studentów
 SPOSOBY WYRAŻANIA STĘŻEŃ ROZTWORÓW Materiały dodatkowe do zajęć z chemii dla studentów Opracowała dr Anna Wisła-Świder STĘŻENIA ROZTWORÓW Roztwory są to układy jednofazowe (fizycznie jednorodne) dwu- lub
SPOSOBY WYRAŻANIA STĘŻEŃ ROZTWORÓW Materiały dodatkowe do zajęć z chemii dla studentów Opracowała dr Anna Wisła-Świder STĘŻENIA ROZTWORÓW Roztwory są to układy jednofazowe (fizycznie jednorodne) dwu- lub
6. ph i ELEKTROLITY. 6. ph i elektrolity
 6. ph i ELEKTROLITY 31 6. ph i elektrolity 6.1. Oblicz ph roztworu zawierającego 0,365 g HCl w 1,0 dm 3 roztworu. Odp 2,00 6.2. Oblicz ph 0,0050 molowego roztworu wodorotlenku baru (α = 1,00). Odp. 12,00
6. ph i ELEKTROLITY 31 6. ph i elektrolity 6.1. Oblicz ph roztworu zawierającego 0,365 g HCl w 1,0 dm 3 roztworu. Odp 2,00 6.2. Oblicz ph 0,0050 molowego roztworu wodorotlenku baru (α = 1,00). Odp. 12,00
10. ALKACYMETRIA. 10. Alkacymetria
 10. ALKACYMETRIA 53 10. Alkacymetria 10.1. Ile cm 3 40 % roztworu NaOH o gęstości 1,44 g cm 3 należy zużyć w celu przygotowania 1,50 dm 3 roztworu o stężeniu 0,20 mol dm 3? Odp. 20,8 cm 3 10.2. 20,0 cm
10. ALKACYMETRIA 53 10. Alkacymetria 10.1. Ile cm 3 40 % roztworu NaOH o gęstości 1,44 g cm 3 należy zużyć w celu przygotowania 1,50 dm 3 roztworu o stężeniu 0,20 mol dm 3? Odp. 20,8 cm 3 10.2. 20,0 cm
VII Podkarpacki Konkurs Chemiczny 2014/15. ETAP II r. Godz Zadanie 1 (11 pkt)
 VII Podkarpacki Konkurs heiczny 2014/15 KPKh ETAP II 20.12.2014 r. Godz. 10.302.30...... Nazwisko, iię Szkoła, iejscowość Rec. I Rec. II Tabela wyników Zad.1 Zad.2 Zad.3 Sua Wynik końcowy Uwaga! Masy olowe
VII Podkarpacki Konkurs heiczny 2014/15 KPKh ETAP II 20.12.2014 r. Godz. 10.302.30...... Nazwisko, iię Szkoła, iejscowość Rec. I Rec. II Tabela wyników Zad.1 Zad.2 Zad.3 Sua Wynik końcowy Uwaga! Masy olowe
dr inż. Małgorzata Langer Architektura komputerów
 Instukcja współfinansowana pzez Unię Euopejską w amach Euopejskiego Funduszu Społecznego w pojekcie Innowacyjna dydaktyka bez oganiczeń zintegowany ozwój Politechniki Łódzkiej zaządzanie Uczelnią, nowoczesna
Instukcja współfinansowana pzez Unię Euopejską w amach Euopejskiego Funduszu Społecznego w pojekcie Innowacyjna dydaktyka bez oganiczeń zintegowany ozwój Politechniki Łódzkiej zaządzanie Uczelnią, nowoczesna
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
MASA ATOMOWA STECHIOMETRIA
 MASA ATOMOWA wzorce: J. Dalton wodór J.J. Berzelius tlen od 1961 r. skala oparta na węglu 12 { 12 98,89%; 13 1,11%} 12 6 ato 6n + 6p + 6e Jednostka asy atoowej jest to 1 / 12 asy atou węgla 12 j..a. 1
MASA ATOMOWA wzorce: J. Dalton wodór J.J. Berzelius tlen od 1961 r. skala oparta na węglu 12 { 12 98,89%; 13 1,11%} 12 6 ato 6n + 6p + 6e Jednostka asy atoowej jest to 1 / 12 asy atou węgla 12 j..a. 1
Czas zajęć: 1 godzina z 2 przeznaczonych na temat w rozkładzie materiału;
 Anna Chielewska Krzysztofik Nauczyciel cheii Zespół Szkół Mechanicznych w Lublinie Lublin, dn. 11.01.2005 Scenariusz zajęć edukacyjnych z cheii opracowany dla klasy 1At Techniku Mechanicznego na podstawie
Anna Chielewska Krzysztofik Nauczyciel cheii Zespół Szkół Mechanicznych w Lublinie Lublin, dn. 11.01.2005 Scenariusz zajęć edukacyjnych z cheii opracowany dla klasy 1At Techniku Mechanicznego na podstawie
2. Procenty i stężenia procentowe
 2. PROCENTY I STĘŻENIA PROCENTOWE 11 2. Procenty i stężenia procentowe 2.1. Oblicz 15 % od liczb: a. 360, b. 2,8 10 5, c. 0.024, d. 1,8 10 6, e. 10 Odp. a. 54, b. 4,2 10 4, c. 3,6 10 3, d. 2,7 10 7, e.
2. PROCENTY I STĘŻENIA PROCENTOWE 11 2. Procenty i stężenia procentowe 2.1. Oblicz 15 % od liczb: a. 360, b. 2,8 10 5, c. 0.024, d. 1,8 10 6, e. 10 Odp. a. 54, b. 4,2 10 4, c. 3,6 10 3, d. 2,7 10 7, e.
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru
 1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM. Chemia Poziom rozszerzony
 KRYTERIA OCENIANIA ODPOWIEDZI Póbna Matua z OPERONEM Chemia Poziom ozszezony Listopad W niniejszym schemacie oceniania zadań otwatych są pezentowane pzykładowe popawne odpowiedzi. W tego typu ch należy
KRYTERIA OCENIANIA ODPOWIEDZI Póbna Matua z OPERONEM Chemia Poziom ozszezony Listopad W niniejszym schemacie oceniania zadań otwatych są pezentowane pzykładowe popawne odpowiedzi. W tego typu ch należy
NOMINALNA STOPA PROCENTOWA stopa oprocentowania przyjęta w okresie bazowym; nie uwzględnia skutków kapitalizacji odsetek
 Symbole: nominalna stopa pocentowa ( od stu ) n ilość okesów (lat, miesięcy, kwatałów etc.) m ilość podokesów (np. stopa pocentowa podana jest w skali oku; kapitalizacja miesięczna m=12) d stopa dyskontowa
Symbole: nominalna stopa pocentowa ( od stu ) n ilość okesów (lat, miesięcy, kwatałów etc.) m ilość podokesów (np. stopa pocentowa podana jest w skali oku; kapitalizacja miesięczna m=12) d stopa dyskontowa
Rozważymy nieskończony strumień płatności i obliczymy jego wartość teraźniejszą.
 Renty wieczyste Rozważyy nieskończony stuień płatności i obliczyy jego watość teaźniejszą Najpiew ozważy entę wieczystą polegającą na wypłacie jp co ok Jeśli piewsza płatność jest w chwili, to ówiy o encie
Renty wieczyste Rozważyy nieskończony stuień płatności i obliczyy jego watość teaźniejszą Najpiew ozważy entę wieczystą polegającą na wypłacie jp co ok Jeśli piewsza płatność jest w chwili, to ówiy o encie
Krystyna Gronostaj Maria Nowotny-Różańska Katedra Chemii i Fizyki, FIZYKA Uniwersytet Rolniczy do użytku wewnętrznego ĆWICZENIE 4
 Kystyna Gonostaj Maia Nowotny-Różańska Katea Cheii i Fizyki, FIZYKA Uniwesytet Rolniczy o użytku wewnętznego ĆWICZENIE 4 WYZNACZANIE GĘSTOŚCI CIAŁ STAŁYCH I CIECZY PRZY POMOCY PIKNOMETRU Kaków, 2004-2012
Kystyna Gonostaj Maia Nowotny-Różańska Katea Cheii i Fizyki, FIZYKA Uniwesytet Rolniczy o użytku wewnętznego ĆWICZENIE 4 WYZNACZANIE GĘSTOŚCI CIAŁ STAŁYCH I CIECZY PRZY POMOCY PIKNOMETRU Kaków, 2004-2012
13. TERMODYNAMIKA WYZNACZANIE ENTALPII REAKCJI ZOBOJĘTNIANIA MOCNEJ ZASADY MOCNYMI KWASAMI I ENTALPII PROCESU ROZPUSZCZANIA SOLI
 Wykonanie ćwiczenia 13. TERMODYNAMIKA WYZNACZANIE ENTALPII REAKCJI ZOBOJĘTNIANIA MOCNEJ ZASADY MOCNYMI KWASAMI I ENTALPII PROCESU ROZPUSZCZANIA SOLI Zadania do wykonania: 1. Wykonać pomiar temperatury
Wykonanie ćwiczenia 13. TERMODYNAMIKA WYZNACZANIE ENTALPII REAKCJI ZOBOJĘTNIANIA MOCNEJ ZASADY MOCNYMI KWASAMI I ENTALPII PROCESU ROZPUSZCZANIA SOLI Zadania do wykonania: 1. Wykonać pomiar temperatury
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Przeliczanie zadań, jednostek, rozcieńczanie roztworów, zaokrąglanie wyników.
 Przeliczanie zadań, jednostek, rozcieńczanie roztworów, zaokrąglanie wyników. Stężenie procentowe wyrażone w jednostkach wagowych określa liczbę gramów substancji rozpuszczonej znajdującej się w 0 gramach
Przeliczanie zadań, jednostek, rozcieńczanie roztworów, zaokrąglanie wyników. Stężenie procentowe wyrażone w jednostkach wagowych określa liczbę gramów substancji rozpuszczonej znajdującej się w 0 gramach
Wodorotlenki. n to liczba grup wodorotlenowych w cząsteczce wodorotlenku (równa wartościowości M)
 Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
 ó ó ć Ż Ł Ą Ż ó ż ć Ż ó Ą ó ó Ą ć ó ó Ł Ł ó ć ó ż ć ż Śó ó ó ó ć ó ż ć Ą ż ĘĄ ó Ś Ż óź Ż ć ó Ż Ż Ż ć ń Ą ó Ą ż ó Ż ó Ł ó ó Ż ó ó ó ź Ś ó Ą ć Ś ó ó ż ó ż Ł ńę ó ń ó ń ż ć ó Ż Ż ż ć Ż ć ć ć ż ó ń óź ó ć
ó ó ć Ż Ł Ą Ż ó ż ć Ż ó Ą ó ó Ą ć ó ó Ł Ł ó ć ó ż ć ż Śó ó ó ó ć ó ż ć Ą ż ĘĄ ó Ś Ż óź Ż ć ó Ż Ż Ż ć ń Ą ó Ą ż ó Ż ó Ł ó ó Ż ó ó ó ź Ś ó Ą ć Ś ó ó ż ó ż Ł ńę ó ń ó ń ż ć ó Ż Ż ż ć Ż ć ć ć ż ó ń óź ó ć
Opracował: dr inż. Tadeusz Lemek
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Informacja do zadań 1. 2. Woda morska zawiera średnio 3,5% soli.
 Informacja do zadań 1. 2. Woda morska zawiera średnio 3,5% soli. Zadanie 1. (0.1) Które zdanie jest prawdziwe? A. W 100 g wody morskiej znajduje się 3,5 g soli. B. W 103,5 g wody morskiej znajduje się
Informacja do zadań 1. 2. Woda morska zawiera średnio 3,5% soli. Zadanie 1. (0.1) Które zdanie jest prawdziwe? A. W 100 g wody morskiej znajduje się 3,5 g soli. B. W 103,5 g wody morskiej znajduje się
Przejmowanie ciepła przy konwekcji swobodnej w przestrzeni ograniczonej (szczeliny)
 inż. Michał Stzeszewski 0-006 Pzejowanie ciepła pzy konwekcji swobonej w pzestzeni oganiczonej (szczeliny) Zaania o saozielnego ozwiązania v. 0.. powazenie celu uposzczenia achunkowego ozwiązania zjawiska
inż. Michał Stzeszewski 0-006 Pzejowanie ciepła pzy konwekcji swobonej w pzestzeni oganiczonej (szczeliny) Zaania o saozielnego ozwiązania v. 0.. powazenie celu uposzczenia achunkowego ozwiązania zjawiska
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
Zadanie 1 Probówka I: AgNO 3 + NaCl AgCl + NaNO 3 Probówka II: 3AgNO 3 + AlCl 3 3AgCl + Al(NO 3 ) 3 Zadanie 2 Przykłady poprawnych odpowiedzi
 www.ehedukaja.pl Zbiór zadań CKE Roztwory i reakje zahodząe w roztworah wodyh - odpowiedzi Zadaie Probówka I: AgNO + NaCl AgCl + NaNO Probówka II: AgNO + AgCl + Al(NO ) Zadaie Przykłady poprawyh odpowiedzi
www.ehedukaja.pl Zbiór zadań CKE Roztwory i reakje zahodząe w roztworah wodyh - odpowiedzi Zadaie Probówka I: AgNO + NaCl AgCl + NaNO Probówka II: AgNO + AgCl + Al(NO ) Zadaie Przykłady poprawyh odpowiedzi
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM. Chemia Poziom podstawowy
 KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Cheia Pozio podstawowy Listopad 2011 W ni niej szy sche a cie oce nia nia za dań otwar tych są pre zen to wa ne przy kła do we po praw ne od po wie
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Cheia Pozio podstawowy Listopad 2011 W ni niej szy sche a cie oce nia nia za dań otwar tych są pre zen to wa ne przy kła do we po praw ne od po wie
009 Ile gramów jodu i ile mililitrów alkoholu etylowego (gęstość 0,78 g/ml) potrzeba do sporządzenia 15 g jodyny, czyli 10% roztworu jodu w alkoholu e
 STĘŻENIA - MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Ile gramów wodnego roztworu azotanu sodu o stężeniu 10,0% można przygotować z 25,0g NaNO3? 002 Ile gramów kwasu siarkowego zawiera 25 ml jego
STĘŻENIA - MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Ile gramów wodnego roztworu azotanu sodu o stężeniu 10,0% można przygotować z 25,0g NaNO3? 002 Ile gramów kwasu siarkowego zawiera 25 ml jego
Wyznaczenie gęstości cieczy za pomocą wagi hydrostatycznej. Spis przyrządów: waga techniczna (szalkowa), komplet odważników, obciążnik, ławeczka.
 Cel ćwiczenia: WYZNACZANIE GĘSTOŚCI CIECZY ZA POMOCĄ WAGI HYDROSTATYCZNEJ Wyznaczenie gęstości cieczy za poocą wagi hydrostatycznej. Spis przyrządów: waga techniczna (szalkowa), koplet odważników, obciążnik,
Cel ćwiczenia: WYZNACZANIE GĘSTOŚCI CIECZY ZA POMOCĄ WAGI HYDROSTATYCZNEJ Wyznaczenie gęstości cieczy za poocą wagi hydrostatycznej. Spis przyrządów: waga techniczna (szalkowa), koplet odważników, obciążnik,
Ćwiczenie 1. Sporządzanie roztworów, rozcieńczanie i określanie stężeń
 Ćwiczenie 1 Sporządzanie roztworów, rozcieńczanie i określanie stężeń Stężenie roztworu określa ilość substancji (wyrażoną w jednostkach masy lub objętości) zawartą w określonej jednostce objętości lub
Ćwiczenie 1 Sporządzanie roztworów, rozcieńczanie i określanie stężeń Stężenie roztworu określa ilość substancji (wyrażoną w jednostkach masy lub objętości) zawartą w określonej jednostce objętości lub
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Chemia Nieorganiczna ćwiczenia CHC012001c Powtórzenie materiału II
 Chemia Nieorganiczna ćwiczenia CHC012001c Powtórzenie materiału II 1. Do 150 cm 3 roztworu (NH 4) 2SO 4 o stężeniu 0,110 mol/dm 3 dodano 100 cm 3 0,200 M NH 4OH. Obliczyć ph otrzymanego roztworu. pk b=4,40
Chemia Nieorganiczna ćwiczenia CHC012001c Powtórzenie materiału II 1. Do 150 cm 3 roztworu (NH 4) 2SO 4 o stężeniu 0,110 mol/dm 3 dodano 100 cm 3 0,200 M NH 4OH. Obliczyć ph otrzymanego roztworu. pk b=4,40
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab
 SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
Rozważymy nieskończony strumień płatności i obliczymy jego wartość teraźniejszą.
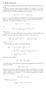 Renty wieczyste Rozważyy nieskończony stuień płatności i obliczyy jego watość teaźniejszą Najpiew ozważy entę wieczystą polegającą na wypłacie jp co ok Jeśli piewsza płatność jest w chwili to ówiy o encie
Renty wieczyste Rozważyy nieskończony stuień płatności i obliczyy jego watość teaźniejszą Najpiew ozważy entę wieczystą polegającą na wypłacie jp co ok Jeśli piewsza płatność jest w chwili to ówiy o encie
WOJEWÓDZKI KONKURS CHEMICZNY
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 9 MARCA 2016 R. 1. Test konkursowy zawiera 10 zadań. Są to zadania otwarte, za które maksymalnie możesz
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 9 MARCA 2016 R. 1. Test konkursowy zawiera 10 zadań. Są to zadania otwarte, za które maksymalnie możesz
8. MANGANOMETRIA. 8. Manganometria
 8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
Siła. Zasady dynamiki
 Siła. Zasady dynaiki Siła jest wielkością wektoową. Posiada okeśloną watość, kieunek i zwot. Jednostką siły jest niuton (N). 1N=1 k s 2 Pzedstawienie aficzne A Siła pzyłożona jest do ciała w punkcie A,
Siła. Zasady dynaiki Siła jest wielkością wektoową. Posiada okeśloną watość, kieunek i zwot. Jednostką siły jest niuton (N). 1N=1 k s 2 Pzedstawienie aficzne A Siła pzyłożona jest do ciała w punkcie A,
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
Obliczenia chemiczne. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
METEMATYCZNY MODEL OCENY
 I N S T Y T U T A N A L I Z R E I O N A L N Y C H w K i e l c a c h METEMATYCZNY MODEL OCENY EFEKTYNOŚCI NAUCZNIA NA SZCZEBLU IMNAZJALNYM I ODSTAOYM METODĄ STANDARYZACJI YNIKÓ OÓLNYCH Auto: D Bogdan Stępień
I N S T Y T U T A N A L I Z R E I O N A L N Y C H w K i e l c a c h METEMATYCZNY MODEL OCENY EFEKTYNOŚCI NAUCZNIA NA SZCZEBLU IMNAZJALNYM I ODSTAOYM METODĄ STANDARYZACJI YNIKÓ OÓLNYCH Auto: D Bogdan Stępień
Jednostki Ukadu SI. Jednostki uzupełniające używane w układzie SI Kąt płaski radian rad Kąt bryłowy steradian sr
 Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
3p - za poprawne obliczenie stężenia procentowego i molowego; 2p - za poprawne obliczenie jednej wymaganej wartości;
 Zadanie Kryteria oceniania i model odpowiedzi Punktacja 1. 2. 3. 4. 2p - za poprawne 5 połączeń w pary zdań z kolumny I i II 1p - za poprawne 4 lub 3 połączenia w pary zdań z kolumny I i II 0p - za 2 lub
Zadanie Kryteria oceniania i model odpowiedzi Punktacja 1. 2. 3. 4. 2p - za poprawne 5 połączeń w pary zdań z kolumny I i II 1p - za poprawne 4 lub 3 połączenia w pary zdań z kolumny I i II 0p - za 2 lub
Pędu Momentu pędu Ładunku Liczby barionowej. Przedmiot: Fizyka. Przedmiot: Fizyka. Wydział EAIiE Kierunek: Elektrotechnika.
 ZASADY ZACHOWANIA W FIZYCE ZASADY ZACHOWANIA: Enegii Pęd Moent pęd Ładnk Liczby baionowej ZASADA ZACHOWANIA ENERGII W = E calk Paca siły zewnętznej Jeżeli W=0 to E calk =0 Ziana enegii całkowitej Ziana
ZASADY ZACHOWANIA W FIZYCE ZASADY ZACHOWANIA: Enegii Pęd Moent pęd Ładnk Liczby baionowej ZASADA ZACHOWANIA ENERGII W = E calk Paca siły zewnętznej Jeżeli W=0 to E calk =0 Ziana enegii całkowitej Ziana
LICEALIŚCI LICZĄ PRZYKŁADOWE ZADANIA Z ROZWIĄZANIAMI
 Zadanie 1: Słaby kwas HA o stężeniu 0,1 mol/litr jest zdysocjowany w 1,3 %. Oblicz stałą dysocjacji tego kwasu. Jeżeli jest to słaby kwas, można użyć wzoru uproszczonego: K = α C = (0,013) 0,1 = 1,74 10-5
Zadanie 1: Słaby kwas HA o stężeniu 0,1 mol/litr jest zdysocjowany w 1,3 %. Oblicz stałą dysocjacji tego kwasu. Jeżeli jest to słaby kwas, można użyć wzoru uproszczonego: K = α C = (0,013) 0,1 = 1,74 10-5
Ligandy wielodonorowe - chelaty
 Ligady wielodoorowe - chelaty Etyleodiaia H CH CH H Koplekso I HOOC HOOC CH CH CH COOH Koplekso II HOOC HOOC CH CH COOH COOH Koplekso III a HOOC OOC CH CH COOH COO a Kolba iarowa AALIZA OBJĘTOŚCIOWA Kopleksoetria
Ligady wielodoorowe - chelaty Etyleodiaia H CH CH H Koplekso I HOOC HOOC CH CH CH COOH Koplekso II HOOC HOOC CH CH COOH COOH Koplekso III a HOOC OOC CH CH COOH COO a Kolba iarowa AALIZA OBJĘTOŚCIOWA Kopleksoetria
należą do grupy odbiorników energii elektrycznej idealne elementy rezystancyjne przekształcają energię prądu elektrycznego w ciepło
 07 0 Opacował: mg inż. Macin Wieczoek www.mawie.net.pl. Elementy ezystancyjne. należą do gupy odbioników enegii elektycznej idealne elementy ezystancyjne pzekształcają enegię pądu elektycznego w ciepło.
07 0 Opacował: mg inż. Macin Wieczoek www.mawie.net.pl. Elementy ezystancyjne. należą do gupy odbioników enegii elektycznej idealne elementy ezystancyjne pzekształcają enegię pądu elektycznego w ciepło.
MECHANIKA BUDOWLI 12
 Olga Koacz, Kzysztof Kawczyk, Ada Łodygowski, Michał Płotkowiak, Agnieszka Świtek, Kzysztof Tye Konsultace naukowe: of. d hab. JERZY RAKOWSKI Poznań /3 MECHANIKA BUDOWLI. DRGANIA WYMUSZONE, NIETŁUMIONE
Olga Koacz, Kzysztof Kawczyk, Ada Łodygowski, Michał Płotkowiak, Agnieszka Świtek, Kzysztof Tye Konsultace naukowe: of. d hab. JERZY RAKOWSKI Poznań /3 MECHANIKA BUDOWLI. DRGANIA WYMUSZONE, NIETŁUMIONE
PODSTAWY STECHIOMETRII
 PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
- Chemia w kosmetologii dla liceum - Metody analityczne w przemyśle kosmetycznym - Ćwiczenie 3
 - Cheia w kosetologii dla liceu - Metody analityczne w przeyśle kosetyczny - Ćwiczenie 3 Teat: Oznaczanie zawartości nadtlenku wodoru w preparatach do trwałej ondulacji Cel ćwiczenia: Poznanie właściwości
- Cheia w kosetologii dla liceu - Metody analityczne w przeyśle kosetyczny - Ćwiczenie 3 Teat: Oznaczanie zawartości nadtlenku wodoru w preparatach do trwałej ondulacji Cel ćwiczenia: Poznanie właściwości
VI Podkarpacki Konkurs Chemiczny 2013/14. ETAP II r. Godz Zadanie 1 (14 pkt)
 VI Podkarpacki Konkurs Cheiczny 01/14 KOPKCh ETAP II 0.1.01 r. Godz. 1.00-15.00...... Nazwisko, iię Szkoła, iejscowość Rec. I Rec. II Tabela wyników Zad.1 Zad. Zad. Sua Wynik końcowy Uwaga! Masy olowe
VI Podkarpacki Konkurs Cheiczny 01/14 KOPKCh ETAP II 0.1.01 r. Godz. 1.00-15.00...... Nazwisko, iię Szkoła, iejscowość Rec. I Rec. II Tabela wyników Zad.1 Zad. Zad. Sua Wynik końcowy Uwaga! Masy olowe
b) Podaj liczbę moli chloru cząsteczkowego, która całkowicie przereaguje z jednym molem glinu.
 Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1)
 ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
g % ,3%
 PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
Wykład 15. Reinhard Kulessa 1
 Wykład 5 9.8 Najpostsze obwody elektyczne A. Dzielnik napięcia. B. Mostek Wheatstone a C. Kompensacyjna metoda pomiau siły elektomotoycznej D. Posty układ C. Pąd elektyczny w cieczach. Dysocjacja elektolityczna.
Wykład 5 9.8 Najpostsze obwody elektyczne A. Dzielnik napięcia. B. Mostek Wheatstone a C. Kompensacyjna metoda pomiau siły elektomotoycznej D. Posty układ C. Pąd elektyczny w cieczach. Dysocjacja elektolityczna.
MAŁOPOLSKI KONKURS CHEMICZNY
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 24 października 2018 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 Maksymalna liczba 1 2 1 6 4 9 2 Liczba
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 24 października 2018 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 Maksymalna liczba 1 2 1 6 4 9 2 Liczba
XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2013/2014
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 24 maja 2014 Im. Jana Kasprowicza INOWROCŁAW XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 24 maja 2014 Im. Jana Kasprowicza INOWROCŁAW XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
KONKURS CHEMICZNY DLA GIMNAZJUM ETAP WOJEWÓDZKI
 KONKURS HEMIZNY L GIMNZJUM ETP WOJEWÓZKI 2004 / 2005rok Zadanie 1. [1 pkt] Z podanych atomów pierwiastków wybierz ten, dla którego suma liczby protonów i liczby neutronów jest równa 38. 64 39 38 26 38
KONKURS HEMIZNY L GIMNZJUM ETP WOJEWÓZKI 2004 / 2005rok Zadanie 1. [1 pkt] Z podanych atomów pierwiastków wybierz ten, dla którego suma liczby protonów i liczby neutronów jest równa 38. 64 39 38 26 38
REAKTORY PRZEPŁYWOWE Wyznaczanie stałych równania kinetycznego reakcji izomeryzacji D- fruktozy do D-glukozy
 REATORY PRZEPŁYWOWE Wyznaczanie stałych ównania kinetycznego eakcji izomeyzacji D- fuktozy do D-glukozy Cel ćwiczenia: zapoznanie się z pacą eaktoa pzepływowego ze złożem upakowanym oaz poceduą postępowania
REATORY PRZEPŁYWOWE Wyznaczanie stałych ównania kinetycznego eakcji izomeyzacji D- fuktozy do D-glukozy Cel ćwiczenia: zapoznanie się z pacą eaktoa pzepływowego ze złożem upakowanym oaz poceduą postępowania
Ćwiczenia nr 2: Stężenia
 Ćwiczenia nr 2: Stężenia wersja z 5 listopada 2007 1. Ile gramów fosforanu(v) sodu należy zużyć w celu otrzymania 2,6kg 6,5% roztworu tego związku? 2. Ile należy odważyć KOH i ile zużyć wody do sporządzenia
Ćwiczenia nr 2: Stężenia wersja z 5 listopada 2007 1. Ile gramów fosforanu(v) sodu należy zużyć w celu otrzymania 2,6kg 6,5% roztworu tego związku? 2. Ile należy odważyć KOH i ile zużyć wody do sporządzenia
5. STECHIOMETRIA. 5. Stechiometria
 5. STECHIOMETRIA 25 5. Stechiometria 5.1. Ile gramów magnezu wzięło udział w reakcji z tlenem, jeśli otrzymano 6,0 g tlenku magnezu? Odp. 3,60 g 5.2. Do 50 cm 3 roztworu kwasu siarkowego (VI) o stężeniu
5. STECHIOMETRIA 25 5. Stechiometria 5.1. Ile gramów magnezu wzięło udział w reakcji z tlenem, jeśli otrzymano 6,0 g tlenku magnezu? Odp. 3,60 g 5.2. Do 50 cm 3 roztworu kwasu siarkowego (VI) o stężeniu
Zadanie: 2 (1 pkt) Zmieszano 100 g 30% roztworu azotanu (V) sodu z 500 g wody. Oblicz Cp otrzymanego roztworu.
 Zadanie: 1 (1 pkt) Oblicz rozpuszczalność chlorowodoru (HCl) w wodzie, jeśli wiesz, że stężony kwas solny, czyli nasycony wodny roztwór chlorowodoru ma stężenie 36%. Zadanie: 2 (1 pkt) Zmieszano 100 g
Zadanie: 1 (1 pkt) Oblicz rozpuszczalność chlorowodoru (HCl) w wodzie, jeśli wiesz, że stężony kwas solny, czyli nasycony wodny roztwór chlorowodoru ma stężenie 36%. Zadanie: 2 (1 pkt) Zmieszano 100 g
Rodzajowy rachunek kosztów Wycena zuŝycia materiałów
 Rodzajowy achunek kosztów (wycena zuŝycia mateiałów) Wycena zuŝycia mateiałów ZuŜycie mateiałów moŝe być miezone, wyceniane, dokumentowane i ewidencjonowane w óŝny sposób. Stosowane metody wywieają jednak
Rodzajowy achunek kosztów (wycena zuŝycia mateiałów) Wycena zuŝycia mateiałów ZuŜycie mateiałów moŝe być miezone, wyceniane, dokumentowane i ewidencjonowane w óŝny sposób. Stosowane metody wywieają jednak
Nazwy pierwiastków: A +Fe 2(SO 4) 3. Wzory związków: A B D. Równania reakcji:
 Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
2.4. ZADANIA STECHIOMETRIA. 1. Ile moli stanowi:
 2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
00502 Podstawy kinematyki D Część 2 Iloczyn wektorowy i skalarny. Wektorowy opis ruchu. Względność ruchu. Prędkość w ruchu prostoliniowym.
 1 00502 Kinematyka D Dane osobowe właściciela akusza 00502 Podstawy kinematyki D Część 2 Iloczyn wektoowy i skalany. Wektoowy opis uchu. Względność uchu. Pędkość w uchu postoliniowym. Instukcja dla zdającego
1 00502 Kinematyka D Dane osobowe właściciela akusza 00502 Podstawy kinematyki D Część 2 Iloczyn wektoowy i skalany. Wektoowy opis uchu. Względność uchu. Pędkość w uchu postoliniowym. Instukcja dla zdającego
WYDZIAŁ FIZYKI, MATEMATYKI I INFORMATYKI POLITECHNIKI KRAKOWSKIEJ Instytut Fizyki LABORATORIUM PODSTAW ELEKTROTECHNIKI, ELEKTRONIKI I MIERNICTWA
 WYDZIAŁ FIZYKI, MATEMATYKI I INFORMATYKI POITEHNIKI KRAKOWSKIEJ Instytut Fizyki ABORATORIUM PODSTAW EEKTROTEHNIKI, EEKTRONIKI I MIERNITWA ĆWIZENIE 7 Pojemność złącza p-n POJĘIA I MODEE potzebne do zozumienia
WYDZIAŁ FIZYKI, MATEMATYKI I INFORMATYKI POITEHNIKI KRAKOWSKIEJ Instytut Fizyki ABORATORIUM PODSTAW EEKTROTEHNIKI, EEKTRONIKI I MIERNITWA ĆWIZENIE 7 Pojemność złącza p-n POJĘIA I MODEE potzebne do zozumienia
Chemiczne metody analizy ilościowej (laboratorium)
 Cheicze etody aalizy ilościowej (laboratoriu) Broiaoetria 9. Przygotowaie iaowaego roztworu broiau (V) potasu Broia(V) potasu ależy do stosowaych w aalizie cheiczej substacji podstawowych. oże być otrzyay
Cheicze etody aalizy ilościowej (laboratoriu) Broiaoetria 9. Przygotowaie iaowaego roztworu broiau (V) potasu Broia(V) potasu ależy do stosowaych w aalizie cheiczej substacji podstawowych. oże być otrzyay
MAŁOPOLSKI KONKURS CHEMICZNY
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu 8 października 2018 r. Etap I (szkolny) Wypełnia Szkolna
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu 8 października 2018 r. Etap I (szkolny) Wypełnia Szkolna
XXV KONKURS CHEMICZNY DLA GIMNAZJALISTÓW
 IMIĘ I NZWISKO PUNKTCJ SZKOŁ KLS NZWISKO NUCZYCIEL CHEMII I LICEUM OGÓLNOKSZTŁCĄCE Inowrocław 12 maja 2018 Im. Jana Kasprowicza INOWROCŁW XXV KONKURS CHEMICZNY DL GIMNZJLISTÓW ROK SZKOLNY 2017/2018 ZDNIE
IMIĘ I NZWISKO PUNKTCJ SZKOŁ KLS NZWISKO NUCZYCIEL CHEMII I LICEUM OGÓLNOKSZTŁCĄCE Inowrocław 12 maja 2018 Im. Jana Kasprowicza INOWROCŁW XXV KONKURS CHEMICZNY DL GIMNZJLISTÓW ROK SZKOLNY 2017/2018 ZDNIE
= ± Ne N - liczba całkowita.
 POL LKTRYCZN W PRÓŻNI Ładunek - elementany Nieodłączna własność niektóych cząstek elementanych, [n. elektonu (-e), otonu (+e)], zejawiająca się w oddziaływaniu elektomagnetycznym tych cząstek. e =,6-9
POL LKTRYCZN W PRÓŻNI Ładunek - elementany Nieodłączna własność niektóych cząstek elementanych, [n. elektonu (-e), otonu (+e)], zejawiająca się w oddziaływaniu elektomagnetycznym tych cząstek. e =,6-9
gdzie m w określa masę węglowodoru, a m r masę całego roztworu. Wyniki zanotować w tabeli. cpods
 Oznaczanie węglowodorów ropopochodnych w wodach i ściekach z zastosowanie techniki analizy fazy nadpowierzchniowej i chroatografii gazowej (Headspace-CG-MS) Wykonanie ćwiczenia Materiały, przyrządy i odczynniki:
Oznaczanie węglowodorów ropopochodnych w wodach i ściekach z zastosowanie techniki analizy fazy nadpowierzchniowej i chroatografii gazowej (Headspace-CG-MS) Wykonanie ćwiczenia Materiały, przyrządy i odczynniki:
Zad: 5 Oblicz stężenie niezdysocjowanego kwasu octowego w wodnym roztworze o stężeniu 0,1 mol/dm 3, jeśli ph tego roztworu wynosi 3.
 Zad: 1 Oblicz wartość ph dla 0,001 molowego roztworu HCl Zad: 2 Oblicz stężenie jonów wodorowych jeżeli wartość ph wynosi 5 Zad: 3 Oblicz stężenie jonów wodorotlenkowych w 0,05 molowym roztworze H 2 SO
Zad: 1 Oblicz wartość ph dla 0,001 molowego roztworu HCl Zad: 2 Oblicz stężenie jonów wodorowych jeżeli wartość ph wynosi 5 Zad: 3 Oblicz stężenie jonów wodorotlenkowych w 0,05 molowym roztworze H 2 SO
Elektrochemia - prawa elektrolizy Faraday a. Zadania
 Elektrochemia - prawa elektrolizy Faraday a Zadania I prawo Faraday a Masa substancji wydzielonej na elektrodach podczas elektrolizy jest proporcjonalna do natężenia prądu i czasu trwania elektrolizy q
Elektrochemia - prawa elektrolizy Faraday a Zadania I prawo Faraday a Masa substancji wydzielonej na elektrodach podczas elektrolizy jest proporcjonalna do natężenia prądu i czasu trwania elektrolizy q
WYMAGANIA EDUKACYJNE
 GIMNAZJUM NR 2 W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie II gimnazjum str. 1 Wymagania edukacyjne niezbędne do
GIMNAZJUM NR 2 W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie II gimnazjum str. 1 Wymagania edukacyjne niezbędne do
AKADEMIA GÓRNICZO-HUTNICZA im. Stanisława Staszica w Krakowie OLIMPIADA O DIAMENTOWY INDEKS AGH 2017/18 CHEMIA - ETAP I
 Związki manganu i manganometria AKADEMIA GÓRNICZO-HUTNICZA 1. Spośród podanych grup wybierz tą, w której wszystkie związki lub jony można oznaczyć metodą manganometryczną: Odp. C 2 O 4 2-, H 2 O 2, Sn
Związki manganu i manganometria AKADEMIA GÓRNICZO-HUTNICZA 1. Spośród podanych grup wybierz tą, w której wszystkie związki lub jony można oznaczyć metodą manganometryczną: Odp. C 2 O 4 2-, H 2 O 2, Sn
Kuratorium Oświaty w Lublinie ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI
 Kuratorium Oświaty w Lublinie.. Imię i nazwisko ucznia Pełna nazwa szkoły Liczba punktów ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI Instrukcja dla ucznia
Kuratorium Oświaty w Lublinie.. Imię i nazwisko ucznia Pełna nazwa szkoły Liczba punktów ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI Instrukcja dla ucznia
LIST EMISYJNY nr 3 /2014 Ministra Finansów
 LIST EMISYJNY n /0 Minista Finansów z dnia stycznia 0. w spawie emisji kótkookesowych oszczędnościowych obligacji skabowych o opocentowaniu stałym ofeowanych w sieci spzedaży detalicznej Na podstawie at.
LIST EMISYJNY n /0 Minista Finansów z dnia stycznia 0. w spawie emisji kótkookesowych oszczędnościowych obligacji skabowych o opocentowaniu stałym ofeowanych w sieci spzedaży detalicznej Na podstawie at.
Fizyka 9. Janusz Andrzejewski
 Fizyka 9 Janusz Andzejewski R K Księżyc kążący wokół iei (Rozważania Newtona) Pzyśpieszenie dośodkowe księżyca 4πRK ak = T Wstawiając dane dla obity księżyca: R K = 3.86 10 T = 7. 3dnia 5 k R 6300 = 386000
Fizyka 9 Janusz Andzejewski R K Księżyc kążący wokół iei (Rozważania Newtona) Pzyśpieszenie dośodkowe księżyca 4πRK ak = T Wstawiając dane dla obity księżyca: R K = 3.86 10 T = 7. 3dnia 5 k R 6300 = 386000
Obliczanie wydajności reakcji
 bliczanie wydajności reakcji Wydajność reakcji chemicznej (W) jest to stosunek masy produktu (m p ) otrzymanej w wyniku przeprowadzenia reakcji chemicznej do masy tego produktu (m t ) wynikającej z równania
bliczanie wydajności reakcji Wydajność reakcji chemicznej (W) jest to stosunek masy produktu (m p ) otrzymanej w wyniku przeprowadzenia reakcji chemicznej do masy tego produktu (m t ) wynikającej z równania
OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIARÓW PRZEWODNICTWA. OZNACZANIE STĘŻENIA WODOROTLENKU SODU METODĄ MIARECZKOWANIA KONDUKTOMETRYCZNEGO
 OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIAÓW PZEWODNICTWA. OZNACZANIE STĘŻENIA WODOOTLENKU SODU METODĄ MIAECZKOWANIA KONDUKTOMETYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIAÓW PZEWODNICTWA. OZNACZANIE STĘŻENIA WODOOTLENKU SODU METODĄ MIAECZKOWANIA KONDUKTOMETYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
Wyrażanie stężeń. Materiały pomocnicze do zajęć wspomagających z chemii. opracował: dr Błażej Gierczyk Wydział Chemii UAM
 Wyrażanie stężeń Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Stężenie procentowe Stężenie procentowe (procent wagowy, procent masowy) wyraża stosunek
Wyrażanie stężeń Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Stężenie procentowe Stężenie procentowe (procent wagowy, procent masowy) wyraża stosunek
Obliczanie stężeń roztworów
 Obliczanie stężeń roztworów 1. Ile mililitrów stężonego, ok. 2,2mol/l (M) roztworu NaOH należy pobrać, aby przygotować 800ml roztworu o stężeniu ok. 0,2 mol/l [ M ]? {ok. 72,7ml 73ml } 2. Oblicz, jaką
Obliczanie stężeń roztworów 1. Ile mililitrów stężonego, ok. 2,2mol/l (M) roztworu NaOH należy pobrać, aby przygotować 800ml roztworu o stężeniu ok. 0,2 mol/l [ M ]? {ok. 72,7ml 73ml } 2. Oblicz, jaką
XXII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2014/2015
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 23 maja 2015 Im. Jana Kasprowicza INOWROCŁAW XXII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 23 maja 2015 Im. Jana Kasprowicza INOWROCŁAW XXII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
MARATON WIEDZY CHEMIA CZ. II
 MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
WYKŁAD Z CHEMII OGÓLNEJ
 WYKŁD Z HEII OGÓLEJ dr Sylwester. Stępniak Katedra heii, SGGW Zakład heii Żywności http://sylwester_stepniak.users.sggw.pl PROGR WYKŁDÓW W_1. heia nauka opisująca właściwości Rzeczywistości W_2. Przeiany
WYKŁD Z HEII OGÓLEJ dr Sylwester. Stępniak Katedra heii, SGGW Zakład heii Żywności http://sylwester_stepniak.users.sggw.pl PROGR WYKŁDÓW W_1. heia nauka opisująca właściwości Rzeczywistości W_2. Przeiany
Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.
![Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów. Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.](/thumbs/97/131732752.jpg) 2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
Graf skierowany. Graf zależności dla struktur drzewiastych rozgrywających parametrycznie
 Gaf skieowany Gaf skieowany definiuje się jako upoządkowaną paę zbioów. Piewszy z nich zawiea wiezchołki gafu, a dugi składa się z kawędzi gafu, czyli upoządkowanych pa wiezchołków. Ruch po gafie możliwy
Gaf skieowany Gaf skieowany definiuje się jako upoządkowaną paę zbioów. Piewszy z nich zawiea wiezchołki gafu, a dugi składa się z kawędzi gafu, czyli upoządkowanych pa wiezchołków. Ruch po gafie możliwy
ROZWIĄZUJEMY PROBLEM RÓWNOWAŻNOŚCI MASY BEZWŁADNEJ I MASY GRAWITACYJNEJ.
 ROZWIĄZUJEMY PROBLEM RÓWNOWAŻNOŚCI MASY BEZWŁADNEJ I MASY GRAWITACYJNEJ. STRESZCZENIE Na bazie fizyki klasycznej znaleziono nośnik ładunku gawitacyjnego, uzyskano jedność wszystkich odzajów pól ( elektycznych,
ROZWIĄZUJEMY PROBLEM RÓWNOWAŻNOŚCI MASY BEZWŁADNEJ I MASY GRAWITACYJNEJ. STRESZCZENIE Na bazie fizyki klasycznej znaleziono nośnik ładunku gawitacyjnego, uzyskano jedność wszystkich odzajów pól ( elektycznych,
Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia. Zdolność do wykonywania pracy lub produkowania ciepła
 Jak miezyć i jak liczyć efekty cieplne eakcji? Enegia Zdolność do wykonywania pacy lub podukowania ciepła Paca objętościowa paca = siła odległość 06_73 P = F A W = F h N m = J P = F A Aea = A ciśnienie
Jak miezyć i jak liczyć efekty cieplne eakcji? Enegia Zdolność do wykonywania pacy lub podukowania ciepła Paca objętościowa paca = siła odległość 06_73 P = F A W = F h N m = J P = F A Aea = A ciśnienie
