REAKCJE CHEMICZNE. syntezy. analizy. wymiany AB A + B. rodzaje reakcji chemicznych reakcje: H 2 SO NaOH A + B AB 2 H 2 + O 2 = 2H 2 O
|
|
|
- Sylwester Karczewski
- 7 lat temu
- Przeglądów:
Transkrypt
1 REAKCJE CHEMICZNE rodzaje reakji hemiznyh reakje: 1. syntezy. analizy 3. wymiany 4. substytuji 5. addyji 6. eliminaji 7. polimeryzaji reakja hemizna to każdy proes w wyniku którego następuje zrywanie i/lub powstawanie nowyh wiązań hemiznyh reakje proste i złożone reakja prosta, to prosty akt zerwania lub powstania jednego wiązania hemiznego Cl Cl + Cl -Cl pod wpływem światła UV reakje złożone, w któryh dohodzi jednoześnie do rozpadu jednyh wiązań i powstania drugih 1 każdą reakje złożoną można "rozłożyć" na wyimaginowany iąg reakji prostyh, H SO 4 + NaOH CH 3 COOH + CH 3 OH H O reakja nieodwraalna H + reakja równowagowa Na SO 4 + H O CH 3 COOCH 3 + H O syntezy z dwu lub więej substanji prostszyh powstaje jedna substanja złożona o odmiennyh właśiwośiah hemiznyh i fizyznyh A + B H + O H O Substraty A + B Kierunek reakji Produkty CaO + CO CaCO 3 N O 5 + H O HNO analizy z jednej substanji złożonej powstają dwie lub kilka substanji prostszyh, różniąyh się od substratu właśiwośiami fizyznymi i hemiznymi Substraty HgO Hg + O A + B Kierunek reakji odwrotność reakji syntezy Produkty A + B MgCO 3 MgO +CO Ca(NO 3 ) CaO +4NO +O wymiana pojedynza (reakja wypierania) - z jednego związku hemiznego i jednego pierwiastka powstaje inny związek hemizny i inny, mniej aktywny pierwiastek Substraty A +BC wymiany A + BC AC + B Zn+HClZnCl +H Kierunek reakji Produkty AC + B Fe +HCl FeCl +H K + H O KOH+1/ H 5 6
2 wymiana podwójna - biorą udział dwa związki hemizne i jako produkty powstają nowe dwa związki + CD AD + BC BaCl + K SO 4 BaSO 4 + KCl Substraty CD Kierunek reakji Produkty AD + BC CaSO 4 + Na CO 3 CaCO 3 + Na SO 4 substytuji reakje substytuji - zyli inazej reakje podstawienia w ząsteze następuje wymiana jakiegoś atomu lub ih grupy hν C H 6 + Cl C H 5 Cl + HCl H SO 4 + Ca(OH) CaSO 4 +H O 7 8 addyji reakje addyji - zyli inazej reakje dodawania reagująa ząstezka ulega powiększeniu o jakiś atom lub grupę atomów. reakja przyłązenia - (przyłązenie, addyja), reakja syntezy polegająa na łązeniu się dwóh ząstezek organiznyh w jedną, zahodząa ze zmniejszeniem krotnośi wiązania wielokrotnego eliminaji reakje eliminaji - zyli inazej reakje oderwania od ząstezki odrywa się jakiś atom lub grupa atomów i ni innego się w to miejse nie przyłąza CH 3 -CH -CH -OHCH 3 -CHCH + H O CH CH + HCl CH 3 -CH Cl CH CH + Cl CH Cl-CH Cl 9 10 polimeryzaji polimeryzaja polega na łązeniu się małyh ząstezek w bardzo duże związek składająy się z tyh bardzo dużyh ząstezek polimer proste związki, z któryh tworzą się polimery monomer KINETYKA I STATYKA REAKCJI CHEMICZNYCH proes podzas którego powstają nowe substanje, nazywamy przemianą hemizną przebieg przemiany hemiznej jest opisany równaniem hemiznym sam proes nazywany jest reakją hemizną aby reakja hemizna była możliwa koniezna jest: 11 obeność ząstek substratów musi dohodzić do zderzeń między ząstkami w momenie zderzenia musi zaistnieć korzystne przestrzenne położenie ząstek względem siebie w momenie zderzenia energia kinetyzna ząstek musi być wyższa od określonej energii minimalnej 1
3 wpływ temperatury szybkość reakji rośnie, ponieważ wzrasta ilość ząstek o energii większej od energii minimalnej konieznej do zapozątkowania zderzeń skuteznyh między ząstkami i zaszła przemiana hemizna. energia minimalna - energia aktywaji energia aktywaji - najmniejsza ilość energii potrzebna do zapozątkowania reakji hemiznej r Svante August Arrhenius sformułował zależność zmian stałej szybkośi reakji k, od zmiany temperatury szwedzki hemik 17 wpływ temperatury na stałą szybkośi reakji opisuje równanie Arrheniusa: k Ae k - stała szybkośi reakji A współzynnik E A - energia aktywaji; R - stała gazowa T - temperatura w kelwinah e - lizba Eulera, podstawa logarytmu naturalnego podwyższenie temperatury o 10 o C podwaja w przybliżeniu szybkość reakji RT E A 18
4 energia produktów - mniejsza od energii substratów reakja egzotermizna (wydzielanie iepła) E s > E p energia produktów - większa od energii substratów reakja endotermizna (pohłanianie iepła) E s < E p Reakja egzotermizna (egzergonizna) iepło opuszza układ H<0 otozenie iepło układ Reakja egndotermizna (endergonizna) układ pobiera iepło układ H>0 H entalpia otozenie iepło układ przemiany energetyzne w zasie reakji hemiznej 19 0 reakja z katalizatorem 1 wpływ katalizatorów katalizator substanja, która bierze udział w etapah elementarnyh reakji ale nie whodzi w skład produktów reakji, a po jej zakońzeniu masa jego pozostaje niezmieniona zjawisko przyspieszania reakji hemiznej przez katalizator nosi nazwę katalizy działanie katalizatorów obniżanie energii aktywaji na skutek zmiany mehanizmu reakji. ilość katalizatora użyta w reakji jest niewielka, a po reakji można go odzyskać A + B wolno A + B + K K szybko 3 K + K szybko 4
5 1) A+B ) A+B A + B d v ± dt 1) A+B v k n m 1 1 A B ) A+B p v k 5 6 v k n m p 1 1 A B v k A+B A+B A + B v v 1 n m k1 k p n m k1 k K p 7 zmiany stężenia w zasie 8 aa + bb m M a A n N b B K mm + nn 9 m M a A n N b B Prawo działania mas W stanie równowagi hemiznej ilozyn stężeń produktów reakji podniesionyh do odpowiednih potęg, podzielony przez ilozyn stężeń substratów reakji, także podniesionyh do odpowiednih K potęg, ma wartość stałą 30
6 Przykład W nazyniu reakyjnym do syntezy jodowodoru umieszzono 4 mole wodoru i mole jodu. Stała równowagi reakji syntezy jodowodoru K 50. Obliz skład mieszaniny w stanie równowagi. H + I HI HI K H I 31 H + I HI W wyniku reakji z jednego mola wodoru i jednego mola jodu powstają mole HI. x ilość reagująego H i I W stanie równowagi w nazyniu reakyjnym będzie znajdować się x moli HI, (4-x) moli wodoru i (-x) moli jodu (x) 50 (4 x)( x) x 1,86 3 W równaniah kinetyznyh oraz w równaniah na stałą równowagi hemiznej śisły obraz odzwieriedlają zależnośi, w któryh zamiast stężeń wstawia się odpowiednie aktywnośi. a f* reakja endotermizna: KCl (s) + H O KCl (aq) -Q Reakjom hemiznym towarzyszą zęsto efekty energetyzne lub/i zmiany objętośi (iśnienia) układu. reakja egzotermizna: Li CO 3(s) + H O Li CO 3(aq) +Q wzrost objętośi (iśnienia) N O 4 NO 36 zmniejszenie objętośi (iśnienia) N + 3H NH 3 37
7 Reguła Le Chateliera- Brauna (przekory) Jeżeli układ będąy w stanie równowagi poddamy działaniu zewnętrznemu, to w układzie tym nastąpią zmiany zmierzająe do osłabienia skutków tego działania 38 T s T s p p NO NH 3 reakja endotermizna: KCl (s) + H O KCl (aq) -Q reakja egzotermizna: Li CO 3(s) + H O Li CO 3(aq) +Q wzrost objętośi (iśnienia) N O 4 NO zmniejszenie objętośi (iśnienia) N + 3H NH 3 40
Stan równowagi chemicznej
 Stan równowagi hemiznej Równowaga hemizna to taki stan układu złożonego z roduktów i substratów dowolnej reakji odwraalnej, w którym szybkość owstawania roduktów jest równa szybkośi ih rozadu Odwraalność
Stan równowagi hemiznej Równowaga hemizna to taki stan układu złożonego z roduktów i substratów dowolnej reakji odwraalnej, w którym szybkość owstawania roduktów jest równa szybkośi ih rozadu Odwraalność
Ćwiczenie 2 Reakcje chemiczne
 Ćwizenie 2 Reakje hemizne Część teoretyzna Reakjami hemiznymi nazywamy proesy, w zasie któryh w wyniku zderzenia się dwóh lub większej ilośi ząstezek (ząstezek, atomów, wolnyh rodników lub jonów) powstają
Ćwizenie 2 Reakje hemizne Część teoretyzna Reakjami hemiznymi nazywamy proesy, w zasie któryh w wyniku zderzenia się dwóh lub większej ilośi ząstezek (ząstezek, atomów, wolnyh rodników lub jonów) powstają
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
Odwracalność przemiany chemicznej
 Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
Wykład z Chemii Ogólnej i Nieorganicznej
 Wykład z Chemii Ogólnej i Nieorganicznej Część 5 ELEMENTY STATYKI CHEMICZNEJ Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja Kopernika w Toruniu Prof. dr hab. n.chem.
Wykład z Chemii Ogólnej i Nieorganicznej Część 5 ELEMENTY STATYKI CHEMICZNEJ Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja Kopernika w Toruniu Prof. dr hab. n.chem.
Kinetyka reakcji chemicznych. Dr Mariola Samsonowicz
 Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
1 Kinetyka reakcji chemicznych
 Podstawy obliczeń chemicznych 1 1 Kinetyka reakcji chemicznych Szybkość reakcji chemicznej definiuje się jako ubytek stężenia substratu lub wzrost stężenia produktu w jednostce czasu. ν = c [ ] 2 c 1 mol
Podstawy obliczeń chemicznych 1 1 Kinetyka reakcji chemicznych Szybkość reakcji chemicznej definiuje się jako ubytek stężenia substratu lub wzrost stężenia produktu w jednostce czasu. ν = c [ ] 2 c 1 mol
Przemiany/Reakcje chemiczne
 Przemiany/Reakcje chemiczne Przemiany/Reakcje chemiczne Reakcje chemiczne są to takie przemiany, w wyniku których z jednych substancji powstają inne substancje, o zupełnie odmiennych właściwościach fizycznych
Przemiany/Reakcje chemiczne Przemiany/Reakcje chemiczne Reakcje chemiczne są to takie przemiany, w wyniku których z jednych substancji powstają inne substancje, o zupełnie odmiennych właściwościach fizycznych
PODSTAWY CHEMII INŻYNIERIA BIOMEDYCZNA. Wykład 3
 PODSTAWY CHEMII INŻYNIERIA BIOMEDYCZNA Wykład Teoria elektrolitów monyh: wprowadzenie Struktura kationu w roztworze wodnym Atmosfera jonowa 8.10.017 Inżynieria Biomedyzna, I rok Roztwór rozieńzony Roztwór
PODSTAWY CHEMII INŻYNIERIA BIOMEDYCZNA Wykład Teoria elektrolitów monyh: wprowadzenie Struktura kationu w roztworze wodnym Atmosfera jonowa 8.10.017 Inżynieria Biomedyzna, I rok Roztwór rozieńzony Roztwór
Kinetyka i równowaga reakcji chemicznej
 Kinetyka i równowaga reakcji chemicznej W przebiegu reakcji chemicznych interesujące są dwa aspekty zachodzących przemian: 1. rodzaj substratów i otrzymanych z nich produktów, 2. szybkość, z jaką substraty
Kinetyka i równowaga reakcji chemicznej W przebiegu reakcji chemicznych interesujące są dwa aspekty zachodzących przemian: 1. rodzaj substratów i otrzymanych z nich produktów, 2. szybkość, z jaką substraty
a) 1 mol b) 0,5 mola c) 1,7 mola d) potrzebna jest znajomość objętości zbiornika, aby można było przeprowadzić obliczenia
 1. Oblicz wartość stałej równowagi reakcji: 2HI H 2 + I 2 w temperaturze 600K, jeśli wiesz, że stężenia reagentów w stanie równowagi wynosiły: [HI]=0,2 mol/dm 3 ; [H 2 ]=0,02 mol/dm 3 ; [I 2 ]=0,024 mol/dm
1. Oblicz wartość stałej równowagi reakcji: 2HI H 2 + I 2 w temperaturze 600K, jeśli wiesz, że stężenia reagentów w stanie równowagi wynosiły: [HI]=0,2 mol/dm 3 ; [H 2 ]=0,02 mol/dm 3 ; [I 2 ]=0,024 mol/dm
RÓWNOWAGI W ROZTWORACH WODNYCH
 RÓWNOWG W ROZTWORCH WODNYCH Substanje hemizne, zgodnie z teorią dysojaji elektrolityznej S. rrheniusa, możemy podzielić na elektrolity i nieelektrolity. Elektrolity występują w roztworze w postai ząstek
RÓWNOWG W ROZTWORCH WODNYCH Substanje hemizne, zgodnie z teorią dysojaji elektrolityznej S. rrheniusa, możemy podzielić na elektrolity i nieelektrolity. Elektrolity występują w roztworze w postai ząstek
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego:
 1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych
 Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
Inżynieria Biomedyczna
 1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
Wykład 10 Równowaga chemiczna
 Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Mieszaniny. Roztwory. mieszaniny jednorodne. rozdzielanie mieszanin. mieszaniny niejednorodne
 Roztwory Mieszaniny mieszaniny niejednorodne (heterogenizne) mieszaniny jednorodne (homogenizne) podział roztworów i harakterystyka roztworów wodnyh sposoby wyrażania stężeń Mieszaniny występują we wszystkih
Roztwory Mieszaniny mieszaniny niejednorodne (heterogenizne) mieszaniny jednorodne (homogenizne) podział roztworów i harakterystyka roztworów wodnyh sposoby wyrażania stężeń Mieszaniny występują we wszystkih
Równowaga to stan w którym nie obserwuje się zmian wraz z upływem czasu
 Równowaa chemiczna Równowaa to stan w którym nie obserwuje się zmian wraz z upływem czasu Reakcja chemiczna osiąa stan równowai dy stężenia substratów i produktów nie uleają zmianie pozostają stałe. ozornie
Równowaa chemiczna Równowaa to stan w którym nie obserwuje się zmian wraz z upływem czasu Reakcja chemiczna osiąa stan równowai dy stężenia substratów i produktów nie uleają zmianie pozostają stałe. ozornie
Wykład 21 XI 2018 Żywienie
 Wykład 21 XI 2018 Żywienie Witold Bekas SGGW Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od warunków przebiegu reakcji pomaga
Wykład 21 XI 2018 Żywienie Witold Bekas SGGW Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od warunków przebiegu reakcji pomaga
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
Przykładowe rozwiązania zadań obliczeniowych
 1 CHEMIA zbiór zadań matura 2018 tom I Przykładowe rozwiązania zadań obliczeniowych 2 Spis treści 1.Stechiometria chemiczna... 3 2.Struktura atomu... 13 4.Kinetyka i statyka chemiczna... 14 5.Roztwory
1 CHEMIA zbiór zadań matura 2018 tom I Przykładowe rozwiązania zadań obliczeniowych 2 Spis treści 1.Stechiometria chemiczna... 3 2.Struktura atomu... 13 4.Kinetyka i statyka chemiczna... 14 5.Roztwory
Mieszaniny. Roztwory. rozdzielanie mieszanin
 Roztwory Mieszaniny mieszaniny niejednorodne (heterogenizne) mieszaniny jednorodne (homogenizne) podział roztworów i harakterystyka roztworów wodnyh sposoby wyrażania stężeń Mieszaniny występują we wszystkih
Roztwory Mieszaniny mieszaniny niejednorodne (heterogenizne) mieszaniny jednorodne (homogenizne) podział roztworów i harakterystyka roztworów wodnyh sposoby wyrażania stężeń Mieszaniny występują we wszystkih
Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. a RT.
 Ćwiczenie 12, 13. Kinetyka chemiczna. Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. Szybkość reakcji chemicznej jest związana
Ćwiczenie 12, 13. Kinetyka chemiczna. Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. Szybkość reakcji chemicznej jest związana
analogicznie: P g, K g, N g i Mg g.
 Zadanie 1 Obliczamy zawartość poszczególnych składników w 10 m 3 koncentratu: Ca: 46 g Ca - 1 dm 3 roztworu x g Ca - 10000 dm 3 roztworu x = 460000 g Ca analogicznie: P 170000 g, K 10000 g, N 110000 g
Zadanie 1 Obliczamy zawartość poszczególnych składników w 10 m 3 koncentratu: Ca: 46 g Ca - 1 dm 3 roztworu x g Ca - 10000 dm 3 roztworu x = 460000 g Ca analogicznie: P 170000 g, K 10000 g, N 110000 g
Jak osiągnąć 100% wydajności reakcji?
 Jak osiągnąć 100% wydajnośi reakji? Stan równowagi ois termodynamizny G 0 A A G + RT ln(q)o B B C (a) (b) wówzas G - RT ln() stała równowagi a) G
Jak osiągnąć 100% wydajnośi reakji? Stan równowagi ois termodynamizny G 0 A A G + RT ln(q)o B B C (a) (b) wówzas G - RT ln() stała równowagi a) G
Definicja szybkości reakcji. Szybkości reakcji. Równanie kinetyczne reakcji ...
 Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany v zmiana stężenia zas potrzebny do zajśia dx
Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany v zmiana stężenia zas potrzebny do zajśia dx
Chemia ogólna nieorganiczna Wykład XII Kinetyka i statyka chemiczna
 Chemia ogólna nieorganiczna Wykład 10 14 XII 2016 Kinetyka i statyka chemiczna Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od
Chemia ogólna nieorganiczna Wykład 10 14 XII 2016 Kinetyka i statyka chemiczna Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od
Inżynieria Biomedyczna
 1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
Dysocjacja kwasów i zasad. ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to:
 Stała równowagi dysocjacji: Dysocjacja kwasów i zasad HX H 2 O H 3 O X - K a [ H 3O [ X [ HX [ H O 2 ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to: K a [ H 3 O [ X [ HX Dla słabych kwasów
Stała równowagi dysocjacji: Dysocjacja kwasów i zasad HX H 2 O H 3 O X - K a [ H 3O [ X [ HX [ H O 2 ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to: K a [ H 3 O [ X [ HX Dla słabych kwasów
Wzory sumaryczne i strukturalne związków
 Wzory sumaryczne i strukturalne związków H S H 3 PO 4 SO CH 4 H SO 4 OHC H 5 NH Wzory sumaryczne i strukturalne związków H SO 4 CuSO 4 siarczanvi miedziii K SO 4 siarczanvi potasu Fe SO 4 3 siarczanvi
Wzory sumaryczne i strukturalne związków H S H 3 PO 4 SO CH 4 H SO 4 OHC H 5 NH Wzory sumaryczne i strukturalne związków H SO 4 CuSO 4 siarczanvi miedziii K SO 4 siarczanvi potasu Fe SO 4 3 siarczanvi
Definicja szybkości reakcji
 Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
Problemy do samodzielnego rozwiązania
 Problemy do samodzielnego rozwiązania 1. Napisz równania reakcji dysocjacji elektrolitycznej, uwzględniając w zapisie czy jest to dysocjacja mocnego elektrolitu, słabego elektrolitu, czy też dysocjacja
Problemy do samodzielnego rozwiązania 1. Napisz równania reakcji dysocjacji elektrolitycznej, uwzględniając w zapisie czy jest to dysocjacja mocnego elektrolitu, słabego elektrolitu, czy też dysocjacja
Definicja szybkości reakcji
 Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
Pojęcie soli, kwasów i zasad
 Pojęie soli, kwasów i zasad Sole, kwasy i zasady należą do podstawowyh rodzajów substanji hemiznyh. Najdawniej znane jest pojęie soli. Nazwa soli wywodzi od się od łaińskiego słowa sal i określała pozątkowo
Pojęie soli, kwasów i zasad Sole, kwasy i zasady należą do podstawowyh rodzajów substanji hemiznyh. Najdawniej znane jest pojęie soli. Nazwa soli wywodzi od się od łaińskiego słowa sal i określała pozątkowo
fermentacja alkoholowa erozja skał lata dni KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 min Karkonosze Pielgrzymy (1204 m n.p.m.)
 Kinetyka chemiczna lata erozja skał Karkonosze Pielgrzymy (1204 m n.p.m.) fermentacja alkoholowa dni min KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 s ms fs http://www2.warwick.ac.uk/fac/sci/chemistry/research/stavros/stavrosgroup/overview/
Kinetyka chemiczna lata erozja skał Karkonosze Pielgrzymy (1204 m n.p.m.) fermentacja alkoholowa dni min KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 s ms fs http://www2.warwick.ac.uk/fac/sci/chemistry/research/stavros/stavrosgroup/overview/
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I ... ... czas trwania: 90 min Nazwa szkoły
 V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
Przykładowe rozwiązania zadań obliczeniowych
 1 CHEMIA zbiór zadań matura 2018 tom II Przykładowe rozwiązania zadań obliczeniowych 2 Spis treści 1.Węglowodory... 3 2. Alkohole, fenole... 4 3. Estry i tłuszcze... 6 6. Związki organiczne zawierające
1 CHEMIA zbiór zadań matura 2018 tom II Przykładowe rozwiązania zadań obliczeniowych 2 Spis treści 1.Węglowodory... 3 2. Alkohole, fenole... 4 3. Estry i tłuszcze... 6 6. Związki organiczne zawierające
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów
 Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów Dział: Reakcje chemiczne. Podstawy obliczeń chemicznych. Kl. I LO Nr programu DKOS-4015-33-02 Nr zad. Sprawdzane wiadomości iumiejętności
Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów Dział: Reakcje chemiczne. Podstawy obliczeń chemicznych. Kl. I LO Nr programu DKOS-4015-33-02 Nr zad. Sprawdzane wiadomości iumiejętności
Opracował: dr inż. Tadeusz Lemek
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
OCENIANIE ARKUSZA POZIOM PODSTAWOWY
 Próbny egzamin maturalny z chemii OCENIANIE ARKUSZA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne
Próbny egzamin maturalny z chemii OCENIANIE ARKUSZA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne
Przemiany substancji
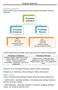 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Reakcje łańcuchowe. Etapy reakcji łańcuchowej
 Reakje łańuhowe Lizne reakje zahodząe w fazie gazowej oraz rekje polimeryzaji w fazie iekłej są reakjami łańuhowymi. W reakjah takih produkt pośredni jednego etapu generuje produkt pośredni w etapie następnym.
Reakje łańuhowe Lizne reakje zahodząe w fazie gazowej oraz rekje polimeryzaji w fazie iekłej są reakjami łańuhowymi. W reakjah takih produkt pośredni jednego etapu generuje produkt pośredni w etapie następnym.
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
Kinetyka. Kinetyka. Stawia dwa pytania: 1)Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? energia swobodna, G. postęp reakcji.
 Kinetyka energia swobodna, G termodynamika stan 1 kinetyka termodynamika stan 2 postęp reakcji 1 Kinetyka Stawia dwa pytania: 1)Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 2 Jak szybko
Kinetyka energia swobodna, G termodynamika stan 1 kinetyka termodynamika stan 2 postęp reakcji 1 Kinetyka Stawia dwa pytania: 1)Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 2 Jak szybko
Kinetyka. energia swobodna, G. postęp reakcji. stan 1 stan 2. kinetyka
 Kinetyka postęp reakcji energia swobodna, G termodynamika kinetyka termodynamika stan 1 stan 2 Kinetyka Stawia dwa pytania: 1) Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 1) Jak szybko
Kinetyka postęp reakcji energia swobodna, G termodynamika kinetyka termodynamika stan 1 stan 2 Kinetyka Stawia dwa pytania: 1) Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 1) Jak szybko
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH
 WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG
 WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG Imię i nazwisko: Klasa i szkoła*: Adres e-mail: Nr telefonu: Czy uczeń jest już uczestnikiem projektu? (odp. otoczyć kółkiem) Ocena
WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG Imię i nazwisko: Klasa i szkoła*: Adres e-mail: Nr telefonu: Czy uczeń jest już uczestnikiem projektu? (odp. otoczyć kółkiem) Ocena
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych
 Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
Jak osiągnąć 100% wydajności reakcji?
 Jak osiągnąć 100% wydajnośi reakji? Stan równowagi ois termodynamizny G 0 A A G + RT ln(q)o B B C (a) (b) wówzas G - RT ln() stała równowagi a) G
Jak osiągnąć 100% wydajnośi reakji? Stan równowagi ois termodynamizny G 0 A A G + RT ln(q)o B B C (a) (b) wówzas G - RT ln() stała równowagi a) G
Tlen. Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki
 Tlen Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki Ogólna charakterystyka tlenowców Tlenowce: obejmują pierwiastki
Tlen Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki Ogólna charakterystyka tlenowców Tlenowce: obejmują pierwiastki
X / \ Y Y Y Z / \ W W ... imię i nazwisko,nazwa szkoły, miasto
 Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
Relaksacja. Chem. Fiz. TCH II/19 1
 Relasaja Relasaja oznaza powrót uładu do stanu równowagi po zaburzeniu równowagi pierwotnej jaimś bodźem (wielośią zewnętrzną zmieniająą swoją wartość soowo, np. stężenie jednego z reagentów, iśnienie
Relasaja Relasaja oznaza powrót uładu do stanu równowagi po zaburzeniu równowagi pierwotnej jaimś bodźem (wielośią zewnętrzną zmieniająą swoją wartość soowo, np. stężenie jednego z reagentów, iśnienie
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
Procentowa zawartość sodu (w molu tej soli są dwa mole sodu) wynosi:
 Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
2.4. ZADANIA STECHIOMETRIA. 1. Ile moli stanowi:
 2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
WYZNACZANIE STAŁEJ SZYBKOŚCI I RZĘDU REAKCJI (Utlenianie jonów Fe 2+ jonami ClO 3
 Ćwizenie nr 4b WYZNACZANIE STAŁEJ SZYBKOŚCI I RZĘDU REAKCJI (Utlenianie jonów Fe + jonami ClO 3 w środowisku kwaśnym) I. Cel ćwizenia Celem ćwizenia jest wyznazenie rzędu reakji, stałej szybkośi reakji
Ćwizenie nr 4b WYZNACZANIE STAŁEJ SZYBKOŚCI I RZĘDU REAKCJI (Utlenianie jonów Fe + jonami ClO 3 w środowisku kwaśnym) I. Cel ćwizenia Celem ćwizenia jest wyznazenie rzędu reakji, stałej szybkośi reakji
Projekt Era inżyniera pewna lokata na przyszłość jest współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 TEMAT I WYBRANE WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH. STOPNIE UTLENIENIA. WIĄZANIA CHEMICZNE. WZORY SUMARYCZNE I STRUKTURALNE. TYPY REAKCJI CHEMICZNYCH. ILOŚCIOWA INTERPRETACJA WZORÓW I RÓWNAŃ CHEMICZNYCH
TEMAT I WYBRANE WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH. STOPNIE UTLENIENIA. WIĄZANIA CHEMICZNE. WZORY SUMARYCZNE I STRUKTURALNE. TYPY REAKCJI CHEMICZNYCH. ILOŚCIOWA INTERPRETACJA WZORÓW I RÓWNAŃ CHEMICZNYCH
Zn + S ZnS Utleniacz:... Reduktor:...
 Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
SPRAWOZDANIE do dwiczenia nr 7 Analiza jakościowa anionów I-VI grupy analitycznej oraz mieszaniny anionów I-VI grupy analitycznej.
 Obserwacje Imię i nazwisko:. Data:.. Kierunek studiów i nr grupy:.. próby:. Analiza systematyczna anionów* SPRAWOZDANIE 7 1. AgNO 3 Odczynnik/ środowisko Jony Cl Br I SCN [Fe(CN) 6 ] 4 [Fe(CN) 6 ] 3 2.
Obserwacje Imię i nazwisko:. Data:.. Kierunek studiów i nr grupy:.. próby:. Analiza systematyczna anionów* SPRAWOZDANIE 7 1. AgNO 3 Odczynnik/ środowisko Jony Cl Br I SCN [Fe(CN) 6 ] 4 [Fe(CN) 6 ] 3 2.
Jak mierzyć i jak liczyć efekty cieplne reakcji?
 Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub do produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie
Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub do produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
KI + Pb(NO 3 ) 2 PbI 2 + KNO 3. fermentacja alkoholowa
 Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
TYPY REAKCJI CHEMICZNYCH
 TYPY REAKCJI CHEMICZNYCH Opracowanie: dr inż Krystyna Moskwa, dr hab. Barbara Stypuła, mgr Agnieszka Tąta Reakcje chemiczne to procesy, w czasie których substancje ulegają przemianom, prowadzącym do powstawania
TYPY REAKCJI CHEMICZNYCH Opracowanie: dr inż Krystyna Moskwa, dr hab. Barbara Stypuła, mgr Agnieszka Tąta Reakcje chemiczne to procesy, w czasie których substancje ulegają przemianom, prowadzącym do powstawania
3p - za poprawne obliczenie stężenia procentowego i molowego; 2p - za poprawne obliczenie jednej wymaganej wartości;
 Zadanie Kryteria oceniania i model odpowiedzi Punktacja 1. 2. 3. 4. 2p - za poprawne 5 połączeń w pary zdań z kolumny I i II 1p - za poprawne 4 lub 3 połączenia w pary zdań z kolumny I i II 0p - za 2 lub
Zadanie Kryteria oceniania i model odpowiedzi Punktacja 1. 2. 3. 4. 2p - za poprawne 5 połączeń w pary zdań z kolumny I i II 1p - za poprawne 4 lub 3 połączenia w pary zdań z kolumny I i II 0p - za 2 lub
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów możliwa
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów możliwa
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM. Chemia Poziom rozszerzony
 KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Chemia Poziom rozszerzony Listopad 01 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Chemia Poziom rozszerzony Listopad 01 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
VII Podkarpacki Konkurs Chemiczny 2014/2015
 II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ
 Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
EGZAMIN MATURALNY Z CHEMII
 1 ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU ROZPOCZĘCIA EGZAMINU! EGZAMIN MATURALNY Z CHEMII MCH P1 MARZEC ROK 2012 POZIOM podstawowy Czas pracy 120 minut Instrukcja dla zdającego 1. Sprawdź,
1 ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU ROZPOCZĘCIA EGZAMINU! EGZAMIN MATURALNY Z CHEMII MCH P1 MARZEC ROK 2012 POZIOM podstawowy Czas pracy 120 minut Instrukcja dla zdającego 1. Sprawdź,
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY
 ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne z poleceniem
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne z poleceniem
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY
 ODPOWIEDZI I SEMAT PUNKTOWANIA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
ODPOWIEDZI I SEMAT PUNKTOWANIA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu
 Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
erozja skał lata KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 min Karkonosze Pielgrzymy (1204 m n.p.m.)
 Kinetyka chemiczna erozja skał Karkonosze Pielgrzymy (1204 m n.p.m.) fermentacja alkoholowa lata min KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 s ms fs http://www2.warwick.ac.uk/fac/sci/chemistry/research/stavros/stavrosgroup/overview/
Kinetyka chemiczna erozja skał Karkonosze Pielgrzymy (1204 m n.p.m.) fermentacja alkoholowa lata min KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 s ms fs http://www2.warwick.ac.uk/fac/sci/chemistry/research/stavros/stavrosgroup/overview/
Model odpowiedzi i schemat oceniania arkusza I
 Model odpowiedzi i schemat oceniania arkusza I Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Gdy do jednego polecenia zdający poda dwie
Model odpowiedzi i schemat oceniania arkusza I Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Gdy do jednego polecenia zdający poda dwie
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym
 1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów. 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań Maksymalna liczba punktów 40. 90% 36 pkt. Uwaga! 1. Wszystkie
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań Maksymalna liczba punktów 40. 90% 36 pkt. Uwaga! 1. Wszystkie
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY
 Próbny egzamin maturalny z chemii 0r. ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach.
Próbny egzamin maturalny z chemii 0r. ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach.
WOJEWÓDZKI KONKURS CHEMICZNY
 Kod ucznia Liczba punktów WOJWÓDZKI KONKURS CHMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2014/2015 16 STYCZNIA 2015 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
Kod ucznia Liczba punktów WOJWÓDZKI KONKURS CHMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2014/2015 16 STYCZNIA 2015 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
PODSTAWY CHEMII INŻYNIERIA BIOMEDYCZNA. Wykład 2
 PODSTAWY CHEMII INŻYNIERIA BIOMEDYCZNA Wykład Plan wykładu II,III Woda jako rozpuszzalnik Zjawisko dysojaji Równowaga w roztworah elektrolitów i o z tego wynika Bufory Hydroliza soli 015-10-17 Inżynieria
PODSTAWY CHEMII INŻYNIERIA BIOMEDYCZNA Wykład Plan wykładu II,III Woda jako rozpuszzalnik Zjawisko dysojaji Równowaga w roztworah elektrolitów i o z tego wynika Bufory Hydroliza soli 015-10-17 Inżynieria
PODSTAWY STECHIOMETRII
 PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Cz. I Stechiometria - Zadania do samodzielnego wykonania
 Cz. I Stechiometria - Zadania do samodzielnego wykonania A. Ustalenie wzoru rzeczywistego związku chemicznego na podstawie składu procentowego. Zadanie i metoda rozwiązania Ustal wzór rzeczywisty związku
Cz. I Stechiometria - Zadania do samodzielnego wykonania A. Ustalenie wzoru rzeczywistego związku chemicznego na podstawie składu procentowego. Zadanie i metoda rozwiązania Ustal wzór rzeczywisty związku
Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph
 Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph Dysocjacja elektrolitów W drugiej połowie XIX wieku szwedzki chemik S.A. Arrhenius doświadczalnie udowodnił, że substancje
Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph Dysocjacja elektrolitów W drugiej połowie XIX wieku szwedzki chemik S.A. Arrhenius doświadczalnie udowodnił, że substancje
Przykładowy zestaw zadań z chemii Odpowiedzi i schemat punktowania poziom podstawowy
 ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
Przykładowy zestaw zadań z chemii dla osób niewidomych Odpowiedzi i schemat punktowania poziom podstawowy
 ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY DLA NIEWIDOMYCH Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY DLA NIEWIDOMYCH Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania
I piętro p. 131 A, 138
 CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I piętro p. 131 A, 138 WYKŁAD - 4 RÓWNOWAGA Termochemia i termodynamika funkcje termodynamiczne, prawa termodynamiki,
CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I piętro p. 131 A, 138 WYKŁAD - 4 RÓWNOWAGA Termochemia i termodynamika funkcje termodynamiczne, prawa termodynamiki,
a) jeżeli przedstawiona reakcja jest reakcją egzotermiczną, to jej prawidłowy przebieg jest przedstawiony na wykresie za pomocą linii...
 1. Spośród podanych reakcji wybierz reakcję egzoenergetyczną: a) Redukcja tlenku miedzi (II) wodorem b) Otrzymywanie tlenu przez rozkład chloranu (V) potasu c) Otrzymywanie wapna palonego w procesie prażenia
1. Spośród podanych reakcji wybierz reakcję egzoenergetyczną: a) Redukcja tlenku miedzi (II) wodorem b) Otrzymywanie tlenu przez rozkład chloranu (V) potasu c) Otrzymywanie wapna palonego w procesie prażenia
ZADANIA Z CHEMII Efekty energetyczne reakcji chemicznej - prawo Kirchhoffa
 ZADANIA Z HEII Efekty energetyzne reakji hemiznej - rawo Kirhhoffa. Prawo Kirhhoffa Różnizkują względem temeratury wyrażenie, ilustrująe rawo Hessa: Otrzymuje się: U= n r,i U tw,r,i n s,i U tw,s,i () d(
ZADANIA Z HEII Efekty energetyzne reakji hemiznej - rawo Kirhhoffa. Prawo Kirhhoffa Różnizkują względem temeratury wyrażenie, ilustrująe rawo Hessa: Otrzymuje się: U= n r,i U tw,r,i n s,i U tw,s,i () d(
Podział reakcji chemicznych. 5. Reakcje chemiczne
 014-11-6 5. Reakcje chemiczne a. Rodzaje reakcji b. Równania reakcji - stechiometria c. Wydajność reakcji d. Teoria zderzeń aktywnych e. Szybkość reakcji chemicznych - rodzaj substratów - stężenie substratów
014-11-6 5. Reakcje chemiczne a. Rodzaje reakcji b. Równania reakcji - stechiometria c. Wydajność reakcji d. Teoria zderzeń aktywnych e. Szybkość reakcji chemicznych - rodzaj substratów - stężenie substratów
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
WYDZIAŁ BIOLOGICZNO-CHEMICZNY. Instytut Chemii
 UNIWERSYTET W BIAŁYMSTOKU WYDZIAŁ BIOLOGICZNO-CHEMICZNY Instytut Chemii r. ak. 0/03 INSTRUKCJE DO ĆWICZEŃ Z CHEMII IZYCZNEJ II III CHEMIA ĆWICZENIE ADSORPCJA KWASU ETANOWEGO NA WĘGLU AKTYWNYM WYMAGANIA
UNIWERSYTET W BIAŁYMSTOKU WYDZIAŁ BIOLOGICZNO-CHEMICZNY Instytut Chemii r. ak. 0/03 INSTRUKCJE DO ĆWICZEŃ Z CHEMII IZYCZNEJ II III CHEMIA ĆWICZENIE ADSORPCJA KWASU ETANOWEGO NA WĘGLU AKTYWNYM WYMAGANIA
f s moŝna traktować jako pracę wykonaną przez siłę tarcia nad ślizgającym się klockiem. Porównując
 Wykład z fizyki. Piotr Posmykiewiz 63 s = ma s = m v f vi = mvi 7- f W równaniu powyŝszym zastosowano równanie Porównują równania 7-0 i 7- otrzymamy: i a s = v f v i v f = 0 ( Patrz równanie -). f s =
Wykład z fizyki. Piotr Posmykiewiz 63 s = ma s = m v f vi = mvi 7- f W równaniu powyŝszym zastosowano równanie Porównują równania 7-0 i 7- otrzymamy: i a s = v f v i v f = 0 ( Patrz równanie -). f s =
KI + Pb(NO 3 ) 2 PbI 2 + KNO 3. fermentacja alkoholowa
 Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
