Składniki, które mogą powodować, że odpady są odpadami niebezpiecznymi
|
|
|
- Szymon Wilczyński
- 7 lat temu
- Przeglądów:
Transkrypt
1 Składniki, które mogą powodować, że odpady są odpadami niebezpiecznymi Jacek Antonkiewicz Katedra Chemii Rolnej i Środowiskowej Uniwersytet Rolniczy w Krakowie Rok akademicki 2013/2014
2 Składniki odpadów według załącznika nr 4 do Ustawy o odpadach W Załączniku nr 4 do Ustawy o odpadach zamieszczono składniki, które mogą powodować, że odpady są odpadami niebezpiecznymi.
3 Składniki, które mogą powodować, że odpady są odpadami niebezpiecznymi Nazwa związku Przykłady Beryl, związki berylu Be, BeCl 2 Związki wanadu V 2 O 3, V 2 O 5, VCl 3, VI 3 Związki chromu (VI) K 2 Cr 2 O 7 Związki kobaltu CoCl 4 Związki niklu NiCl 2, NiSO 4 Związki miedzi CuSO 4 Związki cynku ZnCl 2, ZnSO 4 Arsen, związki arsenu Selen, związki selenu As, AsH 3, AsCl 3 As 2 O 3 - arszenik Se, SeO 2, lotne dimetyloselenki
4 Składniki, które mogą powodować, że odpady są odpadami niebezpiecznymi Nazwa związku Przykłady Ołów, związki ołowiu Pb, PbCl 2, PbBr 2, PbI 2 Siarczki nieorganiczne Na 2 S, K 2 S, FeS, FeS 2 Nieorganiczne związki fluoru, z HF, LiF, NaF, KF, RbF, CsF wyjątkiem fluorku wapnia, Cyjanki nieorganiczne Następujące metale alkaliczne lub metale ziem alkalicznych: lit, sód, potas, wapń, magnez w postaci niezwiązanej KCN, NaCN, Li, Na, K, Ca, Mg
5 Składniki, które mogą powodować, że odpady są odpadami niebezpiecznymi Nazwa związku Przykłady Ołów, związki ołowiu Pb, PbCl 2, PbBr 2, PbI 2 Siarczki nieorganiczne Na 2 S, K 2 S, FeS, FeS 2 Nieorganiczne związki fluoru, z HF, LiF, NaF, KF, RbF, CsF wyjątkiem fluorku wapnia, Cyjanki nieorganiczne Następujące metale alkaliczne lub metale ziem alkalicznych: lit, sód, potas, wapń, magnez w postaci niezwiązanej KCN, NaCN, Li, Na, K, Ca, Mg
6 Składniki, które mogą powodować, że odpady są odpadami niebezpiecznymi Nazwa związku Kwaśne roztwory lub kwasy w postaci stałej Roztwory zasadowe i zasady w postaci stałej Azbest (pył i włókna) Fosfor, związki fosforu, z wyjątkiem fosforanów mineralnych Karbonylki metali Przykłady HCl, HNO 3, H 2 SO 4, NaOH, KOH, Mg(OH) 2, Ca(OH) 2 Minerały krzemianowe P 4, kwasy fosforowe, estry kwasu fosforowego Ni(CO) 4 nieorganiczne związki kompleksowe Nadtlenki H 2 O 2, Na 2 O 2, K 2 O 2, CaO 2
7 Składniki, które mogą powodować, że odpady są odpadami niebezpiecznymi Nazwa związku Kreozoty Izocyjaniany, tiocyjaniany Cyjanki organiczne (np. nitryle) Fenole, związki fenolowe Halogenowane rozpuszczalniki Rozpuszczalniki organiczne Przykłady Stosowany do impregnacji drewna R-N=C=O - izocyjaniany, NH 4 SCN rodanek amonu, KSCN rodanek potasu CH 3 -C N nitryl kw. octowego C 6 H 5 OH, fenolany, krezole Pochodne halogenowe związki Ciekle alkany, etery, alkohole, estry, ketony, aldehydy
8 Składniki, które mogą powodować, że odpady są odpadami niebezpiecznymi Nazwa związku Kreozoty Izocyjaniany, tiocyjaniany Cyjanki organiczne (np. nitryle) Fenole, związki fenolowe Halogenowane rozpuszczalniki Rozpuszczalniki organiczne Przykłady Stosowany do impregnacji drewna R-N=C=O - izocyjaniany, NH 4 SCN rodanek amonu, KSCN rodanek potasu CH 3 -C N nitryl kw. octowego C 6 H 5 OH, fenolany, krezole Pochodne halogenowe związki Ciekle alkany, etery, alkohole, estry, ketony, aldehydy
9 Składniki, które mogą powodować, że odpady są odpadami niebezpiecznymi Nazwa związku Związki halogenoorganiczne Aromatyczne, policykliczne i heterocykliczne związki organiczne Aminy alifatyczne Aminy aromatyczne Przykłady Freony, halogenki alkilowe Benzen, aminy heterocykliczne Putrescyna, kadaweryna Jad trupi Anilina (benzenoamina) Etery CH 3 -O-CH 3 Substancje o właściwościach Triazotan(V) glicerolu, wybuchowych CH 3 -NO 2 (Nitrometan)
10 Literatura Bielański A Podstawy chemii nieorganicznej. Wyd. PWN. Warszawa, ss McMurry J Chemia organiczna. Wyd. PWN, ss Morrison R.T., Boyd R.N Chemia organiczna. Wyd. Nauk. PWN, Warszawa, ss Ustawa o odpadach Dz. U. Nr 0, Poz. 21. z dnia 14 grudnia 2012 r.
11 Substancje gazowe powstałe podczas przetwarzania odpadów Jacek Antonkiewicz Katedra Chemii Rolnej i Środowiskowej Uniwersytet Rolniczy w Krakowie
12 Wprowadzenie Projekt Wiedza i umiejętności kluczem do sukcesu inżynierów Ochrony Bodźcem do poszukiwania metod zagospodarowania odpadów, oprócz dążenia do ochrony środowiska, jest to, że często zawierają one cenne składniki, co czyni je potencjalnym surowcem, zwykle tanim i dostępnym, lecz często wymagającej wstępnej obróbki zwanej uzdatnianiem, na ogół innej niż w przypadku surowców pochodzenia konwencjonalnego, na przykład kopalnych. Metody uzdatniania i kierunki zagospodarowania są przy tym bardzo różnorodne, co wynika z różnic stanu skupienia, właściwości oraz składu jakościowego i ilościowego odpadów. Przemysł chemiczny nie jest głównym wytwórcą odpadów; jego udział wynosi 6-7% łącznej emisji zanieczyszczeń powietrza, ok. 8% zanieczyszczeń odprowadzanych do wód i ok. 10% całkowitej ilości odpadów stałych.
13 Metody utylizacji odpadów gazowych W przypadku odpadów gazowych często występuje potrzeba oddzielania składnika obecnego w niewielkim stężeniu w gazach obojętnych, na przykład w powietrzu; najczęściej potrzeba ta wynika z toksyczności tego składnika. Do oddzielenia go wykorzystuje się procesy oparte na adsorpcji lub absorpcji.
14 Teoria adsorpcji Adsorpcja proces, w którym cząsteczki jednej substancji zostają związane na powierzchni innej substancji. ciecz gaz ciało stałe gaz ciecz ciecz ciało stałe ciecz Zjawisko adsorpcji wynika z istnienia niezrównoważonych, niesymetrycznych sił na powierzchni adsorbentu (nadmiar energii swobodnej powierzchni w stosunku do objętości fazy stałej).
15 Substancje gazowe powstające podczas przetwarzania odpadów Należą tu przede wszystkim toksyczne lub szkodliwe dla zdrowia gazy jak: chlor, brom, siarkowodór, cyjanowodór, fosgen, tlenki siarki, amoniak, tlenki azotu, tlenki węgla, dwusiarczek węgla, karbonylki metali, i inne podobne substancje.
16 Postępowanie z gazami powstającymi podczas przetwarzania odpadów Gazy substancji szkodliwych dla zdrowia jak również substancji charakteryzujących się nieprzyjemnym zapachem muszą być absorbowane w płuczkach lub skruberach wypełnionych odpowiednimi cieczami absorpcyjnymi, dobranymi odpowiednio do chemicznych właściwości wydzielających się substancji gazowych. Nie powinno dopuszczać do wydzielania się takich substancji bezpośrednio do atmosfery. Najczęściej stosuje się roztwory kwasu siarkowego(vi) lub solnego do absorpcji substancji zasadowych. Roztwory wodorotlenku sodowego lub węglanu sodu stosuje się do absorpcji kwasów itp. Po zakończeniu reakcji zawartość absorberów traktuje się tak jak odpowiednie odpady ciekłe.
17 Postępowanie z gazami powstającymi podczas przetwarzania odpadów Gazy substancji szkodliwych dla zdrowia jak również substancji charakteryzujących się nieprzyjemnym zapachem muszą być absorbowane w płuczkach lub skruberach wypełnionych odpowiednimi cieczami absorpcyjnymi, dobranymi odpowiednio do chemicznych właściwości wydzielających się substancji gazowych. Nie powinno dopuszczać do wydzielania się takich substancji bezpośrednio do atmosfery. Najczęściej stosuje się roztwory kwasu siarkowego(vi) lub solnego do absorpcji substancji zasadowych. Roztwory wodorotlenku sodowego lub węglanu sodu stosuje się do absorpcji kwasów itp. Po zakończeniu reakcji zawartość absorberów traktuje się tak jak odpowiednie odpady ciekłe.
18 Utylizacja tlenków kwasowych Spaliny powstające podczas spalania odpadów, zasiarczonych paliw, głównie węgla, zawierają oprócz składników powietrza duże ilości dwutlenku węgla i pary wodnej, znacznie mniejsze dwutlenku siarki i tlenków azotu oraz zmienne ilości popiołu. Reakcja spalania węgla zasiarczonego: C + O 2 CO 2 + Q + SO 2 + N x O y + H 2 O (g) + popiół Z tej mieszaniny najpierw oddziela się składniki stałe (popiół paleniskowy), następnie dwutlenek siarki.
19 Utylizacja dwutlenku węgla - CO 2 Emisji ditlenku węgla powstającego podczas spalania węgla, nie można ograniczyć w jakikolwiek sposób. To samo odnosi się do dowolnego paliwa opartego na węglu. Jednakże wysiłki w celu złagodzenia problemu skupiają się na sposobach zatrzymywania (sekwestracji) powstającego w wyniku spalania ditlenku węgla.
20 Sekwestracja ditlenku węgla Sekwestracja dwutlenku węgla to wychwytywanie i bezpieczne składowanie CO 2, który w innym przypadku byłby wyemitowany do atmosfery i w niej pozostał. Pod tym terminem rozumie się czynności związane z jego wychwytywaniem i oddzielaniem, transportem oraz składowaniem CO 2 w określonym miejscu. Wtrysk CO 2 : w pole naftowe, pole gazowe, pozabilansowe pokłady węgla. Wtrysk CO 2 w pole naftowe powoduje zwiększenie wydobycia.
21 Utylizacja dwutlenku siarki Spaliny powstające podczas spalania odpadów mogą zawierać oprócz składników powietrza duże ilości dwutlenku siarki. Odsiarczanie spalin polega na oddzieleniu tlenków siarki ze spalin i najczęściej stosowana jest metoda 1. wapienna, 2. amoniakalna 3. katalityczne utlenianie dwutlenku siarki.
22 Metoda wapienna utylizacji SO 2 Metoda wapienna wykorzystuje fakt, że kwas węglowy jest kwasem słabszym od siarkawego i polega na absorpcji SO 2 w wodzie zawierającej zawiesinę rozdrobnionego węglanu wapnia; SO 2 + H 2 O H 2 SO 3 H 2 SO 3 + CaCO 3 CaSO 3 + H 2 O + CO 2 Siarczyn wapnia stosunkowo łatwo utlenia się do siarczanu wapnia kosztem tlenu zawartego w spalinach i rozproszonego w zawiesinie absorpcyjnej. 2CaSO 3 + O 2 + 2H 2 O 2CaSO 4. 2H 2 O (gips) Produktem końcowym jest szlam składający się z gipsu CaSO 4. 2H 2 O i nie przereagowanego węglanu wapnia CaCO 3. Szlam ten nadaje się do wytwarzania materiałów budowlanych, spoiwa gipsowego.
23 Schemat instalacji odsiarczania spalin odlotowych metodą wapienną Regenerator ciepła Wentylator Odkraplacze Absorber Separator wstępny Filtr Suszarka Zbiornik zawiesiny Zbiornik dotleniający
24 Zakład produkcji kwasu siarkowego
25 Metoda amoniakalna utylizacji SO 2 Metoda amoniakalna polega na absorpcji dwutlenku siarki w wodzie amoniakalnej: SO 2 + 2NH 3 + H 2 O (NH 4 ) 2 SO 3 SO 2 + NH 3 + H 2 O NH 4 HSO 3 której towarzyszy utlenianie się siarczynu do siarczanu. Z wodorosiarczynu można wydzielić stosunkowo czysty dwutlenek siarki w podwyższonej temperaturze: 2NH 4 HSO 3 (NH 4 ) 2 SO 3 + H 2 O + SO 2 a pozostałą jego ilość wypiera się kwasem siarkowym: NH 4 HSO 3 + H 2 SO 4 (NH 4 ) 2 SO 4 + H 2 O + SO 2 Siarczan amonu znajduje zastosowanie w rolnictwie jako nawóz azotowy.
26 Metoda katalitycznego utleniania Metoda katalitycznego utleniania spaliny z reguły zawierają wystarczającą ilość tlenu, by było możliwe utlenienie dwutlenku siarki do trójtlenku, oraz pary wodnej, aby mógł powstać kwas siarkowy: SO 2 (g) SO 2 (ads) (+O 2 ) SO 3 (+H 2 O) H 2 SO 4 Reakcje przebiegają na sorbencie węglowym, który jest jednocześnie katalizatorem utleniania dwutlenku siarki do trójtlenku, natomiast nie adsorbuje kwasu siarkowego, który spływa do odbieralnika.
27 Utylizacja siarkowodoru Niewielkie ilości siarkowodoru, powstającego na przykład przy produkcji soli baru z barytu: BaSO 4 + C BaS + 2CO 2 W stadium roztwarzania siarczku baru w kwasach: BaS + 2HCl BaCl 2 + H 2 S BaS + 2HNO 3 Ba(NO 3 ) 2 + H 2 S Odpadowy siarkowodór wykorzystuje się najczęściej do produkcji siarczku sodu, znajdującego zastosowanie w garbarstwie i w produkcji barwników: H 2 S + 2NaOH Na 2 S + H 2 O
28 Utylizacja chloru Projekt Wiedza i umiejętności kluczem do sukcesu inżynierów Ochrony W różnych procesach chlorowania powstają gazy resztkowe zawierające nie przereagowany chlor (zwany chlorem odpadowym). Z reguły gazy te kieruje się do absorberów (skruberów) z wodorotlenkiem sodu: Cl 2 + 2NaOH NaClO + NaCl + H 2 O co umożliwia całkowite oddzielenie chloru i otrzymywanie produktu handlowego roztworu podchlorynu sodu, znanego środka dezynfekującego i bakteriobójczego (środki czystości).
29 Skrubery Skrubery są to aparaty do usuwania z mieszaniny gazowej zanieczyszczających ją ciał stałych lub cieczy. Skruber składa się z odpowiednio wypełnionej pionowej kolumny (zbiornika) przez który przeprowadza się gaz, celem usunięcia z niego zbędnych zanieczyszczeń. W zależności od rodzaju skrubera może być on dodatkowo spryskiwany wodą. Warunki pracy skrubera są bardzo trudne, przepływające gazy są zanieczyszczone cząstkami stałym powodując zużycie abrazyjne. Na ścianki skrubera działają agresywne gazy oraz produkty otrzymane w wyniku działania wypełnia skrubera. Z tego powodu skrubery muszą być produkowane z materiałów o najwyższej jakości. Do produkcji skruberów używamy laminat poliestrowo-szklany, który cechuje się bardzo dobrą odpornością abrazyjną i chemiczną.
30 Skruber do oczyszczania gazów
31 Skruber strumieniowy Projekt Wiedza i umiejętności kluczem do sukcesu inżynierów Ochrony Skrubery strumieniowe działają na zasadzie smoczka. W strumieniu przepływającego gazu generują wzrost jego ciśnienia. Dzięki temu nie ma potrzeby montowania wentylatora. Skrubery gazowe nadają się w szczególności do oczyszczania gazów spalinowych o dużej zawartości substancji szkodliwych i/lub kurzu. Dzięki zmodyfikowanej konstrukcji, gazy o temperaturze do 1300 C mogą być schładzane i przemywane w jednym procesie.
32 A Wlot gazu B Wylot gazu Schemat ideowy skruberu strumieniowego C Wejście cieczy D Wylot gazu
33 Utylizacja fluoru Surowce fosforowe (fosforyty, apatyty) z reguły zawierają domieszki związków fluoru, głównie fluorytu (fluorku wapnia). Podczas trawienia tych surowców kwasem siarkowym przy produkcji nawozów fosforowych związki fluoru ulegają rozkładowi z wytworzeniem produktów lotnych: CaF 2 + H 2 SO 4 CaSO 4 + 2HF SiO 2 + 4HF SiF 4 + H 2 O Mieszaninę gazów kieruje się do kilkustopniowej absorpcji. W pierwszym stopniu powinien ulec całkowitemu związaniu fluorek krzemu: SiF 4 + 2HF + Na 2 CO 3 Na 2 SiF 6 + H 2 O + CO 2 Wytrącający się fluorokrzemian sodu znajduje zastosowanie w przemyśle ceramicznym i emalierskim. Pozostały kwas fluorowodorowy przerabia się na czyste fluorki, na przykład fluorek wapnia używany w produkcji materiałów ceramicznych: Ca(OH) 2 + 2HF CaF 2 + 2H 2 O albo na syntetyczny kriolit, a także na fluorki sodu i glinu, stosowane w produkcji aluminium: 12HF + 3Na 2 CO 3 + 2Al(OH) 3 2[3NaF. AlF 3 ] + 3CO 2 + 9H 2 O 2HF + Na 2 CO 3 2NaF + H 2 O + CO 2 3HF + Al(OH) 3 AlF 3 + 3H 2 O
34 Utylizacja wodoru Projekt Wiedza i umiejętności kluczem do sukcesu inżynierów Ochrony W różnych procesach elektrochemicznych powstaje ubocznie wodór zawierający niewielkie ilości tlenu. Mieszaniny takie są typowym produktem ubocznym np. w produkcji chloranów sodu i potasu. Wodór jest traktowany jako odpad nietoksyczny. Wodór po osuszeniu dodaje się do gazu opałowego (ziemnego lub koksowniczego) jest to utylizacja typu energetycznego. Wodór zawierający tlen może być bezpośrednio utylizowany w niektórych procesach, na przykład w produkcji kwasu solnego. Jednocześnie z wytwarzaniem chlorowodoru: H 2 + Cl 2 (spalanie) 2HCl tlen reaguje z wodorem z wytworzeniem pary wodnej, co w tym przypadku nie jest szkodliwe, ponieważ chlorowodór kieruje się do absorpcji w wodzie. O 2 + 2H 2 (katalizator, spalanie) 2H 2 O W poszukiwaniu kierunków utylizacji zanieczyszczonego wodoru tlenem, należy pamiętać czy proces utylizacji zużywa zarówno wodór jak i tlen. Jeśli zużywany jest tylko wodór, udział tlenu w pozostałości gazowej wzrasta i pozostałość ta może stać się wybuchowa.
35 Literatura Projekt Wiedza i umiejętności kluczem do sukcesu inżynierów Ochrony Rosik-Dulewska Podstawy gospodarki odpadami. Wyd. PWN, Warszawa, ss Taniewski M (Praca zbiorowa pod redakcją Mariana Taniewskiego). Technologia chemiczna Surowce. Wyd. Politechniki Śląskiej, Gliwice 1997, ss Warych J Oczyszczanie gazów. Procesy i aparatura. Wyd. Naukowo-Techniczne, Warszawa, ss Warych J Odsiarczanie gazów z wykorzystaniem sorbentów wapniowych. Mat. Konf. Przemysł wapienniczy a ochrona środowiska. Kamień Śląski czerwca 2000,
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
2.4. ZADANIA STECHIOMETRIA. 1. Ile moli stanowi:
 2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
Temat 2: Nazewnictwo związków chemicznych. Otrzymywanie i właściwości tlenków
 Zasada ogólna: We wzorze sumarycznym pierwiastki zapisujemy od metalu do niemetalu, natomiast odczytujemy nazwę zaczynając od niemetalu: MgO, CaS, NaF Nazwy związków chemicznych najczęściej tworzymy, korzystając
Zasada ogólna: We wzorze sumarycznym pierwiastki zapisujemy od metalu do niemetalu, natomiast odczytujemy nazwę zaczynając od niemetalu: MgO, CaS, NaF Nazwy związków chemicznych najczęściej tworzymy, korzystając
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
BUDOWA ATOMU 1. Wymień 3 korzyści płynące z zastosowania pierwiastków promieniotwórczych. 2. Dokończ reakcję i nazwij powstałe pierwiastki:
 BUDOWA ATOMU 1. Wymień 3 korzyści płynące z zastosowania pierwiastków promieniotwórczych. 2. Dokończ reakcję i nazwij powstałe pierwiastki: 235 4 92 U + 2 He 198. 79 Au + ß - 3. Spośród atomów wybierz
BUDOWA ATOMU 1. Wymień 3 korzyści płynące z zastosowania pierwiastków promieniotwórczych. 2. Dokończ reakcję i nazwij powstałe pierwiastki: 235 4 92 U + 2 He 198. 79 Au + ß - 3. Spośród atomów wybierz
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
Wykaz niezgodnych substancji chemicznych
 Wykaz niezgodnych substancji chemicznych 1 Wykaz niezgodnych substancji chemicznych Substancje chemiczne zebrane w kolumnie I s niezgodne (niekompatybilne) z substancjami wymienionymi w kolumnie II i powinny
Wykaz niezgodnych substancji chemicznych 1 Wykaz niezgodnych substancji chemicznych Substancje chemiczne zebrane w kolumnie I s niezgodne (niekompatybilne) z substancjami wymienionymi w kolumnie II i powinny
PODSTAWY STECHIOMETRII
 PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY
 WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY Instrukcja przygotowana w Pracowni Dydaktyki Chemii Zakładu Fizykochemii Roztworów. 1. Zanieczyszczenie wody. Polska nie należy do krajów posiadających znaczne
WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY Instrukcja przygotowana w Pracowni Dydaktyki Chemii Zakładu Fizykochemii Roztworów. 1. Zanieczyszczenie wody. Polska nie należy do krajów posiadających znaczne
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE
 PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
Oczyszczanie gazów odlotowych z zanieczyszczeń gazowych. odlotowych. Metody oczyszczania gazów. Podstawowe pojęcia:
 Oczyszczanie gazów odlotowych z zanieczyszczeń gazowych Wykład Kierunek OCHRONA ŚRODOWISKA, st. inżynierskie III rok Kazimierz Warmiński Metody oczyszczania gazów odlotowych Absorpcyjne Adsorpcyjne Spalanie
Oczyszczanie gazów odlotowych z zanieczyszczeń gazowych Wykład Kierunek OCHRONA ŚRODOWISKA, st. inżynierskie III rok Kazimierz Warmiński Metody oczyszczania gazów odlotowych Absorpcyjne Adsorpcyjne Spalanie
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH
 WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
5. STECHIOMETRIA. 5. Stechiometria
 5. STECHIOMETRIA 25 5. Stechiometria 5.1. Ile gramów magnezu wzięło udział w reakcji z tlenem, jeśli otrzymano 6,0 g tlenku magnezu? Odp. 3,60 g 5.2. Do 50 cm 3 roztworu kwasu siarkowego (VI) o stężeniu
5. STECHIOMETRIA 25 5. Stechiometria 5.1. Ile gramów magnezu wzięło udział w reakcji z tlenem, jeśli otrzymano 6,0 g tlenku magnezu? Odp. 3,60 g 5.2. Do 50 cm 3 roztworu kwasu siarkowego (VI) o stężeniu
WYKAZ ODPADÓW PODDAWANYCH UNIESZKODLIWIENIU LUB ODZYSKOWI
 WYKAZ ODPADÓW PODDAWANYCH UNIESZKODLIWIENIU LUB ODZYSKOWI KOD ODPADU RODZAJ ODPADU 02 02 Odpady z przygotowania i przetwórstwa produktów spożywczych pochodzenia zwierzęcego 02 02 01 Odpady z mycia i przygotowania
WYKAZ ODPADÓW PODDAWANYCH UNIESZKODLIWIENIU LUB ODZYSKOWI KOD ODPADU RODZAJ ODPADU 02 02 Odpady z przygotowania i przetwórstwa produktów spożywczych pochodzenia zwierzęcego 02 02 01 Odpady z mycia i przygotowania
STĘŻENIA ROZTWORÓW. 2. W 100 g wody rozpuszczono 25 g cukru. Oblicz stężenie procentowe roztworu.
 STĘŻENIA ROZTWORÓW Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. W 150 g roztworu znajduje się 10 g soli kuchennej (NaCl). Jakie jest stężenie procentowe
STĘŻENIA ROZTWORÓW Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. W 150 g roztworu znajduje się 10 g soli kuchennej (NaCl). Jakie jest stężenie procentowe
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks
 Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
g % ,3%
 PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
a) Sole kwasu chlorowodorowego (solnego) to... b) Sole kwasu siarkowego (VI) to... c) Sole kwasu azotowego (V) to... d) Sole kwasu węglowego to...
 Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
XV Wojewódzki Konkurs z Chemii
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
KWASY I WODOROTLENKI. 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to:
 KWASY I WODOROTLENKI 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to: 1. kwas siarkowy (IV), kwas siarkowy (VI), kwas azotowy, 2. kwas siarkowy (VI), kwas siarkowy (IV), kwas azotowy (V), 3. kwas siarkowodorowy,
KWASY I WODOROTLENKI 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to: 1. kwas siarkowy (IV), kwas siarkowy (VI), kwas azotowy, 2. kwas siarkowy (VI), kwas siarkowy (IV), kwas azotowy (V), 3. kwas siarkowodorowy,
2. Procenty i stężenia procentowe
 2. PROCENTY I STĘŻENIA PROCENTOWE 11 2. Procenty i stężenia procentowe 2.1. Oblicz 15 % od liczb: a. 360, b. 2,8 10 5, c. 0.024, d. 1,8 10 6, e. 10 Odp. a. 54, b. 4,2 10 4, c. 3,6 10 3, d. 2,7 10 7, e.
2. PROCENTY I STĘŻENIA PROCENTOWE 11 2. Procenty i stężenia procentowe 2.1. Oblicz 15 % od liczb: a. 360, b. 2,8 10 5, c. 0.024, d. 1,8 10 6, e. 10 Odp. a. 54, b. 4,2 10 4, c. 3,6 10 3, d. 2,7 10 7, e.
3. ODSIARCZANIE SPALIN
 3. ODSIARCZANIE SPALIN 3.1. Ogólna charakterystyka procesu, systematyka metod 3.2. Metoda sucha 3.3. Metoda hybrydowa sucha z nawilŝaniem 3.4. Metoda półsucha 3.5. Metoda mokra 3.6. Analiza porównawcza
3. ODSIARCZANIE SPALIN 3.1. Ogólna charakterystyka procesu, systematyka metod 3.2. Metoda sucha 3.3. Metoda hybrydowa sucha z nawilŝaniem 3.4. Metoda półsucha 3.5. Metoda mokra 3.6. Analiza porównawcza
Identyfikacja wybranych kationów i anionów
 Identyfikacja wybranych kationów i anionów ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ NIE ZATYKAĆ PROBÓWKI PALCEM Zadanie 1 Celem zadania jest wykrycie jonów Ca 2+ a. Próba z jonami C 2 O 4 ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ
Identyfikacja wybranych kationów i anionów ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ NIE ZATYKAĆ PROBÓWKI PALCEM Zadanie 1 Celem zadania jest wykrycie jonów Ca 2+ a. Próba z jonami C 2 O 4 ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ
Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne)
 Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne) Zadanie 7 (1 pkt) Uporządkuj podane ilości moli związków chemicznych według rosnącej liczby
Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne) Zadanie 7 (1 pkt) Uporządkuj podane ilości moli związków chemicznych według rosnącej liczby
Materiały pomocnicze do przedmiotu Chemia I dla studentów studiów I stopnia Inżynierii Materiałowej
 Materiały pomocnicze do przedmiotu Chemia I dla studentów studiów I stopnia Inżynierii Materiałowej Opracowali: Jarosław Chojnacki i Łukasz Ponikiewski, Wydział Chemiczny, Politechnika Gdaoska, Gdaosk
Materiały pomocnicze do przedmiotu Chemia I dla studentów studiów I stopnia Inżynierii Materiałowej Opracowali: Jarosław Chojnacki i Łukasz Ponikiewski, Wydział Chemiczny, Politechnika Gdaoska, Gdaosk
PRODUKCJA I ZASTOSOWANIE NAWOZÓW MINERALNYCH W KONTEKŚCIE OCHRONY KLIMATU
 PRODUKCJA I ZASTOSOWANIE NAWOZÓW MINERALNYCH W KONTEKŚCIE OCHRONY KLIMATU WERBKOWICE, 23 czerwca 2016 r. Martin Todorow, dr inż. Krzysztof Dziuba Prezentacja została wykonana w ramach projektu nr BIOSTRATEG1/271322/3/NCBR/2015
PRODUKCJA I ZASTOSOWANIE NAWOZÓW MINERALNYCH W KONTEKŚCIE OCHRONY KLIMATU WERBKOWICE, 23 czerwca 2016 r. Martin Todorow, dr inż. Krzysztof Dziuba Prezentacja została wykonana w ramach projektu nr BIOSTRATEG1/271322/3/NCBR/2015
Instrukcja postępowania z odpadami chemicznymi w ICHNoZiŻ UJD
 INSTRUKCJA POSTĘPOWANIA Z ODPADAMI CHEMICZNYMI W INSTYTUCIE CHEMII, NAUK O ZDROWIU I ŻYWNOŚCI UNIWERSYTETU HUMANISTYCZNO-PRZYRODNICZEGO IM. JANA DŁUGOSZA W CZĘSTOCHOWIE I. Charakterystyka odpadów 1. Za
INSTRUKCJA POSTĘPOWANIA Z ODPADAMI CHEMICZNYMI W INSTYTUCIE CHEMII, NAUK O ZDROWIU I ŻYWNOŚCI UNIWERSYTETU HUMANISTYCZNO-PRZYRODNICZEGO IM. JANA DŁUGOSZA W CZĘSTOCHOWIE I. Charakterystyka odpadów 1. Za
Zadanie 3 Zapisz wzory sumaryczne głównych składników przedstawionych skał i minerałów. kalcyt kreda kwarc gips agat
 CZĘŚĆ 1 Zadanie 1 Wyjaśnij pojęcia. wapno palone, hydraty, zaprawa gipsowa, zaprawa wapienna, wietrzenie skał, wapno gaszone, próchnica, degradacja gleby, właściwości sorpcyjne gleby, wapno palone, degradacja
CZĘŚĆ 1 Zadanie 1 Wyjaśnij pojęcia. wapno palone, hydraty, zaprawa gipsowa, zaprawa wapienna, wietrzenie skał, wapno gaszone, próchnica, degradacja gleby, właściwości sorpcyjne gleby, wapno palone, degradacja
Tlen. Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki
 Tlen Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki Ogólna charakterystyka tlenowców Tlenowce: obejmują pierwiastki
Tlen Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki Ogólna charakterystyka tlenowców Tlenowce: obejmują pierwiastki
WOJEWÓDZKI KONKURS CHEMICZNY
 Kod ucznia Liczba punktów WOJWÓDZKI KONKURS CHMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2014/2015 16 STYCZNIA 2015 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
Kod ucznia Liczba punktów WOJWÓDZKI KONKURS CHMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2014/2015 16 STYCZNIA 2015 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA. z dnia 4 listopada 2002 r. w sprawie wysokości opłat rejestracyjnych. (Dz. U. z dnia 15 listopada 2002 r.
 ROZPORZĄDZENIE MINISTRA ŚRODOWISKA z dnia 4 listopada 2002 r. w sprawie wysokości opłat rejestracyjnych. (Dz. U. z dnia 15 listopada 2002 r.) Na podstawie art. 210 ust. 4 ustawy z dnia 27 kwietnia 2001
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA z dnia 4 listopada 2002 r. w sprawie wysokości opłat rejestracyjnych. (Dz. U. z dnia 15 listopada 2002 r.) Na podstawie art. 210 ust. 4 ustawy z dnia 27 kwietnia 2001
8. Tablice odporności chemicznej PE i PP
 8. Tablice odporności chemicznej PE i PP Oznaczenia: PE- polietylen o dużej gęstości, PP - polipropylen s.s. - roztwór nasycony 1 - odporne, 2 - częściowo odporne 3 - nieodporne, Zamieszczone niżej dane
8. Tablice odporności chemicznej PE i PP Oznaczenia: PE- polietylen o dużej gęstości, PP - polipropylen s.s. - roztwór nasycony 1 - odporne, 2 - częściowo odporne 3 - nieodporne, Zamieszczone niżej dane
Arkusz zadań dla I roku Inżynierii Procesowej i Ochrony Środowiska Chemia II (semestr II)
 Arkusz zadań dla I roku Inżynierii Procesowej i Ochrony Środowiska Chemia II (semestr II) Reakcje w roztworach 1. Jaką objętość 20% roztworu kwasu solnego (o gęstości ρ = 1,10 g/cm 3 ) należy dodać do
Arkusz zadań dla I roku Inżynierii Procesowej i Ochrony Środowiska Chemia II (semestr II) Reakcje w roztworach 1. Jaką objętość 20% roztworu kwasu solnego (o gęstości ρ = 1,10 g/cm 3 ) należy dodać do
ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII
 ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII Zadanie 1. Na rysunku przedstawiono fragment układu okresowego pierwiastków. Dokoocz zdania tak aby były prawdziwe. Wiązanie jonowe występuje w związku chemicznym
ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII Zadanie 1. Na rysunku przedstawiono fragment układu okresowego pierwiastków. Dokoocz zdania tak aby były prawdziwe. Wiązanie jonowe występuje w związku chemicznym
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
MOKRA WAPNIAKOWA TECHNOLOGIA ODSIARCZANIA SPALIN PREZENTACJA
 MOKRA WAPNIAKOWA TECHNOLOGIA ODSIARCZANIA SPALIN PREZENTACJA 2 2 Chemia procesu Wprowadzenie Mokra metoda wapniakowa jest niewątpliwie najbardziej na świecie rozpowszechnioną technologią usuwania dwutlenku
MOKRA WAPNIAKOWA TECHNOLOGIA ODSIARCZANIA SPALIN PREZENTACJA 2 2 Chemia procesu Wprowadzenie Mokra metoda wapniakowa jest niewątpliwie najbardziej na świecie rozpowszechnioną technologią usuwania dwutlenku
NIEBEZPIECZNE REAKCJE CHEMICZNE
 NIBPICN RAKCJ CHMICN Niniejsze zestawienie stanowi jedynie wybór i obejmuje jedynie niektóre reakcje niebezpieczne. Wymienione związki mogą ulegać również innym reakcjom niebezpiecznym. Brak na niniejszej
NIBPICN RAKCJ CHMICN Niniejsze zestawienie stanowi jedynie wybór i obejmuje jedynie niektóre reakcje niebezpieczne. Wymienione związki mogą ulegać również innym reakcjom niebezpiecznym. Brak na niniejszej
10. ALKACYMETRIA. 10. Alkacymetria
 10. ALKACYMETRIA 53 10. Alkacymetria 10.1. Ile cm 3 40 % roztworu NaOH o gęstości 1,44 g cm 3 należy zużyć w celu przygotowania 1,50 dm 3 roztworu o stężeniu 0,20 mol dm 3? Odp. 20,8 cm 3 10.2. 20,0 cm
10. ALKACYMETRIA 53 10. Alkacymetria 10.1. Ile cm 3 40 % roztworu NaOH o gęstości 1,44 g cm 3 należy zużyć w celu przygotowania 1,50 dm 3 roztworu o stężeniu 0,20 mol dm 3? Odp. 20,8 cm 3 10.2. 20,0 cm
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Kategorie cenowe w poszczególnych klasach towarów niebezpiecznych
 Ważny od.06.09 r. Kategorie cenowe w poszczególnych klasach towarów niebezpiecznych Klasa Kod klasyfikacyjny lub UN Uwagi Kategoria - Materiały wybuchowe i przedmioty z materiałami wybuchowymi Wszystkie
Ważny od.06.09 r. Kategorie cenowe w poszczególnych klasach towarów niebezpiecznych Klasa Kod klasyfikacyjny lub UN Uwagi Kategoria - Materiały wybuchowe i przedmioty z materiałami wybuchowymi Wszystkie
Procesy wytwarzania, oczyszczania i wzbogacania biogazu
 Marcin Cichosz, Roman Buczkowski Procesy wytwarzania, oczyszczania i wzbogacania biogazu Schemat ideowy pozyskiwania biometanu SUBSTRATY USUWANIE S, N, Cl etc. USUWANIE CO 2 PRZYGOTOWANIE BIOGAZ SUSZENIE
Marcin Cichosz, Roman Buczkowski Procesy wytwarzania, oczyszczania i wzbogacania biogazu Schemat ideowy pozyskiwania biometanu SUBSTRATY USUWANIE S, N, Cl etc. USUWANIE CO 2 PRZYGOTOWANIE BIOGAZ SUSZENIE
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 2013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 12-617-5229 Katedra
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 2013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 12-617-5229 Katedra
OFERTA NA WYKONYWANIE BADAŃ LABORATORYJNYCH
 OFERTA NA WYKONYWANIE BADAŃ LABORATORYJNYCH Pomiary czynników szkodliwych i uciążliwych na stanowiskach pracy powietrze - czynniki chemiczne pyły hałas Analizy nawozów Analizy wody i ścieków Analizy produktów
OFERTA NA WYKONYWANIE BADAŃ LABORATORYJNYCH Pomiary czynników szkodliwych i uciążliwych na stanowiskach pracy powietrze - czynniki chemiczne pyły hałas Analizy nawozów Analizy wody i ścieków Analizy produktów
Powstawanie żelazianu(vi) sodu przebiega zgodnie z równaniem: Ponieważ termiczny rozkład kwasu borowego(iii) zachodzi zgodnie z równaniem:
 Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
II. CHEMIA NIEORGANICZNA
 pitagoras.d2.pl II. CHEMIA NIEORGANICZNA TLENKI: Tlenki to związki tlenu z innymi pierwiastkami. Tlen w tlenkach ma zawsze II. pierwiastka X I II III IV V VI VII wzór tlenku X 2 O XO X 2 O 3 XO 2 X 2 O
pitagoras.d2.pl II. CHEMIA NIEORGANICZNA TLENKI: Tlenki to związki tlenu z innymi pierwiastkami. Tlen w tlenkach ma zawsze II. pierwiastka X I II III IV V VI VII wzór tlenku X 2 O XO X 2 O 3 XO 2 X 2 O
WYZWANIA EKOLOGICZNE XXI WIEKU
 WYZWANIA EKOLOGICZNE XXI WIEKU ZA GŁÓWNE ŹRÓDŁA ZANIECZYSZCZEŃ UWAŻANE SĄ: -przemysł -transport -rolnictwo -gospodarka komunalna Zanieczyszczenie gleb Przyczyny zanieczyszczeń gleb to, np.: działalność
WYZWANIA EKOLOGICZNE XXI WIEKU ZA GŁÓWNE ŹRÓDŁA ZANIECZYSZCZEŃ UWAŻANE SĄ: -przemysł -transport -rolnictwo -gospodarka komunalna Zanieczyszczenie gleb Przyczyny zanieczyszczeń gleb to, np.: działalność
MARATON WIEDZY CHEMIA CZ. II
 MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
009 Ile gramów jodu i ile mililitrów alkoholu etylowego (gęstość 0,78 g/ml) potrzeba do sporządzenia 15 g jodyny, czyli 10% roztworu jodu w alkoholu e
 STĘŻENIA - MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Ile gramów wodnego roztworu azotanu sodu o stężeniu 10,0% można przygotować z 25,0g NaNO3? 002 Ile gramów kwasu siarkowego zawiera 25 ml jego
STĘŻENIA - MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Ile gramów wodnego roztworu azotanu sodu o stężeniu 10,0% można przygotować z 25,0g NaNO3? 002 Ile gramów kwasu siarkowego zawiera 25 ml jego
11) Stan energetyczny elektronu w atomie kwantowanym jest zespołem : a dwóch liczb kwantowych b + czterech liczb kwantowych c nie jest kwantowany
 PYTANIA EGZAMINACYJNE Z CHEMII OGÓLNEJ I Podstawowe pojęcia chemiczne 1) Pierwiastkiem nazywamy : a zbiór atomów o tej samej liczbie masowej b + zbiór atomów o tej samej liczbie atomowej c zbiór atomów
PYTANIA EGZAMINACYJNE Z CHEMII OGÓLNEJ I Podstawowe pojęcia chemiczne 1) Pierwiastkiem nazywamy : a zbiór atomów o tej samej liczbie masowej b + zbiór atomów o tej samej liczbie atomowej c zbiór atomów
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru
 1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
Zn + S ZnS Utleniacz:... Reduktor:...
 Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 797
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 797 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 15 Data wydania: 19 października 2018 r. Nazwa i adres AB 797
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 797 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 15 Data wydania: 19 października 2018 r. Nazwa i adres AB 797
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów możliwa
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów możliwa
analogicznie: P g, K g, N g i Mg g.
 Zadanie 1 Obliczamy zawartość poszczególnych składników w 10 m 3 koncentratu: Ca: 46 g Ca - 1 dm 3 roztworu x g Ca - 10000 dm 3 roztworu x = 460000 g Ca analogicznie: P 170000 g, K 10000 g, N 110000 g
Zadanie 1 Obliczamy zawartość poszczególnych składników w 10 m 3 koncentratu: Ca: 46 g Ca - 1 dm 3 roztworu x g Ca - 10000 dm 3 roztworu x = 460000 g Ca analogicznie: P 170000 g, K 10000 g, N 110000 g
STAłA I STOPIEŃ DYSOCJACJI; ph MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia!
 STAłA I STOPIEŃ DYSOCJACJI; ph MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Obliczyć stężenie molowe jonów Ca 2+ w roztworze zawierającym 2,22g CaCl2 w 100 ml roztworu, przyjmując a = 100%. 002
STAłA I STOPIEŃ DYSOCJACJI; ph MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Obliczyć stężenie molowe jonów Ca 2+ w roztworze zawierającym 2,22g CaCl2 w 100 ml roztworu, przyjmując a = 100%. 002
Odporność chemiczna. Chemikalia 20 C 50 C Aceton 100% - - Żywica poliestrowa
 Aceton 100% - - kwas adypinowy, wszystkie konc.. + 0 Ałun,wszystkie konc. + 0 Alkohol (butylowy-), 100% + - Alkohol (etylowy), 10% + 0 Alkohol (etylowy), 50% + 0 Alkohol (etylowy), 100% 0 - Alkohol (metylowy),
Aceton 100% - - kwas adypinowy, wszystkie konc.. + 0 Ałun,wszystkie konc. + 0 Alkohol (butylowy-), 100% + - Alkohol (etylowy), 10% + 0 Alkohol (etylowy), 50% + 0 Alkohol (etylowy), 100% 0 - Alkohol (metylowy),
OFERTA NA WYKONYWANIE BADAŃ LABORATORYJNYCH
 OFERTA NA WYKONYWANIE BADAŃ LABORATORYJNYCH Pomiary czynników szkodliwych i uciąŝliwych na stanowiskach pracy powietrze - czynniki chemiczne pyły hałas Analizy nawozów Analizy wody i ścieków Analizy produktów
OFERTA NA WYKONYWANIE BADAŃ LABORATORYJNYCH Pomiary czynników szkodliwych i uciąŝliwych na stanowiskach pracy powietrze - czynniki chemiczne pyły hałas Analizy nawozów Analizy wody i ścieków Analizy produktów
Tabela odporności chemicznej
 Tabela odporności chemicznej Tabela odporności PVC na działanie różnych substancji środowisko Aceton 10 - - - - Alkohol amylowy czysty Alkohol etylowy (etanol) 10 Alkohol izopropylowy niefermentacyjny
Tabela odporności chemicznej Tabela odporności PVC na działanie różnych substancji środowisko Aceton 10 - - - - Alkohol amylowy czysty Alkohol etylowy (etanol) 10 Alkohol izopropylowy niefermentacyjny
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
Chemia Nieorganiczna ćwiczenia CHC012001c Powtórzenie materiału II
 Chemia Nieorganiczna ćwiczenia CHC012001c Powtórzenie materiału II 1. Do 150 cm 3 roztworu (NH 4) 2SO 4 o stężeniu 0,110 mol/dm 3 dodano 100 cm 3 0,200 M NH 4OH. Obliczyć ph otrzymanego roztworu. pk b=4,40
Chemia Nieorganiczna ćwiczenia CHC012001c Powtórzenie materiału II 1. Do 150 cm 3 roztworu (NH 4) 2SO 4 o stężeniu 0,110 mol/dm 3 dodano 100 cm 3 0,200 M NH 4OH. Obliczyć ph otrzymanego roztworu. pk b=4,40
Spis treści 1. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2001 2 2. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2002 7
 Spis treści 1. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2001 2 2. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2002 7 3. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2003 13 4. MIELEC - DANE ZA ROK 2001 19 5. MIELEC
Spis treści 1. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2001 2 2. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2002 7 3. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2003 13 4. MIELEC - DANE ZA ROK 2001 19 5. MIELEC
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje rejonowe II stopień
 POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2013/2014
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 24 maja 2014 Im. Jana Kasprowicza INOWROCŁAW XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 24 maja 2014 Im. Jana Kasprowicza INOWROCŁAW XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
PRZYKŁADY INSTALACJI DO SPALANIA ODPADÓW NIEBEZPIECZNYCH
 PRZYKŁADY INSTALACJI DO SPALANIA ODPADÓW NIEBEZPIECZNYCH 1. INSTALACJA DO TERMICZNEGO PRZEKSZTAŁCANIA ODPADÓW NIEBEZPIECZNYCH W DĄBROWIE GÓRNICZEJ W maju 2003 roku rozpoczęła pracę najnowocześniejsza w
PRZYKŁADY INSTALACJI DO SPALANIA ODPADÓW NIEBEZPIECZNYCH 1. INSTALACJA DO TERMICZNEGO PRZEKSZTAŁCANIA ODPADÓW NIEBEZPIECZNYCH W DĄBROWIE GÓRNICZEJ W maju 2003 roku rozpoczęła pracę najnowocześniejsza w
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 797
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 797 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 16 Data wydania: 24 stycznia 2019 r. Nazwa i adres AB 797 ArcelorMittal
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 797 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 16 Data wydania: 24 stycznia 2019 r. Nazwa i adres AB 797 ArcelorMittal
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego. II Etap - 18 stycznia 2016
 XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
TECHNOLOGIA CHEMICZNA
 TECHNOLOGIA CHEMICZNA Zadanie 1 (Zadanie 5. z finału XXVI Konkursu Chemicznego) Chlorek metylu otrzymuje się w procesie chlorowania metanu w instalacji cyrkulacyjnej. Do obiegu doprowadza się metan (strumień
TECHNOLOGIA CHEMICZNA Zadanie 1 (Zadanie 5. z finału XXVI Konkursu Chemicznego) Chlorek metylu otrzymuje się w procesie chlorowania metanu w instalacji cyrkulacyjnej. Do obiegu doprowadza się metan (strumień
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
OCZYSZCZANIE PRZEMYSŁOWYCH GAZÓW ODLOTOWYCH
 OCZYSZCZANIE PRZEMYSŁOWYCH GAZÓW ODLOTOWYCH Do oczyszczania gazów z zanieczyszczeń gazowych wykorzystuje się podstawowe procesy wymiany masy procesy fizyczne: absorpcję adsorpcję kondensację separację
OCZYSZCZANIE PRZEMYSŁOWYCH GAZÓW ODLOTOWYCH Do oczyszczania gazów z zanieczyszczeń gazowych wykorzystuje się podstawowe procesy wymiany masy procesy fizyczne: absorpcję adsorpcję kondensację separację
23 zadania z chemii. Zadanie 1 (0-1) Podstawowymi składnikami substancji zapachowych wielu roślin są estry. Można je przedstawić wzorem ogólnym:
 23 zadania z chemii Zadanie 1 (0-1) Podstawowymi składnikami substancji zapachowych wielu roślin są estry. Można je przedstawić wzorem ogólnym: Estrem jest związek o wzorze: Zadanie 2 (0-1) Elementy kolejki
23 zadania z chemii Zadanie 1 (0-1) Podstawowymi składnikami substancji zapachowych wielu roślin są estry. Można je przedstawić wzorem ogólnym: Estrem jest związek o wzorze: Zadanie 2 (0-1) Elementy kolejki
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Tabela odporności chemicznej wirników zastosowanych w wentylatorach przeciwwybuchowych-chemoodpornych
 Tabela odporności chemicznej wirników zastosowanych w wentylatorach przeciwwybuchowych-chemoodpornych Medium temp. 1.4301 Woda morska 20 P Chlor suchy 100 70 nasycona 20 - Woda chlorowana 1g/l 20 1mg/l
Tabela odporności chemicznej wirników zastosowanych w wentylatorach przeciwwybuchowych-chemoodpornych Medium temp. 1.4301 Woda morska 20 P Chlor suchy 100 70 nasycona 20 - Woda chlorowana 1g/l 20 1mg/l
Instalacji odmagnezowania blendy flotacyjnej w Dziale Przeróbki Mechanicznej Olkusz Pomorzany ZGH Bolesław S.A.
 Instalacji odmagnezowania blendy flotacyjnej w Dziale Przeróbki Mechanicznej Olkusz Pomorzany ZGH Bolesław S.A. AMK Kraków SA al. Jana Pawła II 41; 31-864 Kraków Tel. 12 647 66 38 www.amk@amk.krakow.pl;
Instalacji odmagnezowania blendy flotacyjnej w Dziale Przeróbki Mechanicznej Olkusz Pomorzany ZGH Bolesław S.A. AMK Kraków SA al. Jana Pawła II 41; 31-864 Kraków Tel. 12 647 66 38 www.amk@amk.krakow.pl;
Trociny, wióry, ścinki, drewno, płyta wiórowa i fornir zawierające substancje niebezpieczne 14. 03 01 82 Osady z zakładowych oczyszczalni ścieków
 1. 02 01 01 Osady z mycia i czyszczenia 2. 02 01 03 Odpadowa masa roślinna 3. 02 01 04 Odpady tworzyw sztucznych (z wyłączeniem opakowań) 4. 02 01 08* Odpady agrochemikaliów zawierające substancje, w tym
1. 02 01 01 Osady z mycia i czyszczenia 2. 02 01 03 Odpadowa masa roślinna 3. 02 01 04 Odpady tworzyw sztucznych (z wyłączeniem opakowań) 4. 02 01 08* Odpady agrochemikaliów zawierające substancje, w tym
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
Najlepsze dostępne praktyki i technologie w metalurgii. dr hab. inż. M. Czaplicka, Instytut Metali Nieżelaznych, Gliwice
 Najlepsze dostępne praktyki i technologie w metalurgii dr hab. inż. M. Czaplicka, Instytut Metali Nieżelaznych, Gliwice Źródła emisji Hg metalurgia metali nieżelaznych Emisje Hg do atmosfery pochodzą głównie
Najlepsze dostępne praktyki i technologie w metalurgii dr hab. inż. M. Czaplicka, Instytut Metali Nieżelaznych, Gliwice Źródła emisji Hg metalurgia metali nieżelaznych Emisje Hg do atmosfery pochodzą głównie
Usuwanie tlenków azotu z gazów odlotowych
 Usuwanie tlenków azotu z gazów odlotowych Metody usuwania NO x z gazów odlotowych: Metody mokre; metody absorpcyjne Metody suche; adsorpcja selektywna redukcja katalityczna, nieselektywna redukcja katalityczna,
Usuwanie tlenków azotu z gazów odlotowych Metody usuwania NO x z gazów odlotowych: Metody mokre; metody absorpcyjne Metody suche; adsorpcja selektywna redukcja katalityczna, nieselektywna redukcja katalityczna,
FRIALIT -DEGUSSIT Ceramika Tlenkowa. Odporność na korozję
 FRIALIT -DEGUSSIT Ceramika Tlenkowa Odporność na korozję FRIALIT -DEGUSSIT MATERIAŁY Z CERAMIKI TLENKOWEJ FRIALIT F99,7 Czysty Al 2 O 3 ; gęsty, niezwykle odporny na zużycie i korozję, bardzo wysokie
FRIALIT -DEGUSSIT Ceramika Tlenkowa Odporność na korozję FRIALIT -DEGUSSIT MATERIAŁY Z CERAMIKI TLENKOWEJ FRIALIT F99,7 Czysty Al 2 O 3 ; gęsty, niezwykle odporny na zużycie i korozję, bardzo wysokie
Aminy. - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin
 Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Ćwiczenie 1: Elementy analizy jakościowej
 Ćwiczenie 1: Elementy analizy jakościowej Analiza chemiczna stanowi zbiór metod stosowanych w celu ustalenia składu jakościowego i ilościowego substancji. Wśród metod analitycznych możemy wyróżnić: 1)
Ćwiczenie 1: Elementy analizy jakościowej Analiza chemiczna stanowi zbiór metod stosowanych w celu ustalenia składu jakościowego i ilościowego substancji. Wśród metod analitycznych możemy wyróżnić: 1)
Związki nieorganiczne
 strona 1/8 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
strona 1/8 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
KLASYFIKACJA ZWIĄZKÓW NIEORGANICZNYCH
 KLASYFIKACJA ZWIĄZKÓW NIEORGANICZNYCH Opracowanie: dr hab. Barbara Stypuła, dr inż. Krystyna Moskwa, mgr Agnieszka Tąta Związki nieorganiczne dzieli się najczęściej na: - tlenki - wodorki - wodorotlenki
KLASYFIKACJA ZWIĄZKÓW NIEORGANICZNYCH Opracowanie: dr hab. Barbara Stypuła, dr inż. Krystyna Moskwa, mgr Agnieszka Tąta Związki nieorganiczne dzieli się najczęściej na: - tlenki - wodorki - wodorotlenki
Tabela Odpornoœci Materia³ów
 ACETON 70 - X X O O O O O O O O O O O O O X X X O X X X O ACETYLEN, (Wybuchowy w kontrakcie z 100 100 O O O O O X X X O O O O O O O X X X O X X X O Cu) ALDEHYD AKRYLOWY Akroleina 100 100 X X L L L X X
ACETON 70 - X X O O O O O O O O O O O O O X X X O X X X O ACETYLEN, (Wybuchowy w kontrakcie z 100 100 O O O O O X X X O O O O O O O X X X O X X X O Cu) ALDEHYD AKRYLOWY Akroleina 100 100 X X L L L X X
Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 Tytuł: Reakcja kwasu i wodorotlenku. Powstawanie soli dobrze rozpuszczalnej. Roztwory: HCl, NaOH; fenoloftaleina Probówka, łapa drewniana, palnik, pipeta Do probówki nalewamy ok. 3cm 3 wodorotlenku sodu
Tytuł: Reakcja kwasu i wodorotlenku. Powstawanie soli dobrze rozpuszczalnej. Roztwory: HCl, NaOH; fenoloftaleina Probówka, łapa drewniana, palnik, pipeta Do probówki nalewamy ok. 3cm 3 wodorotlenku sodu
Instrukcja dla uczestnika
 II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
PODKARPACKI GIMNAZJALNY KONKURS CHEMICZNY
 12 stycznia 2017 r. PODKARPACKI GIMNAZJALNY KONKURS CHEMICZNY Szkoła (pieczątka) Imię i nazwisko ucznia Klasa Imię i nazwisko nauczyciela (tabelkę poniżej wypełnia zespół sprawdzający) Test 1 2 3 4 5 6
12 stycznia 2017 r. PODKARPACKI GIMNAZJALNY KONKURS CHEMICZNY Szkoła (pieczątka) Imię i nazwisko ucznia Klasa Imię i nazwisko nauczyciela (tabelkę poniżej wypełnia zespół sprawdzający) Test 1 2 3 4 5 6
Ćwiczenia nr 2: Stężenia
 Ćwiczenia nr 2: Stężenia wersja z 5 listopada 2007 1. Ile gramów fosforanu(v) sodu należy zużyć w celu otrzymania 2,6kg 6,5% roztworu tego związku? 2. Ile należy odważyć KOH i ile zużyć wody do sporządzenia
Ćwiczenia nr 2: Stężenia wersja z 5 listopada 2007 1. Ile gramów fosforanu(v) sodu należy zużyć w celu otrzymania 2,6kg 6,5% roztworu tego związku? 2. Ile należy odważyć KOH i ile zużyć wody do sporządzenia
Instrukcja do ćwiczenia WŁAŚCIWOŚCI WYBRANYCH ANIONÓW.
 Instrukcja do ćwiczenia WŁAŚCIWOŚCI WYBRANYCH ANIONÓW. CHEMIA ANIONÓW W ROZTWORACH WODNYCH Celem ćwiczenia jest zapoznanie się z właściwościami chemicznymi wybranych anionów pierwiastków I oraz II okresu
Instrukcja do ćwiczenia WŁAŚCIWOŚCI WYBRANYCH ANIONÓW. CHEMIA ANIONÓW W ROZTWORACH WODNYCH Celem ćwiczenia jest zapoznanie się z właściwościami chemicznymi wybranych anionów pierwiastków I oraz II okresu
KONKURS CHEMICZNY,,ROK PRZED MATURĄ
 KONKURS CHEMICZNY,,ROK PRZED MATURĄ ROK SZKOLNY 2007/2008 ETAP SZKOLNY Numer kodowy Suma punktów: Podpisy Komisji: 1.... 2.... 3.... Informacje dla ucznia: 1. Arkusz zawiera 12 zadań. 2. Pisemnych odpowiedzi
KONKURS CHEMICZNY,,ROK PRZED MATURĄ ROK SZKOLNY 2007/2008 ETAP SZKOLNY Numer kodowy Suma punktów: Podpisy Komisji: 1.... 2.... 3.... Informacje dla ucznia: 1. Arkusz zawiera 12 zadań. 2. Pisemnych odpowiedzi
Przemiany substancji
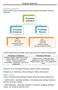 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Wykład 4. Chemia Środowiska
 Wykład 4 Chemia Środowiska Średnioroczne wartości stężeń głównych zanieczyszczeń atmosfery w obszarze GOP w 1989, w µg/m 3 Substancja Stężenie dopuszczalne wg norm Średnie stężenie na terenie GOP Maksymalne
Wykład 4 Chemia Środowiska Średnioroczne wartości stężeń głównych zanieczyszczeń atmosfery w obszarze GOP w 1989, w µg/m 3 Substancja Stężenie dopuszczalne wg norm Średnie stężenie na terenie GOP Maksymalne
Elektrofiltry dla małych kotłów na paliwa stałe. A. Krupa A. Jaworek, A. Sobczyk, A. Marchewicz, D. Kardaś
 Elektrofiltry dla małych kotłów na paliwa stałe A. Krupa A. Jaworek, A. Sobczyk, A. Marchewicz, D. Kardaś Rodzaje zanieczyszczeń powietrza dwutlenek siarki, SO 2 dwutlenek azotu, NO 2 tlenek węgla, CO
Elektrofiltry dla małych kotłów na paliwa stałe A. Krupa A. Jaworek, A. Sobczyk, A. Marchewicz, D. Kardaś Rodzaje zanieczyszczeń powietrza dwutlenek siarki, SO 2 dwutlenek azotu, NO 2 tlenek węgla, CO
Najlepsze dostępne technologie i wymagania środowiskowe w odniesieniu do procesów termicznych. Adam Grochowalski Politechnika Krakowska
 Najlepsze dostępne technologie i wymagania środowiskowe w odniesieniu do procesów termicznych Adam Grochowalski Politechnika Krakowska Termiczne metody utylizacji odpadów Spalanie na ruchomym ruszcie
Najlepsze dostępne technologie i wymagania środowiskowe w odniesieniu do procesów termicznych Adam Grochowalski Politechnika Krakowska Termiczne metody utylizacji odpadów Spalanie na ruchomym ruszcie
Kod ucznia Liczba punktów A X B C X
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich

 Pracownia Ä2'3$'
Pracownia Ä2'3$'