Komórki macierzyste naskórka biologia i potencjalne zastosowanie w medycynie regeneracyjnej
|
|
|
- Angelika Przybylska
- 9 lat temu
- Przeglądów:
Transkrypt
1 Komórki macierzyste naskórka biologia i potencjalne zastosowanie w medycynie regeneracyjnej STRESZCZENIE Komórki macierzyste uczestniczą w odnowie i regeneracji nabłonków różnych narządów. Największym rezerwuarem nabłonkowych komórek macierzystych w organizmie jest skóra. Stanowi ona wyspecjalizowaną barierę chroniącą wnętrze ustroju przed szkodliwym wpływem czynników fizycznych, chemicznych i biologicznych, a jednocześnie zapewnia odbiór sygnałów pochodzących ze środowiska zewnętrznego. Skóra uczestniczy również w licznych procesach fizjologicznych warunkujących zachowanie homeostazy. Odnowa i regeneracja naskórka, stanowiącego zewnętrzną warstwę skóry, możliwa jest dzięki obecności różnych populacji komórek macierzystych rezydujących w mikrośrodowiskach (niszach) tworzących specyficzne warunki umożliwiające zachowanie właściwości tych komórek. Dzięki temu, że komórki w niszy rzadko ulegają podziałom, możliwe stało się ich odróżnienie od innych szybko proliferujących komórek skóry. Na tej podstawie zlokalizowano komórki macierzyste w przedziałach międzymieszkowych, w regionie wybrzuszenia mieszka włosowego, a także w obrębie gruczołów łojowych. Wykazano ponadto, że mieszki włosowe stanowią niszę dla komórek progenitorowych melanocytów oraz innych komórek macierzystych wywodzących się z grzebienia nerwowego, jak również mezenchymalnych komórek macierzystych. Obecność komórek macierzystych charakteryzujących się wysokim potencjałem proliferacyjnym i zdolnością do samoodnowy umożliwia zachowanie równowagi naskórka w warunkach fizjologicznych oraz jego regenerację. Identyfikacja, izolacja i charakterystyka nabłonkowych komórek macierzystych konieczna jest do poznania i zrozumienia podłoża szeregu chorób skóry, opracowania wydajnych metod ich leczenia, jak również szerszego zastosowania tych komórek w medycynie regeneracyjnej, terapii genowej, czy kosmetologii. WPROWADZENIE Nabłonki tworzą zewnętrzną warstwę skóry i wyściełają liczne narządy organizmu, tj. przewód pokarmowy, drogi oddechowe czy układ moczowo-płciowy, oddzielając wnętrze ustroju od środowiska zewnętrznego. Zachowanie homeostazy tej tkanki możliwe jest dzięki obecności multipotencjalnych komórek macierzystych charakteryzujących się zdolnością do samoodnowy i wysokim potencjałem proliferacyjnym [1]. Największym rezerwuarem nabłonkowych komórek macierzystych w organizmie jest skóra, co czyni ją źródłem komórek o potencjalnym zastosowaniu terapeutycznym. Szacuje się, że komórki macierzyste naskórka stanowią 1 10% wszystkich komórek warstwy podstawnej, nie licząc komórek macierzystych rezydujących w mieszkach włosowych [2,3]. Ze względu na łatwą dostępność i szerokie, potencjalne możliwości zastosowania w medycynie regeneracyjnej, terapii genowej i kosmetologii nabłonkowe komórki macierzyste od wielu lat budzą rosnące zainteresowanie badaczy z różnych dziedzin nauki [4]. Dlatego też celem niniejszej pracy jest przedstawienie aktualnej wiedzy na temat biologii komórek macierzystych naskórka i możliwości ich wykorzystania w szeroko pojętej medycynie. NASKÓREK JAKO BOGATE ŹRÓDŁO NABŁONKOWYCH KOMÓREK MACIERZYSTYCH Małgorzata Uzarska 1,* Dorota Porowińska 1 Anna Bajek 1 Tomasz Drewa 1,2 1 Zakład Inżynierii Tkankowej, Collegium Medicum im. Ludwika Rydygiera w Bydgoszczy, Uniwersytet Mikołaja Kopernika w Toruniu, Bydgoszcz 2 Oddział Urologii Ogólnej i Onkologicznej, Specjalistyczny Szpitał Miejski im. Mikołaja Kopernika w Toruniu, Toruń * Zakład Inżynierii Tkankowej, Collegium Medicum im. Ludwika Rydygiera w Bydgoszczy, Uniwersytet Mikołaja Kopernika w Toruniu, ul. Karłowicza 24, Bydgoszcz; tel.: (52) , m.uzarska@wp.pl Artykuł otrzymano 8 marca 2013 r. Artykuł zaakceptowano 21 marca 2013 r. Słowa kluczowe: nabłonkowe komórki macierzyste, skóra, mieszki włosowe, gruczoły łojowe Wykaz skrótów: 3H-Tdr trytowana tymidyna; ASCs komórki macierzyste organizmów dorosłych; BMP białko morfogenetyczne kości; BrdU bromodeoksyurydyna; EPU naskórkowa jednostka proliferacji; FGF czynnik wzrostu fibroblastów; GFP białko zielonej fluorescencji; HFSCs komórki macierzyste mieszków włosowych; IFE przedział międzymieszkowy; LRCs komórki zatrzymujące znacznik; MAPK kinaza białkowa aktywowana mitogenami; MCSP proteoglikan siarczanu chondroityny czerniaka złośliwego; MSCs mezenchymalne komórki macierzyste; SGs gruczoły łojowe; TACs komórki dzielące się przejściowo; TGF-β transformujący czynnik wzrostu beta; TNF czynnik martwicy nowotworów Skóra jest największym narządem ludzkiego organizmu. Stanowi wielofunkcyjną barierę pomiędzy środowiskiem zewnętrznym, a ustrojem, zapewniając jednocześnie kontakt z otoczeniem. Umożliwia zachowanie homeostazy poprzez ochronę przed promieniowaniem słonecznym, działaniem ksenobiotyków oraz patogennych mikroorganizmów, jak również przez udział w procesach termoregulacji, utrzymaniu równowagi wodno-elektrolitowej oraz odpowiedzi immunologicznej [5,6]. Naskórek tworzący zewnętrzną warstwę skóry, zbudowany jest z komórek nabłonkowych pochodzenia ektodermalnego, natomiast leżącą poniżej skórę właściwą i tkankę podskórną tworzą komórki wywodzące się z mezodermy i grzebienia nerwowego. Odnowa tak odmiennych typów komórek możliwa jest dzięki obecności różnych popula- Postępy Biochemii 59 (2)
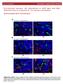
2 cji komórek macierzystych rezydujących w tzw. niszach, inaczej mikrośrodowiskach, zapewniających zachowanie specyficznych właściwości tych komórek [7]. Komórki tworzące niszę izolują komórki macierzyste naskórka przed sygnałami indukującymi różnicowanie, czynnikami proapoptotycznymi oraz innymi bodźcami, które mogłyby wpłynąć na ich równowagę. Środowisko niszy hamuje również nadmierną proliferację, co chroni DNA tych komórek przed uszkodzeniem i zapobiega inicjacji transformacji nowotworowej [8]. Badania opierające się na wykorzystaniu cech charakterystycznych dla komórek macierzystych pozwoliły na wyróżnienie kilku populacji komórek macierzystych naskórka zlokalizowanych w przedziałach międzymieszkowych (IFE, ang. interfollicular epidermis), w regionie wybrzuszenia mieszka włosowego (ang. bulge), a także w obrębie gruczołów łojowych [9,10]. Mieszki włosowe stanowią ponadto niszę dla komórek progenitorowych melanocytów oraz innych komórek macierzystych wywodzących się z grzebienia nerwowego [11]. Asymetryczne podziały komórek macierzystych naskórka Sugeruje się, że zachowanie stałej liczby komórek macierzystych naskórka, podobnie jak innych komórek macierzystych organizmów dorosłych (ASCs, ang. adult stem cells), możliwe jest dzięki asymetrycznym podziałom komórkowym, w wyniku których powstaje identyczna komórka potomna zdolna do samoodnowy oraz komórka progenitorowa, która podlega różnicowaniu podczas kolejnych podziałów (Ryc. 1) [12]. U myszy opisano dwa rodzaje podziałów asymetrycznych komórek macierzystych naskórka, które różnią się między sobą orientacją wrzeciona kariokinetycznego. W naskórku pobranym z ogonów dorosłych osobników podczas podziału wrzeciono położone jest równolegle do błony podstawnej. Obie komórki potomne pozostają czasowo w obszarze niszy, po czym jedna z nich ulega oddzieleniu od błony podstawnej, najprawdopodobniej na skutek działania zewnątrzkomórkowych sygnałów indukujących zmiany w syntezie integryn [13]. Podział, podczas którego wrzeciono układa się prostopadle do błony podstawnej zaobserwowano natomiast w czasie rozwoju zarodkowego tych organizmów. Prostopadła orientacja wrzeciona kariokinetycznego powoduje, że komórka związana z błoną podstawną pozostaje w środowisku niszy, natomiast druga komórka ulega różnicowaniu [14]. Odmienny los komórek potomnych może być wynikiem oddalenia jednej z nich od zewnątrzkomórkowych sygnałów warunkujących zachowanie cech charakterystycznych dla komórek macierzystych lub nierównomiernym rozmieszczeniem czynników determinujących różnicowanie podczas podziału komórki macierzystej [15,16]. Rycina 1. Asymetryczne podziały komórek macierzystych skóry. (A) Wrzeciono kariokinetyczne położone równolegle do błony podstawnej. Obie komórki potomne pozostają początkowo w obszarze niszy (kolor ciemnoniebieski), po czym jedna z nich podlega różnicowaniu (kolor czerwony). (B) Wrzeciono kariokinetyczne położone prostopadle do błony podstawnej. Komórka położona w obszarze niszy pozostaje niezróżnicowana (kolor ciemnoniebieski), natomiast komórka oddalona od sygnałów warunkujących zachowanie cech unikalnych dla komórek macierzystych, podlega różnicowaniu (kolor czerwony) [15,16]
3 Identyfikacja komórek macierzystych naskórka Komórki macierzyste naskórka charakteryzuje zdolność do samoodnowy, wydłużony cykl komórkowy z jednoczesnym zachowaniem wysokiego potencjału proliferacyjnego, aktywacja pod wpływem uszkodzenia bądź innych sygnałów indukujących podziały komórkowe oraz możliwość tworzenia wyspecjalizowanych struktur naskórka [4]. Wykorzystanie specyficznych właściwości nabłonkowych komórek macierzystych umożliwiło opracowanie metod pozwalających na ich identyfikację, izolację i charakterystykę. Znakowanie DNA przy użyciu trytowanej tymidyny (3H-Tdr, ang. tritiated thymidine) lub bromodeoksyurydyny (BrdU, ang. bromodeoxyuridine) pozwala na odróżnienie komórek szybko proliferujących od wolno dzielących się komórek macierzystych. Na tej podstawie zidentyfikowano populację tzw. komórek LRCs (ang. label-retaining cells), które przez dłuższy czas zatrzymują wprowadzony do DNA znacznik [2,17]. LRCs zaobserwowano także, dzięki wykorzystaniu metod inżynierii genetycznej umożliwiających uzyskanie ekspresji genu kodującego białko zielonej fluorescencji (GFP, ang. green fluorescent protein) w komórkach charakteryzujących się wydłużonym cyklem komórkowym [18,19] Możliwa jest również analiza potencjału proliferacyjnego komórek naskórka w hodowli in vitro, poprzez ocenę właściwości kolonii utworzonych przez wyizolowane komórki. Analiza klonalna pozwala na wyróżnienie trzech rodzajów klonów paraklonów, meroklonów oraz holoklonów. Paraklony zbudowane są z komórek zróżnicowanych, o bardzo ograniczonym potencjale proliferacyjnym. Tworzą one nieliczne, małe kolonie, których nie udaje się subklonować. Meroklony powstają z komórek dzielących się przejściowo, budujących kolonie o nieregularnym kształcie, z których tylko część komórek może być dalej klonowana. Komórki macierzyste naskórka, charakteryzujące się wysokim potencjałem proliferacyjnym tworzą natomiast holoklony, zwarte kolonie o regularnym kształcie, które po pasażu dają początek takim samym subklonom [20-22]. Naskórek zbudowany jest z kilku warstw komórek zawierających keratynocyty znajdujące się na różnych etapach zróżnicowania (Ryc. 2). Keratynocyty warstwy podstawnej tworzą pojedynczy rząd komórek o cylindrycznym kształcie, ułożonych prostopadle do błony podstawnej i ściśle z nią związanych za pomocą hemidesmosomów. W miarę dojrzewania keratynocyty przesuwają się ku górnym warstwom, aż docierają do warstwy rogowej, gdzie obumierają i ulegają złuszczeniu [23]. Wytworzenie uwarstwionego naskórka wymaga współdziałania różnych szlaków sygnalizacji wewnątrzkomórkowej. Badania myszy wykazały, że w procesie tym uczestniczy białko Notch, kinaza MAP (MAPK, ang. mitogen-activated protein kinase) oraz liczne czynniki transkrypcyjne, m.in. NF-κB, p63, AP-2, C/EBP, IRF-6, GRHL3 oraz KLF4 [12]. Kluczowym etapem różnicowania jest przejście komórek z warstwy podstawnej do kolczystej, czemu towarzyszy zmiana ekspresji genów kodujących białka strukturalne. W keratynocytach, które oddzieliły się od błony podstawnej, zahamowaniu ulega synteza keratyny 5 oraz 14, jednocześnie aktywowane są geny kodujące keratynę 1 i 10. Komórki warstwy kolczystej wykazują ponadto syntezę innych białek, które gromadzą się pod powierzchnią błony komórkowej i uczestniczą w późnych etapach różnicowania [24]. Dodatkowy wpływ na różnicowanie keratynocytów mogą wywierać mechanizmy epigenetyczne, tj. interferencja mikrorna oraz metylacja histonów [25]. Naskórkowe jednostki proliferacji jako model organizacji komórek macierzystych przestrzeni międzymieszkowych Badania naskórka myszy wykazały, że komórki macierzyste przedziałów międzymieszkowych są rozmieszczone równomiernie w obrębie warstwy podstawnej tworząc liczne, funkcjonalnie niezależne przedziały zwane naskórkowymi jednostkami proliferacji (EPU, ang. epidermal proliferative units). Zakłada się, że EPU zbudowane są z pojedynczej, centralnie położonej komórki macierzystej, otoczonej przez komórki dzielące się przejściowo (TACs, ang. transient amplifying cells), zlokalizowane na obrzeżach jednostki oraz z różnicujących się keratynocytów, które opuszczają jednostkę kierując się ku górnym warstwom naskórka (Ryc. 2) [26-28]. KOMÓRKI MACIERZYSTE W PRZEDZIAŁACH MIĘDZYMIESZKOWYCH A Rycina 2. Położenie komórek macierzystych w obrębie naskórkowych jednostek proliferacji. (A) Budowa naskórka przestrzeni międzymieszkowych. (B) Budowa naskórkowych jednostek proliferacji. Warstwa podstawna naskórka przestrzeni międzymieszkowych zorganizowana jest w postaci heksagonalnych jednostek obejmujących położoną centralnie komórkę macierzystą (kolor ciemnoniebieski), komórki dzielące się przejściowo (kolor jasnoniebieski) oraz różnicujące się keratynocyty, które opuszczają jednostkę kierując się ku warstwie rogowej (kolor różowy) [28]. Taki model organizacji budzi jednak wiele wątpliwości. Wyniki badań naskórka pochodzącego z ogonów mysich sugerują, że keratynocyty warstwy podstawnej zdolne są do podziałów symetrycznych i asymetrycznych, w czasie których dochodzi do powstania dwóch niezróżnicowanych komórek potomnych, dwóch komórek podlegających różnicowaniu, bądź po jednej z każdego rodzaju. Umożliwiłoby to zachowanie homeostazy bez udziału komórek macierzystych w procesie odnowy nieuszkodzonego naskórka [29,30]. Badania nad ludzkimi komórkami macierzystymi obszarów międzymieszkowych są utrudnione ze względu na brak możliwości znakowania DNA in situ oraz brak B markerów charakterystycznych wyłącznie dla komórek macierzystych naskórka. Doświadczenia z wykorzystaniem skóry pochodzącej z Postępy Biochemii 59 (2)
4 napletka noworodków pozwoliły na identyfikację komórek o cechach charakterystycznych dla komórek macierzystych na szczytach brodawek skórnych [31,32]. Z kolei w naskórku osób dorosłych międzymieszkowe komórki macierzyste zlokalizowano w wpukleniach błony podstawnej (ang. rete ridges) [33,34]. Markery komórek macierzystych przedziałów międzymieszkowych Identyfikacja komórek macierzystych przedziałów międzymieszkowych możliwa jest dzięki wykorzystaniu określonych markerów powierzchniowych i wewnątrzkomórkowych. Jednym z wyznaczników komórek macierzystych naskórka jest wysoka synteza β1-integryny, glikoproteiny przytwierdzającej komórki macierzyste do błony podstawnej naskórka [31,35,36]. Na powierzchni komórek macierzystych obserwuje się również zwiększoną syntezę α6-integryny, równocześnie z niską syntezą keratyny 15 i receptora transferyny (CD71) [34]. Innym markerem charakterystycznym dla komórek macierzystych przedziałów międzymieszkowych jest Lrig1, białko transbłonowe warunkujące zachowanie wolnego tempa proliferacji komórek macierzystych IFE. Populację komórek wykazujących produkcję Lrig1 identyfikuje się na wczesnym etapie rozwoju zarodkowego, w tym samym czasie, w którym następuje formowanie mieszków włosowych [37]. Do określenia lokalizacji komórek macierzystych przedziałów międzymieszkowych wykorzystano również proteoglikan siarczanu chondroityny czerniaka złośliwego (MCSP, ang. melanoma-associated chondroitin sulfate proteoglycan), który moduluje dostępność czynników wzrostowych i adhezję komórek do macierzy zewnątrzkomórkowej, co najprawdopodobniej wpływa na tworzenie skupisk komórek macierzystych w obrębie IFE [32]. Kolejnym potencjalnym markerem komórek macierzystych naskórka może być czynnik transkrypcyjny p63 [38]. Występowanie tego białka nie jest jednak ograniczone wyłącznie do komórek macierzystych, co sugeruje, że jest ono raczej markerem TACs [39-41]. Jako wyznacznik komórek macierzystych próbowano również wykorzystać białka desmosomalne m.in. desmoplakinę i desmogleinę [33]. Ponadto, komórki o wysokim potencjale proliferacyjnym mają zdolność do usuwania barwnika fluorescencyjnego Hoechst 33342, który wiąże się z DNA na zasadzie interkalacji. Dzięki temu wykazują one niski poziom fluorescencji, co pozwala na wyróżnienie tej specyficznej populacji komórek (ang. side population). Komórki naskórka, które nie wykazują fluorescencji, nie posiadają jednak cech komórek macierzystych [42]. Pomimo intensywnych badań nie udało się do tej pory wyróżnić markera unikalnego dla komórek macierzystych przedziałów międzymieszkowych. Z tego względu przydatnym narzędziem do identyfikacji komórek macierzystych naskórka może okazać się badanie ekspresji genów w komórkach warstwy podstawnej wykazujących właściwości komórek macierzystych [43]. KOMÓRKI MACIERZYSTE MIESZKÓW WŁOSOWYCH Mieszki włosowe stanowią integralną część naskórka człowieka odgrywając istotną rolę w fizjologicznej odbudowie tej tkanki [44]. Rozwój mieszków włosowych przypada na 8 12 tydzień rozwoju zarodkowego i zależy od wzajemnego oddziaływania komórek epidermalnych i mezenchymalnych. Proces ten kontrolowany jest przez wiele białek, m.in. Wnt/β-kateninę, Sonic Hedgehog, transformujący czynnik wzrostu beta (TGF-β, ang. transforming growth factor-β), czynnik wzrostu fibroblastów (FGF, ang. fibroblast growth factor) oraz czynnik martwicy nowotworów (TNF, ang. tumor necrosis factor) [45]. Dojrzałe mieszki włosowe są strukturami wielowarstwowymi, zbudowanymi z kilku różnych populacji komórek [46]. Każdy mieszek podlega cyklicznym zmianom, składającym się z trzech etapów: fazy wzrostu (anagen), fazy przejściowej (katagen) i fazy spoczynku (telogen) [44,47,48]. W fazie wzrostu ketratynocyty znajdujące się w macierzy intensywnie proliferują, dając początek różnym liniom komórkowym budującym łodygę oraz wewnętrzną osłonkę włosa. Faza przejściowa wiąże się z regresją macierzy i przesunięciem brodawki włosa ku górnym warstwom skóry. Prowadzi to ostatecznie do jego wypadnięcia i zapoczątkowania fazy spoczynku, która trwa dopóki nie nastąpi zainicjowanie wytworzenia nowej macierzy włosa [23,49]. Zdolność mieszków włosowych do samoodnawiania swojej populacji możliwa jest dzięki rezydującym w regionie wybrzuszenia komórkom macierzystym (Ryc. 3) [44,47]. Rycina 3. Budowa mieszka włosowego. Komórki macierzyste rezydujące w obrębie wybrzuszenia mieszka włosowego oznaczono kolorem ciemnoniebieskim [23]. Markery nabłonkowych komórek macierzystych mieszków włosowych Badania w zakresie izolacji oraz biologii komórek macierzystych mieszków włosowych trwają już od ponad 20 lat i prowadzone są głównie na modelu mysim i ludzkim [50-52]. Termin 222
5 komórki macierzyste mieszków włosowych (HFSCs, ang. hair follicle stem cells) najczęściej stosowany jest w odniesieniu do populacji komórek nabłonkowych. Drugą grupę komórek macierzystych mieszków włosowych stanowią mezenchymalne komórki macierzyste (MSCs, ang. mesenchymal stem cells) zlokalizowane w torebce włóknistej włosa i jego brodawce oraz komórki o potencjale zbliżonym do komórek embrionalnych [53-55]. Do tej pory, pomimo intensywnych badań, nie zidentyfikowano uniwersalnego i specyficznego markera charakterystycznego dla komórek macierzystych mieszków włosowych. Dodatkową komplikacją jest duża różnorodność populacji komórek rezydujących w tym obszarze. Najczęściej fenotyp HFSCs opisywany jest na podstawie syntezy markerów wewnątrzkomórkowych, takich jak keratyna 15 i 19, czy białko p53, bądź markerów powierzchniowych β1-integryny, α6-integryny, CD34 oraz CD71 [51,56,57]. Fenotyp komórek macierzystych może jednak zmieniać się w trakcie trwania hodowli w warunkach in vitro. Różnice w zawartości wymienionych markerów mogą być również spowodowane odmiennymi metodami izolacji mieszków włosowych, w zależności od gatunku. Do specyficznych markerów HFSCs myszy i szczurów należą keratyna 15, białko p63, β1-integryna, α6-integryna, oraz CD34 [10,51,58-60]. Z kolei do powszechnie stosowanych markerów ludzkich nabłonkowych komórek macierzystych mieszków włosowych należą keratyna 15 i 19, p63, β-katenina, folistatyna, α6-integryna, PHLDA1, CD200, CD271 oraz czynniki transkrypcyjne Oct-4, Nanog i Pax3 [56,61-63]. Izolowanie komórek macierzystych mieszków włosowych nastręcza wiele trudności, m.in. z powodu niewielkich rozmiarów mieszków. W związku z tym zaproponowano zastosowanie cytometrii przepływowej do sortowania i izolacji komórek macierzystych z regionu wybrzuszenia. Na podstawie przeprowadzonych badań Ohyama scharakteryzował ludzkie komórki macierzyste mieszków włosowych jako CD200+, CD24-, CD34-, CD71- i CD146-. Obecnie uważa się, iż markerem powierzchniowym najlepiej opisującym ludzkie HFSCs jest CD200 [64]. Coraz częściej jednak przedstawiane są wyniki, w których do identyfikacji komórek macierzystych mieszków włosowych stosuje się markery inne, niż te używane dotychczas. Sugeruje to istnienie wielu różnych populacji nabłonkowych komórek macierzystych w obrębie mieszków włosowych, przy czym nadal nie wiadomo, która z tych populacji ma największe zdolności do różnicowania i proliferacji [60,61]. Mieszki włosowe źródłem komórek macierzystych Lokalizacja niszy komórek macierzystych w mieszku włosowym przez długi czas pozostawała nieznana, przede wszystkim dlatego, iż w niszy komórki pozostają niemal nieaktywne mitotycznie. Obecność komórek macierzystych w obrębie wybrzuszenia mieszka włosowego po raz pierwszy została potwierdzona przez Cotsarelis i wsp. [2]. Od tego momentu wiele grup badawczych poczyniło podobne obserwacje, zarówno w odniesieniu do mieszków włosowych człowieka, jak i tych pochodzących od gryzoni. Mieszki włosowe, będąc siedliskiem różnych populacji komórek macierzystych, stanowią obiecujące źródło ASCs zdolnych do wielokierunkowego różnicowania i odpowiedzialnych za regenerację włosów, gruczołów łojowych, czy naskórka [53,65,66]. Zaletą mieszków włosowych jest możliwość mało inwazyjnego sposobu pobierania materiału do izolacji, co stwarza możliwość wykorzystania mieszków jako alternatywnego źródła komórek macierzystych w dorosłym organizmie [44,64,67,68]. KOMÓKI MACIERZYSTE GRUCZOŁÓW ŁOJOWYCH Gruczoły łojowe (SGs, ang. sebaceous glands) powstają podczas rozwoju zarodkowego jako wyrostki zlokalizowane w górnej części mieszka włosowego, ponad regionem wybrzuszenia. Odpowiadają za produkcję dojrzałych sebocytów (komórek łojowych), które na zasadzie wydzielania holokrynowego uwalniają łój do torebki mieszka włosowego [7,24]. Za utrzymanie homeostazy gruczołów łojowych odpowiedzialne są aktywne mitotycznie komórki progenitorowe, zlokalizowane w warstwie podstawnej znajdującej się na obrzeżach tych struktur. Stanowią one rezerwuar komórek umożliwiających odnowę tkanki podczas normalnych cykli wzrostu włosów [69]. Powstające w wyniku podziałów komórki potomne kierowane są do centrum gruczołu, gdzie przestają się dzielić i zaczynają różnicować w kierunku sebocytów, które ostatecznie ulegają lizie w kanale łojowym [70]. Komórki macierzyste SGs są najsłabiej scharakteryzowane spośród wszystkich populacji komórek macierzystych naskórka. W komórkach macierzystych gruczołów łojowych stwierdzono obecność czynnika transkrypcyjnego Blimp1, który został sklasyfikowany jako marker tych komórek [71]. Gen kodujący ten czynnik nie ulega jednak selektywnej ekspresji tylko w komórkach progenitorowych gruczołów łojowych, lecz również w komórkach mieszków włosowych i przedziałów międzymieszkowych [70,72]. Blimp1 działając jako transkrypcyjny represor czynnika c-myc, hamuje podziały komórek i ich różnicowanie w kierunku sebocytów [71]. Brak Blimp1 powoduje wzrost zawartości c-myc, co prowadzi do nadmiernej proliferacji komórek macierzystych i hiperplazji gruczołów łojowych. Blimp1 jest więc odpowiedzialny za utrzymanie komórek macierzystych SGs w stanie niezróżnicowanym. Funkcję taką odgrywa również czynnik Rac1, którego utrata stymuluje różnicowanie komórek macierzystych gruczołów łojowych w sebocyty, uniemożliwiając utrzymanie homeostazy tych struktur [73,74]. Dodatkowym markerem komórek macierzystych SGs może być keratyna 15, jednak nie wiadomo, czy jest to ta sama populacja komórek, w której obserwuje się syntezę czynnika Blimp1 [75]. Sugeruje się, że komórki macierzyste gruczołów łojowych mogą w odpowiednich warunkach różnicować się w różne rodzaje komórek nabłonkowych rezydujących w naskórku [76]. Wykazano, że u myszy o obniżonej odporności (ang. nude mice), formowały one gruczoły łojowe oraz komórki przestrzeni międzymieszkowej, ale nie tworzyły mieszków włosowych [70]. Nie można jednak wykluczyć, że poddane dodatkowej stymulacji mogłyby róż- Postępy Biochemii 59 (2)
6 nicować się również w komórki tworzące mieszki włosowe. Aktywacja β-kateniny w dojrzałych komórkach skóry powoduje tworzenie mieszków włosowych z istniejących gruczołów łojowych sugerując, że komórki macierzyste występujące w obrębie tych struktur zdolne są do przeróżnicowania, które umożliwia powstawanie wszystkich rodzajów komórek mieszków włosowych [77]. HIERARCHIA KOMÓREK MACIERZYSTYCH NASKÓRKA Komórki macierzyste zlokalizowane w przedziałach międzymieszkowych mają mniejszą zdolność do samoodnowy i różnicowania w porównaniu do komórek rezydujących w obrębie wybrzuszenia mieszka włosowego. Charakteryzują się również niższym potencjałem proliferacyjnym w hodowli in vitro [4]. Wykazano ponadto, że urazy w obrębie przedziałów międzymieszkowych, które nie naruszają struktury mieszka włosowego mogą zostać odbudowane, natomiast uszkodzenie mieszków uniemożliwia regenerację naskórka [78]. Co więcej, komórki mieszków włosowych mogą dać początek wszystkim liniom komórek naskórka, łącznie z komórkami przestrzeni międzymieszkowych [65]. Sugeruje to, że komórki macierzyste znajdujące się w wybrzuszeniu mieszków włosowych opuszczają swoją niszę i zasiedlają inne obszary skóry, dając początek populacjom komórek macierzystych przestrzeni międzymieszkowych i gruczołów łojowych [79]. Nabycie i utrzymanie multipotencjalnych właściwości komórek macierzystych mieszka włosowego wiąże się z aktywacją szlaku sygnałowego Wnt/β-katenina. Inicjacja tworzenia mieszków włosowych następuje na skutek oddziaływania pomiędzy komórkami epidermalnymi i mezenchymalnymi podczas rozwoju zarodkowego. Aktywacja szlaku Wnt/β-katenina w komórkach epidermalnych i jednoczesne zahamowanie szlaku białka morfogenetycznego kości (BMP, ang. bone morphogenetic protein) przez mezenchymalne komórki macierzyste powoduje syntezę czynnika transkrypcyjnego Lef1, co związane jest z inicjacją tworzenia włosów [80]. Wykształceniu zawiązków włosa towarzyszy pojawienie się komórek wykazujących koekspresję markerów NFATc1 i Sox9, charakterystycznych dla komórek macierzystych mieszków włosowych oraz Lrig1, typowego dla komórek macierzystych przestrzeni międzymieszkowych i gruczołów łojowych. W dalszych etapach, w komórkach wykazujących obecność Lrig1, zahamowana zostaje synteza NFATc1 i Sox9. Komórki te tworzą najprawdopodobniej populację komórek macierzystych IFE i SGs w naskórku dorosłych organizmów. Sugeruje to, że komórki macierzyste mieszków włosowych, przestrzeni międzymieszkowych i gruczołów łojowych powstają z jednej multipotencjalnej komórki macierzystej [10]. Z kolei analiza klonalna wykazała, że komórki mieszków włosowych nie uczestniczą w odbudowie uszkodzonych przestrzeni międzymieszkowych [81]. Nie obserwuje się również zaburzenia struktury IFE u myszy poddanych ablacji komórek rejonu wybrzuszenia mieszka włosowego [66]. Ponadto, poprzez zmianę szlaków sygnalizacji wewnątrzkomórkowej możliwe jest nadanie komórkom macierzystym przedziałów międzymieszkowych cech charakterystycznych dla komórek mieszka włosowego, takich jak zdolność do tworzenia włosów [77]. Jednoznaczne określenie pochodzenia różnych populacji komórek macierzystych naskórka oraz ich udziału w procesach regeneracji wymaga identyfikacji specyficznego markera pozwalającego na wyróżnienie określonej populacji komórek, spośród innych komórek macierzystych skóry. PERSPEKTY ZASTOSOWANIA KOMÓREK MACIERZYSTYCH SKÓRY W KLINICE Gojenie ran, oparzeń i owrzodzeń skóry Identyfikacja komórek macierzystych skóry umożliwia prowadzenie badań nad biologią, właściwościami i zachowaniem tych komórek. Dokładna charakterystyka komórek macierzystych naskórka ma istotne znaczenie w zrozumieniu podłoża wrodzonych oraz nabytych chorób skóry oraz procesów nowotworowych zachodzących w obrębie tej tkanki. Może także posłużyć do opracowania wydajnych metod leczenia schorzeń zaburzających strukturę i funkcję skóry. Kertynocyty i komórki macierzyste naskórka pobrane od pacjenta i hodowane in vitro znajdują zastosowanie w medycynie regeneracyjnej, do uzyskania substytutów skórnych wspomagających gojenie ran, rozległych oparzeń i owrzodzeń [82,83]. Obecnie najpowszechniejszym sposobem leczenia tego rodzaju uszkodzeń jest autologiczny przeszczep skóry pobranej z niezmienionego miejsca. Transplantacja może być jednak przeprowadzona na ograniczonym obszarze i prowadzi do powstania dodatkowych ran w miejscu pobrania tkanki do przeszczepu. Z kolei zastosowanie substytutów wytworzonych in vitro, pozwala na regenerację dużych uszkodzeń z wykorzystaniem komórek uzyskanych z niewielkich fragmentów zdrowej skóry pacjenta [84]. Obecność w hodowli szybko proliferujących komórek macierzystych umożliwia uzyskanie dużej liczby komórek i jednocześnie chroni przed odrzuceniem przeszczepu [85]. Ponadto zastosowanie matryc z włóknika pobudza proliferację keratynocytów, ułatwia przyjęcie przeszczepionych komórek i przyspiesza gojenie rany [86]. Ograniczeniem tej metody jest jednak czas potrzebny do namnożenia keratynocytów in vitro, podczas którego pacjent narażony jest na infekcje, a także wysoki koszt leczenia [84]. Regeneracja narządów i terapia genowa Niezwykle obiecujące wyniki uzyskano podczas badań prowadzonych na komórkach macierzystych mieszków włosowych. Przeprowadzone do tej pory doświadczenia potwierdziły ich duży potencjał do różnicowania. Udowodniono, że komórki pochodzące z regionu wybrzuszenia i z brodawki włosa mają zdolność do różnicowania w neurony i komórki glejowe, dzięki czemu w przyszłości mogą zostać wykorzystane w leczeniu schorzeń układu nerwowego [87,88]. Ponadto, komórki macierzyste mieszków włosowych ulegają różnicowaniu w komórki wykazujące obecność markerów charakterystycznych dla nabłonka wyściełającego drogi moczowe, co sugeruje ich potencjalne wykorzystanie w regeneracji pęcherza moczowego [89-91]. Wydaje się, że komórki mieszków włosowych mogą także posłużyć do rekonstrukcji tkanek budujących oko. Istnieją 224
7 bowiem dowody na udane próby przeróżnicowania komórek macierzystych mieszków włosowych w nabłonek rogówki [92]. Identyfikacja macierzystych komórek hematopoetycznych w obrębie brodawki włosa niesie za sobą możliwość ich zastosowania w leczeniu chorób układu krwiotwórczego [93]. Sugeruje się również wykorzystanie komórek macierzystych regionu wybrzuszenia w terapii łysienia, do odtworzenia utraconych mieszków włosowych [94]. Charakterystyka komórek macierzystych melanocytów rezydujących w obszarze mieszka włosowego może natomiast dostarczyć wskazówek, które pomogą zapobiegać siwieniu włosów [95]. Wyhodowane w warunkach laboratoryjnych i zmodyfikowane komórki macierzyste skóry mogą zostać wykorzystane w terapii genowej jako nośnik prawidłowej informacji genetycznej [4]. Wprowadzenie nowych genów do komórek macierzystych i ich późniejsza transplantacja stanowi atrakcyjną alternatywę w terapii wrodzonych chorób zaburzających strukturę włosów, do których należy dysplazja ektodermalna, włosy paciorkowate (monilethrix), zespół Nethertona, czy zespół Menkesa, a także innych dermatoz m.in. pęcherzowego oddzielania się naskórka [7]. Przeszczepienie genetycznie zmodyfikowanych komórek, nie wykazujących defektów wywołujących objawy chorobowe, umożliwiałyby odtworzenie zdrowej tkanki. Tego typu leczenie zostało z powodzeniem zastosowane u pacjentów chorych na pęcherzowe oddzielanie się naskórka, wywołane mutacją w genie kodującym lamininę 5 [96]. PODSUMOWANIE W warunkach homeostazy komórki macierzyste naskórka rezydujące w przedziałach międzymieszkowych, mieszkach włosowych oraz w obrębie gruczołów łojowych, dają początek unipotencjalnym komórkom progenitorowym uczestniczącym w odnowie tych specyficznych struktur. Uszkodzenie tkanki prowadzi do aktywacji komórek macierzystych i ich różnicowania w kierunku różnych linii, co pozwala na szybką regenerację skóry. Możliwość izolacji i hodowli komórek macierzystych w warunkach in vitro, poza mikrośrodowiskiem niszy, stwarza perspektywy ich szerokiego zastosowania w klinice. Dzięki zdolności komórek macierzystych do odtworzenia swoich multipotencjalnych właściwości po transplantacji sugeruje się ich wykorzystanie w terapii nabytych i wrodzonych schorzeń skóry, medycynie regeneracyjnej oraz w terapii genowej. Charakterystyka i ocena potencjalnego zastosowania komórek macierzystych wymaga jednak określenia specyficznego dla tych komórek markera. Konieczne jest także poznanie wpływu środowiska niszy na aktywność mitotyczną, zdolność do samoodnowy i różnicowania komórek macierzystych, a także możliwość różnicowania komórek macierzystych skóry w komórki innych linii niż keratynocty. PIŚMIENNICTWO 1. Van Keymeulen A, Blanpain C (2012) Tracing epithelial stem cells during development, homeostasis, and repair. J Cell Biol 197: Cotsarelis G, Sun TT, Lavker RM (1990) Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell 61: Tani H, Morris RJ, Kaur P (2000) Enrichment for murine keratinocyte stem cells based on cell surface phenotype. Proc Natl Acad Sci USA 97: Barthel R, Aberdam D (2005) Epidermal stem cells. J Eur Acad Dermatol Venereol 19: Proksch E, Brandner JM, Jensen JM (2008) The skin: an indispensable barrier. Exp Dermatol 17: Baroni A, Buommino E, De Gregorio V, Ruocco E, Ruocco V, Wolf R (2012) Structure and function of the epidermis related to barrier properties. Clin Dermatol 30: Abbas O, Mahalingam M (2009) Epidermal stem cells: practical perspectives and potential uses. Br J Dermatol 61: Moore KA, Lemischka IR (2006) Stem cells and their niches. Science 311: Blanpain C, Fuchs E (2006) Epidermal stem cells of the skin. Annu Rev Cell Dev Biol 22: Watt FM, Jensen KB (2009) Epidermal stem cell diversity and quiescence. EMBO Mol Med 1: Sieber-Blum M, Grim M, Hu YF, Szeder V (2004) Pluripotent neural crest stem cells in the adult hair follicle. Dev Dyn 231: Blanpain C, Fuchs E (2009) Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol 10: Clayton E, Doupé DP, Klein AM, Winton DJ, Simons BD, Jones PH (2007) A single type of progenitor cell maintains normal epidermis. Nature 446: Lechler T, Fuchs E (2005) Asymmetric cell divisions promote stratification and differentiation of mammalian skin. Nature 437: Ray S, Lechler T (2011) Regulation of asymmetric cell division in the epidermis. Cell Div 6: Poulson ND, Lechler T (2012) Asymmetric cell divisions in the epidermis. Int Rev Cell Mol Biol 295: Morris RJ, Potten CS (1999) Highly persistent label-retaining cells in the hair follicles of mice and their fate following induction of anagen. J Invest Dermatol 112: Tumbar T, Guasch G, Greco V, Blanpain C, Lowry WE, Rendl M, Fuchs E (2004) Defining the epithelial stem cell niche in skin. Science 303: Morris RJ, Liu Y, Marles L, Yang Z, Trempus C, Li S, Lin JS, Sawicki JA, Cotsarelis G (2004) Capturing and profiling adult hair follicle stem cells. Nat Biotechnol 22: Barrandon Y, Green H (1987) Three clonal types of keratinocyte with different capacities for multiplication. Proc Natl Acad Sci USA 84: Rochat A, Kobayashi K, Barrandon Y (1994) Location of stem cells of human hair follicles by clonal analysis. Cell 76: Papini S, Cecchetti D, Campani D, Fitzgerald W, Grivel JC, Chen S, Margolis L, Revoltella RP (2003) Isolation and clonal analysis of human epidermal keratinocyte stem cells in long-term culture. Stem Cells 21: Braun KM, Prowse DM (2006) Distinctepidermal stem cell compartments are maintained by independent niche microenvironments. Stem Cell Rev 2: Fuchs E, Nowak JA (2008) Building Epithelial Tissues from Skin Stem Cells. Cold Spring Harb Symp Quant Biol 73: Beck B, Blanpain C (2012) Mechanisms regulating epidermal stem cells. EMBO J 31: Mackenzie IC (1970) Relationship between mitosis and the ordered structure of the stratum corneum in mouse epidermis. Nature 226: Potten CS (1974) The epidermal proliferative unit: the possible role of the central basal cell. Cell Tissue Kinet 7: Kaur P (2006) Interfollicular epidermal stem cells: identification, challenges, potential. J Invest Dermatol 126: Postępy Biochemii 59 (2)
8 29. Clayton E, Doupé DP, Klein AM, Winton DJ, Simons BD, Jones PH (2007) A single type of progenitor cell maintains normal epidermis. Nature 446: Jones PH, Simons BD, Watt FM (2007) Sic transit gloria: farewell to the epidermal transit amplifying cell? Cell Stem Cell 1: Jensen UB, Lowell S, Watt FM (1999) The spatial relationship between stem cells and their progeny in the basal layer of human epidermis: a new view based on whole-mount labelling and lineage analysis. Development 126: Legg J, Jensen UB, Broad S, Leigh I, Watt FM (2003) Role of melanoma chondroitin sulphate proteoglycan in patterning stem cells in human interfollicular epidermis. Development 130: Wan H, Stone MG, Simpson C, Reynolds LE, Marshall JF, Hart IR, Hodivala-Dilke KM, Eady RA (2003) Desmosomal proteins, including desmoglein 3, serve as novel negative markers for epidermal stemcell- -containing population of keratinocytes. J Cell Sci 116: Webb A, Li A, Kaur P (2004) Location and phenotype of human adult keratinocyte stem cells of the skin. Differentiation 72: Jones PH, Watt FM (1993) Separation of human epidermal stem cells from transit amplifying cells on the basis of differences in integrin function and expression. Cell 73: Jones PH, Harper S, Watt FM (1995) Stem cell patterning and fate in human epidermis. Cell 80: Jensen KB, Collins CA, Nascimento E, Tan DW, Frye M, Itami S, Watt FM (2009) Lrig1 expression defines a distinct multipotent stem cell population in mammalian epidermis. Cell Stem Cell 4: Pellegrini G, Dellambra E, Golisano O, Martinelli E, Fantozzi I, Bondanza S, Ponzin D, McKeon F, De Luca M (2001) p63 identifies keratinocyte stem cells. Proc Natl Acad Sci USA 98: Parsa R, Yang A, McKeon F, Green H (1999) Association of p63 with proliferative potential in normal and neoplastic human keratinocytes. J Invest Dermatol 113: Reis-Filho JS, Torio B, Albergaria A, Schmitt FC (2002) p63 expression in normal skin and usual cutaneous carcinomas. J Cutan Pathol 29: Tsujita-Kyutoku M, Kiuchi K, Danbara N, Yuri T, Senzaki H, Tsubura A (2003) p63 expression in normal human epidermis and epidermal appendages and their tumors. J Cutan Pathol 30: Triel C, Vestergaard ME, Bolund L, Jensen TG, Jensen UB (2004) Side population cells in human and mouse epidermis lack stem cell characteristics. Exp Cell Res 295: Tumbar T, Guasch G, Greco V, Blanpain C, Lowry WE, Rendl M, Fuchs E (2004) Defining the epithelial stem cell niche in skin. Science 303: Jaks V, Kasper M, Toftgard R (2010) The hair follicle-a stem cell zoo. Exp Cell Res 316: Huelsken J, Vogel R, Erdmann B, Gotsarelis G, Birchmeier W (2001) Beta-catenin controls hair follicle morphogenesis and stem cell differentiation in skin. Cell 105: Myung P, Andl T, Ito M (2009) Defining the hair follicle stem cell (Part I). J Cutan Pathol 36: Oh JH, Mohebi P, Farkas DL, Tajbakhsh J (2011) Towards expansion of human hair follicle stem cells in vitro. Cell Prolif 44: Wosicka H, Cal K (2010) Targeting to the hair follicles: Current status and potential. J Dermatol Sci 57: Schneider MR, Schmidt-Ullrich R, Paus R (2009) The hair follicle as a dynamic mini organ. Curr Biol 19: Taylor G, Lehrer MS, Jensen PJ, Sun TT, Lavker RM (2000) Involvement of follicular stem cells in forming not only the follicle but also the epidermis. Cell 102: Zhou J, Jia L, Yang Y, Peng S, Cao Y, Duan E (2004) Enrichment and characterization of mouse putative epidermal stem cells. Cell Biol Int 28: Klima J, Smetana K, Motlik J, Plzakova Z, Liu FT, Stork J, Kaltner H, Chovanec M, Dvorankova B, Andre S, Gabius HJ (2005) Comparative phenotypic characterization of keratinocytes originating from hair follicles. J Mol Histol 36: Richardson GD, Arnott EC, Whitehouse CJ, Lawrence CM, Reynolds AJ, Hole N, Jahoda CA (2005) Plasticity of rodent and human hair follicle dermal cells: implications for cell therapy and tissue engineering. J Investig Dermatol Symp Proc. 10: Mignone JL, Roig-Lopez JL, Fedtsova N, Schones DE, Manganas LN, Maletic-Savatic M, Keyes WM, Mills AA, Gleiberman A, Zhang MQ, Enikolopov G (2007) Neural potential of a stem cell population in the hair follicle. Cell Cycle 6: Tiede S, Kloepper JE, Bodo E, Tiwari S, Kruse C, Paus R (2007) Hair follicle stem cells: walking the maze. Eur J Cell Biol 86: Kloepper JE, Tiede S, Brinckmann J, Reinhardt DP, Meyer W, Faessler R, Paus R (2008) Immunophenotyping of the human bulge region: the quest to define useful in situ markers for human epithelial hair follicle stem cells and their niche. Exp Dermatol 17: Kobayashi T, Shimizu A, Nishifuji K, Amagai M, Iwasaki T, Ohyama M (2009) Canine hair follicle keratinocytes enriched with bulge cells have the highly proliferative characteristics of stem cells. Veterinary Deramtology 20: Trempus CS, Morris RJ, Bortner CD, Cotsarelis G, Faircloth RS, Reece JM, Tennant RW (2003) Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. J Invest Dermatol 120: Blanpain C, Lowry WE, Geoghegan A, Polak L, Fuchs E (2004) Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell 118: Jensen UB, Yan X, Triel C, Woo SH, Christensen R, Owens DM (2008) A distinct population of clonogenic and multipotent murine follicular keratinocytes residing in the upper isthmus. J Cell Sci 121: Yu H, Fang D, Kumar SM, Li L, Nguyen TK, Acs G, Herlyn M, Xu X (2006) Isolation of a novel population of multipotent adult stem cells from human hair follicles. Am J Pathol 168: Huang E, Lian X, Yang T, Chen W, Yang L, Yang T (2009) Characterization of rat hair follicle stem cells selected by vario magnetic activated cell sorting system. Acta Histochem Cytochem 42: Inoue K, Aoi N, Sato T, Yamauchi Y, Suga H, Eto H, Kato H, Araki J, Yoshimura K (2009) Differential expression of stem-cell-associated markers in human hair follicle epithelial cells. Lab Invest 89: Ohyama M (2007) Advances in the study of stem-cell-enriched hair follicle bulge cells: a review featuring characterization and isolation of human bulge cells. Dermatology 214: Morris R, Liu Y, Marles L, Yang Z, Trempus C, Cotsarelis G (2004) Capturing and profiling adult hair follicle stem cells. Nat Biotechnol 22: Ito M, Liu Y, Yang Z, Nguyen J, Liang F, Morris RJ, Cotsarelis G (2005) Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med 11: Jahoda CA, Reynolds AJ (2001) Hair follicle dermal sheath cells: unsung participants in wound healing. Lancet 358: Miyashita H, Hakamata Y, Kobayashi E, Kobayashi K (2004) Characterization of hair follicles induced in implanted, cultured rat keratinocyte sheets. Exp Dermatol 13: Ghazizadeh S, Taichman LB (2001) Multiple classes of stem cells in cutaneous epithelium: a lineage analysis of adult mouse skin. EMBO J 20: Lo Celso C, Berta MA, Braun KM, Frye M, Lyle S, Zouboulis CC, Watt FM (2008) Characterization of bipotential epidermal progenitors derived from human sebaceous gland: contrasting roles of c-myc and beta-catenin. Stem Cells 26: Horsley V, O Carroll D, Tooze R, Ohinata Y, Saitou M, Obukhanych T, Nussenzweig M, Tarakhovsky A, Fuchs E (2006) Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland. Cell 126: Magnúsdóttir E, Kalachikov S, Mizukoshi K, Savitsky D, Ishida-Yamamoto A, Panteleyev AA, Calame K. (2007) Epidermal terminal diffe
9 rentiation depends on B lymphocyte-induced maturation protein-1. Proc Natl Acad Sci USA 104: Arnold I, Watt FM (2001) c-myc activation in transgenic mouse epidermis results in mobilization of stem cells and differentiation of their progeny. Curr Biol 11: Waikel RL, Kawachi Y, Waikel PA, Wang XJ, Roop DR (2001) Deregulated expression of c-myc depletes epidermal stem cells. Nat Genet 28: Bieniek R, Lazar AJ, Photopoulos C, Lyle S (2007) Sebaceous tumours contain a subpopulation of cells expressing the keratin 15 stem cell marker. Br J Dermatol 156: Blanpain C, Horsley V, Fuchs E (2007) Epithelial stem cells: turning over new leaves. Cell 128: Silva-Vargas V, Lo Celso C, Giangreco A, Ofstad T, Prowse DM, Braun KM, Watt FM (2005) Beta-catenin and Hedgehog signal strength can specify number and location of hair follicles in adult epidermis without recruitment of bulge stem cells. Dev Cell 9: Green H (1991) Cultured cells for the treatment of disease. Sci Am 265: Alonso L, Fuchs E (2003) Stem cells of the skin epithelium. Proc Natl Acad Sci USA 100 (Suppl 1): Alonso L, Fuchs E (2003) Stem cells in the skin: waste not, Wnt not. Genes Dev 17: Levy V, Lindon C, Harfe BD, Morgan BA (2005) Distinct stem cell populations regenerate the follicle and interfollicular epidermis. Dev Cell 9: Wood FM, Kolybaba ML, Allen P (2006) The use of cultured epithelial autograft in the treatment of major burn injuries: a critical review of the literature. Burns 32: Atiyeh BS, Costagliola M (2007) Cultured epithelial autograft (CEA) in burn treatment: three decades later. Burns 33: Lapouge G, Blanpain C (2008) Medical applications of epidermal stem cells. W: StemBook, Cambridge (MA): Harvard Stem Cell Institute; dostępne online: Pouliot N, Redvers RP, Ellis S, Saunders NA, Kaur P (2005) Optimization of a transplant model to assess skin reconstitution from stem cell-enriched primary human keratinocyte populations. Exp Dermatol 14: Ronfard V, Rives JM, Neveux Y, Carsin H, Barrandon Y (2000) Long- -term regeneration of human epidermis on third degree burns transplanted with autologous cultured epithelium grown on a fibrin matrix. Transplantation 70: Amoh Y, Li L, Campillo R, Kawahara K, Katsuoka K, Penman S, Hoffman R (2005) Implanted hair follicle stem cells form Schwann cells that support repair of severed peripheral nerves. Proc Natl Acad Sci USA 102: Hunt DP, Morris PN, Sterling J, Anderson JA, Joannides A, Jahoda C, Compston A, Chandran S (2008) A highly enriched niche of precursor cellswith neuronal and glialpotential within the hair follicle dermal papillaof adult skin. Stem Cells 26: Bajek A, Drewa T, Joachimiak R, Marszałek A, Gagat M, Grzanka A (2012) Stem cells for urinary tract regeneration. Central European Journal of Urology doi: /ceju art2 90. Drewa T, Joachimiak R, Bajek A, Gagat M, Grzanka A, Bodnar M, Marszalek A, Dębski R, Chłosta P (2012) Hair follicle stem cells can be driven into a urothelial-like phenotype: An experimental study. Int J Urol doi: /j x. 91. Drewa T, Adamowicz J, Sharma A (2012) Tissue engineering for the oncologic urinary bladder. Nat Rev Urol 9: Błażejewska EA, Schlӧtzer-Schrehardt U, Zenkel M, Bachmann B, Chankiewitz E, Jacobi C, Kruse FE (2009) Corneal limbal microenvironment can induce transdifferentiation of hair follicle stem cells into corneal epithelial-like cells. Stem Cells 27: Shi C, Mai Y, Cheng T (2004) Identification of hematopoietic cell populations from the dermal papillae of human hair follicles. Transplant Proc 36: Cotsarelis G (2006) Epithelial stem cells: a folliculocentric view. J Invest Dermatol 126: Nishimura EK, Granter SR, Fisher DE (2004) Mechanisms of hair graying: incomplete melanocyte stem cell maintenance in the niche. Science 307: Mavilio F, Pellegrini G, Ferrari S, Di Nunzio F, Di Iorio E, Recchia A, Maruggi G, Ferrari G, Provasi E, Bonini C, Capurro S, Conti A, Magnoni C, Giannetti A, De Luca M (2006) Correction of junctional epidermolysis bullosa by transplantation of genetically modified epidermal stem cells. Nat Med 12: Epidermal stem cells biology and potential applications in regenerative medicine Małgorzata Uzarska 1*, Dorota Porowińska 1, Anna Bajek 1, Tomasz Drewa 1,2 1 Department of Tissue Engineering, Nicolaus Copernicus University in Torun, Ludwik Rydygier Medical College in Bydgoszcz, 24 Karłowicza St., Bydgoszcz, Poland 2 Urology Department, Nicolaus Copernicus Hospital, Batory St., Torun, Poland * m.uzarska@wp.pl Key words: epithelial stem cells, skin, hair follicle, sebaceous gland ABSTRACT Stem cells are involved in the renewal and regeneration of the epithelium of various organs. The largest reservoir of epithelial stem cells in the human body is the skin. This organ is a specialized interior barrier protecting the body from the influence of physical, chemical and biological factors, ensuring at the same time the reception of signals from the external environment. Skin is also involved in numerous physiological processes which determine the homeostasis of the body. Renewal and regeneration of the epidermis which is the outer layer of the skin, is possible by the presence of different populations of stem cells that reside in microenvironments (niches), that creates specific conditions to preserve the biological properties of these cells. Because divisions of cells in niches are quite rare, it became possible to distinguish them from other rapidly proliferating cells of the skin. On this basis, the stem cells in the interfollicular epidermis, bulge region of the hair follicles, and within the sebaceous glands were located. Moreover hair follicles are suggested to be a niche for melanocyte progenitor cells and other multipotent stem cells derived from the neural crest, as well as mesenchymal stem cells. The presence of stem cells that are characterized by high proliferative potential and the ability to self-renew allow maintaing homeostasis and regeneration of epidermis. Identification, isolation and characterization of epithelial stem cells is necessary to understand skin diseases background, develop effective methods for their treatment and for wider use of stem cells in regenerative medicine, gene therapy or cosmetology. Postępy Biochemii 59 (2)
Mieszki włosowe nowym źródłem komórek macierzystych Hair follicle as a novel source of stem cells
 Postepy Hig Med Dosw (online), 2012; 66: 181-186 e-issn 1732-2693 www.phmd.pl Review Received: 2011.11.28 Accepted: 2012.03.06 Published: 2012.04.16 Mieszki włosowe nowym źródłem komórek macierzystych
Postepy Hig Med Dosw (online), 2012; 66: 181-186 e-issn 1732-2693 www.phmd.pl Review Received: 2011.11.28 Accepted: 2012.03.06 Published: 2012.04.16 Mieszki włosowe nowym źródłem komórek macierzystych
KOŁO NAUKOWE IMMUNOLOGII. Mikrochimeryzm badania w hodowlach leukocytów in vitro
 KOŁO NAUKOWE IMMUNOLOGII Mikrochimeryzm badania w hodowlach leukocytów in vitro Koło Naukowe Immunolgii kolo_immunologii@biol.uw.edu.pl kolo_immunologii.kn@uw.edu.pl CEL I PRZEDMIOT PROJEKTU Celem doświadczenia
KOŁO NAUKOWE IMMUNOLOGII Mikrochimeryzm badania w hodowlach leukocytów in vitro Koło Naukowe Immunolgii kolo_immunologii@biol.uw.edu.pl kolo_immunologii.kn@uw.edu.pl CEL I PRZEDMIOT PROJEKTU Celem doświadczenia
Onkogeneza i zjawisko przejścia nabłonkowomezenchymalnego. Gabriel Wcisło Klinika Onkologii Wojskowego Instytutu Medycznego, CSK MON, Warszawa
 Onkogeneza i zjawisko przejścia nabłonkowomezenchymalnego raka jajnika Gabriel Wcisło Klinika Onkologii Wojskowego Instytutu Medycznego, CSK MON, Warszawa Sześć diabelskich mocy a komórka rakowa (Gibbs
Onkogeneza i zjawisko przejścia nabłonkowomezenchymalnego raka jajnika Gabriel Wcisło Klinika Onkologii Wojskowego Instytutu Medycznego, CSK MON, Warszawa Sześć diabelskich mocy a komórka rakowa (Gibbs
Good Clinical Practice
 Good Clinical Practice Stowarzyszenie na Rzecz Dobrej Praktyki Badań Klinicznych w Polsce (Association for Good Clinical Practice in Poland) http://www.gcppl.org.pl/ Lecznicze produkty zaawansowanej terapii
Good Clinical Practice Stowarzyszenie na Rzecz Dobrej Praktyki Badań Klinicznych w Polsce (Association for Good Clinical Practice in Poland) http://www.gcppl.org.pl/ Lecznicze produkty zaawansowanej terapii
[2ZPK/KII] Inżynieria genetyczna w kosmetologii
![[2ZPK/KII] Inżynieria genetyczna w kosmetologii [2ZPK/KII] Inżynieria genetyczna w kosmetologii](/thumbs/98/136385472.jpg) [2ZPK/KII] Inżynieria genetyczna w kosmetologii 1. Ogólne informacje o module Nazwa modułu Kod modułu Nazwa jednostki prowadzącej modułu Nazwa kierunku studiów Forma studiów Profil kształcenia Semestr
[2ZPK/KII] Inżynieria genetyczna w kosmetologii 1. Ogólne informacje o module Nazwa modułu Kod modułu Nazwa jednostki prowadzącej modułu Nazwa kierunku studiów Forma studiów Profil kształcenia Semestr
Streszczenie Przedstawiona praca doktorska dotyczy mobilizacji komórek macierzystych do uszkodzonej tkanki mięśniowej. Opisane w niej badania
 Streszczenie Przedstawiona praca doktorska dotyczy mobilizacji komórek macierzystych do uszkodzonej tkanki mięśniowej. Opisane w niej badania koncentrowały się na opracowaniu metod prowadzących do zwiększenia
Streszczenie Przedstawiona praca doktorska dotyczy mobilizacji komórek macierzystych do uszkodzonej tkanki mięśniowej. Opisane w niej badania koncentrowały się na opracowaniu metod prowadzących do zwiększenia
Indukowane pluripotencjalne komórki macierzyste
 Indukowane pluripotencjalne komórki macierzyste Nagroda Nogla w dziedzinie medycyny i fizjologii z roku 2012 dla Brytyjczyka John B.Gurdon oraz Japooczyka Shinya Yamanaka Wykonały: Katarzyna Białek Katarzyna
Indukowane pluripotencjalne komórki macierzyste Nagroda Nogla w dziedzinie medycyny i fizjologii z roku 2012 dla Brytyjczyka John B.Gurdon oraz Japooczyka Shinya Yamanaka Wykonały: Katarzyna Białek Katarzyna
Biologiczne podstawy radioterapii Wykład 4 podstawy radioterapii
 Biologiczne podstawy radioterapii Wykład 4 podstawy radioterapii czyli dlaczego komórki nowotworowe są bardziej wrażliwe na działanie promieniowania jonizującego od komórek prawidłowych? A tumor is a conglomerate
Biologiczne podstawy radioterapii Wykład 4 podstawy radioterapii czyli dlaczego komórki nowotworowe są bardziej wrażliwe na działanie promieniowania jonizującego od komórek prawidłowych? A tumor is a conglomerate
AUTOREFERAT ROZPRAWY DOKTORSKIEJ. The role of Sdf-1 in the migration and differentiation of stem cells during skeletal muscle regeneration
 mgr Kamil Kowalski Zakład Cytologii Wydział Biologii UW AUTOREFERAT ROZPRAWY DOKTORSKIEJ The role of Sdf-1 in the migration and differentiation of stem cells during skeletal muscle regeneration Wpływ chemokiny
mgr Kamil Kowalski Zakład Cytologii Wydział Biologii UW AUTOREFERAT ROZPRAWY DOKTORSKIEJ The role of Sdf-1 in the migration and differentiation of stem cells during skeletal muscle regeneration Wpływ chemokiny
Promotor: prof. dr hab. Katarzyna Bogunia-Kubik Promotor pomocniczy: dr inż. Agnieszka Chrobak
 INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ IM. LUDWIKA HIRSZFELDA WE WROCŁAWIU POLSKA AKADEMIA NAUK mgr Milena Iwaszko Rola polimorfizmu receptorów z rodziny CD94/NKG2 oraz cząsteczki HLA-E w patogenezie
INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ IM. LUDWIKA HIRSZFELDA WE WROCŁAWIU POLSKA AKADEMIA NAUK mgr Milena Iwaszko Rola polimorfizmu receptorów z rodziny CD94/NKG2 oraz cząsteczki HLA-E w patogenezie
Multimedial Unit of Dept. of Anatomy JU
 Multimedial Unit of Dept. of Anatomy JU Ośrodkowy układ nerwowy zaczyna się rozwijać na początku 3. tygodnia w postaci płytki nerwowej, położonej w pośrodkowo-grzbietowej okolicy, ku przodowi od węzła
Multimedial Unit of Dept. of Anatomy JU Ośrodkowy układ nerwowy zaczyna się rozwijać na początku 3. tygodnia w postaci płytki nerwowej, położonej w pośrodkowo-grzbietowej okolicy, ku przodowi od węzła
Organizacja tkanek - narządy
 Organizacja tkanek - narządy Architektura skóry tkanki kręgowców zbiór wielu typów komórek danej tkanki i spoza tej tkanki (wnikają podczas rozwoju lub stale, w trakcie Ŝycia ) neurony komórki glejowe,
Organizacja tkanek - narządy Architektura skóry tkanki kręgowców zbiór wielu typów komórek danej tkanki i spoza tej tkanki (wnikają podczas rozwoju lub stale, w trakcie Ŝycia ) neurony komórki glejowe,
1600-Le5MREG-J Kod ERASMUS 12.00
 Załącznik do zarządzenia nr 166 Rektora UMK z dnia 21 grudnia 2015 r. Formularz opisu (formularz sylabusa) na studiach wyższych, doktoranckich, podyplomowych i kursach dokształcających A. Ogólny opis Nazwa
Załącznik do zarządzenia nr 166 Rektora UMK z dnia 21 grudnia 2015 r. Formularz opisu (formularz sylabusa) na studiach wyższych, doktoranckich, podyplomowych i kursach dokształcających A. Ogólny opis Nazwa
Regulacja wzrostu i różnicowania komórek poprzez oddziaływanie komórek z macierzą zewnątrzkomórkową
 PLAN WYKŁADÓW Regulacja wzrostu i różnicowania komórek poprzez oddziaływanie komórek z macierzą zewnątrzkomórkową Kontrola rozwoju tkanki in vitro Biomateriały i nośniki w medycynie odtwórczej - oddziaływanie
PLAN WYKŁADÓW Regulacja wzrostu i różnicowania komórek poprzez oddziaływanie komórek z macierzą zewnątrzkomórkową Kontrola rozwoju tkanki in vitro Biomateriały i nośniki w medycynie odtwórczej - oddziaływanie
dr hab. prof. AWF Agnieszka Zembroń-Łacny DOPING GENOWY 3 CIEMNA STRONA TERAPII GENOWEJ
 dr hab. prof. AWF Agnieszka Zembroń-Łacny DOPING GENOWY 3 CIEMNA STRONA TERAPII GENOWEJ KOMÓRKI SATELITARNE (ang. stem cells) potencjał regeneracyjny mięśni HIPERTROFIA MIĘŚNI University College London,
dr hab. prof. AWF Agnieszka Zembroń-Łacny DOPING GENOWY 3 CIEMNA STRONA TERAPII GENOWEJ KOMÓRKI SATELITARNE (ang. stem cells) potencjał regeneracyjny mięśni HIPERTROFIA MIĘŚNI University College London,
BIOLOGIA KOMÓRKI WYKORZYSTANIE HODOWANYCH IN VITRO KOMÓREK SKÓRY LUDZKIEJ W TRANSPLANTOLOGII MECHANIZM GOJENIA RAN
 BIOLOGIA KOMÓRKI WYKORZYSTANIE HODOWANYCH IN VITRO KOMÓREK SKÓRY LUDZKIEJ W TRANSPLANTOLOGII MECHANIZM GOJENIA RAN Skóra stanowi barierę ochronną organizmu. Utrata jej integralności na skutek uszkodzenia
BIOLOGIA KOMÓRKI WYKORZYSTANIE HODOWANYCH IN VITRO KOMÓREK SKÓRY LUDZKIEJ W TRANSPLANTOLOGII MECHANIZM GOJENIA RAN Skóra stanowi barierę ochronną organizmu. Utrata jej integralności na skutek uszkodzenia
Biologia komórek macierzystych naskórka oraz ich znaczenie w medycynie* Biology of epidermal stem cells: Impact on medicine
 Postepy Hig Med Dosw. (online), 2009; 63: 449-456 e-issn 1732-2693 www.phmd.pl Review Received: 2009.08.27 Accepted: 2009.09.28 Published: 2009.10.15 Biologia komórek macierzystych naskórka oraz ich znaczenie
Postepy Hig Med Dosw. (online), 2009; 63: 449-456 e-issn 1732-2693 www.phmd.pl Review Received: 2009.08.27 Accepted: 2009.09.28 Published: 2009.10.15 Biologia komórek macierzystych naskórka oraz ich znaczenie
Badanie predyspozycji do łysienia androgenowego u kobiet (AGA)
 Badanie predyspozycji do łysienia androgenowego u kobiet (AGA) RAPORT GENETYCZNY Wyniki testu dla Pacjent Testowy Pacjent Pacjent Testowy ID pacjenta 0999900004112 Imię i nazwisko pacjenta Pacjent Testowy
Badanie predyspozycji do łysienia androgenowego u kobiet (AGA) RAPORT GENETYCZNY Wyniki testu dla Pacjent Testowy Pacjent Pacjent Testowy ID pacjenta 0999900004112 Imię i nazwisko pacjenta Pacjent Testowy
Analysis of infectious complications inf children with acute lymphoblastic leukemia treated in Voivodship Children's Hospital in Olsztyn
 Analiza powikłań infekcyjnych u dzieci z ostrą białaczką limfoblastyczną leczonych w Wojewódzkim Specjalistycznym Szpitalu Dziecięcym w Olsztynie Analysis of infectious complications inf children with
Analiza powikłań infekcyjnych u dzieci z ostrą białaczką limfoblastyczną leczonych w Wojewódzkim Specjalistycznym Szpitalu Dziecięcym w Olsztynie Analysis of infectious complications inf children with
Badanie podatności na łysienie androgenowe u mężczyzn
 Badanie podatności na łysienie androgenowe u mężczyzn RAPORT GENETYCZNY Wyniki testu dla Pacjent Testowy Pacjent Pacjent Testowy ID pacjenta 0999900004136 Imię i nazwisko pacjenta Pacjent testowy Rok urodzenia
Badanie podatności na łysienie androgenowe u mężczyzn RAPORT GENETYCZNY Wyniki testu dla Pacjent Testowy Pacjent Pacjent Testowy ID pacjenta 0999900004136 Imię i nazwisko pacjenta Pacjent testowy Rok urodzenia
CHOROBY NOWOTWOROWE. Twór składający się z patologicznych komórek
 CHOROBY NOWOTWOROWE Twór składający się z patologicznych komórek Powstały w wyniku wielostopniowej przemiany zwanej onkogenezą lub karcinogenezą Morfologicznie ma strukturę zbliżoną do tkanki prawidłowej,
CHOROBY NOWOTWOROWE Twór składający się z patologicznych komórek Powstały w wyniku wielostopniowej przemiany zwanej onkogenezą lub karcinogenezą Morfologicznie ma strukturę zbliżoną do tkanki prawidłowej,
Izolacja komórek szpiku kostnego w celu identyfikacji wybranych populacji komórek macierzystych technikami cytometrycznymi
 Izolacja komórek szpiku kostnego w celu identyfikacji wybranych populacji komórek macierzystych technikami cytometrycznymi PRAKTIKUM Z BIOLOGII KOMÓRKI DLA BIOLOGÓW (BT 216) TEMAT ĆWICZENIA: "Izolacja
Izolacja komórek szpiku kostnego w celu identyfikacji wybranych populacji komórek macierzystych technikami cytometrycznymi PRAKTIKUM Z BIOLOGII KOMÓRKI DLA BIOLOGÓW (BT 216) TEMAT ĆWICZENIA: "Izolacja
Komórki macierzyste Część I wprowadzenie
 3 Komórki macierzyste Część I wprowadzenie Karolina Archacka Streszczenie: Komórki macierzyste mają wyjątkowe właściwości wśród wszystkich komórek organizmu: są zdolne zarówno do samoodnawiania własnej
3 Komórki macierzyste Część I wprowadzenie Karolina Archacka Streszczenie: Komórki macierzyste mają wyjątkowe właściwości wśród wszystkich komórek organizmu: są zdolne zarówno do samoodnawiania własnej
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 197092 (96) Data i numer zgłoszenia patentu europejskiego: 22.11.06 06824279.1 (13) (1) T3 Int.Cl. A61K 3/36 (06.01) A61P
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 197092 (96) Data i numer zgłoszenia patentu europejskiego: 22.11.06 06824279.1 (13) (1) T3 Int.Cl. A61K 3/36 (06.01) A61P
Formularz opisu przedmiotu (formularz sylabusa) na studiach wyższych, doktoranckich, podyplomowych i kursach dokształcających
 Załącznik do zarządzenia nr 110 Rektora UMK z dnia 17 lipca 2013 r. Formularz opisu przedmiotu (formularz sylabusa) na studiach wyższych, doktoranckich, podyplomowych i kursach dokształcających A. Ogólny
Załącznik do zarządzenia nr 110 Rektora UMK z dnia 17 lipca 2013 r. Formularz opisu przedmiotu (formularz sylabusa) na studiach wyższych, doktoranckich, podyplomowych i kursach dokształcających A. Ogólny
Katarzyna Pawlak-Buś
 Katarzyna Pawlak-Buś Klinika Rumatologii i Rehabilitacji Uniwersytetu Medycznego Oddział Reumatologii i Osteoporozy Szpitala im. Józefa Strusia w Poznaniu Canalis at al., N. Engl. J. Med. 2007 Równowaga
Katarzyna Pawlak-Buś Klinika Rumatologii i Rehabilitacji Uniwersytetu Medycznego Oddział Reumatologii i Osteoporozy Szpitala im. Józefa Strusia w Poznaniu Canalis at al., N. Engl. J. Med. 2007 Równowaga
Osocze bogatopłytkowe w ginekologii estetycznej
 Osocze bogatopłytkowe w ginekologii estetycznej Michał Barwijuk 1. Centralny Szpital Kliniczny MSW, Warszawa Klinika Położnictwa, Chorób Kobiecych i Ginekologii Onkologicznej 2. NZOZ Medifem, Warszawa
Osocze bogatopłytkowe w ginekologii estetycznej Michał Barwijuk 1. Centralny Szpital Kliniczny MSW, Warszawa Klinika Położnictwa, Chorób Kobiecych i Ginekologii Onkologicznej 2. NZOZ Medifem, Warszawa
Komórki macierzyste skóry. Wykorzystanie roślinnych komórek macierzystych w kosmetologii. Komórki macierzyste
 Komórki macierzyste skóry Wykorzystanie roślinnych komórek macierzystych w kosmetologii Komórki macierzyste Mitoza Różnicowanie REGENERACJA 1 Komórki macierzyste vs. komórki progenitorowe Komórki progenitorowe:
Komórki macierzyste skóry Wykorzystanie roślinnych komórek macierzystych w kosmetologii Komórki macierzyste Mitoza Różnicowanie REGENERACJA 1 Komórki macierzyste vs. komórki progenitorowe Komórki progenitorowe:
Czy jesteśmy gotowi na stworzenie naturalnego pęcherza? Tomasz Drewa
 Czy jesteśmy gotowi na stworzenie naturalnego pęcherza? Tomasz Drewa Kierownik Oddziału Urologii Ogólnej i Onkologicznej Szpital im. Mikołaja Kopernika w Toruniu Kierownik Katedry Medycyny Regeneracyjnej
Czy jesteśmy gotowi na stworzenie naturalnego pęcherza? Tomasz Drewa Kierownik Oddziału Urologii Ogólnej i Onkologicznej Szpital im. Mikołaja Kopernika w Toruniu Kierownik Katedry Medycyny Regeneracyjnej
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej
 Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Beata Talar Molekularne mechanizmy działania pentoksyfiliny w komórkach czerniaka Promotor: prof. dr hab. Małgorzata Czyż
 Beata Talar Molekularne mechanizmy działania pentoksyfiliny w komórkach czerniaka Promotor: prof. dr hab. Małgorzata Czyż Rozprawa doktorska przygotowana w Zakładzie Biologii Molekularnej Nowotworów Katedry
Beata Talar Molekularne mechanizmy działania pentoksyfiliny w komórkach czerniaka Promotor: prof. dr hab. Małgorzata Czyż Rozprawa doktorska przygotowana w Zakładzie Biologii Molekularnej Nowotworów Katedry
I nforma cje ogólne. Specjalność - jednolite magisterskie * Poziom studiów. I stopnia II stopnia X. Rok 2; semestr I. - zaliczenie
 Załącznik Nr do Uchwały Nr S YL AB US MODUŁ U ( B ad ania genety czn e wyk o rzystywan e w k osmetol ogii ) I nforma cje ogólne Nazwa modułu Rodzaj modułu/przedmiotu Wydział PUM Kierunek studiów Obowiązkowy
Załącznik Nr do Uchwały Nr S YL AB US MODUŁ U ( B ad ania genety czn e wyk o rzystywan e w k osmetol ogii ) I nforma cje ogólne Nazwa modułu Rodzaj modułu/przedmiotu Wydział PUM Kierunek studiów Obowiązkowy
Making the impossible possible: the metamorphosis of Polish Biology Olympiad
 Making the impossible possible: the metamorphosis of Polish Biology Olympiad Takao Ishikawa Faculty of Biology, University of Warsaw, Poland Performance of Polish students at IBO Gold Silver Bronze Merit
Making the impossible possible: the metamorphosis of Polish Biology Olympiad Takao Ishikawa Faculty of Biology, University of Warsaw, Poland Performance of Polish students at IBO Gold Silver Bronze Merit
INICJACJA ELONGACJA TERMINACJA
 INICJACJA ELONGACJA TERMINACJA 2007 by National Academy of Sciences Kornberg R D PNAS 2007;104:12955-12961 Struktura chromatyny pozwala na różny sposób odczytania informacji zawartej w DNA. Możliwe staje
INICJACJA ELONGACJA TERMINACJA 2007 by National Academy of Sciences Kornberg R D PNAS 2007;104:12955-12961 Struktura chromatyny pozwala na różny sposób odczytania informacji zawartej w DNA. Możliwe staje
Immunologia komórkowa
 Immunologia komórkowa ocena immunofenotypu komórek Mariusz Kaczmarek Immunofenotyp Definicja I Charakterystyczny zbiór antygenów stanowiących elementy różnych struktur komórki, związany z jej różnicowaniem,
Immunologia komórkowa ocena immunofenotypu komórek Mariusz Kaczmarek Immunofenotyp Definicja I Charakterystyczny zbiór antygenów stanowiących elementy różnych struktur komórki, związany z jej różnicowaniem,
Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych
 Karolina Klara Radomska Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych Streszczenie Wstęp Ostre białaczki szpikowe (Acute Myeloid Leukemia, AML) to grupa nowotworów mieloidalnych,
Karolina Klara Radomska Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych Streszczenie Wstęp Ostre białaczki szpikowe (Acute Myeloid Leukemia, AML) to grupa nowotworów mieloidalnych,
The Maternal Nucleolus Is Essential for Early Embryonic Development in Mammals
 The Maternal Nucleolus Is Essential for Early Embryonic Development in Mammals autorstwa Sugako Ogushi Science vol 319, luty 2008 Prezentacja Kamil Kowalski Jąderko pochodzenia matczynego jest konieczne
The Maternal Nucleolus Is Essential for Early Embryonic Development in Mammals autorstwa Sugako Ogushi Science vol 319, luty 2008 Prezentacja Kamil Kowalski Jąderko pochodzenia matczynego jest konieczne
Krytyczne czynniki sukcesu w zarządzaniu projektami
 Seweryn SPAŁEK Krytyczne czynniki sukcesu w zarządzaniu projektami MONOGRAFIA Wydawnictwo Politechniki Śląskiej Gliwice 2004 SPIS TREŚCI WPROWADZENIE 5 1. ZARZĄDZANIE PROJEKTAMI W ORGANIZACJI 13 1.1. Zarządzanie
Seweryn SPAŁEK Krytyczne czynniki sukcesu w zarządzaniu projektami MONOGRAFIA Wydawnictwo Politechniki Śląskiej Gliwice 2004 SPIS TREŚCI WPROWADZENIE 5 1. ZARZĄDZANIE PROJEKTAMI W ORGANIZACJI 13 1.1. Zarządzanie
Krwiotworzenie (Hematopoeza)
 Krwiotworzenie (Hematopoeza) Zgadnienia Rozwój układu krwiotwórczego Szpik kostny jako główny narząd krwiotwórczy Metody badania szpiku Krwiotwórcze komórki macierzyste (KKM) Regulacja krwiotworzenia Przeszczepianie
Krwiotworzenie (Hematopoeza) Zgadnienia Rozwój układu krwiotwórczego Szpik kostny jako główny narząd krwiotwórczy Metody badania szpiku Krwiotwórcze komórki macierzyste (KKM) Regulacja krwiotworzenia Przeszczepianie
Projektowanie Procesów Biotechnologicznych
 Projektowanie Procesów Biotechnologicznych wykład 15 styczeń 2014 Modelowanie przyrostu biomasy 1 Wzrost mikroorganizmów Modele wzrostu - teoria i praktyka W teorii można użyć kinetykę i dynamikę reakcji
Projektowanie Procesów Biotechnologicznych wykład 15 styczeń 2014 Modelowanie przyrostu biomasy 1 Wzrost mikroorganizmów Modele wzrostu - teoria i praktyka W teorii można użyć kinetykę i dynamikę reakcji
Profilaktyka i leczenie czerniaka. Dr n. med. Jacek Calik
 Profilaktyka i leczenie czerniaka Dr n. med. Jacek Calik Czerniaki Czerniaki są grupą nowotworów o bardzo zróżnicowanej biologii, przebiegu i rokowaniu. Nowotwory wywodzące się z melanocytów. Pochodzenie
Profilaktyka i leczenie czerniaka Dr n. med. Jacek Calik Czerniaki Czerniaki są grupą nowotworów o bardzo zróżnicowanej biologii, przebiegu i rokowaniu. Nowotwory wywodzące się z melanocytów. Pochodzenie
ROZPRAWA NA STOPIEŃ DOKTORA NAUK MEDYCZNYCH (obroniona z wyróżnieniem )
 Publikacje naukowe: ROZPRAWA NA STOPIEŃ DOKTORA NAUK MEDYCZNYCH (obroniona z wyróżnieniem 7.03.2013) Stosowanie larw Lucilia sericata jako metoda leczenia przewlekłych ran kończyn. Inne publikacje: 1.
Publikacje naukowe: ROZPRAWA NA STOPIEŃ DOKTORA NAUK MEDYCZNYCH (obroniona z wyróżnieniem 7.03.2013) Stosowanie larw Lucilia sericata jako metoda leczenia przewlekłych ran kończyn. Inne publikacje: 1.
Pro-tumoral immune cell alterations in wild type and Shbdeficient mice in response to 4T1 breast carcinomas
 www.oncotarget.com Oncotarget, Supplementary Materials Pro-tumoral immune cell alterations in wild type and Shbdeficient mice in response to 4T1 breast carcinomas SUPPLEMENTARY MATERIALS Supplementary
www.oncotarget.com Oncotarget, Supplementary Materials Pro-tumoral immune cell alterations in wild type and Shbdeficient mice in response to 4T1 breast carcinomas SUPPLEMENTARY MATERIALS Supplementary
Analiza ekspresji genu POU5F1 w komórkach macierzystych człowieka
 UNIWERSYTET MEDYCZNY W LUBLINIE I WYDZIAŁ LEKARSKI Z ODDZIAŁEM STOMATOLOGICZNYM mgr inż. Piotr Chomik Analiza ekspresji genu POU5F1 w komórkach macierzystych człowieka PRACA DOKTORSKA Promotor: Prof. UM
UNIWERSYTET MEDYCZNY W LUBLINIE I WYDZIAŁ LEKARSKI Z ODDZIAŁEM STOMATOLOGICZNYM mgr inż. Piotr Chomik Analiza ekspresji genu POU5F1 w komórkach macierzystych człowieka PRACA DOKTORSKA Promotor: Prof. UM
Dostępność terapii z zastosowaniem pomp insulinowych. Dr hab.n.med. Tomasz Klupa Uniwersytet Jagielloński, Katedra i Klinika Chorób Metabolicznych
 Dostępność terapii z zastosowaniem pomp insulinowych Dr hab.n.med. Tomasz Klupa Uniwersytet Jagielloński, Katedra i Klinika Chorób Metabolicznych Konflikt interesów Wykłady i seminaria dla firmy Medtronic.w
Dostępność terapii z zastosowaniem pomp insulinowych Dr hab.n.med. Tomasz Klupa Uniwersytet Jagielloński, Katedra i Klinika Chorób Metabolicznych Konflikt interesów Wykłady i seminaria dla firmy Medtronic.w
Mechanochemiczny przełącznik między wzrostem i różnicowaniem komórek
 Mechanochemiczny przełącznik między wzrostem i różnicowaniem komórek Model tworzenia mikrokapilar na podłożu fibrynogenowym eksponencjalny wzrost tempa proliferacji i syntezy DNA wraz ze wzrostem stężenia
Mechanochemiczny przełącznik między wzrostem i różnicowaniem komórek Model tworzenia mikrokapilar na podłożu fibrynogenowym eksponencjalny wzrost tempa proliferacji i syntezy DNA wraz ze wzrostem stężenia
Conception of reuse of the waste from onshore and offshore in the aspect of
 Conception of reuse of the waste from onshore and offshore in the aspect of environmental protection" Koncepcja zagospodarowania odpadów wiertniczych powstających podczas wierceń lądowych i morskich w
Conception of reuse of the waste from onshore and offshore in the aspect of environmental protection" Koncepcja zagospodarowania odpadów wiertniczych powstających podczas wierceń lądowych i morskich w
Informacje ogólne. Badania genetyczne wykorzystywane w kosmetologii
 Załącznik Nr do Uchwały Nr SYLABUS MODUŁU (PRZEDMIOTU) Informacje ogólne Nazwa modułu: Badania genetyczne wykorzystywane w kosmetologii Rodzaj modułu/przedmiotu Wydział PUM Kierunek studiów Obowiązkowy
Załącznik Nr do Uchwały Nr SYLABUS MODUŁU (PRZEDMIOTU) Informacje ogólne Nazwa modułu: Badania genetyczne wykorzystywane w kosmetologii Rodzaj modułu/przedmiotu Wydział PUM Kierunek studiów Obowiązkowy
Dr. habil. Anna Salek International Bio-Consulting 1 Germany
 1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
Czym jest medycyna personalizowana w kontekście wyzwań nowoczesnej onkologii?
 Czym jest medycyna personalizowana w kontekście wyzwań nowoczesnej onkologii? Wykorzystanie nowych technik molekularnych w badaniach nad genetycznymi i epigenetycznymi mechanizmami transformacji nowotworowej
Czym jest medycyna personalizowana w kontekście wyzwań nowoczesnej onkologii? Wykorzystanie nowych technik molekularnych w badaniach nad genetycznymi i epigenetycznymi mechanizmami transformacji nowotworowej
ZESZYTY NAUKOWE UNIWERSYTETU SZCZECIŃSKIEGO NR 689 FINANSE, RYNKI FINANSOWE, UBEZPIECZENIA NR 50 2012 ANALIZA WŁASNOŚCI OPCJI SUPERSHARE
 ZESZYTY NAUKOWE UNIWERSYTETU SZCZECIŃSKIEGO NR 689 FINANSE, RYNKI FINANSOWE, UBEZPIECZENIA NR 5 212 EWA DZIAWGO ANALIZA WŁASNOŚCI OPCJI SUPERSHARE Wprowadzenie Proces globalizacji rynków finansowych stwarza
ZESZYTY NAUKOWE UNIWERSYTETU SZCZECIŃSKIEGO NR 689 FINANSE, RYNKI FINANSOWE, UBEZPIECZENIA NR 5 212 EWA DZIAWGO ANALIZA WŁASNOŚCI OPCJI SUPERSHARE Wprowadzenie Proces globalizacji rynków finansowych stwarza
Stem Cells Spin S.A. Debiut na rynku NewConnect 24 sierpnia 2011
 Stem Cells Spin S.A. Debiut na rynku NewConnect 24 sierpnia 2011 Spółka biotechnologiczna zawiązana w lutym 2009r. Cel Spółki - komercjalizacja wynalazków wyprowadzanie, sposób hodowli i zastosowanie komórek
Stem Cells Spin S.A. Debiut na rynku NewConnect 24 sierpnia 2011 Spółka biotechnologiczna zawiązana w lutym 2009r. Cel Spółki - komercjalizacja wynalazków wyprowadzanie, sposób hodowli i zastosowanie komórek
Interfaza to niemal 90% cyklu komórkowego. Dzieli się na 3 fazy: G1, S i G2.
 W wyniku podziału komórki powstaje komórka potomna, która ma o połowę mniej DNA od komórki macierzystej i jest o połowę mniejsza. Aby komórka potomna była zdolna do kolejnego podziału musi osiągnąć rozmiary
W wyniku podziału komórki powstaje komórka potomna, która ma o połowę mniej DNA od komórki macierzystej i jest o połowę mniejsza. Aby komórka potomna była zdolna do kolejnego podziału musi osiągnąć rozmiary
Indukowane pluripotencjalne komórki macierzyste nowe rozwiązanie w medycynie regeneracyjnej
 diagnostyka laboratoryjna Journal of Laboratory Diagnostics 2011 Volume 47 Number 2 187-192 Praca poglądowa Review Article Indukowane pluripotencjalne komórki macierzyste nowe rozwiązanie w medycynie regeneracyjnej
diagnostyka laboratoryjna Journal of Laboratory Diagnostics 2011 Volume 47 Number 2 187-192 Praca poglądowa Review Article Indukowane pluripotencjalne komórki macierzyste nowe rozwiązanie w medycynie regeneracyjnej
Tissue - (Tkanka) Infection - (Infekcja ) TIME. Moisture - (Wilgoć) Edge - (Naskórkowanie )
 Mgr Katarzyna Mucha Tissue - (Tkanka) Infection - (Infekcja ) Moisture - (Wilgoć) TIME Edge - (Naskórkowanie ) TIME skrót i reguła KONCEPCJA OPRACOWANA W 2002, rok później opublikowana Definiuje cztery
Mgr Katarzyna Mucha Tissue - (Tkanka) Infection - (Infekcja ) Moisture - (Wilgoć) TIME Edge - (Naskórkowanie ) TIME skrót i reguła KONCEPCJA OPRACOWANA W 2002, rok później opublikowana Definiuje cztery
Public gene expression data repositoris
 Public gene expression data repositoris GEO [Jan 2011]: 520 k samples 21 k experiments Homo, mus, rattus Bos, sus Arabidopsis, oryza, Salmonella, Mycobacterium et al. 17.01.11 14 17.01.11 15 17.01.11 16
Public gene expression data repositoris GEO [Jan 2011]: 520 k samples 21 k experiments Homo, mus, rattus Bos, sus Arabidopsis, oryza, Salmonella, Mycobacterium et al. 17.01.11 14 17.01.11 15 17.01.11 16
Polskie Forum Psychologiczne, 2013, tom 18, numer 4, s. 441-456
 Polskie Forum Psychologiczne, 2013, tom 18, numer 4, s. 441-456 Anna Ratajska 1 2 1 1 Instytut Psychologii, Uniwersytet Kazimierza Wielkiego Institute of Psychology, Kazimierz Wielki University in Bydgoszcz
Polskie Forum Psychologiczne, 2013, tom 18, numer 4, s. 441-456 Anna Ratajska 1 2 1 1 Instytut Psychologii, Uniwersytet Kazimierza Wielkiego Institute of Psychology, Kazimierz Wielki University in Bydgoszcz
3.
 1 2 3 4. :.1 1392 1390..2 m.adib@sbu.ac.ir 3. mkzadeh@gmail.com ) 1385 15. (..4 yousefi.mary@gmail.com....... 134. 22. 1347 1389 1391. 1392. .. 1392 1389.. 5... 6 : (4 (3 (2 (1 (5 (10 (9 (8 (7 (6 (14 (13
1 2 3 4. :.1 1392 1390..2 m.adib@sbu.ac.ir 3. mkzadeh@gmail.com ) 1385 15. (..4 yousefi.mary@gmail.com....... 134. 22. 1347 1389 1391. 1392. .. 1392 1389.. 5... 6 : (4 (3 (2 (1 (5 (10 (9 (8 (7 (6 (14 (13
Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski. Instytut Farmakologii Polskiej Akademii Nauk, ul.
 Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski Instytut Farmakologii Polskiej Akademii Nauk, ul. Smętna 12, Kraków Plan prezentacji: Cel naukowy Podstawy teoretyczne Przyjęta metodyka
Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski Instytut Farmakologii Polskiej Akademii Nauk, ul. Smętna 12, Kraków Plan prezentacji: Cel naukowy Podstawy teoretyczne Przyjęta metodyka
PRZYKŁADOWE ZASTOSOWANIA PRP W SCHORZENIACH NARZĄDU RUCHU:
 Osocze bogatopłytkowe (PRP, ang. Platelet Rich Plasma) to nic innego jak koncentrat autologicznych (własnych) płytek krwi pacjenta, bogatych w czynniki wzrostu. Ich zawartość w normalnej krwi jest stosunkowo
Osocze bogatopłytkowe (PRP, ang. Platelet Rich Plasma) to nic innego jak koncentrat autologicznych (własnych) płytek krwi pacjenta, bogatych w czynniki wzrostu. Ich zawartość w normalnej krwi jest stosunkowo
Uniwersytet Przyrodniczy we Wrocławiu. Wydział Medycyny Weterynaryjnej. Katedra Biochemii, Farmakologii i Toksykologii.
 Uniwersytet Przyrodniczy we Wrocławiu Wydział Medycyny Weterynaryjnej Katedra Biochemii, Farmakologii i Toksykologii Aleksandra Pawlak CHARAKTERYSTYKA FENOTYPOWA KOMÓREK CHŁONIAKÓW I BIAŁACZEK PSÓW ORAZ
Uniwersytet Przyrodniczy we Wrocławiu Wydział Medycyny Weterynaryjnej Katedra Biochemii, Farmakologii i Toksykologii Aleksandra Pawlak CHARAKTERYSTYKA FENOTYPOWA KOMÓREK CHŁONIAKÓW I BIAŁACZEK PSÓW ORAZ
Mechanizm działania terapii fotodynamicznej w diagnozowaniu i leczeniu nowotworów. Anna Szczypka Aleksandra Tyrawska
 Mechanizm działania terapii fotodynamicznej w diagnozowaniu i leczeniu nowotworów Anna Szczypka Aleksandra Tyrawska Metody fotodynamiczne PDT Technika diagnostyczna i terapeutyczna zaliczana do form fotochemioterapii
Mechanizm działania terapii fotodynamicznej w diagnozowaniu i leczeniu nowotworów Anna Szczypka Aleksandra Tyrawska Metody fotodynamiczne PDT Technika diagnostyczna i terapeutyczna zaliczana do form fotochemioterapii
Lekcja o komórkach macierzystych
 Lekcja o komórkach macierzystych Scenariusz zajęć Ilona Żeber-Dzikowska, Aleksandra Szydłowska Temat: Oskarżeni komórki macierzyste Odbiorcy: uczniowie liceum lub technikum, realizujący rozszerzony zakres
Lekcja o komórkach macierzystych Scenariusz zajęć Ilona Żeber-Dzikowska, Aleksandra Szydłowska Temat: Oskarżeni komórki macierzyste Odbiorcy: uczniowie liceum lub technikum, realizujący rozszerzony zakres
Helena Boguta, klasa 8W, rok szkolny 2018/2019
 Poniższy zbiór zadań został wykonany w ramach projektu Mazowiecki program stypendialny dla uczniów szczególnie uzdolnionych - najlepsza inwestycja w człowieka w roku szkolnym 2018/2019. Składają się na
Poniższy zbiór zadań został wykonany w ramach projektu Mazowiecki program stypendialny dla uczniów szczególnie uzdolnionych - najlepsza inwestycja w człowieka w roku szkolnym 2018/2019. Składają się na
PATOLOGIA OGÓLNA DLA ODDZIAŁU STOMATOLOGII. Procesy naprawcze
 PATOLOGIA OGÓLNA DLA ODDZIAŁU STOMATOLOGII Procesy naprawcze Możliwości naprawcze uszkodzonych tkanek ustroju! Regeneracja (odrost, odnowa)! Organizacja (naprawa, gojenie) Regeneracja komórek, tkanek,
PATOLOGIA OGÓLNA DLA ODDZIAŁU STOMATOLOGII Procesy naprawcze Możliwości naprawcze uszkodzonych tkanek ustroju! Regeneracja (odrost, odnowa)! Organizacja (naprawa, gojenie) Regeneracja komórek, tkanek,
Dane mikromacierzowe. Mateusz Markowicz Marta Stańska
 Dane mikromacierzowe Mateusz Markowicz Marta Stańska Mikromacierz Mikromacierz DNA (ang. DNA microarray) to szklana lub plastikowa płytka (o maksymalnych wymiarach 2,5 cm x 7,5 cm) z naniesionymi w regularnych
Dane mikromacierzowe Mateusz Markowicz Marta Stańska Mikromacierz Mikromacierz DNA (ang. DNA microarray) to szklana lub plastikowa płytka (o maksymalnych wymiarach 2,5 cm x 7,5 cm) z naniesionymi w regularnych
Inżynieria genetyczna- 6 ECTS. Inżynieria genetyczna. Podstawowe pojęcia Część II Klonowanie ekspresyjne Od genu do białka
 Inżynieria genetyczna- 6 ECTS Część I Badanie ekspresji genów Podstawy klonowania i różnicowania transformantów Kolokwium (14pkt) Część II Klonowanie ekspresyjne Od genu do białka Kolokwium (26pkt) EGZAMIN
Inżynieria genetyczna- 6 ECTS Część I Badanie ekspresji genów Podstawy klonowania i różnicowania transformantów Kolokwium (14pkt) Część II Klonowanie ekspresyjne Od genu do białka Kolokwium (26pkt) EGZAMIN
Skóra. - jest dużym i rozległym narządem, osiąga powierzchnię około 2 m 2. - u dorosłego człowieka waży 4-5 kg, co stanowi 6% masy ciała
 Skóra - jest dużym i rozległym narządem, osiąga powierzchnię około 2 m 2 - u dorosłego człowieka waży 4-5 kg, co stanowi 6% masy ciała - grubość skóry jest zmienna i w zależności od okolicy ciała wynosi
Skóra - jest dużym i rozległym narządem, osiąga powierzchnię około 2 m 2 - u dorosłego człowieka waży 4-5 kg, co stanowi 6% masy ciała - grubość skóry jest zmienna i w zależności od okolicy ciała wynosi
Wskaźniki włóknienia nerek
 Wskaźniki włóknienia nerek u dzieci z przewlekłą chorobą nerek leczonych zachowawczo Kinga Musiał, Danuta Zwolińska Katedra i Klinika Nefrologii Pediatrycznej Uniwersytetu Medycznego im. Piastów Śląskich
Wskaźniki włóknienia nerek u dzieci z przewlekłą chorobą nerek leczonych zachowawczo Kinga Musiał, Danuta Zwolińska Katedra i Klinika Nefrologii Pediatrycznej Uniwersytetu Medycznego im. Piastów Śląskich
Czynniki genetyczne sprzyjające rozwojowi otyłości
 Czynniki genetyczne sprzyjające rozwojowi otyłości OTYŁOŚĆ Choroba charakteryzująca się zwiększeniem masy ciała ponad przyjętą normę Wzrost efektywności terapii Czynniki psychologiczne Czynniki środowiskowe
Czynniki genetyczne sprzyjające rozwojowi otyłości OTYŁOŚĆ Choroba charakteryzująca się zwiększeniem masy ciała ponad przyjętą normę Wzrost efektywności terapii Czynniki psychologiczne Czynniki środowiskowe
Badania osobniczej promieniowrażliwości pacjentów poddawanych radioterapii. Andrzej Wójcik
 Badania osobniczej promieniowrażliwości pacjentów poddawanych radioterapii Andrzej Wójcik Zakład Radiobiologii i Immunologii Instytut Biologii Akademia Świętokrzyska Świętokrzyskie Centrum Onkologii Fig.
Badania osobniczej promieniowrażliwości pacjentów poddawanych radioterapii Andrzej Wójcik Zakład Radiobiologii i Immunologii Instytut Biologii Akademia Świętokrzyska Świętokrzyskie Centrum Onkologii Fig.
Komórki satelitowe zlokalizowane w niszy między błoną włókna mięśniowego a otaczającą
 Czy komórki satelitowe są macierzyste? Streszczenie Komórki satelitowe zlokalizowane w niszy między błoną włókna mięśniowego a otaczającą go błoną podstawną są źródłem mioblastów niezbędnych do wzrostu
Czy komórki satelitowe są macierzyste? Streszczenie Komórki satelitowe zlokalizowane w niszy między błoną włókna mięśniowego a otaczającą go błoną podstawną są źródłem mioblastów niezbędnych do wzrostu
MAM HAKA NA CHŁONIAKA
 MAM HAKA NA CHŁONIAKA CHARAKTERYSTYKA OGÓLNA Chłoniaki są to choroby nowotworowe, w których następuje nieprawidłowy wzrost komórek układu limfatycznego (chłonnego). Podobnie jak inne nowotwory, chłoniaki
MAM HAKA NA CHŁONIAKA CHARAKTERYSTYKA OGÓLNA Chłoniaki są to choroby nowotworowe, w których następuje nieprawidłowy wzrost komórek układu limfatycznego (chłonnego). Podobnie jak inne nowotwory, chłoniaki
Akademia Morska w Szczecinie. Wydział Mechaniczny
 Akademia Morska w Szczecinie Wydział Mechaniczny ROZPRAWA DOKTORSKA mgr inż. Marcin Kołodziejski Analiza metody obsługiwania zarządzanego niezawodnością pędników azymutalnych platformy pływającej Promotor:
Akademia Morska w Szczecinie Wydział Mechaniczny ROZPRAWA DOKTORSKA mgr inż. Marcin Kołodziejski Analiza metody obsługiwania zarządzanego niezawodnością pędników azymutalnych platformy pływającej Promotor:
Słowa kluczowe: rak stercza, macierzyste komórki nowotworowe, rozsiany rak stercza, miejscowo zaawansowany rak stercza
 Postępy Nauk Medycznych, t. XXIV, nr 1, 2011 Borgis *Tomasz Drewa 1,2, Piotr L. Chłosta 3 Macierzyste komórki nowotworowe raka stercza. Potencjalne nowe kierunki w leczeniu chorych z procesem rozsianym
Postępy Nauk Medycznych, t. XXIV, nr 1, 2011 Borgis *Tomasz Drewa 1,2, Piotr L. Chłosta 3 Macierzyste komórki nowotworowe raka stercza. Potencjalne nowe kierunki w leczeniu chorych z procesem rozsianym
Mateusz Adamiak. Rozprawa doktorska na tytuł doktora nauk o zdrowiu.
 Mateusz Adamiak ROLA SFINGOZYNO-1-FOSFORANU W PROCESACH ZASIEDLANIA SZPIKU KOSTNEGO ORAZ FARMAKOLOGICZNEJ MOBILIZACJI KRWIOTWÓRCZYCH KOMÓREK MACIERZYSTYCH. The role of sphingosine-1-phosphate in the process
Mateusz Adamiak ROLA SFINGOZYNO-1-FOSFORANU W PROCESACH ZASIEDLANIA SZPIKU KOSTNEGO ORAZ FARMAKOLOGICZNEJ MOBILIZACJI KRWIOTWÓRCZYCH KOMÓREK MACIERZYSTYCH. The role of sphingosine-1-phosphate in the process
This copy is for personal use only - distribution prohibited.
 Kwart. Ortop. 20, 4, str. 34, ISSN 2083-8697 - - - - - REHABILITACJA STAWU BIODROWEGO I KOLANOWEGO, FINANSOWANA PRZEZ NARODOWY FUNDUSZ ZDROWIA W LATACH 2009 200 REHABILITATION OF THE HIP AND KNEE JOINTS
Kwart. Ortop. 20, 4, str. 34, ISSN 2083-8697 - - - - - REHABILITACJA STAWU BIODROWEGO I KOLANOWEGO, FINANSOWANA PRZEZ NARODOWY FUNDUSZ ZDROWIA W LATACH 2009 200 REHABILITATION OF THE HIP AND KNEE JOINTS
Składniki diety a stabilność struktury DNA
 Składniki diety a stabilność struktury DNA 1 DNA jedyna makrocząsteczka, której synteza jest ściśle kontrolowana, a powstałe błędy są naprawiane DNA jedyna makrocząsteczka naprawiana in vivo Replikacja
Składniki diety a stabilność struktury DNA 1 DNA jedyna makrocząsteczka, której synteza jest ściśle kontrolowana, a powstałe błędy są naprawiane DNA jedyna makrocząsteczka naprawiana in vivo Replikacja
POMIAR BIOKONCENTRACJI ZANIECZYSZCZEŃ W OCENIE SKAŻENIA ŚRODOWISKA, NARAŻENIA ORGANIZMÓW ORAZ PROGNOZOWANIU EKOLOGICZNYCH EFEKTÓW ZANIECZYSZCZEŃ
 Ekonomia i Środowisko 2 (49) 2014 Elżbieta Bonda-Ostaszewska POMIAR BIOKONCENTRACJI ZANIECZYSZCZEŃ W OCENIE SKAŻENIA ŚRODOWISKA, NARAŻENIA ORGANIZMÓW ORAZ PROGNOZOWANIU EKOLOGICZNYCH EFEKTÓW ZANIECZYSZCZEŃ
Ekonomia i Środowisko 2 (49) 2014 Elżbieta Bonda-Ostaszewska POMIAR BIOKONCENTRACJI ZANIECZYSZCZEŃ W OCENIE SKAŻENIA ŚRODOWISKA, NARAŻENIA ORGANIZMÓW ORAZ PROGNOZOWANIU EKOLOGICZNYCH EFEKTÓW ZANIECZYSZCZEŃ
INSPECTION METHODS FOR QUALITY CONTROL OF FIBRE METAL LAMINATES IN AEROSPACE COMPONENTS
 Kompozyty 11: 2 (2011) 130-135 Krzysztof Dragan 1 * Jarosław Bieniaś 2, Michał Sałaciński 1, Piotr Synaszko 1 1 Air Force Institute of Technology, Non Destructive Testing Lab., ul. ks. Bolesława 6, 01-494
Kompozyty 11: 2 (2011) 130-135 Krzysztof Dragan 1 * Jarosław Bieniaś 2, Michał Sałaciński 1, Piotr Synaszko 1 1 Air Force Institute of Technology, Non Destructive Testing Lab., ul. ks. Bolesława 6, 01-494
Diety do żywienia medycznego do podaży przez zgłębnik
 Diety do żywienia medycznego do podaży przez zgłębnik Dieta kompletna pod względem odżywczym, gotowa do użycia, zawierająca DHA/EPA, bezresztkowa, przeznaczona do stosowania przez zgłębnik Wskazania: okres
Diety do żywienia medycznego do podaży przez zgłębnik Dieta kompletna pod względem odżywczym, gotowa do użycia, zawierająca DHA/EPA, bezresztkowa, przeznaczona do stosowania przez zgłębnik Wskazania: okres
Tkanka nabłonkowa HISTOLOGIA OGÓLNA (TKANKI)
 HISTOLOGIA OGÓLNA (TKANKI) Elementy składowe tkanki: komórki (o podobnym pochodzeniu, zbliżonej strukturze i funkcji) substancja międzykomórkowa (produkowana przez komórki) Tkanka nabłonkowa Główne rodzaje
HISTOLOGIA OGÓLNA (TKANKI) Elementy składowe tkanki: komórki (o podobnym pochodzeniu, zbliżonej strukturze i funkcji) substancja międzykomórkowa (produkowana przez komórki) Tkanka nabłonkowa Główne rodzaje
Ocena ekspresji genów proangiogennych w komórkach nowotworowych OVP-10 oraz transfektantach OVP-10/SHH i OVP-10/VEGF
 Agnieszka Gładysz Ocena ekspresji genów proangiogennych w komórkach nowotworowych OVP-10 oraz transfektantach OVP-10/SHH i OVP-10/VEGF Katedra i Zakład Biochemii i Chemii Klinicznej Akademia Medyczna Prof.
Agnieszka Gładysz Ocena ekspresji genów proangiogennych w komórkach nowotworowych OVP-10 oraz transfektantach OVP-10/SHH i OVP-10/VEGF Katedra i Zakład Biochemii i Chemii Klinicznej Akademia Medyczna Prof.
RECENZJA. Rozprawy doktorskiej mgr Mateusza Nowickiego. Ocena wybranych elementów niszy szpikowej u pacjentów poddawanych
 Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Klinika Hematologii i Transplantacji Szpiku KIEROWNIK KLINIKI: dr hab. Lidia Gil, prof. UM 60-569 Poznań, ul. Szamarzewskiego 84 ; tel. +48 61
Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Klinika Hematologii i Transplantacji Szpiku KIEROWNIK KLINIKI: dr hab. Lidia Gil, prof. UM 60-569 Poznań, ul. Szamarzewskiego 84 ; tel. +48 61
Rośliny modyfikowane genetycznie (GMO)
 Rośliny modyfikowane genetycznie (GMO) Organizmy modyfikowane genetycznie Organizm zmodyfikowany genetycznie (międzynarodowy skrót: GMO Genetically Modified Organizm) to organizm o zmienionych cechach,
Rośliny modyfikowane genetycznie (GMO) Organizmy modyfikowane genetycznie Organizm zmodyfikowany genetycznie (międzynarodowy skrót: GMO Genetically Modified Organizm) to organizm o zmienionych cechach,
KARTA KURSU. Kod Punktacja ECTS* 3. Poznanie sposobów i typów hodowli komórek i tkanek zwierzęcych oraz metodyki pracy w warunkach sterylnych.
 Załącznik nr 4 do Zarządzenia Nr.. KARTA KURSU Nazwa Nazwa w j. ang. HODOWLE KOMÓREK I TKANEK CELL AND TISSUE CULTURE Kod Punktacja ECTS* 3 Koordynator dr Anna Barbasz Zespół dydaktyczny dr Anna Barbasz
Załącznik nr 4 do Zarządzenia Nr.. KARTA KURSU Nazwa Nazwa w j. ang. HODOWLE KOMÓREK I TKANEK CELL AND TISSUE CULTURE Kod Punktacja ECTS* 3 Koordynator dr Anna Barbasz Zespół dydaktyczny dr Anna Barbasz
Tytuł pracy w języku angielskim: Physical properties of liquid crystal mixtures of chiral and achiral compounds for use in LCDs
 Dr inż. Jan Czerwiec Kierownik pracy: dr hab. Monika Marzec Tytuł pracy w języku polskim: Właściwości fizyczne mieszanin ciekłokrystalicznych związków chiralnych i achiralnych w odniesieniu do zastosowań
Dr inż. Jan Czerwiec Kierownik pracy: dr hab. Monika Marzec Tytuł pracy w języku polskim: Właściwości fizyczne mieszanin ciekłokrystalicznych związków chiralnych i achiralnych w odniesieniu do zastosowań
Immunoterapia w praktyce rak nerki
 Immunoterapia w praktyce rak nerki VII Letnia Akademia Onkologiczna dla Dziennikarzy Warszawa 09 sierpień 2018 Piotr Tomczak Uniwersytet Medyczny Poznań Katedra i Klinika Onkologii Leczenie mrcc - zalecenia
Immunoterapia w praktyce rak nerki VII Letnia Akademia Onkologiczna dla Dziennikarzy Warszawa 09 sierpień 2018 Piotr Tomczak Uniwersytet Medyczny Poznań Katedra i Klinika Onkologii Leczenie mrcc - zalecenia
Spodziewany efekt kliniczny wpływu wit. K na kość
 Rola witaminy K2 w prewencji utraty masy kostnej i ryzyka złamań i w zaburzeniach mikroarchitektury Ewa Sewerynek, Michał Stuss Zakład Zaburzeń Endokrynnych i Metabolizmu Kostnego Uniwersytetu Medycznego
Rola witaminy K2 w prewencji utraty masy kostnej i ryzyka złamań i w zaburzeniach mikroarchitektury Ewa Sewerynek, Michał Stuss Zakład Zaburzeń Endokrynnych i Metabolizmu Kostnego Uniwersytetu Medycznego
Rola czynnika transkrypcyjnego Grainyhead-like 1 w rozwoju nowotworów skóry typu kolczystokomórkowego
 Mgr Michał Mlącki Dziedzina: nauki biologiczne Dyscyplina: biologia Wszczęcie: 17.01.2014 r. Temat: Rola czynnika transkrypcyjnego Grainyhead-like 1 w rozwoju nowotworów skóry typu kolczystokomórkowego
Mgr Michał Mlącki Dziedzina: nauki biologiczne Dyscyplina: biologia Wszczęcie: 17.01.2014 r. Temat: Rola czynnika transkrypcyjnego Grainyhead-like 1 w rozwoju nowotworów skóry typu kolczystokomórkowego
Komórki macierzyste zastosowania w biotechnologii i medycynie BT Metody identyfikacji i fenotypowania populacji komórek macierzystych
 Metody identyfikacji i fenotypowania populacji komórek macierzystych 1 Wstęp Szpik kostny zawiera hematopoetyczne (HSC) oraz niehematopoetyczne komórki macierzyste (KM). Do niehematopoetycznych KM należą:
Metody identyfikacji i fenotypowania populacji komórek macierzystych 1 Wstęp Szpik kostny zawiera hematopoetyczne (HSC) oraz niehematopoetyczne komórki macierzyste (KM). Do niehematopoetycznych KM należą:
SWPS Uniwersytet Humanistycznospołeczny. Wydział Zamiejscowy we Wrocławiu. Karolina Horodyska
 SWPS Uniwersytet Humanistycznospołeczny Wydział Zamiejscowy we Wrocławiu Karolina Horodyska Warunki skutecznego promowania zdrowej diety i aktywności fizycznej: dobre praktyki w interwencjach psychospołecznych
SWPS Uniwersytet Humanistycznospołeczny Wydział Zamiejscowy we Wrocławiu Karolina Horodyska Warunki skutecznego promowania zdrowej diety i aktywności fizycznej: dobre praktyki w interwencjach psychospołecznych
Przeanalizuj 12 obrazów tkanek z otrzymanego katalogu od prowadzącego zajęcia i opisz każde zdjęcie w tabeli zgodnie z podanym wzorem:
 Anatomia i Fizjologia Ćwiczenie 1 Klasyfikacja obrazów mikroskopowych tkanek Przeanalizuj 12 obrazów tkanek z otrzymanego katalogu od prowadzącego zajęcia i opisz każde zdjęcie w tabeli zgodnie z podanym
Anatomia i Fizjologia Ćwiczenie 1 Klasyfikacja obrazów mikroskopowych tkanek Przeanalizuj 12 obrazów tkanek z otrzymanego katalogu od prowadzącego zajęcia i opisz każde zdjęcie w tabeli zgodnie z podanym
Czy immunoterapia nowotworów ma racjonalne podłoże? Maciej Siedlar
 Czy immunoterapia nowotworów ma racjonalne podłoże? Maciej Siedlar Zakład Immunologii Klinicznej Katedra Immunologii Klinicznej i Transplantologii Uniwersytet Jagielloński Collegium Medicum, oraz Uniwersytecki
Czy immunoterapia nowotworów ma racjonalne podłoże? Maciej Siedlar Zakład Immunologii Klinicznej Katedra Immunologii Klinicznej i Transplantologii Uniwersytet Jagielloński Collegium Medicum, oraz Uniwersytecki
Różnicowanie = Tworzenie wyspecjalizowanych komórek
 Różnicowanie = Tworzenie wyspecjalizowanych komórek Czym są komórki macierzyste? Na zdjęciu widzimy Grudkę metalu i dużo różnych rodzajów śrub. Zastanów się Grudki metalu mogą zostać zmienione w wiele
Różnicowanie = Tworzenie wyspecjalizowanych komórek Czym są komórki macierzyste? Na zdjęciu widzimy Grudkę metalu i dużo różnych rodzajów śrub. Zastanów się Grudki metalu mogą zostać zmienione w wiele
starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg
 STRESZCZENIE Przewlekła białaczka limfocytowa (PBL) jest najczęstszą białaczką ludzi starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg kliniczny, zróżnicowane rokowanie. Etiologia
STRESZCZENIE Przewlekła białaczka limfocytowa (PBL) jest najczęstszą białaczką ludzi starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg kliniczny, zróżnicowane rokowanie. Etiologia
NAGRODANOBLA W 2012 ROKU ZA ODKRYCIA DOWODZĄCE, ŻE DOJRZAŁE KOMÓRKI MOGĄ BYĆ PRZEPROGRAMOWANE W MACIERZYSTE KOMÓRKI PLURIPOTENTNE
 NAGRODANOBLA W 2012 ROKU ZA ODKRYCIA DOWODZĄCE, ŻE DOJRZAŁE KOMÓRKI MOGĄ BYĆ PRZEPROGRAMOWANE W MACIERZYSTE KOMÓRKI PLURIPOTENTNE THE NOBLE PRIZE 2012 FOR THE DISCOVERY THAT MATURE CELLS CAN BE REPROGRAMMED
NAGRODANOBLA W 2012 ROKU ZA ODKRYCIA DOWODZĄCE, ŻE DOJRZAŁE KOMÓRKI MOGĄ BYĆ PRZEPROGRAMOWANE W MACIERZYSTE KOMÓRKI PLURIPOTENTNE THE NOBLE PRIZE 2012 FOR THE DISCOVERY THAT MATURE CELLS CAN BE REPROGRAMMED
Materiał i metody. Wyniki
 Abstract in Polish Wprowadzenie Selen jest pierwiastkiem śladowym niezbędnym do prawidłowego funkcjonowania organizmu. Selen jest wbudowywany do białek w postaci selenocysteiny tworząc selenobiałka (selenoproteiny).
Abstract in Polish Wprowadzenie Selen jest pierwiastkiem śladowym niezbędnym do prawidłowego funkcjonowania organizmu. Selen jest wbudowywany do białek w postaci selenocysteiny tworząc selenobiałka (selenoproteiny).
CHOROBY REUMATYCZNE A OBNIŻENIE GĘSTOŚCI MINERALNEJ KOŚCI
 CHOROBY REUMATYCZNE A OBNIŻENIE GĘSTOŚCI MINERALNEJ KOŚCI Katarzyna Pawlak-Buś Katedra i Klinika Reumatologii i Rehabilitacji Uniwersytetu Medycznego w Poznaniu ECHA ASBMR 2018 WIELOCZYNNIKOWY CHARAKTER
CHOROBY REUMATYCZNE A OBNIŻENIE GĘSTOŚCI MINERALNEJ KOŚCI Katarzyna Pawlak-Buś Katedra i Klinika Reumatologii i Rehabilitacji Uniwersytetu Medycznego w Poznaniu ECHA ASBMR 2018 WIELOCZYNNIKOWY CHARAKTER
