Agencja Oceny Technologii Medycznych
|
|
|
- Michał Janicki
- 6 lat temu
- Przeglądów:
Transkrypt
1 Agencja Oceny Technologii Medycznych Rekomendacja nr 5/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 23 stycznia 2012 r. w sprawie usunięcia świadczenia opieki zdrowotnej podanie ofatumumabu we wskazaniu leczenie przewlekłej białaczki limfocytowej (PBL) opornej na leczenie fludarabiną i alemtuzumabem z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej Prezes Agencji rekomenduje usunięcie świadczenia opieki zdrowotnej podanie ofatumumabu we wskazaniu leczenie przewlekłej białaczki limfocytowej (PBL) opornej na leczenie fludarabiną i alemtuzumabem z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej. Uzasadnienie rekomendacji W ślad za stanowiskiem Rady Konsultacyjnej 1 Prezes Agencji rekomenduje usunięcie świadczenia opieki zdrowotnej podanie ofatumumabu we wskazaniu leczenie przewlekłej białaczki limfocytowej (PBL) opornej na leczenie fludarabiną i alemtuzumabem z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej. Skuteczność ofatumumabu w przedmiotowym wskazaniu oparta jest na dowodach o niskiej jakości, a określenie efektywności klinicznej przedmiotowego świadczenia w porównaniu do innych metod terapii nie jest możliwe. Ofatumumab został zarejestrowany jako lek sierocy. Terapia skierowna jest do wąskiej grupy pacjentów z przewlekłą białaczką limfocytową (PBL) oporną na leczenie fludarabiną i alemtuzumabem. Istnieją inne metody terapeutyczne stosowane w przedmiotowym wskazaniu, a prognozowane koszty refundacji leku dla płatnika publicznego są wysokie. Efektywność kosztowa leku nie została udowodniona, co uwzględniły również inne agencje HTA NICE (National Institute for Health and Clinical Excellence) i SMC (Scottish Medicines Consortium). Podobnie francuska HAS (Haute Autorité de Santé) wydała jedynie rekomendację warunkową ze względu na brak danych dotyczących efektywności klinicznej. Prezes Agencji przychyla się również do informacji zawartej w Stanowisku Rady Konsultacyjnej 1, iż w przypadku obniżenia ceny produktu leczniczego Arzerra (ofatumumab) zasadność finansowania tego leku mogłaby zostać ponownie rozpatrzona. Agencja Oceny Technologii Medycznych ul. I. Krasickiego 26, Warszawa tel fax sekretariat@aotm.gov.pl
2 Problem zdrowotny Przewlekłe białaczki limfocytowe (CLL, chronic lymphocytic leukemia) stanowią grupę klonalnych chorób, w których dochodzi do proliferacji, a przede wszystkim akumulacji dojrzałych, obwodowych limfocytów we krwi i szpiku, a czasem również w węzłach chłonnych, śledzionie i wątrobie. Limfocyty białaczkowe najczęściej mają na swojej powierzchni antygeny charakterystyczne dla linii B komórkowej. Znacznie rzadziej przewlekłe białaczki limfocytowe wywodzą się z limfocytów T lub komórek NK (ang. natural killers). W początkowym okresie choroba przebiega bezobjawowo i wtedy jest wykrywana przypadkowo, podczas rutynowej kontroli morfologii krwi. Pierwszym klinicznym symptomem choroby mogą być objawy ogólne (utrata masy ciała > 10% w ciągu 6 miesięcy, podwyższona temperatura ciała bez cech infekcji utrzymująca się > 2 tygodnie, pocenie się, osłabienie). Podczas badania przedmiotowego u części chorych na CLL można stwierdzić różnego stopnia limfadenopatię obwodową, rzadziej powiększenie śledziony i/lub wątroby. Rzadko obserwuje się nacieki w skórze, tkance chłonnej pierścienia Waldeyera oraz innych narządach. Mogą występować wtórne zaburzenia regulacji układu odpornościowego, objawiające się skłonnością do oportunistycznych infekcji oraz obecnością różnych procesów autoimmunizacyjnych (niedokrwistość hemolityczna, małopłytkowość immunizacyjna). 2 W przebiegu CLL stosunkowo często dochodzi do rozwoju powikłań autoimmunizacyjnych, takich jak niedokrwistość autoimmunohemolityczna (ok % chorych), aplazja czysto czerwonokrwinkowa, małopłytkowość autoimmunizacyjna i granulocytopenia autoimmunizacyjna. Wydaje się, że zespoły te nie pogarszają rokowania w CLL i chorzy zwykle dobrze reagują na leczenie. Odrębnym problemem zaburzeń odpornościowych w CLL jest obniżenie odporności, powodujące u niektórych chorych znaczą podatność na infekcje (zarówno wirusowe, jak i bakteryjne), które są u nich częstą przyczyną zgonów. 2 Przewlekła białaczka limfocytowa jest najczęściej występującym rodzajem białaczki u ludzi dorosłych w Europie i Ameryce Północnej (25 30% białaczek, 2,5/ /rok). Średnia wieku w momencie rozpoznania wynosi 65 lat, mężczyźni chorują dwukrotnie częściej, niż kobiety. CLL charakteryzuje się dużą heterogennością. Pomimo że jest to choroba o łagodnym przebiegu, tylko u około 30% chorych obserwuje się długie, nawet letnie przeżycie, zwykle bez leczenia. U pozostałych chorych, białaczka wykazuje od początku agresywny przebieg lub wczesną progresję po zastosowanej terapii. 2 Zgodnie z danymi z Krajowego Rejestru Nowotworów: odpowiednio w latach 2007, 2008, 2009 stwierdzono 1391, 1531, 1628 zachorowań oraz odpowiednio 1216, 1210 i 1196 zgonów. 2 Rozpoznanie CLL opiera się na następujących kryteriach zaproponowanych przez Narodowy Instytut Raka w Stanach Zjednoczonych (NCI, National Cancer Institute): limfocytoza krwi obwodowej większa niż 5,0 G/l; limfocyty morfologicznie dojrzałe, odsetek prolimfocytów i komórek limfoplazmocytowych nie przekracza 5%; limfocyty w biopsji aspiracyjnej stanowią powyżej 30% komórek (komórkowość szpiku prawidłowa); monoklonalna ekspresja łańcuchów lekkich immunoglobulin na limfocytach CLL; ekspresja antygenów pan B; ekspresja CD5 i CD23. 2 Według ekspertów klinicznych, do istotnych następstw choroby należą: przedwczesny zgon, niezdolność do samodzielnej egzystencji, niezdolność do pracy, przewlekłe cierpienie, obniżenie jakości życia. 2 Aktualnie obowiązująca praktyka kliniczna Zgodnie z wytycznymi Polskiej Unii Onkologii (PUO) z 2009 r., aktualnie dostępne metody leczenia przewlekłej białaczki limfocytowej są następujące: leki alkilujące (chlorambucyl, cyklofosfamid) +/ prednizon; analogi puryn (kladrybina, fludarabina, pentostatyna); leczenie skojarzone z uwzględnieniem analogów puryn (fludarabina, cyklofosfamid, kladrybina, mitoksantron);
3 chemioterapia skojarzona, zawierająca leki alkilujące plus antracykliny (schematy COP i CHOP zawierające cyklofosfamid, winkrystynę, adriamycyna, prednizon); przeciwciała monoklonalne (alemtuzumab, rytuksymab); immunochemioterapia (fludarabina, cyklofosfamid, rytuksymab, alemtuzumab), przeszczepienie macierzystych komórek krwiotwórczych. Wytyczne PUO 2009 wskazują zastosowanie przeciwciał monoklonalnych w leczeniu CLL, natomiast nie wymieniają w tym wskazaniu ofatumumabu. 2 Decyzja o leczeniu stanowi wypadkową stopnia zaawansowania CLL, obecności objawów choroby utrudniających funkcjonowanie chorego oraz jej aktywności, ocenianej w pewnym okresie (minimum 2 miesięcy). Wskazaniami do rozpoczęcia leczenia CLL są: objawy ogólne; naciekanie szpiku kostnego (postępująca niedokrwistość i/lub małopłytkowość); masywna splenomegalia (> 6 cm); masywna limfadenopatia (> 10 cm w największym wymiarze); ponad 50 procentowy wzrost limfocytozy w okresie krótszym, niż 2 miesiące (lub czas podwojenia limfocytozy < 6 miesięcy); powikłania autoimmunizacyjne: niedokrwistość hemolityczna i/lub małopłytkowość immunizacyjna. Ocenia się, że około 1/3 chorych na CLL wymaga leczenia w chwili rozpoznania, 1/3 po dłuższym okresie obserwacji, natomiast pozostali pacjenci, w okresie Rai 0 II lub Bineta A lub B, nie wymagają terapii. 2 Opis wnioskowanego świadczenia Ofatumumab jest ludzkim przeciwciałem monoklonalnym (IgG1), które wiąże się specyficznie z określonym epitopem, obejmującym zarówno małą jak i dużą pętlę zewnątrzkomórkową antygenu CD20. Antygen CD20 jest przezbłonową fosfoproteiną występującą na powierzchni komórek linii limfocytów B, od komórek pre B do stadium dojrzałych limfocytów B, oraz na powierzchni komórek guzów wywodzących się z komórek B. Do guzów wywodzących się z komórek B należą: przewlekła białaczka limfocytowa (w przypadku której obserwuje się mniejszą ekspresję CD20) oraz chłoniaki nieziarnicze (z dużą ekspresją CD20 występującą w przypadku > 90% guzów). Antygen CD20 nie jest uwalniany z powierzchni komórki, ani przemieszczany do wnętrza komórki po związaniu z przeciwciałem. Wiązanie ofatumumabu z epitopem w bliższej, w stosunku do błony komórkowej części antygenu CD20, indukuje rekrutację i aktywację układu dopełniacza na powierzchni komórki, co prowadzi do cytotoksyczności zależnej od układu dopełniacza i w rezultacie do lizy komórek guza. Wykazano, że ofatumumab indukuje znaczną lizę komórek z dużą ekspresją cząsteczek hamujących układ dopełniacza. Wykazano również, że ofatumumab indukuje lizę komórek zarówno w przypadku komórek o małej, jak i dużej ekspresji CD20 oraz komórek opornych na rytuksymab. Ponadto wiązanie ofatumumabu umożliwia rekrutację naturalnych komórek cytotoksycznych (komórek NK) i tym samym indukcję śmierci komórki poprzez mechanizm cytotoksyczności komórkowej zależnej od przeciwciał. 2 2 kwietnia 2009 roku opublikowano decyzję COMP (Committee for Orphan Medicinal Products) o uznaniu leku Arzerra za lek sierocy w leczeniu przewlekłej białaczki limfocytowej. Zgodnie z danymi Unii Europejskiej, na PBL zapada nie więcej niż 3,5 na osób i choroba ta jest uznawana za rzadką. 2 Omawiany produkt leczniczy został dopuszczony do obrotu zgodnie z procedurą dopuszczenia warunkowego. Oznacza to, że oczekiwane są dalsze dowody świadczące o korzyści ze stosowania leku. Europejska Agencja Leków (EMA) dokonywać ma każdego roku przeglądu nowych informacji o produkcie, i w razie konieczności, nastąpi aktualizacja Charakterystyki Produktu Leczniczego (ChPL). 2 W Polsce ofatumumab jest obecnie finansowany w ramach świadczenia chemioterapii niestandardowej. Według danych NFZ, w roku 2010 wydano jedną zgodę na leczenie substancją czynną ofatumumab (koszt PLN), w 2011 roku złożono 2 wnioski, a wydano jedną zgodę (kwota PLN). 2
4 Zgodnie z Charakterystyką Produktu Leczniczego, produkt leczniczy Arzerra wskazany jest w leczeniu pacjentów z przewlekłą białaczką limfocytową (PBL) oporną na leczenie fludarabiną i alemtuzumabem. 2 Zlecenie Ministra Zdrowia dotyczy usunięcia przedmiotowego świadczenia opieki zdrowotnej z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej, w odniesieniu do świadczenia gwarantowanego podanie ofatumumabu we wskazaniu leczenie przewlekłej białaczki limfocytowej (PBL) opornej na leczenie fludarabiną i alemtuzumabem na podstawie art. 31e ust. 1, art. 31f ust. 5 oraz art. 31h ustawy o świadczeniach zdrowotnych finansowanych ze środków publicznych. Efektywność kliniczna Celem przedstawionego opracowania było wykazanie korzyści klinicznej zastosowania ofatumumabu, jako terapii kolejnego rzutu w leczeniu przewlekłej białaczki limfocytowej po wcześniejszym niepowodzeniu terapii fludarabiną i alemtuzumabem. W wyniku przeprowadzonego przez autorów analizy systematycznego wyszukiwania, odnaleziono jedną publikację opisującą wieloośrodkowe badanie II fazy bez randomizacji i grupy kontrolnej. W badaniu oceniono skuteczność i bezpieczeństwo stosowania ofatumumabu wśród pacjentów z oporną na leczenie fludarabiną i alemtuzumabem postacią przewlekłej białaczki limfocytowej (grupa DR) oraz wśród pacjentów wykazujących oporność na leczenie fludarabiną i niebędących właściwą populacją do zastosowania alemtuzumabu ze względu na masywną limfadenopatię (ang. bulky lymphadenopathy) będącą wynikiem obecności komórek nowotworowych w węzłach chłonnych (grupa BFR). Pacjenci przyjmowali dożylne infuzje ofatumumabu w trakcie 8 tygodniowych, a następnie w 4 miesięcznych cykli terapeutycznych. Całkowita odpowiedź na leczenie (CR) ogółem w grupie pacjentów opornych na leczenie fludarabiną i alemtuzumabem (DR, N = 59) wystąpiła u 58% (99% CI: 40; 74) pacjentów. W grupie pacjentów opornych na leczenie fludarabiną i masywną limfadenopatią (BFR, N = 79) odpowiedź na leczenie ogółem została odnotowana wśród 47% (99% CI: 32; 62) pacjentów. Wśród pacjentów, u których wystąpiła odpowiedź na leczenie, mediana czasu do wystąpienia odpowiedzi wyniosła 1,8 miesięcy, zarówno wśród pacjentów opornych na leczenie fludarabiną oraz alemtuzumabem, jak i pacjentów opornych na leczenie fludarabiną z masywną limfadenopatią. Mediana długości trwania odpowiedzi na leczenie w populacji pacjentów DR wyniosła 7,1 (95% CI: 3,7; 7,6) miesięcy. W populacji pacjentów z masywną limfadenopatią oraz opornych na terapię fludarabiną (BFR), mediana długości odpowiedzi na leczenie wyniosła natomiast 5,6 (95% CI: 3,6; 7,0) miesięcy. Czas całkowitego przeżycia wyniósł w grupie DR 13,7 miesięcy (95% CI: 9,4; nie określono górnego przedziału), natomiast w grupie BFR 15,4 miesięcy (95% CI: 10,2; 20,2). Wśród pacjentów opornych na leczenie fludarabiną i alemtuzumabem (DR), mediana czasu wolnego od progresji (PFS) wyniosła 5,7 miesięcy (95% CI: 4,5; 8,0). W grupie BFR mediana czasu wolnego od progresji choroby wyniosła 5,9 miesięcy (95% CI: 4,9; 6,4). 2 Bezpieczeństwo stosowania Według Charakterystki Produktu Leczniczego,do działań niepożądanych związanych ze stosowaniem terapii ofatumumabem należą: zakażenie dolnych dróg oddechowych (w tym zapalenie płuc), zakażenie górnych dróg oddechowych; neutropenia i niedokrwistość; wysypka występujące bardzo często ( 1/10); posocznica, w tym posocznica neutropeniczna i wstrząs septyczny, zakażenie wirusem opryszczki, zakażenie układu moczowego; gorączka neutropeniczna, małopłytkowość, leukopenia; reakcje rzekomoanafilaktyczne, nadwrażliwość; tachykardia; niedociśnienie, nadciśnienie; skurcz oskrzeli, hipoksja, duszność, dyskomfort w klatce piersiowej, ból gardła i krtani, kaszel, zatkanie nosa; niedrożność jelita cienkiego, biegunka, nudności; pokrzywka, świąd, zaczerwienienie; ból pleców; zespół uwolnienia cytokin, gorączka, dreszcze, nadmierne pocenie się, zmęczenie występujące często ( 1/100 do < 1/10); agranulocytoza, zaburzenia krzepnięcia, aplazja czerwonokrwinkowa, limfopenia; zespół rozpadu guza występujące niezbyt często ( 1/1 000 do < 1/100). 3
5 Autorzy analizy przedstawionej przez podmiot odpowiedzialny przeprowadzili ocenę bezpieczeństwa w oparciu o działania niepożądane, zidentyfikowane w trakcie prób klinicznych z wykorzystaniem leku Arzerra w wieloośrodkowym badaniu II fazy bez randomizacji i grupy kontrolnej (włączone do analizy efektywności klinicznej). Przeprowadzono również dodatkową analizę bezpieczeństwa, do której włączono 2 publikacje (badanie nierandomizowane, bez grupy kontrolnej i program leczenia idywidualnego). Wśród wszystkich odnotowanych ciężkich działań niepożądanych najczęstszymi były: zapalenia dolnych dróg oddechowych, działania niepożądane związane z powikłaniami septycznymi oraz neutropenia. Prescrire 2010 W publikacji umieszczono informację, iż profil działań niepożądanych ofatumumabu wydaje się być podobny do terapii rytuksymabem, i obejmuje: reakcje nadwrażliwości, infekcje, zaburzenia kardiologiczne i neutropenię. Ponadto stwierdzono, iż w praktyce, pomimo ograniczonej ilości danych, korzystanie z ofatumumabu wydaje się być uzasadnione u chorych, którzy nie mają innych zatwierdzonych opcji terapeutycznych, ale co do których istnieje potrzeba wykonania dalszych badań. 2 Efektywność kosztowa Celem analizy była ocena opłacalności refundacji ofatumumabu (preparat Arzerra ) w leczeniu przewlekłej białaczki limfocytowej u dorosłych pacjentów opornych na leczenie fludarabiną i alemtuzumabem, z perspektywy Narodowego Funduszu Zdrowia, w horyzoncie dożywotnim. Z powodu braku badań bezpośrednio porównujących ofatumumab do innego leku w rozpatrywanym wskazaniu, autorzy analizy przedstawionej przez podmiot odpowiedzialny uznali za niemożliwe obliczenie inkrementalnego współczynnika efektywności kosztów (ICER). Uznano, że z powodu braku takich danych, najwłaściwszym sposobem przeprowadzenia analizy będzie zestawienie kosztów i wyników zdrowotnych oraz obliczenie współczynnika efektywności kosztów dla terapii ofatumumabem. Analiza przeprowadzona została z zastosowaniem modelu Markowa o cyklu trwającym 28 dni. 2 Ze względu kategorię leku (lek sierocy), Ministerstwo Zdrowia wyraziło zgodę (pismo znak: MZ PLA /GB/11 z dnia 28 grudnia 2011 r.) na opracowanie analizy ekonomicznej w ograniczonym zakresie. 2 Według Charakterystyki Produktu Leczniczego, ofatumumab podawany jest zgodnie ze schematem: pierwsza infuzja 300 mg ofatumumabu dożylnie; kolejne infuzje (2 12) 2000 mg ofatumumabu dożylnie. Schemat leczenia obejmuje 8 infuzji podawanych co tydzień, następnie 4 5 tygodni przerwy i 4 kolejne infuzje co 4 tygodnie. Przy uwzględnieniu powyższego shcematu podawaniu leku całkowity koszt terapii ofatumumabem stosowanej u pacjentów w leczeniu PBL, po niepowodzeniu fludarabiną i alemtuzumabem (przy założeniu przyjęcia przez pacjenta 12 infuzji ofatumumabu), oszacowano w analizie na PLN. Koszt monitorowania stanu zdrowia pacjenta w okresie dwóch lat od rozpoczęcia leczenia ofatumumabem wynosi PLN, natomiast koszt leczenia działań niepożądanych przypadający na jednego pacjenta oszacowano w analizie na PLN. 2 Cena produktu leczniczego Azerra (ofatumumab) wynosi PLN brutto za mg. W przypadku zastosowania terapii ofatumumabem w populacji pacjentów z przewlekłą białaczką limfocytową opornych na leczenie fludarabiną i alemtuzumabem, całkowity, średni koszt leczenia pacjenta w horyzocie dożywotnim wynosi ok. PLN, a całkowity efekt zdrowotny na miesiąc życia kształtuje się na poziomie 15,8 miesięcy. Wartość współczynnika CER w horyzoncie dożywotnim wynosi PLN/miesiąc, a w 2 letnim PLN/miesiąc. 2 Przeprowadzono jednokierunkową analizę wrażliwości największe zmiany współczynnika CER obserwowano, przy nieuwzględnieniu dyskontowania efektów (spadek o %) oraz przy przyjęciu minimalnej mediany czasu trwania odpowiedzi (wzrost o %). W ramach wielokierunkowej analizy wrażliwości, w przypadku scenariusza optymistycznego zaobserwowano wzrost efektu zdrowotnego (o %) przy jednoczesnym spadku kosztów. W przypadku scenariusza pesymistycznego odnotowano obniżenie efektu (o %) przy równoczesnym spadku kosztów. 2
6 Wpływ na budżet płatnika Rekomendacja nr 5/2012 Prezesa AOTM z dnia 23 stycznia 2012 r. Celem analizy była ocena wpływu na system ochrony zdrowia refundacji ofatumumabu (preparat Arzerra ) w leczeniu przewlekłej białaczki limfocytowej (PBL) w Polsce. Analizowana substancja czynna jest wskazana w leczeniu pacjentów dorosłych z PBL opornych na leczenie fludarabiną i alemtuzumabem. Populację docelową oszacowano na podstawie liczby osób leczonych alemtuzumabem. Na podstawie badania ankietowego założono, że 30 40% osób leczonych alemtuzumabem nie odpowiada na leczenie. Zgodnie z danymi sprzedażowymi produktu leczniczego MabCampath (alemtuzumab) liczbę chorych przyjmujących ten preparat oszacowano na pacjentów. Stąd populacja chorych przyjmujących ofatumumab włączona do analizy wynosi osób. W analizie przyjęto 2 letni horyzont czasowy oraz przedstawiono wpływ na system ochrony zdrowia z perspektywy płatnika publicznego (NFZ). 2 W analizie wpływu na system ochrony zdrowia porównano skutki dla budżetu refundacyjnego Narodowego Funduszu Zdrowia dwóch scenariuszy sytuacyjnych: scenariusz istniejący refundacja ofatumumabu w ramach wykazu świadczeń gwarantowanych, realizowanych w ramach programu chemioterapii niestandardowej leczenia PBL u pacjentów opornych na leczenie fludarabiną i alemtuzumabem. Pacjenci nieobjęci leczeniem w ramach chemioterapii niestandardowej leczeni są za pomocą schematów Chl+P (chlorambucyl+prednizol) oraz R+CHOP (rytuksymab, winkrystyna, cyklofosfamid, prednizon, adriamecyna). Przyjęto następujące udziały w rynku poszczególnych schematów leczenia: ofatumumab %, R+CHOP %, Chl+P %; scenariusz nowy : Wariant I ofatumumab (preparat Arzerra ) pozostanie na wykazie świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej i obejmie wszystkich pacjentów kwalifikujących się do leczenia (udział w rynku 100%); Wariant II ofatumumab (preparat Arzerra ) zostanie usunięty z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej. W tej sytuacji pacjenci z PBL, u których terapia fludarabiną oraz alemtuzumabem nie przyniosła oczekiwanych efektów, będą poddani leczeniu paliatywnemu. Przyjęto następujące udziały w rynku poszczególnych schematów leczenia: Chl+P %, R+CHOP %. 2 Koszt leczenia z perpektywy NFZ (dla 12 cykli leczenia) przewlekłej białaczki limfocytowej ofatumumabem przypadający na jednego pacjenta oszacowano na PLN. Z danych NFZ wynika, iż leczenie ofatumumabem w ramach chemioterapii niestandardowej jednego pacjenta z przewlekłą białaczką limfocytową w ramach w 2010 r. generowało koszt płatnika (NFZ) w wysokości PLN, natomiast do września 2011 r., leczenie również jednego pacjenta generowało koszt NFZ w wysokości PLN. Natomiast całkowity koszt chemioterapii w schemacie Chl+P stosowanej po niepowodzeniu terapii fludarabiną oraz alemtuzumabem w przeliczeniu na jednego pacjenta oszacowano na PLN. Całkowity koszt chemioterapii w schemacie R+CHOP stosowanej po niepowodzeniu terapii fludarabiną oraz alemtuzumabem w przeliczeniu na jednego pacjenta oszacowano na PLN. W scenariusz istniejącym oszacowano wydatki płanika publicznego w roku 2012 i 2013 na W wariancie I scenariusza nowego, koszt zastąpienia dotychczas stosowanych terapii w leczeniu PBL, po niepowodzeniu chemioterapii fludarabiną oraz alemtuzumabem chemioterapią z zastosowaniem ofatumumabu, oszacowano na PLN w 2012 roku i tyle samo w 2013 roku. Dodatkowe nakłady, które musiałyby zostać poniesione w sytuacji zastąpienia scenariusza istniejącego (refundacja ofatumumabu dla części pacjentów kwalifikujących się do terapii w ramach chemioterapii niestandardowej) scenariuszem nowym (refundacja ofatumumabu dla wszystkich pacjentów kwalifikujących się do leczenia) w roku 2012 i 2013 wzrosną o % ( PLN; według oszacowań analityków AOTM PLN rocznie). W wariancie II scenariusza nowego, w sytuacji usunięcia ofatumumabu z wykazu świadczeń gwarantowanych w zakresie chemioterapii niestandardowej, koszt leczenia pacjentów obecnie dostępnymi (najczęściej stosowanymi) terapiami, będzie dla płatnika publicznego wynosił PLN PLN.
7 rocznie. W stosunku do scenariusza istniejącego, oznacza to spadek kosztów na leczenie analizowanej grupy pacjentów o PLN rocznie ( %), według oszacowań analityków AOTM PLN rocznie. 2 Omówienie rekomendacji wydawanych w innych krajach w odniesieniu do ocenianej technologii Rekomendacje kliniczne 2 Odnaleziono łącznie 6 rekomendacji klinicznych, z czego trzy rekomendacje zalecają stosowanie ofatumumabu w CLL, pozostałe rekomendacje wymieniają inne leki stosowane w tym wskazaniu. 2 British Committee for Standards in Haematology (BCSH, 2004 Guidelines on the diagnosis and management of chronic lymphocytic leukaemia, Wielka Brytania) zaleca w leczeniu I rzutu fludarabinę, FC oraz chlorambucyl, w leczeniu II rzutu HDMP (wysokie dawki metyloprednizolonu), alemtuzumab, fludarabinę, FC oraz schemat CHOP. Włoskie rekomendacje (The Italian Society of Hematology, the Italian Society of Experimental Hematology, the Italian Group for Bone Marrow Transplantation, 2006 Management of chronic lymphocytic leukemia: practice Guidelines ) zalecają w leceniu I rzutu FC oraz chlorambucyl, a w leczeniu II rzutu fludarabinę w monoterapii lub w schemacie leczenia. International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute (Working Group, 1996 guidelines Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia, USA) zalecają, obserwację pacjentów z nowo rozpoznaną B CLL bez objawów choroby, we wczesnym stadium choroby (Rai 0, Binet A) bez rozpoczynania leczenia do czasu wystąpienia dowodów świadczących o postępie choroby. Pacjenci z chorobą oporną na leczenie, którzynie odpowiadają na stosowanie standardowej chemioterapii, powinni zostać poddani allogenicznemu przeszczepowi macierzystych komórek krwiotwórczych. Wytyczne nie wymieniają ofatumumabu jako leku stosowanego w leczeniu CLL. National Comprehensive Cancer Network; NCCN Guidelines Version ; 2010 Clinical Practice Guidelines in Oncology. Ofatumumab jest zalecany u pacjentów bez del(17p), del (11q) 1 w leczeniu II rzutu w przypadku nawrotu choroby (< 2 lat od I linii terapii, pacjenci < 70 lat, lub starsi bez znaczących chorób towarzyszących w chemioimmunoterapii). U pacjentów z del (17p) ofatumumab jest zalecany w leczeniu II rzutu (leczenie nie jest skuteczne u pacjentów z węzłami chłonnymi >5 cm). U pacjentów z del (11q) ofatumumab jest zalecany w leczeniu II rzutu w przypadku nawrotu choroby (< 2 lat od I linii terapii, pacjenci < 70 lat lub starsi bez znaczących chorób towarzyszących w chemioimmunoterapii). European Society for Medical Oncology ESMO, 2010 Clinical Practice Guidelines for diagnosis, treatment and follow up, Chronic lymphocytic leukemia. Wysokie dawki ofatumuabu są zalecane w leczeniu II rzutu w przypadku nawrotu choroby ( 1 rok od monoterapii lub 2lata od chemioimmunoterapii, bądź brak odpowiedzi na leczenie I rzutumonoterapia). European Society for Medical Oncology ESMO, 2011 "ESMO Clinical Practice Guidelines for diagnosis, treatment and follow up. Wytyczne ESMO z 2011 r., wskazują, iż w przypadku nawrotu CLL lub oporności na leczenie pierwszej linii, u pacjentów nieaktywnych fizycznie bez del(17p), stosuje się bendamustynę lub alemtuzumab. W kolejnym nawrocie choroby mogą być stosowane wysokie dawki ofatumumabu lub rytuksymabu z wysokimi dawkami steroidów. Rekomendacje dotyczące finansowania ze środków publicznych 2 Odnaleziono trzy rekomendacje dotyczące finansowania ofatumumabu ze środków publicznych, z czego tylko jedna była pozytywna. Scottish Medicines Consortium (SMC) 2010 Wstępna analiza badania bez randomizacji, z jednym ramieniem, przeprowadzonego na małej populacji, w podgrupie pacjentów z chorobą oporną na fludarabinę i alemtuzumab wskazała, że
8 ofatumumab związany był z odsetkiem odpowiedzi równym 58%. Uzasadnienie kosztu leczenia, w stosunku do korzyści zdrowotnych przedstawione przez producenta, nie wystarcza do uzyskania akceptacji przez SMC, a ponadto producent nie przedstawił wystarczająco wyczerpującej analizy ekonomicznej. Haute Autorité de Santé (HAS) 2010 Nie jest możliwa ocena wkładu terapeutycznego tego leku. Jakość dostępnych danych nie jest wystarczająca dla dokonania oceny wpływu na śmiertelność chorych. W opinii komisji, Arzerra nie poprawi jakości leczenia, jednakże może być stosowana tymczasowo, w oczekiwaniu na dodatkowe doniesienia naukowe. National Institute for Health and Clinical Excellence (NICE) 2010 Ofatumumab nie jest rekomendowany w leczeniu PBL opornej na leczenie fludarabiną i alemtuzumabem. Pacjenci otrzymujący ofatumumab w leczeniu przewlekłej białaczki limfocytowej opornej na leczenie fludarbiną i alemtuzumabem powinni mieć możliwość kontynuowania terapii, do momentu, aż lekarz uzna za zasadne jej przerwanie Na podstawie odnalezionych danych stwierdzono, że ofatumumab jest refundowany: w Wielkiej Brytanii, Irlandii, Niemczech, Francji, Danii i warunkowo w Austrii. W pozostałych siedmiu krajach europejskich, nie jest refundowany. 2 Podstawa przygotowania rekomendacji Rekomendacja została przygotowana na podstawie zlecenia z dnia 3 marca 2011 r. Ministra Zdrowia (znak pisma: MZ PLE /GB/11) oraz pism z dnia 12 września 2011 r. (znak pisma: MZ PLA /GB/11) i z dnia 7 października 2011 r. (znak pisma: MZ PLA /GB/11), odnośnie przygotowania rekomendacji Prezesa Agencji w przedmiocie usunięcia świadczenia opieki zdrowotnej obejmującego podanie ofatumumabu we wskazaniu leczenie przewlekłej białaczki limfocytowej (PBL) opornej na leczenie fludarabiną i alemtuzumabem z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej na podstawie art. 31e ust. 1, art. 31f ust. 5 oraz art. 31h ustawy o świadczeniach zdrowotnych finansowanych ze środków publicznych oraz po uzyskaniu stanowiska Rady Konsultacyjnej nr 5/2012 z dnia 23 stycznia 2012 r. w sprawie usunięcia świadczenia opieki zdrowotnej podanie ofatumumabu we wskazaniu leczenie przewlekłej białaczki limfocytowej (PBL) opornej na leczenie fludarabiną i alemtuzumabem z wykazu świadczeń gwarantowanych. Piśmiennictwo 1. Stanowisko Rady Konsultacyjnej nr 5/2012 z dnia 23 stycznia 2012 r. w sprawie usunięcia świadczenia opieki zdrowotnej podanie ofatumumabu we wskazaniu leczenie przewlekłej białaczki limfocytowej (PBL) opornej na leczenie fludarabiną i alemtuzumabem z wykazu świadczeń gwarantowanych. 2. Raport AOTM OT /2011, Ofatumumab (Azerra ) we wskazaniu: leczenie przewlekłej białaczki limfocytowej opornej na leczenie fludarabiną i alemtuzumabem, Raport ws. oceny świadczenia opieki zdrowotnej, Charakterystyka produktu leczniczego.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 90/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 19 grudnia 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 90/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 19 grudnia 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
Białaczka limfatyczna
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie?
 Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 119/2012 z dnia 26 listopada 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 119/2012 z dnia 26 listopada 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 9/2012 z dnia 27 lutego 2012 w zakresie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie chłoniaków
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 9/2012 z dnia 27 lutego 2012 w zakresie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie chłoniaków
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 33/2012 z dnia 18 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany jego poziomu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 33/2012 z dnia 18 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany jego poziomu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 163/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 163/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Nowe możliwości leczenia ostrej białaczki limfoblastycznej
 Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Przewlekła białaczka limfocytowa
 Przewlekła białaczka limfocytowa Ewa Lech-Marańda Klinika Hematologii Instytutu Hematologii i Transfuzjologii Klinika Hematologii i Transfuzjologii CMKP Przewlekła białaczka limfocytowa (CLL) Początek
Przewlekła białaczka limfocytowa Ewa Lech-Marańda Klinika Hematologii Instytutu Hematologii i Transfuzjologii Klinika Hematologii i Transfuzjologii CMKP Przewlekła białaczka limfocytowa (CLL) Początek
Ulotka dołączona do opakowania: informacja dla użytkownika. Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH
 DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 138/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 138/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
ostrym reumatoidalnym zapaleniem stawów (choroba powodująca stan zapalny stawów), gdzie produkt MabThera podaje się dożylnie z metotreksatem;
 EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 191/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 191/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 38/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 38/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
POSTĘPY W LECZENIU PBL
 POSTĘPY W LECZENIU PBL Klinika Chorób Wewnętrznych i Hematologii Wojskowy Instytut Medyczny Prof. dr hab. med. Piotr Rzepecki Terapia przełomowa Pojęcie terapii przełomowych w hematoonkologii zostało wprowadzone
POSTĘPY W LECZENIU PBL Klinika Chorób Wewnętrznych i Hematologii Wojskowy Instytut Medyczny Prof. dr hab. med. Piotr Rzepecki Terapia przełomowa Pojęcie terapii przełomowych w hematoonkologii zostało wprowadzone
Wydłużenie życia chorych z rakiem płuca - nowe możliwości
 Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 161/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 161/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 20/2014 z dnia 20 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie winorelbiny w rozpoznaniach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 20/2014 z dnia 20 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie winorelbiny w rozpoznaniach
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 162/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 162/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM
 XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM Wykonawca: MAHTA Sp z oo ul Rejtana 17/5 02-516 Warszawa Tel 22
XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM Wykonawca: MAHTA Sp z oo ul Rejtana 17/5 02-516 Warszawa Tel 22
Rysunek. Układ limfatyczny.
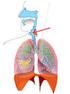 Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 7/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 27 lutego 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 7/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 27 lutego 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
czerniak (nowotwór skóry), który rozprzestrzenił się lub którego nie można usunąć chirurgicznie;
 EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 182/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Mozobil
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 182/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Mozobil
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 268/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie nelarabiny w rozpoznaniach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 268/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie nelarabiny w rozpoznaniach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 189/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 189/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 87/2014 z dnia 24 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 87/2014 z dnia 24 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
Rada Konsultacyjna. Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 3/2012 z dnia 16 stycznia 2012 r. w sprawie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie ostrej
Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 3/2012 z dnia 16 stycznia 2012 r. w sprawie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie ostrej
Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej. Szanowny Panie Marszałku,
 Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej Szanowny Panie Marszałku, w odpowiedzi na interpelację nr 9087 Posłów na Sejm RP: Krystyny Sibińskiej, Marii Janyska,
Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej Szanowny Panie Marszałku, w odpowiedzi na interpelację nr 9087 Posłów na Sejm RP: Krystyny Sibińskiej, Marii Janyska,
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
zaawansowanym rakiem nerkowokomórkowym, rodzajem raka nerki, u pacjentów, którzy byli wcześniej leczeni lekami przeciwnowotworowymi;
 EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka szpikowa
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka szpikowa
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 8/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 28 lutego 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 8/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 28 lutego 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Dziennik Urzędowy Ministra Zdrowia 624 Poz. 71 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Dziennik Urzędowy Ministra Zdrowia 624 Poz. 71 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Przewlekła białaczka
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Przewlekła białaczka
Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie
 brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0)
 Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia
 Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia Analiza wpływu na system ochrony zdrowia maj 2013 Autorzy raportu:
Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia Analiza wpływu na system ochrony zdrowia maj 2013 Autorzy raportu:
Fundusz ratunkowy jako perspektywa dla leczenia osób z chorobami rzadkimi
 Fundusz ratunkowy jako perspektywa dla leczenia osób z chorobami rzadkimi Wiesław Wiktor Jędrzejczak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego
Fundusz ratunkowy jako perspektywa dla leczenia osób z chorobami rzadkimi Wiesław Wiktor Jędrzejczak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 136/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 136/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
chorych na ITP Krzysztof Chojnowski Warszawa, 27 listopada 2009 r.
 Współczesne leczenie chorych na ITP Krzysztof Chojnowski Klinika Hematologii UM w Łodzi Warszawa, 27 listopada 2009 r. Dlaczego wybór postępowania u chorych na ITP może być trudny? Choroba heterogenna,
Współczesne leczenie chorych na ITP Krzysztof Chojnowski Klinika Hematologii UM w Łodzi Warszawa, 27 listopada 2009 r. Dlaczego wybór postępowania u chorych na ITP może być trudny? Choroba heterogenna,
Standard leczenia, jakiego oczekują pacjenci z przewlekłą białaczką limfocytową. Aleksandra Rudnicka rzecznik PKPO
 Standard leczenia, jakiego oczekują pacjenci z przewlekłą białaczką limfocytową Aleksandra Rudnicka rzecznik PKPO Wspólny głos ponad 100 tysięcy pacjentów onkologicznych! 45 organizacje wspólnie działają
Standard leczenia, jakiego oczekują pacjenci z przewlekłą białaczką limfocytową Aleksandra Rudnicka rzecznik PKPO Wspólny głos ponad 100 tysięcy pacjentów onkologicznych! 45 organizacje wspólnie działają
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 98/2012 z dnia 29 października 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 98/2012 z dnia 29 października 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 156/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 156/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
ANEKS I WYKAZ NAZW, POSTACI)FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCA W PAŃSTWACH CZŁONKOWSKICH
 ANEKS I WYKAZ NAZW, POSTACI)FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCA W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie UE/EOG Austria Belgia Dania Finlandia Francja Irlandia
ANEKS I WYKAZ NAZW, POSTACI)FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCA W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie UE/EOG Austria Belgia Dania Finlandia Francja Irlandia
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 75/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 24 października 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 75/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 24 października 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Polskie doświadczenia kliniczne z bendamustyną
 Polskie doświadczenia kliniczne z bendamustyną Iwona Hus Klinika Hematoonkologii i Transplantacji Szpiku UM w Lublinie XXIII Zjazd PTHiT Wrocław 2009 Bendamustyna w leczeniu PBL monoterapia Efficacy of
Polskie doświadczenia kliniczne z bendamustyną Iwona Hus Klinika Hematoonkologii i Transplantacji Szpiku UM w Lublinie XXIII Zjazd PTHiT Wrocław 2009 Bendamustyna w leczeniu PBL monoterapia Efficacy of
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 171/2014 z dnia 7 lipca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 171/2014 z dnia 7 lipca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Wpływ nowych terapii na budżet NFZ czy stać nas na refundację?
 Wpływ nowych terapii na budżet NFZ czy stać nas na refundację? Leszek Stabrawa W A R S Z A W A, 1 1 s i e r p n i a 2 0 1 6 Dostęp do innowacyjnych terapii w Polsce o Jednym z celów ustawy refundacyjnej
Wpływ nowych terapii na budżet NFZ czy stać nas na refundację? Leszek Stabrawa W A R S Z A W A, 1 1 s i e r p n i a 2 0 1 6 Dostęp do innowacyjnych terapii w Polsce o Jednym z celów ustawy refundacyjnej
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego. Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa
 Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka
Załącznik B.14. LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka
Rada Przejrzystości. Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 207/2014 z dnia 1 września 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 207/2014 z dnia 1 września 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych
 Karolina Klara Radomska Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych Streszczenie Wstęp Ostre białaczki szpikowe (Acute Myeloid Leukemia, AML) to grupa nowotworów mieloidalnych,
Karolina Klara Radomska Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych Streszczenie Wstęp Ostre białaczki szpikowe (Acute Myeloid Leukemia, AML) to grupa nowotworów mieloidalnych,
Raport Biała Księga PBL
 Raport Biała Księga PBL 01 agenda 01 Informacje o raporcie 02 Fakty o chorobie 03 Sylwetka pacjenta 04 Standardy leczenia i diagnostyka 05 Wyzwania w opiece nad chorymi w Polsce 06 Wnioski 02 Informacje
Raport Biała Księga PBL 01 agenda 01 Informacje o raporcie 02 Fakty o chorobie 03 Sylwetka pacjenta 04 Standardy leczenia i diagnostyka 05 Wyzwania w opiece nad chorymi w Polsce 06 Wnioski 02 Informacje
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 246/2014 z dnia 24 listopada 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 246/2014 z dnia 24 listopada 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego
Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA
 Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA Co może być istotne w procesie tworzenia RSS? Magdalena Władysiuk Ustawa refundacyjna W krajach o średnim dochodzie RSSs są szansą na finansowanie
Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA Co może być istotne w procesie tworzenia RSS? Magdalena Władysiuk Ustawa refundacyjna W krajach o średnim dochodzie RSSs są szansą na finansowanie
W szpiczaku mnogim, nowotworze pewnego typu białych krwinek zwanych komórkami plazmatycznymi, Revlimid stosuje się:
 EMA/113870/2017 EMEA/H/C/000717 Streszczenie EPAR dla ogółu społeczeństwa lenalidomid Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/113870/2017 EMEA/H/C/000717 Streszczenie EPAR dla ogółu społeczeństwa lenalidomid Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 169/2013 z dnia 2 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 169/2013 z dnia 2 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
www.aotm.gov.pl Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 84/2013 z dnia 22 czerwca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Afinitor
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 84/2013 z dnia 22 czerwca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Afinitor
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 204/2014 z dnia 25 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 204/2014 z dnia 25 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 73/2012 z dnia 24 września 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 73/2012 z dnia 24 września 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 27/2012 z dnia 28 maja 2012 r. w sprawie zasadności usunięcia z wykazu świadczeń gwarantowanych realizowanych
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 27/2012 z dnia 28 maja 2012 r. w sprawie zasadności usunięcia z wykazu świadczeń gwarantowanych realizowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 127/2013 z dnia 8 lipca 2013 r. w sprawie zasadności finansowania leku Benlysta (belimumab) 120 mg, EAN 5909990881123
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 127/2013 z dnia 8 lipca 2013 r. w sprawie zasadności finansowania leku Benlysta (belimumab) 120 mg, EAN 5909990881123
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 79/2013 z dnia 1 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Esbriet
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 79/2013 z dnia 1 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Esbriet
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
ALLOPRZESZCZEPIENIE KRWIOTWÓRCZYCH KOMÓREK MACIERZYSTYCH w PRZEWLEKŁEJ BIAŁACZCE LIMFOCYTOWEJ w POLSCE ANKIETA WIELOOŚRODKOWA
 ALLOPRZESZCZEPIENIE KRWIOTWÓRCZYCH KOMÓREK MACIERZYSTYCH w PRZEWLEKŁEJ BIAŁACZCE LIMFOCYTOWEJ w POLSCE ANKIETA WIELOOŚRODKOWA Ośrodek koordynujący: Śląskiego Uniwersytetu Medycznego w Katowicach Kierownik
ALLOPRZESZCZEPIENIE KRWIOTWÓRCZYCH KOMÓREK MACIERZYSTYCH w PRZEWLEKŁEJ BIAŁACZCE LIMFOCYTOWEJ w POLSCE ANKIETA WIELOOŚRODKOWA Ośrodek koordynujący: Śląskiego Uniwersytetu Medycznego w Katowicach Kierownik
Problem zdrowotny. Opis wnioskowanego świadczenia. Alternatywna technologia medyczna. Skuteczność kliniczna
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 113/2014 z dnia 28 kwietnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 113/2014 z dnia 28 kwietnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 88/2013 z dnia 29 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Halaven
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 88/2013 z dnia 29 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Halaven
Simponi jest lekiem o działaniu przeciwzapalnym. Preparat stosuje się w leczeniu następujących chorób u osób dorosłych:
 EMA/411054/2015 EMEA/H/C/000992 Streszczenie EPAR dla ogółu społeczeństwa golimumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego produktu.
EMA/411054/2015 EMEA/H/C/000992 Streszczenie EPAR dla ogółu społeczeństwa golimumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego produktu.
FARMAKOTERAPIA STWARDNIENIA ROZSIANEGO TERAŹNIEJSZOŚĆ I PRZYSZŁOŚĆ
 FARMAKOTERAPIA STWARDNIENIA ROZSIANEGO TERAŹNIEJSZOŚĆ I PRZYSZŁOŚĆ Prof. dr hab. med. Halina Bartosik - Psujek Katedra i Klinika Neurologii Uniwersytet Medyczny w Lublinie LEKI I RZUTU PREPARATY INTERFERONU
FARMAKOTERAPIA STWARDNIENIA ROZSIANEGO TERAŹNIEJSZOŚĆ I PRZYSZŁOŚĆ Prof. dr hab. med. Halina Bartosik - Psujek Katedra i Klinika Neurologii Uniwersytet Medyczny w Lublinie LEKI I RZUTU PREPARATY INTERFERONU
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 42/2014 z dnia 28 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie bendamustyny w rozpoznaniu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 42/2014 z dnia 28 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie bendamustyny w rozpoznaniu
