Agencja Oceny Technologii Medycznych
|
|
|
- Julian Walczak
- 4 lat temu
- Przeglądów:
Transkrypt
1 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 27/2012 z dnia 28 maja 2012 r. w sprawie zasadności usunięcia z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej lub dokonania zmiany sposobu finansowania świadczenia opieki zdrowotnej Podanie rytuksymabu w leczeniu choroby Hodgkina Rada Przejrzystości uważa za niezasadne usunięcie z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej świadczenia opieki zdrowotnej Podanie rytuksymabu w leczeniu choroby Hodgkina. Uzasadnienie Rada Przejrzystości rekomenduje zostawienie dotychczasowej możliwości stosowania leku w ramach świadczeń gwarantowanych realizowanych w zakresie programu chemioterapii niestandardowej. Produkt leczniczy Mabthera (rytuksymab) jest przeciwciałem monoklonalnym, stosowanym od lat 14, z zarejestrowanymi wskazaniami do leczenia chłoniaków nieziarniczych (NHL), reumatoidalnego zapalenia stawów (RZS) oraz przewlekłej białaczki limfocytowej (PBL). Lek ten od 5-7 lat stosowany jest także w trybie off-label w leczeniu choroby Hodgkina. Z powodu małej liczby leczonych chorych kilka badań klinicznych III fazy ciągle trwa, ale przewiduje się ich zakończenie najpóźniej w okresie dwóch lat, co powinno ostatecznie rozwiązać terapeutyczny dylemat skuteczności i efektywności leku w chorobie Hodgkina. Rocznie w Polsce jest leczona bardzo niewielka, wybrana grupa chorych (najwyżej kilkunastu), a koszty refundacji kształtują się w granicach 1 miliona złotych rocznie. Zostawienie leku w ramach programu chemioterapii niestandardowej pozwoli na ewentualne leczenie wyselekcjonowanej i wąskiej grupy chorych, dla których z różnych przyczyn medycznych nie ma innej opcji terapeutycznej. Przedmiot zlecenia Zlecenie Ministra Zdrowia dotyczące przygotowania rekomendacji Prezesa AOTM w przedmiocie usunięcia z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej lub dokonania zmiany sposobu finansowania świadczenia opieki zdrowotnej podanie rytuksymabu w leczeniu choroby Hodgkina na zasadzie art. 31e ust. 2 ustawy z dnia 24 Agencja Oceny Technologii Medycznych ul. I. Krasickiego 26, Warszawa, tel fax sekretariat@aotm.gov.pl
2 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych ( Dz. U. z 2008 r. Nr 164, poz z późn. zm.), otrzymano pismem z dnia 5 grudnia 2011 r. (znak: MZ-PLA /GB/11). Termin realizacji zlecenia określono wówczas na 30 czerwca 2012 r. Dnia 9 stycznia 2012 r. otrzymano pismo Ministerstwa Zdrowia (znak: MZ-PLA /GB/12 z dnia ) z zapytaniem na temat stanu prac odnośnie określonego wyżej zlecenia. Pismem z dnia 16 stycznia 2012 r. (znak: AOTM-OT (4)/JC/2011) udzielono informacji o konieczności wstrzymania prac analitycznych z powodu dużej ilości zleceń o wyższej kategorii pilności. Minister Zdrowia pismem z dnia 5 marca 2012 (znak: MZ-PLA /GB/12) wyznaczył nowy termin realizacji zlecenia na koniec września 2012 r. Problem zdrowotny Chłoniak Hodgkina (HL) to grupa chorób nowotworowych tkanki limfoidalnej charakteryzujących się występowaniem komórek Reed i Sternberga oraz komórek Hodgkina, otoczonych komórkami odczynowymi, rozwojem głównie w obrębie węzłów chłonnych, tendencją do szerzenia się początkowo przez ciągłość na inne węzły chłonne, a w bardziej zaawansowanych stadiach drogą naczyń krwionośnych. Cechuje się wysoką wyleczalnością jest to choroba o dużej chemioi promieniowrażliwości. W Europie Zachodniej uzyskuje się ponad 80% 10-letnich przeżyć. W Polsce odnotowuje się ok. 800 nowych zachorowań rocznie, co stanowi 0,8% wszystkich nowotworów i ok. 25% chłoniaków. W ciągu ostatnich lat zapadalność w Polsce i na świecie utrzymuje się na stałym poziomie (2-3/ rocznie). W krajach rozwiniętych istnieją dwa szczyty zachorowań: w wieku oraz lat. Wskaźnik umieralności wynosi 1/ W przypadku zgonów w ostatnich latach w Polsce odnotowuje się tendencje spadkową od prawie 400 przypadków w roku 2000 do nieco ponad 200 w Zgodnie z obecną klasyfikacją WHO, wyróżnia się następujące typy HL: HL klasyczny (ang. classical HL chl): Stwardnienie guzkowe (ang. nodular sclerosis classical HL- NSCHL) Postać mieszana (ang. mixed cellularity classical HL - MCCHL) Z zanikiem limfocytów (ang. lymphocytic depletion classical HL - LDCHL) Bogaty w limfocyty (ang. lymphocyte-rich classical HL - LRCHL) HL nieklasyczny: Guzkowy z przewagą limfocytów (ang. nodular lymphocyte predominant HL - NLPHL) lub z przewagą limfocytów (ang. lymphocyte predominant HL - LPHL) Opis ocenianego świadczenia Grupa farmakoterapeutyczna oraz kod ATC: L01X C02, przeciwciało monoklonalne. Produkt leczniczy Mabthera (rytuksymab), to przeciwciało monoklonalne, które wiąże się swoiście z przezbłonowym antygenem CD20,nieglikozylowanąfosfoproteiną, występującą na limfocytach pre-b i na dojrzałych limfocytach B. Antygen ten po połączeniu z przeciwciałem nie podlega wprowadzeniu do komórki i nie jest uwalniany z jej powierzchni. CD20 nie występuje w postaci wolnej, krążącej w osoczu, co wyklucza kompetycyjne wiązanie przeciwciała. Domena Fab cząsteczki rytuksymabu wiąże się z antygenem CD20 na limfocytach B i poprzez domenę Fc uruchamia mechanizmy układu odpornościowego prowadzące do lizy komórek B. Wykazano także, że przyłączenie rytuksymabu do antygenu CD20 na limfocytach B indukuje śmierć komórki w drodze apoptozy. Produkt leczniczy Mabthera uzyskał pozwolenie na dopuszczenie do obrotu w ramach procedury centralnej w dniu 2 czerwca Pozwolenie na dopuszczenie do obrotu jest ważne na czas nieokreślony. 2/5
3 Wskazania rejestracyjne: chłoniaki nieziarnicze (NHL), reumatoidalne zapalenie stawów (RZS), przewlekła białaczka limfocytowa (PBL). Stosowanie Mabthery (rytuksymab) w leczeniu choroby Hodgkina nie jest zgodne z obecnie obowiązującym pozwoleniem na dopuszczenie do obrotu produktu leczniczego jest stosowany w trybie off-label. Alternatywne świadczenia Rytuksymabu w leczeniu choroby Hodgkina może być stosowany na różnych jej etapach (pacjenci nowozdiagnozowani lub po nawrocie) i w różnych schematach (monoterapia lub skojarzenie z chemioterapią, najczęściej z ABVD [adriamycyna, bleomycyna, winblastyna, dakarbazyna] oraz gemcytabiną). Interwencjami alternatywnymi dla Mabthery w rzeczywistej praktyce medycznej w rozpatrywanym wskazaniu może być: chemioterapia (głównie schematy ABVD oraz gemcytabina),radioterapia, immunoterapia inna niż rytuksymab (np. brentuximab vedotin dostępny w Polsce w ramach importu docelowego), autotransplantacja komórek krwiotwórczych, leczenie skojarzone w/w metodami oraz opieka paliatywna. Skuteczność kliniczna W wyniku przeprowadzonego wyszukiwania w bazach Pubmed, Embase, oraz The Cochrane Library nie znaleziono badań porównawczych III fazy z zastosowaniem rytuksymabu u chorych na chorobę Hodgkina. Odnaleziono jedynie 6 badań jednoramiennych II fazy i wobec braku dowodów wyższej jakości, analizę skuteczności klinicznej oparto na nich. Przy ocenie włączonych do analizy badań klinicznych należy jednak zwrócić uwagę na podstawowe ograniczenie, jakim jest fakt, że badania te są badaniami II fazy, nieporównawczymi, jednoramiennymi, a więc nie można na ich podstawie jednoznacznie zinterpretować efektywności klinicznej ocenianej interwencji w rozpatrywanym wskazaniu. Poza tym, w toku prowadzenia oceny dostępnych dowodów analitycy AOTM zidentyfikowali inne ich ograniczenia, m.in.: mało liczne populacje włączone do badań od kilkunastu do maksymalnie około 50 osób; brak definicji punktów końcowych w niektórych badaniach, np. Eichenauer 2011, lub definicje zgodne z International Workshop to Standardize Response Criteria for Non- Hodgkin s Lymphomas, zatem niedostosowane do oceny odpowiedzi leczenia chłoniaków Hodgkina, np. badanie Ekstrand 2003; dawka substancji leczniczej oraz schemat jej podawania niezoptymalizowane pod kątem leczenia chłoniaków Hodgkina; trudna do określenia homogeniczność włączonych do badań populacji np. w badaniu Eichenauer 2011 brak kryteriów wykluczenia; okres obserwacji w badaniach, szczególnie nad pacjentami wcześniej nieleczonymi lub nowozdiagnozowanymi, wydaje się zbyt krótki do przeprowadzenia oceny efektywności klinicznej, jeśli weźmie się pod uwagę długi, często kilkuletni lub nawet kilkudziesięcioletni przebieg choroby; informacje na temat bezpieczeństwa często przedstawione są w sposób skrótowy, część publikacji w ogóle nie podaje informacji na ten temat, np. badanie Younes 2003; We wszystkich włączonych do analizy badaniach wspólnymi i głównymi punktami końcowymi były odpowiedzi na leczenie ORR (ogólna odpowiedź na leczenie), CR (całkowita remisja), CRu (całkowita odpowiedź niepotwierdzona) oraz PR (częściowa odpowiedź/ remisja). Agregację wyników pomiarów tych parametrów, z podziałem na typ terapii, wskazaniem rozpoznania i etapu leczenia prezentuje tabela poniżej. 3/5
4 Tab. Odpowiedzi na leczenie uzyskiwane w poszczególnych badaniach ORR CR + CRu PR Monoterapia: Ekstrand 2003 (pacj. z LPHL wcześniej leczeni i 22/22 (100%) 10/22 (46%) 12/22 (54%) nieleczeni) Eichenauer 2011 (pacj. z LPHL nowozdiagnozowani w st. IA) 28/28 (100%) 24/28 (85,7%) 4/28 (14,3%) Rehwald 2003/Schulz 2008 tylko CR: 8/15 14/15 (93%) (pacj. z LPHL po min. 1 przebytej terapii) (53%) 6/15 (40%) Younes 2003 (pacj. z chl po min. 2 przebytych terapiach) Terapia skojarzona: Oki 2007 R + Gemcytabina (pacj. z chl po min. 2 przebytych terapiach) Kasamon 2012 R + ABVD (pacj. z chl nowozdiagnozowani w st. II- IV) Bezpieczeństwo stosowania 5/22 (23%) tylko CR: 1/22 (5%) 4/22 (18%) 16/33 (48%) 5/33 (15%) 11/33 (33%) 46/49 (94%) tylko CR: 39/49 (80%) 7/49 (14%) Autorzy opisów wyszukanych badań klinicznych zazwyczaj skrótowo odnosili się do bezpieczeństwa stosowanych terapii. Ponadto, dane przedstawione były często w sposób uniemożliwiający ich łączną ilościową agregacje. Na ich podstawie można przypuszczać, że profil bezpieczeństwa leku w tym typie chłoniaka nie odbiega znacząco od tego obserwowanego w innych schorzeniach, w których lek jest podawany zgodnie z ChPL. Zgodnie z aktualną ChPL, najczęstsze ciężkie działania niepożądane, jakie obserwowano u pacjentów cierpiących na chłoniaki nieziarnicze oraz przewlekłą białaczkę limfocytową po zastosowaniu rytuksymabu obejmują: reakcje w wyniku podania wlewu (ogólnie, objawy sugerujące działania niepożądane związane z wlewem odnotowano u ponad 50 % pacjentów uczestniczących w badaniach klinicznych), choroby infekcyjne, reaktywacja patogenów (ogólnie, powikłania infekcyjne występowały u ok % pacjentów podczas badań klinicznych) oraz zaburzenia kardiologiczne. Zgodnie z decyzją Komisji Europejskiej podmiot odpowiedzialny zobowiązany został do przeprowadzenia dodatkowych działań w zakresie nadzoru nad bezpieczeństwem stosowania Mabthery w odniesieniu do m.in. przypadków neutropenii, PML (postępująca leukoencefalopatia wieloogniskowa), PRES (zespół odwracalnej tylnej encefalopatii) oraz przedłużonego obniżenia poziomu komórek B, infekcji oraz reakcji na infuzję. Stosunek kosztów do uzyskiwanych efektów zdrowotnych W toku wyszukiwania dowodów naukowych nie odnaleziono publikacji oceniających pod względem ekonomicznym zastosowania ocenianej interwencji w rozpatrywanym wskazaniu. Wpływ na budżet płatnika publicznego Na podstawie dostępnych danych liczbowych z DGL NFZ obliczono, że leczenie w ramach TPZ Program leczenia w ramach świadczenia chemioterapii niestandardowej 12 pacjentów zakwalifikowanych do kodu ICD-10 C81 (wraz ze wszystkimi podpunktami) pochłonęło w roku tys. PLN, natomiast w roku 2011 w przypadku 6 pacjentów 574 tys. PLN. Bazując na dostępnych danych można założyć, że średnio 9 pacjentów było leczonych rocznie w ramach TPZ, a średnia wartość świadczeń wyniosła około 995 tys. PLN rocznie. Zatem można przypuszczać, że usunięcie świadczenia leczenie choroby Hodgkina przy wykorzystaniu produktu 4/5
5 leczniczego Mabthera (rutyksymab) z wykazu świadczeń gwarantowanych przyniesie oszczędność roczne ok. 1 miliona PLN dla budżetu płatnika. Należy przy tym pamiętać, że powyższe szacowania kosztów w rozpatrywanej sytuacji mogą być obciążone błędem ze względu na specyfikę zasad TPZ Program leczenia w ramach świadczenia chemioterapii niestandardowej możliwe jest, że terapia jednego pacjenta mogła być rozliczana w dwóch latach, nie jest wiadome także, na jakich etapach choroby, w jakich schematach lek był podawany i jakie były tego konsekwencje finansowe wykraczające poza rozpatrywany TPZ (np. pacjent przyjął rytuksymab zamiast innej interwencji). Ponadto, zgodnie z obowiązującymi zasadami raportowania przez świadczeniodawców do NFZ wykonanych świadczeń, podmioty te mogą wprowadzić zmiany w przekazane dane do 5 lat po ich sprawozdaniu. Rekomendacje innych instytucji dotyczące ocenianego świadczenia National Comprehensive Cancer Network (NCCN), 2012 Rytuksymab w monoterapii lub w skojarzeniu z chemioterapią jest rekomendowany w leczeniu pacjentów z LPHL (ang. Lymphocyte Predominant Hodgkin Lymphoma chłoniak Hodgkina z przewagą limfocytów) w stadium IB, IIB, III i IV choroby. Rytuksymab (±radioterapia) może być stosowany na wszystkich etapach leczenia LPHL, tj. zarówno w terapii inicjującej, jak i w leczeniu choroby nawrotowej. Dopuszczalne jest jego stosowanie w monoterapii lub w skojarzeniu z najczęściej stosowanymi schematami chemioterapii: ABVD (adriamycyna, bleomycyna, winblastyna, dakarbazyna); CHOP (cyklofosfamid, doksorubicyna, winkrystyna, prednizon); CVP (cyklofosfamid, tenipozyd, prednizon); EPOCH (cyklofosfamid, doksorubicyna, etopozyd, winkrystyna, prednizon). U pacjentów z LPHL, u których wcześniej stosowano rytuksymab w monoterapii, należy rozważyć podtrzymanie rytuksymabem przez okres 2 lat. Biorąc pod uwagę powyższe argumenty, Rada Przejrzystości przyjęła stanowisko jak na wstępie.... Tryb wydania stanowiska Stanowisko wydano na podstawie art. 31e ust. 2 ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych, z uwzględnieniem opracowania Agencji Oceny Technologii Medycznych Leczenie choroby Hodgkina przy wykorzystaniu produktu leczniczego MabThera (rytuksymab), AOTM-OT /2011, maj 2012 r. Inne wykorzystane źródła danych, oprócz wskazanych w ww. raporcie: 1. Opinia eksperta przedstawiona podczas posiedzenia RP w dniu r. 5/5
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 33/2012 z dnia 18 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany jego poziomu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 33/2012 z dnia 18 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany jego poziomu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 9/2012 z dnia 27 lutego 2012 w zakresie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie chłoniaków
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 9/2012 z dnia 27 lutego 2012 w zakresie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie chłoniaków
Agencja Oceny Technologii Medycznych
 Rekomendacja nr 19/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 28 maja 2012 r. w zakresie usunięcia lub zmiany sposobu finansowania świadczenia opieki zdrowotnej Podanie rytuksymabu w leczeniu
Rekomendacja nr 19/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 28 maja 2012 r. w zakresie usunięcia lub zmiany sposobu finansowania świadczenia opieki zdrowotnej Podanie rytuksymabu w leczeniu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 155/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 155/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 20/2014 z dnia 20 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie winorelbiny w rozpoznaniach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 20/2014 z dnia 20 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie winorelbiny w rozpoznaniach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 38/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 38/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych
 Rekomendacja nr 25/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 18 czerwca 2012 r. w sprawie usunięcia albo dokonania zmiany poziomu lub sposobu finansowania świadczenia opieki zdrowotnej:
Rekomendacja nr 25/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 18 czerwca 2012 r. w sprawie usunięcia albo dokonania zmiany poziomu lub sposobu finansowania świadczenia opieki zdrowotnej:
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Protokół nr 13/2012 z posiedzenia Rady Przejrzystości w dniu 28 maja 2012 roku w siedzibie Agencji Oceny Technologii Medycznych Członkowie Rady
Agencja Oceny Technologii Medycznych Rada Przejrzystości Protokół nr 13/2012 z posiedzenia Rady Przejrzystości w dniu 28 maja 2012 roku w siedzibie Agencji Oceny Technologii Medycznych Członkowie Rady
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych
 Rekomendacja nr 24/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 18 czerwca 2012 r. w sprawie usunięcia albo dokonania zmiany poziomu lub sposobu finansowania świadczenia opieki zdrowotnej:
Rekomendacja nr 24/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 18 czerwca 2012 r. w sprawie usunięcia albo dokonania zmiany poziomu lub sposobu finansowania świadczenia opieki zdrowotnej:
Leczenie choroby Hodgkina przy wykorzystaniu produktu leczniczego MabThera (rytuksymab)
 Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Leczenie choroby Hodgkina przy wykorzystaniu produktu leczniczego MabThera Raport ws. oceny świadczenia opieki zdrowotnej Raport
Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Leczenie choroby Hodgkina przy wykorzystaniu produktu leczniczego MabThera Raport ws. oceny świadczenia opieki zdrowotnej Raport
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 42/2014 z dnia 28 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie bendamustyny w rozpoznaniu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 42/2014 z dnia 28 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie bendamustyny w rozpoznaniu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 138/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 138/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 163/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 163/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 156/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 156/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Białaczka limfatyczna
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 150/2013 z dnia 5 sierpnia 2013 r. w sprawie oceny leku Adcetris (brentuksymab vedotin), EAN: 5909991004545 we
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 150/2013 z dnia 5 sierpnia 2013 r. w sprawie oceny leku Adcetris (brentuksymab vedotin), EAN: 5909991004545 we
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 162/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 162/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 76/2014 z dnia 25 lutego 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie interferonu-alfa-2a w
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 76/2014 z dnia 25 lutego 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie interferonu-alfa-2a w
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 268/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie nelarabiny w rozpoznaniach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 268/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie nelarabiny w rozpoznaniach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 7/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 27 lutego 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 7/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 27 lutego 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 154/2013 z dnia 28 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 154/2013 z dnia 28 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie?
 Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 234/2014 z dnia 3 listopada 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego MabThera
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 234/2014 z dnia 3 listopada 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego MabThera
BENDAMUSTINUM HYDROCHLORIDUM
 Dziennik Urzędowy Ministra Zdrowia 1499 Poz. 71 Załącznik C.67. BENDAMUSTINUM HYDROCHLORIDUM 1. BENDAMUSTINUM HYDROCHLORIDUM C81 2. BENDAMUSTINUM HYDROCHLORIDUM C81.0 3. BENDAMUSTINUM HYDROCHLORIDUM C81.1
Dziennik Urzędowy Ministra Zdrowia 1499 Poz. 71 Załącznik C.67. BENDAMUSTINUM HYDROCHLORIDUM 1. BENDAMUSTINUM HYDROCHLORIDUM C81 2. BENDAMUSTINUM HYDROCHLORIDUM C81.0 3. BENDAMUSTINUM HYDROCHLORIDUM C81.1
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 73/2012 z dnia 24 września 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 73/2012 z dnia 24 września 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Nowe możliwości leczenia ostrej białaczki limfoblastycznej
 Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 90/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania leku Primacor (chlorowodorek lerkanidypiny)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 90/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania leku Primacor (chlorowodorek lerkanidypiny)
Chłoniak Hodgkina. Agnieszka Szeremet Klinika Hematologii, Nowotworów Krwi, Transplantacji Szpiku Wrocław
 Chłoniak Hodgkina Agnieszka Szeremet Klinika Hematologii, Nowotworów Krwi, Transplantacji Szpiku Wrocław 2018-10-01 Hodgkin Lymphoma Agnieszka Szeremet Klinika Hematologii, Nowotworów Krwi, Transplantacji
Chłoniak Hodgkina Agnieszka Szeremet Klinika Hematologii, Nowotworów Krwi, Transplantacji Szpiku Wrocław 2018-10-01 Hodgkin Lymphoma Agnieszka Szeremet Klinika Hematologii, Nowotworów Krwi, Transplantacji
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 161/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 161/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 87/2014 z dnia 24 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 87/2014 z dnia 24 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
ostrym reumatoidalnym zapaleniem stawów (choroba powodująca stan zapalny stawów), gdzie produkt MabThera podaje się dożylnie z metotreksatem;
 EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 90/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 19 grudnia 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 90/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 19 grudnia 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
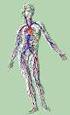
Rysunek. Układ limfatyczny.
 Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 191/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 191/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
NON-HODGKIN S LYMPHOMA
 NON-HODGKIN S LYMPHOMA Klinika Hematologii, Nowotworów Krwi i Transplantacji Szpiku We Wrocławiu Aleksandra Bogucka-Fedorczuk DEFINICJA Chłoniaki Non-Hodgkin (NHL) to heterogeniczna grupa nowotworów charakteryzująca
NON-HODGKIN S LYMPHOMA Klinika Hematologii, Nowotworów Krwi i Transplantacji Szpiku We Wrocławiu Aleksandra Bogucka-Fedorczuk DEFINICJA Chłoniaki Non-Hodgkin (NHL) to heterogeniczna grupa nowotworów charakteryzująca
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 136/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 136/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Nazwa programu: PROGRAM LECZENIA W RAMACH ŚWIADCZENIA CHEMIOTERAPII NIESTANDARDOWEJ
 Załącznik nr 38 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: PROGRAM LECZENIA W RAMACH ŚWIADCZENIA CHEMIOTERAPII NIESTANDARDOWEJ ZAKRES ŚWIADCZENIA GWARANTOWANEGO
Załącznik nr 38 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: PROGRAM LECZENIA W RAMACH ŚWIADCZENIA CHEMIOTERAPII NIESTANDARDOWEJ ZAKRES ŚWIADCZENIA GWARANTOWANEGO
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 15/2014 z dnia 20 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 15/2014 z dnia 20 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 182/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Mozobil
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 182/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Mozobil
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 18/2013 z dnia 28 stycznia 2013 r. w sprawie zasadności finansowania leku Myozyme (alglukozydaza alfa) w ramach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 18/2013 z dnia 28 stycznia 2013 r. w sprawie zasadności finansowania leku Myozyme (alglukozydaza alfa) w ramach
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 83/2012 z dnia 24 września 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych lub zmiany sposobu finansowania
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 83/2012 z dnia 24 września 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych lub zmiany sposobu finansowania
KARTA Nr /2010 REJESTRACJI ŚWIADCZENIOBIORCY DO UDZIAŁU W PROGRAMIE TERAPEUTYCZNYM (LEKOWYM) 11
 1 WZORY PISM I FORMULARZY 1. Wniosek o chemioterapię niestandardową... 3 2. Opinia konsultanta wojewódzkiego... 7 3. Formularz świadomej zgody na zastosowanie leku poza wskazaniami rejestracyjnymi 8 4.
1 WZORY PISM I FORMULARZY 1. Wniosek o chemioterapię niestandardową... 3 2. Opinia konsultanta wojewódzkiego... 7 3. Formularz świadomej zgody na zastosowanie leku poza wskazaniami rejestracyjnymi 8 4.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 204/2014 z dnia 25 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 204/2014 z dnia 25 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Wyzwania systemowe stojące przed hematologią onkologiczną w aspekcie starzejącego się społeczeństwa w Polsce
 Wyzwania systemowe stojące przed hematologią onkologiczną w aspekcie starzejącego się społeczeństwa w Polsce Dr n. med. Jakub Gierczyński, MBA Doradztwo i ekspertyzy Warszawa, 27.01.2016 Wykład odbywa
Wyzwania systemowe stojące przed hematologią onkologiczną w aspekcie starzejącego się społeczeństwa w Polsce Dr n. med. Jakub Gierczyński, MBA Doradztwo i ekspertyzy Warszawa, 27.01.2016 Wykład odbywa
Wsparcie merytoryczne i logistyczne niekomercyjnych badań klinicznych
 Wsparcie merytoryczne i logistyczne niekomercyjnych badań klinicznych Badanie kliniczne definicje badaniem klinicznym jest każde badanie prowadzone z udziałem ludzi w celu odkrycia lub potwierdzenia klinicznych,
Wsparcie merytoryczne i logistyczne niekomercyjnych badań klinicznych Badanie kliniczne definicje badaniem klinicznym jest każde badanie prowadzone z udziałem ludzi w celu odkrycia lub potwierdzenia klinicznych,
Rysunek. Układ limfatyczny.
 Informacja dotyczy chłoniaka grudkowego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu odpornościowego
Informacja dotyczy chłoniaka grudkowego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu odpornościowego
Chemioterapia niestandardowa
 Chemioterapia niestandardowa - Jak podjąć najlepszą decyzję w świetle obowiązujących przepisów? Przebieg procesu decyzyjnego płatnika na podstawie Dolnośląskiego Oddziału Wojewódzkiego NFZ Joanna Krzywkowska
Chemioterapia niestandardowa - Jak podjąć najlepszą decyzję w świetle obowiązujących przepisów? Przebieg procesu decyzyjnego płatnika na podstawie Dolnośląskiego Oddziału Wojewódzkiego NFZ Joanna Krzywkowska
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 114/2014 z dnia 28 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 114/2014 z dnia 28 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
INNOWACJE W LECZENIU RAKA NERKI- OCENA DOSTĘPNOŚCI W POLSCE. Prof. Cezary Szczylik Lek. Przemysław Langiewicz CSK WIM
 INNOWACJE W LECZENIU RAKA NERKI- OCENA DOSTĘPNOŚCI W POLSCE Prof. Cezary Szczylik Lek. Przemysław Langiewicz CSK WIM I/II linia leczenia rozsianego raka nerki Pazopanib - Produkt Votrient jest wskazany
INNOWACJE W LECZENIU RAKA NERKI- OCENA DOSTĘPNOŚCI W POLSCE Prof. Cezary Szczylik Lek. Przemysław Langiewicz CSK WIM I/II linia leczenia rozsianego raka nerki Pazopanib - Produkt Votrient jest wskazany
ANEKS I WYKAZ NAZW, POSTACI)FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCA W PAŃSTWACH CZŁONKOWSKICH
 ANEKS I WYKAZ NAZW, POSTACI)FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCA W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie UE/EOG Austria Belgia Dania Finlandia Francja Irlandia
ANEKS I WYKAZ NAZW, POSTACI)FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCA W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie UE/EOG Austria Belgia Dania Finlandia Francja Irlandia
Rada Przejrzystości. Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
Wydłużenie życia chorych z rakiem płuca - nowe możliwości
 Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 98/2012 z dnia 29 października 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 98/2012 z dnia 29 października 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu
Ulotka dołączona do opakowania: informacja dla użytkownika. Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 Nazwa programu: Terapeutyczne Programy Zdrowotne 2009 Załącznik nr 10 do zarządzenia Nr 98/2008/DGL Prezesa NFZ z dnia 27 października 2008 roku LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Nazwa programu: Terapeutyczne Programy Zdrowotne 2009 Załącznik nr 10 do zarządzenia Nr 98/2008/DGL Prezesa NFZ z dnia 27 października 2008 roku LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 130/2013 z dnia 22 lipca 2013 w sprawie oceny leku Afinitor (ewerolimus), tabletki, 5 mg, 30 tabl., kod EAN 5909990711567
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 130/2013 z dnia 22 lipca 2013 w sprawie oceny leku Afinitor (ewerolimus), tabletki, 5 mg, 30 tabl., kod EAN 5909990711567
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 95/2014 z dnia 24 marca 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie: ewerolimusu w rozpoznaniach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 95/2014 z dnia 24 marca 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie: ewerolimusu w rozpoznaniach
Warszawa, 16-17.03.201217.03.2012 PLRG / PALG 16-17.03.2012
 Przegląd badań klinicznych PLRG Konferencja PLRG i PALG Warszawa, 16-17.03.201217.03.2012 Janusz Szczepanik CRO Quantum Satis 1 Badania kliniczne PLRG PLRG R-CVP/CHOP (PLRG4) HOVON 68 CLL Watch and Wait
Przegląd badań klinicznych PLRG Konferencja PLRG i PALG Warszawa, 16-17.03.201217.03.2012 Janusz Szczepanik CRO Quantum Satis 1 Badania kliniczne PLRG PLRG R-CVP/CHOP (PLRG4) HOVON 68 CLL Watch and Wait
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 83/2014 z dnia 24 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 83/2014 z dnia 24 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Stanowisko Rady Przejrzystości nr 262/2013 z dnia 17 grudnia 2013 r. w sprawie oceny leku Perjeta (pertuzumab) we wskazaniu zaawansowanego raka piersi
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 262/2013 z dnia 17 grudnia 2013 r. w sprawie oceny leku Perjeta (pertuzumab) we wskazaniu zaawansowanego raka
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 262/2013 z dnia 17 grudnia 2013 r. w sprawie oceny leku Perjeta (pertuzumab) we wskazaniu zaawansowanego raka
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA
 ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 załącznik nr 10 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chloniak grudkowy C 83 chłoniaki nieziarniczy rozlane Dziedzina
załącznik nr 10 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chloniak grudkowy C 83 chłoniaki nieziarniczy rozlane Dziedzina
Forum Organizacji Pacjentów Onkologicznych. Problemy dostępu do leczenia
 Forum Organizacji Pacjentów Onkologicznych Problemy dostępu do leczenia Warszawa, 26 kwietnia 2012 1. CIĄGŁOŚĆ LECZENIA ONKOLOGICZNEGO 2. REGULACJA DOSTĘPU DO LECZENIA NA POZIOMIE ROZPORZĄDZEŃ/ZARZĄDZEŃ
Forum Organizacji Pacjentów Onkologicznych Problemy dostępu do leczenia Warszawa, 26 kwietnia 2012 1. CIĄGŁOŚĆ LECZENIA ONKOLOGICZNEGO 2. REGULACJA DOSTĘPU DO LECZENIA NA POZIOMIE ROZPORZĄDZEŃ/ZARZĄDZEŃ
Hematoonkologia w liczbach. Dr n med. Urszula Wojciechowska
 Hematoonkologia w liczbach Dr n med. Urszula Wojciechowska Nowotwory hematologiczne wg Międzynarodowej Statystycznej Klasyfikacji Chorób i Problemów Zdrowotnych (rew 10) C81 -Chłoniak Hodkina C82-C85+C96
Hematoonkologia w liczbach Dr n med. Urszula Wojciechowska Nowotwory hematologiczne wg Międzynarodowej Statystycznej Klasyfikacji Chorób i Problemów Zdrowotnych (rew 10) C81 -Chłoniak Hodkina C82-C85+C96
Innowacje w hematoonkologii ocena dostępności w Polsce
 Warszawa, 22 maja 2012 r. Seminarium edukacyjne pt.: Podsumowanie Seminarium 22 maja 2012 r. miało miejsce w Warszawie ósme z kolei seminarium Fundacji Watch Health Care pt.: " - ocena dostępności w Polsce".
Warszawa, 22 maja 2012 r. Seminarium edukacyjne pt.: Podsumowanie Seminarium 22 maja 2012 r. miało miejsce w Warszawie ósme z kolei seminarium Fundacji Watch Health Care pt.: " - ocena dostępności w Polsce".
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 5/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 23 stycznia 2012 r. w sprawie usunięcia świadczenia opieki zdrowotnej podanie
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 5/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 23 stycznia 2012 r. w sprawie usunięcia świadczenia opieki zdrowotnej podanie
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej. Szanowny Panie Marszałku,
 Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej Szanowny Panie Marszałku, w odpowiedzi na interpelację nr 9087 Posłów na Sejm RP: Krystyny Sibińskiej, Marii Janyska,
Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej Szanowny Panie Marszałku, w odpowiedzi na interpelację nr 9087 Posłów na Sejm RP: Krystyny Sibińskiej, Marii Janyska,
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH
 DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
Wpływ nowych terapii na budżet NFZ czy stać nas na refundację?
 Wpływ nowych terapii na budżet NFZ czy stać nas na refundację? Leszek Stabrawa W A R S Z A W A, 1 1 s i e r p n i a 2 0 1 6 Dostęp do innowacyjnych terapii w Polsce o Jednym z celów ustawy refundacyjnej
Wpływ nowych terapii na budżet NFZ czy stać nas na refundację? Leszek Stabrawa W A R S Z A W A, 1 1 s i e r p n i a 2 0 1 6 Dostęp do innowacyjnych terapii w Polsce o Jednym z celów ustawy refundacyjnej
czerniak (nowotwór skóry), który rozprzestrzenił się lub którego nie można usunąć chirurgicznie;
 EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 207/2014 z dnia 1 września 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 207/2014 z dnia 1 września 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
SYTUACJA PACJENTÓW HEMATOONKOLOGICZNYCH I ICH BLISKICH. Aleksandra Rudnicka Rzecznik PKPO
 SYTUACJA PACJENTÓW HEMATOONKOLOGICZNYCH I ICH BLISKICH Aleksandra Rudnicka Rzecznik PKPO Koalicja to wspólny głos ponad 100 tysięcy pacjentów onkologicznych! 44 organizacje wspólnie działają na rzecz chorych
SYTUACJA PACJENTÓW HEMATOONKOLOGICZNYCH I ICH BLISKICH Aleksandra Rudnicka Rzecznik PKPO Koalicja to wspólny głos ponad 100 tysięcy pacjentów onkologicznych! 44 organizacje wspólnie działają na rzecz chorych
Rola AOTM w procesie kształtowania dostępności do szczepień ochronnych
 Rola AOTM w procesie kształtowania dostępności do szczepień ochronnych experience makes the difference Robert Plisko Świadczenie gwarantowane Świadczenie gwarantowane - świadczenie opieki zdrowotnej finansowane
Rola AOTM w procesie kształtowania dostępności do szczepień ochronnych experience makes the difference Robert Plisko Świadczenie gwarantowane Świadczenie gwarantowane - świadczenie opieki zdrowotnej finansowane
Informacja dotyczy pozawęzłowego chłoniaka strefy brzeżnej systemu MALT (z komórek B), który jest odmianą złośliwego chłoniaka nieziarniczego.
 Chłoniak typu MALT pozawęzłowy chłoniak strefy brzeżnej systemu MALT (z komórek B) Informacja dotyczy pozawęzłowego chłoniaka strefy brzeżnej systemu MALT (z komórek B), który jest odmianą złośliwego chłoniaka
Chłoniak typu MALT pozawęzłowy chłoniak strefy brzeżnej systemu MALT (z komórek B) Informacja dotyczy pozawęzłowego chłoniaka strefy brzeżnej systemu MALT (z komórek B), który jest odmianą złośliwego chłoniaka
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 103/2014 z dnia 31 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 103/2014 z dnia 31 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 189/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 189/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Rada Przejrzystości. Agencja Oceny Technologii Medycznych. Uzasadnienie
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 171/2014 z dnia 9 czerwca 2014 r. w sprawie oceny leku Pentaxim (kod EAN: 5909990625260) we wskazaniach: zapobieganie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 171/2014 z dnia 9 czerwca 2014 r. w sprawie oceny leku Pentaxim (kod EAN: 5909990625260) we wskazaniach: zapobieganie
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Przewlekła białaczka
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Przewlekła białaczka
Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego.
 Chłoniak z komórek płaszcza Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego,
Chłoniak z komórek płaszcza Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 199/2014 z dnia 18 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 199/2014 z dnia 18 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Limfocyty powstają w szpiku kostnym, czyli tam gdzie powstają wszystkie komórki krwi. Występują
 Informacja dotyczy chłoniaka śródpiersia z dużych komórek B, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Informacja dotyczy chłoniaka śródpiersia z dużych komórek B, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 190/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 190/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA
 Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA Co może być istotne w procesie tworzenia RSS? Magdalena Władysiuk Ustawa refundacyjna W krajach o średnim dochodzie RSSs są szansą na finansowanie
Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA Co może być istotne w procesie tworzenia RSS? Magdalena Władysiuk Ustawa refundacyjna W krajach o średnim dochodzie RSSs są szansą na finansowanie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 110/2014 z dnia 28 kwietnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 110/2014 z dnia 28 kwietnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
