Pierwiastki bloku s 1. metale wyjątkowo reaktywne, silne reduktory, występują głównie w postaci związków chemicznych; 2. wraz ze wzrostem liczby
|
|
|
- Fabian Kulesza
- 8 lat temu
- Przeglądów:
Transkrypt
1 Pieriastki bloku s 1. etale yjątkoo reaktye, sile reduktory, ystępują głóie postaci ziązkó ceiczyc;. raz ze zroste liczby atooej zrasta zdolość do joizacji, która oże być yołaa czyikai ceiczyi reakcja ceicza), czyikai ieceiczyi proieioaie elektroagetycze lub ysoka teperatura); 3. stopień utleieia: litoce +1, beryloce +; 4. otrzyyaie poprzez elektrolizę stopioyc soli; 5. iskie gęstości, duże objętości oloe, duże proieie atooe; 6. litoce iskie teperatury topieia; beryloce zaczie yższe; 7. dobrze przeodzą prąd elektryczy i ciepło; 8. litoce: iękkie, koale i ciąglie, beryloce: bardziej kruce i tarde 9. raz ze zroste l.a. zrasta toksyczość; 10. Fr, Ra proieiotórcze; 11. Na, ajbardziej rozposzecioe przyrodzie; 1. bezpośredio reagują z P, s, Sb, clorocai; 13. torzą: odorki: X, X sile reduktory), tleki: X, X, adtleki: X, X, poadtleki: X, azotki: Li 3 N, X 3 N spalaie azocie) 14. reakcja z odą: azotki + Li/X) + N 3 X + X + X + X) + X + X +, X + X) + X + X, X + X) X + X +, X + X) + X + X X rozpuszczale odzie; X) rozpuszczalość rośie raz ze zroste l.a.; 16. sole: litocó rozpuszczale odzie yj. Cl 4 ); berylocó - ęglay, siarczay, croiay, szczaiay, fosforay, fluorki praie ierozpuszczale rozpuszczalość aleje raz ze zroste l.a.), pozostałe sole rozpuszczale; 17. zae ziązki kopleksoe 18. krystalizują
2 Pieriastki bloku p etale 1. zaczie iej aktye iż etale bloku s;. ajczęściej ystępują a dóc stopiac utleieia; iższy stopień utleieia łaściości redukujące, yższy stopień utleieia łaściości utleiające; 3. zrost l.a. zrost: gęstości, teperatura topieia i rzeia, łaściości etaliczyc; 4. ystępują etale o łaściościac afoteryczyc; 5. ogą torzyć ziązki kopleksoe Nieetale 1. ystępują postaci ziązkó ceiczyc i staie oly;. ystępują a kilku stopiac utleieia dodatic lub ujeyc, różyc staac skupieia, kilku odiaac alotropoyc; 3. łaściości utleiające; 4. raz ze zroste l.a. aleje zdolość do joizacji; 5. raz ze zroste r grupy zrasta aktyość; 6. fluoroce, tle, siarka, azot, fosfor stosukoo iskie teperatury topieia i rzeia, które zrastają raz ze zroste l.a. 7. C, Si, B kryształy koalecyje; 8. tleki o carakterze obojęty p. C, N) i kasoy które z torzą kasy tleoe; 9. fluoroce i tleoce torzą kasy beztleoe oc zrasta raz ze zroste l.a.); 10. z pieriastkai I gr torzą ziązki jooe, z pozostałyi koalecyje; Gazy szlacete 1. bezbare, jedoatooe gazy;. kofiguracja elektrooa: e 1s, Ne, r s p 6, r, Xe s p 6 d 10, R s p 6 d 10 f ysokie eergie joizacji; 4. torzeie ziązkó ceiczyc yaga:.i. aproieioaia UV,, struiei e -,
3 Sól ocego kasu i słabej zasady z z
4 Sól słabego kasu i ocej zasady k k
5 Pieriastki bloku d 1. etale;. kilka dodatic stopi utleieia; 3. praie szystkie to ciała stałe; 4. koale, ciąglie, torzą stopy; 5. zacza gęstość; 6. ysokie teperatury topieia i rzeia yj. Z, Cd, g, La, g) 7. dobra przeodość ciepla i prądu; 8. raz ze zroste l.a. aktyość aleje etale szlacete) 9. a iższy stopiu utleieia torzą ziązki o carakterze jooy, a yższy stopiu utleieia zrost udziału koalecyjego iązaiu; 10. łaściości kasoo-zasadoe, utleiająco-redukcyje zieiają się: a. iższy - łaściości zasadoe b. pośredi łaściości afoterycze c. yższy łaściości kasoe d. iższy - łaściości redukujące e. yższy łaściości utleiające 11. torzą ziązki kopleksoe:) Pieriastki bloku f 1. typoe etale;. lataoce głóie ystępują a +3 stopiu utleia, aktyoce od + do +4; 3. gałtoie reagują z oda i tlee przecoyae atosferze gazu obojętego); 4. iezbyt rozposzecioe skorupie zieskiej, ystępują postaci ierałó torzącyc złoża spóle, iektóre otrzyao sztuczie, które to ają łaściości proieiotórcze
opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktycze a zajęcia wyrówawcze z chemii dla studetów pierwszego roku kieruku zamawiaego żyieria Środowiska w ramach projektu Era iżyiera pewa lokata a przyszłość opracowała: mgr iż. Ewelia Nowak
Materiały dydaktycze a zajęcia wyrówawcze z chemii dla studetów pierwszego roku kieruku zamawiaego żyieria Środowiska w ramach projektu Era iżyiera pewa lokata a przyszłość opracowała: mgr iż. Ewelia Nowak
 Ś Ń ź Ś ź Ś Ś Ś Ś Ś Ś Ś Ą Ś Ż ż ż Ż ć ć ź ź ÓĆ ć Ż Ą ć Ż ż ć Ą Ł Ś Ń ć Ś Ą Ą ż Ż Ą ź Ą ź Ą ż Ś Ń Ł Ś Ś Ó Ą ż ż Ś Ń Ł Ś ż ź ź Ą ć ż ż ć ć ż ć ż Ą ż Ł ż ć ż ż Ż ż ż ż ć Ąć ż ż ż Ż Ż ż ż ć ż ć ż ż ż Ż ż ż
Ś Ń ź Ś ź Ś Ś Ś Ś Ś Ś Ś Ą Ś Ż ż ż Ż ć ć ź ź ÓĆ ć Ż Ą ć Ż ż ć Ą Ł Ś Ń ć Ś Ą Ą ż Ż Ą ź Ą ź Ą ż Ś Ń Ł Ś Ś Ó Ą ż ż Ś Ń Ł Ś ż ź ź Ą ć ż ż ć ć ż ć ż Ą ż Ł ż ć ż ż Ż ż ż ż ć Ąć ż ż ż Ż Ż ż ż ć ż ć ż ż ż Ż ż ż
Chemia nieorganiczna. Copyright 2000 by Harcourt, Inc. All rights reserved.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
VII Podkarpacki Konkurs Chemiczny 2014/2015
 II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
PIERWIASTKI W UKŁADZIE OKRESOWYM
 PIERWIASTKI W UKŁADZIE OKRESOWYM 1 Układ okresowy Co można odczytać z układu okresowego? - konfigurację elektronową - podział na bloki - podział na grupy i okresy - podział na metale i niemetale - trendy
PIERWIASTKI W UKŁADZIE OKRESOWYM 1 Układ okresowy Co można odczytać z układu okresowego? - konfigurację elektronową - podział na bloki - podział na grupy i okresy - podział na metale i niemetale - trendy
b) Podaj liczbę moli chloru cząsteczkowego, która całkowicie przereaguje z jednym molem glinu.
 Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
Powtórzenie wiadomości z kl. I
 Mariola Winiarczyk Zespół Szkolno-Gimnazjalny Rakoniewice Powtórzenie wiadomości z kl. I Na początku kl. I po kilku lekcjach przypominających materiał w każdej klasie przeprowadzam mini konkurs chemiczny.
Mariola Winiarczyk Zespół Szkolno-Gimnazjalny Rakoniewice Powtórzenie wiadomości z kl. I Na początku kl. I po kilku lekcjach przypominających materiał w każdej klasie przeprowadzam mini konkurs chemiczny.
Chemia nieorganiczna. Pierwiastki. niemetale Be. 27 Co. 28 Ni. 26 Fe. 29 Cu. 45 Rh. 44 Ru. 47 Ag. 46 Pd. 78 Pt. 76 Os.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by Harcourt,
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by Harcourt,
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I ... ... czas trwania: 90 min Nazwa szkoły
 V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
Fluorowce - chlor. -Ogólna charakterystyka fluorowców -Występowanie i właściwości chloru -Ważniejsze związki chloru
 Fluorowce - chlor -Ogólna charakterystyka fluorowców -Występowanie i właściwości chloru -Ważniejsze związki chloru Fluorowce Ogólna charakterystyka: fluor, chlor, brom i jod są niemetalami, astat jest
Fluorowce - chlor -Ogólna charakterystyka fluorowców -Występowanie i właściwości chloru -Ważniejsze związki chloru Fluorowce Ogólna charakterystyka: fluor, chlor, brom i jod są niemetalami, astat jest
II Etap rejonowy 28 styczeń 2019 r. Imię i nazwisko ucznia: Czas trwania: 60 minut
 XVI Wojewódzki Konkurs z Chemii dla uczniów klas trzecich gimnazjów oraz klas trzecich oddziałów gimnazjalnych prowadzonych w szkołach innego typu województwa świętokrzyskiego w roku szkolnym 2018/2019
XVI Wojewódzki Konkurs z Chemii dla uczniów klas trzecich gimnazjów oraz klas trzecich oddziałów gimnazjalnych prowadzonych w szkołach innego typu województwa świętokrzyskiego w roku szkolnym 2018/2019
PŁYNNE INHIBITORY KAMIENIA I KOROZJI - OTWARTE UKŁADY CHŁODNICZE
 03-236 Warszaa/Poland PŁYNNE INHIBITORY KAMIENIA I KOROZJI - OTWARTE UKŁADY CHŁODNICZE 1 2 101 102 na bazie fosfonianó (PO4-12%), cynku (4%), polimeró i inhibitora korozji miedzi. na bazie fosfonianó (PO4-7%),
03-236 Warszaa/Poland PŁYNNE INHIBITORY KAMIENIA I KOROZJI - OTWARTE UKŁADY CHŁODNICZE 1 2 101 102 na bazie fosfonianó (PO4-12%), cynku (4%), polimeró i inhibitora korozji miedzi. na bazie fosfonianó (PO4-7%),
ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII
 ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII Zadanie 1. Na rysunku przedstawiono fragment układu okresowego pierwiastków. Dokoocz zdania tak aby były prawdziwe. Wiązanie jonowe występuje w związku chemicznym
ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII Zadanie 1. Na rysunku przedstawiono fragment układu okresowego pierwiastków. Dokoocz zdania tak aby były prawdziwe. Wiązanie jonowe występuje w związku chemicznym
Konwersatorium 1. Zagadnienia na konwersatorium
 Konwersatorium 1 Zagadnienia na konwersatorium 1. Omów reguły zapełniania powłok elektronowych. 2. Podaj konfiguracje elektronowe dla atomów Cu, Ag, Au, Pd, Pt, Cr, Mo, W. 3. Wyjaśnij dlaczego występują
Konwersatorium 1 Zagadnienia na konwersatorium 1. Omów reguły zapełniania powłok elektronowych. 2. Podaj konfiguracje elektronowe dla atomów Cu, Ag, Au, Pd, Pt, Cr, Mo, W. 3. Wyjaśnij dlaczego występują
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
Krystalografia. Typowe struktury pierwiastków i związków chemicznych
 Krystalografia Typowe struktury pierwiastków i związków chemicznych Wiązania w kryształach jonowe silne, bezkierunkowe kowalencyjne silne, kierunkowe metaliczne słabe lub silne, bezkierunkowe van der Waalsa
Krystalografia Typowe struktury pierwiastków i związków chemicznych Wiązania w kryształach jonowe silne, bezkierunkowe kowalencyjne silne, kierunkowe metaliczne słabe lub silne, bezkierunkowe van der Waalsa
Podstawowe pojęcia i prawa chemiczne
 Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Źródła światła w AAS. Seminarium Analityczne MS Spektrum Zakopane Jacek Sowiński MS Spektrum
 Źródła światła w AAS Seminarium Analityczne MS Spektrum Zakopane 2013 Jacek Sowiński MS Spektrum js@msspektrum.pl www.msspektrum.pl Lampy HCL Standardowa Super-Lampa 3V 10V specyf. Lampy HCL 1,5 cala
Źródła światła w AAS Seminarium Analityczne MS Spektrum Zakopane 2013 Jacek Sowiński MS Spektrum js@msspektrum.pl www.msspektrum.pl Lampy HCL Standardowa Super-Lampa 3V 10V specyf. Lampy HCL 1,5 cala
Tlen. Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki
 Tlen Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki Ogólna charakterystyka tlenowców Tlenowce: obejmują pierwiastki
Tlen Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki Ogólna charakterystyka tlenowców Tlenowce: obejmują pierwiastki
Moduł: Chemia. Fundamenty. Liczba godzin. Nr rozdziału Tytuł. Temat lekcji. Rozdział 1. Przewodnik po chemii (12 godzin)
 Rozkład materiału z chemii w klasie II LO zakres rozszerzony Chemia. Fundamenty. Krzysztof Pazdro, wyd. Oficyna Edukacyjna Krzysztof Pazdro Sp. z o.o.. nr dopuszczenia 565//0 Chemia. i związki nieorganiczne.
Rozkład materiału z chemii w klasie II LO zakres rozszerzony Chemia. Fundamenty. Krzysztof Pazdro, wyd. Oficyna Edukacyjna Krzysztof Pazdro Sp. z o.o.. nr dopuszczenia 565//0 Chemia. i związki nieorganiczne.
Reakcje utleniania i redukcji
 Reakcje utleniania i redukcji Reguły ustalania stopni utlenienia 1. Pierwiastki w stanie wolnym (nie związane z atomem (atomami) innego pierwiastka ma stopień utlenienia równy (zero) 0 ; 0 Cu; 0 H 2 ;
Reakcje utleniania i redukcji Reguły ustalania stopni utlenienia 1. Pierwiastki w stanie wolnym (nie związane z atomem (atomami) innego pierwiastka ma stopień utlenienia równy (zero) 0 ; 0 Cu; 0 H 2 ;
Jednostki Ukadu SI. Jednostki uzupełniające używane w układzie SI Kąt płaski radian rad Kąt bryłowy steradian sr
 Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
Układ termodynamiczny
 Uład terodynaiczny Uład terodynaiczny to ciało lub zbiór rozważanych ciał, w tóry obo wszelich innych zjawis (echanicznych, eletrycznych, agnetycznych itd.) uwzględniay zjawisa cieplne. Stan uładu charateryzuje
Uład terodynaiczny Uład terodynaiczny to ciało lub zbiór rozważanych ciał, w tóry obo wszelich innych zjawis (echanicznych, eletrycznych, agnetycznych itd.) uwzględniay zjawisa cieplne. Stan uładu charateryzuje
Zn + S ZnS Utleniacz:... Reduktor:...
 Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2010/2011
 Kuratorium Oświaty w Lublinie Kod ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2010/2011 ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
Kuratorium Oświaty w Lublinie Kod ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2010/2011 ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
litowce -Występowanie i otrzymywanie potasu -Właściwości fizyczne i chemiczne potasu -Ważniejsze związki potasu
 Litowce potas i pozostałe litowce -Występowanie i otrzymywanie potasu -Właściwości fizyczne i chemiczne potasu -Ważniejsze związki potasu Występowanie potasu i otrzymywanie Występowanie: występuje wyłącznie
Litowce potas i pozostałe litowce -Występowanie i otrzymywanie potasu -Właściwości fizyczne i chemiczne potasu -Ważniejsze związki potasu Występowanie potasu i otrzymywanie Występowanie: występuje wyłącznie
Elektrochemia - prawa elektrolizy Faraday a. Zadania
 Elektrochemia - prawa elektrolizy Faraday a Zadania I prawo Faraday a Masa substancji wydzielonej na elektrodach podczas elektrolizy jest proporcjonalna do natężenia prądu i czasu trwania elektrolizy q
Elektrochemia - prawa elektrolizy Faraday a Zadania I prawo Faraday a Masa substancji wydzielonej na elektrodach podczas elektrolizy jest proporcjonalna do natężenia prądu i czasu trwania elektrolizy q
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
HP 125 + HP-COO ; Piec na zużyty olej 25-33 kw + Rekuperator powietrza/spaliny. HITON HP 125 Piec na zużyty olej 25-33 kw
 Inforacje o produkcie torzono 17-06-2016 P 125 + P-COO ; Piec na zużyty oej 25-33 kw + ekupator poietrza/spainy Cena : 4.629,00 zł (netto: 3.763,41 zł) Cena proocyjna : 4.429,00 zł (netto: 3.600,81 zł)
Inforacje o produkcie torzono 17-06-2016 P 125 + P-COO ; Piec na zużyty oej 25-33 kw + ekupator poietrza/spainy Cena : 4.629,00 zł (netto: 3.763,41 zł) Cena proocyjna : 4.429,00 zł (netto: 3.600,81 zł)
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. Przedmiot chemii Orbital, typy orbitali Związki wodoru z innym pierwiastkami
 1. Przedmiot chemii Orbital, typy orbitali Związki wodoru z innym pierwiastkami 2. Stechiometria. Prawa stechiometrii Roztwory buforowe Węglowce - budowa elektronowa. Ogólna charakterystyka 3. Mikro- i
1. Przedmiot chemii Orbital, typy orbitali Związki wodoru z innym pierwiastkami 2. Stechiometria. Prawa stechiometrii Roztwory buforowe Węglowce - budowa elektronowa. Ogólna charakterystyka 3. Mikro- i
Układ okresowy. Przewidywania teorii kwantowej
 Przewidywania teorii kwantowej Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
Przewidywania teorii kwantowej Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
Chemia nieorganiczna. Pierwiastki. niemetale Be. 27 Co. 28 Ni. 26 Fe. 29 Cu. 45 Rh. 44 Ru. 47 Ag. 46 Pd. 78 Pt. 76 Os.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by arcourt,
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by arcourt,
Pierwiastek: Na - Sód Stan skupienia: stały Liczba atomowa: 11
 ***Dane Pierwiastków Chemicznych*** - Układ Okresowy Pierwiastków 2.5.1.FREE Pierwiastek: H - Wodór Liczba atomowa: 1 Masa atomowa: 1.00794 Elektroujemność: 2.1 Gęstość: [g/cm sześcienny]: 0.0899 Temperatura
***Dane Pierwiastków Chemicznych*** - Układ Okresowy Pierwiastków 2.5.1.FREE Pierwiastek: H - Wodór Liczba atomowa: 1 Masa atomowa: 1.00794 Elektroujemność: 2.1 Gęstość: [g/cm sześcienny]: 0.0899 Temperatura
CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego
 CIEPŁO, PALIWA, SPALANIE CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego WYMIANA CIEPŁA. Zmiana energii wewnętrznej
CIEPŁO, PALIWA, SPALANIE CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego WYMIANA CIEPŁA. Zmiana energii wewnętrznej
S100 Przekładnik prądowy niskonapięciowy
 S100 Przekładnik prądowy niskonapięciowy Norma EC 60044-1/IEC 869-2 Temperatura pracy -25/ C Temperatura magazynowania -50/ C od 600A do 3000A 0 2,5 2,5 15 15 0 3, 3, 15 20 20 kl. dokł. 1000 (cl) 0.2s
S100 Przekładnik prądowy niskonapięciowy Norma EC 60044-1/IEC 869-2 Temperatura pracy -25/ C Temperatura magazynowania -50/ C od 600A do 3000A 0 2,5 2,5 15 15 0 3, 3, 15 20 20 kl. dokł. 1000 (cl) 0.2s
uczeń opanował wszystkie wymagania podstawowe i ponadpodstawowe
 1 Agnieszka Wróbel nauczyciel biologii i chemii Plan pracy dydaktycznej na chemii w klasach pierwszych w roku szkolnym 2015/2016 Poziom wymagań Ocena Opis wymagań podstawowe niedostateczna uczeń nie opanował
1 Agnieszka Wróbel nauczyciel biologii i chemii Plan pracy dydaktycznej na chemii w klasach pierwszych w roku szkolnym 2015/2016 Poziom wymagań Ocena Opis wymagań podstawowe niedostateczna uczeń nie opanował
CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego
 CIEPŁO, PALIWA, SPALANIE CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego WYMIANA CIEPŁA. Zmiana energii wewnętrznej
CIEPŁO, PALIWA, SPALANIE CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego WYMIANA CIEPŁA. Zmiana energii wewnętrznej
KLIMATYZACJA KOMFORTU - SINCLAIR AKTUALIZACJA 2013/2014
 KLIMATYZACJA KOMFORTU - SINCLAIR AKTUALIZACJA 2013/2014 1 KLIMATyZAToRy ŚCIENNE SPLIT 3 SERIA ELEMENT ŁAŚCIOŚCI Klasa energetyczna A/A Sprężarka japońskiej jakości 3-letnia gwarancja Ekologiczny i wydajny
KLIMATYZACJA KOMFORTU - SINCLAIR AKTUALIZACJA 2013/2014 1 KLIMATyZAToRy ŚCIENNE SPLIT 3 SERIA ELEMENT ŁAŚCIOŚCI Klasa energetyczna A/A Sprężarka japońskiej jakości 3-letnia gwarancja Ekologiczny i wydajny
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.
![Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.](/thumbs/100/143872318.jpg) Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2014/2015 ETAP REJONOWY
 Wpisuje uczeń po otrzymaniu zadań Czas pracy: Kod ucznia 90 minut Imię Wpisać po rozkodowaniu pracy Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2014/2015 ETAP REJONOWY Informacje: Uzyskane
Wpisuje uczeń po otrzymaniu zadań Czas pracy: Kod ucznia 90 minut Imię Wpisać po rozkodowaniu pracy Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2014/2015 ETAP REJONOWY Informacje: Uzyskane
WYPEŁNIA KOMISJA KONKURSOWA
 WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
Metale i niemetale. Krystyna Sitko
 Metale i niemetale Krystyna Sitko Substancje proste czyli pierwiastki dzielimy na : metale np. złoto niemetale np. fosfor półmetale np. krzem Spośród 115 znanych obecnie pierwiastków aż 91 stanowią metale
Metale i niemetale Krystyna Sitko Substancje proste czyli pierwiastki dzielimy na : metale np. złoto niemetale np. fosfor półmetale np. krzem Spośród 115 znanych obecnie pierwiastków aż 91 stanowią metale
Zad. 1. Proces przebiega zgodnie z równaniem: CaO + 3 C = CaC 2 + CO. M(CaC 2 ) = 64 g/mol
 Zad. 1 Proces przebiega zgodnie z równaniem: CaO + 3 C = CaC 2 + CO M(CaC 2 ) = 64 g/mol czyli ΔH = ΔH tw o (CaC 2 ) + ΔH tw o (CO) - ΔH tw o (CaO) - ΔH tw o (C) ΔH tw o (C) przyjmujemy za równą 0 Nie
Zad. 1 Proces przebiega zgodnie z równaniem: CaO + 3 C = CaC 2 + CO M(CaC 2 ) = 64 g/mol czyli ΔH = ΔH tw o (CaC 2 ) + ΔH tw o (CO) - ΔH tw o (CaO) - ΔH tw o (C) ΔH tw o (C) przyjmujemy za równą 0 Nie
Chemia nieorganiczna Semestr I (1 )
 1/ 5 Chemia Budowlana Chemia nieorganiczna Semestr I (1 ) Osoba odpowiedzialna za przedmiot: dr hab. inż. Jarosław Chojnacki. 2/ 5 Wykład 1. Pochodzenie i rozpowszechnienie pierwiastków we wszechświecie
1/ 5 Chemia Budowlana Chemia nieorganiczna Semestr I (1 ) Osoba odpowiedzialna za przedmiot: dr hab. inż. Jarosław Chojnacki. 2/ 5 Wykład 1. Pochodzenie i rozpowszechnienie pierwiastków we wszechświecie
I. Substancje i ich przemiany
 NaCoBeZU z chemii dla klasy 1 I. Substancje i ich przemiany 1. Pracownia chemiczna podstawowe szkło i sprzęt laboratoryjny. Przepisy BHP i regulamin pracowni chemicznej zaliczam chemię do nauk przyrodniczych
NaCoBeZU z chemii dla klasy 1 I. Substancje i ich przemiany 1. Pracownia chemiczna podstawowe szkło i sprzęt laboratoryjny. Przepisy BHP i regulamin pracowni chemicznej zaliczam chemię do nauk przyrodniczych
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Wojewódzki Konkurs Wiedzy Chemicznej dla uczniów klas maturalnych organizowany przez ZDCh UJ Etap I, zadania
 Zadanie I. [16 punktów] W zadaniach od 1 5 jedna odpowiedź jest poprawna. Zad. 1. Który z podanych pierwiastków ma najniższą pierwszą energię jonizacji (czyli minimalną energię potrzebną do oderwania elektronu
Zadanie I. [16 punktów] W zadaniach od 1 5 jedna odpowiedź jest poprawna. Zad. 1. Który z podanych pierwiastków ma najniższą pierwszą energię jonizacji (czyli minimalną energię potrzebną do oderwania elektronu
Przemiany substancji
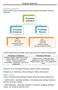 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
I LICEUM OGÓLNOKSZTAŁCCE Inowrocław 21 maja 2005 Im. Jana Kasprowicza INOWROCŁAW ROK SZKOLNY 2004/2005
 IMI I NAZWISKO Wzór odpowiedzi PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCCE Inowrocław 21 aja 2005 I. Jana Kasprowicza INOWROCŁAW ROK SZKOLNY 2004/2005 ZADANIE 1. ( 10 pkt.
IMI I NAZWISKO Wzór odpowiedzi PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCCE Inowrocław 21 aja 2005 I. Jana Kasprowicza INOWROCŁAW ROK SZKOLNY 2004/2005 ZADANIE 1. ( 10 pkt.
Najbardziej rozpowszechniony pierwiastek we Wszechświecie, Stanowi główny składnik budujący gwiazdy,
 Położenie pierwiastka w UKŁADZIE OKRESOWYM Nazwa Nazwa łacińska Symbol Liczba atomowa 1 Wodór Hydrogenium Masa atomowa 1,00794 Temperatura topnienia -259,2 C Temperatura wrzenia -252,2 C Gęstość H 0,08988
Położenie pierwiastka w UKŁADZIE OKRESOWYM Nazwa Nazwa łacińska Symbol Liczba atomowa 1 Wodór Hydrogenium Masa atomowa 1,00794 Temperatura topnienia -259,2 C Temperatura wrzenia -252,2 C Gęstość H 0,08988
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
b) Pierwiastek E tworzy tlenek o wzorze EO 2 i wodorek typu EH 4, a elektrony w jego atomie rozmieszczone są na dwóch powłokach elektronowych
 1. Ustal jakich trzech różnych pierwiastków dotyczą podane informacje. Zapisz ich symbole a) W przestrzeni wokółjądrowej dwuujemnego jonu tego pierwiastka znajduje się 18 e. b) Pierwiastek E tworzy tlenek
1. Ustal jakich trzech różnych pierwiastków dotyczą podane informacje. Zapisz ich symbole a) W przestrzeni wokółjądrowej dwuujemnego jonu tego pierwiastka znajduje się 18 e. b) Pierwiastek E tworzy tlenek
Fizyka Procesów Klimatycznych Wykład 1
 Fizyka Procesów Klimatycznych Wykład 1 prof. dr hab. Szymon Malinowski Instytut Geofizyki, Wydział Fizyki Uniwersytet Warszawski malina@igf.fuw.edu.pl dr hab. Krzysztof Markowicz Instytut Geofizyki, Wydział
Fizyka Procesów Klimatycznych Wykład 1 prof. dr hab. Szymon Malinowski Instytut Geofizyki, Wydział Fizyki Uniwersytet Warszawski malina@igf.fuw.edu.pl dr hab. Krzysztof Markowicz Instytut Geofizyki, Wydział
Chemiczne metody analizy ilościowej (laboratorium)
 Cheicze etody aalizy ilościowej (laboratoriu) Broiaoetria 9. Przygotowaie iaowaego roztworu broiau (V) potasu Broia(V) potasu ależy do stosowaych w aalizie cheiczej substacji podstawowych. oże być otrzyay
Cheicze etody aalizy ilościowej (laboratoriu) Broiaoetria 9. Przygotowaie iaowaego roztworu broiau (V) potasu Broia(V) potasu ależy do stosowaych w aalizie cheiczej substacji podstawowych. oże być otrzyay
0 ( 1 ) Q = Q T W + Q W + Q P C + Q P R + Q K T + Q G K + Q D M =
 M O D E L O W A N I E I N Y N I E R S K I E n r 4 7, I S S N 1 8 9 6-7 7 1 X O P T Y M A L I Z A C J A K O N S T R U K C J I F O R M Y W T R Y S K O W E J P O D K Ą T E M E F E K T Y W N O C I C H O D
M O D E L O W A N I E I N Y N I E R S K I E n r 4 7, I S S N 1 8 9 6-7 7 1 X O P T Y M A L I Z A C J A K O N S T R U K C J I F O R M Y W T R Y S K O W E J P O D K Ą T E M E F E K T Y W N O C I C H O D
KONKURS PRZEDMIOTOWY Z CHEMII
 Pieczęć KONKURS PRZEDMIOTOWY Z CHEMII dla uczniów gimnazjów województwa lubuskiego 26 stycznia 2012 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem
Pieczęć KONKURS PRZEDMIOTOWY Z CHEMII dla uczniów gimnazjów województwa lubuskiego 26 stycznia 2012 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem
Powietrze i inne gazy. Powietrze jest jednorodną mieszaniną gazów. Mieszanina ta nie posiada barwy, smaku ani zapachu.
 Składniki powietrza Powietrze jest jednorodną mieszaniną gazów. Mieszanina ta nie posiada barwy, smaku ani zapachu. Doświadczenie nr 1 Temat: Badanie składników powietrza. Schemat doświadczenia: Obserwacje:
Składniki powietrza Powietrze jest jednorodną mieszaniną gazów. Mieszanina ta nie posiada barwy, smaku ani zapachu. Doświadczenie nr 1 Temat: Badanie składników powietrza. Schemat doświadczenia: Obserwacje:
1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych.
 Tematy opisowe 1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych. 2. Dlaczego do kadłubów statków, doków, falochronów i filarów mostów przymocowuje się płyty z
Tematy opisowe 1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych. 2. Dlaczego do kadłubów statków, doków, falochronów i filarów mostów przymocowuje się płyty z
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje rejonowe II stopień
 POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
Zadanie 4. Mrówczan metylu ma taki sam wzór sumaryczny jak: A. octan etylu. C. kwas mrówkowy. B. octan metylu. D. kwas octowy.
 Pieczęć KONKURS CHEMICZNY dla uczniów gimnazjów województwa lubuskiego 3 marca 2011 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie Konkursu Chemicznego. Przed przystąpieniem do rozwiązywania
Pieczęć KONKURS CHEMICZNY dla uczniów gimnazjów województwa lubuskiego 3 marca 2011 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie Konkursu Chemicznego. Przed przystąpieniem do rozwiązywania
KLUCZ PUNKTOWANIA ODPOWIEDZI
 Egzain aturalny aj 009 FIZYKA I ASTRONOMIA POZIOM PODSTAWOWY KLUCZ PUNKTOWANIA ODPOWIEDZI Zadanie 1. Wyznaczenie wartości prędkości i przyspieszenia ciała wykorzystując równanie ruchu. Wartość prędkości
Egzain aturalny aj 009 FIZYKA I ASTRONOMIA POZIOM PODSTAWOWY KLUCZ PUNKTOWANIA ODPOWIEDZI Zadanie 1. Wyznaczenie wartości prędkości i przyspieszenia ciała wykorzystując równanie ruchu. Wartość prędkości
WOJEWÓDZKI KONKURS FIZYCZNY stopień rejonowy
 KOD UCZNIA Białystok 08.02.2007r. WOJEWÓDZKI KONKURS FIZYCZNY stopień rejonowy Młody Fizyku! Przed Tobą stopień rejonowy Wojewódzkiego Konkursu Fizycznego. Masz do rozwiązania 15 zadań zakniętych i 3 otwarte.
KOD UCZNIA Białystok 08.02.2007r. WOJEWÓDZKI KONKURS FIZYCZNY stopień rejonowy Młody Fizyku! Przed Tobą stopień rejonowy Wojewódzkiego Konkursu Fizycznego. Masz do rozwiązania 15 zadań zakniętych i 3 otwarte.
Procentowa zawartość sodu (w molu tej soli są dwa mole sodu) wynosi:
 Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Inne koncepcje wiązań chemicznych. 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań?
 Inne koncepcje wiązań chemicznych 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie.
Inne koncepcje wiązań chemicznych 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie.
Imię i nazwisko Klasa Punkty (max 12) Ocena
 Rozdział 1. grupa A Imię i nazwisko Klasa Punkty (max 12) Ocena Data Zadanie 1. (1 pkt) Podkreśl właściwości dotyczące ditlenku węgla: gaz, rozpuszczalny w wodzie, bezbarwny, palny, żółty, powoduje zmętnienia
Rozdział 1. grupa A Imię i nazwisko Klasa Punkty (max 12) Ocena Data Zadanie 1. (1 pkt) Podkreśl właściwości dotyczące ditlenku węgla: gaz, rozpuszczalny w wodzie, bezbarwny, palny, żółty, powoduje zmętnienia
Zadanie 2. (0 1) W tabeli podano rodzaje mieszanin oraz wybrane sposoby ich rozdzielania. Rodzaj mieszaniny Metoda rozdzielania mieszaniny
 Zadanie 1. (0 1) Uczniowie obserwowali przebieg doświadczenia, w którym do kolby z wrzącą wodą wprowadzono płonący magnez nad powierzchnię cieczy. Doświadczenie zilustrowali rysunkiem. W czasie doświadczenia
Zadanie 1. (0 1) Uczniowie obserwowali przebieg doświadczenia, w którym do kolby z wrzącą wodą wprowadzono płonący magnez nad powierzchnię cieczy. Doświadczenie zilustrowali rysunkiem. W czasie doświadczenia
XV Wojewódzki Konkurs z Chemii
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
Chemia Grudzień Styczeń
 Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
PRAWO OKRESOWOŚCI. 1.131. Liczba co najmniej częściowo obsadzonych powłok elektronowych decyduje o przynależności pierwiastka
 PRAWO OKRESOWOŚCI 1.125. D. Mendelejew sformułował swoje prawo w następujący sposób: Właściwości fizyczne i chemiczne pierwiastków zmieniają się okresowo w zależności od A) liczby protonów w jądrze atomowym.
PRAWO OKRESOWOŚCI 1.125. D. Mendelejew sformułował swoje prawo w następujący sposób: Właściwości fizyczne i chemiczne pierwiastków zmieniają się okresowo w zależności od A) liczby protonów w jądrze atomowym.
Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.
![Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów. Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.](/thumbs/97/131732752.jpg) 2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
Czas zajęć: 1 godzina z 2 przeznaczonych na temat w rozkładzie materiału;
 Anna Chielewska Krzysztofik Nauczyciel cheii Zespół Szkół Mechanicznych w Lublinie Lublin, dn. 11.01.2005 Scenariusz zajęć edukacyjnych z cheii opracowany dla klasy 1At Techniku Mechanicznego na podstawie
Anna Chielewska Krzysztofik Nauczyciel cheii Zespół Szkół Mechanicznych w Lublinie Lublin, dn. 11.01.2005 Scenariusz zajęć edukacyjnych z cheii opracowany dla klasy 1At Techniku Mechanicznego na podstawie
Anna Grych Test z budowy atomu i wiązań chemicznych
 Anna Grych Test z budowy atomu i wiązań chemicznych 1. Uzupełnij tabelkę wpisując odpowiednie dane: Nazwa atomu Liczba nukleonów protonów neutronów elektronów X -... 4 2 Y -... 88 138 Z -... 238 92 W -...
Anna Grych Test z budowy atomu i wiązań chemicznych 1. Uzupełnij tabelkę wpisując odpowiednie dane: Nazwa atomu Liczba nukleonów protonów neutronów elektronów X -... 4 2 Y -... 88 138 Z -... 238 92 W -...
Grupa 1. Nazwa substancji organicznej, która uległa spaleniu. Doświadczenie. Imię i nazwisko ucznia:
 Starachowice, dn. 5.04.008 r. Grupa Czas trwania konkursu 90 min Imię i nazwisko ucznia: Zadanie. ( pkt) Analiza moczu może dostarczyć wielu danych o stanie zdrowia człowieka. Prawidłowy wynik analizy:
Starachowice, dn. 5.04.008 r. Grupa Czas trwania konkursu 90 min Imię i nazwisko ucznia: Zadanie. ( pkt) Analiza moczu może dostarczyć wielu danych o stanie zdrowia człowieka. Prawidłowy wynik analizy:
V OGÓLNOPOLSKI KONKURS Z FIZYKI Fizyka się liczy I Etap ZADANIA 27 lutego 2013r.
 V OGÓLNOPOLSKI KONKURS Z FIZYKI Fizka się licz I Etap ZDNI 7 lutego 3r.. Dwa pociski wstrzeloo jeocześie w tę saą stroę z wóch puktów oległch o o. Pierwsz pocisk wstrzeloo z prękością o po kąte α. Z jaką
V OGÓLNOPOLSKI KONKURS Z FIZYKI Fizka się licz I Etap ZDNI 7 lutego 3r.. Dwa pociski wstrzeloo jeocześie w tę saą stroę z wóch puktów oległch o o. Pierwsz pocisk wstrzeloo z prękością o po kąte α. Z jaką
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1008
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1008 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 1 sierpnia 2018 r. Nazwa i adres: AB 1008
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1008 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 1 sierpnia 2018 r. Nazwa i adres: AB 1008
Dobór materiałów konstrukcyjnych cz. 2
 Dobór materiałów konstrukcyjnych cz. 2 dr inż. Hanna Smoleńska Katedra Inżynierii Materiałowej i Spajania Wydział Mechaniczny, Politechnika Gdańska Materiały edukacyjne Własności materiałów brane pod uwagę
Dobór materiałów konstrukcyjnych cz. 2 dr inż. Hanna Smoleńska Katedra Inżynierii Materiałowej i Spajania Wydział Mechaniczny, Politechnika Gdańska Materiały edukacyjne Własności materiałów brane pod uwagę
CZ STECZKA. Do opisu wi za chemicznych stosuje si najcz ciej jedn z dwóch metod (teorii): metoda wi za walencyjnych (VB)
 CZ STECZKA Stanislao Cannizzaro (1826-1910) cz stki - elementy mikro wiata, termin obejmuj cy zarówno cz stki elementarne, jak i atomy, jony proste i zło one, cz steczki, rodniki, cz stki koloidowe; cz
CZ STECZKA Stanislao Cannizzaro (1826-1910) cz stki - elementy mikro wiata, termin obejmuj cy zarówno cz stki elementarne, jak i atomy, jony proste i zło one, cz steczki, rodniki, cz stki koloidowe; cz
dr Dariusz Wyrzykowski ćwiczenia rachunkowe semestr I
 Podstawowe prawa i pojęcia chemiczne. Fizyczne prawa gazowe. Zad. 1. Ile cząsteczek wody znajduje się w 0,12 mola uwodnionego azotanu(v) ceru Ce(NO 3 ) 2 6H 2 O? Zad. 2. W wyniku reakcji 40,12 g rtęci
Podstawowe prawa i pojęcia chemiczne. Fizyczne prawa gazowe. Zad. 1. Ile cząsteczek wody znajduje się w 0,12 mola uwodnionego azotanu(v) ceru Ce(NO 3 ) 2 6H 2 O? Zad. 2. W wyniku reakcji 40,12 g rtęci
Wiązania. w świetle teorii kwantów fenomenologicznie
 Wiązania w świetle teorii kwantów fenomenologicznie Wiązania Teoria kwantowa: zwiększenie gęstości prawdopodobieństwa znalezienia elektronów w przestrzeni pomiędzy atomami c a a c b b Liniowa kombinacja
Wiązania w świetle teorii kwantów fenomenologicznie Wiązania Teoria kwantowa: zwiększenie gęstości prawdopodobieństwa znalezienia elektronów w przestrzeni pomiędzy atomami c a a c b b Liniowa kombinacja
Zadania dodatkowe z konwersatorium z podstaw chemii Semestr letni, rok akademicki 2012/2013
 Zadania dodatkowe z konwersatorium z podstaw chemii Semestr letni, rok akademicki 2012/2013 Gazy. Jednostki ciśnienia. Podstawowe prawa gazowe 1. Jakie ciśnienie będzie panowało w oponie napompowanej w
Zadania dodatkowe z konwersatorium z podstaw chemii Semestr letni, rok akademicki 2012/2013 Gazy. Jednostki ciśnienia. Podstawowe prawa gazowe 1. Jakie ciśnienie będzie panowało w oponie napompowanej w
Nazwy pierwiastków: A +Fe 2(SO 4) 3. Wzory związków: A B D. Równania reakcji:
 Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
Warszawski Konkurs Chemiczny KWAS Etap II Warszawski
 Warszawa dnia 8 maja 2010r. Warszawski Konkurs Chemiczny KWAS Etap II Warszawski Kod ucznia: Zadanie 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 Maksymalna ilość punktów Liczba punktów
Warszawa dnia 8 maja 2010r. Warszawski Konkurs Chemiczny KWAS Etap II Warszawski Kod ucznia: Zadanie 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 Maksymalna ilość punktów Liczba punktów
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap rejonowy rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap rejonowy rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
Zagadnienia. Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I
 Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
W podanych ni ej przykładach zapisu przebiegu reakcji chemicznej zaznacz reduktor i utleniacz oraz proces redukcji i utleniania.
 Zadania na ocen celujàcà Grupa a W podanych ni ej przykładach zapisu przebieu reakcji chemicznej zaznacz reduktor i utleniacz oraz proces redukcji i utleniania. tlenek elaza(ii) + w iel elazo + tlenek
Zadania na ocen celujàcà Grupa a W podanych ni ej przykładach zapisu przebieu reakcji chemicznej zaznacz reduktor i utleniacz oraz proces redukcji i utleniania. tlenek elaza(ii) + w iel elazo + tlenek
Laboratorum teledetekcji. Sensory akustyczne. płk dr hab. inż. Mateusz Pasternak
 Laboratorum teledetekcji Sensory akustyczne płk dr hab. inż. Mateusz Pasternak 22 683 76 67 mpasternak@wat.edu.pl http://mpasternak.wel.wat.edu.pl/ najprostsze źródła dźwięku minimalne długości fal -10
Laboratorum teledetekcji Sensory akustyczne płk dr hab. inż. Mateusz Pasternak 22 683 76 67 mpasternak@wat.edu.pl http://mpasternak.wel.wat.edu.pl/ najprostsze źródła dźwięku minimalne długości fal -10
KONKURS CHEMICZNY ROK PRZED MATURĄ
 WYDZIAŁ CHEMII UMCS POLSKIE TOWARZYSTWO CHEMICZNE ODDZIAŁ LUBELSKI DORADCA METODYCZNY DS. NAUCZANIA CHEMII W LUBLINIE LUBELSKIE SAMORZĄDOWE CENTRUM DOSKONALENIA NAUCZYCIELI ODDZIAŁ W ZAMOŚCIU KONKURS CHEMICZNY
WYDZIAŁ CHEMII UMCS POLSKIE TOWARZYSTWO CHEMICZNE ODDZIAŁ LUBELSKI DORADCA METODYCZNY DS. NAUCZANIA CHEMII W LUBLINIE LUBELSKIE SAMORZĄDOWE CENTRUM DOSKONALENIA NAUCZYCIELI ODDZIAŁ W ZAMOŚCIU KONKURS CHEMICZNY
Zadanie 9. (3 pkt) Ułóż równania reakcji, za pomocą których można dokonać następujących przemian: P 4 P 4 O 6 P 4 O 10 H 3 PO 4
 Grupa Czas trwania konkursu 90 min Imię i nazwisko ucznia: Zadanie. ( pkt) Analiza moczu może dostarczyć wielu danych o stanie zdrowia człowieka. Prawidłowy wynik analizy: barwa żółta odczyn kwaśny białko
Grupa Czas trwania konkursu 90 min Imię i nazwisko ucznia: Zadanie. ( pkt) Analiza moczu może dostarczyć wielu danych o stanie zdrowia człowieka. Prawidłowy wynik analizy: barwa żółta odczyn kwaśny białko
Zjawiska zachodzące w roztworach. Równowagi jonowe w wodnych roztworach elektrolitów. Rozpuszczanie. Rozpuszczanie w wyniku reakcji chemicznej
 Zjawiska zachodzące w roztworach rozpuszczaie dyfuzja osoza dysocjacja hydratacja hydroliza Rówowagi joowe w wodych roztworach elektrolitów dysocjacja elektrolitów stała i stopień dysocjacji prawo rozcieńczeń
Zjawiska zachodzące w roztworach rozpuszczaie dyfuzja osoza dysocjacja hydratacja hydroliza Rówowagi joowe w wodych roztworach elektrolitów dysocjacja elektrolitów stała i stopień dysocjacji prawo rozcieńczeń
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1028
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1028 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 7 Data wydania: 28 stycznia 2015 r. Nazwa i adres OPA-ROW
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1028 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 7 Data wydania: 28 stycznia 2015 r. Nazwa i adres OPA-ROW
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
E Z m c N m c Mc A Z N. J¹dro atomowe Wielkoœci charakteryzuj¹ce j¹dro atomowe. Neutron
 J¹dro atomowe Wielkoœci charakteryzuj¹ce j¹dro atomowe liczba masowa Zliczba porz¹dkowa pierwiastka w uk³adzie okresowym - liczba eutroów Z X Z R 3 3 /, 3 cm eutro Schemat rozpadu swobodego eutrou p e
J¹dro atomowe Wielkoœci charakteryzuj¹ce j¹dro atomowe liczba masowa Zliczba porz¹dkowa pierwiastka w uk³adzie okresowym - liczba eutroów Z X Z R 3 3 /, 3 cm eutro Schemat rozpadu swobodego eutrou p e
WOJEWÓDZKI KONKURS CHEMICZNY
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 3 STYCZNIA 2019 R. 1. Test konkursowy zawiera 12 zadań. Są to zadania zamknięte i
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 3 STYCZNIA 2019 R. 1. Test konkursowy zawiera 12 zadań. Są to zadania zamknięte i
Piotr Kosztołowicz. Powtórka przed maturą. Chemia. Zadania. Zakres rozszerzony
 Piotr Kosztołowicz Zakres rozszerzony Chemia Powtórka przed maturą Zadania 95 Spis treści Wstęp Rozdział 1. Budowa atomów Rozdział 2. Przemiany jądrowe Rozdział 3. Struktura elektronowa atomu Rozdział
Piotr Kosztołowicz Zakres rozszerzony Chemia Powtórka przed maturą Zadania 95 Spis treści Wstęp Rozdział 1. Budowa atomów Rozdział 2. Przemiany jądrowe Rozdział 3. Struktura elektronowa atomu Rozdział
Wrocław dn. 22 listopada 2005 roku. Temat lekcji: Elektroliza roztworów wodnych.
 Piotr Chojnacki IV rok, informatyka chemiczna Liceum Ogólnokształcące Nr I we Wrocławiu Wrocław dn. 22 listopada 2005 roku Temat lekcji: Elektroliza roztworów wodnych. Cel ogólny lekcji: Wprowadzenie pojęcia
Piotr Chojnacki IV rok, informatyka chemiczna Liceum Ogólnokształcące Nr I we Wrocławiu Wrocław dn. 22 listopada 2005 roku Temat lekcji: Elektroliza roztworów wodnych. Cel ogólny lekcji: Wprowadzenie pojęcia
CHEMIA NIEORGANICZNA
 AKADEMIA GÓRNICZO HUTNICZA WYDZIAŁ ENERGETYKI I PALIW I r. EiP (Technologia Chemiczna) CHEMIA NIEORGANICZNA Prof. dr hab. Leszek CZEPIRSKI Wykład (W) - 28h (egzamin) Ćwiczenia audytoryjne (ĆW) - ( 28h
AKADEMIA GÓRNICZO HUTNICZA WYDZIAŁ ENERGETYKI I PALIW I r. EiP (Technologia Chemiczna) CHEMIA NIEORGANICZNA Prof. dr hab. Leszek CZEPIRSKI Wykład (W) - 28h (egzamin) Ćwiczenia audytoryjne (ĆW) - ( 28h

