Empress 2. Stomatol. Współcz., 2007, 14, Chiche G. J., Pinault A.: Esthetics of anterior fixed prosthodontics, Quintessence 1994.
|
|
|
- Ludwik Makowski
- 9 lat temu
- Przeglądów:
Transkrypt
1 Cementowanie adhezyjne 12. Borczyk D.: Współczesne systemy pełnoceramiczne i ich wykorzystanie w codziennej praktyce. Mag. Stomatol., 2005, 5, Chang J. C., Hart D. A., Estey A. W., Chan J. T.: Tensile bond strengths of five luting agents to two CAD-CAM restorative materials and enamel. J. Prosthet. Dent., 2003, 90, Piwowarczyk A., Lauer H. C., Sorensen J. A.: Microleakage of various cementing agents for full cast crowns. Dental Materials 2005, 21, Ahmad I.: Nowe systemy adhezyjne w stomatologii. Mag. Stomatol. Estet., 2006, 1, Soederholm K. J.: Historia systemów wiążących z zębiną. Cosmetic Dentistry 2005, 2, Van Meerbeek B., De munck J., Yoshida Y., Inoue S., Vargas M., Vijay P., Van Landuyt K., Lambrechts P., Vanherle G.: Adhezja do szkliwa i zębiny stan aktualny oraz zadania na przyszłość część I. Magazyn Stomatologii Estetycznej 2006, 2, Peumans M., Van Meerbeek B., Lambrechts P., Vanherle G. Porcelain veneers: a review of the literature. J. Dentis. 2000, 28, Zadroga K., Kamiński W., Warda P., Szczyrek P.: Adhezyjne cementowanie licówek ceramicznych badanie absorpcji mocy promieniowania lampy polimeryzacyjnej przez próbki materiału ceramicznego Empress 2. Stomatol. Współcz., 2007, 14, Chiche G. J., Pinault A.: Esthetics of anterior fixed prosthodontics, Quintessence Zaakceptowano do druku: 17.VII.2008 r. Adres autorów: Warszawa, ul. Nowogrodzka 59. Zarząd Główny PTS PROTETYKA STOMATOLOGICZNA, 2009, LIX, 1 25
2 PROTET. STOMATOL., 2009, LIX, 1, Ocena poziomu ph chemicznych środków retrakcyjnych* Evaluation of ph levels in gingival retraction agents Danuta Nowakowska¹, Zbigniew Raszewski² ¹Z Zakładu Materiałoznawstwa p.o. kierownik: dr n. med. D. Nowakowska Z Katedry Protetyki Stomatologicznej AM we Wrocławiu Kierownik: dr hab. n. med. H. Panek, prof. nadzw. ²Z firmy Zhermapol Dental Materials Prezes: dr n. farm. W. M. Zabojszcz HASŁA INDEKSOWE: retrakcja dziąsła, chemiczne czynniki retrakcyjne, zakres ph KEY WORDS: gingival retraction, chemical retraction agents, ph level Streszczenie Cel pracy. Określenie zakresu ph środków chemicznych używanych ex tempore podczas zabiegu retrakcji dziąsła brzeżnego. Materiał i metody. Badaniu poddano 13 leków retrakcyjnych, a wśród nich 10 roztworów i 3 żele. Ze względu na działanie farmakologiczne 4 z nich należą do adrenergików (klasa 1), a 9 do astringentów (klasa 2). Zbadano 1 lek α i β-adrenergiczny Injec. Adrenalini 0,1% oraz 3 nie stomatologiczne α-adrenergiki Visine classic, Afrin i Neosynephrin-POS ). Z klasy astringentów retrakcyjnych oceniono 6 roztworów: Gingiva Liquid, Alustin, Orbat, Racestypine roztwór, Orbat Sensitive i Astringedent oraz 3 żele: Racècord gel, Gel cord i ViscoStat. Zakres ph zmierzono za pomocą elektronicznego ph-metru Elmetron. Badania wykonano dwukrotnie pobierając po 1 ml badanego środka z 2 opakowań tej samej serii wyrobów, a następnie obliczono wartości średnie. Roztworem kontrolnym był 0,9% NaCl. Wyniki. Ustalono, że zakres ph leków należących do grupy 1 (roztwory retrakcyjne) był szeroki i wynosił średnio od 1,83 do 6,85, natomiast w grupie 3 (żele Summary Aim of the study. To determine and evaluate the ph level in chemical agents used ex tempore in gingival retraction procedures. Material and methods. Thirteen retraction agents were examined in this study (10 solutions and 3 gels). Pharmacologically, four of them belong to the group of adrenergics (Class 1), and 9 to astringents (Class 2). The test was also performed on each α- and β-adrenergic agents Injec, Adrenaline 0.1% and three non-dental α-adrenergics (Visine classic, Afrin and Neosynephrin-POS ). Five following solutions of retraction astringent Class 2: Gingiva Liquid, Alustin, Orbat, Racestypine solution, Orbat Sensitive and Astringedent (group 1), and three gels: Racècord gel, Gel cord and ViscoStat (group 2), were evaluated. The ph level was determined with use of Elmetron electronic ph-meter. The tests were performed twice on each retraction agent by using 1 ml of the medicament from two packages of the same manufacture series. Mean values were calculated for each retraction agent. Solution of 0.9% NaCl served as control. Results. The study revealed that the ph-level range *Praca wygłoszona podczas XXVI Międzynarodowej Konferencji Sekcji Protetyki PTS, Wrocław-Książ, 2-4 października 2008 roku. 26
3 Środki retrakcyjne retrakcyjne) wahał się od 1,65 do 3,47. W klasie 1 (adrenergiki) najniższy poziom, ph=3,62, wykazała 0,1% adrenalina (α i β-adrenergik), a najwyższy, ph=6,85, osiągnął chlorowodorek tetryzoliny Visine classic (α-adrenergik). Natomiast w klasie 2 (astringenty) zakres poziomu ph był węższy i wynosił od 1,83 (Astringedent ) do 3,25 (Orbat sensitive). Wśród żeli retrakcyjnych, najniższy poziom ph wykazał ViscoStat (ph=1,6) a najwyższy Gel cord (ph=3,5). Stwierdzono, że leki należące do klasy 1 adrenergików charakteryzują się wyższym poziomem wartości ph niż leki należące do klasy 2 astringentów. Wnioski. Sugeruje się, że ze względu na zdrowie i bezpieczeństwo tkanek dziąsła brzeżnego i zębów, należy wybierać preparaty retrakcyjne z klasy 1 (adrenegiki), których ph jest zbliżone do obojętnego. in the group 1 retraction agents (retraction solutions) was relatively wide (from 1.83 to 6.85 on average), while the ph-level in group 2 (retraction gels) ranged between 1.65 and In Class 1 (adrenergics), 0.1% adrenaline (α and β-adrenergics) proved to have the lowest level of ph equal to The highest level in this Class (ph = 6.85) was registered for 0.05% tetryzoline HCl Visine classic (α-adrenergic). Astringents of Class 2 exhibited a lower level of ph and ranged from 1.83 for Astringedent to 3.25 for Orbat sensitive. Among retraction gels, the lowest ph level was noted for ViscoStat (ph = 1.6) and the highest for Gel cord (ph = 3.5). The study allows to conclude that chemical retraction agents of adrenergics (Class 1) exhibit higher ph values than agents of astringents (Class 2). Conclusion. The results of the study suggest that in terms of health and safety of gingival margin and teeth tissues, chemical retraction medicaments of Class 1 (adrenergics) with ph level close to neutral should be preferred. Wprowadzenie Zachowanie zdrowia i zapobieganie jatrogennym uszkodzeniom tkanek przyzębia i zębów stanowi podstawowy warunek optymalnej strategii retrakcji dziąsła brzeżnego. Zabieg ten jest powszechnie wykonywany klinicznie we wszystkich specjalnościach współczesnej stomatologii. Badania ankietowe wykazały, że najczęściej wybieranym sposobem jego realizacji jest metoda mechaniczno-chemiczna, która oprócz materiału, wymaga zastosowania leku retrakcyjnego (1, 2, 3, 4, 5, 6, 7, 8). Zarówno materiał, głównie nici retrakcyjne, jak i środek chemiczny pozostają w bezpośrednim kontakcie z tkankami dziąsła brzeżnego oraz opracowanymi strukturami zębów. Czas tego kontaktu wynosi od kilkunastu sekund do kilkunastu minut, co udowodniono badając kliniczne nawyki lekarzy stomatologów (9, 10). Zależy on od specyficznych potrzeb leczenia stomatologicznego, od indywidualnych preferencji lekarza, a także może być kojarzony z chemicznym oddziaływaniem użytego leku, którego zadaniem jest przejściowe zmniejszenie objętości tkanek dziąsła brzeżnego oraz eliminowanie wilgotności w rowku dziąsłowym. Można to osiągnąć przez ograniczenie przepływu krwi w drobnych naczyniach krwionośnych przyzębia w efekcie ich skurczu albo w wyniku precypitacji protein osoczowych i tkankowych. Do lekarza należy wybór odpowiedniego leku, w czym pomocna może być zaproponowana własna klasyfikacja środków chemicznych używanych in situ (11). Zależnie od działania farmakologicznego tych środków wprowadzono klasę 1, zawierającą leki kurczące naczynia krwionośne (podklasy: α i β-adrenergiki oraz α-adrenergiki) oraz klasę 2, obejmującą astringenty (podklasy: chlorki glinu oraz siarczany glinu i żelaza). Natomiast biorąc pod uwagę formę kliniczną preparatu podzielono je na 5 grup: grupę 1 obejmującą roztwory retrakcyjne (ang. GRF gingival retraction fluid) aplikowane ex tempore lub stosowane fabrycznie do impregnacji materiałów retrakcyjnych (grupa 2), grupę 3 żele retrakcyjne, a pozostałe grupy 4 i 5 obejmują inne postacie preparatów retrakcyjnych (11). Wszystkie te środki zawierają różne substancje chemiczne czynne i pomocnicze, z czym związany jest przedział odczynu kwasowo-zasadowego, który ma istotny wpływ na zdrowie przyzębia brzeżnego i stan mechanicznie opracowanych struktur zębów w czasie i po zabiegu retrakcji dziąsła (11, 12, 13, 14, 15, 16, 17). PROTETYKA STOMATOLOGICZNA, 2009, LIX, 1 27
4 D. Nowakowska, Z. Raszewski Cel pracy Celem pracy jest określenie zakresu ph środków chemicznych używanych ex tempore podczas retrakcji dziąsła brzeżnego. Materiał i metody Badaniu poddano 13 leków retrakcyjnych zalecanych do stosowania bezpośrednio na tkanki dziąsła brzeżnego, a wśród nich 10 roztworów i 3 żele. Ze względu na działanie farmakologiczne 4 z nich należą do adrenergików (klasa 1), a 9 do astringentów (klasa 2). Spośród środków kurczących naczynia krwionośne badano 1 lek α i β adrenergiczny Injec. Adrenalini 0,1% oraz 3 nie stomatologiczne α-adrenergiki zalecane do retrakcji dziąsła Visine classic, Afrin i Neosynephrin-POS ). Z klasy astringentów retrakcyjnych, do badań wybrano 5 roztworów: 4 zawierające chlorek glinu (Gingiva Liquid, Alustin, Orbat i Racestypine roztwór), 1 siarczan glinu (Orbat Sensitive) i 1 siarczan żelaza (Astringedent ) oraz 3 żele: preparaty na bazie chlorku glinu (Racècord gel), siarczanu glinu (Gel cord) i siarczanu żelaza (ViscoStat ). Zestawienie zawartości głównych i pomocniczych substancji czynnych wymienionych leków przedstawiono w tabelach I i II. T a b e l a I. Skład badanych roztworów retrakcyjnych stosowanych ex tempore (grupa 1 wg własnej klasyfikacji) Preparat Wytwórca Nr serii Główny składnik Substancje pomocnicze Injec. Adrenalini 0,1% Polfa 03BL0807 Visine classic* Pfizer Afrin * Neosynephrin POS 10%* Schering Plough Ursapharm APMB ,1% chlorowodorek adrenaliny 0,05% chlorowodorek tetryzoliny 0,05% chlorowodorek oxymetazoliny 10% chlorowodorek fenylefryny Gingiva Liquid Roeko % chlorek glinu Woda Alustin Chema % chlorek glinu Woda Racestypine roztwór Septodont % chlorek glinu Orbat Sensitive Lege artis % siarczan glinu Woda Astringedent Ultradent B ,5% siarczan żelaza Woda *Preparaty nie stomatologiczne polecane do retrakcji dziąsła brzeżnego. Woda, stabilizatory Chlorek sodu, kwas borowy, wersenian dwusodowy, chlorek benzalkoniowy, boran sodu, woda Dwuwodny dwuwodorofosforan sodu, wersenian dwusodowy, chlorek benzalkoniowy, glikol propylenowy, wodorotlenek sodu, kwas solny, soda oczyszczona, woda Chlorek bezalkoniowy, wersenian dwusodowy, woda Oksychinol, podłoże wodno-alkoholowe T a b e l a I I. Skład badanych żeli retrakcyjnych (grupa 3 wg własnej klasyfikacji) Preparat Wytwórca Nr serii Główny składnik Substancje pomocnicze Racécord żel Septodont % chlorek glinu Utleniony hydrochinon Gel cord Pascal % siarczan glinu Nie ujawnione Visco Stat Ultradent B31BK 20% siarczan żelaza Nie ujawnione 28 PROTETYKA STOMATOLOGICZNA, 2009, LIX, 1
5 Środki retrakcyjne Zakres ph tych środków mierzono metodą potencjometryczną za pomocą wodoszczelnego elektronicznego ph-metru Elmetron (typ IP-67). Standaryzacji miernika dokonano z użyciem testowych roztworów buforowych firmy Chempur (Na 2 HPO 4 -C 6 H 6 O) o ph=4,00 oraz ph=7,00. Opakowania ocenianych preparatów otwierano bezpośrednio przed badaniem. Wszystkie pomiary wykonano dwukrotnie pobierając po 1 ml badanego środka z 2 pojemników tej samej serii wyrobów i uzupełniając wodą destylowaną do objętości 10 ml (rozcieńczenie 1:10). Czas każdego pomiaru wynosił od 4 do 5 sekund, do momentu ustalenia wartości odczytu ph, a następnie obliczono wartości średnie. Roztworem kontrolnym była sól fizjologiczna (Inj. Natrii chlorati isotonica). Badania przeprowadzono w laboratorium chemicznym firmy Zhermapol w Warszawie. Wyniki Wyniki pomiarów wartości ph roztworów i żeli retrakcyjnych oraz roztworu kontrolnego przedstawiono w tabelach III i IV. W badaniach ustalono, że zakres ph leków należących do grupy 1 obejmującej roztwory retrakcyjne był szeroki i wynosił średnio od 1,83 do 6,85, natomiast w grupie 3 zawierającej żele retrakcyjne wahał się od 1,65 do 3,47. W klasie 1 grupującej leki kurczące naczynia krwionośne najniższy poziom ph wynoszący średnio 3,62 wykazała 0,1% adrenalina (podgrupa α i β-adrenergików), a najwyższą średnią, ph = 6,85, T a b e l a I I I. Zakres ph badanych roztworów retrakcyjnych i roztworu kontrolnego (ph-metr Elmetron typ IP- 67) Preparat Producent Główny składnik Zakres ph 1 pomiar 2 pomiar średnia Injec. Adrenalini 0,1% Polfa 0,1% adrenalina HCl 3,66 3,59 3,62 Visine classic* Pfizer 0,05% tetryzolina HCl 6,86 6,84 6,85 Afrin * Schering 0,05% oxymetazolina HCl 4,86 4,84 4,85 Neosynephrin- POS10% * Ursapharm 10% fenylefryna HCl 4,23 4,30 4,26 Gingiva Liquid Roeko 10% AlCl3 2,81 2,84 2,82 Alustin Chema 20% AlCl3 2,37 2,30 2,33 Racestypine roztwór Septodont 25% AlCl3 2,00 1,98 1,99 Orbat Sensitive Lege artis 25% Al2(SO4)3 3,24 3,26 3,25 Astringedent Ultradent 15,5% Fe2(SO4)3 1,81 1,85 1,83 Roztwór kontrolny Polpharma 0,9% NaCl 5,78 5,76 5,77 *Preparaty nie stomatologiczne polecane do retrakcji dziąsła brzeżnego T a b e l a I V. Zakres ph badanych żeli retrakcyjnych i roztworu kontrolnego (ph-metr Elmetron typ IP-67) Preparat Producent Główny składnik Zakres ph 1 pomiar 2 pomiar średnia Racécord żel Septodont 25% AlCl3 1,75 1,78 1,76 Gel cord Pascal 25% Al2(SO4)3 3,47 3,46 3,47 Visco Stat Ultradent 20% Fe2(SO4)3 1,55 1,76 1,65 Roztwór kontrolny Polpharma 0,9% NaCl 5,78 5,76 5,77 PROTETYKA STOMATOLOGICZNA, 2009, LIX, 1 29
6 D. Nowakowska, Z. Raszewski T a b e l a V. Średnie wartości ph badanych chemicznych środków retrakcyjnych Średni poziom ph chemicznych środków retrakcyjnych Klasa II (astringenty) Klasa I (adrenergiki) Grupa chlorki siarczany α i β ph α ph glinu ph glinu ph żelaza ph 1. Roztwory retrakcyjne 3. Żele retrakcyjne Inj. Adrenalini 0,1% 3,6 Visine classic* 6,8 Gingiva liquid Afrin * 4,8 Alustin 2,3 Neosynephrin POS * 4,3 Orbat 2,4 Racestypine 2,0 *Preparaty niestomatologiczne polecane do retrakcji dziąsła brzeżnego. 2,8 Orbat sensitive 3,3 Astringedent 1,8 Racècord 1,8 Gel cord 3,5 Visco Stat 1,6 osiągnął preparat Visine classic (podgrupa α-adrenergików). Natomiast w klasie 2, astringentów retrakcyjnych, zakres poziomu ph był niższy i wynosił od 1,83 preparatu Astringedent z podklasy leków zawierających siarczan żelaza, do 3,25 preparatu Orbat sensitive z podklasy leków na bazie siarczanu glinu. Wśród preparatów w formie żeli retrakcyjnych, zawierających wyłącznie astringenty, najniższy poziom ph wykazał ViscoStat (20% siarczan żelaza), a najwyższy Gel cord (25% siarczan glinu). Odczyn kwasowo-zasadowy soli fizjologicznej użytej jako roztwór kontrolny wynosił średnio 5,77. Następnie porównano zakresy średniego ph chemicznych środków retrakcyjnych należących do obu klas (tabela V) i stwierdzono, że leki należące do klasy 1 adrenergików charakteryzują się wyższym przedziałem wartości ph niż leki należące do klasy 2 astringentów, zarówno w formie roztworów jak i żeli retrakcyjnych. Z kolei zakres ph płynnych astringentów oraz odpowiadających im stężeniem substancji czynnych żeli retrakcyjnych jest podobny, różnice średniego poziomu ph nie przekraczały 0,2. Dyskusja Ocena kliniczna wpływu różnych chemicznych środków retrakcyjnych na tkanki dziąsła brzeżnego i zębów wykazała, że leki te w mniejszym lub większym stopniu powodują przejściowe lub trwałe miejscowe uszkodzenia tych tkanek (12, 13, 14, 15, 17, 18). Niektóre z nich, zwłaszcza epinefryna, powodują także niepożądane efekty ogólnoustrojowe (19). W związku z tym Bowles i wsp. w 1991 roku zaproponowali mniej inwazyjne leki o podobnej skuteczności, które nie były dotychczas używane w stomatologii. Zawierają one aminy sympatykomimetyczne, takie jak tetryzolina, oxymetazolina i fenylefryna, w niskich stężeniach stosowane w okulistyce i laryngologii (20). Chemicznie wszystkie leki retrakcyjne są solami organicznymi lub nieorganicznymi kwasów chlorowodorowego i siarkowego, które w postaci roztworów lub żeli stosuje się in situ. W wilgotnym środowisku związki te są zdolne do dysocjacji ponieważ występują w nich wiązania jonowe lub bardzo silnie spolaryzowane kowalencyjne. Żele podczas produkcji są wykonywane w taki sposób, że w wodzie rozpuszcza się określoną ilość soli, występuje tu więc też proces dysocjacji, a następnie dodaje się środki żelujące, np. pochodne kwasu poliakrylowego, które są stabilne w środowisku kwaśnym. Sole kwasu solnego szczególnie łatwo ulegają dysocjacji, jeśli chodzi o siarczany, jest to trochę trudniejsze. W roztworach dysocjacja jest zawsze procesem odwracalnym. Między formą niezdysocjowaną i zdysocjowaną związku występuje w tych warunkach równowaga. W zależności od własności roz- 30 PROTETYKA STOMATOLOGICZNA, 2009, LIX, 1
7 Środki retrakcyjne puszczalnika i środka chemicznego, temperatury, oraz występowania jonów pochodzących z innych związków równowaga ta może być bardziej przesunięta w stronę formy niezdysocjowanej lub zdysocjowanej. Dodatkowo w szczelinie dziąsłowej mamy do czynienia z płynami ustrojowymi, które mogą powodować dalszą dysocjację tych leków. W latach dziewięćdziesiątych ubiegłego wieku zwrócono uwagę, jak istotną rolę dla zdrowia i bezpieczeństwa tkanek przyzębia oraz zębów może mieć odczyn chemiczny stosowanych środków retrakcyjnych. Pierwsze badania dotyczące zakresu ph płynnych roztworów retrakcyjnych wykonali Woody i wsp. w 1993 roku (11). W badaniu zastosowali urządzenie Corning ph meter (Model 7, Corning Glass Works, Medfield, Mass) uzyskując wyniki dla astringentów w zakresie od 1,1 do 3,0, a dla adrenergików od 6,2 do 7,1. Następnie Land i wsp. w roku 1994, używając przyrządu Beckman 10 ph meter (Beckman Instuments, Inc., San Ramon Calif.) i roztworów testowych o ph=7 i ph=4, zmierzyli kwasowość astringentów podając zakres ich ph od 0,8 (Astringedent) do 1,9 (Gingi-Aid 25%) (12), a w kolejnym badaniu (1996 rok) poziom ph adrenergików, od 2,0 epinefryny w preparacie Orostat 8% do 6,8 sympatykomimetycznego środka kurczącego naczynia krwionośne Visine (13). Szczególnie niskie wartości ph zarówno astringentów, od 0,8 (Racestypine) do 2,6 (Rastringent), oraz 5,6 α-adrenrgiku Visine, wymienili Kopač i wsp. w 2002 roku, autorzy ci nie podali jednak metody pomiaru ph tych środków (14). Natomiast Ayo-Yusuf i wsp. w 2005 roku zmierzyli metodą stosowaną przez Landa zakres ph trzech astringentów retrakcyjnych i podali, że 15,5% siarczan żelaza (Astringent ), 21,3% chlorek glinu (Hemodent ) i buforowany 25% chlorek glinu (Ultradent ), wykazują poziomy ph w zakresie od 1,3 do 1,7 (16). Uzyskane własne wyniki pomiarów zakresu ph roztworów retrakcyjnych są nieco wyższe i wynoszą odpowiednio dla adrenergików od 3,6 (Injec. Adrenalini 0,1%) do 6,8 (Visine classic), a dla astringentów od 1,8 (Astringedent ) do 3,3 (Orbat sensitive). Należy zauważyć, że prawdopodobnie po raz pierwszy dokonano pomiaru zakresu ph 0,1% adrenaliny zalecanej do retrakcji dziąsła brzeżnego, o spodziewanym wyższym zakresie ph niż dotychczas powszechnie stosowane środki zawierające wyższe stężenia tego leku. Ponadto zbadano nowy preparat Orbat sensitive (25% siarczan glinu), którego ph okazało się najwyższe wśród badanych roztworów astringentów. Także przedstawione wyniki badania zakresu ph żeli retrakcyjnych zawierających wyłącznie astringenty, takich jak Racécocd żel (ph=1,76) i Gel cord (ph=3,47) są przypuszczalnie pierwszymi opublikowanymi danymi. Jedynie Rosenstiel i wsp. podali średnią wartość ph żelu ViscoStat wynoszącą 1,6, która jest porównywalna z wynikami wykonanego badania (ph=1,65) (15). Prawdopodobnie na występowanie różnic w średnich wartościach ph mogły mieć wpływ następujące czynniki: technika wykonania pomiaru i rozcieńczenie leku a także typ stosowanego miernika oraz różnice w składzie serii preparatów retrakcyjnych. W badaniu zastosowano rozcieńczenie preparatów wodą destylowaną w proporcji 1:10. Autorzy wcześniejszych publikacji nie podają rozcieńczenia badanych związków. Jeśli chodzi o mierniki to wydaje się, że nie mają one znaczącego wpływu na wynik pomiaru. Wprawdzie wcześniejsze urządzenia lampowe wymagały długiego czasu przygotowania (stabilizacja lamp) około 30 minut, ale po kalibracji na bufor wskazywały podobne wartości. W tym badaniu użyto nowoczesnego wodoszczelnego ph-metru elektronicznego Elmetron (typ IL- 67), który wytestowano w typowy sposób. Ponadto przytoczone wyniki badań Woody i wsp. (11), Land i wsp (12, 13), Kopač i wsp. (14) oraz Ayo-Yusuf i wsp. (16) dotyczyły środków retrakcyjnych pochodzących z różnych wcześniejszych serii wyrobów. W badaniu własnym zastosowano preparaty z aktualnych serii, o datach ważności do 2009/2012. Nie wykluczone, że istnieją drobne różnice w składzie wcześniej i obecnie ocenianych preparatów, co może mieć wpływ na zakres poziomu ich ph. Wniosek W warunkach ograniczenia tego badania ustalono, że zakres ph leków retrakcyjnych należących do klasy 1 (adrenergiki) był wyższy (ph>3,5) niż leków z klasy 2 (astringenty) (ph<3,5). W związku z tym sugeruje się, że ze względu na zdrowie i bezpieczeństwo tkanek dziąsła brzeżnego i zębów, PROTETYKA STOMATOLOGICZNA, 2009, LIX, 1 31
8 D. Nowakowska, Z. Raszewski w warunkach klinicznych należałoby wybierać preparaty retrakcyjne z klasy 1, ponieważ zakres ich ph zbliżony jest do obojętnego. Piśmiennictwo 1. Shillingburg H. T. i wsp.: Impression materials used for cast restoration in eight states. J. Am. Dent. Assoc., 1980, 100, Donovan T. E., Gandara B. K., Nemetz H.: Review and survey of medicaments used with gingival retraction cords. J. Prosthet. Dent., 1985, 53, Shaw D. H., Krejci R. F.: Gingival retraction preference of dentist in general practice. Quintessence Int., 1986, 17, 5, Hansen P. A., Tira D. A., Barlow J.: Current methods of finish-line exposure by practicing prosthodontists. J. Prosthod. 1999, 8, 3, Nowakowska D. i wsp.: Retrakcja dziąsła brzeżnego badania ankietowe wśród polskich lekarzy stomatologów. Część I. Preferencje metod, materiałów i środków chemicznych. Protet. Stomatol., 2006, 56, 5, Nowakowska D.: Ocena składników chemicznych środków retrakcyjnych używanych przez polskich stomatologów. Czas. Stomatol., 2007, 60, 2, Nowakowska D., Panek H.: Classification of Retraction Materials in the Aspect of Biocompatibility with Gingival Sulcus Environment. Polish J. of Environ. Stud., Vol. 16, No 2C, 2007, Benson B. W., Bomberg T. J., Hatch R. A., Hoffman W. Jr.: Tissue displacement methods in fixed prosthodontics. J. Prosthet. Dent., 1986, 55, Nowakowska D. i wsp.: Retrakcja dziąsła brzeżnego badania ankietowe wśród polskich lekarzy stomatologów. Część II. Nawyki kliniczne związane z wykonaniem zabiegu retrakcji. Protet. Stomatol., 2006, 56, 5, Nowakowska D.: Klasyfikacja chemicznych środków retrakcyjnych. Protet. Stomatol., 2008, 58, 3, Woody R. D., Miller A., Staffanou R. S.: Review of the ph of hemostatic agents used in tissue displacement. J. Prosthet. Dent., 1993, 70, Land M. F., Rosenstiel S. F., Sandrik J. L.: Disturbance of the dentinal smear layer by acidic hemostatic agents. J. Prosthet. Dent., 1994, 72, Land M. F., Couri C. C., Johnston W. M.: Smear layer instability caused by hemostatic agents. J. Prosthet. Dent., 1996, 76, Kopač I., Cvetko E., Marion L.: Gingival inflammatory response induced by chemical retraction agents in Beagle dogs. Int. J. Prosth., 2002, 15, 1, Rosenstiel S. F. Land M. F., Fujimoto J.: Współczesne protezy stałe, pod red. K. Dobies, Wyd. Czelej, Lublin Ayo-Yusuf O. A., Driessen C. H., Botha A. J.: SEM- EDX Study of prepared dentine surfaces exposed to gingival retraction fluids. J. Dent., 2005, 33, Woycheshin F. F.: An evoluation of the drugs used for gingival retraction. J Prosthet. Dent., 1964,14, 4, Ruel J., Schuessler P. J., Malament K., Mori D.: Effect of retraction procedures on the parodontium in human. J. Prosthet. Dent., 1980, 44, Bader J. D., Bonito A. J., Shugars D. A.: A systematic review of cardiovascular effects of epinephrine on hypertensive dental patients. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., 2002, 93, 6, Bowles W. H., Tardy S. J., Vahadi A.: Evaluation of new gingival retraction agents. J. Dent. Res., 1991, 70, Fazekas A., Csempesz F., Csabai Z., Vag J.: Effects of pre-soaked retraction cords on the microcirculation of the human gingival margin. Oper. Dent., 2002, 27, 4, Zaakceptowano do druku: 27.XI.2008 r. Adres autora: Wrocław, ul. Krakowska 26. Zarząd Główny PTS PROTETYKA STOMATOLOGICZNA, 2009, LIX, 1
Ocena składników chemicznych środków retrakcyjnych używanych przez polskich stomatologów
 Czas. Stomatol., 2007, LX, 2, 127-132 2007 Polish Stomatological Association http://www.czas.stomat.net Ocena składników chemicznych środków retrakcyjnych używanych przez polskich stomatologów Danuta Nowakowska
Czas. Stomatol., 2007, LX, 2, 127-132 2007 Polish Stomatological Association http://www.czas.stomat.net Ocena składników chemicznych środków retrakcyjnych używanych przez polskich stomatologów Danuta Nowakowska
Wpływ astringentów retrakcyjnych na tkanki dziąsła brzeżnego na podstawie przeglądu badań in vivo*
 PROTET. STOMATOL., 2009, LIX, 2, 128-133 Wpływ astringentów retrakcyjnych na tkanki dziąsła brzeżnego na podstawie przeglądu badań in vivo* The impact of retraction astringents on gingival margin tissues
PROTET. STOMATOL., 2009, LIX, 2, 128-133 Wpływ astringentów retrakcyjnych na tkanki dziąsła brzeżnego na podstawie przeglądu badań in vivo* The impact of retraction astringents on gingival margin tissues
Ocena nici retrakcyjnych nici impregnowane
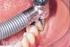 Czas. Stomatol., 2006, LIX, 8, 592-596 Organ Polskiego Towarzystwa Stomatologicznego http://www.czas.stomat.net Ocena nici retrakcyjnych nici impregnowane The evaluation of retraction cords - impregnated
Czas. Stomatol., 2006, LIX, 8, 592-596 Organ Polskiego Towarzystwa Stomatologicznego http://www.czas.stomat.net Ocena nici retrakcyjnych nici impregnowane The evaluation of retraction cords - impregnated
Retrakcja dziąsła brzeżnego badania ankietowe wśród polskich lekarzy stomatologów. Część I. Preferencje metod, materiałów i środków chemicznych
 PROTET. STOMATOL., 2006, LVI, 5, 352-360 Retrakcja dziąsła brzeżnego badania ankietowe wśród polskich lekarzy stomatologów. Część I. Preferencje metod, materiałów i środków chemicznych Gingival retraction
PROTET. STOMATOL., 2006, LVI, 5, 352-360 Retrakcja dziąsła brzeżnego badania ankietowe wśród polskich lekarzy stomatologów. Część I. Preferencje metod, materiałów i środków chemicznych Gingival retraction
klasyfikacji chemicznych środków retrakcyjnych
 PROTET. STOMATOL., 2008, LVIII, 3, 202-208 Klasyfikacja chemicznych środków retrakcyjnych* Classification of chemical retraction agents Danuta Nowakowska Z Zakładu Materiałoznawstwa p.o. Kierownika: dr
PROTET. STOMATOL., 2008, LVIII, 3, 202-208 Klasyfikacja chemicznych środków retrakcyjnych* Classification of chemical retraction agents Danuta Nowakowska Z Zakładu Materiałoznawstwa p.o. Kierownika: dr
Retrakcja dziąsła w świetle piśmiennictwa i stosowane systemy retrakcyjne w praktyce stomatologicznej
 Czas. Stomat., 2005, LVIII, 9 Retrakcja dziąsła w świetle piśmiennictwa i stosowane systemy retrakcyjne w praktyce stomatologicznej Gingival retraction in the light of the literature and retraction systems
Czas. Stomat., 2005, LVIII, 9 Retrakcja dziąsła w świetle piśmiennictwa i stosowane systemy retrakcyjne w praktyce stomatologicznej Gingival retraction in the light of the literature and retraction systems
Zestaw nici retrakcyjnych Septofil ocena kliniczna i mikroskopowa
 Czas. Stomat., 2006, LIX, 2 Zestaw nici retrakcyjnych Septofil ocena kliniczna i mikroskopowa Septofil retraction cords set clinical and microscopic evaluation Danuta Nowakowska 1, Halina Panek 2, Paweł
Czas. Stomat., 2006, LIX, 2 Zestaw nici retrakcyjnych Septofil ocena kliniczna i mikroskopowa Septofil retraction cords set clinical and microscopic evaluation Danuta Nowakowska 1, Halina Panek 2, Paweł
Danuta Nowakowska¹, Krystyna Małecka², Anna Sobolewska¹. The compatibility of 3 selected retraction cord medicaments
 prot. stom., 2005, LV, 3 Ocena in vitro kompatybilności wybranych chemicznych środków retrakcyjnych z elastomerowymi materiałami wyciskowymi używanymi podczas wykonywania protez stałych. Część I środki
prot. stom., 2005, LV, 3 Ocena in vitro kompatybilności wybranych chemicznych środków retrakcyjnych z elastomerowymi materiałami wyciskowymi używanymi podczas wykonywania protez stałych. Część I środki
Wprowadzenie. Cel pracy. Materiał i metody
 Wprowadzenie Nici retrakcyjne są materiałami stomatologicznymi umieszczanymi na krótki okres w rowku dziąsłowym, nieprzekraczającymi nabłonkowej bariery ciała ludzkiego, zaliczanymi do klasy 1, zgodnie
Wprowadzenie Nici retrakcyjne są materiałami stomatologicznymi umieszczanymi na krótki okres w rowku dziąsłowym, nieprzekraczającymi nabłonkowej bariery ciała ludzkiego, zaliczanymi do klasy 1, zgodnie
Mikrostruktura nieimpregnowanych i impregnowanych nici retrakcyjnych*
 PROTET. STOMATOL., 2008, LVIII, 2, 129-136 Mikrostruktura nieimpregnowanych i impregnowanych nici retrakcyjnych* Microstructure of non-impregnated and impregnated retraction cords Nowakowska Danuta 1,
PROTET. STOMATOL., 2008, LVIII, 2, 129-136 Mikrostruktura nieimpregnowanych i impregnowanych nici retrakcyjnych* Microstructure of non-impregnated and impregnated retraction cords Nowakowska Danuta 1,
Inżynieria Środowiska
 ROZTWORY BUFOROWE Roztworami buforowymi nazywamy takie roztwory, w których stężenie jonów wodorowych nie ulega większym zmianom ani pod wpływem rozcieńczania wodą, ani pod wpływem dodatku nieznacznych
ROZTWORY BUFOROWE Roztworami buforowymi nazywamy takie roztwory, w których stężenie jonów wodorowych nie ulega większym zmianom ani pod wpływem rozcieńczania wodą, ani pod wpływem dodatku nieznacznych
ODCZYN WODY BADANIE ph METODĄ POTENCJOMETRYCZNĄ
 ODCZYN WODY BADANIE ph METODĄ POTENCJOMETRYCZNĄ Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wprowadzenie 1.1. Odczyn wody Odczyn roztworu określa stężenie,
ODCZYN WODY BADANIE ph METODĄ POTENCJOMETRYCZNĄ Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wprowadzenie 1.1. Odczyn wody Odczyn roztworu określa stężenie,
HYDROLIZA SOLI. ROZTWORY BUFOROWE
 Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
Akademia Morska w Szczecinie. Wydział Mechaniczny
 Akademia Morska w Szczecinie Wydział Mechaniczny ROZPRAWA DOKTORSKA mgr inż. Marcin Kołodziejski Analiza metody obsługiwania zarządzanego niezawodnością pędników azymutalnych platformy pływającej Promotor:
Akademia Morska w Szczecinie Wydział Mechaniczny ROZPRAWA DOKTORSKA mgr inż. Marcin Kołodziejski Analiza metody obsługiwania zarządzanego niezawodnością pędników azymutalnych platformy pływającej Promotor:
Roztwory buforowe modyfikacja wykonania ćwiczenia.
 Roztwory buforowe modyfikacja wykonania ćwiczenia. Roztwory buforowe otrzymywane będą z 0,1 M roztworów kwasu octowego i octanu sodu. Do roztworów buforowych i wód dodawane będą z biurety roztwory 0,1
Roztwory buforowe modyfikacja wykonania ćwiczenia. Roztwory buforowe otrzymywane będą z 0,1 M roztworów kwasu octowego i octanu sodu. Do roztworów buforowych i wód dodawane będą z biurety roztwory 0,1
Sporządzanie roztworów buforowych i badanie ich właściwości
 Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Skład zespołu (imię i nazwisko): (podkreślić dane osoby piszącej sprawozdanie):
 Wydział Chemii Katedra Chemii Ogólnej i Nieorganicznej pracownia studencka prowadzący: ĆWICZENIE 3 RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW Data wykonania ćwiczenia: Skład zespołu (imię i nazwisko): (podkreślić
Wydział Chemii Katedra Chemii Ogólnej i Nieorganicznej pracownia studencka prowadzący: ĆWICZENIE 3 RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW Data wykonania ćwiczenia: Skład zespołu (imię i nazwisko): (podkreślić
Spektrofotometryczne wyznaczanie stałej dysocjacji czerwieni fenolowej
 Spektrofotometryczne wyznaczanie stałej dysocjacji czerwieni fenolowej Metoda: Spektrofotometria UV-Vis Cel ćwiczenia: Celem ćwiczenia jest zapoznanie studenta z fotometryczną metodą badania stanów równowagi
Spektrofotometryczne wyznaczanie stałej dysocjacji czerwieni fenolowej Metoda: Spektrofotometria UV-Vis Cel ćwiczenia: Celem ćwiczenia jest zapoznanie studenta z fotometryczną metodą badania stanów równowagi
KLASA PRZYGOTOWANIA POWIERZCHNI PRĘTÓW Ti6Al4V NA JAKOŚĆ POŁĄCZENIA Z ZrO 2 W OCENIE BADAŃ MIKROSKOPOWYCH
 Aktualne Problemy Biomechaniki, nr 9/2015 123 Katarzyna WITA, Krzysztof CZAKON, Maciej HAJDUGA, ATH, Bielsko-Biała KLASA PRZYGOTOWANIA POWIERZCHNI PRĘTÓW Ti6Al4V NA JAKOŚĆ POŁĄCZENIA Z ZrO 2 W OCENIE BADAŃ
Aktualne Problemy Biomechaniki, nr 9/2015 123 Katarzyna WITA, Krzysztof CZAKON, Maciej HAJDUGA, ATH, Bielsko-Biała KLASA PRZYGOTOWANIA POWIERZCHNI PRĘTÓW Ti6Al4V NA JAKOŚĆ POŁĄCZENIA Z ZrO 2 W OCENIE BADAŃ
WYMAGANIA EDUKACYJNE
 GIMNAZJUM NR 2 W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie II gimnazjum str. 1 Wymagania edukacyjne niezbędne do
GIMNAZJUM NR 2 W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie II gimnazjum str. 1 Wymagania edukacyjne niezbędne do
ĆWICZENIE 2 KONDUKTOMETRIA
 ĆWICZENIE 2 KONDUKTOMETRIA 1. Oznaczanie słabych kwasów w sokach i syropach owocowych metodą miareczkowania konduktometrycznego Celem ćwiczenia jest ilościowe oznaczenie zawartości słabych kwasów w sokach
ĆWICZENIE 2 KONDUKTOMETRIA 1. Oznaczanie słabych kwasów w sokach i syropach owocowych metodą miareczkowania konduktometrycznego Celem ćwiczenia jest ilościowe oznaczenie zawartości słabych kwasów w sokach
Wpływ chlorku glinu na wybrane parametry wyciskowych mas poliwinylosiloksanowych doniesienie wstępne
 PROT. STOM., 2006, LVI, 1 Wpływ chlorku glinu na wybrane parametry wyciskowych mas poliwinylosiloksanowych doniesienie wstępne Influence of aluminum chloride on selected parameters of vinyl polysiloxane
PROT. STOM., 2006, LVI, 1 Wpływ chlorku glinu na wybrane parametry wyciskowych mas poliwinylosiloksanowych doniesienie wstępne Influence of aluminum chloride on selected parameters of vinyl polysiloxane
OZNACZANIE WŁAŚCIWOŚCI BUFOROWYCH WÓD
 OZNACZANIE WŁAŚCIWOŚCI BUFOROWYCH WÓD POWIERZCHNIOWYCH WPROWADZENIE Właściwości chemiczne wód występujących w przyrodzie odznaczają się dużym zróżnicowaniem. Zależą one między innymi od budowy geologicznej
OZNACZANIE WŁAŚCIWOŚCI BUFOROWYCH WÓD POWIERZCHNIOWYCH WPROWADZENIE Właściwości chemiczne wód występujących w przyrodzie odznaczają się dużym zróżnicowaniem. Zależą one między innymi od budowy geologicznej
OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIARÓW PRZEWODNICTWA. OZNACZANIE STĘŻENIA WODOROTLENKU SODU METODĄ MIARECZKOWANIA KONDUKTOMETRYCZNEGO
 OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIAÓW PZEWODNICTWA. OZNACZANIE STĘŻENIA WODOOTLENKU SODU METODĄ MIAECZKOWANIA KONDUKTOMETYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIAÓW PZEWODNICTWA. OZNACZANIE STĘŻENIA WODOOTLENKU SODU METODĄ MIAECZKOWANIA KONDUKTOMETYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
Spis treści. Wstęp... 9
 Spis treści Wstęp... 9 1. Szkło i sprzęt laboratoryjny 1.1. Szkła laboratoryjne własności, skład chemiczny, podział, zastosowanie.. 11 1.2. Wybrane szkło laboratoryjne... 13 1.3. Szkło miarowe... 14 1.4.
Spis treści Wstęp... 9 1. Szkło i sprzęt laboratoryjny 1.1. Szkła laboratoryjne własności, skład chemiczny, podział, zastosowanie.. 11 1.2. Wybrane szkło laboratoryjne... 13 1.3. Szkło miarowe... 14 1.4.
Cementowanie uzupełnień pełnoceramicznych przegląd piśmiennictwa. Część II
 PROTET. STOMATOL., 2009, LIX, 1, 16-25 Cementowanie uzupełnień pełnoceramicznych przegląd piśmiennictwa. Część II Cementation of porcelain restorations: A literature review. Part II Przemysław Szczyrek
PROTET. STOMATOL., 2009, LIX, 1, 16-25 Cementowanie uzupełnień pełnoceramicznych przegląd piśmiennictwa. Część II Cementation of porcelain restorations: A literature review. Part II Przemysław Szczyrek
Spektroskopia molekularna. Ćwiczenie nr 1. Widma absorpcyjne błękitu tymolowego
 Spektroskopia molekularna Ćwiczenie nr 1 Widma absorpcyjne błękitu tymolowego Doświadczenie to ma na celu zaznajomienie uczestników ćwiczeń ze sposobem wykonywania pomiarów metodą spektrofotometryczną
Spektroskopia molekularna Ćwiczenie nr 1 Widma absorpcyjne błękitu tymolowego Doświadczenie to ma na celu zaznajomienie uczestników ćwiczeń ze sposobem wykonywania pomiarów metodą spektrofotometryczną
Mechanizm działania buforów *
 Mechanizm działania buforów * UNIWERSYTET PRZYRODNICZY Z doświadczenia nabytego w laboratorium wiemy, że dodanie kropli stężonego kwasu do 10 ml wody powoduje gwałtowny spadek ph o kilka jednostek. Tymczasem
Mechanizm działania buforów * UNIWERSYTET PRZYRODNICZY Z doświadczenia nabytego w laboratorium wiemy, że dodanie kropli stężonego kwasu do 10 ml wody powoduje gwałtowny spadek ph o kilka jednostek. Tymczasem
Retrakcja dzi^sl^a podczas leczenia stomatologicznego - metody, materialy i srodki chemiczne - przegl^d pismiennictwa
 PROT. STOM. 2004, LIV. 1 Retrakcja dzi^sl^a podczas leczenia stomatologicznego - metody, materialy i srodki chemiczne - przegl^d pismiennictwa Gingival retraction during dental treatment - methods, materials
PROT. STOM. 2004, LIV. 1 Retrakcja dzi^sl^a podczas leczenia stomatologicznego - metody, materialy i srodki chemiczne - przegl^d pismiennictwa Gingival retraction during dental treatment - methods, materials
Instrukcja do ćwiczeń laboratoryjnych
 UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 3 OZNACZANIE CHLORKÓW METODĄ SPEKTROFOTOMETRYCZNĄ Z TIOCYJANIANEM RTĘCI(II)
UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 3 OZNACZANIE CHLORKÓW METODĄ SPEKTROFOTOMETRYCZNĄ Z TIOCYJANIANEM RTĘCI(II)
II. ODŻELAZIANIE LITERATURA. Zakres wiadomości obowiązujących do zaliczenia przed przystąpieniem do wykonania. ćwiczenia:
 II. ODŻELAZIANIE LITERATURA 1. Akty prawne: Aktualne rozporządzenie dotyczące jakości wody do picia i na potrzeby gospodarcze. 2. Chojnacki A.: Technologia wody i ścieków. PWN, Warszawa 1972. 3. Hermanowicz
II. ODŻELAZIANIE LITERATURA 1. Akty prawne: Aktualne rozporządzenie dotyczące jakości wody do picia i na potrzeby gospodarcze. 2. Chojnacki A.: Technologia wody i ścieków. PWN, Warszawa 1972. 3. Hermanowicz
6. ph i ELEKTROLITY. 6. ph i elektrolity
 6. ph i ELEKTROLITY 31 6. ph i elektrolity 6.1. Oblicz ph roztworu zawierającego 0,365 g HCl w 1,0 dm 3 roztworu. Odp 2,00 6.2. Oblicz ph 0,0050 molowego roztworu wodorotlenku baru (α = 1,00). Odp. 12,00
6. ph i ELEKTROLITY 31 6. ph i elektrolity 6.1. Oblicz ph roztworu zawierającego 0,365 g HCl w 1,0 dm 3 roztworu. Odp 2,00 6.2. Oblicz ph 0,0050 molowego roztworu wodorotlenku baru (α = 1,00). Odp. 12,00
Zadanie: 2 Zbadano odczyn wodnych roztworów następujących soli: I chlorku baru II octanu amonu III siarczku sodu
 Zadanie: 1 Sporządzono dwa wodne roztwory soli: siarczanu (VI) sodu i azotanu (III) sodu Który z wyżej wymienionych roztworów soli nie będzie miał odczynu obojętnego? Uzasadnij odpowiedź i napisz równanie
Zadanie: 1 Sporządzono dwa wodne roztwory soli: siarczanu (VI) sodu i azotanu (III) sodu Który z wyżej wymienionych roztworów soli nie będzie miał odczynu obojętnego? Uzasadnij odpowiedź i napisz równanie
Fragmenty Działu 5 z Tomu 1 REAKCJE W ROZTWORACH WODNYCH
 Fragmenty Działu 5 z Tomu 1 REAKCJE W ROZTWORACH WODNYCH Podstawy dysocjacji elektrolitycznej. Zadanie 485 (1 pkt.) V/2006/A2 Dysocjacja kwasu ortofosforowego(v) przebiega w roztworach wodnych trójstopniowo:
Fragmenty Działu 5 z Tomu 1 REAKCJE W ROZTWORACH WODNYCH Podstawy dysocjacji elektrolitycznej. Zadanie 485 (1 pkt.) V/2006/A2 Dysocjacja kwasu ortofosforowego(v) przebiega w roztworach wodnych trójstopniowo:
dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K
![dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K](/thumbs/55/36391740.jpg) RÓWNOWAGI W ROZTWORACH Szwedzki chemik Svante Arrhenius w 1887 roku jako pierwszy wykazał, że procesowi rozpuszczania wielu substancji towarzyszy dysocjacja, czyli rozpad cząsteczek na jony naładowane
RÓWNOWAGI W ROZTWORACH Szwedzki chemik Svante Arrhenius w 1887 roku jako pierwszy wykazał, że procesowi rozpuszczania wielu substancji towarzyszy dysocjacja, czyli rozpad cząsteczek na jony naładowane
Wymagania edukacyjne niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych. CHEMIA klasa II.
 Wymagania edukacyjne niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych CHEMIA klasa II Oceny śródroczne: Ocenę dopuszczającą otrzymuje uczeń, który: -wymienia zasady bhp
Wymagania edukacyjne niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych CHEMIA klasa II Oceny śródroczne: Ocenę dopuszczającą otrzymuje uczeń, który: -wymienia zasady bhp
OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS
 OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS Zagadnienia teoretyczne. Spektrofotometria jest techniką instrumentalną, w której do celów analitycznych wykorzystuje się przejścia energetyczne zachodzące
OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS Zagadnienia teoretyczne. Spektrofotometria jest techniką instrumentalną, w której do celów analitycznych wykorzystuje się przejścia energetyczne zachodzące
Ocena skuteczności preparatów miejscowo znieczulających skórę w redukcji bólu w trakcie pobierania krwi u dzieci badanie z randomizacją
 234 Ocena skuteczności preparatów miejscowo znieczulających skórę w redukcji bólu w trakcie pobierania krwi u dzieci badanie z randomizacją The effectiveness of local anesthetics in the reduction of needle
234 Ocena skuteczności preparatów miejscowo znieczulających skórę w redukcji bólu w trakcie pobierania krwi u dzieci badanie z randomizacją The effectiveness of local anesthetics in the reduction of needle
Eksperyment laboratoryjny, burza mózgów, pogadanka, praca z całym zespołem, praca w grupach, praca indywidualna.
 Hydroliza soli 1. Cele lekcji a) Wiadomości Uczeń zna: istotę reakcji hydrolizy, pojęcia: hydroliza kationowa i hydroliza anionowa. Uczeń wie: które sole ulegają hydrolizie, które sole nie ulegają hydrolizie.
Hydroliza soli 1. Cele lekcji a) Wiadomości Uczeń zna: istotę reakcji hydrolizy, pojęcia: hydroliza kationowa i hydroliza anionowa. Uczeń wie: które sole ulegają hydrolizie, które sole nie ulegają hydrolizie.
STAłA I STOPIEŃ DYSOCJACJI; ph MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia!
 STAłA I STOPIEŃ DYSOCJACJI; ph MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Obliczyć stężenie molowe jonów Ca 2+ w roztworze zawierającym 2,22g CaCl2 w 100 ml roztworu, przyjmując a = 100%. 002
STAłA I STOPIEŃ DYSOCJACJI; ph MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Obliczyć stężenie molowe jonów Ca 2+ w roztworze zawierającym 2,22g CaCl2 w 100 ml roztworu, przyjmując a = 100%. 002
Zasady oceniania z chemii w klasie II w roku szkolnym 2015/2016. Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra
 Zasady oceniania z chemii w klasie II w roku szkolnym 2015/2016 I. Kwasy wymienia zasady bhp dotyczące obchodzenia się z kwasami definiuje pojęcia: elektrolit i nieelektrolit wyjaśnia, co to jest wskaźnik
Zasady oceniania z chemii w klasie II w roku szkolnym 2015/2016 I. Kwasy wymienia zasady bhp dotyczące obchodzenia się z kwasami definiuje pojęcia: elektrolit i nieelektrolit wyjaśnia, co to jest wskaźnik
Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II
 Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II Szczegółowe kryteria oceniania po pierwszym półroczu klasy II: III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących
Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II Szczegółowe kryteria oceniania po pierwszym półroczu klasy II: III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących
Wymagania z chemii na poszczególne oceny Klasa 2 gimnazjum. Kwasy.
 Wymagania z chemii na poszczególne oceny Klasa 2 gimnazjum Stopień celujący mogą otrzymać uczniowie, którzy spełniają kryteria na stopień bardzo dobry oraz: Omawiają przemysłową metodę otrzymywania kwasu
Wymagania z chemii na poszczególne oceny Klasa 2 gimnazjum Stopień celujący mogą otrzymać uczniowie, którzy spełniają kryteria na stopień bardzo dobry oraz: Omawiają przemysłową metodę otrzymywania kwasu
Wymagania programowe na poszczególne oceny. III. Woda i roztwory wodne. Ocena dopuszczająca [1] Uczeń: Ocena dostateczna [1 + 2]
![Wymagania programowe na poszczególne oceny. III. Woda i roztwory wodne. Ocena dopuszczająca [1] Uczeń: Ocena dostateczna [1 + 2] Wymagania programowe na poszczególne oceny. III. Woda i roztwory wodne. Ocena dopuszczająca [1] Uczeń: Ocena dostateczna [1 + 2]](/thumbs/97/134409727.jpg) Wymagania programowe na poszczególne oceny III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących podaje, na czym polega obieg wody wymienia stany skupienia wody nazywa przemiany stanów skupienia
Wymagania programowe na poszczególne oceny III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących podaje, na czym polega obieg wody wymienia stany skupienia wody nazywa przemiany stanów skupienia
g % ,3%
 PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
009 Ile gramów jodu i ile mililitrów alkoholu etylowego (gęstość 0,78 g/ml) potrzeba do sporządzenia 15 g jodyny, czyli 10% roztworu jodu w alkoholu e
 STĘŻENIA - MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Ile gramów wodnego roztworu azotanu sodu o stężeniu 10,0% można przygotować z 25,0g NaNO3? 002 Ile gramów kwasu siarkowego zawiera 25 ml jego
STĘŻENIA - MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Ile gramów wodnego roztworu azotanu sodu o stężeniu 10,0% można przygotować z 25,0g NaNO3? 002 Ile gramów kwasu siarkowego zawiera 25 ml jego
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
 RÓWNOWAGI W ROZTWORACH ELETROLITÓW Opracowanie: dr Jadwiga Zawada, dr inż. rystyna Moskwa, mgr Magdalena Bisztyga 1. Dysocjacja elektrolityczna Substancje, które podczas rozpuszczania w wodzie (lub innych
RÓWNOWAGI W ROZTWORACH ELETROLITÓW Opracowanie: dr Jadwiga Zawada, dr inż. rystyna Moskwa, mgr Magdalena Bisztyga 1. Dysocjacja elektrolityczna Substancje, które podczas rozpuszczania w wodzie (lub innych
Jak zmierzyć odczyn roztworu. - naturalne i syntetyczne wskaźniki ph.
 1 Jak zmierzyć odczyn roztworu - naturalne i syntetyczne wskaźniki ph. Czas trwania zajęć: 45 minut Pojęcia kluczowe: - odczyn roztworu, - odczyn obojętny, - odczyn kwasowy, - odczyn zasadowy, - ph, -
1 Jak zmierzyć odczyn roztworu - naturalne i syntetyczne wskaźniki ph. Czas trwania zajęć: 45 minut Pojęcia kluczowe: - odczyn roztworu, - odczyn obojętny, - odczyn kwasowy, - odczyn zasadowy, - ph, -
PEHAMETRIA I ROZTWORY BUFOROWE
 4. PEHAMETRIA I ROZTWORY BUFOROWE 1. Sporządzanie i oznaczanie buforu octanowego Pehametria jest analizą instrumentalną, słuŝącą do potencjometrycznego bezpośredniego pomiaru wskaźnika stęŝenia jonów H
4. PEHAMETRIA I ROZTWORY BUFOROWE 1. Sporządzanie i oznaczanie buforu octanowego Pehametria jest analizą instrumentalną, słuŝącą do potencjometrycznego bezpośredniego pomiaru wskaźnika stęŝenia jonów H
CHEMIA KLASA II I PÓŁROCZE
 CHEMIA KLASA II I PÓŁROCZE wymienia zasady bhp dotyczące obchodzenia się z kwasami definiuje pojęcia: elektrolit i nieelektrolit wyjaśnia, co to jest wskaźnik i wymienia trzy przykłady odróżnia kwasy od
CHEMIA KLASA II I PÓŁROCZE wymienia zasady bhp dotyczące obchodzenia się z kwasami definiuje pojęcia: elektrolit i nieelektrolit wyjaśnia, co to jest wskaźnik i wymienia trzy przykłady odróżnia kwasy od
Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak)
 Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak) 1. Właściwości roztworów buforowych Dodatek nieznacznej ilości mocnego kwasu lub mocnej zasady do czystej wody powoduje stosunkowo dużą
Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak) 1. Właściwości roztworów buforowych Dodatek nieznacznej ilości mocnego kwasu lub mocnej zasady do czystej wody powoduje stosunkowo dużą
Wymagania programowe na poszczególne oceny. IV. Kwasy. Ocena bardzo dobra. Ocena dostateczna. Ocena dopuszczająca. Ocena dobra [1] [ ]
![Wymagania programowe na poszczególne oceny. IV. Kwasy. Ocena bardzo dobra. Ocena dostateczna. Ocena dopuszczająca. Ocena dobra [1] [ ] Wymagania programowe na poszczególne oceny. IV. Kwasy. Ocena bardzo dobra. Ocena dostateczna. Ocena dopuszczająca. Ocena dobra [1] [ ]](/thumbs/59/43143309.jpg) Wymagania programowe na poszczególne oceny IV. Kwasy Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra [1] [1 + 2] [1 + 2 + 3] [1 + 2 + 3 + 4] wymienia zasady bhp dotyczące obchodzenia
Wymagania programowe na poszczególne oceny IV. Kwasy Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra [1] [1 + 2] [1 + 2 + 3] [1 + 2 + 3 + 4] wymienia zasady bhp dotyczące obchodzenia
Dysocjacja elektrolityczna, przewodność elektryczna roztworów
 tester woda destylowana tester Ćwiczenie 1a woda wodociągowa tester 5% roztwór cukru tester 0,1 M HCl tester 0,1 M CH 3 COOH tester 0,1 M tester 0,1 M NH 4 OH tester 0,1 M NaCl Dysocjacja elektrolityczna,
tester woda destylowana tester Ćwiczenie 1a woda wodociągowa tester 5% roztwór cukru tester 0,1 M HCl tester 0,1 M CH 3 COOH tester 0,1 M tester 0,1 M NH 4 OH tester 0,1 M NaCl Dysocjacja elektrolityczna,
Obliczenia chemiczne. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
Związki nieorganiczne
 strona 1/8 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
strona 1/8 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
LICEALIŚCI LICZĄ PRZYKŁADOWE ZADANIA Z ROZWIĄZANIAMI
 Zadanie 1: Słaby kwas HA o stężeniu 0,1 mol/litr jest zdysocjowany w 1,3 %. Oblicz stałą dysocjacji tego kwasu. Jeżeli jest to słaby kwas, można użyć wzoru uproszczonego: K = α C = (0,013) 0,1 = 1,74 10-5
Zadanie 1: Słaby kwas HA o stężeniu 0,1 mol/litr jest zdysocjowany w 1,3 %. Oblicz stałą dysocjacji tego kwasu. Jeżeli jest to słaby kwas, można użyć wzoru uproszczonego: K = α C = (0,013) 0,1 = 1,74 10-5
Przewodnictwo elektryczne roztworów wodnych. - elektrolity i nieelektrolity.
 1 Przewodnictwo elektryczne roztworów wodnych - elektrolity i nieelektrolity. Czas trwania zajęć: 45 minut Pojęcia kluczowe: - elektrolit, - nieelektrolit, - dysocjacja elektrolityczna, - prąd, - jony.
1 Przewodnictwo elektryczne roztworów wodnych - elektrolity i nieelektrolity. Czas trwania zajęć: 45 minut Pojęcia kluczowe: - elektrolit, - nieelektrolit, - dysocjacja elektrolityczna, - prąd, - jony.
TWARDOŚĆ WODY. Ca(HCO 3 ) HCl = CaCl 2 + 2H 2 O + 2CO 2. Mg(HCO 3 ) 2 + 2HCl = MgCl 2 + 2H 2 O + 2CO 2
 TWARDOŚĆ WODY Ćwiczenie 1. Oznaczanie twardości przemijającej wody wodociągowej Oznaczenie twardości przemijającej wody polega na miareczkowaniu określonej ilości badanej wody roztworem kwasu solnego o
TWARDOŚĆ WODY Ćwiczenie 1. Oznaczanie twardości przemijającej wody wodociągowej Oznaczenie twardości przemijającej wody polega na miareczkowaniu określonej ilości badanej wody roztworem kwasu solnego o
Część laboratoryjna. Sponsorzy
 XXVII Ogólnopolski Konkurs Chemiczny dla młodzieży szkół średnich Politechnika Śląska Wydział Chemiczny Polskie Towarzystwo Chemiczne Stowarzyszenie Przyjaciół Wydziału Chemicznego Gliwice, 23 marca 2019
XXVII Ogólnopolski Konkurs Chemiczny dla młodzieży szkół średnich Politechnika Śląska Wydział Chemiczny Polskie Towarzystwo Chemiczne Stowarzyszenie Przyjaciół Wydziału Chemicznego Gliwice, 23 marca 2019
Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii
 Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii Dopuszczający (K) Dostateczny(P) Dobry(R) Bardzo dobry (D) Celujący (W) Uczeń : - wie,
Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii Dopuszczający (K) Dostateczny(P) Dobry(R) Bardzo dobry (D) Celujący (W) Uczeń : - wie,
Kliniczna ocena preparatu Pré-emp podczas przygotowania podłoża protetycznego do wycisku*
 PROTET. STOMATOL., 2009, LIX, 5, 334-338 Kliniczna ocena preparatu Pré-emp podczas przygotowania podłoża protetycznego do wycisku* Clinical evaluation of Pré-emp solution during the prosthetic area preparation
PROTET. STOMATOL., 2009, LIX, 5, 334-338 Kliniczna ocena preparatu Pré-emp podczas przygotowania podłoża protetycznego do wycisku* Clinical evaluation of Pré-emp solution during the prosthetic area preparation
Cementowanie uzupełnień pełnoceramicznych przegląd piśmiennictwa. Część I
 PROTET. STOMATOL., 2008, LVIII, 4, 279-283 Cementowanie uzupełnień pełnoceramicznych przegląd piśmiennictwa. Część I Cementing of porcelain restorations review of the literature. Part I Przemysław Szczyrek
PROTET. STOMATOL., 2008, LVIII, 4, 279-283 Cementowanie uzupełnień pełnoceramicznych przegląd piśmiennictwa. Część I Cementing of porcelain restorations review of the literature. Part I Przemysław Szczyrek
POLITECHNIKA POZNAŃSKA ZAKŁAD CHEMII FIZYCZNEJ ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
 WARTOŚĆ ph ROZTWORÓW WODNYCH WSTĘP 1. Wartość ph wody i roztworów Woda dysocjuje na jon wodorowy i wodorotlenowy: H 2 O H + + OH (1) Stała równowagi tej reakcji, K D : wyraża się wzorem: K D = + [ Η ][
WARTOŚĆ ph ROZTWORÓW WODNYCH WSTĘP 1. Wartość ph wody i roztworów Woda dysocjuje na jon wodorowy i wodorotlenowy: H 2 O H + + OH (1) Stała równowagi tej reakcji, K D : wyraża się wzorem: K D = + [ Η ][
SPRAWOZDANIE 2. Data:... Kierunek studiów i nr grupy...
 SPRAWOZDANIE 2 Imię i nazwisko:... Data:.... Kierunek studiów i nr grupy..... Doświadczenie 1.1. Wskaźniki ph stosowane w laboratorium chemicznym. Zanotować obserwowane barwy roztworów w obecności badanych
SPRAWOZDANIE 2 Imię i nazwisko:... Data:.... Kierunek studiów i nr grupy..... Doświadczenie 1.1. Wskaźniki ph stosowane w laboratorium chemicznym. Zanotować obserwowane barwy roztworów w obecności badanych
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego. Wpływ stężenia kwasu na szybkość hydrolizy estru
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Wpływ stężenia kwasu na szybkość hydrolizy estru ćwiczenie nr 25 opracowała dr B. Nowicka, aktualizacja D. Waliszewski Zakres zagadnień obowiązujących do
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Wpływ stężenia kwasu na szybkość hydrolizy estru ćwiczenie nr 25 opracowała dr B. Nowicka, aktualizacja D. Waliszewski Zakres zagadnień obowiązujących do
ĆWICZENIE 2 WSPÓŁOZNACZANIE WODOROTLENKU I WĘGLANÓW METODĄ WARDERA. DZIAŁ: Alkacymetria
 ĆWICZENIE 2 WSPÓŁOZNACZANIE WODOROTLENKU I WĘGLANÓW METODĄ WARDERA DZIAŁ: Alkacymetria ZAGADNIENIA Prawo zachowania masy i prawo działania mas. Stała równowagi reakcji. Stała dysocjacji, stopień dysocjacji
ĆWICZENIE 2 WSPÓŁOZNACZANIE WODOROTLENKU I WĘGLANÓW METODĄ WARDERA DZIAŁ: Alkacymetria ZAGADNIENIA Prawo zachowania masy i prawo działania mas. Stała równowagi reakcji. Stała dysocjacji, stopień dysocjacji
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ELEKTRODA PH. Opis D031. Ryc. 1. Elektroda ph
 ELEKTRODA PH Opis D031 Ryc. 1. Elektroda ph Opis skrócony System pomiaru ph służy do ustalania stopnia kwasowości płynów, których ph przyjmuje wartości od 0 do 14. System tworzą elektroda ph oraz przedwzmacniacz
ELEKTRODA PH Opis D031 Ryc. 1. Elektroda ph Opis skrócony System pomiaru ph służy do ustalania stopnia kwasowości płynów, których ph przyjmuje wartości od 0 do 14. System tworzą elektroda ph oraz przedwzmacniacz
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
ZALEŻNOŚĆ MIĘDZY WYSOKOŚCIĄ I MASĄ CIAŁA RODZICÓW I DZIECI W DWÓCH RÓŻNYCH ŚRODOWISKACH
 S ł u p s k i e P r a c e B i o l o g i c z n e 1 2005 Władimir Bożiłow 1, Małgorzata Roślak 2, Henryk Stolarczyk 2 1 Akademia Medyczna, Bydgoszcz 2 Uniwersytet Łódzki, Łódź ZALEŻNOŚĆ MIĘDZY WYSOKOŚCIĄ
S ł u p s k i e P r a c e B i o l o g i c z n e 1 2005 Władimir Bożiłow 1, Małgorzata Roślak 2, Henryk Stolarczyk 2 1 Akademia Medyczna, Bydgoszcz 2 Uniwersytet Łódzki, Łódź ZALEŻNOŚĆ MIĘDZY WYSOKOŚCIĄ
Badanie wytrzymałości mechanicznej materiałów ceramicznych stosowanych w wykonawstwie uzupełnień pełnoceramicznych
 PROTET. STOMATOL., 2006, LVI, 3, 227-232 Badanie wytrzymałości mechanicznej materiałów ceramicznych stosowanych w wykonawstwie uzupełnień pełnoceramicznych Examination of flexural strength of all ceramic
PROTET. STOMATOL., 2006, LVI, 3, 227-232 Badanie wytrzymałości mechanicznej materiałów ceramicznych stosowanych w wykonawstwie uzupełnień pełnoceramicznych Examination of flexural strength of all ceramic
Kwas HA i odpowiadająca mu zasada A stanowią sprzężoną parę (podobnie zasada B i kwas BH + ):
 Spis treści 1 Kwasy i zasady 2 Rola rozpuszczalnika 3 Dysocjacja wody 4 Słabe kwasy i zasady 5 Skala ph 6 Oblicznie ph słabego kwasu 7 Obliczanie ph słabej zasady 8 Przykłady obliczeń 81 Zadanie 1 811
Spis treści 1 Kwasy i zasady 2 Rola rozpuszczalnika 3 Dysocjacja wody 4 Słabe kwasy i zasady 5 Skala ph 6 Oblicznie ph słabego kwasu 7 Obliczanie ph słabej zasady 8 Przykłady obliczeń 81 Zadanie 1 811
ĆWICZENIE 4. Oczyszczanie ścieków ze związków fosforu
 ĆWICZENIE 4 Oczyszczanie ścieków ze związków fosforu 1. Wprowadzenie Zbyt wysokie stężenia fosforu w wodach powierzchniowych stojących, spiętrzonych lub wolno płynących prowadzą do zwiększonego przyrostu
ĆWICZENIE 4 Oczyszczanie ścieków ze związków fosforu 1. Wprowadzenie Zbyt wysokie stężenia fosforu w wodach powierzchniowych stojących, spiętrzonych lub wolno płynących prowadzą do zwiększonego przyrostu
ODNAWIALNE ŹRÓDŁA ENERGII I GOSPODARKA ODPADAMI STUDIA STACJONARNE
 PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR ZIMOWY) ODNAWIALNE ŹRÓDŁA ENERGII I GOSPODARKA ODPADAMI STUDIA STACJONARNE Ćwiczenie 1 (Karty pracy laboratoryjnej: 1a, 1b, 1d, 1e) 1. Organizacja ćwiczeń.
PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR ZIMOWY) ODNAWIALNE ŹRÓDŁA ENERGII I GOSPODARKA ODPADAMI STUDIA STACJONARNE Ćwiczenie 1 (Karty pracy laboratoryjnej: 1a, 1b, 1d, 1e) 1. Organizacja ćwiczeń.
Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph
 Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph Dysocjacja elektrolitów W drugiej połowie XIX wieku szwedzki chemik S.A. Arrhenius doświadczalnie udowodnił, że substancje
Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph Dysocjacja elektrolitów W drugiej połowie XIX wieku szwedzki chemik S.A. Arrhenius doświadczalnie udowodnił, że substancje
SPOSÓB SPRAWDZANIA ZGODNOŚCI MATERIAŁÓW I WYROBÓW Z TWORZYW SZTUCZNYCH Z USTALONYMI LIMITAMI
 Załącznik do rozporządzenia Ministra Zdrowia z dnia 15 października 2013 r. SPOSÓB SPRAWDZANIA ZGODNOŚCI MATERIAŁÓW I WYROBÓW Z TWORZYW SZTUCZNYCH Z USTALONYMI LIMITAMI Ogólne zasady badania migracji globalnej
Załącznik do rozporządzenia Ministra Zdrowia z dnia 15 października 2013 r. SPOSÓB SPRAWDZANIA ZGODNOŚCI MATERIAŁÓW I WYROBÓW Z TWORZYW SZTUCZNYCH Z USTALONYMI LIMITAMI Ogólne zasady badania migracji globalnej
Reakcje utleniania i redukcji Reakcje metali z wodorotlenkiem sodu (6 mol/dm 3 )
 Imię i nazwisko.. data.. Reakcje utleniania i redukcji 7.1 Reaktywność metali 7.1.1 Reakcje metali z wodą Lp Metal Warunki oczyszczania metalu Warunki reakcji Obserwacje 7.1.2 Reakcje metali z wodorotlenkiem
Imię i nazwisko.. data.. Reakcje utleniania i redukcji 7.1 Reaktywność metali 7.1.1 Reakcje metali z wodą Lp Metal Warunki oczyszczania metalu Warunki reakcji Obserwacje 7.1.2 Reakcje metali z wodorotlenkiem
Równowaga kwasowo-zasadowa
 Równowaga kwasowo-zasadowa Elektrolity - substancje, które rozpuszczając się w wodzie lub innych rozpuszczalnikach rozpadają się na jony dodatnie i ujemne, czyli ulegają dysocjacji elektrolitycznej Stopień
Równowaga kwasowo-zasadowa Elektrolity - substancje, które rozpuszczając się w wodzie lub innych rozpuszczalnikach rozpadają się na jony dodatnie i ujemne, czyli ulegają dysocjacji elektrolitycznej Stopień
Wodorotlenki. n to liczba grup wodorotlenowych w cząsteczce wodorotlenku (równa wartościowości M)
 Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
8. MANGANOMETRIA. 8. Manganometria
 8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
Zmiana barwy wskaźników w roztworach kwaśnych, obojętnych i zasadowych.
 Zmiana barwy wskaźników w roztworach kwaśnych, obojętnych i zasadowych. Doświadczenie1: Poznanie barwy wskaźników w roztworach kwasów, zasad i wody. Wykonanie doświadczenia: Do pięciu probówek wlewamy
Zmiana barwy wskaźników w roztworach kwaśnych, obojętnych i zasadowych. Doświadczenie1: Poznanie barwy wskaźników w roztworach kwasów, zasad i wody. Wykonanie doświadczenia: Do pięciu probówek wlewamy
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 7
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
Ćwiczenie 1. Ćwiczenie Temat: Podstawowe reakcje nieorganiczne. Obliczenia stechiometryczne.
 PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR LETNI) OCHRONA ŚRODOWISKA Literatura zalecana 1. P. Szlachcic, J. Szymońska, B. Jarosz, E. Drozdek, O. Michalski, A. Wisła-Świder, Chemia I: Skrypt do
PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR LETNI) OCHRONA ŚRODOWISKA Literatura zalecana 1. P. Szlachcic, J. Szymońska, B. Jarosz, E. Drozdek, O. Michalski, A. Wisła-Świder, Chemia I: Skrypt do
Zad: 5 Oblicz stężenie niezdysocjowanego kwasu octowego w wodnym roztworze o stężeniu 0,1 mol/dm 3, jeśli ph tego roztworu wynosi 3.
 Zad: 1 Oblicz wartość ph dla 0,001 molowego roztworu HCl Zad: 2 Oblicz stężenie jonów wodorowych jeżeli wartość ph wynosi 5 Zad: 3 Oblicz stężenie jonów wodorotlenkowych w 0,05 molowym roztworze H 2 SO
Zad: 1 Oblicz wartość ph dla 0,001 molowego roztworu HCl Zad: 2 Oblicz stężenie jonów wodorowych jeżeli wartość ph wynosi 5 Zad: 3 Oblicz stężenie jonów wodorotlenkowych w 0,05 molowym roztworze H 2 SO
NAPRĘŻENIA ŚCISKAJĄCE PRZY 10% ODKSZTAŁCENIU WZGLĘDNYM PRÓBEK NORMOWYCH POBRANYCH Z PŁYT EPS O RÓŻNEJ GRUBOŚCI
 PRACE INSTYTUTU TECHNIKI BUDOWLANEJ - KWARTALNIK 1 (145) 2008 BUILDING RESEARCH INSTITUTE - QUARTERLY No 1 (145) 2008 Zbigniew Owczarek* NAPRĘŻENIA ŚCISKAJĄCE PRZY 10% ODKSZTAŁCENIU WZGLĘDNYM PRÓBEK NORMOWYCH
PRACE INSTYTUTU TECHNIKI BUDOWLANEJ - KWARTALNIK 1 (145) 2008 BUILDING RESEARCH INSTITUTE - QUARTERLY No 1 (145) 2008 Zbigniew Owczarek* NAPRĘŻENIA ŚCISKAJĄCE PRZY 10% ODKSZTAŁCENIU WZGLĘDNYM PRÓBEK NORMOWYCH
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
H2S, H2SO4, H2SO3, HNO3, H2CO3,
 Wymagania programowe z chemii dla klasy drugiej (na podstawie treści zawartych w podstawie programowej, programie nauczania oraz podręczniku dla klasy drugiej gimnazjum Chemia Nowej Ery). Wyróżnione wymagania
Wymagania programowe z chemii dla klasy drugiej (na podstawie treści zawartych w podstawie programowej, programie nauczania oraz podręczniku dla klasy drugiej gimnazjum Chemia Nowej Ery). Wyróżnione wymagania
I AM evolution * Efektywna i atraumatyczna retrakcja kieszonki umożliwiająca wykonanie naturalnej i estetycznej protetyki.
 Nr referencyjny Zestawy i aplikator Nr ref. 261 06 Nr ref. 294 000 Wyroby Nr ref. 260 900 Aplikator 1 Kapsułki I KANIULE Nr ref. 261 030 Kapsułki 20 Nr ref. 294 010 Kapsułki 6 Wyrób medyczny klasy I -
Nr referencyjny Zestawy i aplikator Nr ref. 261 06 Nr ref. 294 000 Wyroby Nr ref. 260 900 Aplikator 1 Kapsułki I KANIULE Nr ref. 261 030 Kapsułki 20 Nr ref. 294 010 Kapsułki 6 Wyrób medyczny klasy I -
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW.
 RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW. Zagadnienia: Zjawisko dysocjacji: stała i stopień dysocjacji Elektrolity słabe i mocne Efekt wspólnego jonu Reakcje strącania osadów Iloczyn rozpuszczalności Odczynnik
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW. Zagadnienia: Zjawisko dysocjacji: stała i stopień dysocjacji Elektrolity słabe i mocne Efekt wspólnego jonu Reakcje strącania osadów Iloczyn rozpuszczalności Odczynnik
A4.05 Instrukcja wykonania ćwiczenia
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego A4.05 nstrukcja wykonania ćwiczenia Wyznaczanie współczynników aktywności soli trudno rozpuszczalnej metodą pomiaru rozpuszczalności Zakres zagadnień obowiązujących
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego A4.05 nstrukcja wykonania ćwiczenia Wyznaczanie współczynników aktywności soli trudno rozpuszczalnej metodą pomiaru rozpuszczalności Zakres zagadnień obowiązujących
Kryteria oceniania z chemii dla klasy drugiej DLA UCZNIÓW Z OBOWIĄZKIEM DOSTOSOWANIA WYMAGAŃ EDUKACYJNYCH
 Kryteria oceniania z chemii dla klasy drugiej DLA UCZNIÓW Z OBOWIĄZKIEM DOSTOSOWANIA WYMAGAŃ EDUKACYJNYCH (na podstawie treści zawartych w podstawie programowej, programie nauczania oraz podręczniku dla
Kryteria oceniania z chemii dla klasy drugiej DLA UCZNIÓW Z OBOWIĄZKIEM DOSTOSOWANIA WYMAGAŃ EDUKACYJNYCH (na podstawie treści zawartych w podstawie programowej, programie nauczania oraz podręczniku dla
Równowagi w roztworach elektrolitów
 Do doświadczeń stosować suche szkło i sprzęt laboratoryjny. Po użyciu szkło i sprzęt laboratoryjny należy wstępnie opłukać, a po zakończonych eksperymentach dokładnie umyć (przy użyciu detergentów) i pozostawić
Do doświadczeń stosować suche szkło i sprzęt laboratoryjny. Po użyciu szkło i sprzęt laboratoryjny należy wstępnie opłukać, a po zakończonych eksperymentach dokładnie umyć (przy użyciu detergentów) i pozostawić
PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR LETNI) OCHRONA ŚRODOWISKA
 PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR LETNI) OCHRONA ŚRODOWISKA Ćwiczenie 1 (Karta pracy - 1a, 1b, 1c, 1d, 1e) 1. Organizacja ćwiczeń. Regulamin pracowni chemicznej i przepisy BHP (Literatura
PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR LETNI) OCHRONA ŚRODOWISKA Ćwiczenie 1 (Karta pracy - 1a, 1b, 1c, 1d, 1e) 1. Organizacja ćwiczeń. Regulamin pracowni chemicznej i przepisy BHP (Literatura
RÓWNOWAGI KWASOWO-ZASADOWE W ROZTWORACH WODNYCH
 RÓWNOWAGI KWASOWO-ZASADOWE W ROZTWORACH WODNYCH Większość reakcji chemicznych (w tym również procesy zachodzące w środowisku naturalnym) przebiegają w roztworach wodnych. Jednym z ważnych typów reakcji
RÓWNOWAGI KWASOWO-ZASADOWE W ROZTWORACH WODNYCH Większość reakcji chemicznych (w tym również procesy zachodzące w środowisku naturalnym) przebiegają w roztworach wodnych. Jednym z ważnych typów reakcji
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks
 Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Wymagania programowe na poszczególne oceny CHEMII kl. II 2017/2018. III. Woda i roztwory wodne. Ocena dopuszczająca [1] Uczeń:
![Wymagania programowe na poszczególne oceny CHEMII kl. II 2017/2018. III. Woda i roztwory wodne. Ocena dopuszczająca [1] Uczeń: Wymagania programowe na poszczególne oceny CHEMII kl. II 2017/2018. III. Woda i roztwory wodne. Ocena dopuszczająca [1] Uczeń:](/thumbs/70/63524095.jpg) Wymagania programowe na poszczególne oceny CHEMII kl. II 2017/2018 III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących w przyrodzie podaje, na czym polega obieg wody w przyrodzie wymienia
Wymagania programowe na poszczególne oceny CHEMII kl. II 2017/2018 III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących w przyrodzie podaje, na czym polega obieg wody w przyrodzie wymienia
