MEDYCYNA ROZRODU Z ELEMENTAMI SEKSUOLOGII
|
|
|
- Aniela Smolińska
- 7 lat temu
- Przeglądów:
Transkrypt
1 MEDYCYNA ROZRODU Z ELEMENTAMI SEKSUOLOGII Skrypt dla studentów i lekarzy Autorzy: prof. dr hab. med. Jolanta Słowikowska-Hilczer Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności UM w Łodzi dr hab. med. Renata Walczak-Jędrzejowska Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności UM w Łodzi dr n. med. Katarzyna Marchlewska Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności UM w Łodzi prof. dr hab. med. Krzysztof Kula Instytut Centrum Zdrowia Matki Polki w Łodzi dr med. Elżbieta Oszukowska II Klinika Urologii UM w Łodzi prof. dr hab. med. Agata Karowicz-Bilińska Klinika Patologii Ciąży, I Katedra Ginekologii i Położnictwa UM w Łodzi Łódź 2017
2 Spis treści 1. RÓŻNICOWANIE I ROZWÓJ PŁCIOWY RÓŻNICOWANIE I ROZWÓJ GONAD Fizjologia Zaburzenia różnicowania gonad RÓŻNICOWANIE NARZĄDÓW PŁCIOWYCH (PŁEĆ GENITALNA) Fizjologia Zaburzenia i postępowanie lekarskie ZSTĘPOWANIE JĄDER Fizjologia Zaburzenia i postępowanie lekarskie RÓŻNICOWANIE PŁCIOWE MÓZGU (PŁEĆ PSYCHICZNA) Fizjologia Zaburzenia identyfikacji płciowej DOJRZEWANIE PŁCIOWE Fizjologia Zaburzenia dojrzewania i postępowanie lekarskie MĘSKI UKŁAD PŁCIOWY W OKRESIE DOJRZAŁOŚCI JĄDRO Budowa jądra Czynność plemnikotwórcza Budowa i czynność plemnika Czynność dokrewna jądra i jej regulacja WEWNĘTRZNE NARZĄDY PŁCIOWE Najądrze Nasieniowód Pęcherzyki nasienne Gruczoł krokowy ZEWNĘTRZNE NARZĄDY PŁCIOWE
3 Prącie Moszna REAKCJE PŁCIOWE Wzwód prącia Wytrysk nasienia Szczytowanie DIAGNOSTYKA ANDROLOGICZNA Badanie podmiotowe Badanie przedmiotowe Badanie nasienia wg zaleceń WHO z 2010 roku Badania hormonalne Biopsja jąder Badania genetyczne Inne badania dodatkowe NIEPŁODNOŚĆ MĘSKA Ogólna systematyka Zaburzenia czynności jąder Niedrożność dróg wyprowadzających plemniki Niepłodność autoimmunologiczna CHOROBY ZAPALNE MĘSKIEGO UKŁADU PŁCIOWEGO Zapalenie najądrza i jądra Zapalenie stercza i pęcherzyków nasiennych Łagodny przerost gruczołu krokowego NOWOTWORY MĘSKIEGO UKŁADU PŁCIOWEGO Nowotwory jąder Rak gruczołu krokowego ZABURZENIA MĘSKICH REAKCJI PŁCIOWYCH Zaburzenie ukierunkowania popędu płciowego Zaburzenia nasilenia popędu płciowego
4 Zaburzenia wzwodu Zaburzenia wytrysku Zaburzenia szczytowania CHOROBY SUTKA U MĘŻCZYZN STARZENIE SIĘ MĘSKIEGO UKŁADU PŁCIOWEGO ŻEŃSKI UKŁAD PŁCIOWY W OKRESIE DOJRZAŁOŚCI JAJNIK Budowa jajnika Czynność gametotwórcza jajnika Czynność dokrewna jajnika WEWNĘTRZNE NARZĄDY PŁCIOWE Macica Jajowód Pochwa ZEWNĘTRZNE NARZĄDY PŁCIOWE Wargi sromowe Przedsionek pochwy Łechtaczka REAKCJE PŁCIOWE U KOBIET Pobudzenie seksualne Podniecenie płciowe Orgazm DIAGNOSTYKA ŻEŃSKIEGO UKŁADU PŁCIOWEGO Badanie podmiotowe Badanie przedmiotowe Badania hormonalne Diagnostyka cyklu płciowego Inne badania NIEPŁODNOŚĆ ŻEŃSKA
5 Ogólna systematyka Zaburzenia czynności jajników CHOROBY ZAPALNE ŻEŃSKIEGO UKŁADU PŁCIOWEGO Choroby zapalne sromu Choroby zapalne pochwy Zakażenia macicy i przydatków NOWOTWORY ŻEŃSKIEGO UKŁADU PŁCIOWEGO Nowotwory łagodne Nowotwory złośliwe ZABURZENIA REAKCJI PŁCIOWYCH U KOBIET Wzmożenie popędu płciowego Brak lub osłabienie popędu płciowego Zaburzenia szczytowania Niemożność penetracji pochwy PRZEKWITANIE NIEPŁODNOŚĆ MAŁŻEŃSKA ZAPŁODNIENIE I ZAGNIEŻDŻANIE ZARODKA DEFINICJA NIEPŁODNOŚCI PARY Główne zasady strategii leczenia niepłodnej pary TECHNIKI WSPOMAGANEGO ROZRODU SZTUCZNA INSEMINACJA ZAPŁODNIENIE POZAUSTROJOWE I PRZENIESIENIE ZARODKA DO JAMY MACICY KRIOPREZERWACJA PLEMNIKÓW, KOMÓREK JAJOWYCH I ZARODKÓW ORAZ PROGRAM DAWSTWA ANTYKONCEPCJA METODY ANTYKONCEPCYJNE DLA KOBIET Tabletki dwuskładnikowe Inne formy antykoncepcji hormonalnej Inne metody antykoncepcyjne METODY ANTYKONCEPCYJNE DLA MĘŻCZYZN
6 6.3. SKUTECZNOŚĆ METOD ANTYKONCEPCYJNYCH MIŁOŚĆ I ROZWÓJ ZWIĄZKU UCZUCIOWEGO
7 Spis skrótów A ACTH AFP AGS AID AIH AIS AMH ART ASA AZF BBT BMI BPH CAH CAIS CFTR androstendion ang. adrenocorticotropin hormone, hormon kortykotropowy alfa-fetoproteina ang. adreno-genital syndrome, zespół nadnerczowo-płciowy ang. artificial insemination with donor semen, inseminacja nasieniem dawcy ang. artificial insemination with husband s semen, inseminacja nasieniem męża ang. androgen insensitivity syndrome, zespół niewrażliwości na androgeny ang. anti-müllerian hormone, hormon antymuellerowski ang. assisted reproduction technologies, techniki wspomaganego rozrodu ang. anti-sperm antibody, przeciwciała przeciwplemnikowe ang. azoospermia factor, zespół genów na ramieniu długim chromosomu Y konieczny do postępu spermatogenezy ang. basal body temperature, podstawowa temperatura ciała ang. body mass index, indeks masy ciała ang. benign prostatic hyperplasia, łagodny przerost gruczołu krokowego ang. congenital adrenal hyperplasia, wrodzony przerost nadnerczy, zespół nadnerczowo-płciowy ang. complete androgen insensitivity syndrome, zespół całkowitej niewrażliwości na androgeny ang. cystic fibrosis transmembrane conductance regulator, gen odpowiedzialny za regulację przewodnictwa przezbłonowego w zwłoknieniu torbielowatym, mutacja w tym genie prowadzi do mukowiscydozy CGRP CIN CIS CUN DFI DHEA DHEAS DHT DSD DTA E2 FRP FSH ft3 ft4 FTI FUS ang. calcitonin gene-related peptide, peptyd związany z genem kalcytoniny ang. intracervical neoplasia, stan przedrakowy szyjki macicy łac. carcinoma in situ, przedinwazyjny wewnątrzkanalikowy nowotwór jądra centralny układ nerwowy ang. DNA fragmentation index, odsetek plemników z fragmentacją DNA dehydroepiandrosteron siarczan dehydroepiandrosteronu dihydrotestosteron ang. disorders of sex development, zaburzenia rozwoju płci doustne tabletki antykoncepcyjne estradiol ang. follicle regulatory protein, białko regulacji pęcherzyka ang. follicle stimulating hormone, hormon folikulotropowy wolna trijodotyronina wolna tyroksyna ang. free testosterone index, indeks wolnego testosteronu wyliczany ze stężeń całkowitego testosteronu i SHBG ang. focused ultrasound, ultradźwięki o wysokiej mocy 7
8 GCNIS GCT GnRH HBV hcg HCV HDS HIFU HIV HLP hmg HPV HSG HTZ ICI ICSI IGF IMSI IUD IUI IVF IVF-ET KOWD KOWR LDH LH LOH LUF MACS MESA ang. germ cell neoplasia in situ, nowotwór z komórek płciowych in situ ang. germ cell tumours, nowotwory jąder wywodzące się z płodowych komórek płciowych ang. gonadotropin releasing hormone, hormone uwalniający gonadotropiny, gonadoliberyna ang. hepatitis B virus, wirus zapalenia wątroby typu B ang. human chorionic gonadotropin, ludzka gonadotropina kosmówkowa ang. hepatitis C virus, wirus zapalenia wątroby typu C ang. high DNA stainability, niedojrzałość chromatyny plemnikowej ang. high intensity focused ultrasound, ultradźwięki o wysokiej mocy ang. human immunodeficiency virus, wirus niedoboru odporności ang. human placental lactogen, ludzki laktogen łożyskowy ang. human menopausal gonadotropin, ludzka gonadotropina menopauzalna ang. human papilloma virus, wirus brodawczaka ludzkiego histerosalpingografia hormonalna terapia zastępcza ang. intracervical insemination, inseminacja doszyjkowa ang. intracytoplasmic sperm injection, docytoplazmatyczne wstrzyknięcie plemnika ang. insulin-like growth factor, insulinopodobny czynnik wzrostu ang. intracytoplasmatic morphology-selected sperm injection, docytoplazmatyczne wstrzyknięcie plemnika poprzedzone oceną jego morfologii w dużym powiększeniu ang. intrauterine device, wkładka domaciczna ang. intrauerine insemination, inseminacja domaciczna ang. in vitro fertilization, zapłodnienie pozaustrojowe ang. in vitro fertilization with embryo transfer, sztuczne zapłodnienie z przeniesieniem zarodka do jamy macicy konstytucjonalne opóźnienie wzrostu i dojrzewania konstytucjonalne opóźnienie wzrostu i rozwoju ang. lactate dehydrogenase, dehydrogenaza mleczanowa ang. luteinizing hormone, hormon luteinizujący ang. late-onset hypogonadism, późno występujący hipogonadyzm u mężczyzn ang. luteinized unruptured follicle, luteinizacja niepękniętego pęcherzyka Graafa ang. magnethic activated cell sorting, sortowanie plemników w polu magnetycznym ang. microsurgical epididymal sperm aspiration, mikrochirurgiczne pozyskanie plemników z najądrza MSOME ang. motile sperm organelle morphology examination, wybór plemnika o prawidłowej budowie w mikroskopie o dużym powiększeniu NO NSE OMI OUN tlenek azotu neuroenolaza ang. oocyte meiosis inhibitor, białko hamujące mejozę owocytu wydzielane przez komórki ziarniste pęcherzyka ośrodkowy układ nerwowy 8
9 PADAM ang. partial androgen deficiency in aging men, częściowy niedobór androgenów u starszych mężczyzn PAIS PCOS PCT ang. partial androgen insensitivity syndrome, zespół częściowej niewrażliwości na androgeny ang. polycystic ovary syndrome, zespół policystycznych jajników, zespół Stein-Leventhala ang. postcoital test, test po stosunku, test Simsa-Hühnera PDE-5 ang. phosphodiesterase type 5, fosfodiesteraza typu 5 PDG PGC PICSI PID PLAP PMS PRL PSA SCD SCMC SCSA SDF SHBG SLE SRY T TDS TdT TESA TESE TRH TRUS TUNEL TSH WHO ZIP przedimplantacyjna diagnostyka genetyczna ang. primordial germ cells, pierwotne komórki płciowe ang. physiological intracytoplasmic sperm injection, docytoplazmatyczne wstrzyknięcie plemnika z zastosowaniem testu wiązania kwasu hialuronowego ang. pelvic inflammatory disease, choroba zapalna miednicy mniejszej ang. placental like alkaline phosphatase, fosfataza zasadowa typu łożyskowego ang. premenstrual syndrome, zespół napięcia przedmiesiączkowego prolaktyna ang. prostatic specific antigen, antygen specyficzny dla prostaty ang. sperm chromatin dispersion, test dyspersji chromatyny ang. sperm-cervical mucus contact, test kontaktu nasienia ze śluzem szyjki macicy ang. sperm chromatin structure assay, ocena struktury chromatyny ang. sperm DNA fragmentation, odsetek plemników z pofragmentowanym DNA ang. sex hormone binding globulin, globulina wiążąca steroidy płciowe ang. systemic lupus erythematosus, toczeń rumieniowaty układowy ang. sex determining region Y, zespół genów na krótkim ramieniu chromosomu Y ukierunkowujących rozwój gonady w jadro testosteron ang. testicular dysgenesis syndrome, zespół dysgenezji jąder ang. terminal deoxynucleotidyl transferase, terminalna transferaza deoksynukleotydowa ang. testicular sperm aspiration, aspiracyjne pozyskanie plemników z jądra ang. testicular sperm extraction, pobranie plemników z jąder ang. thyreotropin releasing hormone, tyreoliberyna ang. transrectal ultrasonography, ultrasonografia transrektalna ang. terminal deoxynucleotidyl transferase-mediated dudp nick end-labeling, przyłączenie znakowanego fluorochromem nukletydu do nici DNA w miejscu jej pęknięcia w obecności enzymu terminalnej transferazy deoksynukleotydylowej ang. thyreotropin stimulating hormone, tyreotropina ang. World Health Organization, Światowa Organizacja Zdrowia zaburzenia identyfikacji płciowej 9
10 1. RÓŻNICOWANIE I ROZWÓJ PŁCIOWY Różnicowaniem płciowym nazywamy procesy zachodzące w okresie płodowym, które na podstawie płci genetycznej doprowadzają do powstania różnic płciowych w budowie i czynności gonad (płeć gonadalna), a w konsekwencji czynności hormonalnej gonad do powstania różnic płciowych w budowie i czynności narządów płciowych (płeć genitalna), różnic w budowie ciała ujawniających się w okresie dojrzewania płciowego (płeć somatyczna) oraz w budowie i czynności mózgu (płeć psychiczna) RÓŻNICOWANIE I ROZWÓJ GONAD Fizjologia Gonada niezróżnicowana Pierwotne gonady tworzą się po obu stronach zarodka ze śródnerczy, które są także zawiązkami nerek i nadnerczy. Początkowym etapem powstania gonad jest powstanie listew płciowych, które w 5 tygodniu rozwoju ludzkiego zarodka tworzą się z nabłonka mezenchymalnego na brzuszno przyśrodkowej powierzchni śródnerczy. W 6 tygodniu zanika błona podstawna nabłonka listwy płciowej, a komórki nabłonka penetrują do leżącej pod nim mezenchymy. Zagęszczone pasma komórek nabłonka mezenchymalnego tworzą sznury płciowe. W tym okresie struktura gonady nie ma cech charakterystycznych dla płci (gonada niezróżnicowana). Formowanie pierwotnej, bipotencjalnej gonady odbywa się pod kontrolą takich czynników jak WT1 (ang. Wilms tumour suppressor 1) gen w chromosomie 11, SF1 (ang. steroidogenic factor 1) gen w chromosomie 9, EMX2 (ang. empty spiracles homologue) gen w chromosomie 19, CBX2 (ang. chromobox homologue 2) gen w chromosomie 17, LHX9 (ang. LIM homeobox protein 9) gen w chromosomie 1. Pierwotne komórki płciowe człowieka (komórki prapłciowe, PGC ang. primordial germ cells) wywodzą się z wielopotencjalnych komórek rozwijającego się pęcherzyka żółtkowego. Przekształcanie się w linię płciową podejmują nieliczne komórki epiblastyczne leżące obwodowo i dogłowowo w miejscach styku tarczy zarodkowej z trofoblastem. PGC migrują do szypuły pęcherzyka żółtkowego wokół omoczni, aby wejść do zarodka od dystalnej strony jelita pierwotnego. Są rozpoznawane w sąsiedztwie endodermy pęcherzyka żółtkowego już w 3 tygodniu rozwoju ludzkiego zarodka. Komórki linii płciowej od otaczających je komórek somatycznych można wyróżnić i zidentyfikować, między innymi na podstawie wysokiej aktywności fosfatazy zasadowej. W 4 tygodniu komórki te dzięki zdolności do ruchów ameboidalnych migrują wzdłuż środkowej linii zarodka pod nabłonek przyśrodkowej części śródnercza, gdzie intensywnie namnażają się. Komórki somatyczne śródnercza (prekursory komórek Sertolego) produkują substancje chemotaktyczne, aby przyciągnąć PGC. Czynnikiem chemotaktycznym dla migrujących PGC jest chemokina SDF 1 (ang. stromal cell derived factor 1), dla której mają one białko błonowe CXCR4. Dla przeżycia i proliferacji PGC zasadnicze znaczenie ma receptor c kit kinazy tyrozynowej i jego ligand SCF (ang. stem cell factor). Różnicowanie i rozwój jąder Okres płodowy Przekształcenie się gonady niezróżnicowanej w jądro zależy od obecności i aktywności chromosomu Y. Zespół genów ukierunkowujących rozwój gonady w kierunku męskim został zlokalizowany na krótkim ramieniu chromosomu Y. Gen SRY (ang. sex determining region Y) ma zasadnicze znaczenie w determinacji 10
11 płci. U myszy za kontrolę ekspresji genu Sry odpowiadają takie czynniki jak: SF1, WT1, GATA4/FOG2 (ang. GATA binding protein 4/zinc finger protein 2) i receptory insulinopodobnych czynników wzrostu. Białko SRY jest czynnikiem transkrypcyjnym, którego rola polega na inicjowaniu ekspresji genu SOX9 w chromosomie 19, decydującego o determinacji płci w kierunku męskim. Białko SOX9 jest czynnikiem transkrypcyjnym produkowanym podczas całego okresu rozwoju jądra. Jego rolą jest pobudzanie ekspresji szeregu genów, które mają zasadnicze znaczenie dla powstania fenotypu męskiej gonady. U myszy wykazano, że SOX9 pobudza także ekspresję genu Fgf9 (ang. fibroblast growth factor 9), który zwrotnie podwyższa ekspresję genu Sox9. Dotychczas nie znaleziono jednak związku FGF9 z determinacją płci u człowieka. U ludzi w tym samym czasie co SRY ulega ekspresji gen DMRT1 (ang. Doublesex and MAB 3 Related Transcription Factor 1) w chromosomie 9, który jak się przypuszcza, może mieć udział w determinacji płci męskiej. Szlak molekularny kierujący różnicowaniem bipotencjalnej gonady w jądro musi być zainicjowany wcześniej niż szlak różnicujący pierwotną gonadę w jajnik, aby doprowadzić do jego wyciszenia. Sznury płciowe (zawiązki pierwotnych kanalików jądra) Jednym z pierwszych objawów różnicowania się gonady w kierunku jądra jest powiększenie obwodowych części sznurów płciowych, które następnie rozdzielają się na sznury potomne tworząc pierwotne kanaliki plemnikotwórcze (nasienne) jądra. Przyśrodkowe części sznurów łączą się i tworzą sieć jądra, która z kolei łączy się z kanalikami śródnercza. Powstaną z nich przewody odprowadzające jądra i najądrze. Około 7 tygodnia rozwoju zarodka, w pierwotnych kanalikach jądra stwierdza się obecność pierwotnych komórek Sertolego, których prekursorami są komórki proliferującego nabłonka mezotelialnego sznurów płciowych. Objawem różnicowania pierwotnych komórek pre Sertoli w komórki Sertolego jest ich polaryzacja, podczas której agregaty komórkowe zaczynają się przekształcać w struktury sznurów płciowych. Od 8 tygodnia komórki Sertolego syntetyzują białkowy hormon antymuellerowski (AMH ang. anty müllerian hormone), który powoduje zanik przewodów Müllera (przyśródnerczowych), zawiązków żeńskich wewnętrznych narządów płciowych (jajowodów, macicy, górnej części pochwy). Gen AMH u ludzi zlokalizowany jest na chromosomie 19, a gen receptora typu 2 dla AMH (AMHR2) na chromosomie 12. Gametogeneza płodowa W pierwotnych kanalikach jądra obecne są także pierwotne komórki płciowe nazywane już tutaj gonocytami. Gonocyty od 15 do 25 tygodnia rozwoju zarodka mnożą się intensywnie, ale jednocześnie obserwuje się ich nasiloną apoptozę. W okresie okołourodzeniowym liczba gonocytów w stosunku do komórek Sertolego jest bardzo mała. Jest to spowodowane z jednej strony zahamowaniem procesów podziałowych gonocytów na krótko przed porodem, jak i ich apoptozą. Gruczoł śródmiąższowy Mezenchyma rozrasta się pomiędzy sznurami płciowymi tworząc tkankę śródmiąższową jądra, w której rozwijają się naczynia krwionośne. Komórki mezenchymalne przekształcają się w fibroblasty i komórki Leydiga. Proces różnicowania się pierwszej populacji komórek Leydiga zachodzi przy udziale takich czynników jak: DHH (ang. desert hedgehog), ATRX (ang. α thalassemia, mental retardation, X linked), ARX (ang. aristaless related homeobox X linked), SF1, białko StAR (ang. steroidogenic acute regulatory protein) i enzym CYP11A1. W ok. 7 tygodniu rozwoju zarodka komórki Leydiga rozpoczynają biosyntezę testosteronu. Stężenie testosteronu jest najwyższe między 12 a 14 tygodniem rozwoju zarodka płci męskiej, a później zaczyna 11
12 stopniowo zmniejszać się. Za pobudzenie biosyntezy testosteronu w tym okresie odpowiedzialna jest głównie gonadotropina wytwarzana w kosmówce łożyska (hcg ang. human chorionic gonadotropin). Około 10 tygodnia ciąży stwierdza się jej najwyższe stężenia w surowicy krwi matki i płodu, a w tkance jądra obecne są receptory dla hcg. Gonadotropiny przysadkowe płodu osiągają szczyt stężenia we krwi płodu pomiędzy 18 a 21 tygodniem ciąży, po czym ich stężenie zmniejsza się i utrzymuje na niskim poziomie aż do okresu noworodkowego. Wydzielanie testosteronu przez komórki Leydiga w okresie między 8 a 20 tygodniem ciąży determinuje różnicowanie męskich wewnętrznych narządów płciowych z przewodów śródnerczowych Wolffa oraz zewnętrznych narządów płciowych z zatoki moczowo płciowej, ale dopiero po przekształceniu testosteronu do dihydrotestosteronu (DHT) przy współudziale enzymu 5α reduktazy. Okres niemowlęcy Kanaliki plemnikotwórcze W jądrach noworodków i niemowląt kanaliki plemnikotwórcze mają średnicę stanowiącą ok. 1/5 średnicy stwierdzanej u dorosłych mężczyzn. Kanaliki położone są ściśle obok siebie, tak, że tkanka międzykanalikowa stanowi jedynie niewielki procent objętości gonady. Wypełnione są w sposób zwarty niedojrzałymi komórkami Sertolego, które stanowią około 90% wszystkich komórek kanalika. Pozostałe 10% komórek kanalika to gonocyty i powstałe z nich pierwsze niezróżnicowane spermatogonie (spermatogonie typu A), prekursory spermatogenezy. Tuż po urodzeniu gonocyty są zlokalizowane w centrum kanalika, a następnie przesuwają się do błony podstawnej i stopniowo przekształcają się w spermatogonie typu A. Przypuszcza się, że AMH wydzielane przez komórki Sertolego, może być czynnikiem pobudzającym przekształcenie gonocytów w spermatogonie A. Hormon ten jest również odpowiedzialny za fizjologiczne zatrzymanie spermatogenezy w okresie dziecięcym, aż do okresu dojrzewania na poziomie spermatogonii. Gonocyty powinny przekształcić się w spermatogonie w końcowym okresie życia płodowego, najpóźniej w kilka miesięcy po urodzeniu. Uważa się, że gonocyty, które przetrwają w kanalikach poza okres 1 roku życia chłopca, są komórkami potencjalnie nowotworowymi. Gruczoł śródmiąższowy Nieliczne komórki Leydiga można stwierdzić zaraz po urodzeniu. Objawem krótkotrwałego, przejściowego pobudzenia komórek Leydiga jest wysoki poziom testosteronu stwierdzany do 4 miesiąca po urodzeniu. Następnie komórki Leydiga ulegają fizjologicznemu uwstecznieniu w ciągu kilku pierwszych miesięcy życia i przez wiele lat nie można ich odróżnić od fibroblastów. Okres przeddojrzewaniowy Kanaliki plemnikotwórcze Wzrost ludzkiego jądra w ciągu pierwszych 10 lat życia jest prawie niezauważalny. Objętość jądra w tym okresie wynosi 1-3 ml i wyraźnie zwiększa się kilka miesięcy przed innymi klinicznymi oznakami dojrzewania płciowego (>4 ml). Mimo to, już od okresu niemowlęcego średnica kanalików jądra wzrasta 2-3 krotnie (ok. 45 m przy urodzeniu do 90 m w 10 roku życia), zwiększa się także ich długość i pojawia się światło kanalików. Struktura jądra dzieci jest niezmieniona aż do wczesnego etapu dojrzewania płciowego. Nadal w kanalikach jądra większość komórek stanowią niedojrzałe komórki Sertolego. Im bliżej okresu dojrzewania liczebność komórek Sertolego na przekroju kanalika jest coraz mniejsza, co jest wynikiem zahamowania ich 12
13 podziałów przy postępującym wzroście kanalika. Proliferacja komórek Sertolego u człowieka kończy się bardzo wcześnie, prawdopodobnie jeszcze przed 1 rokiem życia. Hormony tarczycy mają wpływ na przyspieszenie dojrzewania komórek Sertolego i w związku z tym na zakończenie ich proliferacji. Gametogeneza przeddojrzewaniowa Nieliczne komórki płciowe stwierdzane po upływie 1 roku życia chłopca to spermatogonie typu A, wśród których wyróżnia się: ciemne - zapasowe komórki pnia i jasne - różnicujące się. Liczebność spermatogonii A jasnych w stosunku do A ciemnych powoli zwiększa się wraz z wiekiem. Stopniowo zaczynają też pojawiać się komórki reprezentujące wyższe etapy spermatogenezy: spermatogonie typu B i spermatocyty w stadium preleptotenu podziału mejotycznego. U chłopców 4-6 letnich można stwierdzić pojedyncze spermatocyty w stadium leptotenu, zygotenu, a nawet pachytenu pierwszej mejozy. Dynamika tych przemian jest jednak nikła. Gruczoł śródmiąższowy W gruczole śródmiąższowym jądra przeddojrzewaniowego znajdują się głównie fibroblasty i nieliczne komórki Leydiga. Znikoma jest ich czynność, czego dowodem są bardzo niskie poziomy testosteronu we krwi (0,2-0,7 nmol/l). W tym samym czasie niskie są także poziomy gonadotropin we krwi i nie można pobudzić ich wydzielania podawaniem gonadoliberyny. Okres dojrzewania płciowego Pierwszym klinicznym zwiastunem dojrzewania płciowego jest zwiększenie objętości jąder u chłopców w wieku między 9,5 a 13,5 rokiem życia ponad przeddojrzewaniową objętość (za wartość graniczną przyjmuje się 4 ml). Wzrost jądra jest spowodowany zwiększeniem długości oraz średnicy kanalików plemnikotwórczych ( m u dorosłych mężczyzn). Stają się one bardziej kręte, poszerza się ich światło. Wielkość światła kanalików zależy od wzrostu ciśnienia płynu wydzielanego przez dojrzałe komórki Sertolego. Dojrzewanie komórek Sertolego polega na zwiększeniu ich rozmiarów i zmianach w morfologii. Jądra komórkowe powiększają się, a w ich centrum pojawia się duże i wyraźne jąderko. Przestrzenie międzykanalikowe poszerzają się. Pojawiają się w nich komórki Leydiga w zwiększonej liczbie. Pierwsze plemniki pojawiają się już we wczesnym etapie dojrzewania płciowego ok roku życia. Przypuszcza się, że FSH ma największe znaczenie dla dojrzewania kanalika jądra. W okresie, kiedy rozpoczyna się pierwsza spermatogeneza, poziomy FSH osiągają maksimum. Poziom krążącego FSH obniża się dopiero wtedy, gdy w nabłonku plemnikotwórczym pojawiają się pierwsze plemniki. FSH ma zdolność zwiększania liczby receptorów dla LH w jądrze w okresie dojrzewania i w ten sposób przygotowuje gonadę na działanie LH. FSH nie jest jednak jedynym hormonem indukującym odpowiedź na LH. Zdolność tę mają również hormon wzrostu i prolaktyna. Różnicowanie i rozwój jajnika Okres płodowy Zrąb jajnika Żeński genotyp zawiera dwa chromosomy X (płeć genetyczna żeńska). Dla morfogenezy jajnika zasadnicze znaczenie ma gen DAX-1 w chromosomie X. Różnicowanie jajnika rozpoczyna się u zarodka żeńskiego w 8 tygodniu życia płodowego. Sznury płciowe rozdzielają się na wysepki komórkowe, które ulegają zanikowi w części centralnej gonady. Na ich miejsce wni- 13
14 ka mezenchyma, która przekształca się w tkankę łączną zawierającą naczynia krwionośne. Z niej wywodzą się również komórki otoczki pęcherzyków jajnikowych. W części obwodowej (korowej) pozostają wyspy komórek pochodzące z mezodermy nabłonka listwy płciowej. Komórki te są prekursorami komórek ziarnistych (pęcherzykowych). Do nich wnikają gonocyty. Gametogeneza płodowa W 15 tygodniu rozwoju zarodka powstają pierwotne pęcherzyki jajnikowe, które utworzone są z owogonii (przekształcone gonocyty) i pojedynczej warstwy komórek ziarnistych. Owogonie przekształcają się w owocyty I-ego rzędu, które są zahamowane w przebiegu mejozy w profazie w stadium diakinezy, aż do okresu dojrzałości płciowej. Za zatrzymanie mejozy odpowiada białko zwane inhibitorem mejozy owocytu (OMI ang. oocyte meiosis inhibitor), wytwarzane przez komórki warstwy ziarnistej. Owocyty I-ego rzędu stanowią pulę komórek ulegających ciągłej degeneracji (atrezji). Ich liczba zmniejsza się z ok. 7 mln w 7 miesiącu życia płodowego do ok. 1 mln po urodzeniu i ok. 400 tys. w okresie dojrzewania płciowego. Płodowe jajniki wytwarzają niewielkie ilości steroidów podczas pierwszych 6 miesięcy ciąży. Ponadto nie stwierdzono w nich receptorów dla hcg i FSH w tym okresie. Wydaje się jednak, że pod koniec drugiego i w trzecim trymestrze ciąży, na rozwój jajnika mogą wpływać gonadotropiny przysadkowe, zwłaszcza FSH. U płodów bezmózgowych obserwowano bowiem zmniejszenie objętości jajników i zanik pęcherzyków pierwotnych. Okres przeddojrzewaniowy Jajnik zwiększa stale swoją objętość począwszy od okresu noworodkowego (średnica ok. 1 cm) do dojrzałości płciowej (długość 2,5-5 cm, szerokość 1,5-3 cm, grubość 0,5-1,5 cm). Wzrost jajnika spowodowany jest głównie zwiększeniem ilości tkanki łącznej podścieliska. W okresie przeddojrzewaniowym obserwuje się dojrzewanie nielicznych pęcherzyków jajnikowych, które jednak nigdy nie osiągają stadium pęcherzyka Graafa, gdyż ulegają wcześniejszej atrezji. Podstawowe stężenia estradiolu i gonadotropin we krwi są niskie, chociaż obserwuje się ich pewne cykliczne zmiany. Stężenie estradiolu oznaczane w żyle jajnikowej jest 2-3-krotnie większe niż w krążeniu, co wskazuje na pewną aktywność hormonalną komórek ziarnistych w tym okresie. Okres dojrzewania płciowego U większości dziewcząt pierwsze owulacje pojawiają się po ok. 6 miesiącach od wystąpienia pierwszej miesiączki. Cykle jajnikowe w ciągu pierwszych 1-2 lat miesiączkowania mogą charakteryzować się skróconą fazą lutealną i częstym brakiem owulacji Zaburzenia różnicowania gonad Etiologia Przyczyną zaburzeń organogenezy gonad i różnicowania narządów płciowych mogą być zaburzenia liczbowe i strukturalne chromosomów płciowych. Jednak w większości przypadków przyczyna jest nieznana. Wiele badań wykazało związek między częstością występowania zaburzeń rozwoju męskiego układu rozrodczego i wzmożoną ekspozycją na czynniki środowiskowe o działaniu biologicznym naśladującym estrogeny (tzw. ksenoestrogeny), które mają także działanie antyandrogenne. Klasyfikacja Zaburzenie organogenezy (różnicowania) jąder to ich: agenezja niewykształcenie zawiązka gonady i w konsekwencji brak jądra, 14
15 dysgenezja słaby rozwój jądra z gonady pierwotnej, a w konsekwencji zaburzenie jego czynności plemnikotwórczej i hormonalnej, współobecność jądra i jajnika. Wszystkim zaburzeniom organogenezy jąder towarzyszą zaburzenia organogenezy narządów płciowych w kierunku męskim, przy czym zaburzenia organogenezy narządów płciowych mogą występować bez zaburzeń organogenezy gonad. Do niedawna wady te określano mianem interseksualizmu, obojnactwa lub odwróceniem płci. W 2006 r. European Society for Paediatric Endocrinology (ESPE) oraz Lawson Wilkins Paediatric Endocrine Society (LWPES) opracowały konsensus, w którym zaproponowano, aby wszystkie te wady objęto wspólną nazwą zaburzenia rozwoju płciowego (DSD ang. disorders of sex development). W tabeli 1 przedstawione jest porównanie starej i nowej nomenklatury. Tabela 1. Klasyfikacja i nomenklatura stosowana w zaburzeniach rozwoju płci przed i po 2006 roku (Bajszczak i wsp. 2014). Stara klasyfikacja Nowa klasyfikacja Nazwa angielska Interseksualizm, obojnactwo, hermafrodytyzm Obojnactwo rzekome męskie Obojnactwo rzekome żeńskie Zaburzenia rozwoju płci (ZRP) Zaburzenie rozwoju płci z kariotypem 46,XY (46,XY ZRP) Zaburzenie rozwoju płci z kariotypem 46,XX (46,XX ZRP) Disorders of sex development (DSD) 46,XY disorders of sex development (46,XY DSD) 46,XX disorders of sex development (46,XX DSD) Obojnactwo prawdziwe Jajnikowo jądrowe ZRP Ovotesticular DSD Mężczyzna XX lub odwrócenie płci 46,XX XY odwrócenie płci Dysgenezja gonad Jądrowe ZRP, z kariotypem 46,XX (46,XX jądrowe ZRP) Całkowita dysgenezja gonad z kariotypem 46,XY 46,XX testicular DSD 46,XY complete gonadal dysgenesis Dysgenezja jąder należy obecnie do grupy DSD z prawidłowym lub zaburzonym kariotypem, a bardziej szczegółowo do grupy 46,XY DSD lub 45,X/46,XY DSD, poprzednio nazywanej obojnactwem rzekomym męskim. W kariotypie znajduje się chromosom Y lub przynajmniej jego marker molekularny (SRY), a narządy płciowe są żeńskie lub niezróżnicowane (obojnacze). Dysgenezja jąder polega na różnego stopnia zaburzeniu rozwoju struktury jądra. Podstawą rozpoznania jest ocena histologiczna, na podstawie której wyróżnia się (Ryc.1): czystą dysgenezję gonad (ang. complete gonadal dysgenesis), mieszaną dysgenezję gonad (ang. mixed gonadal dysgenesis), częściową dysgenezję gonad (ang. partial gonadal dysgenesis). 15
16 Czysta (całkowita) dysgenezja gonad Obustronnie zamiast gonady obecne jest łącznotkankowe podścielisko przypominające zrąb jajnika (gonada pasmowata). W tkance łącznej mogą być obecne płodowe komórki płciowe gonocyty zgrupowane w tzw. gniazdach, które nie przypominają swoją strukturą ani kanalików jądra, ani pęcherzyków jajnikowych. Narządy płciowe wewnętrzne i zewnętrzne, a także identyfikacja płciowa są typu żeńskiego (gonada taka nie jest aktywna hormonalnie). Jeżeli w strefie rdzennej gonady obecne są grupy komórek Leydiga/tekalne, wydzielające testosteron, to mogą rozwinąć się obojnacze narządy płciowe wewnętrzne i zewnętrzne, a także może rozwinąć się męska płeć psychiczna. Klasycznym przykładem czystej dysgenezji gonad jest zespół Swyera (kariotyp 46,XY). Postępowanie lekarskie polega na substytucyjnym podawaniu steroidów płciowych począwszy od okresu spodziewanego dojrzewania płciowego, aby wywołać i utrzymać trzeciorzędowe cechy płciowe. W przypadku zaburzeń w różnicowaniu zewnętrznych narządów płciowych wykonuje się ich chirurgiczną korekcję. Zwykle usuwa się pasmowate gonady i przeprowadza się ich badanie histopatologiczne. Mieszana (asymetryczna) dysgenezja gonad Do tej grupy zalicza się przypadki, w których po jednej stronie znajduje się pasmo łącznotkankowe (gonada pasmowata), a po drugiej jądro, zwykle dysgenetyczne. W jądrze kanaliki plemnikotwórcze są słabo rozwinięte i mogą zawierać gonocyty. Narządy płciowe wewnętrzne i zewnętrzne mogą być różnie ukształtowane w zależności od aktywności hormonalnej obecnego jednostronnie jądra. Przyczyną bywają często zaburzenia liczbowe i strukturalne chromosomów płciowych np. 45,X/46,XY. W postępowaniu lekarskim uwzględnia się wysokie ryzyko rozwoju nowotworów wywodzących się z komórek płciowych, dlatego gonady zwykle usuwa się. Przeprowadza się korekcję narządów płciowych, a w okresie spodziewanego dojrzewania płciowego substytucyjnie podaje się steroidy płciowe zgodnie z identyfikacją płciową. Częściowa dysgenezja gonad Częściową dysgenezję gonad rozpoznaje się wtedy, kiedy stwierdza się obustronnie strukturę jądra, jednak z różnego stopnia zaburzeniami rozwoju kanalików plemnikotwórczych. Komórki plemnikotwórcze reprezentowane są przez gonocyty, a niekiedy obecne są też spermatogonie. Narządy płciowe wewnętrzne i zewnętrzne, podobnie jak w mieszanej dysgenezji mogą być różnie ukształtowane w zależności od aktywności hormonalnej gonad. Postępowanie lekarskie jest podobne jak w mieszanej dysgenezji gonad. 16
17 JĄDRA DYSGENETYCZNE I. DYSGENEZJA CZYSTA GONADA PASMOWATA GONADA PASMOWATA II. DYSGENEZJA MIESZANA JĄDRO GONADA PASMOWATA III. DYSGENEZJA CZĘŚCIOWA JĄDRO JĄDRO Rycina 1. Schematyczne przedstawienie histopatologicznej klasyfikacji dysgenetycznych gonad. W czystej (całkowitej) dysgenezji gonad obustronnie obecne jest łącznotkankowe podścielisko przypominające zrąb jajnika (gonada pasmowata). Przy mieszanej (asymetrycznej) dysgenezji po jednej stronie obecne jest pasmo tkanki łącznej, a po drugiej słabo rozwinięta struktura jądra (bardzo rzadko jajnika). Przy częściowej dysgenezji po obu stronach stwierdza się zaburzoną strukturę histologiczną jądra. Oprócz klasycznej dysgenezji gonad, ujawniającej się odwróceniem cech płciowych (żeński fenotyp u osób genetycznie męskich), istnieją jej niepełne formy, przy których mogą nie występować zaburzenia różnicowania płciowego. Wiele zaburzeń rozwojowych męskiego układu płciowego, m.in. spodziectwo, wnętrostwo, zatrzymanie spermatogenezy, można zaliczyć do jednej grupy, którą nazywa się zespołem dysgenetycznych jąder (TDS ang. testicular dysgenesis syndrome). We wszystkich tych zaburzeniach obecne są podobne zmiany histologiczne w strukturze jąder. Opisywano obecność kanalików o zmniejszonej średnicy z niedojrzałymi komórkami Sertolego, kanaliki z samymi komórkami Sertolego, ciała hialinowe wewnątrz kanalików oraz kanaliki z przedinwazyjną zmianą nowotworową (CIS, łac. carcinoma in situ, wewnątrzkanalikowy rak jądra; GCNIS, ang. germ cel neoplasia in situ, rak jądra z komórek płciowych in situ). Ciężkie postacie TDS (klasyczna forma dysgenezji jąder, której towarzyszą zaburzenia różnicowania narządów płciowych) występują stosunkowo rzadko: 0,77/ żywych urodzeń/rok w Europie w latach Natomiast łagodne formy TDS są bardziej powszechne np. wnętrostwo / noworodków płci męskiej/rok, spodziectwo 7,96/ noworodków płci męskiej/rok. Współobecność jądra i jajnika Współobecność jądra i jajinika zwana jest jajnikowojądrowym DSD (ang. ovotesticular disorders of sex development) dawniej zwane obojnactwem prawdziwym lub hermafrodytyzmem prawdziwym. Po jednej stronie znajduje się jądro, a po drugiej jajnik lub jedna gonada zawiera oba elementy równocześnie (łac. ovotestis), co stanowi o rozpoznaniu tzw. obojnactwa prawdziwego (łac. hermaphroditismus verus). Najczęstszą przyczyną są zaburzenia w postaci mozaicyzmu chromosomów płciowych np. 46,XX/46,XY. Konsekwencją obecności jądra, które nie jest jednak w pełni aktywne w okresie płodowym, są zwykle obojnacze narządy płciowe wewnętrzne i zewnętrzne tj. częściowo zróżnicowane w kierunku męskim. W przypadku ujawnienia się w okresie dojrzewania płciowego czynności jajnika pojawia się dodatkowo 17
18 rozwój sutków, a przy obecności macicy krwawienia miesięczne. Poczucie przynależności płciowej (identyfikacja płciowa) jest zwykle męska, z powodu wydzielania androgenów przez jądro w okresie płodowym i okołoporodowym. Postępowanie lekarskie sprowadza się do usunięcia gonady i narządów płciowych wewnętrznych niezgodnych z płcią psychiczną dziecka oraz do korekcji narządów płciowych zewnętrznych (chirurgiczne wytworzenie narządów zgodnych z płcią psychiczną). Można tego dokonać nawet w późnym okresie przeddojrzewaniowym po rozpoznaniu identyfikacji, roli i psychoorientacji płciowej dziecka. W przypadku pozostawienia jądra obowiązkowa jest jego biopsja i ocena histopatologiczna w kierunku obecności przedinwazyjnego nowotworu z komórek płciowych (CIS, łac. carcinoma in situ; GCNIS, ang. germ cell neoplasia in situ). Rozwój dziecka musi być pod stałą kontrolą lekarską. Przy braku postępu dojrzewania płciowego (brak czynności hormonalnej pozostawionej gonady) konieczne jest substytucyjne podawanie steroidów płciowych zgodnych z płcią psychiczną dziecka RÓŻNICOWANIE NARZĄDÓW PŁCIOWYCH (PŁEĆ GENITALNA) Fizjologia Poprzez połączenie światła pierwotnego jelita ze światłem omoczni powstaje stek w tylnej części zarodka pod koniec 4 tygodnia jego rozwoju. Pomiędzy 5 a 8 tygodniem, na skutek wzrostu przegrody moczowoodbytniczej, stek zostaje podzielony na dwie części: przednią - zatokę moczowo-płciową i tylną - odbytnicę. Pod koniec 4 tygodnia rozwoju zarodka z mezodermy powstaje sznur komórek nerkotwórczych. Z tylnej części tego sznura oddziela się pasmo komórek, które tworzą cewki środnercza. Pierwsze cewki od strony głowowej są to tzw. przewody śródnercza (przewody Wolffa). W 6. tygodniu po bokach śródnerczy nabłonek jamy ciała formuje przewody przyśródnerczowe (przewody Müllera). Ogonowe końce tych przewodów łączą się ze sobą i uchodzą do zatoki moczowo-płciowej w sąsiedztwie przewodów śródnercza (Ryc. 2). Od 8 tygodnia życia płodu w jądrach komórki Leydiga stymulowane przez hcg wydzielają testosteron. Wysokie stężenia testosteronu są konieczne do przekształcenia kanałów Wolffa w męskie wewnętrzne narządy płciowe: najądrze, nasieniowód, pęcherzyki nasienne i brzuszną część prostaty. W tym samym czasie (8 tydzień życia płodowego) komórki Sertolego wydzielają AMH, który powoduje zanik przewodów Müllera. Od 10 tygodnia ciąży testosteron ulega lokalnej przemianie w dihydrotestosteron (DHT) pod wpływem enzymu 5 -reduktazy, który znajduje się w komórkach zatoki moczowo-płciowej. DHT jest niezbędny do ukształtowania męskich zewnętrznych narządów płciowych. Moszna, prącie, męska cewka moczowa, gruczoł krokowy kształtują się w tygodniu ciąży. Brak AMH powoduje, że przewody Müllera przekształcają się w żeńskie wewnętrzne narządy płciowe: jajowody, macicę i górne 2/3 pochwy. Brak testosteronu powoduje, że kanały Wolffa zanikają. Brak DHT umożliwia powstanie zewnętrznych żeńskich narządów płciowych: łechtaczki, warg sromowych mniejszych i większych, dolnej 1/3 części pochwy oraz żeńskiego typu ujścia cewki moczowej (na kroczu). 18
19 Rycina 2. Schematyczne przedstawienie różnicowania wewnętrznych narządów płciowych. Do 6 tygodnia życia płodowego gonada jest bipotencjalna (niezróżnicowana) i towarzyszą jej zawiązki żeńskich (przewody Müllera) i męskich (przewody Wolffa) wewnętrznych narządów płciowych. Od ok. 7 tygodnia życia płodowego jądro zaczyna wydzielać testosteron (T), który powoduje rozwój męskich wewnętrznych narządów płciowych z przewodów Wolffa i hormon antymuellerowski (AMH), który powoduje zanik przewodów Müllera. Jajnik w tym okresie nie wydziela hormonów, które mogłyby wpłynąć na różnicowanie w kierunku żeńskim. Brak T powoduje zanik przewodów Wolffa, a brak AMH umożliwia przekształcenie przewodów Müllera w żeńskie wewnętrzne narządy płciowe Steroidy płciowe jajnika nie mają wpływu na różnicowanie narządów płciowych u płodów żeńskich. Jednak estradiol pochodzący od matki ma wpływ na pełny rozwój zewnętrznych narządów płciowych u płodów żeńskich w trzecim trymestrze ciąży. Męski płód wytwarza białka alfa-fetoproteinę (AFP) i globulinę wiążącą steroidy płciowe (SHBG, ang. sex hormone binding globulin), które wiążą estrogeny pochodzące od matki. W ten sposób męski płód jest chroniony przed działaniem matczynych estrogenów Zaburzenia i postępowanie lekarskie Jajnikowojądrowe DSD Jajnikowojądrowe DSD, zwane dawniej obojnactwem prawdziwym lub hermafrodytyzmem prawdziwym (łac. hermaphroditismus verus) rozpoznaje się w przypadkach, gdy po jednej stronie znajduje się jądro, a po drugiej jajnik lub jedna gonada zawiera oba elementy równocześnie (łac. ovotestis). Postępowanie lekarskie patrz rozdz Obojnactwo rzekome (łac. pseudohermaphroditismus) Termin ten obecnie oficjalnie nie jest stosowany w dokumentacji medycznej i publikacjach naukowych, ale w dalszym ciągu używany w praktyce klinicznej.występuje wówczas, gdy płeć genitalna, gona- 19
20 dalna i genetyczna nie są zgodne. U podłoża zmian leżą zaburzenia wydzielania lub tkankowego działania hormonów płciowych. 46,XY DSD lub 45,X/46,XY DSD (poprzednio obojnactwo rzekome męskie) Zaburzenia dotyczą rozwoju narządów płciowych wewnętrznych i zewnętrznych w kierunku męskim u osób z kariotypem 46,XY lub obecnością materiału genetycznego chromosomu Y (marker molekularny SRY). W przypadku translokacji materiału genetycznego chromosomu Y na inny chromosom może rozwinąć się tzw. zespół XX male. Jest to fenotypowy mężczyzna z kariotypem 46,XX. Etiologia Zaburzenia organogenezy jąder: - agenezja całkowity brak rozwoju jąder - dysgenezja częściowy rozwój jąder - aplazja zanik jąder w okresie płodowym Zahamowanie biosyntezy testosteronu w jądrach płodu na skutek zaburzeń steroidogenezy w komórkach Leydiga, aplazji/hipoplazji komórek Leydiga, defektu receptora dla LH lub braku wydzielania LH. Nie rozwijają się męskie wewnętrzne i zewnętrzne narządy płciowe (fenotyp żeński). Jeżeli wydzielanie AMH jest zachowane, to zanikają przewody Müllera i nie ma żadnych narządów płciowych wewnętrznych (przy braku testosteronu zanikają także przewody Wolffa). Zahamowanie biosyntezy AMH na skutek zaburzenia czynności komórek Sertolego. Przewody Müllera rozwijają się w żeńskie narządy płciowe wewnętrzne, a przy prawidłowej czynności komórek Leydiga rozwiną się także męskie narządy płciowe wewnętrzne i zewnętrzne (zespół przetrwałych przewodów Müllera). Zahamowanie biosyntezy AMH i testosteronu np. przy całkowitej dysgenezji jąder. Powstają żeńskie narządy płciowe wewnętrzne i zewnętrzne. Niedobór enzymu 5 α-reduktazy prowadzi do braku przemiany testosteronu w DHT. Narządy płciowe wewnętrzne są męskie. Zewnętrzne narządy płciowe nie rozwijają się lub rozwijają się tylko nieznacznie w kierunku męskim, pomimo wysokiego stężenia testosteronu we krwi. W okresie dojrzewania płciowego stwierdza się jednak objawy zależne od działania testosteronu: powiększenie łechtaczki, zstąpienie jąder do dwudzielnej moszny, głos staje się niski, przyrasta masa mięśniowa, brak jest rozwoju sutków. Zespół niewrażliwości na androgeny (AIS ang. androgen insensitivity syndrome) Jest spowodowany brakiem lub defektem receptora androgenowego w tkankach obwodowych. Może występować w postaci całkowitej (CAIS ang. complete androgen insensitivity syndrome) lub częściowej (PAIS ang. partial androgen insensitivity syndrome). Postać całkowitej niewrażliwości na androgeny (dawniej zespół feminizacji jądrowej, zespół Morrisa) charakteryzuje się obecnością żeńskich zewnętrznych narządów płciowych, krótką, ślepo zakończoną pochwą, brakiem macicy i jajowodów, brakiem owłosienia łonowego i pachowego oraz rozwojem sutków w okresie dojrzewania płciowego, zwany też zespołem nieowłosionej kobiety (ang. hairless woman). W jamie brzusznej w położeniu jajnikowym znajdują się jądra bez towarzyszących najądrzy i nasieniowodów. 20
21 Objawy kliniczne obecność narządów z przewodów Müllera, tj. szczątkowych jajowodów, macicy, górnej części pochwy; słabo rozwinięta lub dwudzielna moszna (fałdy wargowo-mosznowe, łac. labioscrotum); słabo rozwinięte prącie (wyrostek falliczny, rozpoznawany czasem jako powiększona łechtaczka); nieprawidłowo ukształtowana męska cewka moczowa z ujściem zewnętrznym położonym poza szczytem żołędzi. Zaburzenie to nazywane jest spodziectwem (łac. hypospadiasis). Jego formy to spodziectwo żołądziowe, prąciowe, prąciowo-mosznowe, kroczowe. Jest to najczęściej występująca wada wrodzona układu moczowo-płciowego u chłopców. Rozwój zewnętrznych narządów płciowych ocenia się według 5-stopniowej skali A. Pradera (Ryc. 3): 1. nieznaczny przerost łechtaczki, wargi sromowe prawidłowo rozwinięte, oddzielne ujścia pochwy i cewki moczowej 2. wyraźny przerost łechtaczki, pogłębienie przedsionka pochwy, w którego dnie znajdują się osobne ujścia układu moczowego i płciowego 3. znaczny przerost łechtaczki, dochodzi do częściowego zrostu warg sromowych oraz wytworzenia wspólnej zatoki moczowo-płciowej 4. łechtaczka jeszcze bardziej przerośnięta, wargi sromowe zrośnięte znacznie, ujście zatoki moczowopłciowej u nasady łechtaczki 5. łechtaczka przypomina prącie, całkowity zrost warg sromowych, zatoka moczowo-płciowa uchodzi na szczycie żołędzi Prawidłowe żeńskie I II III IV V Prawidłowe męskie Rycina 3. Skala oceny różnicowania zewnętrznych narządów płciowych wg A. Pradera. Postępowanie lekarskie Decyzja o wyborze płci genitalnej dziecka powinna być uzależniona od jego płci psychicznej. Jest to możliwe dopiero ok. 3-4 roku życia. Wcześniejsze chirurgiczne korekcje zewnętrznych narządów płciowych mogą wiązać się z ryzykiem pomyłki co do płci psychicznej, która może się ujawnić jako przeciwstawna do płci wytworzonych narządów. W okresie dojrzewania płciowego może być niezbędne substytucyjne podawanie steroidów płciowych zgodnych z płcią psychiczną dla wywołania i utrzymania trzeciorzędowych cech płciowych. 21
22 W tych przypadkach konieczna jest histopatologiczna kontrola wycinków z obu gonad ze względu na wysokie ryzyko rozwoju nowotworów wywodzących się z płodowych komórek płciowych, zwłaszcza w trakcie lub po okresie dojrzewania płciowego. W przypadku spodziectwa postępowanie lekarskie sprowadza się do chirurgicznej korekcji wady. 46,XX DSD (poprzednio obojnactwo rzekome żeńskie) Występuje u osób z kariotypem 46,XX i maskulinizacją narządów płciowych. Zaburzenie polega na częściowym rozwoju zewnętrznych narządów płciowych w kierunku męskim w okresie płodowym (powiększenie łechtaczki lub wytworzenie męskich zewnętrznych narządów płciowych ocena wg skali Pradera) oraz na pojawieniu się w okresie dojrzewania płciowego męskich cech budowy ciała i męskiego typu owłosienia. Identyfikacja płciowa jest najczęściej żeńska, ale rola płciowa i orientacja płciowa mogą oscylować pomiędzy męską a żeńską. Etiologia Wrodzony przerost nadnerczy u płodu (CAH, ang. congenital adrenal hyperplasia), dawniej nazywany zespołem nadnerczowo-płciowym (AGS, ang. adreno-genital syndrome). Jest to zaburzenie steroidogenezy nadnerczy z powodu niedoboru enzymów, najczęściej: 21-hydroksylazy, rzadziej 11-hydroksylazy i 3- beta dehydrogenazy hydroksysteroidowej. Dochodzi do niedoboru gliko- i mineralokortykoidów oraz nadmiaru androgenów syntetyzowanych w korze nadnerczy. Oprócz maskulinizacji zewnętrznych narządów płciowych u płodów żeńskich, u noworodków obu płci mogą wystąpić poważne zaburzenia metaboliczne pod postacią tzw. hiponatremii, hiperkaliemi, hipoglikemii, kwasicy metabolicznej, odwodnienia na skutek braku gliko- i mineralokortykoidów. Przyjmowanie leków o działaniu androgennym (np. pochodne androgenów lub progestageny o działaniu androgenopodobnym) przez matkę w okresie ciąży (przy ciąży zagrożonej poronieniem). Nowotwory nadnerczy lub jajników wytwarzające androgeny u płodu lub matki. Wrodzony niedobór aromatazy, enzymu przekształcającego testosteron do estradiolu. Postępowanie lekarskie W przypadku CAH podaje się substytucyjnie glikokortykoidy i w niektórych przypadkach także mineralokortykoidy. Zwykle w pierwszym roku życia w miarę potrzeby przeprowadza się chirurgiczną korekcję zewnętrznych narządów płciowych w kierunku żeńskim ZSTĘPOWANIE JĄDER Fizjologia W procesie zstępowania jąder można wyróżnić następujące fazy: Przesunięcie gonady ku dołowi w stosunku do nerki w 7-8 tygodniu ciąży. Zejście gonady po tylnej ścianie jamy brzusznej do pierścienia pachwinowego wewnętrznego, które zostaje ukończone ok. 21 tygodnia ciąży. Szybkie przejście jądra przez kanał pachwinowy (prawdziwe zstępowanie jąder), które u 75% płodów odbywa się między 28 a 32 tygodniem ciąży. Zwykle kończy się w pierwszym miesiącu po urodzeniu. 22
23 Przejście jądra od pierścienia zewnętrznego kanału pachwinowego do dna moszny trwa zwykle 3-4 tygodnie. Istnieje wiele dowodów na to, że proces zstępowania jąder przez kanał pachwinowy jest regulowany hormonalnie. Androgeny stymulują rozwój najądrza i nasieniowodu, powodują wydłużenie naczyń krwionośnych powrózka nasiennego, zmniejszają skurcz mięśnia dźwigacza jądra, zwiększają rozmiary kanału pachwinowego i moszny. Ponadto dzięki swemu działaniu anabolicznemu pobudzają rozwój mięśni ścian jamy brzusznej, przez co zwiększają ciśnienie śródbrzuszne. Wykazano, że w zstępowaniu jąder większe znaczenie ma DHT niż sam testosteron. W procesie zstępowania jąder pewną rolę przypisuje się obwodowemu układowi nerwowemu. W perikarionach nerwu udowo-płciowego testosteron pobudza biosyntezę substancji o nazwie - peptyd związany z genem kalcytoniny (CGRP ang. calcitonin gene-related peptide), która może współodpowiadać za zstępowanie jąder do moszny. W zstępowaniu jąder może też brać udział AMH, ponieważ w zespole przetrwałych przewodów Müllera zawsze występuje wnętrostwo. Ostatnio stwierdzono, że insulinopodobny czynnik 3 (INSL3, ang. insuline like factor 3) produkowany przez komórki Leydiga, jest niezbędny dla rozwoju jądrowodu i regresji więzadła wieszadłowego jądra Zaburzenia i postępowanie lekarskie Zatrzymanie jąder podczas ich wędrówki, w czasie życia płodowego, w obrębie brzucha lub kanału pachwinowego nazywane jest wnętrostwem (łac. cryptorchismus). Może być ono jedno lub obustronne. Jądra położone ektopowo, poza drogą naturalnego zstępowania, zalicza się również do wnętrostwa. Częstość występowania wnętrostwa oceniana jest na 2,7-4% noworodków i jest znacznie większa u wcześniaków (20%). W ciągu pierwszego roku życia częstość występowania wnętrostwa spada do 0,8-1,8%. Większość niezstąpionych jąder zstępuje w ciągu pierwszych 3 miesięcy życia. Etiologia Wnętrostwo występuje u chłopców ze zmniejszoną biosyntezą i działaniem androgenów np. w zaburzeniach rozwojowych jąder, przy niedoborze DHT, braku 5 -reduktazy, w zespole całkowitej niewrażliwości na androgeny. Jądra nie zstępują u płodów z niedoborem gonadotropin (patrz etiopatogeneza hipogonadyzmu wtórnego, hipogonadotropowego roz ). Utrudnienie anatomiczne zstępowania jąder może wynikać z obecności przepukliny pachwinowej, zwężenia kanału pachwinowego lub skrócenia tętnicy nasiennej. Wnętrostwo obserwuje się także w przypadkach zaburzeń rozwojowych centralnego układu nerwowego oraz rdzenia kręgowego. Diagnostyka i różnicowanie Wywiad powinien uwzględnić dane dotyczące przebiegu ciąży i leków w tym czasie stosowanych przez matkę. W badaniu przedmiotowym należy zbadać palpacyjnie zewnętrzne narządy płciowe i okolice kanałów pachwinowych. 23
24 Niezstąpienie jąder musi być różnicowane z: jądrami wędrującymi (łac. testes migrantes), które łatwo mogą być przesunięte palpacyjnie do moszny, ale powracają po usunięciu ręki. Jądra wędrujące zstępują do moszny tylko w stanie całkowitego spokoju i rozluźnienia. Powrót jąder do kanału pachwinowego jest zależny od skurczu mięśnia dźwigacza jądra, dlatego badanie okolicy narządów płciowych chłopca należy wykonywać ciepłymi rękami, natychmiast po rozebraniu badanego. Jądra wędrujące zwykle zstępują samoistnie w okresie dojrzewania płciowego. brakiem jąder (łac. anorchia). Jeżeli obie gonady są niewyczuwalne i nie uwidaczniają się w badaniu ultrasonograficznym, należy wykonać test z hcg (patrz rozdz ). Brak odpowiedzi na podanie hcg może wskazywać na brak jąder. Historia naturalna wnętrostwa Zmiany ultrastruktury komórek Leydiga w niezstąpionych jądrach obserwowane są już w 1 roku życia. W 2 roku życia stwierdzano zeszkliwienie ściany kanalików jądra i zmniejszenie ich średnicy, a po trzecim roku zmiany degeneracyjne w nabłonku plemnikotwórczym. Nie wiadomo, czy zmiany te są pierwotne, rozwojowe, czy też zależą od nieprawidłowego położenia jąder i wpływu wyższej temperatury. Zaburzenia nasilają się wraz z wiekiem, czego konsekwencją jest bezpłodność lub obniżony potencjał płodności, stwierdzane w ok. 50% przypadków obustronnego niezstąpienia jąder. Niezstąpione jądro w wywiadzie stanowi czynnik ryzyka rozwoju nowotworów jądra wywodzących się z płodowych komórek płciowych w ok. 5-6% przypadków. Szczególnie narażeni są dorośli mężczyźni z jądrem w jamie brzusznej. Postępowanie lekarskie Leczenie operacyjne polega na chirurgicznym sprowadzeniu jąder do moszny (łac. orchidopexia). Obecnie poleca się przeprowadzanie operacji ok. 1 roku życia. Należy podkreślić, że operacja wnętrostwa zawsze stanowi duży problem techniczny. Najlepszym sposobem jest zastosowanie technik mikrochirurgicznych. Powikłaniem leczenia chirurgicznego może być uszkodzenie naczyń powrózka nasiennego i atrofia jądra. W leczeniu zachowawczym stosowano preparaty domięśniowe ludzkiej gonadotropiny kosmówkowej oraz preparaty donosowe GnRH. Jednak ze względu na wyniki badań wskazujących na niekorzystny wpływ tych preparatów na spermatogenezę, leczenie to nie jest polecane. U chłopców z jądrami sprowadzonymi do moszny wymagane jest przynajmniej raz w roku kontrolne badanie lekarskie. Dzięki częstej kontroli (badanie palpacyjne, ultrasonografia jąder) możliwe jest wczesne uchwycenie zmian nowotworowych gonady. Należy również kontrolować przebieg dojrzewania płciowego, gdyż wnętrostwo może być pierwszym objawem hipogonadyzmu (patrz rozdz ) RÓŻNICOWANIE PŁCIOWE MÓZGU (PŁEĆ PSYCHICZNA) Fizjologia Wyrazem płci psychicznej jest: identyfikacja płciowa (poczucie przynależności do danej płci) rola płciowa (męski lub żeński typ zachowania) 24
25 psychoorientacja płciowa (ukierunkowanie popędu płciowego). Psychoorientacja płciowa może być: heteroseksualna (do płci przeciwnej), biseksualna (do obu płci) lub homoseksualna (do tej samej płci) Zanim pojawiły się sugestie, że rozwój identyfikacji płciowej jest determinowany hormonalnie uważano, że jest ona determinowana tylko genetycznie lub zależy wyłącznie od oddziaływania otoczenia i wychowania. Okres między 1 a 4 rokiem życia dziecka uważano za zasadniczy dla procesu kształtowania identyfikacji płciowej. Koncepcje te zostały podważone poprzez wyniki doświadczeń na noworodkach zwierząt, w których wykazano, że krótkotrwałe podawanie steroidów płciowych w okresie okołourodzeniowym decyduje o męskich zachowaniach płciowych w okresie dojrzałości, niezależnie od sygnałów płynących ze środowiska. Stwierdzono też, że pod wpływem androgenów następuje ustalenie charakterystycznego dla płci męskiej acyklicznego typu wydzielania gonadoliberyny przez podwzgórze. Potwierdzały to kolejne obserwacje wskazujące, że androgeny podawane samicom szczurów w okresie okołourodzeniowym powodują trwały brak owulacji oraz typowy dla samców sposób zachowania płciowego w okresie dojrzałości (np. przewaga odruchu krycia ). Z kolei podanie antyandrogenów męskim noworodkom szczura powodowało, że zachowywały się one w sposób charakterystyczny dla samic (np. przewaga odruchu lordozy w odpowiedzi na bodźce seksualne). Milowym krokiem w ustaleniu dymorfizmu płciowego mózgu były badania anatomiczne mózgu szczura i człowieka. Wykazały one obecność różnic między płciami w wielkości części centralnej jądra przedwzrokowego przyśrodkowego podwzgórza. Jest ono znacznie większe u samców niż u samic, a jego uszkodzenie powoduje zaburzenia w zachowaniu kopulacyjnym samców. Stwierdzono ponadto, że testosteron indukuje zarówno męskie zachowania płciowe jak i wzrost jądra przedwzrokowego przyśrodkowego podwzgórza. Wymagane jest jednak tutaj przekształcenie testosteronu do estradiolu dzięki enzymowi aromatazie, który znajduje się właśnie w tej okolicy mózgu. Istnieją też dane, że również u człowieka podobnie jak u zwierząt, różnicowanie płciowe mózgu przypada na okres noworodkowy i wczesnego dzieciństwa i jest ono zależne od działania steroidów płciowych. U noworodków ludzkich płci męskiej stwierdzono wysoki poziom testosteronu we krwi między 2 a 5 miesiącem życia, a w ślinie już w dniu urodzenia. Prawdopodobnie w tym okresie determinowana jest acykliczna czynność podwzgórza i rozwój struktur mózgu odpowiedzialnych za męską identyfikację płciową. Poczucie przynależności płciowej ujawnia się zwykle między drugą połową drugiego, a pierwszą połową trzeciego roku życia. Stwierdzono jednak, że u dzieci jeszcze w ciągu kilku następnych lat występują zmiany budowy tych jąder podwzgórza, które wykazują różnice międzypłciowe, i być może są one odpowiedzialne za płeć psychiczną. Tak, więc nie można wykluczyć, że aż do okresu dojrzewania płciowego czynniki endogenne, a także środowisko, mogą wpływać na rozwój stref płciowych mózgu u ludzi. Wykazano natomiast, że raz wykształcone poczucie przynależności płciowej jest nieodwracalne Zaburzenia identyfikacji płciowej Transseksualizm jest najcięższym, krańcowym typem zaburzeń identyfikacji (tożsamości płciowej). Transseksualiści od wczesnego dzieciństwa mają identyfikację płciową przeciwstawną do płci genetycznej, gonadalnej i somatycznej. Rzadko mają kontakty heteroseksualne, a jeśli próbują kontaktów erotycznych z homoseksualistami, to również nie są z nich zadowoleni. Mają bardzo silną niechęć do swoich narządów 25
26 płciowych niezgodnych z ich poczuciem przynależności płciowej i żądają ich chirurgicznej zmiany w kierunku zgodnym z płcią psychiczną. Żyją w związkach z osobami heteroseksualnymi, które uznają ich płeć psychiczną. Po rozpoznaniu transseksualizmu i zmianie płci metrykalnej postępowanie lekarskie polega na: podawaniu steroidów płciowych zgodnych z identyfikacją płciową, usunięciu gonad i wewnętrznych narządów płciowych niezgodnych z identyfikacją płciową, chirurgicznym wytworzeniu zewnętrznych narządów płciowych zgodnych z identyfikacją płciową, pomocy psychologicznej. Podstawą postępowania medycznego przy transseksualizmie jest wydana przez WHO Międzynarodowa Statystyczna Klasyfikacja Chorób i Problemów Zdrowotnych (ICD-10) (1992), która w dziale zaburzeń osobowości i zachowań dorosłych (F60-F69) uwzględnia zaburzenia identyfikacji płciowej (ZIP): Kryteria diagnostyczne różnych typów zaburzeń identyfikacji płciowej wg ICD-10: I. Rozpoznanie transseksualizmu (F 64.0) opiera się na 3 kryteriach: 1. Pragnienie życia i bycia akceptowanym jako osoba o płci przeciwnej, któremu zwykle towarzyszy konieczność upodobnienia się do preferowanej przez siebie płci poprzez leczenie operacyjne i hormonalne. 2. Identyfikacja transseksualna jest obecna ciągle od co najmniej 2 lat. 3. Zaburzenie nie jest objawem innych zaburzeń psychicznych lub anomalii genetycznych związanych z DSD. II. Rozpoznanie transwestytyzmu o typie podwójnej roli (F64.1) opiera się na 3 kryteriach: 1. Noszenie ubrania typowego dla płci przeciwnej dla przeżycia przejściowego wrażenia przynależności do płci przeciwnej. 2. Brak motywacji seksualnej dla przebierania się. 3. Brak pragnienia trwałej zmiany płci. III. Zaburzenie identyfikacji płciowej w dzieciństwie (F64.2) ma osobne kryteria dla dziewcząt i dla chłopców Dla dziewcząt: 1. Dziecko wykazuje trwałe i intensywne niezadowolenie z bycia dziewczynką i ma trwałe pragnienie bycia chłopcem (bez wpływu kulturowych zalet bycia chłopcem) lub oznajmia, że jest chłopcem. 2. Występują następujące cechy: a. trwała, wyraźna awersja do typowych ubiorów żeńskich i uporczywe ubieranie się w stereotypowe ubiory męskie; b. trwała niechęć do żeńskiej budowy anatomicznej przy obecności jednego z następujących objawów: przeświadczenie, że posiada ona albo urośnie jej prącie, niechęć do mikcji w pozycji siedzącej, przeświadczenie, że nie wystąpi u niej rozwój piersi i miesiączkowanie. 26
27 3. Dziewczynka nie rozpoczęła dojrzewania płciowego. 4. Zaburzenie musi trwać przynajmniej od 6 miesięcy. Dla chłopców: 1. Dziecko wykazuje trwałe i silne niezadowolenie z bycia chłopcem i ma pragnienie bycia dziewczyną lub rzadziej, oznajmia, że jest dziewczyną. 2. Obecna jest jedna z następujących cech: a. nadmierne, stereotypowo żeńskie zachowania w postaci preferencji dla przebierania się w żeński strój lub w postaci silnego pragnienia uczestnictwa w grach i zabawach dziewcząt z odrzuceniem stereotypowo męskich zabaw i zachowań. b. trwała niechęć do własnej męskiej budowy anatomicznej przy obecności przynajmniej jednej z następujących cech : przeświadczenie, że rozwija się, aby stać się kobietą (nie tylko w roli kobiecej), przeświadczenie, że jego prącie lub jądra są obrzydliwe lub zanikną z czasem, przeświadczenie, że byłoby lepiej nie mieć prącia lub jąder. 3. Chłopiec nie rozpoczął dojrzewania płciowego. 4. Zaburzenie musi trwać przynajmniej od 6 miesięcy. IV. Inne zaburzenia identyfikacji płciowej (F 64.8) nie mają specyficznych kryteriów. V. Zaburzenie identyfikacji płciowej, nieokreślone (F 64.9)- brak specyficznych kryteriów. Kryteria dla dziewcząt i chłopców mogą być stosowane dla określenia identyfikacji i roli płciowej u osób z DSD (zaburzeniami rozwoju narządów płciowych). Zaburzenia identyfikacji płciowej (ZIP) wg Amerykańskiego Towarzystwa Psychiatrycznego umieszczone w Diagnostic and Statistical Manual of Mental Disorders (DSM-IV 1994, 2000): w dzieciństwie u nastolatków u osób dorosłych zaburzenie identyfikacji płciowej, nieokreślone transseksualizm (transgenderyzm) Na rycinie 4 przedstawiono historię naturalną zaburzeń identyfikacji płciowej u nastolatków. Najszersze badania w tym zakresie pochodzą z ośrodków holenderskich. Według tych badań u większości nastolatków z ZIP rozwija się homoseksualizm lub zaburzenie samoistnie znika. Częstość występowania tych dwóch przemian nie jest jednoznacznie określona. Natomiast częstość rozwoju ZIP w kierunku transseksualizmu wynosi 6-30%. 27
28 Rycina 4. Historia naturalna zaburzeń identyfikacji płciowej (ZIP) u nastolatków. Tabela 2. Podtypy zaburzeń identyfikacji płciowej. Wczesnorozwojowe (głębokie, pierwotne, głównie homoseksualne ) Głębokie odwrócenie poczucia płci Przebieranie nie wywołuje podniecenia płciowego Budzą zainteresowanie tej samej płci homoseksualne Wcześnie żądają korekcji operacyjnej Nie mają problemów psychologicznych przed leczeniem Późnorozwojowe (powierzchowne, wtórne, fetyszystyczne nie-homoseksualne ) Przebieranie wywołuje podniecenie płciowe Budzą zainteresowanie płci przeciwnej Późno żądają korekcji operacyjnej Mają dzieci Są mało stabilni psychicznie 28
29 Z IP u nas tolatków Zakochują się W rówieśnikach tej samej płci Na dystans Ze współżyciem płciowym Bez udziału cech płciowych Zachowania typowe dla płci marzenia Korekcja narządów Współżycie płciowe Rycina 5. Formy zachowań płciowych nastolatków z zaburzeniami identyfikacji płciowej (ZIP). Diagnostyka różnicowa zaburzeń identyfikacji płciowej Młodzi mężczyźni z homoseksualizmem mogą mylić swój homoseksualizm z ZIP (w dzieciństwie mogą u nich występować epizody przebierania się w stereotypowe ubiory żeńskie, które jednak już nie pojawiają się po dojrzewaniu płciowym). Fetyszyzm transwestytyczny: mężczyźni heteroseksualni lub biseksualni ulegają podnieceniu płciowemu przy przebieraniu się. Transwestytyzm z podwójną rolą: noszą ubrania przeciwnej płci dla przejściowego, a nie stałego, doświadczenia przynależności do płci przeciwnej, bez motywacji seksualnej przebierania się. Osoby aseksualne: żądają operacji dla pozbycia się swoich narządów płciowych, ale nie pragną uzyskać cech innej płci. Zaburzenia psychiczne (np. schizofrenia), którym towarzyszą omamy przynależności do płci przeciwnej. Przy słabo wyrażonych ZIP nie ma dążenia do pełnej korekcji narządów płciowych. Osoby te podejmują próby integracji swoich męskich i żeńskich pierwiastków i tylko chcą zastosowania hormonów lub niewielkich korekcji chirurgicznych. Tylko osoby z krańcowymi formami ZIP mogą być poddane chirurgicznej korekcji płci. Identyfikacja płciowa przy DSD Przy DSD identyfikacja płciowa może być: żeńska najczęściej przy obecności jajników lub dysgenetycznych jąder (brak czynności hormonalnej jąder), ale także przy całkowitym braku wrażliwości na androgeny (CAIS) u osób z fenotypem żeńskim i obecnością jąder. męska przy obecności jąder, pomimo żeńskiego fenotypu np. przy niedoborze 5 -reduktazy. 29
30 W przypadkach, gdzie u podłoża nieprawidłowego formowania narządów płciowych u mężczyzn leży częściowe zaburzenie receptora androgenowego (PAIS) lub steroidogenezy jąder rozpoznanie identyfikacji, roli i psychoorientacji płciowej w okresie wczesnorozwojowym jest niepewne. Identyfikacja płciowa przy DSD spowodowanym następującymi zaburzeniami: Niedobór enzymu 5 α-reduktazy Przy tym zaburzeniu wydzielanie testosteronu przez jądra jest prawidłowe lub podwyższone, zatem mózg poddawany jest ekspozycji na działanie androgenów. Dzieci o kariotypie męskim, posiadające jądra, rodzą się jednak z żeńskimi zewnętrznymi narządami płciowymi. Chłopcy ci uważani są przez otoczenie za dziewczęta i zgodnie z tym wychowywani. Podczas dojrzewania płciowego następuje jednak maskulinizacja zewnętrznych narządów płciowych (powiększenie łechtaczki, kształtowanie moszny i zstępowanie jąder). W tym okresie ujawnia się często poczucie męskiej identyfikacji płciowej. Rola płciowa, pomimo wychowania jako dziewczynki, okazuje się też być najczęściej męska (ok. 70%), psychoorientacja heteroseksualna (w kierunku kobiet), zgodna z męską płcią genetyczną i gonadalną. Zespół niewrażliwości na androgeny W CAIS zewnętrzne narządy płciowe, budowa ciała, a także identyfikacja płciowa są żeńskie pomimo wysokich stężeń androgenów wydzielanych przez prawidłowo zbudowane jądra znajdujące się w jamie brzusznej. Przy braku receptora androgenowego mózg nie jest poddawany działaniu androgenów. Przy PAIS identyfikacja płciowa może być męska lub żeńska. Wrodzony przerost nadnerczy Dziewczynki (płeć genetyczna i gonadalna żeńska) rodzą się z obojnaczymi narządami płciowymi. W zaburzeniu tym obecny jest defekt jednego z enzymów uczestniczących w steroidogenezie kory nadnerczy, w wyniku czego w nadmiarze syntetyzowane są androgeny. W okresie życia płodowego mózg poddawany jest ekspozycji na działanie androgenów. Dziewczęta są wychowywane zgodnie ze swoją płcią gonadalną i genitalną. Większość z nich ma żeńską identyfikację płciową i prezentuje żeńską rolę płciową. W zachowaniu tych dziewcząt obecne są jednak pewne cechy typowe dla chłopców np. małe zainteresowanie lalkami i niemowlętami, a większe - uprawianiem sportów wymagających siły i wytrzymałości, częste inicjowanie bójek, a w okresie dojrzałości poświęcanie się karierze zawodowej i często rezygnacja z roli żon i matek. Jatrogenna ekspozycja na działanie steroidów płciowych w okresie płodowym Steroidy płciowe o typie progestagenów są podawane kobietom w ciąży zagrożonej poronieniem. Wykazano, że androgeno-podobne progestageny mają wpływ maskulinizujący na płody żeńskie. Dziewczęta, których matki otrzymywały androgeno-podobne progestageny wykazywały pewne męskie cechy w zachowaniu np. uprawiały bardziej wysiłkowe sporty, były bardziej samodzielne, mniejsze było ich zainteresowanie macierzyństwem. Natomiast dziewczęta i chłopcy poddani ekspozycji wewnątrzmacicznej na progesterono-podobne progestageny wykazywali bardziej żeńskie zachowania w porównaniu z grupą kontrolną. Syntetyczny estrogen diethylstilbestrol (DES) był stosowany w USA u ciężarnych kobiet, dopóki nie stwierdzono w 1975 roku jego działania rakotwórczego. Dzieci tych matek były bardziej łagodne, spokojne i posłuszne niż ich rodzeństwo nie poddawane działaniu DES. Ponadto stwierdzono, że prena- 30
31 talna ekspozycja na DES wpływa na psychoorientację płciową. Wśród kobiet, których matki otrzymywały DES, obserwowano większą częstość występowania homo- i biseksualizmu DOJRZEWANIE PŁCIOWE Dojrzewanie płciowe (syn. pokwitanie, pubertas) jest to okres, w którym zachodzą zmiany hormonalne prowadzące do zakończenia rozwoju somatycznego oraz do osiągnięcia dojrzałości płciowej i związanej z nią płodności Fizjologia Dojrzewanie płciowe u dziewczynek przebiega pomiędzy 9 a 18 rokiem życia, u chłopców między 11 a 17 rokiem życia. Można w nim wyróżnić następujące etapy: Późny okres przedpokwitaniowy Nie ma jeszcze somatycznych oznak pokwitania, ale wykrywalne są metodami laboratoryjnymi pierwsze zmiany hormonalne w postaci wzrostu stężenia we krwi androgenów nadnerczowych (adrenarche), głównie dehydroepiandrosteronu (DHEA). Wczesny okres dojrzewania - pojawiają się pierwsze oznaki somatyczne: U chłopców występuje powiększenie jąder ponad objętość przeddojrzewaniową (4 ml) oraz powiększenie, pomarszczenie, ścieńczenie i zwiększenie unaczynienia skóry moszny. U dziewcząt występuje powiększenie sutków do stadium pączka (łac. thelarche), pofałdowanie i zwiększenie unaczynienia warg sromowych oraz pojawia się biała wydzielina z pochwy. U obu płci występuje zmniejszenie tempa wzrastania, zwiększenie amplitudy nocnych wyrzutów gonadotropin (zwłaszcza LH), zwiększenie stężenia we krwi steroidów płciowych (testosteronu i estradiolu) oraz dalsze zwiększanie się stężenia androgenów nadnerczowych, pojawia się popęd płciowy. Środkowy okres dojrzewania U chłopców występuje dalszy wzrost jąder, w porannym moczu można stwierdzić obecność plemników (łac. spermarche), powiększa się prącie i moszna, pojawia się owłosienie wokół podstawy prącia (pubarche), owłosienie pod pachami (łac. axillarche), na twarzy. Zwiększa się masa mięśniowa, może wystąpić przejściowe powiększenie sutków (łac. gynecomastia), zaczyna się mutacja głosu, pojawia się aktywność gruczołów apokrynowych (zmienia się zapach potu). U dziewcząt występuje dalsze powiększanie gruczołów sutkowych, powiększanie narządów płciowych, pojawia się owłosienie łonowe i nieco później pachowe, zwiększa się aktywność gruczołów apokrynowych (pojawia się charakterystyczny zapach potu), zmienia się rozkład tkanki tłuszczowej, sylwetka ciała przybiera charakter kobiecy. U obu płci tempo wzrastania ulega gwałtownemu nasileniu (tzw. skok pokwitaniowy). Wzrasta amplituda pulsów nocnego wydzielania LH. Później pojawia się także pulsacja dzienna LH i dobowa FSH, a podstawowy poziom gonadotropin i steroidów płciowych we krwi jest wyraźnie wyższy niż w okresie przedpokwitaniowym. 31
32 Późny okres dojrzewania U chłopców jądra i narządy płciowe powiększają się do rozmiarów stwierdzanych u dorosłych mężczyzn (prawidłowa objętość jąder ml), zewnętrzne narządy płciowe przybierają ciemniejszą barwę, pojawiają się nocne wytryski nasienia, ejakulat zawiera dojrzałe plemniki, a jego objętość wzrasta. Owłosienie łonowe staje się obfite, sztywne i skręcone, rozwija się owłosienie pachowe i na twarzy, występuje mutacja głosu, rozwój masy mięśniowej doprowadza do powstania męskiej sylwetki ciała. U dziewcząt występuje dalszy rozwój gruczołów sutkowych oraz powiększanie narządów płciowych, powstaje pigmentacja otoczek brodawek sutkowych oraz warg sromowych, rozwija się owłosienie łonowe i pachowe, kształtuje się kobieca sylwetka ciała, pojawia się pierwsza miesiączka (łac. menarche). U obu płci tempo wzrostu wyraźnie zmniejsza się, podstawowe stężenia gonadotropin i steroidów płciowych we krwi osiągają poziomy charakterystyczne dla dorosłych, silnie wyrażone są identyfikacja, rola i psychoorientacja płciowa Zaburzenia dojrzewania i postępowanie lekarskie Opóźnione dojrzewanie płciowe (łac. pubertas tarda) Jest to brak oznak dojrzewania w czasie o 2-2,5 SD ponad średni wiek początku dojrzewania w danej populacji. Dla chłopców rasy białej w klimacie umiarkowanym jest to wiek 14 lat. Opóźnione dojrzewanie u dziewcząt to brak oznak dojrzewania płciowego do ukończenia 14 roku życia lub brak miesiączki w 16 roku życia mimo rozwoju drugo- i trzeciorzędowych cech płciowych.` Do tego zaburzenia zalicza się także sytuacje, kiedy zaczyna się dojrzewanie, ale postępuje bardzo wolno. W tych przypadkach u chłopców okres od początku powiększenia jąder do całkowitego zakończenia ich dojrzewania trwa dłużej niż 5 lat. Etiologia Konstytucjonalne (rodzinne) opóźnienie wzrostu i rozwoju/ lub dojrzewania (KOWR lub KOWD). Wiek kostny jest zwykle opóźniony o ok. 2 lata w stosunku do większości rówieśników. Oprócz braku oznak dojrzewania nie stwierdza się innych odchyleń od normy. Zaburzenie to uważane jest za wariant prawidłowego dojrzewania płciowego. Uszkodzenie czynności podwzgórza, przysadki lub gonad, które prowadzi do rozwoju hipogonadyzmu (patrz rozdz i 3.6.2). Opóźnione dojrzewanie płciowe wtórne do chorób przewlekłych np. ciężki przebieg astmy oskrzelowej, wady serca, choroba Crohna, celiakia, niewydolność nerek, wątroby, ale także niedożywienie, jadłowstręt psychiczny, nadmierny wysiłek fizyczny, przewlekły stres, alkohol, narkotyki. Postępowanie lekarskie Konstytucjonalne opóźnienie dojrzewania płciowego pozostawia się zwykle bez leczenia. Po osiągnięciu odpowiedniej dojrzałości kośćca rozpoczyna się prawidłowe dojrzewanie płciowe. W sytuacjach tego wymagających stosuje się psychoterapię, a także podawanie małych dawek preparatów testosteronu dla wcześniejszego wywołania dojrzewania płciowego np. enantan testosteronu mg i.m. co 3-4 tyg. w cyklu 3-6 mies. podawania preparatu / 5-6 mies. przerwy. 32
33 Uszkodzenie czynności dokrewnej podwzgórza, przysadki lub gonad leczy się poprzez odpowiednią substytucję hormonalną (patrz rozdz i 3.6.2). Przedwczesne dojrzewanie płciowe (łac. pubertas praecox) Przedwczesne dojrzewanie płciowe rozpoznaje się wówczas gdy, trzeciorzędowe cechy płciowe pojawiają się przed upływem 8 roku życia u dziewcząt i przed upływem 9 roku życia u chłopców. Wyróżnia się przedwczesne dojrzewanie zależne i niezależne od GnRH oraz przedwczesne dojrzewanie w postaci izolowanych oznak. Przedwczesne dojrzewanie zależne od GnRH (syn. centralne, kompletne, prawdziwe) Spowodowane jest przedwczesnym rozpoczęciem czynności osi podwzgórze-przysadka-gonada. We krwi stwierdza się wysokie poziomy gonadotropin i steroidów płciowych. Etiologia Choroby ośrodkowego układu nerwowego, które mogą przedwcześnie zapoczątkować pokwitanie to: urazy, zapalenia, nowotwory, wady rozwojowe, napromieniowanie, zatrucia substancjami toksycznymi. Przyczyny tego zaburzenia są jednak często nieznane. Postępowanie lekarskie Leczenie farmakologiczne Agonistyczne analogi GnRH hamują wydzielanie gonadotropin na drodze ujemnej regulacji receptora dla GnRH w przysadce, jeśli nie są podawane pulsacyjnie, a w konsekwencji hamowane jest wydzielanie steroidów płciowych przez gonady. Progestageny (pochodne 17 -hydroksyprogesteronu tj. medroksyprogesteron, chlormadinon, octan cyproteronu), które wykorzystując mechanizmy ujemnego sprzężenia zwrotnego hamują sekrecję gonadotropin i w konsekwencji steroidów płciowych. Leczenie chirurgiczne podejmuje się w przypadku guza mózgu i niektórych wad rozwojowych ośrodkowego układu nerwowego. Przedwczesne dojrzewanie niezależne od GnRH (syn. niekompletne, rzekome) Spowodowane jest zwiększeniem stężenia steroidów płciowych we krwi, podczas gdy poziom GnRH i wydzielanie gonadotropin pozostają w normie. Etiologia Zwiększone wydzielanie androgenów przez nadnercza np. wrodzony przerost nadnerczy, guzy wirylizujące nadnerczy. Guzy hormonalnie czynne gonad np. leydigioma u chłopców lub arrhenoblastoma u dziewcząt. Nowotwory wydzielające hcg np. chorioepithelioma. Rodzinnie występujący rozrost gruczołu śródmiąższowego jądra (testotoxicosis). Torbiele jajników. Zespół McCune-Albrighta (wielonarządowa endokrynopatia z przedwczesnym dojrzewaniem płciowym) Długotrwałe podawanie leków steroidowych (postać jatrogenna). 33
34 Postępowanie lekarskie Leczenie tych przypadków polega na eliminacji przyczyny zaburzenia. W testotoksykozie lub przy braku przyczyny niekiedy skutecznie stosuje się leki hamujące steroidogenezę np. ketokonazol. Niestety leki te mają wiele działań ubocznych i nie mogą być stosowane przewlekle. Formy izolowane przedwczesnego dojrzewania płciowego jak: W zaburzeniu tym przedwcześnie pojawiają się tylko pojedyncze cechy dojrzewania, najczęściej takie powiększenie sutków (łac. thelarche praecox), owłosienie łonowe (łac. pubarche praecox), rzadziej pachowe (łac. axillarche praecox). Poziomy gonadotropin i steroidów płciowych są zwykle prawidłowe. Objawy te najczęściej ustępują samoistnie lub utrzymują się do okresu pełnego, prawidłowego dojrzewania płciowego. Stan ten zwykle występuje u dziewczynek i najczęściej nie wymaga leczenia. 2. MĘSKI UKŁAD PŁCIOWY W OKRESIE DOJRZAŁOŚCI 2.1. JĄDRO Budowa jądra Objętość jądra dorosłego mężczyzny wynosi zwykle ml (norma ml). Jądra położone są poza jamą brzuszną w skórno-mięśniowym worku - mosznie. Lewe jądro znajduje się nieco niżej niż prawe. Na powierzchni górnej i tylnej jądra położone jest najądrze. Poniżej głowy najądrza znajduje się przyczepek jądra (łac. appendix testis), który jest pozostałością przewodu przyśródnerczowego. Gonada męska otoczona jest łącznotkankową błoną białawą (łac. tunica albuginea). Z zewnątrz zrasta się z nią blaszka trzewna osłonki pochwowej jądra (błona surowicza), która przechodzi w blaszkę ścienną. Pomiędzy nimi znajduje się szczelinowata jama surowicza. Na górnym i tylnym brzegu jądra błona biaława przechodzi w śródjądrze (łac. mediastinum testis), od którego odchodzą przegrody jądra dzielące miąższ na ok. 200 zrazików. Każdy zrazik zawiera 2-3 kanaliki plemnikotwórcze (kanaliki nasienne lub kręte) (łac. tubuli seminiferi). Kanaliki w pobliżu śródjądrza łączą się po kilka i tworzą kanaliki proste (łac. tubuli recti), które przechodzą w sieć jądra (łac. rete testis). Kanaliki plemnikotwórcze stanowią ok % masy narządu. W kanalikach znajduje się nabłonek plemnikotwórczy, w skład którego wchodzą komórki plemnikotwórcze reprezentujące różne etapy spermatogenezy oraz komórki Sertolego. Proces spermatogenezy odbywa się w łożysku utworzonym przez cytoplazmę komórek Sertolego, w izolacji od środowiska wewnętrznego organizmu. Komórki Sertolego formują barierę krew-jądro. Pośredniczą w przekazywaniu większości sygnałów hormonalnych i niehormonalnych wpływających na proces tworzenia plemników, wytwarzają czynniki wzrostowe, białkowe hormony inhibinę i aktywinę, eliminują obumarłe komórki plemnikotwórcze. Gruczoł śródmiąższowy położony między kanalikami plemnikotwórczymi składa się z komórek Leydiga, fibroblastów i makrofagów. Komórki Leydiga wytwarzają steroidy płciowe, głównie testosteron. 34
35 Czynność plemnikotwórcza Spermatogeneza jest to złożony proces podziałów i przekształceń komórek plemnikotwórczych w kanalikach jądra, w wyniku którego ze spermatogonii powstają dojrzałe gamety męskie - plemniki. U człowieka proces ten trwa ok. 74 dni (±6 dni). Spermatogenezę można podzielić na trzy kolejne, jakościowo różne etapy (Ryc. 6): podziały mitotyczne spermatogonii (spermatogoniogeneza), podział redukcyjny (mejoza) spermatocytów (spermatocytogeneza), bezpodziałowe przekształcenie spermatyd w plemniki (spermiogeneza) Budowa i czynność plemnika Dojrzały plemnik ma długość ok. 60 m i składa się z główki oraz witki, w której możemy wyróżnić szyjkę, wstawkę (część pośrednią), cześć główną i cześć końcową (Ryc. 7). Główka plemnika ma kształt owalny. Jej długość wynosi 4-5 m, a szerokość 2,5 3,5 m. Zawiera ona jądro komórkowe o chromatynie jednolicie gęstej, które otoczone jest od przodu tzw. akrosomem, który powstaje z przekształcenia aparatu Golgiego. W akrosomie znajdują się enzymy proteolityczne konieczne dla przejścia przez osłonkę przejrzystą owocyta (hialuronidaza, akrozyna, fosfataza kwaśna, neuraminidaza). Z tyłu akrosomu błona komórkowa plemnika ma zagłębienie zwane pierścieniem równikowym. Od strony szyjki główka jest wklęsła i tworzy wgłębienie zwane dołkiem implantacyjnym. Ap PLEMNIKI Ad Ad Ap Ap B PL L Z PA II SW Ad Ap Ap Ap PL L Z PA II SW ETAP: PREMEIOTIC PRZEDMEJOTYCZNY MEJOTYCZNY MEIOTIC POSTMEJOTYCZNY POSTMEIOTIC Rycina 6. Schemat spermatogenezy u człowieka. Etap przedmejotyczny (spermatogoniogeneza): spermatogonie typu A- ciemne (Ad) są komórkami pnia i komórkami rezerwowymi spermatogenezy, namnażają się tylko przy regeneracji nabłonka plemnikotwórczego po jego uszkodzeniu. Spermatogonie typu A-jasne (Ap) są macierzystymi, różnicującymi się komórkami plemnikotwórczymi. W drodze licznych podziałów mitotycznych namnażają się i różnicują do spermatogonii typu B (B) i samoodtwarzają (strzałka pogrubiona). Spermatogonie typu B różnicują się do spermatocytów preleptotenu (PL). Etap mejotyczny (spermatocytogeneza): PL wchodzą w profazę I -go podziału redukcyjnego. Pojawiają się najpierw spermatocyty I-rzędu w stadium leptotenu i zygotenu (L), a potem pachytenu (PA). Po zakończeniu pierwszego podziału powstają spermatocyty II-rzędu (II), które ulegają drugiemu podziałowi redukcyjnemu. Powstają spermatydy wczesne (SW) ze zredukowaną (haploidalną) liczbą chromosomów. Etap postmejotyczny (spermiogeneza): jest to proces bezpodziałowego różnicowania (metamorfozy) wczesnych spermatyd w plemniki. Aparat ruchowy plemnika zlokalizowany jest w witce. W jej początkowej części - szyjce, znajdują się struktury łączące główkę plemnika z pozostałymi częściami witki. Zawiera ona dwie centriole, z których 35
36 centriola dystalna stanowi równocześnie ciałko podstawne witki i bierze udział w tworzeniu włókna aksonemalnego. Aksonema stanowi podstawowy aparat ruchu plemnika i przebiega przez całą witkę. Jest to kompleks mikrotubul, zbudowany z 2 mikrotubul centralnych, otoczonych przez 9 podwójnych mikrotubul obwodowych. Na zewnątrz każdej z par obwodowych mikrotubul leżą pojedyncze włókna grube (keratynowe). Akrosom Jądro komórkowe Włókna grube Błona komórkowa Mitochondria Aksonema Ciałko podstawne Centriola proksymalna Dołek implantacyjny Pierścień równikowy 5 7 m 45 m 5 m Szyjka Wstawka Część główna Część końcowa Główka Witka Rycina 7. Budowa plemnika. Wstawka ma grubość poniżej 1 µm i długość 5-7 µm. We wstawce oprócz centralnie umieszczonej aksonemy znajduje się mankiet składający się z 20 wydłużonych mitochondriów ułożonych spiralnie. Cześć główna witki ma długość ok. 45 µm. Aksonema otoczona jest tu przez 9, a na końcu przez 7, włókien grubych i osłonkę. W części końcowej witki, o długości 5 m, brak jest włókien grubych i osłonki włóknistej, a aksonema otoczona jest jedynie przez błonę komórkową. Struktura chromatyny plemnika Podstawową jednostkę struktury chromatyny w komórkach somatycznych stanowi nukleosom. W skład nukleosomu wchodzi odcinek DNA o długości ok. 146 par zasad (pz) owiniętych wokół tzw. cząsteczki rdzeniowej zbudowanej z oktameru histonowego (po 2 cząsteczki histonów H2A, H2B, H3 i H4) oraz histon łącznikowy (H1). Pomiędzy nukleosomami znajduje się DNA łącznikowy o długości ok. 50 pz (Ryc. 8). Około 6 nukleosomów i ich DNA łącznikowe układają się w specyficzny sposób tworząc solenoid czyli włókno o średnicy 30 nm. Solenoid układa się w tzw. domeny, z których zbudowane są chromatydy, następnie kondensuje w supersolenoid, dalej w superheliksę finalnie stając się chromosomem matafazowym. Włókna solenoidu wiążą się do macierzy jądrowej. 36
37 Rycina 8. Nukleosom - podstawowa jednostka struktury chromatyny w komórkach somatycznych (opis w tekście). Struktura chromatyny plemnika jest całkowicie odmienna od struktury obserwowanej w komórkach somatycznych. Zmiany prowadzące do uformowania specyficznej dla plemnika struktury chromatyny przebiegają wieloetapowo. Proces zapoczątkowany zostaje w czasie mejozy spermatocytów i wówczas rozpoczyna się wymiana histonów somatycznych na histony specyficzne dla jądra (tzw. histony jądrowe). Kolejnym etapem jest wymiana histonów jądrowych na tzw. białka przejściowe (ang. transition proteins) co następuje podczas wczesnych etapów procesu spermiogenezy (spermatydy okrągłe). W końcowym etapie, w wydłużających się spermatydach, białka przejściowe zastąpione zostają przez niskocząsteczkowe białka - protaminy (protamina 1 i protamina 2), które wiążą się z helisą DNA w tzw. procesie protaminacji. Stosunek protaminy 1 do protaminy 2 w plemniku ludzkim powinien wynosić 1:1. Protaminy są białkami o wysokiej zawartości cysteiny i argininy, dzięki której tworzą stabilny kompleks z nicią DNA i prowadzą do zwijania nici DNA w szerokie, ściśle ułożone koncentryczne kręgi (ang. donut-loop model. Nakładające się na siebie kręgi ulegają silnej kondensacji, co umożliwia uformowanie unikatowej, prawie krystalicznej, struktury chromatyny plemnika w postaci tzw. toroidu (ang. protamine toroid). Kręgi chromatyny wchodzące w skład toroidów stabilizowane są jonami cynku. Chromatyna upakowana w formie toroidu jest niewrażliwa na działanie nukleaz. Mówi się o tzw. uśpieniu genomu (zahamowanie procesu transkrypcji). Struktura ta zabezpiecza genom ojcowski przed uszkodzeniami w czasie transportu plemnika do komórki jajowej. Jądro plemnika zawiera ok. 50 tys. toroidów, które za pomocą łącznikowych pętli DNA (poniżej 1000 pz) (ang. toroid linker) są powiązane ze sobą oraz z włóknami macierzy jądrowej (ang. matrix attachment region). Rycina 9 przedstawia końcowe etapy formowania unikalnej struktury chromatyny plemnika. Oprócz łącznikowych pętli DNA w chromatynie plemnika występują miejsca gdzie DNA pozostaje związane z histonami (w postaci solenoidu). W ludzkim plemniku 10-15% chromatyny pozostaje nadal w postaci solenoidu. Badania ostatnich lat sugerują, że fragmenty DNA związane z histonami zawierają promotory genów, niezbędnych na wczesnych etapach embriogenezy, ale także dla procesu spermiogenezy. DNA łącznikowe i związane z histonami, w przeciwieństwie do DNA tworzącego strukturę toroidu, jest aktywne transkrypcyjnie, wrażliwe na działanie nukleaz oraz czynników uszkadzających, co może prowadzić do pęknięć nici DNA. Po fuzji plemnika z komórką jajową (oocytem), przed pierwszym podziałem mi- 37
38 totycznym zygoty, zachodzi proces odwrotny do protaminacji chromatyny plemnika tzn. wymiana protamin na histony. Rycina 9. Końcowe etapy formowania unikalnej struktury chromatyny plemnika (opis w tekście; na podstawie: Kazienko i ws.,. Post. Biol. Kom. 2012; Ward, Mol Hum Reprod zmodyfikowane). Każde zaburzenie kondensacji chromatyny, które prowadzi do zwiększenia odsetka chromatyny uformowanej w postaci nukleosomów (np. zmniejszona protaminacja), są jednoznaczne ze zwiększeniem podatności DNA plemnika na fragmentację w wyniku działania czynników zewnętrznych. Nasienie zawierające zwiększony odsetek plemników z pęknięciami nici DNA (zwiększona fragmentacja DNA) wykazuje zmniejszony potencjał zapładniający. Do czynników wpływających na zwiększenie fragmentacji DNA plemnika należy zaliczyć: leukocytospermię podwyższona koncentracja leukocytów w nasieniu w wyniku stanów zapalnych/zakażeń w męskim układzie płciowym, palenie papierosów, chemioterapeutyki, promieniowanie jonizujące, zanieczyszczenie środowiska, wiek. Czynność plemnika W odróżnieniu od biernego transportu plemników w męskim układzie płciowym, ich czynną wędrówkę w żeńskim układzie płciowym nazywamy migracją. Podczas gdy bierny transport plemników zależy od 38
39 ciśnienia płynu wewnątrz kanalików jądra i najądrza oraz perystaltyki nasieniowodów, migracja zależy głównie od właściwości motorycznych samych plemników. Po osiągnięciu śluzu szyjkowego część plemników natychmiast migruje do jamy macicy i jajowodów. W optymalnym okresie okołoowulacyjnym, już po upływie 5 minut od depozycji nasienia w pochwie, plemniki mogą znaleźć się w jajowodach, gdzie odbywa się zapłodnienie. Wiele plemników (w I fazie cyklu płciowego kobiety) zatrzymuje się w tzw. kryptach gruczołów szyjkowych (kolonizacja krypt szyjkowych), a następnie opuszcza ten naturalny rezerwuar, przez ok. 7 dni, kierując się w stronę jamy macicy i jajowodów. Kapacytacja (fizjologiczne uzdatnienie) jest procesem dalszego dojrzewania plemników w trakcie migracji w żeńskim układzie płciowym. Proces ten jest potrzebny do zapoczątkowania tzw. reakcji akrosomalnej plemnika, niezbędnej do penetracji otoczki komórki jajowej. Kapacytacja jest niewykrywalna morfologicznie. Kapacytacja rozpoczyna się od szybkiego napływu jonów wapnia do komórki, co wywołuje nasilenie ruchliwości plemnika (hiperkineza). W błonie komórkowej dochodzi do obniżenia stosunku cholesterolu do fosfolipidów i utraty z powierzchni plemników resztek plazmy nasienia, która ma właściwości utrudniające zapłodnienie. Występuje też destabilizacja (częściowe upłynnienie) błony komórkowej plemnika. Czas potrzebny do kapacytacji wynosi u człowieka około 6 godzin. Ostatni etap dojrzewania plemników w trakcie migracji to reakcja akrosomalna. Polega ona na rozpadzie i uwolnieniu zawartości akrosomu po kontakcie plemnika z otoczką przejrzystą komórki jajowej. Reakcja akrosomalna zapoczątkowana jest napływem jonów wapnia do plemnika. Uwolnienie enzymów proteolitycznych z akrosomu np. proakrozyny, umożliwia plemnikom przejście przez otoczkę komórki jajowej. Podczas tej reakcji zmienia się struktura równikowego regionu błony główki plemnika, pozwalając na boczne, równikowe przylgnięcie plemnika do błony komórki jajowej, od którego zaczyna się proces zapłodnienia Czynność dokrewna jądra i jej regulacja Układ podwzgórze-przysadka-gonada Z wyniosłości pośrodkowej podwzgórza do układu naczyń wrotnych przysadki wydzielana jest pulsacyjnie GnRH, która stymuluje pulsacyjne uwalnianie z przedniego płata przysadki gonadotropin LH i FSH. Komórkami docelowymi dla LH są komórki Leydiga w gruczole śródmiąższowym jądra. LH aktywuje enzymy uczestniczące w procesie steroidogenezy jądra, dzięki czemu wytwarzany jest testosteron (ryc. 8). FSH działa pobudzająco na komórki Sertolego. Ważnym mechanizmem w regulacji czynności osi podwzgórze-przysadka-jądro jest mechanizm ujemnego sprzężenia zwrotnego, w którym odpowiednio wysoki poziom testosteronu we krwi hamuje wydzielanie GnRH przez podwzgórze i gonadotropin, głównie LH, przez przysadkę. Białkowe produkty komórek Sertolego zarówno hamują (inhibina), jak i pobudzają (aktywina) wydzielanie FSH przez przysadkę. Mechanizm działania androgenów Komórki Leydiga gruczołu śródmiąższowego jądra wytwarzają androgeny, głównie testosteron. W tkankach obwodowych z testosteronu powstaje dihydrotestosteron (DHT), który jest najaktywniejszym biologicznie androgenem (Ryc. 10). Źródłem androgenów jest również kora nadnerczy. Powstaje tutaj dehydroepiandrosteron (DHEA). 39
40 Biologiczne efekty działania androgenów różnią się w zależności od okresu życia, w którym działają: życie płodowe (8-20 tydzień) - wywołują różnicowanie wewnętrznych i zewnętrznych narządów płciowych, okres okołoporodowy (8 miesiąc ciąży - 4 miesiąc po urodzeniu) - uczestniczą w procesie zstępowania jąder do moszny oraz prawdopodobnie w różnicowaniu płciowym podwzgórza i wyższych pięter mózgu odpowiedzialnych za płeć psychiczną, dojrzewanie i dojrzałość płciowa efekty androgenne - androgeny współuczestniczą w inicjacji i regulacji spermatogenezy, wywołują rozwój i utrzymują drugo- i trzeciorzędowe cechy płciowe męskie oraz popęd płciowy. efekty metaboliczne - androgeny mają pobudzający wpływ na czynność wątroby oraz układu krwiotwórczego, mięśniowego, kostnego. KOMÓRKA LEYDIGA KRĄŻENIE TKANKI OBWODOWE OCTANY CHOLESTEROL CHOLESTEROL (LDL) PREGNENOLON PROGESTERON 17OH-PREGNENOLON 17OH-PROGESTERON DEHYDROEPIANDROSTERON ANDROSTENDION ANDROSTENDIOL DHT TESTOSTERON TESTOSTERON TESTOSTERON ESTRADIOL ESTRADIOL ESTRADIOL Rycina 10. Biosynteza androgenów oraz ich przemiany w komórce Leydiga i w obwodowych tkankach docelowych. Cholesterol jest syntetyzowany w komórkach Leydiga z octanów lub dostarczany z krążenia z frakcji lipoprotein małej gęstości (LDL). Produktami steroidogenezy jądrowej są w największych ilościach testosteron i estradiol, które są wydzielane do krwi i dyfundują do tkanek. W komórkach docelowych testosteron działa bezpośrednio (przez receptor androgenowy) lub po przekształceniu do dihydrotestosteronu (DHT) (przez receptor androgenowy) lub do estradiolu (przez receptor estrogenowy). Krążący testosteron pochodzi głównie z jąder. Krążący estradiol jest sumą estradiolu wydzielanego przez jądra i wytwarzanego w tkankach obwodowych. 40
41 2.2. WEWNĘTRZNE NARZĄDY PŁCIOWE Najądrze (łac. epidydimis) Z sieci jądra wywodzą się przewody wyprowadzające tworzące głowę najądrza. Przewody te łączą się w jeden, kręty przewód najądrza, długości 3-5 m, który formuje trzon i ogon najądrza. Dzięki ruchom perystaltycznym przewodu najądrza plemniki są przesuwane do nasieniowodu podczas pierwszej fazy wytrysku. W najądrzu plemniki nie są magazynowane, ale podlegają dojrzewaniu czynnościowemu. Polega ono na uzyskaniu przez plemniki zdolności do poruszania się szybkim ruchem prostoliniowym, pokryciu główki plemników białkami umożliwiającymi rozpoznanie i związanie do komórki jajowej, substancjami immunosupresyjnymi, chroniącymi przed rozpoznaniem przez układ immunologiczny kobiety i zmianach w metabolizmie. Czas transportu plemników przez najądrze jest zmienny (2-12 dni). Przy braku wytrysku trwającym kilka tygodni plemniki ulegają cytolizie i fagocytozie przez makrofagi lub dochodzi do spontanicznej emisji do cewki. Jednym ze składników wydzieliny najądrzy jest α-glukozydaza obojętna, która oznaczana w plazmie nasienia jest markerem czynności najądrzy i pozwala na różnicowanie azoospermii obstrukcyjnej od sekrecyjnej. Czynność sekrecyjna najądrza kontrolowana jest przez testosteron, a aktywność skurczowa przewodu najądrza poprzez nerwowy układ autonomiczny Nasieniowód (łac. ductus deferens) Nasieniowód jest przedłużeniem przewodu najądrza o długości ok cm. Wyróżnia się: część mosznową, pachwinową i miedniczną (w miednicy mniejszej). Część pachwinowa nasieniowodu wraz tętnicą jądrową, splotem wciowatym, tętnicą i żyłami nasieniowodu, splotem nerwowym jądrowym, nerwami nasieniowodu oraz naczyniami limfatycznymi wchodzi w skład powrózka nasiennego. Dystalna poszerzona część miednicza nasieniowodu nosi nazwę bańki i łączy się z przewodem odprowadzającym pęcherzyka nasiennego, na tylnej powierzchni gruczołu krokowego. Od miejsca połączenia tych przewodów powstaje przewód wytryskowy, który po wniknięciu do gruczołu krokowego, uchodzi do cewki moczowej na wzgórku nasiennym. Głównym zadaniem nasieniowodu jest transport plemników w czasie ejakulacji. Komórki gruczołowe bańki nasieniowodu wytwarzają wydzielinę pobudzającą plemniki do ruchu Pęcherzyki nasienne (łac. vesiculae seminales) Są to gruczoły parzyste położone na tylnej powierzchni pęcherza moczowego, tuż powyżej gruczołu krokowego, o długości ok. 5 cm i objętości ok. 3-4 ml. Ich wydzielina stanowi 50-70% objętości ejakulatu (plazmy nasienia) i ma odczyn zasadowy (ph ok. 8-9). Wydzielina pęcherzyków nasiennych bogata jest we fruktozę (substancja energetyczna dla plemników), prostaglandyny (pobudzają ruch) oraz seminogelinę, które odpowiada za koagulację nasienia. Fruktoza uważana jest za wskaźnik czynności pęcherzyków nasiennych i może być oznaczana w plazmie nasienia Gruczoł krokowy (syn. stercz, łac. prostata) Jest to nieparzysty gruczoł położony poniżej pęcherza moczowego, otaczający cewkę moczową. Miąższ gruczołu krokowego zbudowany jest z gruczołów cewkowo-pęcherzykowych, które kończą się przewodzikami stercza, które uchodzą do cewki moczowej wokół wzgórka nasiennego. Miąższ podzielony jest pasmami mięśniówki gładkiej i tkanki łącznej na nieregularne jednostki. Wydzielina gruczołu krokowego ma odczyn 41
42 kwaśny (ph 4,5-5,5), zawiera duże ilości kwasu cytrynowego, kwaśnej fosfatazy, cynku i proteinaz. Kwas cytrynowy jest uważany za wskaźnik czynności gruczołu krokowego i może być oznaczany w plazmie nasienia metodą spektrofotometryczną. Poliaminy (spermina, spermidyna i putreiscyna) są cząsteczkami o dodatnim ładunku i zasadowym odczynie, łatwo łączą się ze cząsteczkami kwaśnymi lub o ujemnym ładunku elektrycznym, jak jony fosforanowe, fosfolipidy czy kwasy nukleinowe. Poliaminy mogą być utleniane przez oksydazę diaminową do aldehydów, które są toksyczne dla bakterii i plemników oraz odpowiadają za charakterystyczny zapach nasienia. Cynk ma działanie antybakteryjne i jest składnikiem wielu metaloproteinaz. Antygen specyficzny dla prostaty (PSA ang. prostatic specific antigen) wydzielany w dużych ilościach do nasienia jest proteinazą serynową i odpowiada za upłynnianie nasienia poprzez trawienie seminogeliny, białka powodującego koagulację nasienia, wydzielanego przez pęcherzyki nasienne. Wydzielina stercza stanowi ok % objętości nasienia. Plemniki zawieszone w wydzielinie stercza zachowują lepsze parametry ruchu i lepszą stabilizację chromatyny. Kwaśne ph wydzieliny gruczołu krokowego podtrzymuje ruch plemników, a cynk obecny w wysokich stężeniach odpowiada za utrzymanie prawidłowej struktury DNA plemników ZEWNĘTRZNE NARZĄDY PŁCIOWE Prącie (syn. członek męski, łac. penis) W budowie prącia wyróżnia się nieruchomą część tylną - nasadę oraz ruchomy odcinek, na który składa się część pośrednia - trzon i przednia - żołądź. Prącie utworzone jest z parzystych ciał jamistych i nieparzystego ciała gąbczastego, obejmującego cewkę moczową. Odnogi ciał jamistych przykryte są mięśniami kulszowo-jamistymi i przytwierdzone do gałęzi dolnej kości łonowej. Ciało gąbczaste rozpoczyna się opuszką prącia przykrytą mięśniem opuszkowo-gąbczastym. Gruba łącznotkankowa błona biaława otacza ciała jamiste przedzielając je przegrodą. Cieńsza błona biaława otacza ciało gąbczaste. Ciała jamiste i ciało gąbczaste zbudowane są z licznych jamek, które po wypełnieniu krwią znacznie zwiększają swą objętość powodując wzwód prącia. W przegrodach ciał jamistych znajdują się komórki mięśniowe gładkie, które w skurczu wywołują stan wiotkości prącia Moszna (łac. scrotum) Moszna zbudowana jest ze skóry oraz mięśniówki gładkiej tworzącej tzw. błonę kurczliwą. Worek moszny podzielony jest przegrodą moszny na dwie części, w których znajdują się jądra. Temperatura w obrębie moszny jest o 2-3 o C niższa niż we wnętrzu ciała REAKCJE PŁCIOWE Aktywność płciowa człowieka służy poszukiwaniu rozkoszy seksualnej lub motywowana jest potrzebą rozrodu. Chociaż z punktu widzenia biologicznego jej podstawowym przeznaczeniem jest rozród, to sprzyja ona dobremu samopoczuciu i odprężeniu oraz pogłębieniu więzi emocjonalnej między partnerami. Cele te najczęściej realizowane są poprzez współżycie płciowe. Niezbędnym warunkiem odbycia stosunku płciowego jest podniecenie płciowe, które zapoczątkowywane jest przez bodźce psychiczne. Dla narastania pobudzenia płciowego wielkie znaczenie ma fizyczne pobudzanie stref erogennych. Pierwotne strefy erogenne znajdują się na zewnętrznych narządach płciowych, a tzw. wtórne na całej skórze. Pobudzenia ze stref pierwotnych są 42
43 przekazywane do ośrodków rdzeniowych. Natomiast pobudzenia ze stref wtórnych są przekazywane do ośrodków w centralnym układzie nerwowym, a stąd do ośrodków rdzeniowych Wzwód prącia (łac. erectio) Do wzwodu prącia może dochodzić: przy pełnej świadomości, jako skutek podniecenia płciowego, samoistnie w czasie fazy paradoksalnej snu. Wzwód prącia przebiega w następujących fazach: faza utajona (wydłużenie prącia bez wzrostu ciśnienia krwi w ciałach jamistych), nabrzmienie prącia (wzrost ciśnienia krwi w ciałach jamistych), pełny wzwód, faza ustępowania wzwodu. W stanie wiotkości prącia jamki ciał jamistych i ciała gąbczastego mają małą objętość na skutek skurczu mięśni gładkich znajdujących się w przegrodach. Mięśnie te posiadają receptory dla katecholamin (noradrenaliny, adrenaliny, serotoniny, histaminy) wydzielanych z zakończeń nerwów układu współczulnego. Nerwy te wywodzą się z ośrodków rdzeniowych Th 12-L 2, a następnie poprzez splot podbrzuszny górny i dolny, drogą nerwu sromowego wnikają wraz z tętnicami do ciał jamistych prącia. Stała stymulacja układu współczulnego utrzymuje prącie w stanie zwiotczenia. Wzwód prącia następuje na skutek rozkurczu włókien mięśniowych gładkich i rozszerzenia jamek ciał jamistych pod wpływem pobudzenia układu przywspółczulnego. W części krzyżowej rdzenia kręgowego (S 2- S 4) znajduje się ośrodek autonomiczny przywspółczulny zwany ośrodkiem erekcji. Włókna przywspółczulne dochodzą do zwojów miednicznych i jako nerwy jamiste prącia biegną wzdłuż naczyń tętniczych do mięśniówki gładkiej ciał jamistych i ciała gąbczastego. Z zakończeń włókien przywspółczulnych uwalniane są mediatory cholinergiczne: acetylocholina, wazoaktywny peptyd jelitowy (VIP ang. vasoactive intestinal peptide) oraz peptyd związany z genem kalcytoniny CGRP (ang. calcitonin gene-related peptide). Mediatory te działają bezpośrednio na komórki mięśniowe gładkie naczyń i przegród ciał jamistych (stymulując ich rozkurcz) oraz na śródbłonek jamek ciał jamistych prącia pobudzając je do syntezy tlenku azotu (NO). NO jest najsilniejszym lokalnym czynnikiem powodującym rozkurcz włókien mięśniowych gładkich i wywołującym wzwód. NO po wniknięciu do komórki mięśniowej gładkiej indukuje syntezę w cytoplazmie cgmp (cykliczny guanozyno-3,5 -monofosforan), który otwiera kanały jonowe i uruchamia wypływ jonów wapnia z komórki. W ten sposób dochodzi do rozkurczu komórek mięśniowych gładkich tętnic prącia oraz ciał jamistych, co umożliwia wypełnienie jamek ciał jamistych krwią. cgmp jest rozkładane przez znajdującą się w cytoplazmie fosfodiesterazę typu 5 (PDE-5 ang. phosphodiesterase type 5). Zwiększenie objętości jamek ciał jamistych powoduje rozciągnięcie błony białawej prącia, zwężenie, a w dalszej kolejności zaciśnięcie światła żył wypustowych, co powoduje utrudnienie odpływu krwi żylnej z ciał jamistych. Odpływ krwi z ciała gąbczastego jest cały czas możliwy. Z tego powodu ciało gąbczaste, chociaż zwiększa swoją objętość, nie powoduje ucisku na cewkę moczową. Dzięki temu cewka moczowa pozostaje drożna w czasie wytrysku. W czasie wzwodu ciała jamiste zawierają ml krwi, a ciśnienie w nich jest 43
44 równe tętniczemu ciśnieniu skurczowemu. W stanie pełnego wzwodu przepływ krwi w naczyniach prącia jest znacznie zmniejszony, ale wystarczający dla prawidłowego zaopatrzenia tkanek w tlen. Wzwód prącia ustępuje na skutek pobudzenia układu adrenergicznego, związanego z wytryskiem nasienia, stresem lub zanikiem pobudzenia płciowego Wytrysk nasienia (łac. eiaculatio) Wytrysk nasienia następuje w wyniku pobudzenia seksualnego podczas stosunku płciowego, masturbacji lub w czasie snu. Wywołany jest bodźcami płynącymi z tych samych ośrodków rdzeniowych, częściowo kontrolowanych przez centralny układ nerwowy, które odpowiadają za mechanizm wzwodu. Wyróżnia się następujące fazy wytrysku: Emisja - szybkie przesunięcie plemników z najądrza do nasieniowodów oraz pojawienie się wydzielin gruczołu krokowego i pęcherzyków nasiennych w części sterczowej cewki moczowej. Wytrysk właściwy - rytmiczne wytryskiwanie nasienia przez ujście zewnętrzne cewki moczowej. Emisja jest wynikiem rytmicznych skurczów mięśniówki gładkiej przewodów najądrza, nasieniowodów oraz przewodów wyprowadzających gruczołów dodatkowych męskiego układu płciowego. Wytrysk właściwy występuje na skutek kilku rytmicznych skurczów mięśnia poprzecznego powierzchownego krocza, mięśni opuszkowo-jamistych, kulszowo-jamistych, mięśnia dźwigacza odbytu oraz mięśniówki gładkiej cewki moczowej. Występujący podczas wytrysku odruchowy skurcz szyi pęcherza moczowego zapobiega wystąpieniu wytrysku wstecznego (do pęcherza moczowego). Nasienie wydobywa się przez zewnętrzne ujście cewki moczowej w 3-5 porcjach. W pierwszej porcji nasienia dominują plemniki i wydzielina gruczołu krokowego, a w następnych wydzielina pęcherzyków nasiennych. Wytryskowi zazwyczaj towarzyszy szczytowe odczucie rozkoszy (orgazm). W czasie wytrysku dochodzi do wydzielania dużych ilości adrenaliny. Pobudzenie układu współczulnego powoduje zwiększenie napięcia tętnicy głębokiej prącia i obkurczanie beleczek mięśni gładkich w przegrodach ciał jamistych, co prowadzi do ustąpienia wzwodu. Rozpoczyna się wtedy okres refrakcji, podczas którego następny wzwód nie jest możliwy, a receptory stref erogennych tracą wrażliwość. Czas trwania okresu refrakcji zależny jest od właściwości osobniczych i wieku mężczyzny Szczytowanie (łac. orgasmus) Orgazm jest uruchamiany przez ośrodek mózgowy zlokalizowany w układzie limbicznym. Do ośrodka orgazmu dochodzą pobudzenia ze stref erogennych oraz doznania z kory mózgowej. Ośrodki nerwowe orgazmu są czynnościowo związane z centralnymi i rdzeniowymi ośrodkami wzwodu oraz ejakulacji. Dodatnie sprzężenia zwrotne między nimi wzmacniają pobudzenia. Podczas orgazmu silnie pobudzane jest podwzgórze, dzięki czemu wydzielane są duże ilości oksytocyny, co wywołuje silne skurcze dna miednicy. Uczuciu rozkoszy związanemu z orgazmem towarzyszy wydzielanie dużych ilości endorfin w mózgu. Przebieg orgazmu jest zupełnie wyłączony spod kontrolującego wpływu kory mózgowej. Świadomie można wpływać jedynie na zapoczątkowanie wytrysku nasienia. Czas potrzebny do uruchomienia odruchów wzwodu, wytrysku i orgazmu wydłuża się wraz z wiekiem. 44
45 2.5. DIAGNOSTYKA ANDROLOGICZNA Badanie podmiotowe Wywiad powinien uwzględniać: aktualne dolegliwości, w tym ze strony układu płciowego, jakość współżycia płciowego, obecność spontanicznych wzwodów prącia w czasie snu, nasilenie popędu płciowego, tryb życia (obciążenie pracą, stresem, długość i jakość snu), rodzaj wykonywanej pracy, narażenie na niekorzystne czynniki środowiskowe, substancje toksyczne, przebyte i aktualne choroby i urazy centralnego układu nerwowego, przebyte i aktualne choroby i urazy narządów układu moczowo-płciowego, ciężkie choroby ogólnoustrojowe, stosowane leki i używki (alkohol, papierosy, narkotyki), dane dotyczące przebiegu ciąży u matki i leków stosowanych w tym czasie, dane dotyczące przebiegu dojrzewania płciowego, wywiad rodzinny w celu wykluczenia zaburzeń genetycznych. Powinno uwzględniać: Badanie przedmiotowe badanie internistyczne, w którym ocenia się: sylwetkę ciała, rozkład tkanki tłuszczowej, rozwój masy mięśniowej, stan skóry, stan gruczołów piersiowych, stopień rozwoju płciowego (owłosienie łonowe i pachowe, owłosienie na twarzy, wielkość narządów płciowych, mutacja głosu), stan zewnętrznych narządów płciowych, stan najądrzy, obecność nasieniowodów, stan wężłow chłonnych pachwinowych, konsystencję, ruchomość, równość powierzchni, bolesność jąder z oceną objętości z zastosowaniem orchidometru Pradera (wzorzec wielkości jąder), obecność węchu. elementy badania urologicznego - ocena gruczołów płciowych dodatkowych (badanie przez odbytnicę, łac. per rectum), elementy badania neurologicznego - badanie pola widzenia. 45
46 Badanie nasienia wg zaleceń WHO z 2010 roku W 2010 roku po raz piąty został opublikowany podręcznik Światowej Organizacji Zdrowia (WHO) przedstawiający zalecaną procedurę wykonywania badania nasienia oraz nowe wartości referencyjne dla poszczególnych parametrów tego badania (dostępny na stronie internetowej WHO: publications/infertility/ /en/). Po raz pierwszy wartości referencyjne parametrów nasienia oparte są na wynikach uzyskanych w grupie płodnych mężczyzn, których partnerki uzyskały ciążę w czasie 12 miesięcy lub krótszym (tzw. EBM, ang. evidence based medicine) (Tab. 3). W 2015 roku ukazało się polskie opracowanie rekomendacji WHO, które jest dostępne na stronie internetowej Krajowej Izby Diagnostów Laboratoryjnych: Warunki wstępne przygotowanie pacjenta 1. Okres wstrzemięźliwości płciowej (czas od ostatniego wytrysku nasienia) przed oddaniem nasienia do badania powinien wynosić co najmniej 48 godzin, ale nie dłużej niż 7 dni. Informacja o okresie abstynencji powinna znaleźć się na wyniku. Długość abstynencji płciowej wpływa na wartości takich parametrów jak objętość, liczba, żywotność, ruch i morfologia plemników. 2. W przypadkach kolejnego badania nasienia, najlepiej, aby okres wstrzemięźliwości płciowej był taki sam jak przy pierwszym badaniu. 3. Zalecane jest oddanie nasienia w laboratorium, w warunkach zapewniających intymność, drogą masturbacji do pojemnika (zalecane są pojemniki jednorazowe, obojętne dla plemników). Naczynie powinno być ogrzane do temperatury pokojowej, gdyż obniżenie temperatury ujemnie wpływa na ruch plemników i może być źródłem fałszywych wyników. 4. Nasienie powinno być oddane w całości, przy zachowaniu podstawowych zasad higieny. Jeśli nasienie nie zostało oddane w całości, to mężczyzna powinien poinformować o tym personel medyczny, a badanie nasienia nie powinno być wykonywane. 5. W przypadku problemów z oddaniem nasienia w laboratorium możliwe jest jego oddanie w warunkach domowych (do odpowiedniego pojemnika lub przy użyciu specjalnych prezerwatyw) i dostarczenie do laboratorium w czasie nie dłuższym niż 60 min. Nasienie w czasie transportu powinno być zabezpieczone przed wychłodzeniem (temp C). 6. Wiarygodne dane o jakości nasienia uzyskuje się po wykonaniu co najmniej 2 lub 3 badań w odstępach nie krótszych niż 7 dni i nie dłuższych niż 3 tygodnie. Wynika to ze zmienności fizjologicznej w produkcji plemników oraz wpływu czynników zewnętrznych. Ocena makroskopowa nasienia Objętość 95% objętości nasienia stanowi wydzielina pęcherzyków nasiennych i gruczołu krokowego. Za prawidłową objętość ejakulatu przyjęto wartość równą lub wyższą niż 1,5 ml. Objętość poniżej 1 ml (parvi- 46
47 semia) może wynikać z niepełnego wytrysku, niedorozwoju lub zmian zapalnych w gruczołach płciowych dodatkowych lub też z utraty części próbki przy jej oddawaniu. Czas upłynnienia Po oddaniu nasienie stanowi półpłynną, skoagulowaną masę, która ulega procesowi upłynnienia. Koagulacja nasienia zależy od białka (seminogeliny), wydzielanego przez pęcherzyki nasienne. Po upłynnieniu w temperaturze pokojowej do 60 minut nasienie staje się homogenne i wodniste. Może zawierać ciałka żelatynowe, które nie ulegają upłynnieniu i nie mają znaczenia klinicznego. Brak upłynnienia nasienia może świadczyć o zaburzeniach czynności gruczołu krokowego, gdyż właśnie tam produkowany jest enzym (PSA) odpowiedzialny za trawienie seminogeliny. Wygląd, kolor i zapach nasienia Prawidłowe nasienie jest homogenne, nieprzezroczyste, koloru szaroopalizującego. Przezroczystość nasienia może wskazywać na niską liczbę plemników. W przypadku obecności krwi w nasieniu, może ono mieć odcień brunatny (hematospermia). Żółty kolor nasienia występuje np. w przypadku żółtaczki lub przyjmowania niektórych witamin i leków. Nasienie ma zapach kasztanów (składniki zapachowe pochodzą z prostaty). Lepkość (konsystencja) nasienia Lepkość nasienia bada się poprzez ocenę długości nitki tworzącej się przy opadaniu kropli nasienia z pipety. Nasienie o prawidłowej lepkości tworzy nitkę do 2 cm długości. Nieprawidłowa podwyższona lepkość nasienia spowodowana np. dużą zawartością śluzu, może przeszkadzać w ocenie parametrów takich jak ruchliwość, liczba plemników oraz przy ocenie testów immunologicznych. ph Ocena tego parametru powinna być dokonana zaraz po upłynnieniu i dokładnym wymieszaniu ejakulatu. ph nasienia zależy od stosunku objętości wydzieliny prostaty (kwaśnej) i pęcherzyków nasiennych (zasadowej). Prawidłowe ph wynosi 7,2. Nasienie o ph <7,0 obserwuje się przy obturacji przewodów wytryskowych i zwykle łączy się z azoospermią. Naturalne właściwości buforujące nasienia ulegają osłabieniu wraz z upływem czasu, co wpływa na wzrost ph nasienia. Ocena mikroskopowa nasienia Wstępna analiza mikroskopowa w preparacie bezpośrednim, przyżyciowym umożliwia ocenę występowania pasm śluzu, samoistnej aglutynacji i niespecyficznej agregacji plemników oraz innych, poza plemnikami, elementów komórkowych (komórki nabłonkowe, komórki okrągłe). Dalsza analiza mikroskopowa obejmuje ocenę ruchu plemników (preparat bezpośredni, przyżyciowy), ich żywotności, koncentracji i całkowitej liczby (komora Neubauera) oraz morfologii (wybarwiony rozmaz). Ocena liczby, ruchu i morfologii plemników jest najważniejsza dla wnioskowania co do płodności mężczyzny. Niespecyficzna agregacja i samoistna aglutynacja plemników Niespecyficzna agregacja to występowanie nieruchomych plemników przylegających do siebie, jak i ruchomych przylegających do pasm śluzu, komórek innych niż plemniki lub ciałek resztkowych. Samoistna aglutynacja to występowanie ruchomych plemników przylegających do siebie i tworzących skupiska ( zlepy ). Według WHO 2010 rozmiar aglutynacji określany jest w czterech stopniach: 1. liczba plemników w aglutynatach < 10; większość plemników jest wolna; 47
48 2. liczba plemników w aglutynatach od 10 do 50; obecne są wolne plemniki; 3. liczba plemników w aglutynatach > 50; pojedyncze plemniki wolne; 4. wszystkie plemniki tworzą aglutynaty. Oprócz oceny rozmiaru aglutynacji wyróżniamy jej 5 typów: np. główka-do-główki, witka-do-witki, koniec witki-do-końca witki, mieszany (główka-do-główki, witka-do-witki) i splątany. Obecność aglutynacji nie jest wystarczającym dowodem na istnienie immunologicznej przyczyny niepłodności, ale może wskazywać na obecność przeciwciał przeciwplemnikowych. W takich przypadkach powinno się wykonać testy dodatkowe (MAR test, Immunobead test). Obecność przeciwciał przeciwplemnikowych stwierdza się u ok. 8% niepłodnych mężczyzn. Koncentracja i całkowita liczba plemników Terminy całkowita liczba plemników oraz koncentracja plemników nie są synonimami. Termin koncentracja plemników oznacza liczbę plemników w jednostce objętości nasienia (1 ml), podczas gdy całkowita liczba plemników odnosi się do liczby plemników w całym ejakulacie i oblicza ją się przez pomnożenie koncentracji plemników przez objętość nasienia. Koncentrację plemników określa się za pomocą komory do liczenia krwinek (hematocytometr - komora Neubauera). Liczba plemników może różnić się u tego samego pacjenta w różnych ejakulatach. Wartość referencyjna koncentracji plemników wynosi 15 mln plemników w 1 ml nasienia, a całkowitej liczby plemników 39 mln plemników w całym ejakulacie. Tylko w przypadku, gdy oba parametry są poniżej wartości referencyjnych mówimy o oligozoospermii. Jeśli w preparacie przyżyciowym nie ma plemników, to próbkę powinno się odwirować (15 min., 3000g) i wykonać preparat mikroskopowy z osadu po odwirowaniu. Jeśli w preparacie nie ma żadnego plemnika, to jest to azoospermia. Jeśli w osadzie po wirowaniu obecne są plemniki to jest to kryptozoospermia. Ruch plemników Wyróżnia się następujące kategorie ruchu: 1. ruch postępowy (progresywny, PR, ang. progressive motility) plemniki poruszające się ruchem postępowym zarówno liniowym, jak i nieliniowym lub po dużym kole bez względu na ich szybkość; 2. ruch niepostępowy (nieprogresywny, NP, ang. non-progressive motility) - plemniki drgające w miejscu lub poruszające się po małym kole; 3. plemniki nieruchome (IM, ang. immotility). Według WHO 2010 prawidłowe nasienie powinno zawierać co najmniej 32% plemników wykazujących ruch postępowy. Jeśli w nasieniu odsetek plemników o ruchu progresywnym jest poniżej wartości referencyjnej to mówimy o asthenozoospermii (Tab.4). Na wyniku należy podawać też odsetek określający całkowity ruch plemników (suma odsetka plemników wykazujących ruch postępowy i niepostępowy), który nie powinien być niższy niż 40%. W przypadku, gdy ponad 60% plemników jest nieruchomych należy zbadać żywotność plemników. Z klinicznego punktu widzenia istotne jest obliczenie całkowitej liczby plemników o ruchu postępowym w ejakulacie. Uzyskuje się ją mnożąc całkowitą liczbę plemników w ejakulacie przez odsetek plemników o ruchu postępowym. Dolna wartość referencyjna dla tego parametru wynosi: 12,5 mln/ejakulat. 48
49 Testy do oceny żywotności plemników Badanie to może być wykonywane rutynowo we wszystkich próbkach nasienia, jednak konieczne jest w przypadkach, gdzie ruch całkowity plemników był poniżej wartości referencyjnych (<40%). Zalecane testy oceny żywotności plemników: 1. test eozyna-nigrozyna 2. test eozynowy 3. test pęcznienia plemników (HOS test, ang. hypoosmotic swelling test) Przyżyciowe testy eozyna-nigrozyna oraz eozynowy opierają się na zasadzie przepuszczalności błony komórkowej martwej komórki dla barwnika. Nigrozyna jest używana do podbarwiania tła, co ułatwia różnicowanie. Plemniki żywe nie absorbują eozyny i pozostają niezabarwione, plemniki martwe natomiast barwią się na czerwono lub ciemno-różowo. Odsetek plemników niezabarwionych (żywych) nie powinien być mniejszy niż odsetek plemników ruchomych. Test HOS tzw. test pęcznienia jest metodą alternatywną do metod barwnych. Plemniki z nienaruszoną błoną komórkową (żywe) zawieszone w hipoosmotycznym medium pęcznieją (zmiana wyglądu witki). Według WHO 2010 wartość referencyjna dla żywotności plemników wynosi co najmniej 58% plemników niezabarwionych (test eozyna, eozyna-nigrozyna) lub ze zmienioną witką (HOS). Z klinicznego punktu widzenia istotne jest obliczenie całkowitej liczby plemników żywych w ejakulacie. Uzyskuje się ją mnożąc całkowitą liczbę plemników w ejakulacie przez odsetek plemników żywych. Dolna wartość referencyjna dla tego parametru wynosi: 22,6 mln/ejakulat. Ocena morfologiczna plemników Morfologicznej analizy plemników dokonuje się wg ścisłych kryteriów Krűgera w preparatach rozmazów nasienia barwionych metodą Papanicolaou, Shorra lub Diff-Quick. W preparatach oblicza się odsetek plemników wykazujących prawidłową budowę. Główki plemników w preparatach barwionych są mniejsze od główek plemników żywych, lecz ich kształt pozostaje niezmieniony. Prawidłowa główka ma kształt owalny. Region akrosomalny powinien zajmować od 40-70% powierzchni główki. W obszarze akrosomalnym dopuszcza się występowanie do 2 małych wakuoli. Według WHO 2010 wartość referencyjna dla morfologii plemników to co najmniej 4% plemników o prawidłowej morfologii. Jeśli wartość ta jest niższa to mówimy o teratozoospermii). Z klinicznego punktu widzenia istotne jest obliczenie całkowitej liczby plemników o prawidłowej morfologii w ejakulacie. Uzyskuje się ją mnożąc całkowitą liczbę plemników w ejakulacie przez odsetek plemników o prawidłowej morfologii. Dolna wartość referencyjna dla tego parametru wynosi: 1,6 mln/ejakulat. Wyróżnia się następujące rodzaje zaburzeń budowy plemników: główka: zbyt duża, zbyt mała, wydłużona, gruszkowata, wielokształtna, zwakuolizowana, podwójna oraz kombinacje wyżej wymienionych zaburzeń; wstawka: brak wstawki i witki (same główki), ustawiona nie w podłużnej osi główki, rozciągnięta, rozszerzona, nieregularna, zbyt cienka (brak mitochondriów), zgięta; witka: zbyt krótka, wieloczłonowa, załamana lub zgięta pod kątem większym niż 90 o, o kształcie szpilki do włosów, o nieregularnej szerokości, zwinięta, zakończona w kształcie kropli lub kombinacje tych zaburzeń; przywieszka cytoplazmatyczna plemnika jest to pozostałość cytoplazmy resztkowej, która na drodze prawidłowej spermiogenezy jest usuwana z plemników przed ich uwolnieniem z nabłonka 49
50 plemnikotwórczego (w czasie spermiacji). Przywieszka cytoplazmatyczna nie powinna występować lub nie powinna być większa niż 1/3 wielkości główki plemnika. Jeżeli podczas analizy morfologicznej stwierdza się zaburzenie w budowie główek większości plemników, które są okrągłe i nie mają akrosomu, to mówimy o globozoospermii. Tabela 3. Wartości referencyjne spermiogramu wg WHO (2010). Parametr badania nasienia Badania podstawowe Czas upłynnienia Objętość ph Koncentracja plemników Całkowita liczba plemników Ruchliwość plemników ruch postępowy całkowity ruch Morfologia plemników Żywotność plemników Koncentracja komórek okrągłych Koncentracja leukocytów MAR Test, Immunobead Test Testy biochemiczne: Cynk Kwas cytrynowy α-glukozydaza Fruktoza Wartość referencyjna do 60 min. 1,5 ml 7,2 15 mln/ml 39 mln/ejakulat 32% 40% 4% o prawidłowej budowie 58% żywych plemników < 5 mln/ml < 1 mln/ml < 50% plemników związanych z kuleczkami 2,4 µmol/ejakulat 52 µmol/ejakulat 20 mu/ejakulat 13 µmol/ejakulat Inne elementy komórkowe nasienia komórki spermatogenezywczesniejszych etapów (okrągłe spermatydy, spermatocyty, spermatogonie); leukocyty, głównie granulocyty obojętnochłonne. Do różnicowania granulocytów stosuje się barwienie na obecność peroksydazy leukocytów lub immunocytochemiczne przy użyciu przeciwciał przeciwko antygenom krwinek białych (CD45). Liczba leukocytów powyżej 1 mln/ml (leukocytospermia/leukospermia/pyospermia) może wskazywać na obecność infekcji w narządach płciowych. Leukocytospermii mogą towarzyszyć zmniejszona objętość ejakulatu, mniejsza liczba, ruchliwość i zaburzenia morfologiczne plemników. Takie parametry nasienia są wskazaniem do wykonania badań mikrobiologicznych nasienia i moczu. Komórki spermatogenezy wcześniejszych etapów oraz leukocyty stanowią kategorię tzw. komórek okrągłych. Wartość referencyjna dla liczby komórek okrągłych nie powinna być wyższa niż 5 mln/ml. 50
51 Oprócz komórek okrągłych w nasieniu mogą być obecne komórki nabłonkowe pochodzące z nabłonka cewki moczowej. Tabela 4. Międzynarodowe nazewnictwo rozpoznań przy badaniu nasienia. (hemosper- aspermia parvisemia hematospermia mia) brak ejakulatu objętość ejakulatu <1 ml obecność erytrocytów w ejakulacie leukocytospermia (leukospermia, pyospermia) normozoospermia asthenozoospermia nekrozoospermia oligozoospermia kryptozoospermia azoospermia teratozoospermia globozoospermia oligoasthenoteratozoospermia obecność leukocytów w ejakulacie powyżej 1 mln/ml prawidłowa całkowita liczba plemników w ejakulacie (lub ich koncentracja) i ruchliwość i budowa morfologiczna plemników odsetek plemników z ruchem postępowym poniżej wartości referencyjnej niski odsetek żywych plemników oraz wysoki odsetek plemników nieruchomych w ejakulacie* całkowita liczba plemników w ejakulacie i ich koncentracja poniżej wartości referencyjnej brak plemników w preparatach bezpośrednich, ale stwierdzane po odwirowaniu ejakulatu zupełny brak plemników, potwierdzony badaniem osadu po odwirowaniu nasienia odsetek plemników wykazujących prawidłową morfologię poniżej wartości referencyjnej wysoki odsetek plemników z okrągłymi główkami (brak akrosomu) łącznie zaburzenia w postaci: zmniejszonej liczby, ruchliwości i prawidłowej morfologii plemników * znaczenie tego terminu jest niejednoznaczne; klasycznie termin ten był używany w przypadkach całkowitego braku żywotności plemników (0% żywych plemników); obecnie, oprócz klasycznego znaczenia, niektórzy różnicują nekrozoospermię częściową przy różnych wartościach granicznych np. <5%, <25% lub <45% żywych plemników. Wybrane testy dodatkowe testy do oceny obecności przeciwciał przeciwplemnikowych w nasieniu - przeciwciała przeciwplemnikowe należą głównie do klas IgA lub IgG, bardzo rzadko do IgM (ze względu na dużą masę cząsteczkową). Wiążąc się z plemnikami powodują aglutynację lub unieruchomienie plemników w nasieniu. Testy wykrywające przeciwciała polegają na dodaniu do nasienia zawiesiny kuleczek (lateksowych lub poliakrylamidowych) związanych z przeciwciałami przeciwko ludzkim immunoglobulinom. Jeśli na plemnikach znajdują się przeciwciała przeciwplemnikowe to wiążą się one z przeciwciałami antyglobulinowymi obecnymi na kuleczkach. W mikroskopie świetlnym lub fazowo-kontrastowym widoczne są wówczas ruchliwe plemniki pokryte kuleczkami. Wykonuje się mieszany test antyglobulinowy (MAR Test) lub test wiązania immunologicznego (Immunobead Test). Wyniki tych testów uważa się za pozytywne jeśli co najmniej 40% (zalecenia producenta) lub 50% (zalecenia WHO 2010) swobodnie poruszających się plemników związanych jest z cząsteczkami lateksu lub pokrytych kuleczkami poliakrylamidowymi. Oba 51
52 testy mają zastosowanie tylko w próbkach, gdzie plemniki wykazują ruch oraz obserwuje się tworzenie ich aglutynatów w preparacie bezpośrednim. Nie mają one zastosowania w przypadku, gdy przeciwciała powodują unieruchomienie plemników. badanie mikrobiologiczne nasienia - czynnikami etiologicznymi zakażeń męskiego układu płciowego mogą być bakterie tlenowe, beztlenowe oraz takie drobnoustroje wewnątrzkomórkowe jak: Chlamydia trachomatis, Mycoplasma homonis, Mycoplasma genitalium i Ureaplasma urealyiticum (niewykrywalne w rutynowych posiewach mikrobiologicznych) oraz grzyby (dominuje rodzaj Candida i Cryptococcus). Z tego względu dla uzyskania pełnego obrazu możliwych czynników etiologicznych wywołujących stan zapalny niezbędne jest wykonanie testów umożliwiających wykrycie różnych grup patogenów; analiza biochemiczna plazmy nasienia pozwala na ocenę czynności gruczołów dodatkowych (najądrze, prostata, pęcherzyki nasienne) poprzez oznaczanie stężenia typowych dla nich znaczników w plazmie nasienia: cynk, kwas cytrynowy - znaczniki czynności gruczołu krokowego, α-glukozydaza obojętna - znacznik czynności najądrzy, fruktoza - znacznik czynności pęcherzyków nasiennych. Ilości tych znaczników ulegają zmianie np. w przypadku występowania stanów zapalnych gruczołów dodatkowych, niedrożności dróg wyprowadzających nasienie, wytrysku wstecznego lub niskich wartości koncentracji testosteronu we krwi. Wartości referencyjne zamieszczono w tabeli 3. testy oceny chromatyny plemnika ocena chromatyny plemnika dotyczy zarówno stopnia jej dojrzałości (stopień protaminacji, prawidłowe upakowanie chromatyny), jak i uszkodzenia (pęknięcia) nici DNA. Test z fluorochromem chromomycyną A3, który wiąże się specyficznie do nici DNA w miejscach z sekwencjami G-C, do których wykazują powinowactwo także protaminy, ocenia pośrednio zakres protaminacji chromatyny a tym samym jej dojrzałość. Innym testem wykorzystywanym przy ocenie protaminacji chromatyny jest test z kwaśną aniliną blue, która barwi bogate w lizynę białka histonowe nie wykazując powinowactwa do bogatych w argininę i cysteinę protamin. Testy te wykorzystywane są najczęściej w badaniach naukowych i nie znalazły szerokiego zastosowania w rutynowej diagnostyce męskiej płodności min. ze względu na brak standaryzacji oraz opracowania wartości odcięcia między populacją mężczyzn płodnych i niepłodnych. Wśród testów oceniających uszkodzenia, czyli tzw. fragmentację DNA (pęknięcia nici DNA) najczęściej wykorzystywane są: test SCSA (ang. sperm chromatin structure assay), metoda TUNEL (ang. terminal deoxynucleotidyl transferase-mediated dudp nick end-labeling) oraz dostępny komercyjnie w formie zestawu test dyspersji chromatyny (SCD, ang. sperm chromatin dispersion) znany także pod nazwą Halo test. Testy SCSA oraz TUNEL wymagają specjalistycznego sprzętu (cytometr przepływowy) oraz wykwalifikowanego personelu, w przeciwieństwie do testu SCD, do wykonania którego wystaraczy mikroskop świetlny. Wyniki wyrażane są jako odsetek plemników z pofragmentowanym DNA (SDF, ang. sperm DNA fragmentation lub DFI, ang. DNA fragmantation index). Testy SCSA i SCD są testami pośrednimi oceniającymi podatność DNA na denaturację, która zachodzi znacznie łatwiej w pofragmnentowanej nici DNA. Oprócz odsetka plemników z pofragmentowanym DNA tylko test SCSA ma możliwośc równoczesnego określenia odsetka populacji plemników z niedojrzałą chromatyną (HDS, ang. high DNA stainability). Metoda TUNEL uznawana jest za metodę bezpośrednią, polegającą na przyłączaniu znakowanego fluoro- 52
53 chromem nukletydu do nici DNA w miejscu jej pęknięcia w obecności enzymu terminalnej transferazy (TdT, ang. terminal deoxynucleotidyl transferase). Najwięcej opracowań naukowych, dotyczących standaryzacji metody, jej walidacji oraz opracowania wartości odcięcia między populacją mężczyzn płodnych i niepłodnych można znaleźć dla testu SCSA. Na podstawie danych literaturowych, dla testu SCSA, DFI <15% uznawany jest za wartość prawidłową, DFI >30% dotyczy mężczyzn z niskim potencjałem plemników do zapłodnienia, a zakres między tymi wartościami (DFI %) mężczyzn, u których może wystąpić obniżenie tego potencjału. Powyższe wartości odcięcia zostały także zaadoptowane dla testu SCD. Z kolei wartości odcięcia DFI dla metody TUNEL, różnicujące mężczyzn płodnych od niepłodnych, wahają się według danych literaturowych, od 16,8 do 20%. Wskazania do wykonania testów oceniających fragmentację DNA: pacjenci z żylakami powrózków nasiennych - obserwuje się zależność między występowaniem fragmentacji DNA plemnika i obecnością żylaków 2 i 3 stopnia. W takich przypadkach operacja usunięcia żylaków skutkuje zmniejszeniem fragmentacji DNA oraz zwiększeniem częstości uzyskiwania ciąż; męska niepłodność idiopatyczna zwiększona fragmentacja DNA może występować przy prawidłowych wynikach podstawowego badania nasienia. Ocena fragmentacji DNA stanowi niezależny predyktor stanu męskiej płodności, jej wynik koreluje z prawdopodobieństwem uzyskania ciąży w sposób naturalny; historia nawracających poronień u partnerki fragmentacja DNA plemnika jest związana ze zwiększoną częstością poronień u partnerki; powtarzający się brak powodzenia uzyskania ciąży przy wykorzystywaniu techniki inseminacji domacicznej (IUI, ang. intrauterine insemination) fragmentacja DNA plemnika związana jest z niższą częstością uzyskania ciąż przy IUI; powtarzający się brak powodzenia uzyskania ciąży przy technikach wspomaganego rozrodu (IVF i ICSI) fragmentacja DNA plemnika umiarkowanie wpływa na brak powodzenia techniki IVF, z kolei nie wykazano wpływu na powodzenie techniki ICSI, jednakże niezależnie od wykorzystywanej techniki wysoka fragmatnacja DNA plemnika zwiększa ryzyko wystąpienia poronień; przy zwiększonym narażeniu na szkodliwe czynniki środowiskowe oraz czynniki ryzyka związane ze stylem życia wiek, otyłość, palenie papierosów, czynniki szkodliwe w miejscu pracy lub życia. test wiązania z hialuronianem (HBA, ang. hyaluronian binding assay) - ocenia czynność i dojrzałość plemników. Prawidłowe plemniki mają zdolność łączenia się z hialuronianem, który jest składnikiem wieńca promienistego komórki jajowej. W teście HBA hialuronian znajduje się na płytce (szkiełko mikroskopowe), na którą nakłada się nasienie. Plemniki prawidłowe wchodzą w reakcję z hialuronianem i są wiązane na płytce. Wartość referencyjna podana przez producenta wynosi powyżej 80% plemników reagujących w teście. test migracyjny (ang. swim up) - pozwala na ocenę zdolności plemników do migracji do medium o składzie podobnym do płynu jajowodowego. Test ten sprawdza zdolność plemników do opuszczenia płynu nasiennego dzięki chemotaksji dodatniej. Plemniki o prawidłowej czynności powinny czynnie migrować do medium umieszczonego ponad próbką nasienia (wbrew grawitacji). Dodatkowo test wykorzystywany jest do separacji plemników do zabiegu inseminacji domacicznej. 53
54 ocena stresu oksydacyjnego w nasieniu powinna dotyczyc zarówno oceny ilości wolnych rodników tlenowych, jak i całkowitej zdolności antyoksydacyjnej nasienia. Chemiluminescencja jest metodą najszerzej stosowaną do oceny poziomu wolnych rodników tlenowych w nasieniu. W metodzie tej w wyniku reakcji rodników tlenowych z odpowiednim znacznikiem (np. luminol) powstają wzbudzone formy emitujące chemiluminescencję. Wyniki wyrażane są jako ilość względnych jednostek światła (RLU, ang. relative light unit) w czasie, w przeliczeniu na 10 6 plemników (RLU/s/10 6 plemników). Według danych literaturowych wartość odcięcia różnicująca mężczyzn z grupy kontrolnej od mężczyzn niepłodnych została ustalona na poziomie RLU/s/10 6 plemników. Metoda TEAC (ang. trolox eqiuvalent antioxidant capacity) jest metodą kolorymetryczną, wykorzystywaną do oceny całkowitej zdolności antyoksydacyjnej nasienia. Zasada tej metody polega na hamowaniu przez czynniki antyoksydacyjne plazmy nasienia utleniania ABTS (kwas 2,2 -azynobis (3-etylenobenzotiazolinowy) do kationorodnika ABTS+, co powoduje zmianę absorbancji. Zdolność antyoksydacyjna próbki jest porównywana ze zdolnościa antyoksydacyjną standardu - troloksu (kwas 6-hydroksy-2,5,7,8-tetrametylchroman-2-karboksylowy) i wyrażana jest w µm ekwiwalentu troloksu. Wg danych literaturowych wyniki powyżej 1947 µm uzyskiwane są u zdowych mężczyzn, a te poniżej wskazują na obecność stresu oksydacyjnego. Ocena potencjału oksydo-redukcyjnego (ORP) nasienia test przeprowadza się w analizatorze MiOXSYS z wykorzystaniem technologii elektrochemicznej w celu ilościowego pomiaru (mv) potencjału oksydo-redukcyjnego (ORP) w nasieniu. Uzyskany wynik jest zintegrowaną miarą równowagi pomiędzy całkowitą aktywnością utleniaczy a całkowitą aktywnością czynników redukujących w nasieniu. Wartość całkowitego ORP (mv) dzieli się przez wartość koncentracji plemników (mln/ml) i w ten sposób uzyskuje wartość skorygowanego ORP (sorp). Za dolną granicę wartości referencyjnej sorp u mężczyzn w przedziale wiekowym lat uważa się 1,38 mv/10 6 /ml plemników. Wśród innych testów oceniających w nasieniu i/lub plemnikach poziom stresu oksydacyjnego w sposób pośredni wyróżnić można pomiar stężenia aldehydu malonowego (MDA), produktu peroksydacji lipidów błony komórkowej plemnika, oraz pomiar stężenia 8-hydroksy-2 - deoksyguanozyny (8-OHdG), markera uszkodzeń oksydacyjnych DNA. Brak standaryzacji oraz ustalonych wartości referencyjnych sprawia, że metody te wykorzystywane są głównie w badaniach naukowych. Obecnie rozwój metod diagnostycznych męskiej niepłodności ukierunkowany jest na badania nad profilem mirna oraz nad składem białkowym plemników i/lub plazmy nasienia (proteomika) przy zaburzeniach płodności o różnej etiologii Badania hormonalne Krew na oznaczenia hormonalne powinna być pobierana w godzinach porannych (między 7 a 10). Prawidłowe wartości stężeń hormonów we krwi dorosłego mężczyzny wynoszą: FSH 1,5-8,0 U/L LH 1,5-8,0 U/L testosteron całkowity nmol/l (3,5-12 ng/ml) 54
55 testosteron wolny 0,3-2,3 nmol/l ( pg/ml), oznaczenia obarczone dużym błędem z powodów metodologicznych SHBG nmol/l (ang. sex hormone binding globulin globulina wiążąca steroidy płciowe) jest wytwarzana w wątrobie, wiąże ona specyficznie i silnie testosteron w surowicy krwi. Testosteron związany z SHBG jest uważany za hormon nieaktywny biologicznie. FTI (ang. free testosterone index, indeks wolnego testosteronu) Znacznie dokładniej określa ilość testosteronu bioaktywnego w puli testosteronu obecnego w krążeniu niż oznaczenia wolnego testosteronu. FTI oblicza się z wzoru: testosteron całkowity / SHBG x 100 (w tych samych jednostkach). Prawidłowe wartości FTI zależą od wieku. DHT (dihydrotestosteron) - nie jest rutynowo oznaczany. Jedynie w przypadku podejrzenia niedoboru aktywności 5α-reduktazy określa się współczynnik testosteron/dht w surowicy lub 5β/5α pochodnych w moczu (etiocholanolon /androsteron) (stężenia hormonów w tych samych jednostkach). Prawidłowe współczynniki powinny wynosić ok. 1, a gdy są >2, może to świadczyć o deficycie 5αreduktazy. estradiol pmol /l (12-75 pg/ml) prolaktyna - do 330 mu/l (do 20 ng/ml) inhibina B ng/l nie jest oznaczana powszechnie, chociaż obecnie uważa się, że jest to najlepszy parametr diagnostyczny czynności komórek Sertolego. Stwierdzenie niskich stężeń inhibiny B i wysokich FSH jednoznacznie wskazuje na uszkodzenie kanalików plemnikotwórczych. AMH (hormon antymuellerowski) <80 pmol/l. Niskie stężenie tego hormonu wskazuje na dojrzałość komórek Sertolego. wolne hormony tarczycy (tyroksyna i trijodotyronina) i TSH oznaczane są dla potwierdzenia lub wykluczenia nadczynności lub niedoczynności tarczycy, które mogą ujemnie wpływać na czynność gonad. Testy czynnościowe: z hcg ocenia zdolności komórek Leydiga do odpowiedzi na stymulację. hcg działa poprzez receptor dla LH. Test wykorzystywany jest dla wykluczenia lub potwierdzenia obecności jąder przy niemożności znalezienia ich w badaniu przedmiotowym i badaniach obrazowych. Poziom testosteronu i estradiolu we krwi oznaczany jest przed oraz po 48 i 72 godz. od jednorazowego wstrzyknięcia domięśniowego hcg w dawce 2000 j.m./m 2 pow. ciała (u dorosłych mężczyzn 5000 j.m.). U osób po okresie dojrzewania płciowego co najmniej 2-krotne zwiększenie stężenia testosteronu we krwi świadczy o obecności jądra i prawidłowej czynności komórek Leydiga. U dzieci w okresie przeddojrzewaniowym nawet 2- krotny wzrost stężenia testosteronu jest niemiarodajny ze względu na bardzo niskie stężenia tego hormonu. Uważa się, że wzrost stężenia testosteronu do wartości co najmniej 2 nmol/l świadczy tutaj o obecności aktywnych komórek Leydiga. Przy leydigioma obserwuje się nadmierny wzrost wydzielania estradiolu po hcg. z GnRH służy ocenie zdolności wydzielania gonadotropin przez przysadkę. Stężenia FSH i LH we krwi oznacza się przed i w odstępach co 30 min. przez 2 godz. po jednorazowym dożylnym podaniu GnRH w dawce 100 µg (u dzieci 75 µg/ m 2 pow. ciała). U osób po dojrzewaniu płciowym za prawidłowe uważane jest co najmniej 2-krotne zwiększenie stężenia LH we krwi i 1,5-krotne stężenia FSH. U osób przed dojrzewaniem płciowym przysadka jest niewrażliwa na GnRH. Dopiero podanie GnRH w pompie infuzyjnej 55
56 (5 µg co 120 min.) przez 7 dni uwrażliwia przysadkę na GnRH, a wtedy ponowne wykonanie testu jest miarodajne. z klomifenem służy do oceny rezerwy wydzielniczej gonadotropin. Jest testem tańszym od testu z GnRH, ale mniej precyzyjnym. Cytrynian klomifenu jest antyestrogenem, blokuje receptory estrogenowe w podwzgórzu i przysadce (blokuje hamujące działanie estrogenów) i w ten sposób pobudza wydzielanie gonadotropin. Po doustnym podaniu 50 mg cytrynianu klomifenu po 7-10 dniach oznacza się stężenie FSH i LH we krwi. z FSH służy ocenie czynności komórek Sertolego. Preparat czystego FSH podaje się w jednorazowej dawce 3000 j.mn. domięśniowo lub podskórnie. Przed oraz 4 i 5 dnia po podaniu FSH określa się stężenie inhibiny B we krwi. U osób z prawidłową czynnością komórek Sertolego stężenie inhibiny B wzrasta co najmniej dwukrotnie. ze stanozololem służy ocenie wrażliwości na androgeny. Stanozolol jest pochodną metylotestosteronu, anabolicznym androgenem (nie jest dopuszczony do sprzedaży w Polsce). Lek podaje się doustnie w dawce 0,2 mg/kg masy ciała/dzień przez 3 dni. Określa się stężenie SHBG we krwi przed i 5, 6, 7 dni po podaniu preparatu. U osób z niezmienioną wrażliwością na androgeny stężenie SHBG zmniejsza się do ok. 50% wartości początkowych. U osób z częściową niewrażliwością na androgeny najniższa wartość (nadir) stężenia SHBG stanowi 70-89% wartości początkowych, a przy całkowitej niewrażliwości na androgeny ponad 90%. z tyreoliberyną (TRH) pomaga w ocenie zaburzeń wydzielania prolaktyny przez przysadkę. TRH oprócz wpływu na wydzielanie TSH wzmaga wydzielanie prolaktyny. Test z TRH umożliwia wykrycie tzw. hiperprolaktynemii utajonej, w której wydzielanie podstawowe prolaktyny jest prawidłowe, ale jej rezerwa wydzielnicza jest znacznie podwyższona, co może wpływać ujemnie na czynność gonad Biopsja jąder Wskazaniami do wykonania biopsji jądra są: diagnostyka przyczyn azoospermii u mężczyzn z prawidłową objętością jąder i prawidłowymi poziomami FSH. Pozwala na różnicowanie azoospermii sekrecyjnej (zaburzenia czynności plemnikotwórczej jądra) od azoospermii obturacyjnej (niedrożności dróg wyprowadzających plemniki), diagnostyka przedinwazyjnego wewnątrzkanalikowego nowotworu jądra z komórek płciowych carcinoma in situ (CIS) jądra, pozyskanie z tkanki jądra plemników lub spermatyd, które mogą być wykorzystane do zapłodnienia pozaustrojowego (patrz rozdział Techniki wspomaganego rozrodu ). Biopsja jądra może być wykonywana metodą otwartą (biopsja chirurgiczna) lub przezskórną (gruboigłową). Do utrwalania wycinków stosuje się płyny Bouina, Stievea lub Clelanda. Nie należy stosować formaliny, która uszkadza strukturę komórek i utrudnia postawienie rozpoznania. Oprócz rutynowej obróbki histologicznej (skrawki parafinowe, barwienie hematoksyliną i eozyną) przeprowadza się dodatkowe barwienie immunohistochemiczne w celu wykrycia komórek CIS (patrz rozdz ). Dodatkowymi wskazaniami do wykonania biopsji jądra jest występowanie zaburzeń takich jak: 1) ciężka postać oligozoospermii, 2) podwyższone stężenie FSH i obniżone inhibiny B we krwi, 3) objętość jądra <12 ml, 4) mikrozwapnienia widoczne w badaniu ultrasonograficznym jąder. Gdy niepłodna para akceptuje ART, część wycinka może zostać zamrożona (kriokonserwacja w ciekłym azocie), aby ewentual- 56
57 nie znalezione plemniki mogły być wykorzystane do zapłodnienia metodą wstrzyknięcia plemnika do cytoplazmy komórki jajowej (ICSI, ang. intracytoplasmic sperm injection). Wyniki badania histopatologicznego pojedynczego wycinka pobranego z jądra nie dają pewności, że taki sam stan kanalików plemnikotwórczych jest w całej gonadzie. Badanie histopatologiczne preparatów składa się z: Oceny jakościowej struktury jądra, średnicy kanalików plemnikotwórczych, rodzaju komórek zawartych w kanalikach, obecności plemników, wielkości przestrzeni międzykanalikowych, obecność komórek Leydiga. Oceny ilościowej poszczególnych rodzajów komórek plemnikotwórczych i komórek Sertolego w kanalikach plemnikotwórczych oraz liczby komórek Leydiga w przestrzeniach międzykanalikowych Badania genetyczne Przy podejrzeniu zaburzeń o podłożu genetycznym wykonuje się: chromatynę płciową test chromatyny X - u mężczyzn prawidłowo <4% komórek chromatyno-dodatnich test chromatyny Y - u mężczyzn prawidłowo >30% komórek chromatyno-dodatnich kariotyp badanie kariotypu nie tylko pozwala na zbadanie obecności chromosomów plciowych, ale także na ocenę, czy niepłodny mężczyzna nie jest nosicielem zrównoważonych translokacji lub innych uszkodzeń autosomów; AZF (ang. azoospermia factor) to grupa trzech genów (a,b,c) zlokalizowanych na ramieniu długim chromosomu Y, które są niezbędne do prawidłowego wytwarzania plemników. Uszkodzenie AZFa prowadzi do powstania w nabłonku plemnikotwórczym zespołu samych komórek Sertolego, AZFb zwykle do zatrzymania spermatogenezy, a AZFc do mieszanych zaburzeń, które manifestują się ciężką oligozoospermią. Mutacje w genach AZF mogą przenosić się na potomstwo i mogą mieć związek z rozwojem GCT; mutacje w genie CFTR (ang. cystic fibrosis transmembrane conductance regulator) tzw. ciężkie prowadzą do rozwoju mukowiscydozy. Wszyscy mężczyźni z mukowiscydozą są niepłodni z powodu agenezji i niedrożności nasieniowodów i najądrzy. U chorych z tzw. słabymi mutacjami nie dochodzi do rozwoju mukowiscydozy, ale rozwija się wrodzony obustronny brak nasieniowodów (CBAVD ang. congenital bilateral absence of the vas deferens). W badaniu nasienia obserwuje się azoospermię, a poziomy gonadotropin we krwi i objętość jąder są prawidłowe. Do powstania CBAVD może dochodzić także u chorych, u których nie znajduje się klasycznych mutacji, a jedynie zmiany w tzw. odcinkach polimorficznych. Polimorfizm w intronie 8 genu CFTR (IVS8-5T) jest przyczyną CBAVD w 13-44% przypadków. Polega on na obecności 5, 7 lub 9 reszt tymidynowych, opisywany jest jako 5T, 7T lub 9T. Występowanie wariantu 7T lub 9T jest neutralne, natomiast wariant 5T jest przyczyną utraty exonu 9 w nici m-rna i prowadzi to do powstania nieprawidłowego funkcjonalnie białka. Penetracja 5T zależy dodatkowo od polimorfizmu innego odcinka genu CFTR - powtórzeń TG, których zwykle jest od 8 do 13. U mężczyzn z CBAVD i obecnością 5T częściej występuje większa liczba powtórzeń w łańcuchu TG (TG12 lub TG13) niż u zdrowych. Współwystępowanie 5T z TG12 lub 13 zwiększa ryzyko rozwoju CBAVD. Poziom α-glukozydazy w nasieniu u chorych z CBAVD jest zwykle niewykrywalny. Jeżeli dodatkowo u chorego rozwinie się ageneza pęcherzyków nasiennych to w badaniu nasienia oprócz azoospermii wystąpi obniżone ph i zmniejszona objętość. 57
58 mutacje w genach receptorów androgenowych, estrogenowych, FSH, LH i genów kontrolujących biosyntezę enzymów steroidogenezy mogą być przyczyną zaburzeń czynności dokrewnej jądra lub męskiej niepłodności Inne badania dodatkowe Podstawowe badania laboratoryjne są elementem diagnostyki zaburzeń czynności gonad i układu płciowego. Ich wyniki mogą nasunąć podejrzenie chorób z układu moczowo-płciowego lub innych ogólnoustrojowych chorób, które mogą mieć wpływ na czynność układu płciowego. Najczęściej wykonuje się następujące badania: morfologia krwi badanie ogólne moczu wskaźniki biochemiczne czynności wątroby, nerek lipidogram Badanie ultrasonograficzne umożliwia ocenę: położenia jąder (w przypadku wnętrostwa), objętości i struktury jąder (możliwość stwierdzenia guzów jąder, wodniaków itp.), objętości i struktury najądrza (zapalenie, torbiele nasienne), żylaków powrózka nasiennego, objętości i struktury gruczołu krokowego i pęcherzyków nasiennych. Badania immunologiczne: przeciwciała przeciwplemnikowe we krwi, przeciwciała przeciwplemnikowe w nasieniu (patrz rozdz, 2.5.3) przeciwciała przeciw antygenom drobnoustrojów chorobotwórczych przenoszonych drogą płciową takich jak chlamydia, mykoplazmy, krętki kiły, HIV. 58
59 2.6. NIEPŁODNOŚĆ MĘSKA Ogólna systematyka Niepłodność (łac. sterilitas, ang. infertility) to brak zdolności do poczęcia dziecka. W tabeli 5 przestawiono systematykę przyczyn męskiej niepłodności. Należy zaznaczyć, że w części przypadków przyczyny niepłodności pozostają nieznane i prawdopodobnie mają charakter zmian subkomórkowych na poziomie gonady. Tabela 5. Znane przyczyny męskiej niepłodności. Przyczyny przedjądrowe 1. Upośledzenie czynności podwzgórza i/lub przysadki - hipogonadyzm hipogonadotropowy wrodzone np. wielohormonalna niedoczynność przysadki, zespół Kallmana, zespół Pradera-Willego nowotwory okolicy podwzgórzowo-przysadkowej pierwotne np. czaszkogardlak lub wtórne, przerzutowe nabyte uszkodzenie podwzgórza i/lub przysadki np. zapalenie, uraz ośrodkowego układu nerwowego przewlekłe choroby ogólnoustrojowe np. przewlekłe schorzenia tkanki łącznej, niewydolność układu krążenia, nerek, wątroby zaaawansowany wiek 2. Nadmiar androgenów nadczynność androgenna nadnerczy np. wrodzony przerost nadnerczy (zespół nadnerczowo-płciowy), choroba/zespół Cushinga, nowotwory nadnerczy nowotwory jądra wytwarzające androgeny np. leydigioma leki o działaniu androgennym np. preparaty testosteronu, steroidy anaboliczne upośledzenie przetwarzania i wydalania steroidów płciowych np. marskość wątroby, niewydolność nerek 3. Nadmiar estrogenów nowotwory produkujące estrogeny np. sertolioma, leydigioma nadczynność tarczycy (nadmierne wiązanie androgenów i przewaga działania estrogenów) leki o działaniu antyandrogennym (powodujące przewagę działania estrogenów) np. spironolakton, flutamid, finasteryd, dutasteryd, ketokonazol czynniki środowiskowe o działaniu estrogennym tzw. ksenoestrogeny np. rozpuszczalniki organiczne, metale ciężkie, herbicydy, pestycydy 4. Niedobór estrogenów np. brak aktywności aromatazy 5. Nadmiar prolaktyny gruczolak prolaktynowy przysadki czynnościowy nadmiar prolaktyny niektóre leki o działaniu antydopaminergicznym np. metoclopramid, cymetydyna, fenotiazyna 6. Nadmiar glikokortykoidów zespół lub choroba Cushinga steroidoterapia 7. Żylaki powrózków nasiennych (2 i 3 stopnia) 8. Nieodpowiedni tryb życia np. używki (alkohol, tytoń, narkotyki), stres, siedzący tryb życia, przebywanie w wysokiej temperaturze Zaburzenia metaboliczne np. otyłość, niedożywienie, hipo- i hiperglikemia, dyslipidemia Przyczyny jądrowe 59
60 1. Wrodzone zaburzenia rozwoju jąder agenezja jąder np. mutacja genu SRY (ang. sex determining region Y) dysgenezja jąder np. zespół Klinefeltera wnętrostwo 2. Wrodzone zaburzenia czynności jąder mutacje odcinka AZF (ang. azoospermic factor) chromosomu Y niewrażliwość na androgeny (mutacje genu dla receptora androgenowego na chromosomie X) zaburzenia receptora LH/hCG (mutacje genu dla receptora LH/hCG na chromosomie 2) zaburzenia receptora FSH (mutacje genu dla receptora FSH na chromosomie 2) 3. Nabyte uszkodzenia struktury i czynności jąder zapalenie jąder uraz mechaniczny jąder skręt powrózka nasiennego, niedokrwienie i martwica jąder nowotwory jąder uszkodzenie komórek spermatogenezy na skutek szkodliwego działania leczniczego np. radioterapia, cytostatyki, niektóre antybiotyki (makrolidy, tetracykliny, aminoglikozydy), chemioterapeutyki (nitrofurantoina), leki przeciwzapalne (sulfasalazyna) zaaawansowany wiek 9. Niedoczynność tarczycy (długotrwała powoduje atrofię jąder) Przyczyny pozajądrowe obustronny wrodzony brak połączenia na drodze sieć jądra-najądrza-nasieniowody obustronny wrodzony brak nasieniowodów (CBAVD, ang. congenital bilateral absence of the vas deferens) w ok. 80% przypadków na skutek mutacji genu CFTR (ang. cystic fibrosis transmembrane conductance regulator) obustronny wrodzony brak najądrzy np. w częściowej niewrażliwości na androgeny torbiel pośrodkowa stercza zarośnięcie przewodów wytryskowych (EDO, ang. ejaculatory duct obstruction) zablokowanie przewodów najądrza przez gęstą wydzielinę (zespół Younga) stany zapalne w układzie moczowo-płciowym uraz mechaniczny najądrzy, nasieniowodów np. przecięcie lub podwiązanie nasieniowodów wady wrodzone i nabyte cewki moczowej 2. Zaburzenia ruchliwości plemników nieprawidłowe dojrzewanie plemników w najądrzach o nieznanej etiologii tzw. zespół wrogiego najądrza nieprawidłowy skład plazmy nasienia np. w zapaleniu gruczołów dodatkowych (gruczoł krokowy, pęcherzyki nasienne) zaburzenia upłynnienia plazmy nasienia np. mukowiscydoza, niedrożność przewodów wyprowadzających gruczołu krokowego zaburzenia budowy i czynności witki plemnika np. zespół 9+0, pierwotna dyskineza rzęsek (zespół nieruchomych rzęsek) narażenie na działanie zbyt dużych stężeń wolnych rodników tlenowych opłaszczenie witek plemników przeciwciałami przeciwplemnikowymi niektóre leki np. antybiotyki (makrolidy, tetracykliny), chemioterapeutyki (nitrofurantoina), leki przeciwzapalne (sulfasalazyna) 3. Zaburzenia połączenia plemnika z komórką jajową zaburzenie budowy i czynności akrosomów plemników np. w globozoospermii uszkodzenia chromatyny plemników np. nieprawidłowa kondensacja i nadmierna fragmentacja DNA molekularne defekty białek strukturalnych i enzymatycznych plemników opłaszczenie główek plemników przeciwciałami przeciwplemnikowymi niektóre leki np. blokery kanału wapniowego 60
61 4. Zaburzenia seksualne zaburzenia wzwodu prącia z powodu np. zaburzeń krążenia, cukrzycy, zespołu metabolicznego, hipogonadyzmu, depresji, stosowania niektórych leków np. antyandrogenów, β-blokerów zaburzenia wytrysku brak wytrysku np. zapalenie w układzie płciowym, zaburzenia neurologiczne wytrysk wsteczny np. zaburzenia neurologiczne wytrysk przedwczesny np. nerwica, depresja niemożność wprowadzenia członka do pochwy na skutek wad anatomicznych prącia np. skrzywienie prącia, małe prącie zaburzenia popędu płciowego brak popędu płciowego z powodu np. hipogonadyzmu, depresji zaburzenia ukierunkowania popędu płciowego np. autoerotyzm, homoseksualizm aseksualizm Zaburzenia czynności jąder Hipogonadyzm męski Hipogonadyzm pierwotny (łac. hypogonadismus hypergonadotropicus, syn. hipergonadotropowy) Jest to brak czynności hormonalnej i plemnikotwórczej jąder spowodowany ich obustronnym uszkodzeniem. Czynność podwzgórza i przysadki nie jest zaburzona. Brak steroidów płciowych jest przyczyną nadmiernego wydzielania gonadotropin do krwi (hipergonadotropizmu). Hipogonadyzm pierwotny może być: całkowity - niedoczynność kanalików plemnikotwórczych i komórek Leydiga, która łączy się z nadmiernym wydzielaniem FSH i LH częściowy - wygaśnięcie czynności komórek Leydiga przebiegające z nadmiernym wydzielaniem LH Etiologia wrodzony brak jąder (łac. agenesia testes), przyczyną może być skręt powrózka nasiennego lub zaburzenia rozwoju naczyń krwionośnych jądra w życiu płodowym, zaburzenia chromosomalne, przy których hipogonadyzm pierwotny występuje łącznie z nieprawidłowościami w innych układach ustroju (np. zespół Klinefeltera), nabyty zanik jąder (łac. atrophia testes) występuje jako następstwo urazu, zapalenia jader, skrętu powrózka nasiennego, a także bywa powikłaniem operacyjnego sprowadzenia jąder do moszny lub operacji przepukliny pachwinowej, kastracja najczęściej z powodu nowotworu jądra, starzenie się męskiego układu płciowego jest niekiedy przyczyną pogorszenia czynności hormonalnej i plemnikotwórczej gonady męskiej i rozwoju późno występującego hipogonadyzmu (LOH ang. late-onset hypogonadism), agenezja lub hipoplazja komórek Leydiga, mogą być uwarunkowane genetycznie 61
62 Zespół Klinefeltera Zespół Klinefeltera (ZK) charakteryzuje się obecnością jednego (80% przypadków) lub więcej dodatkowych chromosomów X w kariotypie z chromosomem Y. ZK występuje z częstością 0,1-0,2% wśród noworodków płci męskiej i 3,1% wśród niepłodnych mężczyzn. Przed okresem dojrzewania płciowego nieprawidłowości nie ujawniają się lub ujawniają bardzo dyskretnie (np. nadmierna długość kończyn dolnych). Chłopcy z ZK mogą prezentować opóźniony rozwój mowy (ok. 40% przypadków) i upośledzony rozwój motoryczny. Rozwój płciowy jest zwykle prawidłowy, stwierdza się jednak większą częstość występowania wnętrostwa (ok. 30% przypadków) i mniejszych wymiarów prącia wielkości prącia (ok. 15% przypadków). Tempo wzrostu bywa wyraźnie przyspieszone już w wieku 3 lat, co może prowadzić do znacznie wyższego wzrostu niż oczekiwany w wieku 5 6 lat i późniejszym (ok. 30% przypadków). Początkowo czynność układu podwzgórze-przysadka-jądra jest prawidłowa, dlatego dojrzewanie płciowe zwykle nie jest opóźnione. Po jego rozpoczęciu w jądrach gwałtownie przyspiesza proces degeneracji nabłonka plemnikotwórczego (komórek płciowych i komórek Sertolego), który zaczyna się prawdopodobnie już w okresie płodowym. Komórki Leydiga nadmiernie proliferują i wykazują stopniowe pogorszenie czynności wydzielniczej. W środkowym okresie dojrzewania płciowego rozwija się hipogonadyzm hipergonadotropowy. Gwałtownie zwiększa się stężenie gonadotropin we krwi (>95% przypadków), a stężenie testosteronu jest poniżej (ok. 70% przypadków) lub w dolnych granicach wartości typowych dla zdrowych rówieśników. Niski poziom testosteronu może powodować słaby postęp dojrzewania płciowego i ostatecznie niepełny rozwój wtórnych męskich cech płciowych. Objętość jąder zwiększa się w nieznacznym stopniu i pozostaje ostatecznie mała (2-6 ml) (>95% przypadków). U ponad połowy pacjentów rozwija się różnego stopnia ginekomastia, a ryzyko rozwoju raka sutka jest ok. 50 razy większe niż w ogólnej populacji mężczyzn. Dorośli mężczyźni z ZK w ok. 70% przypadków zgłaszają obniżony popęd płciowy i zaburzenia erekcji. Większość pacjentów jest niepłodnych (>95% przypadków) z powodu całkowitego braku plemników w nasieniu (azoospermia). Jedynie ok. 8-10% mężczyzn ma pojedyncze plemniki w nasieniu, są to zazwyczaj pacjenci <30 roku życia z kariotypem mozaikowym. Dorośli z ZK mają 5-krotnie wyższe ryzyko rozwinięcia zespołu metabolicznego w porównaniu ze zdrową populacją. Stwierdzono także wyższą częstość występowania chorób sercowo-naczyniowych, niedokrwistości, nowotworów śródpiersia pochodzenia zarodkowego, niedoczynności tarczycy, chorób płuc, żołądkowo-jelitowych, reumatycznych, skórnych i naczyniowych oraz autoimmunologicznych. Ryzyko wczesnego zgonu jest wyższe niż w populacji ogólnej. Ponadto pacjenci z ZK mają trudności w identyfikacji i werbalizacji emocji, częsty jest znaczny deficyt funkcji ekspresywnej języka, zaburzenia koncentracji, zaburzenia emocjonalne, a ponadto upośledzone są funkcje psychospołeczne, behawioralne i poznawcze. Diagnozowane są zwykle przypadki o wyraźnym obrazie klinicznym. Pacjenci z kariotypem mozaikowym zwykle prezentują mniej objawów klinicznych, np. mogą występować tylko zaburzenia płodności. Rozpoznanie i leczenie już w okresie przeddojrzewaniowym może znacząco polepszyć jakość życia pacjentów i zapobiec rozwojowi chorób towarzyszących. Opieka nad pacjentem z ZK powinna być organizowana stosownie do wieku i rodzaju zaburzeń stwierdzanych u pacjenta pacjenta. Przed w zespole wielodyscyplinarnym, w którym w zależności od potrzeby powinni się znaleźć lekarze pediatrzy, endokrynolodzy i urolodzy dziecięcy, endokrynolodzy/androlodzy dla dorosłych, specjaliści zajmujący się niepłodnością, genetycy kliniczni, logopedzi, fizjoterapeuci, psycholodzy i pedagodzy. 62
63 U pacjentów mogą występować takie zaburzenia, które wymagają leczenia, jak wnętrostwo, ginekomastia, osteoporoza, zespół metaboliczny, hipogonadyzm (patrz opisy postępowania w rozdziałach poświęconych poszczególnym zaburzeniom). U pacjentów z ZK wprowadza się substytucję preparatami testosteronu zwykle w okresie dojrzewania płciowego lub dojrzałości, gdy zostaną stwierdzone jego niskie poziomy w surowicy krwi i występują objawy kliniczne hipogonadyzmu. W niektórych przypadkach zaleca się podanie testosteronu już we wczesnym okresie dojrzewania płciowego (stadium GII lub GIII według skali Tannera), jeśli pacjent jest wysokiego wzrostu i pojawia się eunuchoidalna budowa ciała. Substytucja testosteronu koryguje objawy deficytu androgenów, ale nie wpływa na poprawę płodności. Pacjenci z ZK wytwarzający w jądrach plemniki mają szansę na ojcostwo dzięki technikom rozrodu wspomaganego (ART, ang. assisted reproductive technology), przede wszystkim dzięki technice wstrzyknięcia plemnika lub dojrzałej spermatydy do cytoplazmy komórki jajowej (ICSI, ang. intracytoplsmic sperm injection). Młodzi mężczyźni <30 roku życia mają większą szansę na uzyskanie plemników. Z tego powodu proponuje się zamrażanie nasienia zanim dojdzie do całkowitej degeneracji nabłonka plemnikotwórczego i zanim rozpocznie się substytucję testosteronem. Proponuje się również pobranie bioptatu z jądra i poszukiwanie spermatyd, a następnie ich zamrożenie do wykorzystania w przyszłości w procedurze ICSI. Pacjenci, a w przypadku młodzieży także rodzice, powinni być poinformowani o takich możliwościach. Większość potomstwa mężczyzn z ZK ma prawidłowy kariotyp, ale ryzyko dziedziczenia aberracji chromosomalnych jest u nich wyższe niż w populacji. Z tego powodu powinno się omówić ryzyko potecjalych zaburzeń genetycznych u potomstwa chorego z ZK. Pacjenci z ZK często potrzebują fizjoterapii, terapii mowy oraz dodatkowej pomocy edukacyjnej, a także wymagają wsparcia psychologicznego na każdym etapie życia. Hipogonadyzm wtórny (łac. hypogonadismus hypogonadotropicus, syn. hipogonadotropowy) Jest to zaburzenie czynności jąder spowodowane brakiem wydzielania gonadotropin przez przysadkę lub GnRH przez podwzgórze. Etiologia Wrodzona niedoczynność podwzgórza lub przysadki może być spowodowana: zaburzeniami chromosomalnymi np. zespół Kallmanna (brak węchu i neuronów GnRH w podwzgórzu), z. Laurence-Moon-Bardet-Biedla, z. Pradera-Labharta-Willego (uszkodzenie ośrodków pnia mózgu i zaburzenia regulacji lipogenezy), z. Pasqualiniego (izolowany niedobór LH) Zespół Kallmanna jest częstą przyczyną hipogonadyzmu wtórnego z powodu niedoboru GnRH. Na ramieniu krótkim chromosomu X znajduje się gen zwany KAL1. Białkowy produkt tego genu niezbędny jest w czasie życia płodowego do wzrostu aksonów i migracji prekursorów neuronów GnRH z węchomózgowia do podwzgórza. Delecja lub mutacje w genie KAL1 prowadzą do braku powonienia (anosmia), i braku wydzielania GnRH (hipogonadyzm wtórny), który manifestuje się opóźnieniem dojrzewania. Oprócz anosmii i hipogonadyzmu chorzy niekiedy mają dodatkowe zaburzenia jak: zaburzenia słuchu (5-10%), rozszczep wargi lub podniebienie łukowate. Zespół Pradera-Labharta-Willego spowodowany jest zaburzeniami genomowego piętnowania rodzicielskiego (ang. imprinting) w obrębie chromosomu 15. Najczęściej obserwuje się delecję ojcowskiej kopii regionu chromosomu 15q Chorzy od urodzenia maja hipotonię mięśni z opóźnionym rozwojem ruchowym, hiperfagię i otyłość, hipopigmentację skóry, opóźnienie umysłowe. Zewnętrzne narządy płciowe są hipoplastyczne, a u chłopców często występuje wnętrostwo. Dojrzewanie płciowe jest opóźnione. 63
64 nieznanymi przyczynami, jak np. w karłowatości przysadkowej, gdzie niedoborowi gonadotropin towarzyszy niedobór innych hormonów wydzielanych przez przysadkę, Nabyta niedoczynność podwzgórza lub przysadki może być spowodowana nowotworami, zapaleniem, uszkodzeniem toksycznym, niedokrwieniem, krwotokiem, radio- i chemioterapią, niedożywieniem (jadłowstręt psychiczny, łac. anorexia nervosa), nadużywaniem narkotyków lub ciężkimi chorobami ogólnoustrojowymi np.cukrzyca, gruźlica. Objawy kliniczne hipogonadyzmu męskiego zależą od okresu życia, w którym zaistniała przyczyna zaburzenia: w okresie płodowym, dominują objawy niezróżnicowania narządów płciowych, mają cechy zbliżone do fenotypu kobiecego, występuje wnętrostwo; po urodzeniu pierwszym zauważalnym objawem klinicznym jest opóźnienie dojrzewania płciowego, rozwój eunuchoidalnej budowy ciała, brak popędu płciowego, anemia, osteoporoza. Eunuchoidyzm charakteryzuje się wysokim wzrostem i nieprawidłowymi proporcjami ciała tj. długimi kończynami przy względnie krótkim tułowiu. Może pojawić się charakterystyczny dla kobiet rozkład tkanki tłuszczowej w okolicy pasa biodrowego i w okolicy gruczołów piersiowych (budowa ginekoidalna u mężczyzn). Nie występuje mutacja głosu, nie pojawia się owłosienie na twarzy. Owłosienie łonowe i pachowe może rozwinąć się na skutek działania androgenów pochodzących z kory nadnerczy. Zewnętrzne narządy płciowe są słabo rozwinięte. Objętość jąder jest mała, zwykle nie przekracza 6 ml. W nabłonku plemnikotwórczym znajdują się jedynie pierwotne komórki plemnikotwórcze (spermatogonie) lub tylko same komórki Sertolego. po okresie dojrzewania płciowego: zanik/obniżenie popędu płciowego, niepłodność (brak lub obniżona liczba plemników w nasieniu). Może wystąpić zmniejszenie owłosienia łonowego i pachowego, osłabienie siły mięśniowej, zaburzenia psychiczne (zwykle depresja), osłabienie, anemia, osteoporoza. Diagnostyka hipogonadyzmu męskiego Wywiad powinien uwzględniać: choroby i urazy centralnego układu nerwowego, choroby i urazy narządów moczowo-płciowych, ciężkie choroby ogólnoustrojowe, przyjmowane leki, przebieg dojrzewania płciowego, przebieg ciąży i leków stosowanych w tym czasie u matki, pracę wykonywaną przez chorego i narażenie na szkodliwe czynniki, wywiad rodzinny, który może nasunąć podejrzenie zaburzeń genetycznych. Badanie przedmiotowe powinno uwzględniać: badanie internistyczne, w którym należy zwrócić szczególną uwagę na sylwetkę ciała, rozkład tkanki tłuszczowej, rozwój masy mięśniowej, stan gruczołów piersiowych, stopień rozwoju płciowego (owłosienie łonowe i pachowe, owłosienie na twarzy, wielkość narządów płciowych, mutacja głosu), konsystencję i wielkość jąder i obecność węchu, elementy badania neurologicznego (np. badanie pola widzenia). 64
65 Badanie nasienia pozwala na ocenę czynności plemnikotwórczej jądra. Ultrasonografia jąder - umożliwia ocenę położenia, objętości, struktury jąder. Badania hormonalne: FSH, LH inhibina B testosteron całkowity (tzw. kastracyjny poziom testosteronu, typowy dla braku czynności hormonalnej jąder wynosi poniżej 4,5 nmol/l (1,3 ng/ml)) estradiol prolaktyna hormony tarczycy i TSH hormonalne testy dynamiczne (patrz rozdz ). Badanie tomograficzne lub rezonans magnetyczny głowy umożliwiają ocenę układu podwzgórzowoprzysadkowego. Densytometria kości Badania laboratoryjne - wykonywane raz w roku podczas terapii preparatami testosteronu: morfologia krwi biochemiczne wskaźniki czynności wątroby ASPAT, ALAT, bilirubina biochemiczne wskaźniki czynności nerek mocznik, kreatynina lipidogram PSA (norma < 4,0 ng/ml) SHBG Leczenie hipogonadyzmu męskiego W hipogonadyzmie pierwotnym substytucyjnie podawane są preparaty androgenów. Leczenie takie wywołuje rozwój i podtrzymuje drugo- i trzeciorzędowe cechy płciowe męskie. Parametrem pomyślnego wyniku leczenia jest zwiększenie stężenia testosteronu we krwi i poprawa stanu klinicznego chorego. Równolegle do pojawienia się somatycznych objawów dojrzewania płciowego dochodzi do wzrostu popędu płciowego, zwiększenia częstości wzwodów i wytrysków nasienia. Substytucja androgenowa zapewnia również normalizację metabolizmu ustroju tj. wywołuje efekty anaboliczne. Poprawia się stan psychiczny chorego. Przeciwwskazaniem do stosowania terapii androgenowej jest rak prostaty, rak sutka, ciężkie napady bezdechu nocnego, policytemia (hematokryt >54%), ciężkie objawy ze strony dolnych dróg moczowych spowodowane łagodnym rozrostem gruczołu krokowego i ciężka przewlekła niewydolność serca/ NYHA IV (ang. New York Heart Association Class IV). Przed rozpoczęciem terapii testosteronem należy wykonać ocenę hematologiczną, układu krążenia, piersi i gruczołu krokowego. W czasie podawania testosteronu należy monitorować hematokryt i stężenie hemoglobiny oraz PSA we krwi, a także stan gruczołu krokowego i układu krążenia. 65
66 W hipogonadyzmie wtórnym leczenie polega na substytucyjnym podawaniu preparatów gonadotropin i/lub androgenów. Stosowane są tu następujące preparaty gonadotropin: hcg - preparat wykazujący aktywność biologiczną LH, uzyskiwany z moczu kobiet ciężarnych. hmg - preparat wykazujący aktywność biologiczną LH i FSH w stosunku 1: 1, uzyskiwany z moczu kobiet po przekwitaniu. Dzięki krótkiemu okresowi półtrwania w krążeniu LH zawarte w hmg nie wywołuje efektów klinicznych. Jest to, więc głównie preparat o działaniu FSH. rekombinowany FSH uzyskiwany metodami inżynierii genetycznej. syntetyczne GnRH podawane za pomocą specjalnej pompy, naśladującej naturalne pulsy wydzielnicze GnRH. Zaburzenia czynności kanalików plemnikotwórczych jądra Etiologia W przypadkach, gdy nie jest znana przyczyna uszkodzenia czynności kanalików plemnikotwórczych, rozpoznaje się idiopatyczne uszkodzenie czynności plemnikotwórczej jądra. W niektórych jednak przypadkach można stwierdzić przyczynę uszkodzenia spermatogenezy. Mogą to być: zaburzenia genetyczne: zespół Klinefeltera, kariotyp 46,XX (zespół XX male), hipogonadyzm hipogonadotropowy, wnętrostwo, CIS lub nowotwór jądra, wpływ toksycznych czynników środowiskowych. Objawy kliniczne Głównym objawem jest niepłodność, a w nasienia stwierdza się azoo- lub oligozoospermię. Czynność gruczołu śródmiąższowego jest prawidłowa, podobnie jak poziom testosteronu we krwi. Podwyższone stężenie FSH przy prawidłowych poziomach LH i testosteronu, sugeruje uszkodzenie kanalików plemnikotwórczych. Dodatkowo obniżenia poziomu inhibiny B we krwi potwierdza uszkodzenie nabłonka plemnikotwórczego. Diagnostyka Patrz diagnostyka andrologiczna (rozdz. 2.5). Podstawowym kryterium rozpoznania jest wynik biopsji jądra. W obrazie mikroskopowym można stwierdzić w tych przypadkach: brak komórek rozrodczych z obecnością jedynie komórek Sertolego (zespół samych komórek Sertolego, inaczej zespół Del Castillo), zatrzymanie spermatogenezy, zmniejszoną wydajność ilościową spermatogenezy (hipospermatogeneza). Postępowanie lekarskie Uszkodzenie czynności plemnikotwórczej jest zwykle zaburzeniem nieodwracalnym i podawanie leków rzadko przynosi poprawę. 66
67 Niedrożność dróg wyprowadzających plemniki Niedrożność przewodów wyprowadzających jądra, przewodu najądrza lub/i nasieniowodu jest stosunkowo częstą przyczyną męskiej niepłodności. Etiologia wady wrodzone niedrożność sieci jądra, najądrze odsznurowane, agenezja najądrza lub nasieniowodu (patrz roz ), mukowiscydoza, torbiel pośrodkowa prostaty, zmiany pozapalne w sieci jądra, najądrzu, gruczole krokowym, po urazach jąder, najądrzy, powrózków nasiennych. Objawy kliniczne Objawem całkowitej niedrożności przewodów transportujących plemniki jest azoospermia, a niedrożności częściowej oligozoospermia. Postępowanie lekarskie Jeśli przyczyną są zmiany zapalne w układzie moczowo-płciowym, to ich skuteczne leczenie może poprawić drożność przewodów wyprowadzających plemniki. W innych przypadkach podejmuje się próby przywrócenia drożności przewodów z zastosowaniem technik mikrochirurgicznych. Można także pobrać plemniki z jądra/najądrza i wykorzystać je do wspomaganego rozrodu (patrz rozdz. 5) Niepłodność autoimmunologiczna Etiologia Przyczyną tego zaburzenia może być przerwanie bariery krew-jądro lub krew-najądrze. Produkty rozpadu haploidalnych komórek plemnikotwórczych mogą być rozpoznawane jako obce antygenowo i stymulować produkcję przeciwciał przeciwplemnikowych (ASA, ang. anti-sperm antibody). Sytuacja taka może zaistnieć w przypadku: urazu jądra, zapalenia jądra i/lub najądrza, skrętu powrózka nasiennego i długotrwałego niedokrwienia gonady, podwiązania nasieniowodów. Przeciwciała przeciwplemnikowe występują w plazmie nasienia (związane lub nie z plemnikami) oraz w surowicy krwi. W nasieniu występują ASA klasy IgG oraz IgA, które nieruchamiają plemniki, utrudniają przechodzenie plemników do śluzu szyjkowego lub mogą utrudniać reakcję akrosomalną i wiązanie plemnika z osłonką przejrzystą komórki jajowej. ASA stwierdzano w niepłodnych parach u 7-10% mężczyzn i u 2-3% kobiet. Znaczenie kliniczne mają tylko ASA związane z plemnikami. Objawy kliniczne Aglutynacja i asthenozoospermia w badaniu nasienia, a w konsekwencji niepłodność. Diagnostyka W celu wykrycia obecności przeciwciał przeciwplemnikowych w nasieniu stosuje się odpowiednie testy (patrz rozdz ). 67
68 Postępowanie lekarskie Podejmuje się próby leczenia glikokortykoidami i lekami immunosupresyjnymi, ale schematy postępowania lekarskiego nie są tutaj ustalone CHOROBY ZAPALNE MĘSKIEGO UKŁADU PŁCIOWEGO Zapalenie najądrza i jądra (łac. epididymitis, orchitis) Zapalenie jądra i najądrza może doprowadzić do niedrożności przewodów wyprowadzających jądra i najądrza, uszkodzenia struktury gonady lub jej zaniku oraz do powstania przeciwciał przeciwplemnikowych. Czynniki stanu zapalnego zwiększają poziom stersu oksydacyjnego, przez co wpływają stymulująco na fragmenrację chromatyny plemnikowej. Etiologia Najczęstszymi patogenami są drobnoustroje przenoszone drogą płciową, takie jak: Escherichia coli, Streptococcus faecalis, Proteus i Staphylococcus aureus, gonokoki, chlamydia, mykoplazmy oraz wirusy opryszczki przenoszone drogą płciową i grzyby. W nagminnym zapaleniu ślinianek (świnka) często obserwuje się obustronne zapalenie jąder. Najądrza są także miejscem rozwoju gruźlicy pozapłucnej. Objawy kliniczne Ostre zapalenie najądrza i/lub jądra objawia się silnie bolesnym obrzękiem najądrza i/lub jądra, rumieniem skóry moszny, gorączką. Ostre zapalenie najądrza/jądra może przejść w zapalenie przewlekłe. Często nie daje ono subiektywnych dolegliwości, a objawia się zmniejszoną liczbą plemników w nasieniu, zwiększonym odsetkiem plemników nieruchomych lub martwych lub o nieprawidłowej budowie, zwiększoną lepkością nasienia i zwiększoną koncentracją leukocytów, obniżeniem ilości α-glukozydazy obojętnej w plazmie nasienia. Czasem dołączają się zaburzenia seksualne np. brak lub niepełny wzwód, przedwczesny wytrysk nasienia, osłabienie popędu płciowego. Diagnostyka morfologia krwi (leukocytoza), ultrasonografia pozwala na różnicowanie ostrego zapalenia najądrza/jądra od skrętu powrózka nasiennego. ocena koncentracji α-glukozydazy obojętnej w plazmie nasienia. Postępowanie lekarskie Chory z ostrym zapaleniem jądra i/lub najądrza wymaga hospitalizacji i pozajelitowego podawania antybiotyków. Ulgę przynosi wysokie ułożenie jąder. Przy zapaleniu przewlekłym podaje się doustnie antybiotyki (najlepiej terapia celowana lub o szerokim spektrum działania), niesterydowe leki przeciwzapalne, czasem glikokortykoidy. 68
69 Zapalenie stercza i pęcherzyków nasiennych (łac. prostatitis, vesiculitis) Etiologia - u mężczyzn przed 40 r.ż. patogenami są głównie drobnoustroje przenoszone drogą płciową, a po 40 r.ż.: Escherichia coli, rzadziej Proteus, Klebsiella, Enterobacter, Pseudomonas, Streptococcus faecalis, Staphylococcus aureus, Ureaplasma urealyticum. Objawy kliniczne Zapalenie gruczołów dodatkowych męskiego układu płciowego może doprowadzić do zaburzeń w składzie plazmy nasienia i w konsekwencji do pogorszenia ruchliwości plemników. Ostre zapalenie pęcherzyków nasiennych często przebiega z ostrym zapaleniem gruczołu krokowego i powoduje bóle w kroczu, okolicy krzyżowej, częste i bolesne oddawanie moczu, ropomocz, leukocyto- i hamatospermię (obecność krwinek białych i czerwonych w nasieniu). Ostre zapalenie gruczołów dodatkowych może przejść w zapalenie przewlekłe, które nie daje objawów klinicznych poza, często niespecyficznymi, zmianami w nasieniu. ph nasienia przesunięte w stronę zasadową wskazuje na zaburzenie czynności gruczołu krokowego, a w kwaśną, pęcherzyków nasiennych. Diagnostyka i postępowanie lekarskie wywiad, morfologia krwi, badanie ogólne moczu, posiew moczu, antybiogram, badanie nasienia, posiew nasienia, antybiogram, ocena koncentracji markerów specyficznych dla gruczołów dodatkowych w plazmie nasienia (kwas cytrynowy, cynk, fruktoza) badanie palpacyjne per rectum, ultrasonografia transrektalna (TRUS, ang. transrectal ultrasonography) Leczenie polega na długotrwałym (do 6 tyg.) podawaniu leków przeciwbakteryjnych, zgodnie z posiewem i antybiogramem i leków przeciwzapalnych Łagodny przerost gruczołu krokowego (BPH, ang. benign prostatic hyperplasia) Etiologia Wykazano, że obecność metabolitów testosteronu, DHT i estradiolu jest związana z rozwojem BPH. DHT wiąże się ze specyficznymi receptorami w komórkach gruczołu krokowego (mięśnie gładkie, tkanka łączna, nabłonek gruczołowy) i pobudza je do proliferacji. Estrogeny, których stężenie w gruczole krokowym wzrasta wraz z wiekiem, zwiększają liczbę receptorów dla DHT. Zaburzenie stosunku stężeń steroidów płciowych i zmiany w liczbie ich receptorów są prawdopodobnie przyczyną powstania i rozwoju BPH. Łagodny rozrost gruczołu krokowego nie występuje u hipogonadyków. 69
70 Objawy kliniczne Choroba występuje u mężczyzn już po 50-tym roku życia. Objawy kliniczne wynikają z utrudnionego opróżniania i podrażnienia pęcherza moczowego. Najczęściej występują: częstomocz, parcia naglące, nietrzymanie moczu z parcia, oddawanie moczu w nocy (nokturia), oddawanie moczu kroplami, zatrzymanie moczu. Stężenie PSA we krwi chorych z BPH jest zwykle prawidłowe, ale zależy od wielkości gruczolaka. Diagnostyka BPH należy różnicować z zapaleniem i rakiem gruczołu krokowego (patrz diagnostyka przy zapaleniu gruczołów dodatkowych męskiego układu płciowego). Postępowanie lekarskie W leczeniu farmakologicznym stosuje się inhibitory 5 -reduktazy w celu zmniejszenia wpływu androgenów na gruczoł krokowy oraz -blokery, które zmniejszają napięcie mięśni gładkich stercza i ułatwiają oddawanie moczu. W leczeniu chirurgicznym wykonuje się usunięcie gruczolaka drogą przezbrzuszną lub elektroresekcję przezcewkową NOWOTWORY MĘSKIEGO UKŁADU PŁCIOWEGO Nowotwory jąder Nowotwory jąder wywodzące się z płodowych komórek płciowych (GCT ang. germ cell tumours) Nowotwory te, zwane również zarodkowymi, stanowią 0,5-1% wszystkich nowotworów występujących u mężczyzn i 4-5% nowotworów męskich narządów płciowych. Częstość występowania nowotworów złośliwych jądra w europejskiej populacji mężczyzn wynosi 0,9-11,8/ /rok. GCT wywodzą się z pierwotnych, płodowych komórek płciowych - gonocytów. Stanowią ok. 95% wszystkich nowotworów jąder i wszystkie uważane są za złośliwe. Należą do nich nowotwory takie jak: nasieniaki (seminoma), które stanowią ok. 48% nowotworów pochodzenia zarodkowego. W wieku poniżej 20 lat stanowią ok. 6% nowotworów wywodzących się z komórek płciowych, w wieku między 20 a 40 lat - 51%, a powyżej 40 lat - 80%. nowotwory nienasieniakowate stanowią ok. 52% nowotworów pochodzenia zarodkowego. W wieku poniżej 20 lat stanowią 61% wszystkich nowotworów wywodzących się z komórek plemnikotwórczych, w wieku lat - 24%, a powyżej 40 lat - 15%. Wśród nowotworów zarodkowych nienasieniakowatych wyróżnia się: raki zarodkowe (carcinoma embryonale) utworzone z prymitywnych, polimorficznych komórek, które tworzą lite pasma lub układy łukowate, brodawczakowate, gruczołowate, produkują alfafetoproteinę (AFP). kosmówczaki (choriocarcinoma) produkują ludzką gonadotropinę łożyskową (hcg), ludzki łożyskowy laktogen (HPL) i ciążowo specyficzną ß 1-glikoproteinę (SP 1). potworniaki (teratoma), utworzone z tkanek dojrzałych i płodowych pochodzących z jednego lub wszystkich elementów zarodka, tj. ektodermy, entodermy, mezodermy. 70
71 Do grupy ryzyka rozwoju raka jądra zalicza się mężczyzn z: zaburzeniami zstępowania jąder, rakiem jednego jądra, zaburzeniami różnicowania płciowego przy obecności chromosomu Y w kariotypie (DSD), brakiem wrażliwości na androgeny, zespołem Klinefeltera, wrodzonymi zaburzeniami biosyntezy testosteronu, zaburzeniami czynności kanalików plemnikotwórczych (objawiające się oligo- lub azoospermią). Objawy kliniczne Pierwsze objawy kliniczne GCT to zwykle niebolesne powiększenie, stwardnienie lub nierówność powierzchni jądra. Niekiedy pierwszymi objawami są ból i rozpieranie moszny sugerujące zapalenie jądra. Zdarza się, że chory zgłasza się do lekarza z powodu klinicznych objawów przerzutów np. ból w okolicy lędźwiowej, wodonercze z objawami kolki nerkowej, kaszel, duszność, powiększenie węzłów chłonnych nadobojczykowych. Większość chorych ma złe jakościowo i ilościowo parametry nasienia w chwili rozpoznania. Przebieg choroby jest dość gwałtowny. Stosunkowo szybko powstają przerzuty do regionalnych węzłów chłonnych (zaotrzewnowych), a drogą krwionośną do płuc. Zmienione nowotworowo zaotrzewnowe węzły chłonne mogą uciskać na moczowód powodując zastój moczu u układzie kielichowo-miedniczkowym nerki lub na naczynia żylne powodując obrzęki kończyn dolnych. Diagnostyka Wywiad powinien uwzględnić objawy podmiotowe, ale także przebyte choroby układu moczowo-płciowego i choroby nowotworowe występujące w rodzinie. Badanie przedmiotowe z badaniem palpacyjnym jąder oraz węzłów chłonnych Badania laboratoryjne: morfologia, elektrolity, badania biochemiczne nerek, badanie stężenia markerów nowotworowych we krwi: AFP (alfa-fetoproteina, norma < 6 ng/ml), wydzielana przez nienasieniaki -hcg (ludzka gonadotropina kosmówkowa, norma < 5 U/l), wydzielana przez nienasieniaki i niewielki odsetek nasieniaków; NSE (neuroenolaza), marker nasieniaków; LDH (dehydrogenaza mleczanowa), jest znacznikiem rozpadu komórkowego. Badanie ultrasonograficzne jąder i jamy brzusznej. Tomografia komputerowa jamy brzusznej i klatki piersiowej. Badanie nasienia, gdy chory chce zdeponować swoje nasienie w banku nasienia Postępowanie lekarskie Standardowym leczeniem raków jądra typu zarodkowego jest usunięcie chirurgiczne gonady. Uzupełniające zastosowanie chemio-, radioterapii czy limfadenektomii zaotrzewnowej jest uzależnione od 71
72 stopnia zaawansowania klinicznego choroby nowotworowej. Wszyscy chorzy przed podjęciem leczenia powinni być poinformowani o wpływie leczenia na płodność oraz o możliwości zdeponowania nasienia w banku nasienia. Carcinoma in situ kanalików plemnikotwórczych (CIS, GCNIS, ang. germ cell neoplasia in situ) Jest to stan przedrakowy jądra tzw. wewnątrzkanalikowy nowotwór jądra z komórek płciowych. Charakteryzuje się obecnością w nabłonku plemnikotwórczym komórek wykazujących cechy morfologiczne i biochemiczne typowe dla płodowych komórek płciowych - gonocytów. Uważa się, że komórki CIS są prekursorami nowotworów jądra wywodzących się z płodowych komórek płciowych (GCT), oprócz nasieniaka spermatocytarnego. Etiologia Postuluje się, że komórki CIS są gonocytami, które uległy nowotworowej transformacji jeszcze w okresie płodowym i przetrwały zamiast ulec przemianie w spermatogonie. GCT rozwijają się dopiero po okresie dojrzewania płciowego i przypuszcza się, że przemianie CIS w GCT sprzyjają wysokie stężenia steroidów płciowych i gonadotropin. Objawy kliniczne CIS nie daje objawów klinicznych. Czasem można jednak stwierdzić zmniejszenie objętości jądra i zmianę jego konsystencji. Jest to spowodowane degeneracją nabłonka plemnikotwórczego oraz szkliwieniem kanalików plemnikotwórczych. U ok. 70% chorych obserwuje się oligozoospermię znacznego stopnia. Poziomy markerów nowotworowych we krwi są prawidłowe. Zagrożenie rozwojem inwazyjnego raka w przypadkach nieleczonego CIS wynosi 50% w ciągu 5 lat. Diagnostyka Kliniczna ocena jąder - badanie objętości i konsystencji jąder oraz badanie nasienia powtarzane w krótkich odstępach czasu np. co 6 miesięcy, może być pomocne dla wczesnego wykrycia zmian w gonadach osób należących do grup ryzyka. Biopsja chirurgiczna jądra jest najbardziej polecaną metodą wykrywania CIS. Oprócz rutynowej oceny histologicznej tkanki jądra wykonuje się barwienia immunohistochemiczne przeciwko antygenom płodowym obecnym w patologicznych komórkach. Najczęściej stosuje się przeciwciała przeciwko fosfatazie alkalicznej typu łożyskowego (PLAP ang. placental like alkaline phosphatase). Jest to enzym obecny w cytoplazmie gonocytów płodowych, ale także w cytoplazmie komórek CIS i nasieniaka. U chorych ze stwierdzonym guzem jądra nie wykonuje się biopsji, ale usuwa całe jądro z guzem. Ultrasonografia jąder może być metodą wstępnej kwalifikacji do biopsji. Charakterystyczne jest w niektórych przypadkach występowanie w jądrach rozsianych mikrozwapnień (obraz zamieci śnieżnej). Postępowanie lekarskie Radioterapia powoduje zniszczenie komórek CIS wraz z komórkami plemnikotwórczymi. Czynność komórek Leydiga zostaje zachowana lub nieznacznie obniżona. Radioterapia to najskuteczniejsza i mająca najmniej działań ubocznych metoda leczenia CIS. Usunięcie jądra 72
73 Chemioterapia okazała się nieskuteczna w wielu przypadkach CIS, a ponadto wykazuje szereg niekorzystnych działań ubocznych. Gonadoblastoma Jest to nowotwór wywodzący się ze sznurów płciowych (pierwotnych kanalików plemnikotwórczych). W guzie obecne są płodowe komórki płciowe (gonocyty) i somatyczne komórki sznurów płciowych. Gonadoblastoma tworzy najczęściej dobrze ograniczone gniazda, w których często znajdują się ogniska zwapnienia i zeszkliwienia. Biologia i historia naturalna tego nowotworu nie są dokładnie poznane. Nie wiadomo, bowiem, dlaczego część z nich ulega zmianom wstecznym (zwapnienie, zeszkliwienie), a ok. 50% ulega przemianie w GCT. Za tym ostatnim przemawia obecność dużej liczby gonocytów o aneuploidalnej zawartości DNA w jądrach komórkowych. Gonadoblastoma występuje najczęściej w gonadach z zaburzeniami różnicowania płciowego. W kariotypie obecny jest zawsze chromosom Y. Nowotwór ten występuje także w jądrach niezstąpionych, położonych w jamie brzusznej. Diagnostyka i postępowanie lekarskie U dzieci z obojnaczymi narządami płciowymi wskazane jest obustronne usunięcie gonad. U chorych z małym nasileniem zaburzeń różnicowania płciowego wykonuje się tylko biopsję diagnostyczną. Pozostawienie gonad wymaga ich częstej kontroli lekarskiej. Nowotwór jąder wywodzący się z komórek Leydiga (leydigioma) Guzy te stanowią 1-3% wszystkich nowotworów jąder. Zwykle mają niewielkie rozmiary (1-2,5 cm średnicy) i występują jednostronnie (w 5-10% przypadków obustronnie). Duże guzy (ok. 5 cm średnicy), z wysokim indeksem mitotycznym i dużą atypią komórkową mogą być złośliwe (ok. 10% przypadków). Guzy z komórek Leydiga są aktywne hormonalnie i wydzielają duże ilości testosteronu, a niekiedy estrogenów. Leydigioma występują głównie w trzech grupach wiekowych: przeddojrzewaniowej (5-9 lat), dorosłych mężczyzn (30-35 lat) i starszych mężczyzn (ok. 60 lat). Objawy kliniczne U dzieci występuje najczęściej przedwczesne dojrzewanie płciowe (zwykle przyspieszony wzrost długości ciała, powiększenie zewnętrznych narządów płciowych, pojawienie się owłosienia łonowego) oraz powiększenie i wzmożona konsystencja zwykle jednego jądra. U dorosłych oprócz wzmożenia konsystencji, niebolesnego powiększenia jądra obserwuje się ginekomastię, oligozoospermię, obniżone libido oraz rzadziej atrofię drugiego jądra. Diagnostyka badania hormonalne - zwykle stwierdza się podwyższenie stężenia testosteronu, estradiolu, przy niskim stężeniu gonadotropin we krwi i podwyższenie poziomu 17-ketosteroidów w moczu. W teście z hcg obserwuje się nadmierne wydzielanie estradiolu, niewspółmierne do wydzielania testosteronu; ultrasonografia jąder; konieczne jest różnicowanie z GCT (patrz postępowanie diagnostyczne w nowotworach wywodzących się z komórek płciowych). Postępowanie lekarskie 73
74 W przypadku małych, ograniczonych leydigioma usuwa się chirurgicznie tylko sam guz (potwierdzając rozpoznanie doraźnym badaniem histopatologicznym). Rozplem komórek Leydiga w całej gonadzie lub duże guzy są wskazaniem do usunięcia jądra. Kliniczne objawy hormonalnej czynności leydigioma cofają się zwykle w ciągu roku od operacji. Mimo to wskazana jest obserwacja pacjenta wraz z okresową kontrolą poziomu testosteronu i estradiolu we krwi przynajmniej przez 5 następnych lat. W rzadkich przypadkach obserwuje się wzrost leydigioma w drugim jądrze. Nowotwór jąder wywodzący się z komórek Sertolego (łac. sertolioma) Jest to patologiczny rozplem komórek Sertolego ograniczony zwykle do kanalików plemnikotwórczych. Są to najczęściej nowotwory łagodne. Występują przeważnie w pierwszych 20 latach życia. Mogą występować rodzinnie. Objawy kliniczne Większość chorych nie ma żadnych objawów lub są one ograniczone do gonady (powiększenie, stwardnienie, nierówność powierzchni). Mogą dotyczyć jednego lub obu jąder. U części chorych występują objawy endokrynologiczne w postaci przedwczesnego dojrzewania płciowego, ginekomastii, podwyższonych poziomów testosteronu i estradiolu w surowicy krwi oraz 17-ketosteroidów w moczu. Nowotworom tym może towarzyszyć nadczynność innych gruczołów wydzielania wewnętrznego, a także śluzak serca i zaburzenia pigmentacji skóry. W przypadku złośliwego typu sertolioma, przerzuty są obserwowane niezwykle rzadko. Diagnostyka i postępowanie lekarskie Po wstępnej diagnostyce (patrz diagnostyka GCT), chirurgicznie usuwa się jądro. Inne nowotwory jądra Chłoniaki złośliwe (łac. lymphoma) stanowią 1-8% wszystkich nowotworów jąder. Jako nowotwory pierwotne występują najczęściej u starszych mężczyzn. Jądra są najczęstszym wtórnym umiejscowieniem chłoniaków w każdej grupie wiekowej. Główne objawy kliniczne to powiększenie jądra, które narasta stopniowo oraz objawy ogólne choroby. Ogniska białaczkowe (leucaemia) w jądrach występują najczęściej w okresie przeddojrzewaniowym. Objawy kliniczne to zwykle niebolesne powiększenie jądra. Rakowiak (łac. carcinoid) zbudowany jest z komórek zwanych komórkami Kultschitsky'ego, które w warunkach prawidłowych znajdują się w nabłonku przewodu pokarmowego i oskrzeli. Komórki rakowiaka wydzielają kininy i prostaglandyny. Objawy kliniczne rakowiaka dotyczą zwykle samej gonady (powiększenie, bolesność, wzmożona konsystencja jądra), ale w 6% przypadków obserwuje się objawy ogólne w postaci napadowego czerwienienia skóry, bólów brzucha, biegunki, rzadziej stanów skurczowych oskrzeli. Nieoperowany rakowiak szybko daje przerzuty. Nowotwory przerzutowe występują w jądrze w przebiegu raka gruczołu krokowego, jelita grubego, nerki i układu współczulnego. 74
75 Rak gruczołu krokowego Etiologia Czynnikiem promującym rozwój raka gruczołu krokowego mogą być zaburzone proporcje stężeń hormonów płciowych oraz przewlekłe zapalenie. Choroba ta nie rozwija się u hipogonadyków. Objawy kliniczne U mężczyzn po 65 roku życia wzrasta częstość występowania raka gruczołu krokowego, najczęściej adenocarcinoma. W części przypadków obserwuje się objawy kliniczne podobne jak w BPH (patrz roz ). Większość pacjentów nie wykazuje jednak żadnych objawów choroby nowotworowej, a raka prostaty stwierdza się dopiero po śmierci z innej przyczyny, podczas autopsji. Pierwsze objawy mogą też być spowodowane przerzutami, najczęściej do kości. U chorych z rakiem gruczołu krokowego stwierdza się wzrost stężenia PSA. Diagnostyka Badanie per rectum wraz z oznaczeniem stężenia PSA w surowicy krwi oraz biopsja stercza pod kontrolą USG. Postępowanie lekarskie Wybór sposobu leczenia zależy od stopnia złośliwości histologicznej nowotworu, stadium zaawansowania, wieku i ogólnego stanu zdrowia chorego. Stosuje się: prostatektomię radykalną (chirurgiczne usunięcie całego gruczołu krokowego) wraz z pęcherzykami nasiennymi i regionalnymi węzłami chłonnymi, tele- i brachyterapię, kastrację chirurgiczną lub farmakologiczną (podawanie antyandrogenów i agonistów/antagonistów GnRH) ZABURZENIA MĘSKICH REAKCJI PŁCIOWYCH Zaburzenie ukierunkowania popędu płciowego i sposobu stymulacji seksualnej (Syn. parafilia, dawniej zboczenie, dewiacja lub perwersja seksualna) Istotą tych zaburzeń jest dążenie do niezwykłego obiektu seksualnego lub sposobu stymulacji seksualnej i przedkładanie go nad powszechnie uznany sposób realizacji potrzeby seksualnej. Zaburzenia ukierunkowania popędu płciowego Częściej spotykane są: pedofilia - preferowanym sposobem osiągania satysfakcji seksualnej są kontakty seksualne z dziećmi w okresie przedpokwitaniowym lub wczesnej fazie pokwitania (F65.4), gerontofilia - osiąganie możliwe jest tylko poprzez kontakty z osobami w znacznie (F65.8), zoofilia - preferowanym sposobem osiągania satysfakcji seksualnej jest wykonywanie czynności seksualnych przy udziale zwierząt (F65.8); 75
76 nekrofilia - stan, w którym bodźcem stymulującym seksualnie mogą być jedynie ludzkie zwłoki (F65.8). Homoseksualizm, czyli zaangażowanie psychoemocjonalne i pociąg seksualny do osób tej samej płci, kiedyś uważany był za parafilię. Obecnie jest zaliczany do odmian orientacji seksualnych obok heteroseksualizmu, czyli popędu do płci przeciwnej oraz biseksualizmu, czyli popędu do osób obu płci. W 1973 roku Amerykańskie Towarzystwo Psychiatryczne wykreśliło homoseksualność z międzynarodowej listy zaburzeń psychicznych DSM. W 1990 roku również WHO wykreśliła homoseksualizm z Międzynarodowej Statystycznej Klasyfikacji Chorób i Problemów Zdrowotnych ICD-10. Badania psychologiczne wskazują, że homoseksualność per se nie wiąże się z jakimikolwiek zaburzeniami psychicznymi, ani też do nich nie prowadzi. Niezależnie od orientacji homoseksualnej czy heteroseksualnej, mogą się pojawiać zaburzenia wynikające z problemów związanych z rozwojem i akceptacją własnej seksualności. Zaburzenia te, wspólne dla wszystkich orientacji, według ICD-10 dzieli się na: zaburzenie dojrzewania seksualnego (F66.0.1), orientacja seksualna niezgodna z ego (egodystoniczna) (F66.1.1), zaburzenie związków seksualnych (F66.2.1). Potrzeba niezwykłych okoliczności dla odbycia aktu płciowego: transwestytyzm (eonizm, metatropizm) upodobnianie się do osoby płci przeciwnej poprzez ubiór i zachowanie w celu osiągnięcia satysfakcji emocjonalnej (transwestytyzm podwójnej roli F64.1), bądź seksualnej (transwestytyzm fetyszystyczny F65.1). fetyszyzm - uzyskiwaniu satysfakcji seksualnej głównie lub wyłącznie w wyniku kontaktu z obiektem pobudzającym fetyszem, często kojarzących się z partnerem seksualnym, zwykle dla aktywności masturbacyjnej (F65.0) sadyzm - potrzeba sprawiania cierpień fizycznych i psychicznych partnerowi seksualnemu (F65.5 sadomasochizm) masochizm - oczekiwanie i doznawanie cierpień od partnera seksualnego ekshibicjonizm - obnażanie się przy osobach płci przeciwnej, zwykle podczas aktywności masturbacyjnej (F65.2) podglądactwo (voyeuryzm, skoptofilia) - stan, w którym jedynym lub preferowanym sposobem osiągania satysfakcji seksualnej jest podglądanie praktyk seksualnych innych osób oraz wykonywanie w tym czasie masturbacji (F65.3) Leczenie parafilii sprowadza się głównie do psychoterapii Zaburzenia nasilenia popędu płciowego Ocena nasilenia popędu płciowego jest w dużym stopniu zależna od norm kulturowych przyjętych w danym społeczeństwie. Mimo to, można stwierdzić zaburzenia nasilenia popędu płciowego, takie jak: wzmożenie popędu płciowego, gdy życie seksualne ma znaczenie pierwszoplanowe, a współżycie płciowe z jednym partnerem nie wystarcza do zaspokojenia seksualnego. Może wystąpić w postaci: hiperseksualizmu (syn. hiperlibidemia, erotomania, satyriasia) - uporczywa potrzeba uprawiania stosunków płciowych, przesłaniająca inne oraz niezwykle częste zmiany partnerów seksualnych, 76
77 patologicznego samogwałtu (masturbacji), uprawianego przez dorosłych zamiast stosunków płciowych, mimo możliwości ich utrzymywania. Przyczyną tych zaburzeń mogą być: kompensacja poczucia niższości, nieśmiałości, braku osiągnięć w innych dziedzinach życia, potrzeba ciągłego sprawdzania swoich możliwości seksualnych, reakcje nerwicowe, choroby psychiczne, choroby organiczne np. uszkodzenia mózgu, alkoholizm, narkomania. Obniżenie lub brak popędu płciowego - brak zainteresowania partnerem seksualnym (aseksualizm). Przyczyną mogą być: stłumienie potrzeb seksualnych na skutek braku możliwości prawidłowego zaspokojenia popędu płciowego np. więźniowie, reakcje nerwicowe, choroby psychiczne np. depresja, zaburzenia hormonalne np. hipogonadyzm, przewlekłe, wyniszczające choroby organiczne, silnie działające leki psychotropowe. Leczenie zaburzeń popędu płciowego leczenie choroby podstawowej, eliminacja czynników sprzyjających powstaniu zaburzenia, psychoterapia Zaburzenia wzwodu (łac. impotentio, ang. erectile dysfunction - ED) Polegają na niemożności uzyskania i utrzymania wzwodu prącia, tak by mogło dojść do satysfakcjonującego stosunku płciowego. Etiologia - przyczyną mogą być zaburzenia: psychogenne (10-30%) - zaburzenia erekcji występują nagle, zwykle tylko podczas kontaktu seksualnego z partnerką, w sytuacjach powodujących stres. Utrzymują się one okresowo. Samoistne wzwody nocne i poranne są zachowane. Podczas masturbacji nie ma zaburzeń wzwodu i ejakulacji. Libido może być obniżone. Przyczyna ta dominuje u mężczyzn poniżej 40 roku życia. organiczne (ok. 85%) - niemożność uzyskania wzwodu występuje stale, brak jest wzwodów nocnych, libido może być zachowane lub jest obniżone. Przyczyny te dominują u mężczyzn starszych, powyżej 45 roku życia. Wśród przyczyn organicznych wyróżnia się: powikłania chorób układu krążenia (ok %) - miażdżyca naczyń tętniczych i żylnych, nadciśnienie tętnicze i choroba niedokrwienna serca; 77
78 powikłania cukrzycy (ok. 30%) - zmiany zarówno w naczyniach krwionośnych i w obwodowym przewodnictwie nerwowym; choroby neurologiczne (ok. 18%) - są najczęściej spowodowane urazami kręgosłupa i mózgu, chorobami OUN (parkinsonizm, udar, nowotwór, stwardnienie rozsiane), obwodowymi neuropatiami; leki (ok. 8%) niektóre leki hormonalne (estrogeny, antyandrogeny), leki stosowane w nadciśnieniu tętniczym (np.beta-blokery), leki uspokajające, nasenne i przeciwpadaczkowe; zaburzenia hormonalne (ok. 5%) - mogą wynikać z obniżenia poziomu testosteronu, podwyższenia poziomu prolaktyny i/lub estradiolu. Zaburzenia hormonalne mogą być skutkiem obniżonej czynności gonad, a także być wynikiem zaburzeń czynności kory nadnerczy, przysadki, tarczycy (nadczynność lub niedoczynność), nerek i wątroby; uzależnienia - alkoholizm, narkotyki, papierosy. Palenie ponad 20 papierosów dziennie przez 20 lat może być przyczyną uszkodzenia naczyń krwionośnych prącia i zaburzeń wzwodu u palaczy. mieszane (ok. 15%) - najczęściej u mężczyzn powyżej 40 roku życia nieznane (ok. 5%) choroby prącia - powodują mechaniczne utrudnienie wzwodu na skutek: wrodzonej wady anatomicznej prącia nieprawidłowości w błonie białawej prącia np. w chorobie Peyroniego (induratio penis plastica), po urazach nieprawidłowej czynności mięśni gładkich ścian ciał jamistych np. zwłóknienie przy cukrzycy, miażdżycy naczyń krwionośnych nieprawidłowego przepływu krwi w naczyniach krwionośnych prącia np. przy przecieku żylnym pomiędzy ciałami jamistymi (wada wrodzona, po urazach) Diagnostyka Wywiad powinien uwzględniać opis sytuacji, w jakich występuje zaburzenie wzwodu, obecność wzwodów nocnych, porannych i podczas masturbacji, obecność chorób, które mogłyby być przyczyną zaburzeń wzwodu, wykaz przyjmowanych leków, używek (alkohol, papierosy, narkotyki), opis trybu życia (obciążenie pracą, stres, sen itd.). Badanie internistyczne oraz urologiczne ze szczególnym uwzględnieniem stanu zewnętrznych narządów płciowych, gruczołu krokowego i jąder. Badania laboratoryjne: badania podstawowe: morfologia krwi, wskaźniki biochemiczne czynności wątroby, nerek, lipidogram, proteinogram, poziom glukozy we krwi badania hormonalne: LH, FSH, testosteron, estradiol, prolaktyna, TSH. Badanie przepływu krwi przez prącie: ultrasonografia dopplerowska. Badanie neurologiczne Postępowanie lekarskie W impotencji psychogennej: 78
79 edukacja seksualna, psychoterapia indywidualna i obu partnerów seksualnych (m.in. zmiana nastawienia do seksu, rozwiązywanie problemów psychologicznych, a głównie ułatwienie wzajemnego porozumienia między partnerami), pozorowane podawanie leków (placebo), zmiana trybu życia (unikanie stresu, przemęczenia pracą). W impotencji o podłożu organicznym: leczenie choroby podstawowej, odstawienie leków niekorzystnie wpływających na potencję, podawanie testosteronu przy obniżeniu jego stężenia we krwi. farmakoterapia doustna: leki niespecyficzne: bromokryptyna, johimbina, apomorfina, fentolamina, arginina, naltrekson, leki homeopatyczne i ziołowe; leki specyficznie poprawiające wzwód: sildenafil, wardenafil, tadalafil, awanafil. Leki te różnią się czasem działania, najkrótszy czas działania wykazuje wardenafil, a najdłuższy tadalafil. Mechanizm działania tych leków polega na zahamowaniu aktywności enzymu fosfodiesterazy-5 rozkładającego cgmp. cgmp jest substancją wytwarzaną w odpowiedzi na pojawienie się tlenku azotu, który powoduje rozkurcz komórek mięśni gładkich ciał jamistych i tętnic prącia. Zahamowanie degradacji cgmp umożliwia silniejszy i dłuższy wzwód. farmakoterapia miejscowa wstrzyknięcia do ciała jamistego: papaweryny, fentolaminy, prostaglandyny E1, pojedynczo lub w mieszaninie, nitrogliceryna (plaster lub maść na skórę prącia i moszny), PGE1 w żelu do aplikacji docewkowej, aparat próżniowy - cylinder zakładany na prącie, połączony z pompą do wytwarzania podciśnienia, które powoduje napłynięcie krwi do ciał jamistych. Po uzyskaniu wzwodu na podstawę prącia nakładana jest gumowa opaska, która uniemożliwia odpłynięcie krwi. Nie może ona być utrzymywana dłużej niż minut. leczenie operacyjne - protezy wewnętrzne prącia implantowane do ciał jamistych z tworzyw sztucznych, mogą być półsztywne lub czasowo wypełniane płynem (hydrauliczne) Zaburzenia wytrysku A. Brak wytrysku (łac. aneiaculatio) Etiologia Wytrysk wsteczny (łac. eiaculatio retrograda) polega na przedostawaniu się nasienia do pęcherza moczowego i braku wytrysku na zewnątrz. Wzwód prącia i orgazm są zwykle prawidłowe. W moczu stwierdza się plemniki. Wytrysk wsteczny może wystąpić na skutek: 79
80 zaburzeń neurogennych: o o o uszkodzenia rdzenia kręgowego (uraz, guz, zwężenie kanału kręgowego) neuropatie (cukrzyca, stwardnienie rozsiane) operacje w przestrzeni zaotrzewnowej (uszkodzenie dróg nerwowych) zaburzeń czynności szyi pęcherza moczowego wad wrodzonych pęcherza instrumentacji dróg moczowych (zabiegi na gruczole krokowym, zastawki cewki tylnej) Brak płynu nasiennego (niedorozwój pęcherzyków nasiennych, gruczołu krokowego) Całkowite uszkodzenie dróg nerwowych (łac. paraplegia). Czynnościowy brak wytrysku - podczas stosunku płciowego nie dochodzi do wystąpienia wytrysku, mimo że stosunek trwa odpowiednio długo i utrzymuje się wzwód prącia. Stosunek płciowy zostaje przerwany na skutek fizycznego zmęczenia partnerów. W większości przypadków występuje brak lub słaby orgazm. Zaburzenie to może być spowodowane reakcją nerwicową, spożyciem alkoholu, narkotyków, leków psychotropowych (np. thiorydazyna, chloropromazyna, ismelina), uszkodzeniem obwodowego układu nerwowego, po urazach rdzenia kręgowego. Postępowanie lekarskie W wytrysku wstecznym: leczenie farmakologiczne (leki alfa-adrenergiczne np. efedryna, midodrin, oxedrin lub antycholinergiczne np. bromfeniramina, leki przeciwdepresyjne np. imipramina, desipramina) pozyskiwanie plemników z moczu do inseminacji lub zapłodnienia in vitro pozyskiwanie plemników z najądrza lub jądra do zapłodnienia in vitro W uszkodzeniu dróg nerwowych: stymulacja wibratorem elektrostymulacja splotu podbrzusznego W czynnościowym braku wytrysku: unikanie niekorzystnie działających czynników psychoterapia B. Wytrysk opóźniony (łac. eiaculatio retardata) Wytrysk pojawia się po bardzo długim czasie od rozpoczęcia stosunku płciowego. Przez cały czas może utrzymywać się prawidłowa erekcja. Etiologia dysproporcja w budowie narządów płciowych partnerów, reakcje nerwicowe, 80
81 schorzenia organiczne np. cukrzyca, brak atrakcyjności seksualnej partnerki, po alkoholu, lekach przeciwdepresyjnych Postępowanie lekarskie leczenie choroby podstawowej, unikanie niekorzystnie działających czynników, psychoterapia. C. Wytrysk przedwczesny (łac. eiaculatio praecox) Do wytrysku dochodzi przed wprowadzeniem członka do pochwy. Gdy do wytrysku dochodzi po wprowadzeniu członka do pochwy, ale po wykonaniu zaledwie kilku ruchów frykcyjnych, nazywa się wytryskiem zbyt wczesnym (czas trwania stosunku poniżej 2 min.). Etiologia: zaburzenie wrodzone, długi okres wstrzemięźliwości płciowej, reakcje nerwicowe, zaburzenia psychiczne. Postępowanie lekarskie leki przeciwdepresyjne, głównie inhibitory zwrotnego wychwytu serotoniny, leki miejscowo znieczulające np. lidokaina, psychoterapia obu partnerów, pozorowane leczenie lekami doustnymi (placebo), leki uspokajające Zaburzenia szczytowania Przy prawidłowych reakcjach płciowych oraz prawidłowym przebiegu stosunku płciowego brak jest odczucia orgazmu. Częściej występuje u kobiet. Etiologia reakcje nerwicowe np. lęk, rozproszenie uwagi, obawa przed zapłodnieniem, zaburzenia psychiczne np. depresja. Postępowanie lekarskie unikanie sytuacji stresujących, psychoterapia, pozorowane leczenie lekami doustnymi (placebo), leki przeciwdepresyjne. 81
82 2.10. CHOROBY SUTKA U MĘŻCZYZN Powiększenie gruczołów piersiowych (łac. gynaecomastia, syn. ginekomastia) Jest to najczęstsza choroba sutka u mężczyzn. Zaburzenie to może pojawić się w każdym wieku. Ginekomastia spowodowana jest patologicznym rozrostem nabłonka przewodów wyprowadzających oraz rozrostem i obrzękiem tkanki łącznej podścieliska gruczołów sutkowych. Czasem towarzyszy temu rozrost tkanki gruczołowej i/lub tłuszczowej. Przy długotrwałej ginekomastii przeważają procesy włóknienia i szkliwienia tkanki łącznej okołoprzewodowej. Etiologia Podwyższony stosunek stężenia wolnego (aktywnego biologicznie) estradiolu do wolnego testosteronu (E/T) we krwi Lokalnie zwiększona aktywność aromatazy, enzymu przekształcającego testosteron do estradiolu. Nadmierna wrażliwość gruczołu sutkowego na estrogeny. Wrodzony defekt receptora androgenowego lub jego zablokowanie czynnikami egzogennymi (leki). Powiększenie gruczołów sutkowych u osobników płci męskiej może występować: u noworodków, przyczyną jest wysokie stężenie estradiolu w krążeniu płodowo-łożyskowym. Powiększenie sutków ustępuje samoistnie zwykle w ciągu kilku tygodni, rzadziej utrzymuje się przez kilka miesięcy; w czasie dojrzewania płciowego ginekomastia obserwowana jest u około 50% prawidłowo dojrzewających chłopców. Powiększeniu towarzyszy bolesność gruczołów piersiowych. Zmiany te ustępują z reguły samoistnie w czasie nie dłuższym niż 2 lata. Niekiedy mogą przetrwać do okresu dojrzałości, a wtedy wymagane jest leczenie; ginekomastia idiopatyczna występuje u mężczyzn, u których nie stwierdza się żadnej przyczyny tego stanu; u starszych mężczyzn przyczyną jest obniżenie stężenia testosteronu i zwiększenie stężenie estradiolu we krwi; w otyłości - dochodzi do zwiększonej przemiany androgenów do estrogenów w nadmiernie rozwiniętej tkance tłuszczowej, w której znajduje się duża ilość enzymu aromatazy; po lekach, które zmniejszają dostępność testosteronu np. antyandrogeny, antagoniści aldosteronu (spironolacton); przy nowotworach hormonalnie czynnych, które wytwarzają androgeny lub/i estrogeny (np. leydigioma, sertolioma), ich prekursory (np. rak kory nadnerczy), a także przy nowotworach wytwarzających β-hcg (rak jadra, płuc); w hipogonadyzmie pierwotnym zmniejszonej biosyntezie androgenów w gonadach towarzyszy zwiększona ich aromatyzacja pod wpływem nadmiaru gonadotropin. Występuje wówczas podwyższenie stosunku E/T we krwi, czego objawem jest ginekomastia; 82
83 przy wrodzonych zaburzeniach biosyntezy testosteronu lub wrodzonym defekcie receptora androgenowego, oprócz zaburzeń różnicowania narządów płciowych w okresie dojrzewania płciowego rozwija się ginekomastia; u chorych z przewlekłą niewydolnością nerek i z marskością wątroby dochodzi do niedostatecznej neutralizacji i eliminacji estrogenów oraz androgenów. Nadmiar androgenów ulega konwersji do estrogenów w tkankach obwodowych. Zwiększa się stosunek estradiol/testosteron we krwi; przy nadczynności tarczycy występuje wysokie stężenie SHBG, która głównie wiąże testosteron, prowadząc do obniżenia poziomu wolnego. Zwiększa się wówczas względne stężenie wolnego estradiolu, a w efekcie występuje podwyższenie stosunku estradiol/testosteron. Diagnostyka i różnicowanie W badaniu przedmiotowym należy określić czy powiększenie sutków jest obustronne czy też jednostronne. Gruczoł sutkowy bada się poprzez ujęcie go pomiędzy palcem wskazującym a kciukiem, ocenia się utkanie, sprężystość oraz ruchomość tkanki gruczołowej względem podłoża. Należy zwrócić uwagę na obecność wydzieliny z brodawki sutkowej, która wydostaje się samoistnie lub przy ucisku. Przy raku sutka u mężczyzn w ok. 60% przypadków wyczuwa się twardy guzek, często zrośnięty z podłożem, zwykle nieregularny, zaciągający skórę (objaw skórki pomarańczowej). Stwierdzenie ginekomastii wymaga przeprowadzenia dokładnego badania przedmiotowego, ze szczególnym uwzględnieniem oceny jąder i obwodowych węzłów chłonnych. Należy także poszukiwać objawów nadczynności tarczycy, niewydolności wątroby i nerek oraz brać pod uwagę hormonalnie czynne nowotwory. Badania hormonalne estradiol, testosteron, FSH i LH, prolaktyna, hormony tarczycy i TSH (przy podejrzeniu nadczynności tarczycy), SHBG. Badania obrazowe ultrasonografia sutków (ewentualnie także mammografia) mogą być pomocne przy różnicowaniu z nowotworem gruczołu piersiowego, ultrasonografia jąder w celu wykluczenia nowotworu jadra, w uzasadnionych przypadkach należy rozważyć wykonanie ultrasonografii, tomografii komputerowej lub rezonansu magnetycznego jamy brzusznej ze zwróceniem szczególnej uwagi na nadnercza i węzły chłonne, badanie radiologiczne klatki piersiowej. Badanie poziomu markerów nowotworowych we krwi przy podejrzeniu nowotworu wywodzącego się z komórek płciowych (patrz rozdz ). 83
84 Biopsja sutka przy podejrzeniu raka gruczołu piersiowego. Badanie poziomu biochemicznych wskaźników czynności nerek i wątroby. Postępowanie lekarskie "Fizjologiczna" ginekomastia okresu noworodkowego i pokwitaniowego nie wymaga interwencji lekarskiej, ale ginekomastia utrzymująca się po pokwitaniu wymaga leczenia. Jeżeli ginekomastia jest objawem zaburzeń ogólnoustrojowych, poprawę przynosi leczenie choroby podstawowej. Jeżeli przyczyną ginekomastii jest przyjmowanie leków, to powinny być one odstawione lub zastąpione innymi. Poprawę lub ustąpienie ginekomastii uzyskuje się poprzez zmianę stosunku E/T we krwi poprzez podawanie preparatów testosteronu i antyestrogenów (leków hamujących wiązanie estrogenów z receptorami tkankowymi) oraz inhibitorów aromatazy. Długotrwała ginekomastia jest zwykle niepodatna na leczenie farmakologiczne. Stosuje się wówczas leczenie chirurgiczne. Nowotwory sutka u mężczyzn Nowotwory sutka występują u mężczyzn znacznie rzadziej niż u kobiet, z częstością ok. 1%. U pacjentów z zespołem Klinefeltera obserwuje się nieco częściej raka sutka niż w ogólnej populacji mężczyzn. Rozpoznanie to należy jednak zawsze brać pod uwagę przy różnicowaniu powiększenia sutków u mężczyzn (patrz rozdział powyżej) STARZENIE SIĘ MĘSKIEGO UKŁADU PŁCIOWEGO Stan ten jest nieprawidłowo nazywany andropauzą (przez analogię do menopauzy u kobiet). U mężczyzn, inaczej niż u kobiet (w okresie przekwitania), nie występuje zatrzymanie czynności rozrodczych, a starzenie się układu płciowego przebiega powoli, stopniowo i nie dotyczy w równym stopniu wszystkich mężczyzn. Dla zmian związanych z wiekiem starczym u mężczyzn zaproponowano nazwę PADAM (ang. partial androgen deficiency in aging men), andropenia lub późno występujący hipogonadyzm LOH (ang. late-onset hypogonadism). U niektórych młodych mężczyzn występują wyraźne objawy niedomogi czynności hormonalnej gonad. Mówimy wtedy o przedwczesnym zatrzymaniu czynności komórek Leydiga. Fizjologiczne starzenie się męskiego układu płciowego, nie należy mylić z patologicznym zatrzymaniem czynności plemnikotwórczej i dokrewnej jądra. Przyczyną tych zaburzeń jest uszkodzenie gonady (hipogonadyzm hipergonadotropowy) lub przysadki i/lub podwzgórza (hipogonadyzm hipogonadotropowy). Objawy kliniczne Niedomoga czynności jąder u większości mężczyzn występuje dopiero po 70-tym roku życia. Składają się na nią: niedomoga czynności dokrewnej jąder, kiedy wraz z wiekiem dochodzi do zmniejszenia liczby komórek Leydiga oraz do obniżenia ich reaktywności na działanie gonadotropin. U starzejącego się mężczyzny 84
85 może dochodzić do obniżenia poziomu testosteronu we krwi. Testosteron całkowity stanowi sumę testosteronu krążącego w formie wolnej (aktywnego biologicznie) i testosteronu związanego z białkami osocza SHBG i albuminami. Z tych dwóch frakcji poziom testosteronu wolnego obniża się w znacznie większym stopniu na skutek wzrostu stężenia SHBG. niedomoga czynności nabłonka plemnikotwórczego, gdy obserwuje się pogorszenie parametrów ilościowych (zmniejszenie objętości nasienia, oligozoospermia) i jakościowych (zwiększenie liczebności form nieprawidłowych plemników) nasienia. Niektórzy mężczyźni zachowują jednak prawidłową czynność nabłonka plemnikotwórczego nawet w 90 roku życia. Najstarszy mężczyzna, który został ojcem miał 96 lat (Indie). Niedomoga czynności podwzgórza i przysadki. U starzejących się mężczyzn zmienia się amplituda pulsów i rytm dobowy wydzielania gonadoliberyny i gonadotropin oraz wzrasta wrażliwość przysadki na zwrotne hamowanie przez steroidy płciowe. W odróżnieniu od kobiet w okresie przekwitania, poziom gonadotropin we krwi u starzejących się mężczyzn nie jest pomocnym wskaźnikiem diagnostycznym. Niektórzy starsi mężczyźni z niskimi poziomami testosteronu we krwi wykazują prawidłowe poziomy gonadotropin. Osłabienie reakcji seksualnych. Dochodzi do stałego obniżania zdolności do przeżywania orgazmu, wydłuża się okres refrakcji pomiędzy kolejnymi wzwodami i występują zaburzenia erekcji. Mniejszy jest również popęd płciowy. Częstość ejakulacji stopniowo zmniejsza się. Przewlekłe obniżenie stężenia testosteronu oprócz objawów ze strony układu płciowego może manifestować się szeregiem objawów metabolicznych: osteoporozą tj. utratą masy kostnej objawiającą się zmniejszeniem gęstości utkania kostnego, ścieńczeniem warstwy korowej kości i zatarciem ich struktury beleczkowej. Doprowadza to do zwiększonej łamliwości kości, zniekształcenia trzonów kręgów i dolegliwości bólowych. Objawy te występują jednak znacznie rzadziej u mężczyzn niż u kobiet po okresie przekwitania. anemią tj. zmniejszeniem liczby krwinek czerwonych, obniżeniem poziomu hemoglobiny i wskaźnika hematokrytu. wzrostem ilości tkanki tłuszczowej, szczególnie w górnej połowie ciała, co sprzyja rozwojowi chorób układu krążenia oraz zmniejszeniem masy i siły mięśniowej. zwiększeniem humoralnej i komórkowej odpowiedzi immunologicznej, co prowadzi do częstszego występowania u starszych mężczyzn chorób autoimmunologicznych np. chorób reumatoidalnych. U starzejących się mężczyzn częściej obserwuje się łagodny przerost i raka stercza. Diagnostyka: wywiad powinien uwzględniać oprócz poznania rodzaju dolegliwości, początek ich wystąpienia, nasilenie i przebieg, badanie internistyczne oraz urologiczne ze szczególnym uwzględnieniem stanu jąder, gruczołu krokowego i narządów płciowych, badanie stężenia hormonów we krwi: LH, FSH, testosteron, estradiolu, badania podstawowe: morfologia krwi, badanie ogólne moczu, wskaźniki biochemiczne czynności wątroby, nerek, kości, lipidogram, 85
86 wskaźniki czynności gruczołu krokowego PSA, ultasonografia jamy brzusznej i transrektalna, badanie radiologiczne klatki piersiowej, densytometria kości. Postępowanie lekarskie W przypadku stwierdzenia zaburzeń układowych lub ogólnoustrojowych leczy się chorobę podstawową. Łagodny przerost i rak prostaty są przedmiotem leczenia urologicznego. Przedmiotem dyskusji pozostaje odpowiedź na pytanie, czy starsi mężczyźni z obniżonymi poziomami testosteronu we krwi powinni być poddani "terapii substytucyjnej". Wydaje się, że w przypadkach znacznego obniżenia poziomu testosteronu, z nasilonymi objawami hipoandrogenizmu, może być ono celowe. Pojawiły się, bowiem pierwsze doniesienia o możliwości korzystnego wpływu podawania testosteronu na profil lipidowy krwi, redukcję ciśnienia tętniczego i zmniejszenie otyłości u starszych mężczyzn. Przy wstępnej kwalifikacji do "substytucji" hormonalnej i w przebiegu jej prowadzenia ważne jest wykluczenie przedklinicznego raka stercza. Przeciwwskazania, sposób monitorowania leczenia patrz rozdz ŻEŃSKI UKŁAD PŁCIOWY W OKRESIE DOJRZAŁOŚCI 3.1. JAJNIK Budowa jajnika (łac. ovarium) Jajnik jest narządem parzystym położonym w jamie brzusznej po obu stronach macicy. Zadaniem jajnika jest cykliczne uwalnianie gamet - owocytów II rzędu oraz cykliczne wytwarzanie hormonów płciowych, którymi są: estradiol i progesteron. U dojrzałej kobiety wymiary jajnika wynoszą ok. 4 x 2 x 1 cm. Jajnik pokryty jest nabłonkiem płciowym, który jest swoiście zmienionym nabłonkiem otrzewnej. Pod nim leży torebka łącznotkankowa zwana błoną białawą (łac. tunica albuginea), której włókna wnikają w głąb narządu tworząc w jego wnętrzu zrąb jajnika (łac. stroma ovarii). W korze jajnika znajdują się pęcherzyki jajnikowe w różnych stadiach rozwoju. Rdzeń jajnika (łac. medulla ovarii) znajduje się w części centralnej narządu i zawiera naczynia krwionośne, chłonne, komórki zwojów nerwowych i zakończenia nerwowe Czynność gametotwórcza jajnika Od uzyskania dojrzałości płciowej do menopauzy w jajniku zachodzą cykliczne zmiany (folikulogeneza). Pęcherzyk dominujący po 14 dniach wzrostu (faza folikularna) pęka i uwalnia komórkę jajową (owulacja), a następnie przekształca się w pojedyncze ciałko żółte (łac. corpus luteum). Po upływie kolejnych 14 dni (faza lutealna) ciałko żółte zanika, przekształca się w ciałko białawe. Zanik ciałka żółtego wywołuje kilkudniową przerwę w wydzielaniu hormonów przez jajnik, co wywołuje wystąpienie krwawienia miesięcznego. Po tej przerwie czynność hormonalną podejmuje kolejny dominujący pęcherzyk jajnikowy. Procesy te powtarzają się nieprzerwanie, aż do wyczerpania puli pęcherzyków jajnikowych i zawartych w nich owocytów. 86
87 Ustanie procesu folikulogenezy łączy się z zanikiem czynności hormonalnej jajnika oraz zatrzymaniem krwawień miesięcznych. Folikulogeneza i cykl pęcherzyka jajnikowego Pierwotne pęcherzyki jajnikowe, które powstały w czasie życia płodowego, wzrastają poprzez namnażanie komórek ziarnistych i stają się pęcherzykami wtórnymi, tj. pęcherzykami z wieloma warstwami komórek ziarnistych. Z fibroblastów tworzy się osłonka zewnętrzna pęcherzyka, a jej warstwa wewnętrzna zbudowana jest z tzw. komórek tekalnych (warstwa tekalna). Wzrost pęcherzyków pierwotnych i wtórnych jest niezależny od hormonów i trwa ok. 85 dni, po czym przekształcają się one w pęcherzyki antralne. Pęcherzyki antralne zawierają jamkę (łac. antrum) wypełnioną płynem pęcherzykowym, który produkowany jest przez komórki ziarniste. Komórki ziarniste zaczynają być wrażliwe na FSH i dalsze ich namnażanie oraz rozwój pęcherzyka są ściśle uzależnione od obecności FSH. Rekrutacją nazywamy proces podtrzymywania i pobudzania wzrostu pęcherzyków antralnych poprzez FSH w fazie lutealnej poprzedniego cyklu płciowego. Łączy się to z procesem selekcji pęcherzyka dominującego. Pęcherzyk antralny z najwyższą wrażliwością na FSH staje się tzw. pęcherzykiem dominującym, w którym komórki ziarniste pod wpływem FSH rozpoczynają wytwarzanie tzw. białka regulacji pęcherzykowej (FRP, ang. follicle regulatory protein). FRP hamuje biosyntezę estrogenów w pozostałych pęcherzykach antralnych i powoduje ich atrezję. Przed krwawieniem miesięcznym, kiedy obniża się poziom hormonów jajnika we krwi, dochodzi do wzmożonego wydzielania FSH i rozpoczyna się rekrutacja, a następnie selekcja pęcherzyka dominującego dla następnego cyklu. Pęcherzyk jajnikowy wzrastający i pęcherzyk jajnikowy dojrzały (pęcherzyk Graafa) są ostatnimi stadiami wzrostu pęcherzyka jajnikowego. Pęcherzyk wzrastający pojawia się w jajniku zbieżnie z wystąpieniem krwawienia miesięcznego, a pęcherzyk Graafa jest pęcherzykiem przedowulacyjnym o średnicy ok. 20 mm. Obecność pęcherzyka o większej średnicy lub kilku widocznych w ultrasonografii pęcherzyków jednocześnie oznacza zwykle patologię procesu folikulogenezy. W pęcherzyku wzrastającym i w pęcherzyku Graafa komórki ziarniste namnażają się, tworząc wzgórek jajonośny, w którym znajduje się owocyt. Część wewnętrzna osłonki pęcherzyka zawierająca komórki tekalne ulega postępującemu rozrostowi, a jej nadmierny rozrost należy do jednej z najczęstszych patologii folikulogenezy, a w konsekwencji zaburzeń owulacji. Owulacja polega na pęknięciu wystającej ponad powierzchnię jajnika ściany pęcherzyka Graafa i wydostaniu się z niego płynu pęcherzykowego wraz z komórką jajową otoczoną resztką komórek ziarnistych (wieniec promienisty). W czasie owulacji komórka jajowa kończy I podział redukcyjny i uwalnia pierwsze ciałko kierunkowe. Ciałko żółte powstaje po owulacji na skutek tzw. luteinizacji komórek ziarnistych, procesu, który rozpoczyna się na krótko przed samą owulacją. Wyróżnia się ciałko żółte menstruacyjne, które ulega zanikowi (luteolizie) po dniach od momentu powstania i ciałko żółte ciążowe, które utrzymuje się przez pierwsze 3 miesiące ciąży. Głównym przeznaczeniem ciałka żółtego jest wydzielanie progesteronu i estradiolu. Ten pierwszy hormon jest szczególnie ważny dla utrzymania ciąży. 87
88 Gametogeneza w okresie dojrzałości płciowej Dojrzewanie komórki jajowej w cyklu jajnikowym dojrzałej kobiety polega najpierw na zwiększaniu objętości cytoplazmy (gromadzenie substancji zapasowych) i zakończeniu rozpoczętego w okresie płodowym pierwszego podziału redukcyjnego. Owocyt kończy pierwszy podział redukcyjny tuż przed owulacją. Powstaje wtedy owocyt II-go rzędu. Prawdopodobnie warunkiem tego procesu jest przemiana komórek ziarnistych w komórki lutealne, co łączy się z zahamowaniem wytwarzania w komórkach ziarnistych białka OMI (ang. oocyte meiosis inhibitor), które hamuje mejozę. Drugi podział redukcyjny owocytu i powstanie w pełni dojrzałej gamety żeńskiej odbywa się po owulacji, poza gonadą, w czasie tzw. aktywacji owocytu spowodowanej wnikaniem do komórki jajowej plemnika. Przy obu podziałach mejotycznych przeżywa tylko jedna komórka potomna, a druga ulega zanikowi jako tzw. ciałko kierunkowe. Przypuszcza się, że w części przypadków ciąż mnogich, tzw. dwuzygotycznych, nie powstaje drugie ciałko kierunkowe, lecz równoważna, zdolna do zapłodnienia, komórka jajowa. Rezerwa jajnikowa Każda kobieta posiada w jajnikach określoną pulę pęcherzyków jajnikowych pierwotnych zdolnych do przekształcenia się w pęcherzyk dojrzały, który może uwolnić komórkę jajową. W każdym cyklu część pęcherzyków jest zużywana (rekrutacja i selekcja) zmniejszając powoli całkowitą liczbę pęcherzyków jajnikowych. Rezerwa jajnikowa jest jednym z czynników określających potencjał płodności kobiety i jest zależna od liczby pozostałych w jajniku pęcherzyków pierwotnych. Wielkość rezerwy jajnikowej określa się na podstawie poziomów FSH, inhibiny B i hormonu antymüllerowskiego (AMH) we krwi. Wielkość tej rezerwy determinuje czas wystąpienia menopauzy u kobiety, ale także jest ważnym czynnikiem predykcyjnym w leczeniu niepłodności u kobiet Czynność dokrewna jajnika Układ podwzgórze - przysadka - gonada Z wyniosłości pośrodkowej podwzgórza do układu naczyń wrotnych przysadki wydzielana jest pulsacyjnie GnRH, która pobudza pulsacyjne uwalnianie z przedniego płata przysadki gonadotropin LH i FSH. FSH wbudowuje się wyłącznie do komórek ziarnistych pęcherzyka jajnikowego, podczas gdy LH łączy się z komórkami tekalnymi oraz z komórkami ciałka żółtego. Po zapłodnieniu czynność ciałka żółtego ciążowego podtrzymywana jest przez hcg, hormon wydzielany przez łożysko rozwijającego się płodu. FSH pobudza namnażanie i dojrzewanie komórek ziarnistych pęcherzyka jajnikowego. Zwiększenie liczby komórek warstwy ziarnistej odpowiada za wzrost pęcherzyka jajnikowego. Dojrzewanie komórek ziarnistych jest procesem polegającym na przygotowaniu tych komórek do przekształcenia w komórki ciałka żółtego (w procesie tzw. luteinizacji). Dochodzi wówczas do syntezy receptorów dla LH oraz odpowiednich enzymów koniecznych do wytwarzania estrogenów i progesteronu z cholesterolu i pregnenolonu. Biosynteza hormonów jajnika Czynność dokrewna jajnika jest zmienna w 28-dniowym cyklu płciowym kobiety. Głównym hormonem pęcherzyka jajnikowego jest estradiol, a głównym hormonem ciałka żółtego progesteron. Pęcherzyk jajnikowy wydziela ponadto polipeptydy, takie jak inhibina i aktywina oraz liczne czynniki wzrostu. Inhibina ha- 88
89 muje, a aktywina pobudza wydzielanie FSH. Przez działanie wewnątrzjajnikowe (parakrynne) inhibina i aktywina regulują steroidogenezę jajnika, tu też działają one przeciwstawnie. Estrogeny Rycina 11. Czynność dwóch przedziałów (komórki tekalne i ziarniste) pęcherzyka jajnikowego. Biosynteza estrogenów u kobiety odbywa się w komórkach ziarnistych pęcherzyka jajnikowego. W mniejszych ilościach estrogeny powstają w komórkach ciałka żółtego, łożysku i nadnerczach. Współczesne poglądy na temat biosyntezy estrogenów uwzględniają tzw. teorię dwóch przedziałów (ryc. 11). Komórkami docelowymi w jajniku dla LH są komórki warstwy wewnętrznej osłonki pęcherzyka jajnikowego tzw. komórki tekalne. Wytwarzają one androgeny testosteron i androstendion, które dyfundują do wnętrza pęcherzyka jajnikowego i w komórkach ziarnistych ulegają aromatyzacji: testosteron do estradiolu, a androstendion do estronu. Aktywność aromatazy zależny od poziomów FSH. Najaktywniejszym biologicznie estrogenem jest 17ß-estradiol. Progesteron Progesteron jest głównie wydzielany przez ciałko żółte i łożysko. Jedna z jego pochodnych, 17αhydroksyprogesteron jest wydzielany także przez pęcherzyk jajnikowy (komórki tekalne). Działanie hormonów jajnika Estrogeny we krwi estradiol pozostaje w stałej równowadze ze swym metabolitem estronem, a ten może być metabolizowany do jeszcze słabszego estrogenu, jakim jest estriol. W osoczu krwi estrogeny są związane (70%) przez SHBG i w tej formie są nieaktywne biologicznie. odpowiadają za rozwój i utrzymanie czynności macicy, jajowodów, pochwy, zewnętrznych narządów płciowych oraz gruczołów sutkowych; pobudzają czynność skurczową mięśnia macicy oraz jajowodów; 89
MEDYCYNA ROZRODU Z SEKSUOLOGIĄ RÓŻNICOWANIE PŁCIOWE
 MEDYCYNA ROZRODU Z SEKSUOLOGIĄ RÓŻNICOWANIE PŁCIOWE Różnicowaniem płciowym nazywamy procesy zachodzące w okresie płodowym, które na podstawie płci genetycznej doprowadzają do powstania różnic w budowie
MEDYCYNA ROZRODU Z SEKSUOLOGIĄ RÓŻNICOWANIE PŁCIOWE Różnicowaniem płciowym nazywamy procesy zachodzące w okresie płodowym, które na podstawie płci genetycznej doprowadzają do powstania różnic w budowie
MEDYCYNA ROZRODU Z ELEMENTAMI SEKSUOLOGII
 KATEDRA ANDROLOGII I ENDOKRYNOLOGII PŁODNOŚCI MEDYCYNA ROZRODU Z ELEMENTAMI SEKSUOLOGII Pod redakcją: prof. dr hab. n. med. Krzysztofa Kuli dr hab. n. med. prof. nadzw. Jolanty Słowikowskiej-Hilczer Autorzy:
KATEDRA ANDROLOGII I ENDOKRYNOLOGII PŁODNOŚCI MEDYCYNA ROZRODU Z ELEMENTAMI SEKSUOLOGII Pod redakcją: prof. dr hab. n. med. Krzysztofa Kuli dr hab. n. med. prof. nadzw. Jolanty Słowikowskiej-Hilczer Autorzy:
Narządy płciowe Gruczoły płciowe Drogi przewodzące komórki płciowe Narządy płciowe zewnętrzne
 Narządy płciowe Gruczoły płciowe Drogi przewodzące komórki płciowe Narządy płciowe zewnętrzne Męskie narządy płciowe prącie: moszna Zewnętrzne narządy płciowe: Wewnętrzne narządy płciowe : jądra męski
Narządy płciowe Gruczoły płciowe Drogi przewodzące komórki płciowe Narządy płciowe zewnętrzne Męskie narządy płciowe prącie: moszna Zewnętrzne narządy płciowe: Wewnętrzne narządy płciowe : jądra męski
Układ rozrodczy samca
 Układ rozrodczy samca ESPZiWP Układ rozrodczy samca dwa jądra drogi wyprowadzające ( najądrza i nasieniowody wraz z przewodem moczopłciowym wtórnym) prącie wraz napletkiem gruczoł krokowy (prostata) 1
Układ rozrodczy samca ESPZiWP Układ rozrodczy samca dwa jądra drogi wyprowadzające ( najądrza i nasieniowody wraz z przewodem moczopłciowym wtórnym) prącie wraz napletkiem gruczoł krokowy (prostata) 1
Zaburzenia determinacji i różnicowania płci
 Choroby układu wewnątrzwydzielniczego IV H Zaburzenia determinacji i różnicowania płci Krzysztof Kula, Jolanta Słowikowska-Hilczer 1. Fizjologia Różnicowanie płciowe to procesy zachodzące w okresie płodowym,
Choroby układu wewnątrzwydzielniczego IV H Zaburzenia determinacji i różnicowania płci Krzysztof Kula, Jolanta Słowikowska-Hilczer 1. Fizjologia Różnicowanie płciowe to procesy zachodzące w okresie płodowym,
Embriologia I. Rozwój męskiego i żeńskiego układu płciowego Zapłodnienie
 Embriologia I Rozwój męskiego i żeńskiego układu płciowego Zapłodnienie Rozwój układu moczowego Mezoderma pośrednia Nerka ostateczna Przednercze zanika Przewody przednercza, przyśródnerczowe (Przewody
Embriologia I Rozwój męskiego i żeńskiego układu płciowego Zapłodnienie Rozwój układu moczowego Mezoderma pośrednia Nerka ostateczna Przednercze zanika Przewody przednercza, przyśródnerczowe (Przewody
Gonocyty komórki prapłciowe
 GAMETOGENEZA Gametogeneza Gametogeneza (z grec. gamete żona, gametes mąż) Proces powstawania oraz rozwoju specjalnej populacji komórek, które nazywa się gametami lub komórkami rozrodczymi. Mejoza i różnicowanie
GAMETOGENEZA Gametogeneza Gametogeneza (z grec. gamete żona, gametes mąż) Proces powstawania oraz rozwoju specjalnej populacji komórek, które nazywa się gametami lub komórkami rozrodczymi. Mejoza i różnicowanie
Prenatalny okres życia człowieka a identyfikacja płciowa. Emilia Lichtenberg-Kokoszka Uniwersytet Opolski Polska
 Prenatalny okres życia człowieka a identyfikacja płciowa Emilia Lichtenberg-Kokoszka Uniwersytet Opolski Polska Seksualność jest zjawiskiem wieloaspektowym, wielowymiarowym, obejmującym szereg cech i czynności
Prenatalny okres życia człowieka a identyfikacja płciowa Emilia Lichtenberg-Kokoszka Uniwersytet Opolski Polska Seksualność jest zjawiskiem wieloaspektowym, wielowymiarowym, obejmującym szereg cech i czynności
Sposoby determinacji płci
 W CZASIE WYKŁADU TELEFONY KOMÓRKOWE POWINNY BYĆ WYŁĄCZONE LUB WYCISZONE Sposoby determinacji płci TSD thermal sex determination GSD genetic sex determination 26 o C Środowiskowa: ekspresja genu
W CZASIE WYKŁADU TELEFONY KOMÓRKOWE POWINNY BYĆ WYŁĄCZONE LUB WYCISZONE Sposoby determinacji płci TSD thermal sex determination GSD genetic sex determination 26 o C Środowiskowa: ekspresja genu
RozmnaŜanie się i rozwój człowieka
 RozmnaŜanie się i rozwój człowieka 1. Zaznacz definicję rozwoju osobniczego. A. Proces prowadzący do uzyskania przez organizm energii. B. Usuwanie z organizmu zbędnych produktów przemiany materii. C. Zmiany
RozmnaŜanie się i rozwój człowieka 1. Zaznacz definicję rozwoju osobniczego. A. Proces prowadzący do uzyskania przez organizm energii. B. Usuwanie z organizmu zbędnych produktów przemiany materii. C. Zmiany
Wizyta kwalifikująca do procedury. Wizyta lekarska w trakcie monitoringu cyklu (jedna wizyta) Estradiol (jedno badanie) Progesteron (jedno badanie)
 InviMed Wrocław In vitro Pakiet IVF ICSI 7.991 PLN Wizyta kwalifikująca do procedury Estradiol (jedno badanie) Progesteron (jedno badanie) Punkcja jajników (ze znieczuleniem i wywiadem anestezjologicznym)
InviMed Wrocław In vitro Pakiet IVF ICSI 7.991 PLN Wizyta kwalifikująca do procedury Estradiol (jedno badanie) Progesteron (jedno badanie) Punkcja jajników (ze znieczuleniem i wywiadem anestezjologicznym)
Diagnostyka przyczyn niepłodności męskiej, badanie nasienia oraz interpretacja wyników.
 Diagnostyka przyczyn niepłodności męskiej, badanie nasienia oraz interpretacja wyników. Wywiad i badanie przedmiotowe Historia niepłodności: -czas trwania, wiek małżonków -Wywiad rodzinny -wywiad osobisty:
Diagnostyka przyczyn niepłodności męskiej, badanie nasienia oraz interpretacja wyników. Wywiad i badanie przedmiotowe Historia niepłodności: -czas trwania, wiek małżonków -Wywiad rodzinny -wywiad osobisty:
Rekomendacje dotyczące diagnostyki i leczenia niepłodności
 Rekomendacje dotyczące diagnostyki i leczenia niepłodności Polskie Towarzystwo Ginekologiczne Polskie Towarzystwo Medycyny Rozrodu 2012 Polskie Towarzystwo Ginekologiczne i Polskie Towarzystwo Medycyny
Rekomendacje dotyczące diagnostyki i leczenia niepłodności Polskie Towarzystwo Ginekologiczne Polskie Towarzystwo Medycyny Rozrodu 2012 Polskie Towarzystwo Ginekologiczne i Polskie Towarzystwo Medycyny
KARTA PRZEDMIOTU BIOMEDYCZNE ASPEKTY ANDROLOGII. 1. Nazwa przedmiotu. 2. Numer kodowy PHY06e. 3. Język, w którym prowadzone są zajęcia polski
 Projekt OPERACJA SUKCES unikatowy model kształcenia na Wydziale Lekarskim Uniwersytetu Medycznego w Łodzi odpowiedzią na potrzeby gospodarki opartej na wiedzy współfinansowany ze środków Europejskiego
Projekt OPERACJA SUKCES unikatowy model kształcenia na Wydziale Lekarskim Uniwersytetu Medycznego w Łodzi odpowiedzią na potrzeby gospodarki opartej na wiedzy współfinansowany ze środków Europejskiego
OFERTA SPECJALNA LUX MED Program Zdrowie Piękno Harmonia
 OFERTA SPECJALNA LUX MED Program Zdrowie Piękno Harmonia Wszystkim posiadaczom Karty Pacjenta LUX MED (po wcześniejszym okazaniu) przysługują następujące zniżki: 4201 PANEL SERCE. Predyspozycje do chorób
OFERTA SPECJALNA LUX MED Program Zdrowie Piękno Harmonia Wszystkim posiadaczom Karty Pacjenta LUX MED (po wcześniejszym okazaniu) przysługują następujące zniżki: 4201 PANEL SERCE. Predyspozycje do chorób
Leszek Pawelczyk Klinika Niepłodności i Endokrynologii Rozrodu Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
 Leszek Pawelczyk Klinika Niepłodności i Endokrynologii Rozrodu Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Nagroda Nobla w dziedzinie Fizjologii i Medcyny 2010 Człowiek należy do gatunku
Leszek Pawelczyk Klinika Niepłodności i Endokrynologii Rozrodu Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Nagroda Nobla w dziedzinie Fizjologii i Medcyny 2010 Człowiek należy do gatunku
Układ wewnątrzwydzielniczy
 Układ wewnątrzwydzielniczy 1. Gruczoły dokrewne właściwe: przysadka mózgowa, szyszynka, gruczoł tarczowy, gruczoły przytarczyczne, nadnercza 2. Gruczoły dokrewne mieszane: trzustka, jajniki, jądra 3. Inne
Układ wewnątrzwydzielniczy 1. Gruczoły dokrewne właściwe: przysadka mózgowa, szyszynka, gruczoł tarczowy, gruczoły przytarczyczne, nadnercza 2. Gruczoły dokrewne mieszane: trzustka, jajniki, jądra 3. Inne
InviMed Bydgoszcz. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Bydgoszcz In vitro Pakiet IVF 5.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
InviMed Bydgoszcz In vitro Pakiet IVF 5.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
Oś podwzgórze przysadka gonada
 Oś podwzgórze przysadka gonada podwzgórze gonadoliberyna (GnRH) dekapeptyd wydzielany pulsacyjnie co 90-120 min przysadka gonadotropiny: FSH, LH glikoproteiny zbudowane z dwóch podjednostek: i FSH h. folikulotropowy
Oś podwzgórze przysadka gonada podwzgórze gonadoliberyna (GnRH) dekapeptyd wydzielany pulsacyjnie co 90-120 min przysadka gonadotropiny: FSH, LH glikoproteiny zbudowane z dwóch podjednostek: i FSH h. folikulotropowy
tel:
 Meskie narządy płciowe, 4 części Nr ref: MA01592 Informacja o produkcie: Męskie narządy rozrodcze 4 częściowy model naturalnej wielkości męskich organów rozrodczych. Istnieje możliwość otwarcia modelu
Meskie narządy płciowe, 4 części Nr ref: MA01592 Informacja o produkcie: Męskie narządy rozrodcze 4 częściowy model naturalnej wielkości męskich organów rozrodczych. Istnieje możliwość otwarcia modelu
Sposoby determinacji płci
 Sposoby determinacji płci TSD thermal sex determination GSD genetic sex determination 26 o C Środowiskowa: ekspresja genu DMRT zależna jest od warunków środowiska ~30 o C ~33 o C ~35 o C n=16
Sposoby determinacji płci TSD thermal sex determination GSD genetic sex determination 26 o C Środowiskowa: ekspresja genu DMRT zależna jest od warunków środowiska ~30 o C ~33 o C ~35 o C n=16
InviMed Gdynia. In vitro. Wizyta kwalifikująca do procedury. Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Gdynia In vitro Pakiet IVF 5.500 PLN Wizyta kwalifikująca do procedury Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury embriologiczne
InviMed Gdynia In vitro Pakiet IVF 5.500 PLN Wizyta kwalifikująca do procedury Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury embriologiczne
Choroby gonad męskich
 G Krzysztof Kula, Jolanta Słowikowska-Hilczer 1. Fizjologia Gonada męska jądro (testis) jest narządem parzystym o objętości 12 30 ml, otoczonym łącznotkankową błoną białawą. W kanalikach plemnikotwórczych
G Krzysztof Kula, Jolanta Słowikowska-Hilczer 1. Fizjologia Gonada męska jądro (testis) jest narządem parzystym o objętości 12 30 ml, otoczonym łącznotkankową błoną białawą. W kanalikach plemnikotwórczych
OFERTA SPECJALNA LUX MED Program Zdrowie Piękno Harmonia
 OFERTA SPECJALNA LUX MED Program Zdrowie Piękno Harmonia Wszystkim posiadaczom Karty Pacjenta LUX MED (po wcześniejszym okazaniu) przysługują następujące zniżki: 4201 PANEL SERCE. Predyspozycje do chorób
OFERTA SPECJALNA LUX MED Program Zdrowie Piękno Harmonia Wszystkim posiadaczom Karty Pacjenta LUX MED (po wcześniejszym okazaniu) przysługują następujące zniżki: 4201 PANEL SERCE. Predyspozycje do chorób
InviMed Poznań. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Poznań In vitro Pakiet IVF ICSI 6.700 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
InviMed Poznań In vitro Pakiet IVF ICSI 6.700 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
5. Powstawanie dwulistkowej tarczki zarodkowej. Drugi tydzień rozwoju 107 Zaburzenia w rozwoju w pierwszych dwóch tygodniach...
 SPIS TREŚCI CZĘŚĆ OGÓLNA 1. Zarys historii embriologii................ 16 2. Układ rozrodczy................... 26 Układ rozrodczy męski.................. 26 Narządy rozrodcze wewnętrzne...............
SPIS TREŚCI CZĘŚĆ OGÓLNA 1. Zarys historii embriologii................ 16 2. Układ rozrodczy................... 26 Układ rozrodczy męski.................. 26 Narządy rozrodcze wewnętrzne...............
Wykłady z anatomii dla studentów pielęgniarstwa i ratownictwa medycznego
 Wykłady z anatomii dla studentów pielęgniarstwa i ratownictwa medycznego Zdolność do rozmnażania się jest jedną z właściwości odróżniających materię ożywioną od nieożywionej. Im prymitywniejsze zwierzę,
Wykłady z anatomii dla studentów pielęgniarstwa i ratownictwa medycznego Zdolność do rozmnażania się jest jedną z właściwości odróżniających materię ożywioną od nieożywionej. Im prymitywniejsze zwierzę,
Jakie są objawy zespołu policystycznych jajników?
 3 Jakie są objawy zespołu policystycznych jajników? Najważniejsze punkty zu kobiet występuje różne nasilenie objawów; u niektórych objawy mogą być ciężkie, u innych nieznaczne. zobjawami zespołu PCOS mogą
3 Jakie są objawy zespołu policystycznych jajników? Najważniejsze punkty zu kobiet występuje różne nasilenie objawów; u niektórych objawy mogą być ciężkie, u innych nieznaczne. zobjawami zespołu PCOS mogą
InviMed Poznań. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Poznań In vitro Pakiet IVF ICSI 6.700 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
InviMed Poznań In vitro Pakiet IVF ICSI 6.700 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
Układ rozrodczy samicy
 Układ rozrodczy samicy ESPZiWP układ rozrodczy samicy jajniki, jajowody, macica, pochwa, srom 1 Jajniki Jajniki pełnią funkcje wewnątrzwydzielniczą (hormonalną) i rozrodczą, które są ze sobą ściśle powiązane.
Układ rozrodczy samicy ESPZiWP układ rozrodczy samicy jajniki, jajowody, macica, pochwa, srom 1 Jajniki Jajniki pełnią funkcje wewnątrzwydzielniczą (hormonalną) i rozrodczą, które są ze sobą ściśle powiązane.
1 Proces zapłodnienia 15 Kobiecy cykl miesiączkowy 15 Spermatogeneza 20 Zapłodnienie 22. Kiedy należy zwrócić się o pomoc do lekarza?
 SPIS TREŚCI Wstęp 10 1 Proces zapłodnienia 15 Kobiecy cykl miesiączkowy 15 Spermatogeneza 20 Zapłodnienie 22 Zagnieżdżenie 23 Prawdopodobieństwo zajścia w ciążę 23 Kiedy należy zwrócić się o pomoc do lekarza?
SPIS TREŚCI Wstęp 10 1 Proces zapłodnienia 15 Kobiecy cykl miesiączkowy 15 Spermatogeneza 20 Zapłodnienie 22 Zagnieżdżenie 23 Prawdopodobieństwo zajścia w ciążę 23 Kiedy należy zwrócić się o pomoc do lekarza?
Niepłodność u mężczyzn. etiopatogeneza, diagnostyka, leczenie
 Niepłodność u mężczyzn etiopatogeneza, diagnostyka, leczenie Wywiad: czas trwania niepłodności częstość współżycia i zaburzenia seksualne wcześniejsze leczenie niepłodności choroby wieku dziecięcego i
Niepłodność u mężczyzn etiopatogeneza, diagnostyka, leczenie Wywiad: czas trwania niepłodności częstość współżycia i zaburzenia seksualne wcześniejsze leczenie niepłodności choroby wieku dziecięcego i
InviMed Gdynia. In vitro. Wizyta kwalifikująca do procedury. Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Gdynia In vitro Pakiet IVF 5.500 PLN Wizyta kwalifikująca do procedury Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury embriologiczne
InviMed Gdynia In vitro Pakiet IVF 5.500 PLN Wizyta kwalifikująca do procedury Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury embriologiczne
Spis treści. Epidemiologia niepłodności 11 Jerzy Radwan. Psychologiczny aspekt niepłodności 15 Jerzy Radwan
 Epidemiologia niepłodności 11 Psychologiczny aspekt niepłodności 15 Czynniki zawodowe i styl życia a płodność 19 Wojciech Hanke Czynniki chemiczne 19 Czynniki fizyczne 21 Czynniki psychologiczne 21 Nikotynizm
Epidemiologia niepłodności 11 Psychologiczny aspekt niepłodności 15 Czynniki zawodowe i styl życia a płodność 19 Wojciech Hanke Czynniki chemiczne 19 Czynniki fizyczne 21 Czynniki psychologiczne 21 Nikotynizm
Podstawowe informacje o chorobach i raku gruczołu krokowego
 W TROSCE O PACJENTA CHOREGO NA RAKA GRUCZOŁU KROKOWEGO Ogólnopolski program edukacyjny Podstawowe informacje o chorobach i raku gruczołu krokowego Program realizowany pod patronatem Polskiego Towarzystwa
W TROSCE O PACJENTA CHOREGO NA RAKA GRUCZOŁU KROKOWEGO Ogólnopolski program edukacyjny Podstawowe informacje o chorobach i raku gruczołu krokowego Program realizowany pod patronatem Polskiego Towarzystwa
LECZENIE PRZEDWCZESNEGO DOJRZEWANIA PŁCIOWEGO U DZIECI
 Załącznik nr 11 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE PRZEDWCZESNEGO DOJRZEWANIA PŁCIOWEGO U DZIECI ICD-10 E 22.8 Przedwczesne dojrzewanie płciowe
Załącznik nr 11 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE PRZEDWCZESNEGO DOJRZEWANIA PŁCIOWEGO U DZIECI ICD-10 E 22.8 Przedwczesne dojrzewanie płciowe
Układ dokrewny. Hormony zwierzęce związki chemiczne wydzielane przez gruczoły i tkanki układu dokrewnego; mają funkcję regulacyjną.
 Układ dokrewny (hormonalny, wewnątrzwydzielniczy, endokrynny) układ narządów u zwierząt składający się z gruczołów dokrewnych i pojedynczych komórek tkanek; pełni funkcję regulacyjną. Hormony zwierzęce
Układ dokrewny (hormonalny, wewnątrzwydzielniczy, endokrynny) układ narządów u zwierząt składający się z gruczołów dokrewnych i pojedynczych komórek tkanek; pełni funkcję regulacyjną. Hormony zwierzęce
InviMed Katowice. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
InviMed Katowice. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
InviMed Katowice. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
Sposoby determinacji płci
 GAMETOGENEZA spermatogonium oogonium spermatocyty I-ego rzędu spermatocyty II-ego rzędu oocyty II-ego rzędu oocyty I-ego rzędu pierwsze ciałko kierunkowe spermatydy ootydy drugie ciałko kierunkowe plemniki
GAMETOGENEZA spermatogonium oogonium spermatocyty I-ego rzędu spermatocyty II-ego rzędu oocyty II-ego rzędu oocyty I-ego rzędu pierwsze ciałko kierunkowe spermatydy ootydy drugie ciałko kierunkowe plemniki
Pytania z zakresu ginekologii i opieki ginekologicznej
 Pytania z zakresu ginekologii i opieki ginekologicznej - 2017 1. Proszę wymienić zagrożenia zdrowotne dla kobiety jakie mogą wystąpić w okresie okołomenopauzalnym. 2. Proszę omówić rolę położnej w opiece
Pytania z zakresu ginekologii i opieki ginekologicznej - 2017 1. Proszę wymienić zagrożenia zdrowotne dla kobiety jakie mogą wystąpić w okresie okołomenopauzalnym. 2. Proszę omówić rolę położnej w opiece
Endokrynologia Pediatryczna Pediatric Endocrinology
 Vol. 5/2006 Nr 1(14) Endokrynologia Pediatryczna Pediatric Endocrinology Współczesne poglądy na temat uwarunkowań gonadogenezy i prezentacja przypadków z rodzinnym występowaniem dysgenezji jąder Current
Vol. 5/2006 Nr 1(14) Endokrynologia Pediatryczna Pediatric Endocrinology Współczesne poglądy na temat uwarunkowań gonadogenezy i prezentacja przypadków z rodzinnym występowaniem dysgenezji jąder Current
InviMed Wrocław. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Wrocław In vitro Pakiet IVF ICSI 7.400 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
InviMed Wrocław In vitro Pakiet IVF ICSI 7.400 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
Gruczoły wydzielania wewnętrznego - oddają swoją wydzielinę bezpośrednio do krwi - wydzielają hormony. anatomia i fizjologia człowieka
 Gruczoły wydzielania wewnętrznego - oddają swoją wydzielinę bezpośrednio do krwi - wydzielają hormony Gruczoły dokrewne człowieka PRZYSADKA mózgowa Przysadka mózgowa jest gruczołem wielkości ziarna grochu
Gruczoły wydzielania wewnętrznego - oddają swoją wydzielinę bezpośrednio do krwi - wydzielają hormony Gruczoły dokrewne człowieka PRZYSADKA mózgowa Przysadka mózgowa jest gruczołem wielkości ziarna grochu
Molekuły Miłości. Borys Palka Katarzyna Pyzik. www.agh.edu.pl
 Molekuły Miłości Borys Palka Katarzyna Pyzik www.agh.edu.pl Zakochanie Przyczyną Hormonalnych Zmian Grupa zakochanych, 24 osoby (12 mężczyzn, 12 kobiet ) Grupa kontrolna, 24 osoby (12 mężczyzn, 12 kobiet)
Molekuły Miłości Borys Palka Katarzyna Pyzik www.agh.edu.pl Zakochanie Przyczyną Hormonalnych Zmian Grupa zakochanych, 24 osoby (12 mężczyzn, 12 kobiet ) Grupa kontrolna, 24 osoby (12 mężczyzn, 12 kobiet)
Biblioteka ginekologa praktyka
 Biblioteka ginekologa praktyka pod redakcją prof. dr. hab. n. med. Mirosława Wielgosia Postępowanie z niepłodną parą 4 Postępowanie z niepłodną parą Gdańsk 2010 Redaktor prowadzący: Agnieszka Frankiewicz
Biblioteka ginekologa praktyka pod redakcją prof. dr. hab. n. med. Mirosława Wielgosia Postępowanie z niepłodną parą 4 Postępowanie z niepłodną parą Gdańsk 2010 Redaktor prowadzący: Agnieszka Frankiewicz
OKRES DOJRZAŁOŚCI PŁCIOWEJ - POKWITANIE
 OKRES DOJRZAŁOŚCI PŁCIOWEJ - POKWITANIE Co powinno zostać w mojej pamięci po wykładzie Symptomy pokwitania Mechanizm pokwitania Znajomość pojęć: adrenarche, gonadarche, przedwczesne pokwitanie płciowe
OKRES DOJRZAŁOŚCI PŁCIOWEJ - POKWITANIE Co powinno zostać w mojej pamięci po wykładzie Symptomy pokwitania Mechanizm pokwitania Znajomość pojęć: adrenarche, gonadarche, przedwczesne pokwitanie płciowe
Michał Brzewski, Andrzej Marciński, Agnieszka Biejat Zakład Radiologii Pediatrycznej Akademii Medycznej w Warszawie
 DIAGNOSTYKA CHORÓB NARZĄDÓW MIEDNICY MNIEJSZEJ U DZIEWCZĄT Michał Brzewski, Andrzej Marciński, Agnieszka Biejat Zakład Radiologii Pediatrycznej Akademii Medycznej w Warszawie 1 2 2 Cele wykładu Zaprezentowanie
DIAGNOSTYKA CHORÓB NARZĄDÓW MIEDNICY MNIEJSZEJ U DZIEWCZĄT Michał Brzewski, Andrzej Marciński, Agnieszka Biejat Zakład Radiologii Pediatrycznej Akademii Medycznej w Warszawie 1 2 2 Cele wykładu Zaprezentowanie
InviMed Poznań. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Poznań In vitro Pakiet IVF ICSI 6.700 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Zapłodnienie
InviMed Poznań In vitro Pakiet IVF ICSI 6.700 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Zapłodnienie
Cennik InviMed Wrocław
 Cennik InviMed Wrocław In Vitro Pakiet ICSI 8 020 zł Wizyta kwali kująca do procedury Punkcja jajników (ze znieczuleniem) 1 6 Procedury embriologiczne 3 400 zł Zapłodnienie metodą ICSI 1 300 zł Transfer
Cennik InviMed Wrocław In Vitro Pakiet ICSI 8 020 zł Wizyta kwali kująca do procedury Punkcja jajników (ze znieczuleniem) 1 6 Procedury embriologiczne 3 400 zł Zapłodnienie metodą ICSI 1 300 zł Transfer
HIPOGONADYZM. to obniżenie lub brak wydzielania hormonów sterydowych przez gonady i obniżenie lub brak płodności
 HIPOGONADYZM to obniżenie lub brak wydzielania hormonów sterydowych przez gonady i obniżenie lub brak płodności Kliniczne różnicowanie hipogonadyzmu testosteron FSH, LH estradiol FSH, LH pierwotny (gonadalny)
HIPOGONADYZM to obniżenie lub brak wydzielania hormonów sterydowych przez gonady i obniżenie lub brak płodności Kliniczne różnicowanie hipogonadyzmu testosteron FSH, LH estradiol FSH, LH pierwotny (gonadalny)
Genetyczne podłoże zaburzeń determinacji płci i rozwoju gonad
 /REWIEVS Genetyczne podłoże zaburzeń determinacji płci i rozwoju gonad Endokrynologia Polska/Polish Journal of Endocrinology Tom/Volume 59; Numer/Number 6/2008 ISSN 0423 104X Genetic background of sex
/REWIEVS Genetyczne podłoże zaburzeń determinacji płci i rozwoju gonad Endokrynologia Polska/Polish Journal of Endocrinology Tom/Volume 59; Numer/Number 6/2008 ISSN 0423 104X Genetic background of sex
REGULACJA WYDZIELANIA HORMONÓW
 REGULACJA WYDZIELANIA HORMONÓW Regulacja nerwowa wpływ układu wegetatywnego na czynność endokrynną gruczołów wydzielania dokrewnego wytwarzanie i uwalnianie hormonów z zakończeń neuronów np.wazopresyny
REGULACJA WYDZIELANIA HORMONÓW Regulacja nerwowa wpływ układu wegetatywnego na czynność endokrynną gruczołów wydzielania dokrewnego wytwarzanie i uwalnianie hormonów z zakończeń neuronów np.wazopresyny
Cennik InviMed Gdynia
 Cennik InviMed Gdynia In Vitro Pakiet ICSI 8 0 Wizyta kwali kująca do procedury 13 Opieka koordynatora Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) 60 Instruktaż podawania leków
Cennik InviMed Gdynia In Vitro Pakiet ICSI 8 0 Wizyta kwali kująca do procedury 13 Opieka koordynatora Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) 60 Instruktaż podawania leków
Bezpłodność. n Obwiniano kobiety n Tylko modlitwa n Mężczyźni nie rozumiano ich roli
 IVF itd Bezpłodność n Obwiniano kobiety n Tylko modlitwa n Mężczyźni nie rozumiano ich roli Definicja n Niemożność zajścia w ciążę przez rok n 10-15% populacji n 15-20 % z tej grupy nie wiadomo dlaczego
IVF itd Bezpłodność n Obwiniano kobiety n Tylko modlitwa n Mężczyźni nie rozumiano ich roli Definicja n Niemożność zajścia w ciążę przez rok n 10-15% populacji n 15-20 % z tej grupy nie wiadomo dlaczego
Układ rozrodczy męski. Bogusław Nedoszytko
 Układ rozrodczy męski Bogusław Nedoszytko Układ rozrodczy męski - funkcje Wytwarzanie, odŝywianie i czasowe przechowywanie gamet męskich (plemników) Wprowadzenie zawiesiny plemników (nasienia) do układu
Układ rozrodczy męski Bogusław Nedoszytko Układ rozrodczy męski - funkcje Wytwarzanie, odŝywianie i czasowe przechowywanie gamet męskich (plemników) Wprowadzenie zawiesiny plemników (nasienia) do układu
Hormony Gruczoły dokrewne
 Hormony Gruczoły dokrewne Dr n. biol. Urszula Wasik Zakład Biologii Medycznej HORMON Przekazuje informacje między poszczególnymi organami regulują wzrost, rozwój organizmu efekt biologiczny - niewielkie
Hormony Gruczoły dokrewne Dr n. biol. Urszula Wasik Zakład Biologii Medycznej HORMON Przekazuje informacje między poszczególnymi organami regulują wzrost, rozwój organizmu efekt biologiczny - niewielkie
Przyczyny hiperkortyzolemii u dzieci. Objawy hiperkortyzolemii u dzieci. Badania laboratoryjne. Cześć korowa
 Zaburzenia funkcji nadnerczy. Wrodzony przerost nadnerczy. Cześć korowa 80-90% całego nadnercza. Składa się z trzech warstw o różnej budowie histologicznej: kłębkowatej (zona glomerulosa) pasmowatej (zona
Zaburzenia funkcji nadnerczy. Wrodzony przerost nadnerczy. Cześć korowa 80-90% całego nadnercza. Składa się z trzech warstw o różnej budowie histologicznej: kłębkowatej (zona glomerulosa) pasmowatej (zona
ID Nazwa usługi Rabat PANEL SERCE. Predyspozycje do chorób zakrzepowo-zatorowych 60%
 ID Nazwa usługi Rabat 4201 PANEL SERCE. Predyspozycje do chorób zakrzepowozatorowych 60% 4202 PANEL SERCE i NADCIŚNIENIE. Predyspozycje do chorób zakrzepowozatorowych i nadciśnienia 60% 4194 Detekcja polimorfizmu
ID Nazwa usługi Rabat 4201 PANEL SERCE. Predyspozycje do chorób zakrzepowozatorowych 60% 4202 PANEL SERCE i NADCIŚNIENIE. Predyspozycje do chorób zakrzepowozatorowych i nadciśnienia 60% 4194 Detekcja polimorfizmu
FIZJOLOGIA I PATOLOGIA SUTKÓW U DZIECI I MŁODZIEŻY W DIAGNOSTYCE ULTRASONOGRAFICZNEJ
 FIZJOLOGIA I PATOLOGIA SUTKÓW U DZIECI I MŁODZIEŻY W DIAGNOSTYCE ULTRASONOGRAFICZNEJ A.JAKUBOWSKA, M.BRZEWSKI, M.GRAJEWSKA-FERENS, A.MARCIŃSKI, J.MĄDZIK ZAKŁAD RADIOLOGII PEDIATRYCZNEJ I KLINIKA ENDOKRYNOLOGII
FIZJOLOGIA I PATOLOGIA SUTKÓW U DZIECI I MŁODZIEŻY W DIAGNOSTYCE ULTRASONOGRAFICZNEJ A.JAKUBOWSKA, M.BRZEWSKI, M.GRAJEWSKA-FERENS, A.MARCIŃSKI, J.MĄDZIK ZAKŁAD RADIOLOGII PEDIATRYCZNEJ I KLINIKA ENDOKRYNOLOGII
Male reproductive system Męski układ płciowy
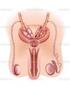 Male reproductive system Męski układ płciowy Produkcja, odżywianie i czasowe magazynowanie plemników Produkcja hormonów płciowych męskich androgenów Wprowadzenie zawiesiny nasienia do dróg rodnych żeńskich
Male reproductive system Męski układ płciowy Produkcja, odżywianie i czasowe magazynowanie plemników Produkcja hormonów płciowych męskich androgenów Wprowadzenie zawiesiny nasienia do dróg rodnych żeńskich
Biomedyczne aspekty kształtowania płci somatycznej. Znaczenie prenatalnego okresu życia
 Emilia Lichtenberg-Kokoszka Wydział Nauk Społecznych, Instytut Nauk Pedagogicznych, Uniwersytet Opolski Biomedyczne aspekty kształtowania płci somatycznej. Znaczenie prenatalnego okresu życia Biomedical
Emilia Lichtenberg-Kokoszka Wydział Nauk Społecznych, Instytut Nauk Pedagogicznych, Uniwersytet Opolski Biomedyczne aspekty kształtowania płci somatycznej. Znaczenie prenatalnego okresu życia Biomedical
Bliźniak z zespołem Beckwitha-Wiedemanna
 Bliźniak z zespołem Beckwitha-Wiedemanna Marek Szczepański, Renata Posmyk Klinika Neonatologii i intensywnej Terapii Noworodka Uniwersytet Medyczny w Białymstoku Konferencja,,Neonatologia przez przypadki
Bliźniak z zespołem Beckwitha-Wiedemanna Marek Szczepański, Renata Posmyk Klinika Neonatologii i intensywnej Terapii Noworodka Uniwersytet Medyczny w Białymstoku Konferencja,,Neonatologia przez przypadki
Ciąża ektopowa. I Katedra i Klinika Położnictwa i Ginekologii Warszawskiego Uniwersytetu Medycznego
 Ciąża ektopowa I Katedra i Klinika Położnictwa i Ginekologii Warszawskiego Uniwersytetu Medycznego Definicja: ciąża ektopowa - to ciąża rozwijająca się poza jamą macicy. W ostatnim okresie stwierdza się
Ciąża ektopowa I Katedra i Klinika Położnictwa i Ginekologii Warszawskiego Uniwersytetu Medycznego Definicja: ciąża ektopowa - to ciąża rozwijająca się poza jamą macicy. W ostatnim okresie stwierdza się
PROGRAM SZKOLENIA WSTĘPNEGO LEKARZE
 Lp. TEMAT SZKOLENIA Czas trwania 1. Polskie i europejskie przepisy prawne dotyczące medycznie wspomaganej prokreacji oraz gromadzenia, testowania, przetwarzania, przechowywania i dystrybucji komórek rozrodczych
Lp. TEMAT SZKOLENIA Czas trwania 1. Polskie i europejskie przepisy prawne dotyczące medycznie wspomaganej prokreacji oraz gromadzenia, testowania, przetwarzania, przechowywania i dystrybucji komórek rozrodczych
Pęcherz. Pęcherzyki nasienne. Gruczoł krokowy Część sterczowa cewki moczowej Część błoniasta cewki moczowej. Bańka nasieniowodu
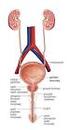 Męski układ płciowy Produkcja, odżywianie i czasowe magazynowanie plemników Wprowadzenie zawiesiny nasienia do dróg rodnych żeńskich Produkcja hormonów płciowych męskich androgenów Jądra, miejsce powstawania
Męski układ płciowy Produkcja, odżywianie i czasowe magazynowanie plemników Wprowadzenie zawiesiny nasienia do dróg rodnych żeńskich Produkcja hormonów płciowych męskich androgenów Jądra, miejsce powstawania
1. Zaznacz punkt, w którym prawidłowo opisano rozmnażanie. (0 1) A) Zmiany zachodzące w organizmie od momentu jego powstania aż do jego śmierci.
 Sprawdzian b Imię i nazwisko Klasa Liczba punktów Ocena Test podsumowujący dział XI Rozmnażanie Masz przed sobą test składający się z 15 zadań. Przy każdym poleceniu podano liczbę punktów możliwych do
Sprawdzian b Imię i nazwisko Klasa Liczba punktów Ocena Test podsumowujący dział XI Rozmnażanie Masz przed sobą test składający się z 15 zadań. Przy każdym poleceniu podano liczbę punktów możliwych do
PEDIATRIA - WYKŁAD 5 marca 2008
 T: Cukrzyca. 1. Cukrzyca choroba genetycznie uwarunkowana, występująca rodzinnie, dotyczy wszystkich chorób metabolicznych ustroju, spowodowana niedomogą komórek β wysp Langerhansa. 2. Klimat a cukrzyca
T: Cukrzyca. 1. Cukrzyca choroba genetycznie uwarunkowana, występująca rodzinnie, dotyczy wszystkich chorób metabolicznych ustroju, spowodowana niedomogą komórek β wysp Langerhansa. 2. Klimat a cukrzyca
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych wwwaotmgovpl Rekomendacja nr 52/2014 z dnia 24 lutego 2014 r Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Gonapeptyl
Agencja Oceny Technologii Medycznych wwwaotmgovpl Rekomendacja nr 52/2014 z dnia 24 lutego 2014 r Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Gonapeptyl
Rak gruczołu krokowego
 Rak gruczołu krokowego Rak stercza (PCa - prostatic cancer) należy do najczęściej występujących nowotworów złośliwych u mężczyzn. W Polsce pod względem zapadalności ustępuje jedynie rakowi płuca i wyprzedza
Rak gruczołu krokowego Rak stercza (PCa - prostatic cancer) należy do najczęściej występujących nowotworów złośliwych u mężczyzn. W Polsce pod względem zapadalności ustępuje jedynie rakowi płuca i wyprzedza
SCENARIUSZ LEKCJI W KLASIE II BIOLOGIA. HASŁO PROGRAMOWE: Funkcjonowanie organizmu człowieka jako zintegrowanej całości
 SCENARIUSZ LEKCJI W KLASIE II BIOLOGIA NAUCZYCIEL PROWADZĄCY... TEMAT LEKCJI: Rozwój płodowy człowieka KLASA... DATA:... GODZ... HASŁO PROGRAMOWE: Funkcjonowanie organizmu człowieka jako zintegrowanej
SCENARIUSZ LEKCJI W KLASIE II BIOLOGIA NAUCZYCIEL PROWADZĄCY... TEMAT LEKCJI: Rozwój płodowy człowieka KLASA... DATA:... GODZ... HASŁO PROGRAMOWE: Funkcjonowanie organizmu człowieka jako zintegrowanej
FORMULARZ DLA PARY Z PROBLEMEM NIEPŁODNOŚCI
 Dodatkowe informacje: FORMULARZ DLA PARY Z PROBLEMEM NIEPŁODNOŚCI DANE OSOBOWE lek. med. Laura Grześkowiak Data wypełnienia: Imiona (męża i żony):.. Nazwisko(a):. Adres:... Tel. kontaktowy: PESEL: CZĘŚD
Dodatkowe informacje: FORMULARZ DLA PARY Z PROBLEMEM NIEPŁODNOŚCI DANE OSOBOWE lek. med. Laura Grześkowiak Data wypełnienia: Imiona (męża i żony):.. Nazwisko(a):. Adres:... Tel. kontaktowy: PESEL: CZĘŚD
Cennik InviMed Warszawa
 Cennik InviMed Warszawa In Vitro Pakiet ICSI 7 7 Monitoring cyklu Punkcja jajników (ze znieczuleniem) 1 6 Procedury embriologiczne 3 Zapłodnienie metodą ICSI 1 Transfer świeży zarodka/zarodków 1 200 zł
Cennik InviMed Warszawa In Vitro Pakiet ICSI 7 7 Monitoring cyklu Punkcja jajników (ze znieczuleniem) 1 6 Procedury embriologiczne 3 Zapłodnienie metodą ICSI 1 Transfer świeży zarodka/zarodków 1 200 zł
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 55/2014 z dnia 24 lutego 2014 r. w sprawie oceny leku Gonapeptyl Daily, EAN: 5909990707553, we wskazaniu dysensytyzacja
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 55/2014 z dnia 24 lutego 2014 r. w sprawie oceny leku Gonapeptyl Daily, EAN: 5909990707553, we wskazaniu dysensytyzacja
Definicja niepłodności:
 Niepłodność kobieca Definicja niepłodności: Brak potomstwa po dwunastomiesięcznym okresie regularnego współżycia bez stosowania środków antykoncepcyjnych. W Polsce niepłodność dotyczy 14 % par. Przyczyny
Niepłodność kobieca Definicja niepłodności: Brak potomstwa po dwunastomiesięcznym okresie regularnego współżycia bez stosowania środków antykoncepcyjnych. W Polsce niepłodność dotyczy 14 % par. Przyczyny
Cennik InviMed Poznań
 Cennik InviMed Poznań In Vitro Pakiet ICSI 7 4 6 700 zł Wizyta kwali kująca do procedury Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) 6 Punkcja jajników (ze znieczuleniem) 1 4 Procedury
Cennik InviMed Poznań In Vitro Pakiet ICSI 7 4 6 700 zł Wizyta kwali kująca do procedury Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) 6 Punkcja jajników (ze znieczuleniem) 1 4 Procedury
Układ kostny jest strukturą żywą, zdolną do:
 FUNKCJE KOŚCI Układ kostny jest strukturą żywą, zdolną do: wzrostu adaptacji naprawy ROZWÓJ KOŚCI przed 8 tyg. życia płodowego szkielet płodu złożony jest z błon włóknistych i chrząstki szklistej po 8
FUNKCJE KOŚCI Układ kostny jest strukturą żywą, zdolną do: wzrostu adaptacji naprawy ROZWÓJ KOŚCI przed 8 tyg. życia płodowego szkielet płodu złożony jest z błon włóknistych i chrząstki szklistej po 8
Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011
 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki,
Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki,
Konferencja prasowa 29 października 2012
 Konferencja prasowa 29 października 2012 Konferencja prasowa 29 października 2012 NAGRODA NOBLA ROBERT GEOFFREY EDWARDS 2010 Nagroda Nobla w dziedzinie medycyny i fizjologii Twórca metody invitro, Laureat
Konferencja prasowa 29 października 2012 Konferencja prasowa 29 października 2012 NAGRODA NOBLA ROBERT GEOFFREY EDWARDS 2010 Nagroda Nobla w dziedzinie medycyny i fizjologii Twórca metody invitro, Laureat
1. Zarys historii embriologii 3 Zarys historii embriologii medycznej w Polsce 13
 Spis treści CZĘŚĆ OGÓLNA 1. Zarys historii embriologii 3 Zarys historii embriologii medycznej w Polsce 13 2. Układ rozrodczy 17 Układ rozrodczy żeński 17 Narządy rozrodcze wewnętrzne 17 Narządy rozrodcze
Spis treści CZĘŚĆ OGÓLNA 1. Zarys historii embriologii 3 Zarys historii embriologii medycznej w Polsce 13 2. Układ rozrodczy 17 Układ rozrodczy żeński 17 Narządy rozrodcze wewnętrzne 17 Narządy rozrodcze
Okres zarodkowy (embrionalny) jest to okres rozwojowy człowieka, który trwa od około szóstego lub ósmego dnia, czyli od momentu
 Pracownia Multimedialna Katedry Anatomii UJ CM Okres zarodkowy (embrionalny) jest to okres rozwojowy człowieka, który trwa od około szóstego lub ósmego dnia, czyli od momentu implantacji zagnieżdżenia
Pracownia Multimedialna Katedry Anatomii UJ CM Okres zarodkowy (embrionalny) jest to okres rozwojowy człowieka, który trwa od około szóstego lub ósmego dnia, czyli od momentu implantacji zagnieżdżenia
Układ rozrodczy. Jądro nasieniowód najądrze. Tkanka łączna tworzy torebkę i przegrody dzielące miąższ na zraziki. Kanalik nasienny
 Jądro nasieniowód najądrze Układ rozrodczy Tkanka łączna tworzy torebkę i przegrody dzielące miąższ na zraziki Kanalik nasienny Zrazik jądra: kanaliki nasienne tkanka łączna śródmiąższowa zawierająca:
Jądro nasieniowód najądrze Układ rozrodczy Tkanka łączna tworzy torebkę i przegrody dzielące miąższ na zraziki Kanalik nasienny Zrazik jądra: kanaliki nasienne tkanka łączna śródmiąższowa zawierająca:
Choroby związane z wygasaniem czynności jajników.
 Choroby związane z wygasaniem czynności jajników. Sytuacja hormonalna przed i po menopauzie Względny hyperestrogenizm - zmiany przerostowe (polipy, mięśniaki, przerost śluzówki macicy, mastopatia) Hypoestrogenizm
Choroby związane z wygasaniem czynności jajników. Sytuacja hormonalna przed i po menopauzie Względny hyperestrogenizm - zmiany przerostowe (polipy, mięśniaki, przerost śluzówki macicy, mastopatia) Hypoestrogenizm
Cennik usług dla kobiet
 Cennik usług dla kobiet Kliniki Zdrowia Kobiety Cena Profesorska Konsultacja kardiologiczna 150 200 Konsultacja urologiczna 150 200 Konsultacja chirurgiczna 150 200 Konsultacja ortopedyczna 150 200 Konsultacja
Cennik usług dla kobiet Kliniki Zdrowia Kobiety Cena Profesorska Konsultacja kardiologiczna 150 200 Konsultacja urologiczna 150 200 Konsultacja chirurgiczna 150 200 Konsultacja ortopedyczna 150 200 Konsultacja
Cennik InviMed Katowice
 Cennik InviMed Katowice In Vitro Pakiet ICSI 6 500 zł Wizyta kwali kująca do procedury Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) 630 zł Punkcja jajników (ze znieczuleniem)
Cennik InviMed Katowice In Vitro Pakiet ICSI 6 500 zł Wizyta kwali kująca do procedury Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) 630 zł Punkcja jajników (ze znieczuleniem)
Wstęp do hiperandrogenizmu. Mateusz Klukowski
 Wstęp do hiperandrogenizmu Mateusz Klukowski Plan prezentacji 1. Źródła androgenów i ich rola w ciele kobiety 2. Zagadnienia związane z tematem hiperandrogenizmu 3. Epidemiologia 4. Objawy 5. Przyczyny
Wstęp do hiperandrogenizmu Mateusz Klukowski Plan prezentacji 1. Źródła androgenów i ich rola w ciele kobiety 2. Zagadnienia związane z tematem hiperandrogenizmu 3. Epidemiologia 4. Objawy 5. Przyczyny
Płodność jako element zdrowia. Problemy z płodnością- przyczyny, diagnostyka, terapia.
 Zadanie finansowane ze środków Narodowego Programu Zdrowia na lata 2016-2020 Płodność jako element zdrowia. Problemy z płodnością- przyczyny, diagnostyka, terapia. Ewa Ślizień Kuczapska Lekarz położnik
Zadanie finansowane ze środków Narodowego Programu Zdrowia na lata 2016-2020 Płodność jako element zdrowia. Problemy z płodnością- przyczyny, diagnostyka, terapia. Ewa Ślizień Kuczapska Lekarz położnik
Układ moczowo-płciowy
 WJ Układ moczowo-płciowy Klasyfikuj prace ogólne dotyczące układu moczowo-płciowego i chorób/zaburzeń układu moczowo-płciowego u dzieci w WS 320-322. Opieka pielęgniarska w chorobach układu moczowo-płciowego
WJ Układ moczowo-płciowy Klasyfikuj prace ogólne dotyczące układu moczowo-płciowego i chorób/zaburzeń układu moczowo-płciowego u dzieci w WS 320-322. Opieka pielęgniarska w chorobach układu moczowo-płciowego
Budowa anatomiczna: macica pochwa jajniki
 Budowa anatoiczna: acica pochwa jajniki Jajniki: okres płodowy forowanie pęcherzyków pierwotnych zatrzyanie podziału ejotycznego koórki jajowej okres dojrzałości płciowej rekrutacja selekcja dojrzewanie
Budowa anatoiczna: acica pochwa jajniki Jajniki: okres płodowy forowanie pęcherzyków pierwotnych zatrzyanie podziału ejotycznego koórki jajowej okres dojrzałości płciowej rekrutacja selekcja dojrzewanie
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 177/2015 z dnia 16 października 2015 r. o projekcie programu polityki
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 177/2015 z dnia 16 października 2015 r. o projekcie programu polityki
Genetyczna determinacja płci u człowieka i jej zaburzenia Prof. dr hab. med. Maciej Krawczyński Katedra i Zakład Genetyki Medycznej UMP
 Genetyczna determinacja płci u człowieka i jej zaburzenia Prof. dr hab. med. Maciej Krawczyński Katedra i Zakład Genetyki Medycznej UMP Historia badań nad determinacją i różnicowaniem płci lata 40. XX
Genetyczna determinacja płci u człowieka i jej zaburzenia Prof. dr hab. med. Maciej Krawczyński Katedra i Zakład Genetyki Medycznej UMP Historia badań nad determinacją i różnicowaniem płci lata 40. XX
Algorytmy diagnostyczno-lecznicze w zastosowaniu do niepłodności rekomendacje PTMR
 Algorytmy diagnostyczno-lecznicze w zastosowaniu do niepłodności rekomendacje PTMR { Autorzy: Prof. Leszek Bablok Warszawski Uniwersytet Medyczny, I Katedra i Klinika Położnictwa i Ginekologii Prof. Mariusz
Algorytmy diagnostyczno-lecznicze w zastosowaniu do niepłodności rekomendacje PTMR { Autorzy: Prof. Leszek Bablok Warszawski Uniwersytet Medyczny, I Katedra i Klinika Położnictwa i Ginekologii Prof. Mariusz
SCENARIUSZ ZAJĘĆ Z WYCHOWANIADO ŻYCIAW RODZINIE UCZNIÓW SZKOŁY PONADGIMNAZJALNEJ. Temat: FIZJOLOGIA PŁODNOŚCI
 SCENARIUSZ ZAJĘĆ Z WYCHOWANIADO ŻYCIAW RODZINIE DLA UCZNIÓW SZKOŁY PONADGIMNAZJALNEJ Treści: fizjologia układu płciowego człowieka, fazy cyklu miesiączkowego kobiety, owulacja, fazy płodności i niepłodności
SCENARIUSZ ZAJĘĆ Z WYCHOWANIADO ŻYCIAW RODZINIE DLA UCZNIÓW SZKOŁY PONADGIMNAZJALNEJ Treści: fizjologia układu płciowego człowieka, fazy cyklu miesiączkowego kobiety, owulacja, fazy płodności i niepłodności
Biologia. Klasa VII. Prywatna Szkoła Podstawowa i Gimnazjum im. Z. I J. Moraczewskich w Sulejówku
 Biologia 2017 Klasa VII Dział I : HIERARCHICZNA BUDOWA ORGANIZMU CZŁOWIEKA, SKÓRA, UKŁAD RUCHU 1. Organizm człowieka jako zintegrowana całość 2. Budowa i funkcje skóry 3. Choroby skóry oraz zasady ich
Biologia 2017 Klasa VII Dział I : HIERARCHICZNA BUDOWA ORGANIZMU CZŁOWIEKA, SKÓRA, UKŁAD RUCHU 1. Organizm człowieka jako zintegrowana całość 2. Budowa i funkcje skóry 3. Choroby skóry oraz zasady ich
Dr hab. n. med. Aneta Gawlik
 Dr hab. n. med. Aneta Gawlik Katedra i Klinika Endokrynologii i Pediatrii SUM Dr hab. n. med. Iwona Maruniak- Chudek Klinika Intensywnej Terapii i Patologii Noworodka SUM Konsultant wojewódzki ds. Neonatologii
Dr hab. n. med. Aneta Gawlik Katedra i Klinika Endokrynologii i Pediatrii SUM Dr hab. n. med. Iwona Maruniak- Chudek Klinika Intensywnej Terapii i Patologii Noworodka SUM Konsultant wojewódzki ds. Neonatologii
SPIS TREŚCI. CZĘŚĆ PIERWSZA Podstawy histologii. CZĘŚĆ DRUGA Podstawy anatomii i fizjologii człowieka. Przedmowa 11 Wykaz skrótów 13
 SPIS TREŚCI Przedmowa 11 Wykaz skrótów 13 CZĘŚĆ PIERWSZA Podstawy histologii I. TKANKI CZŁOWIEKA (dr Joanna Kaźmierczak) 17 1. Tkanka nabłonkowa 17 1.1. Nabłonek pokrywający 18 1.2. Nabłonek gruczołowy
SPIS TREŚCI Przedmowa 11 Wykaz skrótów 13 CZĘŚĆ PIERWSZA Podstawy histologii I. TKANKI CZŁOWIEKA (dr Joanna Kaźmierczak) 17 1. Tkanka nabłonkowa 17 1.1. Nabłonek pokrywający 18 1.2. Nabłonek gruczołowy
