9. Odstępstwa od składu stechiometrycznego i defekty w tlenku niklu Tlenek niklu, podobnie jak szereg innych tlenków metali przejściowych, zaliczamy
|
|
|
- Stanisław Morawski
- 8 lat temu
- Przeglądów:
Transkrypt
1 9. Odstępstwa od składu stechiometrycznego i defekty w tlenku niklu Tlenek niklu, podobnie jak szereg innych tlenków metali przejściowych, zaliczamy do bertolidów, to jest związków, których skład chemiczny może się zmieniać w pewnym zakresie. Tlenek niklu charakteryzuje się niedomiarem metalu w stosunku do tlenu, a jego wzór można wyrazić jako Ni 1-x O. W tlenku niklu, w zależności od warunków syntezy, obecna jest pewna liczba węzłów sieciowych nie obsadzonych przez kationy (wakancje). Wakancja kationowa oznaczona symbolem V Ni formalnie ma ładunek ujemny (brak w sieci dwóch elementarnych ładunków dodatnich jonu Ni 2+ ). Ze względu na konieczność zachowania elektroobojętności sieci przestrzennej w chwili tworzenia się wakancji kationowej pojawiają się dwa dodatnie ładunki elementarne (dziury elektronowe), zlokalizowane na kationach niklu. Czyli dwa jony Ni 3+, oznaczone symbolem h. Wprowadzenie nadmiaru tlenu do sieci stechiometrycznego NiO możemy przedstawić w symbolice Krogera Vinka następującym równaniem: ½ O 2(g) = O o + V Ni + 2 h (1) Symbol O o oznacza atom tlenu w pozycji anionowej, wykazujący normalny w danym przypadku ładunek, to znaczy jon O 2-. Odstępstwo od stechiometrii w tlenku niklu możemy wykryć na drodze analitycznej, posługując się metodą Bunsena Ruppa, która pozwala na określenie stężenia Ni 3+. Oprócz defektów powodujących odstępstwa od składu ściśle stechiometrycznego w tlenku niklu i innych tlenkach mogą występować defekty zwane defektami Schottk ego. Defekty takie powstają na skutek pojawienia się równych liczb wakancji kationowych i anionowych, dzięki czemu skład fazy stałej nie ulega zmianie. Celem niniejszego ćwiczenia jest zapoznanie się z defektami i odstępstwami od stechiometrii w ciałach stałych na przykładzie tlenku niklu. Zakres materiału naukowego Reakcja rozkładu ciał stałych. Bertolidy i daltonidy. Kryształy rzeczywiste i chemia defektów (defekty Schottky ego i Frenkla). Obowiązująca literatura 1. Bielański A.: Podstawy chemii nieorganicznej, Wydawnictwo Naukowe PWN, Warszawa 2002, rozdz Williams A.F.: Chemia nieorganiczna. Podstawy teoretyczne, PWN, Warszawa 1986, rozdz
2 3. Dereń J., Haber J., Pampuch R.: Chemia ciała stałego, PWN, Warszawa 1975, cz. II, rozdz i 10.1; cz. IV, rozdz. 17. Odczynniki naczynia i przyrządy Ni(NO 3 ) 2 6 H 2 O, NH 4 HCO 3, FeSO 4, I 2 (przesublimowany), HCl stęż., 0,01 mol/dm 3 Na 2 S 2 O 3 (mianowany), KI (3 %), roztwór skrobii, CCl 4, metanol, 2 zlewki (0,5 dm 3 ), 2 szalki Petriego, słoiczki zamykane (250 i 100 cm 3 3 szt), mikrobiureta, ultrawirówka, zestaw do oznaczania tlenu nadmiarowego metodą Bunsena Ruppa, butla z azotem, eksykator. Sposób wykonania Otrzymywanie tlenku niklu * 50 g Ni(NO 3 ) 2 6 H 2 O rozpuścić w 100 cm 3 wody, podgrzać do ok. 60 o C i zadawać powoli, stale mieszając, nasyconym roztworem NH 4 HCO 3. Roztworu węglanu należy dodawać do momentu, aż ciecz nad osadem stanie się bezbarwna. Otrzymany osad zasadowego węglanu niklu przemyć kilkakrotnie wodą, najpierw przez dekantację, a następnie przez wirowanie, aż do zaniku reakcji na jon NO 3 -. Ostatnie przemycie wykonać metanolem. Osad przenieść do szalki Petriego, pozostawić na powietrzu do wyschnięcia, a następnie utrzeć w moździerzu i przesypać do słoika. Tlenek niklu otrzymuje się przez termiczny rozkład zasadowego węglanu niklu. W tym celu otrzymany zasadowy węglan niklu podzielić na trzy części, przenieść do parownicy i prażyć w piecu według następującego schematu. Część I: 1 godz w 300 o C 3 godz w 400 o C. Część II: 1 godz w 300 o C 3 godz w 500 o C. Część III: 1 godz w 300 o C 3 godz w 900 o C. Otrzymane preparaty rozetrzeć w moździerzu i przechowywać w szczelnie zamkniętych słoikach w eksykatorze. Wyznaczanie odstępstw od ściśle stechiometrycznego składu NiO Tlen nadmiarowy oznacza się jodometrycznie metodą Bunsena Ruppa. Próbkę rozpuszcza się we wrzącym kwasie solnym. Jony Ni 3+ obecne w próbce ulegają wówczas reakcji Ni 3+ + Cl - = Ni 2+ + ½ Cl 2 (2) * Ze względu na długotrwałe prażenie można tę część ćwiczenia opuścić dostarczając studentom gotowych, przygotowanych wcześniej preparatów. 2
3 Wydzielony w czasie reakcji chlor wprowadza się do roztworu jodku potasu Cl 2 + KI = 2 KCl + I 2 (3) Jod wyparty działaniem chloru oznacza się przez miareczkowanie 0,02 mol/dm 3 tiosiarczanem sodowym I Na 2 S 2 O 3 = 2 NaI + Na 2 S 4 O 6 (4) Zakładając, że dwa jony Ni 3+ odpowiadają jednemu atomowi tlenu nadmiarowego, obliczyć tlen nadmiarowy. Pomiar wykonuje się za pomocą zestawu przedstawionego na rysunku 9.1. Rys. 9.1 Zestaw pomiarowy w metodzie Bunsena-Ruppa Do odbieralnika (4) nalać ¾ objętości 3 % roztworu jodku potasu. Do kolby (1), zdejmując szlif (2), wprowadzić za pomocą lejka z długą nóżką około 0,05 g badanego preparatu, a następnie 10 cm 3 HCl (1:1), Szybko zamknąć układ i przepuszczać N 2 (ewentualnie CO 2 ), ogrzewając równocześnie roztwór do wrzenia. Po całkowitym rozpuszczeniu preparatu ogrzewać jeszcze roztwór przez 2-3 min, następnie wyjąć rurkę (3) z odbieralnika i spłukać wodą destylowaną. Zawartość odbieralnika przenieść ilościowo do erlenmajerki i natychmiast miareczkować 0,01 mol/dm 3 Na 2 S 2 O 3 w obecności skrobi jako wskaźnika (sprawdzić uprzednio miano 0,01 mol/dm 3 Na 2 S 2 O 3, stosując jod jako substancję podstawową). Wykonać pomiar tlenu nadmiarowego dla każdego preparatu 2 razy i wyniki zestawić w tabeli 9.1 3
4 Tabela 9.1 Wyniki pomiaru tlenu nadmiarowego Temp. kalcynacji [ o C] m 1 [g] 400 v (Na 2 S 2 O 3 ) [cm 3 ] Pomiar I Tlen nadmiarowy [% atomowy] m 1 [g] v (Na 2 S 2 O 3 ) [cm 3 ] Pomiar II Tlen nadmiarowy [% atomowy] Średnia [% atomowy] Opracowanie wyników 1. Podaj równanie całkowitego rozkładu zasadowego węglanu niklu oraz oblicz procentowy ubytek masy. 2. Naszkicuj dwuwymiarowy schemat struktury NiO, uwzględniając istnienie doświadczalnie stwierdzonych defektów. 3. Wyjaśnij zmiany zabarwienia preparatów w zależności od temperatury kalcynacji. 4. Wyjaśnij wpływ temperatury kalcynacji zasadowego węglanu niklu na zdefektowanie NiO. 5. Podaj przykład związku, w którym obserwuje się: a) defekty Schottk ego, b) defektu Frenkla. Narysuj dwuwymiarowy schemat ilustrujący powstawanie tych defektów. 4
5 Komentarz do ćwiczenia nr 9. Stefan Witkowski 1. Trochę historii Idee atomu (Demokryt), cząsteczki (S. Basson, I. Beeckman, P. Gassendi; XVII w.) oraz prawo stosunków stałych (J. Proust XIX w) formowały stopniowo podstawy dzisiejszego rozumienia chemii. Chemikom działającym okresie XVIII i XIX wieku, gdy chemia powstawała jako nauka a później konsolidowała swoje podstawy, udało się zidentyfikować bardzo wiele związków chemicznych oraz określić poprawnie ich skład. Wraz z rozwojem chemii poznawano także coraz więcej substancji nie spełniających prawa stosunków stałych. Nie można im było przypisać wzoru stechiometrycznego w którym współczynnikami byłyby (tak jak to jest zazwyczaj) małe liczby naturalne. Ponieważ nie powiodły się próby rozdzielenia takich substancji na kilka prawidłowych związków chemicznych stworzono dla nich oddzielną grupę: bertolidów. Poprawne związki chemiczne spełniające prawo stałości składu nazwano zaś daltonidami. 2. Wojna daltonidów z bertolidami Wprowadzenie podziału na daltonidy i bertolidy było przyznaniem się ówczesnego przyrodoznawstwa do braku zrozumienia budowy materii, a w szczególności ciała stałego. Nazwy takie jak związek niestechiometryczny czy odstępstwa od stechiometryczności nie tłumaczą istoty sprawy, a co najwyżej drażnią czytelnika. Sugerują istnienie związków chemicznych, w których dopuszczalna byłaby ułamkowa ilość wiązań chemicznych wychodzących z jednego atomu! A taka sytuacja byłaby całkowicie niezgodna ze współczesnym rozumieniem chemii. 3. Zjawiska kolektywne prowadzą do nowych zależności Aby wyjaśnić z czym naprawdę mamy do czynienia przyglądnijmy się sprawie nieco bliżej. To co określono jako związki niestechiometryczne to ciała stałe o budowie krystalicznej. Tlenki metali przejściowych są typowymi przedstawicielami związków niestechiometrycznych. Niestechiometria pojawia się jako skutek odstępstwa od idealnej budowy kryształu. Rozważmy popularny związek chemiczny M jakim jest sól kuchenna (NaCl). Tworzy ona kryształy dobrze rozpuszczalne w wodzie. Chlorek sodu w roztworze obecny jest w postaci jonów. W krysztale zostaje to zachowane. Mamy zatem kryształ jonowy, w którym nie możemy ani wyróżnić odrębnych cząsteczek ani wyróżnić wiązań M
6 pomiędzy poszczególnymi jonami. Cały kryształ należy traktować jak jedną kolektywną makro-molekułę. Elementami tej molekuły są jony rozmieszczone periodycznie w przestrzeni tak aby spełniały warunek elektroobojętności zarówno lokalnie jak i globalnie. 4. Warunek elektroobojętności Stabilne istnienie w czasie ciała stałego o wymiarach makroskopowych wymaga aby suma ładunków dodatnich była równa sumie ładunków ujemnych globalnie w obrębie tego ciała. Gdy przechodzimy do rozmiarów molekularnych, warunek elektroobojętności przedstawia się w sposób następujący: gdy sumujemy po możliwie najbliższym otoczeniu wybranego elementu (atomu, jonu, wakancji etc...) ładunek wypadkowy również ma wynosić zero, z tym, że jak pokazuję to poniżej, warunek ten modyfikowany jest przez termodynamikę, która w temperaturach większych od zera bezwzględnego dopuszcza odstępstwa od ścisłego wymogu lokalnej obojętności. 5. Defekty w kryształach, wyjątek czy reguła Spróbujmy oszacować prawdopodobieństwo wystąpienia defektów w strukturze kryształu. Zrobimy to dla najprostszego przypadku. Weźmy kryształ składający się z atomów jednego rodzaju (np. metal). Rozważmy możliwość wystąpienia wakancji (wakancje nie zmieniają ładunku kryształu, a do spowodowania ich obecności nie są konieczne oddziaływania z fazą gazową otaczającą kryształ). Z termodynamiki wiemy, że entalpia swobodna układu jest dana wzorem G=H-TS gdzie T jest temperaturą w skali Kelvina, a H i S entalpią i entropią układu. Jeśli układ pozostaje w równowadze w określonych warunkach temperatury i ciśnienia wówczas jego entalpia swobodna osiąga minimum. A to oznacza zerowanie wyrażenia: dg T,p =0 Niechaj nasz idealny kryształ składa się z N identycznych atomów w pozycjach węzłowych. Gdy w naszym krysztale powstanie n defektów (tu konkretnie wakancji) zmiana entalpii swobodnej G możezostać zapisana jako G = n H T S gdzie H to entalpia tworzenia jednej wakancji, a S to zmiana entropii związana z tym procesem. S składa się z dwóch przyczynków: entropii konfiguracyjnej i wibracyjnej. S config jest związana z dystrybucją n wakancji wśród N+n pozycji strukturalnych. S vib spowodowana jest przez zmianę symetrii drgań atomów sąsiadujących z wakancją. Ograniczenie rozważań do niezbyt wysokich temperatur (do ok K) pozwala pominąć człon entropii elektronowej a entropia związana z rotacją nie może wystąpić bo atomy są sferycznie symetryczne. A zatem G = n( H T S ) T vibr S config S config możemy przedstawić jako S config =klnw, zaś k jest w powyższym wzorze stałą Boltzmann a. W jest prawdopodobieństwem termodynamicznym, określa się je jako ilość sposobów na jakie można rozmieścić n wakancji pośród N+n możliwych pozycji strukturalnych. ( N + n)! W = N! n! Ponieważ zarównonjakinsądużymi liczbami możemy użyć przybliżenia Stirlinga do obliczenia lnw (lnx!=xlnx-x). Po jego zastosowaniu otrzymujemy: N n S = k( N ln + nln ) config N + n N + n
7 W warunkach równowagi termodynamicznej G osiąga minimum dla pewnej ilości defektów. G n = H T Svibr + kt ln = 0 n N + n Wyrażenie pod logarytmem (n/n+n) określa udział (stężenie) wakancji w krysztale. Ponieważ celem tych przekształceń było zorientowanie się w zależności udziału wakancji od temperatury, następnym krokiem jest pozbycie się logarytmu. n Svibr H = exp( ) exp( ) N + n k kt W powyższym wzorze S vib oraz H oznaczają zmianę entropii wibracyjnej i zmianę entalpii tworzenia pojedynczej wakancji. Pierwszy człon eksponencjalny jest w przybliżeniu stały, drugi jest jawnie zależny od temperatury. Gdy (tak jak założyliśmy wcześniej) tworzenie wakancji zachodzi bez oddziaływania z fazą gazową, to H tego prcesu jest zawsze większe od zera (wyrwanie atomu z jego miejsca w krysztale wymaga dostarczenia pracy). W takiej sytuacji stężenie wakancji jest niezerowe w każdej temperaturze T>0 i rośnie wrazze wzrostem temperatury. Oznacza to, że populacja wakancji w sieci metalu powinna być zauważalna w temperaturach zbliżonych do temperatury pokojowej. W tych warunkach pozostałe rodzaje defektów są dość pospolicie obecne w ciałach stałych choć szczegółowe zależności stężenia od warunków mogą się znacznie różnić od przedstawionego wyżej. W skomplikowanych przypadkach takich jak tlenek niklu łatwiej dokonać pomiaru. 6. Notacja Krögera-Vinka Notacja Krögera-Vinka stosowana do opisu defektów w kryształach wprowadza oznaczenia dla jonów, atomów i pseudocząstek w rozmaitych pozycjach strukturalnych. W tlenku MO kationy metalu zajmujące właściwe pozycje kationowe oznaczane są M M, analogicznie jony tlenu we właściwych pozycjach anionowych O O. Wakancje są oznaczane V z indeksem oznaczającym typ pozycji strukturalnej (V M, V O ). Ładunek elementu strukturalnego określa się względem idealnego kryształu. Jon O 2- w pozycji anionowej jest zatem zapisywany jako neutralny względem sieci. Aniony, kationy, wakancje których ładunek odpowiada danej pozycji strukturalnej oznaczamy górnym indeksem x, (M M x,o O x,v O x ). Zauważmy, że wakancja rozumiana jako całkiem puste miejsce po dwudodatnim kationie (V M ) jest dwuujemnie naładowana względem sieci. Ładunek względem sieci oznaczany jest nie przez + i lecz przez kropkę i apostrof. V O oznacza miejsce po jonie tlenkowym gdzie pozostał tylko jeden elektron, czyli wakancję jednododatnią w stosunku do sieci. Jony z niedomiarem elektronów względem sieci można oznaczać jako dziury elektronowe (h), na przykład M M oznaczamy jako h. Atomy, jony lub miejsca międzywęzłowe oznaczane są dolnym indeksem i. 7. Rodzaje defektów w tlenkach Jak łatwo zauważyć omówiony powyżej prosty przypadek wakancji w sieci metalu nie miał związku z tworzeniem niestechiometryczności, nie uwzględniał bowiem oddziaływnia z fazą gazową. Generalnie defekty w tlenkach możemy podzielić na stechiometryczne i niestechiometryczne. Poniżej zestawiono rodzaje defektów stechiometrycznych wykryte w realnych układach fizycznych. Dwa pierwsze są bardzo popularne, pozostałe cztery znane występują rzadko.
8 8. Defekty stechiometryczne 1. (VM+VO) defekt polega na jednoczesnej obecności wakancji kationowych i anionowych. Jest to tak zwany defekt Schottkiego. MI VM.. VO.. VM 2. Defekt charakeryzuje się obecnością wakancji i jonów międzywęzłowych tego samego rodzaju: (VM+MI) lub (VO+OI) lub ich kombinacji. Jest to defekt Frenkla. 3. Defekt typu (OM+MO). Powstaje, gdy dochodzi do podmiany atomów w strukturze, metal zajmuje miejsce w podsieci anionowej, tlen w kationowej. OM MO VM 4. Defekt polegający na obecności dla tego samego jonu jednocześnie: wakancji i podmienionych atomów: (VM+MO)
9 5. W tym rodzaju defektów występują atomy tego samego rodzaju przemieszczone do pozycji międzywęzłowych i podmienione: (OI+MO). OI MO OI 6. Ten rodzaj defektów tworzą jony lub atomy międzywęzłowe: (MI+OI). MI 9. Defekty niestechiometryczne Jeśli stechiometryczny tlenek poddamy działaniu warunków redukujących lub utleniających zaczną w jego strukturze zachodzić zmiany związane z osiąganiem nowej równowagi termodynamicznej. Gdy impuls jest stosunkowo słaby, lub czas działania zbyt krótki, nie dochodzi jeszcze do powstania nowej fazy będącej w równowadze termodynamicznej. Jednak utlenione lub zredukowane są pojedyncze jony lub atomy w sieci kryształu. Ich obecność zmienia ilość nośników ładunku obecnych w sieci. Aby zachować elektroobojętność kryształ lokalnie przebudowuje się. Warto zauważyć analogię pomiędzy systemem defekty/kryształ, a układem substancja rozpuszczona/rozpuszczalnik. W odpowiednich warunkach temperatury i ciśnienia defekty są mobilne podobnie jak jonu w roztworze. Jeśli stężenie defektów wzrośnie powyżej wartości krytycznej, zapoczątkowane zostają zmiany strukturalne których końcem jest powstanie moakroskopowych fragmentów nowej fazy korzystaniejszej termodynamicznie. Poniżej zestawione zostały w formie rysunków cztery (spośród wielu) typów niestechiometrycznych defektów punktowych.
10 10 Przypadek tlenku z deficytem metalu (tlenek nadmiernie utleniony) Obydwa przedstawione tu defekty możemy obserwować w tlenkach typu MO. W pierwszym przypadku (rysunek po prawej obok) powstaniu wakancji kationowej towarzyszą dwie mobilne dziury elektronowe ( ). Należy oczekiwać dobrego przewodnictwa dziurowego zwłaszcza w podwyższonych temperaturach. VM W drugim przypadku (rysunek po lewej) powstaje zlokalizowany kompleks obejmujący kation międzywęzłowy oraz dwie wakancje kationowe. Nie należy więc oczekiwać dobrego przewodnictwa elektrycznego. VM 11 MI VM Przypadek tlenku z deficytem tlenu (tlenek nieco zredukowany) W obu przypadkach przedstawiono defekty w sieci typu MO2. Na rysunku po prawej mamy wakancję anionową i towarzyszące jej dwa zredukowane jony metalu. Tlenek może wykazywać dobre przewodnictwo elektronowe ze względu na mobilność quasi-swobodnych elektronów przeskakujących pomiędzy kationami... MI VO.. Przypadek przedstawiony po lewej stronie jest prawie identyczny z poprzednim, z tym, że zamiast wakancji anionowej zawiera kation międzywęzłowy.
11 12. Reakcje prowadzące do niestechiometryczności W stechiometrycznym tlenku niklu wystawionym na działanie powietrza dochodzi do szeregu procesów rozpoczynających się adsorpcją cząsteczki tlenu na powierzchni tlenku niklu. O 2gaz O 2ads Następnym procesem jest dysocjacja pewnej części zaadsorbowanego tlenu na atomy. Jest to proces wymagający dostarczenia energii. Oddziaływanie zaadsorbowanego tlenu z powierzchnią ułatwia dysocjację tlenu (obniża energię aktywacji procesu dysocjacji). O 2ads 2O ads W dalszej kolejności atomy tlenu dobudowują się do podsieci tlenkowej kryształu i zmieniają się w jony tlenu. W tym procesie miejsca na powierzchni, które powinny być zajęte przez jony metalu pozostają puste. A zatem zostają wykreowane wakancje kationowe o formalnym ładunku 2+ (zgodnym z ładunkiem jonu niklu w normalnym położeniu strukuralnym). Podsumowując: skutkiem przyłączenia n atomów tlenu jest przyrost kryształu o 2n pozycji strukturalnych, połowa z nich to pozycje anionowe (zajęte), druga połowa to pozycje kationowe (puste). O ads V x M +O o W zapisie powyżej V x M oznacza wakancję w pozycji kationowej o takim samym ładunku jak nieobecny kation (w tym przypadku 2+). Ładunek przypisany wakancji ma charakter formalny i wynika z konieczności zapewnienia elektroobojętności systemu. W rzeczywistym układzie takim jak tlenek niklu, źródłem ładunku dodatniego musi być to samo indywiduum które przekazało do atomów tlenu elektrony pozwalając imstać się jonami tlenkowymi. W rozważanym układzie istnieje tylko jeden rodzaj dawcy, są nim jony niklu (II) obecne w podsieci kationowej (M x M ). Poprawiając sztuczny zapis możemy zatem napisać: V x M =V M + 2M M O ads V M + 2M M +O o lub O ads V M + 2h +O o Zapis ten należy rozumieć wnastępujący sposób. Aby tlen atomowy stał się jonem tlenkowym O o w nowoutworzonej warstwie podsieci anionowej i aby mu towarzyszyła wakancja kationowa pozbawiona ładunku V M (wiec dwu-ujemna w stosunku do podsieci kationowej) potrzeba powstania dwu dziur elektronowych 2h czyli jonów niklu (III) (M M ). Informacje uzupełniająceotlenkuniklu Apendix 1 Tlenek niklu badano intensywnie w pięćdziesiątych i sześćdziesiątych latach ubiegłego stulecia. Między innymi określono: budowę kryształu: NiO ma strukturę NaCl. sposób terminacji kryształu: powierzchnia kryształów tlenku niklu będąca w kontakcie z fazą gazową terminowana jest zawsze warstwą jonów tlenu przewodnictwo: NiO jest półprzewodnikiem typu p. stechiometrię i odstępstwa od niej: NiO jest stechiometryczny tylko gdy tlenek niklu pozostaje w kontakcie z metalicznym niklem (warstwa NiO na Ni). W innych przypadkach (a zwłaszcza przy ciśnieniu parcjalnym tlenu większym od 10-3 atm.) jest tlenkiem z deficytem metalu. rodzaje mobilnych indywiduów obecnych w NiO: atomy tlenu, atomy niklu oraz wakancje kationowe V Ni
12 entalpię tworzenia wakancji kationowych V Ni w przybliżeniu równą 18 kcal/mol 1 na podstawie zależności temperaturowych energie aktywacji następujących procesów: dyfuzji tlenu (57.5 kcal/mol), dyfuzji niklu (56 kcal/mol) 2, dyfuzji wakancji kationowych (5 kcal/mol) Apendix 2 Próbki tlenku niklu, badane w trakcie ćwiczenia 9 pochodzą z rozkładu zasadowego węglanu niklu. W trakcie rozkładu trwającego kilka godzin i prowadzonego w atmosferze powietrza krystality zasadowego węglanu niklu uwalniają wodę i dwutlenek węgla. Wraz z rozpadem struktury węglanu zachodzi tworzenie struktury tlenku. Stopniowo powstają klastery tlenku, które następnie rozrastają się w duże kryształy. Im kryształ mniejszy tym większy jest jego ważniejszą rolę w jego budowie i stechiometrii odgrywa jego powierzchnia. Apendix 3 Aby stwierdzić czy otrzymane wyniki pomiaru stężenia dziur elektronowych w NiO są kontrolowane przez równowagę termodynamiczną, można porównać je z oryginalnymi wynikami pochodzącymi z Tretyakov a i Rapp a. Wyniki te otrzymano w warunkach równowagi termodynamicznej. Dla porównania najwygodniej będzie posłużyć się wykresem Arrheniusa (szczegóły konstrukcji w przypisie nr 1). Wyniki podane są parami (temp. w st. Celsjusza; wartość ywni y O). (840; 9.7x10-5 ), (890; 23x10-5 ), (960; 28x10-5 ), (990; 36x10-5 ), (1040; 42x10-5 ), (1090; 50x10-5 ) Zakończenie Defekty punktowe są mobilne, migrując wewnątrz kryształu niekiedy spotykają się. Takie spotkania mogą kończyć się anihilacją defektów punktowych. Zamiast tego powstają defekty liniowe lub płaszczyznowe (np. płaszczyzny ścinania), które stanowią ziarno nowej bardziej dopasowanej termodynamicznie fazy. Ale, jak zwykł był mawiać Rudyard Kipling, to już zupełnie inna bajeczka. Opracowane na podstawie: A. Bielański; Podstawy chemii nieorganicznej, wyd. 4, PWN, JDereń, J. Haber, R. Pampuch; Chemia ciała stałego, PWN, P. Kofstad; Nonstoichiometry, diffusion and electrical conductivity in binary metal oxides, Wiley-Interscience, H. Schmalzried; Solid State Reactions, 2 nd edition 1981, Verl. Chem., Monographs in Modern Chemistry vol Tlenek niklu prażono w zakresie temperatur o C w powietrzu. Po ustaleniu równowagi termodynamicznej (ok. 1 h) próbkę gwałtownie chłodzono a stężenie wakancji oznaczano metodą Ruppa. Do wyznaczenia entalpii tworzenia posłużono się równaniem Arrheniusa. Wykonywano wykres gdzie na osi rzędnych odkładano logarytm z wartości y ze wzoru Ni (1-y) O, zaś na osi odciętych absolutną temperaturę odwrotną (10 4 /T). 2 Nie jest jasne czy w sieci dyfundowały jony czy atomy.
7. Defekty samoistne Typy defektów Zdefektowanie samoistne w związkach stechiometrycznych
 7. Defekty samoistne 7.1. Typy defektów Zgodnie z trzecią zasadą termodynamiki, tylko w temperaturze 0[K] kryształ może mieć zerową entropię. Oznacza to, że jeśli temperatura jest wyższa niż 0[K] to w
7. Defekty samoistne 7.1. Typy defektów Zgodnie z trzecią zasadą termodynamiki, tylko w temperaturze 0[K] kryształ może mieć zerową entropię. Oznacza to, że jeśli temperatura jest wyższa niż 0[K] to w
Związek rzeczywisty TiO TiO x 0.65<x<1.25 TiO 2 TiO x 1.998<x<2.0 VO VO x 0.79<x<1.29 MnO Mn x O 0.848<x<1.0 NiO Ni x O 0.999<x<1.
 8. Defekty chemiczne 8.1. Związki niestechiometryczne Na poprzednich zajęciach rozważaliśmy defekty punktowe, powstałe w związkach stechiometrycznych. Niestety, rzeczywistość jest dużo bardziej złożona
8. Defekty chemiczne 8.1. Związki niestechiometryczne Na poprzednich zajęciach rozważaliśmy defekty punktowe, powstałe w związkach stechiometrycznych. Niestety, rzeczywistość jest dużo bardziej złożona
Nauka o Materiałach Wykład II Monokryształy Jerzy Lis
 Wykład II Monokryształy Jerzy Lis Treść wykładu: 1. Wstęp stan krystaliczny 2. Budowa kryształów - krystalografia 3. Budowa kryształów rzeczywistych defekty WPROWADZENIE Stan krystaliczny jest podstawową
Wykład II Monokryształy Jerzy Lis Treść wykładu: 1. Wstęp stan krystaliczny 2. Budowa kryształów - krystalografia 3. Budowa kryształów rzeczywistych defekty WPROWADZENIE Stan krystaliczny jest podstawową
Praca objętościowa - pv (wymiana energii na sposób pracy) Ciepło reakcji Q (wymiana energii na sposób ciepła) Energia wewnętrzna
 Energia - zdolność danego układu do wykonania dowolnej pracy. Potencjalna praca, którą układ może w przyszłości wykonać. Praca wykonana przez układ jak i przeniesienie energii może manifestować się na
Energia - zdolność danego układu do wykonania dowolnej pracy. Potencjalna praca, którą układ może w przyszłości wykonać. Praca wykonana przez układ jak i przeniesienie energii może manifestować się na
CHEMIA DEFEKTÓW PUNKTOWYCH, CZ. I NIEDOSKONAŁOŚCI BUDOWY CIAŁA STAŁEGO
 CHEMIA DEFEKTÓW PUNKTOWYCH, CZ. I NIEDOSKONAŁOŚCI BUDOWY CIAŁA STAŁEGO KRYSZTAŁY RZECZYWISTE - NIEDOSKONAŁOŚCI BUDOWY CIAŁA STAŁEGO źródła defektów w ciałach stałych i ich klasyfikacja, trwałość termodynamiczna
CHEMIA DEFEKTÓW PUNKTOWYCH, CZ. I NIEDOSKONAŁOŚCI BUDOWY CIAŁA STAŁEGO KRYSZTAŁY RZECZYWISTE - NIEDOSKONAŁOŚCI BUDOWY CIAŁA STAŁEGO źródła defektów w ciałach stałych i ich klasyfikacja, trwałość termodynamiczna
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
Elektrolity wykazują przewodnictwo jonowe Elektrolity ciekłe substancje rozpadające się w roztworze na jony
 Elektrolity wykazują przewodnictwo jonowe Elektrolity ciekłe substancje rozpadające się w roztworze na jony Przewodniki jonowe elektrolity stałe duża przewodność jonowa w stanie stałym; mały wkład elektronów
Elektrolity wykazują przewodnictwo jonowe Elektrolity ciekłe substancje rozpadające się w roztworze na jony Przewodniki jonowe elektrolity stałe duża przewodność jonowa w stanie stałym; mały wkład elektronów
Zadanie 2. (1 pkt) Uzupełnij tabelę, wpisując wzory sumaryczne tlenków w odpowiednie kolumny. CrO CO 2 Fe 2 O 3 BaO SO 3 NO Cu 2 O
 Test maturalny Chemia ogólna i nieorganiczna Zadanie 1. (1 pkt) Uzupełnij zdania. Pierwiastek chemiczny o liczbie atomowej 16 znajduje się w.... grupie i. okresie układu okresowego pierwiastków chemicznych,
Test maturalny Chemia ogólna i nieorganiczna Zadanie 1. (1 pkt) Uzupełnij zdania. Pierwiastek chemiczny o liczbie atomowej 16 znajduje się w.... grupie i. okresie układu okresowego pierwiastków chemicznych,
Instrukcja dla uczestnika
 II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
Procentowa zawartość sodu (w molu tej soli są dwa mole sodu) wynosi:
 Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Opracował: dr inż. Tadeusz Lemek
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Małopolski Konkurs Chemiczny dla Gimnazjalistów
 Kod ucznia Małopolski Konkurs Chemiczny dla Gimnazjalistów Etap wojewódzki 5 marca 2013 roku Wypełnia wojewódzka komisja konkursowa Zadanie Liczba punktów Podpis oceniającego Liczba punktów po weryfikacji
Kod ucznia Małopolski Konkurs Chemiczny dla Gimnazjalistów Etap wojewódzki 5 marca 2013 roku Wypełnia wojewódzka komisja konkursowa Zadanie Liczba punktów Podpis oceniającego Liczba punktów po weryfikacji
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Transport jonów: kryształy jonowe
 Transport jonów: kryształy jonowe JONIKA I FOTONIKA MICHAŁ MARZANTOWICZ Jodek srebra AgI W 42 K strukturalne przejście fazowe I rodzaju do fazy α stopiona podsieć kationowa. Fluorek ołowiu PbF 2 zdefektowanie
Transport jonów: kryształy jonowe JONIKA I FOTONIKA MICHAŁ MARZANTOWICZ Jodek srebra AgI W 42 K strukturalne przejście fazowe I rodzaju do fazy α stopiona podsieć kationowa. Fluorek ołowiu PbF 2 zdefektowanie
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7
 Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
CHEMIA. Wymagania szczegółowe. Wymagania ogólne
 CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
Kryteria oceniania z chemii kl VII
 Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 7
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIARÓW PRZEWODNICTWA. OZNACZANIE STĘŻENIA WODOROTLENKU SODU METODĄ MIARECZKOWANIA KONDUKTOMETRYCZNEGO
 OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIAÓW PZEWODNICTWA. OZNACZANIE STĘŻENIA WODOOTLENKU SODU METODĄ MIAECZKOWANIA KONDUKTOMETYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIAÓW PZEWODNICTWA. OZNACZANIE STĘŻENIA WODOOTLENKU SODU METODĄ MIAECZKOWANIA KONDUKTOMETYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
8. Trwałość termodynamiczna i kinetyczna związków kompleksowych
 8. Trwałość termodynamiczna i kinetyczna związków kompleksowych Tworzenie związku kompleksowego w roztworze wodnym następuje poprzez wymianę cząsteczek wody w akwakompleksie [M(H 2 O) n ] m+ na inne ligandy,
8. Trwałość termodynamiczna i kinetyczna związków kompleksowych Tworzenie związku kompleksowego w roztworze wodnym następuje poprzez wymianę cząsteczek wody w akwakompleksie [M(H 2 O) n ] m+ na inne ligandy,
Litowce i berylowce- lekcja powtórzeniowa, doświadczalna.
 Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego. II Etap - 18 stycznia 2016
 XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
Wodorotlenki. n to liczba grup wodorotlenowych w cząsteczce wodorotlenku (równa wartościowości M)
 Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
Wewnętrzna budowa materii
 Atom i układ okresowy Wewnętrzna budowa materii Atom jest zbudowany z jądra atomowego oraz krążących wokół niego elektronów. Na jądro atomowe składają się protony oraz neutrony, zwane wspólnie nukleonami.
Atom i układ okresowy Wewnętrzna budowa materii Atom jest zbudowany z jądra atomowego oraz krążących wokół niego elektronów. Na jądro atomowe składają się protony oraz neutrony, zwane wspólnie nukleonami.
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013
 Kuratorium Oświaty w Lublinie Kod ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
Kuratorium Oświaty w Lublinie Kod ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr.
 Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
Transport jonów: kryształy jonowe
 Transport jonów: kryształy jonowe Jodek srebra AgI W 420 K strukturalne przejście fazowe I rodzaju do fazy α stopiona podsieć kationowa. Fluorek ołowiu PbF 2 zdefektowanie Frenkla podsieci anionowej, klastry
Transport jonów: kryształy jonowe Jodek srebra AgI W 420 K strukturalne przejście fazowe I rodzaju do fazy α stopiona podsieć kationowa. Fluorek ołowiu PbF 2 zdefektowanie Frenkla podsieci anionowej, klastry
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
Obliczenia stechiometryczne, bilansowanie równań reakcji redoks
 Obliczenia stechiometryczne, bilansowanie równań reakcji redoks Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Obliczenia stechiometryczne Podstawą
Obliczenia stechiometryczne, bilansowanie równań reakcji redoks Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Obliczenia stechiometryczne Podstawą
Za poprawną metodę Za poprawne obliczenia wraz z podaniem zmiany ph
 Zadanie 1 ( pkt.) Zmieszano 80 cm roztworu CHCH o stężeniu 5% wag. i gęstości 1,006 g/cm oraz 70 cm roztworu CHCK o stężeniu 0,5 mol/dm. bliczyć ph powstałego roztworu. Jak zmieni się ph roztworu po wprowadzeniu
Zadanie 1 ( pkt.) Zmieszano 80 cm roztworu CHCH o stężeniu 5% wag. i gęstości 1,006 g/cm oraz 70 cm roztworu CHCK o stężeniu 0,5 mol/dm. bliczyć ph powstałego roztworu. Jak zmieni się ph roztworu po wprowadzeniu
Reakcje utleniania i redukcji Reakcje metali z wodorotlenkiem sodu (6 mol/dm 3 )
 Imię i nazwisko.. data.. Reakcje utleniania i redukcji 7.1 Reaktywność metali 7.1.1 Reakcje metali z wodą Lp Metal Warunki oczyszczania metalu Warunki reakcji Obserwacje 7.1.2 Reakcje metali z wodorotlenkiem
Imię i nazwisko.. data.. Reakcje utleniania i redukcji 7.1 Reaktywność metali 7.1.1 Reakcje metali z wodą Lp Metal Warunki oczyszczania metalu Warunki reakcji Obserwacje 7.1.2 Reakcje metali z wodorotlenkiem
Sprawdzian 1. CHEMIA. Przed próbną maturą (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 30. Imię i nazwisko ...
 CHEMIA Przed próbną maturą 2017 Sprawdzian 1. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 30 Imię i nazwisko... Liczba punktów Procent 2 Zadanie 1. Chlor i brom rozpuszczają się
CHEMIA Przed próbną maturą 2017 Sprawdzian 1. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 30 Imię i nazwisko... Liczba punktów Procent 2 Zadanie 1. Chlor i brom rozpuszczają się
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II
 TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
XV Wojewódzki Konkurs z Chemii
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
HYDROLIZA SOLI. 1. Hydroliza soli mocnej zasady i słabego kwasu. Przykładem jest octan sodu, dla którego reakcja hydrolizy przebiega następująco:
 HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
Chemia - B udownictwo WS TiP
 Chemia - B udownictwo WS TiP dysocjacja elektrolityczna, reakcje w roztworach wodnych, ph wykład nr 2b Teoria dys ocjacji jonowej Elektrolity i nieelektrolity Wpływ polarnej budowy cząsteczki wody na proces
Chemia - B udownictwo WS TiP dysocjacja elektrolityczna, reakcje w roztworach wodnych, ph wykład nr 2b Teoria dys ocjacji jonowej Elektrolity i nieelektrolity Wpływ polarnej budowy cząsteczki wody na proces
Defekty punktowe II. M. Danielewski
 Defekty punktowe II 2008 M. Danielewski Defekty, niestechiometria, roztwory stałe i przewodnictwo jonowe w ciałach stałych Atkins, Shriver, Mrowec i inni Defekty w kryształach: nie można wytworzyć kryształu
Defekty punktowe II 2008 M. Danielewski Defekty, niestechiometria, roztwory stałe i przewodnictwo jonowe w ciałach stałych Atkins, Shriver, Mrowec i inni Defekty w kryształach: nie można wytworzyć kryształu
OTRZYMYWANIE ZWIĄZKÓW CHEMICZNYCH: PREPARATYKA TLENKÓW MIEDZI
 15 OTRZYMYWANIE ZWIĄZKÓW CHEMICZNYCH: PREPARATYKA TLENKÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z prostymi metodami syntezy związków chemicznych i chemią związków miedzi Zakres obowiązującego materiału
15 OTRZYMYWANIE ZWIĄZKÓW CHEMICZNYCH: PREPARATYKA TLENKÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z prostymi metodami syntezy związków chemicznych i chemią związków miedzi Zakres obowiązującego materiału
CEL ĆWICZENIA Zapoznanie studentów z chemią 14 grupy pierwiastków układu okresowego
 16 SOLE KWASU WĘGLOWEGO CEL ĆWICZENIA Zapoznanie studentów z chemią 14 grupy pierwiastków układu okresowego Zakres obowiązującego materiału Węgiel i pierwiastki 14 grupy układu okresowego, ich związki
16 SOLE KWASU WĘGLOWEGO CEL ĆWICZENIA Zapoznanie studentów z chemią 14 grupy pierwiastków układu okresowego Zakres obowiązującego materiału Węgiel i pierwiastki 14 grupy układu okresowego, ich związki
XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2015/2016
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 21 maja 2016 Im. Jana Kasprowicza INOWROCŁAW XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 21 maja 2016 Im. Jana Kasprowicza INOWROCŁAW XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph
 Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph Dysocjacja elektrolitów W drugiej połowie XIX wieku szwedzki chemik S.A. Arrhenius doświadczalnie udowodnił, że substancje
Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph Dysocjacja elektrolitów W drugiej połowie XIX wieku szwedzki chemik S.A. Arrhenius doświadczalnie udowodnił, że substancje
prof. dr hab. Małgorzata Jóźwiak
 Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
OTRZYMYWANIE ZWIĄZKÓW CHEMICZNYCH: PREPARATYKA TLENKÓW MIEDZI
 15 OTRZYMYWANIE ZWIĄZKÓW CHEMICZNYCH: PREPARATYKA TLENKÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z prostymi metodami syntezy związków chemicznych i chemią związków miedzi Zakres obowiązującego materiału
15 OTRZYMYWANIE ZWIĄZKÓW CHEMICZNYCH: PREPARATYKA TLENKÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z prostymi metodami syntezy związków chemicznych i chemią związków miedzi Zakres obowiązującego materiału
Przemiany substancji
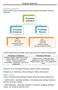 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab
 SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks
 Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II
 Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II Łączenie się atomów. Równania reakcji Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] Ocena dobra [1 + 2 + 3] Ocena bardzo dobra
Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II Łączenie się atomów. Równania reakcji Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] Ocena dobra [1 + 2 + 3] Ocena bardzo dobra
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018. Eliminacje szkolne
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
Zakład Chemii Organicznej, Wydział Chemii UMCS Strona 1
 PREPARAT NR 20 KWAS 2JODOBENZOESOWY NH 2 NaNO 2, HCl Woda, < 5 o C, 15 min N 2 Cl KI Woda, < 5 o C, potem 50 o C, 20 min I Stechiometria reakcji Kwas antranilowy Azotyn sodu Kwas solny stężony 1 ekwiwalent
PREPARAT NR 20 KWAS 2JODOBENZOESOWY NH 2 NaNO 2, HCl Woda, < 5 o C, 15 min N 2 Cl KI Woda, < 5 o C, potem 50 o C, 20 min I Stechiometria reakcji Kwas antranilowy Azotyn sodu Kwas solny stężony 1 ekwiwalent
KATALIZA I KINETYKA CHEMICZNA
 9 KATALIZA I KINETYKA CHEMICZNA CEL ĆWICZENIA Zapoznanie studenta z procesami katalitycznymi oraz wpływem stężenia, temperatury i obecności katalizatora na szybkość reakcji chemicznej. Zakres obowiązującego
9 KATALIZA I KINETYKA CHEMICZNA CEL ĆWICZENIA Zapoznanie studenta z procesami katalitycznymi oraz wpływem stężenia, temperatury i obecności katalizatora na szybkość reakcji chemicznej. Zakres obowiązującego
Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ
 Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
X / \ Y Y Y Z / \ W W ... imię i nazwisko,nazwa szkoły, miasto
 Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
Fizyka Ciała Stałego
 Wykład III Struktura krystaliczna Fizyka Ciała Stałego Ciała stałe można podzielić na: Krystaliczne, o uporządkowanym ułożeniu atomów lub molekuł tworzącym sieć krystaliczną. Amorficzne, brak uporządkowania,
Wykład III Struktura krystaliczna Fizyka Ciała Stałego Ciała stałe można podzielić na: Krystaliczne, o uporządkowanym ułożeniu atomów lub molekuł tworzącym sieć krystaliczną. Amorficzne, brak uporządkowania,
imię i nazwisko, nazwa szkoły, miejscowość Zadania I etapu Konkursu Chemicznego Trzech Wydziałów PŁ V edycja
 Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE
 PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Reakcje chemiczne. Typ reakcji Schemat Przykłady Reakcja syntezy
 Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
3. Przejścia fazowe pomiędzy trzema stanami skupienia materii:
 Temat: Zmiany stanu skupienia. 1. Energia sieci krystalicznej- wielkość dzięki której można oszacować siły przyciągania w krysztale 2. Energia wiązania sieci krystalicznej- ilość energii potrzebnej do
Temat: Zmiany stanu skupienia. 1. Energia sieci krystalicznej- wielkość dzięki której można oszacować siły przyciągania w krysztale 2. Energia wiązania sieci krystalicznej- ilość energii potrzebnej do
1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych.
 Tematy opisowe 1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych. 2. Dlaczego do kadłubów statków, doków, falochronów i filarów mostów przymocowuje się płyty z
Tematy opisowe 1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych. 2. Dlaczego do kadłubów statków, doków, falochronów i filarów mostów przymocowuje się płyty z
Szkolny konkurs chemiczny Grupa B. Czas pracy 80 minut
 Szkolny konkurs chemiczny Grupa B Czas pracy 80 minut Piła 1 czerwca 2017 1 Zadanie 1. (0 3) Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie: elektrony rozmieszczone
Szkolny konkurs chemiczny Grupa B Czas pracy 80 minut Piła 1 czerwca 2017 1 Zadanie 1. (0 3) Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie: elektrony rozmieszczone
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak
 Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga ciało
Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga ciało
STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI
 Ćwiczenie 8 Semestr 2 STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI Obowiązujące zagadnienia: Stężenie jonów wodorowych: ph, poh, iloczyn jonowy wody, obliczenia rachunkowe, wskaźniki
Ćwiczenie 8 Semestr 2 STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI Obowiązujące zagadnienia: Stężenie jonów wodorowych: ph, poh, iloczyn jonowy wody, obliczenia rachunkowe, wskaźniki
CHEMIA NIEORGANICZNA. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I piętro p. 138 WYKŁAD -1
 CHEMIA NIEORGANICZNA Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I piętro p. 138 WYKŁAD -1 w poprzednim odcinku RÓWNOWAGA PRZEMIANA STRUKTURA w poprzednim odcinku w poprzednim odcinku poziomy
CHEMIA NIEORGANICZNA Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I piętro p. 138 WYKŁAD -1 w poprzednim odcinku RÓWNOWAGA PRZEMIANA STRUKTURA w poprzednim odcinku w poprzednim odcinku poziomy
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
KONKURS CHEMICZNY ROK PRZED MATURĄ
 Wydział Chemii UMCS Polskie Towarzystwo Chemiczne Doradca metodyczny ds. nauczania chemii KONKURS CHEMICZNY ROK PRZED MATURĄ ROK SZKOLNY 2006/2007 ETAP SZKOLNY Numer kodowy Suma punktów Podpisy Komisji:
Wydział Chemii UMCS Polskie Towarzystwo Chemiczne Doradca metodyczny ds. nauczania chemii KONKURS CHEMICZNY ROK PRZED MATURĄ ROK SZKOLNY 2006/2007 ETAP SZKOLNY Numer kodowy Suma punktów Podpisy Komisji:
Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem
 Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI
 6 KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z zagadnieniami katalizy homogenicznej i wykorzystanie reakcji tego typu do oznaczania śladowych ilości jonów Cu 2+. Zakres obowiązującego
6 KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z zagadnieniami katalizy homogenicznej i wykorzystanie reakcji tego typu do oznaczania śladowych ilości jonów Cu 2+. Zakres obowiązującego
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym
 1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru
 1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
Część I. TEST WYBORU 18 punktów
 Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
Wykład 10 Równowaga chemiczna
 Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje szkolne I stopień
 POUFNE Pieczątka szkoły 9 listopada 2015 r. Imię Czas pracy 60 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje szkolne I stopień Informacje: 1. Przeczytaj uważnie
POUFNE Pieczątka szkoły 9 listopada 2015 r. Imię Czas pracy 60 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje szkolne I stopień Informacje: 1. Przeczytaj uważnie
Nazwy pierwiastków: A +Fe 2(SO 4) 3. Wzory związków: A B D. Równania reakcji:
 Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
1. Od czego i w jaki sposób zależy szybkość reakcji chemicznej?
 Tematy opisowe 1. Od czego i w jaki sposób zależy szybkość reakcji chemicznej? 2. Omów pomiar potencjału na granicy faz elektroda/roztwór elektrolitu. Podaj przykład, omów skale potencjału i elektrody
Tematy opisowe 1. Od czego i w jaki sposób zależy szybkość reakcji chemicznej? 2. Omów pomiar potencjału na granicy faz elektroda/roztwór elektrolitu. Podaj przykład, omów skale potencjału i elektrody
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
OCENIANIE ARKUSZA POZIOM ROZSZERZONY
 Próbny egzamin maturalny z chemii OCENIANIE ARKUSZA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne
Próbny egzamin maturalny z chemii OCENIANIE ARKUSZA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne
Różne dziwne przewodniki
 Różne dziwne przewodniki czyli trzy po trzy o mechanizmach przewodzenia prądu elektrycznego Przewodniki elektronowe Metale Metale (zwane również przewodnikami) charakteryzują się tym, że elektrony ich
Różne dziwne przewodniki czyli trzy po trzy o mechanizmach przewodzenia prądu elektrycznego Przewodniki elektronowe Metale Metale (zwane również przewodnikami) charakteryzują się tym, że elektrony ich
Oznaczanie SO 2 w powietrzu atmosferycznym
 Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania
 Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
DEZYNFEKCJA WODY CHLOROWANIE DO PUNKTU
 DEZYNFEKCJA WODY CHLOROWANIE DO PUNKTU PRZEŁAMANIA WPROWADZENIE Ostatnim etapem uzdatniania wody w procesie technologicznym dla potrzeb ludności i przemysłu jest dezynfekcja. Proces ten jest niezbędny
DEZYNFEKCJA WODY CHLOROWANIE DO PUNKTU PRZEŁAMANIA WPROWADZENIE Ostatnim etapem uzdatniania wody w procesie technologicznym dla potrzeb ludności i przemysłu jest dezynfekcja. Proces ten jest niezbędny
Powstawanie żelazianu(vi) sodu przebiega zgodnie z równaniem: Ponieważ termiczny rozkład kwasu borowego(iii) zachodzi zgodnie z równaniem:
 Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
O MATURZE Z CHEMII ANALIZA TRUDNYCH DLA ZDAJĄCYCH PROBLEMÓW
 O MATURZE Z CHEMII ANALIZA TRUDNYCH DLA ZDAJĄCYCH PROBLEMÓW Jolanta Baldy Politechnika Wrocławska, 6 listopada 2015 r. Matura 2015 z chemii w liczbach Średni wynik procentowy Województwo dolnośląskie Województwo
O MATURZE Z CHEMII ANALIZA TRUDNYCH DLA ZDAJĄCYCH PROBLEMÓW Jolanta Baldy Politechnika Wrocławska, 6 listopada 2015 r. Matura 2015 z chemii w liczbach Średni wynik procentowy Województwo dolnośląskie Województwo
Szkła specjalne Przejście szkliste i jego termodynamika Wykład 5. Ryszard J. Barczyński, 2017 Materiały edukacyjne do użytku wewnętrznego
 Szkła specjalne Przejście szkliste i jego termodynamika Wykład 5 Ryszard J. Barczyński, 2017 Materiały edukacyjne do użytku wewnętrznego Czy przejście szkliste jest termodynamicznym przejściem fazowym?
Szkła specjalne Przejście szkliste i jego termodynamika Wykład 5 Ryszard J. Barczyński, 2017 Materiały edukacyjne do użytku wewnętrznego Czy przejście szkliste jest termodynamicznym przejściem fazowym?
