(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
|
|
|
- Michał Morawski
- 7 lat temu
- Przeglądów:
Transkrypt
1 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego: (13) (51) T3 Int.Cl. A61K 38/24 ( ) A61P 15/08 ( ) Urząd Patentowy Rzeczypospolitej Polskiej (97) O udzieleniu patentu europejskiego ogłoszono: Europejski Biuletyn Patentowy 2015/25 EP B1 (54) Tytuł wynalazku: Kompozycja do stosowania w leczeniu niepłodności (30) Pierwszeństwo: EP (43) Zgłoszenie ogłoszono: w Europejskim Biuletynie Patentowym nr 2013/32 (45) O złożeniu tłumaczenia patentu ogłoszono: Wiadomości Urzędu Patentowego 2015/12 (73) Uprawniony z patentu: Ferring B.V., Hoofddorp, NL (72) Twórca(y) wynalazku: PL/EP T3 JOAN CARLOS ARCE SAEZ, Dragør, DK (74) Pełnomocnik: rzecz. pat. Janina Kossowska PATPOL KANCELARIA PATENTOWA SP. Z O.O. ul. Nowoursynowska 162 J Warszawa Uwaga: W ciągu dziewięciu miesięcy od publikacji informacji o udzieleniu patentu europejskiego, każda osoba może wnieść do Europejskiego Urzędu Patentowego sprzeciw dotyczący udzielonego patentu europejskiego. Sprzeciw wnosi się w formie uzasadnionego na piśmie oświadczenia. Uważa się go za wniesiony dopiero z chwilą wniesienia opłaty za sprzeciw (Art. 99 (1) Konwencji o udzielaniu patentów europejskich).
2 Opis [0001] Niniejszy wynalazek dotyczy kompozycji i produktów farmaceutycznych do leczenia bezpłodności. [0002] Techniki wspomaganego rozrodu (ART), takie jak zapłodnienie in vitro, są dobrze znane. Te techniki ART na ogół wymagają etapu kontrolowanej stymulacji jajników (COS), w którym grupa około 7 do 17 pęcherzyków jest stymulowana do pełnej dojrzałości. Reżimy standardowej COS obejmują podawanie hormonów gonadotropowych, takich jak hormon folikulotropowy (FSH), sam lub w połączeniu z aktywnością hormonu luteinizującego (LH), w celu stymulowania rozwoju pęcherzyków, zwykle z podawaniem analogu GnRH przed i/lub podczas stymulacji, aby zapobiec przedwczesnemu nagromadzeniu się LH. Kompozycje farmaceutyczne powszechnie stosowane do COS zawierają rekombinowany hormon folikulotropowy (FSH), FSH pochodzący z moczu, rekombinowany FSH + preparaty LH i menotropinę [ludzka menopauzalna gonadotropina (hmg)] pochodzącą z moczu oraz wysoko oczyszczoną ludzką menopauzalną gonadotropinę (HP-hMG). [0003] Preparaty FSH rekombinowanego i pochodzącego z moczu obejmują tylko FSH. Preparaty HMG i HP-hMG zawierają FSH i aktywność hormonu luteinizującego (LH). Aktywność LH może pochodzić z LH lub z ludzkiej gonadotropiny kosmówkowej, hcg, w zależności od konkretnego preparatu hmg. Na przykład, 75 IU preparatu HP-hMG MENOPUR odpowiada w przybliżeniu 10 IU hcg w odniesieniu do aktywności LH. [0004] Zgłaszający niniejszy wynalazek starali się dostarczyć zoptymalizowanej kompozycji, która zawiera FSH (np. rekombinowany FSH) i dodatkową aktywność LH do stosowania w kontrolowanej stymulacji jajników. Zoptymalizowane kompozycje mogą dostarczyć wyższego poziomu aktywności LH (dostarczonej przez hcg) niż obecny w znanych pochodzących z moczu preparatach hmg / HPhMG lub znanych preparatach rekombinowany FSH + LH. [0005] Zatem, zgodnie z niniejszym wynalazkiem dostarczony jest produkt (np. produkt farmaceutyczny), obejmujący hormon folikulotropowy (FSH), na przykład rekombinowany FSH, i ludzką gonadotropinę kosmówkową (hcg) do stosowania w leczeniu bezpłodności (i/lub do kontrolowanej stymulacji jajników) u osobnika, w którym FSH jest do podawania w dawce wynoszącej lub równoważnej 75 do 250 IU FSH na dzień (np. w dawce wynoszącej, lub równoważnej 100 IU FSH, 150 IU FSH, 200 IU FSH lub 225 IU FSH na dzień) począwszy od pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni); i hcg jest do podawania w dawce wynoszącej lub równoważnej 75 do 160 IU hcg na dzień (np. w dawce wynoszącej lub równoważnej 100 lub 150 IU hcg na dzień) począwszy od pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni, na przykład 10 do 13 dni, na przykład 10 do 11 dni). Produkt może być do podawania 12 do 16, np. 13 do 15, np. 14 dni po podaniu (np. po rozpoczęciu podawania, np. po rozpoczęciu codziennego podawania) agonisty GnRH (np. Synarel, Lupron, Decapeptyl). Produkt może być do podawania z agonistą GnRH. Produkt może być do podawania przed podawaniem antagonisty GnRH (np. ganireliksu, cetroreliksu), na przykład do podawania pięć lub sześć dni przed podaniem antagonisty GnRH. Produkt może być do 1
3 podawania z antagonistą GnRH. Produkt może być do podawania osobnikowi (lub pacjentowi) po tym jak osobnik był wcześniej leczony kompozycją farmaceutyczną, która tłumi endogenne wytwarzanie gonadotropiny (np. gdy osobnik był (wstępnie) leczony steroidem, agonistą GnRH, antagonistą GnRH, itd). W niniejszym opisie, określenie "wcześniej leczony" lub "wcześniej traktowany" odnosi się do podawania kompozycji farmaceutycznej, która tłumi wytwarzanie endogennej gonadotropiny przed pierwszym dniem leczenia FSH i hcg. [0006] FSH może być do podawania w dawce wynoszącej lub równoważnej 75 do 200 IU FSH na dzień (np. w dawce wynoszącej lub równoważnej 150 IU FSH na dzień) począwszy od pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni). Korzystnie, FSH jest do podawania w dawce wynoszącej lub równoważnej 140 do 160 IU FSH na dzień (np. w dawce wynoszącej lub równoważnej 150 IU FSH na dzień) rozpoczynając od pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni). FSH może być do podawania w dawce wynoszącej lub równoważnej 90 do 110 IU FSH na dzień (np. w dawce wynoszącej lub równoważnej 100 IU FSH dziennie) rozpoczynając od pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni). FSH można podawać w dawce wynoszącej lub równoważnej 190 do 235 IU FSH na dzień (np. w dawce wynoszącej lub równoważnej 200 IU FSH na dzień lub w dawce wynoszącej lub równoważnej 225 IU FSH na dzień) rozpoczynając od pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni). [0007] hcg jest do podawania w dawce wynoszącej lub równoważnej 75 do 160 IU hcg na dzień [rozpoczynając od pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni, na przykład 10 do 13 dni, na przykład 10 do 11 dni)]. hcg może być do podawania w dawce wynoszącej lub równoważnej 75 do 125 IU hcg na dzień, na przykład w dawce wynoszącej lub równoważnej 90 do 110 IU hcg na dzień. hcg może być do podawania w dawce wynoszącej lub równoważnej 125 do 160 IU hcg na dzień, na przykład w dawce wynoszącej lub równoważnej 140 do 155 IU hcg na dzień. Korzystnie, FSH jest rekombinowanym FSH. hcg może być rekombinowanym hcg. [0008] Jak wskazano powyżej, wiadomo, że dzienna dawka wynosząca 75 IU preparatu HP-hMG MENOPUR odpowiada około 10 IU hcg w stosunku do aktywności LH. Wiadomo, że dzienna dawka 450 lu HP-hMG (w przypadku MENOPUR oznaczająca 450 IU aktywności LH, co odpowiada w przybliżeniu 60 IU hcg) może być skutecznie i bezpiecznie podawana osobnikom poddanym kontrolowanej stymulacji jajników. Jednak istnieją obawy, że wysoki poziom LH w surowicy być może mógłby niekorzystnie wpływać na leczenie (np. przez zmniejszony współczynnik ciąż i zwiększony współczynnik poronień). Zgłaszający niniejszy wynalazek nieoczekiwanie stwierdzili, że podawanie 100 lub nawet 150 IU hcg w dawce dziennej razem ze 150 IU FSH może dostarczyć skutecznej kontrolowanej stymulacji jajników (COS) bez oznak szkodliwego wpływu na skuteczność. Zgłaszający niniejszy wynalazek również nieoczekiwanie stwierdzili, że podawanie 100 lub nawet 150 IU hcg jako dawki dziennej razem ze 150 IU FSH może dostarczyć znaczącego wzrostu liczby najwyższej jakości 2
4 zarodków w porównaniu z konwencjonalnym protokołem leczenia (Tabela I, IV). W niniejszym wynalazku, najwyższej jakości zarodek jest zdefiniowany jako cztery do pięciu komórek w dniu 2, siedem lub więcej komórek w dniu 3, równej wielkości blastomery i 20% fragmentacji w dniu 3 oraz brak wielojądrzastych. [0009] Dawkowanie FSH i hcg może rozpoczynać się w pierwszym dniu leczenia i być kontynuowane dwa do dwudziestu dni, na przykład może być kontynuowane przez 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 lub 20 dni. Dawki FSH i hcg mogą rozpoczynać się w pierwszym dniu leczenia i mogą być kontynuowane przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni, na przykład 10 do 13 dni, na przykład 10 do 11 dni. Dawka FSH i hcg może być podawana w dawce równoważnej dziennym dawkom wymienionym powyżej. Na przykład, kompozycja może być do podawania w dawce 450 IU FSH co trzy dni (np. do podawania w dniach 1, 4, 7, i tak dalej) i w dawce 300 IU hcg lub 450 IU hcg co trzy dni (np. podawanie w dniach 1, 4, 7, i tak dalej). W innym przykładzie, kompozycja może być do podawania w dawce wynoszącej (lub równoważnej) 1050 IU FSH co siedem dni (np. do podawania w dniach 7, 14, i tak dalej) i w dawce wynoszącej (lub równoważnej) 700 IU hcg lub 1050 IU hcg co siedem dni (np. do podawania w dniach 7, 14, i tak dalej). [0010] W niniejszym opisie, określenie "produkt" lub "produkt leczniczy" obejmuje kompozycje lub kompozycje farmaceutyczne zawierające zarówno FSH jak i hcg do podawania razem - na przykład fiolkę zawierającą FSH i hcg, jednodawkową formulację (np. do iniekcji) zawierającą określone ilości FSH i hcg (np. 150 IU FSH i 100 IU hcg) lub wielodawkową formulację (np. do iniekcji) zawierającą wiele (np. pięć) dziennych dawek określonych ilości FSH i hcg (np. 750 IU FSH i 500 IU hcg). Określenie "produkt" obejmuje także oddzielne kompozycje lub kompozycje farmaceutyczne, z których każda zawiera albo FSH albo hcg, które są do podawania osobno (na przykład w postaci oddzielnych iniekcji) w zdefiniowanych dawkach dziennych, na przykład zestaw obejmujący pojemnik (np. fiolkę) zawierający jedną lub więcej dziennych dawek FSH i oddzielny pojemnik (np. drugą fiolkę) zawierającą jedną lub więcej dawek dziennych hcg. Jeśli produkt zawiera oddzielne kompozycje, dzienna dawka FSH jest do podawania przed, po lub w tym samym czasie co dzienna dawka hcg, korzystnie w ciągu 6 godzin, korzystnie w ciągu 60 minut, bardziej korzystnie w ciągu 1 do 10 minut po podaniu dziennej dawki hcg. [0011] Zatem, produkt według wynalazku może zawierać pierwszą kompozycję obejmującą FSH, korzystnie rekombinowany FSH, do podawania w dawce 75 do 250 IU FSH na dzień (np. 100 IU FSH, 150 IU FSH, 200 IU FSH lub 225 IU FSH na dzień lub np. w dawce 75 do 200 IU FSH na dzień, np. 140 do 160 IU FSH na dzień), rozpoczynając od pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni, na przykład 10 do 13 dni, na przykład 10 do 11 dni); i drugą kompozycję obejmującą hcg do podawania w dawce 75 do 160 IU hcg na dzień (np. 100 lub 150 IU hcg na dzień), rozpoczynając od pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni, na przykład 10 do 13 dni, na przykład 10 do 11 dni). Pierwsza i druga kompozycja mogą być do podawania jednocześnie lub oddzielnie. Jeśli kompozycje są do podawania oddzielnie, dzienną dawkę FSH można podawać 3
5 przed lub po dziennej dawce hcg, korzystnie w ciągu 6 godzin, korzystnie w ciągu 60 minut, bardziej korzystnie w ciągu 1 do 10 minut po podaniu dziennej dawki hcg. [0012] W dalszym wykonaniu produkt według wynalazku może zawierać kompozycję obejmującą FSH, korzystnie rekombinowany FSH i hcg, do podawania w dawce 75 do 250 IU FSH (np. 100 IU FSH, 150 IU FSH, 200 IU FSH lub 225 IU FSH lub w dawce 75 do 200 IU FSH na dzień, np. 140 do 160 IU FSH) i 75 do 160 IU hcg na dzień (np. 100 lub 150 IU hcg na dzień) na dzień, rozpoczynając od pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni, na przykład 10 do 13 dni, na przykład 10 do 11 dni). [0013] Korzystnie produkt jest do podawania przed podaniem wysokiej (owulacyjnej) dawki hcg (4000 do IU hcg, np 5000 IU hcg, IU hcg, itd.; lub 150 do 350 mikrogramów rekombinowanej hcg, na przykład 250 mikrogramów rekombinowanej hcg ) w celu wywołania końcowego dojrzewania pęcherzyków. [0014] Kompozycja może być do (codziennego) podawania hcg razem z (np. codziennym podawaniem) hormonem folikulotropowym (FSH), rozpoczynając od pierwszego dnia leczenia i kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni, na przykład 10 do 13 dni, na przykład 10 do 11 dni). Kompozycja może być do podawania 12 do 16, np. 13 do 15, np. 14 dni po podaniu (np. po rozpoczęciu podawania, np. po rozpoczęciu codziennego podawania) agonisty GnRH (np. Synarel, Lupron, Decapeptyl). Kompozycja może być do podawania z agonistą GnRH. Kompozycja może być do podawania przed podaniem antagonisty GnRH (np. ganireliksu, cetroreliksu), na przykład do podawania pięć lub sześć dni przed podaniem antagonisty GnRH. Kompozycje mogą być do podawania z antagonistą GnRH. [0015] W niniejszym opisie określenie "leczenie bezpłodności" obejmuje leczenie bezpłodności za pomocą kontrolowanej stymulacji jajników (COS) lub sposobów, które obejmują etap lub stadium kontrolowanej stymulacji jajników (COS), na przykład inseminację domaciczną (IUI), zapłodnienie in vitro (IVF) lub intracytoplasmic sperm injection (ICSI). Określenie "leczenie bezpłodności" obejmuje leczenie bezpłodności za pomocą indukcji owulacji (Ol) lub za pomocą sposobów, które obejmują etap lub fazę indukcji owulacji (Ol). Określenie "leczenie bezpłodności" obejmuje leczenie bezpłodności u osobnika z jajowodową lub niewyjaśnioną bezpłodnością, w tym, leczenie bezpłodności u osobnika z endometriozą, na przykład, endometriozą stopnia I lub stopnia II, i/lub u osobnika cierpiącego na bezpłodność z powodu braku jajeczkowania, na przykład typu WHO bezpłodności stopnia II z powodu braku jajeczkowania, i/lub u osobnika z partnerem z czynnikiem męskiej bezpłodności. [0016] Produkt (lub kompozycja) do (stosowania w) leczenia (leczeniu) bezpłodności (i/lub do kontrolowanej stymulacji jajników) u osobnika z endometriozą, na przykład u osobnika z endometriozą stopnia I lub stopnia II, jak zdefiniowane w systemie klasyfikacji Amerykańskiego Towarzystwa Medycyny Rozrodu (ASRM) dla różnych stopni endometriozy (stopień IV - najcięższy; stopień I - najmniej ciężki) [Amerykańskie Towarzystwo Medycyny Rozrodu. Revised American Society for Reproductive Medicine classification of endometriosis: 1996 Fertil Steril 1997; 67, ]. 4
6 [0017] Produkt (kompozycja) może być do (stosowania w) leczenia (leczeniu) bezpłodności (i/lub do kontrolowanej stymulacji jajników) u osobnika z normalnym poziomem FSH w surowicy w wysokości 1 do 12 IU/l we wczesnej fazie pęcherzykowej. [0018] Produkt (kompozycja) może być do (stosowania w) leczenia (leczeniu) bezpłodności (i/lub do kontrolowanej stymulacji jajników) u osobnika w wieku 18 do 42 lat, na przykład 25 do 37 lat. Produkt może być do (stosowania w) leczenia niepłodności (i/lub do kontrolowanej stymulacji jajników) u osobnika z BMI > 18 i BMI < 35 kg/m 2, na przykład osobnika z BMI > 20 i BMI < 25 kg/m 2. [0019] Niniejsi zgłaszający nieoczekiwanie stwierdzili, że leczenie za pomocą 100 lub nawet 150 IU hcg jako dziennej dawki razem z np. 150 IU FSH, może dostarczyć skutecznej kontrolowanej stymulacji jajników (COS) bez oznak szkodliwego wpływu na skuteczność. Niniejsi zgłaszający nieoczekiwanie stwierdzili również, że podawanie np. 100 lub 150 IU hcg w dziennej dawce wraz z 150 IU FSH, może dostarczyć znaczącego wzrostu uzyskanej liczby zarodków najwyższej jakości w porównaniu z konwencjonalnym protokołem leczenia (Tabela I, IV). Zgłaszający stwierdzili, że podawanie np. 100 lub 150 IU hcg (razem z FSH) 3 dnia zwiększyło liczbę zarodków najwyższej jakości, w porównaniu z protokołem konwencjonalnym (kontrola) lub zmniejszą (np. 50 IU) dawką hcg. Największą liczbę zarodków najwyższej jakości stwierdzono 3 dnia w grupie, której podawano 150 IU hcg na dzień, chociaż ta grupa nie miała najwyższego wskaźnika zapłodnienia. Oznacza to, że leczenie za pomocą około 150 IU hcg zwiększa szansę rozwoju najwyższej ilości zarodków, chociaż leczenie dawkami około 100 IU hcg daje największą szansę na osiągnięcie trwającej ciąży w tym samym cyklu (pobierania). [0020] Produkt może być do stosowania w leczeniu bezpłodności (i/lub do kontrolowanej stymulacji jajników) u osobniczki z jajowodową lub niewyjaśnioną bezpłodnością, w tym osobniczki z endometriozą, na przykład endometriozą stopnia I lub stopnia II, jak zdefiniowane w systemie klasyfikacji Amerykańskiego Towarzystwa Medycyny Rozrodu (ASRM) dla różnych stadiów endometriozy (stadium IV - najpoważniejsze; stadium I - najmniej ciężkie) [Amerykańskie Towarzystwo Medycyny Rozrodu. Revised American Society for Reproductive Medicine classification of endometriosis: Fertil Steril; 67, ]. [0021] Produkt może być do stosowania w leczeniu bezpłodności (i/lub do kontrolowanej stymulacji jajników) u osobniczki z (prawidłowym) poziomem FSH w surowicy od 1 do 12 IU/l we wczesnej fazie pęcherzykowej. [0022] Produkt może być do stosowania w leczeniu bezpłodności (i/lub do kontrolowanej stymulacji jajników) u osobniczki w wieku 18 do 42 lat, na przykład 25 do 37 lat. Produkt może być do stosowania w leczeniu bezpłodności (i/lub do kontrolowanej stymulacji jajników) u pacjentki z BMI > 18 i BMI < 35 kg/m 2, na przykład pacjentki z BMI > 20 i BMI < 25 kg/m 2. [0023] Niniejszy wynalazek znajduje również zastosowanie w sposobach leczenia bezpłodności, które obejmują lub mogą obejmować etap zamrażania zarodków do późniejszego wykorzystania. Pacjentki poddawane leczeniu bezpłodności mogą chcieć zamrozić żywotne zarodki do późniejszego wykorzystania (np. z powodu stylu życia lub zdrowia albo w celu zmniejszenia kosztów związanych z powtarzającymi się zabiegami). Stosunkowo najnowsze osiągnięcia w technologii zamrażania zarodków oznaczają, że wskaźniki przeżywalności poprawiły się znacznie od około 50% do obecnej 5
7 przeżywalności 80-90%. Niemniej jednak, nadal istnieje zapotrzebowanie na ulepszone sposoby dostarczania najwyższej jakości zarodków do zamrażania i późniejszego stosowania do leczenia bezpłodności. [0024] Jak omówiono tutaj, Zgłaszający stwierdzili, że podawanie np. 100 lub 150 IU hcg (razem z FSH) zwiększyło liczbę zarodków najwyższej jakości 3. dnia w porównaniu do konwencjonalnego protokołu (kontrola) lub mniejszej (np. 50 IU) dawki hcg. Największą liczbę zarodków najwyższej jakości stwierdzono 3 dnia w grupie, której podawano 150 IU hcg na dzień. [0025] Według niniejszego wynalazku, w dalszym aspekcie dostarczony jest produkt (np. produkt farmaceutyczny) obejmujący hormon folikulotropowy (FSH), na przykład rekombinowany FSH, i ludzką gonadotropinę kosmówkową (hcg) do (stosowania w) leczenia (leczeniu) bezpłodności u osobnika (np. człowieka) w celu rozwinięcia jednego lub więcej zarodków najwyższej jakości, przy czym FSH jest do podawania w dawce wynoszącej lub równoważnej 75 do 250 IU FSH na dzień (np. w dawce wynoszącej lub równoważnej 100 IU FSH, 150 IU FSH, 200 IU FSH lub 225 IU FSH na dzień lub w dawce wynoszącej lub równoważnej 75 do 200 IU FSH na dzień) rozpoczynając od pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni); a hcg jest do podawania w dawce wynoszącej lub równoważnej 140 do 190 IU hcg na dzień (np. w dawce wynoszącej lub równoważnej 140 do 160 IU hcg na dzień, np. w dawce wynoszącej lub równoważnej 150 IU hcg na dzień) rozpoczynając od pierwszego dnia leczenia i kontynuując przez kolejne dwa do dwudziestu dni (na przykład kontynuując przez siedem do trzynastu dni, na przykład dziewięć do trzynastu dni, na przykład 10 do 13 dni, na przykład 10 do 11 dni ). Produkt może być do stosowania w leczeniu bezpłodności w celu rozwinięcia jednego lub więcej zarodków najwyższej jakości, przy czym leczenie obejmuje dalszy etap zamrażania co najmniej jednego otrzymanego zarodka najwyższej jakości. [0026] Zgłaszający stwierdzili, że suplementowanie FSH z np. 150 IU hcg może znacznie zwiększyć prawdopodobieństwo rozwoju zarodka najwyższej jakości. [0027] Produkt (dawki FSH/hCG) może być do podawania osobnikowi po tym jak osobnik został poddany wcześniej leczeniu za pomocą kompozycji farmaceutycznej, która hamuje endogenne wytwarzanie gonadotropiny (np. gdy pacjent był wcześniej leczony steroidem, agonistą GnRH, antagonistą GnRH, itd.). [0028] FSH można otrzymać za pomocą dowolnych środków znanych w stanie techniki, chociaż korzystny jest rekombinowany FSH. Produkty rekombinowanego FSH są znane, na przykład Puregon (Organon), Gonal-F lub FSH pochodzący z ludzkiej linii komórkowej ujawnionej w WO2009/ FSH, jak stosuje się tutaj, obejmuje FSH pochodzący od człowieka i rekombinowany. FSH pochodzący od człowieka może być oczyszczony z dowolnego odpowiedniego źródła (np. z moczu) za pomocą dowolnego sposobu znanego w tej dziedzinie. Sposoby wyrażania i oczyszczania rekombinowanego FSH (np. z linii komórkowych CHO lub ludzkich) są znane w stanie techniki. Należy zauważyć, że chociaż rekombinowany FSH jest korzystny, kompozycje według wynalazku można dostarczyć stosując preparaty FSH pochodzącego od człowieka, takie jak hmg i HP-hMG. W tym przypadku pewna aktywność hcg może być dostarczona przez FSH pochodzący od człowieka; może 6
8 to być uzupełnione w celu dostarczenia kompozycji według wynalazku przez dodanie hcg, co jest łatwo zrozumiałe dla specjalisty w tej dziedzinie. [0029] hcg można otrzymać za pomocą dowolnych środków znanych w tej dziedzinie. hcg, jak stosuje się tutaj, obejmuje hcg pochodzącą od człowieka i rekombinowaną. hcg pochodząca od człowieka może być oczyszczona z dowolnego odpowiedniego źródła (np. z moczu i łożyska) w dowolny sposób znany w tej dziedzinie. Sposoby wyrażania i oczyszczania rekombinowanej hcg są dobrze znane w tej dziedzinie. [0030] Produkt (farmaceutyczny) może być do leczenia bezpłodności, np. do zastosowania w technikach wspomaganego rozrodu (ART), indukcji owulacji lub zapłodnienia domacicznego (IUI). Produkt może być stosowany, na przykład, we wskazaniach medycznych, w których stosowane są znane preparaty samego FSH, jak również preparaty obejmujące zarówno aktywność FSH jak i LH, takie jak FSH z moczu, hmg i HP-hMG. Aktywne składniki produktów, dawki i sposoby według wynalazku (tj.. FSH i hcg) mogą być formułowane w znane kompozycje do dowolnej drogi podawania leku, np. doustnej, doodbytniczej, pozajelitowej, przezskórnej (np. technologia plastrów), dożylnej, domięśniowej, podskórnej, podpotylicznej, dopochwowej, dootrzewnowej, miejscowej (proszki, maści lub krople) lub jako spray do nosa lub do jamy ustnej. Typowa kompozycja obejmuje farmaceutycznie dopuszczalny nośnik, taki jak wodny roztwór, nietoksyczne substancje pomocnicze, takie jak sole, cukry, aminokwasy, środki powierzchniowo czynne, środki konserwujące, stabilizatory, środki izotonizujące, bufory i tym podobne, jak opisano w Remington's Pharmaceutical Sciences, wydanie piętnaste, (Matt Publishing Company, 1975), na stronach 1405 do 1412 i , i w narodowym receptariuszu XIV, wydanie czternaste, (American Pharmaceutical Association, 1975), między innymi. Przykłady odpowiednich wodnych i niewodnych nośników farmaceutycznych, rozcieńczalników, rozpuszczalników lub podłoży obejmują wodę, etanol, poliole (takie jak glicerol, glikol propylenowy, glikol polietylenowy i tym podobne), karboksymetylocelulozę i ich odpowiednie mieszaniny, oleje roślinne (takie jak olej rycynowy) i estry organiczne do iniekcji, takie jak oleinian etylu. Produkty (dawki i kompozycje) według niniejszego wynalazku mogą również zawierać dodatki, takie jak, ale nie wyłącznie, środki konserwujące, środki zwilżające, środki emulgujące i środki dyspergujące. W celu zapobiegania wzrostowi bakterii mogą być włączone środki przeciwbakteryjne i przeciwgrzybicze i obejmują one, na przykład, paraben, chlorobutanol, fenol, kwas sorbinowy i tym podobne. Ponadto, może być pożądane włączenie do kompozycji środków izotonicznych, takich jak cukry, chlorek sodu i tym podobne. [0031] W niektórych przypadkach, do spowodowania przedłużonego działania, pożądane jest spowolnienie wchłaniania FSH i/lub hcg z iniekcji podskórnej lub domięśniowej. Można to osiągnąć przez zastosowanie ciekłej zawiesiny krystalicznej lub bezpostaciowej substancji o słabej rozpuszczalności w wodzie. Szybkość wchłaniania FSH i/lub hcg zależy wówczas od ich szybkości rozpuszczania, która z kolei może zależeć od wielkości kryształów i postaci krystalicznej. Alternatywnie, opóźnione wchłanianie podawanej pozajelitowo postaci skojarzonej FSH jak i hcg osiąga się przez rozpuszczenie lub zawieszenie kombinacji FSH i hcg w podłożu olejowym (takim jak olej rycynowy). Postacie depot do iniekcji mogą być wytwarzane przez formowanie mikroenkapsulowanych matryc FSH i hcg (i innych środków, jeśli są obecne) w biodegradowalnych 7
9 polimerach, takich jak polilaktyd-poliglikolid. W zależności od stosunku FSH i hcg do polimeru oraz od charakteru konkretnego stosowanego polimeru, szybkość uwalniania FSH i hcg może być regulowana. Przykłady innych biodegradowalnych polimerów obejmują poliwinylopirolidon, poli (ortoestry), poli(bezwodniki), kwas hialuronowy, itd. Formulacje depot do iniekcjiwytwarza się także przez zamykanie FSH i hcg w liposomach, mikroemulsjach lub nanoukładach (jak zawiesiny i emulsje), które są kompatybilne z tkankami organizmu. [0032] Produkty, kompozycje, itd. według wynalazku mogą być formułowane jako, na przykład, półstałe folie do stosowania jako plaster transdermalny. [0033] Typowa kompozycja obejmuje farmaceutycznie dopuszczalny nośnik, taki jak wodny roztwór, nietoksyczne substancje pomocnicze, takie jak sole i środki konserwujące, bufory i tym podobne, jak opisane w Remington's Pharmaceutical Sciences, wydanie piętnaste (Matt Publishing Company, 1975), na stronach 1405 do 1412 i , oraz w narodowym receptariuszu, wydanie czternaste (American Pharmaceutical Association, 1975), między innymi. Przykłady odpowiednich wodnych i niewodnych nośników farmaceutycznych, rozcieńczalników, rozpuszczalników lub podłoży obejmują wodę, etanol, poliole (takie jak glicerol, glikol propylenowy, glikol polietylenowy i tym podobne), karboksymetylocelulozę i ich odpowiednie mieszaniny, oleje roślinne (takie jak oliwa z oliwek) oraz estry organiczne do iniekcji, takie jak oleinian etylu. Produkty (dawki i kompozycje) według niniejszego wynalazku mogą również zawierać dodatki, takie jak, ale nie wyłącznie, środki konserwujące, środki zwilżające, środki emulgujące i środki dyspergujące. W celu zapobieżenia wzrostowi drobnoustrojów mogą być włączone środki przeciwbakteryjne i przeciwgrzybicze i obejmują one, na przykład, paraben, chlorobutanol, fenol, kwas sorbinowy, i tym podobne. Ponadto, może być pożądane włączenie do kompozycji środków izotonicznych, takich jak cukry, chlorek sodu i tym podobne. [0034] W niektórych przypadkach, do uzyskania przedłużonego działania pożądane jest spowolnienie wchłaniania FSH i/lub hcg z iniekcji podskórnej lub domięśniowej. Można to osiągnąć przez zastosowanie ciekłej zawiesiny krystalicznej lub bezpostaciowej substancji o słabej rozpuszczalności w wodzie. Szybkość wchłaniania FSH i/lub hcg zależy wówczas od ich szybkości rozpuszczania, która z kolei może zależeć od wielkości kryształów i postaci krystalicznej. Alternatywnie, opóźnione wchłanianie podawanej pozajelitowo postaci skojarzonej FSH i hcg osiąga się przez rozpuszczenie lub zawieszenie kombinacji FSH i hcg w podłożu olejowym. Postacie depot do iniekcji mogą być wytwarzane przez formowanie mikroenkapsulowanych matryc FSH i hcg (i innych środków, jeśli są obecne) w biodegradowalnych polimerach, takich jak polilaktyd-poliglikolid. W zależności od stosunku FSH i hcg do polimeru i charakteru konkretnego stosowanego polimeru, może być regulowana szybkość uwalniania FSH i hcg. Przykłady innych biodegradowalnych polimerów obejmują poliwinylopirolidon, poli(ortoestry), poli(bezwodniki) itd. Formulacje depot do iniekcji wytwarza się także przez zamykanie FSH i hcg w liposomach lub mikroemulsjach, które są kompatybilne z tkankami organizmu. [0035] Formulacje i kompozycje do iniekcji można sterylizować, na przykład, przez filtrację przez filtr zatrzymujący bakterie lub przez włączenie środków sterylizujących w postaci sterylnych stałych kompozycji, które można rozpuszczać lub dyspergować w jałowej wodzie lub innym jałowym medium do iniekcji bezpośrednio przed zastosowaniem. Formulacje do iniekcji mogą być dostarczane w 8
10 dowolnym odpowiednim pojemniku, np. fiolce, wstępnie napełnionych strzykawkach, kartridżach do iniekcji i tym podobnych. Preparaty do iniekcji mogą być dostarczane jako produkt zawierający kompozycje farmaceutyczne obejmujące FSH i hcg do podawania razem lub oddzielnie. Przy podawaniu oddzielnie, podawanie może być sekwencyjne. Produkt może być dostarczony w dowolnym odpowiednim opakowaniu. Na przykład, produkt może zawierać pewną liczbę napełnionych strzykawek, z których każda zawiera albo FSH (kompozycja FSH) i hcg ( kompozycja hcg) albo kombinację (kompozycja zawierająca) zarówno FSH jak i hcg, np. strzykawki pakowane w opakowaniu typu blister lub w inny sposób w celu utrzymania sterylności. Produkt może ewentualnie zawierać instrukcje dotyczące stosowania formulacji FSH i hcg. [0036] ph i dokładne stężenie różnych składników produktu są dostosowywane zgodnie z rutynową praktyką w tej dziedzinie. Zobacz GOODMAN i GILMAN, THE PHARMACOLOGICAL BASIS FOR THERAPEUTICES, 7. wyd. W korzystnym wykonaniu produkty według wynalazku są dostarczane jako kompozycje do podawania pozajelitowego. Ogólne sposoby wytwarzania preparatów pozajelitowych są znane w dziedzinie i są opisane w REMINGTON; THE SCIENCE AND PRACTICE OF PHARMACY, jak wyżej, na stronach Produkty pozajelitowe mogą być dostarczane w ciekłej formulacji lub jako substancja stała, którą zmiesza się z jałowym medium do iniekcji tuż przed podaniem. W szczególnie korzystnym wykonaniu dostarczane są produkty do podawania pozajelitowego w postaci jednostek dawkowania w celu ułatwienia podawania i ujednolicenia dawkowania. [0037] Produkty i kompozycje według wynalazku wskazują konkretne dawki FSH i hcg lub równoważne im dawki. Dawki są określone w międzynarodowych jednostkach aktywności (IU), jak jest to dobrze znane w tej dziedzinie. W niniejszym opisie określenie "równoważny" oznacza równy lub zasadniczo równy pod względem aktywności terapeutycznej. Specjalista łatwo zrozumie, jak obliczyć lub określić dawkę odpowiednią lub równoważną dla danego preparatu FSH lub hcg. Szczegółowy opis wynalazku. Niniejszy wynalazek jest zdefiniowany w zastrzeżeniach [0038] Niniejszy wynalazek zostanie teraz opisany bardziej szczegółowo w odniesieniu do Figury 1, która przedstawia stężenie (ng/ml) progesteronu w osoczu w dniach stymulacji ("stym") 1, 6, 10 i dniu indukcji końcowego dojrzewania pęcherzyka przez podanie IU Pregnylu (hcg), dla ramion kontrolnego i niskich, średnich i wysokich dawek hcg. [0039] Badanie przeprowadzono w klinice bezpłodności Szpitala Uniwersyteckiego w Kopenhadze, zgodnie z odpowiednimi wymogami prawnymi, jak ICH Harmonised Tripartite Guideline dla GCP, istniejącym prawem duńskim jak i zasadami etycznymi Deklaracji Helsińskiej jak przyjęta przez 18te Światowe Zgromadzenie Medyczne w Helsinkach, Finlandia, w 1964 roku i późniejsze wersje. Oznacza to, że pacjenci otrzymali zarówno pisemne jak i ustne informacje oraz mieli możliwość obecności obserwatora podczas wywiadu informacyjnego i mieli czas na zastanowienie się. Pacjenci mogli swobodnie i w każdej chwili wycofać się z badania. Nazwisko i numer telefonu prowadzącego badanie zostały przekazane pacjentowi podczas rozmowy ustnej jak i w pisemnej informacji dla 9
11 uczestnika. Informacje dotyczące pacjentów chronione są przepisami ustawy dotyczącej danych osobowych, jak i ustawy o zdrowiu, sekcja 3 dotycząca sytuacji prawnej pacjentów. [0040] Uczestniczący pacjenci byli kobietami skierowanymi do kliniki na leczenie bezpłodności. Pacjentom spełniającym kryteria włączenia do badania oferowano informacje o badaniu. leczeniu bezpłodności (i/lub do kontrolowanej stymulacji jajników) u osobnika mającego poziom FSH w osoczu w wysokości 1 do 12 IU/l we wczesnej fazie pęcherzykowej. [0040] Uczestniczącymi pacjentami były kobiety skierowane do kliniki na leczenie bezpłodności. Pacjentkom spełniającym kryteria włączenia do badania oferowano informacje o badaniu. [0041] Kryteria włączenia do badania były następujące 1. Kobiety ze wskazaniem na COS i IVF; 2. Wiek pomiędzy lat; 3. BMI >18 i < 30 kg/m 2 ; 4. Regularny cykl miesiączkowy między 24 a 35 dniem i przypuszczalnie owulacyjny; 5. Dwa jajniki; 6. Jajowodowa lub niewyjaśniona bezpłodność, w tym endometrioza stopnia I/II; 7. Macica zgodna z oczekiwaną prawidłową funkcją (np. brak ingerujących klinicznie mięśniaków macicy) udokumentowaną za pomocą USG przezpochwowego podczas skriningu; 8. Mężczyzna - partner z jakością nasienia kompatybilną do zapłodnienia procedurą IVF lub z poprzednią ciążą kliniczną; 9. Poziomy FSH w surowicy1-12 IU/I we wczesnej fazie pęcherzykowej; 10. Całkowita liczba pęcherzyków antralnych (2-10 mm) we wczesnej fazie pęcherzykowej 6; 11. Potwierdzenie regulacji w dół przed randomizacją za pomocą przezpochwowego USG; 12. Chętne i zdolne do podpisania świadomej zgody. Kryteria wyłączenia były następujące: 1. Historia lub aktualny PCOS, endometrioza stopnia III/IV lub ciężki czynnik męski wymagający ICSI; 2. Historia ciężkiego zespołu hiperstymulacji jajników (OHSS); 3. Obecność jednostronnego lub obustronnego wodniaka jajowodu w USG; 4. Więcej niż trzy wcześniejsze cykle COS; 5. Poprzednia słaba odpowiedź na cykl IVF, zdefiniowana jako> 20 dni stymulacji gonadotropiną, odwołanie ze względu na ograniczoną odpowiedź pęcherzykową lub mniej niż cztery pęcherzyki o średnicy 15 mm; 6. Poprzedni cykl IVF z nieudanym zapłodnieniem, zdefiniowanym jako zapłodnienie 20% pobranych komórek jajowych; 7. Historia powtarzających się poronień; 8. FSH>12 IU/l lub LH>12 UI/l (wczesna faza pęcherzykowa); 9. Przeciwwskazania do stosowania gonadotropiny lub analogów GnRH; 10
12 10. Niedawna historia obecnej padaczki, zakażenie HIV, cukrzyca lub choroby układu krążenia, przewodu pokarmowego, wątroby, nerek lub płuc; 11. Ciąża, laktacja i przeciwwskazania do ciąży; 12. Obecne przeszłe (ostatnie 12 miesięcy) nadużywanie alkoholu lub narkotyków; 13. Historia chemioterapii (z wyjątkiem stanów ciążowych) lub radioterapii; 14. Niezdiagnozowane krwawienie z pochwy; 15. Nowotwory jajnika, piersi, nadnerczy, przysadki lub podwzgórza i wady rozwojowe narządów płciowych uniemożliwiające zajście w ciążę; 16. Nieprawidłowy kariotyp pacjenta (jeśli przeprowadza się kariotypowanie); 17. Nadwrażliwość na którykolwiek badany produkt. [0042] Pacjentki zostały poddane procesowi skriningu, który obejmował pełną historię medyczną i ginekologiczną (w tym historię bezpłodności); przezpochwowemu USG z pomiarem objętości jajników, liczby pęcherzyków antralnych i grubości endometrium, oraz potwierdzeniu obecności obu jajników i wykluczeniu wodniaka jajowodu, endometriozy i nieprawidłowości jajników; pełnemu pomiarowi wysokości, wagi, itp; i pobraniu próbek krwi (FSH, LH i AMH). [0043] Każdej pacjentce podawano donosowo agonistę GnRH Synarela (RTM) (200 mikrogramów) w 21. dniu cyklu. Regulację w dół potwierdzono przezpochwowym USG w dniu 35 i zdefiniowano jako krwawienia miesiączkowe i przezpochwowe USG wykazujące złuszczone endometrium o grubości mniejszej niż 5 mm, bez torbieli jajnika. Po potwierdzeniu regulacji w dół każdą pacjentkę randomizowano do jednej z czterech grup dla etapu stymulacji, jak określono poniżej (grupy określane są jako ramię kontrolne, ramię niskiej dawki hcg, ramię średniej dawki hcg lub ramię wysokiej dawki hcg). Podawanie antagonisty GnRH kontynuowano z kontrolowaną stymulacją jajników poniżej. [0044] Etap kontrolowanej stymulacji jajników rozpoczęto w 35 dniu cyklu (tutaj "dzień stymulacji 1", " 1 dzień leczenia " lub "dzień leczenia 1"). Wszystkim pacjentkom (n = 62) podawano rekombinowany FSH w 150 IU/dzień w postaci dostępnego w handlu preparatu Puregon (RTM) (N.V. Organon, Oss, Holandia) zaczynając od 1 dnia leczenia (dzień stymulacji 1). Pacjentki w grupie niskiej, średniej i wysokiej dawki hcg leczono dostępnym w handlu preparatem hcg (Predalon (RTM) Organon, Berlin, Niemcy), rozpoczynając od 1 dnia leczenia (dzień stymulacji 1), po randomizacji. Czterema grupami badania są: 1 Ramie kontrolne ("Dawka 0" lub "D0") 150 IU/dzień samego rfsh 2 Niska dawka hcg ("Dawka 50" lub "D50") 150 IU/dzień rfsh i 50 IU/dzień hcg od 1 dnia stymulacji / 1 dzień leczenia 3 Średnia dawka hcg ("Dawka 100" lub "D100") 4 Wysoka dawka hcg ("Dawka 150" lub "D150") 150 IU/dzień rfsh i 100 IU/ dzień hcg od 1 dnia stymulacji / 1 dzień leczenia 150 IU/ dzień rfsh i 150 IU/ dzień hcg od 1 dnia stymulacji / 1 dzień leczenia 11
13 W 1 dniu stymulacji, pielęgniarka biorąca udział w badaniu poinstruowała pacjentkę, jak mieszać lek. Pacjentka została poinstruowana, aby każdego dnia otworzyć nową ampułkę Predalonu 500 IU i rozcieńczyć to odpowiednio, przed podaniem. Innymi słowy, w tym badaniu FSH i hcg podawano w tej samej iniekcji. Dawkę rfsh utrzymywano na stałym poziomie, niezależnie od odpowiedzi u wszystkich pacjentek, z wyjątkiem przypadków (n = 3), gdzie istniało nieuchronne ryzyko OHSS, gdzie dopuszczalne było zmniejszenie dawki rfsh, po 5 dniu. Cel dla stymulacji jajników był ustawiony na 7-15 komórek jajowych przy pobieraniu, a maksymalny całkowity czas trwania stymulacji wynosił 20 dni. Korzystnie, długość stymulacji [tj. podawanie FSH we wszystkich badanych grupach i hcg w badanych grupach 2, 3 lub 4] trwała od 9 do 13 dni. USG przeprowadzono w dniach 1, 6, 8 i 10 oraz w dniu indukowania końcowego dojrzewania pęcherzyków. Między 10 dniem i dniem indukowania ostatecznego dojrzewania pęcherzyków za pomocą owulacyjnej dawki hcg pacjentkę skanowano co drugi lub trzeci dzień. USG było stosowane do pomiaru ilości i wielkości kategorii każdego pęcherzyka podczas stymulacji. USG stosowano również do pomiaru grubości endometrium, wzoru trójwarstwowego i i echogeniczności, w 1 dniu 1, 6 dniu i ostatniego dnia stymulacji. Gdy badanie USG wykazało, że było 3 pęcherzyki przy wielkości mm, dużą dawkę hcg (10000 IU Pregnylu, N.V. Organon, Oss, Holandia) podawano wieczorem lub dzień po indukowaniu ostatecznego dojrzewania pęcherzyków; ta wysoka dawka jest dobrze znana w tej dziedzinie. [0045] Próbki krwi pobierano w dniach 1, 3, 6, 8, 10 i w dniu indukowania końcowego dojrzewania pęcherzykowego, a także w dniach, w których przeprowadzono badanie USG. Próbki krwi stosowano do oceny hcg, FSH, LH, estradiolu, progestoronu, androstendionu, całkowitego testosteronu, hormonu płciowego wiążącego globulinę (SHBG), inhibiny B i hormonu anty-mullerowskiego (AMH). Próbki krwi wiruje się przez 12 minut przy 3000 x g, a surowicę przechowuje się osobno w -18 C i później analizuje się ilościowo dla wszystkich próbek w tej samej serii. Analizy hcg, androstendionu i progesteronu przeprowadzono w Laboratorium für Klinische Forschung (LKF; Raisdorf, Niemcy). Estradiol, FSH, LH i AMH analizowano w Zakładzie Biochemii Klinicznej, Rigshospitalet, Dania. [0046] Dla każdej pacjentki, pobranie komórek jajowych i transfer embrionu przeprowadzono w zwykły sposób. Pobieranie komórek jajowych odbyło się 36h (± 2 godziny) po indukcji ostatecznego dojrzewania pęcherzyków za pomocą podawania r-hcg. Ze wszystkich pęcherzyków zebrano płyn pęcherzykowy i oceniano ilość dla każdego pęcherzyka. Odnotowano, czy komórkę jajową otrzymano z pęcherzyka, czy nie. Ocena wyglądu masy wzgórka i zebranie niektórych (zluteinizowanych) komórek ziarnistych i komórek wzgórka przeprowadzono przy pobieraniu komórek jajowych. [0047] Zapłodnienie przez zwykłe IVF miało miejsce 3 godziny (± 2 h) po pobraniu komórki jajowej według zwykłej procedury klinicznej. [0048] Wszystkie komórki jajowe były obserwowane indywidualnie i oceniono jakość w dniu pobierania i 1, 2 i 3 dnia po pobraniu komórki jajowej. Zapłodnienie i jakość zarodka oceniano (z zastosowaniem mikroskopu odwróconego) 20 h (± 2 h), 26 h (± 2 h), 44 h (± 2 h) i 68 h (± 2 h) po pobraniu komórki jajowej. Ocena jakości zarodków składała się z oceny liczby komórek i trzech parametrów morfologii zarodka: stopnia rozdrobnienia, blastomerowej jednolitości i wielojądrzastości. Oceniono liczbę embrionów najwyższej jakości: najwyższej jakości zarodek jest określony jako cztery 12
14 do pięciu komórek w 2 dniu, siedem lub więcej komórek w 3 dniu, równej wielkości blastomery i 20% fragmentacji w 3 dniu i brak wielojądrzastości. Definicja "najwyższej jakości zarodka" jest dobrze znana w tej dziedzinie. Jeden lub dwa z najlepszych zarodków przeniesiono pacjentce w 3 dniu po pobraniu komórki jajowej (inne poddano krioprezerwacji do zastosowania w transferze zamrożonych zarodków FER). Dwa tygodnie po przeniesieniu zarodka w celu potwierdzenia ciąży przeprowadzono test ciążowy. Jeśli test ten był pozytywny, USG wykonano pięć do sześciu tygodni po transferze zarodka. Dla celów badania, pacjentka została uznana za gotową w przypadku negatywnego s-hcg w dniu po przeniesieniu zarodka. W przypadku pozytywnego s-hcg pacjentka była skanowana przy ciąży klinicznej (7-8 tygodnia ciąży) oraz w trwającej ciąży (10-12 tydzień ciąży). Część kliniczna badania została w tym czasie oficjalnie zamknięta, ale wszystkie ciąże były (będą) obserwowane do dnia porodu. Ponadto, niektóre pacjentki, które nie osiągnęły trwającej ciąży, mają kriokonserwowane niewykorzystane zarodki, a niektóre pacjentki, które nie osiągnęły trwającej ciąży, mają jeszcze niewykorzystane kriokonserwowane zarodki. Wszystkie ciąże były obserwowane do porodu. Ponadto, zamrożone zarodki otrzymane z badań obserwowano rok po zakończeniu badania. [0049] Pochwowy progesteron podawano w postaci tabletek Progestanu 200 mg x 3/dzień dla lutealnego wsparcia od dnia przeniesienia zarodka do momentu potwierdzenia ciąży lub negatywnego testu βhcg w surowicy dni po przeniesieniu zarodka. Jest to dobrze znane w tej dziedzinie. Wyniki [0050] Wyniki przedstawione są w Tabelach I-VI. Tabela I zawiera dane na dzień 10 września Tabela II jest podobna do Tabeli I zaktualizowanej, aby zawierała dane z obserwacji do jednego roku po zakończeniu badania i jest prawidłowa na 17 sierpnia Poziomy progesteronu w osoczu określone z próbek krwi są przedstawione na Fig. 1. [0051] Badanie wykazało, że podawanie 100 lub nawet 150 IU hcg w dziennej dawce wraz ze 150 IU FSH, dostarcza skutecznej kontrolowanej stymulacji jajników (COS). Wstępne wyniki badań (Tabela 1) wskazują, że włączenie hcg, zwłaszcza około 100 IU hcg do 150 IU hcg w dziennej dawce, na przykład, wraz z 150 IU FSH, może zapewnić pewną optymalizację w porównaniu z samym FSH. Badania nie wykazały żadnych oznak szkodliwego wpływu na jakość odpowiedzi jajników, zarodek lub ciążę. [0052] Kliniczne wyniki według grup leczenia przedstawiono w Tabeli I i II. [0053] Pobieranie komórek jajowych przeprowadzono dla wszystkich pacjentek z wyjątkiem jednej pacjentki w D100, ponieważ nie było rozwoju pęcherzyków. Konwersję do ICSI przeprowadzono dla jednej pacjentki w D100 i jednej pacjentki w D150. Przeniesienia nie osiągnięto dla siedmiu pacjentek z powodu braku komórek jajowych przy pobieraniu, niepowodzenia w zapłodnieniu i braku zdolnych do przeniesienia zarodków. Przeniesienie blastocysty w dniu 5 przeprowadzono u dwóch pacjentek (D100.D150) z powodu bólów brzucha i podejrzenia zakażenia w 2 dniu, co opóźniło przeniesienie. Nie potwierdzono żadnego zakażenia. 13
15 [0054] Grupa średniej dawki hcg (D100) wykazała najwyższy skumulowany wskaźnik ciąż na rozpoczęty świeży cykl (około 69%, Tabela 1). [0055] Liczbę zarodków najwyższej jakości na pacjentkę analizowano jako liczbę Poissona (Tabela IV). Średnia liczba zarodków najwyższej jakości na pacjentkę wynosiła D0: 0,8 ± 1,2, D50: 0,5 ± 0,7, D100: 1,2 ± 1,7 i D150: 1,5 ± 1,7 (p = 0,04). Te średnie wartości dla czterech grup porównano i D150 miała statystyczne znacząco wyższą średnią liczbę w porównaniu z D50 (Tabela IV). Tak więc stwierdzono, że znaczący wpływ hcg na liczbę najwyższej jakości zarodków nastąpił 3 dnia. Najwyższą liczbę stwierdzono w grupie, której podawano 150 IU hcg na dzień. [0056] Poziomy hormonu w surowicy są przedstawione w Tabeli VI. Stały poziom s-hcg osiągnięto w 6 dniu stymulacji. [0057] W dniu podawania hcg, w celu zaindukowania ostatecznego dojrzewania pęcherzyków ("Dzień hcg", patrz Tabela VI), poziomy hcg w osoczu (IU /l) wynosiły D0: <0,1, D50: 3,1 (2,6-3,6), D100: 5,5 (4,1-7,4) i D150: 11,0 (8,9-13,6) (p <0,001). Tak więc, poziom hcg w osoczu niemal podwoił się, gdy dawkę hcg zwiększono o 50 IU. Poziomy s-androstendionu znacznie wzrosły przy wyższych dawkach hcg. W dniu hcg dwie grupy, którym podano najwyższe dawki hcg, miały najwyższe poziomy S-estradiolu (p = 0,090). D150 miał najwyższy s-progesteron i był znacząco różny od D0 przy najniższej wartości. Poziomy FSH i LH nie różniły się między grupami. [0058] Celem badania było znalezienie dawki hcg, która osiągnęłaby "poziom sufitu", powyżej którego niektóre z mierzonych parametrów byłyby mniej korzystne dla ciąży. Dla progesteronu, zwiększenie dawek powyżej 150 IU progesteronu zaindukowało średnie wartości w osoczu sięgające 1,2 ng/ml (patrz Tabela VI, Fig. 1). Zbliżały się one do wartości 1,5 mg/l, co do której wykazano, że zmniejsza częstotliwość trwającej ciąży (Andersen, Devroey et al, 2006;. Bosch, Labarta et al, 2010). Stwierdzono również, że wysoka dawka hcg była związana ze zwiększonym zgrubieniem endometrium, co jest być może także związane ze zmniejszeniem częstotliwości trwającej ciąży. [0059] Wyniki sugerują, że jeśli głównym celem jest dostarczenie wielu zarodków najwyższej jakości (np. dostarczenie części zarodków dla późniejszego zamrażania), wtedy odpowiednia może być suplementacja np. 150 IU hcg (wyższa dawka). Jednakże, jeżeli w cyklu pobierania celem jest także trwająca ciąża, dawka około 100 IU hcg może być bardziej odpowiednia, ponieważ dostarcza kombinacji dużej liczby zarodków najwyższej jakości, z największą szansą na trwającą ciążę. Niepożądane zdarzenia [0060] Zespołu hiperstymulacji jajników (OHSS) nie zaobserwowano w dwóch grupach z najwyższym hcg, co sugeruje dalsze zalety tych dawek; u dwóch pacjentek, po jednej w każdej grupie, D0 i D50 odpowiednio, zdiagnozowano OHSS. Jedna pacjentka w D50 miała skręt jajnika. Przeniesienie blastocysty 5 dnia przeprowadzono u dwóch pacjentek (D100, D150) z powodu bólu brzucha i podejrzenia zakażenia w 2 dniu, co opóźniło transferu. Nie potwierdzono żadnego zakażenia. [0061] Z powodu ciąży pozamacicznej (2) i poronień (3) łączna liczba strat ciąży wynosiła pięć. 14
16 Tabela I. Wynik cyklu IVF 1 u 60 pacjentek protokołu pen* leczonych FSH, zgodnie z dawkami hcg wynoszącymi 0, 50, 100 i 150 IU/dzień, podawanymi jako współleczenie od 1 dnia stymulacji. Dawka 0 Dawka 50 Dawka 100 Dawka 150 Cykl Aspiracje Przeniesienie Trwanie leczenia (dni) 10,25 9,33 9,88 10,80 Całkowita dawka (IU) Pobrane komórki jajowe 9,3 8,5 8,6 11,3 Zarodki najwyższej jakości na pacjenta 0,75 (12/16) 0,47 (7/15) 1,18(19/16) 1,50 (19/13) Zarodki zamrożone (n) Zarodki zamrożone na pacjentkę 2,75 2,70 2,82 3,15 Grubość endometrium (mm), dni hcg 9,61 9,66 9,51 11,17 Pozytywna hcg / rozpoczęty cykl 7/16 (43,8%) 5/15 (33,3%) 7/16 (43,8%) 5/13 (38,5%) Ciąża kliniczna / rozpoczęty cykl 4/16 (25,0%) 4/15 (26,7%) 6/16 (37,5%) 5/13 (38,5%) Ciąża trwająca / rozpoczęty cykl 4/16 (25,0%) 4/15 (26,7%) 4/16 (25,0%) 4/13 (30,8%) Ciąże mnogie po "świeżych cyklach" (n) Liczba cykli FER 2 w czerwcu Pozytywna hcg po cyklach FER / FER 1/6 (16,7%) 2/7 (28,6%) 4/8 (50%) 1/2 (50%) Ciąża trwająca po FER (n) Ciąże mnogie po FER (n) Skumulowana liczba pozytywnej hcg / rozpoczęty "świeży" cykl Skumulowana liczba ciąży trwających / rozpoczęty "świeży" cykl 8/16 (50%) 7/15 (46,7%) 11/16 (68,8%) 6/13 (46,2%) 5/16 (31,3%) 5/15 (33,3%) 7/16 (43,8%) 5/13 (38,5%) Skumulowane ciąże mnogie (n)
17 * Dwie pacjentki wycofały się po randomizacji do 150 IU / dzień hcg. Ich cykle zostały anulowane odpowiednio po 9 i 3 dniach stymulacji. Wynikało to z dużego błędu dozowania hcg. Zamiast 150 IU/dzień, jednej pacjentce wstrzykiwano 1500 IU dziennie przez 3 dni, a drugiej pacjentce wstrzyknięto 1500 IU w 2 dniu stymulacji.. 1 Dana na 1 września FER oznacza przeniesienie zamrożonych zarodków Tabela II. Wynik cyklu. Dawka 0 Dawka Dawka 100 Dawka 150 Wartość P (n=16) 50 (n=15) (n=16) (n=13) Czas trwania leczenia (dni) 10,3 ± 1,4 9,3 ± 1,4 9,9 ± 1,3 10,4 ± 1,1 0,14 Całkowita dawka rfsh (IV) 1538 ± ± ± ± 163 0,10 Pacjentki, które osiągnęły pobieranie komórek jajowych [n(%)] Pobrane komórki jajowe / na pobranie 16 (100) 15 (100) 15 (94) 13 (100) 0,42 9,3 ± 6,3 8,5 ± 4,4 9,2 ± 4,2 11,3 ± 5,7 0,53 Wskaźnik zapłodnienia (%) a 0,77±0,27 0,72±0,27 0,83±0,23 0,67±0,34 0,51 Szybkość bruzdkowania b 0,72 ± 0,27 0,66±0,27 0,77 ± 0,23 0,60 ± 0,34 0,41 Pacjentki z przeniesieniem zarodków [n (%)] 14(88) 14 (93) 15 (94) 10 (77) 0,48 Przeniesione zarodki 1,1 ± 0,27 1,1 ± 0,27 1,2 ± 0,41 1,0 ± 0,0 0,37* SET [n (% na przeniesienia zarodków)] Całkowity wskaźnik Całkowity wskaźnik implantacji c (%) 13 (93) 13(93) 12 (80) 10 (100) 0,37 4/15 (27) 4/15 (27) 5/18 (28) 4/10 (40) 0,78 Pacjentki z zamrożonymi zarodkami 8 (50) 8 (53) 12 (75) 8 (62) 0,48 Zamrożone zarodki na pacjentkę 2,8 ± 3,7 2,2 ± 2,6 2,8 ± 2,4 3,2 ± 3,4 0,87 Pozytywna hcg / rozpoczęty cykl 7 (44) 5 (33) 7 (44) 5 (39) 0,92 Ciąża kliniczna / rozpoczęty cykl 4 (25) 4 (27) 6 (38) 4 (31) 0,87 Żywe narodziny d / rozpoczęty cykl Liczba cykli FER Pozytywna hcg po cyklach FER / FER Żywe narodziny po FER (n) 4 (25) 4 (27) 7 4 (25) 4 (31) 2 0,98 1 (17) 2 (29) 1 4 (50) 3 1 (50) 1 0,57 16
18 Skumulowana liczba żywych narodzin / rozpoczęty świeży cykl 5 (31) 5 (33) 7 (44) 5 (39) 0,89 Wartości są średnią ± SD lub liczbą (procent kolumny). a Zapłodnione komórki jajowe na pobraną nieuszkodzoną komórkę jajową. Komórka b> 1 dnia 2 na nieuszkodzoną zaaspirowaną komórkę jajową. c Ciążowe pęcherzyki na przeniesione zarodki. d Wszystkie świeże przeniesienia były pojedyncze. e Dwie mnogie ciąże po FER. *test nieparametryczny Tabela III. Charakterystyki stymulacji Dawka 0 Dawka 50 Dawka 100 Dawka 150 (n=13) Wartość (n=16) (n=15) (n=16) P Dzień hcg Pęcherzyki 10 mm 8,6 ± 4,8 7,7 ± 4,2 7,2 ± 4,2 7,9 ± 4,5 0,86 Pęcherzyki mm 7,9 ± 5,8 6,7 ± 5,1 6,5 ± 4,0 5,3 ± 4,4 0,58 Pęcherzyki 15 mm 5,8 ± 2,0 6,4 ± 2,6 7,9 ± 3,6 7,5 ± 2,9 0,16 Endometrium (mm) 1 Dzień stymulacji 3,0 ± 0,9 2,9 ± 1,0 2,6 ± 0,6 2,7 ± 0,8 0,48 6 Dzień stymulacji 6,2 ± 1,7 6,8 ± 2,2 6,7 ± 1,6 6,8 ± 1,8 0,71 Dzień hcg 9,6 ± 1,8 9,7 ± 2,3 10,1 ± 1,9 11,2 ± 2,5 0,20 Wartości są średnią ± SD. Tabela IV. Główny punkt końcowy Dawka Dawka Dawka Dawka Wartość 0(n=16) 50(n=15) 100(n=16) 150(n=13) P Całkowita liczba zarodków (n) Całkowita liczba zdolnych do przeniesienia zarodków (n) Całkowita liczba zarodków najwyższej jakości(n)
19 Zarodki na pacjentkę a 6,4 ± 4,7 4,7 ± 3,6 6,2 ± 4,3 6,8 ± 5,7 0,44 Zdolne do przeniesienia zarodki na pacjentkę a Zarodki najwyższej jakości na pacjentkę a 3,1 ± 3,9 2,3 ± 2,3 3,6 ± 2,6 3,6 ± 3,5 0,65 0,8 ± 1,2 0,5 ± 0,7 1,2 ± 1,7 1,5 ± 1,7 0,23 Zarodki najwyższej jakości b 0,8 ± 1,2 0,5 ± 0,7 1,2 ± 1,7 1,5 ± 1,7 0,04 Pacjentki z zarodkami najwyższej jakości [n (%)] 6(38) 5 (33) 8 (50) 8 (62) 0,43 Zarodki najwyższej jakości / pobrane komórki jajowe (%) 8,2 ± 13,2 6,1 ± 11,4 13,7 ± 16,8 12,3 ± 13,8 0,44 Wartości są średnią ± SD lub liczbą (procent kolumny). a ANOVA. b Rozkład Poissona. Tabela V. Główny punkt końcowy. Poziomy hcg 6 Dnia. Poziomy hcg 6 dnia stymulacji (IU/L) 0,5-3,5(n=16) 3,6-8,0(n=14) 8,1-21,1(n=14) P-value Zarodki najwyższej jakości na pacjentkę 0,5 ± 0,9 1,1 ± 1,8 1,5 ± 1,5 0,03 a Wartości są średnią ± SD. a Rozkład Poissona Tabela VI. Wyniki endokrynologiczne. Dawka 0 Dawka 50 Dawka 100 Dawka 150 Wartość (n=16) (n=15) (n=16) (n=13) P hcg (UI/l) 1 Dzień stymulacji <0,1 <0,1 <0,1 <0,1 3 Dzień stymulacji <0,1 1,6 (1,2-2,1) 3,1 (2,2-4,4) 6,3 (5,2-7,7) <0,01* 6 Dzień stymulacji <0,1 2,2 (1,1-4,1) 5,7 (4,4-7,5) 10,5 (8,5-13,2) <0,01* 8 Dzień stymulacji <0,1 2,9 (2,3-3,6) 5,8 (4,3-7,7) 10,8 (8,5-13,8) <0,01* 10 Dzień stymulacji <0,1 2,8 (1,7-4,7) 5,7 (3,9-8,3) 11,2 (8,4-15,1) <0,01* 18
20 Dzień hcg <0,1 3,1 (2,6-3,6) 5,5 (4,1-7,4) 11,0 (8,9-13,6) <0,01 Androstenodion (ng/ml) 1 Dzień stymulacji 1,1 (0,9-1,2) 1,3 (1,1-1,6) 1,1 (0,9-1,4) 1,1 (0,9-1,2) 0,27 6 Dzień stymulacji 1,2 (1,0-1,4) 1,8 (1,5-2,1) 1,5 (1,3-1,9) 1,5 (1,2-1,8) 0,03 Dzień hcg 2,1 (1,6-2,6) 3,2 (2,3-4,5) 4,0 (3,2-5,0) 4,6 (3,5-6,1) <0,01 Progesteron (ng/ml) 1 Dzień stymulacji 6 Dzień stymulacji 8 Dzień stymulacji Dzień stymulacji Dzień hcg Estradiol (nmol/l) 0,48 (0,38-0,59) 0,47 (0,39-0,57) 0,61 (0,49-0,76) 0,62 (0,47-0,82) 0,72 (0,58-0,89) 0,59 (0,45-0,77) 0,43 (0,34-0,55) 0,45 (0,34-0,60) 0,24 0,72 (0,58-0,90) 0,47 (0,36-0,60) 0,51 (0,39-0,60) 0,02 0,77 (0,58-1,02) 0,63 (0,51-0,78) 0,62 (0,46-0,82) 0,48 0,82 (0,53-1,26) 0,66 (0,47-0,91) 0,97 (0,72-1,31) 0,09 1,03 (0,79-1,34) 0,92 (0,79-1,08) 1,17 (0,82-1,67) 0,03 1 Dzień stymulacji <0,1 <0,1 <0,1 <0,1 3 Dzień stymulacji 0,2 (0,1-0,2) 0,3 (0,1-0,4) 0,2 (0,1-0,3) 0,2 (0,1-0,2) 0,31 6 Dzień stymulacji 0,8 (0,1-1,2) 1,9 (1,2-3,0) 1,3 (0,7-2,3) 1,2 (0,7-2,0) 0,09 8 Dzień stymulacji 1,7 (1,1-2,5) 2,5 (1,1-5,5) 3,4 (1,9-6,0) 3,5 (2,4-5,2) 0,19 Dzień stymulacji 4,1 (3,0-5,6) 5,9 (3,5-9,8) 4,6 (1,8-11,8) 7,3 (4,1-13,1) 0,41 Dzień hcg FSH (UI/l) 6,3 (3,7-10,8) 10,0 (6,3-16,0) 12,8 (9,5-17,2) 12,0 (7,2-20,0) 0,09 1 Dzień stymulacji 3,0 (2,3-4,1) 3,2 (2,5-4,1) 3,1 (2,4-4,1) 2,4 (1,7-3,2) 0,43 3 Dzień stymulacji 8,9 (8,0-9,9) 9,1 (8,3-9,9) 8,8 (7,6-10,1) 8,8 (7,8-9,9) 0,97 6 Dzień stymulacji 8 Dzień stymulacji Dzień stymulacji Dzień hcg LH (UI/l) 11,6 (10,7-12,7) 11,7 (10,7-12,9) 10,8 (9,8-12,1) 11,2 (10,2-12,2) 11,6 (10,5-12,9) 11,7 (10,3-13,3) 11,2 (10,1-12,4) 0,93 10,9 (8,7-13,6) 11,9 (10,4-13,6) 11,8 10,6-13,1) 0,77 12,5 (10,6-14,6) 11,8 (9,7-14,2) 12,5 (10,8-14,6) 0,35 11,7 (10,4-13,2) 10,9 (9,6-12,4) 11,7 (10,4-13,1) 0,73 19
21 1 Dzień stymulacji 3,0 (2,3-4,1) 3,2 (2,5-4,1) 3,1 (2,4-4,1) 2,4 (1,7-3,2) 0,43 3 Dzień stymulacji 2,1 (1,7-2,7) 2,1 (1,6-2,8) 2,1 (1,5-2,9) 1,7 (1,3-2,2) 0,48 6 Dzień stymulacji 1,9 (1,5-2,4) 1,9 (1,4-2,8) 1,7 (1,3-2,1) 1,2 (0,8-1,9) 0,15 8 Dzień stymulacji 1,7 (1,2-2,3) 1,9 (1,2-3,0) 2,2 (1,7-2,9) 1,5 (1,0-2,1) 0,35 Dzień stymulacji 1,9 (1,4-2,5) 1,7 (0,9-3,4) 2,3 (1,5-3,5) 2,0 (1,2-3,4) 0,72 Dzień hcg 2,1 (1,5-2,9) 1,9 (1,3-2,6) 2,1 (1,6-2,8) 1,5 (1,1-2,1) 0,41 Wartości są średnią i 95% CI. Bezwzględna różnica pomiędzy grupami (%) * Test nieparametryczny Wniosek [0062] Suplementacja 100 lub 150 IU hcg od pierwszego dnia stymulacji może zwiększyć wskaźnik ciąż i/lub liczbę zarodków najwyższej jakości. Zastrzeżenia 1. Produkt obejmujący hormon folikulotropowy (FSH) i ludzką gonadotropinę kosmówkową (hcg) do zastosowania w leczeniu bezpłodności, w którym FSH jest do podawania w dawce wynoszącej lub w dawce równoważnej 75 do 250 IU FSH na dzień rozpoczynając pierwszego dnia leczenia i kontynuując przez kolejne dwa do dwudziestu dni; i hcg jest do podawania w dawce wynoszącej lub w dawce równoważnej 75 do 160 IU hcg na dzień, rozpoczynając pierwszego dnia leczenia i kontynuując przez dwa do dwudziestu dni. 2. Produkt do zastosowania według zastrzeżeń 1 lub 2, w którym FSH jest do podawania w dawce wynoszącej lub w dawce równoważnej 75 do 200 IU FSH na dzień, na przykład w dawce wynoszącej lub w dawce równoważnej 140 do 160 IU FSH, na dzień. 3. Produkt do zastosowania według zastrzeżeń 1 lub 2, w którym FSH jest rekombinowanym FSH i/lub w którym hcg jest rekombinowanym hcg. 4. Produkt do stosowania według któregokolwiek z poprzednich zastrzeżeń, w którym dzienne (lub równoważne) dawki FSH i hcg są do podawania razem lub do podawania w ciągu sześciu godzin po sobie. 5. Produkt do zastosowania według któregokolwiek z poprzednich zastrzeżeń do podawania 12 do 16 dni po podaniu agonisty GnRH lub do podawania z antagonistą GnRH. 20
22 6. Produkt do zastosowania według któregokolwiek z poprzednich zastrzeżeń, w którym FSH jest do podawania rozpoczynając od pierwszego dnia leczenia i kontynuując przez siedem do trzynastu dni, i/lub w którym hcg jest do podawania rozpoczynając od pierwszego dnia leczenia i kontynuując przez siedem do trzynastu dni. 7. Produkt do zastosowania według któregokolwiek z poprzednich zastrzeżeń, w którym hcg jest do podawania w dawce wynoszącej lub w dawce równoważnej 90 do 110 IU hcg na dzień lub w dawce wynoszącej lub w dawce równoważnej 100 lub 150 IU hcg na dzień. 8. Produkt do zastosowania według któregokolwiek z poprzednich zastrzeżeń obejmujący pierwszą kompozycję, która obejmuje FSH, do podawania w dawce wynoszącej 140 do 160 IU FSH na dzień i drugą kompozycję obejmującą hcg do podawania w dawce 75 do 160 IU hcg na dzień. 9. Produkt do zastosowania według dowolnego z poprzednich zastrzeżeń obejmujący pojedynczą kompozycję obejmującą FSH i hcg. 10. Produkt do zastosowania według dowolnego z poprzednich zastrzeżeń, do podawania przed podaniem dużej dawki hcg w celu zaindukowania końcowego dojrzewania pęcherzyków. 11. Produkt do zastosowania według dowolnego z poprzednich zastrzeżeń do stosowania w leczeniu bezpłodności (i/lub do kontrolowanej stymulacji jajników) u osobniczki z jajowodową lub niewyjaśnioną bezpłodnością, na przykład u osobniczki z endometriozą i/lub u osobniczki mającej bezpłodność z braku owulacji typu II WHO; i/lub do stosowania w leczeniu bezpłodności (i/lub do kontrolowanej stymulacji jajników) u osobniczki mającej poziom FSH w osoczu w wysokości 1 do 12 IU/l we wczesnej fazie pęcherzykowej. 12. Produkt obejmujący hormon folikulotropowy (FSH) i ludzką gonadotropinę kosmówkową (hcg) do zastosowania w leczeniu bezpłodności w celu rozwoju jednego lub więcej zarodków najwyższej jakości, przy czym FSH jest do podawania w dawce wynoszącej lub równoważnej 75 do 250 IU FSH na dzień rozpoczynając od pierwszego dnia leczenia i kontynuując przez kolejne dwa do dwudziestu dni; a hcg jest do podawania w dawce wynoszącej lub równoważnej 140 do 190 IU hcg na dzień rozpoczynając od pierwszego dnia leczenia i kontynuując przez kolejne dwa do dwudziestu dni. 13. Produkt do zastosowania według zastrzeżenia 12, w którym leczenie obejmuje ponadto etap zamrażania co najmniej jednego otrzymanego zarodka najwyższej jakości. 21
23 S-Progesteron Progesteron (ng/ml) Dawka 0 Dawka 50 Dawka 100 Dawka 150 Stym. 1 Stym. 6* Stym. 8 Stym. 10 Dzień hcg* 22
24 ODNIESIENIA CYTOWANE W OPISIE Lista odnośników cytowanych przez zgłaszającego ma jedynie służyć wygodzie czytelnika. Nie stanowi ona części europejskiego dokumentu patentowego. Mimo że wyboru odnośników dokonano z wielką starannością, nie można wykluczyć błędów lub przeoczeń, a EUP nie bierze żadnej odpowiedzialności w tym względzie. Dokumenty patentowe cytowane w opisie Literatura niepatentowa cytowana w opisie 23
(86) Data i numer zgłoszenia międzynarodowego: , PCT/EP00/02466 (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 199569 (21) Numer zgłoszenia: 351327 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 21.03.2000 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 199569 (21) Numer zgłoszenia: 351327 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 21.03.2000 (86) Data i numer zgłoszenia
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1773451 (96) Data i numer zgłoszenia patentu europejskiego: 08.06.2005 05761294.7 (13) (51) T3 Int.Cl. A61K 31/4745 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1773451 (96) Data i numer zgłoszenia patentu europejskiego: 08.06.2005 05761294.7 (13) (51) T3 Int.Cl. A61K 31/4745 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
Rekomendacje dotyczące diagnostyki i leczenia niepłodności
 Rekomendacje dotyczące diagnostyki i leczenia niepłodności Polskie Towarzystwo Ginekologiczne Polskie Towarzystwo Medycyny Rozrodu 2012 Polskie Towarzystwo Ginekologiczne i Polskie Towarzystwo Medycyny
Rekomendacje dotyczące diagnostyki i leczenia niepłodności Polskie Towarzystwo Ginekologiczne Polskie Towarzystwo Medycyny Rozrodu 2012 Polskie Towarzystwo Ginekologiczne i Polskie Towarzystwo Medycyny
ULOTKA DLA PACJENTA - 1 -
 ULOTKA DLA PACJENTA - 1 - Ulotka dołączona do opakowania: informacja dla pacjenta MENOGON; 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum Należy uważnie
ULOTKA DLA PACJENTA - 1 - Ulotka dołączona do opakowania: informacja dla pacjenta MENOGON; 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum Należy uważnie
Leszek Pawelczyk Klinika Niepłodności i Endokrynologii Rozrodu Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
 Leszek Pawelczyk Klinika Niepłodności i Endokrynologii Rozrodu Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Nagroda Nobla w dziedzinie Fizjologii i Medcyny 2010 Człowiek należy do gatunku
Leszek Pawelczyk Klinika Niepłodności i Endokrynologii Rozrodu Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Nagroda Nobla w dziedzinie Fizjologii i Medcyny 2010 Człowiek należy do gatunku
Koryfolitropina alfa (Elonva ) w leczeniu niepłodności. Analiza wpływu na budżet
 Koryfolitropina alfa (Elonva ) w leczeniu niepłodności Analiza wpływu na budżet Warszawa 2013 Zleceniodawca raportu/finansowanie projektu: MSD Polska Sp. z o.o. ul. Chłodna 51 00-867 Warszawa Polska 2/67
Koryfolitropina alfa (Elonva ) w leczeniu niepłodności Analiza wpływu na budżet Warszawa 2013 Zleceniodawca raportu/finansowanie projektu: MSD Polska Sp. z o.o. ul. Chłodna 51 00-867 Warszawa Polska 2/67
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 10 1. NAZWA PRODUKTU LECZNICZEGO MENOPUR, 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 10 1. NAZWA PRODUKTU LECZNICZEGO MENOPUR, 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA MENOPUR 1200 j.m. FSH + 1200 j.m. LH proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (Menotropinum) Należy zapoznać się z treścią ulotki
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA MENOPUR 1200 j.m. FSH + 1200 j.m. LH proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (Menotropinum) Należy zapoznać się z treścią ulotki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 1. NAZWA PRODUKTU LECZNICZEGO MENOPUR, 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 1. NAZWA PRODUKTU LECZNICZEGO MENOPUR, 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ULOTKA DLA PACJENTA. Strona 1 z 9
 ULOTKA DLA PACJENTA Strona 1 z 9 MENOPUR, 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku,
ULOTKA DLA PACJENTA Strona 1 z 9 MENOPUR, 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MENOPUR; 1200 j.m. FSH + 1200 j.m. LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MENOPUR; 1200 j.m. FSH + 1200 j.m. LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA BRAVELLE 75 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (Urofollitropinum) Należy zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA BRAVELLE 75 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (Urofollitropinum) Należy zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO BRAVELLE 75 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna fiolka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO BRAVELLE 75 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna fiolka zawiera
1 Proces zapłodnienia 15 Kobiecy cykl miesiączkowy 15 Spermatogeneza 20 Zapłodnienie 22. Kiedy należy zwrócić się o pomoc do lekarza?
 SPIS TREŚCI Wstęp 10 1 Proces zapłodnienia 15 Kobiecy cykl miesiączkowy 15 Spermatogeneza 20 Zapłodnienie 22 Zagnieżdżenie 23 Prawdopodobieństwo zajścia w ciążę 23 Kiedy należy zwrócić się o pomoc do lekarza?
SPIS TREŚCI Wstęp 10 1 Proces zapłodnienia 15 Kobiecy cykl miesiączkowy 15 Spermatogeneza 20 Zapłodnienie 22 Zagnieżdżenie 23 Prawdopodobieństwo zajścia w ciążę 23 Kiedy należy zwrócić się o pomoc do lekarza?
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO CHORAGON 5000, 5000 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ampułka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO CHORAGON 5000, 5000 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ampułka
LEKI STOSOWANE W STYMULACJI ZAPŁODNIENIA POZAUTROJOWEGO TRUDNOŚCI W OCENIE HTA
 LEKI STOSOWANE W STYMULACJI ZAPŁODNIENIA POZAUTROJOWEGO Dr n. med. Wojciech Matusewicz Prezes Agencji Oceny Technologii Medycznych Warszawa, 26.06.2013 1 ROBERT EDWARDS 1926-2013 PIONIER ZAPŁODNIENIA IN
LEKI STOSOWANE W STYMULACJI ZAPŁODNIENIA POZAUTROJOWEGO Dr n. med. Wojciech Matusewicz Prezes Agencji Oceny Technologii Medycznych Warszawa, 26.06.2013 1 ROBERT EDWARDS 1926-2013 PIONIER ZAPŁODNIENIA IN
PROGRAM SZKOLENIA WSTĘPNEGO LEKARZE
 Lp. TEMAT SZKOLENIA Czas trwania 1. Polskie i europejskie przepisy prawne dotyczące medycznie wspomaganej prokreacji oraz gromadzenia, testowania, przetwarzania, przechowywania i dystrybucji komórek rozrodczych
Lp. TEMAT SZKOLENIA Czas trwania 1. Polskie i europejskie przepisy prawne dotyczące medycznie wspomaganej prokreacji oraz gromadzenia, testowania, przetwarzania, przechowywania i dystrybucji komórek rozrodczych
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2179743 (96) Data i numer zgłoszenia patentu europejskiego: 13.07.2009 09460028.5 (13) (51) T3 Int.Cl. A61K 38/18 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2179743 (96) Data i numer zgłoszenia patentu europejskiego: 13.07.2009 09460028.5 (13) (51) T3 Int.Cl. A61K 38/18 (2006.01)
ULOTKA DLA PACJENTA. Strona 1 z 9
 ULOTKA DLA PACJENTA Strona 1 z 9 Ulotka dołączona do opakowania: informacja dla pacjenta MENOPUR, 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum Należy
ULOTKA DLA PACJENTA Strona 1 z 9 Ulotka dołączona do opakowania: informacja dla pacjenta MENOPUR, 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO - 1 - 1. NAZWA PRODUKTU LECZNICZEGO BRAVELLE, 75 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna fiolka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO - 1 - 1. NAZWA PRODUKTU LECZNICZEGO BRAVELLE, 75 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna fiolka
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1663252 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 10.09.2004 04786930.0
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1663252 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 10.09.2004 04786930.0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 1. NAZWA PRODUKTU LECZNICZEGO MENOPUR; 1200 j.m. FSH + 1200 j.m. LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 1. NAZWA PRODUKTU LECZNICZEGO MENOPUR; 1200 j.m. FSH + 1200 j.m. LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 1. NAZWA PRODUKTU LECZNICZEGO MENOPUR, 1200 IU FSH + 1200 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 1. NAZWA PRODUKTU LECZNICZEGO MENOPUR, 1200 IU FSH + 1200 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 8/2014 z dnia 13 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją i ustalenia urzędowej ceny
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 8/2014 z dnia 13 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją i ustalenia urzędowej ceny
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1879609. (96) Data i numer zgłoszenia patentu europejskiego: 04.05.2006 06742792.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1879609 (96) Data i numer zgłoszenia patentu europejskiego: 04.05.2006 06742792.2 (13) (51) T3 Int.Cl. A61K 38/17 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1879609 (96) Data i numer zgłoszenia patentu europejskiego: 04.05.2006 06742792.2 (13) (51) T3 Int.Cl. A61K 38/17 (2006.01)
ULOTKA DLA PACJENTA. Strona 1 z 11
 ULOTKA DLA PACJENTA Strona 1 z 11 Ulotka dołączona do opakowania: informacja dla pacjenta MENOPUR 1200 j.m. FSH + 1200 j.m. LH proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum
ULOTKA DLA PACJENTA Strona 1 z 11 Ulotka dołączona do opakowania: informacja dla pacjenta MENOPUR 1200 j.m. FSH + 1200 j.m. LH proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum
(12) OPIS PATENTOWY (19) PL (11)
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 188998 (21 ) Numer zgłoszenia: 333174 (22) Data zgłoszenia: 23.10.1997 (86) Data i numer zgłoszenia międzynarodowego:
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 188998 (21 ) Numer zgłoszenia: 333174 (22) Data zgłoszenia: 23.10.1997 (86) Data i numer zgłoszenia międzynarodowego:
PL 204536 B1. Szczepanik Marian,Kraków,PL Selmaj Krzysztof,Łódź,PL 29.12.2003 BUP 26/03 29.01.2010 WUP 01/10
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204536 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 354698 (22) Data zgłoszenia: 24.06.2002 (51) Int.Cl. A61K 38/38 (2006.01)
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204536 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 354698 (22) Data zgłoszenia: 24.06.2002 (51) Int.Cl. A61K 38/38 (2006.01)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Pregnyl, 5000 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 fiolka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Pregnyl, 5000 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 fiolka zawiera
LECZENIE PRZEDWCZESNEGO DOJRZEWANIA PŁCIOWEGO U DZIECI
 Załącznik nr 11 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE PRZEDWCZESNEGO DOJRZEWANIA PŁCIOWEGO U DZIECI ICD-10 E 22.8 Przedwczesne dojrzewanie płciowe
Załącznik nr 11 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE PRZEDWCZESNEGO DOJRZEWANIA PŁCIOWEGO U DZIECI ICD-10 E 22.8 Przedwczesne dojrzewanie płciowe
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1787644 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 07.11.2006 06123574.3
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1787644 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 07.11.2006 06123574.3
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 55/2014 z dnia 24 lutego 2014 r. w sprawie oceny leku Gonapeptyl Daily, EAN: 5909990707553, we wskazaniu dysensytyzacja
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 55/2014 z dnia 24 lutego 2014 r. w sprawie oceny leku Gonapeptyl Daily, EAN: 5909990707553, we wskazaniu dysensytyzacja
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Orgalutran 0,25 mg/0,5 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułko-strzykawka zawiera 0,25 mg ganireliksu
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Orgalutran 0,25 mg/0,5 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułko-strzykawka zawiera 0,25 mg ganireliksu
InviMed Katowice. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
Wizyta kwalifikująca do procedury. Wizyta lekarska w trakcie monitoringu cyklu (jedna wizyta) Estradiol (jedno badanie) Progesteron (jedno badanie)
 InviMed Wrocław In vitro Pakiet IVF ICSI 7.991 PLN Wizyta kwalifikująca do procedury Estradiol (jedno badanie) Progesteron (jedno badanie) Punkcja jajników (ze znieczuleniem i wywiadem anestezjologicznym)
InviMed Wrocław In vitro Pakiet IVF ICSI 7.991 PLN Wizyta kwalifikująca do procedury Estradiol (jedno badanie) Progesteron (jedno badanie) Punkcja jajników (ze znieczuleniem i wywiadem anestezjologicznym)
InviMed Katowice. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Puregon 50 j.m./0,5 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna fiolka zawiera 50 j.m. rekombinowanego hormonu
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Puregon 50 j.m./0,5 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna fiolka zawiera 50 j.m. rekombinowanego hormonu
IVF. Aberdeen Fertility Centre. Przewodnik Pacjenta po Leczeniu oraz Badaniach Naukowych In Vitro (IVF) Postępowanie w Przypadku Bezpłodności
 Aberdeen Fertility Centre Przewodnik Pacjenta po Leczeniu oraz Badaniach Naukowych In Vitro (IVF) Postępowanie w Przypadku Bezpłodności Skierowanie Ocena Diagnoza Leczenie Czynnik Męski Czynnik Jajowodowy
Aberdeen Fertility Centre Przewodnik Pacjenta po Leczeniu oraz Badaniach Naukowych In Vitro (IVF) Postępowanie w Przypadku Bezpłodności Skierowanie Ocena Diagnoza Leczenie Czynnik Męski Czynnik Jajowodowy
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1680075 (13) T3 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 11.10.2004
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1680075 (13) T3 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 11.10.2004
ULOTKA DLA PACJENTA - 1 -
 ULOTKA DLA PACJENTA - 1 - Ulotka dołączona do opakowania: informacja dla użytkownika BRAVELLE, 75 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Urofollitropinum Należy uważnie
ULOTKA DLA PACJENTA - 1 - Ulotka dołączona do opakowania: informacja dla użytkownika BRAVELLE, 75 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Urofollitropinum Należy uważnie
InviMed Gdynia. In vitro. Wizyta kwalifikująca do procedury. Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Gdynia In vitro Pakiet IVF 5.500 PLN Wizyta kwalifikująca do procedury Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury embriologiczne
InviMed Gdynia In vitro Pakiet IVF 5.500 PLN Wizyta kwalifikująca do procedury Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury embriologiczne
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Pregnyl, 5000 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Gonadotropinum chorionicum Należy uważnie zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla użytkownika Pregnyl, 5000 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Gonadotropinum chorionicum Należy uważnie zapoznać się z treścią
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych wwwaotmgovpl Rekomendacja nr 52/2014 z dnia 24 lutego 2014 r Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Gonapeptyl
Agencja Oceny Technologii Medycznych wwwaotmgovpl Rekomendacja nr 52/2014 z dnia 24 lutego 2014 r Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Gonapeptyl
Tyreologia opis przypadku 14
 Kurs Polskiego Towarzystwa Endokrynologicznego Tyreologia opis przypadku 14 partner kursu: (firma nie ma wpływu na zawartość merytoryczną) Opis przypadku 32 letnia pacjentka zgłosiła się do Poradni Endokrynologicznej.
Kurs Polskiego Towarzystwa Endokrynologicznego Tyreologia opis przypadku 14 partner kursu: (firma nie ma wpływu na zawartość merytoryczną) Opis przypadku 32 letnia pacjentka zgłosiła się do Poradni Endokrynologicznej.
ULOTKA DLA PACJENTA. Strona 1 z 10
 ULOTKA DLA PACJENTA Strona 1 z 10 Ulotka dołączona do opakowania: informacja dla pacjenta MENOPUR, 600 IU FSH + 600 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum
ULOTKA DLA PACJENTA Strona 1 z 10 Ulotka dołączona do opakowania: informacja dla pacjenta MENOPUR, 600 IU FSH + 600 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fertavid 50 j.m./0,5 ml roztwór do wstrzykiwań Fertavid 75 j.m./0,5 ml roztwór do wstrzykiwań Fertavid 100 j.m./0,5 ml roztwór
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fertavid 50 j.m./0,5 ml roztwór do wstrzykiwań Fertavid 75 j.m./0,5 ml roztwór do wstrzykiwań Fertavid 100 j.m./0,5 ml roztwór
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Elonva 150 mikrogramów roztwór do wstrzykiwań, koryfolitropina alfa Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Elonva 150 mikrogramów roztwór do wstrzykiwań, koryfolitropina alfa Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych
InviMed Gdynia. In vitro. Wizyta kwalifikująca do procedury. Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Gdynia In vitro Pakiet IVF 5.500 PLN Wizyta kwalifikująca do procedury Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury embriologiczne
InviMed Gdynia In vitro Pakiet IVF 5.500 PLN Wizyta kwalifikująca do procedury Kontrola stymulacji (trzy wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury embriologiczne
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1711158 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 16.11.2004 04806793.8
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1711158 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 16.11.2004 04806793.8
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Puregon 300 j.m./0,36 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 wkład zawiera dawkę 300 j.m. rekombinowanego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Puregon 300 j.m./0,36 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 wkład zawiera dawkę 300 j.m. rekombinowanego
InviMed Bydgoszcz. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Bydgoszcz In vitro Pakiet IVF 5.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
InviMed Bydgoszcz In vitro Pakiet IVF 5.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA
 ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
InviMed Katowice. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
InviMed Katowice In vitro Pakiet IVF ICSI 6.500 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem)
ZAJĘCIA TEORETYCZNE DLA PRACOWNIKÓW MEDYCZNYCH I ADMINISTRACYJNYCH (SZKOLENIA USTAWICZNE)
 ZAJĘCIA TEORETYCZNE DLA PRACOWNIKÓW MEDYCZNYCH I ADMINISTRACYJNYCH (SZKOLENIA USTAWICZNE) Lp. TEMAT. Hodowla zarodków in vitro. Ocena potencjału rozwojowego zarodków. Parametry predykcji pełnego rozwoju
ZAJĘCIA TEORETYCZNE DLA PRACOWNIKÓW MEDYCZNYCH I ADMINISTRACYJNYCH (SZKOLENIA USTAWICZNE) Lp. TEMAT. Hodowla zarodków in vitro. Ocena potencjału rozwojowego zarodków. Parametry predykcji pełnego rozwoju
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 9 1. NAZWA PRODUKTU LECZNICZEGO MENOGON, 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 9 1. NAZWA PRODUKTU LECZNICZEGO MENOGON, 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Fertavid 75 j.m./0,5 ml roztwór do wstrzykiwań folitropina beta
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Fertavid 75 j.m./0,5 ml roztwór do wstrzykiwań folitropina beta Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Fertavid 75 j.m./0,5 ml roztwór do wstrzykiwań folitropina beta Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2131847. (96) Data i numer zgłoszenia patentu europejskiego: 27.02.2008 08716068.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2131847 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 27.02.2008 08716068.5
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2131847 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 27.02.2008 08716068.5
ANKIETA DLA PACJENTKI. Imię:. Nazwisko:... Data urodzenia:
 Data:... ANKIETA DLA PACJENTKI Imię:. Nazwisko:.... Data urodzenia: Szanowna Pani, serdecznie prosimy o poświęcenie 15 minut na wypełnienie poniższego dokumentu. Zawiera on pytania, które bardzo pomogą
Data:... ANKIETA DLA PACJENTKI Imię:. Nazwisko:.... Data urodzenia: Szanowna Pani, serdecznie prosimy o poświęcenie 15 minut na wypełnienie poniższego dokumentu. Zawiera on pytania, które bardzo pomogą
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1886669 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 02.08.2007 07113670.9
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1886669 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 02.08.2007 07113670.9
Folitropina beta (Puregon ) w leczeniu niepłodności. Analiza wpływu na budżet
 Folitropina beta (Puregon ) w leczeniu niepłodności Analiza wpływu na budżet . Zleceniodawca raportu/finansowanie projektu: MSD Polska Sp. z o.o. ul. Chłodna 51 00-867 Warszawa Polska 2/79 Folitropina
Folitropina beta (Puregon ) w leczeniu niepłodności Analiza wpływu na budżet . Zleceniodawca raportu/finansowanie projektu: MSD Polska Sp. z o.o. ul. Chłodna 51 00-867 Warszawa Polska 2/79 Folitropina
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Pregnyl, 5000 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 fiolka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Pregnyl, 5000 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 fiolka zawiera
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2190940 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 11.09.2008 08802024.3
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2190940 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 11.09.2008 08802024.3
CIBA-GEIGY Sintrom 4
 CIBA-GEIGY Sintrom 4 Sintrom 4 Substancja czynna: 3-[a-(4-nitrofenylo-)-0- -acetyloetylo]-4-hydroksykumaryna /=acenocoumarol/. Tabletki 4 mg. Sintrom działa szybko i jest wydalany w krótkim okresie czasu.
CIBA-GEIGY Sintrom 4 Sintrom 4 Substancja czynna: 3-[a-(4-nitrofenylo-)-0- -acetyloetylo]-4-hydroksykumaryna /=acenocoumarol/. Tabletki 4 mg. Sintrom działa szybko i jest wydalany w krótkim okresie czasu.
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Ovitrelle 250 mikrogramów, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Ovitrelle 250 mikrogramów, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. GONAPEPTYL Daily; 0,1 mg/1 ml roztwór do wstrzykiwań. Triptorelini acetas
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GONAPEPTYL Daily; 0,1 mg/1 ml roztwór do wstrzykiwań Triptorelini acetas Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GONAPEPTYL Daily; 0,1 mg/1 ml roztwór do wstrzykiwań Triptorelini acetas Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta
 Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta: Informacja dla użytkownika Medivitan iv ampułki 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny chlorowodorek
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta: Informacja dla użytkownika Medivitan iv ampułki 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny chlorowodorek
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO GONAL-f 75 j.m. (5,5 mikrograma), proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO GONAL-f 75 j.m. (5,5 mikrograma), proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Puregon 150 j.m./0,18 ml roztwór do wstrzykiwań Puregon 300 j.m./0,36 ml roztwór do wstrzykiwań Puregon 600 j.m./0,72 ml roztwór
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Puregon 150 j.m./0,18 ml roztwór do wstrzykiwań Puregon 300 j.m./0,36 ml roztwór do wstrzykiwań Puregon 600 j.m./0,72 ml roztwór
Lp. TEMAT SZKOLENIA Czas trwania
 Lp. TEMAT SZKOLENIA Czas trwania 1. Polskie i europejskie przepisy prawne dotyczące medycznie wspomaganej prokreacji oraz gromadzenia, testowania, przetwarzania, przechowywania i dystrybucji komórek rozrodczych
Lp. TEMAT SZKOLENIA Czas trwania 1. Polskie i europejskie przepisy prawne dotyczące medycznie wspomaganej prokreacji oraz gromadzenia, testowania, przetwarzania, przechowywania i dystrybucji komórek rozrodczych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Oestrophan 0,25 mg/ml roztwór do wstrzykiwań dla bydła i świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Oestrophan 0,25 mg/ml roztwór do wstrzykiwań dla bydła i świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
NOWOCZESNE, SKUTECZNE, OPŁACALNE NARZĘDZIE do zarządzania rozrodem u świń ŚWIATOWY PATENT NOWOŚĆ!
 NOWOCZESNE, SKUTECZNE, OPŁACALNE NARZĘDZIE do zarządzania rozrodem u świń ŚWIATOWY PATENT NOWOŚĆ! NOWOCZESNE, SKUTECZNE, OPŁACALNE NARZĘDZIE do zarządzania rozrodem u świń indukcja rui pierwszy na świecie
NOWOCZESNE, SKUTECZNE, OPŁACALNE NARZĘDZIE do zarządzania rozrodem u świń ŚWIATOWY PATENT NOWOŚĆ! NOWOCZESNE, SKUTECZNE, OPŁACALNE NARZĘDZIE do zarządzania rozrodem u świń indukcja rui pierwszy na świecie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 1. NAZWA PRODUKTU LECZNICZEGO CHORAPUR, 1500 IU, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań CHORAPUR, 5000 IU, proszek i rozpuszczalnik
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 1. NAZWA PRODUKTU LECZNICZEGO CHORAPUR, 1500 IU, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań CHORAPUR, 5000 IU, proszek i rozpuszczalnik
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Elonva 100 mikrogramów, roztwór do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułkostrzykawka zawiera 100 mikrogramów
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Elonva 100 mikrogramów, roztwór do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułkostrzykawka zawiera 100 mikrogramów
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Orgalutran 0,25 mg/0,5 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułko-strzykawka zawiera 0,25 mg ganireliksu
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Orgalutran 0,25 mg/0,5 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułko-strzykawka zawiera 0,25 mg ganireliksu
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO GONAL-f 75 j.m. (5,5 mikrograma), proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO GONAL-f 75 j.m. (5,5 mikrograma), proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
PL B1 (12) O P I S P A T E N T O W Y (19) P L (11) (13) B 1 A61K 9/20. (22) Data zgłoszenia:
 R Z E C Z PO SPO L IT A PO LSK A (12) O P I S P A T E N T O W Y (19) P L (11) 1 7 7 6 0 7 (21) Numer zgłoszenia: 316196 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.03.1995
R Z E C Z PO SPO L IT A PO LSK A (12) O P I S P A T E N T O W Y (19) P L (11) 1 7 7 6 0 7 (21) Numer zgłoszenia: 316196 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.03.1995
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1586320 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 02.02.2005 05472001.6 (51) Int. Cl. A61K31/435 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1586320 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 02.02.2005 05472001.6 (51) Int. Cl. A61K31/435 (2006.01)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MACMIROR COMPLEX 500 (500 mg + 200 000 j.m.) globulki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 globulka dopochwowa zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MACMIROR COMPLEX 500 (500 mg + 200 000 j.m.) globulki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 globulka dopochwowa zawiera
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
Ulotka dołączona do opakowania: informacja dla pacjenta Luteina, 50 mg, tabletki dopochwowe. Progesteronum
 Ulotka dołączona do opakowania: informacja dla pacjenta Luteina, 50 mg, tabletki dopochwowe Progesteronum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Luteina, 50 mg, tabletki dopochwowe Progesteronum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 123/2014 z dnia 19 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Gonal-
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 123/2014 z dnia 19 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Gonal-
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA MERIONAL 75 j.m. (75 j.m. FSH i 75 j.m. LH) + 1 ml rozpuszczalnika, liofilizat i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań Menotropinum Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA MERIONAL 75 j.m. (75 j.m. FSH i 75 j.m. LH) + 1 ml rozpuszczalnika, liofilizat i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań Menotropinum Należy
INFORMACJA DLA PACJENTA ORAZ FORMULARZ ŚWIADOMEJ ZGODY NA KRIOKONSERWACJĘ (ZAMROŻENIE) OOCYTÓW DO PROCEDUR MEDYCZNIE WSPOMAGANEJ PROKREACJI
 Pola do uzupełnienia INFORMACJA DLA PACJENTA ORAZ FORMULARZ ŚWIADOMEJ ZGODY NA KRIOKONSERWACJĘ (ZAMROŻENIE) OOCYTÓW DO PROCEDUR MEDYCZNIE WSPOMAGANEJ PROKREACJI Imię PACJENTKA(DAWCZYNI) Nazwisko Data urodzenia
Pola do uzupełnienia INFORMACJA DLA PACJENTA ORAZ FORMULARZ ŚWIADOMEJ ZGODY NA KRIOKONSERWACJĘ (ZAMROŻENIE) OOCYTÓW DO PROCEDUR MEDYCZNIE WSPOMAGANEJ PROKREACJI Imię PACJENTKA(DAWCZYNI) Nazwisko Data urodzenia
InviMed Wrocław. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Wrocław In vitro Pakiet IVF ICSI 7.400 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
InviMed Wrocław In vitro Pakiet IVF ICSI 7.400 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1732433 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 27.01.2005 05702820.1
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1732433 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 27.01.2005 05702820.1
Ulotka dołączona do opakowania: informacja dla użytkownika. Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych
 Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
FOSTIMON 75 j.m./fiolkę + 1 ml rozpuszczalnika proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (Urofollitropinum)
 Ulotka dołączona do opakowania: informacja dla pacjenta FOSTIMON 75 j.m./fiolkę + 1 ml rozpuszczalnika proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (Urofollitropinum) Należy uważnie
Ulotka dołączona do opakowania: informacja dla pacjenta FOSTIMON 75 j.m./fiolkę + 1 ml rozpuszczalnika proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (Urofollitropinum) Należy uważnie
(86) Data i numer zgłoszenia międzynarodowego: , PCT/FR02/02519 (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 202567 (21) Numer zgłoszenia: 367089 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 16.07.2002 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 202567 (21) Numer zgłoszenia: 367089 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 16.07.2002 (86) Data i numer zgłoszenia
Ulotka dla Pacjenta: Informacja dla Użytkownika
 Ulotka dla Pacjenta: Informacja dla Użytkownika PABAL, 100 mikrogramów/ml, roztwór do wstrzykiwań Carbetocinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
Ulotka dla Pacjenta: Informacja dla Użytkownika PABAL, 100 mikrogramów/ml, roztwór do wstrzykiwań Carbetocinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
InviMed Poznań. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
 InviMed Poznań In vitro Pakiet IVF ICSI 6.700 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Zapłodnienie
InviMed Poznań In vitro Pakiet IVF ICSI 6.700 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Zapłodnienie
Klinika Zdrówko s.c. Iwona Adamczak, Rafał Adamczak Al. Adama Mickiewicza 23, 86-032 Niemcz tel.52 375-25-07 www. klinika-zdrowko.
 Klinika Zdrówko s.c. Iwona Adamczak, Rafał Adamczak Al. Adama Mickiewicza 23, 86-032 Niemcz tel.52 375-25-07 www. klinika-zdrowko.pl ZGODA NA WYKONA ZABIEGU WSPOMAGANEGO ROZRODU ( dołączyć do ZGODA NA
Klinika Zdrówko s.c. Iwona Adamczak, Rafał Adamczak Al. Adama Mickiewicza 23, 86-032 Niemcz tel.52 375-25-07 www. klinika-zdrowko.pl ZGODA NA WYKONA ZABIEGU WSPOMAGANEGO ROZRODU ( dołączyć do ZGODA NA
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Opinia Prezesa Agencji Oceny Technologii Medycznych nr 21/2014 z dnia 24 lutego 2014 r. o projekcie programu Leczenie niepłodności metodą zapłodnienia pozaustrojowego
Agencja Oceny Technologii Medycznych Opinia Prezesa Agencji Oceny Technologii Medycznych nr 21/2014 z dnia 24 lutego 2014 r. o projekcie programu Leczenie niepłodności metodą zapłodnienia pozaustrojowego
InviMed Poznań. In vitro. II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu)
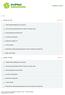 InviMed Poznań In vitro Pakiet IVF ICSI 6.700 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
InviMed Poznań In vitro Pakiet IVF ICSI 6.700 PLN II wizyta (wizyta kwalifikująca do procedury) Kontrola stymulacji (wizyty lekarskie w trakcie monitoringu cyklu) Punkcja jajników (ze znieczuleniem) Procedury
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 09.12.2005 05077837.
 RZECZPSPLITA PLSKA (12) TŁUMACZENIE PATENTU EURPEJSKIEG (19) PL (11) PL/EP 1671547 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 09.12.2005 05077837.2 (51) Int. Cl. A23B7/154 (2006.01) (97)
RZECZPSPLITA PLSKA (12) TŁUMACZENIE PATENTU EURPEJSKIEG (19) PL (11) PL/EP 1671547 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 09.12.2005 05077837.2 (51) Int. Cl. A23B7/154 (2006.01) (97)
