Surowce pochodzenia mineralnego
|
|
|
- Kornelia Zakrzewska
- 8 lat temu
- Przeglądów:
Transkrypt
1 strona 1/5 Surowce pochodzenia mineralnego Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Surowce i tworzywa pochodzenia mineralnego: węgiel kamienny, ropa naftowa, gaz ziemny, wapień, gips, szkło. Zagadnienia do powtórki Surowce mineralne Metale w służbie człowieka Surowce energetyczne Sole wapnia wykorzystywane w budownictwie Wszechobecna krzemionka Kompendium wiedzy 1. Surowce mineralne Surowce mineralne to materiały pochodzenia naturalnego, które są wydobywane i przetwarzane przez człowieka w celach użytkowych. Gospodarka surowcami mineralnymi to bardzo ważna dziedzina polityki gospodarczej kraju. Powinna być prowadzona w sposób: oszczędny ze względu na nieodnawialność surowców mineralnych, odpowiedzialny ze względu na konsekwencje wynikające z ujemnych skutków wydobywania bo- gactw naturalnych. W stanie wolnym (w postaci pierwiastków chemicznych) w skorupie ziemskiej występują tylko nieliczne metale (złoto, srebro oraz platynowce) i niemetale (siarka, węgiel w postaci grafitu lub diamentu). Rudy, minerały to związki chemiczne lub ich mieszaniny, które powstały w skorupie ziemskiej i używane są bezpośrednio w życiu codziennym, w przemyśle lub stanowią surowiec do otrzymywania zawartych w nich pierwiastków lub związków chemicznych.
2 strona 2/5 2. Metale w służbie człowieka Właściwości fizyczne metali: w temperaturze pokojowej metale są ciałami stałymi (za wyjątkiem rtęci) najczęściej mają srebrzysto-szarą barwę (z wyjątkiem złota i miedzi, cezu) są dobrymi przewodnikami prądu i ciepła posiadają różną twardość (sód jest miękki, a żelazo bardzo twarde), posiadają charakterystyczny połysk, są kowalne i ciągliwe (miedź, glin, srebro) mają różne temperatury topnienia (najniższą rtęć, bardzo wysoką wolfram), niektóre łatwo reagują z tlenem (metale nieszlachetne), inne są odporne na działanie tlenu i in- nych czynników (metale szlachetne złoto, srebro, platyna). Ze względu na właściwości fizyczne metale są w różnorodny sposób wykorzystywane przez człowieka np.: miedź do produkcji przewodów elektrycznych ze względu na dobre przewodnictwo elektryczne, do produkcji rur rozprowadzających wodę ze względu na odporność chemiczną, stopy glinu do wyrobu kabli elektrycznych ze względu na dobre przewodnictwo elektryczne i dużą ciągliwość, rtęć do wyrobu termometrów, ponieważ ma najniższą temperaturę topnienia i dużą rozszerzalność termiczną oraz do produkcji lamp jarzeniowych, wolfram do produkcji żarówek, bo przewodzi prąd, a równocześnie ma bardzo wysoką temperaturę topnienia. Metale otrzymywane są między innymi z rud w procesach utleniania i redukcji, np. utlenianie 2Pb + C = 2Pb + C 2 redukcja Tlenek ołowiu(ii) pełni rolę utleniacza (oddaje tlen), a węgiel rolę reduktora (odbiera tlen). Bardzo duże znaczenie w gospodarce człowieka mają stopy wykonane z różnorodnych metali.
3 strona 3/5 Stopy to mieszaniny jednorodne otrzymane w wyniku stopienia pierwiastków, posiadają inne właściwości niż składniki, z których są otrzymane. Stopy to: stal (żelazo i węgiel), brąz (cyna i miedź), mosiądz (cynk i miedź), duraluminium (glin, magnez, krzem, żelazo i mangan). Korozja proces chemiczny polegający na niszczeniu metali, przede wszystkim żelaza i jego stopów, zachodzący pod wpływem czynników atmosferycznych: tlenu, wody, tlenków azotu, tlenku siarki(iv). Pasywacja to proces polegający na powstawaniu na powierzchni metalu cienkiej warstwy tlenku, która chroni metal przed dalszym działaniem czynników atmosferycznych. Patynowanie powstawanie cienkiej warstwy patyny, czyli związków miedzi o barwie zielonej, na powierzchni miedzi i jej stopów. Patyna jest mieszaniną wodorotlenku miedzi(ii) Cu(H) 2 i węglanu miedzi(ii) CuC Surowce energetyczne Tradycyjne źródła energii to: węgle kopalne (antracyt, węgiel kamienny, węgiel brunatny i torf) ropa naftowa gaz ziemny Uzyskiwanie energii w sposób tradycyjny (spalanie węgla, ropy naftowej gazu ziemnego) wiąże się z emisją do atmosfery tlenków węgla, siarki, azotu. Jeśli tradycyjne źródła energii będą eksploatowane tak intensywnie jak dotychczas, to w niedługim czasie wyczerpią się. Bardziej opłacalna jest przeróbka węgla kamiennego i ropy naftowej. W wyniku suchej destylacji węgla kamiennego można otrzymać następujące produkty: gaz świetlny, wodę pogazową i koks. Wszystkie te substancje to podstawowe surowce w wielu dziedzinach przemysłu. W wyniku destylacji frakcjonowanej ropy naftowej (mieszaniny węglowodorów) otrzymuje się: gaz opałowy, benzynę, benzynę ciężką, naftę, olej napędowy, olej opałowy, olej smarowy, mazut i asfalt. Frakcje o wyższej temperaturze wrzenia np. benzynę ciężką, naftę, oleje poddaje się procesowi krakingu, czyli rozbijaniu długich łańcuchów węglowodorowych na krótkie liczące od 5 10 atomów węgla. Alternatywnymi źródłami energii są: energia słoneczna energia wodna energia wiatru energia biopaliwa energia geotermiczna
4 strona 4/5 4. Sole wapnia wykorzystywane w budownictwie Węglan wapnia CaC 3 jest głównym składnikiem skał wapiennych (wapieni, kalcytu, kredy, marmurów). Jest powszechnie stosowany w budownictwie zarówno jako kamień budulcowy, jak również jako źródło otrzymywania wapna palonego, czyli tlenku wapnia Ca. W piecach zwanych wapiennikami poddaje się wapienie termicznemu rozkładowi: CaC 3 900o C Ca + C 2 trzymane wapno palone miesza się z wodą i otrzymuje się wapno gaszone, czyli w postaci stałej wodorotlenek wapnia Ca(H) 2. Ten proces nazywany jest procesem gaszenia wapna. W trakcie gaszenia wapna do otoczenia wydziela się ciepło, jest to proces egzoenergetyczny. Powstająca substancja ma właściwości żrące, dlatego należy zachować szczególną ostrożność. Ca + H 2 = Ca(H) 2 Wapno gaszone miesza się z piaskiem i wodą w celu otrzymania zaprawy murarskiej. Zaprawa murarska na wskutek oddziaływania z tlenkiem węgla(iv) zawartym w powietrzu twardnieje: Ca(H) 2 + C 2 = CaC 3 + H 2 Powyższe równanie reakcji ilustruje proces twardnienia zaprawy murarskiej, jest również odpowiedzią na pytanie: dlaczego w nowo wybudowanym budynku czuje się wilgoć. prócz tlenku węgla(iv) wiąże zaprawę murarską również piasek, którego głównym składnikiem jest tlenek krzemu(iv) Si 2 : Ca(H) 2 + Si 2 = CaSi 3 + H 2 Skały wapienne można wykryć spośród innych skał za pomocą roztworu kwasu np. popularnego octu CaC 3 + 2CH 3 CH = (CH 3 C) 2 Ca + H 2 + C 2 Na powierzchni skały wapiennej oblanej kwasem pojawiają się pęcherzyki wydzielającego się gazu tlenku węgla(iv). Siarczan(VI) wapnia woda 1/2, czyli CaS 4 2H 2, to główny składnik gipsu. zdobna odmiana gipsu to alabaster. Związek będący głównym składnikiem gipsu należy do tzw. hydratów, czyli soli uwodnionych, które w sieć krystaliczną mają wbudowane cząsteczki wody. W nazwie hydratu zawarta jest informacja, ile cząsteczek wody przypada na określoną liczbę jonów tworzących sól, np. CaS 4 2H 2 to siarczan(vi) wapnia woda 1/2, co oznacza, że na 1 kation wapnia Ca 2+ 2 i 1 anion S 4 przypadają 2 cząsteczki wody.
5 strona 5/5 Gips stosuje się w budownictwie wyrównuje się ściany zaprawą gipsową, która po pewnym czasie twardnieje. Zaprawa gipsowa to mieszanina gipsu palonego i wody. Gips palony otrzymuje się w trakcie rozkładu termicznego gipsu krystalicznego: 2[CaS 4 2H 2 ] temperatura (CaS 4 ) 2 H 2 + 3H 2 W trakcie twardnienia zaprawy gipsowej zachodzi proces odwrotny gips palony łączy się z wodą i twardnieje. Proces ten wykorzystywany jest w medycynie do usztywniania złamanych kończyn. 5. Wszechobecna krzemionka Tlenek krzemu(iv) czyli Si 2 to składnik piasku, zwyczajowo nazywa się go krzemionką. W przyrodzie występuje pod postacią: kwarcu tworzącego skały (granity, gnejs i piaskowce) barwnych odmian kwarcu: ametystu (fioletowy), cytrynu (żółty), kwarcu różowego bezpostaciowej ziemi okrzemkowej kamienia ozdobnego: opal Krzemionka jest odporna na działanie czynników atmosferycznych. Stopiona z tlenkami metali tworzy szkło, przezroczyste, bezpostaciowe ciało stałe: szkło kwarcowe (produkcja naczyń laboratoryjnych, elementów aparatury optycznej i lamp kwarcowych): Si 2 szkło sodowe (wyrób przedmiotów codziennego użytku): Si, Ca, Na 2 2 szkło potasowe (produkcja szkła laboratoryjnego): Si, Ca, K 2 2 szkło ołowiowe (produkcja soczewek i kryształów): Si 2, Pb, K 2
Materiały i tworzywa pochodzenia naturalnego
 Materiały i tworzywa pochodzenia naturalnego 1. Przyporządkuj opisom odpowiadające im pojęcia. Wpisz litery (A I) w odpowiednie kratki. 3 p. A. hydraty D. wapno palone G. próchnica B. zaprawa wapienna
Materiały i tworzywa pochodzenia naturalnego 1. Przyporządkuj opisom odpowiadające im pojęcia. Wpisz litery (A I) w odpowiednie kratki. 3 p. A. hydraty D. wapno palone G. próchnica B. zaprawa wapienna
Bogusława Kozub; nauczyciel chemii w Publicznym Gimnazjum nr 5 w Płazie
 Bogusława Kozub; nauczyciel chemii w Publicznym Gimnazjum nr 5 w Płazie Temat: Surowce i tworzywa pochodzenia mineralnego. Temat realizowany metodą projektu. Celem projektu jest zapoznanie się uczniów
Bogusława Kozub; nauczyciel chemii w Publicznym Gimnazjum nr 5 w Płazie Temat: Surowce i tworzywa pochodzenia mineralnego. Temat realizowany metodą projektu. Celem projektu jest zapoznanie się uczniów
Metale i niemetale. Krystyna Sitko
 Metale i niemetale Krystyna Sitko Substancje proste czyli pierwiastki dzielimy na : metale np. złoto niemetale np. fosfor półmetale np. krzem Spośród 115 znanych obecnie pierwiastków aż 91 stanowią metale
Metale i niemetale Krystyna Sitko Substancje proste czyli pierwiastki dzielimy na : metale np. złoto niemetale np. fosfor półmetale np. krzem Spośród 115 znanych obecnie pierwiastków aż 91 stanowią metale
DZIAŁ 2 ŹRÓDŁA ENERGII przygotowanie do sprawdzianu
 DZIAŁ 2 ŹRÓDŁA ENERGII przygotowanie do sprawdzianu I. RODZAJE PALIW KOPALNYCH. II. PRZERÓBKA ROPY NAFTOWEJ I WĘGLA KAMIENNEGO. III. BENZYNA IV. SPOSOBY POZYSKIWANIA ENERGII A ŚRODOWIKO NATURALNE. 1. Wymienić
DZIAŁ 2 ŹRÓDŁA ENERGII przygotowanie do sprawdzianu I. RODZAJE PALIW KOPALNYCH. II. PRZERÓBKA ROPY NAFTOWEJ I WĘGLA KAMIENNEGO. III. BENZYNA IV. SPOSOBY POZYSKIWANIA ENERGII A ŚRODOWIKO NATURALNE. 1. Wymienić
KLASA II I. WODA I ROZTORY WODNE. - wie gdzie i w jakiej postaci występuje woda w przyrodzie - wie jak powstaje roztwór i z czego się składa
 SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII KLASA II I. WODA I ROZTORY WODNE Ocena dopuszczająca - wie gdzie i w jakiej postaci występuje woda w przyrodzie - wie jak powstaje roztwór i z czego się składa -
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII KLASA II I. WODA I ROZTORY WODNE Ocena dopuszczająca - wie gdzie i w jakiej postaci występuje woda w przyrodzie - wie jak powstaje roztwór i z czego się składa -
Zadanie 3 Zapisz wzory sumaryczne głównych składników przedstawionych skał i minerałów. kalcyt kreda kwarc gips agat
 CZĘŚĆ 1 Zadanie 1 Wyjaśnij pojęcia. wapno palone, hydraty, zaprawa gipsowa, zaprawa wapienna, wietrzenie skał, wapno gaszone, próchnica, degradacja gleby, właściwości sorpcyjne gleby, wapno palone, degradacja
CZĘŚĆ 1 Zadanie 1 Wyjaśnij pojęcia. wapno palone, hydraty, zaprawa gipsowa, zaprawa wapienna, wietrzenie skał, wapno gaszone, próchnica, degradacja gleby, właściwości sorpcyjne gleby, wapno palone, degradacja
Litowce i berylowce- lekcja powtórzeniowa, doświadczalna.
 Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
Towaroznawstwo artykułów przemysłowych
 Towaroznawstwo artykułów przemysłowych Towaroznawstwo Tomasz Poskrobko Przemysł produkcja materialna, polegająca na wytwarzaniu wyrobów w sposób masowy, przy użyciu urządzeń mechanicznych, Towary przemysłowe
Towaroznawstwo artykułów przemysłowych Towaroznawstwo Tomasz Poskrobko Przemysł produkcja materialna, polegająca na wytwarzaniu wyrobów w sposób masowy, przy użyciu urządzeń mechanicznych, Towary przemysłowe
w_08 Chemia mineralnych materiałów budowlanych c.d. Chemia metali budowlanych
 w_08 Chemia mineralnych materiałów budowlanych c.d. Chemia metali budowlanych Spoiwa krzemianowe Kompozyty krzemianowe (silikatowe) kity, zaprawy, farby szkło wodne Na 2 SiO 3 + 2H 2 O H 2 SiO 3 +
w_08 Chemia mineralnych materiałów budowlanych c.d. Chemia metali budowlanych Spoiwa krzemianowe Kompozyty krzemianowe (silikatowe) kity, zaprawy, farby szkło wodne Na 2 SiO 3 + 2H 2 O H 2 SiO 3 +
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7
 Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Wodorotlenki O O O O. I n. I. Wiadomości ogólne o wodorotlenkach.
 Wodorotlenki I. Wiadomości ogólne o wodorotlenkach. Wodorotlenki są to związki chemiczne zbudowane z atomu metalu i grupy wodorotlenowej. Wzór ogólny wodorotlenków: wartościowość metalu M n ( ) grupa wodorotlenowa
Wodorotlenki I. Wiadomości ogólne o wodorotlenkach. Wodorotlenki są to związki chemiczne zbudowane z atomu metalu i grupy wodorotlenowej. Wzór ogólny wodorotlenków: wartościowość metalu M n ( ) grupa wodorotlenowa
Kryteria oceniania z chemii kl VII
 Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
Nauczycielski plan dydaktyczny z chemii klasa: 1 LO, I ZS, 2 TA, 2 TŻ1, 2 TŻ2, 2 TŻR, 2 TI,2 TE1, 2 TE2, zakres podstawowy
 Nauczycielski plan dydaktyczny z chemii klasa: 1 LO, I ZS, 2 TA, 2 TŻ1, 2 TŻ2, 2 TŻR, 2 TI,2 TE1, 2 TE2, zakres podstawowy Temat lekcji Treści nauczania 1. Zapoznanie z przedmiotowym systemem oceniania
Nauczycielski plan dydaktyczny z chemii klasa: 1 LO, I ZS, 2 TA, 2 TŻ1, 2 TŻ2, 2 TŻR, 2 TI,2 TE1, 2 TE2, zakres podstawowy Temat lekcji Treści nauczania 1. Zapoznanie z przedmiotowym systemem oceniania
I. Substancje i ich przemiany
 NaCoBeZU z chemii dla klasy 1 I. Substancje i ich przemiany 1. Pracownia chemiczna podstawowe szkło i sprzęt laboratoryjny. Przepisy BHP i regulamin pracowni chemicznej zaliczam chemię do nauk przyrodniczych
NaCoBeZU z chemii dla klasy 1 I. Substancje i ich przemiany 1. Pracownia chemiczna podstawowe szkło i sprzęt laboratoryjny. Przepisy BHP i regulamin pracowni chemicznej zaliczam chemię do nauk przyrodniczych
ROZKŁAD MATERIAŁU NAUCZANIA CHEMII KL II. Treści nauczania (temat lekcji)
 ROZKŁAD MATERIAŁU NAUCZANIA CHEMII KL II Lp. Treści nauczania (temat lekcji) Liczba godzin na realizację Umiejętności wymagania szczegółowe Wprowadzane pojęcia ZWIĄZKI NIEORGANICZNE KWASY I WODOROTLENKI
ROZKŁAD MATERIAŁU NAUCZANIA CHEMII KL II Lp. Treści nauczania (temat lekcji) Liczba godzin na realizację Umiejętności wymagania szczegółowe Wprowadzane pojęcia ZWIĄZKI NIEORGANICZNE KWASY I WODOROTLENKI
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7
 Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Część I. TEST WYBORU 18 punktów
 Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
Wymagania programowe na poszczególne oceny chemia kl. I
 I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
Zapisz równanie zachodzącej reakcji. Wskaż pierwiastki, związki chemiczne, substraty i produkty reakcji.
 test nr 2 Termin zaliczenia zadań: IIIa - 29 października 2015 III b - 28 października 2015 zad.1 Reakcja rozkładu tlenku rtęci(ii) 1. Narysuj schemat doświadczenia, sporządź spis użytych odczynników,
test nr 2 Termin zaliczenia zadań: IIIa - 29 października 2015 III b - 28 października 2015 zad.1 Reakcja rozkładu tlenku rtęci(ii) 1. Narysuj schemat doświadczenia, sporządź spis użytych odczynników,
1. Pochodzenie i klasyfikacja zasobów przyrodniczych... 11
 Spis treści 1. Pochodzenie i klasyfikacja zasobów przyrodniczych... 11 1.1. Rozwój cywilizacji człowieka a korzystanie z zasobów Ziemi... 11 1.2. Czy zasoby naturalne Ziemi mogą ulec wyczerpaniu?... 14
Spis treści 1. Pochodzenie i klasyfikacja zasobów przyrodniczych... 11 1.1. Rozwój cywilizacji człowieka a korzystanie z zasobów Ziemi... 11 1.2. Czy zasoby naturalne Ziemi mogą ulec wyczerpaniu?... 14
Temat lekcji Bogactwa Naturalne Ziemi
 Piotr Chojnacki Anna Kaczmarek Anna Kaleta Jolanta Karpińska Daniel Synówka Wrocław dn. 30 maja 2005r Temat lekcji Bogactwa Naturalne Ziemi Cele główne lekcji: 1. Poznanie bogactw naturalnych ziemi. 2.
Piotr Chojnacki Anna Kaczmarek Anna Kaleta Jolanta Karpińska Daniel Synówka Wrocław dn. 30 maja 2005r Temat lekcji Bogactwa Naturalne Ziemi Cele główne lekcji: 1. Poznanie bogactw naturalnych ziemi. 2.
BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE.
 BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE. 1. Którą mieszaninę można rozdzielić na składniki poprzez filtrację; A. Wodę z octem. B. Wodę z kredą. C. Piasek z cukrem D. Wodę
BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE. 1. Którą mieszaninę można rozdzielić na składniki poprzez filtrację; A. Wodę z octem. B. Wodę z kredą. C. Piasek z cukrem D. Wodę
Wymagania programowe na poszczególne oceny z chemii w kl.1. I. Substancje i ich przemiany
 Wymagania programowe na poszczególne oceny z chemii w kl.1 I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia
Wymagania programowe na poszczególne oceny z chemii w kl.1 I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia
nazywa wybrane elementy szkła i sprzętu laboratoryjnego oraz określa ich przeznaczenie (4)
 Wymagania na poszczególne oceny z chemii w klasie I Uczeń: I. Substancje i ich właściwości stosuje zasady bezpieczeństwa obowiązujące w pracowni chemicznej (2) zalicza chemię do nauk przyrodniczych (2)
Wymagania na poszczególne oceny z chemii w klasie I Uczeń: I. Substancje i ich właściwości stosuje zasady bezpieczeństwa obowiązujące w pracowni chemicznej (2) zalicza chemię do nauk przyrodniczych (2)
Wymagania edukacyjne z chemii Klasa II WODOROTLENKI A ZASADY
 Wymagania edukacyjne z chemii Klasa II WODOROTLENKI A ZASADY Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą wymienia rodzaje wskaźników; sprawdza doświadczalnie działanie podaje przykłady
Wymagania edukacyjne z chemii Klasa II WODOROTLENKI A ZASADY Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą wymienia rodzaje wskaźników; sprawdza doświadczalnie działanie podaje przykłady
Warszawski konkurs chemiczny KWAS. Etap I szkolny. Zadanie 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
 Warszawa 17 marca 2009r. Warszawski konkurs chemiczny KWAS Etap I szkolny Kod ucznia: Zadanie 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Maksymalna ilość punktów 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 Liczba
Warszawa 17 marca 2009r. Warszawski konkurs chemiczny KWAS Etap I szkolny Kod ucznia: Zadanie 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Maksymalna ilość punktów 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 Liczba
Substancje chemiczne Powietrze
 Substancje chemiczne Powietrze strona 1/5 Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Substancje i przemiany chemiczne w otoczeniu człowieka. Metale i niemetale, mieszaniny,
Substancje chemiczne Powietrze strona 1/5 Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Substancje i przemiany chemiczne w otoczeniu człowieka. Metale i niemetale, mieszaniny,
Wymagania programowe na poszczególne oceny
 Przedmiot: chemia Klasa: Ia, Ib Nauczyciel: Agata SROKA Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady
Przedmiot: chemia Klasa: Ia, Ib Nauczyciel: Agata SROKA Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady
SCENARIUSZ ZAJĘĆ TEMAT: ŚWIAT METALI.
 SCENARIUSZ ZAJĘĆ Publiczne Gimnazjum w Pajęcznie Klasa II Przedmiot - chemia Prowadzący zajęcia - mgr Bożena Dymek Dział programu SUROWCE I TWORZYWA POCHODZENIA MINERALNEGO TEMAT: ŚWIAT METALI. CELE OGÓLNE:
SCENARIUSZ ZAJĘĆ Publiczne Gimnazjum w Pajęcznie Klasa II Przedmiot - chemia Prowadzący zajęcia - mgr Bożena Dymek Dział programu SUROWCE I TWORZYWA POCHODZENIA MINERALNEGO TEMAT: ŚWIAT METALI. CELE OGÓLNE:
Wymagania programowe na poszczególne oceny przygotowana na podstawie treści zawartych w podstawie programowej, programie nauczania oraz podręczniku
 Wymagania programowe na poszczególne oceny przygotowana na podstawie treści zawartych w podstawie programowej, programie nauczania oraz podręczniku dla klasy siódmej szkoły podstawowej Chemia Nowej Ery
Wymagania programowe na poszczególne oceny przygotowana na podstawie treści zawartych w podstawie programowej, programie nauczania oraz podręczniku dla klasy siódmej szkoły podstawowej Chemia Nowej Ery
CHEMIA I GIMNAZJUM WYMAGANIA PODSTAWOWE
 WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II
 Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II Łączenie się atomów. Równania reakcji Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] Ocena dobra [1 + 2 + 3] Ocena bardzo dobra
Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II Łączenie się atomów. Równania reakcji Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] Ocena dobra [1 + 2 + 3] Ocena bardzo dobra
Substancje i ich właściwości
 Pierwsza partia materiału i dobrane do nich zadania typu egzaminacyjnego. Materia jest to wszystko co nas otacza. Materię tworzą substancje, posiadające określony stały skład i określone właściwości. Właściwości
Pierwsza partia materiału i dobrane do nich zadania typu egzaminacyjnego. Materia jest to wszystko co nas otacza. Materię tworzą substancje, posiadające określony stały skład i określone właściwości. Właściwości
Chemia. 3. Która z wymienionych substancji jest pierwiastkiem? A Powietrze. B Dwutlenek węgla. C Tlen. D Tlenek magnezu.
 Chemia Zestaw I 1. Na lekcjach chemii badano właściwości: żelaza, węgla, cukru, miedzi i magnezu. Który z zestawów badanych substancji zawiera tylko niemetale? A Węgiel, siarka, tlen. B Węgiel, magnez,
Chemia Zestaw I 1. Na lekcjach chemii badano właściwości: żelaza, węgla, cukru, miedzi i magnezu. Który z zestawów badanych substancji zawiera tylko niemetale? A Węgiel, siarka, tlen. B Węgiel, magnez,
Scenariusz lekcji chemii w klasie drugiej gimnazjum
 mgr Sylwia Pięta nauczyciel chemii i matematyki Zespół Szkół z Oddziałami Sportowymi nr 1 61-638 Poznań, Os. Pod Lipami 106 Cele lekcji Temat lekcji: Poznajemy sole Formy pracy: Metody pracy: Scenariusz
mgr Sylwia Pięta nauczyciel chemii i matematyki Zespół Szkół z Oddziałami Sportowymi nr 1 61-638 Poznań, Os. Pod Lipami 106 Cele lekcji Temat lekcji: Poznajemy sole Formy pracy: Metody pracy: Scenariusz
Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019
 Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019 I. Eliminacje szkolne (60 minut, liczba punktów: 30). Wymagania szczegółowe. Cele kształcenia
Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019 I. Eliminacje szkolne (60 minut, liczba punktów: 30). Wymagania szczegółowe. Cele kształcenia
Instrukcja dla uczestnika
 II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
Plan: 1) krutki opis w ramach wstępu 2) Występowanie 3) Otrzymywanie 4) Właściwości 5) Związki 6) Izotopy 7) Zastosowanie 8) Znaczenie biologiczne
 Mied ź Plan: 1) krutki opis w ramach wstępu 2) Występowanie 3) Otrzymywanie 4) Właściwości 5) Związki 6) Izotopy 7) Zastosowanie 8) Znaczenie biologiczne 1) krutki opis w ramach wstępu Miedź (Cu, łac.
Mied ź Plan: 1) krutki opis w ramach wstępu 2) Występowanie 3) Otrzymywanie 4) Właściwości 5) Związki 6) Izotopy 7) Zastosowanie 8) Znaczenie biologiczne 1) krutki opis w ramach wstępu Miedź (Cu, łac.
Obliczenia chemiczne
 strona 1/8 Obliczenia chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Wagowe stosunki stechiometryczne w związkach chemicznych i reakcjach chemicznych masa atomowa
strona 1/8 Obliczenia chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Wagowe stosunki stechiometryczne w związkach chemicznych i reakcjach chemicznych masa atomowa
Wymagania programowe na poszczególne oceny w klasie pierwszej. I. Substancje i ich przemiany
 Wymagania programowe na poszczególne oceny w klasie pierwszej I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
Wymagania programowe na poszczególne oceny w klasie pierwszej I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
Wymagania edukacyjne na poszczególne oceny: I. Substancje i ich przemiany
 Wymagania edukacyjne na poszczególne oceny: I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia jest nauką stosuje
Wymagania edukacyjne na poszczególne oceny: I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia jest nauką stosuje
Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany. Ocena dopuszczająca [1]
![Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany. Ocena dopuszczająca [1] Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany. Ocena dopuszczająca [1]](/thumbs/100/147928509.jpg) Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego
Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego
ROZKŁAD MATERIAŁU Z CHEMII W KLASIE II
 ROZKŁAD MATERIAŁU Z CHEMII W KLASIE II Temat i numer kolejny lekcji Zagadnienia programowe Wymagania: podstawowe (P) ponadpodstawowe (PP) Przykłady metod i form pracy 1. Organizacja pracy na lekcjach chemii.
ROZKŁAD MATERIAŁU Z CHEMII W KLASIE II Temat i numer kolejny lekcji Zagadnienia programowe Wymagania: podstawowe (P) ponadpodstawowe (PP) Przykłady metod i form pracy 1. Organizacja pracy na lekcjach chemii.
Wymagania programowe na poszczególne oceny z chemii dla klasy 1 gimnazjum. I. Substancje i ich przemiany
 Wymagania programowe na poszczególne oceny z chemii dla klasy 1 gimnazjum I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia,
Wymagania programowe na poszczególne oceny z chemii dla klasy 1 gimnazjum I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia,
Wymagania edukacyjne z chemii dla klasy I oparte na Programie nauczania Chemia Nowej Ery
 Wymagania edukacyjne z chemii dla klasy I oparte na Programie nauczania Chemia Nowej Ery I. Substancje i ich przemiany Poziom wymagań Konieczny Podstawowy Rozszerzający Dopełniający zalicza chemię do nauk
Wymagania edukacyjne z chemii dla klasy I oparte na Programie nauczania Chemia Nowej Ery I. Substancje i ich przemiany Poziom wymagań Konieczny Podstawowy Rozszerzający Dopełniający zalicza chemię do nauk
Klasa 1 Wymagania programowe na poszczególne oceny. I. Substancje i ich przemiany
 Klasa 1 Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena niedostateczna Uczeń nie potrafi: Nazwać wybranych elementów szkła i sprzętu laboratoryjnego; Nie potrafi opisać właściwości
Klasa 1 Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena niedostateczna Uczeń nie potrafi: Nazwać wybranych elementów szkła i sprzętu laboratoryjnego; Nie potrafi opisać właściwości
Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020
 Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020 Ocenę niedostateczną otrzymuje uczeń, który nie opanował wymagań na ocenę dopuszczającą.
Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020 Ocenę niedostateczną otrzymuje uczeń, który nie opanował wymagań na ocenę dopuszczającą.
Test diagnozujący z chemii wrzesień Klasa II gimnazjum
 Test diagnozujący z chemii wrzesień 2017 Klasa II gimnazjum 1. Wskaż przykład mieszaniny niejednorodnej i poprawny sposób rozdzielenia jej na składniki. A. sól rozpuszczona w wodzie / sedymentacja B. piasek
Test diagnozujący z chemii wrzesień 2017 Klasa II gimnazjum 1. Wskaż przykład mieszaniny niejednorodnej i poprawny sposób rozdzielenia jej na składniki. A. sól rozpuszczona w wodzie / sedymentacja B. piasek
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
Reakcje chemiczne. Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn. Kompendium wiedzy. 1. Reakcje chemiczne i ich symboliczny zapis
 strona 1/6 Reakcje chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Reakcje chemiczne i równania reakcji chemicznych. Zagadnienia do powtórki 1. 2. 3. Reakcje chemiczne
strona 1/6 Reakcje chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Reakcje chemiczne i równania reakcji chemicznych. Zagadnienia do powtórki 1. 2. 3. Reakcje chemiczne
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
I. Substancje i ich przemiany
 Wymagania edukacyjne na poszczególne oceny szkolne klasa 7 Niepełnosprawność intelektualna oraz obniżenie wymagań i dostosowanie ich do możliwości ucznia I. Substancje i ich przemiany stosuje zasady bezpieczeństwa
Wymagania edukacyjne na poszczególne oceny szkolne klasa 7 Niepełnosprawność intelektualna oraz obniżenie wymagań i dostosowanie ich do możliwości ucznia I. Substancje i ich przemiany stosuje zasady bezpieczeństwa
Budowa atomu. Wiązania chemiczne
 strona /6 Budowa atomu. Wiązania chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Budowa atomu; jądro i elektrony, składniki jądra, izotopy. Promieniotwórczość i
strona /6 Budowa atomu. Wiązania chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Budowa atomu; jądro i elektrony, składniki jądra, izotopy. Promieniotwórczość i
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
uczeń opanował wszystkie wymagania podstawowe i ponadpodstawowe
 1 Agnieszka Wróbel nauczyciel biologii i chemii Plan pracy dydaktycznej na chemii w klasach pierwszych w roku szkolnym 2015/2016 Poziom wymagań Ocena Opis wymagań podstawowe niedostateczna uczeń nie opanował
1 Agnieszka Wróbel nauczyciel biologii i chemii Plan pracy dydaktycznej na chemii w klasach pierwszych w roku szkolnym 2015/2016 Poziom wymagań Ocena Opis wymagań podstawowe niedostateczna uczeń nie opanował
Pierwiastki bloku d. Zadanie 1.
 Zadanie 1. Zapisz równania reakcji tlenków chromu (II), (III), (VI) z kwasem solnym i zasadą sodową lub zaznacz, że reakcja nie zachodzi. Określ charakter chemiczny tlenków. Charakter chemiczny tlenków:
Zadanie 1. Zapisz równania reakcji tlenków chromu (II), (III), (VI) z kwasem solnym i zasadą sodową lub zaznacz, że reakcja nie zachodzi. Określ charakter chemiczny tlenków. Charakter chemiczny tlenków:
Wymagania programowe na poszczególne oceny. Chemia Kl.2. I. Kwasy
 Wymagania programowe na poszczególne oceny Chemia Kl.2 I. Kwasy Ocena dopuszczająca zna zasady bhp dotyczące obchodzenia się z kwasami definiuje elektrolit, nieelektrolit wyjaśnia pojęcie wskaźnika i wymienia
Wymagania programowe na poszczególne oceny Chemia Kl.2 I. Kwasy Ocena dopuszczająca zna zasady bhp dotyczące obchodzenia się z kwasami definiuje elektrolit, nieelektrolit wyjaśnia pojęcie wskaźnika i wymienia
Egzamin gimnazjalny. Chemia. Także w wersji online TRENING PRZED EGZAMINEM. Sprawdź, czy zdasz!
 Egzamin gimnazjalny 1 Chemia TRENING PRZED EGZAMINEM Także w wersji online Sprawdź, czy zdasz! Spis treści Zestaw 1: Substancje i ich właściwości 5 Zestaw 2: Wewnętrzna budowa materii 9 Zestaw 3: Reakcje
Egzamin gimnazjalny 1 Chemia TRENING PRZED EGZAMINEM Także w wersji online Sprawdź, czy zdasz! Spis treści Zestaw 1: Substancje i ich właściwości 5 Zestaw 2: Wewnętrzna budowa materii 9 Zestaw 3: Reakcje
Substancje i ich właściwości - zadania
 Zadanie 1 Spośród niżej wymienionych pierwiastków zaznacz ten, który jest metalem: a. N b. C c. S d. Ag Zadanie 2 Ceglastoczerwonym metalem jest: a. Zelazo b. Wapń c. Miedź d. Srebro Zadanie 3 Charakterystycznego
Zadanie 1 Spośród niżej wymienionych pierwiastków zaznacz ten, który jest metalem: a. N b. C c. S d. Ag Zadanie 2 Ceglastoczerwonym metalem jest: a. Zelazo b. Wapń c. Miedź d. Srebro Zadanie 3 Charakterystycznego
a) jeżeli przedstawiona reakcja jest reakcją egzotermiczną, to jej prawidłowy przebieg jest przedstawiony na wykresie za pomocą linii...
 1. Spośród podanych reakcji wybierz reakcję egzoenergetyczną: a) Redukcja tlenku miedzi (II) wodorem b) Otrzymywanie tlenu przez rozkład chloranu (V) potasu c) Otrzymywanie wapna palonego w procesie prażenia
1. Spośród podanych reakcji wybierz reakcję egzoenergetyczną: a) Redukcja tlenku miedzi (II) wodorem b) Otrzymywanie tlenu przez rozkład chloranu (V) potasu c) Otrzymywanie wapna palonego w procesie prażenia
Pracownia chemiczna. miejsce przeprowadzania doświadczeń
 Pracownia chemiczna miejsce przeprowadzania doświadczeń Chemicy to ludzie, którzy przeprowadzają doświadczenia, aby odpowiedzieć na różne pytania, na przykład takie: Dlaczego z lodowych sopli kapie woda?
Pracownia chemiczna miejsce przeprowadzania doświadczeń Chemicy to ludzie, którzy przeprowadzają doświadczenia, aby odpowiedzieć na różne pytania, na przykład takie: Dlaczego z lodowych sopli kapie woda?
WYMAGANIA NA POSZCZEGÓLNE STOPNIE SZKOLNE Z CHEMII klasa I
 WYMAGANIA NA POSZCZEGÓLNE STOPNIE SZKOLNE Z CHEMII klasa I Aby uzyskać ocenę wyższą niż dana ocena, uczeń musi opanować wiadomości i umiejętności dotyczące danej oceny oraz ocen od niej niższych. Dział:
WYMAGANIA NA POSZCZEGÓLNE STOPNIE SZKOLNE Z CHEMII klasa I Aby uzyskać ocenę wyższą niż dana ocena, uczeń musi opanować wiadomości i umiejętności dotyczące danej oceny oraz ocen od niej niższych. Dział:
a) Sole kwasu chlorowodorowego (solnego) to... b) Sole kwasu siarkowego (VI) to... c) Sole kwasu azotowego (V) to... d) Sole kwasu węglowego to...
 Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
KONKURS PRZEDMIOTOWY CHEMICZNY DLA UCZNIÓW GIMNAZJUM
 ... pieczątka nagłówkowa szkoły... kod pracy ucznia KONKURS PRZEDMIOTOWY CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP SZKOLNY Drogi Uczniu, Witaj w pierwszym etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
... pieczątka nagłówkowa szkoły... kod pracy ucznia KONKURS PRZEDMIOTOWY CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP SZKOLNY Drogi Uczniu, Witaj w pierwszym etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
SCENARIUSZ ZAJĘĆ INTERDYSCYPLINARNYCH
 85 S t r o n a IV. SCENARIUSZ ZAJĘĆ INTERDYSCYPLINARNYCH Temat:. Ściany jako podstawowy element domu, materiały izolacyjne. Czas trwania: 45 min. Cel główny: Uczeń: - potrafi rozpoznać materiały stosowane
85 S t r o n a IV. SCENARIUSZ ZAJĘĆ INTERDYSCYPLINARNYCH Temat:. Ściany jako podstawowy element domu, materiały izolacyjne. Czas trwania: 45 min. Cel główny: Uczeń: - potrafi rozpoznać materiały stosowane
Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014 Imię i nazwisko uczestnika Szkoła Klasa Nauczyciel Imię
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014 Imię i nazwisko uczestnika Szkoła Klasa Nauczyciel Imię
CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery.
 CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Substancje i ich przemiany WYMAGANIA PODSTAWOWE stosuje zasady bezpieczeństwa
CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Substancje i ich przemiany WYMAGANIA PODSTAWOWE stosuje zasady bezpieczeństwa
Wojewódzki Konkurs Wiedzy Chemicznej dla uczniów klas maturalnych organizowany przez ZDCh UJ Etap I, zadania
 Zadanie I. [16 punktów] W zadaniach od 1 5 jedna odpowiedź jest poprawna. Zad. 1. Który z podanych pierwiastków ma najniższą pierwszą energię jonizacji (czyli minimalną energię potrzebną do oderwania elektronu
Zadanie I. [16 punktów] W zadaniach od 1 5 jedna odpowiedź jest poprawna. Zad. 1. Który z podanych pierwiastków ma najniższą pierwszą energię jonizacji (czyli minimalną energię potrzebną do oderwania elektronu
Wymagania edukacyjne na poszczególne oceny z chemii dla klasy II gimnazjum oparte na programie nauczania Chemia Nowa Era
 Wymagania edukacyjne na poszczególne oceny z chemii dla klasy II gimnazjum oparte na programie nauczania Chemia Nowa Era IV. Kwasy Opracowała mgr Agnieszka Para Ocena dopuszczająca [1] wymienia zasady
Wymagania edukacyjne na poszczególne oceny z chemii dla klasy II gimnazjum oparte na programie nauczania Chemia Nowa Era IV. Kwasy Opracowała mgr Agnieszka Para Ocena dopuszczająca [1] wymienia zasady
b) Podaj liczbę moli chloru cząsteczkowego, która całkowicie przereaguje z jednym molem glinu.
 Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
Nazwy pierwiastków: A +Fe 2(SO 4) 3. Wzory związków: A B D. Równania reakcji:
 Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
I. Substancje i ich przemiany
 NaCoBeZU z chemii dla klasy 7 I. Substancje i ich przemiany 1. Zasady bezpiecznej pracy na lekcjach chemii zaliczam chemię do nauk przyrodniczych stosuję zasady bezpieczeństwa obowiązujące w pracowni chemicznej
NaCoBeZU z chemii dla klasy 7 I. Substancje i ich przemiany 1. Zasady bezpiecznej pracy na lekcjach chemii zaliczam chemię do nauk przyrodniczych stosuję zasady bezpieczeństwa obowiązujące w pracowni chemicznej
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab
 SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
DZIAŁ 3: ROZTWORY WODNE OCENA ŚRÓDROCZNA
 Wymagania edukacyjne niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z chemii w klasie II, wynikające z realizowanego programu nauczania chemii w gimnazjum K.M. Pazdro
Wymagania edukacyjne niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z chemii w klasie II, wynikające z realizowanego programu nauczania chemii w gimnazjum K.M. Pazdro
Substancje chemiczne Powietrze
 strona 1/9 Substancje chemiczne Powietrze Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Substancje i przemiany chemiczne w otoczeniu człowieka. Metale i niemetale, mieszaniny,
strona 1/9 Substancje chemiczne Powietrze Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Substancje i przemiany chemiczne w otoczeniu człowieka. Metale i niemetale, mieszaniny,
Podstawowe pojęcia i prawa chemiczne
 Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Związki nieorganiczne. Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn
 strona 1/7 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
strona 1/7 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
Beata Mendak fakultety z chemii II tura PYTANIA Z KLASY PIERWSZEJ
 Beata Mendak fakultety z chemii II tura Test rozwiązywany na zajęciach wymaga powtórzenia stężenia procentowego i rozpuszczalności. Podaję również pytania do naszej zaplanowanej wcześniej MEGA POWTÓRKI
Beata Mendak fakultety z chemii II tura Test rozwiązywany na zajęciach wymaga powtórzenia stężenia procentowego i rozpuszczalności. Podaję również pytania do naszej zaplanowanej wcześniej MEGA POWTÓRKI
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje wojewódzkie
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje wojewódzkie Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje wojewódzkie Zadanie
Drewno. Zalety: Wady:
 Drewno Drewno to naturalny surowiec w pełni odnawialny. Dzięki racjonalnej gospodarce leśnej w Polsce zwiększają się nie tylko zasoby drewna, lecz także powierzchnia lasów. łatwość w obróbce, lekkość i
Drewno Drewno to naturalny surowiec w pełni odnawialny. Dzięki racjonalnej gospodarce leśnej w Polsce zwiększają się nie tylko zasoby drewna, lecz także powierzchnia lasów. łatwość w obróbce, lekkość i
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap rejonowy rok szkolny 2010/2011 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap rejonowy rok szkolny 2010/2011 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
Powstawanie żelazianu(vi) sodu przebiega zgodnie z równaniem: Ponieważ termiczny rozkład kwasu borowego(iii) zachodzi zgodnie z równaniem:
 Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
Skały budujące Ziemię
 Skały budujące Ziemię Minerały Minerał pierwiastek lub związek chemiczny powstały w przyrodzie w sposób naturalny, jednorodny pod względem chemicznym i fizycznym. Minerały w większości mają budowę krystaliczną.
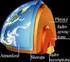
Skały budujące Ziemię Minerały Minerał pierwiastek lub związek chemiczny powstały w przyrodzie w sposób naturalny, jednorodny pod względem chemicznym i fizycznym. Minerały w większości mają budowę krystaliczną.
Wymagania edukacyjne z chemii dla klasy drugiej
 Na ocenę dopuszczającą uczeń: Wymagania edukacyjne z chemii dla klasy drugiej odczytuje wartościowość pierwiastka z układu okresowego pierwiastków chemicznych; nazywa tlenki zapisane za pomocą wzoru sumarycznego;
Na ocenę dopuszczającą uczeń: Wymagania edukacyjne z chemii dla klasy drugiej odczytuje wartościowość pierwiastka z układu okresowego pierwiastków chemicznych; nazywa tlenki zapisane za pomocą wzoru sumarycznego;
Roczny rozkład materiału nauczania chemii w II klasie gimnazjum (IICG)
 Roczny rozkład materiału nauczania chemii w II klasie gimnazjum (IICG) na rok szkolny 2015/16; 2 godz. tygodniowo x 34 tyg. = 68 godz. Dział 3: Łączenie się atomów wiązania chemiczne 5 godzin 1/1 Jak zapisać
Roczny rozkład materiału nauczania chemii w II klasie gimnazjum (IICG) na rok szkolny 2015/16; 2 godz. tygodniowo x 34 tyg. = 68 godz. Dział 3: Łączenie się atomów wiązania chemiczne 5 godzin 1/1 Jak zapisać
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
Plan wynikowy z wymaganiami edukacyjnymi przedmiotu chemia w zakresie podstawowym dla klasy I szkoły ponadgimnazjalnej. Ocena dobra.
 Plan wynikowy z wymaganiami edukacyjnymi przedmiotu chemia w zakresie podstawowym dla klasy I szkoły ponadgimnazjalnej Temat Ocena dopuszczająca. Uczeń: Ocena dostateczna. Uczeń: Dział 1. Materiały i tworzywa
Plan wynikowy z wymaganiami edukacyjnymi przedmiotu chemia w zakresie podstawowym dla klasy I szkoły ponadgimnazjalnej Temat Ocena dopuszczająca. Uczeń: Ocena dostateczna. Uczeń: Dział 1. Materiały i tworzywa
Przykłady ważniejszych minerałów występujących w skorupie ziemskiej
 Powtórzenie materiału do sprawdzianu skały i minerały I. Minerały i skały 1. Minerały - pierwiastki w stanie wolnym lub związki chemiczne, które występują przyrodzie i powstały w wyniku naturalnych procesów
Powtórzenie materiału do sprawdzianu skały i minerały I. Minerały i skały 1. Minerały - pierwiastki w stanie wolnym lub związki chemiczne, które występują przyrodzie i powstały w wyniku naturalnych procesów
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE etap szkolny rok szkolny 2010/2011 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE etap szkolny rok szkolny 2010/2011 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
Przedmiotowy system oceniania dla uczniów z obowiązkiem dostosowania wymagań edukacyjnych z chemii kl. II
 Chemia klasa II - wymagania programowe dla uczniów z obowiązkiem dostosowania wymagań edukacyjnych opracowane na podstawie planu wynikowego opublikowanego przez wydawnictwo OPERON 1. Wodorotlenki i kwasy
Chemia klasa II - wymagania programowe dla uczniów z obowiązkiem dostosowania wymagań edukacyjnych opracowane na podstawie planu wynikowego opublikowanego przez wydawnictwo OPERON 1. Wodorotlenki i kwasy
Temat 2: Nazewnictwo związków chemicznych. Otrzymywanie i właściwości tlenków
 Zasada ogólna: We wzorze sumarycznym pierwiastki zapisujemy od metalu do niemetalu, natomiast odczytujemy nazwę zaczynając od niemetalu: MgO, CaS, NaF Nazwy związków chemicznych najczęściej tworzymy, korzystając
Zasada ogólna: We wzorze sumarycznym pierwiastki zapisujemy od metalu do niemetalu, natomiast odczytujemy nazwę zaczynając od niemetalu: MgO, CaS, NaF Nazwy związków chemicznych najczęściej tworzymy, korzystając
Chemia klasa II - wymagania programowe. opracowane na podstawie planu wynikowego opublikowanego przez wydawnictwo OPERON
 Chemia klasa II - wymagania programowe opracowane na podstawie planu wynikowego opublikowanego przez wydawnictwo OPERON 1. Wodorotlenki i kwasy na ocenę dopuszczającą uczeń: - dzieli tlenki na tlenki metali
Chemia klasa II - wymagania programowe opracowane na podstawie planu wynikowego opublikowanego przez wydawnictwo OPERON 1. Wodorotlenki i kwasy na ocenę dopuszczającą uczeń: - dzieli tlenki na tlenki metali
Kod ucznia Liczba punktów A X B C X
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich
wcześniej. Sprawdziany mogą zawierać dodatkowe pytania (zadania) na ocenę celującą;
 PRZEDMIOTOWY SYSTEM OCENIANIA Z CHEMII 1. Uczniowie są oceniani w skali 1-6. Wspomagająco również plusami i minusami. 2. Uczeń może otrzymać ocenę za: a) wypowiedzi ustne (przynajmniej raz w semestrze,
PRZEDMIOTOWY SYSTEM OCENIANIA Z CHEMII 1. Uczniowie są oceniani w skali 1-6. Wspomagająco również plusami i minusami. 2. Uczeń może otrzymać ocenę za: a) wypowiedzi ustne (przynajmniej raz w semestrze,
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
SPOIWA MINERALNE POLITECHNIKA GDAŃSKA WYDZIAŁ CHEMICZNY KATEDRA INŻYNIERII PROCESOWEJ I TECHNOLOGII CHEMICZNEJ TECHNOLOGIE MATERIAŁÓW BUDOWLANYCH
 POLITECHNIKA GDAŃSKA WYDZIAŁ CHEMICZNY KATEDRA INŻYNIERII PROCESOWEJ I TECHNOLOGII CHEMICZNEJ TECHNOLOGIE MATERIAŁÓW BUDOWLANYCH SPOIWA MINERALNE dr hab. inż. Anna Zielińska-Jurek mgr inż. Zuzanna Bielan
POLITECHNIKA GDAŃSKA WYDZIAŁ CHEMICZNY KATEDRA INŻYNIERII PROCESOWEJ I TECHNOLOGII CHEMICZNEJ TECHNOLOGIE MATERIAŁÓW BUDOWLANYCH SPOIWA MINERALNE dr hab. inż. Anna Zielińska-Jurek mgr inż. Zuzanna Bielan
