Wstęp do Optyki i Fizyki Materii SkondensowanejI
|
|
|
- Jacek Kosiński
- 6 lat temu
- Przeglądów:
Transkrypt
1 Wstęp do Optyki i Fizyki Materii SkondensowanejI Ciało stałe 1+2 Wydział Fizyki UW Jacek.Szczytko@fuw.edu.pl Potr.Fita@fuw.edu.pl
2 Wiązania chemiczne i molekuły Przybliżenie Borna Oppenheimera Max Born ( ) Jacob R. Oppenheimer ( )
3 Molecules Dwuatomowe cząsteczki heterojądrowe e.g. CO, NO, HCl, HF Wiązanie jest silne gdy: Duża wartość całki nakrywania S i proporcjonalnej do niej całki H AB. Niewielka różnica energii orbitali atomowych E at, A, E at,b Orbitale molekularne nie muszą być zbudowane z orbitali atomowych tego samego typu (s-s lub p-p). e 2 E at,b e e 1 2 E E at, A at, B ( H E AB ( H E at, B AB at, B E E E at, A E at, A at, B S) at, A 2 S) 2 E at,a e1 H AA E at,a H BB E at,b dla E at,a < E at,b
4 Od molekuły do ciała stałego P. Atkins
5 Teoria pasmowa ciał stałych W. R. Fahrner (Editor) Nanotechnology and Nanoelectronics
6 Teoria pasmowa ciał stałych Model ciasnego wiązania W. R. Fahrner (Editor) Nanotechnology and Nanoelectronics
7 W. Ibach J. Ginter Od molekuły do ciała stałego Mała odległość między atomami Pasma (bands) Duża odległość między atomami Poziomy (levels) Dr hab. Darek Wasik 7
8 J. Ginter Od molekuły do ciała stałego E g Mała odległość między atomami Pasma (bands) Duża odległość między atomami Poziomy (levels) Przerwa energetyczna Energy gap
9 Molekuły Hybrydyzacja Carbon
10 Rodzaje wiązań Hybrydyzacja Półprzewodniki Carbon The binding energy per atom: C (diamond) 7.30 ev Si 4.64 ev Ge 3.87 ev
11 Rodzaje wiązań Kowalencyjne Półprzewodniki II III IV V VI Be B C N O Mg Al Si P S jonowość jonowość Zn Ga Ge As Se Cd In Sn Sb Te Group IV: diamond, Si, Ge Group III-V: GaAs, AlAs, InSb, InAs... Group II-VI: ZnSe, CdTe, ZnO, SdS
12 Rodzaje wiązań Carriers (nośniki): holes + electrons - Impurities (domieszki): Acceptrs (p-type) Donors (n-type) II III IV V VI Be B C N O Mg Al Si P S jonowość Półprzewodniki jonowość Zn Ga Ge As Se Cd In Sn Sb Te Group IV: diamond, Si, Ge Group III-V: GaAs, AlAs, InSb, InAs... Group II-VI: ZnSe, CdTe, ZnO, SdS
13 Rodzaje wiązań Kowalencyjne
14 Rodzaje wiązań Kowalencyjne Allotropes of carbon
15 Graphene Rodzaje wiązań Kowalencyjne
16 Rodzaje wiązań Kowalencyjne (+ kowalencyjne spolaryzowane) Valence electrons are shared between atoms (non-polar Dc < 0,4; polar 0,4 < Dc < 1,7) Ibach. Luth
17 Rodzaje wiązań Kowalencyjne (+ kowalencyjne spolaryzowane) Valence electrons are shared between atoms (non-polar Dc < 0,4; polar 0,4 < Dc < 1,7)
18 Rodzaje wiązań Wiązania jonowe Elektroujemność (ozn. c) - zdolność atomu w cząsteczce do przyciągania (przyłączania) elektronu. W skrajnym przypadku, gdy elektroujemności obu pierwiastków bardzo się różnią (np. Li i F), dochodzi do pełnego przeskoku elektronów na bardziej elektroujemny atom, co prowadzi do powstania wiązania jonowego (Dc 1,7). NaCl Wartości elektroujemności (wg Paulinga) dla kilku ważniejszych pierwiastków (dla H przyjęto 2,1) I II III IV V VI VII Li 1,0 Na 0,9 K 0,8 Rb 0,8 Be 1,5 Mg 1,2 Ca 1,0 B 2,0 Al 1,5 Ga 1,6 Jonowość C 2,5 Si 1,8 Ge 1,7 Sn 1,7 N 3,0 P 2,1 As 2,0 O 3,5 S 2,5 Se 2,4 Jonowość F 4,0 Cl 3,0 Br 2,8 J 2,
19 Rodzaje wiązań Wiązania jonowe Elektroujemność (ozn. c) - zdolność atomu w cząsteczce do przyciągania (przyłączania) elektronu. W skrajnym przypadku, gdy elektroujemności obu pierwiastków bardzo się różnią (np. Li i F), dochodzi do pełnego przeskoku elektronów na bardziej elektroujemny atom, co prowadzi do powstania wiązania jonowego (Dc 1,7). NaCl Convention: Covalent bond Dc 0,4 Polar Covalent 0,4 Dc 1,7 Ionic Bonds Dc 1,
20 Rodzaje wiązań Wiązania jonowe Elektroujemność (ozn. c) - zdolność atomu w cząsteczce do przyciągania (przyłączania) elektronu. W skrajnym przypadku, gdy elektroujemności obu pierwiastków bardzo się różnią (np. Li i F), dochodzi do pełnego przeskoku elektronów na bardziej elektroujemny atom, co prowadzi do powstania wiązania jonowego (Dc 1,7). NaCl The binding energy per pair of ions : NaCl 7.95 ev NaI 7.10 ev KBr 6.92 ev Distribution of charge density in the NaCl plane based on X-ray results. C. Kittel
21 Rodzaje wiązań Wiązania jonowe Elektroujemność (ozn. c) - zdolność atomu w cząsteczce do przyciągania (przyłączania) elektronu. W skrajnym przypadku, gdy elektroujemności obu pierwiastków bardzo się różnią (np. Li i F), dochodzi do pełnego przeskoku elektronów na bardziej elektroujemny atom, co prowadzi do powstania wiązania jonowego (Dc 1,7). NaCl V Ԧr ij = ± e2 4πε 0 r ij Potential energy between two singly charged ions i, j r ij = a p ij separation of nearest neighbours depends on crystal structure V r = 4πε 0 a i j e2 ±1 p ij = Ibach. Luth 18/01/ e2 4πε 0 a i j The Madelung constant A depends on the structure e.g. A NaCl = ±1 = e2 p ij 4πε 0 a A
22 Rodzaje wiązań Elektroujemność (ozn. c) - zdolność atomu w cząsteczce do przyciągania (przyłączania) elektronu. Wiązanie kowalencyjne (niespolaryzowane i spolaryzowane) Uwspólniona para elektronów (niespolaryzowane Dc < 0,4; spolaryzowane 0,4 < Dc < 1,7) Wiązanie jonowe Przeskok elektronu na jedno z centrów wiązania (Dc 1,7). Zasadniczy wkład do energii wiązania kryształów jonowych daje oddziaływanie elektrostatyczne (energa Madelunga): U r = N e2 4πε 0 r ±1 + B p ij r n i j i j r odległość między najbliższymi sąsiadami rp ij - odległość między parą jonów i, j B, n parametry potencjału odpychającego (n = 6 12) 1 p ij n A = σ i j ±1 p ij - stała Madelunga (dla struktury NaCl A = 1,748 dla CsCl A = 1,763)
23 Rodzaje wiązań Wiązanie metaliczne Wiązanie chemiczne w metalach, utworzone w wyniku elektrodynamicznego oddziaływania między dodatnio naładowanymi rdzeniami atomowymi, które znajdują się w węzłach sieci krystalicznej, a ujemnie naładowaną plazmą elektronową (elektronami zdelokalizowanymi, gazem elektronowym). Podobne do wiązania kowalencyjnego, ale elektrony tworzące wiązanie są wspólne dla wielkiej liczby atomów. Na + e Na + e Na + e Na + e Na + e Na + e Na + e Na + e Na + e e e e Na + Na + Na + Na + Na + e e e e e Na + Na + Na + Na + Na + e e e e Na + Na + Na + Na + Na + e e e e Na + Na + Na + Na + Na + e Electron gas e
24 Rodzaje wiązań Wiązanie metaliczne Wiązanie chemiczne w metalach, utworzone w wyniku elektrodynamicznego oddziaływania między dodatnio naładowanymi rdzeniami atomowymi, które znajdują się w węzłach sieci krystalicznej, a ujemnie naładowaną plazmą elektronową (elektronami zdelokalizowanymi, gazem elektronowym). Podobne do wiązania kowalencyjnego, ale elektrony tworzące wiązanie są wspólne dla wielkiej liczby atomów. W metalach alkalicznych zdelokalizowane mogą być tylko elektrony z ostatniej powłoki ns. W takich metalach łatwo zmienić długość wiązania (duża ściśliwość) W metalach z dalszych kolumn układu okresowego do wiązania dają istotny wkład głębsze powłoki (w szczególności w metalach przejściowych i ziemiach rzadkich niezamknięte powłoki d i f). W takich metalach znacznie trudniej zmienić długość wiązania (mała ściśliwość) W metalach wiązania są najczęściej niezbyt silne, ale są też metale o silnym wiązaniu np. wolfram 18/01/
25 Rodzaje wiązań Wiązanie metaliczne Wiązanie chemiczne w metalach, utworzone w wyniku elektrodynamicznego oddziaływania między dodatnio naładowanymi rdzeniami atomowymi, które znajdują się w węzłach sieci krystalicznej, a ujemnie naładowaną plazmą elektronową (elektronami zdelokalizowanymi, gazem elektronowym). Podobne do wiązania kowalencyjnego, ale elektrony tworzące wiązanie są wspólne dla wielkiej liczby atomów
26 Rodzaje wiązań Wiązanie wodorowe Hydrogen is shared between atoms Celulose
27 Rodzaje wiązań Wiązanie wodorowe Hydrogen is shared between atoms HF 2 C. Kittel
28 Rodzaje wiązań Wiązanie wodorowe Hydrogen is shared between atoms (H 2 0)
29 Rodzaje wiązań Wiązania Van der Waalsa Ne, Ar, Kr, Xe interaction of induced dipole moments
30 Rodzaje wiązań Wiązanie dipolowe (also intermolecular interaction) attractive forces between the positive end of one polar molecule and the negative end of another polar molecule - intermolecular interaction (e.g. ICl)
31 Wiązania Siły van der Waalsa (międzymolekularne) oddziaływanie pomiędzy dipolami trwałymi (oddziaływanie Keesoma) oddziaływanie pomiędzy dipolem trwałym i indukowanym (oddziaływanie Debye a) oddziaływanie Londona siły dyspersyjne Londona (oddziaływanie pomiędzy dipolami indukowanymi) Potencjal Lennarda-Jonesa U r = 4ε σ r 12 σ r 6 Energia potencjalna N atomów U tot r = 2Nε i j σ p ij r 12 i j σ p ij r 6 Wiązanie van der Waalsa Ne, Ar, Kr, Xe oddziaływanie wyindukowanych momentów dipolowych. Odpowiedzialne za możliwość skroplenia i zestalania gazów szlachetnych (oddziaływanie Londona)
32 Wiązania Elektroujemność (ozn. c) - zdolność atomu w cząsteczce do przyciągania (przyłączania) elektronu. Wiązanie kowalencyjne Wiązanie jonowe Wiązanie metaliczne Wiązanie kierunkowe (hybrydyzacja) Izolatory lub półprzewodniki (ładunek pomiędzy atomami) Wiele ze związków kowalencyjnych rozpuszcza się w rozpuszczalnikach niepolarnych, a nie rozpuszcza się w wodzie Wiązanie bezkierunkowe Izolatory (ładunek skupiony na jonach) Wiele ze związków jonowych rozpuszcza się w rozpuszczalnikach polarnych (woda), a nie rozpuszcza się w niepolarnych Wiązanie bezkierunkowe, elektrony zdelokalizoane (minimalizacja E kin ) Im więcej elektronów tym silniejsze wiązanie Przewodniki (ładunek swobodny) Metale krystalizują preferencyjnie w strukturach gęsto upakowanych (fcc, hcp, bcc) Plastyczne (jony metalu łatwo przemieszczają się pod wpływem siły zewnętrznej)
33 Wiązania Elektroujemność (ozn. c) - zdolność atomu w cząsteczce do przyciągania (przyłączania) elektronu. Wiązanie kowalencyjne Wiązanie jonowe Wiązanie metaliczne Wiązanie kierunkowe (hybrydyzacja) Izolatory lub półprzewodniki (ładunek pomiędzy atomami) Wiele ze związków kowalencyjnych rozpuszcza się w rozpuszczalnikach niepolarnych, a nie rozpuszcza się w wodzie Wiązanie bezkierunkowe Izolatory (ładunek skupiony na jonach) Wiele ze związków jonowych rozpuszcza się w rozpuszczalnikach polarnych (woda), a nie rozpuszcza się w niepolarnych Wiązanie bezkierunkowe, elektrony zdelokalizoane (minimalizacja E kin ) Im więcej elektronów tym silniejsze wiązanie Przewodniki (ładunek swobodny) Metale krystalizują preferencyjnie w strukturach gęsto upakowanych (fcc, hcp, bcc) Plastyczne (jony metalu łatwo przemieszczają się pod wpływem siły zewnętrznej)
34 Struktura krystaliczna Kryształy T n t 1 1 n2t2 n3t3 V ( r ) V ( r T ) wektory translacji prymitywnych Sieć (węzły sieci) jest regularnym i periodycznym układem punktów w przestrzeni. Jest ona matematyczna abstrakcją; ze strukturą krystaliczną mamy do czynienia jedynie wtedy, gdy baza atomów jest przyporządkowana jednoznacznie do każdego węzła sieci. Kryształ Ciało amorficzne
35 Porządek bliskiego zasięgu Al 2 O 3 Bliski porządek: ciała bezpostaciowe (amorficzne), przechłodzone ciecze każdy biały atom ma 2 czarnych sąsiadów każdy czarny atom ma 3 białych sąsiadów brak symetrii translacyjnej R. Stępniewski, Współczesne metody doświadczalne fizyki materii skondensowanej i optyki M. Baj Wykład
36 Porządek dalekiego zasięgu Al 2 O 3 Daleki porządek, kryształ (także ciekły!) każdy biały atom ma 2 czarnych sąsiadów każdy czarny atom ma 3 białych sąsiadów symetria translacyjna R. Stępniewski, Współczesne metody doświadczalne fizyki materii skondensowanej i optyki M. Baj Wykład
37 Struktura krystaliczna Wskaźniki węzłów T = n 1 Ԧt 1 + n 2 Ԧt 2 + n 3 Ԧt 3 primitive translation vectors wektory translacji prymitywnych
38 Struktura krystaliczna Wskaźniki węzłów T = n 1 Ԧt 1 + n 2 Ԧt 2 + n 3 Ԧt 3 primitive translation vectors wektory translacji prymitywnych Wektory translacji prymitywnych nie są wybrane jednoznacznie!
39 Struktura krystaliczna Wskaźniki węzłów T = n 1 Ԧt 1 + n 2 Ԧt 2 + n 3 Ԧt 3 primitive translation vectors wektory translacji prymitywnych Wektory translacji prymitywnych nie są wybrane jednoznacznie!
40 Struktura krystaliczna Wskaźniki węzłów T = n 1 Ԧt 1 + n 2 Ԧt 2 + n 3 Ԧt 3 primitive translation vectors Można na wiele sposobów wybrać komórkę elementarną. Zwykle chcemy, żeby komórka taka: miała możliwie najwyższą symetrię, najmniejszą objętość Komórka prosta: komórka elementarna o najmniejszej objętości Komórka prosta primitive lattice cell
41 Struktura krystaliczna Wskaźniki węzłów T = n 1 Ԧt 1 + n 2 Ԧt 2 + n 3 Ԧt 3 primitive translation vectors Wigner-Seitz primitive cell C. Kittel
42 Struktura krystaliczna Wskaźniki węzłów T = n 1 Ԧt 1 + n 2 Ԧt 2 + n 3 Ԧt 3 primitive translation vectors The basis (baza) may be a single atom, ion, a set of atoms, eg. proteins 10 5, positioned around each and every lattice point
43 Struktura krystaliczna Crystals T = n 1 Ԧt 1 + n 2 Ԧt 2 + n 3 Ԧt 3 R 0j Basis R nj = R 0j + T primitive translation vectors The basis (baza) may be a single atom, ion, a set of atoms, eg. proteins 10 5, positioned around each and every lattice point
44 Struktura krystaliczna Wskaźniki węzłów Hong Kong 𝑇 = 𝑛1 𝑡Ԧ1 + 𝑛2 𝑡Ԧ2 + 𝑛3 𝑡Ԧ3 fcc lattice 001 primitive translation vectors 011 ½½1 101 Photos by Michael Wolf 111 Translation vectors of lattice 0½ ½ ½ 0½ ½1 ½ 𝑛1 𝑎Ԧ1, 𝑛2 𝑎Ԧ 2, 𝑛3 𝑎Ԧ 3 1½ ½ Coordinates of a cell 𝑛1, 𝑛2, 𝑛 ½ ½
45 Struktura krystaliczna Wskaźniki węzłów Hong Kong 𝑇 = 𝑛1 𝑡Ԧ1 + 𝑛2 𝑡Ԧ2 + 𝑛3 𝑡Ԧ3 fcc lattice 001 primitive translation vectors 011 ½½ Translation vectors of lattice 0½ ½ ½ 0½ ½1 ½ 𝑛1 𝑎Ԧ1, 𝑛2 𝑎Ԧ 2, 𝑛3 𝑎Ԧ 3 1½ ½ Coordinates of a cell 𝑛1, 𝑛2, 𝑛 ½ ½
46 Struktura krystaliczna Crystals B n t 1 A B A = CD = nt 1 = t cos φ j j cos φ = n C A t 1 B D
47 Struktura krystaliczna Sieci Bravais T = n 1 Ԧt 1 + n 2 Ԧt 2 + n 3 Ԧt 3 primitive translation vectors High symmetry cell Primitive cell
48 Struktura krystaliczna Sieci Bravais Istnieje 14 możliwych sieci wypełniających przestrzeń. Sieci te noszą nazwę sieci Bravais. Tworzą one 7 układów krystalograficznych Auguste Bravais
49 Struktura krystaliczna Sieci Bravais Regularna Istnieje 14 możliwych sieci wypełniających przestrzeń. Sieci te noszą nazwę sieci Bravais. a b c 90 Tworzą one 7 układów krystalograficznych a b c 90 Tetragonalna Heksagonalna a b c Rombowa a b c 90 Romboedryczna a b c Jednoskośna a b c a b c Trójskośna
50 Struktura krystaliczna Sieć Bravais (Bravais lattice)
51 Struktura krystaliczna Bravais lattice Example: close packed structure 1 layer A
52 Struktura krystaliczna Bravais lattice Example: close packed structure 1 layer A 2 layer B
53 Struktura krystaliczna Bravais lattice Example: close packed structure 1 layer A 2 layer B 3 layer A B A B
54 Struktura krystaliczna Bravais lattice Example: close packed structure 1 layer A 2 layer B 3 layer C A B C
55 Struktura krystaliczna Bravais lattice Example: close packed structure hexagonal close-packed (HCP) Hexagonal lattice with basis fcc lattice
56 Struktura krystaliczna Bravais lattice Example: close packed structure hexagonal close-packed (HCP) Hexagonal lattice with basis fcc lattice
57 Struktura krystaliczna Bravais lattice Example: close packed structure hexagonal close-packed (HCP) Hexagonal lattice with basis
58 Struktura krystaliczna Bravais lattice Example: close packed structure fcc lattice
59 Struktura krystaliczna Bravais lattice Example: close packed structure fcc lattice
60 Struktura krystaliczna Bravais lattice Example: close packed structure fcc lattice
61 Struktura krystaliczna Wskaźniki węzłów T = n 1 Ԧt 1 + n 2 Ԧt 2 + n 3 Ԧt 3 primitive translation vectors fcc lattice ½ ½ 1 Translation vectors of lattice n 1 Ԧa 1, n 2 Ԧa 2, n 3 Ԧa 3 Coordinates of a cell ½ ½ ½ 0½ 1½ ½ 000 ½1 ½ ½ ½
62 Struktura krystaliczna Wskaźniki węzłów T = n 1 Ԧt 1 + n 2 Ԧt 2 + n 3 Ԧt 3 primitive translation vectors fcc lattice ½ ½ 1 Translation vectors of lattice n 1 Ԧa 1, n 2 Ԧa 2, n 3 Ԧa 3 Coordinates of a cell n 1, n 2, n ½ ½ ½ 0½ 1½ ½ 000 ½1 ½ ½ ½
63 Struktura krystaliczna Wskaźniki kierunków Zbiór najmniejszych liczb całkowitych względnie pierwszych u,v,w, które mają się do siebie tak, jak rzuty wektora równoległego do danego kierunku na osie krystaliczne. u vҧ w Wartości ujemne oznaczone są przez kreskę ( bar ) ponad liczbą [001] 011 ½ ½ 1 [112] [101] [111] ½ 0½ 1½ ½ fcc lattice 0½ ½ ½1 ½ ത1 [100] 000 ½ ½0 [110] [010]
64 Struktura krystaliczna Wskaźniki płaszczyzn Wskaźniki płaszczyzn zapisuje się jako (hkl), i oznaczają rodzinę płaszczyzn, która przecina osie w punktach: Ԧa 1 h, Ԧa 2 k, Ԧa 3 l Jeśli jeden ze wskaźników wynosi 0 to oznacza to, że jedna z płaszyzn nie przecina osi (1/0 = infinity) C Także: rodzina płaszyzn prostopadła do: h Ԧg 1 + k Ԧg 2 + l Ԧg 3 Gdzie Ԧg 1, Ԧg 2, Ԧg 3 są wektorami sieci odwrotnej E.g.: A=2, B=3, C=6, płaszczyzna (3,2,1) hkl płaszczyzna (plane) hkl rodzina płaszczyzn (set of planes) hkl kierunki (diections) hkl kierunki równoważne (set of directions) A 000 B
65 Struktura krystaliczna Wskaźniki płaszczyzn Wskaźniki płaszczyzn zapisuje się jako (hkl), i oznaczają rodzinę płaszczyzn, która przecina osie w punktach: Ԧa 1 h, Ԧa 2 k, Ԧa 3 l Jeśli jeden ze wskaźników wynosi 0 to oznacza to, że jedna z płaszyzn nie przecina osi (1/0 = infinity) C [321] Także: rodzina płaszyzn prostopadła do: h Ԧg 1 + k Ԧg 2 + l Ԧg 3 Gdzie Ԧg 1, Ԧg 2, Ԧg 3 są wektorami sieci odwrotnej E.g.: A=2, B=3, C=6, płaszczyzna (3,2,1) hkl płaszczyzna (plane) hkl rodzina płaszczyzn (set of planes) hkl kierunki (diections) hkl kierunki równoważne (set of directions) A 000 B
66 Struktura krystaliczna Wskaźniki płaszczyzn Wskaźniki płaszczyzn zapisuje się jako (hkl), i oznaczają rodzinę płaszczyzn, która przecina osie w punktach: Ԧa 1 h, Ԧa 2 k, Ԧa 3 l Jeśli jeden ze wskaźników wynosi 0 to oznacza to, że jedna z płaszyzn nie przecina osi (1/0 = infinity) Także: rodzina płaszyzn prostopadła do: h Ԧg 1 + k Ԧg 2 + l Ԧg 3 Gdzie Ԧg 1, Ԧg 2, Ԧg 3 są wektorami sieci odwrotnej E.g.: A=2, B=3, C=6, płaszczyzna (3,2,1) hkl płaszczyzna (plane) hkl rodzina płaszczyzn (set of planes) hkl kierunki (diections) hkl kierunki równoważne (set of directions)
67 Struktura krystaliczna Wskaźniki płaszczyzn Wskaźniki płaszczyzn zapisuje się jako (hkl), i oznaczają rodzinę płaszczyzn, która przecina osie w punktach: Ԧa 1 h, Ԧa 2 k, Ԧa 3 l Jeśli jeden ze wskaźników wynosi 0 to oznacza to, że jedna z płaszyzn nie przecina osi (1/0 = infinity) (100) (110) (111)
68 Struktura krystaliczna Wskaźniki płaszczyzn (110) (120) (212) (100) (110) (111)
69 Struktura krystaliczna Planes in the crystal
70 Krystalografia Wskaźniki płaszczyzn The crystalline structure is studied by means of the diffraction of photons, neutrons, electrons or other light particles
71 Krystalografia Dyfrakcja 1912 Max von Laue zauważył, że długości fali promieniowania X są porównywalne z odległościami międzyatomowymi w krysztale. Sugestia ta została szybko potwierdzona przez Waltera Friedricha i Paula Knippinga Model kryształu. Zbiór odbijających równoległych płaszczyzn o odległościach między płaszczyznowych d 2dsinθ = nλ William Lawrence Bragg (son) and William Henry Bragg (father), 1913 Max von Laue e.g. λ=1,54 Å, d = 4 Å, kryształ o symetrii regularnej, pierwszy refleks θ = 11 P. Atkins
72 Krystalografia Dyfrakcja Brehmsstrahlung promieniowanie hamowania "braking radiation" or "deceleration radiation" continuous spectrum
73 Krystalografia Dyfrakcja characteristic spectrum
74 Krystalografia methoda Lauego Kryształ oświetlony jest światłem białym. W wyniku rozproszenia fale o różnych długościach zostają rozproszone w różnych kierunkach. Otrzymujemy na kliszy różne punkty dla różnych kolorów (długości fali). Układ plamek ma symetrię taką jak kierunek w krysztale, wzdłuż którego pada fala
75 Quasicrystals and non-crystalline mater Theoretical description of liquids, amorphous solids, glasses, quasicrystals - very complicated - no translational symmetry. Condensation: Short-range order (liquid, solid amorphous, glass) Long-range order (crystalline matter) Penrose tiling
76 Krystalografia methoda Debaye-Scherera Peter Joseph Debye Paul Scherrer
77 Krystalografia Debaye-Scherer method Badanym ośrodkiem jest proszek z chaotyczna orientacją kryształów w przestrzeni. Oświetla się go falą monochromatyczną. Rozproszenie na różnie zorientowanych kryształach powoduje powstanie na kliszy łuków odpowiadających płaszczyznom, na których możliwe było ugięcie promienia
78 Krystalografia Atomic form factor (czynnik atomowy) NaCl KCl P. Atkins Both salts have the same crystal structure, but different diffraction, why? 79
79 Crystalography Atomic form factor (czynnik atomowy) NaCl KCl P. Atkins Both salts have the same crystal structure, but different diffraction, why? 80
80 Crystalography Atomic form factor (czynnik atomowy) K + and Cl - have the same number of electrons. They scatter similarly X-rays. For certain directions the destructive interference occurs (total extinction) Na + and Cl - - waves are scattered by atoms with different electrons, no total extinction. Thus there is atomic form factor
Wstęp do Optyki i Fizyki Materii Skondensowanej. Mateusz Goryca
 Wstęp do Optyki i Fizyki Materii Skondensowanej Mateusz Goryca mgoryca@fuw.edu.pl Uniwersytet Warszawski 2015 Materia skondensowana OC 6 H 13 H 13 C 6 O OC 6 H 13 H 17 C 8 O H 17 C 8 O N N Cu O O H 21
Wstęp do Optyki i Fizyki Materii Skondensowanej Mateusz Goryca mgoryca@fuw.edu.pl Uniwersytet Warszawski 2015 Materia skondensowana OC 6 H 13 H 13 C 6 O OC 6 H 13 H 17 C 8 O H 17 C 8 O N N Cu O O H 21
+ + Struktura cia³a sta³ego. Kryszta³y jonowe. Kryszta³y atomowe. struktura krystaliczna. struktura amorficzna
 Struktura cia³a sta³ego struktura krystaliczna struktura amorficzna odleg³oœci miêdzy atomami maj¹ tê sam¹ wartoœæ; dany atom ma wszêdzie takie samo otoczenie najbli szych s¹siadów odleg³oœci miêdzy atomami
Struktura cia³a sta³ego struktura krystaliczna struktura amorficzna odleg³oœci miêdzy atomami maj¹ tê sam¹ wartoœæ; dany atom ma wszêdzie takie samo otoczenie najbli szych s¹siadów odleg³oœci miêdzy atomami
Proste struktury krystaliczne
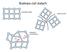 Budowa ciał stałych Proste struktury krystaliczne sc (simple cubic) bcc (body centered cubic) fcc (face centered cubic) np. Piryt FeSe 2 np. Żelazo, Wolfram np. Miedź, Aluminium Struktury krystaliczne
Budowa ciał stałych Proste struktury krystaliczne sc (simple cubic) bcc (body centered cubic) fcc (face centered cubic) np. Piryt FeSe 2 np. Żelazo, Wolfram np. Miedź, Aluminium Struktury krystaliczne
Chemia nieorganiczna. Pierwiastki. niemetale Be. 27 Co. 28 Ni. 26 Fe. 29 Cu. 45 Rh. 44 Ru. 47 Ag. 46 Pd. 78 Pt. 76 Os.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by arcourt,
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by arcourt,
Chemia nieorganiczna. Copyright 2000 by Harcourt, Inc. All rights reserved.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
Chemia nieorganiczna. Copyright 2000 by Harcourt, Inc. All rights reserved.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
Energia wiązania [ev] Wiązanie. Właściwości ciał stałych
![Energia wiązania [ev] Wiązanie. Właściwości ciał stałych Energia wiązania [ev] Wiązanie. Właściwości ciał stałych](/thumbs/42/23077809.jpg) Wiązanie Energia wiązania [ev] kowalencyjne 7-12 jonowe 7-10 metaliczne 1-4 wodorowe 0.2 0.4 Van der Waalsa 0.1 0.2 Właściwości ciał stałych - wysoka temperatura topnienia - twarde lub średniotwarde -
Wiązanie Energia wiązania [ev] kowalencyjne 7-12 jonowe 7-10 metaliczne 1-4 wodorowe 0.2 0.4 Van der Waalsa 0.1 0.2 Właściwości ciał stałych - wysoka temperatura topnienia - twarde lub średniotwarde -
Wstęp do Optyki i Fizyki Materii SkondensowanejI
 Wstęp do Optyki i Fizyki Materii SkondensowanejI 1100-3003 Ciało stałe 2 Wydział Fizyki UW Jacek.Szczytko@fuw.edu.pl Piotr.Fita@fuw.edu.pl Struktura krystaliczna Crystals B n t 1 A B A = CD = nt 1 = t
Wstęp do Optyki i Fizyki Materii SkondensowanejI 1100-3003 Ciało stałe 2 Wydział Fizyki UW Jacek.Szczytko@fuw.edu.pl Piotr.Fita@fuw.edu.pl Struktura krystaliczna Crystals B n t 1 A B A = CD = nt 1 = t
4. STRUKTURA KRYSZTAŁÓW PÓŁPRZEWODNIKOWYCH. Irena Zubel Wydział Elektroniki Mikrosystemów i Fotoniki Politechnika Wrocławska (na prawach rękopisu)
 4. STRUKTURA KRYSZTAŁÓW PÓŁPRZEWODNIKOWYCH Irena Zubel Wydział Elektroniki Mikrosystemów i Fotoniki Politechnika Wrocławska (na prawach rękopisu) Krzem, podstawowe parametry 1. Konfiguracja elektronowa:
4. STRUKTURA KRYSZTAŁÓW PÓŁPRZEWODNIKOWYCH Irena Zubel Wydział Elektroniki Mikrosystemów i Fotoniki Politechnika Wrocławska (na prawach rękopisu) Krzem, podstawowe parametry 1. Konfiguracja elektronowa:
Chemia nieorganiczna. Pierwiastki. niemetale Be. 27 Co. 28 Ni. 26 Fe. 29 Cu. 45 Rh. 44 Ru. 47 Ag. 46 Pd. 78 Pt. 76 Os.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by Harcourt,
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by Harcourt,
Ciała stałe. Ciała krystaliczne. Ciała amorficzne. Bardzo często mamy do czynienia z ciałami polikrystalicznymi, rzadko monokryształami.
 Ciała stałe Ciała krystaliczne Ciała amorficzne Bardzo często mamy do czynienia z ciałami polikrystalicznymi, rzadko monokryształami. r T = Kryształy rosną przez regularne powtarzanie się identycznych
Ciała stałe Ciała krystaliczne Ciała amorficzne Bardzo często mamy do czynienia z ciałami polikrystalicznymi, rzadko monokryształami. r T = Kryształy rosną przez regularne powtarzanie się identycznych
Inne koncepcje wiązań chemicznych. 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań?
 Inne koncepcje wiązań chemicznych 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie.
Inne koncepcje wiązań chemicznych 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie.
Lekcja 15. Temat: Prąd elektryczny w róŝnych środowiskach.
 Lekcja 15 Temat: Prąd elektryczny w róŝnych środowiskach. Pod wpływem pola elektrycznego (przyłoŝonego napięcia) w materiałach, w których istnieją ruchliwe nośniki ładunku dochodzi do zjawiska przewodzenia
Lekcja 15 Temat: Prąd elektryczny w róŝnych środowiskach. Pod wpływem pola elektrycznego (przyłoŝonego napięcia) w materiałach, w których istnieją ruchliwe nośniki ładunku dochodzi do zjawiska przewodzenia
Wiązania. w świetle teorii kwantów fenomenologicznie
 Wiązania w świetle teorii kwantów fenomenologicznie Wiązania Teoria kwantowa: zwiększenie gęstości prawdopodobieństwa znalezienia elektronów w przestrzeni pomiędzy atomami c a a c b b Liniowa kombinacja
Wiązania w świetle teorii kwantów fenomenologicznie Wiązania Teoria kwantowa: zwiększenie gęstości prawdopodobieństwa znalezienia elektronów w przestrzeni pomiędzy atomami c a a c b b Liniowa kombinacja
Teoria VSEPR. Jak przewidywac strukturę cząsteczki?
 Teoria VSEPR Jak przewidywac strukturę cząsteczki? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie. Rozkład elektronów walencyjnych w cząsteczce (struktura Lewisa) stuktura
Teoria VSEPR Jak przewidywac strukturę cząsteczki? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie. Rozkład elektronów walencyjnych w cząsteczce (struktura Lewisa) stuktura
Stany skupienia materii
 Stany skupienia materii Ciała stałe - ustalony kształt i objętość - uporządkowanie dalekiego zasięgu - oddziaływania harmoniczne Ciecze -słabo ściśliwe - uporządkowanie bliskiego zasięgu -tworzą powierzchnię
Stany skupienia materii Ciała stałe - ustalony kształt i objętość - uporządkowanie dalekiego zasięgu - oddziaływania harmoniczne Ciecze -słabo ściśliwe - uporządkowanie bliskiego zasięgu -tworzą powierzchnię
WIĄZANIA. Co sprawia, że ciała stałe istnieją i są stabilne? PRZYCIĄGANIE ODPYCHANIE
 WIĄZANIA Co sprawia, że ciała stałe istnieją i są stabilne? PRZYCIĄGANIE ODPYCHANIE Przyciąganie Wynika z elektrostatycznego oddziaływania między elektronami a dodatnimi jądrami atomowymi. Może to być
WIĄZANIA Co sprawia, że ciała stałe istnieją i są stabilne? PRZYCIĄGANIE ODPYCHANIE Przyciąganie Wynika z elektrostatycznego oddziaływania między elektronami a dodatnimi jądrami atomowymi. Może to być
WIĄZANIA. Co sprawia, że ciała stałe istnieją i są stabilne? PRZYCIĄGANIE ODPYCHANIE
 WIĄZANIA Co sprawia, że ciała stałe istnieją i są stabilne? PRZYCIĄGANIE ODPYCHANIE 1 Przyciąganie Wynika z elektrostatycznego oddziaływania między elektronami a dodatnimi jądrami atomowymi. Może to być
WIĄZANIA Co sprawia, że ciała stałe istnieją i są stabilne? PRZYCIĄGANIE ODPYCHANIE 1 Przyciąganie Wynika z elektrostatycznego oddziaływania między elektronami a dodatnimi jądrami atomowymi. Może to być
Informacje uzyskiwane dzięki spektrometrii mas
 Slajd 1 Spektrometria mas i sektroskopia w podczerwieni Slajd 2 Informacje uzyskiwane dzięki spektrometrii mas Masa cząsteczkowa Wzór związku Niektóre informacje dotyczące wzoru strukturalnego związku
Slajd 1 Spektrometria mas i sektroskopia w podczerwieni Slajd 2 Informacje uzyskiwane dzięki spektrometrii mas Masa cząsteczkowa Wzór związku Niektóre informacje dotyczące wzoru strukturalnego związku
CZ STECZKA. Do opisu wi za chemicznych stosuje si najcz ciej jedn z dwóch metod (teorii): metoda wi za walencyjnych (VB)
 CZ STECZKA Stanislao Cannizzaro (1826-1910) cz stki - elementy mikro wiata, termin obejmuj cy zarówno cz stki elementarne, jak i atomy, jony proste i zło one, cz steczki, rodniki, cz stki koloidowe; cz
CZ STECZKA Stanislao Cannizzaro (1826-1910) cz stki - elementy mikro wiata, termin obejmuj cy zarówno cz stki elementarne, jak i atomy, jony proste i zło one, cz steczki, rodniki, cz stki koloidowe; cz
S. Baran - Podstawy fizyki materii skondensowanej Wiązania chemiczne w ciałach stałych. Wiązania chemiczne w ciałach stałych
 Wiązania chemiczne w ciałach stałych Wiązania chemiczne w ciałach stałych typ kowalencyjne jonowe metaliczne Van der Waalsa wodorowe siła* silne silne silne pochodzenie uwspólnienie e- (pary e-) przez
Wiązania chemiczne w ciałach stałych Wiązania chemiczne w ciałach stałych typ kowalencyjne jonowe metaliczne Van der Waalsa wodorowe siła* silne silne silne pochodzenie uwspólnienie e- (pary e-) przez
Elementy teorii powierzchni metali
 Prof. dr hab. Adam Kiejna Elementy teorii powierzchni metali Wykład dla studentów fizyki Rok akademicki 2017/18 (30 godz.) Wykład 1 Plan wykładu Struktura periodyczna kryształów, sieć odwrotna Struktura
Prof. dr hab. Adam Kiejna Elementy teorii powierzchni metali Wykład dla studentów fizyki Rok akademicki 2017/18 (30 godz.) Wykład 1 Plan wykładu Struktura periodyczna kryształów, sieć odwrotna Struktura
Podstawowe oddziaływania w Naturze
 Podstawowe oddziaływania w Naturze Wszystkie w zjawiska w Naturze są określone przez cztery podstawowe oddziaływania Silne Grawitacja Newton Elektromagnetyczne Słabe n = p + e - + ν neutron = proton +
Podstawowe oddziaływania w Naturze Wszystkie w zjawiska w Naturze są określone przez cztery podstawowe oddziaływania Silne Grawitacja Newton Elektromagnetyczne Słabe n = p + e - + ν neutron = proton +
Krystalografia. Typowe struktury pierwiastków i związków chemicznych
 Krystalografia Typowe struktury pierwiastków i związków chemicznych Wiązania w kryształach jonowe silne, bezkierunkowe kowalencyjne silne, kierunkowe metaliczne słabe lub silne, bezkierunkowe van der Waalsa
Krystalografia Typowe struktury pierwiastków i związków chemicznych Wiązania w kryształach jonowe silne, bezkierunkowe kowalencyjne silne, kierunkowe metaliczne słabe lub silne, bezkierunkowe van der Waalsa
Wykład 9 Wprowadzenie do krystalochemii
 Wykład 9 Wprowadzenie do krystalochemii 1. Krystalografia a krystalochemia. 2. Prawa krystalochemii 3. Sieć krystaliczna i pozycje atomów 4. Bliskie i dalekie uporządkowanie. 5. Kryształ a cząsteczka.
Wykład 9 Wprowadzenie do krystalochemii 1. Krystalografia a krystalochemia. 2. Prawa krystalochemii 3. Sieć krystaliczna i pozycje atomów 4. Bliskie i dalekie uporządkowanie. 5. Kryształ a cząsteczka.
Fizyka Ciała Stałego
 Wykład III Struktura krystaliczna Fizyka Ciała Stałego Ciała stałe można podzielić na: Krystaliczne, o uporządkowanym ułożeniu atomów lub molekuł tworzącym sieć krystaliczną. Amorficzne, brak uporządkowania,
Wykład III Struktura krystaliczna Fizyka Ciała Stałego Ciała stałe można podzielić na: Krystaliczne, o uporządkowanym ułożeniu atomów lub molekuł tworzącym sieć krystaliczną. Amorficzne, brak uporządkowania,
Wiązania chemiczne. Związek klasyfikacji ciał krystalicznych z charakterem wiązań atomowych. 5 typów wiązań
 Wiązania chemiczne Związek klasyfikacji ciał krystalicznych z charakterem wiązań atomowych 5 typów wiązań wodorowe A - H - A, jonowe ( np. KCl ) molekularne (pomiędzy atomami gazów szlachetnych i małymi
Wiązania chemiczne Związek klasyfikacji ciał krystalicznych z charakterem wiązań atomowych 5 typów wiązań wodorowe A - H - A, jonowe ( np. KCl ) molekularne (pomiędzy atomami gazów szlachetnych i małymi
SPEKTROSKOPIA LASEROWA
 SPEKTROSKOPIA LASEROWA Spektroskopia laserowa dostarcza wiedzy o naturze zjawisk zachodz cych na poziomie atomów i cz steczek oraz oddzia ywaniu promieniowania z materi i nale y do jednej z najwa niejszych
SPEKTROSKOPIA LASEROWA Spektroskopia laserowa dostarcza wiedzy o naturze zjawisk zachodz cych na poziomie atomów i cz steczek oraz oddzia ywaniu promieniowania z materi i nale y do jednej z najwa niejszych
Agrofi k zy a Wyk Wy ł k ad V Marek Kasprowicz
 Agrofizyka Wykład V Marek Kasprowicz Spektroskopia p nauka o powstawaniu i interpretacji widm powstających w wyniku oddziaływań wszelkich rodzajów promieniowania na materię ę rozumianą jako zbiorowisko
Agrofizyka Wykład V Marek Kasprowicz Spektroskopia p nauka o powstawaniu i interpretacji widm powstających w wyniku oddziaływań wszelkich rodzajów promieniowania na materię ę rozumianą jako zbiorowisko
STRUKTURA CIAŁA STAŁEGO
 STRUKTURA CIAŁA STAŁEGO Podział ciał stałych Ciała - bezpostaciowe (amorficzne) Szkła, żywice, tłuszcze, niektóre proszki. Nie wykazują żadnych regularnych płaszczyzn ograniczających, nie można w nich
STRUKTURA CIAŁA STAŁEGO Podział ciał stałych Ciała - bezpostaciowe (amorficzne) Szkła, żywice, tłuszcze, niektóre proszki. Nie wykazują żadnych regularnych płaszczyzn ograniczających, nie można w nich
40. Międzynarodowa Olimpiada Fizyczna Meksyk, 12-19 lipca 2009 r. ZADANIE TEORETYCZNE 2 CHŁODZENIE LASEROWE I MELASA OPTYCZNA
 ZADANIE TEORETYCZNE 2 CHŁODZENIE LASEROWE I MELASA OPTYCZNA Celem tego zadania jest podanie prostej teorii, która tłumaczy tak zwane chłodzenie laserowe i zjawisko melasy optycznej. Chodzi tu o chłodzenia
ZADANIE TEORETYCZNE 2 CHŁODZENIE LASEROWE I MELASA OPTYCZNA Celem tego zadania jest podanie prostej teorii, która tłumaczy tak zwane chłodzenie laserowe i zjawisko melasy optycznej. Chodzi tu o chłodzenia
Model wiązania kowalencyjnego cząsteczka H 2
 Model wiązania kowalencyjnego cząsteczka H 2 + Współrzędne elektronu i protonów Orbitale wiążący i antywiążący otrzymane jako kombinacje orbitali atomowych Orbital wiążący duża gęstość ładunku między jądrami
Model wiązania kowalencyjnego cząsteczka H 2 + Współrzędne elektronu i protonów Orbitale wiążący i antywiążący otrzymane jako kombinacje orbitali atomowych Orbital wiążący duża gęstość ładunku między jądrami
Laboratorium z Konwersji Energii. Ogniwo fotowoltaiczne
 Laboratorium z Konwersji Energii Ogniwo fotowoltaiczne 1.0 WSTĘP Energia słoneczna jest energią reakcji termojądrowych zachodzących w olbrzymiej odległości od Ziemi. Zachodzące na Słońcu przemiany helu
Laboratorium z Konwersji Energii Ogniwo fotowoltaiczne 1.0 WSTĘP Energia słoneczna jest energią reakcji termojądrowych zachodzących w olbrzymiej odległości od Ziemi. Zachodzące na Słońcu przemiany helu
Kwantowa natura promieniowania elektromagnetycznego
 Kwantowa natura promieniowania elektromagnetycznego Zjawisko fotoelektryczne. Zadanie 1. Jaką prędkość posiada fotoelektron wytworzony przez kwant γ o energii E γ=1,27mev? W porównaniu z pracą wyjścia
Kwantowa natura promieniowania elektromagnetycznego Zjawisko fotoelektryczne. Zadanie 1. Jaką prędkość posiada fotoelektron wytworzony przez kwant γ o energii E γ=1,27mev? W porównaniu z pracą wyjścia
Od redakcji. Symbolem oznaczono zadania wykraczające poza zakres materiału omówionego w podręczniku Fizyka z plusem cz. 2.
 Od redakcji Niniejszy zbiór zadań powstał z myślą o tych wszystkich, dla których rozwiązanie zadania z fizyki nie polega wyłącznie na mechanicznym przekształceniu wzorów i podstawieniu do nich danych.
Od redakcji Niniejszy zbiór zadań powstał z myślą o tych wszystkich, dla których rozwiązanie zadania z fizyki nie polega wyłącznie na mechanicznym przekształceniu wzorów i podstawieniu do nich danych.
MATERIA. = m i liczby całkowite. ciała stałe. - kryształy - ciała bezpostaciowe (amorficzne) - ciecze KRYSZTAŁY. Periodyczność
 MATERIA ciała stałe - kryształy - ciała bezpostaciowe (amorficzne) - ciecze - gazy KRYSZTAŁY Periodyczność Kryształ (idealny) struktura zbudowana z powtarzających się w przestrzeni periodycznie identycznych
MATERIA ciała stałe - kryształy - ciała bezpostaciowe (amorficzne) - ciecze - gazy KRYSZTAŁY Periodyczność Kryształ (idealny) struktura zbudowana z powtarzających się w przestrzeni periodycznie identycznych
PIERWIASTKI W UKŁADZIE OKRESOWYM
 PIERWIASTKI W UKŁADZIE OKRESOWYM 1 Układ okresowy Co można odczytać z układu okresowego? - konfigurację elektronową - podział na bloki - podział na grupy i okresy - podział na metale i niemetale - trendy
PIERWIASTKI W UKŁADZIE OKRESOWYM 1 Układ okresowy Co można odczytać z układu okresowego? - konfigurację elektronową - podział na bloki - podział na grupy i okresy - podział na metale i niemetale - trendy
S. Baran - Podstawy fizyki materii skondensowanej Struktura krystaliczna. Struktura krystaliczna
 S. Baran - Podstawy fizyki materii skondensowanej Struktura krystaliczna Struktura krystaliczna Kwarc (SiO2) (źródło: Wikipedia) Piryt (FeS2) (źródło: Wikipedia) Halit/Sól kamienna (NaCl) (źródło: Wikipedia)
S. Baran - Podstawy fizyki materii skondensowanej Struktura krystaliczna Struktura krystaliczna Kwarc (SiO2) (źródło: Wikipedia) Piryt (FeS2) (źródło: Wikipedia) Halit/Sól kamienna (NaCl) (źródło: Wikipedia)
TEORIE KWASÓW I ZASAD.
 TERIE KWASÓW I ZASAD. Teoria Arrheniusa (nagroda Nobla 1903 r). Kwas kaŝda substancja, która dostarcza jony + do roztworu. A + + A Zasada kaŝda substancja, która dostarcza jony do roztworu. M M + + Reakcja
TERIE KWASÓW I ZASAD. Teoria Arrheniusa (nagroda Nobla 1903 r). Kwas kaŝda substancja, która dostarcza jony + do roztworu. A + + A Zasada kaŝda substancja, która dostarcza jony do roztworu. M M + + Reakcja
Techniczne nauki М.М.Zheplinska, A.S.Bessarab Narodowy uniwersytet spożywczych technologii, Кijow STOSOWANIE PARY WODNEJ SKRAPLANIA KAWITACJI
 Techniczne nauki М.М.Zheplinska, A.S.Bessarab Narodowy uniwersytet spożywczych technologii, Кijow STOSOWANIE PARY WODNEJ SKRAPLANIA KAWITACJI SKLAROWANEGO SOKU JABŁKOWEGO Skutecznym sposobem leczenia soku
Techniczne nauki М.М.Zheplinska, A.S.Bessarab Narodowy uniwersytet spożywczych technologii, Кijow STOSOWANIE PARY WODNEJ SKRAPLANIA KAWITACJI SKLAROWANEGO SOKU JABŁKOWEGO Skutecznym sposobem leczenia soku
Ćwiczenie: "Ruch harmoniczny i fale"
 Ćwiczenie: "Ruch harmoniczny i fale" Opracowane w ramach projektu: "Wirtualne Laboratoria Fizyczne nowoczesną metodą nauczania realizowanego przez Warszawską Wyższą Szkołę Informatyki. Zakres ćwiczenia:
Ćwiczenie: "Ruch harmoniczny i fale" Opracowane w ramach projektu: "Wirtualne Laboratoria Fizyczne nowoczesną metodą nauczania realizowanego przez Warszawską Wyższą Szkołę Informatyki. Zakres ćwiczenia:
PRÓG RENTOWNOŚCI i PRÓG
 PRÓG RENTOWNOŚCI i PRÓG WYPŁACALNOŚCI (MB) Próg rentowności (BP) i margines bezpieczeństwa Przychody Przychody Koszty Koszty całkowite Koszty stałe Koszty zmienne BP Q MB Produkcja gdzie: BP próg rentowności
PRÓG RENTOWNOŚCI i PRÓG WYPŁACALNOŚCI (MB) Próg rentowności (BP) i margines bezpieczeństwa Przychody Przychody Koszty Koszty całkowite Koszty stałe Koszty zmienne BP Q MB Produkcja gdzie: BP próg rentowności
RAPORT z diagnozy Matematyka na starcie
 RAPORT z diagnozy Matematyka na starcie przeprowadzonej w klasach pierwszych szkół ponadgimnazjalnych 1 Analiza statystyczna Wskaźnik Wartość wskaźnika Wyjaśnienie Liczba uczniów Liczba uczniów, którzy
RAPORT z diagnozy Matematyka na starcie przeprowadzonej w klasach pierwszych szkół ponadgimnazjalnych 1 Analiza statystyczna Wskaźnik Wartość wskaźnika Wyjaśnienie Liczba uczniów Liczba uczniów, którzy
Jak TO działa? Co to są półprzewodniki? TRENDY: Prawo Moore a. Google: Jacek Szczytko Login: student Hasło: *******
 Co to są półprzewodniki? Jak TO działa? http://www.fuw.edu.pl/~szczytko/ Google: Jacek Szczytko Login: student Hasło: ******* Jacek.Szczytko@fuw.edu.pl Wydział Fizyki UW 2 TRENDY: Prawo Moore a TRENDY:
Co to są półprzewodniki? Jak TO działa? http://www.fuw.edu.pl/~szczytko/ Google: Jacek Szczytko Login: student Hasło: ******* Jacek.Szczytko@fuw.edu.pl Wydział Fizyki UW 2 TRENDY: Prawo Moore a TRENDY:
Fizyka Ciała Stałego. Struktura krystaliczna. Struktura amorficzna
 Wykład II Struktura krystaliczna Fizyka Ciała Stałego Ciała stałe można podzielić na: Amorficzne, brak uporządkowania, np. szkła; Krystaliczne, o uporządkowanym ułożeniu atomów lub molekuł tworzącym sieć
Wykład II Struktura krystaliczna Fizyka Ciała Stałego Ciała stałe można podzielić na: Amorficzne, brak uporządkowania, np. szkła; Krystaliczne, o uporządkowanym ułożeniu atomów lub molekuł tworzącym sieć
Objaśnienia do Wieloletniej Prognozy Finansowej na lata 2011-2017
 Załącznik Nr 2 do uchwały Nr V/33/11 Rady Gminy Wilczyn z dnia 21 lutego 2011 r. w sprawie uchwalenia Wieloletniej Prognozy Finansowej na lata 2011-2017 Objaśnienia do Wieloletniej Prognozy Finansowej
Załącznik Nr 2 do uchwały Nr V/33/11 Rady Gminy Wilczyn z dnia 21 lutego 2011 r. w sprawie uchwalenia Wieloletniej Prognozy Finansowej na lata 2011-2017 Objaśnienia do Wieloletniej Prognozy Finansowej
Fizyka Ciała Stałego. Struktura krystaliczna. Struktura amorficzna
 Wykład II Struktura krystaliczna Fizyka Ciała Stałego Ciała stałe można podzielić na: Amorficzne, brak uporządkowania, np. szkła; Krystaliczne, o uporządkowanym ułożeniu atomów lub molekuł tworzącym sieć
Wykład II Struktura krystaliczna Fizyka Ciała Stałego Ciała stałe można podzielić na: Amorficzne, brak uporządkowania, np. szkła; Krystaliczne, o uporządkowanym ułożeniu atomów lub molekuł tworzącym sieć
Atom poziom podstawowy
 Atom poziom podstawowy Zadanie 1. (1 pkt) Źródło: CKE 2010 (PP), zad. 1. Atomy pewnego pierwiastka w stanie podstawowym maj nast puj c konfiguracj elektronów walencyjnych: 2s 2 2p 3 (L 5 ) Okre l po o
Atom poziom podstawowy Zadanie 1. (1 pkt) Źródło: CKE 2010 (PP), zad. 1. Atomy pewnego pierwiastka w stanie podstawowym maj nast puj c konfiguracj elektronów walencyjnych: 2s 2 2p 3 (L 5 ) Okre l po o
Fizyka Laserów wykład 10. Czesław Radzewicz
 Fizyka Laserów wykład 10 Czesław Radzewicz Struktura energetyczna półprzewodników Regularna budowa kryształu okresowy potencjał Funkcja falowa elektronu. konsekwencje: E ψ r pasmo przewodnictwa = u r e
Fizyka Laserów wykład 10 Czesław Radzewicz Struktura energetyczna półprzewodników Regularna budowa kryształu okresowy potencjał Funkcja falowa elektronu. konsekwencje: E ψ r pasmo przewodnictwa = u r e
Zasady obsadzania poziomów
 Zasady obsadzania poziomów Model atomu Bohra Model kwantowy atomu Fala stojąca Liczby kwantowe -główna liczba kwantowa (n = 1,2,3...) kwantuje energię elektronu (numer orbity) -poboczna liczba kwantowa
Zasady obsadzania poziomów Model atomu Bohra Model kwantowy atomu Fala stojąca Liczby kwantowe -główna liczba kwantowa (n = 1,2,3...) kwantuje energię elektronu (numer orbity) -poboczna liczba kwantowa
Elementy teorii powierzchni metali
 prof. dr hab. Adam Kiejna Elementy teorii powierzchni metali Wykład 4 v.16 Wiązanie metaliczne Wiązanie metaliczne Zajmujemy się tylko metalami dlatego w zasadzie interesuje nas tylko wiązanie metaliczne.
prof. dr hab. Adam Kiejna Elementy teorii powierzchni metali Wykład 4 v.16 Wiązanie metaliczne Wiązanie metaliczne Zajmujemy się tylko metalami dlatego w zasadzie interesuje nas tylko wiązanie metaliczne.
Wyznaczanie współczynnika sprężystości sprężyn i ich układów
 Ćwiczenie 63 Wyznaczanie współczynnika sprężystości sprężyn i ich układów 63.1. Zasada ćwiczenia W ćwiczeniu określa się współczynnik sprężystości pojedynczych sprężyn i ich układów, mierząc wydłużenie
Ćwiczenie 63 Wyznaczanie współczynnika sprężystości sprężyn i ich układów 63.1. Zasada ćwiczenia W ćwiczeniu określa się współczynnik sprężystości pojedynczych sprężyn i ich układów, mierząc wydłużenie
Metody wyceny zasobów, źródła informacji o kosztach jednostkowych
 Metody wyceny zasobów, źródła informacji o kosztach jednostkowych by Antoni Jeżowski, 2013 W celu kalkulacji kosztów realizacji zadania (poszczególnych działań i czynności) konieczne jest przeprowadzenie
Metody wyceny zasobów, źródła informacji o kosztach jednostkowych by Antoni Jeżowski, 2013 W celu kalkulacji kosztów realizacji zadania (poszczególnych działań i czynności) konieczne jest przeprowadzenie
TEST DIAGNOZUJACY Z FIZYKI DLA UCZNIÓW KLAS I GIMNAZJUM
 Henryk Rej nauczyciel fizyki Gimnazjum Nr 1 43-100 Tychy ul. Brzozowa 24 PROPOZYCJA ZAJĘĆ Z FIZYKI: TEST DIAGNOZUJACY Z FIZYKI DLA UCZNIÓW KLAS I GIMNAZJUM CELE OGÓLNY: popularyzacja nauk przyrodniczych
Henryk Rej nauczyciel fizyki Gimnazjum Nr 1 43-100 Tychy ul. Brzozowa 24 PROPOZYCJA ZAJĘĆ Z FIZYKI: TEST DIAGNOZUJACY Z FIZYKI DLA UCZNIÓW KLAS I GIMNAZJUM CELE OGÓLNY: popularyzacja nauk przyrodniczych
Biuro Ruchu Drogowego
 KOMENDA GŁÓWNA G POLICJI Biuro Ruchu Drogowego Kampania pod hasłem ODBLASKI ŻYCIA W okresie od stycznia do października 2008 roku miało miejsce: 40 725 wypadków drogowych, w wyniku których 51 987 osób
KOMENDA GŁÓWNA G POLICJI Biuro Ruchu Drogowego Kampania pod hasłem ODBLASKI ŻYCIA W okresie od stycznia do października 2008 roku miało miejsce: 40 725 wypadków drogowych, w wyniku których 51 987 osób
Objaśnienia wartości, przyjętych do Projektu Wieloletniej Prognozy Finansowej Gminy Golina na lata 2012-2015
 Załącznik Nr 2 do Uchwały Nr XIX/75/2011 Rady Miejskiej w Golinie z dnia 29 grudnia 2011 r. Objaśnienia wartości, przyjętych do Projektu Wieloletniej Prognozy Finansowej Gminy Golina na lata 2012-2015
Załącznik Nr 2 do Uchwały Nr XIX/75/2011 Rady Miejskiej w Golinie z dnia 29 grudnia 2011 r. Objaśnienia wartości, przyjętych do Projektu Wieloletniej Prognozy Finansowej Gminy Golina na lata 2012-2015
Nauka o Materiałach. Wykład XII. Właściwości elektryczne. Jerzy Lis
 Nauka o Materiałach Wykład XII Właściwości elektryczne Jerzy Lis Nauka o Materiałach Treść wykładu: 1. Wprowadzenie 2. a) wiadomości podstawowe b) przewodniki c) półprzewodniki d) izolatory 3. Właściwości
Nauka o Materiałach Wykład XII Właściwości elektryczne Jerzy Lis Nauka o Materiałach Treść wykładu: 1. Wprowadzenie 2. a) wiadomości podstawowe b) przewodniki c) półprzewodniki d) izolatory 3. Właściwości
Ćwiczenie 5 Hologram gruby
 Ćwiczenie 5 Hologram gruby 1. Wprowadzenie: Na poprzednim ćwiczeniu zapoznaliśmy się z hologramem Fresnela, który daje nam moŝliwość zapisu obiektu przestrzennego. Wadą jego jednak jest to, iŝ moŝemy go
Ćwiczenie 5 Hologram gruby 1. Wprowadzenie: Na poprzednim ćwiczeniu zapoznaliśmy się z hologramem Fresnela, który daje nam moŝliwość zapisu obiektu przestrzennego. Wadą jego jednak jest to, iŝ moŝemy go
UKŁAD OKRESOWY PIERWIASTKÓW
 UKŁAD OKRESOWY PIERWIASTKÓW Michał Sędziwój (1566-1636) Alchemik Sędziwój - Jan Matejko Pierwiastki chemiczne p.n.e. Sb Sn Zn Pb Hg S Ag C Au Fe Cu (11)* do XVII w. As (1250 r.) P (1669 r.) (2) XVIII
UKŁAD OKRESOWY PIERWIASTKÓW Michał Sędziwój (1566-1636) Alchemik Sędziwój - Jan Matejko Pierwiastki chemiczne p.n.e. Sb Sn Zn Pb Hg S Ag C Au Fe Cu (11)* do XVII w. As (1250 r.) P (1669 r.) (2) XVIII
Zagospodarowanie magazynu
 Zagospodarowanie magazynu Wymagania wobec projektu magazynu - 1 jak najlepsze wykorzystanie pojemności związane z szybkością rotacji i konieczną szybkością dostępu do towaru; im większa wymagana szybkość
Zagospodarowanie magazynu Wymagania wobec projektu magazynu - 1 jak najlepsze wykorzystanie pojemności związane z szybkością rotacji i konieczną szybkością dostępu do towaru; im większa wymagana szybkość
MATERIAŁ UZUPEŁNIAJĄCY DO WYKŁADU - MATERIAŁOZNAWSTWO WBiIŚ, sem. 02
 2. Struktura materiałów 2.1. Budowa atomu MATERIAŁ UZUPEŁNIAJĄCY DO WYKŁADU - MATERIAŁOZNAWSTWO WBiIŚ, sem. 02 Każdy przedmiot, zarówno wytworzony przez przyrodę, jak i będący dziełem pracy ludzkiej, utworzony
2. Struktura materiałów 2.1. Budowa atomu MATERIAŁ UZUPEŁNIAJĄCY DO WYKŁADU - MATERIAŁOZNAWSTWO WBiIŚ, sem. 02 Każdy przedmiot, zarówno wytworzony przez przyrodę, jak i będący dziełem pracy ludzkiej, utworzony
Kalendarz Maturzysty 2010/11 Fizyka
 Kalendarz Maturzysty 2010/11 Fizyka Kalendarz Maturzysty 2010/11 Fizyka Patryk Kamiński Drogi Maturzysto, Oddajemy Ci do rąk profesjonalny Kalendarz Maturzysty z fizyki stworzony przez naszego eksperta.
Kalendarz Maturzysty 2010/11 Fizyka Kalendarz Maturzysty 2010/11 Fizyka Patryk Kamiński Drogi Maturzysto, Oddajemy Ci do rąk profesjonalny Kalendarz Maturzysty z fizyki stworzony przez naszego eksperta.
POSTĘP TECHNOLOGICZNY A STRUKTURA CZASU PRACY, KOSZTY I EFEKTYWNOŚĆ NAKŁADÓW W TRANSPORCIE WARZYW
 InŜynieria Rolnicza 11/2006 Stanisław Kokoszka, Sylwester Tabor Katedra InŜynierii Rolniczej i Informatyki Akademia Rolnicza w Krakowie POSTĘP TECHNOLOGICZNY A STRUKTURA CZASU PRACY, KOSZTY I EFEKTYWNOŚĆ
InŜynieria Rolnicza 11/2006 Stanisław Kokoszka, Sylwester Tabor Katedra InŜynierii Rolniczej i Informatyki Akademia Rolnicza w Krakowie POSTĘP TECHNOLOGICZNY A STRUKTURA CZASU PRACY, KOSZTY I EFEKTYWNOŚĆ
WZORU UŻYTKOWEGO EGZEMPLARZ ARCHIWALNY. d2)opis OCHRONNY. (19) PL (n)62894. Centralny Instytut Ochrony Pracy, Warszawa, PL
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej d2)opis OCHRONNY WZORU UŻYTKOWEGO (21) Numer zgłoszenia: 112772 (22) Data zgłoszenia: 29.11.2001 EGZEMPLARZ ARCHIWALNY (19) PL (n)62894 (13)
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej d2)opis OCHRONNY WZORU UŻYTKOWEGO (21) Numer zgłoszenia: 112772 (22) Data zgłoszenia: 29.11.2001 EGZEMPLARZ ARCHIWALNY (19) PL (n)62894 (13)
PRZEWODNIK PO PRZEDMIOCIE
 Nazwa przedmiotu: Kierunek: Inżynieria Biomedyczna Rodzaj przedmiotu: obowiązkowy moduł kierunkowy ogólny Rodzaj zajęć: wykład, ćwiczenia, laboratorium CHEMIA Chemistry Forma studiów: studia stacjonarne
Nazwa przedmiotu: Kierunek: Inżynieria Biomedyczna Rodzaj przedmiotu: obowiązkowy moduł kierunkowy ogólny Rodzaj zajęć: wykład, ćwiczenia, laboratorium CHEMIA Chemistry Forma studiów: studia stacjonarne
FOTOMETRYCZNE PRAWO ODLEGŁOŚCI (O9)
 FOTOMETRYCZNE PRAWO ODLEGŁOŚCI (O9) INSTRUKCJA WYKONANIA ĆWICZENIA I. Zestaw przyrządów: Rys.1 Układ pomiarowy II. Wykonanie pomiarów: 1. Na komputerze wejść w zakładkę student a następnie klikać: start
FOTOMETRYCZNE PRAWO ODLEGŁOŚCI (O9) INSTRUKCJA WYKONANIA ĆWICZENIA I. Zestaw przyrządów: Rys.1 Układ pomiarowy II. Wykonanie pomiarów: 1. Na komputerze wejść w zakładkę student a następnie klikać: start
NAJWAŻNIEJSZE ZALETY LAMP DIODOWYCH
 NAJWAŻNIEJSZE ZALETY LAMP DIODOWYCH Pozwalają zaoszczędzić do 80% energii elektrycznej i więcej! Strumień światła zachowuje 100% jakości w okresie eksploatacji nawet do 50.000 do 70.000 h tj. w okresie
NAJWAŻNIEJSZE ZALETY LAMP DIODOWYCH Pozwalają zaoszczędzić do 80% energii elektrycznej i więcej! Strumień światła zachowuje 100% jakości w okresie eksploatacji nawet do 50.000 do 70.000 h tj. w okresie
Budowa i dziaanie aparatu
 Budowa i dziaanie aparatu Fizyczne właściwości urządzeo rentgenowskiego radiologicznych stosowanych w danej dziedzinie mgr Adam Łukowiak Charakterystyka urządzeo radiologicznych ze względu na rejestrację
Budowa i dziaanie aparatu Fizyczne właściwości urządzeo rentgenowskiego radiologicznych stosowanych w danej dziedzinie mgr Adam Łukowiak Charakterystyka urządzeo radiologicznych ze względu na rejestrację
STRUKTURA KRYSZTAŁÓW
 STRUKTURA KRYSZTAŁÓW Skala wielkości spotykanych w krystalografii: Średnica atomu wodoru: 10 Rozmiar komórki elementarnej: od kilku do kilkudziesięciu Å o D = 1*10 m = 1A 1 Struktura = sieć + baza atomowa
STRUKTURA KRYSZTAŁÓW Skala wielkości spotykanych w krystalografii: Średnica atomu wodoru: 10 Rozmiar komórki elementarnej: od kilku do kilkudziesięciu Å o D = 1*10 m = 1A 1 Struktura = sieć + baza atomowa
LVI OLIMPIADA FIZYCZNA 2006/2007 Zawody II stopnia
 LVI OLIMPIADA FIZYCZNA 2006/2007 Zawody II stopnia Zadanie doświadczalne Energia elektronów w półprzewodniku może przybierać wartości należące do dwóch przedziałów: dolnego (tzw. pasmo walencyjne) i górnego
LVI OLIMPIADA FIZYCZNA 2006/2007 Zawody II stopnia Zadanie doświadczalne Energia elektronów w półprzewodniku może przybierać wartości należące do dwóch przedziałów: dolnego (tzw. pasmo walencyjne) i górnego
Temat: Funkcje. Własności ogólne. A n n a R a j f u r a, M a t e m a t y k a s e m e s t r 1, W S Z i M w S o c h a c z e w i e 1
 Temat: Funkcje. Własności ogólne A n n a R a j f u r a, M a t e m a t y k a s e m e s t r 1, W S Z i M w S o c h a c z e w i e 1 Kody kolorów: pojęcie zwraca uwagę * materiał nieobowiązkowy A n n a R a
Temat: Funkcje. Własności ogólne A n n a R a j f u r a, M a t e m a t y k a s e m e s t r 1, W S Z i M w S o c h a c z e w i e 1 Kody kolorów: pojęcie zwraca uwagę * materiał nieobowiązkowy A n n a R a
9. Dyfrakcja światła laserowego na tkaninach i siatce dyfrakcyjnej oraz promieni X na krysztale. Obliczenia dyfrakcyjne.
 9. Dyfrakcja światła laserowego na tkaninach i siatce dyfrakcyjnej oraz promieni X na krysztale. Obliczenia dyfrakcyjne. Opracowanie: dr hab inż. Jarosław Chojnacki Politechnika Gdańska, Gdańsk 016 Materiały:
9. Dyfrakcja światła laserowego na tkaninach i siatce dyfrakcyjnej oraz promieni X na krysztale. Obliczenia dyfrakcyjne. Opracowanie: dr hab inż. Jarosław Chojnacki Politechnika Gdańska, Gdańsk 016 Materiały:
Wsparcie wykorzystania OZE w ramach RPO WL 2014-2020
 Wsparcie wykorzystania OZE w ramach RPO WL 2014-2020 Zarys finansowania RPO WL 2014-2020 Na realizację Regionalnego Programu Operacyjnego Województwa Lubelskiego na lata 2014-2020 przeznaczono łączną kwotę
Wsparcie wykorzystania OZE w ramach RPO WL 2014-2020 Zarys finansowania RPO WL 2014-2020 Na realizację Regionalnego Programu Operacyjnego Województwa Lubelskiego na lata 2014-2020 przeznaczono łączną kwotę
PRAWA ZACHOWANIA. Podstawowe terminy. Cia a tworz ce uk ad mechaniczny oddzia ywuj mi dzy sob i z cia ami nie nale cymi do uk adu za pomoc
 PRAWA ZACHOWANIA Podstawowe terminy Cia a tworz ce uk ad mechaniczny oddzia ywuj mi dzy sob i z cia ami nie nale cymi do uk adu za pomoc a) si wewn trznych - si dzia aj cych na dane cia o ze strony innych
PRAWA ZACHOWANIA Podstawowe terminy Cia a tworz ce uk ad mechaniczny oddzia ywuj mi dzy sob i z cia ami nie nale cymi do uk adu za pomoc a) si wewn trznych - si dzia aj cych na dane cia o ze strony innych
Kod pracy. Po udzieleniu odpowiedzi do zadań 1 20, wypełnij tabelkę
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Kod pracy Wypełnia Przewodniczący Wojewódzkiej Koisji Wojewódzkiego Konkursu Przediotowego z Fizyki Iię i nazwisko ucznia... Szkoła...
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Kod pracy Wypełnia Przewodniczący Wojewódzkiej Koisji Wojewódzkiego Konkursu Przediotowego z Fizyki Iię i nazwisko ucznia... Szkoła...
Bioinformatyka Laboratorium, 30h. Michał Bereta mbereta@pk.edu.pl www.michalbereta.pl
 Bioinformatyka Laboratorium, 30h Michał Bereta mbereta@pk.edu.pl www.michalbereta.pl 1 Filogenetyka molekularna wykorzystuje informację zawartą w sekwencjach aminokwasów lub nukleotydów do kontrukcji drzew
Bioinformatyka Laboratorium, 30h Michał Bereta mbereta@pk.edu.pl www.michalbereta.pl 1 Filogenetyka molekularna wykorzystuje informację zawartą w sekwencjach aminokwasów lub nukleotydów do kontrukcji drzew
Gaz i jego parametry
 W1 30 Gaz doskonały Parametry gazu Równanie Clapeyrona Mieszaniny gazów Warunki normalne 1 Gazem doskonałym nazywamy gaz spełniaj niający następuj pujące warunki: - cząstki gazu zachowują się jako doskonale
W1 30 Gaz doskonały Parametry gazu Równanie Clapeyrona Mieszaniny gazów Warunki normalne 1 Gazem doskonałym nazywamy gaz spełniaj niający następuj pujące warunki: - cząstki gazu zachowują się jako doskonale
Konfiguracja elektronowa atomu
 Konfiguracja elektronowa atomu ANALIZA CHEMICZNA BADANIE WŁAŚCIWOŚCI SUBSTANCJI KONTROLA I STEROWANIE PROCESAMI TECHNOLOGICZNYMI Właściwości pierwiastków - Układ okresowy Prawo okresowości Mendelejewa
Konfiguracja elektronowa atomu ANALIZA CHEMICZNA BADANIE WŁAŚCIWOŚCI SUBSTANCJI KONTROLA I STEROWANIE PROCESAMI TECHNOLOGICZNYMI Właściwości pierwiastków - Układ okresowy Prawo okresowości Mendelejewa
Pomiary geofizyczne w otworach
 Pomiary geofizyczne w otworach Profilowanie w geofizyce otworowej oznacza rejestrację zmian fizycznego parametru z głębokością. Badania geofizyki otworowej, wykonywane dla potrzeb geologicznego rozpoznania
Pomiary geofizyczne w otworach Profilowanie w geofizyce otworowej oznacza rejestrację zmian fizycznego parametru z głębokością. Badania geofizyki otworowej, wykonywane dla potrzeb geologicznego rozpoznania
Błędy fotografii akwarystycznej
 Błędy fotografii akwarystycznej Błędy metody nr.2 Źle ustawiona lampa błyskowa na stopce - promień odbity zamiast biec pomiędzy lampą błyskową a aparatem trafił w obiektyw. Przy okazji widać ślady po związkach
Błędy fotografii akwarystycznej Błędy metody nr.2 Źle ustawiona lampa błyskowa na stopce - promień odbity zamiast biec pomiędzy lampą błyskową a aparatem trafił w obiektyw. Przy okazji widać ślady po związkach
Maria Kościelna, Wroclaw University of Economics
 Maria Kościelna, Wroclaw University of Economics Working paper Prognoza przychodów ze sprzedaży na podstawie przedsiębiorstwa z gastronomi. Słowa kluczowe: Przychody ze sprzedaży, koszt kapitału pracującego,
Maria Kościelna, Wroclaw University of Economics Working paper Prognoza przychodów ze sprzedaży na podstawie przedsiębiorstwa z gastronomi. Słowa kluczowe: Przychody ze sprzedaży, koszt kapitału pracującego,
14P2 POWTÓRKA FIKCYJNY EGZAMIN MATURALNYZ FIZYKI I ASTRONOMII - II POZIOM PODSTAWOWY
 14P2 POWTÓRKA FIKCYJNY EGZAMIN MATURALNYZ FIZYKI I ASTRONOMII - II POZIOM PODSTAWOWY Ruch jednostajny po okręgu Pole grawitacyjne Rozwiązania zadań należy zapisać w wyznaczonych miejscach pod treścią zadania
14P2 POWTÓRKA FIKCYJNY EGZAMIN MATURALNYZ FIZYKI I ASTRONOMII - II POZIOM PODSTAWOWY Ruch jednostajny po okręgu Pole grawitacyjne Rozwiązania zadań należy zapisać w wyznaczonych miejscach pod treścią zadania
spektroskopia UV Vis (cz. 2)
 spektroskopia UV Vis (cz. 2) spektroskopia UV-Vis dlaczego? wiele związków organicznych posiada chromofory, które absorbują w zakresie UV duża czułość: zastosowanie w badaniach kinetyki reakcji spektroskop
spektroskopia UV Vis (cz. 2) spektroskopia UV-Vis dlaczego? wiele związków organicznych posiada chromofory, które absorbują w zakresie UV duża czułość: zastosowanie w badaniach kinetyki reakcji spektroskop
wiat o mo e by rozumiane jako strumie fotonów albo jako fala elektromagnetyczna. Najprostszym przypadkiem fali elektromagnetycznej jest fala p aska
 G ÓWNE CECHY WIAT A LASEROWEGO wiat o mo e by rozumiane jako strumie fotonów albo jako fala elektromagnetyczna. Najprostszym przypadkiem fali elektromagnetycznej jest fala p aska - cz sto ko owa, - cz
G ÓWNE CECHY WIAT A LASEROWEGO wiat o mo e by rozumiane jako strumie fotonów albo jako fala elektromagnetyczna. Najprostszym przypadkiem fali elektromagnetycznej jest fala p aska - cz sto ko owa, - cz
INSTRUKCJA DLA UCZESTNIKÓW ZAWODÓW ZADANIA
 INSTRUKCJA DLA UCZESTNIKÓW ZAWODÓW 1. Zawody III stopnia trwają 150 min. 2. Arkusz egzaminacyjny składa się z 2 pytań otwartych o charakterze problemowym, 1 pytania opisowego i 1 mini testu składającego
INSTRUKCJA DLA UCZESTNIKÓW ZAWODÓW 1. Zawody III stopnia trwają 150 min. 2. Arkusz egzaminacyjny składa się z 2 pytań otwartych o charakterze problemowym, 1 pytania opisowego i 1 mini testu składającego
Statystyczna analiza danych w programie STATISTICA. Dariusz Gozdowski. Katedra Doświadczalnictwa i Bioinformatyki Wydział Rolnictwa i Biologii SGGW
 Statystyczna analiza danych w programie STATISTICA ( 4 (wykład Dariusz Gozdowski Katedra Doświadczalnictwa i Bioinformatyki Wydział Rolnictwa i Biologii SGGW Regresja prosta liniowa Regresja prosta jest
Statystyczna analiza danych w programie STATISTICA ( 4 (wykład Dariusz Gozdowski Katedra Doświadczalnictwa i Bioinformatyki Wydział Rolnictwa i Biologii SGGW Regresja prosta liniowa Regresja prosta jest
Właściwości materii - powtórzenie
 Przygotowano za pomocą programu Ciekawa fizyka. Bank zadań Copyright by Wydawnictwa Szkolne i Pedagogiczne sp. z o.o., Warszawa 2011 strona 1 Imię i nazwisko ucznia Data...... Klasa... Zadanie 1. Czy zjawisko
Przygotowano za pomocą programu Ciekawa fizyka. Bank zadań Copyright by Wydawnictwa Szkolne i Pedagogiczne sp. z o.o., Warszawa 2011 strona 1 Imię i nazwisko ucznia Data...... Klasa... Zadanie 1. Czy zjawisko
Udoskonalona wentylacja komory suszenia
 Udoskonalona wentylacja komory suszenia Komora suszenia Kratka wentylacyjna Zalety: Szybkie usuwanie wilgoci z przestrzeni nad próbką Ograniczenie emisji ciepła z komory suszenia do modułu wagowego W znacznym
Udoskonalona wentylacja komory suszenia Komora suszenia Kratka wentylacyjna Zalety: Szybkie usuwanie wilgoci z przestrzeni nad próbką Ograniczenie emisji ciepła z komory suszenia do modułu wagowego W znacznym
Efektywność nauczania w Gimnazjum w Lutyni
 Efektywność nauczania w Gimnazjum w Lutyni Efektywność nauczania w danej szkole często utożsamiana jest z jej wynikami egzaminacyjnymi. Gdyby wszystkie szkoły w Polsce pracowały z uczniami o tym samym
Efektywność nauczania w Gimnazjum w Lutyni Efektywność nauczania w danej szkole często utożsamiana jest z jej wynikami egzaminacyjnymi. Gdyby wszystkie szkoły w Polsce pracowały z uczniami o tym samym
KONKURS PRZEDMIOTOWY Z FIZYKI dla uczniów gimnazjów województwa lubuskiego 23 marca 2012 r. zawody III stopnia (finałowe)
 Pieczęć KONKURS PRZEDMIOTOWY Z FIZYKI dla uczniów gimnazjów województwa lubuskiego 23 marca 2012 r. zawody III stopnia (finałowe) Witamy Cię na trzecim etapie Konkursu Przedmiotowego z Fizyki i życzymy
Pieczęć KONKURS PRZEDMIOTOWY Z FIZYKI dla uczniów gimnazjów województwa lubuskiego 23 marca 2012 r. zawody III stopnia (finałowe) Witamy Cię na trzecim etapie Konkursu Przedmiotowego z Fizyki i życzymy
MATEMATYKA 9. INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 FUNKCJE WYKŁADNICZE, LOGARYTMY
 INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 017/018 www.medicus.edu.pl tel. 501 38 39 55 MATEMATYKA 9 FUNKCJE WYKŁADNICZE, LOGARYTMY Dla dowolnej liczby a > 0, liczby
INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 017/018 www.medicus.edu.pl tel. 501 38 39 55 MATEMATYKA 9 FUNKCJE WYKŁADNICZE, LOGARYTMY Dla dowolnej liczby a > 0, liczby
wstrzykiwanie "dodatkowych" nośników w przyłożonym polu elektrycznym => wzrost gęstości nośników (n)
 UKŁADY STUDNI KWANTOWYCH I BARIER W POLU LEKTRYCZNYM transport podłużny efekt podpasm energia kinetyczna ruchu do złącz ~ h 2 k 2 /2m, na dnie podpasma k =0 => v =0 wstrzykiwanie "dodatkowych" nośników
UKŁADY STUDNI KWANTOWYCH I BARIER W POLU LEKTRYCZNYM transport podłużny efekt podpasm energia kinetyczna ruchu do złącz ~ h 2 k 2 /2m, na dnie podpasma k =0 => v =0 wstrzykiwanie "dodatkowych" nośników
KLAUZULE ARBITRAŻOWE
 KLAUZULE ARBITRAŻOWE KLAUZULE arbitrażowe ICC Zalecane jest, aby strony chcące w swych kontraktach zawrzeć odniesienie do arbitrażu ICC, skorzystały ze standardowych klauzul, wskazanych poniżej. Standardowa
KLAUZULE ARBITRAŻOWE KLAUZULE arbitrażowe ICC Zalecane jest, aby strony chcące w swych kontraktach zawrzeć odniesienie do arbitrażu ICC, skorzystały ze standardowych klauzul, wskazanych poniżej. Standardowa
Wpływ wyników misji Planck na obraz Wszechświata
 Wpływ wyników misji Planck na obraz Wszechświata Sławomir Stachniewicz, IF PK 1. Skąd wiemy, jaki jest Wszechświat? Nasze informacje na temat Wszechświata pochodzą z dwóch źródeł: z obserwacji i z modeli
Wpływ wyników misji Planck na obraz Wszechświata Sławomir Stachniewicz, IF PK 1. Skąd wiemy, jaki jest Wszechświat? Nasze informacje na temat Wszechświata pochodzą z dwóch źródeł: z obserwacji i z modeli
PODSTAWOWE ELEMENTY ELEKTRONICZNE
 PODSTAWOWE ELEMENTY ELEKTRONCZNE Publikacja współfinansowana ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego 1. Diody półprzewodnikowe Złącze PN - podstawa budowy i działania diody,
PODSTAWOWE ELEMENTY ELEKTRONCZNE Publikacja współfinansowana ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego 1. Diody półprzewodnikowe Złącze PN - podstawa budowy i działania diody,
Segment B.XII Opór elektryczny Przygotował: Michał Zawada
 Segment B.XII Opór elektryczny Przygotował: Michał Zawada Zad. 1 Człowiek może zostać porażony nawet przez tak słaby prąd, jak prąd o natężeniu 50 ma, jeżeli przepływa on blisko serca. Elektryk, pracując
Segment B.XII Opór elektryczny Przygotował: Michał Zawada Zad. 1 Człowiek może zostać porażony nawet przez tak słaby prąd, jak prąd o natężeniu 50 ma, jeżeli przepływa on blisko serca. Elektryk, pracując
Technologie kodowania i oznaczania opakowań leków w gotowych. Koło o ISPE AMG 2007
 Technologie kodowania i oznaczania opakowań leków w gotowych Michał Burdyński Koło o ISPE AMG 2007 Na początek trochę faktów Roczny wzrost przemysłu u opakowań farmaceutycznych szacuje się na poziomie
Technologie kodowania i oznaczania opakowań leków w gotowych Michał Burdyński Koło o ISPE AMG 2007 Na początek trochę faktów Roczny wzrost przemysłu u opakowań farmaceutycznych szacuje się na poziomie
STA T T A YSTYKA Korelacja
 STATYSTYKA Korelacja Pojęcie korelacji Korelacja (współzależność cech) określa wzajemne powiązania pomiędzy wybranymi zmiennymi. Charakteryzując korelację dwóch cech podajemy dwa czynniki: kierunek oraz
STATYSTYKA Korelacja Pojęcie korelacji Korelacja (współzależność cech) określa wzajemne powiązania pomiędzy wybranymi zmiennymi. Charakteryzując korelację dwóch cech podajemy dwa czynniki: kierunek oraz
Teoria pasmowa ciał stałych
 Teoria pasmowa ciał stałych Poziomy elektronowe atomów w cząsteczkach ulegają rozszczepieniu. W kryształach zjawisko to prowadzi do wytworzenia się pasm. Klasyfikacja ciał stałych na podstawie struktury
Teoria pasmowa ciał stałych Poziomy elektronowe atomów w cząsteczkach ulegają rozszczepieniu. W kryształach zjawisko to prowadzi do wytworzenia się pasm. Klasyfikacja ciał stałych na podstawie struktury
