Własności chemiczne pierwiastków transaktynowych
|
|
|
- Feliks Brzozowski
- 8 lat temu
- Przeglądów:
Transkrypt
1 Własności chemiczne pierwiastków transaktynowych Aleksander Bilewicz II Letnia Szkoła Energetyki i Chemii Jądrowej
2 Własności chemiczne pierwiastków transaktynowych II Letnia Szkoła Energetyki I Chemii Jądrowej Centrum Nauk Biologiczno-Chemicznych UW, Aleksander Bilewicz Instytut Chemii i Techniki Jądrowej
3 Ilość protonów Pierwiastki transfermowe 114 wyspa SHE szczyt Th,U 82 Morze niestabilności Szczyt Pb Cieśnina radioaktywn ości 50 Szczyt Sn 20 Szczyt Ca Morze niestabilności Ilość neutronów
4 Rf Db Sg Bh Hs G.T. Seaborg, W. D. Loveland (1990)
5 2013 Transaktynowce >103 Transfermowce > 100 Superciężkie > 103
6
7 Dlaczego badamy pierwiastki superciężkie Ile pierwiastków może istnieć? ograniczenia fizyczne i chemiczne Trwałość jądra atomowego Jak efekty relatywistyczne mogą wpływać na własności chemiczne pierwiastków Budowa układu okresowego
8 V r Z 137,035 c orbital 1s m m 1 0 v c 2 <r 1s >rel/<r 1s > a 0 4π me ,9 0,8 V r Z c 137,035 0,7 0,6 0,5 0, Z
9 Sg Z=106 V 1s =0,77 c m= 1,58 m 0 r = 0,63 r 0
10 Stabilizacja orbitali s i p 1/2 Ekspansja orbitali d, f Rozszczepienie orbitali p, d, f,
11
12 Konsekwencje chemiczne efektu relatywistycznego - Zmiana konfiguracji stanu podstawowego - Zmiana energii jonizacji - Zmiana promienia atomowego i jonowego - Zmiana dostępności orbitali atomowych do tworzenia orbitali molekularnych - Zmiana energii wiązań w cząsteczkach
13 Efekty relatywistyczne w chemii Szlachetne złoto [Xe]5d 10 6s 1 Ciekła rtęć [Xe]5d 10 6s 2 Żółty kolor złota i cezu Anion Au - Niskie stopnie utlenienia Tl +, [Xe]5d 10 6s 2 6p 1/2 Pb 2+, [Xe]5d 10 6s 2 6p 2 1/2 Bi +, [Xe]5d 10 6s 2 6p 2 1/26p 3/2 Po 2+ [Xe]5d 10 6s 2 6p 2 1/26p 2 3/2
14 Najcięższe aktynowce Promienie jonowe Ak Ac 110 rj (pm) La Ce Pa U Pr Nd Np Pm Pu Sm Am Cm Bk Cf Eu Gd Tb Es Fm Md Ln3+ Ak Dy Ho Er Tm Yb Lr Lu 80 Ak 3+ - [Rn]5f n W grupie aktynowców podobnie jak w grupie lantanowców występuje kontrakcja promienia
15 Pierwiastek 101, Mendelew (Md) izotop T 1/2 rozpad Produkt rozpadu 257 Fm 257 Md 5.52 h α 253 Es SF Md 51,5 d ε 258 Fm SF - α 256 Es 260 Md 31,8 d ε 260 Fm β 260 No Md [Rn] 5f 13 7s 2 Md 3+, Md 2+, Md +? 253 Es (a,2n) 255 Md
16 Pierwiastek 102, nobel (No) Błędna identyfikacja przez instytut noblowski Md [Rn] 5f 14 7s 2 Izotopy nobelu 253 No 1.62 min 254 No 51 s 255 No 3.1 min 257 No 25 s 259 No 58 min
17 248 Cm( 18 O,α,3n) 259 No No [Rn] 5f 14 7s 2 No 2+, No 3+ No 2+, Yb 3+, Lu 3+ Er 3+, Ho 3+ No 2+ No 3+ kryptomelan
18 events events No 2+ 1 Sr Lu Yb Er Y, Ho 0 C T 0,8 1,2 1,6 2 2,4 2,8 3,2 3,6 Kd No Fm E/keV logk d Fm-254 No-259 0,8 Am 0,7 Eu 0,6 0,5 0,4 Y Er Tm 0,3 Yb 0,2 Lu R² = 0,9914 0,1 0 0,01 0,0105 0,011 0,0115 0,012 r j = 89,4 ±0.7 pm r -1 ( pm -1 )
19 Pierwiastek 103, lorens (Lr) Lr - [Rn] 5f 14 6d 1 7s 2 rel. Lr - [Rn] 5f 14 7s 2 7p 1/2 Lu - [Xe] 4f 14 5d 1 6s 2 Tl - [Xe] 4f 14 5d 10 6s 2 6p Lr + (Tl + ) r i = 200 pm Większa lotność atomów Lr, gdyż dla Lu temperatura topnienia wynosi 1655 o C a temperatura wrzenia o C, podczas gdy dla Tl odpowiednio 303 o C i 1460 o C. Jednakże dane eksperymentalne uzyskane metodą chromatografii gazowej wykazały, że w warunkach redukujących w temperaturze 1000 o C pary Lr 0 nie adsorbują się ani w kolumnie platynowej, ani w kwarcowej. Wyniki te nie mogły więc rozstrzygnąć, czy lorens ma charakter pierwiastka p czy d elektronowego.
20
21 Ununoctium 294 Uuo 89 ms 117 Ununseptium 294 Uus 78 m 116 Livermoore 293 Lv 61 m 115 Ununpentium 288 Uup 173 m 114 Flerow 289m Fl ~1,1 min 113 Ununtrium 286 Uut 19,6 s 112 Kopernik 285m Cn 8.9 min 111 Rentgen 281 Rg 26 sek 110 Darmstadt 281m Ds ~3,7 min 109 Meitner 278 Mt 7,6 s 108 Hass 277m Hs ~12 min 107 Bohr 270 Bh 61 s 106 Seaborg 269 Sg ~2,1 min 105 Dubień 268 Db 29 godz 104 Rutherford 266 Rf ~10 godz 103 Lawrens 262 Lr 3,6 godz
22
23 Techniki badań Techniki podziałowe Ciało stałe gaz Ciecz ciecz Ciecz- cialo stałe
24 Techniki podziałowe Ciało stałe gaz Ciecz ciecz Faza 1 Faza 2 Kd C F1 C F2 = 5 Ciecz - cialo stałe Układ klasyczny Faza 1 Faza K d K d Kd K d 0 K d K d P(1) > P(2) Chemia pojedynczego atomu Kd 5
25 Automatyczny system do mini ekstrakcji SISAK
26 Chromatografia
27 Termochromatografia
28 A R K A A I D A
29 Pierwiastek 104 Rf [Rn] 5f 14 6d 2 7s 2 [Rn] 5f 14 6d 1 7s 2 7p 1 Chromatografia gazowa MCl 4 i MBr 4
30 Izotopy rutherfordu (pierwiastka 104) 261 Rf 78 s α, SF Cm( 18 O,5n) 255 Rf 2.3 s ε?, α, SF Pb( 50 Ti,2n) 262 Rf 2.3 s α, SF Pu( 22 Ne,4n) 259m Rf 2.5 s ε Cf( 13 C,3n) 259 Rf 3.2 s α, SF Cf( 13 C,3n) 257m Rf 4.1 s ε, α, SF Cf( 12 C,4n) 257 Rf 4.7 s ε, α, SF Cf( 12 C,4n) 265 Rf 2.5 min SF Sg(,α) 263 Rf 15 min α, SF Db 264 Rf 1? h α? unknown 267 Rf 1.3 h SF Sg(,α) 268 Rf 6 h? α, SF? 2004? 268 Db e) 266 Rf 10 h? α, SF? 2007? 266 Db e)? [
31 M + O H H Promień jonowy r j Rf 4+ >Hf 4+ > Zr 4+ > Ti 4+ Hydroliza w Grupie 4 Ti>Rf>Zr>Hf
32 MCl 4 (TBP) 2 Ekstrakcja TBP
33 Stałe hydrolizy Grupa 11 Grupa 12 Grupa 13 kation r i, pm pk 1h kation r i, pm pk 1h kation r i, pm pk 1h Cu + Ag + Au Zn 2+ Cd 2+ Hg Ga 3+ In 3+ Tl Grupa 2 kation r i (pm) (CN=8) pk 1h Ca ,22 Sr ,83 Ba ,07 Ra ,07
34
35 Badanie kompleksów fluorkowych Szeglowski i wsp. metoda 3 kolumn jonitowych HF + HCl 4M HCl Ekstrakcja TIOA ZrF6 HfF RfF 2 6 Kation r j (pm) Zr Hf kationit An 3+ anionit RfF 6 2- kationit No 2+, Fm 3+ Es 3+ Rf (79) 261 Rf 257 No 253 Fm 249 Es
36 Adsorption / % Tworzenie kompleksów chlorkowych AIDA Rf, Zr, Hf w HCl Hf (Cm/Gd) Rf (Cm/Gd) Zr (Ge/Gd) Hf (Ge/Gd) HCl concentration / M
37 Pierwiastek 105 Db [Rn] 5f 14 6d 3 7s 2
38 Izotopy dubnia (pierwiastek 105) 262 Db 34 s a 262 Db 27 s a 266 Db 22 min SF 267 Db 1.2 h SF 268 Db 29 h SF ε 270 Db 23 h SF
39 Kompleksy Db 5+ z F - Chromatografia Ekstrakcja
40 Tworzenie kompleksów chlorkowych (układ woda aliquat 336 J.Kratz, Chemistry of Tranactinides
41 243 Am + 48 Ca R Db a Bh a MeV s 276 Mt a MeV 1.03 s a MeV 5.2 s a MeV 0.69 s MeV 125 ms 268 Db SF 205 MeV 23.1 hr
42
43 Pierwiastek 106 Sg 1-2 atomy/dzień Pierwszy człowiek celebrujący swój pierwiastek SgO 2 Cl 2
44 Pierwiastek 107 Bohr Izotermalna chromatografia TcO 3 Cl, ReO 3 Cl i BhO 3 Cl
45 Pierwiastek 108 Hs [Rn] 5f 14 6d 4 7s 2 269,270 Hs Lotność RuO 4 <HsO 4 <OsO 4
46 Izotopy Darmsztadtu (pierwiastek 110) Izotop T 1 / 2 rozpad Odkrycie (rok) Reakcja 267 Ds? 2.8 μs α Bi( 59 Co,n) 269 Ds 179 μs α Pb( 62 Ni,n) 270 Ds 100 μs α, SF Pb( 64 Ni,n) 8 atomów 270m Ds 6.0 ms α, IT Pb( 64 Ni,n) 271 Ds 1.63 ms α Pb( 64 Ni,n) 14 atomów 271m Ds 69 ms α Pb( 64 Ni,n) 273 Ds 170 μs α Pu( 34 S,5n) 277 Ds 5.7 ms α Fl(,2α) 279 Ds 0.18 s α, SF Lv(,3α) 1 atom 281 Ds 11 s SF Fl(,2α) 1 atom 281m Ds? ~3.7 min α Fl(, 2 atomy
47 Pierwiastek Cn 112 eka Hg 112 [Rn] 5f 14 6d 10 7s 2
48 Izotopy Kopernika (pierwiastek 112) Izotop Masa T 1/2 rozpad 277 Cn 277 0,24 ms α do 273 Ds 283 Cn m SF 284 Cn ,3 s 285 Cn m α do 280 Ds α do 281 Ds
49 yield [%] temperature [K] Adsorpcja na powierzchni złota Surface: Gold Hg-192 Hads = -87 kj/mol Rn-219 Hads = -27 kj/mol lenght [cm]
50 Synteza Cn 244 Pu+ 48 Ca 238 U + 48 Ca a a SF a a
51 The element 112,114 experiments (IVO Technique) Beam ( 48 Ca) Window/ Target ( 242,244 Pu) SiO 2 -Filter Ta metal 850 C Teflon capillary Cryo On-line Detector (4p COLD) (32 pairs PIN diodes, one side gold covered) Recoil chamber Beam stop Quartz inlay Quartz column T Hg 112,114? Rn Temperature gradient: 35 C to 180 C Loop Carrier gas He/Ar (70/30) l
52 a 242 Pu( 48 Ca,3n) 287 Fl 283 Cn
53 Rel. yield / detector, % Temperature, C Adsorpcja pierwiastka 112 na powierzchni złota a) gold ice Hg 219 Rn b) gold ice Hg 219 Rn c) gold ice Hg Rn Detector # Pierwiastek 112 jest podobny do Hg, ale bardziej lotny
54 Flerow Fl [Rn]5f 14 6d 10 7s 2 7p 1/2 2
55 Izotopy Flerowa Z(p) N(n) masa atomowa T 1/2 rozpad 285 Fl ms α 286 Fl ms SF (60%) α (40%) 287 Fl ms α 287m Fl 5.5s α 288 Fl s α 289 Fl s α 289m Fl 1.1 min α
56 Otrzymywanie pierwiastka Pu ( 48 Ca, 3n) Pu ( 48 Ca, 3-4n) s MeV s 9.95 MeV s 9.82 MeV s 9.54 MeV s SF s 9.16 MeV 279 Ds 0.2 s SF 281 Ds 11 s SF Yu.Ts. Oganessian et al., 2004
57 Results with element 114 Dubna Pu ( 48 Ca, 3n) Pu ( 48 Ca, 3-4n) Ca during 16 days Ca during 51 days MeV 9.95 MeV 9.81 MeV Det# t: s a 9.53 t: 0.11 s SF 62+n.d. t: 0.10 s SF 108+n.d MeV 279 Ds t: s SF N R =2E-2 N R =1.5E-3 N R =1.1E-2 Det#6 281 Ds t: 3.38 s SF N R =1.8E-3
58 Rel. yield / detector, % Temperature, C (2007/2008) gold -4 C ( ) Z= C -88 C -90 C ( > ) Detector # ice
59
60 Własności chemiczne pierwiastków Eka Tl 113 7s 2 7p 1/2 +1,-1 Eka Pb 114 7s 2 7p 2 1/2 0, +2 Eka Bi 115 7s 2 7p 2 1/27p 3/ Eka Po 116 7s 2 7p 2 1/27p 2 3/2 +2 Eka At 117 7s 2 7p 2 1/27p 3 3/2 +3 Eka Rn 118 7s 2 7p 2 1/27p 4 3/2 +4
61 TASCA TransActinide Separator and Chemistry Apparatus
62 MASHA
63 Identyfikacja chemiczna pierwiatka 115 MASHA Off-line 243 Am n 5a Ca Db IS + MS DbCl 5 Db A = 268 (5 grupa, A = 268) 268 Db
64 Pierwiastki superciężkie w naturze Liczby magiczne N = 2, 8, 20, 28, 50, 82, 126 Z = 2, 8, 20, 28, 50, 82 N 184 Z 114, 120, 128 Sferyczne jądra Pierwiastki 298 Fl, , Eka Pb eka Ra eka Pt
65 296 Hs Ch. Briançon, Yu. Oganessian, et al. Saclay-Dubna report
66 Eksperymenty Destylacja OsO 4 Przewidywane jest SF produktów rozpadu a Eksperyment z 0,5 kg osmu trwa już 625 dni i osiągnięto limit detekcji g/g
67 Dziękuję za uwagę
PIERWIASTKI W UKŁADZIE OKRESOWYM
 PIERWIASTKI W UKŁADZIE OKRESOWYM 1 Układ okresowy Co można odczytać z układu okresowego? - konfigurację elektronową - podział na bloki - podział na grupy i okresy - podział na metale i niemetale - trendy
PIERWIASTKI W UKŁADZIE OKRESOWYM 1 Układ okresowy Co można odczytać z układu okresowego? - konfigurację elektronową - podział na bloki - podział na grupy i okresy - podział na metale i niemetale - trendy
Pierwiastek: Na - Sód Stan skupienia: stały Liczba atomowa: 11
 ***Dane Pierwiastków Chemicznych*** - Układ Okresowy Pierwiastków 2.5.1.FREE Pierwiastek: H - Wodór Liczba atomowa: 1 Masa atomowa: 1.00794 Elektroujemność: 2.1 Gęstość: [g/cm sześcienny]: 0.0899 Temperatura
***Dane Pierwiastków Chemicznych*** - Układ Okresowy Pierwiastków 2.5.1.FREE Pierwiastek: H - Wodór Liczba atomowa: 1 Masa atomowa: 1.00794 Elektroujemność: 2.1 Gęstość: [g/cm sześcienny]: 0.0899 Temperatura
Co to są jądra superciężkie?
 Jądra superciężkie 1. Co to są jądra superciężkie? 2. Metody syntezy jąder superciężkich 3. Odkryte jądra superciężkie 4. Współczesne eksperymenty syntezy j.s. 5. Metody identyfikacji j.s. 6. Przewidywania
Jądra superciężkie 1. Co to są jądra superciężkie? 2. Metody syntezy jąder superciężkich 3. Odkryte jądra superciężkie 4. Współczesne eksperymenty syntezy j.s. 5. Metody identyfikacji j.s. 6. Przewidywania
Układ okresowy. Przewidywania teorii kwantowej
 Przewidywania teorii kwantowej Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
Przewidywania teorii kwantowej Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
dra superci kie 1. Co to s dra superci kie? 2. Metody syntezy j der superci kich 3. Odkryte j dra superci
 Jądra superciężkie 1. Co to są jądra superciężkie? 2. Metody syntezy jąder superciężkich 3. Odkryte jądra superciężkie 4. Współczesne eksperymenty syntezy j.s. 5. Metody identyfikacji j.s. 6. Przewidywania
Jądra superciężkie 1. Co to są jądra superciężkie? 2. Metody syntezy jąder superciężkich 3. Odkryte jądra superciężkie 4. Współczesne eksperymenty syntezy j.s. 5. Metody identyfikacji j.s. 6. Przewidywania
Chemia. Wykłady z podstaw chemii. Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej r Odkrycie fosforu przez Henninga Branda
 Chemia Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
Chemia Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
UKŁAD OKRESOWY PIERWIASTKÓW
 UKŁAD OKRESOWY PIERWIASTKÓW Michał Sędziwój (1566-1636) Alchemik Sędziwój - Jan Matejko Pierwiastki chemiczne p.n.e. Sb Sn Zn Pb Hg S Ag C Au Fe Cu (11)* do XVII w. As (1250 r.) P (1669 r.) (2) XVIII
UKŁAD OKRESOWY PIERWIASTKÓW Michał Sędziwój (1566-1636) Alchemik Sędziwój - Jan Matejko Pierwiastki chemiczne p.n.e. Sb Sn Zn Pb Hg S Ag C Au Fe Cu (11)* do XVII w. As (1250 r.) P (1669 r.) (2) XVIII
Chemia. Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej r Odkrycie fosforu przez Henninga Branda
 Chemia Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
Chemia Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
Wykład 9 Wprowadzenie do krystalochemii
 Wykład 9 Wprowadzenie do krystalochemii 1. Krystalografia a krystalochemia. 2. Prawa krystalochemii 3. Sieć krystaliczna i pozycje atomów 4. Bliskie i dalekie uporządkowanie. 5. Kryształ a cząsteczka.
Wykład 9 Wprowadzenie do krystalochemii 1. Krystalografia a krystalochemia. 2. Prawa krystalochemii 3. Sieć krystaliczna i pozycje atomów 4. Bliskie i dalekie uporządkowanie. 5. Kryształ a cząsteczka.
CHEMIA WARTA POZNANIA
 Materiały do zajęć dokształcających z chemii nieorganicznej i fizycznej Wydział Chemii UAM Poznań 2011 Część I Atom jest najmniejszą częścią pierwiastka chemicznego, która zachowuje jego właściwości chemiczne
Materiały do zajęć dokształcających z chemii nieorganicznej i fizycznej Wydział Chemii UAM Poznań 2011 Część I Atom jest najmniejszą częścią pierwiastka chemicznego, która zachowuje jego właściwości chemiczne
Wykłady z podstaw chemii
 Chemia dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
Chemia dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
Układ okresowy. Przewidywania teorii kwantowej
 Przewidywania teorii kwantowej 1 Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
Przewidywania teorii kwantowej 1 Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
1669 r Odkrycie fosforu przez Henninga Branda. Chemia. dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej
 1669 r Odkrycie fosforu przez Henninga Branda Chemia dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA 5 GAZY 3 TERMOCHEMIA 2 TERMODYNAMIKA 4 RÓWNOWAGA
1669 r Odkrycie fosforu przez Henninga Branda Chemia dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA 5 GAZY 3 TERMOCHEMIA 2 TERMODYNAMIKA 4 RÓWNOWAGA
BUDOWA ATOMU. Pierwiastki chemiczne
 BUDOWA ATOMU Pierwiastki chemiczne p.n.e. Sb Sn n Pb Hg S Ag C Au Fe Cu ()* do XVII w. As (5 r.) P (669 r.) () XVIII w. N Cl Cr Co Y Mn Mo () Ni Pt Te O U H W XIX w. (m.in.) Na Ca Al Si F Cs Ba B Bi I
BUDOWA ATOMU Pierwiastki chemiczne p.n.e. Sb Sn n Pb Hg S Ag C Au Fe Cu ()* do XVII w. As (5 r.) P (669 r.) () XVIII w. N Cl Cr Co Y Mn Mo () Ni Pt Te O U H W XIX w. (m.in.) Na Ca Al Si F Cs Ba B Bi I
XXIII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych. Etap II. Poznań, Zadanie 1. Zadanie 2. Zadanie 3
 XXIII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II Zadanie 1 Poniżej zaprezentowano schemat reakcji, którym ulegają związki manganu. Wszystkie reakcje (poza prażeniem) zachodzą w środowisku
XXIII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II Zadanie 1 Poniżej zaprezentowano schemat reakcji, którym ulegają związki manganu. Wszystkie reakcje (poza prażeniem) zachodzą w środowisku
Struktura elektronowa
 Struktura elektronowa Struktura elektronowa atomów układ okresowy pierwiastków: 1) elektrony w atomie zajmują poziomy energetyczne od dołu, inaczej niż te gołębie (w Australii, ale tam i tak chodzi się
Struktura elektronowa Struktura elektronowa atomów układ okresowy pierwiastków: 1) elektrony w atomie zajmują poziomy energetyczne od dołu, inaczej niż te gołębie (w Australii, ale tam i tak chodzi się
Radionuklidy naturalne
 Radionuklidy naturalne Niektóre pierwiastki promieniotwórcze powstałe w procesie wychwytu ( 40 K) w reakcji n,γ 176 Lu, 187 Re, 87 Rb, 138 La oraz w momencie wybuchu supernowej ( 232 Th, 235,238 U, 244
Radionuklidy naturalne Niektóre pierwiastki promieniotwórcze powstałe w procesie wychwytu ( 40 K) w reakcji n,γ 176 Lu, 187 Re, 87 Rb, 138 La oraz w momencie wybuchu supernowej ( 232 Th, 235,238 U, 244
Poznań, Aktywność 57
 XXIII onkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap finałowy Zadanie 1 Zbudowano układ pomiarowy złożony z licznika Geigera i źródła promieniotwórczego. Przeprowadzono pomiar aktywności (wyrażonej
XXIII onkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap finałowy Zadanie 1 Zbudowano układ pomiarowy złożony z licznika Geigera i źródła promieniotwórczego. Przeprowadzono pomiar aktywności (wyrażonej
Konwersatorium 1. Zagadnienia na konwersatorium
 Konwersatorium 1 Zagadnienia na konwersatorium 1. Omów reguły zapełniania powłok elektronowych. 2. Podaj konfiguracje elektronowe dla atomów Cu, Ag, Au, Pd, Pt, Cr, Mo, W. 3. Wyjaśnij dlaczego występują
Konwersatorium 1 Zagadnienia na konwersatorium 1. Omów reguły zapełniania powłok elektronowych. 2. Podaj konfiguracje elektronowe dla atomów Cu, Ag, Au, Pd, Pt, Cr, Mo, W. 3. Wyjaśnij dlaczego występują
Układ okresowy Przewidywania teorii kwantowej
 Przewiywania teorii kwantowej Chemia kwantowa - oumowanie Czątka w ule Atom wooru Równanie Schroeingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - oumowanie rozwiązanie Czątka w ule Atom wooru Ψn
Przewiywania teorii kwantowej Chemia kwantowa - oumowanie Czątka w ule Atom wooru Równanie Schroeingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - oumowanie rozwiązanie Czątka w ule Atom wooru Ψn
ul. Umultowska 89b, Collegium Chemicum, Poznań tel ; fax
 Wydział Chemii Zakład Chemii Analitycznej Plazma kontra plazma: optyczna spektrometria emisyjna w badaniach środowiska Przemysław Niedzielski ul. Umultowska 89b, Collegium Chemicum, 61-614 Poznań tel.
Wydział Chemii Zakład Chemii Analitycznej Plazma kontra plazma: optyczna spektrometria emisyjna w badaniach środowiska Przemysław Niedzielski ul. Umultowska 89b, Collegium Chemicum, 61-614 Poznań tel.
Chemia. dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej r Odkrycie fosforu przez Henninga Branda
 Chemia dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady Chemia Ogólna i Nieorganiczna Organizacja kursu WYKŁAD Seminarium Cwiczenia Zal. (ECTS
Chemia dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady Chemia Ogólna i Nieorganiczna Organizacja kursu WYKŁAD Seminarium Cwiczenia Zal. (ECTS
Sympozjum SHE 2017 Challenges in the studies of super-heavy nuclei and atoms
 Sympozjum SHE 2017 Challenges in the studies of super-heavy nuclei and atoms Kazimierz Dolny 10-14.09.2017 Organizacja UMCS, NCBJ, UW i ZIBJ-Dubna ZIBJ sponsorowało około 70 uczestników Statystyka - uczestników
Sympozjum SHE 2017 Challenges in the studies of super-heavy nuclei and atoms Kazimierz Dolny 10-14.09.2017 Organizacja UMCS, NCBJ, UW i ZIBJ-Dubna ZIBJ sponsorowało około 70 uczestników Statystyka - uczestników
imię i nazwisko numer w dzienniku klasa
 Test po. części serii Chemia Nowej Ery CHEMIA I grupa imię i nazwisko numer w dzienniku klasa Test składa się z 8 zadań. Czytaj uważnie treść poleceń. W zadaniach. 5., 7.., 3. 7. wybierz poprawną odpowiedź
Test po. części serii Chemia Nowej Ery CHEMIA I grupa imię i nazwisko numer w dzienniku klasa Test składa się z 8 zadań. Czytaj uważnie treść poleceń. W zadaniach. 5., 7.., 3. 7. wybierz poprawną odpowiedź
Chemia nieorganiczna. Copyright 2000 by Harcourt, Inc. All rights reserved.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
Anna Grych Test z budowy atomu i wiązań chemicznych
 Anna Grych Test z budowy atomu i wiązań chemicznych 1. Uzupełnij tabelkę wpisując odpowiednie dane: Nazwa atomu Liczba nukleonów protonów neutronów elektronów X -... 4 2 Y -... 88 138 Z -... 238 92 W -...
Anna Grych Test z budowy atomu i wiązań chemicznych 1. Uzupełnij tabelkę wpisując odpowiednie dane: Nazwa atomu Liczba nukleonów protonów neutronów elektronów X -... 4 2 Y -... 88 138 Z -... 238 92 W -...
Wiązania. w świetle teorii kwantów fenomenologicznie
 Wiązania w świetle teorii kwantów fenomenologicznie Wiązania Teoria kwantowa: zwiększenie gęstości prawdopodobieństwa znalezienia elektronów w przestrzeni pomiędzy atomami c a a c b b Liniowa kombinacja
Wiązania w świetle teorii kwantów fenomenologicznie Wiązania Teoria kwantowa: zwiększenie gęstości prawdopodobieństwa znalezienia elektronów w przestrzeni pomiędzy atomami c a a c b b Liniowa kombinacja
XXIV Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych. Etap finałowy. Poznań, Zadanie 1
 XXIV Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap finałowy Zadanie 1 Związek A to krystaliczne ciało stałe, dobrze rozpuszczalne w wodzie oraz wielu rozpuszczalnikach organicznych. Analiza
XXIV Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap finałowy Zadanie 1 Związek A to krystaliczne ciało stałe, dobrze rozpuszczalne w wodzie oraz wielu rozpuszczalnikach organicznych. Analiza
Chemia nieorganiczna. Pierwiastki. niemetale Be. 27 Co. 28 Ni. 26 Fe. 29 Cu. 45 Rh. 44 Ru. 47 Ag. 46 Pd. 78 Pt. 76 Os.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by Harcourt,
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by Harcourt,
KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW I ETAP SZKOLNY. 19 października 2015
 KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW I ETAP SZKOLNY 19 października 2015 Ważne informacje: 1. Masz 60 minut na rozwiązanie wszystkich zadań. 2. Możesz korzystać z kalkulatora. 3. Pisz długopisem
KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW I ETAP SZKOLNY 19 października 2015 Ważne informacje: 1. Masz 60 minut na rozwiązanie wszystkich zadań. 2. Możesz korzystać z kalkulatora. 3. Pisz długopisem
Inne koncepcje wiązań chemicznych. 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań?
 Inne koncepcje wiązań chemicznych 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie.
Inne koncepcje wiązań chemicznych 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie.
FIZYKA III MEL Fizyka jądrowa i cząstek elementarnych
 FIZYKA III MEL Fizyka jądrowa i cząstek elementarnych Wykład 1 własności jąder atomowych Odkrycie jądra atomowego Rutherford (1911) Ernest Rutherford (1871-1937) R 10 fm 1908 Skala przestrzenna jądro
FIZYKA III MEL Fizyka jądrowa i cząstek elementarnych Wykład 1 własności jąder atomowych Odkrycie jądra atomowego Rutherford (1911) Ernest Rutherford (1871-1937) R 10 fm 1908 Skala przestrzenna jądro
Grupa b. Zadania na ocen celujàcà
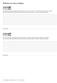 Zadania na ocen celujàcà Grupa a Do reakcji syntezy siarczku glinu przygotowano g glinu i, g siarki. Czy substraty przereagowały w całoêci? JeÊli nie przereagowały, podaj nazw substratu, który nie przereagował
Zadania na ocen celujàcà Grupa a Do reakcji syntezy siarczku glinu przygotowano g glinu i, g siarki. Czy substraty przereagowały w całoêci? JeÊli nie przereagowały, podaj nazw substratu, który nie przereagował
Fragmentacja pocisków
 Wybrane zagadnienia spektroskopii jądrowej 2004 Fragmentacja pocisków Marek Pfützner 823 18 96 pfutzner@mimuw.edu.pl http://zsj.fuw.edu.pl/pfutzner Plan wykładu 1. Wiązki radioaktywne i główne metody ich
Wybrane zagadnienia spektroskopii jądrowej 2004 Fragmentacja pocisków Marek Pfützner 823 18 96 pfutzner@mimuw.edu.pl http://zsj.fuw.edu.pl/pfutzner Plan wykładu 1. Wiązki radioaktywne i główne metody ich
Zadania powtórkowe do egzaminu maturalnego z chemii Budowa atomu, układ okresowy i promieniotwórczość
 strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Budowa atomu, układ okresowy i promieniotwórczość Monika Gałkiewicz Zad. 1 () Przedstaw pełną konfigurację elektronową atomu pierwiastka
strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Budowa atomu, układ okresowy i promieniotwórczość Monika Gałkiewicz Zad. 1 () Przedstaw pełną konfigurację elektronową atomu pierwiastka
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I ... ... czas trwania: 90 min Nazwa szkoły
 V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW II ETAP REJONOWY 18 listopada 015 Ważne informacje: 1. Masz 90 minut na rozwiązanie wszystkich zadań.. Możesz korzystać z kalkulatora.. Pisz długopisem
KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW II ETAP REJONOWY 18 listopada 015 Ważne informacje: 1. Masz 90 minut na rozwiązanie wszystkich zadań.. Możesz korzystać z kalkulatora.. Pisz długopisem
ROZPORZĄDZENIE RADY MINISTRÓW. z dnia 12 lipca 2006 r. w sprawie szczegółowych warunków bezpiecznej pracy ze źródłami promieniowania jonizującego 1)
 Dziennik Ustaw z 2006 r. Nr 140 poz. 994 ROZPORZĄDZENIE RADY MINISTRÓW z dnia 12 lipca 2006 r. w sprawie szczegółowych warunków bezpiecznej pracy ze źródłami promieniowania jonizującego 1) (Dz. U. z dnia
Dziennik Ustaw z 2006 r. Nr 140 poz. 994 ROZPORZĄDZENIE RADY MINISTRÓW z dnia 12 lipca 2006 r. w sprawie szczegółowych warunków bezpiecznej pracy ze źródłami promieniowania jonizującego 1) (Dz. U. z dnia
I. Substancje i ich przemiany
 NaCoBeZU z chemii dla klasy 1 I. Substancje i ich przemiany 1. Pracownia chemiczna podstawowe szkło i sprzęt laboratoryjny. Przepisy BHP i regulamin pracowni chemicznej zaliczam chemię do nauk przyrodniczych
NaCoBeZU z chemii dla klasy 1 I. Substancje i ich przemiany 1. Pracownia chemiczna podstawowe szkło i sprzęt laboratoryjny. Przepisy BHP i regulamin pracowni chemicznej zaliczam chemię do nauk przyrodniczych
Nowa Tablica Układu Okresowego Pierwiastków Chemicznych
 Strona 1 z 5 Nowa Tablica Układu Okresowego Pierwiastków Chemicznych Tablica Klasyczna D. Mendelejew Układ Okresowy a budowa atomu NOWA TABLICA 1-168 zgłoś uwagi str. główna Nowy układ okresowy pierwiastków
Strona 1 z 5 Nowa Tablica Układu Okresowego Pierwiastków Chemicznych Tablica Klasyczna D. Mendelejew Układ Okresowy a budowa atomu NOWA TABLICA 1-168 zgłoś uwagi str. główna Nowy układ okresowy pierwiastków
XVIII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych. Etap II. Poznań, Zadanie 1
 XVIII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II Zadanie 1 dczynnik Fehlinga stosowany jest do wykrywania niektórych cukrów. Składa się on z dwóch roztworów: A i B, przed wykonaniem
XVIII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II Zadanie 1 dczynnik Fehlinga stosowany jest do wykrywania niektórych cukrów. Składa się on z dwóch roztworów: A i B, przed wykonaniem
CHEMIA 1. INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna ATOM.
 INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 1 ATOM Budowa atomu - jądro, zawierające
INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 1 ATOM Budowa atomu - jądro, zawierające
Chemia nieorganiczna. Copyright 2000 by Harcourt, Inc. All rights reserved.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
Teoria VSEPR. Jak przewidywac strukturę cząsteczki?
 Teoria VSEPR Jak przewidywac strukturę cząsteczki? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie. Rozkład elektronów walencyjnych w cząsteczce (struktura Lewisa) stuktura
Teoria VSEPR Jak przewidywac strukturę cząsteczki? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie. Rozkład elektronów walencyjnych w cząsteczce (struktura Lewisa) stuktura
Wstęp do fizyki jądrowej Tomasz Pawlak, 2013
 24-06-2007 Wstęp do fizyki jądrowej Tomasz Pawlak, 2013 część 1 własności jąder (w stanie podstawowym) składniki jąder przekrój czynny masy jąder rozmiary jąder Rutherford (1911) Ernest Rutherford (1871-1937)
24-06-2007 Wstęp do fizyki jądrowej Tomasz Pawlak, 2013 część 1 własności jąder (w stanie podstawowym) składniki jąder przekrój czynny masy jąder rozmiary jąder Rutherford (1911) Ernest Rutherford (1871-1937)
ZAPROSZENIE DO SKŁADANIA OFERT
 Katowice, 17.07.2018 r. ZAPROSZENIE DO SKŁADANIA OFERT Na usługę analizy składu pierwiastkowego finansowanego w ramach projektu Inkubator Innowacyjności+ dofinansowanym ze środków: Ministra Nauki i Szkolnictwa
Katowice, 17.07.2018 r. ZAPROSZENIE DO SKŁADANIA OFERT Na usługę analizy składu pierwiastkowego finansowanego w ramach projektu Inkubator Innowacyjności+ dofinansowanym ze środków: Ministra Nauki i Szkolnictwa
Okresowość właściwości chemicznych pierwiastków. Układ okresowy pierwiastków. 1. Konfiguracje elektronowe pierwiastków
 Układ okresowy pierwiastków Okresowość właściwości chemicznych pierwiastków 1. Konfiguracje elektronowe pierwiastków. Konfiguracje a układ okresowy 3. Budowa układu okresowego 4. Historyczny rozwój układu
Układ okresowy pierwiastków Okresowość właściwości chemicznych pierwiastków 1. Konfiguracje elektronowe pierwiastków. Konfiguracje a układ okresowy 3. Budowa układu okresowego 4. Historyczny rozwój układu
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 31 stycznia 2019 r. zawody II stopnia (rejonowe) Schemat punktowania zadań
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 31 stycznia 2019 r. zawody II stopnia (rejonowe) Maksymalna liczba punktów 40. 85% 34 pkt. Schemat punktowania zadań Uwaga! 1. Wszystkie
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 31 stycznia 2019 r. zawody II stopnia (rejonowe) Maksymalna liczba punktów 40. 85% 34 pkt. Schemat punktowania zadań Uwaga! 1. Wszystkie
Współczesny układ okresowy pierwiastków
 strona 1/6 Współczesny układ okresowy pierwiastków Alina Samotus 1 1 18 1 H 1,008 2 13 14 15 16 17 2 He 4,003 2 3 Li 6,941 4 Be 9,012 5 B 10,81 6 C 12,01 7 N 14,01 8 O 16,00 9 F 19,00 10 Ne 20,18 3 11
strona 1/6 Współczesny układ okresowy pierwiastków Alina Samotus 1 1 18 1 H 1,008 2 13 14 15 16 17 2 He 4,003 2 3 Li 6,941 4 Be 9,012 5 B 10,81 6 C 12,01 7 N 14,01 8 O 16,00 9 F 19,00 10 Ne 20,18 3 11
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
Zadanie 3. (2 pkt) Uzupełnij zapis, podając liczbę masową i atomową produktu przemiany oraz jego symbol chemiczny. Th... + α
 Zadanie: 1 (2 pkt) Określ liczbę atomową pierwiastka powstającego w wyniku rozpadów promieniotwórczych izotopu radu 223 88Ra, w czasie których emitowane są 4 cząstki α i 2 cząstki β. Podaj symbol tego
Zadanie: 1 (2 pkt) Określ liczbę atomową pierwiastka powstającego w wyniku rozpadów promieniotwórczych izotopu radu 223 88Ra, w czasie których emitowane są 4 cząstki α i 2 cząstki β. Podaj symbol tego
Temat 1: Budowa atomu zadania
 Budowa atomu Zadanie 1. (0-1) Dany jest atom sodu Temat 1: Budowa atomu zadania 23 11 Na. Uzupełnij poniższą tabelkę. Liczba masowa Liczba powłok elektronowych Ładunek jądra Liczba nukleonów Zadanie 2.
Budowa atomu Zadanie 1. (0-1) Dany jest atom sodu Temat 1: Budowa atomu zadania 23 11 Na. Uzupełnij poniższą tabelkę. Liczba masowa Liczba powłok elektronowych Ładunek jądra Liczba nukleonów Zadanie 2.
O egzotycznych nuklidach i ich promieniotwórczości
 O egzotycznych nuklidach i ich promieniotwórczości Marek Pfützner Instytut Fizyki Doświadczalnej Uniwersytet Warszawski Tydzień Kultury w VIII LO im. Władysława IV, 13 XII 2005 Instytut Radowy w Paryżu
O egzotycznych nuklidach i ich promieniotwórczości Marek Pfützner Instytut Fizyki Doświadczalnej Uniwersytet Warszawski Tydzień Kultury w VIII LO im. Władysława IV, 13 XII 2005 Instytut Radowy w Paryżu
Wymagania programowe na poszczególne oceny z chemii w kl.1. I. Substancje i ich przemiany
 Wymagania programowe na poszczególne oceny z chemii w kl.1 I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia
Wymagania programowe na poszczególne oceny z chemii w kl.1 I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia
Aktynowce i Transaktynowce
 Chemia nieorganiczna część B Prowadzący: Prof. dr hab. inż. Stanisław Krompiec Aktynowce i Transaktynowce Uniwersytet Śląski, Instytut Chemii Zakład Chemii Nieorganicznej, Metaloorganicznej i Katalizy
Chemia nieorganiczna część B Prowadzący: Prof. dr hab. inż. Stanisław Krompiec Aktynowce i Transaktynowce Uniwersytet Śląski, Instytut Chemii Zakład Chemii Nieorganicznej, Metaloorganicznej i Katalizy
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
Metale przejściowe. Co to sąs. związki zki kompleksowe? Układ okresowy. Pm Sm 20_431
 Metale przejściowe to sąs związki zki kompleksowe? 20_431 Metale przejściowe Układ okresowy Sc Ti V Cr Mn Fe i Cu Zn Y Zr b Mo Tc Ru Rh Pd Ag Cd La Hf Ta W Re Os Ir Pt Au Hg Ac Unq Unp Unh Uns Uno Une
Metale przejściowe to sąs związki zki kompleksowe? 20_431 Metale przejściowe Układ okresowy Sc Ti V Cr Mn Fe i Cu Zn Y Zr b Mo Tc Ru Rh Pd Ag Cd La Hf Ta W Re Os Ir Pt Au Hg Ac Unq Unp Unh Uns Uno Une
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7
 Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Wymagania programowe na poszczególne oceny
 Przedmiot: chemia Klasa: Ia, Ib Nauczyciel: Agata SROKA Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady
Przedmiot: chemia Klasa: Ia, Ib Nauczyciel: Agata SROKA Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 950
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 950 wydany przez POLSKIE CENTRUM AKREDYTACJI 01382 Warszawa, ul. Szczotkarska 42 Wydanie nr 3, Data wydania: 5 maja 2011 r. Nazwa i adres INSTYTUT PODSTAW
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 950 wydany przez POLSKIE CENTRUM AKREDYTACJI 01382 Warszawa, ul. Szczotkarska 42 Wydanie nr 3, Data wydania: 5 maja 2011 r. Nazwa i adres INSTYTUT PODSTAW
Wewnętrzna budowa materii - zadania
 Poniższe zadania rozwiąż na podstawie układu okresowego. Zadanie 1 Oceń poprawność poniższych zdań, wpisując P, gdy zdanie jest prawdziwe oraz F kiedy ono jest fałszywe. Stwierdzenie Atom potasu posiada
Poniższe zadania rozwiąż na podstawie układu okresowego. Zadanie 1 Oceń poprawność poniższych zdań, wpisując P, gdy zdanie jest prawdziwe oraz F kiedy ono jest fałszywe. Stwierdzenie Atom potasu posiada
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA
 Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Poziom podstawowy Odpowiedzi Uwagi Punktacja za czynność za zadanie Zadanie. a) za podanie symbolu
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Poziom podstawowy Odpowiedzi Uwagi Punktacja za czynność za zadanie Zadanie. a) za podanie symbolu
b) Pierwiastek E tworzy tlenek o wzorze EO 2 i wodorek typu EH 4, a elektrony w jego atomie rozmieszczone są na dwóch powłokach elektronowych
 1. Ustal jakich trzech różnych pierwiastków dotyczą podane informacje. Zapisz ich symbole a) W przestrzeni wokółjądrowej dwuujemnego jonu tego pierwiastka znajduje się 18 e. b) Pierwiastek E tworzy tlenek
1. Ustal jakich trzech różnych pierwiastków dotyczą podane informacje. Zapisz ich symbole a) W przestrzeni wokółjądrowej dwuujemnego jonu tego pierwiastka znajduje się 18 e. b) Pierwiastek E tworzy tlenek
Wymagania programowe na poszczególne oceny chemia kl. I
 I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
Budowa atomu. Izotopy
 Budowa atomu. Izotopy Zadanie. atomu lub jonu Fe 3+ atomowa Z 9 masowa A Liczba protonów elektronów neutronów 64 35 35 36 Konfiguracja elektronowa Zadanie 2. Atom pewnego pierwiastka chemicznego o masie
Budowa atomu. Izotopy Zadanie. atomu lub jonu Fe 3+ atomowa Z 9 masowa A Liczba protonów elektronów neutronów 64 35 35 36 Konfiguracja elektronowa Zadanie 2. Atom pewnego pierwiastka chemicznego o masie
BUDOWA ATOMU. Pierwiastki chemiczne
 BUDOWA ATOMU Pierwiastki chemiczne p.n.e. Sb Sn Zn Pb Hg S Ag C Au Fe Cu (11)* do XVII w. As (125 r.) P (1669 r.) (2) XVIII w. N Cl Cr Co Y Mn Mo (14) Ni Pt Te O U H W XIX w. (m.in.) Na Ca Al Si F Cs Ba
BUDOWA ATOMU Pierwiastki chemiczne p.n.e. Sb Sn Zn Pb Hg S Ag C Au Fe Cu (11)* do XVII w. As (125 r.) P (1669 r.) (2) XVIII w. N Cl Cr Co Y Mn Mo (14) Ni Pt Te O U H W XIX w. (m.in.) Na Ca Al Si F Cs Ba
Wymagania edukacyjne na poszczególne śródroczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020
 Wymagania edukacyjne na poszczególne śródroczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 209/2020 Ocenę niedostateczną otrzymuje uczeń, który nie opanował wymagań na ocenę dopuszczającą.
Wymagania edukacyjne na poszczególne śródroczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 209/2020 Ocenę niedostateczną otrzymuje uczeń, który nie opanował wymagań na ocenę dopuszczającą.
Rozdział 1. Nazwa i adres Zamawiającego Gdyński Ośrodek Sportu i Rekreacji jednostka budżetowa Rozdział 2.
 Z n a k s p r a w y G O S i R D Z P I 2 7 1 0 3 62 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A Z a p e w n i e n i e z a s i l a n i ea n e r g e t y c z ne g o
Z n a k s p r a w y G O S i R D Z P I 2 7 1 0 3 62 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A Z a p e w n i e n i e z a s i l a n i ea n e r g e t y c z ne g o
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
Poznań, Oblicz, jakie ilości powyższych składników i ile wody musi zmieszać technolog, aby uzyskać 10 m 3 koncentratu.
 XVII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II Zad. 1 Pewna firma produkuje koncentrat pożywki do uprawy roślin. Wytwarzany produkt zawiera 46 g wapnia, 17 g fosforu, 212 g potasu,
XVII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II Zad. 1 Pewna firma produkuje koncentrat pożywki do uprawy roślin. Wytwarzany produkt zawiera 46 g wapnia, 17 g fosforu, 212 g potasu,
Metale przejściowe. związki zki kompleksowe? Co to sąs. Copyright 2000 by Harcourt, Inc. All rights reserved.
 Metale przejściowe Co to sąs związki zki kompleksowe? 1 1 1 H 3 Li 11 a 19 K 37 Rb 55 Cs 87 Fr 4 Be 12 Mg 20 Ca 38 Sr 56 Ba 88 Ra Układ okresowy 2 13 14 15 16 17 21 Sc 39 Y 57 La 89 Ac 22 Ti 40 Zr 72 Hf
Metale przejściowe Co to sąs związki zki kompleksowe? 1 1 1 H 3 Li 11 a 19 K 37 Rb 55 Cs 87 Fr 4 Be 12 Mg 20 Ca 38 Sr 56 Ba 88 Ra Układ okresowy 2 13 14 15 16 17 21 Sc 39 Y 57 La 89 Ac 22 Ti 40 Zr 72 Hf
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
Dział 1. Rodzaje i przemiany materii
 Dział 1. Rodzaje i przemiany materii podaje przykłady obecności chemii w swoim życiu; wymienia podstawowe narzędzia pracy chemika; zna i stosuje zasady bezpiecznej pracy w pracowni chemicznej; wie, na
Dział 1. Rodzaje i przemiany materii podaje przykłady obecności chemii w swoim życiu; wymienia podstawowe narzędzia pracy chemika; zna i stosuje zasady bezpiecznej pracy w pracowni chemicznej; wie, na
3. Jaka jest masa atomowa pierwiastka E w następujących związkach? Który to pierwiastek? EO o masie cząsteczkowej 28 [u]
![3. Jaka jest masa atomowa pierwiastka E w następujących związkach? Który to pierwiastek? EO o masie cząsteczkowej 28 [u] 3. Jaka jest masa atomowa pierwiastka E w następujących związkach? Który to pierwiastek? EO o masie cząsteczkowej 28 [u]](/thumbs/58/41892324.jpg) 1. Masa cząsteczkowa tlenku dwuwartościowego metalu wynosi 56 [u]. Masa atomowa tlenu wynosi 16 [u]. Ustal jaki to metal i podaj jego nazwę. Napisz wzór sumaryczny tego tlenku. 2. Ile razy masa atomowa
1. Masa cząsteczkowa tlenku dwuwartościowego metalu wynosi 56 [u]. Masa atomowa tlenu wynosi 16 [u]. Ustal jaki to metal i podaj jego nazwę. Napisz wzór sumaryczny tego tlenku. 2. Ile razy masa atomowa
Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany. Ocena dopuszczająca [1]
![Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany. Ocena dopuszczająca [1] Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany. Ocena dopuszczająca [1]](/thumbs/100/147928509.jpg) Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego
Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 274
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 274 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 25 sierpnia 2016 r. Nazwa i adres INSTYTUT
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 274 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 25 sierpnia 2016 r. Nazwa i adres INSTYTUT
Świat chemii cz. 1, rok szkolny 2016/17 Opis założonych osiągnięć ucznia
 Świat chemii cz. 1, rok szkolny 2016/17 Opis założonych osiągnięć ucznia Osiągnięcia podstawowe Rodzaje i przemiany materii wymienia powtarzające się elementy podręcznika i wskazuje rolę, jaką odgrywają;
Świat chemii cz. 1, rok szkolny 2016/17 Opis założonych osiągnięć ucznia Osiągnięcia podstawowe Rodzaje i przemiany materii wymienia powtarzające się elementy podręcznika i wskazuje rolę, jaką odgrywają;
Wymagania techniczne dla pracowni Zasady pracy ze źródłami promieniowania jonizującego
 OCHRONA RADIOLOGICZNA Wymagania techniczne dla pracowni Zasady pracy ze źródłami promieniowania jonizującego Jakub Ośko Na podstawie materiałów Tomasza Pliszczyńskiego Wymagania techniczne i ochrony radiologicznej
OCHRONA RADIOLOGICZNA Wymagania techniczne dla pracowni Zasady pracy ze źródłami promieniowania jonizującego Jakub Ośko Na podstawie materiałów Tomasza Pliszczyńskiego Wymagania techniczne i ochrony radiologicznej
S.A RAPORT ROCZNY Za 2013 rok
 O P E R A T O R T E L E K O M U N I K A C Y J N Y R A P O R T R O C Z N Y Z A 2 0 1 3 R O K Y u r e c o S. A. z s i e d z i b t w O l e ~ n i c y O l e ~ n i c a, 6 m a j a 2 0 14 r. S p i s t r e ~ c
O P E R A T O R T E L E K O M U N I K A C Y J N Y R A P O R T R O C Z N Y Z A 2 0 1 3 R O K Y u r e c o S. A. z s i e d z i b t w O l e ~ n i c y O l e ~ n i c a, 6 m a j a 2 0 14 r. S p i s t r e ~ c
Chemia nieorganiczna. Pierwiastki. niemetale Be. 27 Co. 28 Ni. 26 Fe. 29 Cu. 45 Rh. 44 Ru. 47 Ag. 46 Pd. 78 Pt. 76 Os.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by arcourt,
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by arcourt,
Szanowni Państwo, Spis treści
 Szanowni Państwo, z przyjemnością przekazujemy Państwu broszurę, w której przedstawiamy w skrócie najważniejsze informacje dotyczące zmian w szkołach ponadpodstawowych, wynikających z przeprowadzanej reformy
Szanowni Państwo, z przyjemnością przekazujemy Państwu broszurę, w której przedstawiamy w skrócie najważniejsze informacje dotyczące zmian w szkołach ponadpodstawowych, wynikających z przeprowadzanej reformy
Jądra dalekie od stabilności
 Jądra dalekie od stabilności 1. Model kroplowy jądra atomowego. Ścieżka stabilności b 3. Granice Świata nuklidów 4. Rozpady z emisją ciężkich cząstek naładowanych a) rozpad a b) rozpad protonowy c) rozpad
Jądra dalekie od stabilności 1. Model kroplowy jądra atomowego. Ścieżka stabilności b 3. Granice Świata nuklidów 4. Rozpady z emisją ciężkich cząstek naładowanych a) rozpad a b) rozpad protonowy c) rozpad
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1525
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1525 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 3 Data wydania: 27 maja 2016 r. AB 1525 Nazwa i adres UNIWERSYTET
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1525 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 3 Data wydania: 27 maja 2016 r. AB 1525 Nazwa i adres UNIWERSYTET
Wymagania edukacyjne na poszczególne oceny: I. Substancje i ich przemiany
 Wymagania edukacyjne na poszczególne oceny: I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia jest nauką stosuje
Wymagania edukacyjne na poszczególne oceny: I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia jest nauką stosuje
Wymagania programowe na poszczególne oceny w klasie pierwszej. I. Substancje i ich przemiany
 Wymagania programowe na poszczególne oceny w klasie pierwszej I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
Wymagania programowe na poszczególne oceny w klasie pierwszej I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1525
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1525 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 5 Data wydania: 11 grudnia 2017 r. AB 1525 Kod identyfikacji
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1525 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 5 Data wydania: 11 grudnia 2017 r. AB 1525 Kod identyfikacji
Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek
 strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek Monika Gałkiewicz Zad. 1 () Podaj wzory dwóch dowolnych kationów i dwóch dowolnych anionów posiadających
strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek Monika Gałkiewicz Zad. 1 () Podaj wzory dwóch dowolnych kationów i dwóch dowolnych anionów posiadających
Elektronowa struktura atomu
 Elektronowa struktura atomu Model atomu Bohra oparty na teorii klasycznych oddziaływań elektrostatycznych Elektrony mogą przebywać tylko w określonych stanach, zwanych stacjonarnymi, o określonej energii
Elektronowa struktura atomu Model atomu Bohra oparty na teorii klasycznych oddziaływań elektrostatycznych Elektrony mogą przebywać tylko w określonych stanach, zwanych stacjonarnymi, o określonej energii
BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE.
 BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE. 1. Którą mieszaninę można rozdzielić na składniki poprzez filtrację; A. Wodę z octem. B. Wodę z kredą. C. Piasek z cukrem D. Wodę
BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE. 1. Którą mieszaninę można rozdzielić na składniki poprzez filtrację; A. Wodę z octem. B. Wodę z kredą. C. Piasek z cukrem D. Wodę
Wymagania edukacyjne z chemii dla klasy I oparte na Programie nauczania Chemia Nowej Ery
 Wymagania edukacyjne z chemii dla klasy I oparte na Programie nauczania Chemia Nowej Ery I. Substancje i ich przemiany Poziom wymagań Konieczny Podstawowy Rozszerzający Dopełniający zalicza chemię do nauk
Wymagania edukacyjne z chemii dla klasy I oparte na Programie nauczania Chemia Nowej Ery I. Substancje i ich przemiany Poziom wymagań Konieczny Podstawowy Rozszerzający Dopełniający zalicza chemię do nauk
Wymagania programowe na poszczególne oceny z chemii dla klasy 1 gimnazjum. I. Substancje i ich przemiany
 Wymagania programowe na poszczególne oceny z chemii dla klasy 1 gimnazjum I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia,
Wymagania programowe na poszczególne oceny z chemii dla klasy 1 gimnazjum I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia,
Fizyka współczesna. Jądro atomowe podstawy Odkrycie jądra atomowego: 1911, Rutherford Rozpraszanie cząstek alfa na cienkich warstwach metalu
 Odkrycie jądra atomowego: 9, Rutherford Rozpraszanie cząstek alfa na cienkich warstwach metalu Tor ruchu rozproszonych cząstek (fakt, że część cząstek rozprasza się pod bardzo dużym kątem) wskazuje na
Odkrycie jądra atomowego: 9, Rutherford Rozpraszanie cząstek alfa na cienkich warstwach metalu Tor ruchu rozproszonych cząstek (fakt, że część cząstek rozprasza się pod bardzo dużym kątem) wskazuje na
uczeń opanował wszystkie wymagania podstawowe i ponadpodstawowe
 1 Agnieszka Wróbel nauczyciel biologii i chemii Plan pracy dydaktycznej na chemii w klasach pierwszych w roku szkolnym 2015/2016 Poziom wymagań Ocena Opis wymagań podstawowe niedostateczna uczeń nie opanował
1 Agnieszka Wróbel nauczyciel biologii i chemii Plan pracy dydaktycznej na chemii w klasach pierwszych w roku szkolnym 2015/2016 Poziom wymagań Ocena Opis wymagań podstawowe niedostateczna uczeń nie opanował
Energetyka konwencjonalna odnawialna i jądrowa
 Energetyka konwencjonalna odnawialna i jądrowa Wykład 8-27.XI.2018 Zygmunt Szefliński Środowiskowe Laboratorium Ciężkich Jonów szef@fuw.edu.pl http://www.fuw.edu.pl/~szef/ Wykład 8 Energia atomowa i jądrowa
Energetyka konwencjonalna odnawialna i jądrowa Wykład 8-27.XI.2018 Zygmunt Szefliński Środowiskowe Laboratorium Ciężkich Jonów szef@fuw.edu.pl http://www.fuw.edu.pl/~szef/ Wykład 8 Energia atomowa i jądrowa
Budowa atomu Poziom: rozszerzony Zadanie 1. (2 pkt.)
 Budowa atomu Poziom: rozszerzony Zadanie 1. (2 pkt.) Zadanie 1 2 3 4 5 6 7 8 9 10 Punkty Okres połowiczego rozpadu pewnego radionuklidu wynosi 16 godzin. a) Określ, ile procent atomów tego izotopu rozpadnie
Budowa atomu Poziom: rozszerzony Zadanie 1. (2 pkt.) Zadanie 1 2 3 4 5 6 7 8 9 10 Punkty Okres połowiczego rozpadu pewnego radionuklidu wynosi 16 godzin. a) Określ, ile procent atomów tego izotopu rozpadnie
XXII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych. Etap II. Poznań, Zadanie 1
 XXII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II Zadanie 1 Związki A-I zawierają ołów (na schemacie pominięto produkty nie zawierające tego pierwiastka). Wszystkie reakcje (poza prażeniem)
XXII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II Zadanie 1 Związki A-I zawierają ołów (na schemacie pominięto produkty nie zawierające tego pierwiastka). Wszystkie reakcje (poza prażeniem)
Związki kompleksowe pigmenty i barwniki co to są związki kompleksowe? jaka jest ich budowa? skąd się bierze kolor?
 pigmenty i barwniki co to są związki kompleksowe? jaka jest ich budowa? skąd się bierze kolor? 1 1 1 H 3 Li 11 Na 19 K 37 Rb 55 Cs 87 Fr 4 Be 12 Mg 20 Ca 38 Sr 56 Ba 88 Ra Układ okresowy 2 13 14 15 16
pigmenty i barwniki co to są związki kompleksowe? jaka jest ich budowa? skąd się bierze kolor? 1 1 1 H 3 Li 11 Na 19 K 37 Rb 55 Cs 87 Fr 4 Be 12 Mg 20 Ca 38 Sr 56 Ba 88 Ra Układ okresowy 2 13 14 15 16
Związki kompleksowe. pigmenty i barwniki. co to są związki kompleksowe? jaka jest ich budowa? skąd się bierze kolor? Pierwiastki
 pigmenty i barwniki co to są związki kompleksowe? jaka jest ich budowa? skąd się bierze kolor? 1 07_117 Układ okresowy Pierwiastki 1 1 H 3 Li 11 Na 19 K 37 Rb 55 Cs 87 Fr metale niemetale 2 13 14 15 16
pigmenty i barwniki co to są związki kompleksowe? jaka jest ich budowa? skąd się bierze kolor? 1 07_117 Układ okresowy Pierwiastki 1 1 H 3 Li 11 Na 19 K 37 Rb 55 Cs 87 Fr metale niemetale 2 13 14 15 16
