Kultura i fuzja protoplastów ziemniaka
|
|
|
- Władysław Skiba
- 8 lat temu
- Przeglądów:
Transkrypt
1 Kultura i fuzja protoplastów ziemniaka 187 Kultura i fuzja protoplastów ziemniaka TOMASZ KOMOŃ* Instytut Hodowli i Aklimatyzacji Roślin Oddział Naukowy w Młochowie ul. Platanowa Młochów *autor, do którego należy kierować korespondencję: tel.: , faks , tomek.komon@wp.pl S t r e s z c z e n i e Protoplasty roślinne są szeroko wykorzystywane w badaniach funkcjonowania i organizacji komórek oraz genomów, transgenezy czy biosyntezy ważnych związków organicznych. W specjalnie stworzonych i kontrolowanych warunkach protoplasty wykazują zdolność do łączenia się (fuzji, inaczej hybrydyzacji), prowadzącej do powstania mieszańców somatycznych. W otrzymanych fuzantach występują nowe kombinacje genów jądrowych, cytoplazmatycznych czy jądrowo-cytoplazmatycznych ważnych pod względem poznawczym i aplikacyjnym. Ziemniak jest jedną z roślin uprawnych, w których hybrydyzacja somatyczna jest stosunkowo szeroko stosowana w pracach badawczych i hodowlanych. W niniejszej pracy przedstawiono najważniejsze zagadnienia związane z metodami otrzymywania protoplastów i mieszańców somatycznych ziemniaka oraz wybrane aspekty ich zastosowania we współczesnej hodowli. Słowa kluczowe: protoplasty, fuzja protoplastów, mieszańce somatyczne, ziemniak WSTĘP Protoplasty roślinne są to pozbawione ściany komórkowej żywe komórki wraz z całą zawartością otoczone plazmolemą. Początki zastosowania protoplastów w badaniach biologicznych datują się na lata 70. ubiegłego wieku, kiedy to skutecznie udało się je wyizolować w wielu gatunkach roślin i utrzymywać w kulturach in vitro [1]. Każdy protoplast jest potencjalnie zdolny do odtworzenia nowej ściany komórkowej oraz rozpoczęcia podziałów mitotycznych, a w efekcie końcowym do re- Vol. 54 No
2 T. Komoń 188 generacji w funkcjonalną i płodną roślinę. Dzięki tym właściwościom protoplasty stały się ważnym narzędziem badań struktury i funkcjonowania komórki oraz genomu roślin. Obecnie protoplasty wykorzystuje się rutynowo w laboratoriach na całym świecie w pracach z zakresu genomiki, proteomiki, metabolomiki, a także w nowoczesnej hodowli roślin uprawnych [2]. Ziemniak (Solanum tuberosum L.) pochodzi z Ameryki Południowej. Stamtąd upowszechnił się na całej kuli ziemskiej i obecnie uprawiany jest w ponad 125 krajach na świecie. Ziemniak jest zdrowym pokarmem zawierającym skrobię, pełnowartościowe białka, witaminę C, witaminy z grupy B oraz wiele niezbędnych składników mineralnych. Ocenia się, że ziemniak stanowi podstawę diety ponad miliarda ludzi na całym świecie, a odsetek jego konsumentów wciąż rośnie, szczególnie w Azji (Chiny, Indie) oraz Afryce. Skrobia znajduje zastosowanie w produkcji dekstryn, hydrolizatów, syropów, glukozy oraz krochmalu modyfikowanego. Wraz z etanolem są obecnie dwoma najważniejszymi produktami przetwarzania ziemniaka stosowanymi w przemyśle spożywczym, papierniczym, włókienniczym, farmaceutycznym, kosmetycznym i chemicznym. Etanol jest również wykorzystywany jako dodatek do paliw [3]. Znaczenie gospodarcze ziemniaka ma wpływ na zainteresowanie nim przedstawicieli różnych dyscyplin naukowych, w tym szczególnie szeroko rozumianej biotechnologii. Zastosowanie technik molekularnych pozwoliło lepiej zrozumieć i poznać strukturę i funkcjonowanie komórki oraz genomu ziemniaka. Biotechnologia umożliwiła również postęp we wprowadzaniu interesujących genów z różnych gatunków w ogólną pulę genową S. tuberosum. Ziemniak był jedną z pierwszych roślin uprawnych, w której z powodzeniem wprowadzono do badań protoplasty. Protoplasty i ich hybrydyzacja pozwoliły na wykorzystanie w hodowli S. tuberosum zasobów genowych dzikich gatunków z rodzaju Solanum, spokrewnionych z ziemniakiem uprawnym, ale się z nim nie krzyżujących, z pominięciem naturalnych barier krzyżowalności [4]. IZOLACJA PROTOPLASTÓW Na początkowym etapie rozwoju kultur in vitro stosowano mechaniczną izolację protoplastów, polegającą na plazmolizie tkanki, a następnie na rozdrabnianiu jej skalpelem lub igłą preparacyjną pod mikroskopem. Obecnie technika ta praktycznie nie jest stosowana, ponieważ jest mało wydajna i powoduje liczne uszkodzenia komórek [5]. Mechaniczna izolacja protoplastów zastąpiona została metodą enzymatyczną, którą opracował Cocking [6], i która z małymi modyfikacjami, zależnymi od badanego gatunku rośliny, stosowana jest do dziś. Polega ona na wytrawieniu odpowiednimi enzymami ściany komórkowej bez naruszenia plazmolemy oraz cytoplazmy i jej zawartości. Cały proces enzymatycznej izolacji protoplastów odbywa się w kolejno następujących po sobie etapach: (i) przygotowania roślin rodzicielskich, (ii) przygotowania tkanki roślinnej, (iii) trawienia en-
3 Kultura i fuzja protoplastów ziemniaka zymatycznego, (iv) właściwej izolacji oraz (v) określenia żywotności otrzymanych protoplastów. Materiał wyjściowy do izolacji protoplastów stanowią aseptyczne rośliny wyprowadzone z kultur in vitro [7]. Protoplasty można również izolować z roślin rosnących w szklarni lub w polu. Jednak nie jest to wskazane, ponieważ zmienne czynniki zewnętrzne oraz sterylizacja roślin silnie obniżają jakość otrzymywanych z nich protoplastów [8]. Protoplasty ziemniaka są najczęściej izolowane z mezofilu liści, rzadziej natomiast z hypokotyli, liścieni, siewek, zielonych części pędów, korzeni lub z zawiesiny komórkowej [9,10]. Przygotowanie tkanki roślinnej do izolacji protoplastów polega na stabilizacji komórek w procesach plazmolizy oraz na eliminacji skrobi syntetyzowanej w warunkach świetlnych. W tym celu stosowane są następujące metody: (i) dwudniowa inkubacja liści w roztworach flotujących i kondycjonujących w warunkach ciemności [11], (ii) pozostawienie całych roślin w ciemności na 1 2 doby, a następnie dwu- lub trzygodzinna inkubacja tkanki w roztworze plazmolizującym [12], (iii) sześciogodzinna inkubacja liści w roztworze prekondycjonującym [13] oraz (iv) trzytygodniowa hodowla roślin in vitro w warunkach obniżonego natężenia światła, obniżonej temperatury i skróconego fotoperiodu [14]. Splazmolizowaną i pozbawioną skrobi tkankę rozdrabnia się, aby ułatwić dostęp enzymów do komórek. Najczęściej stosowaną techniką rozdrabniania tkanki jest krojenie liści na paski szerokości 1-2 mm [15, 16]. Rzadziej, w celu odsłonięcia mezofilu, usuwa się dolną epidermę za pomocą pincety lub pocierania szczoteczką [17]. Następnie tak przygotowaną tkankę roślinną poddaje się trawieniu enzymatycznemu. Trawienie enzymatyczne tkanki roślinnej przebiega w roztworach zawierających enzymy pektynolityczne, tzw. pektynazy (np. Macerosyme, Pectolyase, Macerase), które uwalniają komórki z tkanki oraz enzymy celulolityczne celulazy, hydrolizujące ścianę komórkową (np. Cellulase Onozuka, Driselase, Cellulysin) [18, 19]. Protoplasty ziemniaka izolowano, stosując stężenia enzymów na poziomie 0,05 3%. Stężenie enzymów ustalane jest doświadczalnie i jest wypadkową gatunku rośliny, użytej tkanki, czasu inkubacji (najczęściej do 18 godzin) oraz temperatury inkubacji (22 27 ) [11, 20]. Do roztworu enzymów dodawane są sole mineralne i regulatory ciśnienia osmotycznego, np. sacharoza, glukoza, mannitol lub sorbitol. Wymienione regulatory ciśnienia osmotycznego utrzymują potencjał osmotyczny na poziomie mosm, zapewniając odpowiedni stopień plazmolizy komórek oraz zmniejszając stopień uszkodzeń protoplastów [21]. Wśród soli mineralnych dodawanych do roztworu trawiącego najważniejsze są jony wapnia, które zwiększają stabilność błon komórkowych i podnoszą przeżywalność protoplastów [22]. Stwierdzono, że dodawanie soli amonowych jest niekorzystne, gdyż obniżają one wydajność izolacji protoplastów [23]. W niektórych przypadkach do roztworu enzymatycznego dodaje się albuminę wołową [24]. BSA chroni plazmolemę przed proteazami, jakie mogą występować w gorszej jakości preparatach celulaz i pektynaz. Proteazy, niszcząc białka błonowe, zmniejszają stopień przeżywalności protoplastów. Rola ochronna albuminy polega na współ- 189 Vol. 54 No
4 T. Komoń 190 zawodniczeniu z białkami błonowymi o centra aktywne enzymów proteolitycznych. W celu podwyższenia przeżywalności izolowanych protoplastów można także stosować przeciwutleniacz ditiotreitol, który zmniejsza skutki stresu oksydacyjnego prowadzącego do apoptozy komórek [25]. Oprócz składu mieszaniny trawiącej, niezwykle ważna jest odpowiednia proporcja masy tkanki do objętości roztworu. Zazwyczaj na 1 g świeżej masy stosuje się 10 cm 3 mieszaniny trawiącej. Trawienie prowadzi się w ciemności na szalce Petriego, ze wskazanym łagodnym kołysaniem [26, 27]. Poprawnie przeprowadzone trawienie enzymatyczne pozwala wg różnych autorów uzyskać od 100 tys. do kilku milionów protoplastów z 1 g tkanki [2]. Bezpośrednio po zakończeniu trawienia enzymatycznego następuje izolacja właściwa protoplastów, podczas której żywotne protoplasty oddzielane są od pozostałości niedotrawionej tkanki i uszkodzonych komórek. Pierwszym etapem izolacji właściwej jest sączenie mieszaniny trawiącej przez specjalne sitka o odpowiedniej średnicy oczek ( μm) [28]. Następnie przeprowadza się wirowanie przesączu w roztworze o dużej gęstości (0,3 0,4 M sacharoza, rzadziej mannitol, sorbitol lub Percoll), po którym żywotne i nieuszkodzone komórki unoszą się na powierzchni supernatantu w postaci pierścienia. Uszkodzone, martwe lub posiadające ścianę komórkową protoplasty tworzą osad na dnie probówki lub pozostają w roztworze [1]. Wyizolowane oraz oczyszczone protoplasty umieszcza się w świeżej pożywce do kultury protoplastów. Wyizolowane protoplasty oceniane są w komorze Thoma pod kątem liczby żywych komórek otrzymanych z danej jednostki masy. Żywotność komórek oceniana jest za pomocą barwienia przyżyciowego przy zastosowaniu błękitu Ewansa lub FDA. Błękit Ewansa (roztwór 1% przez 5 min) wybarwia martwe protoplasty z uszkodzonymi błonami, które nie mogą uczestniczyć w aktywnym usuwaniu barwnika z cytoplazmy [29]. Dwuoctan fluoresceiny (roztwór 0,05% przez 5 min) wybarwia protoplasty żywe. Działanie FDA opiera się na aktywności esteraz, które w żywych komórkach odcinają grupy octanowe tego związku, uwalniając fluoresceinę, która świeci żółtozielono w widmie niebieskim mikroskopu fluorescencyjnego [12]. KULTURA PROTOPLASTÓW Wyizolowane żywotne protoplasty przenoszone są na pożywkę. Na pożywce następuje odbudowanie ściany komórkowej, podziały mitotyczne, tworzą się kolonie komórek, a następnie mikrokalusów (protoklonów), zachodzi ich morfogeneza i ostatecznie regeneracja funkcjonalnych roślin. Proces kultury protoplastów podlega działaniu wielu czynników, które mają wpływ na efekt końcowy. Do tych najważniejszych czynników należą: zagęszczenie protoplastów w pożywce, odpowiedni skład pożywki, temperatura, natężenie światła oraz fotoperiod [30].
5 Kultura i fuzja protoplastów ziemniaka Zagęszczenie protoplastów w pożywce jest jednym z ważniejszych czynników wpływających stymulująco na regenerujące komórki. Najlepsze rezultaty regeneracji protoklonów uzyskuje się przy ilości protoplastów/cm 3 pożywki [31, 32]. Liczne są doniesienia o stymulującym wpływie bliskiego sąsiedztwa dzielących się, aktywnych mitotycznie komórek na regenerujące protoplasty. Jest to tzw. kultura niańki. Polega ona na umieszczeniu w jednej pożywce protoplastów i szybko rosnącej kultury tkankowej (najczęściej kalusa), oddzielonych od siebie błoną półprzepuszczalną. Membrana umożliwia przenikanie składników pożywki (zwłaszcza aminokwasów i witamin) z kultury tkankowej do zawiesiny protoplastów, przy jednoczesnym fizycznym rozdzieleniu od siebie wymienionych systemów komórkowych. Odmianą kultury niańki, ale bez stosowania błony półprzepuszczalnej jest tzw. pożywka przystosowawcza, którą wcześniej kondycjonowano w krótkiej hodowli intensywnie rosnącego kalusa [2]. W hodowli protoplastów ziemniaka najczęściej stosowane są pożywki stałe w postaci cienkiej warstwy specjalnej, niskotopliwej agarozy (SeaPlaque Agarose). Protoplasty zatapiane są w całej objętości pożywki stałej na szalkach Petriego. Daje to duże możliwości swobodnego manipulowania zatopionymi protoplastami, pasażowania ich na świeże pożywki, w których prowadzone są następne etapy kultury [33-35]. Uważa się, że zestalenie pożywki jest czynnikiem wpływającym korzystnie na rozwój kultury i zwiększającym udział zregenerowanych protoplastów [36]. Znacznie rzadziej stosowane są media płynne, w których wyizolowane protoplasty zawiesza się w kropli siedzącej na dnie szalki lub kropli wiszącej na wieczku [14]. W pożywce stałej łączonej z płynną protoplasty umieszcza się w medium agarozowym, które następnie w postaci kropli umieszcza się na dnie płytki Petriego i po zestaleniu zalewa pożywką płynną [37]. Kultura in vitro protoplastów ziemniaka, ze względu na ich duże wymagania pokarmowe (zwłaszcza przed regeneracją ściany komórkowej) oparta jest na bogatych pożywkach MS [38], Cul [39], KM [40], B5 [41] oraz SKM [42] (tab. 1). Do pożywek dodawane są najczęściej regulatory wzrostu są: BAP, NAA, kinetyna, GA3, zeatyna, IAA, kwas abscysynowy. Źródłem węgla dla regenerujących protoplastów są sacharoza lub glukoza [30]. 191 Skład pożywek do kultur protoplastów Ta b e l a 1. składniki [mg/l] SKM Cul KM B5 MS H 3 BO 3 3 3,1 3,0 3,0 6,2 KCl KI 0,75 0,41 0,75 0,75 0,83 KH 2 PO KNO NH 4 NO CaCl 2 x 2H 2 O Vol. 54 No
6 T. Komoń 192 CoCl 2 x 6H 2 O 0,0025 0,013 0,025 0,025 0,025 CuSO 4 x 5H 2 O 0,0025 0,013 0,025 0,025 0,025 MgSO 4 x 7H 2 O , MnSO 4 x H 2 O 10 8, ,0 16,9 ZnSO 4 x 7H 2 O 2 4,3 0,02 2,0 8,6 Na 2 MoO 4 x 2H 2 O 0,25 0,13 0,26 0,25 0,26 EDTA NaFe x 2H 2 O 47,3 23,6 47,3 37,0 47,3 NH 4 Cl siarczan adeniny tiamina HCl 2 0,5 1,0 10,0 10 pirydoksyna HCl 0,5 5 0,2 1,0 1 kwas nikotynowy 5 5 1,0 1,0 1 biotyna 0,005 0,05 1,0 - - glicyna kwas foliowy 0,2 0, D-Ca-pantotenian 0,5-1,0 - - kwas p-aminobenzoesowy 0,01-2,0 - - chlorek choliny 0,5-0,4 - - ryboflawina 0,1-1,0 - - kwas askorbinowy 1-0, L-glutamina hydrolizat kazeiny BAP 0, NAA 1 0, kinetyna t-zeatyna GA celobioza D-mannitol glukoza fruktoza inozytol mannoza sacharoza sorbitol ramnoza ryboza ksyloza BSA woda kokosowa [ml/l] agar
7 Kultura i fuzja protoplastów ziemniaka Warunki cieplne, oświetleniowe oraz fotoperiod ustalane są eksperymentalnie odpowiednio do genotypu, odmiany czy gatunku Solanum. Na ogół stosuje się temperaturę około C (dzień) i C (noc), przy fotoperiodzie h/10 8 h dzień/noc i intensywności oświetlenia luksów [43 45]. Wydajność kultury protoplastów określana jest na podstawie oceny wysiewu wyrażającej się stosunkiem liczby komórek ulegających efektywnym podziałom do całkowitej liczby protoplastów znajdujących się w danej pożywce. Właściwie prowadzona kultura protoplastów powinna charakteryzować się wydajnością wysiewu od 20 do 80%. Niższy odsetek regenerujących protoplastów informuje o konieczności optymalizacji warunków prowadzenia hodowli. Całkowity czas zregenerowania protoplastów do w pełni funkcjonalnej rośliny poprzez etap tworzenia się mikrokalusów i organogenezę trwa około 2 miesięcy [46]. 193 FUZJA PROTOPLASTÓW Fuzja somatyczna (hybrydyzacja somatyczna) jest fizycznym procesem spontanicznego łączenia się wyizolowanych komórek. Zjawisko łączenia się ze sobą protoplastów pomimo jego naturalnej spontaniczności jest niezwykle trudne. Przyczyną tych trudności jest ujemny ładunek elektryczny grup fosforanowych błony komórkowej powodujący odpychanie elektrostatyczne protoplastów. Wzajemny kontakt pomiędzy komórkami uniemożliwia także hydrofobowość plazmolemy spowodowana dominującym udziałem kwasów tłuszczowych w jej strukturze [47]. Bariery te pokonano poprzez zastosowanie tzw. fuzogenów, czyli czynników stymulujących fuzję. Fuzogen umożliwia bezpośredni kontakt błon protoplastów, podczas którego następuje ich niszczenie, a następnie odbudowa. W konsekwencji dochodzi do łączenia się cytoplazm komórek wraz z ich zawartością. Ze względu na rodzaj użytego fuzogenu wyróżnia się następujące metody hybrydyzacji somatycznej: (i) chemiczną, (ii) elektrofuzję, (iii) ultradźwiękową oraz (iv) z wykorzystaniem mikromanipulatora [2]. Najszersze zastosowanie w badaniach naukowych znalazły dwie pierwsze metody, pozostałe natomiast wykorzystywane są marginalnie. Fuzogenem chemicznym stosowanym na szeroką skalę jest glikol polietylenowy (PEG polyethylene glycol) o masie cząsteczkowej 6000 Da i stężeniu 25 40% w obecności jonów wapnia. Fuzja chemiczna może się odbywać w skali mikro i makro. W metodzie mikro protoplasty komponentów rodzicielskich łączy się ze sobą i inkubuje w roztworze stymulującym w zagłębieniach płytek titracyjnych lub na szalkach Petriego. W zagłębieniach płytek lub na szalkach dochodzi do fuzji komórek, które potem swobodnie opadają na ich dno. Następnie fuzogen wypłukuje się pożywką do kultury fuzantów [48, 49]. W skali makro hybrydyzacja odbywa się w probówce, a swobodne opadanie komórek, a także płukanie zastąpione jest łagodnym wirowaniem [50, 51]. Vol. 54 No
8 T. Komoń 194 W elektrofuzji do zapoczątkowania łączenia się protoplastów wykorzystywane są impulsy elektryczne działające na mieszaninę protoplastów umieszczoną pomiędzy elektrodami. Hybrydyzacja elektryczna składa się z dwóch etapów. W etapie pierwszym mieszanina protoplastów komponentów rodzicielskich poddawana jest działaniu prądu zmiennego o wysokiej częstotliwości (0,5 4 MHz) i niskim natężeniu ( V/cm). Prąd zmienny prowadzi do tworzenia się sznura łączących się ze sobą protoplastów wzdłuż linii sił pola elektrycznego. W etapie drugim zostaje przyłożony prąd stały ( V/cm) o krótkim impulsie (2 30 μs), jednorazowo lub w postaci szybko następujących po sobie serii impulsów. Efektem działania prądu stałego jest powstawanie w plazmolemie licznych odwracalnych perforacji (mikroporów), umożliwiających łączenie się cytoplazmy sąsiadujących protoplastów [21, 52, 53]. Wynikiem fuzji protoplastów komórek somatycznych jest otrzymanie mieszańców somatycznych. Wyróżniamy kilka typów mieszańców somatycznych. Mieszaniec posiadający kompletne genomy jądrowe obydwu komponentów rodzicielskich jest mieszańcem symetrycznym [44, 48, 52]. Eliminacja podczas fuzji chromosomu (-ów) lub jego fragmentów, albo nawet części jednego z genomów, prowadzi do powstania fuzanta asymetrycznego [53]. Innym typem mieszańca asymetrycznego jest tzw. cybryda lub inaczej mieszaniec cytoplazmatyczny. Cybryda posiada jądro komórkowe jednego rodzica, plastydy oraz mitochondria obydwu komponentów fuzji albo cytoplazmę komponenta innego niż dawca jądra. Mieszaniec cytoplazmatyczny powstaje w wyniku fuzji cytoplastu z karioplastem [2]. Cytoplasty są to protoplasty pozbawione jądra komórkowego w wyniku procesu enukleacji. Jądra komórkowe można niszczyć poprzez traktowanie protoplastów cytochalazyną B i wirowanie w gradiencie [55]. W celu enukleacji często stosuje się także promieniowanie UV, rzadziej γ lub X [56, 57]. Karioplast jest strukturą składającą się z jądra komórkowego otoczonego bardzo cienką warstwą cytoplazmy oraz błoną komórkową. Genom plastydowy i mitochondrialny w karioplastach degradowano poprzez traktowanie komórek jodooctanem lub rodaminą 6G [58]. Produktem procesów enukleacji lub niszczenia plastydów i mitochondriów są również tzw. mikroprotoplasty (fragmenty protoplastów wraz z kilkoma chromosomami otoczonymi fragmentem cytoplazmy) oraz mikroplasty (fragmenty cytoplazmy otoczone plazmolemą bez struktur jądra komórkowego [1]. WERYFIKACJA MIESZAŃCÓW SOMATYCZNYCH Mieszanina pofuzyjna zawiera heterokariony (heterokariocyty), czyli produkty obydwu komponentów fuzji, homokariony (homokariocyty) produkty komponentów rodzicielskich, które uległy tzw. autofuzji oraz protoplasty nie biorące udziału w hybrydyzacji somatycznej, a także komórki zdegenerowane [2]. Wyróżnienie heterokarionów z tak zróżnicowanej mieszaniny produktów hybrydyzacji somatycznej odbywa się za pomocą specjalnych technik. Niezmiernie rzad-
9 Kultura i fuzja protoplastów ziemniaka ko heterokariocyty można odróżnić na podstawie morfologii fuzantów. Jest to możliwe, jeżeli różnice pomiędzy komórkami rodzicielskimi, np. w wielkości czy barwie organelli, są wyraźne [2]. Innym sposobem wstępnej selekcji heterokariocytów jest przyżyciowe barwienie komponentów protoplastów rodzicielskich. Najczęściej stosowanymi barwnikami są FDA (powoduje żółtozielone świecenie w UV) oraz izotiocyjanian rodaminy B (powoduje czerwona fluorescencję). W heterokariocycie w świetle UV mikroskopu fluoroscencyjnego widoczne jest świecenie obydwu barwników [12]. Innym przykładem odróżniania heterokarionów od pozostałych produktów fuzji jest stosowanie specjalnych pożywek selekcyjnych. W metodzie tej wykorzystuje się zróżnicowaną tolerancję roślin na antybiotyki. Gdy każdy rodzic wykazuje tolerancję na inny rodzaj antybiotyku, to fuzanty są tolerancyjne w stosunku obu preparatów biobójczych jednocześnie. Prawidłowy rozwój fuzanta na podłożu z dodatkiem dwóch antybiotyków wskazuje, że powstał z protoplastów obu rodziców. Do selekcji najczęściej stosuje się obecne na rynku antybiotyki: kanamycynę i streptomycynę [47]. W niektórych przypadkach możliwe jest odróżnienie mieszańców na etapie formowania się kalusów, na podstawie obserwowanych różnic w ich morfologii i wigorze [56]. Niektórzy badacze zastosowali do selekcji funkcjonalnych heterokarionów cytometrię przepływową w połączeniu z automatycznym selekcjonowaniem komórek [34]. Metodami tymi dokonuje się wstępnej selekcji heterokarionów mieszańcowych. Ostatecznym potwierdzeniem mieszańcowości otrzymanych fuzantów jest analiza zregenerowanych roślin w porównaniu z formami matecznymi. Do oceny i identyfikacji wyprowadzonych fuzantów wykorzystuje się markery morfologiczne, cytogenetyczne, biochemiczne oraz genetyczne. Analiza morfologiczna mieszańców somatycznych opiera się na porównaniu do form rodzicielskich i opisie np. wyglądu liści, kwiatów, słupków i pręcików, pyłku oraz nasion. Metoda ta stosowana jest od początków doświadczeń nad fuzją somatyczną do dziś, ze względu na jej niski koszt oraz prostotę wykonania [46, 58, 59]. Obecnie ocena fenotypowa jest uzupełnieniem innych technik weryfikowania mieszańcowości fuzantów. Badania cytogenetyczne nie dają jednak odpowiedzi na pytanie, czy zregenerowana roślina jest mieszańcem somatycznym. Służą głównie do oszacowania ploidalności fuzanta [2]. Do najprostszych metod cytogenetycznych umożliwiających szybkie oszacowanie poziomu ploidalności należy liczenie chloroplastów w komórkach przyszparkowych aparatów szparkowych dolnej epidermy liści [7, 46]. Ploidalność określa się także za pomocą liczenia chromosomów w komórkach matafazowych wierzchołków wzrostu korzenia. Utrudnieniem w tej metodzie są małe rozmiary chromosomów ziemniaka [12,33]. W badaniach cytogenetycznych fuzantów ziemniaka dosyć często stosowana jest cytometria przepływowa [44, 60]. Metoda ta pozwala szybko i skutecznie określić liczbę, strukturę chromosomów i poziom ploidalności oraz rozpoznać procesy rekombinacji, segregacji i eliminacji części chromosomów, które mogą zachodzić podczas hybrydyzacji somatycznej. Z innych technik coraz częściej stosowana jest genomowa hybry- 195 Vol. 54 No
10 T. Komoń 196 dyzacja in situ (GISH), która pozwala uwidocznić odpowiednie fragmenty genomu obojga rodziców użytych do fuzji [61]. Markery izoenzymatyczne służą do analizy biochemicznej mieszańców somatycznych. Wykorzystanie tych markerów polega na porównaniu roślin otrzymanych w wyniku fuzji protoplastów z roślinami rodzicielskimi pod względem składu i występowania izoform enzymów. Thieme i in. [24] do oceny mieszańcowości produktów hybrydyzacji protoplastów S. tuberosum z S. pinnatisectum zastosowali peroksydazę. W badaniach innego mieszańca, S. tuberosum (+) S. bulbocastanum użyto 8 enzymów (izomerazy fosfoglukozy, dehydrogenazy 6-fosfoglukanianowej, dehydrogenazy jabłczanowej, kwaśnej fosfatazy, transaminazy glutaminianowej, fosfoglukomutazy, peroksydazy, dehydrogenazy alkoholowej) [62]. W badaniach mieszańców somatycznych ziemniaka również znalazły zastosowanie markery molekularne. Markery RAPD wykorzystano do weryfikacji mieszańcowości fuzantów otrzymanych pomiędzy S. tuberosum i S. bulbocastanum [63] oraz fuzantów S. tuberosum (+) S. pinnatisectum [33]. Oberwald i in. [56] wykorzystał polimorfizm długości fragmentów restrykcyjnych (RFLP) do oceny mieszańcowości form uzyskanych pomiędzy S. tuberosum z dwoma dzikimi gatunkami ziemniaka: S. bulbocastanum i S. circaeifolium ssp. quimense. Markery RAPD i RFLP jednocześnie zastosowano do określenia mieszańcowości fuzantów powstałych z hybrydyzacji S. melongena (+) S. sisymbrifolium [64] oraz form otrzymanych z fuzji protoplastów S. tuberosum i S. bulbocastanum [48]. W badaniach mieszańców somatycznych S.tuberosum (+) S. berthaultii Biadani i in. [65] użyli markerów opartych na polimorfizmie odcinków DNA pomiędzy sekwencjami mikrosatelitarnymi (ISSR, inter simple sequence repeats). Niektórzy autorzy podjęli próbę analizy mieszańców somatycznych za pomocą badań genomów mitochondrialnych oraz plastydowych. Scotti i in. [66] potwierdził otrzymanie fuzantów S. tuberosum (+) S. commersoni na podstawie analizy restrykcyjnej mitochondrialnych genów z regionu rpl5-rpl14, zaś Bastia i in. [45] badał sekwencje DNA chloroplastowego tej samej kombinacji rodzicielskiej. Silnie i często zachodzące procesy eliminacji części materiału genetycznego komórek mieszańcowych podczas i po fuzji mogą powodować, że dany marker może nie wykazywać takiego sprzężenia z daną cechą, które występowało u jednego z rodziców. Dlatego też na ogół do identyfikacji mieszańców somatycznych stosuje się jednocześnie różne markery [24, 32, 44, 67]. WYBRANE ASPEKTY ZASTOSOWANIA MIESZAŃCÓW SOMATYCZNYCH W HO- DOWLI ZIEMNIAKA Pierwsze udane próby izolacji protoplastów z mezofilu liści ziemniaka i regeneracji z nich roślin wykonali Butenko i in. [68] oraz Shepard i Toten [69]. Fuzję protoplastów w obrębie S. tuberosum przeprowadzili Melchers i in. [70], a hybrydyzację somatyczną dzikich gatunków S. etuberosum i S. pinnatisectum z uzyska-
11 Kultura i fuzja protoplastów ziemniaka niem w pełni wykształconych mieszańców przeprowadzili Hermsen i Taylor [71]. Jednym z pierwszych praktycznych zastosowań fuzji protoplastów w hodowli ziemniaka było przeniesienie odporności na herbicyd (atrazynę) z dzikiego gatunku S. nigrum do S. tuberosum przez Bindinga i in. [72]. Intensywne i ciągle prowadzone badania nad dzikimi gatunkami ziemniaka lub spokrewnionymi z nim gatunkami z rodzaju Solanum potwierdzają ich ogromny potencjał jako źródeł nowych alleli cech jakościowych i odpornościowych. Bezpośrednie wykorzystanie zmienności genetycznej dzikich lub odległych gatunków Solanum nie zawsze jest możliwe ze względu na szereg naturalnych barier krzyżowalności. Zastosowanie fuzji somatycznej pozwala na pominięcie niektórych barier i uzyskanie połączeń genomów interesujących nas form rodzicielskich [73]. Rośliny o potwierdzonej mieszańcowości uzyskane w wyniku fuzji protoplastów wnoszą nową zmienność genetyczną, inną jakościowo niż zmienność uzyskiwana za pomocą tradycyjnych metod. Hybrydyzacja somatyczna umożliwia wprowadzenie nowych, interesujących genów z dzikich gatunków Solanum na tło genetyczne S. tuberosum, ale gatunki dzikie są również donorami cech nieprzydatnych lub niepożądanych w hodowli. Ważne jest otrzymanie płodnych mieszańców somatycznych umożliwiających przeprowadzenie krzyżowań wstecznych mieszańca z formą S. tuberosum. Przenoszenie niepożądanych genów z gatunków dzikich uniemożliwia również częściowo zastosowanie fuzji asymetrycznej, w której nastąpiła eliminacja genomów jądrowych lub/i cytoplazmatycznych [30, 74]. Dzikie i uprawne gatunki ziemniaka były głównie wykorzystywane jako źródło odporności na różne patogeny, jak wirusy, bakterie lub grzyby. W wyniku fuzji somatycznej gatunków z rodzaju Solanum z S. tuberosum uzyskano mieszance somatyczne wykazujące ekspresje wprowadzonych genów odporności (tab. 2). Aktualne trendy hodowli na ogół miały wpływ na wybór cech wprowadzanych do S. tuberosum za pomocą hybrydyzacji somatycznej. W mniejszym stopniu zajmowano się przekazywaniem cech jakościowych lub fizjologicznych [2]. W pracach nad mieszańcami somatycznymi ziemniaka komponentami rodzicielskimi były zarówno gatunki wytwarzające bulwy (np. S. tuberosum, S. phureja, S. pinnatisectum, S. bulbocastanum), jak i nie tuberyzujące (np. S. nigrum, S. brevidens) [75]. Jednym z pierwszych dzikich gatunków ziemniaka wykorzystanym na szeroką skalę jako komponent rodzicielski w hybrydyzacji somatycznej był S. brevidens. Fuzjonując protoplasty tego gatunku z protoplastami S. tuberosum, otrzymano mieszańce somatyczne odporne na Pectobacterium carotovora powodującą mokrą zgniliznę bulw, Phytophtora infestans odpowiedzialną za zarazę ziemniaka, wirusy X (PVX potato virus X) i Y (PVY potato virus Y) oraz liściozwoju ziemniaka (PLRV potato leaf roll wirus). Z sukcesem przekazano geny odporności na te patogeny z mieszańców somatycznych do ziemniaka uprawnego w wyniku wstecznych krzyżowań generatywnych [31, 60, 76-78]. 197 Vol. 54 No
12 T. Komoń 198 Ta b e l a 2. Przykłady cech wprowadzonych z dzikich gatunków Solanum do S. tuberosum na drodze fuzji somatycznej mieszaniec somatyczny cecha uzyskana w wyniku fuzji piśmiennictwo S. tuberosum (+) S. brevidens odporność na PLRV [60,76] odporność na PVX, PVY i PLRV [77] odporność na bakterie Erwinia spp. [78] odporność na P. infestans [31] odporność na Erwinia spp. i P. infestans [79] S. tuberosum (+) S. etuberosum odporność na PVY [61] S. tuberosum (+) S. bulbocastanum odporność na P. infestans [48] odporność na nicienie Meloidogyne chitwoodi [62] S. tuberosum (+) S. stenotomum odporność na bakterie Ralstonia solanacearum [80] S.tuberosum (+) S. phureja odporność na bakterie R. solanacearum [67] S.tuberosum (+) S. pinnatisectum odporność na P. infestans [24] odporność na bakterie Erwinia spp. [86] S.tuberosum (+) S. nigrum odporność na P. infestans [59,81] S.tuberosum (+) S. commersoni odporność na bakterie R. solanacearum [82] odporność na Verticillium dahliae [45] S. tuberosum (+) S. verrucosum odporność na PLRV [83] S. tuberosum (+) S. acule odporność na PVX [84] S.tuberosum (+) S. circaeifolium odporność na P. infestans [85] S. melongena (+) S. sisymbrifolium odporność na R. solanacearum oraz V. dahliae [64] S. melongena (+) S. aethiopicum odporność na Fusarium spp. [32] S. tuberosum (+) S. tarnii odporność na PVY i P. infestans [86] Przy wyborze partnerów do fuzji używa się na ogół form diploidalnych, chociaż Szczerbakowa i in. [81] z powodzeniem przeprowadzili hybrydyzację somatyczną protoplastów heksaploidalnego S. nigrum z diploidami S. tuberosum. S. nigrum jest gatunkiem odpornym na P. infestans, sprawcę zarazy ziemniaka. Uzyskano mieszańce, które zawiązywały struktury bulwopodobne, pomimo że S. nigrum jest gatunkiem nietuberyzujacym. Niestety, niestabilność genetyczna oraz niepłodność pyłku były główną przyczyną niepowodzenia krzyżowań generatywnych otrzymanych mieszańców S. nigrum (+) S. tuberosum z formami ziemniaka uprawnego [59]. Badania nad fuzantami nie ograniczają się do testów w warunkach laboratoryjnych in vitro czy szklarniowych. Mieszańce somatyczne ziemniaka charakteryzowano także w rozmnożeniach polowych. Pierwsze doświadczenia polowe z fuzantami S. tuberosum (+) S. brevidens przeprowadzili Austin i in. [87]. Jakuczun i in. [88] stwierdzili, że mieszańce somatyczne dobrze znoszą warunki polowe. Rozmnażane rośliny były bujne, intensywnie kwitły, w większości tuberyzowały, a jakość bulw była bardzo zróżnicowana. Thieme i in. [86] uzyskali mieszańce
13 Kultura i fuzja protoplastów ziemniaka somatyczne S. tuberosum (+) S. tarnii. Mieszańce te charakteryzowały się wysoką odpornością na PVX oraz P. infestans. Poprzez krzyżowania wsteczne fuzantów z odmianą Delikt, autorzy otrzymali potomstwo (BC1), które charakteryzowało się odpornością na wirus X ziemniaka, jednakże odporność na zarazę ziemniaka była już niska. Wybrane mieszańce S. tuberosum (+) S. tarnii oraz ich potomstwo BC1 poddano również ocenom polowym, uzyskując bulwy o dobrej jakości i zadowalającym plonie. Doświadczenia polowe z mieszańcami somatycznymi pozwalają przypuszczać, że wykorzystanie ich w hodowli ziemniaka jest możliwe, chociaż wymaga dalszych prac metodycznych. 199 PODSUMOWANIE Obserwowany w ciągu ostatnich 20 lat znaczny postęp metod pozyskiwania protoplastów ziemniaka, a następnie poddawania ich fuzji, może zostać w przyszłości z powodzeniem wykorzystany do hodowli nowych odmian. Mieszańce somatyczne pozwalają poszerzyć zawężona pulę genową S. tuberosum. Hybrydyzacja somatyczna umożliwia pominięcie barier gatunkowych, których nie można było pokonać w tradycyjnych krzyżowaniach seksualnych. Mieszańce somatyczne są źródłem poznania mechanizmów dziedziczenia oraz poszerzają wiedzę na temat losu materiału genetycznego podczas procesów rekombinacji oraz rearanżacji genomów jądrowych i cytoplazmatycznych. Próby przeniesienia pożądanych cech do S. tuberosum za pomocą hybrydyzacji somatycznej nie zawsze kończą się sukcesem. Niejednokrotnie obserwuje się obniżenie ekspresji wprowadzanego genu w fuzantach w porównaniu z ekspresją tego genu w komponencie rodzicielskiem. Pomimo wielu trudności w procesie otrzymywania mieszańców somatycznych ziemniaka prognozuje się dalszy rozwój prac nad hybrydyzacją protoplastów. Aczkolwiek rozwój ten związany być musi z dalszymi doświadczeniami w zakresie optymalizacji warunków izolacji, kultury i fuzji protoplastów oraz selekcji i regeneracji w pełni funkcjonalnych roślin mieszańcowych. Wykaz stosowanych skrótów: BAP 6-benzyloaminopuryna (6-benzyloaminopurine) BSA albumina wołowa (bovine serum albumine) FDA dwuoctan fluorosceiny (fluorosceine diacetate) GA 3 kwas giberelinowy (gibberellic acid) IAA kwas indolilo-3-octowy (indole-3-acetic acid) ISSR między-mikrostalitarny polimorfizm odcinków DNA (inter-simple sequence repeat) NAA kwas α-naftylooctowy (α-naphthaleneacetic acid) RAPD polimorfizm losowo powielonych fragmentów DNA (random amplified polymorphic DNA) RFLP polimorfizm długości fragmentów restrykcyjnych (restriction fragment length polymorphism) Vol. 54 No
14 T. Komoń 200 PIŚMIENNICTWO 1. Davey MR, Anthony P, Power JB, Lowe KC. Protoplast applications in biotechnology. In: Goodman RM, ed. Encyclopaedia of plant and crop science. New York 2004: Davey MR, Anthony P, Power JB, Lowe KC. Plant protolast: status and biotechnological perspectives. Biotech Adv 2005; 23: Mullins E, Milbourne D, Petti C, Doyle-Prestwich BM, Meade C. Potato in the age of biotechnology. Trends Plant Sci 2006; 11: Rommens CM, Haring MA, Swords K, Davies HV, Belknap WR. The intragenic approach as a new extension to traditional plant breeding. Trends Plant Sci 2001; 12: Binder KA, Wegner LH, Heidecker M, Zimmermann U. Gating of Cl - currents in protoplast from the marine alga Valonia utricularis depends on the transmembrane Cl - gradient and is affected by enzymatic cell wall dagradation. J Membr Biol 2003; 191: Cocking EC. A new method for the isolation of plant protoplasts and vacuoles. Nature 1960; 187: Liu J, Xu X, Den X. Intergeneric somatic hybridization and its application to crop genetic improvement. Plant Cell Tiss Organ Cult 2005; 82: Power JB, Davey MR, Anthony P, Lowe KC. Protoplast culture and regeneration. In: Goodman RM, ed. Encyclopaedia of plant and crop science. New York 2004: Anjum MA. Effect of protolast source and media on growth and regenerability of protoplast-derived calluses of Solanum tuberosum L. Acta Physiol Plant 1998; 20: Dovzhenko A, Dal Bosco C, Meurer J, Koop HU. Efficient regeneration from cotyledon protoplasts in Arabidopsis thaliana. Protoplasma 2003; 222: Szczerbakowa A, Borkowska M, Wielgat B. Plant regeneration from the protoplast of Solanum tuberosum, S. nigrum and S. bulbocastanum. Acta Physiol Plant 2000; 22: Przetakiewicz J, Nadolska-Orczyk A, Kuć D, Orczyk W. Tetraploid somatic hybrids (Solanum tuberosum L.) obtained from diploid breeding lines. Cell Mol Biol Lett 2007; 12: Lillo C. Effects of media components and environmental factors on shoot formation from protoplastderived calli of Solanum tuberosum. Plant Cell Tiss Organ Cult 1989; 19: Briza J, Machova I. Regeneration of plants from leaf mesophyll protoplasts of the tetraploid potato cultivars Xenia and Bintje. Biol Plant 1991; 33: Sun Y, Zhang X, Nie Y, Guo X. Production of fertile somatic hybrids of Gossypium hirsutum + G. bicki and G. hirsutum + G. stockii via protoplast fusion. Plant Cell Tiss Organ Cult 2005; 83: Guo JM, Liu QC, Zhai H, Wang YP. Regenaration of plants from Ipomoea cairica L. protoplasts and production of somatic hybrids between I. cairica L. and sweetpotato, I. batatas (L.) Lam. Plant Cell Tiss Organ Cult 2006; 87: Vasil V, Vasil IK. Isolation and culture of cereal protoplast. Theor Appl Genet 1980; 56: Gumnadi SN, Panada T. Purification annd biochemical properties of microbial pectinases a reviev. Process Biochem 2003; 38: Doi RH, Tamaru Y. Clostridium cellulovorans cellulosome: an enzyme complex with plant cell wall degrading activity. Chem Rec 2001; 1: Trabelsi S, Gargouri-Bouzid R, Pedel F, Nato A, Lakhoua L, Drira N. Somatic hybrids between potato Solanum tuberosum and wild species Solanum vernei exhibit a recombination in the plastome. Plant Cell Tiss Organ Cult 2005; 83: Rokka VM, Tauriainem A, Pietila L, Pehu E. Interspecific somatic hybrids between wild potato Solanum acaule Bitt. and anther-derived dihaploid potato (Solanum tuberosum L.). Plant Cell Rep 1998; 18: Liu QC, Kokubu T, Sato M. Plant regeneration from Ipomoea tirloba L. protoplast. Japan J Breed 1991; 41: Lightbourn GJ, Veilleux RE. Production and evaluation of somatic hybrids derived from monoploid potato. Amer J Potato Res 2007; 84: Thieme R, Darsow U, Gavrilenko T, Dorokhov D, Tiemann H. Production of somatic hybrids between S. tuberosum L and late blight resistant Mexican wild potato species. Euphytica 1997; 97: Moreira CD, Chase CD, Gmitter FG, Grosser JW. Transmission of organelle genomes in citrus somatic hybrids. Plant Cell Tiss Organ Cult 2000; 61:165-8.
15 Kultura i fuzja protoplastów ziemniaka Vasil V, Vasil IK. Isolation and culture of cereal protoplast. Part 2: Embryogenesis and plantlet formation from protoplasts of Pennisetum americanum. Theor Appl Genet 1980; 56: Sinha A, Wetten AC, Caligari PDS. Optimisation of protoplast production in white lupin. Biol Plant 2003; 47: Mliki A, Jardask R, Reustle GM. Isolation and culture of leaf protoplast from Tunisian grapes. J Int Sci Vigne Vin 2003; 37: Scarano MT, Abbate L, Ferrante S, Lucretti S, Tusa N. ISSR-PCR technique: a useful method for characterizing new allotetraploid somatic hybrids of mandarin. Plant Cell Rep 2002; 20: Orczyk W, Przetakiewicz J, Nadolska-Orczyk A. Somatic hybrids of Solanum tuberosum application to genetics and breeding. Plant Cell Tiss Organ Cult 2003; 74: Rakosy-Tican L, Hornok M, Menczel L. An improved procedure for protoplast microelectrofusion and culture of Nicotiana tabacum intraspecific somatic hybrids: plant regeneration and initial proofs on organelle segregation. Plant Cell Tiss Organ Cult 2001; 67: Rotino GL, Sihachakr D, Rizza F, Vale G, Tacconi MG, Alberti P, Mennella G, Sabatini E, Toppino L, D Alessandro A, Acciarri N. Current status in production and utilization of dihaploids from soamtic hybrids between eggplant (Solanum melongena L.) and its wild relatives. Acta Physiol Plant 2005; 27 (4B): Rokka VM, Xu YS, Kankila A, Kuusela A, Pulli S, Pehu E. Identification of somatic hybrids of dihaploid Solanum tuberosum lines and S. brevidens by species specific RAPD patterns and assessment of disease resistance of the hybrids. Euphytica 1994; 80: Rizza F, Menella G, Collonnier C, Sihachakr D, Kashyap V, Rajam MV, Prestera M, Rotino GL. Androgenic dihaploids from somatic hybrids between Solanum melongena and S. aethiopicum group gilo as a source of resistance to Fusarium oxysporum f. sp. melongenae. Plant Cell Rep 2002; 20: Szczerbakowa A, Bołtowicz D, Lebecka R, Radomski P, Wielgat B. Characterization of the interspecific somatic hybrids Solanum pinnatisectum (+) S. tuberosum H Acta Physiol Plant 2005; 27 (3A): Zhou C, Xia G, Zhi D, Chen Y. Genetic characterization of asymmetric somatic hybrids between Bupleurum scorzonerifolium Willd and Triticum aestivum L.: potential application to the study of the wheat genome. Planta 2006; 223: Pupilli E, Labombarda P, Arcioni S. New mitochondrial genome organization in three interspecific somatic hybrids of Medicago sativa including the parent-specific amplification of substoichiometric mitochondrial DNA units. Theor Appl Genet 2001; 103: Murashige T, Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol Plant 1962; 15: Haberlach GT, Cohen BA, Baer MA, Towill LE, Helgeson JP. Isolation, culture and regeneration of protoplasts from potato several related Solanum species. Plant Sci 1985; 39: Kao KN, Michayluk MR. Nutrient requirements of growth of Vicia hajastana cells and protoplast at very low density in liquid media. Planta 1975; 126: Gamborg OL, Miller R, Ojima K. Nutrient requirements of suspension cultures of soybean root cells. Exp Cell Res 1968; 50: Hunt GJ, Helgeson JP. A medium and simplified procedure for rowing single cells from Solanum species. Plant Sci 1989; 60: Rokka VM, Xu YS, Tanhuanpaa P, Pietila L, Pehu E. Electrofusion of protoplast of anther-derived dihaploids lines of commeriacial potato cultivars. Agric Food Sci 1996; 5: Szczerbakowa A, Bołtowicz D, Wielgat B. Interspecific somatic hybrids Solanum bulbocastanum (+) S. tuberosum H Acta Physiol Plant 2003; 25: Bastia T, Carotenuto N, Basile B, Zoina A, Cardi T. Introduction of novel organelle DNA variation and transfer of resistance to frost and Verticillium wilt in Solanum tuberosum through somatic hybridization with 1EBN S. commersonii. Euphytica 2000; 116: Cardi T. Multivariate analysis of variation among Solanum commersonii (+) S. tuberosum somatic hybrids with different ploidy levels. Euphytica 1998; 99: Binsfeld PC, Schnabi H. Molecular and cytogenetic constitutionof plants obtained via two different somatic hybridization methods. Plant Cell Rep 2002; 21: Helgenson JP, Pohlman JD, Austin S, Haberlach GT, Wielgus SM, Ronis D, Zambolin L, Tooley P, McGrath JM, James RV, Stevenson WR. Somatic hybrids between Solanum bulbocastanum and potato: a new source of resistance to late blight. Theor Appl Genet 1998; 96: Vol. 54 No
16 T. Komoń Fock I, Collonnier C, Lavergne D, Vaniet S, Ambroise A, Luisetti J, Kodja H, Sihachakr D. Evaluation of somatic hybrids of potato with Solanum stenotomum after a long-term in vitro conservation. Plant Physiol Biochem 2007; 45: Bastia T, Scotti N, Cardi T. Organelle DNA analysis of Solanum and Brassica somatic hybrids by PCR with universal primers. Theor Appl Genet 2001; 102: Cheng YJ, Guo WW, Deng XX. Molecular characterization of cytoplasmic and nuclear genomes in phenotypicalli abnormal Valencia orange (Citrus sinensis) + Meiwa kumquat (Fortunella crassifolia) intergeneric somatic hybrids. Plant Cell Rep 2003; 21: Szczebakowa A, Maciejewska U, Pawłowski P, Siekierski JS, Wielgat B. Electrofusion of protoplast from Solanum tuberosum, S. nigrum and S.bulbocastanum. Acta Physiol Plant 2001; 23: Borgato L, Conicella C, Pisani F, Furini A. Production and characterization of arboreous and fertile Solanum melongena + Solanum marginatum somatic hybrid plants. Planta 2007; 226: Deng J, Cui H, Zhi D, Zhou C, Xia G. Analysis of remote asymmetric somatic hybrids between common wheat and Arabidopsis thaliana. Plant Cell Rep 2007; 26: Liu J, Deng X. Regeneration and analysis of citrus interspecific mixoploid hybrid plants from asymmetric somatic hybridization. Euphytica 2002; 125: Oberwalder B, Schilde-Rentschler L, Ruoß B, Wittemann S, Ninnemann H. Asymmetric protoplast fusions between wild species and breeding lines of potato effect of recipients and genome stability. Theor Appl Genet 1998; 97: Xu XY, Hu ZY, Li JF, Liu JH, Deng XX. Assymetric somatic hybridization between UV-irradiated Citrus unshiu and C. sinensis: regeneration and characterization of hybrid shoots. Plant Cell Rep 2007; 26: Rokka VM, Tauriainem A, Pietila L, Pehu E. Interspecific somatic hybrids between wild potato Solanum acaule Bitt. and anther-derived dihaploid potato (Solanum tuberosum L.). Plant Cell Rep 1998; 18: Zimnoch-Guzowska E, Lebecka R, Kryszczuk A, Maciejewska U, Szczerbakowa A, Wielgat B. Resistance to Phytophthora infestans in somatic hybrids of Solanum nigrum L. and diploid potato. Theor Appl Genet 2003; 107: Rokka VM, Valkonen JPT, Pehu E. Production and characterization of haploids dericved from somatic hybrids between Solanum brevidens and S. tuberosum through anther culture. Plant Sci 1995; 112: Gavrilenko T, Thieme R, Heimbach U, Thieme T. Fertile somatic hybrids of Solanum tuberosum (+) dihaploid solanum tuberosum and their backcrossing progenies: relationship of genome dosage with tuber development and resistance to potato wirus Y. Euphytica 2003; 131: Austin S, Pohlman JD, Brown CR, Mojtahedi H, Santo GS, Douches DS, Helgeson JP. Interspecific somatic hybridisation between Solanum tuberosum L. and S. bulbocastanum Dun. as a means of transferring nematode resistance. Am Potato J 1993; 70: Bołtowicz D, Szczerbakowa A, Wielgat B. RAPD analysis of the interspecific somatic hybrids Solanum bulbocastanum (+) S. tuberosum. Cell Mol Biol Lett 2005; 10: Collonnier C, Fock I, Daunay MC, Servaes A, Vedel F, Siljak-Yakovlev S, Souvannavong V, Sihachakr D. Somtic hybrids between Solanum melongena and S. sisymbrifolium, as a useful source of resistance against bacterial and fungal wilts. Plant Sci 2003; 164: Bidani A, Nouri-Ellouz O, Lakhoua L, Sihachakr D, Cheniclet C, Mahjoub A, Drira N, Gargouri-Bouzid R. Interspecific potato somatic hybrids between Solanum berthaultii and Solanum tuberosum L. showed recombinant plastome and improved tolerance to salinity. Plant Cell Tiss Organ Cult 2007; 91: Scotti N, Marechal-Drouard L, Cardi T. The rpl5-rps14 mitochondrial region: a hot spot for DNA rearrangements in Solanum spp. somatic hybrids. Curr Genet 2004; 45: Fock I, Collonnier C, Purwito A, Luisetti J, Souvannavong V, Vedel F, Servaes A, Ambroise A, Kodja H, Ducreux G, Sihachakr D. Resistance to bacterial wilt in somatic hybrids between Solanum tuberosum and Solanum phureja. Plant Sci 2000; 160: Butenko RG, Kuchko AA, Vitenko AA, Avetisiv VA. Preparation and cultivation of isolated protoplast from the mesophyll of leaves of S. tuberosum L. and S. chacoense Bitt. Plant Physiol 1977; 24: Shepard JF, Toten RE. Mesophyll cell protoplasts of potato: isolation, proliferation, and plant regeneration. Plant Physiol 1977; 60: Melchers G, Sacristan MD, Holder AA. Somatic hybrid plants of potato and tomato regenerated from fused protoplasts. Carlsberg Res Comm 1978; 43:
17 Kultura i fuzja protoplastów ziemniaka Hermsen JD, Taylor LM. Successful hybridization of non-tuberous Solarium etuberosum LIND. and tuberbearing S. pinnatisectum DUN. Euphytica 1979; 28: Binding HSM, Jain, JFG, Mordhorst RN Gressel J. Somatic hybridization of an atrazine resistant biotype of Solanum nigrum and S. tuberosum. I. Clonal variation in morphology and in atrazine sensitivity. Theor Appl Genet 1982; 63: Wielgat B, Wasilewska LD. Hybrydyzacja somatyczna pomiędzy dzikimi i uprawnymi gatunkami ziemniaka. Biotechnologia 2001; 2: Rybczyński JJ. Poszerzanie zmienności genetycznej z wykorzystaniem somatycznej hybrydyzacji w obrębie Gramineae. Biotechnologia 2006; 4: Szczerbakowa A. Międzygatunkowe mieszańce somatyczne ziemniaka. Ziemniak Polski 2008; 1: Austin S, Baer MA, Helgeson JP. Transfer of resistance to potato leaf roll virus from Solanum brevidens into Solanum tuberosum by somatic fusion. Plant Sci 1985; 39: Pehu E, Gibson RW, Jones MKG, Kari A. Studies on the genetic basis of resistance to potoato leaf roll virus, potato virus Y and potato virus X in S. brevidens and S. tuberosum. Plant Sci 1990; 69: McGrath JM, Williams CE, Haberlach GT, Wielgus SM, Uchytil TF, Helgeson JP. Introgession and stabilization of Erwinia tuber soft rot resistance into potato after somatic hybridisation of Solanum tuberosum and S. brevidens. Am J Potato Res 2002; 79: Helgeson JP, Haberlach GT, Ehlenfeld MK, Hunt G, Pohlaman JD, Austin S. Sexual progeny of somatic hybrids between potato and Solanum brevidens: potential for use in breeding programs. Am Potato J 1993; 70: Fock I, Collonnier C, Luisetti J, Purwito A, Souvannavong V, Vedel F, Servaes A, Ambroise A, Kodja H, Ducreux G, Sihachakr D. Use of Solanum stenotomum for introduction of resistance to bacterial wilt in somatic hybrids of potato. Plant Physiol Biochem 2001; 39: Szczerbakowa A, Maciejewska U, Zimnoch-Guzowska E, Wielgat B. Somatic hybrids Solanum nigrum (+) S. tuberosum: morphological assessment and verification of hybridity. Plant Cell Rep 2003; 21: Laferriere LT, Heleson JP, Allen C. Fertile Solanum tuberosum + S. commersoni somatic hybrids as sources of resistance to bacterial wilt caused by Ralstonia solanasearum. Theor Appl Genet 1999; 98: Carrasco A, De galarreta JIR, Rico A, Ritter E. Transfer of PLRV resistance from Solanum verrucosum Schlechdt to potato (S. tuberosum L.) by protoplast electrofuzion. Potato Res 2000; 43: Yamada T, Hosaka K, Nakagawa K, Kaide N, Misoo S, Kamijima O. Nuclear genome constitution and other characteristic of somatic hybrids between dihapliod Solanum acaule and tetraploid S. tuberosum. Euphytica 1998; 102: Rokka VM, Laurila J, Tauriainen A, Laakso I, Larkka J, Metzler M, Pietilä L. Glycoalkaloid aglycone accumulations associated with infection by Clavibacter michiganensis ssp. sepedonicus in potato species Solanum acaule and Solanum tuberosum and their interspecific somatic hybrids. Plant Cell Rep 2005; 23: Thieme R, Rakosy-Tican E, gavrilenko T, Antonova O, Schubert J, Nachtigall M, Udo Heimbach U, Thieme T. Novel somatic hybrids (Solanum tuberosum L. + Solanum tarnii) and their fertile BC 1 progenies express extreme resistance to potatovirus Y and late blight. Theor Appl Genet 2008; (online) DOI / s Austin S, Ehlenfeld MK, Baer MA, Helgeson JP. Somatic hybrids produced by protoplast fusion between S. tuberosum and S. brevidens: phenotypic variation under field conditions. Theor Appl Genet 1986; 71: Jakuczun H, Wasilewicz-Flis I, Przetakiewicz J, Orczyk W, Zimnoch-Guzowska E. Wykorzystanie fuzji somatycznej mieszańców diploidalnych Solanum do rozszerzenia puli hodowlanej ziemniaka (Solanum tuberosum). W: Streszczenia. II Polski Kongres Genetyki. Warszawa, września2007: 271. Vol. 54 No
MIĘDZYGATUNKOWE MIESZAŃCE SOMATYCZNE ZIEMNIAKA
 1 Genetyka i hodowla MIĘDZYGATUNKOWE MIESZAŃCE SOMATYCZNE ZIEMNIAKA dr Anna Szczerbakowa Instytut Biochemii i Biofizyki PAN, ul. Pawińskiego 5a, 02-106 Warszawa e-mail: annasz@ibb.waw.pl Współczesne odmiany
1 Genetyka i hodowla MIĘDZYGATUNKOWE MIESZAŃCE SOMATYCZNE ZIEMNIAKA dr Anna Szczerbakowa Instytut Biochemii i Biofizyki PAN, ul. Pawińskiego 5a, 02-106 Warszawa e-mail: annasz@ibb.waw.pl Współczesne odmiany
Roślinne kultury tkankowe in vitro hodowla roślin, części roślin, tkanek lub pojedynczych komórek na sztucznych pożywkach w sterylnych warunkach.
 Roślinne kultury tkankowe in vitro hodowla roślin, części roślin, tkanek lub pojedynczych komórek na sztucznych pożywkach w sterylnych warunkach. TOTIPOTENCJA Zdolności do odtworzenia poszczególnych organów,
Roślinne kultury tkankowe in vitro hodowla roślin, części roślin, tkanek lub pojedynczych komórek na sztucznych pożywkach w sterylnych warunkach. TOTIPOTENCJA Zdolności do odtworzenia poszczególnych organów,
Regeneracja pędów z segmentów hypokotylowych lnianki siewnej Camelina sativa L. w kulturach in vitro
 Tom XX Rośliny Oleiste 1999 Jolanta Zandecka-Dziubak, Tadeusz Łuczkiewicz Akademia Rolnicza w Poznaniu, Katedra Genetyki i Hodowli Roślin Regeneracja pędów z segmentów hypokotylowych lnianki siewnej Camelina
Tom XX Rośliny Oleiste 1999 Jolanta Zandecka-Dziubak, Tadeusz Łuczkiewicz Akademia Rolnicza w Poznaniu, Katedra Genetyki i Hodowli Roślin Regeneracja pędów z segmentów hypokotylowych lnianki siewnej Camelina
Efektywność embriogenezy somatycznej w kulturach in vitro lnianki siewnej (Camelina sativa L.)
 Tom XXI Rośliny Oleiste 2000 Jolanta Zandecka-Dziubak, Tadeusz Łuczkiewicz Akademia Rolnicza w Poznaniu, Katedra Genetyki i Hodowli Roślin Efektywność embriogenezy somatycznej w kulturach in vitro lnianki
Tom XXI Rośliny Oleiste 2000 Jolanta Zandecka-Dziubak, Tadeusz Łuczkiewicz Akademia Rolnicza w Poznaniu, Katedra Genetyki i Hodowli Roślin Efektywność embriogenezy somatycznej w kulturach in vitro lnianki
Licealista w świecie nauki
 Zespół Szkół Ponadgimnazjalnych w Chojnie V EDYCJA PROJEKTU EDUKACYJNEGO Licealista w świecie nauki Uczestnicy projektu: 1. Hanna Babiarz 2. Ilona Brzezińska 3. Wiktoria Bujak 4. Oliwia Gramburg 5. Łucja
Zespół Szkół Ponadgimnazjalnych w Chojnie V EDYCJA PROJEKTU EDUKACYJNEGO Licealista w świecie nauki Uczestnicy projektu: 1. Hanna Babiarz 2. Ilona Brzezińska 3. Wiktoria Bujak 4. Oliwia Gramburg 5. Łucja
Kierownik: dr Aurelia Ślusarkiewicz-Jarzina Wykonawcy: dr Aurelia Ślusarkiewicz-Jarzina, mgr Hanna Pudelska, mgr Jolanta Woźna
 Badania nad zwiększeniem efektywności uzyskiwania haploidów w procesie androgenezy oraz optymalizacja parametrów otrzymywania podwojonych haploidów pszenżyta ozimego i jarego. Nr decyzji MRiRW: HOR hn-801-pb-9/16,
Badania nad zwiększeniem efektywności uzyskiwania haploidów w procesie androgenezy oraz optymalizacja parametrów otrzymywania podwojonych haploidów pszenżyta ozimego i jarego. Nr decyzji MRiRW: HOR hn-801-pb-9/16,
inż. Danuta Sekrecka, mgr inż. Dorota Michałowska IHAR PIB, Pracownia Zasobów Genowych i Kultur in vitro w Boninie
 Ziemniak Polski 2013 nr 2 15 ZASOBY BANKU GENÓW ZIEMNIAKA IN VITRO I ICH WYKORZYSTANIE W PRAKTYCE inż. Danuta Sekrecka, mgr inż. Dorota Michałowska IHAR PIB, Pracownia Zasobów Genowych i Kultur in vitro
Ziemniak Polski 2013 nr 2 15 ZASOBY BANKU GENÓW ZIEMNIAKA IN VITRO I ICH WYKORZYSTANIE W PRAKTYCE inż. Danuta Sekrecka, mgr inż. Dorota Michałowska IHAR PIB, Pracownia Zasobów Genowych i Kultur in vitro
Bariery krzyżowalności w rodzaju Nicotiana i sposoby ich przełamywania. Anna Depta, Teresa Doroszewska
 w rodzaju Nicotiana i sposoby ich przełamywania Anna Depta, Teresa Doroszewska Rodzaj Nicotiana: Należy do rodziny Solaneceae; Nazwa rodzaju pochodzi od francuskiego dyplomaty Jeana Nicota, który w XI
w rodzaju Nicotiana i sposoby ich przełamywania Anna Depta, Teresa Doroszewska Rodzaj Nicotiana: Należy do rodziny Solaneceae; Nazwa rodzaju pochodzi od francuskiego dyplomaty Jeana Nicota, który w XI
Postepy nauk rolniczych
 Postepy nauk rolniczych Advances in Agricultural Sciences 3/2011 Polska Akademia Nauk Wydział Nauk Biologicznych i Rolniczych Kwartalnik nr 347 rok 63 Rada Redakcyjna A. Grzywacz (przewodnicz¹cy), J. Haman,
Postepy nauk rolniczych Advances in Agricultural Sciences 3/2011 Polska Akademia Nauk Wydział Nauk Biologicznych i Rolniczych Kwartalnik nr 347 rok 63 Rada Redakcyjna A. Grzywacz (przewodnicz¹cy), J. Haman,
Metoda bezpośredniego uzyskiwania podwojonych haploidów z mikrospor zarodków rzepaku ozimego (Brassica napus L.)
 Tom XIX Rośliny Oleiste 98 Teresa Cegielska-Taras, Laurencja Szała Instytut Hodowli i Aklimatyzacji Roślin, Zakład Roślin Oleistych w Poznaniu Metoda bezpośredniego uzyskiwania podwojonych haploidów z
Tom XIX Rośliny Oleiste 98 Teresa Cegielska-Taras, Laurencja Szała Instytut Hodowli i Aklimatyzacji Roślin, Zakład Roślin Oleistych w Poznaniu Metoda bezpośredniego uzyskiwania podwojonych haploidów z
Rośliny z probówki. Jak powstają? Alina Trejgell & Agata Stawicka, UMK
 Rośliny z probówki Jak powstają? I. Dojrzałe i niedojrzałe nasiona szarotka (Leontopodium alpinum) II. Inne organy roślin wyka (Vicia sepium) zarodki zygotyczne pąki kwiatowe wilca (Pharbitis nil) korzeń
Rośliny z probówki Jak powstają? I. Dojrzałe i niedojrzałe nasiona szarotka (Leontopodium alpinum) II. Inne organy roślin wyka (Vicia sepium) zarodki zygotyczne pąki kwiatowe wilca (Pharbitis nil) korzeń
ZŁOśONE POCHODZENIE DIPLOIDALNYCH KLONÓW ZIEMNIAKA ŹRÓDŁEM ZMIENNOŚCI GENETYCZNEJ DLA HODOWLI
 ZESZYTY PROBLEMOWE POSTĘPÓW NAUK ROLNICZYCH 007 z. 57: 775-78 ZŁOśONE POCHODZENIE DIPLOIDALNYCH KLONÓW ZIEMNIAKA ŹRÓDŁEM ZMIENNOŚCI GENETYCZNEJ DLA HODOWLI Iwona Wasilewicz-Flis, Henryka Jakuczun, Ewa
ZESZYTY PROBLEMOWE POSTĘPÓW NAUK ROLNICZYCH 007 z. 57: 775-78 ZŁOśONE POCHODZENIE DIPLOIDALNYCH KLONÓW ZIEMNIAKA ŹRÓDŁEM ZMIENNOŚCI GENETYCZNEJ DLA HODOWLI Iwona Wasilewicz-Flis, Henryka Jakuczun, Ewa
Kolekcja podstawowa w banku genów ziemniaka in vitro gromadzenie, utrzymywanie i wykorzystanie. Dorota Michałowska
 Kolekcja podstawowa w banku genów ziemniaka in vitro gromadzenie, utrzymywanie i wykorzystanie Dorota Michałowska W ciągu ostatnich 100 lat na świecie wyginęło ok. 75% odmian roślin użytkowych. Ochrona
Kolekcja podstawowa w banku genów ziemniaka in vitro gromadzenie, utrzymywanie i wykorzystanie Dorota Michałowska W ciągu ostatnich 100 lat na świecie wyginęło ok. 75% odmian roślin użytkowych. Ochrona
Hodowla roślin genetyka stosowana
 Hodowla roślin genetyka stosowana Hodowla roślin jest świadomą działalnością człowieka zmierzającą do wytworzenia nowych, ulepszonych odmian oraz zachowania istniejących odmian na nie zmienionym poziomie.
Hodowla roślin genetyka stosowana Hodowla roślin jest świadomą działalnością człowieka zmierzającą do wytworzenia nowych, ulepszonych odmian oraz zachowania istniejących odmian na nie zmienionym poziomie.
Wpływ kwasu abscysynowego (ABA) na regenerację roślin Camelina Sativa L. w warunkach kultury in vitro
 Tom XXI Rośliny Oleiste 2000 Anna Mielcarek, Jolanta Zandecka-Dziubak, Tadeusz Łuczkiewicz Akademia Rolnicza w Poznaniu, Katedra Genetyki i Hodowli Roślin Wpływ kwasu abscysynowego (ABA) na regenerację
Tom XXI Rośliny Oleiste 2000 Anna Mielcarek, Jolanta Zandecka-Dziubak, Tadeusz Łuczkiewicz Akademia Rolnicza w Poznaniu, Katedra Genetyki i Hodowli Roślin Wpływ kwasu abscysynowego (ABA) na regenerację
gibereliny naturalna : GA 3 (kwas giberelowy)
 gibereliny naturalna : GA 3 (kwas giberelowy) Miejsce wytwarzania: w dojrzewających nasionach, owocach, zielonych częściach rośliny, w wierzchołkach wzrostu pędu, korzeniach i pręcikach. Biosynteza w plastydach
gibereliny naturalna : GA 3 (kwas giberelowy) Miejsce wytwarzania: w dojrzewających nasionach, owocach, zielonych częściach rośliny, w wierzchołkach wzrostu pędu, korzeniach i pręcikach. Biosynteza w plastydach
Bezpośrednia embriogeneza somatyczna
 Bezpośrednia embriogeneza somatyczna Zarodki somatyczne formują się bezpośrednio tylko z tych komórek roślinnych, które są kompetentne już w momencie izolowania z rośliny macierzystej, czyli z proembriogenicznie
Bezpośrednia embriogeneza somatyczna Zarodki somatyczne formują się bezpośrednio tylko z tych komórek roślinnych, które są kompetentne już w momencie izolowania z rośliny macierzystej, czyli z proembriogenicznie
Analiza genetyczna kilku cech ilościowych związanych z regeneracją lnianki siewnej (Camelina sativa L.) w warunkach kultur in vitro
 NR 242 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2006 TADEUSZ ŁUCZKIEWICZ JERZY NAWRACAŁA MAŁGORZATA STRYBE KAROLINA SATKIEWICZ Katedra Genetyki i Hodowli Roślin Akademia Rolnicza im. A. Cieszkowskiego
NR 242 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2006 TADEUSZ ŁUCZKIEWICZ JERZY NAWRACAŁA MAŁGORZATA STRYBE KAROLINA SATKIEWICZ Katedra Genetyki i Hodowli Roślin Akademia Rolnicza im. A. Cieszkowskiego
Regeneracja roślin z niedojrzałych zarodków Camelina sativa L. (lnianka siewna) w kulturach in vitro
 Tom XIX Rośliny Oleiste 1998 Jolanta Zandecka-Dziubak Akademia Rolnicza w Poznaniu, Katedra Genetyki i Hodowli Roślin Regeneracja roślin z niedojrzałych zarodków Camelina sativa L. (lnianka siewna) w kulturach
Tom XIX Rośliny Oleiste 1998 Jolanta Zandecka-Dziubak Akademia Rolnicza w Poznaniu, Katedra Genetyki i Hodowli Roślin Regeneracja roślin z niedojrzałych zarodków Camelina sativa L. (lnianka siewna) w kulturach
Czynniki, od których zależy wynik kultury in vitro:
 Czynniki, od których zależy wynik kultury in vitro: 1. Wewnętrzne (związane bezpośrednio z eksplantatem): genotyp rośliny, dawcy eksplantatu (rodzaj, gatunek, odmiana) rodzaj organu, tkanki oraz jego wielkość
Czynniki, od których zależy wynik kultury in vitro: 1. Wewnętrzne (związane bezpośrednio z eksplantatem): genotyp rośliny, dawcy eksplantatu (rodzaj, gatunek, odmiana) rodzaj organu, tkanki oraz jego wielkość
Zadanie 2.4. Cel badań:
 Zadanie 2.4 Poszerzanie puli genetycznej buraka cukrowego przez doskonalenie procesu gynogenezy oraz podnoszenie odporności na wirus nekrotycznego żółknięcia nerwów i tolerancji na suszę Cel badań: Celem
Zadanie 2.4 Poszerzanie puli genetycznej buraka cukrowego przez doskonalenie procesu gynogenezy oraz podnoszenie odporności na wirus nekrotycznego żółknięcia nerwów i tolerancji na suszę Cel badań: Celem
Zad. 2.2 Poszerzenie puli genetycznej jęczmienia
 Zad. 2.2 Poszerzenie puli genetycznej jęczmienia Sprawozdanie 2016r Kierownik zadania: prof. dr hab. Jerzy H. Czembor (KCRZG) Wykonawcy: dr hab. Paweł Cz. Czembor (ZGiHR) mgr Piotr Słowacki (ZGiHR) mgr
Zad. 2.2 Poszerzenie puli genetycznej jęczmienia Sprawozdanie 2016r Kierownik zadania: prof. dr hab. Jerzy H. Czembor (KCRZG) Wykonawcy: dr hab. Paweł Cz. Czembor (ZGiHR) mgr Piotr Słowacki (ZGiHR) mgr
Mieszańce diploidalne ziemniaka źródłem odporności na raka ziemniaka (Synchytrium endobioticum (Schilb.) Perc.)
 NR 268 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2013 HENRYKA JAKUCZUN 1 JAROSŁAW PRZETAKIEWICZ 2 IWONA WASILEWICZ-FLIS 1 AGNIESZKA HARA-SKRZYPIEC 1 PAULINA SMYDA 1 EWA ZIMNOCH-GUZOWSKA 1 1 Instytut
NR 268 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2013 HENRYKA JAKUCZUN 1 JAROSŁAW PRZETAKIEWICZ 2 IWONA WASILEWICZ-FLIS 1 AGNIESZKA HARA-SKRZYPIEC 1 PAULINA SMYDA 1 EWA ZIMNOCH-GUZOWSKA 1 1 Instytut
Wprowadzenie do hodowli in vitro dowolnej rośliny
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Kultury tkankowe i komórkowe roślin i zwierząt Wprowadzenie do hodowli in vitro dowolnej rośliny WSTĘP Metoda kultury in vitro,
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Kultury tkankowe i komórkowe roślin i zwierząt Wprowadzenie do hodowli in vitro dowolnej rośliny WSTĘP Metoda kultury in vitro,
Celem projektu jest zbadanie mechanizmu aborcji kwiatów i zarodków gryki zwyczajnej pod wpływem stresu termicznego lub troficznego.
 Raport za rok 2018 z projektu NCN 2017/25/B/NZ9/00148 pt. Badanie mechanizmu degeneracji woreczkówzalążkowych i aborcji kwiatów jako przyczyny słabego zawiązywania nasion gryki zwyczajnej(fagopyrum esculentum
Raport za rok 2018 z projektu NCN 2017/25/B/NZ9/00148 pt. Badanie mechanizmu degeneracji woreczkówzalążkowych i aborcji kwiatów jako przyczyny słabego zawiązywania nasion gryki zwyczajnej(fagopyrum esculentum
Spis treści Część I. Genetyczne podstawy hodowli roślin 1. Molekularne podstawy dziedziczenia cech Dariusz Crzebelus, Adeta Adamus, Maria Klein
 Spis treści Część I. Genetyczne podstawy hodowli roślin 1. Molekularne podstawy dziedziczenia cech... 15 Dariusz Crzebelus, Adeta Adamus, Maria Klein 1.1. Budowa DNA i przepływ informacji genetycznej...
Spis treści Część I. Genetyczne podstawy hodowli roślin 1. Molekularne podstawy dziedziczenia cech... 15 Dariusz Crzebelus, Adeta Adamus, Maria Klein 1.1. Budowa DNA i przepływ informacji genetycznej...
WYŻEJ OPISANA CZĘŚĆ DOŚWIADCZENIA JEST PRZYGOTOWANA EOZYNA ŻÓŁTAWA
 ĆWICZENIE 6 Gospodarka wodna Szybkość dyfuzji barwników organicznych w żelatynie Materiał: a/ odczynniki: 20 % roztwór żelatyny, tusz, 1-2 mm roztwory eozyny żółtawej, błękitu metylenowego, oranżu metylowego
ĆWICZENIE 6 Gospodarka wodna Szybkość dyfuzji barwników organicznych w żelatynie Materiał: a/ odczynniki: 20 % roztwór żelatyny, tusz, 1-2 mm roztwory eozyny żółtawej, błękitu metylenowego, oranżu metylowego
Transformacja pośrednia składa się z trzech etapów:
 Transformacja pośrednia składa się z trzech etapów: 1. Otrzymanie pożądanego odcinka DNA z materiału genetycznego dawcy 2. Wprowadzenie obcego DNA do wektora 3. Wprowadzenie wektora, niosącego w sobie
Transformacja pośrednia składa się z trzech etapów: 1. Otrzymanie pożądanego odcinka DNA z materiału genetycznego dawcy 2. Wprowadzenie obcego DNA do wektora 3. Wprowadzenie wektora, niosącego w sobie
Zadanie 2.4. Dr inż. Anna Litwiniec Dr inż. Barbara Skibowska Dr inż. Sandra Cichorz
 Zadanie 2.4 Poszerzanie puli genetycznej buraka cukrowego przez doskonalenie procesu gynogenezy oraz podnoszenie odporności na wirus nekrotycznego żółknięcia nerwów i tolerancji na suszę Dr inż. Anna Litwiniec
Zadanie 2.4 Poszerzanie puli genetycznej buraka cukrowego przez doskonalenie procesu gynogenezy oraz podnoszenie odporności na wirus nekrotycznego żółknięcia nerwów i tolerancji na suszę Dr inż. Anna Litwiniec
Ocena zdolności pylników wybranych odmian lnu oleistego (Linum usitatissimum L.) do tworzenia kalusa
 Tom XXVII ROŚLINY OLEISTE OILSEED CROPS 2006 Karolina Wielgus 1, 2, Grażyna Mańkowska 1 1 Instytut Włókien Naturalnych w Poznaniu, Zakład Biotechnologii i Biologii Molekularnej 2 Akademia Rolnicza im.
Tom XXVII ROŚLINY OLEISTE OILSEED CROPS 2006 Karolina Wielgus 1, 2, Grażyna Mańkowska 1 1 Instytut Włókien Naturalnych w Poznaniu, Zakład Biotechnologii i Biologii Molekularnej 2 Akademia Rolnicza im.
Zastosowanie nowych technologii genotypowania w nowoczesnej hodowli i bankach genów
 Zastosowanie nowych technologii genotypowania w nowoczesnej hodowli i bankach genów Jerzy H. Czembor, Bogusław Łapiński, Aleksandra Pietrusińska, Urszula Piechota Krajowe Centrum Roślinnych Zasobów Genowych
Zastosowanie nowych technologii genotypowania w nowoczesnej hodowli i bankach genów Jerzy H. Czembor, Bogusław Łapiński, Aleksandra Pietrusińska, Urszula Piechota Krajowe Centrum Roślinnych Zasobów Genowych
Dział PP klasa Doświadczenie Dział PP klasa obserwacja
 Wykaz obserwacji i doświadczeń ujętych w podstawie programowej przedmiotu przyroda i biologia Dział PP klasa Doświadczenie Dział PP klasa obserwacja I klasa V na intensywność procesu fotosyntezy I klasa
Wykaz obserwacji i doświadczeń ujętych w podstawie programowej przedmiotu przyroda i biologia Dział PP klasa Doświadczenie Dział PP klasa obserwacja I klasa V na intensywność procesu fotosyntezy I klasa
1. Biotechnologia i inżynieria genetyczna zagadnienia wstępne 13
 Spis treści Przedmowa 11 1. Biotechnologia i inżynieria genetyczna zagadnienia wstępne 13 1.1. Wprowadzenie 13 1.2. Biotechnologia żywności znaczenie gospodarcze i społeczne 13 1.3. Produkty modyfikowane
Spis treści Przedmowa 11 1. Biotechnologia i inżynieria genetyczna zagadnienia wstępne 13 1.1. Wprowadzenie 13 1.2. Biotechnologia żywności znaczenie gospodarcze i społeczne 13 1.3. Produkty modyfikowane
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
Klub Młodego Wynalazcy - Laboratoria i wyposażenie. Pracownia hodowli roślin i roślinnych kultur in vitro
 Klub Młodego Wynalazcy - Laboratoria i wyposażenie Zadbaliśmy o to, żeby wyposażenie w Klubie Młodego Wynalazcy było w pełni profesjonalne. Ważne jest, aby dzieci i młodzież, wykonując doświadczenia korzystały
Klub Młodego Wynalazcy - Laboratoria i wyposażenie Zadbaliśmy o to, żeby wyposażenie w Klubie Młodego Wynalazcy było w pełni profesjonalne. Ważne jest, aby dzieci i młodzież, wykonując doświadczenia korzystały
Księgarnia PWN: Biotechnologia roślin, redakcja naukowa: Stefan Malepszy SPIS TREŚCI
 Księgarnia PWN: Biotechnologia roślin, redakcja naukowa: Stefan Malepszy SPIS TREŚCI 1 Wprowadzenie 15 2 Metoda kultury in vitro 19 2.1. Kultura komórek i tkanek............................... 19 2.1.1.
Księgarnia PWN: Biotechnologia roślin, redakcja naukowa: Stefan Malepszy SPIS TREŚCI 1 Wprowadzenie 15 2 Metoda kultury in vitro 19 2.1. Kultura komórek i tkanek............................... 19 2.1.1.
Fizjologiczne i molekularne markery tolerancji buraka cukrowego na suszę. Dr Danuta Chołuj
 Fizjologiczne i molekularne markery tolerancji buraka cukrowego na suszę Dr Danuta Chołuj Szacunkowe straty plonu buraków cukrowych w Europie na skutek suszy kształtują się pomiędzy 5 a 30 % W jakiej fazie
Fizjologiczne i molekularne markery tolerancji buraka cukrowego na suszę Dr Danuta Chołuj Szacunkowe straty plonu buraków cukrowych w Europie na skutek suszy kształtują się pomiędzy 5 a 30 % W jakiej fazie
DR ŻANETA PACUD Zdolność patentowa roślin
 DR ŻANETA PACUD Zdolność patentowa roślin czyli rzecz o brokułach i pomidorach Sposoby ochrony prawnej roślin wprowadzenie Ochrona prawna odmian roślin - Międzynarodowa konwencja o ochronie nowych odmian
DR ŻANETA PACUD Zdolność patentowa roślin czyli rzecz o brokułach i pomidorach Sposoby ochrony prawnej roślin wprowadzenie Ochrona prawna odmian roślin - Międzynarodowa konwencja o ochronie nowych odmian
Zastosowanie metody RAPD do różnicowania szczepów bakteryjnych
 Zastosowanie metody RAPD do różnicowania szczepów bakteryjnych Wstęp teoretyczny Technika RAPD (ang. Random Amplification of Polymorphic DNA) opiera się na prostej reakcji PCR, przeprowadzanej na genomowym
Zastosowanie metody RAPD do różnicowania szczepów bakteryjnych Wstęp teoretyczny Technika RAPD (ang. Random Amplification of Polymorphic DNA) opiera się na prostej reakcji PCR, przeprowadzanej na genomowym
Charakterystyka izoenzymów aminotransferazy asparaginianowej z siewek pszenicy zwyczajnej (Triticum aestivum L.)
 Charakterystyka izoenzymów aminotransferazy asparaginianowej z siewek pszenicy zwyczajnej (Triticum aestivum L.) Marcin Maciąga & Andrzej Paszkowski Katedra Biochemii, Wydział Rolnictwa i Biologii, SGGW
Charakterystyka izoenzymów aminotransferazy asparaginianowej z siewek pszenicy zwyczajnej (Triticum aestivum L.) Marcin Maciąga & Andrzej Paszkowski Katedra Biochemii, Wydział Rolnictwa i Biologii, SGGW
ZASTOSOWANIE MIKROROZMNAŻANIA W HODOWLI I NASIENNICTWIE ZIEMNIAKA
 8 ZASTOSOWANIE MIKROROZMNAŻANIA W HODOWLI I NASIENNICTWIE ZIEMNIAKA mgr Rajmund Bruski Hodowla Roślin w Szyldaku Spółka z o.o., ul. Gdańska 10, 14-106 Szyldak Z iemniak należy do roślin rozmnażanych wegetatywnie.
8 ZASTOSOWANIE MIKROROZMNAŻANIA W HODOWLI I NASIENNICTWIE ZIEMNIAKA mgr Rajmund Bruski Hodowla Roślin w Szyldaku Spółka z o.o., ul. Gdańska 10, 14-106 Szyldak Z iemniak należy do roślin rozmnażanych wegetatywnie.
Bloki licencjackie i studia magisterskie na Kierunkach: Biotechnologia, specjalność Biotechnologia roślinna oraz Genetyka
 Bloki licencjackie i studia magisterskie na Kierunkach: Biotechnologia, specjalność Biotechnologia roślinna oraz Genetyka INSTYTUT BIOLOGII EKSPERYMENTALNEJ W Katedrze Genetyki Ogólnej, Biologii Molekularnej
Bloki licencjackie i studia magisterskie na Kierunkach: Biotechnologia, specjalność Biotechnologia roślinna oraz Genetyka INSTYTUT BIOLOGII EKSPERYMENTALNEJ W Katedrze Genetyki Ogólnej, Biologii Molekularnej
Otrzymywanie spontanicznych i indukowanych linii podwojonych haploidów pszenżyta ozimego z wykorzystaniem kultur pylnikowych
 NR 260/261 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2011 ALEKSANDRA PONITKA AURELIA ŚLUSARKIEWICZ-JARZINA Instytut Genetyki Roślin PAN w Poznaniu Otrzymywanie spontanicznych i indukowanych linii
NR 260/261 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2011 ALEKSANDRA PONITKA AURELIA ŚLUSARKIEWICZ-JARZINA Instytut Genetyki Roślin PAN w Poznaniu Otrzymywanie spontanicznych i indukowanych linii
Sukces kultur in vitro oparty jest na zjawisku totipotencji, czyli nieograniczonej zdolności komórek do dzielenia się i odtwarzania całego organizmu
 Rośliny z probówki Kultury in vitro to uprawa części roślin, tkanek, pojedynczych komórek, a nawet protoplastów poza organizmem macierzystym, na sztucznych pożywkach w warunkach sterylnych Sukces kultur
Rośliny z probówki Kultury in vitro to uprawa części roślin, tkanek, pojedynczych komórek, a nawet protoplastów poza organizmem macierzystym, na sztucznych pożywkach w warunkach sterylnych Sukces kultur
Ziemniak Polski 2011 nr 1 1
 Ziemniak Polski 2011 nr 1 1 Hodowla i genetyka OCENY CYTOLOGICZNE STOSOWANE W PRACACH HODOWLANO- -GENETYCZNYCH NAD ZIEMNIAKIEM mgr Iwona Wasilewicz-Flis IHAR PIB, Zakład Genetyki i Materiałów Wyjściowych
Ziemniak Polski 2011 nr 1 1 Hodowla i genetyka OCENY CYTOLOGICZNE STOSOWANE W PRACACH HODOWLANO- -GENETYCZNYCH NAD ZIEMNIAKIEM mgr Iwona Wasilewicz-Flis IHAR PIB, Zakład Genetyki i Materiałów Wyjściowych
52. Badania nad indukcją embriogenezy mikrospor u roślin z rodzaju Brassica prof. dr hab. T. Cegielska-Taras
 Lp. w zał. do Rozporządzenia MRiRW: 52. Tytuł zadania: Badania nad indukcją embriogenezy mikrospor u roślin z rodzaju Brassica. Kierownik zadania: prof. dr hab. T. Cegielska-Taras Cele zdania: A/ Badanie
Lp. w zał. do Rozporządzenia MRiRW: 52. Tytuł zadania: Badania nad indukcją embriogenezy mikrospor u roślin z rodzaju Brassica. Kierownik zadania: prof. dr hab. T. Cegielska-Taras Cele zdania: A/ Badanie
Nasiennictwo. Tom I. Spis treści
 Nasiennictwo. Tom I Spis treści PRZEDMOWA 1. ŚWIATOWY PRZEMYSŁ NASIENNY 1.1. ZNACZENIE MATERIAŁU SIEWNEGO 1.2. PRZEMYSŁ NASIENNY 1.3. ŹRÓDŁA WSPIERANIA ROZWOJU PRZEMYSŁU NASIENNEGO 1.4. MIĘDZYNARODOWY
Nasiennictwo. Tom I Spis treści PRZEDMOWA 1. ŚWIATOWY PRZEMYSŁ NASIENNY 1.1. ZNACZENIE MATERIAŁU SIEWNEGO 1.2. PRZEMYSŁ NASIENNY 1.3. ŹRÓDŁA WSPIERANIA ROZWOJU PRZEMYSŁU NASIENNEGO 1.4. MIĘDZYNARODOWY
Ziemniak Polski 2016 nr 4
 10 Ziemniak Polski 2016 nr 4 TERMOTERAPIA I CHEMIOTERAPIA PORÓWNANIE SKUTECZNOŚCI METOD W ELIMINACJI WIRUSÓW S I M ZIEMNIAKA inż. Danuta Sekrecka, mgr inż. Dorota Michałowska, mgr inż. Joanna Piskorz IHAR
10 Ziemniak Polski 2016 nr 4 TERMOTERAPIA I CHEMIOTERAPIA PORÓWNANIE SKUTECZNOŚCI METOD W ELIMINACJI WIRUSÓW S I M ZIEMNIAKA inż. Danuta Sekrecka, mgr inż. Dorota Michałowska, mgr inż. Joanna Piskorz IHAR
Zadanie 77: Hybrydyzacja oddalona gatunków Prunus cerasifera (ałycza), Prunus armeniaca (morela), Prunus salicina (śliwa japońska), Prunus domestica
 Zadanie 77: Hybrydyzacja oddalona gatunków Prunus cerasifera (ałycza), Prunus armeniaca (morela), Prunus salicina (śliwa japońska), Prunus domestica (śliwa domowa) w celu zwiększenia bioróżnorodności genetycznej
Zadanie 77: Hybrydyzacja oddalona gatunków Prunus cerasifera (ałycza), Prunus armeniaca (morela), Prunus salicina (śliwa japońska), Prunus domestica (śliwa domowa) w celu zwiększenia bioróżnorodności genetycznej
BIOTECHNOLOGIA I BIOLOGIA EKSPERYMENTALNA ROŚLIN
 BIOTECHNOLOGIA I BIOLOGIA EKSPERYMENTALNA ROŚLIN Udział w międzynarodowych projektach badawczych: Rodzaj projektu: międzynarodowy, współfinansowany Nr grantu: 2904/FAO/IAEA/2013/0 Temat: Pakiet narzędzi
BIOTECHNOLOGIA I BIOLOGIA EKSPERYMENTALNA ROŚLIN Udział w międzynarodowych projektach badawczych: Rodzaj projektu: międzynarodowy, współfinansowany Nr grantu: 2904/FAO/IAEA/2013/0 Temat: Pakiet narzędzi
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
Pszenżyto: w czym tkwi jego fenomen?
 https://www. Pszenżyto: w czym tkwi jego fenomen? Autor: Sylwia Krupiak Data: 7 sierpnia 2016 Pszenżyto jest polską specjalnością. Mimo że jest to bardzo popularne u nas zboże, czy na pewno znamy je dobrze?
https://www. Pszenżyto: w czym tkwi jego fenomen? Autor: Sylwia Krupiak Data: 7 sierpnia 2016 Pszenżyto jest polską specjalnością. Mimo że jest to bardzo popularne u nas zboże, czy na pewno znamy je dobrze?
Spis treści. 1 Budowa genomu jądrowego (M.J. Olszewska, J. Małuszyńska) 13. Przedmowa 10
 Spis treści Przedmowa 10 1 Budowa genomu jądrowego (M.J. Olszewska, J. Małuszyńska) 13 1.1. Organizacja DNA jądrowego 13 1.1.1. Rodzaje sekwencji powtarzalnych i ich lokalizacja 14 1.1.1.1. Sekwencje rozproszone
Spis treści Przedmowa 10 1 Budowa genomu jądrowego (M.J. Olszewska, J. Małuszyńska) 13 1.1. Organizacja DNA jądrowego 13 1.1.1. Rodzaje sekwencji powtarzalnych i ich lokalizacja 14 1.1.1.1. Sekwencje rozproszone
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej
 Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Sprawdź swoją wiedzę i umiejętności TKANKI ROŚLINNE. 1. Uzupełnij schemat ilustrujący hierarchiczną budowę organizmu roślin. komórka...
 Sprawdź swoją wiedzę i umiejętności TKANKI ROŚLINNE. 1. Uzupełnij schemat ilustrujący hierarchiczną budowę organizmu roślin. komórka...... organizm 2. Na rysunku komórki roślinnej wskaż i podpisz następujące
Sprawdź swoją wiedzę i umiejętności TKANKI ROŚLINNE. 1. Uzupełnij schemat ilustrujący hierarchiczną budowę organizmu roślin. komórka...... organizm 2. Na rysunku komórki roślinnej wskaż i podpisz następujące
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
OPIS PRZEDMIOTU ZAMÓWIENIA ARKUSZ KALKULACYJNY OKREŚLAJĄCY CENĘ OFERTY. zestaw 4
 . Pieczęć nagłówkowa ZAŁĄCZNIK NR 1A.1 DO SIWZ Data... OPIS PRZEDMIOTU ZAMÓWIENIA ARKUSZ KALKULACYJNY OKREŚLAJĄCY CENĘ OFERTY Część nr 1 Odczynniki do hodowli komórkowych Wartość 1 Zestaw uzupełniający
. Pieczęć nagłówkowa ZAŁĄCZNIK NR 1A.1 DO SIWZ Data... OPIS PRZEDMIOTU ZAMÓWIENIA ARKUSZ KALKULACYJNY OKREŚLAJĄCY CENĘ OFERTY Część nr 1 Odczynniki do hodowli komórkowych Wartość 1 Zestaw uzupełniający
Nowoczesne systemy ekspresji genów
 Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Mikrosatelitarne sekwencje DNA
 Mikrosatelitarne sekwencje DNA Małgorzata Pałucka Wykorzystanie sekwencji mikrosatelitarnych w jądrowym DNA drzew leśnych do udowodnienia pochodzenia materiału dowodowego w postępowaniu sądowym 27.09.2012
Mikrosatelitarne sekwencje DNA Małgorzata Pałucka Wykorzystanie sekwencji mikrosatelitarnych w jądrowym DNA drzew leśnych do udowodnienia pochodzenia materiału dowodowego w postępowaniu sądowym 27.09.2012
Autor: dr Mirosława Staniaszek
 Zakład Hodowli Roślin Ogrodniczych Pracownia Genetyki i Hodowli Roślin Warzywnych Fot. J. Sobolewski Procedura identyfikacji genu Frl warunkującego odporność pomidora na Fusarium oxysporum f.sp. radicis-lycopersici
Zakład Hodowli Roślin Ogrodniczych Pracownia Genetyki i Hodowli Roślin Warzywnych Fot. J. Sobolewski Procedura identyfikacji genu Frl warunkującego odporność pomidora na Fusarium oxysporum f.sp. radicis-lycopersici
BIOLOGIA KOMÓRKI. Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych
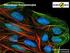 BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
Zawartość składników pokarmowych w roślinach
 Zawartość składników pokarmowych w roślinach Poszczególne rośliny różnią się zawartością składników pokarmowych zarówno w organach wegetatywnych, jak i generatywnych. Wynika to z różnych funkcji, jakie
Zawartość składników pokarmowych w roślinach Poszczególne rośliny różnią się zawartością składników pokarmowych zarówno w organach wegetatywnych, jak i generatywnych. Wynika to z różnych funkcji, jakie
Hormony roślinne ( i f t i o t h o or o m r on o y n )
 Hormony roślinne (fitohormony) Hormony roślinne: To związki chemiczne syntetyzowane w pewnych częściach rośliny służące do "komunikacji" pomiędzy poszczególnymi jej częściami. Działają w bardzo małych
Hormony roślinne (fitohormony) Hormony roślinne: To związki chemiczne syntetyzowane w pewnych częściach rośliny służące do "komunikacji" pomiędzy poszczególnymi jej częściami. Działają w bardzo małych
Zadanie 77: Hybrydyzacja oddalona gatunków Prunus cerasifera (ałycza), Prunus armeniaca (morela), Prunus salicina (śliwa japońska), Prunus domestica
 1 Zadanie 77: Hybrydyzacja oddalona gatunków Prunus cerasifera (ałycza), Prunus armeniaca (morela), Prunus salicina (śliwa japońska), Prunus domestica (śliwa domowa) w celu zwiększenia bioróżnorodności
1 Zadanie 77: Hybrydyzacja oddalona gatunków Prunus cerasifera (ałycza), Prunus armeniaca (morela), Prunus salicina (śliwa japońska), Prunus domestica (śliwa domowa) w celu zwiększenia bioróżnorodności
Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY)
 Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY) Cel ćwiczenia Amplifikacja fragmentu genu amelogeniny, znajdującego się na chromosomach X i Y, jako celu molekularnego przydatnego
Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY) Cel ćwiczenia Amplifikacja fragmentu genu amelogeniny, znajdującego się na chromosomach X i Y, jako celu molekularnego przydatnego
SPRAWOZDANIE MERYTORYCZNE
 Nr zadania: 85 SPRAWOZDANIE MERYTORYCZNE z realizacji zadania na rzecz postępu biologicznego w produkcji roślinnej w 2016 roku 1. Tytuł zadania: Badanie reakcji mikrospor żyta na stres i warunki kultury
Nr zadania: 85 SPRAWOZDANIE MERYTORYCZNE z realizacji zadania na rzecz postępu biologicznego w produkcji roślinnej w 2016 roku 1. Tytuł zadania: Badanie reakcji mikrospor żyta na stres i warunki kultury
Otrzymywanie podwojonych haploidów z mieszańców ozimych i jarych pszenżyta z zastosowaniem kolchicyny w kulturach pylnikowych
 NR 276 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2015 AURELIA ŚLUSARKIEWICZ-JARZINA ALEKSANDRA PONITKA Instytut Genetyki Roślin PAN w Poznaniu Otrzymywanie podwojonych haploidów z mieszańców ozimych
NR 276 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2015 AURELIA ŚLUSARKIEWICZ-JARZINA ALEKSANDRA PONITKA Instytut Genetyki Roślin PAN w Poznaniu Otrzymywanie podwojonych haploidów z mieszańców ozimych
mikrosatelitarne, minisatelitarne i polimorfizm liczby kopii
 Zawartość 139371 1. Wstęp zarys historii genetyki, czyli od genetyki klasycznej do genomiki 2. Chromosomy i podziały jądra komórkowego 2.1. Budowa chromosomu 2.2. Barwienie prążkowe chromosomów 2.3. Mitoza
Zawartość 139371 1. Wstęp zarys historii genetyki, czyli od genetyki klasycznej do genomiki 2. Chromosomy i podziały jądra komórkowego 2.1. Budowa chromosomu 2.2. Barwienie prążkowe chromosomów 2.3. Mitoza
Efektywność uzyskiwania haploidów pszenicy z mieszańców F 1 i ich form wyjściowych poprzez krzyżowanie z kukurydzą
 NR 231 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2004 KAROLINA KRYSTKOWIAK ANETTA KUCZYŃSKA MICHAŁ RĘBARZ RENATA TRZECIAK Instytut Genetyki Roślin PAN, Poznań Efektywność uzyskiwania haploidów
NR 231 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2004 KAROLINA KRYSTKOWIAK ANETTA KUCZYŃSKA MICHAŁ RĘBARZ RENATA TRZECIAK Instytut Genetyki Roślin PAN, Poznań Efektywność uzyskiwania haploidów
Laboratorium Pomorskiego Parku Naukowo-Technologicznego Gdynia.
 Laboratorium Pomorskiego Parku Naukowo-Technologicznego Gdynia www.ppnt.pl/laboratorium Laboratorium jest częścią modułu biotechnologicznego Pomorskiego Parku Naukowo Technologicznego Gdynia. poprzez:
Laboratorium Pomorskiego Parku Naukowo-Technologicznego Gdynia www.ppnt.pl/laboratorium Laboratorium jest częścią modułu biotechnologicznego Pomorskiego Parku Naukowo Technologicznego Gdynia. poprzez:
WYMAGANIA EDUKACYJNE Z BIOLOGII KLASA 5 DOBRY. DZIAŁ 1. Biologia jako nauka ( 4godzin)
 WYMAGANIA EDUKACYJNE Z BIOLOGII KLASA 5 DOPUSZCZAJĄCY DOSTATECZNY DOBRY BARDZO DOBRY CELUJĄCY DZIAŁ 1. Biologia jako nauka ( 4godzin) wskazuje biologię jako naukę o organizmach wymienia czynności życiowe
WYMAGANIA EDUKACYJNE Z BIOLOGII KLASA 5 DOPUSZCZAJĄCY DOSTATECZNY DOBRY BARDZO DOBRY CELUJĄCY DZIAŁ 1. Biologia jako nauka ( 4godzin) wskazuje biologię jako naukę o organizmach wymienia czynności życiowe
Budowa tkanki korzeni buraków cukrowych
 Cukier z buraków jest od dawna pozyskiwany na drodze dyfuzji. Jako materiał zapasowy rośliny dwuletniej znajduje się w tkance korzenia (rys.). Budowa tkanki korzeni buraków cukrowych W korzeniu wyróżnia
Cukier z buraków jest od dawna pozyskiwany na drodze dyfuzji. Jako materiał zapasowy rośliny dwuletniej znajduje się w tkance korzenia (rys.). Budowa tkanki korzeni buraków cukrowych W korzeniu wyróżnia
Ocena stabilności genetycznej rozmnażanych in vitro polskich odmian tulipanów przy użyciu markerów molekularnych ISSR
 Ocena stabilności genetycznej rozmnażanych in vitro polskich odmian tulipanów przy użyciu markerów molekularnych ISSR Małgorzata Podwyszyńska, Anita Kuras, Małgorzata Korbin Instytut sadownictwa i Kwiaciarstwa,
Ocena stabilności genetycznej rozmnażanych in vitro polskich odmian tulipanów przy użyciu markerów molekularnych ISSR Małgorzata Podwyszyńska, Anita Kuras, Małgorzata Korbin Instytut sadownictwa i Kwiaciarstwa,
Inżynieria genetyczna- 6 ECTS. Inżynieria genetyczna. Podstawowe pojęcia Część II Klonowanie ekspresyjne Od genu do białka
 Inżynieria genetyczna- 6 ECTS Część I Badanie ekspresji genów Podstawy klonowania i różnicowania transformantów Kolokwium (14pkt) Część II Klonowanie ekspresyjne Od genu do białka Kolokwium (26pkt) EGZAMIN
Inżynieria genetyczna- 6 ECTS Część I Badanie ekspresji genów Podstawy klonowania i różnicowania transformantów Kolokwium (14pkt) Część II Klonowanie ekspresyjne Od genu do białka Kolokwium (26pkt) EGZAMIN
Novabeads Food DNA Kit
 Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN
 ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ZADANIE1.6. Gromadzenie i przechowywanie kolekcji patogenów ziemniaka. Jadwiga Śliwka IHAR-PIB O/Młochów 2013
 ZADANIE1.6 Gromadzenie i przechowywanie kolekcji patogenów ziemniaka Jadwiga Śliwka IHAR-PIB O/Młochów 2013 1 Realizacja w Pracowniach: 1. Badania Odporności na Grzyby i Bakterie (POGB); Młochów: Jadwiga
ZADANIE1.6 Gromadzenie i przechowywanie kolekcji patogenów ziemniaka Jadwiga Śliwka IHAR-PIB O/Młochów 2013 1 Realizacja w Pracowniach: 1. Badania Odporności na Grzyby i Bakterie (POGB); Młochów: Jadwiga
Tematy- Biologia zakres rozszerzony, klasa 2TA,2TŻ-1, 2TŻ-2
 Tematy- Biologia zakres rozszerzony, klasa 2TA,2TŻ-1, 2TŻ-2 Nr lekcji Temat Zakres treści 1 Zapoznanie z PSO, wymaganiami edukacyjnymi i podstawą programową PSO, wymagania edukacyjne i podstawa programowa
Tematy- Biologia zakres rozszerzony, klasa 2TA,2TŻ-1, 2TŻ-2 Nr lekcji Temat Zakres treści 1 Zapoznanie z PSO, wymaganiami edukacyjnymi i podstawą programową PSO, wymagania edukacyjne i podstawa programowa
Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro
 Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro Miarą aktywności cytotoksycznej badanej substancji jest określenie stężenia hamującego, IC 50 (ang. inhibitory concentration), dla
Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro Miarą aktywności cytotoksycznej badanej substancji jest określenie stężenia hamującego, IC 50 (ang. inhibitory concentration), dla
Czy żywność GMO jest bezpieczna?
 Instytut Żywności i Żywienia dr n. med. Lucjan Szponar Czy żywność GMO jest bezpieczna? Warszawa, 21 marca 2005 r. Od ponad połowy ubiegłego wieku, jedną z rozpoznanych tajemnic życia biologicznego wszystkich
Instytut Żywności i Żywienia dr n. med. Lucjan Szponar Czy żywność GMO jest bezpieczna? Warszawa, 21 marca 2005 r. Od ponad połowy ubiegłego wieku, jedną z rozpoznanych tajemnic życia biologicznego wszystkich
Mutacja typu Virescens u rzepaku ozimego Brassica napus L.
 Tom XIX Rośliny Oleiste 1998 Akademia Rolnicza w Poznaniu, Katedra Genetyki i Hodowli Roślin Mutacja typu Virescens u rzepaku ozimego Brassica napus L. Virescens type of mutation in winter rape Brassica
Tom XIX Rośliny Oleiste 1998 Akademia Rolnicza w Poznaniu, Katedra Genetyki i Hodowli Roślin Mutacja typu Virescens u rzepaku ozimego Brassica napus L. Virescens type of mutation in winter rape Brassica
1
 PLAN STUDIÓW kierunek BIOTECHNOLOGIA MOLEKULARNA studia drugiego stopnia PIERWSZY ROK STUDIÓW I semestr (zimowy) WBt BT2 001 Biochemia kurs zaawansowany 1 0+5 Z 7 WBt BT2 004 Biotechnologia dla środowiska
PLAN STUDIÓW kierunek BIOTECHNOLOGIA MOLEKULARNA studia drugiego stopnia PIERWSZY ROK STUDIÓW I semestr (zimowy) WBt BT2 001 Biochemia kurs zaawansowany 1 0+5 Z 7 WBt BT2 004 Biotechnologia dla środowiska
Wykorzystanie gynogenezy in vitro dla uzyskania dihaploidów buraka cukrowego
 NR 234 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2004 MARIA GOŚKA 1 TERESA KRYSIŃSKA 2 KRYSTYNA STRYCHARCZUK 2 1 Instytut Hodowli i Aklimatyzacji Roślin, Oddział w Bydgoszczy 2 Kutnowska Hodowla
NR 234 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2004 MARIA GOŚKA 1 TERESA KRYSIŃSKA 2 KRYSTYNA STRYCHARCZUK 2 1 Instytut Hodowli i Aklimatyzacji Roślin, Oddział w Bydgoszczy 2 Kutnowska Hodowla
Zastosowanie markerów RAPD do określenia podobieństwa genetycznego odmian jęczmienia ozimego (Hordeum vulgare L.)
 NR 226/227/1 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2003 ANETTA KUCZYŃSKA 1 JAN BOCIANOWSKI 1 PIOTR MASOJĆ 2 MARIA SURMA 1 TADEUSZ ADAMSKI 1 1 Instytut Genetyki Roślin Polskiej Akademii Nauk
NR 226/227/1 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2003 ANETTA KUCZYŃSKA 1 JAN BOCIANOWSKI 1 PIOTR MASOJĆ 2 MARIA SURMA 1 TADEUSZ ADAMSKI 1 1 Instytut Genetyki Roślin Polskiej Akademii Nauk
Anna Litwiniec 1, Beata Choińska 1, Aleksander Łukanowski 2, Żaneta Świtalska 1, Maria Gośka 1
 Anna Litwiniec 1, Beata Choińska 1, Aleksander Łukanowski 2, Żaneta Świtalska 1, Maria Gośka 1 1 Zakład Genetyki i Hodowli Roślin Korzeniowych, Pracownia Biotechnologii, Instytut Hodowli i Aklimatyzacji
Anna Litwiniec 1, Beata Choińska 1, Aleksander Łukanowski 2, Żaneta Świtalska 1, Maria Gośka 1 1 Zakład Genetyki i Hodowli Roślin Korzeniowych, Pracownia Biotechnologii, Instytut Hodowli i Aklimatyzacji
KOŁO NAUKOWE IMMUNOLOGII. Mikrochimeryzm badania w hodowlach leukocytów in vitro
 KOŁO NAUKOWE IMMUNOLOGII Mikrochimeryzm badania w hodowlach leukocytów in vitro Koło Naukowe Immunolgii kolo_immunologii@biol.uw.edu.pl kolo_immunologii.kn@uw.edu.pl CEL I PRZEDMIOT PROJEKTU Celem doświadczenia
KOŁO NAUKOWE IMMUNOLOGII Mikrochimeryzm badania w hodowlach leukocytów in vitro Koło Naukowe Immunolgii kolo_immunologii@biol.uw.edu.pl kolo_immunologii.kn@uw.edu.pl CEL I PRZEDMIOT PROJEKTU Celem doświadczenia
Numer zadania 4.3. pt Oszacowanie możliwości koegzystencji upraw różnych typów odmian rzepaku ozimego w warunkach agroklimatycznych Polski
 ROZLICZENIE KOŃCOWE z wykonania zadań i wykorzystania dotacji na zadania określone w rozdziale IV programu wieloletniego Tworzenie naukowych podstaw postępu biologicznego i ochrona roślinnych zasobów genowych
ROZLICZENIE KOŃCOWE z wykonania zadań i wykorzystania dotacji na zadania określone w rozdziale IV programu wieloletniego Tworzenie naukowych podstaw postępu biologicznego i ochrona roślinnych zasobów genowych
Komórka organizmy beztkankowe
 Grupa a Komórka organizmy beztkankowe Poniższy test składa się z 12 zadań. Przy każdym poleceniu podano liczbę punktów możliwą do uzyskania za prawidłową odpowiedź. Za rozwiązanie całego testu możesz otrzymać
Grupa a Komórka organizmy beztkankowe Poniższy test składa się z 12 zadań. Przy każdym poleceniu podano liczbę punktów możliwą do uzyskania za prawidłową odpowiedź. Za rozwiązanie całego testu możesz otrzymać
Inżynieria Genetyczna ćw. 3
 Materiały do ćwiczeń z przedmiotu Genetyka z inżynierią genetyczną D - blok Inżynieria Genetyczna ćw. 3 Instytut Genetyki i Biotechnologii, Wydział Biologii, Uniwersytet Warszawski, rok akad. 2018/2019
Materiały do ćwiczeń z przedmiotu Genetyka z inżynierią genetyczną D - blok Inżynieria Genetyczna ćw. 3 Instytut Genetyki i Biotechnologii, Wydział Biologii, Uniwersytet Warszawski, rok akad. 2018/2019
Program wieloletni: Tworzenie naukowych podstaw
 Program wieloletni: Tworzenie naukowych podstaw postępu biologicznego i ochrona roślinnych zasobów genowych źródłem innowacji i wsparcia zrównoważonego rolnictwa oraz bezpieczeństwa żywnościowego kraju
Program wieloletni: Tworzenie naukowych podstaw postępu biologicznego i ochrona roślinnych zasobów genowych źródłem innowacji i wsparcia zrównoważonego rolnictwa oraz bezpieczeństwa żywnościowego kraju
Metody poprawy jakości nasion buraka cukrowego
 Metody poprawy jakości nasion buraka cukrowego Podlaski Sławomir Jubileusz 90-lecia urodzin Prof. dr hab. B. Geja i 90-lecia powstania Katedry Fizjologii Roślin Budowa handlowego nasienia buraka cukrowego
Metody poprawy jakości nasion buraka cukrowego Podlaski Sławomir Jubileusz 90-lecia urodzin Prof. dr hab. B. Geja i 90-lecia powstania Katedry Fizjologii Roślin Budowa handlowego nasienia buraka cukrowego
POZIOMY WYMAGAŃ EDUKACYJNYCH Z BIOLOGII KLASA V
 POZIOMY WYMAGAŃ EDUKACYJNYCH Z BIOLOGII KLASA V Program PULS ŻYCIA autor: Anna Zdziennicka Podręcznik do biologii opracowany przez: Joanna Stawarz i Marian Sęktas NA ŚRÓDROCZNĄ OCENĘ KLASYFIKACYJNĄ ocena
POZIOMY WYMAGAŃ EDUKACYJNYCH Z BIOLOGII KLASA V Program PULS ŻYCIA autor: Anna Zdziennicka Podręcznik do biologii opracowany przez: Joanna Stawarz i Marian Sęktas NA ŚRÓDROCZNĄ OCENĘ KLASYFIKACYJNĄ ocena
Technika hodowli komórek leukemicznych
 Fizjologiczne Techniki Badań Technika hodowli komórek leukemicznych Zasady prowadzenia hodowli komórek leukemicznych, pasażowania, mrożenia, rozmrażania i przechowywania komórek leukemicznych Warunki wstępne:
Fizjologiczne Techniki Badań Technika hodowli komórek leukemicznych Zasady prowadzenia hodowli komórek leukemicznych, pasażowania, mrożenia, rozmrażania i przechowywania komórek leukemicznych Warunki wstępne:
Wykorzystanie zasobów genowych w hodowli roślin i pracach badawczych
 Wykorzystanie zasobów genowych w hodowli roślin i pracach badawczych Prof. dr hab. Edward Arseniuk Instytut Hodowli i Aklimatyzacji Roślin-PIB Radzików, 05-870 Błonie ZASOBY GENOWE ROŚLIN UŻYTKOWYCH NA
Wykorzystanie zasobów genowych w hodowli roślin i pracach badawczych Prof. dr hab. Edward Arseniuk Instytut Hodowli i Aklimatyzacji Roślin-PIB Radzików, 05-870 Błonie ZASOBY GENOWE ROŚLIN UŻYTKOWYCH NA
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK
 BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
Producent: Barenbrug 208,00 zł Cena brutto: 170,00 zł Cena netto: 157,41 zł. Kod QR:
 Fungi-Chem P.W. Dorota Kaletka ul. Kwiatowa 1 64-000 Pianowo tel. +48 65 511 96 13 sklep@fungichem.pl Zapraszamy do sklepu www.fungichem.pl Facebook.com/FungiChem Nawóz Barenbrug Barfertile Regeneration
Fungi-Chem P.W. Dorota Kaletka ul. Kwiatowa 1 64-000 Pianowo tel. +48 65 511 96 13 sklep@fungichem.pl Zapraszamy do sklepu www.fungichem.pl Facebook.com/FungiChem Nawóz Barenbrug Barfertile Regeneration
Hodowlą nazywamy masę drobnoustrojów wyrosłych na podłożu o dowolnej konsystencji.
 Wzrost mikroorganizmów rozumieć można jako: 1. Wzrost masy i rozmiarów pojedynczego osobnika, tj. komórki 2. Wzrost biomasy i liczebności komórek w środowisku, tj. wzrost liczebności populacji Hodowlą
Wzrost mikroorganizmów rozumieć można jako: 1. Wzrost masy i rozmiarów pojedynczego osobnika, tj. komórki 2. Wzrost biomasy i liczebności komórek w środowisku, tj. wzrost liczebności populacji Hodowlą
Numer zadania 2.7. pt Poszerzanie puli genetycznej roślin oleistych dla przetwórstwa rplno-spożywczego i innycj gałęzi przemysłu
 ROZLICZENIE KOŃCOWE z wykonania zadań i wykorzystania dotacji na zadania określone w rozdziale IV programu wieloletniego Tworzenie naukowych podstaw postępu biologicznego i ochrona roślinnych zasobów genowych
ROZLICZENIE KOŃCOWE z wykonania zadań i wykorzystania dotacji na zadania określone w rozdziale IV programu wieloletniego Tworzenie naukowych podstaw postępu biologicznego i ochrona roślinnych zasobów genowych
Zmienność wykształcenia pylników w obrębie roślin pszenżyta ozimego z cytoplazmą Triticum timopheevi *
 NR 236 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2005 HALINA GÓRAL GRZEGORZ JAGODZIŃSKI Katedra Hodowli Roślin i Nasiennictwa Akademia Rolnicza, Kraków Zmienność wykształcenia pylników w obrębie
NR 236 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2005 HALINA GÓRAL GRZEGORZ JAGODZIŃSKI Katedra Hodowli Roślin i Nasiennictwa Akademia Rolnicza, Kraków Zmienność wykształcenia pylników w obrębie
Wpływ metabolitów form Tox 0 grzyba Phoma lingam na kultury zarodków mikrosporowych oraz protoplastów rzepaku *
 Tom XIX Rośliny Oleiste 1998 Wei Zhang, Piotr Kachlicki*, Teresa Cegielska**, Małgorzata Jędryczka* Genetic Engineering Laboratory, College of Biotechnology, South China Agricultural University, Guangzhou,
Tom XIX Rośliny Oleiste 1998 Wei Zhang, Piotr Kachlicki*, Teresa Cegielska**, Małgorzata Jędryczka* Genetic Engineering Laboratory, College of Biotechnology, South China Agricultural University, Guangzhou,
