Agencja Oceny Technologii Medycznych
|
|
|
- Agata Kaźmierczak
- 9 lat temu
- Przeglądów:
Transkrypt
1 Rekomendacja nr 19/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 28 maja 2012 r. w zakresie usunięcia lub zmiany sposobu finansowania świadczenia opieki zdrowotnej Podanie rytuksymabu w leczeniu pacjentów z chorobą Hodgkina realizowanego w ramach programu chemioterapii niestandardowej Prezes Agencji nie rekomenduje usunięcia z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej świadczenia opieki zdrowotnej Podanie rytuksymabu w leczeniu choroby Hodgkina. Jednocześnie nie rekomenduje też zmiany jego sposobu finansowania. Uzasadnienie rekomendacji Prezes Agencji, przychylając się do stanowiska Rady Przejrzystości 1, nie rekomenduje usunięcia z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej świadczenia opieki zdrowotnej: Podanie rytuksymabu w leczeniu choroby Hodgkina. Rytuksymab (substancja czynna produktu leczniczego Mabthera ) jest przeciwciałem monoklonalnym anty CD20 zarejestrowanym we wskazaniu: leczenie chłoniaków nieziarniczych (NHL), reumatoidalnego zapalenia stawów (RZS) oraz przewlekłej białaczki limfocytowej (PBL). Zgodnie z istniejącą praktyką kliniczną rytuksymab stosowany jest także w terapii choroby Hodgkina, poza obecnie obowiązującymi wskazaniami rejestracyjnymi i jest obecnie refundowany w ramach Terapeutycznego Programu Zdrowotnego Program leczenia w ramach świadczenia chemioterapii niestandardowej. Badania nad potwierdzeniem klinicznej efektywności rytuksymabu w przedmiotowym wskazaniu nadal trwają. W Polsce populacja chorych leczonych rytuksymabem w przedmiotowym wskazaniu w ramach TPZ Program leczenia w ramach świadczenia chemioterapii niestandardowej jest stosunkowo niewielka, a koszty refundacji kształtują się w granicach 1 miliona złotych rocznie. Dalsze finansowanie produktu leczniczego Mabthera w ramach programu chemioterapii niestandardowej pozwoli na zastosowanie leczenia w wyselekcjonowanej i wąskiej grupie chorych, dla których z różnych przyczyn medycznych nie ma innej opcji terapeutycznej. ul. I. Krasickiego 26, Warszawa tel fax
2 Problem zdrowotny Rekomendacja nr 19/2012 Prezesa AOTM z dnia 28 maja 2012 r. Choroba Hodgkina (ang. Hodgkin Lymphoma HL; Hodgkin Disease HD), określana także jako chłoniak ziarniczy, ziarnica złośliwa, to grupa chorób nowotworowych wywodząca się tkanki limfoidalnej charakteryzująca się występowaniem w naciekach ziarniczych komórek Reed Sternberga (R S) oraz komórek Hodgkina (H), którym towarzyszą komórki odczynowe (limfocyty, histiocyty, eozynofile, neutrofile, plazmocyty i fibroblasty). Choroba Hodgkina początkowo rozwija się głównie w obrębie węzłów chłonnych i ma tendencję do szerzenia się początkowo przez ciągłość na inne węzły chłonne, a w bardziej zaawansowanych stadiach drogą naczyń krwionośnych, wywołując zmiany w odległych strukturach limfatycznych i narządach wewnętrznych. Etiologia choroby Hodgkina nie jest znana. Jako potencjalne czynniki chorobotwórcze brane są pod uwagę m.in.: zakażenie wirusem Epsteina Barra (EBV), wirusem ludzkiej białaczki z komórek T (HTLV I, HTLV II), ludzkim wirusem herpes (HHV 6), wirusem cytomegalii (CMV), działanie promieniowania jonizującego, immunosupresja, predyspozycje genetyczne (ryzyko zachorowania u rodzeństwa tej samej płci jest zwiększone 10 krotnie, a u bliźniąt monozygotycznych ok. 100 krotnie, w porównaniu z bliźniętami dizygotycznymi i populacją ogólną). Sugeruje się, że powstanie nowotworowego klonu w HL może być konsekwencją utraty hamowania wzrostu komórek w wyniku inhibicji genu p53. Znaczenie w patogenezie HL mogą mieć także niektóre cytokiny wytwarzane przez komórki nowotworowe (IL 1, IL 2, TNF α, IL 5), które nie tylko wpływają na charakter komórek odczynowych, ale także warunkują występowanie objawów klinicznych. Chłoniak Hodgkina cechuje się wysoką wyleczalnością, jest to choroba o dużej chemioi promieniowrażliwości. W Europie Zachodniej uzyskuje się ponad 80% 10 letnich przeżyć. W Polsce rocznie odnotowuje się w przybliżeniu 800 nowych zachorowań, co stanowi 0,8% wszystkich nowotworów i około 25% chłoniaków. Szczytową zachorowalność dla HL obserwuje się u ludzi w wieku lat oraz między rokiem życia. Wskaźniki zachorowalności (1/ ludności) wynoszą dla mężczyzn 2,1 a dla kobiet 1,9. Wskaźniki umieralności wynoszą odpowiednio 1,1 u mężczyzn i 0,9 u kobiet. W Polsce w ostatnich latach odnotowuje się tendencję spadkową liczby zgonów z rozpoznaniem chłoniaka Hodgkina. Według Krajowego Rejestru Nowotworów dla rozpoznania choroba Hodgkina (ICD 10: C81) liczba ta wahała się od około 400 przypadków w 2000 roku do nieco ponad 200 w Na obraz kliniczny choroby składają się: Objawy ogólne, nieswoiste tzw. objawy typu B (u w przybliżeniu 30% chorych): utrata masy ciała o około 10% w ciągu ostatnich 6 miesięcy; utrzymująca się dłużej niż 2 tygodnie gorączka powyżej 38 C bez współistnienia zakażenia, wzmożona potliwość w nocy, znaczne osłabienie, nadmierna męczliwość uniemożliwiająca wykonywanie pracy lub codziennych czynności, świąd skóry, nietolerancja alkoholu (ból węzłów chłonnych po wypiciu); Powiększenie węzłów chłonnych (u 95% chorych). Węzły są niebolesne, a ich powiększenie nie cofa się pod dotykiem. Najczęściej zajęte są węzły powyżej przepony (szyjne w 60 80% przypadków, pachowe i śródpiersia w 5 20%), rzadziej poniżej (pachwinowe i zaotrzewnowe w 10%). Przy zajętych węzłach chłonnych szyjnych i nadobojczykowych po stronie lewej lub obustronnie w 50% przypadków zajęte są też węzły poniżej przepony, natomiast przy zajętych węzłach chłonnych po stronie prawej odsetek ten wynosi tylko 7%; Objawy związane z powiększeniem węzłów chłonnych w śródpiersiu, występuje duszność, kaszel, a w skrajnych przypadkach zespół żyły głównej górnej; w przestrzeni zaotrzewnowej dyskomfort w jamie brzusznej, trudności w oddawaniu moczu; 2
3 Zmiany pozawęzłowe dotyczą powiększenie śledziony i wątroby. Przy zajęciu śledziony w 30% przypadków współistnieją zmiany ziarnicze w wątrobie, a zajęciu wątroby towarzyszą zmiany w węzłach okołoaortalnych. Zmiany ziarnicze poza układem chłonnym mogą występować w kościach (u 10 30% chorych), nerkach (13%), macicy (10%), jajnikach (5%), pęcherzu moczowym (5%), skórze (4%), w ośrodkowym układzie nerwowym (2%), jądrach (0,5%). Rzadko dochodzi do zajęcia pierścienia Waldeyera. W Polsce występują pewne rozbieżności w stosowaniu klasyfikacji ICD10 opisującej chorobę Hodgkina (HL) w porównaniu do klasyfikacji stosowanej przez Światową Organizacje Zdrowia (WHO). Zgodnie z polskim kodem ICD10: C81 chłoniak Hodgkina nie obejmuje rozpoznania C81.4: HL bogatego w limfocyty (ang. lymphocyte rich classical HL LRCHL), inaczej jest też zdefiniowany kod C81.7: inna choroba Hodgkina w edycji polskiej, inny klasyczny chłoniak Hodgkina w edycji WHO. Pozostałe rozpoznania to: C81.0 Przewaga limfocytów; C81.1 Stwardnienie guzkowe; C81.2 Mieszanokomórkowa; C81.3 Zmniejszenie limfocytów; C81.7 Inna choroba Hodgkina; C81.9 Choroba Hodgkina, nieokreślona. Klasyczny podział ICD 10 wg WHO obejmuje: C81 Hodgkin lymphoma (chl):; C81.0 Nodular lymphocyte predominant Hodgkin lymphoma (HL NLPHL); C81.1 Nodular sclerosis classical Hodgkin lymphoma (HL NSCHL); C81.2 Mixed cellularity classical Hodgkin lymphoma (HL MCCHL); C81.3 Lymphocytic depletion classical Hodgkin lymphoma (HL LDCHL); C81.4 Lymphocyterich classical Hodgkin lymphoma (HL LRCHL), Excl.: Lymphocyte predominant Hodgkin lymphoma (C81.0); C81.7 Other classical Hodgkin lymphoma; Classic Hodgkin lymphoma, type not specified; C81.9 Hodgkin lymphoma, unspecified. Po ustaleniu rozpoznania ocenia się stopień zaawansowania klinicznego choroby celem wprowadzenia optymalnego postępowania leczniczego. Według szeroko stosowanej klasyfikacji Ann Arbor w HL wyróżnia się: stadium I zajęcie jednej grupy węzłów chłonnych lub ograniczone zajęcie pojedynczego narządu/miejsca pozalimfatycznego (IE); stadium II zajęcie dwóch lub więcej grup węzłów chłonnych po jednej stronie przepony (II) lub zlokalizowane (jednoogniskowe) zajęcie narządu pozalimfatycznego z objęciem jednego lub więcej okolicznych węzłów chłonnych z lub bez zajęcia innych węzłów chłonnych po tej samej stronie przepony (IIE); stadium III zajęcie węzłów chłonnych po obu stronach przepony, czemu towarzyszyć może jednoogniskowe zajęcie narządu pozalimfatycznego (IIIE) lub zajęcie śledziony (IIIS) lub też jednoogniskowe zajęcie narządu pozalimfatycznego i zajęcie śledziony (IIIES); stadium IV rozlane lub rozsiane zajęcie jednego lub więcej narządów pozalimfatycznych, niezależnie od stanu węzłów lub ograniczonego zajęcia narządu pozalimfatycznego z zajęciem odległych węzłów chłonnych. Klasyfikacja stopnia zaawansowania zawiera również występowanie objawów systemowych (ogólnych) chłoniaka Hodgkina: litera B występują, litera A brak. Uzupełnienie oceny stadium klinicznego zaawansowania choroby stanowi określenie wydolności narządów krytycznych (serce, płuca, nerki, wątroba), ze względu na działania niepożądane leków i promieniowania jonizującego stosowanych w leczeniu 2. Aktualnie obowiązująca praktyka kliniczna Podstawą rozpoznania choroby Hodgkina (HL) jest badanie histologiczne i immunohistochemiczne węzła chłonnego lub wycinka innej zajętej tkanki w celu określenia typu wg klasyfikacji WHO. 3
4 Postać klasyczna HL występuje częściej u płci męskiej powyżej 35 roku życia. Zwykle nie występują objawy ogólne, choroba szerzy się na przyległe grupy węzłów chłonnych i może ulegać histologicznej progresji. Postać HL nieklasyczna, guzkowa z przewagą limfocytów stanowi kilka procent przypadków HL, i w 70% występuje głównie u młodych mężczyzn, lokalizuje się w węzłach chłonnych obwodowych. Choroba przebiega zwykle bardzo powoli, przez wiele lat nie dając klinicznej progresji. Wznowy, które powstają w sposób nieciągły z ogniska pierwotnego, łatwo poddają się leczeniu. HL nieklasyczna często współistnieje z chłoniakiem nieziarniczym z komórek B. W HL dodatkowo wykonuje się diagnostykę pomocniczą polegającą na wykonaniu badania laryngologicznego z oceną jamy nosowej i gardła, stomatologicznego przeprowadzonego na dni przed rozpoczęciem chemio lub radioterapii, wykonuje się badania laboratoryjne krwi i moczu, badania obrazowe (RTG, tomografia komputerowa, PET), USG jamy brzusznej, trepanobiopsję szpiku z talerza biodrowego, scyntygrafię kości, badanie czynności serca (EKG i echokardiografia), badanie wydolności płuc (spirometria). U pacjentów cierpiących na HL klasyfikacja Ann Arbor jest często łączona z oceną pod kątem czynników prognostycznych, które podzielono na 3 grupy: wczesny stopnień korzystny (stopień I II bez czynników niekorzystnych), wczesny stopień niekorzystny (stopień I II z którymś z czynników niekorzystnych, takich jak duży guz śródpiersia, objawy B, liczne lokalizacje choroby) oraz zaawansowany stopień choroby (stopnie III IV). Celem prowadzonej terapii w HL jest uzyskanie wyleczenia lub całkowitej remisji w jak najkrótszym czasie. Cel ten można osiągnąć stosując radioterapię, chemioterapię bądź najczęściej łącząc te dwie metody. Wybór metody leczenia zależy od stopnia zaawansowania klinicznego i obecności czynników rokowniczych. Podstawową leczenia systemowego HL jest chemioterapia w schemacie ABVD (doksorubicyna, bleomycyna, dakarbazyna, winblastyna) skojarzona lub nie w zależności od stopnia zaawansowania klinicznego. U chorych w starszym wieku ze współistniejącymi chorobami układu krążenia lub układu oddechowego stosuje się program MOPP (chlormetyna, winkrystyna, prokarbazyna, prednizon). W programach drugiego rzutu stosuje się cykle chemioterapii konwencjonalnej. Zakwalifikowanie chorego do chemioterapii radykalnej nie wyklucza możliwości zastosowania ograniczonej radioterapii jako leczenia uzupełniającego w przypadku niecałkowitej regresji. Schematy leczenia II rzutu oparte są o: CN3OP, ESHAP, DHAP, ICE, IGEV. W przebiegu chłoniaka Hodgkina wyróżnia się zarazem oporność pierwotną brak całkowitej remisji (CR) w odpowiedzi na leczenie oraz wznowy: wczesną do 12 miesięcy od CR i późną po 12 miesiącach od CR. Większość wznów HL występuje w pierwszych 2 3 latach po leczeniu pierwotnym. Nawrót HL występuje u 15 20% pacjentów w stopniach I II, a u 35 40% chorych w stopniach III IV. Konieczna jest weryfikacja histopatologiczna wznowy i ponowne wykonanie badań w celu określenia jej zasięgu. Należy dążyć do zaplanowania leczenia maksymalnie radykalnego, szczególnie w przypadkach pierwszej wznowy, gdyż w wielu sytuacjach możliwe jest osiągnięcie całkowitego wyleczenia. W przypadku progresji pierwotnej lub we wczesnych wznowach stosuje się chemioterapię wysokodawkową wspomaganą autologicznym przeszczepem komórek krwiotwórczych. W przypadku wznowy po 12 miesiącach od leczenia pierwotnego można rozważyć zastosowanie ponownie tego samego programu chemioterapii. Po zastosowaniu chemioterapii konwencjonalnej II rzutu w przypadkach pierwotnej progresji HL uzyskiwane przeżycia chorych nie przekraczają 8 lat, natomiast dla wznów wczesnych i późnych całkowite przeżycia 20 letnie wynoszą odpowiednio 11% i 20%. 4
5 W przypadkach wznów po radioterapii u chorych w stadium I lub II przeżycia całkowite po zastosowaniu chemioterapii konwencjonalnej wynoszą 50 70%. Leczenie według programu ABVD daje około 50% wieloletnich bezobjawowych przeżyć. W leczeniu stosuje się chemioterapię wysokodawkową z przeszczepem autologicznym, programy BEACOPP (doksyrubicyna, cyklofosfamid, etopozyd, bleomycyna, winkrystyna, prokarbazyna, prednizon) i schematy II rzutu z immunoterapią (np. R ICE) lub nowe leki cytostatyczne: winorelbina, idarubicyna, gemcytabina, ifosfamid z immunoterapią. Immunoterapia znajduje zastosowanie zarówno w leczeniu I rzutu rzadkich postaci (NLPHL), jak i w zwalczaniu przetrwałych komórek nowotworowych opornych na zastosowane uprzednio intensywne schematy chemioterapii 2. Opis wnioskowanego świadczenia MabThera (substancja czynna rytuksymab; kod ATC: L01X C02) jest przeciwciałem monoklonalnym, które wiąże się swoiście z transbłonowym antygenem CD20 nieglikozylowaną fosfoproteiną, występującą na limfocytach pre B i na dojrzałych limfocytach B. Antygen CD20 występuje w około 95% przypadków wszystkich chłoniaków nieziarniczych (NHL) z komórek B. Antygen CD20 występuje na prawidłowych limfocytach B, jak i na zmienionych nowotworowo komórkach B, lecz nie występuje na hematopoetycznych komórkach pnia, na wczesnych limfocytach pro B, na prawidłowych komórkach plazmatycznych, ani na komórkach innych zdrowych tkanek. Antygen ten po połączeniu z przeciwciałem nie podlega wprowadzeniu do komórki i nie jest uwalniany z jej powierzchni. CD20 nie występuje w postaci wolnej, krążącej w osoczu, co wyklucza kompetycyjne wiązanie przeciwciała. Domena Fab cząsteczki rytuksymabu wiąże się z antygenem CD20 na limfocytach B i poprzez domenę Fc uruchamia mechanizmy układu odpornościowego prowadzące do lizy komórek B. Wykazano także, że przyłączenie rytuksymabu do antygenu CD20 na limfocytach B indukuje śmierć komórki w drodze apoptozy. Produkt leczniczy Mabthera uzyskał pozwolenie na dopuszczenie do obrotu w ramach procedury centralnej w dniu 2 czerwca 1998 r. Pozwolenie na dopuszczenie do obrotu jest ważne na czas nieokreślony. Wskazania rejestracyjne preparatu leczniczego MabThera obejmują: chłoniaki nieziarnicze (NHL), reumatoidalne zapalenie stawów (RZS), przewlekła białaczka limfocytowa (PBL). W omawianym wskazaniu lek finansowany jest w ramach TPZ Program leczenia w ramach świadczenia chemioterapii niestandardowej 2, a także może być refundowany w ramach katalogu substancji czynnych stosowanych w chemioterapii oraz TPZ Leczenie chloniaków złośliwych 2. Efektywność kliniczna Najczęściej stosowaną immunoterapią jest immmunoterapia bierna przeciwciałami monoklonalnymi ukierunkowanymi na komórki nowotworowe. Wykazano skuteczność kliniczną przeciwciała monoklonalnego anty CD20 (rytuksymab) w postaci LP chłoniaka Hodgkina, w którym komórki Hodgkina (H) i Reed Sternberga (RS) wykazują ekspresję antygenu CD20. Ekspresja CD20 w postaciach klasycznych HL sięga 15 30% przypadków. We wszystkich badaniach włączonych do analizy efektywności klinicznej wspólnymi, głównymi punktami końcowymi były: ogólna odpowiedź na leczenie (ORR), całkowita remisja (CR), całkowita odpowiedź niepotwierdzona (CRu) oraz częściowa odpowiedź/remisja (PR). 5
6 Wyniki z zastosowania rytuksymabu w monoterapii w dawce 375 mg/m 2 przez 4 kolejne tygodnie przedstawiają poniższe badania kliniczne. W badaniu Eichenauer 2011 (Niemiecka Grupa Leczenia HL) wzięli udział pacjenci w stopniu zaawansowania IA LPHL bez czynników ryzyka w I linii leczenia. W analizie uwzględniono 28 pacjentów, mediana wieku wynosiła 40 lat. Podczas ostatniej oceny odpowiedzi na terapie, po 4 tygodniach od zakończenia leczenia rytuksymabem, 24 pacjentów wykazało CR/CRu, co stanowi 85,7%. U 4 pacjentów (14.3%) zaobserwowano częściową odpowiedź/remisję (PR), a ogólna odpowiedź ORR wyniosła 100%. Przy medianie okresu obserwacji wynoszącej 43 miesięce, wszyscy pacjenci żyli. Siedmiu pacjentów (25%) wykazało nawrót, natomiast 2 chorych rozwinęło wtórne guzy lite. Nawroty potwierdzone były biopsją i występowały w miejscach wcześniej zajętych, oprócz jednego pacjenta, który miał chorobę w II stadium. W badaniu Ekstrand 2003 uczestniczyło 22 pacjentów ze stwierdzonym LPHL uprzednio nieleczonych (12 pacjentów) oraz nawrotami choroby po wcześniej przebytych terapiach (10 pacjentów). Mediana czasu od zdiagnozowania choroby do badania dla pacjentów z nawrotem wynosiła 11,9 roku (zakres 1 33 lata), natomiast mediana długości trwania ostatniej remisji wynosiła 9 lat (zakres 0,4 27 lat). Dla pacjentów wcześniej nieleczonych mediana czasu od diagnozy do rozpoczęcia leczenia wynosiła 3 miesiące (zakres 1,8 7,5 miesiąca). Oceniono odpowiedź na leczenie u wszystkich 22 pacjentów. Wyniki punktów końcowych kształtowały się następująco: ORR wyniosło 100%, 9 pacjentów (41%) osiągnęło CR, 1 pacjent (5%) CRu, a pozostałych 12 pacjentów (54%) PR. Dla wszystkich pacjentów najlepsza odpowiedź była rejestrowana w 3 miesiące po zakończeniu leczenia. W czasie trwania badania (mediana follow up równa 13 miesięcy; zakres 3 32 miesiące) 9 pacjentów (41%) odnotowało nawrót choroby, mediana czasu do nawrotu wyniosła 9 miesięcy, w 8 przypadkach nawrót choroby pojawił się w miejscu wcześniej zajętym przez chłoniaka. Jakość odpowiedzi na rytuksymab korelowała z możliwością nawrotu. W czasie obserwacji zanotowano nawroty choroby u 2 na 10 pacjentów z CR/Cru w porównaniu do 7 na 12 w grupie PR (p=0,0686). Nie odnotowano żadnego nawrotu w okresie 6 miesięcy od zakończenia badania, zaś prawdopodobieństwo wystąpienia nawrotu choroby w okresie 10,2 miesięcy wynosiło 52% (± SE 13%). Nie stwierdzono zgonów w czasie obserwacji pacjentów, a całkowity czas przeżycia(os) w okresie obserwacji wyniósł 100%. Badanie Rehwald 2003; Schulz 2008 (z 7 letnim follow up) objęło pacjentów z LPHL po pierwszej lub kolejnej wznowie, lub w stanie progresji choroby, po co najmniej jednej przebytej terapii, gdzie przynajmniej 30% komórek guza wykazywało ekspresje antygenu CD20. Do prób klinicznych włączono 21 pacjentów z LPHL, jednakże diagnoza LPHL potwierdzona przez patologa miała miejsce w 15 przypadkach (71%), pozostali pacjenci zostali wykluczeni z oceny odpowiedzi na leczenie. Mediana czasu od pierwszej diagnozy wynosiła 12 lat (zakres 0,5 21 lat). W czasie włączania do badania mediana ilości nawrotów wynosiła 2 (zakres 1 3). U 9 z 15 pacjentów (60%) stwierdzono stadium I/II, u pozostałych 6 (40%) stadium III/IV. ORR dla 15 analizowanych pacjentów wyniósł 94% (8 CR i 6 PR). Wszystkich 5 pacjentów w stadium I/II odpowiedziało na leczenie (CR wystąpiło u 56%; PR 44%). ORR dla pacjentów w stadium III/IV wyniosło 83%, CR 55%, PR 33%. Jeden pacjent z tej grupy nie wykazał odpowiedzi na leczenie (PD). Drugą grupą pacjentów, która może odnieść korzyść z leczenia rytuksymabem, są chorzy z postacią klasyczną choroby Hodgkina (chl), w fazie oporności na leczenie przy ekspresji CD20+, także w połączeniu z cytostatykami (gemcytabina, ifosfamid, oxaliplatyna i inne). Takie zastosowanie uzasadniły wyniki przeprowadzonych badań. 6
7 W Badaniu Younes 2003 rytuksymab podawano w dawce 375 mg/m 2 raz w tygodniu przez 6 kolejnych tygodni 22 pacjentom z nawracającym lub opornym na leczenie chl po minimum dwóch wcześniejszych kursach leczenia, niezależnie od obecności CD20 na komórkach H/RS, potransplantacji szpiku lub komórek macierzystych lub niekwalifikowalnych do tych procedur, ze zmianą mierzalną i udowodnionym histologicznie chl. Do oceny skuteczności terapii włączono pacjentów z histologicznie udokumentowanym stwardnieniem guzkowatym (HL NSCHL). Mediana wieku pacjentów wyniosła 35 lat. Mediana ilości wcześniejszych terapii wynosiła 4 (zakres 2 12). 18 pacjentów (82%) przeszło przeszczep szpiku lub komórek macierzystych, natomiast 4 pozostałych pacjentów było niekwalifikowanych do tych procedur. W 9 przypadkach choroba ograniczała się do węzłów chłonnych i śledziony, a pozostałych 13 pacjentów miało zajęte węzły chłonne oraz zmiany pozawęzłowe. U 6 pacjentów wykazano ekspresję CD20 na komórkach H/RS, u 15 pacjentów nie wykryto tego antygenu, a w 1 przypadku nie udało się ustalić ekspresji CD20. Osiągnięte punkty końcowe kształtowały się następująco: ORR wyniosło 22%, 4 pacjentów (18%) wykazało PR, a jeden (4%) CR. Mediana trwania odpowiedzi wyniosła 7,8 miesiąca (zakres 3,3 14,9). U 8 pacjentów (36%) stwierdzono chorobę stabilną (SD). Gdy brano pod uwagę jedynie pacjentów CD20+, ORR wyniosło 33% (2 PR na 6 pacjentów, brak CR), natomiast u pacjentów CD20 ORR wyniosło 19% (2 PR oraz 1 CR wśród 16 pacjentów). W badaniu tym obserwowano remisje kliniczne tylko u pacjentów z chorobą ograniczoną do węzłów chłonnych i śledziony: 5 z 9 pacjentów (55%) z odpowiedziało na rytuksymab (4 PR, 1 CR, wszyscy pacjenci wykazujący odpowiedź przebyli wcześniejszą transplantację komórek), natomiast żaden z 13 pacjentów, którzy mieli zmiany pozawęzłowe, nie wykazał odpowiedzi (u 5 osób stwierdzono tylko stabilizację choroby). W badaniu Oki 2007 wzięli udział pacjenci z nawracającym lub opornym na leczenie chl po minimum dwóch wcześniejszych kursach leczenia, ze zmianą mierzalną i wskaźnikiem ECOG mniejszym lub równym 2. Rytuksymab stosowano w dawce 375 mg/m 2 raz w tygodniu, przez 6 tygodni w terapii skojarzonej z gemcytabiną podawaną w dawce 1250 mg/m 2 w 1 i 8 dniu 21 dniowego kursu. Do badania zakwalifikowano 33 pacjentów. Mediana wieku pacjentów wynosiła 32 lata (zakres lat), 9% (3 pacjentów) było w wieku powyżej 60 lat. Przed rozpoczęciem badania wszyscy mieli zdiagnozowany chl i przebyli minimum 2 cykle leczenia, mediana ilości wcześniejszych terapii wynosiła 3 (zakres 2 7). Ocena histologiczna biopsji guzów wykazała postaci mieszane (ang. mixed cellularity classica; HL MCCHL) w 2 przypadkach oraz stwardnienie guzkowe (ang. nodular sclerosis classical HL NSCHL) w 29 przypadkach, pozostałe 2 przypadki oceniono jako chl bez klasyfikacji z powodu rozległej nekrozy. U 15% pacjentów (5 przypadków) wykazano ekspresję antygenu CD20, u 82% pacjentów (27 przypadków) było CD20 negatywnych, natomiast w 1 przypadku nie udało się tego ocenić. Odpowiedź na leczenie zaobserwowano u 16 pacjentów (48%), w tym u 5 wystąpiło CR/CRu (15%) a u 11 PR (33%). Odpowiedź obserwowano zarówno u pacjentów, którzy wcześniej przeszli autologiczny przeszczep komórek macierzystych (11 z 18 pacjentów, 61%) oraz u tych, którzy tego zabiegu nie przechodzili (5 z 15 pacjentów, 33%). U pacjentów po 3 i więcej kursach leczenia ORR kształtowało się na poziomie 42% (8 z 19 pacjentów), a u leczonych 4 i więcej ORR wyniosło 57% (8 z 14 pacjentów). Odpowiedź u pacjentów CD20+ wynosiła 40% (2 z 5 pacjentów), u pacjentów z CD20 52% (14 z 27 pacjentów). Mediana czasu przeżycia wolnego od niepowodzenia leczenia (FFS) wyniosła 2,7 miesiąca (zakres 0,9 18,3 miesiąca). Długość FFS była podobna u pacjentów, którzy przeszli autologiczny przeszczep komórek macierzystych oraz u tych, którzy nie byli poddani tej procedurze (p=0,78), z medianą odpowiednio 3,6 i 2,3 miesiąca. Pacjenci odpowiadający na terapię wykazali medianę czasu trwania odpowiedzi na poziomie 3,7 miesiąca (zakres 0,4 16,9). 7
8 Przy ocenie włączonych do analizy badań klinicznych należy jednak zwrócić uwagę, iż badania te są badaniami II fazy, nie porównawczymi, jednoramiennymi, a więc nie można na ich podstawie jednoznacznie zinterpretować efektywności klinicznej ocenianej interwencji w rozpatrywanym wskazaniu. Ograniczeniem w jednoznacznej ocenie skuteczności terapii rytuksymabem są dodatkowo: mało liczne populacje włączone do badań od kilkunastu do około 50 osób; brak definicji punktów końcowych, w niektórych badaniach; dawka substancji leczniczej oraz schemat jej podawania niezoptymalizowany pod kątem leczenia chłoniaków Hodgkina; trudna do określenia homogeniczność włączonych do badań populacji; krótki okres obserwacji w badaniach, szczególnie nad pacjentami wcześniej nieleczonymi lub nowo zdiagnozowanymi; brak pełnej informacji na temat bezpieczeństwa, często przedstawianej w sposób skrótowy 2. Bezpieczeństwo stosowania Zgodnie z Charakterystyką Produktu Leczniczego 3 (CHPL), najczęstsze ciężkie działania niepożądane, typowe dla tej substancji, mogą występować na każdym etapie leczenia. Najistotniejsze z nich to: reakcje w wyniku podania najczęściej raportowane (w ChPL bardzo częste lub częste) łącznie z zespołem uwalniania cytokin i rozpadu guza u pacjentów z dużą masą guza. choroby infekcyjne, reaktywacja patogenów powikłania infekcyjne, głównie bakteryjne i wirusowe, występowały u ok % pacjentów podczas badań klinicznych prowadzonych wśród pacjentów z chłoniakami nieziarniczymi (w ChPL bardzo częste lub częste). Ryzyko większe w leczeniu podtrzymującym rytuksymabem. zaburzenia sercowe objawy dławicy piersiowej lub zaburzeń rytmu serca (w ChPL podane są jako częste, niezbyt częste i o nieznanej częstości). Na stronach internetowych EMA, FDA i URPL iznajdują się komunikaty na temat bezpieczeństwa stosowania leku dotyczące postępującej wieloogniskowej leukoencefalopatii (PML) oraz reakcji na wlew u chorych na RZS, które prowadziły do zgonów. Decyzją Komisji Europejskiej, podmiot odpowiedzialny zobowiązany został do przeprowadzenia dodatkowych ponad rutynowe działań w zakresie nadzoru nad bezpieczeństwem stosowania MabThery w zakresie monitorowania przypadków: neutropenii, PML (postępującej wieloogniskowej leukoencefalopatii), PRES (zespołu odwracalnej tylnej encefalopatii) oraz przedłużonego obniżenia poziomu komórek B, infekcji oraz reakcji na infuzję, ciąży i laktacji 2. Efektywność kosztowa Na dzień wydania rekomendacji nie odnaleziono informacji dotyczących efektywności kosztowej ocenianej interwencji w rozpatrywanym wskazaniu. Wpływ na budżet płatnika publicznego Na podstawie dostępnych danych liczbowych Departamentu Gospodarki Lekowej Narodowego Funduszu Zdrowia (NFZ) obliczono, że w 2010 r. terapia rytuksymabem w ramach terapeutycznego programu zdrowotnego świadczenia chemioterapii niestandardowej, według kodu ICD 10: C81 (wraz ze wszystkimi podpunktami) objęła 12 pacjentów, a koszty terapii wyniosły tys. PLN. W 2011 roku zakwalifikowano 6 pacjentów, których koszty leczenia oszacowano na 574 tys. PLN. 8
9 Bazując na dostępnych danych można założyć, że średnio 9 pacjentów było leczonych rocznie w ramach Terapeutycznego Programu Zdrowotnego Program leczenia w ramach świadczenia chemioterapii niestandardowej, a średnia wartość świadczeń wyniosła około 995 tys. PLN rocznie. Zatem można przypuszczać, że usunięcie świadczenia Podanie rytuksymabu w leczeniu pacjentów z chorobą Hodgkina z wykazu świadczeń gwarantowanych przyniesie oszczędność rocznie około 1 miliona PLN dla budżetu płatnika. Należy przy tym pamiętać, że powyższe szacowania kosztów w rozpatrywanej sytuacji mogą być obciążone błędem, ze względu na specyfikę zasad TPZ Program leczenia w ramach świadczenia chemioterapii niestandardowej możliwe jest, że terapia jednego pacjenta mogła być rozliczana w dwóch latach, nie jest wiadome także, na jakich etapach choroby, w jakich schematach lek był podawany i jakie były tego konsekwencje finansowe wykraczające poza rozpatrywany TPZ (np. pacjent przyjął rytuksymab zamiast innej interwencji). Ponadto, zgodnie z obowiązującymi zasadami raportowania przez świadczeniodawców do NFZ wykonanych świadczeń, podmioty te mogą wprowadzić zmiany w przekazane dane do 5 lat po ich sprawozdaniu 2. Omówienie rekomendacji wydawanych w innych krajach w odniesieniu do ocenianej technologii National Comprehensive Cancer Network (NCCN), 2012 Rytuksymab w monoterapii lub w skojarzeniu z chemioterapią jest rekomendowany w leczeniu pacjentów z LPHL (ang. Lymphocyte Predominant Hodgkin Lymphoma chłoniak Hodgkina z przewagą limfocytów) w stadium IB, IIB, III i IV choroby. Rytuksymab (±radioterapia) może być stosowany na wszystkich etapach leczenia LPHL, tj. zarówno w terapii inicjującej, jak i w leczeniu choroby nawrotowej. Dopuszczalne jest jego stosowanie w monoterapii lub w skojarzeniu z najczęściej stosowanymi schematami chemioterapii: ABVD (adriamycyna, bleomycyna, winblastyna, dakarbazyna); CHOP (cyklofosfamid, doksorubicyna, winkrystyna, prednizon); CVP (cyklofosfamid, tenipozyd, prednizon); EPOCH (cyklofosfamid, doksorubicyna, etopozyd, winkrystyna, prednizon). U pacjentów z LPHL, u których wcześniej stosowano rytuksymab w monoterapii, należy rozważyć podtrzymanie rytuksymabem przez okres 2 lat. European Society for Medical Oncology (ESMO), 2011 W przypadku nawrotowego LPHL zaleca się stosowanie rytuksymabu w monoterapii. Pacjenci z nawrotowym LPHL powinni otrzymywać bardziej agresywne leczenie możliwie skojarzone z rytuksymabem. 2 Podstawa przygotowania rekomendacji Rekomendacja Prezesa Agencji w przedmiocie usunięcia lub dokonania zmiany sposobu finansowania świadczenia opieki zdrowotnej Podanie rytuksymabu w leczeniu pacjentów z chorobą Hodgkina realizowanego w ramach programu chemioterapii niestandardowej została przygotowana na podstawie zlecenia Ministra Zdrowia z dnia 5 grudnia 2011 r. (znak pismamz PLA /GB/11) zgodnie z art. 31e ust. 2, ustawy o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych z dnia 27 sierpnia 9
10 2004 r. (Dz. U. z 2008 r., Nr 164, poz z późn. zm.), oraz w nawiązaniu do pisma z dnia 5 marca 2012 r. (znak pisma: MZ PLA /GB/12) w sprawie ustalenia terminu wydania rekomendacji. Piśmiennictwo 1. Stanowisko Rady Przejrzystości nr 27/2012 z dnia 28 maja 2012 r. w sprawie zasadności usunięcia z wykazu świadczeń gwarantowanych realizowanych w ramach programu chemioterapii niestandardowej lub dokonania zmiany sposobu finansowania świadczenia opieki zdrowotnej Podanie rytuksymabu w leczeniu choroby Hodgkina. 2. Raport AOTM OT /2011 Leczenie choroby Hodgkina przy wykorzystaniu produktu leczniczego MabThera (rytuksymab). 3. Charakterystyka Produktu Leczniczego.. 10
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 27/2012 z dnia 28 maja 2012 r. w sprawie zasadności usunięcia z wykazu świadczeń gwarantowanych realizowanych
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 27/2012 z dnia 28 maja 2012 r. w sprawie zasadności usunięcia z wykazu świadczeń gwarantowanych realizowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 33/2012 z dnia 18 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany jego poziomu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 33/2012 z dnia 18 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany jego poziomu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 9/2012 z dnia 27 lutego 2012 w zakresie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie chłoniaków
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 9/2012 z dnia 27 lutego 2012 w zakresie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie chłoniaków
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 38/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 38/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych
 Rekomendacja nr 25/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 18 czerwca 2012 r. w sprawie usunięcia albo dokonania zmiany poziomu lub sposobu finansowania świadczenia opieki zdrowotnej:
Rekomendacja nr 25/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 18 czerwca 2012 r. w sprawie usunięcia albo dokonania zmiany poziomu lub sposobu finansowania świadczenia opieki zdrowotnej:
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 155/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 155/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Rekomendacja nr 24/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 18 czerwca 2012 r. w sprawie usunięcia albo dokonania zmiany poziomu lub sposobu finansowania świadczenia opieki zdrowotnej:
Rekomendacja nr 24/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 18 czerwca 2012 r. w sprawie usunięcia albo dokonania zmiany poziomu lub sposobu finansowania świadczenia opieki zdrowotnej:
NON-HODGKIN S LYMPHOMA
 NON-HODGKIN S LYMPHOMA Klinika Hematologii, Nowotworów Krwi i Transplantacji Szpiku We Wrocławiu Aleksandra Bogucka-Fedorczuk DEFINICJA Chłoniaki Non-Hodgkin (NHL) to heterogeniczna grupa nowotworów charakteryzująca
NON-HODGKIN S LYMPHOMA Klinika Hematologii, Nowotworów Krwi i Transplantacji Szpiku We Wrocławiu Aleksandra Bogucka-Fedorczuk DEFINICJA Chłoniaki Non-Hodgkin (NHL) to heterogeniczna grupa nowotworów charakteryzująca
Leczenie choroby Hodgkina przy wykorzystaniu produktu leczniczego MabThera (rytuksymab)
 Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Leczenie choroby Hodgkina przy wykorzystaniu produktu leczniczego MabThera Raport ws. oceny świadczenia opieki zdrowotnej Raport
Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Leczenie choroby Hodgkina przy wykorzystaniu produktu leczniczego MabThera Raport ws. oceny świadczenia opieki zdrowotnej Raport
CHŁONIAKI ZŁOŚLIWE U DZIECI
 Prof. dr hab.med. Jacek Wachowiak CHŁONIAKI ZŁOŚLIWE PODZIAŁ CHŁONIAKI ZŁOŚLIWE 1. CHŁONIAKI NIEZIARNICZE 2. CHOROBA HODGKINA (ZIARNICA ZŁOŚLIWA) EPIDEMIOLOGIA - OK. 10% NOWOTWORÓW Klinika Onkologii, Hematologii
Prof. dr hab.med. Jacek Wachowiak CHŁONIAKI ZŁOŚLIWE PODZIAŁ CHŁONIAKI ZŁOŚLIWE 1. CHŁONIAKI NIEZIARNICZE 2. CHOROBA HODGKINA (ZIARNICA ZŁOŚLIWA) EPIDEMIOLOGIA - OK. 10% NOWOTWORÓW Klinika Onkologii, Hematologii
Białaczka limfatyczna
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 20/2014 z dnia 20 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie winorelbiny w rozpoznaniach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 20/2014 z dnia 20 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie winorelbiny w rozpoznaniach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 42/2014 z dnia 28 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie bendamustyny w rozpoznaniu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 42/2014 z dnia 28 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie bendamustyny w rozpoznaniu
Chłoniak Hodgkina. Agnieszka Szeremet Klinika Hematologii, Nowotworów Krwi, Transplantacji Szpiku Wrocław
 Chłoniak Hodgkina Agnieszka Szeremet Klinika Hematologii, Nowotworów Krwi, Transplantacji Szpiku Wrocław 2018-10-01 Hodgkin Lymphoma Agnieszka Szeremet Klinika Hematologii, Nowotworów Krwi, Transplantacji
Chłoniak Hodgkina Agnieszka Szeremet Klinika Hematologii, Nowotworów Krwi, Transplantacji Szpiku Wrocław 2018-10-01 Hodgkin Lymphoma Agnieszka Szeremet Klinika Hematologii, Nowotworów Krwi, Transplantacji
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 Nazwa programu: Terapeutyczne Programy Zdrowotne 2009 Załącznik nr 10 do zarządzenia Nr 98/2008/DGL Prezesa NFZ z dnia 27 października 2008 roku LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Nazwa programu: Terapeutyczne Programy Zdrowotne 2009 Załącznik nr 10 do zarządzenia Nr 98/2008/DGL Prezesa NFZ z dnia 27 października 2008 roku LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 156/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 156/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 załącznik nr 10 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chloniak grudkowy C 83 chłoniaki nieziarniczy rozlane Dziedzina
załącznik nr 10 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chloniak grudkowy C 83 chłoniaki nieziarniczy rozlane Dziedzina
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 162/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 162/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Nowe możliwości leczenia ostrej białaczki limfoblastycznej
 Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
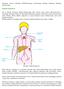
Rysunek. Układ limfatyczny.
 Informacja dotyczy chłoniaka grudkowego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu odpornościowego
Informacja dotyczy chłoniaka grudkowego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu odpornościowego
Terapeutyczne Programy Zdrowotne 2012 Leczenie glejaków mózgu Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r.
 Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
Limfocyty powstają w szpiku kostnym, czyli tam gdzie powstają wszystkie komórki krwi. Występują
 Informacja dotyczy chłoniaka śródpiersia z dużych komórek B, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Informacja dotyczy chłoniaka śródpiersia z dużych komórek B, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 268/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie nelarabiny w rozpoznaniach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 268/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie nelarabiny w rozpoznaniach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 138/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 138/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Rysunek. Układ limfatyczny.
 Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
MAM HAKA NA CHŁONIAKA
 MAM HAKA NA CHŁONIAKA CHARAKTERYSTYKA OGÓLNA Chłoniaki są to choroby nowotworowe, w których następuje nieprawidłowy wzrost komórek układu limfatycznego (chłonnego). Podobnie jak inne nowotwory, chłoniaki
MAM HAKA NA CHŁONIAKA CHARAKTERYSTYKA OGÓLNA Chłoniaki są to choroby nowotworowe, w których następuje nieprawidłowy wzrost komórek układu limfatycznego (chłonnego). Podobnie jak inne nowotwory, chłoniaki
Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008.
 załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0)
 Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Rysunek. Układ limfatyczny.
 Poniższa informacja dotyczy rodzaju chłoniaka nieziarniczego, zwanego chłoniakiem anaplastycznym z dużych komórek. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest
Poniższa informacja dotyczy rodzaju chłoniaka nieziarniczego, zwanego chłoniakiem anaplastycznym z dużych komórek. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 163/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 163/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie?
 Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 76/2014 z dnia 25 lutego 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie interferonu-alfa-2a w
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 76/2014 z dnia 25 lutego 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie interferonu-alfa-2a w
Rysunek. Układ Limfatyczny.
 Informacja dotyczy chłoniaka rozlanego z dużych komórek B, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu
Informacja dotyczy chłoniaka rozlanego z dużych komórek B, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 150/2013 z dnia 5 sierpnia 2013 r. w sprawie oceny leku Adcetris (brentuksymab vedotin), EAN: 5909991004545 we
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 150/2013 z dnia 5 sierpnia 2013 r. w sprawie oceny leku Adcetris (brentuksymab vedotin), EAN: 5909991004545 we
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Ulotka dołączona do opakowania: informacja dla użytkownika. Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 161/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 161/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
S T R E S Z C Z E N I E
 STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego.
 Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu odpornościowego
Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu odpornościowego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 73/2012 z dnia 24 września 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 73/2012 z dnia 24 września 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 87/2014 z dnia 24 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 87/2014 z dnia 24 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32.a. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE
Załącznik B.32.a. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE
WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI
 WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI Elżbieta Adamkiewicz-Drożyńska Katedra i Klinika Pediatrii, Hematologii i Onkologii Początki choroby nowotworowej u dzieci Kumulacja wielu zmian genetycznych
WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI Elżbieta Adamkiewicz-Drożyńska Katedra i Klinika Pediatrii, Hematologii i Onkologii Początki choroby nowotworowej u dzieci Kumulacja wielu zmian genetycznych
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Chłoniak z obwodowych komórek T może wystąpić w każdym wieku, najczęściej jednak pojawia się u osób dorosłych, zarówno kobiet jak i mężczyzn.
 Informacja dotyczy chłoniaka z obwodowych komórek T bliżej nieokreślonego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi
Informacja dotyczy chłoniaka z obwodowych komórek T bliżej nieokreślonego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi
Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego.
 Chłoniak z komórek płaszcza Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego,
Chłoniak z komórek płaszcza Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 204/2014 z dnia 25 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 204/2014 z dnia 25 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
ostrym reumatoidalnym zapaleniem stawów (choroba powodująca stan zapalny stawów), gdzie produkt MabThera podaje się dożylnie z metotreksatem;
 EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Hematoonkologia w liczbach. Dr n med. Urszula Wojciechowska
 Hematoonkologia w liczbach Dr n med. Urszula Wojciechowska Nowotwory hematologiczne wg Międzynarodowej Statystycznej Klasyfikacji Chorób i Problemów Zdrowotnych (rew 10) C81 -Chłoniak Hodkina C82-C85+C96
Hematoonkologia w liczbach Dr n med. Urszula Wojciechowska Nowotwory hematologiczne wg Międzynarodowej Statystycznej Klasyfikacji Chorób i Problemów Zdrowotnych (rew 10) C81 -Chłoniak Hodkina C82-C85+C96
BENDAMUSTINUM HYDROCHLORIDUM
 Dziennik Urzędowy Ministra Zdrowia 1499 Poz. 71 Załącznik C.67. BENDAMUSTINUM HYDROCHLORIDUM 1. BENDAMUSTINUM HYDROCHLORIDUM C81 2. BENDAMUSTINUM HYDROCHLORIDUM C81.0 3. BENDAMUSTINUM HYDROCHLORIDUM C81.1
Dziennik Urzędowy Ministra Zdrowia 1499 Poz. 71 Załącznik C.67. BENDAMUSTINUM HYDROCHLORIDUM 1. BENDAMUSTINUM HYDROCHLORIDUM C81 2. BENDAMUSTINUM HYDROCHLORIDUM C81.0 3. BENDAMUSTINUM HYDROCHLORIDUM C81.1
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 154/2013 z dnia 28 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 154/2013 z dnia 28 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Rysunek. Układ limfatyczny.
 Informacja dotyczy chłoniaka limfoblastycznego stanowiącego odmianę złośliwego chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Informacja dotyczy chłoniaka limfoblastycznego stanowiącego odmianę złośliwego chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
VII. ŚWIADCZENIA MEDYCYNY NUKLEARNEJ. LP. Nazwa świadczenia gwarantowanego Warunki realizacji świadczeń
 VII. ŚWIADCZENIA MEDYCYNY NUKLEARNEJ LP. Nazwa świadczenia gwarantowanego Warunki realizacji świadczeń 1. Scyntygrafia i radioizotopowe badanie czynnościowe tarczycy 1) gamma kamera planarna lub scyntygraf;
VII. ŚWIADCZENIA MEDYCYNY NUKLEARNEJ LP. Nazwa świadczenia gwarantowanego Warunki realizacji świadczeń 1. Scyntygrafia i radioizotopowe badanie czynnościowe tarczycy 1) gamma kamera planarna lub scyntygraf;
LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0)
 Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0) ŚWIADCZENIOBIORCY Kwalifikacja do programu A. Kryteria kwalifikacji do leczenia ustekinumabem w ramach programu 1.Do programu
Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0) ŚWIADCZENIOBIORCY Kwalifikacja do programu A. Kryteria kwalifikacji do leczenia ustekinumabem w ramach programu 1.Do programu
Efektywna kontrola chorych po leczeniu nowotworów jąder
 Efektywna kontrola chorych po leczeniu nowotworów jąder Marzena Wełnicka-Jaśkiewicz Klinika Onkologii i Radioterapii Gdańskiego Uniwersytetu Medycznego Efektywna kontrola ścisła obserwacja po leczeniu
Efektywna kontrola chorych po leczeniu nowotworów jąder Marzena Wełnicka-Jaśkiewicz Klinika Onkologii i Radioterapii Gdańskiego Uniwersytetu Medycznego Efektywna kontrola ścisła obserwacja po leczeniu
Postępowanie diagnostyczno terapeutyczne u pacjentów z HL po ASCT
 Postępowanie diagnostyczno terapeutyczne u pacjentów z HL po ASCT RAPORT Z BADANIA DLA FIRMY TAKEDA Sierpień 2018 Spis treści Cele badania 3 Metodologia badania 4 Wyniki badania 5 1. Potencjał lekarza
Postępowanie diagnostyczno terapeutyczne u pacjentów z HL po ASCT RAPORT Z BADANIA DLA FIRMY TAKEDA Sierpień 2018 Spis treści Cele badania 3 Metodologia badania 4 Wyniki badania 5 1. Potencjał lekarza
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego. Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa
 Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011
 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki,
Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki,
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Przewlekła białaczka
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Przewlekła białaczka
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 7/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 27 lutego 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 7/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 27 lutego 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo
Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych
 Karolina Klara Radomska Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych Streszczenie Wstęp Ostre białaczki szpikowe (Acute Myeloid Leukemia, AML) to grupa nowotworów mieloidalnych,
Karolina Klara Radomska Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych Streszczenie Wstęp Ostre białaczki szpikowe (Acute Myeloid Leukemia, AML) to grupa nowotworów mieloidalnych,
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Nowotwory złośliwe skóry. Katedra Onkologii AM w Poznaniu
 Nowotwory złośliwe skóry Katedra Onkologii AM w Poznaniu Nowotwory złośliwe skóry Raki: rak podstawnokomórkowy rak kolczystokomórkowy rak płakonabłonkowy Czerniak Nowotwory złośliwe skóryrak podstawnokomórkowy
Nowotwory złośliwe skóry Katedra Onkologii AM w Poznaniu Nowotwory złośliwe skóry Raki: rak podstawnokomórkowy rak kolczystokomórkowy rak płakonabłonkowy Czerniak Nowotwory złośliwe skóryrak podstawnokomórkowy
LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45)
 Dziennik Urzędowy Ministra Zdrowia 615 Poz. 27 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
Dziennik Urzędowy Ministra Zdrowia 615 Poz. 27 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 181/2012 z dnia 13 sierpnia 2012 r. w sprawie objęcia refundacją produktów leczniczych zawierających temozolomid,
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 181/2012 z dnia 13 sierpnia 2012 r. w sprawie objęcia refundacją produktów leczniczych zawierających temozolomid,
czerniak (nowotwór skóry), który rozprzestrzenił się lub którego nie można usunąć chirurgicznie;
 EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 191/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 191/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Warszawa, 16-17.03.201217.03.2012 PLRG / PALG 16-17.03.2012
 Przegląd badań klinicznych PLRG Konferencja PLRG i PALG Warszawa, 16-17.03.201217.03.2012 Janusz Szczepanik CRO Quantum Satis 1 Badania kliniczne PLRG PLRG R-CVP/CHOP (PLRG4) HOVON 68 CLL Watch and Wait
Przegląd badań klinicznych PLRG Konferencja PLRG i PALG Warszawa, 16-17.03.201217.03.2012 Janusz Szczepanik CRO Quantum Satis 1 Badania kliniczne PLRG PLRG R-CVP/CHOP (PLRG4) HOVON 68 CLL Watch and Wait
LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0)
 Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA
 ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia
 Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
STRESZCZENIE Wstęp: Celem pracy Materiały i metody:
 STRESZCZENIE Wstęp: Dzięki poprawie wyników leczenia przeciwnowotworowego u dzieci i młodzieży systematycznie wzrasta liczba osób wyleczonych z choroby nowotworowej. Leczenie onkologiczne nie jest wybiórcze
STRESZCZENIE Wstęp: Dzięki poprawie wyników leczenia przeciwnowotworowego u dzieci i młodzieży systematycznie wzrasta liczba osób wyleczonych z choroby nowotworowej. Leczenie onkologiczne nie jest wybiórcze
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r.
 Dziennik Ustaw Nr 269 15678 Poz. 1593 1593 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na podstawie
Dziennik Ustaw Nr 269 15678 Poz. 1593 1593 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na podstawie
LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0)
 Załącznik B.22. LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0) WIADCZENIOBIORCY Kwalifikacji świadczeniobiorców do terapii dokonuje Zespół Koordynacyjny ds. Chorób Ultrarzadkich powoływany przez Prezesa Narodowego
Załącznik B.22. LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0) WIADCZENIOBIORCY Kwalifikacji świadczeniobiorców do terapii dokonuje Zespół Koordynacyjny ds. Chorób Ultrarzadkich powoływany przez Prezesa Narodowego
Wydłużenie życia chorych z rakiem płuca - nowe możliwości
 Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Terapeutyczne Programy Zdrowotne 2010 Leczenie raka nerki Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku
 Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
typ 3, sporadyczny; Techniki Obrazowe
 Guz neuroendokrynny żołądka typ 3, sporadyczny; Techniki Obrazowe Mariusz I.Furmanek CSK MSWiA i CMKP Warszawa Ocena wyjściowa, metody strukturalne WHO 2 (rak wysoko zróżnicowany); Endoskopia i/lub EUS;
Guz neuroendokrynny żołądka typ 3, sporadyczny; Techniki Obrazowe Mariusz I.Furmanek CSK MSWiA i CMKP Warszawa Ocena wyjściowa, metody strukturalne WHO 2 (rak wysoko zróżnicowany); Endoskopia i/lub EUS;
LECZENIE RAKA PIERSI ICD-10 C
 załącznik nr 5 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE RAKA PIERSI ICD-10 C 50 nowotwór złośliwy sutka Dziedzina medycyny: onkologia kliniczna I. Cel
załącznik nr 5 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE RAKA PIERSI ICD-10 C 50 nowotwór złośliwy sutka Dziedzina medycyny: onkologia kliniczna I. Cel
