1. Wprowadzenie teoretyczne Co to jest elektroforeza Parametry elektryczne Podstawowe informacje na temat białek...
|
|
|
- Sabina Duda
- 7 lat temu
- Przeglądów:
Transkrypt
1 ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM Spis treści 1. Wprowadzenie teoretyczne Co to jest elektroforeza Parametry elektryczne Podstawowe informacje na temat białek Rodzaje nośników elektroforetycznych Przykładowe obrazy żeli PAGE Układ doświadczalny Opis aparatury do elektroforezy Odczynniki zużywalne Materiały zużywalne Sprzęt laboratoryjny Wykonanie elektroforezy: Przygotowanie odczynników do elektroforezy Przygotowanie żelu dolnego Przygotowanie żelu górnego Przygotowanie buforu do próbek Przygotowanie próbek Montowanie zestawu do elektroforezy Wykonanie rozdziału elektroforetycznego białek Barwienie żel poliakrylamidowych azotanem srebra Materiały zużywalne Odczynniki zużywalne Sprzęt laboratoryjny Naczynia laboratoryjne Wykonanie barwienia Problemy-rozwiązywanie przy barwieniu azotanem srebra Barwienie żeli poliakrylamidowych Coomassie Blue Materiały zużywalne Odczynniki zużywalne Sprzęt laboratoryjny Naczynia laboratoryjne Wykonanie barwienia Załączniki Literatura Strona 1
2 Spis ilustracji Rysunek 1: Budowa i stopień jonizacji aminokwasu w zależności od ph roztworu. Źródło: 3 Rysunek 2. Przykład elektroforezy białek osocza w żelu poliakrylamidowym (PAGE-SDS). Żele barwione metoda srebrową... 4 Rysunek 3. Zestaw do elektroforezy wertykalnej (Bio-Rad, Mini-PROTEAN Tetra Cell Systems) Rysunek 4 Kasetka z komory do umieszczania żeli Rysunek 5. Elementy stojaka do wylewania żeli na płytkach do elektroforezy Rysunek 6. Zasilacz do zestawu do elektroforezy Rysunek 7. Schemat żelu do elektroforezy (1)... 8 Rysunek 8. Schemat numerowania studzienek w żelu Wprowadzenie teoretyczne 1.1. Co to jest elektroforeza Terminem elektroforeza określa się zjawisko migracji cząstek lub cząsteczek w polu elektrycznym w zależności od posiadanego ładunku. Elektroforeza jako technika rozdzielania substancji została zainicjowana przez Arne Tiseliusa w 1937 roku. Po umieszczeniu w rurce między roztworem buforów mieszaniny białek surowicy i po przyłożeniu pola elektrycznego zaobserwował, że składniki próbki migrują w kierunku i z szybkością jaka zależała od ich ładunku oraz właściwości jakie nazwał ruchliwością. Za tę pracę A. Tiselius dostał nagrodę Nobla w 1948 roku z Chemii "for his research on electrophoresis and adsorption analysis, especially for his discoveries concerning the complex nature of the serum proteins". Na cząstkę o ładunku elektrycznym q znajdującą się w polu elektrycznym o natężeniu E działa siła. Siła ta powoduje ruch cząstki (zgodnie z II ZDN jednostajnie przyspieszony). Jednak ruchowi temu przeciwdziała siła lepkości środowiska (oporu), która dla cząstki kulistej może być opisana wzorem Stokesa:. W związku z tym, po chwili cząstka zaczyna poruszać się ruchem jednostajnym z prędkością. W praktyce laboratoryjnej stosuje się jednak zazwyczaj wielkość zwaną ruchliwością elektroforetyczną U, tj. Łatwo zauważyć, iż ruch cząsteczki zależy od parametrów środowiska oraz parametrów cząsteczki. Do parametrów środowiska zaliczamy: różnicę potencjałów, natężenie prądu, ph środowiska, temperaturę oraz przewodnictwo i lepkość roztworu. Najczęściej podczas elektroforezy staramy się zachować je wszystkie stałe. Wówczas ruch cząsteczki zależy tylko od jej ładunku oraz jej rozmiaru i geometrii, a także masy (w przypadku elektroforezy żelowej). Elektroforezę możemy podzielić ze względu na: - rodzaj nośnika (np. bibułowa, żelowa, gradientowa, kapilarna) - rodzaj stosowanego prądu (np. pulsacyjna, stałonapięciowa) - ze względu na rozdzielny materiał (związki drobnocząsteczkowe: aminy, amidy, barwniki, makromolekuły: białka, RNA, DNA). Dokładny opis i przykłady zastosowań znajdują się w materiałach uzupełniających [1]. W naszym doświadczeniu będziemy wykonywać elektroforezę białek w żelu poliakrylamidowym przy stałym napięciu Parametry elektryczne Zjawisko elektroforezy zachodzi dzięki obecności pola elektrycznego. Siła, z jaką pole to oddziałuje na ładunek elektryczny jonu jest proporcjonalna do natężenia tego pola (E [V/m]), a ta Strona 2
3 wielkość jest z kolei proporcjonalna do napięcia U [V] przyłożonego do elektrod. W zakresie niskich sił jonowych istnieje prosta relacja wynikająca z prawa Ohma regulująca zależność pomiędzy przyłożonym napięciem U, a płynącym w wyniku tego prądem I [A] oraz oporem elektrycznym (rezystancją) R [Ω] elektrolitu: V = I R. Podczas przepływu prądu elektrycznego, w wyniku wykonywania pracy przeniesienia ładunku elektrycznego przez pole, na opornościach obwodu tracona jest moc P [W]. Pracy tej towarzyszy wydzielanie się ciepła, zwanego ciepłem Joule'a. Ilość wydzielonego ciepła Q [J] można obliczyć korzystając z równania: Q = U I t. Oczywiście ciepło to jest wydzielane na wszystkich oporach obwodu, ale największy udział w tym zjawisku posiada elektrolit. Zasilacze stosowane do elektroforezy zwykle mogą utrzymywać stałą wartość jednego z parametrów: prądu I, napięcia U lub mocy P. Dla pozostałych parametrów ustala się tylko górny limit wartości. W ciągu trwania elektroforezy oporność elektrolitu ulega zmianom - zwykle obniża się ze wzrostem temperatury wynikającym z ciepła Joule'a. W zależności od składu elektrolitu oraz wyboru stabilizowanego parametru obserwuje się wzrost lub spadek ilości wydzielanego ciepła. I tak przy stałym prądzie wzrasta oporność układu i wraz z tym wzrasta ilość wydzielanego ciepła. Układ wymaga aktywnego odprowadzania ciepła. Z drugiej strony, gdy stabilizowane jest napięcie, ze wzrostem oporu następuje ograniczenie prądu, a w ślad za tym spadek ilości oddawanego ciepła. Układ nie wymaga termostatowania, ale znacznie wydłuża się czas trwania elektroforezy Podstawowe informacje na temat białek Białka są podstawowym składnikiem organizmów żywych i pełnią role budulcową oraz funkcjonalną. Sa one zbudowane z aminokwasów połączonych ze sobą wiązaniami peptydowymi. Pojedynczy aminokwas jest zbudowany z grupy karboksylowej, aminowej, atomów wodoru oraz charakterystycznej dla danego aminokwasu grupy R, zwanej łańcuchem bocznym. Wszystkie powyższe wiążą się kowalencyjnie z pierwszym atomem węgla, określanym jako węgiel (alfa). Ze względu na obecność grupy aminowej i karboksylowej w roztworze o ph obojętnym aminokwasy występują zazwyczaj w formie zjonizowanej, jako jony obojnacze - amfolity (grupa aminowa NH 3 + oraz karboksylowa COO - ). Stan ten można regulować poprzez zmianę ph następuje wtedy zmiana jonizacji cząsteczki. Rysunek 1: Budowa i stopień jonizacji aminokwasu w zależności od ph roztworu. Źródło: Znanych jest 22 aminokwasów, których łańcuchy boczne różnią się budową, ładunkiem elektrycznym, zdolnością do tworzenia wiązań wodorowych oraz reaktywnością chemiczną. Każde białko, ze względu na liczbę i rodzaj aminokwasów, z których jest zbudowane, posiada określoną masę, ładunek oraz kształt, tzw. strukturę 2-go i 3-cio rzędową Rodzaje nośników elektroforetycznych Rozdziały elektroforetyczne mogą być prowadzone bezpośrednio w objętości elektrolitu, lub w nośniku elektroforetycznym wypełnionym odpowiednim elektrolitem. W tym drugim przypadku nośnik elektroforetyczny (bibuła filtracyjna, octan celulozy, agaroza, skrobia, krzemionka, Strona 3
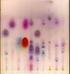
4 poliakrylamid i inne) nie tylko stabilizuje elektrolit (m.in. poprzez tłumienie prądów konwekcyjnych), ale często przyczynia się do lepszej separacji makrocząsteczek; efekt sita molekularnego - cząsteczki, których rozmiary są małe w porównaniu z porami żelu łatwo w nim wędrują, natomiast cząsteczki znacznie większe od porów są prawie nieruchome. W tym celu stosuje się porowate nośniki takie jak: agaroza i poliakrylamid (PAGE). Nośniki te są chemicznie obojętnie i łatwo się je otrzymuje poprzez polimeryzację (poliakrylamid) lub żelifikację). Do przeprowadzenia rozdziału elektroforetycznego białek ze względu na masę cząsteczkową (a nie łądunek), stosuje się elektroforezę w żelu poliakrylamidowym w warunkach denaturujących. W tym celu mieszaninę białek rozpuszcza się w roztworze dodecylosiarczanu sodu (SDS). Aniony tego detergentu wiążą się w stałych proporcjach z łańcuchami głównymi białka nadając powstałemu kompleksowi duży ujemny ładunek wypadkowy proporcjonalny do masy białka i zazwyczaj znacznie większy niż ładunek natywnego białka, który staje się tym samym nieistotny Przykładowe obrazy żeli PAGE Rysunek 2. Przykład elektroforezy białek osocza w żelu poliakrylamidowym (PAGE-SDS). Żele barwione metoda srebrową A. żel 8%; B. żel 15%; C. żel 8%; D. żel 10% A, B. Ścieżki 1,10 standard białek (Precision Plus Protein Dual Color Standards (Bio-Rad) -2µl A,B. Ścieżki 2-8 przedstawiają rozdział elektroforetyczny białek ludzkiego osocza rozcieńczonego w PBS-ie w stosunku 1:10, 1:20, 1:40, 1:50, 1:80, 1:100 i 1:120 (nałożone w następującej kolejności rozpoczynając od 2 studzienki), natomiast ścieżka 9 przedstawia rozdział mieszaniny Albumina-Inhibitor trypsyny-pbs (stosunek 1:1:2). C,D. Ścieżki 1,8- standard białek (Precision Plus Protein Dual Color Standards (Bio-Rad) -2µl C,D. Ścieżki 2-5 przedstawiają rozdział elektroforetyczny białek ludzkiego osocza rozcieńczonego w PBS-ie w stosunku 1:10, 1:80, 1:100 i 1:150 (nałożone w następującej kolejności rozpoczynając od 2 studzienki). A,B,C,D. Próbki nakładano w objętości 20µl na dołek (10µl rozcieńczonego osocza+10µl buforu do próbek) Strona 4
5 2. Układ doświadczalny 2.1. Opis aparatury do elektroforezy Rysunek 3. Zestaw do elektroforezy wertykalnej (Bio-Rad, Mini-PROTEAN Tetra Cell Systems). 1. Komora do przeprowadzania rozdziału elektroforetycznego wraz z kablami zasilającymi, 2. Grzebienie, które służą do utworzenia dołków w żelu poliakrylamidowym, 3. Płytki podstawowe z przerwą 1mm, 4. Płytki nakrywkowe, 5. Przegrody ułatwiające wprowadzanie białek do studzienek, 6. Stojak i okienka do przygotowywania żeli. Przed wykonaniem żeli, szkiełka należy dokładnie umyć w wodzie z detergentem i odtłuścić alkoholem (70% etanol). W okienkach (6) umieszcza się założone na siebie płytkę podstawową i nakrywkową (płytka podstawowa znajduje się od strony stojaka, natomiast przed nią znajduje się płytka nakrywkowa). W celu eliminacji ryzyka wypłynięcia żelu, okienka montuje się na stole, tak aby dolne krawędzie płytek równo stykały się z powierzchnią stołu. Dociska się je poprzez otwarcie okienka jak na rysunku poniżej. Całość montuje się na stojaku na gumowych paseczkach, zapobiegającym wypływaniu żelu. W tak ustawionym układnie można rozpocząć przygotowanie żeli. Przed przystąpieniem do montowania aparatu i przygotowania żeli zalecane jest obejrzenie filmu edukacyjnego [2]. Rysunek 4. Elementy stojaka do wylewania żeli na płytkach do elektroforezy. Po lewej stronie przedstawiono okienko do umieszczania płytek. Po prawej stronie znajduje się dwustanowiskowy stojak do przygotowywania żeli. Strona 5
6 W komorze do rozdziału elektroforetycznego warto wyróżnić dwie kasetki do montowania żeli (Rysunek 5). Płytki z żelem umieszcza się w szczelinie pomiędzy białym wnętrzem a zielonymi, ruchomymi elementami. Rysunek 5. Kasetka z komory do umieszczania żeli. Po lewej stronie znajduje się przykład kasetki zamkniętej, po prawej otwartej. Całość zestawu zasilana jest przy pomocy zasilacza, którego obsługa jest bardzo intuicyjna. Rysunek 4. Zasilacz do zestawu do elektroforezy Odczynniki zużywalne 1. Woda destylowana 2. Woda demineralizowana 3. 96% Alkohol etylowy skażony (Linegal Chemicals, nr kat. LL-00012) 4. 40% Akrylamid (Bio-Rad, nr kat ) 5. 2% Bisakrylamid (Bio-Rad, nr kat ) 6. 10% SDS (Bio-Rad, nr kat ) 7. TEMED (Bio-Rad, nr kat ) 8. 10% Nadsiarczan amonu (APS) (Bio-Rad, nr kat ) 9. 1,5 M Bufor Tris-HCl, ph 8,8 (Bio-Rad, nr kat ) 10. 0,5 M Bufor Tris-HCl, ph 6,8 (Bio-Rad, nr kat ) 11. Laemmli bufor obciążający do próbek (Bio-Rad, nr kat ) Bufor obciążający do próbek zawiera 65.8 mm Tris-HCl (ph 6.8), 2.1% SDS, 26.3% (w/v) glicerol, 0.01% błękit bromofenolowy 12. β-merkaptoetanol (Bio-Rad, nr kat ) Strona 6
7 13. Bufor do elektroforezy - 10x Tris/Glycine/SDS (Bio-Rad, nr kat ) Bufor do elektroforezy po 10-krotnym rozcieńczeniu w wodzie demineralizowanej zawiera 25 mm Tris, 192 mm glicynę i 0,1% SDS. ph buforu wynosi Standard masowy białek (tzw. drabinka) - Precision Plus Protein Dual Color Standards (Bio-Rad, nr kat ) 15. Lodowaty kwas octowy 2.3. Materiały zużywalne 1. Końcówki do pipet automatycznych o objętości 10µl, 200µl, 1000µl, 5ml 2. Probówki typu Falcon o objętości 50ml 3. Eppendorfy o objętości 1,5ml 2.4. Sprzęt laboratoryjny 1. Pipety automatyczne na 10µl, 200µl, 1000µl, 5ml 2. Worteks 3. Wytrząsarka 4. Waga elektroniczna UWAGA! Poliakrylamid w postaci ciekłej jest substancją neurotoksyczną dlatego należy zachować odpowiednie warunki bezpieczeństwa. Przed przygotowaniem roztworów należy ubrać fartuch laboratoryjny, rękawiczki gumowe oraz okulary laboratoryjne a cała procedura powinna być wykonana pod dygestorium 3. Wykonanie elektroforezy: 3.1. Przygotowanie odczynników do elektroforezy 1. Obejrzyj firm edukacyjny [2] 2. Na wadze analitycznej odważ 0,1 g APS, a następnie rozpuść go w 1ml wody demineralizowanej. 3. W celu uzyskania 30ml 30% roztworu akrylamidu mix, pod dygestorium wymieszaj 22,5ml 40% akrylamidu i 7,5ml 2% bisakrylamidu. 4. Tab.1. Skład żelu rozdzielającego 8% i 15% o objętości 10ml (ilość wystarczająca na dwa żele) Odczynnik Żel 8% Żel 15% Woda demineralizowana 4,6ml 2,3ml 30% roztwór akrylamidu 2,7ml 5,0ml mix 1,5M Tris-HCl, ph 8.8 2,5ml 2,5ml 10% SDS 0,1ml 0,1ml 10% APS 0,1ml 0,1ml TEMED 0,006ml 0,004ml Strona 7
8 Tab.2. Skład żelu zagęszczającego 5% o objętości 8ml ( ilość wystarczająca na cztery żele) Odczynnik Żel 5% Woda demineralizowana 5,5ml 30% roztwór akrylamidu 1,3ml mix 0,5M Tris-HCl, ph 6.8 1,0ml 10% SDS 0,08ml 10% APS 0,08ml TEMED 3.2. Przygotowanie żelu dolnego 0,008ml 1. Wymyj płytki w wodzie z detergentem a następnie w alkoholu. 2. Załóż na siebie płytkę podstawową i nakrywkową, i umieść je w okienku, które należy zamontować w stojaku 3. Przygotuj żel rozdzielający o pożądanym stężeniu (stopniu polimeryzacji tabelka 1) i wprowadź między płytki 5ml przygotowanego roztworu. 4. Na wierzch żelu wprowadź wodę demineralizowaną, w celu usunięcia bąbli powietrza. Polimeryzacja trwa około minut w temperaturze pokojowej Przygotowanie żelu górnego 1. Zlej wodę demineralizowaną znad żelu dolnego, lekko osusz górną krawędź żelu (np. bibułką) 2. Wprowadź wcześniej przygotowany żel zagęszczający i włóż grzebień między płytki, w celu utworzenia studzienek. Prawidłowo wykonany żel powinien wyglądać jak na rysunku 7. UWAGA!!! Żel górny szybko polimeryzuje! 3.4. Przygotowanie buforu do próbek Rysunek 5. Schemat żelu do elektroforezy (1) W celu uzyskania buforu do próbek przygotuj w eppendorfie roztwór składający się z 950µl buforu Laemlii i 50µl β-merkaptoetanolu. Strona 8
9 3.5. Przygotowanie próbek Przed przystąpieniem do przygotowania próbek obejrzyj film edukacyjny [3] 1. Przygotuj próbki białek wykonując odpowiednie naważki w/g instrukcji prowadzącego 2. Zdenaturuj próbki białka w wodzie o temperaturze 100 C (2x10minut). 3. Gdy stężenie białka jest za wysokie rozcieńcz próbki w przefitrowanym PBSie bez jonów wapnia i magnezu. 4. Rozcieńcz przygotowane próbki białek buforem do próbek w stosunku próbka:bufor = 1: Montowanie zestawu do elektroforezy 1. Zamontuj płytki szklane w kasetkach (holderach) 2. Przenieś zmontowane płytki do komory elektroforetycznej. 3. Wlej bufor do elektroforezy do wysokości uzależnionej od ilości wykorzystywanych kaset (1- dolna kreska, 2-górna kreska). Pomiędzy płytkami nalej bufor do samego końca. 4. Delikatnie usuń grzebienie. 5. Nałóż po 20µl badanych próbek (do studzienek 2-9) na studzienkę oraz 1-2µl markeru (do studzienki 1 i 10). Rysunek 6. Schemat numerowania studzienek w żelu. 6. Zamknij pokrywę i włącz elektroforezę. Uwaga!!! W przypadku pomiaru 1 lub 3 żeli po przeciwnej stronie żelu włożyć zaślepkę. Pomiar przy pomocy jednej kasetki (1 lub 2 żele) należy przeprowadzać w części podłączanej bezpośrednio do elektrod Wykonanie rozdziału elektroforetycznego białek 1. Włącz zasilacz (o jego działaniu informują pojawiające się w roztworze pęcherzyki). 2. Prowadź rozdział elektroforetyczny przy stałym napięciu U=100 V przez około pół godziny (do czasu osiągnięcia przez próbki żelu rozdzielającego). 3. Po osiągnięciu przez próbki żelu rozdzielającego, zmień wartość napięcia na 160V 4. Zatrzymaj elektroforezę, gdy front markera dojdzie do ok.0.5cm do końca płytki. Strona 9
10 5. Wyłącz zasilanie. 6. Wyciągnij z kasetek płytki z żelami. 7. Delikatnie zsuń płytkę nakrywkową od podstawową i przenieś cały żel do szalki zawierającej utrwalacz. 8. Bufor do elektroforezy zlej do butelki szklanej, bufor można użyć 2 razy. 4. Barwienie żel poliakrylamidowych azotanem srebra Przed przystąpieniem barwienia obejrzyj film edukacyjny [4] Materiały zużywalne 1. Końcówki do pipet automatycznych o objętości 5ml, 1000µl, 2. Pipety serologiczne o objętości 25ml 4.2. Odczynniki zużywalne 1. Woda demineralizowana 2. 96% etanol (Linegal Chemicals, nr kat. LL-00012) 3. 99,5-99,9% kwas octowy (POCH, nr kat ) 4. 20% roztwór azotanu srebra 3 ml (POCH, nr kat ). Koncentrat wykonaj z wody demineralizowanej i przechowuj w ciemnej szczelnie zamkniętej butelce w temp. pokojowej. 5. Węglan sodu bezwodny (CZDA, odcz.fp, nr kat ) % Formaldehyd (POCH, nr kat ) 4.3. Sprzęt laboratoryjny 1. Wytrząsarka z ustawianym rpm lub platforma bujana 2. Dygestorium 3. Waga elektroniczna 4. Pipety automatyczne 4.4. Naczynia laboratoryjne 1. Szalki szklane 2. Butelki szklane 3. Zlewki szklane 4.5. Wykonanie barwienia 1. Pod dygestorium przygotuj utrwalacz mieszając: 30 ml etanolu, 60 ml wody demineralizowanej i 10 ml lodowatego kwasu octowego 2. Po elektroforezie żel umieść w utrwalaczu (5 objętości żelu) na 4-12 godzin w temperaturze pokojowej pod dygestorium lub na dłużej w lodówce. 3. Przy użyciu pipetora zlej utrwalacz do butelki i 30% etanol (5 objętości żelu). Inkubuj żel przez 30 minut w temperaturze pokojowej przez cały czas wytrząsając na wytrząsarce (10 rpm, im mniej tym lepiej) lub platformie bujanej. 4. Powtórz krok Przy użyciu pipetora zlej etanol do butelki i dodaj wodę demineralizowaną (10 objętości żelu). Inkubuj żel przez 10 minut w temperaturze pokojowej na wytrząsarce (10 rpm) lub platformie bujanej 6. Powtórz krok 5 4-krotnie 7. Przy użyciu pipetora usuń wodę demineralizowaną i dodaj 0,1% roztwór azotanu srebra (5 objętości żelu). Wykonaj świeży z 20% roztworu AgNO 3. Inkubuj żel w temperaturze pokojowej przez 30 minut stale wytrząsając na wytrząsarce (10 rpm) lub platformie bujanej Strona 10
11 8. Przy użyciu pipetora usuń roztwór azotanu srebra, a następnie przepłukaj obie strony żelu wodą demineralizowaną przez 20 sekund 9. Pod dygestorium rozpuść 2,5g węglanu sodu (Na 2 CO 3 ) w 100ml wody demineralizowanej ( 2,5% roztwór węglanu sodu), a następnie bezpośrednio przed dodaniem roztworu do żelu, dodaj do tego roztworu 250µl 8% formaldehydu (0.02% roztwór formaldehydu). 10. Przy użyciu pipetora dodaj świeżo przygotowany roztwór 2,5% węglanu sodu i 0,02% formaldehydu (5 objętości żelu). Inkubuj żel w temperaturze pokojowej stale wytrząsając na wytrząsarce. Obserwuj żel, gdyż prążki pojawią się w ciągu kilku minut. 11. Gdy pojawią się dobrze widoczne prążki, usuń wyżej wymieniony roztwór i dodaj 1% kwasu octowego (5 objętości żelu) na kilka minut. 12. Usuń roztwór kwasu octowego i przepłukaj żel kilkukrotnie w wodzie demineralizowanej (10 minut) na wytrząsarce Problemy-rozwiązywanie przy barwieniu azotanem srebra Problem Możliwa przyczyna Proponowane rozwiązanie Szare tło 1. Zbyt długi czas wybarwiania 2. Niedokładne płukanie: a. mała objętość r-rów płuczących (pkt ) b. szybkie obroty wytrząsarki (pkt ) 3. Zanieczyszczona woda Żółte tło 1. Ekspozycja na światło podczas inkubacji z r-rem AgNO 3 Pozostałości białek w studzienkach Niewidoczny front elektroforezy 1. Gdy białko pozostaje w pojedynczych studzienkach: a. Nie skuteczna denaturacja białek 2. Gdy białko pozostaje we wszystkich studzienkach, a badamy różne białka: a. Elektroforeza nie zaszła 3. Gdy białko pozostaje we wszystkich studzienkach, a badamy jedno białko: a. Nie skuteczna denaturacja białek 1. Zbyt długo prowadzona elektroforeza 1. Skrócenie czasu wybarwiania 2. a. Zwiększ objętość r-rów płuczących b. zmniejszenie szybkość wytrząsania 3. Używaj tylko wody demineralizowanej 1. Zakryj szalkę z żelem folią aluminiową lub grubym papierem. Chroń przed światłem. 1. a. Sprawdź czy dodałeś SDS do próbek i 2-merkaptaetanol, sprawdź warunki denaturacji (10 min 99 C) 2. a. Sprawdź czy w komorze do elektroforezy znajduje się bufor lub sprawdź skład buforu do elektroforezy 3. a. Sprawdź czy dodałeś SDS i 2-merkaptoetanol, sprawdź warunki denaturacji (10 min 99 C) 1. Zatrzymać elektroforezę, gdy front markera będzie znajdował się 1-1,5cm od końca żelu Strona 11
12 Słabo wybarwiony środek żelu Elektroforeza z tzn. efektem uśmiechu (szybszy rozdział elektroforetyczny próbek znajdujących się po środku żelu) Nierównomierne tempo elektroforezy na całej długości żelu Słabo rozdzielone prążki w żelu 1. Nierównomierne płukanie żelu i barwienie 1. Środek żelu cieplejszy od skrajnych części 1. Przeładowane próbki 2. Zbyt duże napięcie 1. Zbyt duża zawartość białka w próbce 2. Zanieczyszczenie próbek 3. Nieskuteczna denaturacja białek 1. Zmniejszenie prędkości wytrząsania lub zastosuj platformę bujaną 1. a. Sprawdź skład i zamień bufor do elektroforezy b. Sprawdź ustawione wartości napięcia: - rozdziału elektroforetyczny w żelu zagęszczającym 100V - rozdział elektroforetyczny w żelu rozdzielającym 160V c. Kontrola czy pomiędzy żelami znajduje się odpowiednia ilość buforu 1. Zmniejszenie ilości białka w próbce 2. Sprawdź ustawione wartości napięcia: a. rozdział elektroforetyczny w żelu zagęszczającym 100V, b. rozdział elektroforetyczny w żelu rozdzielającym 160V 1. Przygotuj próbki zawierające odpowiednie ilości białka: a. Dla metody z AgNO3 <20μg na studzienkę b. Dla metody Coomassie ~50μg na studzienkę 2. Przygotuj próbki unikając możliwych źródeł zanieczyszczenia próbki 3. Sprawdź czy dodałeś SDS do próbek i 2-merkaptoetanol, sprawdź warunki denaturacji (10 min 99 C) 5. Barwienie żeli poliakrylamidowych Coomassie Blue 5.1. Materiały zużywalne 1. Końcówki do pipet automatycznych o objętości 5ml, 1000µl, 2. Pipety serologiczne o objętości 25ml 5.2. Odczynniki zużywalne 1. Woda demineralizowana 2. 96% etanol (Linegal Chemicals, nr kat. LL-00012) 3. Lodowaty kwas octowy 4. Coomassie Brilliant Blue R250 (EM Science) Strona 12
13 5.3. Sprzęt laboratoryjny 1. Wytrząsarka z ustawianym rpm lub platforma bujana 2. Dygestorium 3. Waga elektroniczna 4. Pipety automatyczne 5.4. Naczynia laboratoryjne 1. Szalki szklane 2. Butelki szklane 3. Zlewki szklane 5.5. Wykonanie barwienia 1. Pod dygestorium przygotuj utrwalacz mieszając: 30 ml etanolu, 60 ml wody demineralizowanej i 10 ml kwasu octowego 2. Po elektroforezie żel umieść w utrwalaczu (5 objętości żelu) na 4-12 godzin w temperaturze pokojowej pod dygestorium lub na dłużej w lodówce. 3. Odważ 0,25g Coomassie Blue 4. Przygotuj roztwór barwiący poprzez rozpuszczenie 0,25g Coomassie Blue w 10ml lodowatego kwasu octowego, 45ml wody i 45ml etanolu 5. Przy użyciu pipetora zlej utrwalacz do butelki i dodaj 5 objętości roztworu barwiącego. Inkubuj żel przez minut w temperaturze pokojowej przez cały czas wytrząsając na wytrząsarce (10 rpm, im mniej tym lepiej) lub platformie bujanej. 6. Przy użyciu pipetora zlej barwnik i dodaj wodę demineralizowaną (10 objętości żelu). Inkubuj żel przez co najmniej 10 minut w temperaturze pokojowej na wytrząsarce (10 rpm) lub platformie bujanej 7. Powtórz krok kilkukrotnie aż do pojawienia się niebieskich prążków. 6. Załączniki Skład buforu SDS-PAGE o ph 8.3: 1x 10x Związek Stężenie w buforze 1x 3g 30.2g TRIS 25mM 14,4g 144g Glicyna 192mM 2g 20g SDS 0,2% ( lub 1g = 0.1%) Uzupełnić do 1 litra Uzupełnić do 1 litra Woda - Bufor Laemmli 5x 1ml (w oparciu o Maniatis A8.42 Cell lysis 1x SDS buffer) Składnik Objętość/Masa Stężenie w roztworze 5x (1x) Tris ph 6.8 (1,0M) 300 µl 300 mm (60 mm) Glicerol 500 µl 50% (10%) SDS 0.1 g 10% (1%) Bromofenol g 0.005% (0.001%) woda 200 µl - Strona 13
14 7. Literatura 1. Elektroforeza przykłady zastosowań, praca zbiorowa pod redakcją Bogdana Walkowiaka i Violetty Kochmańskiej, s / Molecular cloning: a laboratory manual Tom Maniatis, E. F. Fritsch, Joseph Sambrook, Strona 14
NA ŻELU POLIAKRYLAMIDOWYM
 Z48 ELEKTROFOREZA BIAŁEK NA ŻELU POLIAKRYLAMIDOWYM Terminem elektroforeza określa się zjawisko migracji cząstek lub cząsteczek w polu elektrycznym w zależności od posiadanego ładunku. Elektroforeza jako
Z48 ELEKTROFOREZA BIAŁEK NA ŻELU POLIAKRYLAMIDOWYM Terminem elektroforeza określa się zjawisko migracji cząstek lub cząsteczek w polu elektrycznym w zależności od posiadanego ładunku. Elektroforeza jako
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH
 ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH WPROWADZENIE Elektroforeza od ponad 60 lat pozostaje najczęściej stosowaną metodą izolacji makrocząstek w układach biologicznych
ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH WPROWADZENIE Elektroforeza od ponad 60 lat pozostaje najczęściej stosowaną metodą izolacji makrocząstek w układach biologicznych
ELEKTROFORETYCZNY ROZDZIAŁ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 2 ELEKTROFORETYCZNY ROZDZIAŁ BIAŁEK I. WSTĘP TEORETYCZNY Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 2 ELEKTROFORETYCZNY ROZDZIAŁ BIAŁEK I. WSTĘP TEORETYCZNY Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej,
- oznaczenia naukowo-badawcze. - jedna z podstawowych technik. - oznaczenia laboratoryjnodiagnostyczne. Elektroforeza. badawczych.
 Elektroforeza - jedna z podstawowych technik badawczych - oznaczenia naukowo-badawcze - oznaczenia laboratoryjnodiagnostyczne Annals of the New York Academy of Sciences 928:54-64 (2001) 2001 New York
Elektroforeza - jedna z podstawowych technik badawczych - oznaczenia naukowo-badawcze - oznaczenia laboratoryjnodiagnostyczne Annals of the New York Academy of Sciences 928:54-64 (2001) 2001 New York
ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO
 ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO CZĘŚĆ TEORETYCZNA Metody badań i cechy w oparciu o które przeprowadzana jest klasyfikacja i identyfikacja mikroorganizmówh Struktura
ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO CZĘŚĆ TEORETYCZNA Metody badań i cechy w oparciu o które przeprowadzana jest klasyfikacja i identyfikacja mikroorganizmówh Struktura
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
ĆWICZENIE II. PRZYGOTOWANIE ŻELU POLIAKRYLAMIDOWEGO DO ELEKTROFOREZY BIAŁEK W WARUNKACH DENATURUJĄCYCH (SDS-PAGE)
 ĆWICZENIE II. ELEKTROFOREZA W ŻELU POLIAKRYLAMIDOWYM (ANG. POLYACRYLAMIDE GEL ELECTROPHORESIS - PAGE) PRZYGOTOWANIE ŻELU POLIAKRYLAMIDOWEGO DO ELEKTROFOREZY BIAŁEK W WARUNKACH DENATURUJĄCYCH (SDS-PAGE)
ĆWICZENIE II. ELEKTROFOREZA W ŻELU POLIAKRYLAMIDOWYM (ANG. POLYACRYLAMIDE GEL ELECTROPHORESIS - PAGE) PRZYGOTOWANIE ŻELU POLIAKRYLAMIDOWEGO DO ELEKTROFOREZY BIAŁEK W WARUNKACH DENATURUJĄCYCH (SDS-PAGE)
Multipol Standard. Aparat do jednoczesnego wylewania do 6 żeli poliakrylamidowych. Instrukcja Obsługi. Numer katalogowy:
 Multipol Standard Aparat do jednoczesnego wylewania do 6 żeli poliakrylamidowych Instrukcja Obsługi Numer katalogowy: 101-150 Aby uzys k ać pomoc techniczną : T 22 668 71 47 Spis treści 1. Informacje ogólne
Multipol Standard Aparat do jednoczesnego wylewania do 6 żeli poliakrylamidowych Instrukcja Obsługi Numer katalogowy: 101-150 Aby uzys k ać pomoc techniczną : T 22 668 71 47 Spis treści 1. Informacje ogólne
ĆWICZENIE III. ELEKTROFOREZA W ŻELU POLIAKRYLAMIDOWYM (ANG. POLYACRYLAMIDE GEL ELECTROPHORESIS - PAGE)
 ĆWICZENIE III. ELEKTROFOREZA W ŻELU POLIAKRYLAMIDOWYM (ANG. POLYACRYLAMIDE GEL ELECTROPHORESIS - PAGE) ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH (SDS-PAGE) DETEKCJA BIAŁEK
ĆWICZENIE III. ELEKTROFOREZA W ŻELU POLIAKRYLAMIDOWYM (ANG. POLYACRYLAMIDE GEL ELECTROPHORESIS - PAGE) ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH (SDS-PAGE) DETEKCJA BIAŁEK
Wyścigi w polu elektrycznym
 Wyścigi w polu elektrycznym - czyli słów kilka o nowoczesnych technikach elektromigracyjnych Paweł Kubalczyk Katedra Chemii Środowiska Wydział Chemii UŁ Mieszaniny Mieszanina to układ dwóch lub więcej
Wyścigi w polu elektrycznym - czyli słów kilka o nowoczesnych technikach elektromigracyjnych Paweł Kubalczyk Katedra Chemii Środowiska Wydział Chemii UŁ Mieszaniny Mieszanina to układ dwóch lub więcej
Metody badania ekspresji genów
 Metody badania ekspresji genów dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Metody badania ekspresji genów zamieszczonym w skrypcie pod reakcją A. Lityńskiej i M. Lewandowskiego
Metody badania ekspresji genów dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Metody badania ekspresji genów zamieszczonym w skrypcie pod reakcją A. Lityńskiej i M. Lewandowskiego
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
K05 Instrukcja wykonania ćwiczenia
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego K05 Instrukcja wykonania ćwiczenia Wyznaczanie punktu izoelektrycznego żelatyny metodą wiskozymetryczną Zakres zagadnień obowiązujących do ćwiczenia 1. Układy
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego K05 Instrukcja wykonania ćwiczenia Wyznaczanie punktu izoelektrycznego żelatyny metodą wiskozymetryczną Zakres zagadnień obowiązujących do ćwiczenia 1. Układy
WYSOKOSPRAWNA ELEKTROFOREZA KAPILARNA (HPCE) + +
 WYSOKOSPRAWNA ELEKTROFOREZA KAPILARNA (HPCE) WSTĘP Zjawisko elektroforezy polega na poruszaniu się lub migracji cząstek naładowanych w polu elektrycznym w wyniku przyciągania względnie odpychania. Najprostszy
WYSOKOSPRAWNA ELEKTROFOREZA KAPILARNA (HPCE) WSTĘP Zjawisko elektroforezy polega na poruszaniu się lub migracji cząstek naładowanych w polu elektrycznym w wyniku przyciągania względnie odpychania. Najprostszy
MINIPOL 2. Zestaw do minielektroforezy płytowej w jednym lub dwóch żelach poliakrylamidowych. Instrukcja Obsługi. Numer katalogowy:
 MINIPOL 2 Zestaw do minielektroforezy płytowej w jednym lub dwóch żelach poliakrylamidowych Instrukcja Obsługi Numer katalogowy: 103-100 Aby uzys k ać pomoc techniczną : T 22 668 71 47 Spis treści 1. Informacje
MINIPOL 2 Zestaw do minielektroforezy płytowej w jednym lub dwóch żelach poliakrylamidowych Instrukcja Obsługi Numer katalogowy: 103-100 Aby uzys k ać pomoc techniczną : T 22 668 71 47 Spis treści 1. Informacje
Metody chromatograficzne w chemii i biotechnologii, wykład 6. Łukasz Berlicki
 Metody chromatograficzne w chemii i biotechnologii, wykład 6 Łukasz Berlicki Techniki elektromigracyjne Elektroforeza technika analityczna polegająca na rozdzielaniu mieszanin związków przez wymuszenie
Metody chromatograficzne w chemii i biotechnologii, wykład 6 Łukasz Berlicki Techniki elektromigracyjne Elektroforeza technika analityczna polegająca na rozdzielaniu mieszanin związków przez wymuszenie
Western Blot. Praktyczny poradnik.
 Western Blot. Praktyczny poradnik. Western Blot jest techniką powszechnie stosowaną w biologii molekularnej w różnych laboratoriach na całym świecie. W przeciwieństwie do hybrydyzacji Southern i Northern,
Western Blot. Praktyczny poradnik. Western Blot jest techniką powszechnie stosowaną w biologii molekularnej w różnych laboratoriach na całym świecie. W przeciwieństwie do hybrydyzacji Southern i Northern,
BADANIE WŁASCIWOSCI FIZYKOCHEMICZNYCH KWASÓW NUKLEINOWYCH
 BADANIE WŁASCIWOSCI FIZYKOCHEMICZNYCH KWASÓW NUKLEINOWYCH ROZPUSZCZALNOŚĆ KWASÓW NUKLEINOWYCH Kwasy nukleinowe mają charakter polianionowy, wynikający z bogactwa reszt fosforanowych w ich strukturze, dzięki
BADANIE WŁASCIWOSCI FIZYKOCHEMICZNYCH KWASÓW NUKLEINOWYCH ROZPUSZCZALNOŚĆ KWASÓW NUKLEINOWYCH Kwasy nukleinowe mają charakter polianionowy, wynikający z bogactwa reszt fosforanowych w ich strukturze, dzięki
ELEKTROFOREZA ŻELOWA KOLAGENU
 ELEKTROFOREZA ŻELOWA KOLAGENU I. PRZYGOTOWANIE ŻELU POLIAKRYLAMIDOWEGO DO ELEKTROFOREZY BIAŁEK W WARUNKACH DENATURUJĄCYCH (SDS-PAGE) Żele poliakrylamidowe do elektroforezy wytwarza się poprzez wolnorodnikową
ELEKTROFOREZA ŻELOWA KOLAGENU I. PRZYGOTOWANIE ŻELU POLIAKRYLAMIDOWEGO DO ELEKTROFOREZY BIAŁEK W WARUNKACH DENATURUJĄCYCH (SDS-PAGE) Żele poliakrylamidowe do elektroforezy wytwarza się poprzez wolnorodnikową
Próba kontrolna (PK) 1000 l 1000 l
 Ćwiczenie 10. A. Oznaczanie stężenia bilirubiny całkowitej w surowicy krwi. Wymagane zagadnienia teoretyczne 1. Biosynteza hemu - metabolity pośrednie syntezy hemu. 2. Katabolizm hemu - powstawanie barwników
Ćwiczenie 10. A. Oznaczanie stężenia bilirubiny całkowitej w surowicy krwi. Wymagane zagadnienia teoretyczne 1. Biosynteza hemu - metabolity pośrednie syntezy hemu. 2. Katabolizm hemu - powstawanie barwników
Elektroforeza kwasów nukleinowych
 Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA i jest stosunkowo czuła (po odpowiednim wybarwieniu
Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA i jest stosunkowo czuła (po odpowiednim wybarwieniu
Elektroforeza kwasów nukleinowych
 Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA ze stosunkowo wysoką czułością (po odpowiednim
Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA ze stosunkowo wysoką czułością (po odpowiednim
Elektroforeza kwasów nukleinowych
 Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA ze stosunkowo wysoką czułością (po odpowiednim
Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA ze stosunkowo wysoką czułością (po odpowiednim
ELEKTROFOREZA. Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM
 Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM Zadania: 1. Wykonać elektroforezę poziomą wybranych barwników w żelu agarozowym przy trzech różnych wartościach ph roztworów buforowych.
Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM Zadania: 1. Wykonać elektroforezę poziomą wybranych barwników w żelu agarozowym przy trzech różnych wartościach ph roztworów buforowych.
HYDROLIZA SOLI. ROZTWORY BUFOROWE
 Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K
![dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K](/thumbs/55/36391740.jpg) RÓWNOWAGI W ROZTWORACH Szwedzki chemik Svante Arrhenius w 1887 roku jako pierwszy wykazał, że procesowi rozpuszczania wielu substancji towarzyszy dysocjacja, czyli rozpad cząsteczek na jony naładowane
RÓWNOWAGI W ROZTWORACH Szwedzki chemik Svante Arrhenius w 1887 roku jako pierwszy wykazał, że procesowi rozpuszczania wielu substancji towarzyszy dysocjacja, czyli rozpad cząsteczek na jony naładowane
STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI
 Ćwiczenie 8 Semestr 2 STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI Obowiązujące zagadnienia: Stężenie jonów wodorowych: ph, poh, iloczyn jonowy wody, obliczenia rachunkowe, wskaźniki
Ćwiczenie 8 Semestr 2 STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI Obowiązujące zagadnienia: Stężenie jonów wodorowych: ph, poh, iloczyn jonowy wody, obliczenia rachunkowe, wskaźniki
Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii ELEKTROFOREZA. Prowadzący: mgr inż. Marta Grec Miejsce ćwiczeń: sala 102
 Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii ELEKTROFOREZA Prowadzący: mgr inż. Marta Grec Miejsce ćwiczeń: sala 102 1. Wstęp teoretyczny Przyłożenie pola elektrycznego do wodnego roztworu
Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii ELEKTROFOREZA Prowadzący: mgr inż. Marta Grec Miejsce ćwiczeń: sala 102 1. Wstęp teoretyczny Przyłożenie pola elektrycznego do wodnego roztworu
Laboratorium 3 Toksykologia żywności
 Laboratorium 3 Toksykologia żywności Literatura zalecana: Orzeł D., Biernat J. (red.) 2012. Wybrane zagadnienia z toksykologii żywności. Wydawnictwo Uniwersytetu Przyrodniczego we Wrocławiu. Wrocław. Str.:
Laboratorium 3 Toksykologia żywności Literatura zalecana: Orzeł D., Biernat J. (red.) 2012. Wybrane zagadnienia z toksykologii żywności. Wydawnictwo Uniwersytetu Przyrodniczego we Wrocławiu. Wrocław. Str.:
Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek.
 Pracownia Biologii Molekularnej Część II Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek. Spis treści 1 I spotkanie: Ekspresja białka w komórkach
Pracownia Biologii Molekularnej Część II Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek. Spis treści 1 I spotkanie: Ekspresja białka w komórkach
bi ~ Zestaw dydal<tyczny umożliwiający przeprowadzenie izolacji genomowego DNA z bakterii EasyLation Genomie DNA INSTRUI<CJA DLA STUDENTÓW
 Zestaw dydaktyczny EasyLation Genomie DNA Nr kat. DY80 Wersja zestawu: 1.2014 Zestaw dydal
Zestaw dydaktyczny EasyLation Genomie DNA Nr kat. DY80 Wersja zestawu: 1.2014 Zestaw dydal
SubDNA. Zestaw do elektroforezy horyzontalnej w żelu agarozowym z chłodzeniem* Instrukcja Obsługi
 * SubDNA Zestaw do elektroforezy horyzontalnej w żelu agarozowym z chłodzeniem* Instrukcja Obsługi Numer katalogowy: 130-100 Numer katalogowy: 131-100* Aby uzys k ać pomoc techniczną (+48) 22 668 71 47
* SubDNA Zestaw do elektroforezy horyzontalnej w żelu agarozowym z chłodzeniem* Instrukcja Obsługi Numer katalogowy: 130-100 Numer katalogowy: 131-100* Aby uzys k ać pomoc techniczną (+48) 22 668 71 47
ĆWICZENIE I. ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH. µ = ν / E ELEKTROFOREZA
 ĆWICZENIE I. ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem przyłożonej zewnętrznie różnicy potencjałów
ĆWICZENIE I. ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem przyłożonej zewnętrznie różnicy potencjałów
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna.
 Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Laboratorium 8. Badanie stresu oksydacyjnego jako efektu działania czynników toksycznych
 Laboratorium 8 Badanie stresu oksydacyjnego jako efektu działania czynników toksycznych Literatura zalecana: Jakubowska A., Ocena toksyczności wybranych cieczy jonowych. Rozprawa doktorska, str. 28 31.
Laboratorium 8 Badanie stresu oksydacyjnego jako efektu działania czynników toksycznych Literatura zalecana: Jakubowska A., Ocena toksyczności wybranych cieczy jonowych. Rozprawa doktorska, str. 28 31.
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2019 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Scenariusz lekcji chemii w klasie III gimnazjum. Temat lekcji: Białka skład pierwiastkowy, budowa, właściwości i reakcje charakterystyczne
 Scenariusz lekcji chemii w klasie III gimnazjum Temat lekcji: Białka skład pierwiastkowy, budowa, właściwości i reakcje charakterystyczne Czas trwania lekcji: 2x 45 minut Cele lekcji: 1. Ogólny zapoznanie
Scenariusz lekcji chemii w klasie III gimnazjum Temat lekcji: Białka skład pierwiastkowy, budowa, właściwości i reakcje charakterystyczne Czas trwania lekcji: 2x 45 minut Cele lekcji: 1. Ogólny zapoznanie
OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIARÓW PRZEWODNICTWA. OZNACZANIE STĘŻENIA WODOROTLENKU SODU METODĄ MIARECZKOWANIA KONDUKTOMETRYCZNEGO
 OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIAÓW PZEWODNICTWA. OZNACZANIE STĘŻENIA WODOOTLENKU SODU METODĄ MIAECZKOWANIA KONDUKTOMETYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIAÓW PZEWODNICTWA. OZNACZANIE STĘŻENIA WODOOTLENKU SODU METODĄ MIAECZKOWANIA KONDUKTOMETYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
E.coli Transformer Kit
 E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH
 ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH Instrukcja wykonana w Katedrze Chemii Środowiska ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem
ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH Instrukcja wykonana w Katedrze Chemii Środowiska ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem
Kuratorium Oświaty w Lublinie
 Kuratorium Oświaty w Lublinie KOD UCZNIA ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 ETAP WOJEWÓDZKI Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
Kuratorium Oświaty w Lublinie KOD UCZNIA ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 ETAP WOJEWÓDZKI Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW.
 RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW. Zagadnienia: Zjawisko dysocjacji: stała i stopień dysocjacji Elektrolity słabe i mocne Efekt wspólnego jonu Reakcje strącania osadów Iloczyn rozpuszczalności Odczynnik
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW. Zagadnienia: Zjawisko dysocjacji: stała i stopień dysocjacji Elektrolity słabe i mocne Efekt wspólnego jonu Reakcje strącania osadów Iloczyn rozpuszczalności Odczynnik
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2015/2016
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2015/2016 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2015/2016 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 STOPIEŃ WOJEWÓDZKI 9 MARCA 2018 R.
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
ELEKTROFOREZA DWUWYMIAROWA 2-DE BIAŁEK
 ELEKTROFOREZA DWUWYMIAROWA 2-DE BIAŁEK WPROWADZENIE Dwuwymiarowa elektroforeza żelowa jest metodą znaną od lat 70-tych ubiegłego wieku. Obecnie jest powszechnie stosowaną metodą rozdziału pozwalającą na
ELEKTROFOREZA DWUWYMIAROWA 2-DE BIAŁEK WPROWADZENIE Dwuwymiarowa elektroforeza żelowa jest metodą znaną od lat 70-tych ubiegłego wieku. Obecnie jest powszechnie stosowaną metodą rozdziału pozwalającą na
ELEKTROFOREZA JAKO METODA ANALIZY BIAŁEK
 Ćwiczenie 2 ELEKTROFOREZA JAKO METODA ANALIZY BIAŁEK 2.1.CEL ĆWICZENIA Zapoznanie się z techniką elektroforezy białek, w szczególności elektroforezy w żelu poliakrylamidowym w warunkach denaturujących
Ćwiczenie 2 ELEKTROFOREZA JAKO METODA ANALIZY BIAŁEK 2.1.CEL ĆWICZENIA Zapoznanie się z techniką elektroforezy białek, w szczególności elektroforezy w żelu poliakrylamidowym w warunkach denaturujących
Gel-Out. 50 izolacji, 250 izolacji. Nr kat , Zestaw do izolacji DNA z żelu agarozowego. wersja 0617
 Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
I BIOTECHNOLOGIA. 3-letnie studia stacjonarne I stopnia
 I BIOTECHNOLOGIA 3-letnie studia stacjonarne I stopnia PRZEDMIOT: CHEMIA OGÓLNA Z ELEMENTAMI CHEMII FIZYCZNEJ Ćwiczenia laboratoryjne semestr pierwszy 30 godz. Program ćwiczeń laboratoryjnych będzie realizowany
I BIOTECHNOLOGIA 3-letnie studia stacjonarne I stopnia PRZEDMIOT: CHEMIA OGÓLNA Z ELEMENTAMI CHEMII FIZYCZNEJ Ćwiczenia laboratoryjne semestr pierwszy 30 godz. Program ćwiczeń laboratoryjnych będzie realizowany
Elektroforeza kwasów nukleinowych
 Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA i jest stosunkowo czuła (po odpowiednim wybarwieniu
Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA i jest stosunkowo czuła (po odpowiednim wybarwieniu
ĆWICZENIE I - BIAŁKA. Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi.
 ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
ĆWICZENIE 2 KONDUKTOMETRIA
 ĆWICZENIE 2 KONDUKTOMETRIA 1. Oznaczanie słabych kwasów w sokach i syropach owocowych metodą miareczkowania konduktometrycznego Celem ćwiczenia jest ilościowe oznaczenie zawartości słabych kwasów w sokach
ĆWICZENIE 2 KONDUKTOMETRIA 1. Oznaczanie słabych kwasów w sokach i syropach owocowych metodą miareczkowania konduktometrycznego Celem ćwiczenia jest ilościowe oznaczenie zawartości słabych kwasów w sokach
Litowce i berylowce- lekcja powtórzeniowa, doświadczalna.
 Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE
 OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE WPROWADZENIE Przyswajalność pierwiastków przez rośliny zależy od procesów zachodzących między fazą stałą i ciekłą gleby oraz korzeniami roślin. Pod względem stopnia
OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE WPROWADZENIE Przyswajalność pierwiastków przez rośliny zależy od procesów zachodzących między fazą stałą i ciekłą gleby oraz korzeniami roślin. Pod względem stopnia
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
Różne dziwne przewodniki
 Różne dziwne przewodniki czyli trzy po trzy o mechanizmach przewodzenia prądu elektrycznego Przewodniki elektronowe Metale Metale (zwane również przewodnikami) charakteryzują się tym, że elektrony ich
Różne dziwne przewodniki czyli trzy po trzy o mechanizmach przewodzenia prądu elektrycznego Przewodniki elektronowe Metale Metale (zwane również przewodnikami) charakteryzują się tym, że elektrony ich
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA
 Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
ĆWICZENIE 1 i 2 Modyfikacja geu wołowej beta-laktoglobuliny przy użyciu metody Overlap Extension PCR (wydłużania nakładających się odcinków)
 ĆWICZENIE 1 i 2 Modyfikacja geu wołowej beta-laktoglobuliny przy użyciu metody Overlap Extension PCR (wydłużania nakładających się odcinków) Celem ćwiczenia jest wprowadzenie mutacji punktowej do genu
ĆWICZENIE 1 i 2 Modyfikacja geu wołowej beta-laktoglobuliny przy użyciu metody Overlap Extension PCR (wydłużania nakładających się odcinków) Celem ćwiczenia jest wprowadzenie mutacji punktowej do genu
TaqNova-RED. Polimeraza DNA RP20R, RP100R
 TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
ĆWICZENIE 5 Barwniki roślinne. Ekstrakcja barwników asymilacyjnych. Rozpuszczalność chlorofilu
 ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
Laboratorium z bionanostruktur. Prowadzący: mgr inż. Jan Procek Konsultacje: WT D- 1 8A
 Laboratorium z bionanostruktur Prowadzący: mgr inż. Jan Procek Konsultacje: WT 9.00-10.00 D- 1 8A Regulamin Studenci są dopuszczeni do wykonywania ćwiczenia jeżeli posiadają: Buty na płaskim obcasie, Fartuchy,
Laboratorium z bionanostruktur Prowadzący: mgr inż. Jan Procek Konsultacje: WT 9.00-10.00 D- 1 8A Regulamin Studenci są dopuszczeni do wykonywania ćwiczenia jeżeli posiadają: Buty na płaskim obcasie, Fartuchy,
Ćwiczenie II Roztwory Buforowe
 Ćwiczenie wykonać w parach lub trójkach. Ćwiczenie II Roztwory Buforowe A. Sporządzić roztwór buforu octanowego lub amonowego o określonym ph (podaje prowadzący ćwiczenia) Bufor Octanowy 1. Do zlewki wlej
Ćwiczenie wykonać w parach lub trójkach. Ćwiczenie II Roztwory Buforowe A. Sporządzić roztwór buforu octanowego lub amonowego o określonym ph (podaje prowadzący ćwiczenia) Bufor Octanowy 1. Do zlewki wlej
XXV KONKURS CHEMICZNY DLA GIMNAZJALISTÓW
 IMIĘ I NZWISKO PUNKTCJ SZKOŁ KLS NZWISKO NUCZYCIEL CHEMII I LICEUM OGÓLNOKSZTŁCĄCE Inowrocław 12 maja 2018 Im. Jana Kasprowicza INOWROCŁW XXV KONKURS CHEMICZNY DL GIMNZJLISTÓW ROK SZKOLNY 2017/2018 ZDNIE
IMIĘ I NZWISKO PUNKTCJ SZKOŁ KLS NZWISKO NUCZYCIEL CHEMII I LICEUM OGÓLNOKSZTŁCĄCE Inowrocław 12 maja 2018 Im. Jana Kasprowicza INOWROCŁW XXV KONKURS CHEMICZNY DL GIMNZJLISTÓW ROK SZKOLNY 2017/2018 ZDNIE
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA
 Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Materiały pomocnicze 10 do zajęć wyrównawczych z Fizyki dla Inżynierii i Gospodarki Wodnej
 Materiały pomocnicze 10 do zajęć wyrównawczych z Fizyki dla Inżynierii i Gospodarki Wodnej 1. Siła Coulomba. F q q = k r 1 = 1 4πεε 0 q q r 1. Pole elektrostatyczne. To przestrzeń, w której na ładunek
Materiały pomocnicze 10 do zajęć wyrównawczych z Fizyki dla Inżynierii i Gospodarki Wodnej 1. Siła Coulomba. F q q = k r 1 = 1 4πεε 0 q q r 1. Pole elektrostatyczne. To przestrzeń, w której na ładunek
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2018/2019 CHEMIA
 WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 208/209 CHEMIA Informacje dla ucznia. Na stronie tytułowej arkusza w wyznaczonym miejscu wpisz
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 208/209 CHEMIA Informacje dla ucznia. Na stronie tytułowej arkusza w wyznaczonym miejscu wpisz
1 K A T E D R A F I ZYKI S T O S O W AN E J
 1 K A T E D R A F I ZYKI S T O S O W AN E J P R A C O W N I A P O D S T A W E L E K T R O T E C H N I K I I E L E K T R O N I K I Ćw. 1. Łączenie i pomiar oporu Wprowadzenie Prąd elektryczny Jeżeli w przewodniku
1 K A T E D R A F I ZYKI S T O S O W AN E J P R A C O W N I A P O D S T A W E L E K T R O T E C H N I K I I E L E K T R O N I K I Ćw. 1. Łączenie i pomiar oporu Wprowadzenie Prąd elektryczny Jeżeli w przewodniku
Zapisz za pomocą symboli i wzorów następujące ilości substancji :
 ZESTAW I Zadanie 1. Zapisz za pomocą symboli i wzorów następujące ilości substancji : a) dwa atomy wapnia... b) cztery cząsteczki wodoru... c) trzy cząsteczki siarczku żelaza... d) atom magnezu... e) dwie
ZESTAW I Zadanie 1. Zapisz za pomocą symboli i wzorów następujące ilości substancji : a) dwa atomy wapnia... b) cztery cząsteczki wodoru... c) trzy cząsteczki siarczku żelaza... d) atom magnezu... e) dwie
PARAMETRY TECHNICZNE I ILOŚCIOWE PRZEDMIOTU NINIEJSZEGO POSTĘPOWANIA
 Znak sprawy: 13/G/2016 Załącznik nr 2 PARAMETRY TECHNICZNE I ILOŚCIOWE PRZEDMIOTU NINIEJSZEGO POSTĘPOWANIA 1. [APARAT DO AUTOMATYCZNEJ IZOLACJI KWASÓW NUKLEINOWYCH] MagCore HF16Plus szt.1 / NIE 1 Automatyczna
Znak sprawy: 13/G/2016 Załącznik nr 2 PARAMETRY TECHNICZNE I ILOŚCIOWE PRZEDMIOTU NINIEJSZEGO POSTĘPOWANIA 1. [APARAT DO AUTOMATYCZNEJ IZOLACJI KWASÓW NUKLEINOWYCH] MagCore HF16Plus szt.1 / NIE 1 Automatyczna
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU ELEKTROFOREZA
 SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU ELEKTROFOREZA SPIS TREŚCI: I. Wprowadzenie. II. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. III. Karty pracy. 1. Karta
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU ELEKTROFOREZA SPIS TREŚCI: I. Wprowadzenie. II. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. III. Karty pracy. 1. Karta
PARAMETRY TECHNICZNE PRZEDMIOTU ZAMÓWIENIA
 Załącznik nr 1A.do SIWZ PARAMETRY TECHNICZNE PRZEDMIOTU ZAMÓWIENIA Zadanie nr 1. AUTOKLAW Objętość Ciśnienie robocze Płaszcz grzejny Manometr Inne Katedra Chemii - 200 ml 100 bar a) z regulatorem temperatury
Załącznik nr 1A.do SIWZ PARAMETRY TECHNICZNE PRZEDMIOTU ZAMÓWIENIA Zadanie nr 1. AUTOKLAW Objętość Ciśnienie robocze Płaszcz grzejny Manometr Inne Katedra Chemii - 200 ml 100 bar a) z regulatorem temperatury
Elektroforeza kapilarna oznaczanie benzoesanu sodu w próbkach wodnych + +
 Elektroforeza kapilarna oznaczanie benzoesanu sodu w próbkach wodnych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wstęp Zjawisko elektroforezy polega na poruszaniu
Elektroforeza kapilarna oznaczanie benzoesanu sodu w próbkach wodnych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wstęp Zjawisko elektroforezy polega na poruszaniu
XX KONKURS CHEMICZNY KLAS TRZECICH GIMNAZJALNYCH ROK SZKOLNY 2012/2013
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 25 maja 2013 Im. Jana Kasprowicza INOWROCŁAW XX KONKURS CHEMICZNY KLAS TRZECICH GIMNAZJALNYCH ROK
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 25 maja 2013 Im. Jana Kasprowicza INOWROCŁAW XX KONKURS CHEMICZNY KLAS TRZECICH GIMNAZJALNYCH ROK
Wielofunkcyjne związki organiczne poziom rozszerzony
 Wielofunkcyjne związki organiczne poziom rozszerzony Zadanie 1. (2 pkt) Źródło: KE 2010 (PR), zad. 29. Pewien dwufunkcyjny związek organiczny ma masę molową równą 90 g/mol. W jego cząsteczce stosunek liczby
Wielofunkcyjne związki organiczne poziom rozszerzony Zadanie 1. (2 pkt) Źródło: KE 2010 (PR), zad. 29. Pewien dwufunkcyjny związek organiczny ma masę molową równą 90 g/mol. W jego cząsteczce stosunek liczby
Zestaw do izolacji DNA z żeli agarozowych. Nr kat. EM08 Wersja zestawu:
 Zestaw do izolacji DNA z żeli agarozowych Nr kat. EM08 Wersja zestawu: 1.2014 www.dnagdansk.com 2 Nr kat. EM08 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA GEL OUT przeznaczony jest do szybkiej i wydajnej
Zestaw do izolacji DNA z żeli agarozowych Nr kat. EM08 Wersja zestawu: 1.2014 www.dnagdansk.com 2 Nr kat. EM08 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA GEL OUT przeznaczony jest do szybkiej i wydajnej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks
 Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 02
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 02
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Obsługa maszyn i urządzeń przemysłu chemicznego Oznaczenie kwalifikacji: A.06 Numer
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Obsługa maszyn i urządzeń przemysłu chemicznego Oznaczenie kwalifikacji: A.06 Numer
Akademickie Centrum Czystej Energii. Ogniwo paliwowe
 Ogniwo paliwowe 1. Zagadnienia elektroliza, prawo Faraday a, pierwiastki galwaniczne, ogniwo paliwowe 2. Opis Główną częścią ogniwa paliwowego PEM (Proton Exchange Membrane) jest membrana złożona z katody
Ogniwo paliwowe 1. Zagadnienia elektroliza, prawo Faraday a, pierwiastki galwaniczne, ogniwo paliwowe 2. Opis Główną częścią ogniwa paliwowego PEM (Proton Exchange Membrane) jest membrana złożona z katody
Zestaw dydaktyczny. genotypowanie szczepów 5taphy/ococcus aureus metodą PCR-RFLP
 2014-07-17 Zestaw dydaktyczny EasyGenotyping PCR-RFLP - S. aureus genotypowanie szczepów 5taphy/ococcus aureus metodą PCR-RFLP Celem ćwiczenia jest przeprowadzenie typowania genetycznego dostarczonych
2014-07-17 Zestaw dydaktyczny EasyGenotyping PCR-RFLP - S. aureus genotypowanie szczepów 5taphy/ococcus aureus metodą PCR-RFLP Celem ćwiczenia jest przeprowadzenie typowania genetycznego dostarczonych
a) proces denaturacji białka następuje w probówce: b) proces zachodzący w probówce nr 1 nazywa się:
 Zadanie 1. (4 pkt) Zaprojektuj doświadczenie chemiczne, za pomocą którego można wykryć siarkę w związkach organicznych. a) opisz przebieg doświadczenia b) zapisz przewidywane spostrzeżenia c) napisz równanie
Zadanie 1. (4 pkt) Zaprojektuj doświadczenie chemiczne, za pomocą którego można wykryć siarkę w związkach organicznych. a) opisz przebieg doświadczenia b) zapisz przewidywane spostrzeżenia c) napisz równanie
LABORATORIUM FIZYKI PAŃSTWOWEJ WYŻSZEJ SZKOŁY ZAWODOWEJ W NYSIE. Ćwiczenie nr 2 Temat: Wyznaczenie współczynnika elektrochemicznego i stałej Faradaya.
 LABOATOIUM FIZYKI PAŃSTWOWEJ WYŻSZEJ SZKOŁY ZAWODOWEJ W NYSIE Ćwiczenie nr Temat: Wyznaczenie współczynnika elektrochemicznego i stałej Faradaya.. Wprowadzenie Proces rozpadu drobin związków chemicznych
LABOATOIUM FIZYKI PAŃSTWOWEJ WYŻSZEJ SZKOŁY ZAWODOWEJ W NYSIE Ćwiczenie nr Temat: Wyznaczenie współczynnika elektrochemicznego i stałej Faradaya.. Wprowadzenie Proces rozpadu drobin związków chemicznych
Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów.
 Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów. Wprowadzenie teoretyczne Cel ćwiczeń: Poznanie metod otrzymywania oraz badania właściwości węglowodorów alifatycznych
Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów. Wprowadzenie teoretyczne Cel ćwiczeń: Poznanie metod otrzymywania oraz badania właściwości węglowodorów alifatycznych
imię i nazwisko, nazwa szkoły, miejscowość Zadania I etapu Konkursu Chemicznego Trzech Wydziałów PŁ V edycja
 Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak)
 Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak) 1. Właściwości roztworów buforowych Dodatek nieznacznej ilości mocnego kwasu lub mocnej zasady do czystej wody powoduje stosunkowo dużą
Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak) 1. Właściwości roztworów buforowych Dodatek nieznacznej ilości mocnego kwasu lub mocnej zasady do czystej wody powoduje stosunkowo dużą
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje wojewódzkie III stopień
 ZASTRZEŻONE Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Pieczątka szkoły 17 marca 2016 r. Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje
ZASTRZEŻONE Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Pieczątka szkoły 17 marca 2016 r. Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje
Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.
![Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów. Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.](/thumbs/97/131732752.jpg) 2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana. Argentometryczne oznaczanie chlorków w mydłach
 Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Argentometryczne oznaczanie chlorków w mydłach Ćwiczenie obejmuje: 1. Oznaczenie miana roztworu AgNO
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Argentometryczne oznaczanie chlorków w mydłach Ćwiczenie obejmuje: 1. Oznaczenie miana roztworu AgNO
Równowagi w roztworach elektrolitów
 Do doświadczeń stosować suche szkło i sprzęt laboratoryjny. Po użyciu szkło i sprzęt laboratoryjny należy wstępnie opłukać, a po zakończonych eksperymentach dokładnie umyć (przy użyciu detergentów) i pozostawić
Do doświadczeń stosować suche szkło i sprzęt laboratoryjny. Po użyciu szkło i sprzęt laboratoryjny należy wstępnie opłukać, a po zakończonych eksperymentach dokładnie umyć (przy użyciu detergentów) i pozostawić
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA
 Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
A4.05 Instrukcja wykonania ćwiczenia
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego A4.05 nstrukcja wykonania ćwiczenia Wyznaczanie współczynników aktywności soli trudno rozpuszczalnej metodą pomiaru rozpuszczalności Zakres zagadnień obowiązujących
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego A4.05 nstrukcja wykonania ćwiczenia Wyznaczanie współczynników aktywności soli trudno rozpuszczalnej metodą pomiaru rozpuszczalności Zakres zagadnień obowiązujących
Zapisz równanie zachodzącej reakcji. Wskaż pierwiastki, związki chemiczne, substraty i produkty reakcji.
 test nr 2 Termin zaliczenia zadań: IIIa - 29 października 2015 III b - 28 października 2015 zad.1 Reakcja rozkładu tlenku rtęci(ii) 1. Narysuj schemat doświadczenia, sporządź spis użytych odczynników,
test nr 2 Termin zaliczenia zadań: IIIa - 29 października 2015 III b - 28 października 2015 zad.1 Reakcja rozkładu tlenku rtęci(ii) 1. Narysuj schemat doświadczenia, sporządź spis użytych odczynników,
LABORATORIUM Z PODSTAW BIOFIZYKI ĆWICZENIE NR 4 1. CEL ĆWICZENIA
 1. CEL ĆWICZENIA Pomiar potencjału dyfuzyjnego roztworów o różnych stężeniach jonów oddzielonych membranami: półprzepuszczalną i jonoselektywną w funkcji ich stężenia. Wykorzystanie równania Nernsta do
1. CEL ĆWICZENIA Pomiar potencjału dyfuzyjnego roztworów o różnych stężeniach jonów oddzielonych membranami: półprzepuszczalną i jonoselektywną w funkcji ich stężenia. Wykorzystanie równania Nernsta do
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
K1. KONDUKTOMETRYCZNE MIARECZKOWANIE STRĄCENIOWE I KOMPLEKSOMETRYCZNE
 K1. KONDUKTOMETRYCZNE MIARECZKOWANIE STRĄCENIOWE I KOMPLEKSOMETRYCZNE Postępowanie analityczne, znane pod nazwą miareczkowania konduktometrycznego, polega na wyznaczeniu punktu końcowego miareczkowania
K1. KONDUKTOMETRYCZNE MIARECZKOWANIE STRĄCENIOWE I KOMPLEKSOMETRYCZNE Postępowanie analityczne, znane pod nazwą miareczkowania konduktometrycznego, polega na wyznaczeniu punktu końcowego miareczkowania
1. Właściwości białek
 1. Właściwości białek a. 1. Cele lekcji i. a) Wiadomości Uczeń zna: Uczeń: właściwości białek, proces denaturacji białek, reakcje charakterystyczne dla białek. ii. b) Umiejętności rozróżnia reakcje charakterystyczne
1. Właściwości białek a. 1. Cele lekcji i. a) Wiadomości Uczeń zna: Uczeń: właściwości białek, proces denaturacji białek, reakcje charakterystyczne dla białek. ii. b) Umiejętności rozróżnia reakcje charakterystyczne
Zakład Biologii Molekularnej, Wydział Farmaceutyczny, WUM.
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
