Wykład 3 Nomenklatura, podział I czynniki regulujące kinetykę procesów enzymatycznych
|
|
|
- Zuzanna Maj
- 8 lat temu
- Przeglądów:
Transkrypt
1 ENZYMOLOGIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr I Wykład 3 Nomenklatura, podział I czynniki regulujące kinetykę procesów enzymatycznych WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
2 Zakres materiału ENZYMOLOGIA 1. Biochemia, Autor: Jeremy Berg, Lubert Stryer, John L. Tymoczko, PWN Warszawa (2005) Rozdziały: 8. Enzymy:: podstawowe pojęcia i kinetyka 9. Strategie katalityczne 10. Strategie regulacyjne:: enzymy i hemoglobina 2. Ćwiczenia z enzymologii i technik biochemicznych. Bartoszewska, Niziołek, Paszowski, Wydawnictwo SGGW 3. Handbook of Food Enzymology ed. John R. Whitaker et al., CRC Press; (2002) 4. Enzymes in Food Technology - ROBERT J. WHITEHURST, BARRY A. LAW, Editors Sheffield Academic Press CRC Press (2002) 3. Food chemistry - Hans- Dieter Belitz, Werner Grosch, Peter Schieberle, Springer (2004)
3 Nazewnictwo enzymów Nomenklatura i systematyka enzymów 1961 pierwsze podstawowe zasady nomenklatury i klasyfikacji enzymów przez Komisję Enzymatyczną powołaną przez Międzynarodową Unię Biochemiczną i Biologii Molekularnej (IUBMB) w 1955r 1972 Komitet Nazewnictwa (ang. Nomenclature Commihee) Międzynarodowej Unii Biochemii i Biologii Molekularnej w latach opracował dla enzymów nomenklaturę naukową numer EC Nomenklatura enzymów wydana przez Komitet Enzymowy (NC) IUBMB pozycja książkowa Nomenklatura EC: Każdy enzym jest opisany przez ciąg czterech segmentów cyfr, oddzielonych od siebie kropką, poprzedzonych literami "EC" (Enzyme Commission lub Enzyme Catalogue): EC x.xx.xx.xx. Pierwsza cyfra dzieli enzymy, według mechanizmu reakcji przez nie katalizowanych Następne liczby numeru EC oddzielone kropkami klasyfikują dany enzym odpowiednio do podklasy i podpodklasy, natomiast ostatnia liczba określa miejsce enzymu w podpodklasie. Nazewnictwo zwyczajowe W nazewnictwie enzymów zaleca się stosowanie numeru EC, jednak dopuszcza się stosowanie nazw zwyczajowych z przyrostkiem - aza, gdzie pierwszy człon określa reakcję, a drugi jej substrat
4 Nazewnictwo/klasyfikacja enzymów EC Enzymy dzieli się na 6 grup (mechanizm reakcji ): EC 1 oksydoreduktazy: katalizują reakcje utleniania i redukcji, EC 2 transferazy: przenoszą grupy funkcyjne, EC 3 hydrolazy: katalizują hydrolizę różnych wiązań, EC 4 liazy: rozcinają różne wiązania na drodze innej niż hydroliza czy utlenianie, EC 5 izomerazy: katalizują zmiany izomeracyjne cząsteczek, EC 6 ligazy: łączą cząsteczki wiązaniami kowalencyjnymi. EC1 oksydoreduktazy - AH 2 + B A + BH 2 ; EC2 transferazy - AB + C A + BC; EC3 hydrolazy - AB + H 2 O A + B; EC4 liazy - AB A + B; EC5 izomerazy - AB BA; EC6 ligazy - A + B AB;
5 Enzymy katalizujące reakcje oksydoredukcyjne, polegające na przenoszeniu elektronów, protonów lub polegające na bezpośrednim włączaniu tlenu do substratu. Klasa ta obejmuje następujące grupy enzymów Dehydrogenazy odwodorowanie, utlenianie przenośniki e - i H + - NAD +, FAD Reduktazy redukcja przenośniki e- i H+ - NADP+, FAD, ferredoksyna, cytochromy Oksydazy Peroksydazy Oksygenazy (a) i hydroksylazy (b) Oksydoreduktaza β- D- glukoza: tlen nazwa systematyczna Oksydaza glukozy nazwa potoczna EC numer klasyfikacyjny 4- kolejność w podklasie 3- akceptor: tlen 1- utleniana grupa w donorze: CH- OH 1- klasa enzymu (oksydoreduktaza) 1. OKSYDOREDUKTAZY Zastosowanie oksydoreduktaz: Do usuwania glukozy i tlenu z opakowań Do stabilizacji piwa, win, soków Do odcukrzania masy jajowej przed suszeniem Do oznaczania ilościowej glukozy
6 1. Klasa ta obejmuje enzymy katalizujące przeniesienie grup chemicznych pomiędzy poszczególnymi związkami i to zwykle przy udziale specyficznych koenzymów. 2. W zależności od rodzaju przenoszonych grup lub rodników wyróżniamy m.in.: - Aminotransferazy: przenoszą grupą aminową- NH 2 - Fosfotransferazy (kinazy): przenoszą grupy fosforanowe z udziałem ATP - Metylotransferazy: przenoszą grupę- CH 3 - Glikozylotransferazy: przenoszą grupy cukrowe - Acylotransferazy: przenoszą grupy acylowe 2,4,6- węglowe 6- fosfotransferaza ATP - enzym katalizujący przeniesienie fosforanu z ATP na grupę hydroksylową przy 6 at. węgla D- heksoza nazwa systematyczna Heksokinaza nazwa potoczna 2. TRANSFERAZY EC numer klasyfikacyjny 1- kolejność w podklasie 1- grupa akceptorowa: grupa alkoholowa 7- przenoszona grupa: grupa zawierająca fosfor 2- klasa enzymu
7 3. HYDROLAZY 1. Enzymy katalizujące reakcję hydrolizy, czyli rozkładu wiązań z udziałem cząsteczki wody. 2. Jest to jedna klasa enzymów, która nie wymaga obecności koenzymów 3. W zależności od rodzaju atakowanych wiązań rozróżniamy hydrolazy m.in.: - Etsterazy - rozkładające wiązania estrowe - Lipazy (hydrolazy estrów karboksylowych) - Fosfatazy (hydrolazy monoestrów fosforanowych) - Glikozydazy - hydrolizujące wiązania glikozydowe - np. amylazy, celulazy - Peptydazy - Hydrolizujące wiązania peptydowe np. trypsyna, pepsyna, chymotrypsyna - Amidohydrolazy - rozkładające wiązanie C- N inne niż peptydowe np. w amidach Galaktohydrolaza β-d-galaktozydu nazwa systematyczna β-d-galaktozydaza, laktaza nazwa potoczna EC kolejność w podklasie 1- hydrolizowane wiązanie dokładniej O- lub S- glikozylowe 2- hydrolizowane wiązanie: wiązanie glikozydowi 3- klasa enzymu
8 LAKATAZA produkcja mleka przy nietolerancji laktozy, hydroliza laktozy do glukozy i galaktozy polepsza rozpuszczalność, zmniejsza koncentrację sacharydów w produktach koncentratów z mleka i serwatki (łatwa produkcja lodów, deserów) glukoza słodsza od laktozy 3. HYDROLAZY (cz. II) rozkład glukozy przyspiesza fermentację mleka w technologii napojów fermentowanych, twarogów, serów SACHARAZA inwertaza (sacharaza, β- fruktofuranozydaza) hydrolizuje wiązanie α- 1,4- glikozydowe i powstaje α- D- glukoza i β- D- fruktoza produkcja cukru inwertowanego otrzymywanie fruktozy Fruktoza: najlepiej rozpuszczalna w wodzie słodzenie soków (nie krystalizuje w czasie przechowywania) higroskopijna zapobiega utracie wilgoci z żywności, np. owoce kandyzowane syropy fruktozowe (dla diabetyków)
9 Enzymy katalizujące odwracalne lub nieodwracalne rozerwanie różnych wiązań bez udziału wody, przy czym z substratu, na który działa enzym, odłączane są pewne grupy (np. CO 2, H 2 O, NH 3, aldehydy). Ze względu na rodzaj rozszczepianych wiązań wyróżniamy m.in. liazy: - dekarboksylazy - rozrywające wiązanie C- C - uwalniają CO 2 z substratów - aldolazy uwalniają aldehydy z substratu - dehydratazy - działające na wiązanie C- O odłączają cząsteczkę wody - hydratazy przyłączają i odłączają cząsteczkę wody - deaminazy - rozszczepiające wiązanie C- N odłączają NH 3 Do klasy tej należą SYNTAZY, które nie wymagają nakładu energii do syntezy wiązań. PRZYKŁAD: karboksyliaza 2- oksokwasów dekarboksylaza pirogronianowa 4. LIAZY EC numer klasyfikacyjny 1 - kolejność w podklasie 1 - odszczepiana grupa: grupa COO rozszczepiane wiązanie: wiązanie C- C 4 - klasa enzymu!
10 1. Klasa enzymów katalizujących przekształcenia wewnątrzcząsteczkowe. 2. Może to być przegrupowanie atomów bądź grup. 3. Skład chemiczny związku nie ulega zmianie. Należą tutaj enzymy katalizujące różne reakcje izomeryzacji, m.in.: - racemazy i epimerazy odpowiedzialne za zmianę konfiguracji przy węglu asymetrycznym (wzajemne przekształcenia konfiguracji L i D lub formy α i β) - mutazy odpowiedzialne za przemieszczenie grup wewnątrz cząsteczki - izomerazy cis- trans izomeria geometryczna (cis- trans) - izomerazy odpowiedzialne za wewnątrzcząsteczkowe przemiany oksydoredukcyjne (przesunięcie atomów H+) PRZYKŁAD: ketolo- izomeraza D- ksylozy izomeraza ksylozowa (glukozowa) 5. IZOMERAZY EC numer klasyfikacyjny 5 - kolejność w podpodklasie 1 - przekształcenie: przemiana aldoza ketoza 3 - typ przekształcenia: przegrupowanie atomów H 5 - klasa enzymu!
11 6. LIGAZY 1. Enzymy (pot. syntetazy) katalizujące syntezę powstanie nowych wiązań: C- O, C- S, C- N, C- C. 2. Wszystkie reakcje katalizowane przez ligazy zachodzą z udziałem ATP lub innego związku makroergicznego. Syntetazy katalizujące dołączenie do substratu CO 2 nazywamy potocznie karboksylazami. PRZYKŁAD: ligaza octan: CoA (AMP) syntetaza acetylo- CoA EC numer klasyfikacyjny 1 - kolejność w podklasie 1- substraty syntezy: kwas - vol 2 - powstające wiązanie: C- S 6 - klasa enzymu Ligaza DNA!
12 PORÓWNANIE KATALIZY I BIOKATALIZY PORÓWNYWANY CZYNNIK temperatura ph wrażliwość na zatrucia BIOKATALIZA Duże ograniczenie, potrzeba ścisłego kontrolowania warunków mniejsza (trucizny, inhibitory) KATALIZA Duży zakres temperatur stosowanych, mniej wrażliwe na zmiany warunków duża ( zatrucia) specyficzność duża w zależności od procesu selektywność duża w zależności od procesu żywotność duża mniejsza w porównaniu do biokatalizatorów możliwość aktywacji koenzymy, aktywatory promotory zakres stężeń reagentów nieduże różne
13 Czynniki regulujące szybkość działania enzymów 1. kinetyczne: temperatura, ph, dyfuzja, kształt, lepkość roztworu stężenie substratów obecność enzymatycznych aktywatorów i enzymatycznych inhibitorów czynniki pośrednie: czynniki allosteryczne, sprzężenie zwrotne, przemiana proenzymu w enzym 2. strukturalne: powiązanie enzymów z określonymi strukturami i ich rozgraniczenie błonami wewnątrzkomórkowymi regulowany transport przez błony komórkowe i cytoplazmatyczne szybkość odprowadzania produktów
14 KINETYKA REAKCJI ENZYMATYCZNYCH 1. Kinetyka badanie szybkości, z jaką przebiega reakcja oraz czynników wpływających na tą czynność reakcji. Nie zajmuje się naturą chemiczną zmian. 2. Kinetyczny opis aktywności enzymów jest konieczny do zrozumienia działania enzymów. Czynniki: - stężenie enzymów i substratu - występowanie i stężenie kofaktorów, inhibitorów i aktywatorów - temperatura - stężenie H + (ph) - oddziaływania allosteryczne, modyfikacje kowalencyjne, aktywacja proteolityczna Wpływ stężenia enzymu na szybkość reakcji enzymatycznej V Zależność wprost proporcjonalna 2x większe stężenie E => 2x szybsza reakcje ALE Substrat w nadmiarze! [E]
15 KINETYKA REAKCJI ENZYMATYCZNYCH 1. Oznaczanie aktywności enzymatycznej wykonuje się na początku reakcji enzymatycznej, ponieważ może dojść do: - hamowania aktywności enzymatycznej produktem na drodze hamowania zwrotnego, - enaturacji białka enzymatycznego. Wpływ temperatury V Działa na cząsteczki S i E. temp. => en. kinetycznej cz. S Cząsteczki substratu szybciej się poruszają, zderzają się częściej, więcej z nich może osiągnąć stan przejściowy. [ C] 1. W pewnym momencie osiągnięta zostaje temp. optymalna dla działania enzymu. 2. Temperatura optymalna temperatura, przy której szybkość reakcji enzymatycznej biegnie z maksymalną szybkością, a nie ma miejsca jeszcze denaturacja białka enzymatycznego. 3. Zbyt wysoka temperatura powoduje drgania w cząsteczkach enzymu i dochodzi do rozerwania wiązań w enzymie.
16 Reguła van Hoffa Wzrost temperatury o 10 C powoduje: krotny wzrost szybkości reakcji nieenzymatycznej krotny wzrost szybkości reakcji enzymatycznej Równanie Arrheniusa KINETYKA REAKCJI ENZYMATYCZNYCH Opvmum temperatury zależy od czasu przyjętego do obliczenia szybkości reakcji. Termostabilność enzymu możemy określić podając najwyższą temperaturę, w której jeszcze nie dochodzi do termicznej inaktywacji enzymu. Badanie wpływu temperatury na aktywność enzymu: - przygotowuje się mieszaninę reakcyjną S + E, ph, bufor; mieszaninę przenosi się do określonej temperatury i reakcja enzymatyczna zachodzi właśnie w takiej określonej temperaturze, następnie zatrzymujemy reakcję i mierzymy szybkość reakcji enzymatycznej.
17 Badanie termostabilności białka: KINETYKA REAKCJI ENZYMATYCZNYCH - Badanie temperatury, w której enzym zachowuje aktywność. - Białko enzymatyczne poddaje się traktowaniu różnymi temperaturami badamy, jak ten enzym zachowuje się w różnych temperaturach. - Białko enzymatyczne przenosi się do temperatury optymalnej i dodaje pozostałe składniki reakcyjne. - Reakcja enzymatyczna biegnie w temperaturze optymalnej. Termostabilność celulaz różne mikroorganizmy
18 Kinetyka reakcji enzymatycznych - wpływ ph ph środowiska wpływa na: wiązanie substratu przez E, aktywność katalityczną E, stan jonizacji substratu, zmiany w strukturze przestrzennej E. ph wpływa na stopień zdysocjowania (uprotonowania): - grup funkcyjnych centrum aktywnego, - grup funkcyjnych, które uczestniczą w katalizie, - grup funkcyjnych substratu, które uczestniczą w wiązaniu do enzymu, - grup funkcyjnych leżących w pobliżu centrum aktywnego, które decydują o konformacji tego centrum aktywnego. Optymalne ph działania wartość ph, przy której szybkość katalizowanej reakcji jest maksymalna. Krzywe zależności v/ph mogą być też prostoliniowe. Niewielkie odchylenie ph od wartości optymalnych powoduje nagły spadek szybkości reakcji enzymatycznej.
19 Kinetyka reakcji enzymatycznych optymalne ph Optymalne ph reakcji jest różne dla różnych enzymów. Dla większości mieści się w granicach odczynu obojętnego (ph 6-9). pepsyna 1,8 proteinaza kwaśna 3,5 trypsyna 8 arginaza 10
20 Kinetyka reakcji enzymatycznych - wpływ ph
21 Kinetyka reakcji enzymatycznych wpływ podstawowych czynników
22 WPŁYW ŚRODOWISKA NA SZYBKOŚĆ REAKCJI
23 STĘŻENIE SOLI
24 Kinetyka reakcji enzymatycznych wpływ innych czynników Inne czynniki szybkość dyfuzji jest odwrotnie proporcjonalna od wielkości cząsteczek (dla wody w temp C wynosi 2, cm/s), kształt i wielkość cząsteczek, lepkość roztworu. Działanie czynników regulujących potencjał oksydoredukcyjny środowiska - aktywacja enzymów zawierających w centrum katalitycznym wolne grupy hydrosulfidowe SH - aktywatory: substancje o niskim potencjale oksydoredukcyjnym (reduktory) zwykle zawierające grupy SH, np.: cysteina, glutavon, merkaptoetanol - enzymy: papaina, dehydrogenaza alkoholowa i inne
Mechanizmy działania i regulacji enzymów
 Mechanizmy działania i regulacji enzymów Enzymy: są katalizatorami, które zmieniają szybkość reakcji, same nie ulegając zmianie są wysoce specyficzne ich aktywność może być regulowana m.in. przez modyfikacje
Mechanizmy działania i regulacji enzymów Enzymy: są katalizatorami, które zmieniają szybkość reakcji, same nie ulegając zmianie są wysoce specyficzne ich aktywność może być regulowana m.in. przez modyfikacje
Przemiana materii i energii - Biologia.net.pl
 Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Enzymy katalizatory biologiczne
 Enzymy katalizatory biologiczne Kataliza zjawisko polegające na obniżeniu energii aktywacji reakcji i zwiększeniu szybkości reakcji chemicznej i/lub skierowaniu reakcji na jedną z termodynamicznie możliwych
Enzymy katalizatory biologiczne Kataliza zjawisko polegające na obniżeniu energii aktywacji reakcji i zwiększeniu szybkości reakcji chemicznej i/lub skierowaniu reakcji na jedną z termodynamicznie możliwych
Wykład 2. Kinetyka reakcji enzymatycznych.
 Wykład 2 Kinetyka reakcji enzymatycznych. Kofaktory enzymów wd_2 2 Ryboflawina witamina B 2 Ryboflawina wit. B 2 FAD dinukleotyd flawinoadeninowy wd_2 3 Niacyna witamina PP (B 3 ) NAD + dinukleotyd nikotynamidoadeninowy
Wykład 2 Kinetyka reakcji enzymatycznych. Kofaktory enzymów wd_2 2 Ryboflawina witamina B 2 Ryboflawina wit. B 2 FAD dinukleotyd flawinoadeninowy wd_2 3 Niacyna witamina PP (B 3 ) NAD + dinukleotyd nikotynamidoadeninowy
Bliskie spotkania z biologią METABOLIZM. dr hab. Joanna Moraczewska, prof. UKW. Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki
 Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
KINETYKA HYDROLIZY SACHAROZY
 Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
Spis treści. 1. Wiadomości wstępne Skład chemiczny i funkcje komórki Przedmowa do wydania czternastego... 13
 Przedmowa do wydania czternastego... 13 Częściej stosowane skróty... 15 1. Wiadomości wstępne... 19 1.1. Rys historyczny i pojęcia podstawowe... 19 1.2. Znaczenie biochemii w naukach rolniczych... 22 2.
Przedmowa do wydania czternastego... 13 Częściej stosowane skróty... 15 1. Wiadomości wstępne... 19 1.1. Rys historyczny i pojęcia podstawowe... 19 1.2. Znaczenie biochemii w naukach rolniczych... 22 2.
KINETYKA HYDROLIZY SACHAROZY (REAKCJA ENZYMATYCZNA I CHEMICZNA)
 Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY (REAKCJA ENZYMATYCZNA I CHEMICZNA) ĆWICZENIE PRAKTYCZNE I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie
Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY (REAKCJA ENZYMATYCZNA I CHEMICZNA) ĆWICZENIE PRAKTYCZNE I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Biochemia Oddychanie wewnątrzkomórkowe
 Państwowa Wyższa Szkoła Zawodowa w Krośnie Biochemia Oddychanie wewnątrzkomórkowe Dr n. biol. Henryk Różański Laboratorium Biologii Przemysłowej i Eksperymentalnej Oddychanie Glikoliza beztlenowy, wewnątrzkomórkowy
Państwowa Wyższa Szkoła Zawodowa w Krośnie Biochemia Oddychanie wewnątrzkomórkowe Dr n. biol. Henryk Różański Laboratorium Biologii Przemysłowej i Eksperymentalnej Oddychanie Glikoliza beztlenowy, wewnątrzkomórkowy
Enzymologia SYLABUS A. Informacje ogólne
 Enzymologia A. Informacje ogólne Elementy sylabusu Nazwa jednostki prowadzącej kierunek Nazwa kierunku studiów Poziom kształcenia Profil studiów Forma studiów Kod Język Rodzaj Rok studiów /semestr Wymagania
Enzymologia A. Informacje ogólne Elementy sylabusu Nazwa jednostki prowadzącej kierunek Nazwa kierunku studiów Poziom kształcenia Profil studiów Forma studiów Kod Język Rodzaj Rok studiów /semestr Wymagania
Przegląd budowy i funkcji białek - od enzymów do prionów -
 Przegląd budowy i funkcji białek - od enzymów do prionów - Zakład Biologii Molekularnej Instytut Biochemii, Wydział Biologii UW Takao Ishikawa Kontakt Imię i nazwisko: Takao Ishikawa Mail: takao@biol.uw.edu.pl
Przegląd budowy i funkcji białek - od enzymów do prionów - Zakład Biologii Molekularnej Instytut Biochemii, Wydział Biologii UW Takao Ishikawa Kontakt Imię i nazwisko: Takao Ishikawa Mail: takao@biol.uw.edu.pl
Trawienie i wchłanianie substancji odżywczych
 Trawienie i wchłanianie substancji odżywczych Człowiek, aby mógł się rozwijać, wzrastać i wykonywać podstawowe funkcje życiowe musi się odżywiać. Poprzez ten proces każda komórka organizmu otrzymuje niezbędne
Trawienie i wchłanianie substancji odżywczych Człowiek, aby mógł się rozwijać, wzrastać i wykonywać podstawowe funkcje życiowe musi się odżywiać. Poprzez ten proces każda komórka organizmu otrzymuje niezbędne
Bliskie spotkania z biologią METABOLIZM. dr hab. Joanna Moraczewska, prof. UKW. Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki
 Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Oddychanie komórkowe. Pozyskiwanie i przetwarzanie energii w komórkach roślinnych. Oddychanie zachodzi w mitochondriach Wykład 7.
 Wykład 7. Pozyskiwanie i przetwarzanie energii w komórkach roślinnych Literatura dodatkowa: Oddychanie to wielostopniowy proces utleniania substratów związany z wytwarzaniem w komórce metabolicznie użytecznej
Wykład 7. Pozyskiwanie i przetwarzanie energii w komórkach roślinnych Literatura dodatkowa: Oddychanie to wielostopniowy proces utleniania substratów związany z wytwarzaniem w komórce metabolicznie użytecznej
Wykład 1 Enzymologia a technlogia żywności.
 ENZYMOLOGIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr I Wykład 1 Enzymologia a technlogia żywności. WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW
ENZYMOLOGIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr I Wykład 1 Enzymologia a technlogia żywności. WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW
Laboratorium 5. Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna
 Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014
 Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014 S E M E S T R II Tydzień 1 24.02-28.02 2 03.03-07.03 3 10.03-14.03 Wykłady
Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014 S E M E S T R II Tydzień 1 24.02-28.02 2 03.03-07.03 3 10.03-14.03 Wykłady
Bliskie spotkania z biologią METABOLIZM. dr hab. Joanna Moraczewska, prof. UKW. Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki
 Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Enzymy. Ogólne właściwości Kinetyka i inhibicja reakcji enzymatycznych Regulacja aktywności enzymatycznej
 Enzymy Ogólne właściwości Kinetyka i inhibicja reakcji enzymatycznych Regulacja aktywności enzymatycznej Enzymy jako biokatalizatory głównie białka (także RNA rybozymy, DNA DNA-zymy) wytwarzane tylko przez
Enzymy Ogólne właściwości Kinetyka i inhibicja reakcji enzymatycznych Regulacja aktywności enzymatycznej Enzymy jako biokatalizatory głównie białka (także RNA rybozymy, DNA DNA-zymy) wytwarzane tylko przez
ENZYMY W CHEMII. Michał Rachwalski. Uniwersytet Łódzki, Wydział Chemii, Katedra Chemii Organicznej i Stosowanej
 ENZYMY W CHEMII Michał Rachwalski Uniwersytet Łódzki, Wydział Chemii, Katedra Chemii rganicznej i Stosowanej Czym są enzymy? Enzymy są białkami zawierającymi od 60 do 1000 reszt aminokwasów; Enzymy są
ENZYMY W CHEMII Michał Rachwalski Uniwersytet Łódzki, Wydział Chemii, Katedra Chemii rganicznej i Stosowanej Czym są enzymy? Enzymy są białkami zawierającymi od 60 do 1000 reszt aminokwasów; Enzymy są
BIAŁKA KATALITYCZNE ENZYMY ENZYMOLOGIA
 BIAŁKA KATALITYCZNE ENZYMY ENZYMOLOGIA dr hab. prof. AWF Agnieszka Zembroń-Łacny Zamiejscowy Wydział Kultury Fizycznej w Gorzowie Wlkp. Akademii Wychowania Fizycznego w Poznaniu ROBACZKI ŚWIĘTOJAŃSKIE
BIAŁKA KATALITYCZNE ENZYMY ENZYMOLOGIA dr hab. prof. AWF Agnieszka Zembroń-Łacny Zamiejscowy Wydział Kultury Fizycznej w Gorzowie Wlkp. Akademii Wychowania Fizycznego w Poznaniu ROBACZKI ŚWIĘTOJAŃSKIE
Wykład 14 Biosynteza białek
 BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
Reakcje enzymatyczne. Co to jest enzym? Grupy katalityczne enzymu. Model Michaelisa-Mentena. Hamowanie reakcji enzymatycznych. Reakcje enzymatyczne
 Reakcje enzymatyczne Enzym białko katalizujące reakcje chemiczne w układach biologicznych (przyśpieszają reakcje przynajmniej 0 6 raza) 878, Wilhelm uehne, użył po raz pierwszy określenia enzym (w zaczynie)
Reakcje enzymatyczne Enzym białko katalizujące reakcje chemiczne w układach biologicznych (przyśpieszają reakcje przynajmniej 0 6 raza) 878, Wilhelm uehne, użył po raz pierwszy określenia enzym (w zaczynie)
ENZYMOLOGIA. Ćwiczenie 2. Hydrolazy. Czynniki wpływające na szybkość reakcji enzymatycznych
 ENZYMOLOGIA Wydział Nauk o Żywności i Rybactwa Centrum Bioimmobilizacji i Innowacyjnych Materiałów Opakowaniowych ul. Klemensa Janickiego 35 71-270 Szczecin Ćwiczenie 2 Hydrolazy. Czynniki wpływające na
ENZYMOLOGIA Wydział Nauk o Żywności i Rybactwa Centrum Bioimmobilizacji i Innowacyjnych Materiałów Opakowaniowych ul. Klemensa Janickiego 35 71-270 Szczecin Ćwiczenie 2 Hydrolazy. Czynniki wpływające na
KINETYKA INWERSJI SACHAROZY
 Dorota Warmińska, Maciej Śmiechowski Katedra Chemii Fizycznej, Wydział Chemiczny, Politechnika Gdańska KINETYKA INWERSJI SACHAROZY Wstęp teoretyczny Kataliza kwasowo-zasadowa Kataliza kwasowo-zasadowa
Dorota Warmińska, Maciej Śmiechowski Katedra Chemii Fizycznej, Wydział Chemiczny, Politechnika Gdańska KINETYKA INWERSJI SACHAROZY Wstęp teoretyczny Kataliza kwasowo-zasadowa Kataliza kwasowo-zasadowa
ENZYMOLOGIA. Ćwiczenie 4. α-amylaza (cz. I) Oznaczanie aktywności enzymu metodą kolorymetryczną
 ENZYMOLOGIA Wydział Nauk o Żywności i Rybactwa Centrum Bioimmobilizacji i Innowacyjnych Materiałów Opakowaniowych ul. Klemensa Janickiego 35 71-270 Szczecin Ćwiczenie 4 α-amylaza (cz. I) Oznaczanie aktywności
ENZYMOLOGIA Wydział Nauk o Żywności i Rybactwa Centrum Bioimmobilizacji i Innowacyjnych Materiałów Opakowaniowych ul. Klemensa Janickiego 35 71-270 Szczecin Ćwiczenie 4 α-amylaza (cz. I) Oznaczanie aktywności
Nukleotydy w układach biologicznych
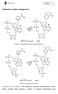 Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Metody fosforylacji. Schemat 1. Powstawanie trifosforanu nukleozydu
 Metody fosforylacji Fosforylacja jest procesem przenoszenia reszty fosforanowej do nukleofilowego atomu dowolnego związku chemicznego. Najczęściej fosforylację przeprowadza się na atomie tlenu grupy hydroksylowej
Metody fosforylacji Fosforylacja jest procesem przenoszenia reszty fosforanowej do nukleofilowego atomu dowolnego związku chemicznego. Najczęściej fosforylację przeprowadza się na atomie tlenu grupy hydroksylowej
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych
 Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI CHEMICZNYCH. ILOŚCIOWE ZBADANIE SZYBKOŚCI ROZPADU NADTLENKU WODORU.
 CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI CHEMICZNYCH. ILOŚCIOWE ZBADANIE SZYBKOŚCI ROZPADU NADTLENKU WODORU. Projekt zrealizowany w ramach Mazowieckiego programu stypendialnego dla uczniów szczególnie uzdolnionych
CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI CHEMICZNYCH. ILOŚCIOWE ZBADANIE SZYBKOŚCI ROZPADU NADTLENKU WODORU. Projekt zrealizowany w ramach Mazowieckiego programu stypendialnego dla uczniów szczególnie uzdolnionych
Kinetyka reakcji chemicznych. Dr Mariola Samsonowicz
 Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
III. OZNACZANIE AKTYWNOŚCI KWAŚNEJ FOSFATAZY W HOMOGENACIE Z KIEŁKÓW ROŚLINNYCH
 III. OZNACZANIE AKTYWNOŚCI KWAŚNEJ FOSFATAZY W HOMOGENACIE Z KIEŁKÓW ROŚLINNYCH I. WSTĘP Enzymy są to katalizatory, które zwiększają szybkość reakcji chemicznej, same nie ulegając zmianie. Przy braku enzymów
III. OZNACZANIE AKTYWNOŚCI KWAŚNEJ FOSFATAZY W HOMOGENACIE Z KIEŁKÓW ROŚLINNYCH I. WSTĘP Enzymy są to katalizatory, które zwiększają szybkość reakcji chemicznej, same nie ulegając zmianie. Przy braku enzymów
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Badanie wpływu temperatury, ph, aktywatorów i inhibitorów na aktywność α-amylazy Wstęp Szybkość reakcji enzymatycznej jest
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Badanie wpływu temperatury, ph, aktywatorów i inhibitorów na aktywność α-amylazy Wstęp Szybkość reakcji enzymatycznej jest
prof. dr hab. Maciej Ugorski Efekty kształcenia 2 Posiada podstawowe wiadomości z zakresu enzymologii BC_1A_W04
 BIOCHEMIA (BC) Kod przedmiotu Nazwa przedmiotu Kierunek Poziom studiów Profil Rodzaj przedmiotu Semestr studiów 2 ECTS 5 Formy zajęć Osoba odpowiedzialna za przedmiot Język Wymagania wstępne Skrócony opis
BIOCHEMIA (BC) Kod przedmiotu Nazwa przedmiotu Kierunek Poziom studiów Profil Rodzaj przedmiotu Semestr studiów 2 ECTS 5 Formy zajęć Osoba odpowiedzialna za przedmiot Język Wymagania wstępne Skrócony opis
Chemia ogólna nieorganiczna Wykład XII Kinetyka i statyka chemiczna
 Chemia ogólna nieorganiczna Wykład 10 14 XII 2016 Kinetyka i statyka chemiczna Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od
Chemia ogólna nieorganiczna Wykład 10 14 XII 2016 Kinetyka i statyka chemiczna Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od
Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ
 Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
Laboratorium 4. Określenie aktywności katalitycznej enzymu. Wprowadzenie do metod analitycznych. 1. CZĘŚĆ TEORETYCZNA
 Laboratorium 4 Określenie aktywności katalitycznej enzymu. Wprowadzenie do metod analitycznych. Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Enzymy to wielkocząsteczkowe, w większości białkowe,
Laboratorium 4 Określenie aktywności katalitycznej enzymu. Wprowadzenie do metod analitycznych. Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Enzymy to wielkocząsteczkowe, w większości białkowe,
ENZYMY. KINETYKA REAKCJI ENZYMATYCZNYCH
 Ćwiczenie 7 ENZYMY. KINETYKA REAKCJI ENZYMATYCZNYCH Część doświadczalna obejmuje: - wyznaczenie optimum ph dla reakcji katalizowanej przez kwaśną fosfatazę - wyznaczenie szybkości początkowej reakcji katalizowanej
Ćwiczenie 7 ENZYMY. KINETYKA REAKCJI ENZYMATYCZNYCH Część doświadczalna obejmuje: - wyznaczenie optimum ph dla reakcji katalizowanej przez kwaśną fosfatazę - wyznaczenie szybkości początkowej reakcji katalizowanej
PRZEWODNIK DYDAKTYCZNY PRZEDMIOTU
 PRZEWODNIK DYDAKTYCZNY PRZEDMIOTU (SYLABUS) NAZWA JEDNOSTKI PROWADZĄCEJ KIERUNEK: Zakład Biologii Molekularnej NAZWA KIERUNKU: Biotechnologia PROFIL KSZTAŁCENIA: ogólnoakademicki SPECJALNOŚĆ: Biotechnologia
PRZEWODNIK DYDAKTYCZNY PRZEDMIOTU (SYLABUS) NAZWA JEDNOSTKI PROWADZĄCEJ KIERUNEK: Zakład Biologii Molekularnej NAZWA KIERUNKU: Biotechnologia PROFIL KSZTAŁCENIA: ogólnoakademicki SPECJALNOŚĆ: Biotechnologia
Badanie termostabilności oraz wpływu aktywatorów i inhibitorów na działanie α-amylazy [EC ]
![Badanie termostabilności oraz wpływu aktywatorów i inhibitorów na działanie α-amylazy [EC ] Badanie termostabilności oraz wpływu aktywatorów i inhibitorów na działanie α-amylazy [EC ]](/thumbs/66/55837946.jpg) Badanie termostabilności oraz wpływu aktywatorów i inhibitorów na działanie α-amylazy [EC 3.2.1.1.] Termostabilność enzymów Dla większości enzymów zmiany denaturacyjne zachodzą bardzo intensywnie powyżej
Badanie termostabilności oraz wpływu aktywatorów i inhibitorów na działanie α-amylazy [EC 3.2.1.1.] Termostabilność enzymów Dla większości enzymów zmiany denaturacyjne zachodzą bardzo intensywnie powyżej
KI + Pb(NO 3 ) 2 PbI 2 + KNO 3. fermentacja alkoholowa
 Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Wykład 21 XI 2018 Żywienie
 Wykład 21 XI 2018 Żywienie Witold Bekas SGGW Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od warunków przebiegu reakcji pomaga
Wykład 21 XI 2018 Żywienie Witold Bekas SGGW Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od warunków przebiegu reakcji pomaga
Projektowanie Procesów Biotechnologicznych
 Projektowanie Procesów Biotechnologicznych wykład 14 styczeń 2014 Kinetyka prostych reakcji enzymatycznych Kinetyka hamowania reakcji enzymatycznych 1 Enzymy - substancje białkowe katalizujące przemiany
Projektowanie Procesów Biotechnologicznych wykład 14 styczeń 2014 Kinetyka prostych reakcji enzymatycznych Kinetyka hamowania reakcji enzymatycznych 1 Enzymy - substancje białkowe katalizujące przemiany
SPIS TREŚCI OD AUTORÓW... 5
 SPIS TREŚCI OD AUTORÓW... 5 BIAŁKA 1. Wprowadzenie... 7 2. Aminokwasy jednostki strukturalne białek... 7 2.1. Klasyfikacja aminokwasów... 9 2.1.1. Aminokwasy białkowe i niebiałkowe... 9 2.1.2. Zdolność
SPIS TREŚCI OD AUTORÓW... 5 BIAŁKA 1. Wprowadzenie... 7 2. Aminokwasy jednostki strukturalne białek... 7 2.1. Klasyfikacja aminokwasów... 9 2.1.1. Aminokwasy białkowe i niebiałkowe... 9 2.1.2. Zdolność
etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
 Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. a RT.
 Ćwiczenie 12, 13. Kinetyka chemiczna. Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. Szybkość reakcji chemicznej jest związana
Ćwiczenie 12, 13. Kinetyka chemiczna. Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. Szybkość reakcji chemicznej jest związana
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych
 Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
Co to jest FERMENTACJA?
 Co to jest FERMENTACJA? FERMENTACJA - rozkład niektórych monosacharydów, np. glukozy, pod wpływem enzymów wydzielanych przez drożdże lub bakterie. czyli tzw. biokatalizatorów. Enzymy (biokatalizatory)
Co to jest FERMENTACJA? FERMENTACJA - rozkład niektórych monosacharydów, np. glukozy, pod wpływem enzymów wydzielanych przez drożdże lub bakterie. czyli tzw. biokatalizatorów. Enzymy (biokatalizatory)
KI + Pb(NO 3 ) 2 PbI 2 + KNO 3. fermentacja alkoholowa
 Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Mechanizm działania buforów *
 Mechanizm działania buforów * UNIWERSYTET PRZYRODNICZY Z doświadczenia nabytego w laboratorium wiemy, że dodanie kropli stężonego kwasu do 10 ml wody powoduje gwałtowny spadek ph o kilka jednostek. Tymczasem
Mechanizm działania buforów * UNIWERSYTET PRZYRODNICZY Z doświadczenia nabytego w laboratorium wiemy, że dodanie kropli stężonego kwasu do 10 ml wody powoduje gwałtowny spadek ph o kilka jednostek. Tymczasem
pobrano z
 ODPOWIEDZI Zadanie 1. (2 pkt) 1. promienia atomowego, promienia jonowego 2. najwyższego stopnia utlenienia Zadanie 2. (1 pkt) 1. Pierwiastek I jest aktywnym metalem. Tworzy wodorek, w którym wodór przyjmuje
ODPOWIEDZI Zadanie 1. (2 pkt) 1. promienia atomowego, promienia jonowego 2. najwyższego stopnia utlenienia Zadanie 2. (1 pkt) 1. Pierwiastek I jest aktywnym metalem. Tworzy wodorek, w którym wodór przyjmuje
Oksydoreduktazy i transferazy.
 ENZYMOLOGIA Wydział Nauk o Żywności i Rybactwa Centrum Bioimmobilizacji i Innowacyjnych Materiałów Opakowaniowych ul. Klemensa Janickiego 35 71-270 Szczecin Ćwiczenie 1 Oksydoreduktazy i transferazy. Ogólne
ENZYMOLOGIA Wydział Nauk o Żywności i Rybactwa Centrum Bioimmobilizacji i Innowacyjnych Materiałów Opakowaniowych ul. Klemensa Janickiego 35 71-270 Szczecin Ćwiczenie 1 Oksydoreduktazy i transferazy. Ogólne
Projekt Era inżyniera pewna lokata na przyszłość jest współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 TEMAT I WYBRANE WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH. STOPNIE UTLENIENIA. WIĄZANIA CHEMICZNE. WZORY SUMARYCZNE I STRUKTURALNE. TYPY REAKCJI CHEMICZNYCH. ILOŚCIOWA INTERPRETACJA WZORÓW I RÓWNAŃ CHEMICZNYCH
TEMAT I WYBRANE WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH. STOPNIE UTLENIENIA. WIĄZANIA CHEMICZNE. WZORY SUMARYCZNE I STRUKTURALNE. TYPY REAKCJI CHEMICZNYCH. ILOŚCIOWA INTERPRETACJA WZORÓW I RÓWNAŃ CHEMICZNYCH
Zagadnienia. Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I
 Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Komputerowe wspomaganie projektowanie leków
 Komputerowe wspomaganie projektowanie leków wykład II Prof. dr hab. Sławomir Filipek Grupa BIOmodelowania Uniwersytet Warszawski, Wydział Chemii oraz Centrum Nauk Biologiczno-Chemicznych Cent-III www.biomodellab.eu
Komputerowe wspomaganie projektowanie leków wykład II Prof. dr hab. Sławomir Filipek Grupa BIOmodelowania Uniwersytet Warszawski, Wydział Chemii oraz Centrum Nauk Biologiczno-Chemicznych Cent-III www.biomodellab.eu
PODSTAWOWE PROCESY METABOLICZNE ORGANIZMÓW
 PODSTAWOWE PROCESY METABOLICZNE ORGANIZMÓW METABOLIZM (gr. metabole = przemiana) - przemiana materii - całość procesów biochemicznych zachodzących w żywych organizmach, warunkujących ich wzrost i funkcjonowanie.
PODSTAWOWE PROCESY METABOLICZNE ORGANIZMÓW METABOLIZM (gr. metabole = przemiana) - przemiana materii - całość procesów biochemicznych zachodzących w żywych organizmach, warunkujących ich wzrost i funkcjonowanie.
Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną ĆWICZENIE 5 OZNACZANIE AKTYWNOŚCI -AMYLAZY SŁODU METODĄ KOLORYMETRYCZNĄ Enzymy
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną ĆWICZENIE 5 OZNACZANIE AKTYWNOŚCI -AMYLAZY SŁODU METODĄ KOLORYMETRYCZNĄ Enzymy
Ćwiczenie 6 Aminokwasy
 Ćwiczenie 6 Aminokwasy Aminokwasy są to związki dwufunkcyjne, których cząsteczki zawierają grupy karboksylowe i aminowe: grupa aminowa:nh 2 grupa karboksylowa COOH Nomenklatura aminokwasów: Naturalne aminokwasy
Ćwiczenie 6 Aminokwasy Aminokwasy są to związki dwufunkcyjne, których cząsteczki zawierają grupy karboksylowe i aminowe: grupa aminowa:nh 2 grupa karboksylowa COOH Nomenklatura aminokwasów: Naturalne aminokwasy
Inżynieria Biomedyczna
 1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
METODY PRZECHOWYWANIA I UTRWALANIA BIOPRODUKTÓW SUSZENIE PODSTAWY TEORETYCZNE CZ.1
 METODY PRZECHOWYWANIA I UTRWALANIA BIOPRODUKTÓW SUSZENIE PODSTAWY TEORETYCZNE CZ.1 Opracował: dr S. Wierzba Katedra Biotechnologii i Biologii Molekularnej Uniwersytetu Opolskiego Suszenie mikroorganizmów
METODY PRZECHOWYWANIA I UTRWALANIA BIOPRODUKTÓW SUSZENIE PODSTAWY TEORETYCZNE CZ.1 Opracował: dr S. Wierzba Katedra Biotechnologii i Biologii Molekularnej Uniwersytetu Opolskiego Suszenie mikroorganizmów
Biochemia Ćwiczenie 4
 Imię i nazwisko Uzyskane punkty Nr albumu data /2 podpis asystenta ĆWICZENIE 4 KINETYKA REAKCJI ENZYMATYCZNYCH Wstęp merytoryczny Peroksydazy są enzymami występującymi powszechne zarówno w świecie roślinnym
Imię i nazwisko Uzyskane punkty Nr albumu data /2 podpis asystenta ĆWICZENIE 4 KINETYKA REAKCJI ENZYMATYCZNYCH Wstęp merytoryczny Peroksydazy są enzymami występującymi powszechne zarówno w świecie roślinnym
1. Oznaczanie aktywności lipazy trzustkowej i jej zależności od stężenia enzymu oraz żółci jako modulatora reakcji enzymatycznej.
 ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Transport przez błony
 Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu
 Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
Spis treści. Od Autora 9. Wprowadzenie 11 CZĘŚĆ A. MOLEKULARNE MENU 13
 Spis treści Od Autora 9 Wprowadzenie 11 CZĘŚĆ A. MOLEKULARNE MENU 13 1. Białka 13 1.1. Budowa białek 13 1.1.1. Peptydy 15 1.1.2. Struktury przestrzenne łańcuchów polipeptydowych 16 1.1.2.1. Bioróżnorodność
Spis treści Od Autora 9 Wprowadzenie 11 CZĘŚĆ A. MOLEKULARNE MENU 13 1. Białka 13 1.1. Budowa białek 13 1.1.1. Peptydy 15 1.1.2. Struktury przestrzenne łańcuchów polipeptydowych 16 1.1.2.1. Bioróżnorodność
KARTA KURSU. Chemia fizyczna I. Physical Chemistry I
 Biologia, I stopień, studia stacjonarne, 2017/2018, II semestr KARTA KURSU Nazwa Nazwa w j. ang. Chemia fizyczna I Physical Chemistry I Koordynator Prof. dr hab. Maria Filek Zespół dydaktyczny Prof. dr
Biologia, I stopień, studia stacjonarne, 2017/2018, II semestr KARTA KURSU Nazwa Nazwa w j. ang. Chemia fizyczna I Physical Chemistry I Koordynator Prof. dr hab. Maria Filek Zespół dydaktyczny Prof. dr
Czy produkcja żywności to procesy fizyczne i reakcje chemiczne?
 Czy produkcja żywności to procesy fizyczne i reakcje chemiczne? Co to jest przemiana fizyczna? Podaj przykład przemiany fizycznej? Co to jest przemiana chemiczna? Podaj przykład przemiany chemicznej? Doświadczenie
Czy produkcja żywności to procesy fizyczne i reakcje chemiczne? Co to jest przemiana fizyczna? Podaj przykład przemiany fizycznej? Co to jest przemiana chemiczna? Podaj przykład przemiany chemicznej? Doświadczenie
ZMIANY CECH PRODUKTÓW PODCZAS ZAMRAŻANIA
 METODY PRZECHOWYWANIA I UTRWALANIA BIOPRODUKTÓW ZMIANY CECH PRODUKTÓW PODCZAS ZAMRAŻANIA Opracował: dr S. Wierzba Katedra Biotechnologii i Biologii Molekularnej Uniwersytetu Opolskiego Nietrwałość produktów
METODY PRZECHOWYWANIA I UTRWALANIA BIOPRODUKTÓW ZMIANY CECH PRODUKTÓW PODCZAS ZAMRAŻANIA Opracował: dr S. Wierzba Katedra Biotechnologii i Biologii Molekularnej Uniwersytetu Opolskiego Nietrwałość produktów
Ćwiczenie nr 3 Kinetyka enzymatyczna
 Ćwiczenie nr 3 Kinetyka enzymatyczna Celem ćwiczenia jest: omówienie peroksydaz i metod oznaczania katalitycznej aktywności peroksydaz omówienie procesu odwracalnej i nieodwracalnej denaturacji i renaturacji
Ćwiczenie nr 3 Kinetyka enzymatyczna Celem ćwiczenia jest: omówienie peroksydaz i metod oznaczania katalitycznej aktywności peroksydaz omówienie procesu odwracalnej i nieodwracalnej denaturacji i renaturacji
- substancja, której mała ilość przyspiesza reakcję chemiczną i która nie ulega przy tym zużyciu
 Ćwiczenie nr 3 Enzymy klasyfikacja; peroksydaza, reakcja katalizowana; peroksydaza chrzanowa; oznaczanie katalitycznej aktywności; denaturacja/renaturacja, kinetyka reakcji 0- i I- rzędu oraz obliczanie
Ćwiczenie nr 3 Enzymy klasyfikacja; peroksydaza, reakcja katalizowana; peroksydaza chrzanowa; oznaczanie katalitycznej aktywności; denaturacja/renaturacja, kinetyka reakcji 0- i I- rzędu oraz obliczanie
Inżynieria Biomedyczna
 1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
BIOCHEMICZNE ZAPOTRZEBOWANIE TLENU
 BIOCHEMICZNE ZAPOTRZEBOWANIE TLENU W procesach samooczyszczania wód zanieczyszczonych związkami organicznymi zachodzą procesy utleniania materii organicznej przy współudziale mikroorganizmów tlenowych.
BIOCHEMICZNE ZAPOTRZEBOWANIE TLENU W procesach samooczyszczania wód zanieczyszczonych związkami organicznymi zachodzą procesy utleniania materii organicznej przy współudziale mikroorganizmów tlenowych.
KARTA KURSU. Kod Punktacja ECTS* 2
 KARTA KURSU Nazwa Nazwa w j. ang. BIOCHEMIA BIOCHEMISTRY Kod Punktacja ECTS* 2 Koordynator Prof. dr hab. Maria Filek Zespół dydaktyczny dr Anna Barbasz dr Elżbieta Rudolphi-Skórska dr Apolonia Sieprawska
KARTA KURSU Nazwa Nazwa w j. ang. BIOCHEMIA BIOCHEMISTRY Kod Punktacja ECTS* 2 Koordynator Prof. dr hab. Maria Filek Zespół dydaktyczny dr Anna Barbasz dr Elżbieta Rudolphi-Skórska dr Apolonia Sieprawska
Izoenzymy. Katalizują te same reakcje, ale różnią się właściwościami fizycznymi lub kinetycznymi. Optimum ph. Powinowactwo do substratu
 Izoenzymy Katalizują te same reakcje, ale różnią się właściwościami fizycznymi lub kinetycznymi Optimum ph Powinowactwo do substratu Wrażliwość na inhibitory Badanie LDH H4 (serce) H3M1 H2M2 H1M3 M4 (wątroba)
Izoenzymy Katalizują te same reakcje, ale różnią się właściwościami fizycznymi lub kinetycznymi Optimum ph Powinowactwo do substratu Wrażliwość na inhibitory Badanie LDH H4 (serce) H3M1 H2M2 H1M3 M4 (wątroba)
WŁASNOŚCI SPEKTRALNE NUKLEOTYDÓW PIRYDYNOWYCH (NAD +, NADP + ) OZNACZANIE AKTYWNOŚCI TRANSAMINAZY ALANINOWEJ
 WŁASNOŚCI SPEKTRALNE NUKLEOTYDÓW PIRYDYNOWYCH (NAD +, NADP + ) OZNACZANIE AKTYWNOŚCI TRANSAMINAZY ALANINOWEJ WSTĘP Nukleotydy pirydynowe (NAD +, NADP + ) pełnią funkcję koenzymów dehydrogenaz przenosząc
WŁASNOŚCI SPEKTRALNE NUKLEOTYDÓW PIRYDYNOWYCH (NAD +, NADP + ) OZNACZANIE AKTYWNOŚCI TRANSAMINAZY ALANINOWEJ WSTĘP Nukleotydy pirydynowe (NAD +, NADP + ) pełnią funkcję koenzymów dehydrogenaz przenosząc
ENZYMY W CHEMII. Michał Rachwalski. Uniwersytet Łódzki, Wydział Chemii, Katedra Chemii Organicznej i Stosowanej
 ENZYMY W CHEMII Michał Rachwalski Uniwersytet Łódzki, Wydział Chemii, Katedra Chemii rganicznej i Stosowanej - pojęcie enzymu; Plan wykładu - enzymy izolowane a całe komórki - enzymy jako katalizatory
ENZYMY W CHEMII Michał Rachwalski Uniwersytet Łódzki, Wydział Chemii, Katedra Chemii rganicznej i Stosowanej - pojęcie enzymu; Plan wykładu - enzymy izolowane a całe komórki - enzymy jako katalizatory
Ćwiczenie 14. Maria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYMATYCZNYCH
 Ćwiczenie 14 aria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYATYCZNYCH Zagadnienia: Podstawowe pojęcia kinetyki chemicznej (szybkość reakcji, reakcje elementarne, rząd reakcji). Równania kinetyczne prostych
Ćwiczenie 14 aria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYATYCZNYCH Zagadnienia: Podstawowe pojęcia kinetyki chemicznej (szybkość reakcji, reakcje elementarne, rząd reakcji). Równania kinetyczne prostych
BIOCHEMIA. Enzymy. Oznaczanie aktywności wybranych enzymów. Ćwiczenie 8 Trypsyna. Ćwiczenie 9 Lipaza
 BIOCHEMIA Wydział Nauk o Żywności i Rybactwa Centrum Bioimmobilizacji i Innowacyjnych Materiałów Opakowaniowych ul. Klemensa Janickiego 35 71-270 Szczecin Enzymy. Oznaczanie aktywności wybranych enzymów
BIOCHEMIA Wydział Nauk o Żywności i Rybactwa Centrum Bioimmobilizacji i Innowacyjnych Materiałów Opakowaniowych ul. Klemensa Janickiego 35 71-270 Szczecin Enzymy. Oznaczanie aktywności wybranych enzymów
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
BADANIE WŁASNOŚCI KOENZYMÓW OKSYDOREDUKTAZ
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska BADANIE WŁASNOŚCI KOENZYMÓW OKSYDOREDUKTAZ ĆWICZENIE 2 Nukleotydy pirydynowe (NAD +, NADP + ) pełnią funkcję koenzymów dehydrogenaz przenosząc jony
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska BADANIE WŁASNOŚCI KOENZYMÓW OKSYDOREDUKTAZ ĆWICZENIE 2 Nukleotydy pirydynowe (NAD +, NADP + ) pełnią funkcję koenzymów dehydrogenaz przenosząc jony
Wpływ ph i temperatury na aktywność enzymów na przykładzie α-amylazy [EC ]
![Wpływ ph i temperatury na aktywność enzymów na przykładzie α-amylazy [EC ] Wpływ ph i temperatury na aktywność enzymów na przykładzie α-amylazy [EC ]](/thumbs/66/56278117.jpg) Wpływ ph i temperatury na aktywność enzymów na przykładzie α-amylazy [EC 3.2.1.1.] Szybkość katalizowanej przez enzym przemiany danego substratu w określony produkt jest ściśle uzależniona od stężenia
Wpływ ph i temperatury na aktywność enzymów na przykładzie α-amylazy [EC 3.2.1.1.] Szybkość katalizowanej przez enzym przemiany danego substratu w określony produkt jest ściśle uzależniona od stężenia
Katedra Chemii Nieorganicznej i Analitycznej Uniwersytet Łódzki ul.tamka 12, Łódź. Dr Paweł Krzyczmonik
 Katedra Chemii Nieorganicznej i Analitycznej Uniwersytet Łódzki ul.tamka 12, 91-403 Łódź Dr Paweł Krzyczmonik Łódź, kwiecień 2015 Plan wykładu Detekcja optyczna w biosensorach Biosensory optyczne - przykłady
Katedra Chemii Nieorganicznej i Analitycznej Uniwersytet Łódzki ul.tamka 12, 91-403 Łódź Dr Paweł Krzyczmonik Łódź, kwiecień 2015 Plan wykładu Detekcja optyczna w biosensorach Biosensory optyczne - przykłady
ENZYMOLOGIA. Ćwiczenie 3 Lipaza. Oznaczanie aktywności enzymu metodą miareczkową. Centrum Bioimmobilizacji i Innowacyjnych Materiałów Opakowaniowych
 ENZYMOLOGIA Wydział Nauk o Żywności i Rybactwa Centrum Bioimmobilizacji i Innowacyjnych Materiałów Opakowaniowych ul. Klemensa Janickiego 35 71-270 Szczecin Ćwiczenie 3 Lipaza. Oznaczanie aktywności enzymu
ENZYMOLOGIA Wydział Nauk o Żywności i Rybactwa Centrum Bioimmobilizacji i Innowacyjnych Materiałów Opakowaniowych ul. Klemensa Janickiego 35 71-270 Szczecin Ćwiczenie 3 Lipaza. Oznaczanie aktywności enzymu
3. Badanie kinetyki enzymów
 3. Badanie kinetyki enzymów Przy stałym stężeniu enzymu, a przy zmieniającym się początkowym stężeniu substratu, zmiany szybkości reakcji katalizy, wyrażonej jako liczba moli substratu przetworzonego w
3. Badanie kinetyki enzymów Przy stałym stężeniu enzymu, a przy zmieniającym się początkowym stężeniu substratu, zmiany szybkości reakcji katalizy, wyrażonej jako liczba moli substratu przetworzonego w
Wykrywanie obecności enzymów.
 ĆWICZENIE 5 Wykrywanie obecności enzymów. Prowadzący: mgr inż. Jadwiga ZAWISZA Miejsce ćwiczenia: sala 104 CEL ĆWICZENIA Celem ćwiczenia jest praktyczne poznanie enzymów z klasy oksydoreduktaz. PODSTAWY
ĆWICZENIE 5 Wykrywanie obecności enzymów. Prowadzący: mgr inż. Jadwiga ZAWISZA Miejsce ćwiczenia: sala 104 CEL ĆWICZENIA Celem ćwiczenia jest praktyczne poznanie enzymów z klasy oksydoreduktaz. PODSTAWY
Reakcje chemiczne. Typ reakcji Schemat Przykłady Reakcja syntezy
 Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
ODDYCHANIE KOMÓRKOWE
 NM Gera ODDYCHANIE KOMÓRKOWE 1 A) ODDYCHANIE TLENOWE B) PROCESY BEZTLENOWEGO UZYSKIWANIA ENERGII ZADANIE DOMOWE W FORMIE REFERATU OPRACUJ ZAGADNIENIA DOTYCZĄCE PRZEBIEGU CHEMOSYNTEZY ORAZ BEZTLENOWEGO
NM Gera ODDYCHANIE KOMÓRKOWE 1 A) ODDYCHANIE TLENOWE B) PROCESY BEZTLENOWEGO UZYSKIWANIA ENERGII ZADANIE DOMOWE W FORMIE REFERATU OPRACUJ ZAGADNIENIA DOTYCZĄCE PRZEBIEGU CHEMOSYNTEZY ORAZ BEZTLENOWEGO
Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy. Dział Zakres treści
 Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym
 1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
Podziały. ze względu na budowę: - proste - złożone z grupą prostetyczną - z koenzymem
 Enzymy Definicja Swoiste biokatalizatory o budowie białkowej, które obniżają energię aktywacji substratu umożliwiając lub przyspieszając tym samym przebieg reakcji Podziały ze względu na budowę: - proste
Enzymy Definicja Swoiste biokatalizatory o budowie białkowej, które obniżają energię aktywacji substratu umożliwiając lub przyspieszając tym samym przebieg reakcji Podziały ze względu na budowę: - proste
Bliskie spotkania z biologią. METABOLIZM część II. dr hab. Joanna Moraczewska, prof. UKW
 Bliskie spotkania z biologią METABOLIZM część II dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki METABOLIZM KATABOLIZM - rozkład związków chemicznych
Bliskie spotkania z biologią METABOLIZM część II dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki METABOLIZM KATABOLIZM - rozkład związków chemicznych
Przedmiot CHEMIA Kierunek: Transport (studia stacjonarne) I rok TEMATY WYKŁADÓW 15 godzin Warunek zaliczenia wykłady: TEMATY LABORATORIÓW 15 godzin
 Program zajęć: Przedmiot CHEMIA Kierunek: Transport (studia stacjonarne) I rok Wykładowca: dr Jolanta Piekut, mgr Marta Matusiewicz Zaliczenie przedmiotu: zaliczenie z oceną TEMATY WYKŁADÓW 15 godzin 1.
Program zajęć: Przedmiot CHEMIA Kierunek: Transport (studia stacjonarne) I rok Wykładowca: dr Jolanta Piekut, mgr Marta Matusiewicz Zaliczenie przedmiotu: zaliczenie z oceną TEMATY WYKŁADÓW 15 godzin 1.
Dysocjacja kwasów i zasad. ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to:
 Stała równowagi dysocjacji: Dysocjacja kwasów i zasad HX H 2 O H 3 O X - K a [ H 3O [ X [ HX [ H O 2 ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to: K a [ H 3 O [ X [ HX Dla słabych kwasów
Stała równowagi dysocjacji: Dysocjacja kwasów i zasad HX H 2 O H 3 O X - K a [ H 3O [ X [ HX [ H O 2 ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to: K a [ H 3 O [ X [ HX Dla słabych kwasów
WĘGLOWODANY WŁAŚCIWOŚCI I METABOLIZM
 WĘGLOWODANY WŁAŚCIWOŚCI I METABOLIZM RÓŻNE OBLICZA CUKRÓW.. Cukier jest słodki i sprawia nam wiele przyjemności, tymczasem... Jest postrzegany jako jedna z najważniejszych przyczyn plagi, jaka zalała świat,
WĘGLOWODANY WŁAŚCIWOŚCI I METABOLIZM RÓŻNE OBLICZA CUKRÓW.. Cukier jest słodki i sprawia nam wiele przyjemności, tymczasem... Jest postrzegany jako jedna z najważniejszych przyczyn plagi, jaka zalała świat,
ANALIZA TŁUSZCZÓW WŁAŚCIWYCH CZ II
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska ANALIZA TŁUSZCZÓW WŁAŚCIWYCH CZ II ĆWICZENIE 8 ZADANIE 1 HYDROLIZA LIPIDÓW MLEKA ZA POMOCĄ LIPAZY TRZUSTKOWEJ Lipazy (EC 3.1) to enzymy należące
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska ANALIZA TŁUSZCZÓW WŁAŚCIWYCH CZ II ĆWICZENIE 8 ZADANIE 1 HYDROLIZA LIPIDÓW MLEKA ZA POMOCĄ LIPAZY TRZUSTKOWEJ Lipazy (EC 3.1) to enzymy należące
Katedra Chemii Nieorganicznej i Analitycznej Uniwersytet Łódzki ul.tamka 12, Łódź
 Katedra hemii Nieorganicznej i Analitycznej Uniwersytet Łódzki ul.tamka 12, 91-403 Łódź Dr Paweł Krzyczmonik Łódź, kwiecień 2014 Plan wykładu Biosensory wstęp Metody immobilizacji enzymów i białek Kinetyka
Katedra hemii Nieorganicznej i Analitycznej Uniwersytet Łódzki ul.tamka 12, 91-403 Łódź Dr Paweł Krzyczmonik Łódź, kwiecień 2014 Plan wykładu Biosensory wstęp Metody immobilizacji enzymów i białek Kinetyka
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
