a b zasi g kilku centymetrów zasi g kilkudziesi ciu centymetrów zasi g nieograniczony ATOM jàdro atomowe neutrony protony nukleony pow oki elektronowe
|
|
|
- Dariusz Bogdan Wieczorek
- 6 lat temu
- Przeglądów:
Transkrypt
1 ZAWARTOÂå SK ADNIKA W ROZTWORZE nasyconym i nienasyconym ATOM (najmniejsza czàstka pierwiastka chemicznego) st enie procentowe 2% jàdro atomowe g wody ms = 2 g 00 g roztworu nasyconym protony neutrony St enie procentowe to liczba gramów substancji zawarta w 00 g roztworu. rozpuszczalnoêç 2 g /00 g wody w T= C nukleony 2 g roztworu 00 g wody ms = 2 g pow oki elektronowe Miarą rozpuszczalnoêci w określonych warunkach ciśnienia i temperatury jest stosunek masy substancji rozpuszczonej do masy lub objętości rozpuszczalnika albo roztworu. elektrony PODSTAWOWE METODY OTRZYMYWANIA SOLI okres liczba pow ok liczba p + = liczba ē elektrony walencyjne grupa 9 K metal + kwas $ sól + wodór Mg + 2 NO $ Mg(NO ) liczba masowa liczba atomowa A Z E symbol pierwiastka tlenek metalu + kwas $ sól + woda MgO + 2 Cl $ MgCl O A Z = liczba neutronów w izotopie wodorotlenek metalu + kwas $ sól + woda Mg(O) NO (rozcieƒczony) $ Mg(NO ) O tlenek metalu + tlenek kwasowy $ sól MgO + N 2 O $ Mg(NO ) 2 c BLACA O OWIANA BLACA ALUMINIOWA b PAPIER a zasada + tlenek kwasowy $ sól + woda Mg(O) 2 + N 2 O $ Mg(NO ) O metal + niemetal $ sól kwasu beztlenowego Mg + Cl 2 $ MgCl 2 a b + + zasi g kilku centymetrów zasi g kilkudziesi ciu centymetrów c zasi g nieograniczony
2 Szereg aktywnoêci metali metale aktywniejsze od wodoru metale mniej aktywne od wodoru KNaCaMgAl Zn Fe Sn Cu g Ag Pt Au kierunek przebiegu SUBSTRATY PRODUKTY REAGENTY REAKCJE CEMICZNE SÑ ZGODNE Z PRAWAMI zachowania masy m substratów = m produktów sta oêci sk adu Sk ad zwiàzku chemicznego jest sta y. Podzia reakcji chemicznych ze wzgl du na zachowanie wobec tlenu utlenianie reduktor nie zawiera tlenu i mo e go przyjàç redukcja utleniacz ma tlen i mo e go oddaç
3 PODZIA ROZTWORÓW ze wzgl du na: iloêç substancji rozpuszczonej nasycone nienasycone st one rozcieƒczone przewodnictwo elektryczne roztwory elektrolitów przewodzà pràd elektryczny roztwory niektórych: kwasów, na przyk ad Cl wodorotlenków, na przyk ad NaO soli, na przyk ad NaCl roztwory nieelektrolitów nie przewodzà pràdu elektrycznego woda destylowana alkohol roztwór cukru PODZIA MIESZANIN ze wzgl du na: wielkoêç czàstek substancji rozproszonej lub rozpuszczonej roztwory w aêciwe koloidy zawiesiny Pochodne w glowodorów alkohole kwasy estry aminy RO RCOO RCOOR' RN 2 monohydroksylowe polihydroksylowe
4 DYSOCJACJA rozpad elektrolitów na jony pod wpływem wody kwasów jony + i aniony reszty kwasowej 2O n R E n + + R n Cl $ 2O + + Cl 2 SO $ 2O SO wodorotlenków jony O i kationy metalu I M(O) n E 2O M n+ + no NaO $ 2O Na + + O 2O Mg(O) 2 E Mg O soli kationy metali i aniony reszty kwasowej m n M n R m $ 2O m+ nm + mr n NaCl $ 2O Na + + Cl K 2 SO $ 2O 2 K SO Odczyn roztworu kwasowy oboj tny zasadowy [ + ] > [O ] [ + ] = [O ] [ + ] < [O ] skala p miara odczynu roztworu wzrost odczynu kwasowego odczyn oboj tny wzrost odczynu zasadowego W GLOWODORY ( aƒcuchowe) nasycone alkany C n 2n + 2 C C wszystkie wiàzania pojedyncze pomi dzy alkeny C n 2n C = C jedno wiàzanie podwójne pomi dzy nienasycone alkiny C n 2n 2 C / C jedno wiàzanie potrójne pomi dzy
5 2 e numer grupy,009,00202 wodór hel 2 2 Li Be numer okresu B C N O F Ne symbol pierwiastka,9 9,0282 masa atomowa [u] 22,9890 0,8 2,00,00,999 8, ,9 lit beryl sód nazwa bor w giel azot tlen fluor neon liczba atomowa (liczba porzàdkowa) metale niemetale gazy szlachetne Na Mg Al Si P S Cl Ar 22,9890 2,00 2,988 28,08 0,9 2,0,2 9,98 sód magnez glin krzem fosfor siarka chlor argon i Na K Ca Sc T V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 9,098 0,08,99,8 0,9,99,9809,8 8,92 8,9,,9 9,2 2,,92 8,9 9,90 8,80 potas wapƒ skand tytan wanad chrom mangan elazo kobalt nikiel miedê cynk gal german arsen selen brom krypton Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd ln Sn Sb Te l X 8,8 8,2 88,908 9,22 92,908 9,9 9,90 0,0 02,900 0,2 0,882 2,,88 8, 2,0 2,0 2,90,29 rubid stront itr cyrkon niob molibden technet ruten rod pallad srebro kadm ind cyna antymon tellur jod ksenon Cs Ba La f Ta W Re Os Ir Pt Au g Tl Pb Bi Po At Rn 2,90,2 8,90 8,9 80,99 8,8 8,20 90,2 92,2 9,08 9,9 200,9 20,8 20,2 208, , ,98 222,08 cez bar lantan hafn tantal wolfram ren osm iryd platyna z oto rt ç tal o ów bizmut polon astat radon Fr Ra Ac Rf Db Sg Bh s Mt Ds Rg 22,020 22,02 22,028 2,09 2, 2, frans rad aktyn rutherford dubn seaborg bohr has meitner darmstadt roentgen e Ce Pr Nd Pm Sm Eu Gd Tb Dy o Er Tm Yb Lu 0, 0,90,2,9 0,,9,2 8,92 2,0,902,2 8,92,0,9 cer prazeodym neodym promet samar europ gadolin terb dysproz holm erb tul iterb lutet Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr 22,08 2,088 28,0289 2,08 2,0 2,0 2,00 2,00 2,08 22,088 2,09 28,098 29,0 22,0 tor proaktyn uran neptun pluton ameryk kiur berkel kaliforn einstein ferm mendelew nobel lorens
Pierwiastek: Na - Sód Stan skupienia: stały Liczba atomowa: 11
 ***Dane Pierwiastków Chemicznych*** - Układ Okresowy Pierwiastków 2.5.1.FREE Pierwiastek: H - Wodór Liczba atomowa: 1 Masa atomowa: 1.00794 Elektroujemność: 2.1 Gęstość: [g/cm sześcienny]: 0.0899 Temperatura
***Dane Pierwiastków Chemicznych*** - Układ Okresowy Pierwiastków 2.5.1.FREE Pierwiastek: H - Wodór Liczba atomowa: 1 Masa atomowa: 1.00794 Elektroujemność: 2.1 Gęstość: [g/cm sześcienny]: 0.0899 Temperatura
Grupa b. Zadania na ocen celujàcà
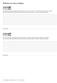 Zadania na ocen celujàcà Grupa a Do reakcji syntezy siarczku glinu przygotowano g glinu i, g siarki. Czy substraty przereagowały w całoêci? JeÊli nie przereagowały, podaj nazw substratu, który nie przereagował
Zadania na ocen celujàcà Grupa a Do reakcji syntezy siarczku glinu przygotowano g glinu i, g siarki. Czy substraty przereagowały w całoêci? JeÊli nie przereagowały, podaj nazw substratu, który nie przereagował
PRZEDMIOTOWY KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 ... pieczątka nagłówkowa szkoły... kod pracy ucznia PRZEDMIOTOWY KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
... pieczątka nagłówkowa szkoły... kod pracy ucznia PRZEDMIOTOWY KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
Drogi Uczniu, Przed tobą test złożony z 20 zadań. Czytaj wszystko bardzo uważnie i udziel prawidłowej odpowiedzi w załączonej karcie odpowiedzi.
 B... pieczątka nagłówkowa WKK............... kod pracy ucznia (wpisuje uczeń) KONKURS PRZEDMIOTOWY CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ETAP WOJEWÓDZKI Drogi Uczniu, Przed tobą test złożony z 20 zadań. Czytaj
B... pieczątka nagłówkowa WKK............... kod pracy ucznia (wpisuje uczeń) KONKURS PRZEDMIOTOWY CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ETAP WOJEWÓDZKI Drogi Uczniu, Przed tobą test złożony z 20 zadań. Czytaj
1/8. KOMISJA WOJEWÓDZKA KONKURSU CHEMICZNEGO Warszawa, dnia 6 listopada 2010 roku
 1/8 KOMISJA WOJEWÓDZKA KONKURSU CHEMICZNEGO Warszawa, dnia 6 listopada 2010 roku KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ETAP II REJONOWY KOD UCZNIA:.. zadanie 1 2 3 4 5 6 razem Maksymalna liczba punktów
1/8 KOMISJA WOJEWÓDZKA KONKURSU CHEMICZNEGO Warszawa, dnia 6 listopada 2010 roku KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ETAP II REJONOWY KOD UCZNIA:.. zadanie 1 2 3 4 5 6 razem Maksymalna liczba punktów
PIERWIASTKI W UKŁADZIE OKRESOWYM
 PIERWIASTKI W UKŁADZIE OKRESOWYM 1 Układ okresowy Co można odczytać z układu okresowego? - konfigurację elektronową - podział na bloki - podział na grupy i okresy - podział na metale i niemetale - trendy
PIERWIASTKI W UKŁADZIE OKRESOWYM 1 Układ okresowy Co można odczytać z układu okresowego? - konfigurację elektronową - podział na bloki - podział na grupy i okresy - podział na metale i niemetale - trendy
1/8. KOMISJA WOJEWÓDZKA KONKURSU CHEMICZNEGO Warszawa, dnia 4 października 2010 roku
 1/8 KOMISJA WOJEWÓDZKA KONKURSU CHEMICZNEGO Warszawa, dnia 4 października 2010 roku KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ETAP I SZKOLNY KOD UCZNIA:.. zadanie 1 2 3 4 5 6 razem Maksymalna liczba punktów
1/8 KOMISJA WOJEWÓDZKA KONKURSU CHEMICZNEGO Warszawa, dnia 4 października 2010 roku KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ETAP I SZKOLNY KOD UCZNIA:.. zadanie 1 2 3 4 5 6 razem Maksymalna liczba punktów
1/9. zadanie razem Maksymalna liczba punktów
 podpis nauczyciela 1/9 KOMISJA WOJEWÓDZKA KONKURSU CHEMICZNEGO Warszawa, dnia 08 stycznia 2011 roku KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ETAP III WOJEWÓDZKI KOD UCZNIA:.. zadanie 1 2 4 5 razem Maksymalna
podpis nauczyciela 1/9 KOMISJA WOJEWÓDZKA KONKURSU CHEMICZNEGO Warszawa, dnia 08 stycznia 2011 roku KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ETAP III WOJEWÓDZKI KOD UCZNIA:.. zadanie 1 2 4 5 razem Maksymalna
Rozdział 6 Atomy wieloelektronowe
 Rozdział 6 Atomy wieloelektronowe 6.1: Atomy a struktura układu okresowego 6.2: Zakaz Pauliego 6.3: Wypełnianie powłok elektronami 6.4: Układ okresowy 6.5: Całkowity moment pędu 6.6: Oddziaływanie spin-orbita
Rozdział 6 Atomy wieloelektronowe 6.1: Atomy a struktura układu okresowego 6.2: Zakaz Pauliego 6.3: Wypełnianie powłok elektronami 6.4: Układ okresowy 6.5: Całkowity moment pędu 6.6: Oddziaływanie spin-orbita
PRZEDMIOTOWY KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM
 ... piecztka nagłówkowa szkoły... kod pracy ucznia PRZEDMIOTOWY KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uwanie instrukcj i
... piecztka nagłówkowa szkoły... kod pracy ucznia PRZEDMIOTOWY KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uwanie instrukcj i
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1050
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1050 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 7, Data wydania: 14 lipca 2015 r. Nazwa i adres AB 1050 AKADEMIA
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1050 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 7, Data wydania: 14 lipca 2015 r. Nazwa i adres AB 1050 AKADEMIA
DLA UCZNIÓW GIMNAZJÓW II ETAP REJONOWY
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW II ETAP REJONOWY 16 listopada 2012 Ważne informacje: 1. Masz 90 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną odpowiedź A, B,
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW II ETAP REJONOWY 16 listopada 2012 Ważne informacje: 1. Masz 90 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną odpowiedź A, B,
DLA UCZNIÓW GIMNAZJÓW II ETAP REJONOWY
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW II ETAP REJONOWY 16 listopada 2012 Ważne informacje: 1. Masz 90 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną odpowiedź A, B,
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW II ETAP REJONOWY 16 listopada 2012 Ważne informacje: 1. Masz 90 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną odpowiedź A, B,
DLA UCZNIÓW GIMNAZJÓW II ETAP REJONOWY
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW II ETAP REJONOWY 16 listopada 2012 Ważne informacje: 1. Masz 90 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną odpowiedź A, B,
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW II ETAP REJONOWY 16 listopada 2012 Ważne informacje: 1. Masz 90 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną odpowiedź A, B,
KONKURS PRZEDMIOTOWY CHEMICZNY DLA UCZNIÓW GIMNAZJUM
 Kod ucznia Kod szkoły... pieczątka WKK Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS PRZEDMIOTOWY CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP WOJEWÓDZKI Drogi Uczniu, witaj na II etapie konkursu chemicznego.
Kod ucznia Kod szkoły... pieczątka WKK Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS PRZEDMIOTOWY CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP WOJEWÓDZKI Drogi Uczniu, witaj na II etapie konkursu chemicznego.
KONKURS CHEMICZNY DLA UCZNIÓW SZKÓŁ GIMNAZJALNYCH ETAP SZKOLNY
 ... pieczątka nagłówkowa szkoły... kod pracy ucznia KONKURS CHEMICZNY DLA UCZNIÓW SZKÓŁ GIMNAZJALNYCH ETAP SZKOLNY Drogi Uczniu, Witaj w pierwszym etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
... pieczątka nagłówkowa szkoły... kod pracy ucznia KONKURS CHEMICZNY DLA UCZNIÓW SZKÓŁ GIMNAZJALNYCH ETAP SZKOLNY Drogi Uczniu, Witaj w pierwszym etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
Badania laboratoryjne składu chemicznego wód podziemnych
 Katowice 27.11.2015r. Odpowiedź na list Towarzystwa na rzecz Ziemi W związku ze zgłaszanymi przez Towarzystwo na rzecz Ziemi (pismo z dnia 05.11.2015r.) pytaniami dotyczącymi pierwiastków występujących
Katowice 27.11.2015r. Odpowiedź na list Towarzystwa na rzecz Ziemi W związku ze zgłaszanymi przez Towarzystwo na rzecz Ziemi (pismo z dnia 05.11.2015r.) pytaniami dotyczącymi pierwiastków występujących
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP SZKOLNY
 suma uzyskanych punktów...... pieczątka nagłówkowa szkoły... kod pracy ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie
suma uzyskanych punktów...... pieczątka nagłówkowa szkoły... kod pracy ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie
DLA UCZNIÓW GIMNAZJÓW I ETAP SZKOLNY
 KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW I ETAP SZKOLNY 11 października 2012 Ważne informacje: 1. Masz 60 minut na rozwiązanie wszystkich 20 zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną
KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW I ETAP SZKOLNY 11 października 2012 Ważne informacje: 1. Masz 60 minut na rozwiązanie wszystkich 20 zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną
Układ okresowy. Przewidywania teorii kwantowej
 Przewidywania teorii kwantowej Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
Przewidywania teorii kwantowej Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM
 pieczątka WKK Kod ucznia - - Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP REJONOWY Drogi Uczniu, Witaj w drugim etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
pieczątka WKK Kod ucznia - - Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP REJONOWY Drogi Uczniu, Witaj w drugim etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM
 pieczątka WKK Kod ucznia - - Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP REJONOWY Drogi Uczniu, Witaj w drugim etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
pieczątka WKK Kod ucznia - - Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP REJONOWY Drogi Uczniu, Witaj w drugim etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW I ETAP SZKOLNY. 09 października 2013
 KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW I ETAP SZKOLNY 09 października 2013 Ważne informacje: 1. Masz 60 minut na rozwiązanie wszystkich zadań. 2. Zapisuj szczegółowe obliczenia i komentarze
KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW I ETAP SZKOLNY 09 października 2013 Ważne informacje: 1. Masz 60 minut na rozwiązanie wszystkich zadań. 2. Zapisuj szczegółowe obliczenia i komentarze
Wykaz ważniejszych symboli agadnienia ogólne Wstęp Zarys historii chemii analitycznej
 Spis rzeczy Z Wykaz ważniejszych symboli............................. 13 1. agadnienia ogólne................................. 15 1.1. Wstęp..................................... 15 1.. Zarys historii chemii
Spis rzeczy Z Wykaz ważniejszych symboli............................. 13 1. agadnienia ogólne................................. 15 1.1. Wstęp..................................... 15 1.. Zarys historii chemii
Wykład 9 Wprowadzenie do krystalochemii
 Wykład 9 Wprowadzenie do krystalochemii 1. Krystalografia a krystalochemia. 2. Prawa krystalochemii 3. Sieć krystaliczna i pozycje atomów 4. Bliskie i dalekie uporządkowanie. 5. Kryształ a cząsteczka.
Wykład 9 Wprowadzenie do krystalochemii 1. Krystalografia a krystalochemia. 2. Prawa krystalochemii 3. Sieć krystaliczna i pozycje atomów 4. Bliskie i dalekie uporządkowanie. 5. Kryształ a cząsteczka.
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM
 pieczątka WKK Kod ucznia - - Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP REJONOWY Drogi Uczniu, Witaj w drugim etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
pieczątka WKK Kod ucznia - - Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP REJONOWY Drogi Uczniu, Witaj w drugim etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
Konwersatorium 1. Zagadnienia na konwersatorium
 Konwersatorium 1 Zagadnienia na konwersatorium 1. Omów reguły zapełniania powłok elektronowych. 2. Podaj konfiguracje elektronowe dla atomów Cu, Ag, Au, Pd, Pt, Cr, Mo, W. 3. Wyjaśnij dlaczego występują
Konwersatorium 1 Zagadnienia na konwersatorium 1. Omów reguły zapełniania powłok elektronowych. 2. Podaj konfiguracje elektronowe dla atomów Cu, Ag, Au, Pd, Pt, Cr, Mo, W. 3. Wyjaśnij dlaczego występują
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1050
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1050 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 11 Data wydania: 27 maja 2019 r. Nazwa i adres AB 1050 AKADEMIA
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1050 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 11 Data wydania: 27 maja 2019 r. Nazwa i adres AB 1050 AKADEMIA
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
imię i nazwisko numer w dzienniku klasa
 Test po. części serii Chemia Nowej Ery CHEMIA I grupa imię i nazwisko numer w dzienniku klasa Test składa się z 8 zadań. Czytaj uważnie treść poleceń. W zadaniach. 5., 7.., 3. 7. wybierz poprawną odpowiedź
Test po. części serii Chemia Nowej Ery CHEMIA I grupa imię i nazwisko numer w dzienniku klasa Test składa się z 8 zadań. Czytaj uważnie treść poleceń. W zadaniach. 5., 7.., 3. 7. wybierz poprawną odpowiedź
KONKURS Z CHEMII DLA UCZNIÓW SZKOŁY PODSTAWOWEJ
 pieczątka WKK Kod ucznia - - Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS Z CHEMII DLA UCZNIÓW SZKOŁY PODSTAWOWEJ ETAP REJONOWY Drogi Uczniu, Witaj w drugim etapie konkursu chemicznego. Przeczytaj uważnie
pieczątka WKK Kod ucznia - - Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS Z CHEMII DLA UCZNIÓW SZKOŁY PODSTAWOWEJ ETAP REJONOWY Drogi Uczniu, Witaj w drugim etapie konkursu chemicznego. Przeczytaj uważnie
Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem
 Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
Chemia nieorganiczna. Copyright 2000 by Harcourt, Inc. All rights reserved.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Pierwiastki 1 1 H 3 Li 11
Wiązania. w świetle teorii kwantów fenomenologicznie
 Wiązania w świetle teorii kwantów fenomenologicznie Wiązania Teoria kwantowa: zwiększenie gęstości prawdopodobieństwa znalezienia elektronów w przestrzeni pomiędzy atomami c a a c b b Liniowa kombinacja
Wiązania w świetle teorii kwantów fenomenologicznie Wiązania Teoria kwantowa: zwiększenie gęstości prawdopodobieństwa znalezienia elektronów w przestrzeni pomiędzy atomami c a a c b b Liniowa kombinacja
Chemia nieorganiczna. Pierwiastki. niemetale Be. 27 Co. 28 Ni. 26 Fe. 29 Cu. 45 Rh. 44 Ru. 47 Ag. 46 Pd. 78 Pt. 76 Os.
 Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by Harcourt,
Chemia nieorganiczna 1. Układ okresowy metale i niemetale 2. Oddziaływania inter- i intramolekularne 3. Ciała stałe rodzaje sieci krystalicznych 4. Przewodnictwo ciał stałych Copyright 2000 by Harcourt,
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Struktura elektronowa
 Struktura elektronowa Struktura elektronowa atomów układ okresowy pierwiastków: 1) elektrony w atomie zajmują poziomy energetyczne od dołu, inaczej niż te gołębie (w Australii, ale tam i tak chodzi się
Struktura elektronowa Struktura elektronowa atomów układ okresowy pierwiastków: 1) elektrony w atomie zajmują poziomy energetyczne od dołu, inaczej niż te gołębie (w Australii, ale tam i tak chodzi się
Podstawowe obliczenia w chemii analitycznej
 Podstawowe obliczenia w chemii analitycznej GBC Rodzinnie Zakopane 2012 Jacek Sowiński GBC Polska js@gbcpolska.pl www.gbcpolska.pl Podstawowe parametry obliczane dla wykonywanych analiz Stężenie charakterystyczne
Podstawowe obliczenia w chemii analitycznej GBC Rodzinnie Zakopane 2012 Jacek Sowiński GBC Polska js@gbcpolska.pl www.gbcpolska.pl Podstawowe parametry obliczane dla wykonywanych analiz Stężenie charakterystyczne
Wzory sumaryczne i strukturalne związków
 Wzory sumaryczne i strukturalne związków H S H 3 PO 4 SO CH 4 H SO 4 OHC H 5 NH Wzory sumaryczne i strukturalne związków H SO 4 CuSO 4 siarczanvi miedziii K SO 4 siarczanvi potasu Fe SO 4 3 siarczanvi
Wzory sumaryczne i strukturalne związków H S H 3 PO 4 SO CH 4 H SO 4 OHC H 5 NH Wzory sumaryczne i strukturalne związków H SO 4 CuSO 4 siarczanvi miedziii K SO 4 siarczanvi potasu Fe SO 4 3 siarczanvi
PRÓBNY EGZAMIN MATURALNY Z CHEMII
 (wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO PRÓBNY EGZAMIN MATURALNY Z CHEMII Arkusz I Poziom podstawowy Instrukcja dla zdającego: Czas pracy 120 minut 1. Proszę sprawdzić, czy arkusz zawiera
(wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO PRÓBNY EGZAMIN MATURALNY Z CHEMII Arkusz I Poziom podstawowy Instrukcja dla zdającego: Czas pracy 120 minut 1. Proszę sprawdzić, czy arkusz zawiera
Źródła światła w AAS. Seminarium Analityczne MS Spektrum Zakopane Jacek Sowiński MS Spektrum
 Źródła światła w AAS Seminarium Analityczne MS Spektrum Zakopane 2013 Jacek Sowiński MS Spektrum js@msspektrum.pl www.msspektrum.pl Lampy HCL Standardowa Super-Lampa 3V 10V specyf. Lampy HCL 1,5 cala
Źródła światła w AAS Seminarium Analityczne MS Spektrum Zakopane 2013 Jacek Sowiński MS Spektrum js@msspektrum.pl www.msspektrum.pl Lampy HCL Standardowa Super-Lampa 3V 10V specyf. Lampy HCL 1,5 cala
UKŁAD OKRESOWY PIERWIASTKÓW
 UKŁAD OKRESOWY PIERWIASTKÓW Michał Sędziwój (1566-1636) Alchemik Sędziwój - Jan Matejko Pierwiastki chemiczne p.n.e. Sb Sn Zn Pb Hg S Ag C Au Fe Cu (11)* do XVII w. As (1250 r.) P (1669 r.) (2) XVIII
UKŁAD OKRESOWY PIERWIASTKÓW Michał Sędziwój (1566-1636) Alchemik Sędziwój - Jan Matejko Pierwiastki chemiczne p.n.e. Sb Sn Zn Pb Hg S Ag C Au Fe Cu (11)* do XVII w. As (1250 r.) P (1669 r.) (2) XVIII
KONKURS PRZEDMIOTOWY Z CHEMII
 Pieczęć KONKURS PRZEDMIOTOWY Z CHEMII dla uczniów gimnazjów województwa lubuskiego 26 stycznia 2012 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem
Pieczęć KONKURS PRZEDMIOTOWY Z CHEMII dla uczniów gimnazjów województwa lubuskiego 26 stycznia 2012 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem
ul. Umultowska 89b, Collegium Chemicum, Poznań tel ; fax
 Wydział Chemii Zakład Chemii Analitycznej Plazma kontra plazma: optyczna spektrometria emisyjna w badaniach środowiska Przemysław Niedzielski ul. Umultowska 89b, Collegium Chemicum, 61-614 Poznań tel.
Wydział Chemii Zakład Chemii Analitycznej Plazma kontra plazma: optyczna spektrometria emisyjna w badaniach środowiska Przemysław Niedzielski ul. Umultowska 89b, Collegium Chemicum, 61-614 Poznań tel.
Inne koncepcje wiązań chemicznych. 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań?
 Inne koncepcje wiązań chemicznych 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie.
Inne koncepcje wiązań chemicznych 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie.
CZY POTRZEBNA NAM ENERGETYKA JĄDROWA?
 Kształtowanie kompetencji kluczowych w nauczaniu biologii CZY POTRZEBNA NAM ENERGETYKA JĄDROWA? Danuta Wojcieszyńska, Urszula Guzik Katedra Biochemii Uniwersytet Śląski KAPITAŁ LUDZKI NARODOWA STRATEGIA
Kształtowanie kompetencji kluczowych w nauczaniu biologii CZY POTRZEBNA NAM ENERGETYKA JĄDROWA? Danuta Wojcieszyńska, Urszula Guzik Katedra Biochemii Uniwersytet Śląski KAPITAŁ LUDZKI NARODOWA STRATEGIA
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I ... ... czas trwania: 90 min Nazwa szkoły
 V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019
 Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019 I. Eliminacje szkolne (60 minut, liczba punktów: 30). Wymagania szczegółowe. Cele kształcenia
Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019 I. Eliminacje szkolne (60 minut, liczba punktów: 30). Wymagania szczegółowe. Cele kształcenia
MARATON WIEDZY CHEMIA CZ. II
 MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
CHEMIA. Wymagania szczegółowe. Wymagania ogólne
 CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
PRÓBNY EGZAMIN MATURALNY Z CHEMII
 POUFNE do dnia... godz.... KOD ZDAJĄCEGO IMIĘ NAZWISKO WPISUJE PISZĄCY PO OTRZYMANIU PRACY - - WPISAĆ PO ROZKODOWANIU PRACY ARKUSZ II PRÓBNY EGZAMIN MATURALNY Z CHEMII Czas pracy 120 minut Informacje 1.
POUFNE do dnia... godz.... KOD ZDAJĄCEGO IMIĘ NAZWISKO WPISUJE PISZĄCY PO OTRZYMANIU PRACY - - WPISAĆ PO ROZKODOWANIU PRACY ARKUSZ II PRÓBNY EGZAMIN MATURALNY Z CHEMII Czas pracy 120 minut Informacje 1.
a) Sole kwasu chlorowodorowego (solnego) to... b) Sole kwasu siarkowego (VI) to... c) Sole kwasu azotowego (V) to... d) Sole kwasu węglowego to...
 Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
Układ okresowy. Przewidywania teorii kwantowej
 Przewidywania teorii kwantowej 1 Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
Przewidywania teorii kwantowej 1 Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
Spis treœci Wstêp Od epoki br¹zu do in ynierii materia³owej Przedmowa Rozdzia³ 1 Budowa atomowa metali Rozdzia³ 2 Krzepniêcie metali
 5 Spis treœci Wstêp Od epoki br¹zu do in ynierii materia³owej Adolf Maciejny... 17 Przedmowa Znaczenie metali w rozwoju cywilizacji... 31 Rozdzia³ 1 Budowa atomowa metali Karol Przyby³owicz... 37 1.1.
5 Spis treœci Wstêp Od epoki br¹zu do in ynierii materia³owej Adolf Maciejny... 17 Przedmowa Znaczenie metali w rozwoju cywilizacji... 31 Rozdzia³ 1 Budowa atomowa metali Karol Przyby³owicz... 37 1.1.
ARKUSZ PRÓBNEJ MATURY Z OPERONEM FIZYKA
 Miejsce na identyfikację szkoły ARKUSZ PRÓBNEJ MATURY Z OPERONEM FIZYKA POZIOM ROZSZERZONY LISTOPAD 2014 Instrukcja dla zdającego Czas pracy: 180 minut 1. Sprawdź, czy arkusz egzaminacyjny zawiera 20 stron
Miejsce na identyfikację szkoły ARKUSZ PRÓBNEJ MATURY Z OPERONEM FIZYKA POZIOM ROZSZERZONY LISTOPAD 2014 Instrukcja dla zdającego Czas pracy: 180 minut 1. Sprawdź, czy arkusz egzaminacyjny zawiera 20 stron
3. Jaka jest masa atomowa pierwiastka E w następujących związkach? Który to pierwiastek? EO o masie cząsteczkowej 28 [u]
![3. Jaka jest masa atomowa pierwiastka E w następujących związkach? Który to pierwiastek? EO o masie cząsteczkowej 28 [u] 3. Jaka jest masa atomowa pierwiastka E w następujących związkach? Który to pierwiastek? EO o masie cząsteczkowej 28 [u]](/thumbs/58/41892324.jpg) 1. Masa cząsteczkowa tlenku dwuwartościowego metalu wynosi 56 [u]. Masa atomowa tlenu wynosi 16 [u]. Ustal jaki to metal i podaj jego nazwę. Napisz wzór sumaryczny tego tlenku. 2. Ile razy masa atomowa
1. Masa cząsteczkowa tlenku dwuwartościowego metalu wynosi 56 [u]. Masa atomowa tlenu wynosi 16 [u]. Ustal jaki to metal i podaj jego nazwę. Napisz wzór sumaryczny tego tlenku. 2. Ile razy masa atomowa
Piotr Kosztołowicz. Powtórka przed maturą. Chemia. Zadania. Zakres rozszerzony
 Piotr Kosztołowicz Zakres rozszerzony Chemia Powtórka przed maturą Zadania 95 Spis treści Wstęp Rozdział 1. Budowa atomów Rozdział 2. Przemiany jądrowe Rozdział 3. Struktura elektronowa atomu Rozdział
Piotr Kosztołowicz Zakres rozszerzony Chemia Powtórka przed maturą Zadania 95 Spis treści Wstęp Rozdział 1. Budowa atomów Rozdział 2. Przemiany jądrowe Rozdział 3. Struktura elektronowa atomu Rozdział
Lista badań prowadzonych w ramach zakresu elastycznego nr AB 550
 Lista badań prowadzonych w ramach zakresu elastycznego nr AB 550 ZESPÓŁ LABORATORIÓW ENERGOPOMIAR Sp. z o.o. Wydanie nr 2 Imię i nazwisko Podpis Data Weryfikował Damian Adrjan 27.04.2016 Zatwierdził Katarzyna
Lista badań prowadzonych w ramach zakresu elastycznego nr AB 550 ZESPÓŁ LABORATORIÓW ENERGOPOMIAR Sp. z o.o. Wydanie nr 2 Imię i nazwisko Podpis Data Weryfikował Damian Adrjan 27.04.2016 Zatwierdził Katarzyna
ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU DATA URODZENIA UCZNIA. rok
 ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU EGZAMINU KOD UCZNIA DATA URODZENIA UCZNIA rok miejsce z kodem dysleksja EGZAMIN W TRZECIEJ KLASIE GIMNAZJUM Z ZAKRESU PRZEDMIOTÓW MATEMATYCZNO-PRZYRODNICZYCH
ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU EGZAMINU KOD UCZNIA DATA URODZENIA UCZNIA rok miejsce z kodem dysleksja EGZAMIN W TRZECIEJ KLASIE GIMNAZJUM Z ZAKRESU PRZEDMIOTÓW MATEMATYCZNO-PRZYRODNICZYCH
XXIII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych. Etap II. Poznań, Zadanie 1. Zadanie 2. Zadanie 3
 XXIII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II Zadanie 1 Poniżej zaprezentowano schemat reakcji, którym ulegają związki manganu. Wszystkie reakcje (poza prażeniem) zachodzą w środowisku
XXIII Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II Zadanie 1 Poniżej zaprezentowano schemat reakcji, którym ulegają związki manganu. Wszystkie reakcje (poza prażeniem) zachodzą w środowisku
Anna Grych Test z budowy atomu i wiązań chemicznych
 Anna Grych Test z budowy atomu i wiązań chemicznych 1. Uzupełnij tabelkę wpisując odpowiednie dane: Nazwa atomu Liczba nukleonów protonów neutronów elektronów X -... 4 2 Y -... 88 138 Z -... 238 92 W -...
Anna Grych Test z budowy atomu i wiązań chemicznych 1. Uzupełnij tabelkę wpisując odpowiednie dane: Nazwa atomu Liczba nukleonów protonów neutronów elektronów X -... 4 2 Y -... 88 138 Z -... 238 92 W -...
Opracowała: mgr Agata Wiśniewska PRZYKŁADOWE SPRAWDZIANY WIADOMOŚCI l UMIEJĘTNOŚCI Współczesny model budowy atomu (wersja A)
 PRZYKŁADOW SPRAWDZIANY WIADOMOŚCI l UMIJĘTNOŚCI Współczesny model budowy atomu (wersja A) 1. nuklid A. Zbiór atomów o tej samej wartości liczby atomowej. B. Nazwa elektrycznie obojętnej cząstki składowej
PRZYKŁADOW SPRAWDZIANY WIADOMOŚCI l UMIJĘTNOŚCI Współczesny model budowy atomu (wersja A) 1. nuklid A. Zbiór atomów o tej samej wartości liczby atomowej. B. Nazwa elektrycznie obojętnej cząstki składowej
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7
 Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Chemia. Wykłady z podstaw chemii. Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej r Odkrycie fosforu przez Henninga Branda
 Chemia Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
Chemia Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM
 pieczątka WKK Kod ucznia - - Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP REJONOWY Drogi Uczniu, Witaj w drugim etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
pieczątka WKK Kod ucznia - - Dzień Miesiąc Rok DATA URODZENIA UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ETAP REJONOWY Drogi Uczniu, Witaj w drugim etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
CHEMIA WARTA POZNANIA
 Materiały do zajęć dokształcających z chemii nieorganicznej i fizycznej Wydział Chemii UAM Poznań 2011 Część I Atom jest najmniejszą częścią pierwiastka chemicznego, która zachowuje jego właściwości chemiczne
Materiały do zajęć dokształcających z chemii nieorganicznej i fizycznej Wydział Chemii UAM Poznań 2011 Część I Atom jest najmniejszą częścią pierwiastka chemicznego, która zachowuje jego właściwości chemiczne
XV Wojewódzki Konkurs z Chemii
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
Co to są jądra superciężkie?
 Jądra superciężkie 1. Co to są jądra superciężkie? 2. Metody syntezy jąder superciężkich 3. Odkryte jądra superciężkie 4. Współczesne eksperymenty syntezy j.s. 5. Metody identyfikacji j.s. 6. Przewidywania
Jądra superciężkie 1. Co to są jądra superciężkie? 2. Metody syntezy jąder superciężkich 3. Odkryte jądra superciężkie 4. Współczesne eksperymenty syntezy j.s. 5. Metody identyfikacji j.s. 6. Przewidywania
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7
 Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Teoria VSEPR. Jak przewidywac strukturę cząsteczki?
 Teoria VSEPR Jak przewidywac strukturę cząsteczki? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie. Rozkład elektronów walencyjnych w cząsteczce (struktura Lewisa) stuktura
Teoria VSEPR Jak przewidywac strukturę cząsteczki? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie. Rozkład elektronów walencyjnych w cząsteczce (struktura Lewisa) stuktura
DLA UCZNIÓW GIMNAZJÓW III ETAP WOJEWÓDZKI
 KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW III ETAP WOJEWÓDZKI 18 stycznia 2013 Ważne informacje: 1. Masz 120 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną
KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW III ETAP WOJEWÓDZKI 18 stycznia 2013 Ważne informacje: 1. Masz 120 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną
DLA UCZNIÓW GIMNAZJÓW III ETAP WOJEWÓDZKI
 KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW III ETAP WOJEWÓDZKI 18 stycznia 2013 Ważne informacje: 1. Masz 120 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną
KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW III ETAP WOJEWÓDZKI 18 stycznia 2013 Ważne informacje: 1. Masz 120 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną
DLA UCZNIÓW GIMNAZJÓW III ETAP WOJEWÓDZKI
 KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW III ETAP WOJEWÓDZKI 18 stycznia 2013 Ważne informacje: 1. Masz 120 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną
KOD UCZNIA KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW III ETAP WOJEWÓDZKI 18 stycznia 2013 Ważne informacje: 1. Masz 120 minut na rozwiązanie wszystkich zadań. 2. W każdym zadaniu zaznacz kółkiem wybraną
I. Substancje i ich przemiany
 NaCoBeZU z chemii dla klasy 7 I. Substancje i ich przemiany 1. Zasady bezpiecznej pracy na lekcjach chemii zaliczam chemię do nauk przyrodniczych stosuję zasady bezpieczeństwa obowiązujące w pracowni chemicznej
NaCoBeZU z chemii dla klasy 7 I. Substancje i ich przemiany 1. Zasady bezpiecznej pracy na lekcjach chemii zaliczam chemię do nauk przyrodniczych stosuję zasady bezpieczeństwa obowiązujące w pracowni chemicznej
Układ okresowy pierwiastków. Myślenie bez intuicji jest puste, intuicja bez myślenia jest ślepa. Albert Einstein
 Układ okresowy pierwiastków Myślenie bez intuicji jest puste, intuicja bez myślenia jest ślepa. Albert Einstein Spis treści Ważne pojęcia Trochę historii O ilu pierwiastkach wiemy Wygląd współczesnego
Układ okresowy pierwiastków Myślenie bez intuicji jest puste, intuicja bez myślenia jest ślepa. Albert Einstein Spis treści Ważne pojęcia Trochę historii O ilu pierwiastkach wiemy Wygląd współczesnego
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
OPIS PRZEDMIOTU ZAMÓWIENIA po zmianie treści w dniu r. (zmiany naniesiono kolorem czerwonym)
 Załącznik nr 5 do SIWZ Oznaczenie sprawy (numer referencyjny): ZP 0/WILiŚ/09, CRZP 9/00/D/9 OPIS PRZEDMIOTU ZAMÓWIENIA po zmianie treści w dniu 4.04.09r. (zmiany naniesiono kolorem czerwonym). Przedmiotem
Załącznik nr 5 do SIWZ Oznaczenie sprawy (numer referencyjny): ZP 0/WILiŚ/09, CRZP 9/00/D/9 OPIS PRZEDMIOTU ZAMÓWIENIA po zmianie treści w dniu 4.04.09r. (zmiany naniesiono kolorem czerwonym). Przedmiotem
CHEMIA I GIMNAZJUM WYMAGANIA PODSTAWOWE
 WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
Chemia. Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej r Odkrycie fosforu przez Henninga Branda
 Chemia Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
Chemia Dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
 PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
Układ okresowy pierwiastków
 strona 1/8 Układ okresowy pierwiastków Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Teoria atomistyczno-cząsteczkowa, nieciągłość budowy materii. Układ okresowy pierwiastków
strona 1/8 Układ okresowy pierwiastków Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Teoria atomistyczno-cząsteczkowa, nieciągłość budowy materii. Układ okresowy pierwiastków
WYMAGANIA EDUKACYJNE
 SZKOŁA PODSTAWOWA W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie 7 Szkoły Podstawowej str. 1 Wymagania edukacyjne
SZKOŁA PODSTAWOWA W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie 7 Szkoły Podstawowej str. 1 Wymagania edukacyjne
CHEMIA kl. I. Nauczyciel mgr Ewa Doroszuk. Wymagania edukacyjne (obowiązkowe i formalne):
 CHEMIA kl. I Nauczyciel mgr Ewa Doroszuk Wymagania edukacyjne (obowiązkowe i formalne): Dział I Substancje i ich przemiany. UCZEŃ: zna regulamin szkolnej pracowni chemicznej i konsekwencje nieprzestrzegania
CHEMIA kl. I Nauczyciel mgr Ewa Doroszuk Wymagania edukacyjne (obowiązkowe i formalne): Dział I Substancje i ich przemiany. UCZEŃ: zna regulamin szkolnej pracowni chemicznej i konsekwencje nieprzestrzegania
PRAWO OKRESOWOŚCI. 1.131. Liczba co najmniej częściowo obsadzonych powłok elektronowych decyduje o przynależności pierwiastka
 PRAWO OKRESOWOŚCI 1.125. D. Mendelejew sformułował swoje prawo w następujący sposób: Właściwości fizyczne i chemiczne pierwiastków zmieniają się okresowo w zależności od A) liczby protonów w jądrze atomowym.
PRAWO OKRESOWOŚCI 1.125. D. Mendelejew sformułował swoje prawo w następujący sposób: Właściwości fizyczne i chemiczne pierwiastków zmieniają się okresowo w zależności od A) liczby protonów w jądrze atomowym.
BUDOWA ATOMU. Pierwiastki chemiczne
 BUDOWA ATOMU Pierwiastki chemiczne p.n.e. Sb Sn n Pb Hg S Ag C Au Fe Cu ()* do XVII w. As (5 r.) P (669 r.) () XVIII w. N Cl Cr Co Y Mn Mo () Ni Pt Te O U H W XIX w. (m.in.) Na Ca Al Si F Cs Ba B Bi I
BUDOWA ATOMU Pierwiastki chemiczne p.n.e. Sb Sn n Pb Hg S Ag C Au Fe Cu ()* do XVII w. As (5 r.) P (669 r.) () XVIII w. N Cl Cr Co Y Mn Mo () Ni Pt Te O U H W XIX w. (m.in.) Na Ca Al Si F Cs Ba B Bi I
1669 r Odkrycie fosforu przez Henninga Branda. Chemia. dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej
 1669 r Odkrycie fosforu przez Henninga Branda Chemia dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA 5 GAZY 3 TERMOCHEMIA 2 TERMODYNAMIKA 4 RÓWNOWAGA
1669 r Odkrycie fosforu przez Henninga Branda Chemia dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA 5 GAZY 3 TERMOCHEMIA 2 TERMODYNAMIKA 4 RÓWNOWAGA
Wykłady z podstaw chemii
 Chemia dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
Chemia dr hab. Joanna Łojewska Zakład Chemii Nieorganicznej 1669 r Odkrycie fosforu przez Henninga Branda Wykłady z podstaw chemii Lista wykładów STECHIOMETRIA GAZY TERMOCHEMIA TERMODYNAMIKA RÓWNOWAGA
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.
![Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.](/thumbs/100/143872318.jpg) Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów
I. Substancje i ich przemiany
 Wymagania edukacyjne na poszczególne oceny szkolne klasa 7 Niepełnosprawność intelektualna oraz obniżenie wymagań i dostosowanie ich do możliwości ucznia I. Substancje i ich przemiany stosuje zasady bezpieczeństwa
Wymagania edukacyjne na poszczególne oceny szkolne klasa 7 Niepełnosprawność intelektualna oraz obniżenie wymagań i dostosowanie ich do możliwości ucznia I. Substancje i ich przemiany stosuje zasady bezpieczeństwa
Plan pracy Szkoła Podstawowa Chemia Klasa VII
 Plan pracy Szkoła Podstawowa Chemia Klasa VII Numer lekcji Treści nauczania (temat lekcji) Liczba godzin na realizację Umiejętności wymagania szczegółowe Doświadczenia/pokazy /przykłady/zadania (wyróżnione
Plan pracy Szkoła Podstawowa Chemia Klasa VII Numer lekcji Treści nauczania (temat lekcji) Liczba godzin na realizację Umiejętności wymagania szczegółowe Doświadczenia/pokazy /przykłady/zadania (wyróżnione
Wyjaśnienie treści Specyfikacji Istotnych Warunków Zamówienia
 Warszawa, dn. 03-07-2018 r. godz. 7:30 Wyjaśnienie treści Specyfikacji Istotnych Warunków Zamówienia dotyczy: postępowania o udzielenie zamówienia publicznego, prowadzonego w trybie przetargu nieograniczonego
Warszawa, dn. 03-07-2018 r. godz. 7:30 Wyjaśnienie treści Specyfikacji Istotnych Warunków Zamówienia dotyczy: postępowania o udzielenie zamówienia publicznego, prowadzonego w trybie przetargu nieograniczonego
Regulamin Przedmiotowy. XII Wojewódzkiego Konkursu Chemicznego. dla uczniów szkół gimnazjalnych województwa świętokrzyskiego
 Regulamin Przedmiotowy XII Wojewódzkiego Konkursu Chemicznego dla uczniów szkół gimnazjalnych województwa świętokrzyskiego w roku szkolnym 2014/ 2015 I. Informacje ogólne 1. Niniejszy Regulamin określa
Regulamin Przedmiotowy XII Wojewódzkiego Konkursu Chemicznego dla uczniów szkół gimnazjalnych województwa świętokrzyskiego w roku szkolnym 2014/ 2015 I. Informacje ogólne 1. Niniejszy Regulamin określa
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
Powiatowy Konkurs Chemiczny dla Gimnazjalistów Młody Chemik. Drogi gimnazjalisto!
 KOD UCZNIA:.. Powiatowy Konkurs Chemiczny dla Gimnazjalistów Młody Chemik Drogi gimnazjalisto! 1. Przed Tobą zestaw 22 zadań konkursowych, za rozwiązanie których możesz uzyskać 35 punktów. 2. Na rozwiązanie
KOD UCZNIA:.. Powiatowy Konkurs Chemiczny dla Gimnazjalistów Młody Chemik Drogi gimnazjalisto! 1. Przed Tobą zestaw 22 zadań konkursowych, za rozwiązanie których możesz uzyskać 35 punktów. 2. Na rozwiązanie
Pracownia Wzorców Chemicznych CENNIK ZA WYKONANIE MATERIAŁÓW ODNIESIENIA Obowiązuje od 01.09.2014r. 4 Materiały odniesienia - 4.
 Pracownia Wzorców Chemicznych CENNIK ZA WYKONANIE MATERIAŁÓW ODNIESIENIA Obowiązuje od 009.2014r. Lp. Wzorce jednoskładnikowe 7. 8. 9. 10. 1 Antymon (Sb 3+ ) 101 Arsen (As 3+ ) 102 Azot amonowy (N NH4
Pracownia Wzorców Chemicznych CENNIK ZA WYKONANIE MATERIAŁÓW ODNIESIENIA Obowiązuje od 009.2014r. Lp. Wzorce jednoskładnikowe 7. 8. 9. 10. 1 Antymon (Sb 3+ ) 101 Arsen (As 3+ ) 102 Azot amonowy (N NH4
Wojewódzki Konkurs Przedmiotowy. dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014 KOD UCZNIA Etap: Data: Czas pracy: Rejonowy 17 stycznia 2014 90 minut Informacje dla ucznia
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014 KOD UCZNIA Etap: Data: Czas pracy: Rejonowy 17 stycznia 2014 90 minut Informacje dla ucznia
