Ogólne podsumowanie oceny naukowej szczepionki Priorix i produktów z nią związanych pod różnymi nazwami(patrz aneks I)
|
|
|
- Bartosz Wrona
- 8 lat temu
- Przeglądów:
Transkrypt
1 Aneks II Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego, oznakowania opakowań i ulotki dla pacjenta przedstawione przez Europejską Agencję Leków 9
2 Wnioski naukowe Ogólne podsumowanie oceny naukowej szczepionki Priorix i produktów z nią związanych pod różnymi nazwami(patrz aneks I) Produkt Priorix to złożona, liofilizowana szczepionka przeciwko odrze (ang. measles, M), śwince (ang. mumps, M) i różyczce (ang. rubeola, R). Postać farmaceutyczna i moc szczepionki są jednakowe we wszystkich państwach. Szczepionka występuje w postaci liofilizatu, który przed zastosowaniem jest rekonstytuowany z zastosowaniem oddzielnie dostarczanego jałowego rozpuszczalnika (woda do wstrzykiwań). Szczepionka Priorix jest zarejestrowana w drodze procedur krajowych w 20 państwach i w drodze procedury wzajemnego uznania - w 9 państwach. Charakterystyki produktu leczniczego (ChPL) zatwierdzone w państwach członkowskich podczas procedury wzajemnego uznania i podczas procedur krajowych nieznacznie się różnią. Celem tej procedury zgodnej z art. 30 jest ujednolicenie ChPL produktu Priorix i produktów z nią związanych pod różnymi nazwami w państwach członkowskich. Aspekty kliniczne Ogólnie rzecz biorąc, podmiot odpowiedzialny zaproponował ujednolicony tekst zredagowany głównie na podstawie ChPL zatwierdzonej w procedurze wzajemnego uznania z pewnymi zmianami. Ponadto informacja o produkcie została przedstawiona z wykorzystaniem najnowszej wersji wzorca QRD, wersji 2, opublikowanej 12 października 2011 r. Punkt Wskazania do stosowania Szczepionka Priorix jest wskazana w czynnym uodpornianiu przeciwko odrze, śwince i różyczce. Zatwierdzona dolna granica wieku, w którym można zastosować szczepionkę Priorix waha się od 9. do 15. miesiąca życia w różnych państwach członkowskich UE. W niektórych przypadkach jest odzwierciedleniem krajowych wytycznych dotyczących rutynowo stosowanych szczepień MMR. Immunogenność szczepionki Priorix oceniono w wielu badaniach klinicznych u dzieci w wieku od 12 do 24 miesięcy, 11 do 23 miesięcy i 9 do 12 miesięcy. Na podstawie oceny wszystkich danych podmiot odpowiedzialny zaproponował ujednolicenie wskazania do stosowania szczepionki Priorix do dzieci w wieku od 9. miesiąca życia, stosując następujące sformułowanie: Szczepionka PRIORIX jest wskazana w czynnym uodparnianiu dzieci w wieku od 9. miesiąca życia, młodzieży i osób dorosłych przeciwko odrze, śwince i różyczce. CHMP zwrócił uwagę, że najnowsze dane z epidemii we Francji wskazują, że zakażenia wirusem odry występują najczęściej u dzieci poniżej 1. roku życia, a następnie u dzieci pomiędzy 1. a 2. rokiem życia. Częstości występowania w obu tych grupach wiekowych wynosiły odpowiednio ponad 50 i 45 przypadków na W porównaniu z 2009 r. liczba przypadków w 2010 r. zwiększyła się ponad trzykrotnie u dzieci w wieku poniżej 1 roku i wzrosła pięciokrotnie u osób dorosłych w wieku lat. Wśród obserwowanych przypadków w 2010 r. prawie 30% było hospitalizowanych i cięższe nasilenie choroby obserwowano u dzieci poniżej 1. roku życia i osób dorosłych w wieku powyżej 20 lat z odsetkami przypadków wymagających hospitalizacji wynoszącymi, odpowiednio, 38% i 46%. Szczepienie dzieci w wieku od 9. miesiąca życia jest więc jednym z narzędzi opanowania takiego rodzaju epidemii. 10
3 Jednakże dane dotyczące immunogenności wyraźnie wskazują, że u dzieci w wieku 9-11 miesięcy w czasie pierwszego uodporniania obserwowano słabszą odpowiedź w postaci przeciwciał niż u dzieci starszych, co jest najprawdopodobniej wynikiem krążących przeciwciał pochodzących od matki lub niedojrzałości układu immunologicznego. Dlatego, w celu zapewnienia odpowiedniej ochrony przeciwko odrze, śwince i różyczce w tej grupie wiekowej, konieczne jest podanie drugiej dawki najlepiej po trzech miesiącach po podaniu dawki pierwszej. Podsumowując, na podstawie danych klinicznych przyjęto niższą granicę wieku, jednakże z uwagi na słabszą odpowiedź immunologiczną po podaniu pojedynczej dawki szczepionki Priorix dzieciom w wieku poniżej 12 miesięcy zamieszczono odniesienia do punktów 4.2, 4.4 i 5.1. W szczególności: W przypadku stosowania u dzieci pomiędzy 9. a 12. miesiącem życia, patrz punkty 4.2, 4.4 i 5.1. Podmiot odpowiedzialny zamieścił także w tym punkcie twierdzenie Stosowanie szczepionki PRIORIX powinno być zgodne z oficjalnymi wytycznymi, ale CHMP ustalił przeniesienie tego twierdzenia na początek punku 4.2 Dawkowanie i sposób podawania, ponieważ, zgodnie z wytycznymi dotyczącymi ChPL z września 2009 r., odniesienie do oficjalnych zaleceń powinno być zamieszczone w punkcie 4.2. Punkt Dawkowanie i sposób podawania We wszystkich państwach dawka przygotowanej do podania szczepionki Priorix wynosi 0,5 ml. Sposób podawania szczepionki Priorix to wstrzyknięcie podskórne, chociaż może być ona także podawana we wstrzyknięciu domięśniowym. Domięśniowy sposób podania jest zatwierdzony we wszystkich państwach członkowskich z wyjątkiem Holandii. Zgodnie z wytycznymi dotyczącymi ChPL podmiot odpowiedzialny zaproponował także dodanie specyficznego podpunktu dotyczącego dzieci i młodzieży. CHMP uznał, że zalecania dotyczące dawkowania są możliwe do zaakceptowania, jednakże w celu dostarczenia jasnych instrukcji dla pracowników służby zdrowia zaproponował bardziej rozbudowane sformułowanie (tzn. rozdzielenie zaleceń dla grup wiekowych). W uaktualnionej dokumentacji klinicznej nie zamieszczono informacji co do domięśniowej drogi podania, ale takie dane dostarczono we wstępnym wniosku o pozwolenie na dopuszczenie do obrotu. Domięśniowa droga podania była wstępnie zbadana u malej liczby osób (N=40) z odsetkami serokonwersji, odpowiednio, 96,7%, 97,5% i 100% przeciwko odrze, śwince i różyczce. Średnie geometryczne miana przeciwciał (GMT) u osób, u których doszło do serokonwersji, wynosiły odpowiednio: 2431,9 miu/ml, 1010,0 U/ml i 67,1 IU/ml, dla przeciwciał przeciwko odrze, śwince i różyczce i były nieco niższe niż wartości uzyskane po podaniu podskórnym (odpowiednio 2958 miu/ml, 1400 U/ml i 73 IU/ml). Chociaż dostępne są jedynie ograniczone dane, zwrócono uwagę, że podanie domięśniowe jest standardowo stosowaną praktyką w wielu państwach członkowskich. Ponadto doświadczenia dotyczące innych szczepionek MMR lub MMRV (odra, świnka, różyczka, ospa wietrzna) nie wskazują na żaden niekorzystny wpływ na odpowiedź immunologiczną lub profil bezpieczeństwa po podaniu domięśniowym. U pacjentów z trombocytopenią lub jakimkolwiek zaburzeniem krzepnięcia zaleca się podskórne podanie szczepionki, toteż zamieszczono odpowiednią uwagę. 11
4 Punkt Przeciwwskazania Osoby z niedoborem odporności Główna rozbieżność w zatwierdzonych ChPL dotyczy podawania szczepionki Priorix osobom zakażonym wirusem HIV. Przeglądy systemowe dotyczące bezpieczeństwa, immunogenności i skuteczności szczepienia przeciwko odrze u dzieci zakażonych wirusem HIV wskazały, że atenuowany wirus zawarty w szczepionce przeciwko odrze może wywołać ciężkie powikłania lub chorobę zakończoną zgonem u pacjentów z ciężkim upośledzeniem odporności zakażonych wirusem HIV. Ponadto odpowiedź w postaci wytworzenia przeciwciał po podaniu szczepionki przeciwko odrze zmniejsza się wraz ze wzrostem stopnia upośledzenia odporności. Związek pomiędzy brakiem przeciwciał przeciwko odrze po zaszczepieniu i niską liczbą limfocytów T CD4+ (<600 komórek/mm 3 ) został stwierdzony w opublikowanych badaniach (Moss i wsp., 2003). U dzieci zakażonych wirusem HIV bez zaburzeń odporności szczepionka przeciwko odrze jest bezpieczna, a ryzyko wystąpienia choroby wirusowej w wyniku podania szczepionki jest bardzo niskie. Biorąc pod uwagę ciężki przebieg zakażenia wirusem odry dzikiego typu u pacjentów z zaawansowanym zakażeniem HIV, Światowa Organizacja Zdrowia zaleca rutynowe szczepienie potencjalnie podatnych na zakażenie, bezobjawowych dzieci i dorosłych zakażonych wirusem HIV. Nie stwierdzono, aby zawarte w szczepionce wirusy świnki i różyczki wywoływały poważne powikłania u osób zakażonych wirusem HIV, ale z uwagi na niewielkie prawdopodobieństwa odniesienia korzyści ze szczepienia i możliwość wystąpienia powikłań, osoby z ciężkimi zaburzeniami odporności nie powinny być szczepione. CHMP uznał, że twierdzenie dotyczące osób z niedoborem odporności humoralnej i komórkowej jest odpowiednie i zgodne z zatwierdzonymi przeciwwskazaniami dla innych szczepionek MMR. W odniesieniu do HIV nie ma wspólnych wytycznych europejskich dotyczących klasyfikacji CD4+ pod względem %CD4+ lub liczby komórek. Opublikowana w 2006 r. klasyfikacja WHO choroby związanej z zakażeniem wirusem HIV u osób dorosłych i dzieci stanowi, co następuje: Kryteria immunologiczne rozpoznawania zaawansowanego HIV u dzieci w wieku poniżej 5 lat z ciężkim zakażeniem HIV: %CD4+ < 25 u dzieci w wieku poniżej 12 miesięcy %CD4+ <20 u dzieci w wieku miesięcy %CD4+ <15 u dzieci w wieku miesięcy Ponadto występują zgłoszenia dotyczące zapalenia mózgu z obecnymi ciałkami wtrętowymi wirusa odry po szczepieniu MMR u dzieci z pierwotnym zespołem niedoboru odporności i dysgammaglobulinemią (patrz Bitnun i wsp., 1999 Clin. Infect Dis). Podsumowując, CHMP poparł propozycję podmiotu odpowiedzialnego: Niedobór odporności humoralnej i komórkowej (pierwotny lub nabyty), w tym hipogammaglobulinemia i AIDS lub objawowe zakażenie HIV lub specyficzny dla wieku odsetek limfocytów CD4+ < 25%. Jednakże uznano, że konieczne jest włącznie specyficznego dla wieku odsetka CD4+ zgodnie z wytycznymi WHO, ponieważ zalecane jest szczepienie dzieci od wieku od 9 miesięcy. CHMP zwrócił także uwagę, że w wyniku postępu nauki i ważnych danych immunologicznych, przeciwwskazanie u osób z upośledzeniem odporności może wymagać przeredagowania w przypadku wszystkich szczepionek MMR. To może wymagać ponownej oceny wszystkich podobnych produktów. 12
5 Ciąża W okresie ciąży podawanie szczepionki Priorix jest przeciwwskazane. W czasie dyskusji w CHMP poddano pod wątpliwość, czy ciąża ma być nadal przeciwwskazaniem. W celu uzyskania dalszego wglądu w potencjalnie szkodliwy wpływ szczepienia MMR w czasie ciąży lub okresie przed poczęciem CHMP zwrócił się do podmiotu odpowiedzialnego o przedstawienie dowodów z zaawansowanych obserwacji i badań z grupą kontrolną, skupiających się na ryzyku spontanicznych poronień u kobiet podatnych na odrę, świnkę i różyczkę, ryzyku wad i zespołu różyczki wrodzonej u potomstwa tych kobiet, danych z obserwacji do ukończenia 1. roku życia dzieci urodzonych przez matki podatne na różyczkę. Ponieważ szczepionka Priorix jest przeciwwskazana u kobiet w ciąży, nie ustalono działań interwencyjnych ani aktywnych działań obserwacyjnych. Dane przedstawiony przez podmiot odpowiedzialny zawierają dane z obserwacji po wprowadzeniu do obrotu z bazy danych podmiotu odpowiedzialnego i dane z ostatnio opublikowanego piśmiennictwa dotyczącego szczepienia MMR u kobiet w ciąży. Dane ze zgłoszeń spontanicznych i rejestru ciąż nie wskazały na zastrzeżenia dotyczące bezpieczeństwa w odniesieniu do samoistnych poronień i wad wrodzonych w związku z nieumyślnym podaniem szczepionki Priorix kobietom w ciąży. Jednakże podmiot odpowiedzialny zwrócił uwagę, że dane są bardzo ograniczone, biorąc pod uwagę przeciwwskazanie zamieszczone obecnie na oznakowaniu opakowań. Naturalne zakażenie różyczką może mieć niszczący wpływ na ciążę, prowadzić do zgonu dziecka, przedwczesnego porodu i szeregu wad wrodzonych. Zakażenie wirusem różyczki w pierwszym trymestrze ciąży wywołuje niekorzystny wpływ w 85% ciąż. Zakażenie płodu wywołane przez atenuowany szczep wirusa zawarty w obecnie stosowanej szczepionce przeciwko różyczce występuje rzadko i nie ma dowodów wskazujących na to, że zakażenie płodu wirusem szczepionki jest szkodliwe. Teoretyczne maksymalne ryzyko rozwoju zespołu różyczki wrodzonej po podaniu szczepionki równe 1,6% jest o wiele niższe niż ryzyko poważnych wad wrodzonych niebędących wynikiem zespołu różyczki wrodzonej w czasie ciąży (Bozz i wsp., 2011). Chociaż dane dostępne w piśmiennictwie podkreślają wartościową perspektywę w odniesieniu do ogólnego ryzyka ekspozycji na szczepionkę w różnych stadiach ciąży z uwagi na teoretyczne ryzyko i brak możliwości udowodnienia, że ryzyko jest zerowe, podmiot odpowiedzialny zaproponował, by ciąża pozostała przeciwwskazaniem do podawania szczepionki przeciwko różyczce. CHMP zwrócił uwagę, że z uwagi na powszechne przeciwwskazanie szczepienia przeciwko odrze, śwince i różyczce u kobiet w ciąży dostępne są jedynie ograniczone dane dotyczące samoistnych poronień, wad i wrodzonego zespołu różyczki u potomstwa kobiet zaszczepionych szczepionką Priorix. Przegląd danych zebranych w ramach nadzoru nad bezpieczeństwem farmakoterapii i danych z piśmiennictwa nie wskazuje na ryzyko wystąpienia zespołu różyczki wrodzonej u dzieci kobiet zaszczepionych w ciąży lub poczętych w krótkim okresie po zaszczepieniu szczepionką Priorix. Dane z piśmiennictwa dotyczące kobiet w okresie rozrodczym, które zostały zaszczepione na terenie Ameryki Środkowej i Południowej wskazują na brak ryzyka lub nieistotne ryzyko (0-0,2%) wystąpienia zespołu różyczki wrodzonej po zaszczepieniu kobiet nieświadomych tego, że są w ciąży, szczepionką przeciwko różyczce. Teoretyczne ryzyko wpływu teratogennego po zaszczepieniu szczepionką przeciwko różyczce oceniono jako 0,5% w czasie pierwszego trymestru i sięgające 1,6% po podaniu szczepionki w okresie od 1-2 tygodni przed zapłodnieniem do 4-6 tygodni po zapłodnieniu dziecka. Z powodu tego teoretycznego ryzyka wpływu teratogennego w 2011 r. WHO zaleciła unikanie podawania szczepionki przeciwko różyczce kobiet w ciąży z zasady, a kobietom planującym ciążę doradzenie odłożenia tych planów na okres 1 miesiąca po szczepieniu przeciwko różyczce. Ponieważ nadal istnieje teoretyczne ryzyko związane ze szczepionkami 13
6 zawierającymi różyczkę, ustalono, że ta bardzo wrażliwa grupa nie powinna być narażana na ryzyko. Podsumowując, CHMP uznał, że ustanowienie ciąży jako przeciwwskazanie jest zgodne z zatwierdzonym przeciwwskazaniem dla innych szczepionek MMR. Obecnie brak jest danych, aby wnioskować, że istnieje wpływ teratogenny po podaniu szczepionek MMR, jednakże teoretyczna obawa pozostaje. Ryzyko dla szczepionki przeciwko odrze (zwiększenie samoistnych poronień martwego płodu) jest wskazane jako nieznane. CHMP zwrócił także uwagę, że istnieją obecnie pewne opublikowane dane, które mogą uzasadniać zniesienie bezwzględnego przeciwwskazania do stosowania szczepionki MMR u kobiet w ciąży, ponieważ uważa się, że chociaż szczepienie kobiety w ciąży jest niezalecane, w niektórych indywidualnych przypadkach korzyści wynikające z podania szczepionki kobiecie w ciąży mogą przewyższać ryzyko. To może wymagać ponownej oceny dla wszystkich podobnych produktów. Punkt Specjalne ostrzeżenia i środki ostrożności podczas stosowania Aby zachować zgodność z wytycznymi dotyczącymi ChPL, firma zaproponowała: skrócenie długiego ustępu dotyczącego stosowania epinefryny, zastępując go ogólnym stwierdzeniem o dostępności odpowiedniego leczenia i nadzorowania po podaniu szczepionki; wprowadzenie sformułowania dotyczącego osób zakażonych wirusem HIV i nadwrażliwości na składniki szczepionki zgodnie z punktem 4.3; usunięcie sformułowania dotyczącego wieku szczepienia (zawarte w punkcie 4.2). Firma zaproponowała także przeformułowanie fragmentu dotyczącego idiopatycznej czerwienicy trombocytopenicznej (ITP). CHMP zalecił zmianę kolejności niektórych twierdzeń i dodanie podtytułów, aby wyraźnie rozdzielić każde ostrzeżenie (tzn. trombocytopenia, pacjenci z niedoborem odporności i przenoszenie zakażenia). Ponieważ brak jest dostępnych danych dotyczących immunogenności w odniesieniu do wpływu profilaktycznego stosowania leków przeciwgorączkowych, zalecono przeredagowanie ustępu dotyczącego podawania szczepionki Priorix osobnikom z zaburzeniami ośrodkowego układu nerwowego (OUN) w następujący sposób: Należy zachować ostrożność podczas podawania szczepionki PRIORIX u osób z zaburzeniami ośrodkowego układu nerwowego (OUN), osób podatnych na występowanie drgawek gorączkowych lub w przypadku występowania drgawek w rodzinie. Należy prowadzić uważną obserwację po szczepieniu osób, u których w przeszłości występowały drgawki gorączkowe. CHMP uznał, że twierdzenie dotyczące nietolerancji fruktozy należy zmienić z: Szczepionki nie należy podawać pacjentom z rzadkim zaburzeniem wrodzonym w postaci nietolerancji fruktozy na: Szczepionka PRIORIX zawiera sorbitol, dlatego nie należy jej podawać osobom z rzadkim zaburzeniem w postaci nietolerancji fruktozy. Z punktu 4.4 postanowiono usunąć twierdzenie dotyczące ciąży, ponieważ zgodnie z wytycznymi dotyczącymi oceny ryzyka produktów leczniczych na płodność i laktację u ludzi: od danych do oznakowania (EAEA/CHMP/203927/200), odniesienie do stosowania w ciąży może być zawarte tylko w punktach 4.3 i 4.6. Z uwagi na znacznie większe prawdopodobieństwo występowania trombocytopenii po naturalnym zakażeniu, korzyści ze szczepienia najczęściej przewyższały ryzyko ciężkiej objawowej trombocytopenii wywołanej przez uodpornienie. Dlatego CHMP zasugerował dodanie informacji z ostatnio przeprowadzonego przeglądu systematycznego, że Trombocytopenia związana z podaniem szczepionki MMR występuje rzadko i w większości przypadków ulega samoograniczeniu. 14
7 Również w celu wyjaśnienia CHMP uzgodnił zastąpienie proponowanego przez firmę twierdzenia: W takich przypadkach należy dokładnie ocenić stosunek korzyści do ryzyka uodpornienia szczepionką Priorix twierdzeniem: Należy zachować ostrożność podczas uodparniania pacjentów z rozpoznaną trombocytopenią lub osób, u których w przeszłości wystąpiła trombocytopenia po szczepieniu przeciwko odrze, śwince lub różyczce. Podmiot odpowiedzialny zmodyfikował nieco proponowany tekst i ostateczne sformułowanie zatwierdzone przez CHMP to: Po szczepieniu żywą szczepionką przeciwko odrze, śwince i różyczce zgłaszano przypadki pogorszenia w przebiegu trombocytopenii i przypadki nawrotu trombocytopenii u osób, u których doszło do rozwoju trombocytopenii po podaniu pierwszej dawki. Trombocytopenia związana z MMR występuje rzadko i zasadniczo ulega samoograniczeniu. U pacjentów z obecną trombocytopenią lub u których w przeszłości wystąpiła trombocytopenia po szczepieniu przeciwko odrze, śwince lub różyczce należy dokładnie ocenić stosunek korzyści do ryzyka podania szczepionki PRIORIX. Podczas szczepienia tych pacjentów należy zachować ostrożność i raczej wybrać podskórny sposób podania. CHMP uznał, że zaproponowany przez podmiot odpowiedzialny ustęp dotyczący upośledzenia odporności jest przestarzały, i zaproponował jego przeredagowanie. Podmiot odpowiedzialny zaakceptował nowy tekst i dodał jeszcze twierdzenie dotyczące obserwacji tych pacjentów, które zostało przyjęte przez CHMP. Ostateczne uzgodnione sformułowanie jest następujące: U pacjentów z upośledzeniem odporności bez przeciwwskazań do tego szczepienia (patrz punkt 4.3) odpowiedź może być słabsza niż u pacjentów z prawidłową odpornością, dlatego niektórzy z tych pacjentów mogą zarazić się odrą, świnką lub różyczką w przypadku kontaktu, pomimo odpowiednio przeprowadzonego szczepienia. Tych pacjentów należy uważnie obserwować pod kątem objawów odry, zapalenia ślinianek przyusznych i różyczki. Po zapoznaniu się z tekstem dotyczącym przenoszenia CHMP uznał, że propozycja podmiotu odpowiedzialnego jest zasadniczo możliwa do zaakceptowania z dodaniem, że znane jest występowanie nie tylko różyczki, ale także wirusa odry w wydzielinie z gardła. Podmiot odpowiedzialny zmienił odpowiednią część tekstu zgodnie z tym i dodał także kolejne twierdzenie w celu odzwierciedlenia potwierdzonej możliwości transmisji przez łożysko. CHMP zaakceptował to twierdzenie. Ostateczne zatwierdzone sformułowanie to: Nie udowodniono dotychczas przeniesienia wirusa odry i świnki od osób zaszczepionych na podatne osoby z kontaktu. Znane jest występowanie wirusów różyczki i odry w wydzielinie z gardła w okresie od 7. do 28. dnia po szczepieniu ze szczytowym wydzielaniem około 11. dnia. Jednakże nie ma dowodów wskazujących na przeniesienie tych wydzielonych wirusów szczepionki na podatne osoby z kontaktu. Potwierdzono przeniesienie wirusa ze szczepionki przeciwko różyczce na dzieci poprzez mleko matki oraz przeniesienie przez łożysko bez obecności objawów klinicznych choroby. Punkt Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji W badaniach klinicznych wykazano, że szczepionka Priorix może być podawana jednocześnie z żywą atenuowaną szczepionką przeciwko ospie wietrznej, DTPa-IPV i złożoną szczepionką przeciwko zapaleniu wątroby typu A i B (Marshall i wsp., 2006; Stuck i wsp., 2002; Usonis i wsp., 2005; Wellington i Goa, 2003). W ostatnim czasie szczepionkę Priorix podawano jednocześnie ze szczepionką przeciwko Haemophilus influenze typu B (HiB) i skoniugowaną szczepionką przeciwko meningokokom typu C oraz jednocześnie z inaktywowaną szczepionką przeciwko zapaleniu wątroby typu A i 7-walentną skoniugowaną szczepionką przeciwko pneumokokom. Dostępne dane nie 15
8 wskazują na żadne klinicznie istotne oddziaływanie na odpowiedź w postaci wytworzenia przeciwciał przeciwko każdemu oddzielnemu antygenowi (Carmona i wsp., 2010; Pace i wsp., 2008). Niektóre szczepionki, które można podawać jednocześnie ze szczepionką Priorix, są wymienione w ChPL w Belgii, Bułgarii, na Cyprze, w Danii, Estonii, we Francji, w Holandii, w Luksemburgu, na Malcie, w Polsce, Rumunii i Wielkiej Brytanii. Podmiot odpowiedzialny zaproponował zastosowanie ogólnego twierdzenia, zamiast zamieszczanie wykazu różnych szczepionek. CHMP zwrócił uwagę, że dla większości badań klinicznych, w których oceniano jednoczesne podawanie szczepionki Priorix z innymi szczepionkami, brak jest raportów końcowych, ale dostępne są jedynie odniesienia do piśmiennictwa. Dostępne dane nie wskazują, że jednoczesne podawanie tych szczepionek ma wpływ na immunogenność i bezpieczeństwo badanych antygenów. Jednakże z uwagi na fakt, że nowe i bardzo złożone szczepionki dla dzieci są w trakcie opracowywania, zalecono sporządzenie wykazu szczepionek odpowiednich do jednoczesnego podawania zamiast dodanie ogólnego stwierdzenia dotyczącego jednoczesnego stosowania z innymi szczepionkami. Podmiot odpowiedzialny zmienił ten ustęp zgodnie z zaleceniami CHMP i dodał do wykazu 1 dodatkową szczepionkę (10-walentną skoniugowaną szczepionkę przeciw pneumokokom). Po przeglądzie i ocenie raportu badania klinicznego, który został przedstawiony na poparcie jednoczesnego podawania produktu Priorix z ta szczepionką, CHMP wyraził na to zgodę. Ostatecznie uzgodnione sformułowanie to: Szczepionkę PRIORIX może podawać jednocześnie (ale w różne miejsca) z którąkolwiek z następujących monowalentnych i złożonych szczepionek [w tym z sześciowalentnymi szczepionkami DTPa-HBV-IPV/Hib)]: acelularna szczepionka przeciwko błonicy, tężcowi i krztuścowi (DTPa), szczepionka przeciwko Haemophilus influenzae typu b (Hib), inaktywowana szczepionka przeciwko polio (IPV), szczepionka przeciwko zapaleniu wątroby typu B (HBV), szczepionka przeciwko zapaleniu wątroby typu A (HAV), szczepionka skoniugowana przeciwko meningokokom typu C (MenC), szczepionka przeciwko ospie wietrznej i półpaścowi (VZV), doustna szczepionka przeciwko polio (OPV) i 10-walentna skoniugowana szczepionka przeciwko pneumokokom zgodnie z lokalnymi wytycznymi. Jeśli szczepionki nie zostaną podane w tym samym czasie, zaleca się odstęp co najmniej 1 miesiąca pomiędzy podaniem szczepionki PRIORIX i innych żywych atenuowanych szczepionek. Brak danych na poparcie stosowania szczepionki PRIORIX z jakimikolwiek innymi szczepionkami. W odniesieniu do odłożenia szczepienia u osoby, która otrzymała gammaglobuliny ludzkie lub miała przetoczoną krew, CHMP uznał, że dłuższy odstęp pomiędzy podaniem immunoglobuliny lub innych produktów krwi i kolejnej dawki szczepionki jest zalecany w przypadku podawania dużych dawek, jak np. w przypadku leczenia stosowanego w chorobie Kawasaki (2g/kg). Ten fragment został przeredagowany w następujący sposób: U osób, które otrzymały gammaglobulinę ludzką lub miały przetoczoną krew, szczepienie należy odroczyć na okres trzech miesięcy lub dłuższy (do 11 miesięcy), w zależności od podanej dawki globulin ludzkich, z uwagi na możliwość niepowodzenia szczepienia z powodu biernie nabytych przeciwciał przeciwko odrze, śwince i różyczce. Punkt 4.6 Wpływ na płodność, ciążę i laktację Płodność Twierdzenie zostało zmodyfikowane zgodnie z zaleceniami zawartymi w wzorcu QRD Nie przeprowadzono badań do oceny wpływu szczepionki PRIORIX na rozrodczość. Ciąża 16
9 Szczepionka Priorix jest przeciwwskazana w ciąży, ale ponieważ w chwili obecnej brak jest informacji pozwalających wywnioskować, że po szczepieniu szczepionkami MMR istnieje wpływ teratogenny, uzgodniono następujące sformułowanie: Szczepionka PRIORIX jest przeciwwskazana w czasie ciąży (patrz punkt. 4.3) Jednakże dotychczas nie potwierdzono szkodliwego wpływu na płód po podaniu szczepionek przeciwko odrze, śwince i różyczce kobietom nieświadomym, że są w ciąży we wczesnym jej okresie. Kobiety w wieku rozrodczym W ChPL obowiązującej w Bułgarii, na Cyprze, w Estonii, na Malcie i w Wielkiej Brytanii podano, że należy unikać zajścia w ciążę przez miesiąc po zaszczepieniu, natomiast w ChPL państw włączonych w plan zarządzania ryzykiem i innych państw okres ten wynosi 3 miesiące. Komitet Doradczy ds. Szczepień (ang. Advisory Committee on Immunization Practices, ACIP) w 2001 r. skrócił zalecany okres unikania ciąży po otrzymaniu szczepionki zawierającej różyczkę z 3 miesięcy do 28 dni, ponieważ nie wykryto przypadków zespołu różyczki wrodzonej wśród dzieci kobiet, które zostały nieumyślnie zaszczepione przeciwko różyczce w okresie 3 miesięcy lub we wczesnej ciąży (Centrum Kontroli i Zapobiegania Chorób, 2001). Jednakże ponieważ nie przeprowadzono badań z zastosowaniem szczepionki Priorix u kobiet w ciąży, podmiot odpowiedzialny zaproponował, że należy unikać zajścia w ciążę w okresie 3 miesięcy po szczepieniu. CHMP zwrócił uwagę, że z powodu tego teoretycznego ryzyka wpływu teratogennego, WHO w 2011 r. zaleciła, że szczepienia przeciwko różyczce kobiet w ciąży należy unikać z zasady, a kobietom, które planują zajście w ciążę, należy poradzić, żeby odłożyły to do 1 miesiąca po zaszczepieniu przeciwko różyczce. Aby zachować zgodność z obecnymi zaleceniami WHO CHMP uznał, że odłożenie ciąży powinno zostać zmienione z 3 miesięcy na 1 miesiąc po zaszczepieniu. Ostatecznie zatwierdzone sformułowanie to: Kobietom, które planują zajście w ciążę, należy doradzić, aby odłożyły te plany na okres 1 miesiąca po zaszczepieniu. Chociaż należy zapytać kobietę o możliwość bycia we wczesnej ciąży przed zaszczepieniem, nie ma konieczności przeprowadzania testów przesiewowych w celu wykluczenia ciąży. Nieumyślne zaszczepienie nieświadomej ciąży kobiety szczepionką PRIORIX nie powinno być powodem przerwania ciąży. Karmienie piersią Podmiot odpowiedzialny stwierdził, że doświadczenie dotyczące stosowania szczepionki Priorix u kobiet karmiących piersią jest niedostateczne i że szczepienie kobiet karmiących piersią można rozważyć, jeśli korzyści wynikające ze szczepienia przewyższają ryzyko. CHMP zwrócił uwagę, że nie ma teoretycznych zagrożeń wynikających ze szczepienia w okresie karmienia piersią. Nawet jeśli dojdzie do przekazania wirusa zawartego w szczepionce zakażenie będzie łagodne i ustąpi samoistnie (ACIP 2011). Dlatego zaproponowano odpowiednią zmianę treści tego fragmentu. Szczepienie u kobiet karmiących piersią przeciwko odrze, śwince i różyczce nie wiązało się z żadnymi zastrzeżeniami dotyczącymi bezpieczeństwa dla kobiet i dzieci, chociaż doświadczenia w stosowaniu szczepionki Priorix w okresie karmienia piersią są ograniczone. Tylko w przypadku potwierdzenia lub podejrzenia, że u dziecka występuje niedobór odporności, należy rozważyć ryzyko i korzyści z zaszczepienia kobiety karmiącej piersią. Ponadto stwierdzono, że porada dotycząca karmienia piersią powinna wyraźnie rozróżniać zalecenia dotyczące szczepienia matek dzieci z niedoborem odporności lub z prawidłową odpornością. Podmiot odpowiedzialny wprowadził wszystkie komentarze CHMP i ostatecznie zatwierdzone sformułowanie brzmi: Doświadczenie dotyczące podawania szczepionki Priorix w czasie ciąży jest ograniczone. W badaniach wykazano, że kobiety karmiące piersią zaszczepione żywą atenuowaną szczepionką przeciwko różyczce mogą wydzielać wirus do mleka i przekazywać go dziecku karmionemu piersią bez objawów choroby. Tylko w przypadku potwierdzenia lub podejrzewania 17
10 występowania niedoboru odporności u dziecka należy ocenić korzyści i ryzyko związane z podaniem szczepionki (patrz punkt 4.3). Punkt Działania niepożądane Główne rozbieżności pomiędzy proponowaną ujednoliconą ChPL i zatwierdzonymi krajowymi informacjami o produkcie wiążą się z opisem zgłoszeń po wprowadzeniu do obrotu. Aby zachować zgodność z wytycznymi dotyczącymi ChPL podmiot odpowiedzialny zaproponował wykaz działań niepożądanych zgodnie z klasyfikacją MedDRA. Ponadto podmiot odpowiedzialny zaproponował usunięcie sformułowań dotyczących badań porównawczych, w których wykazano statystycznie istotne rzadsze występowanie bólu, zaczerwienienia i obrzęku w miejscu wstrzyknięcia po podaniu szczepionki Priorix w porównaniu z produktem referencyjnym (Ipp i wsp., 2004; Ipp i wsp., 2006; Knutsson i wsp., 2006; Taddio i wsp., 2009; Wellington i Goa, 2003). Zgodnie z wytycznymi dotyczącymi ChPL, ma ona dostarczać informacji dotyczących danego produktu leczniczego, dlatego nie powinna zawierać porównań z innymi produktami leczniczymi. CHMP uznał, że wykaz działań niepożądanych zgłaszanych w badaniach klinicznych i obserwacjach po wprowadzeniu do obrotu został w odpowiedni sposób odzwierciedlony w zaproponowanej ujednoliconej ChPL. Jednakże zwrócono się do podmiotu odpowiedzialnego o rozważenie przeredagowania punktu 4.8 zgodnie z wytycznymi dotyczącymi ChPL w celu dostarczenia wyraźnej i łatwo dostępnej informacji (podsumowanie profilu bezpieczeństwa, tabelaryczny wykaz działań niepożądanych, opis wybranych działań niepożądanych). Ponadto, ponieważ stwierdzono jedną nieścisłość z ulotką dla pacjenta, zwrócono się do podmiotu odpowiedzialnego o dodanie terminu nietypowa łagodna lub atenuowana odra w punkcie 4.8 do grupy zakażeń i zarażeń pasożytniczych. Ponadto zalecono, aby podmiot odpowiedzialny dodał informację o ryzyku zapalenia mózgu po zakażeniu wirusem świnki w uwagach dotyczących zapalenia mózgu: świnka: 2-4 na 1000 przypadków. Ponadto we wszystkich punktach termin zdarzenia niepożądane zastąpiono terminem działania niepożądane zgodnie z komentarzami zawartymi we wzorcach QRD. Podmiot odpowiedzialny wprowadził wszystkie powyżej omawiane zmiany, ale w celu zachowania zgodności z ChPL wszystkich szczepionek firmy GSK podmiot odpowiedzialny wystąpił z wnioskiem o kontynuowanie przedstawiania działań niepożądanych w postaci wykazu z zachowaniem podziału na działania niepożądane obserwowane w badaniach klinicznych i działania niepożądane zgłoszone po wprowadzeniu do obrotu. CHMP zaakceptował to uzasadnienie. Punkt Właściwości farmakodynamiczne Zgodnie z wytycznymi dotyczącymi ChPL w tekście na należy zamieszczać odniesień do innych produktów leczniczych, więc podmiot odpowiedzialny zaproponował usunięcie odniesień dotyczących wyników badań porównawczych, przedstawionych w ChPL w niektórych państwach członkowskich. CHMP zwrócił uwagę, że obecne doświadczenie kliniczne ze szczepionką Priorix jest ograniczone do stosowania u dzieci i nie przeprowadzono badań z udziałem młodzieży i osób dorosłych. Dlatego należy dodać twierdzenie dotyczące stosowania u młodzieży i osób dorosłych. Zwrócono się do podmiotu odpowiedzialnego o rozważenie dodania specyficznego przeglądu badań dotyczących immunogenności u dzieci zaszczepionych w wieku poniżej 12 miesięcy z podaniem wartości po podaniu pierwszej dawki dla poszczególnych miesięcy, jeśli są dostępne, oraz 18
11 przeglądu dotyczącego oceny wczesnego podania drugiej dawki. Z tego powodu oraz w celu odzwierciedlenia najnowszych informacji dane dotyczące immunogenności zostały rozdzielone na dwie grupy: Odpowiedź immunologiczna u dzieci w wieku 12 miesięcy i starszych i Odpowiedź immunologiczna u dzieci w wieku od 9 do 10 miesięcy. Zwrócono się do podmiotu odpowiedzialnego o rozważenie dodania przeglądu badań dotyczących immunogenności (badania kliniczne) i dodania także wartości określających skuteczność szczepionki, jeśli są dostępne lub adnotacji o ich braku. Seropozytywna odpowiedź w teście ELISA nie musi koniecznie świadczyć o zabezpieczeniu, zwłaszcza w przypadku świnki. Dana dotyczące skuteczności szczepionki powinny wskazywać różnice pomiędzy podaniem jednej lub dwóch dawek szczepionki. W ostatnim dziesięcioleciu zgłoszono wiele epidemii świnki w populacji osób zaszczepionych (dwie dawki). W wielu badaniach udokumentowano zwiększone ryzyko rozwoju świnki wzrastające w czasie po zaszczepieniu (Vandermeulen i wsp., 2004; Cortese i wsp., 2008; Castilla i wsp., 2009), a dane z Wielkiej Brytanii wskazują, że skuteczność szczepionki może zmniejszyć się z wiekiem, co prawdopodobnie także odzwierciedla czas, który upłynął od zaszczepienia (Cohen i wsp., 2007). Zasugerowano, że skuteczność szczepionki przeciwko śwince jest niższa w środowisku o wysokim stopniu przenoszenia zakażenia (Brockhoff 2004). Podmiot odpowiedzialny został poproszony o dodanie informacji dotyczących tych zagadnień. Jednakże w żadnym z badań terenowych (dotyczącym epidemii) przedstawionych przez podmiot odpowiedzialny nie podano danych dotyczących specyficznie szczepionki Priorix. Tak więc dane dotyczące skuteczności w odniesieniu do świnki nie były specyficzne dla szczepionki Priorix, toteż CHMP zatwierdził ogólny komentarz zaproponowany przez podmiot odpowiedzialny. Ponadto CHMP wystąpił o zastąpienie podanych odsetków serokonwersji nowszymi danymi zgłoszonymi dla preparatu szczepionki Priorix niewiążącej ludzkich albumin osoczowych (HSA-free) i zwrócił się do podmiotu odpowiedzialnego z zapytaniem o dostępność danych dotyczących immunogenności po podaniu szczepionki HSA-free u dzieci w wieku poniżej 12 miesięcy. Podmiot odpowiedzialny zamienił odsetek serokonwersji i oświadczył, że dane pochodzące od dzieci w wieku poniżej 12 miesięcy będą dostępne po zakończeniu obecnie prowadzonego badania. Podstawy zmiany charakterystyki produktu leczniczego, oznakowania opakowań i ulotki dla pacjenta Zważywszy, że zakres arbitrażu obejmował harmonizację charakterystyki produktu leczniczego, oznakowania opakowań i ulotki dla pacjenta na podstawie przedstawionej dokumentacji i dyskusji naukowej przeprowadzonej wewnątrz Komitetu dokonano oceny charakterystyki produktu leczniczego, oznakowania opakowań i ulotki dla pacjenta zaproponowanych przez podmioty odpowiedzialne CHMP zalecił zmianę pozwoleń na dopuszczenie do obrotu dla produktu Priorix i produktów z nim związanych pod różnymi nazwami (patrz aneks I), dla których charakterystyka produktu leczniczego, oznakowanie opakowań i ulotka dla pacjenta zostały przedstawione w aneksie III. 19
Nazwa Moc* Postać farmaceutyczna. Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Kraj Członkowski
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Kraj Członkowski
Wyniki procedur na mocy art. 20 rozporządzenia (WE) nr 726/2004 oraz art. 31 dyrektywy 2001/83/WE
 28 lutego 2013 r. EMA/136606/2013 wer.1 EMEA/H/A-31/1333 EMEA/H/C/000604/A20/45 EMEA/H/C/000622/A20/60 EMEA/H/C/000674/A20/52 Pytania i odpowiedzi dotyczące ponownej oceny monowalentnych i poliwalentnych
28 lutego 2013 r. EMA/136606/2013 wer.1 EMEA/H/A-31/1333 EMEA/H/C/000604/A20/45 EMEA/H/C/000622/A20/60 EMEA/H/C/000674/A20/52 Pytania i odpowiedzi dotyczące ponownej oceny monowalentnych i poliwalentnych
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Charakterystyka Produktu Leczniczego, Oznakowanie Opakowań i Ulotka dla Pacjenta
 Aneks III Charakterystyka Produktu Leczniczego, Oznakowanie Opakowań i Ulotka dla Pacjenta Uwaga: Ta wersja Charakterystyki Produktu Leczniczego uzyskuje ważność w momencie wydania Dezycji Komisji Europejskiej.
Aneks III Charakterystyka Produktu Leczniczego, Oznakowanie Opakowań i Ulotka dla Pacjenta Uwaga: Ta wersja Charakterystyki Produktu Leczniczego uzyskuje ważność w momencie wydania Dezycji Komisji Europejskiej.
FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania
 Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
Ogólne podsumowanie oceny naukowej preparatu Atacand Plus i nazwy produktów związanych (patrz Aneks I)
 ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 15 Wnioski naukowe Ogólne podsumowanie
ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 15 Wnioski naukowe Ogólne podsumowanie
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 16 Wnioski naukowe Haldol, który zawiera substancję czynną haloperydol, jest lekiem przeciwpsychotycznym należącym do grupy pochodnych butyrofenonu. Jest silnym antagonistą ośrodkowych
Aneks II Wnioski naukowe 16 Wnioski naukowe Haldol, który zawiera substancję czynną haloperydol, jest lekiem przeciwpsychotycznym należącym do grupy pochodnych butyrofenonu. Jest silnym antagonistą ośrodkowych
Silny niepożądany odczyn poszczepienny u rocznego dziecka. Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, r.
 Silny niepożądany odczyn poszczepienny u rocznego dziecka Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, 18.11.2016 r. 2 Co to jest niepożądany odczyn poszczepienny Niepożądany odczyn poszczepienny
Silny niepożądany odczyn poszczepienny u rocznego dziecka Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, 18.11.2016 r. 2 Co to jest niepożądany odczyn poszczepienny Niepożądany odczyn poszczepienny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
Lipophoral Tablets 150mg. Mediator 150 mg Tabletka Podanie doustne. Benfluorex Qualimed. Mediator 150mg Tabletka Podanie doustne
 ANEKS I WYKAZ NAZW WŁASNYCH, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH (EOG) 1
ANEKS I WYKAZ NAZW WŁASNYCH, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH (EOG) 1
UWAGA: W składzie szczepionki podano minimalne miana wirusów odry, świnki i różyczki oznaczane pod koniec terminu ważności preparatu.
 ULOTKA DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem PRIORIX (Vaccinum morbillorum, parotitidis et rubellae vivum) Liofilizat i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
ULOTKA DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem PRIORIX (Vaccinum morbillorum, parotitidis et rubellae vivum) Liofilizat i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
Nazwa własna Moc Postać farmaceutyczna
 Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego weterynaryjnego, gatunki zwierząt i podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich
Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego weterynaryjnego, gatunki zwierząt i podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich
1. NAZWA PRODUKTU LECZNICZEGO ^015-08" 2 6 ^
 Sprawdzono M pc cl wgtędem merytorycznym 1. NAZWA PRODUKTU LECZNICZEGO ^015-08" 2 6 ^ PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce,
Sprawdzono M pc cl wgtędem merytorycznym 1. NAZWA PRODUKTU LECZNICZEGO ^015-08" 2 6 ^ PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce,
ULOTKA DLA PACJENTA. nie mniej niż 2 j.m.
 ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem szczepionki. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać - Należy zwrócić się do lekarza lub
ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem szczepionki. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać - Należy zwrócić się do lekarza lub
WNIOSKI NAUKOWE I PODSTAWY ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU DLA HBVAXPRO PRZEDSTAWIONE PRZEZ EMEA
 WNIOSKI NAUKOWE I PODSTAWY ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU DLA HBVAXPRO PRZEDSTAWIONE PRZEZ EMEA WPROWADZENIE HBVAXPRO jest monowalentną szczepionką opracowaną w celu czynnego uodporniania
WNIOSKI NAUKOWE I PODSTAWY ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU DLA HBVAXPRO PRZEDSTAWIONE PRZEZ EMEA WPROWADZENIE HBVAXPRO jest monowalentną szczepionką opracowaną w celu czynnego uodporniania
Ogólne podsumowanie oceny naukowej produktu leczniczego Mifepristone Linepharma i nazw produktów związanych (patrz aneks I)
 Aneks II Wnioski naukowe i podstawy pozytywnej opinii zgodnie z warunkiem pozwolenia na dopuszczenie do obrotu i warunkiem zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione
Aneks II Wnioski naukowe i podstawy pozytywnej opinii zgodnie z warunkiem pozwolenia na dopuszczenie do obrotu i warunkiem zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione
Anna Skop. Zachęcam do zapoznania się z prezentacja na temat szczepień.
 W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
SPGZOZ O F E R T A ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO PUBLICZNEGO GMINNEGO ZAKŁADU OPIEKI ZDROWOTNEJ W NADARZYNIE
 ... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum morbillorum, parotitidis et rubellae vivum Szczepionka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum morbillorum, parotitidis et rubellae vivum Szczepionka
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem
 INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE
 WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
ZP.II.3331-01/11 Załącznik nr 5 FORMULARZ CENOWY. Pakiet nr I
 Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. Postać farmaceutyczna: proszek i rozpuszczalnik do sporządzania zawiesiny doustnej. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi,
Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. Postać farmaceutyczna: proszek i rozpuszczalnik do sporządzania zawiesiny doustnej. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi,
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Szczepienia ochronne. Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak
 Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
Większość pacjentów poddanych chemioterapii i radioterapii doświadcza nudności i wymiotów, które można sklasyfikować w następujący sposób:
 ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 11 Wnioski naukowe Ogólne podsumowanie
ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 11 Wnioski naukowe Ogólne podsumowanie
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego, droga podania, wnioskodawcy / podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Podmiot
Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego, droga podania, wnioskodawcy / podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Podmiot
Aneks III. Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
 Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
ZP.II /13 Załącznik nr 5 FORMULARZ CENOWY. Pakiet nr I
 Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona), poliomyelitis (inaktywowana) i Haemophilus
Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona), poliomyelitis (inaktywowana) i Haemophilus
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk
 Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
Ze względu na brak potwierdzenia w badaniu przeprowadzonym wśród młodzieży (opisanym poniżej) wyniki zostały uznane za niedostatecznie przekonujące.
 ZAŁĄCZNIK II WNIOSKI NAUKOWE I PODSTAWY DO WYDANIA POZYTYWNEJ OPINII ORAZ ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ
ZAŁĄCZNIK II WNIOSKI NAUKOWE I PODSTAWY DO WYDANIA POZYTYWNEJ OPINII ORAZ ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ
Wiek Szczepienie przeciw Uwagi
 Wiek Szczepienie przeciw Uwagi 1 życia w ciągu 24 godzin po urodzeniu WZW typu B - domięśniowo (pierwsza dawka) GRUŹLICY - śródskórnie szczepionką BCG Szczepienie noworodków przeciw gruźlicy powinno być
Wiek Szczepienie przeciw Uwagi 1 życia w ciągu 24 godzin po urodzeniu WZW typu B - domięśniowo (pierwsza dawka) GRUŹLICY - śródskórnie szczepionką BCG Szczepienie noworodków przeciw gruźlicy powinno być
CZYM JEST SZCZEPIONKA?
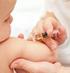 CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
III. INFORMACJE UZUPEŁNIAJĄCE. A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B)
 III. INFORMACJE UZUPEŁNIAJĄCE A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B) 1. Szczepienia podstawowe noworodków i niemowląt wykonywane są trzema dawkami szczepionki w cyklu zbliżonym
III. INFORMACJE UZUPEŁNIAJĄCE A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B) 1. Szczepienia podstawowe noworodków i niemowląt wykonywane są trzema dawkami szczepionki w cyklu zbliżonym
ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYK PRODUKTU LECZNICZEGO I ULOTEK DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW
 ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYK PRODUKTU LECZNICZEGO I ULOTEK DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 108 WNIOSKI NAUKOWE OGÓLNE PODSUMOWANIE OCENY NAUKOWEJ
ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYK PRODUKTU LECZNICZEGO I ULOTEK DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 108 WNIOSKI NAUKOWE OGÓLNE PODSUMOWANIE OCENY NAUKOWEJ
Aneks II. Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu przedstawione przez EMA
 Aneks II Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu przedstawione przez EMA 5 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych zawierających meprobamat
Aneks II Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu przedstawione przez EMA 5 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych zawierających meprobamat
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
Aneks I. Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki informacyjnej
 Aneks I Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki informacyjnej Ogólne podsumowanie oceny naukowej weterynaryjnych produktów leczniczych zawierających (fluoro)chinolony
Aneks I Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki informacyjnej Ogólne podsumowanie oceny naukowej weterynaryjnych produktów leczniczych zawierających (fluoro)chinolony
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX. 1 dawka (0,5 ml) szczepionki po rekonstytucji zawiera: CCID 50. szczepu Jeryl Lynn) hodowli komórkowej
 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, 2. 1 dawka (0,5 ml) szczepionki po rekonstytucji zawiera: 1 (szczep Schwarz) 3,0 3 CCID 50 1 3,7 3 CCID 50 szczepu Jeryl Lynn) 2 (szczep Wistar RA 27/3) 3,0 3 CCID
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, 2. 1 dawka (0,5 ml) szczepionki po rekonstytucji zawiera: 1 (szczep Schwarz) 3,0 3 CCID 50 1 3,7 3 CCID 50 szczepu Jeryl Lynn) 2 (szczep Wistar RA 27/3) 3,0 3 CCID
Aneks II. Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu 11 Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Po rozważeniu zalecenia PRAC z dnia
Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu 11 Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Po rozważeniu zalecenia PRAC z dnia
Moc Gatunki zwierząt. Postać farmaceutyczna. Samice psów. Enurace 50 Tabletki 50 mg
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
Meningokoki trzeba myśleć na zapas
 Meningokoki trzeba myśleć na zapas prof. dr hab. med. Jacek Wysocki dr n. med. Ilona Małecka Katedra i Zakład Profilaktyki Zdrowotnej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Specjalistyczny
Meningokoki trzeba myśleć na zapas prof. dr hab. med. Jacek Wysocki dr n. med. Ilona Małecka Katedra i Zakład Profilaktyki Zdrowotnej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Specjalistyczny
NAUKOWE WNIOSKI I PODSTAWY DO ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU PREPARATU PROCOMVAX, PRZEDSTAWIONE PRZEZ EMEA
 NAUKOWE WNIOSKI I PODSTAWY DO ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU PREPARATU PROCOMVAX, PRZEDSTAWIONE PRZEZ EMEA WSTĘP Zaaprobowane wskazania do stosowania preparatu Procomvax to szczepienie przeciw
NAUKOWE WNIOSKI I PODSTAWY DO ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU PREPARATU PROCOMVAX, PRZEDSTAWIONE PRZEZ EMEA WSTĘP Zaaprobowane wskazania do stosowania preparatu Procomvax to szczepienie przeciw
OFERTA WYKONAWCY ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO GMINNEGO ZAKŁADU OPIEKI ZDROWOTNEJ W NADARZYNIE
 ... wykonawca (pieczęć firmowa) tel./fax:... e-mail:... Załącznik nr 1 Do:......... OFERTA WYKONAWCY W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK
... wykonawca (pieczęć firmowa) tel./fax:... e-mail:... Załącznik nr 1 Do:......... OFERTA WYKONAWCY W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
Igantet j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Igantet 250 250 j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Igantet 250 250 j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE
 WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE Stanowisko Zarządu Polskiego Towarzystwa Wakcynologii z dnia 10 marca 2017 roku w sprawie stosowania szczepionki Tetraxim w szczepieniu podstawowym przeciwko krztuścowi
WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE Stanowisko Zarządu Polskiego Towarzystwa Wakcynologii z dnia 10 marca 2017 roku w sprawie stosowania szczepionki Tetraxim w szczepieniu podstawowym przeciwko krztuścowi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków
 Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
Wirusologia 2019 XII EDYCJA DOBRO INDYWIDUALNE CZY PUBLICZNE? PSO 2019
 Wirusologia 2019 XII EDYCJA 21.05.2019 SZCZEPIENIA OCHRONNE DOBRO INDYWIDUALNE CZY PUBLICZNE? PSO 2019 Izabela Kucharska _ Zastępca Głównego Inspektora Sanitarnego Podstawy prawne szczepień Art. 17 ustawy
Wirusologia 2019 XII EDYCJA 21.05.2019 SZCZEPIENIA OCHRONNE DOBRO INDYWIDUALNE CZY PUBLICZNE? PSO 2019 Izabela Kucharska _ Zastępca Głównego Inspektora Sanitarnego Podstawy prawne szczepień Art. 17 ustawy
B. ULOTKA INFORMACYJNA
 B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
Pakiet 1 Załącznik nr 5. Nazwa handlowa
 Pakiet 1 Załącznik nr 5 L..p j.m. Przedmiot zamówienia 1. Szczepionka skojarzona przeciw błonicy, tężcowi i krztuścowi acelularna zawierająca : antytoksynę błonniczą, antytoksynę tężcową i trzy antygeny
Pakiet 1 Załącznik nr 5 L..p j.m. Przedmiot zamówienia 1. Szczepionka skojarzona przeciw błonicy, tężcowi i krztuścowi acelularna zawierająca : antytoksynę błonniczą, antytoksynę tężcową i trzy antygeny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 8 1. NAZWA PRODUKTU LECZNICZEGO, 180 j.m./ml Roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 8 1. NAZWA PRODUKTU LECZNICZEGO, 180 j.m./ml Roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
Dziecko w wieku 2 lat po leczeniu sterydami i przetoczeniu preparatu krwiotwórczego. Dr n. med. Ewa Duszczyk
 Dziecko w wieku 2 lat po leczeniu sterydami i przetoczeniu preparatu krwiotwórczego Dr n. med. Ewa Duszczyk Niektóre wskazania do leczenia GKS Zespół nerczycowy Choroby rozrostowe krwi (nie wszystkie)
Dziecko w wieku 2 lat po leczeniu sterydami i przetoczeniu preparatu krwiotwórczego Dr n. med. Ewa Duszczyk Niektóre wskazania do leczenia GKS Zespół nerczycowy Choroby rozrostowe krwi (nie wszystkie)
sulfadiazyny i 66,7 mg/g trimetoprimu
 ANEKS I NAZWA, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU 1/7 Wnioskodawca lub podmiot odpowiedzialny
ANEKS I NAZWA, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU 1/7 Wnioskodawca lub podmiot odpowiedzialny
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Aneks III. Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta
 Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE
 ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE 1/5 WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO
ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE 1/5 WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Vanguard Plus 5, liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla psów 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Vanguard Plus 5, liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla psów 2. SKŁAD
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ODRA, ŚWINKA, RÓŻYCZKA (MMR)
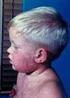 ODRA, ŚWINKA, RÓŻYCZKA (MMR) CO POWINIENEŚ WIEDZIEĆ NA TEN TEMAT? CZY JESTEŚ PEWIEN, ŻE JESTEŚ CHRONIONY PRZED MMR? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ! szczepionka przeciw MMR CZY WIESZ,
ODRA, ŚWINKA, RÓŻYCZKA (MMR) CO POWINIENEŚ WIEDZIEĆ NA TEN TEMAT? CZY JESTEŚ PEWIEN, ŻE JESTEŚ CHRONIONY PRZED MMR? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ! szczepionka przeciw MMR CZY WIESZ,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów
 FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AVAXIM 160 U, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum hepatitidis A inactivatum adsorbatum Szczepionka przeciw wirusowemu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AVAXIM 160 U, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum hepatitidis A inactivatum adsorbatum Szczepionka przeciw wirusowemu
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Aneks II. Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC
 Aneks II Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC 70 Wnioski naukowe CMDh rozpatrzył poniższe zalecenia PRAC
Aneks II Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC 70 Wnioski naukowe CMDh rozpatrzył poniższe zalecenia PRAC
1. NAZWA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Igantet 250, 250 j.m./ml, roztwór do wstrzykiwań Immunoglobulinum humanum tetanicum 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Igantet 250, 250 j.m./ml, roztwór do wstrzykiwań Immunoglobulinum humanum tetanicum 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera:
Dr med. Paweł Grzesiowski
 DOSTĘPNOŚĆ DO SZCZEPIEŃ OCHRONNYCH W WYBRANYCH KRAJACH EUROPY CENTRALNEJ MECHANIZMY FINANSOWANIA SZCZEPIEŃ I OCENY ICH EFEKTYWNOŚCI Dr med. Paweł Grzesiowski FUNDACJA INSTYTUT PROFILAKTYKI ZAKAŻEŃ WARSZAWA,
DOSTĘPNOŚĆ DO SZCZEPIEŃ OCHRONNYCH W WYBRANYCH KRAJACH EUROPY CENTRALNEJ MECHANIZMY FINANSOWANIA SZCZEPIEŃ I OCENY ICH EFEKTYWNOŚCI Dr med. Paweł Grzesiowski FUNDACJA INSTYTUT PROFILAKTYKI ZAKAŻEŃ WARSZAWA,
Ulotka dołączona do opakowania: informacja dla użytkownika. POLIORIX, roztwór do wstrzykiwań
 Ulotka dołączona do opakowania: informacja dla użytkownika POLIORIX, roztwór do wstrzykiwań Szczepionka przeciw poliomyelitis, inaktywowana Szczepionka 1-dawkowa Należy uważnie zapoznać się z treścią ulotki
Ulotka dołączona do opakowania: informacja dla użytkownika POLIORIX, roztwór do wstrzykiwań Szczepionka przeciw poliomyelitis, inaktywowana Szczepionka 1-dawkowa Należy uważnie zapoznać się z treścią ulotki
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów
 FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
Nazwa. UMAN BIG 180 I.E./ml Injektionslösung. UMAN BIG 180 IU/ml Roztwór do wstrzykiwań. Umanbig 180 NE/ml. UMAN BIG 180 IU/ml Roztwór do wstrzykiwań
 ANEKS I WYKAZ NAZW, POSTAĆ(CI) FARMACEUTYCZNA(YCH), MOC(Y) PRODUKTÓW LECZNICZYCH, DROGA(DRÓG) PODANIA, WNIOSKODAWCA(Y), PODMIOT(Y) ODPOWIEDZIALNY(E) POSIADAJĄCY(E) POZWOLENIE NA DOPUSZCZENIE DO OBROTU
ANEKS I WYKAZ NAZW, POSTAĆ(CI) FARMACEUTYCZNA(YCH), MOC(Y) PRODUKTÓW LECZNICZYCH, DROGA(DRÓG) PODANIA, WNIOSKODAWCA(Y), PODMIOT(Y) ODPOWIEDZIALNY(E) POSIADAJĄCY(E) POZWOLENIE NA DOPUSZCZENIE DO OBROTU
21.04.2016 r., OZiPZ PSSE Opole Lubelskie
 24-30 kwietnia 2016 r. ph DOMKNIJMY LUKĘ W SZCZEPIENIACH! Główny cel inicjatywy: zwiększenie liczby osób zaszczepionych poprzez podniesienie wiedzy i świadomości społeczeństwa na temat znaczenia szczepień
24-30 kwietnia 2016 r. ph DOMKNIJMY LUKĘ W SZCZEPIENIACH! Główny cel inicjatywy: zwiększenie liczby osób zaszczepionych poprzez podniesienie wiedzy i świadomości społeczeństwa na temat znaczenia szczepień
Annex I. Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia
 Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 1000 Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Roztwór do wstrzykiwań Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 1000 Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Roztwór do wstrzykiwań Należy
Międzynarodowa nazwa. niezastrzeżona (INN) Ferri hydroxidum dextranum
 Aneks I 1 Państwo członkowskie Podmiot odpowiedzialny posiadający pozwolenie Kontakt z lokalnym Międzynarodowa nazwa Nazwa własna Moc Postać farmaceutyczna Droga podania (w EOG) na dopuszczenie do obrotu
Aneks I 1 Państwo członkowskie Podmiot odpowiedzialny posiadający pozwolenie Kontakt z lokalnym Międzynarodowa nazwa Nazwa własna Moc Postać farmaceutyczna Droga podania (w EOG) na dopuszczenie do obrotu
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Szczepienia w pytaniach i odpowiedziach
 Jacek Wysocki Hanna Czajka Szczepienia w pytaniach i odpowiedziach Wydanie V zaktualizowane i uzupełnione Copyright 2014 by Wydawnictwo Help-Med s.c. Kraków All rights reserved. Wszelkie prawa zastrzeżone.
Jacek Wysocki Hanna Czajka Szczepienia w pytaniach i odpowiedziach Wydanie V zaktualizowane i uzupełnione Copyright 2014 by Wydawnictwo Help-Med s.c. Kraków All rights reserved. Wszelkie prawa zastrzeżone.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
Postać farmaceutyczna. Moc. Clavulanic acid 10 mg. Clavulanic acid 10 mg. Clavulanic acid 10 mg. Clavulanic acid 10 mg
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktu leczniczego weterynaryjnego, gatunków zwierząt, dróg podania, wnioskodawców/podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktu leczniczego weterynaryjnego, gatunków zwierząt, dróg podania, wnioskodawców/podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Szczepionka tężcowa adsorbowana (T), zawiesina do wstrzykiwań Szczepionka przeciw tężcowi, adsorbowana 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Szczepionka tężcowa adsorbowana (T), zawiesina do wstrzykiwań Szczepionka przeciw tężcowi, adsorbowana 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Jedna dawka (0,5 ml) po rekonstytucji, zawiera: Polisacharyd otoczkowy Haemophilus influenzae typ b.. 10 mikrogramów
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Act-HIB, 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum haemophili stirpi b coniugatum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Act-HIB, 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum haemophili stirpi b coniugatum
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Priorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla użytkownika Priorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa Należy uważnie zapoznać
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
SPGZOZ O F E R T A ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO PUBLICZNEGO GMINNEGO ZAKŁADU OPIEKI ZDROWOTNEJ W NADARZYNIE
 ... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
Aneks IV. Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks IV Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu 137 Wnioski naukowe CHMP rozważył poniższe zalecenie PRAC z dnia 5 grudnia 2013 r. odnoszące się do procedury zgodnej
Aneks IV Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu 137 Wnioski naukowe CHMP rozważył poniższe zalecenie PRAC z dnia 5 grudnia 2013 r. odnoszące się do procedury zgodnej
Obowiązkowe szczepienia ochronne. Dz.U t.j. z dnia Status: Akt obowiązujący Wersja od: 1 stycznia 2017 r.
 Obowiązkowe szczepienia ochronne. Dz.U.2016.849 t.j. z dnia 2016.06.15 Status: Akt obowiązujący Wersja od: 1 stycznia 2017 r. Wejście w życie: 1 października 2011 r. ROZPORZĄDZENIE MINISTRA ZDROWIA 1 z
Obowiązkowe szczepienia ochronne. Dz.U.2016.849 t.j. z dnia 2016.06.15 Status: Akt obowiązujący Wersja od: 1 stycznia 2017 r. Wejście w życie: 1 października 2011 r. ROZPORZĄDZENIE MINISTRA ZDROWIA 1 z
