Charakterystyka Produktu Leczniczego, Oznakowanie Opakowań i Ulotka dla Pacjenta
|
|
|
- Bożena Wróblewska
- 8 lat temu
- Przeglądów:
Transkrypt
1 Aneks III Charakterystyka Produktu Leczniczego, Oznakowanie Opakowań i Ulotka dla Pacjenta Uwaga: Ta wersja Charakterystyki Produktu Leczniczego uzyskuje ważność w momencie wydania Dezycji Komisji Europejskiej. Po wydaniu Decyzji Komisji Europejskiej, odpowiednie władze Krajów Członkowskich, w porozumieniu z odpowiednim Krajem Członkowskim, zaktualizują Informację o Produkcie zgodnie z wymaganiami. W związku z tym Charakterystyki Produktu Leczniczego, Oznakowanie Opakowań i Ulotka dla Pacjenta mogą nie odzwierciedlać aktualnego tekstu. 20
2 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 21
3 1. NAZWA PRODUKTU LECZNICZEGO Patrz aneks I Do uzupełnienia na szczeblu krajowym 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje pomocnicze o znanym działaniu: Szczepionka zawiera 9 mg sorbitolu, patrz punkt 4.4. Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania PRIORIX jest przeznaczony do czynnego uodparniania przeciwko odrze, śwince i różyczce dzieci po ukończeniu 9 miesiąca życia, nastolatków oraz osób dorosłych. W celu uzyskania informacji dotyczącej stosowania u dzieci w wieku od 9 do 12 miesięcy, patrz punkty 4.2, 4.4 i Dawkowanie i sposób podawania Dawkowanie Szczepionka PRIORIX powinna być stosowana zgodnie z oficjalnymi zaleceniami. Osoby w wieku 12 miesięcy i starsze Zaleca się podanie jednej dawki (0,5 ml) szczepionki. Druga dawka powinna zostać podana zgodnie z oficjalnymi zaleceniami. Szczepionka PRIORIX może być stosowana u osób, które zostały uprzednio zaszczepione inną monowalentną lub skojarzoną szczepionką przeciw odrze, śwince i różyczce. Niemowlęta w wieku od 9 do 12 miesięcy Niemowlęta w pierwszym roku życia mogą nie wytworzyć wystarczającej odpowiedzi na składniki szczepionki. W przypadku, gdy sytuacja epidemiologiczna wymaga szczepienia niemowląt w pierwszym roku ich życia (np. wybuch epidemii lub podróż w rejony endemiczne), druga dawka szczepionki PRIORIX powinna zostać podana w drugim roku życia, najlepiej 3 miesiące od podania pierwszej dawki. W żadnym przypadku odstęp pomiędzy dawkami nie powinien być krótszy niż 4 tygodnie (patrz punkty 4.4 i 5.1). Niemowlęta w wieku poniżej 9 miesięcy 22
4 Bezpieczeństwo i skuteczność szczepionki PRIORIX stosowanej u niemowląt w wieku poniżej 9 miesięcy nie została oceniona. Sposób podawania PRIORIX podaje się podskórnie, jakkolwiek można także podać domięśniowo (patrz punkty 4.4 i 5.1). Szczepionka powinna zostać podana podskórnie u pacjentów z trombocytopenią lub u których występują zaburzenia krzepnięcia (patrz punkt 4.4).Instrukcja dotycząca rekonstytucji produktu leczniczego przed podaniem, patrz punkt Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, lub neomycynę. Stwierdzone w wywiadzie kontaktowe zapalenie skóry wywołane przez neomycynę nie jest przeciwwskazaniem do szczepienia. W celu uzyskania informacji dotyczących reakcji nadwrażliwości na białko jaja kurzego, patrz punkt 4.4. Zaburzona humoralna lub komórkowa odpowiedź immunologiczna (pierwotna lub nabyta), obejmująca hypogammaglobulinemię, dysgammaglobulinemię oraz AIDS lub objawy infekcji wirusem HIV lub specyficzny dla wieku procent komórek CD4+ u dzieci w wieku poniżej 12 miesięcy: CD4+ <25%; dzieci w wieku od 12 do 35 miesięcy: CD4+<20%; dzieci w wieku od 36 do 59 miesięcy: CD4+<15%; (patrz punkt 4.4). Ciąża (patrz punkt 4.6). Tak jak w przypadku innych szczepionek, u osób w okresie ostrych i ciężkich chorób przebiegających z gorączką podanie szczepionki powinno być odroczone. Łagodna infekcja, taka jak przeziębienie, nie jest przeciwwskazaniem do szczepienia. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podobnie jak w przypadku wszystkich szczepionek podawanych w iniekcji, istnieje możliwość wystąpienia reakcji anafilaktycznej, dlatego należy zapewnić możliwość fachowej opieki medycznej bezpośrednio po szczepieniu. Alkohol, a także inne środki dezynfekujące powinny wyparować ze skóry przed podaniem szczepionki, ponieważ mogą unieczynnić atenuowane wirusy znajdujące się w szczepionce. Niemowlęta szczepione w pierwszym roku życia mogą nie wytworzyć wystarczającej odpowiedzi immunologicznej na składniki szczepionki, w związku z możliwą obecnością przeciwciał matczynych w ich organizmie (patrz punkty 4.2 i 5.1) Szczególna ostrożność powinna zostać zachowana w przypadku podawania szczepionki PRIORIX osobom z zaburzeniami ośrodkowego układu nerwowego, u których istnieje ryzyko występowania drgawek gorączkowych lub u osób z drgawkami w wywiadzie rodzinnym. Osoby z przebytymi drgawkami gorączkowymi, powinny być ściśle monitorowane. U osób z chorobami alergicznymi w wywiadzie lub w wywiadzie rodzinnym, należy zachować ostrożność stosując szczepionkę. Zawarte w szczepionce wirusy odry i świnki są uzyskiwane z hodowli komórek zarodka kurzego i z tego powodu mogą zawierać śladowe ilości białka jaja. Osoby z reakcjami anafilaktycznymi, anafilaktoidalnymi lub innymi reakcjami typu natychmiastowego w wywiadzie (np. uogólniona pokrzywka, obrzęk jamy ustnej i gardła, trudności w oddychaniu, obniżenie ciśnienia tętniczego lub wstrząs) występującymi po spożyciu jaj mogą być bardziej narażone na wystąpienie reakcji typu 23
5 natychmiastowego po szczepieniu, chociaż jak wykazano, reakcje te są bardzo rzadkie. Podczas szczepienia tych osób, należy zachować szczególną ostrożność oraz zapewnić dostępność odpowiednich środków leczniczych na wypadek wystąpienia reakcji nadwrażliwości. Pacjenci z rzadkimi dziedzicznymi problemami dotyczącymi nietolerancji fruktozy, nie powinny być szczepione szczepionką PRIORIX, gdyż zawiera ona sorbitol. Ograniczona ochrona przeciw odrze może zostać uzyskana przez zaszczepienie w ciągu 72 godzin od momentu narażenia na zarażenie naturalnie występującą odrą. Tak jak w przypadku wszystkich szczepionek, nie wszystkie zaszczepione osoby mogą wytworzyć ochronny poziom przeciwciał. PRIORIX W ŻADNYM PRZYPADKU NIE MOŻE BYĆ PODAWANY DONACZYNIOWO. Trombocytopenia Przypadki nasilenia lub nawrotu trombocytopenii u osób chorujących na tę chorobę były zgłaszane po podaniu pierwszej dawki żywych szczepionek przeciwko odrze, śwince, różyczce. Trombocytopenia związana ze szczepieniem szczepionką MMR jest rzadka i zasadniczo samo ograniczająca. U pacjentów z istniejącą trombocytopenią lub historią trombocytopenii po szczepieniu przeciw odrze, śwince i różyczce należy dokładnie ocenić stosunek korzyści do ryzyka wynikający ze szczepienia szczepionką PRIORIX. Tych pacjentów należy szczepić z zachowaniem ostrożności i wykorzystując podskórną drogę podania. Pacjenci z upośledzoną odpornością Pacjenci z upośledzoną odpornością, u których nie ma przeciwwskazań do szczepienia (patrz punkt 4.3) mogą nie odpowiedzieć na szczepienie tak dobrze, jak pacjenci immunokompetentni, w związku z tym niektórzy z tych pacjentów mogą zachorować na odrę, świnkę lub różyczkę w przypadku kontaktu z wirusami, pomimo odpowiedniego podania szczepionki. Pacjentów tych należy ściśle monitorować pod kątem wystąpienia objawów odry, zapalenia ślinianek przyusznych oraz różyczki. Przenoszenie Przeniesienie wirusów odry i świnki ze szczepionki na osoby podatne na zachorowanie nie zostało nigdy udokumentowane. Wydalanie wirusów różyczki i odry do gardła występuje około 7 do 28 dni po szczepieniu, ze szczytową ilością wydalania około 11 dnia. Jednakże brak jest dowodów transmisji tych wydalonych wirusów na osoby podatne na zachorowanie. Przeniesienie wirusa różyczki na niemowlęta poprzez mleko matki, oraz transmisja wirusa przez łożysko zostały udokumentowane, bez żadnego dowodu na wystąpienie klinicznych objawów choroby. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Szczepionka PRIORIX może zostać podana jednocześnie (ale w inne miejsce wstrzyknięcia) z każdą z następujących monowalentnych lub skojarzonych szczepionek [w tym hexawalentnymi szczepionkami (DTPa-HBV-IPV/Hib)]: szczepionką przeciwko błonicy, tężcowi, krztuścowi (bezkomórkowa) (DTPa), szczepionką przeciw Haemophilus influenzae typu B (Hib), inaktywowaną szczepionką przeciw polio (IPV), szczepionką przeciw Hepatitis B (HBV), szczepionką przeciw Hepatitis A (HAV), szczepionką przeciw meningokokom grupy C, koniugowaną (MenC), szczepionką przeciw ospie (VZV), doustną szczepionką przeciw polio (OPV) oraz 10-walentną koniugowanąszczepionką przeciw pneumokokom, zgodnie z oficjalnymi zaleceniami. Jeżeli PRIORIX nie może być podany w tym samym czasie, co inne szczepionki zawierające żywe, atenuowane wirusy, należy zachować odstęp co najmniej jednego miesiąca pomiędzy szczepieniami. Brak danych, które mogłyby poprzeć jednoczesne podawanie szczepionki PRIORIX z jakimikolwiek innymi szczepionkami. 24
6 Jeżeli istnieje konieczność przeprowadzenia testów tuberkulinowych, należy je wykonać przed lub równocześnie z podaniem szczepionki, ponieważ istnieją doniesienia, że szczepionki przeciw odrze, śwince i różyczce mogą spowodować przejściowe obniżenie wrażliwości skórnej na tuberkulinę. Anergia ta może utrzymywać się do 6 tygodni po szczepieniu i w tym okresie nie należy przeprowadzać prób tuberkulinowych, aby uniknąć fałszywie ujemnych wyników. U pacjentów, którzy otrzymywali ludzką immunoglobulinę lub transfuzję krwi należy wstrzymać się z podawaniem szczepionki przez okres trzech miesięcy lub dłużej (aż do 11 miesięcy) w zależności od dawki ludzkiej immunoglobuliny, jaka została podana, z powodu możliwości nie wytworzenia u nich odporności na skutek obecności biernie nabytych przeciwciał przeciwko śwince, odrze lub różyczce. 4.6 Wpływ na płodność, ciążę i laktację Płodność Szczepionka PRIORIX nie była oceniana w badaniach dotyczących płodności. Ciąża Szczepionka PRIORIX jest przeciwwskazana w okresie ciąży (patrz punk 4.3). Jednakże uszkodzenia płodów nie zostały udokumentowane, w przypadku gdy szczepionka przeciw odrze, śwince i różyczce została podana kobietom, które nie wiedziały, iż są w pierwszym okresie ciąży. Kobiety w wieku rozrodczym Należy doradzić kobietom, które zamierzają zajść w ciążę, aby po szczepieniu szczepionką PRIORIX opóźniły moment zajścia w ciążę o 1 miesiąc. Jednakże przed szczepieniem kobiety należy zapytać o możliwość wczesnej ciąży. Testy diagnostyczne wykluczające ciążę nie są wymagane. Nieumyślne szczepienie szczepionką PRIORIX kobiety, która nie wie o tym, iż jest w ciąży nie jest powodem do jej przerwania. Karmienie piersią Istnieją tylko ograniczone doniesienia dotyczące stosowania szczepionki PRIORIX w czasie karmienia piersią. Badania wykazały, ze kobiety karmiące piersią po porodzie, zaszczepione żywą, atentowaną szczepionką przeciw różyczce mogą wydzielać wirusy wraz z mlekiem i przenosić je na dziecko karmione piersią, bez dowodu na wystąpienie klinicznych objawów choroby. Jedynie w przypadku, gdy zostanie potwierdzone lub gdy przypuszcza się, iż dziecko ma obniżoną odporność, należy przeprowadzić analizę korzyści i ryzyka wynikającego ze szczepienia (patrz punkt 4.3). 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. PRIORIX nie ma istotnego wpływu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu. 4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Przedstawiony profil bezpieczeństwa oparty jest na danych uzyskanych z badań klinicznych, w których uczestniczyło około osób zaszczepionych szczepionką PRIORIX. 25
7 Działania niepożądane, które mogą wystąpić po podaniu skojarzonej szczepionki przeciw odrze, śwince i różyczce są takie same, jak objawy obserwowane po podaniu szczepionek monowalentnych osobno lub w kombinacji. W kontrolowanych badaniach klinicznych aktywnie monitorowano objawy występujące po szczepieniu w czasie 42 dniowej obserwacji. Osoby zaszczepione były również proszone o odnotowywanie wszelkich zdarzeń klinicznych pojawiających się w trakcie trwania badania. Najczęstszymi działaniami niepożądanymi występującym po podaniu szczepionki PRIORIX były zaczerwienienie w miejscu podania oraz gorączka 38 o C (mierzona w odbytnicy) lub 37,5 o C.(temperatura mierzona pod pachą lub w ustach). Lista działań niepożądanych Działania niepożądane wymienione są zgodnie z częstością występowania: Bardzo często: 1/10 Często: 1/100 do <1/10 Niezbyt często: 1/1000 do <1/100 Rzadko: 1/ do <1/1000 Bardzo rzadko: <1/ Dane pochodzące z badań klinicznych Zakażenia i zarażenia pasożytnicze Często: zakażenie górnych dróg oddechowych Niezbyt często: zapalenia ucha środkowego Zaburzenia krwi i układu chłonnego Niezbyt często: uogólnione powiększenie węzłów chłonnych Zaburzenia układu immunologicznego: Rzadko: reakcje alergiczne Zaburzenia metabolizmu i odżywiania: Niezbyt często: jadłowstręt Zaburzenia psychiczne: Niezbyt często: nerwowość, nietypowy płacz, bezsenność, Zaburzenia układu nerwowego: Rzadko: drgawki gorączkowe Zaburzenia oka: Niezbyt często: zapalenie spojówek Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Niezbyt często: zapalenie oskrzeli, kaszel Zaburzenia układu pokarmowego: Niezbyt często: obrzęk ślinianki przyusznej, biegunka, wymioty, Zaburzenia skóry i tkanki podskórnej: Często: wysypka Zaburzenia ogólne i stany w miejscu podania: 26
8 Bardzo często: zaczerwienienie w miejscu podania, gorączka (mierzona w odbytnicy 38 C; mierzona pod pachą lub w ustach 37,5 C) Często: ból i obrzęk w miejscu podania, gorączka (mierzona w odbytnicy > 39,5 C; mierzona pod pachą lub w ustach > 39 C) Kategorie częstości występowania działań niepożądanych były podobne po podaniu pierwszej i drugiej dawki szczepionki, z wyjątkiem bólu w miejscu wstrzyknięcia, który występował często po pierwszej dawce szczepionki i bardzo często po drugiej dawce szczepionki. Dane pochodzące z okresu po wprowadzeniu do obrotu W trakcie monitorowania działań niepożądanych po wprowadzeniu do obrotu odnotowano występowanie poniższych działań niepożądanych pozostających w związku czasowym z podaniem szczepionki PRIORIX. Z uwagi na to, iż działania niepożądane raportowane były spontanicznie, nie jest możliwe dokładne określenie częstości ich występowania. Zakażenia i zarażenia pasożytnicze: Zapalenie opon mózgowo-rdzeniowych, zapalenie jąder i zapalenie najądrzy, nietypowe łagodne lub słabe objawy przypominające odrę. Zaburzenia krwi i układu chłonnego: Małopłytkowość (trombocytopenia), plamica małopłytkowa Zaburzenia układu immunologicznego: Reakcje anafilaktyczne Zaburzenia układu nerwowego: Poprzeczne zapalenie rdzenia, zespół Guillain-Barré, zapalenie nerwów obwodowych, zapalenie mózgu* Zaburzenia skóry i tkanki podskórnej: Rumień wielopostaciowy Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Bóle stawów, zapalenie stawów Zaburzenia ogólne i stany w miejscu podania: Choroba Kawasaki *Zapalenie mózgu było zgłaszane z częstością mniejszą niż 1 na 10 milionów dawek. Ryzyko wystąpienia zapalenie mózgu w następstwie podania szczepionki jest znacznie niższe niż ryzyko wystąpienia zapalenia mózgu spowodowanego przez choroby, przeciw którym szczepionka uodparnia (odra: 1 na do przypadków; świnka: 2-4 na 1000 przypadków, różyczka około 1 na przypadków). Przypadkowe donaczyniowe podanie szczepionki może wywołać ciężką reakcję, a nawet wstrząs. Natychmiastowe działania lecznicze, które należy podjąć, zależą od ciężkości reakcji (patrz punkt 4.4). 4.9 Przedawkowanie Przypadki przedawkowania (podania dawki około dwukrotnie większej niż zalecana) były zgłaszane podczas monitorowania działań niepożądanych po wprowadzeniu szczepionki do obrotu. Nie były one powiązane z wystąpieniem żadnych działań niepożądanych. 27
9 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna - szczepionka przeciwwirusowa; odra połączona ze świnką i różyczką, żywa, atenuowana, kod ATC J07BD52 Odpowiedź immunologiczna u dzieci w wieku 12 miesięcy i starszych W badaniach klinicznych z udziałem dzieci w wieku od 12 miesięcy do 2 lat wykazano, iż szczepionka PRIORIX jest wysoce immunogenna. Szczepienie pojedynczą dawką szczepionki PRIORIX indukowało wytwarzanie przeciwciał przeciw odrze u 98%, przeciwko śwince u 94,4% oraz przeciwko różyczce u 100% uprzednio seronegatywnych zaszczepionych, Dwa lata po szczepieniu pierwotnym wskaźniki serokonwersji wynosiły 93,4% dla odry, 94,4% dla świnki oraz 100% dla różyczki. Mimo iż brak danych dotyczących skuteczności ochronnej szczepionki PRIORIX, immunogenność jest akceptowana jako wskaźnik skuteczności ochronnej. Jednakże, niektóre z badań wskazują, iż efektywność ochrony przed świnką może być niższa niż obserwowane wskaźniki serokonwersji wobec świnki. Odpowiedź immunologiczna u dzieci w wieku od 9 do 10 miesięcy Do udziału w badaniu klinicznym zakwalifikowano 300 zdrowych dzieci w wieku od 9 do 10 miesięcy, w czasie otrzymywania pierwszej dawki szczepionki. 147 dzieci z tej grupy otrzymały równocześnie szczepionki PRIORIX i VARILRIX. Wskaźniki serokonwersji dla odry, świnki i różyczki wynosiły odpowiednio 92,6%, 91,5% oraz 100%. Wskaźniki serokonwersji po podaniu drugiej dawki, podanej 3 miesiące po pierwszej dawce wynosiły 100% dla odry oraz 99,2% dla świnki. W związku z tym, aby zapewnić optymalną odpowiedź immunologiczną, druga dawka szczepionki PRIORIX powinna zostać podana w ciągu 3 miesięcy. Młodzież i osoby dorosłe Bezpieczeństwo i immunogenność szczepionki PRIORIX u nastolatków i osób dorosłych nie była szczegółowo badana w badaniach klinicznych. Domięśniowa droga podania Ograniczona liczba pacjentów otrzymała w trakcie badań klinicznych szczepionkę PRIORIX domięśniowo. Wskaźniki serokonwersji wobec 3 składników były porównywalne do tych obserwowanych w przypadku podskórnej drogi podania. 5.2 Właściwości farmakokinetyczne Ocena właściwości farmakokinetycznych nie jest wymagana dla szczepionek. 5.3 Przedkliniczne dane o bezpieczeństwie Przedkliniczne dane, opierające się na ogólnych badaniach bezpieczeństwa, nie wykazują żadnego ryzyka dla ludzi. 6. DANE FARMACEUTYCZNE: 28
10 6.1 Wykaz substancji pomocniczych 6.2 Niezgodności farmaceutyczne Wobec braku badań zgodności, szczepionka ta nie może być mieszana z innymi produktami leczniczymi. 6.3 Okres ważności 2 lata Po rekonstytucji szczepionkę należy zużyć natychmiast. Jeśli nie jest to możliwe, powinna być przechowywana w temperaturze 2C - 8C i zużyta w ciągu 8 godzin od jej rekonstytucji. 6.4 Specjalne środki ostrożności podczas przechowywania Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt Rodzaj i zawartość opakowania Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu leczniczego do stosowania Przed podaniem rozpuszczalnik oraz szczepionkę poddaną rekonstytucji należy obejrzeć pod kątem obecności obcych cząstek i (lub) zmian fizycznych. W przypadku stwierdzenia nieprawidłowości w wyglądzie szczepionki, nie należy jej podawać. Szczepionkę należy odtworzyć poprzez dodanie do fiolki z proszkiem całej objętości rozpuszczalnika. Następnie należy energicznie wstrząsnąć, do momentu całkowitego rozpuszczenia proszku. Należy podać całą zawartość fiolki. Zależnie od niewielkich wahań ph, szczepionka po rekonstytucji może przybierać barwę od brzoskwiniowej do różowej o odcieniu fuksji, co pozostaje bez wpływu na jej skuteczność. Należy wstrzyknąć całą zawartość fiolki. Należy unikać kontaktu szczepionki ze środkami dezynfekującymi (patrz punkt 4.4). Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami 29
11 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Patrz aneks I - Do uzupełnienia na szczeblu krajowym 8. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU 9. DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO 30
12 1. NAZWA PRODUKTU LECZNICZEGO Patrz aneks I - Do uzupełnienia na szczeblu krajowym 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje pomocnicze, o znanym działaniu: Szczepionka zawiera 9 mg sorbitolu, patrz punkt 4.4. Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania PRIORIX jest przeznaczony do czynnego uodparniania przeciwko odrze, śwince i różyczce dzieci po ukończeniu 9 miesiąca życia, nastolatków oraz osób dorosłych. W celu uzyskania informacji dotyczącej stosowania u dzieci w wieku od 9 do 12 miesięcy, patrz punkty 4.2, 4.4 i Dawkowanie i sposób podawania Dawkowanie Szczepionka PRIORIX powinna być stosowana zgodnie z oficjalnymi zaleceniami. Osoby w wieku 12 miesięcy i starsze Zaleca się podanie jednej dawki (0,5 ml) szczepionki. Druga dawka powinna zostać podana zgodnie z oficjalnymi zaleceniami. Szczepionka PRIORIX może być stosowana u osób, które zostały uprzednio zaszczepione inną monowalentną lub skojarzoną szczepionką przeciw odrze, śwince i różyczce. Niemowlęta w wieku od 9 do 12 miesięcy Niemowlęta w pierwszym roku życia mogą nie wytworzyć wystarczającej odpowiedzi na składniki szczepionki. W przypadku, gdy sytuacja epidemiologiczna wymaga szczepienia niemowląt w pierwszym roku ich życia (np. wybuch epidemii lub podróż w rejony endemiczne), druga dawka szczepionki PRIORIX powinna zostać podana w drugim roku życia, najlepiej 3 miesiące od podania pierwszej dawki. W żadnym przypadku odstęp pomiędzy dawkami nie powinien być krótszy niż 4 tygodnie (patrz punkty 4.4 i 5.1). Niemowlęta w wieku poniżej 9 miesięcy 31
13 Bezpieczeństwo i skuteczność szczepionki PRIORIX stosowanej u niemowląt w wieku poniżej 9 miesięcy nie została oceniona. Sposób podawania PRIORIX podaje się podskórnie, jakkolwiek można także podać domięśniowo (patrz punkty 4.4 i 5.1). Szczepionka powinna zostać podana podskórnie u pacjentów z trombocytopenią lub u których występują zaburzenia krzepnięcia (patrz punkt 4.4). Instrukcja dotycząca rekonstytucji produktu leczniczego przed podaniem, patrz punkt Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, lub neomycynę. Stwierdzone w wywiadzie kontaktowe zapalenie skóry wywołane przezneomycynę nie jest przeciwwskazaniem do szczepienia. W celu uzyskania informacji dotyczących reakcji nadwrażliwości na białko jaja kurzego, patrz punkt 4.4. Zaburzona humoralna lub komórkowa odpowiedź immunologiczna (pierwotna lub nabyta), obejmująca hypogammaglobulinemię, dysgammaglobulinemię oraz AIDS lub objawy infekcji wirusem HIV lub specyficzny dla wieku procent komórek CD4+ u dzieci w wieku poniżej 12 miesięcy: CD4+ <25%; dzieci w wieku od 12 do 35 miesięcy: CD4+<20%; dzieci w wieku od 36 do 59 miesięcy: CD4+<15%; (patrz punkt 4.4). Ciąża (patrz punkt 4.6). Tak jak w przypadku innych szczepionek, u osób w okresie ostrych i ciężkich chorób przebiegających z gorączką podanie szczepionki powinno być odroczone. Łagodna infekcja, taka jak przeziębienie, nie jest przeciwwskazaniem do szczepienia. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podobnie jak w przypadku wszystkich szczepionek podawanych w iniekcji, istnieje możliwość wystąpienia reakcji anafilaktycznej, dlatego należy zapewnić możliwość fachowej opieki medycznej bezpośrednio po szczepieniu. Alkohol, a także inne środki dezynfekujące powinny wyparować ze skóry przed podaniem szczepionki, ponieważ mogą unieczynnić atenuowane wirusy znajdujące się w szczepionce. Niemowlęta szczepione w pierwszym roku życia mogą nie wytworzyć wystarczającej odpowiedzi immunologicznej na składniki szczepionki, w związku z możliwą obecnością przeciwciał matczynych w ich organizmie (patrz punkty 4.2 i 5.1) Szczególna ostrożność powinna zostać zachowana w przypadku podawania szczepionki PRIORIX osobom z zaburzeniami ośrodkowego układu nerwowego, u których istnieje ryzyko występowania drgawek gorączkowych lub u osób z drgawkami w wywiadzie rodzinnym. Osoby z przebytymi drgawkami gorączkowymi, powinny być ściśle monitorowane. U osób z chorobami alergicznymi w wywiadzie lub w wywiadzie rodzinnym, należy zachować ostrożność stosując szczepionkę. Zawarte w szczepionce wirusy odry i świnki są uzyskiwane z hodowli komórek zarodka kurzego i z tego powodu mogą zawierać śladowe ilości białka jaja. Osoby z reakcjami anafilaktycznymi, anafilaktoidalnymi lub innymi reakcjami typu natychmiastowego w wywiadzie (np. uogólniona pokrzywka, obrzęk jamy ustnej i gardła, trudności w oddychaniu, obniżenie ciśnienia tętniczego lub 32
14 wstrząs) występującymi po spożyciu jaj mogą być bardziej narażone na wystąpienie reakcji typu natychmiastowego po szczepieniu, chociaż jak wykazano, reakcje te są bardzo rzadkie. Podczas szczepienia tych osób, należy zachować szczególną ostrożność oraz zapewnić dostępność odpowiednich środków leczniczych na wypadek wystąpienia reakcji nadwrażliwości. Pacjenci z rzadkimi dziedzicznymi problemami dotyczącymi nietolerancji fruktozy, nie powinny być szczepione szczepionką PRIORIX, gdyż zawiera ona sorbitol. Ograniczona ochrona przeciw odrze może zostać uzyskana przez zaszczepienie w ciągu 72 godzin od momentu narażenia na zarażenie naturalnie występującą odrą. Tak jak w przypadku wszystkich szczepionek, nie wszystkie zaszczepione osoby mogą wytworzyć ochronny poziom przeciwciał. PRIORIX W ŻADNYM PRZYPADKU NIE MOŻE BYĆ PODAWANY DONACZYNIOWO. Trombocytopenia Przypadki nasilenia lub nawrotu trombocytopenii u osób chorujących na tę chorobę były zgłaszane po podaniu pierwszej dawki żywych szczepionek przeciwko odrze, śwince, różyczce. Trombocytopenia związana ze szczepieniem szczepionką MMR jest rzadka i zasadniczo samo ograniczająca. U pacjentów z istniejącą trombocytopenią lub historią trombocytopenii po szczepieniu przeciw odrze, śwince i różyczce należy dokładnie ocenić stosunek korzyści do ryzyka wynikający ze szczepienia szczepionką PRIORIX. Tych pacjentów należy szczepić z zachowaniem ostrożności i wykorzystując podskórną drogę podania. Pacjenci z upośledzoną odpornością Pacjenci z upośledzoną odpornością, u których nie ma przeciwwskazań do szczepienia (patrz punkt 4.3) mogą nie odpowiedzieć na szczepienie tak dobrze, jak pacjenci immunokompetentni, w związku z tym niektórzy z tych pacjentów mogą zachorować na odrę, świnkę lub różyczkę w przypadku kontaktu z wirusami, pomimo odpowiedniego podania szczepionki. Pacjentów tych należy ściśle monitorować pod kątem wystąpienia objawów odry, zapalenia ślinianek przyusznych oraz różyczki. Przenoszenie Przeniesienie wirusów odry i świnki ze szczepionki na osoby podatne na zachorowanie nie zostało nigdy udokumentowane. Wydalanie wirusów różyczki i odry do gardła występuje około 7 do 28 dni po szczepieniu, ze szczytową ilością wydalania około 11 dnia. Jednakże brak jest dowodów transmisji tych wydalonych wirusów na osoby podatne na zachorowanie. Przeniesienie wirusa różyczki na niemowlęta poprzez mleko matki, oraz transmisja wirusa przez łożysko zostały udokumentowane, bez żadnego dowodu na wystąpienie klinicznych objawów choroby. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Szczepionka PRIORIX może zostać podana jednocześnie (ale w inne miejsce wstrzyknięcia) z każdą z następujących monowalentnych lub skojarzonych szczepionek [w tym hexawalentnymi szczepionkami (DTPa-HBV-IPV/Hib)]: szczepionką przeciwko błonicy, tężcowi, krztuścowi (bezkomórkowa) (DTPa), szczepionka przeciw Haemophilus influenzae typu B (Hib), inaktywowaną szczepionką przeciw polio (IPV), szczepionką przeciw Hepatitis B (HBV), szczepionką przeciw Hepatitis A (HAV), szczepionką przeciw meningokokom grupy C, koniugowaną (MenC), szczepionką przeciw ospie (VZV), doustną szczepionką przeciw polio (OPV) oraz 10-walentną koniugowanąszczepionką przeciw pneumokokom, zgodnie z oficjalnymi zaleceniami. Jeżeli PRIORIX nie może być podany w tym samym czasie, co inne szczepionki zawierające żywe, atenuowane wirusy, należy zachować odstęp co najmniej jednego miesiąca pomiędzy szczepieniami. 33
15 Brak danych, które mogłyby poprzeć jednoczesne podawanie szczepionki PRIORIX z jakimikolwiek innymi szczepionkami. Jeżeli istnieje konieczność przeprowadzenia testów tuberkulinowych, należy je wykonać przed lub równocześnie z podaniem szczepionki, ponieważ istnieją doniesienia, że szczepionki przeciw odrze, śwince i różyczce mogą spowodować przejściowe obniżenie wrażliwości skórnej na tuberkulinę. Anergia ta może utrzymywać się do 6 tygodni po szczepieniu i w tym okresie nie należy przeprowadzać prób tuberkulinowych, aby uniknąć fałszywie ujemnych wyników. U pacjentów, którzy otrzymywali ludzką immunoglobulinę lub transfuzję krwi należy wstrzymać się z podawaniem szczepionki przez okres trzech miesięcy lub dłużej (aż do 11 miesięcy) w zależności od dawki ludzkiej immunoglobuliny, jaka została podana, z powodu możliwości nie wytworzenia u nich odporności na skutek obecności biernie nabytych przeciwciał przeciwko śwince, odrze lub różyczce. 4.6 Wpływ na płodność, ciążę i laktację Płodność Szczepionka PRIORIX nie była oceniana w badaniach dotyczących płodności. Ciąża Szczepionka PRIORIX jest przeciwwskazana w okresie ciąży (patrz punk 4.2) Jednakże uszkodzenia płodów nie zostały udokumentowane, w przypadku gdy szczepionka przeciw odrze, śwince i różyczce została podana kobietom, które nie wiedziały, iż są w pierwszym okresie ciąży. Kobiety w wieku rozrodczym Należy doradzić kobietom, które zamierzają zajść w ciążę, aby po szczepieniu szczepionką PRIORIX opóźniły moment zajścia w ciążę o 1 miesiąc. Jednakże przed szczepieniem kobiety należy zapytać o możliwość wczesnej ciąży. Testy diagnostyczne wykluczające ciążę nie są wymagane. Nieumyślne szczepienie szczepionką PRIORIX kobiety, która nie wie o tym, iż jest w ciąży nie jest powodem do jej przerwania. Karmienie piersią Istnieją tylko ograniczone doniesienia dotyczące stosowania szczepionki PRIORIX w czasie karmienia piersią. Badania wykazały, ze kobiety karmiące piersią po porodzie, zaszczepione żywą, atentowaną szczepionką przeciw różyczce mogą wydzielać wirusy wraz z mlekiem i przenosić je na dziecko karmione piersią, bez dowodu na wystąpienie klinicznych objawów choroby. Jedynie w przypadku, gdy zostanie potwierdzone lub gdy przypuszcza się, iż dziecko ma obniżoną odporność, należy przeprowadzić analizę korzyści i ryzyka wynikającego ze szczepienia (patrz punkt 4.3). 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. PRIORIX nie ma istotnego wpływu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu. 4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Przedstawiony profil bezpieczeństwa oparty jest na danych uzyskanych z badań klinicznych, w których uczestniczyło około osób zaszczepionych szczepionką PRIORIX. 34
16 Działania niepożądane, które mogą wystąpić po podaniu skojarzonej szczepionki przeciw odrze, śwince i różyczce są takie same, jak objawy obserwowane po podaniu szczepionek monowalentnych osobno lub w kombinacji. W kontrolowanych badaniach klinicznych aktywnie monitorowano objawy występujące po szczepieniu w czasie 42 dniowej obserwacji. Osoby zaszczepione były również proszone o odnotowywanie wszelkich zdarzeń klinicznych pojawiających się w trakcie trwania badania. Najczęstszymi działaniami niepożądanymi występującym po podaniu szczepionki PRIORIX były zaczerwienienie w miejscu podania oraz gorączka 38 oc (mierzona w odbytnicy) lub 37,5 o C.(temperatura mierzona pod pachą lub w ustach). Lista działań niepożądanych Działania niepożądane wymienione są zgodnie z częstością występowania: Bardzo często: 1/10 Często: 1/100 do <1/10 Niezbyt często: 1/1000 do <1/100 Rzadko: 1/ do <1/1000 Bardzo rzadko: <1/ Dane pochodzące z badań klinicznych Zakażenia i zarażenia pasożytnicze Często: zakażenie górnych dróg oddechowych Niezbyt często: zapalenia ucha środkowego Zaburzenia krwi i układu chłonnego Niezbyt często: uogólnione powiększenie węzłów chłonnych Zaburzenia układu immunologicznego: Rzadko: reakcje alergiczne Zaburzenia metabolizmu i odżywiania: Niezbyt często: jadłowstręt Zaburzenia psychiczne: Niezbyt często: nerwowość, bezsenność, nietypowy płacz Zaburzenia układu nerwowego: Rzadko: drgawki gorączkowe Zaburzenia oka: Niezbyt często: zapalenie spojówek Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Niezbyt często: zapalenie oskrzeli, kaszel Zaburzenia układu pokarmowego: Niezbyt często: obrzęk ślinianki przyusznej, biegunka, wymioty, Zaburzenia skóry i tkanki podskórnej: Często: wysypka 35
17 Zaburzenia ogólne i stany w miejscu podania: Bardzo często: zaczerwienienie w miejscu podania, gorączka (mierzona w odbytnicy 38 C; mierzona pod pachą lub w ustach 37,5 C) Często: ból i obrzęk w miejscu podania, gorączka (mierzona w odbytnicy > 39,5 C; mierzona pod pachą lub w ustach > 39 C) Kategorie częstości występowania działań niepożądanych były podobne po podaniu pierwszej i drugiej dawki szczepionki, z wyjątkiem bólu w miejscu wstrzyknięcia, który występował często po pierwszej dawce szczepionki i bardzo często po drugiej dawce szczepionki. Dane pochodzące z okresu po wprowadzeniu do obrotu W trakcie monitorowania działań niepożądanych po wprowadzeniu do obrotu odnotowano występowanie poniższych działań niepożądanych pozostających w związku czasowym z podaniem szczepionki PRIORIX. Z uwagi na to, iż działania niepożądane raportowane były spontanicznie, nie jest możliwe dokładne określenie częstości ich występowania. Zakażenia i zarażenia pasożytnicze: Zapalenie opon mózgowo-rdzeniowych, zapalenie jąder i zapalenie najądrzy, nietypowe łagodne lub słabe objawy przypominające odrę. Zaburzenia krwi i układu chłonnego: Małopłytkowość (trombocytopenia), plamica małopłytkowa Zaburzenia układu immunologicznego: Reakcje anafilaktyczne Zaburzenia układu nerwowego: Poprzeczne zapalenie rdzenia, zespół Guillain-Barré, zapalenie nerwów obwodowych, zapalenie mózgu* Zaburzenia skóry i tkanki podskórnej: Rumień wielopostaciowy Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Bóle stawów, zapalenie stawów Zaburzenia ogólne i stany w miejscu podania: Choroba Kawasaki *Zapalenie mózgu było zgłaszane z częstością mniejszą niż 1 na 10 milionów dawek. Ryzyko wystąpienia zapalenie mózgu w następstwie podania szczepionki jest znacznie niższe niż ryzyko wystąpienia zapalenia mózgu spowodowanego przez choroby, przeciw którym szczepionka uodparnia (odra: 1 na do przypadków; świnka: 2-4 na 1000 przypadków, różyczka około 1 na przypadków). Przypadkowe donaczyniowe podanie szczepionki może wywołać ciężką reakcję, a nawet wstrząs. Natychmiastowe działania lecznicze, które należy podjąć, zależą od ciężkości reakcji (patrz punkt 4.4). 4.9 Przedawkowanie Przypadki przedawkowania (podania dawki około dwukrotnie większej niż zalecana) były zgłaszane podczas monitorowania działań niepożądanych po wprowadzeniu szczepionki do obrotu. Nie były one powiązane z wystąpieniem żadnych działań niepożądanych. 36
18 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna - szczepionka przeciwwirusowa; odra połączona ze świnką i różyczką, żywa, atenuowana, kod ATC J07BD52 Odpowiedź immunologiczna u dzieci w wieku 12 miesięcy i starszych W badaniach klinicznych z udziałem dzieci w wieku od 12 miesięcy do 2 lat wykazano, iż szczepionka PRIORIX jest wysoce immunogenna. Szczepienie pojedynczą dawką szczepionki PRIORIX indukowało wytwarzanie przeciwciał przeciw odrze u 98%, przeciwko śwince u 94,4% oraz przeciwko różyczce u 100% uprzednio seronegatywnych zaszczepionych, Dwa lata po szczepieniu pierwotnym wskaźniki serokonwersji wynosiły 93,4% dla odry 94,4% dla świnki oraz 100% dla różyczki. Mimo iż brak danych dotyczących skuteczności ochronnej szczepionki PRIORIX, immunogenność jest akceptowana jako wskaźnik skuteczności ochronnej. Jednakże, niektóre z badań wskazują, iż efektywność ochrony przed świnką może być niższa niż obserwowane wskaźniki serokonwersji wobec świnki. Odpowiedź immunologiczna u dzieci w wieku od 9 do 10 miesięcy Do udziału w badaniu klinicznym zakwalifikowano 300 zdrowych dzieci w wieku od 9 do 10 miesięcy, w czasie otrzymywania pierwszej dawki szczepionki. 147 dzieci z tej grupy otrzymały równocześnie szczepionki PRIORIX i VARILRIX. Wskaźniki serokonwersji dla odry, świnki i różyczki wynosiły odpowiednio 92,6%, 91,5% oraz 100%. Wskaźniki serokonwersji po podaniu drugiej dawki, podanej 3 miesiące po pierwszej dawce wynosiły 100% dla odry oraz 99,2% dla świnki. W związku z tym, aby zapewnić optymalną odpowiedź immunologiczną, druga dawka szczepionki PRIORIX powinna zostać podana w ciągu 3 miesięcy. Młodzież i osoby dorosłe Bezpieczeństwo i immunogenność szczepionki PRIORIX u nastolatków i osób dorosłych nie była szczegółowo badana w badaniach klinicznych. Domięśniowa droga podania Ograniczona liczba pacjentów otrzymała w trakcie badań klinicznych szczepionkę PRIORIX domięśniowo. Wskaźniki serokonwersji wobec 3 składników były porównywalne do tych obserwowanych w przypadku podskórnej drogi podania. 5.2 Właściwości farmakokinetyczne Ocena właściwości farmakokinetycznych nie jest wymagana dla szczepionek. 5.3 Przedkliniczne dane o bezpieczeństwie Przedkliniczne dane, opierające się na ogólnych badaniach bezpieczeństwa, nie wykazują żadnego ryzyka dla ludzi. 37
19 6. DANE FARMACEUTYCZNE: 6.1 Wykaz substancji pomocniczych 6.2 Niezgodności farmaceutyczne Wobec braku badań zgodności, szczepionka ta nie może być mieszana z innymi produktami leczniczymi. 6.3 Okres ważności 2 lata Po rekonstytucji szczepionkę należy zużyć natychmiast. Jeśli nie jest to możliwe, powinna być przechowywana w temperaturze 2C - 8C i zużyta w ciągu 8 godzin od jej rekonstytucji. 6.4 Specjalne środki ostrożności przy przechowywaniu Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt Rodzaj i zawartość opakowania Nie wszystkie wielkości opakowań muszą znajdować się na rynku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu leczniczego do stosowania Przed podaniem rozpuszczalnik oraz szczepionkę poddaną rekonstytucji należy obejrzeć pod kątem obecności obcych cząstek i (lub) zmian fizycznych. W przypadku stwierdzenia nieprawidłowości w wyglądzie szczepionki, nie należy jej podawać. Szczepionkę należy odtworzyć poprzez dodanie do fiolki z proszkiem całej objętości rozpuszczalnika. Następnie należy energicznie wstrząsnąć, do momentu całkowitego rozpuszczenia proszku. Należy podać całą zawartość fiolki. Zależnie od niewielkich wahań ph, szczepionka po rekonstytucji może przybierać barwę od brzoskwiniowej do różowej o odcieniu fuksji, co pozostaje bez wpływu na jej skuteczność. Należy wstrzyknąć całą zawartość fiolki. Należy unikać kontaktu szczepionki ze środkami dezynfekującymi (patrz punkt 4.4). Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami 38
20 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Patrz aneks I - Do uzupełnienia na szczeblu krajowym 8. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU 9. DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO 39
21 OZNAKOWANIE OPAKOWAŃ I ULOTKA DLA PACJENTA 40
22 OZNAKOWANIE OPAKOWAŃ 41
23 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH FIOLKA + AMPUŁKA, OPAKOWANIE ZAWIERAJĄCE 1, 10, 20, 25, 40, 100 SZTUK 1. NAZWA PRODUKTU LECZNICZEGO Patrz aneks I - Do uzupełnienia na szczeblu krajowym 2. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ(YCH) 3. WYKAZ SUBSTANCJI POMOCNICZYCH 4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA 5. SPOSÓB I DROGA(I) PODANIA Należy zapoznać się z treścią ulotki przed zastosowaniem szczepionki Do podawania podskórnego (sc.) lub domięśniowego (im.) Proszek i rozpuszczalnik powinny być zmieszane przed użyciem Przed użyciem wstrząsnąć 6. OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO W MIEJSCU NIEWIDOCZNYM I NIEDOSTĘPNYM DLA DZIECI Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE 8. TERMIN WAŻNOŚCI Termin ważności: Po rekonstytucji, szczepionkę należy zużyć natychmiast lub w ciągu 8 godzin, jeśli jest przechowywana w lodówce. 9. WARUNKI PRZECHOWYWANIA 42
24 10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI WŁAŚCIWE Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami. 11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO [Patrz aneks I NUMER(Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU 13. NUMER SERII Nr serii: 14. OGÓLNA KATEGORIA DOSTĘPNOŚCI Produkt leczniczy wydawany z przepisu lekarza. 15. INSTRUKCJA UŻYCIA 16. INFORMACJA PODANA SYSTEMEM BRAILLE A 43
25 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH FIOLKA + AMPUŁKO-STRZYKAWKA Z IGŁĄ OPAKOWANIE ZAWIERAJĄC 10, 25, 100 SZTUK Z 2 IGŁAMI DOŁACZONYMI DO OPAKOWANIA OPAKOWANIE ZAWIERAJĄCE 1, 10, 25, 100 SZTUK BEZ IGŁY: OPAKOWANIE ZAWIERAJĄCE 1, 10, 25, 100 SZTUK 1. NAZWA PRODUKTU LECZNICZEGO Patrz aneks I - Do uzupełnienia na szczeblu krajowym 2. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ(YCH) 3. WYKAZ SUBSTANCJI POMOCNICZYCH 4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA 5. SPOSÓB I DROGA(I) PODANIA Należy zapoznać się z treścią ulotki przed zastosowaniem szczepionki Do podawania podskórnego (sc.) lub domięśniowego (im.) Proszek i rozpuszczalnik powinny być zmieszane przed użyciem Przed użyciem wstrząsnąć 6. OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO W MIEJSCU NIEWIDOCZNYM I NIEDOSTĘPNYM DLA DZIECI Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE 8. TERMIN WAŻNOŚCI Termin ważności: Po rekonstytucji, szczepionkę należy zużyć natychmiast lub w ciągu 8 godzin, jeśli jest przechowywana w lodówce. 44
26 9. WARUNKI PRZECHOWYWANIA 10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI WŁAŚCIWE Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami. 11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO [Patrz aneks I - Do uzupełnienia na szczeblu krajowym 12. NUMER(Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU 13. NUMER SERII Nr serii: 14. OGÓLNA KATEGORIA DOSTĘPNOŚCI Produkt leczniczy wydawany z przepisu lekarza. 15. INSTRUKCJA UŻYCIA 16. INFORMACJA PODANA SYSTEMEM BRAILLE A 45
27 MINIMUM INFORMACJI ZAMIESZCZANYCH NA MAŁYCH OPAKOWANIACH BEZPOŚREDNICH FIOLKA Z PROSZKIEM 1. NAZWA PRODUKTU LECZNICZEGO I DROGA(I) PODANIA Patrz aneks I - Do uzupełnienia na szczeblu krajowym sc. lub im. 2. SPOSÓB PODAWANIA 3. TERMIN WAŻNOŚCI Termin ważności: 4. NUMER SERII Nr serii 5. ZAWARTOŚĆ OPAKOWANIA Z PODANIEM MASY, OBJĘTOŚCI LUB LICZBY JEDNOSTEK 1 dawka 6. INNE 46
28 MINIMUM INFORMACJI ZAMIESZCZANYCH NA MAŁYCH OPAKOWANIACH BEZPOŚREDNICH AMPUŁKO-STRZYKAWKA, AMPUŁKA Z ROZPUSZCZALNIKIEM 1. NAZWA PRODUKTU LECZNICZEGO I DROGA(I) PODANIA Patrz aneks I - Do uzupełnienia na szczeblu krajowym 2. SPOSÓB PODAWANIA 3. TERMIN WAŻNOŚCI Termin ważności: 4. NUMER SERII Nr serii: 5. ZAWARTOŚĆ OPAKOWANIA Z PODANIEM MASY, OBJĘTOŚCI LUB LICZBY JEDNOSTEK 1 dawka (0,5 ml) [Do uzupełnienia na szczeblu krajowym 6. INNE Logo GSK 47
29 ULOTKA DLA PACJENTA 48
30 Ulotka dla pacjenta: informacja dla użytkownika Patrz aneks I - Do uzupełnienia na szczeblu krajowym Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem szczepionki, ponieważ zawiera ona informacje ważne dla pacjenta. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty, w razie jakichkolwiek dalszych wątpliwości. - Szczepionkę przepisano ściśle określonej osobie. Nie należy jej przekazywać innym. - Jeśli nasili się którykolwiek z objawów niepożądanych lub wystąpią jakiekolwiek objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Spis treści ulotki: 1. Co to jest szczepionka Priorix i w jakim celu się ją stosuje 2. Informacje ważne przed zastosowaniem szczepionki Priorix 3. Jak stosować szczepionkę Priorix 4. Możliwe działania niepożądane 5. Jak przechowywać szczepionkę Priorix 6. Zawartość opakowania i inne informacje 1. Co to jest szczepionka Priorix i w jakim celu się ją stosuje Priorix jest szczepionką stosowaną u dzieci po ukończeniu 9. miesiąca życia, nastolatków oraz osób dorosłych w celu zapobiegania odrze, śwince i różyczce. Jak działa Priorix System immunologiczny (naturalny system ochronny organizmu) osoby, której podano szczepionkę PRIORIX będzie wytwarzał przeciwciała, dzięki czemu pacjent będzie chroniony przed infekcją wirusami odry, świnki i różyczki. Mimo iż szczepionka PRIORIX zawiera żywe wirusy, są one zbyt słabe, by powodować zachorowanie na odrę, świnkę i różyczkę u zdrowych osób. 2. Informacje ważne przed zastosowaniem szczepionki Priorix Kiedy nie stosować szczepionki Priorix jeśli kiedykolwiek wystąpiła reakcja uczuleniowa na jakikolwiek składniku tej szczepionki ( wymienione w punkcie 6). Wśród objawów uczulenia należy wymienić swędzącą wysypkę skórną, trudności w oddychaniu, obrzęk twarzy lub języka; jeśli kiedykolwiek wystąpiła reakcja alergiczna na neomycynę (antybiotyk). Kontaktowe zapalenie skóry wywołane przez neomycynę (wysypka skórna w sytuacji, gdy występuje bezpośredni kontakt z alergenem takim jak neomycyna) nie stanowi przeciwwskazania do stosowania szczepionki, ale należy poinformować o tym lekarza; jeśli występuje ostra i ciężka choroba przebiegająca z gorączką. W takim przypadku szczepienie zostanie odłożone do czasu wyzdrowienia. Łagodna infekcja, taka jak np. przeziębienie, nie powinna być przeciwwskazaniem do szczepienia, ale należy najpierw porozmawiać z lekarzem jeśli pacjent cierpi na jakiekolwiek choroby takie jak zakażenie Ludzkim wirusem niedoboru odporności (HIV) lub Zespół nabytego niedoboru odporności (AIDS) lub przyjmuje jakiekolwiek leki osłabiające system immunologiczny. Otrzymanie szczepienia będzie zależało od wyniku badania poziomu ochrony immunologicznej. 49
31 szczepionki Priorix nie należy podawać kobietom w ciąży. Należy unikać zajścia w ciążę 1 miesiąc po szczepieniu. Przypadkowe podanie szczepionki PRIORIX kobiecie w ciąży, nie powinno być powodem przerwania ciąży. Ostrzeżenia i środki ostrożności Należy porozmawiać z lekarzem lub farmaceutą przed podaniem szczepionki PRIORIX, jeśli: jeśli osoba szczepiona cierpi na zaburzenia ośrodkowego układu nerwowego, drgawki z towarzyszącą wysoką gorączką lub jeśli w jej rodzinie kiedykolwiek wystąpiły drgawki. W przypadku wystąpienia wysokiej gorączki po szczepieniu należy niezwłocznie skonsultować się z lekarzem. jeśli kiedykolwiek wystąpiło uczulenie na białko jaja kurzego; jeśli u dziecka wystąpiły działania niepożądane po szczepieniu przeciwko odrze, śwince lub różyczce obejmujące łatwe powstawanie siniaków lub krwawienie dłuższe niż zwykle (patrz punkt 4). jeśli pacjent ma osłabioną ochronę immunologiczną (np. z powodu zakażenia wirusem HIV. Pacjent powinien być monitorowany, gdyż odpowiedź na szczepienie może nie być wystarczająca, aby zapewnić ochronę przeciw chorobom (patrz punkt 2). Jeśli pacjent zostanie zaszczepiony w ciągu 72 godzin od kontaktu z osobą chorą na odrę, szczepionka PRIORIX w pewnym zakresie może zapewnić ochronę przed zachorowaniem. Dzieci w wieku poniżej 12 miesięcy Dzieci zaszczepione w pierwszym roku życia mogą nie być w pełni chronione. Jeśli konieczne będzie podanie dodatkowych dawek szczepionki, lekarz zaleci ich podanie. Tak jak w przypadku wszystkich szczepionek, szczepionka Priorix może nie w pełni chronić wszystkie zaszczepione osoby. Inne leki i szczepionka Priorix Należy powiedzieć lekarzowi lub farmaceucie o wszystkich przyjmowanych ostatnio szczepieniach oraz lekach. Szczepionka PRIORIX może zostać podana w tym samym czasie, co inne zalecane szczepionki, takie jak szczepionka przeciw błonicy, tężcowi, krztuścowi, zakażeniom Haemophilus influenzae typu B, doustna lub inaktywowana szczepionka przeciw polio, szczepionka przeciw zapaleniu wątroby typu A i B, skoniugowane szczepionki przeciw meningokokom z serogrupy C, szczepionka przeciw ospie wietrznej oraz 10-walentna koniugowana szczepionka przeciw pneumokokom. Wstrzyknięcia powinny zostać wykonane w różne miejsca. Lekarz udzieli porady dotyczącej miejsca wstrzyknięcia. Jeżeli Priorix nie może być podany w tym samym czasie, co inne szczepionki zawierające żywe, atenuowane wirusy, należy zachować odstęp co najmniej jednego miesiąca pomiędzy szczepieniami. Szczepienie może zostać odroczone na co najmniej 3 miesiące, jeśli dziecko ostatnio otrzymało przetoczenie krwi lub ludzką immunoglobulinę. Jeżeli u dziecka ma być przeprowadzony test tuberkulinowy (skórne badanie w kierunku gruźlicy), należy go wykonać przed lub równocześnie z podaniem szczepionki albo po upływie 6 tygodni od szczepienia. Ciąża, karmienie piersią i wpływ na płodność 50
32 Szczepionki Priorix nie należy stosować w u kobiet w ciąży. Należy unikać zajścia w ciążę w ciągu 1 miesiąca po szczepieniu. Przypadkowe podanie szczepionki Priorix kobiecie w ciąży nie powinno być powodem przerwania ciąży. Jeśli kobieta jest w ciąży lub karmi piersią, myśli, że może być w ciąży lub planuje ciążę, przed przyjęciem szczepionki powinna porozmawiać z lekarzem lub farmaceutą. Priorix zawiera sorbitol. Jeśli pacjent został poinformowany przez lekarza, iż występuje u niego nietolerancja niektórych cukrów, przed przyjęciem szczepionki powinien skonsultować się z lekarzem. [Do uzupełnienia na szczeblu krajowym 3. Jak stosować szczepionkę Priorix Szczepionkę Priorix podaje się podskórnie lub domięśniowo. Priorix jest przeznaczony do stosowania u dzieci po ukończeniu 9. miesiąca życia, nastolatków oraz osób dorosłych. Odpowiedni moment szczepienia oraz liczba podawanych dawek zostanie określona przez lekarza w oparciu o oficjalne zalecenia. Szczepionki w żadnym wypadku nie należy podawać donaczyniowo. 4. Możliwe działania niepożądane Jak każdy lek, ta szczepionka może powodować działania niepożądane, chociaż nie u każdego one wystąpią. Następujące działania niepożądane mogą wystąpić, po podaniu szczepionki PRIORIX: Bardzo często (mogą wystąpić częściej niż 1 na 10 dawek szczepionki): Zaczerwienienie w miejscu podania Gorączka (38 C lub wyższa) Często (mogą wystąpić rzadziej niż 1 na 10 dawek szczepionki): Ból i obrzęk w miejscu podania Gorączka (wyższa niż 39,5 o C) Wysypka Zakażenie górnych dróg oddechowych Niezbyt często (mogą wystąpić rzadziej niż 1 na 100 dawek szczepionki): Zapalenie ucha środkowego Powiększenie węzłów chłonnych ( węzły w okolicach szyi, pachy lub pachwiny) Utrata apetytu Nerwowość Nietypowy płacz Bezsenność Zaczerwienienie, podrażnienie lub łzawienie oczu (zapalenie spojówek) Zapalenie oskrzeli Kaszel Obrzęk ślinianki przyusznej (węzeł chłonny w okolicy policzka) Biegunka 51
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum morbillorum, parotitidis et rubellae vivum Szczepionka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum morbillorum, parotitidis et rubellae vivum Szczepionka
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX. 1 dawka (0,5 ml) szczepionki po rekonstytucji zawiera: CCID 50. szczepu Jeryl Lynn) hodowli komórkowej
 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, 2. 1 dawka (0,5 ml) szczepionki po rekonstytucji zawiera: 1 (szczep Schwarz) 3,0 3 CCID 50 1 3,7 3 CCID 50 szczepu Jeryl Lynn) 2 (szczep Wistar RA 27/3) 3,0 3 CCID
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, 2. 1 dawka (0,5 ml) szczepionki po rekonstytucji zawiera: 1 (szczep Schwarz) 3,0 3 CCID 50 1 3,7 3 CCID 50 szczepu Jeryl Lynn) 2 (szczep Wistar RA 27/3) 3,0 3 CCID
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Priorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla użytkownika Priorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa Należy uważnie zapoznać
1. NAZWA PRODUKTU LECZNICZEGO ^015-08" 2 6 ^
 Sprawdzono M pc cl wgtędem merytorycznym 1. NAZWA PRODUKTU LECZNICZEGO ^015-08" 2 6 ^ PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce,
Sprawdzono M pc cl wgtędem merytorycznym 1. NAZWA PRODUKTU LECZNICZEGO ^015-08" 2 6 ^ PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce,
UWAGA: W składzie szczepionki podano minimalne miana wirusów odry, świnki i różyczki oznaczane pod koniec terminu ważności preparatu.
 ULOTKA DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem PRIORIX (Vaccinum morbillorum, parotitidis et rubellae vivum) Liofilizat i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
ULOTKA DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem PRIORIX (Vaccinum morbillorum, parotitidis et rubellae vivum) Liofilizat i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Priorix-Tetra, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej,
Ulotka dołączona do opakowania: informacja dla użytkownika Priorix-Tetra, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
Ulotka dołączona do opakowania: informacja dla użytkownika. POLIORIX, roztwór do wstrzykiwań
 Ulotka dołączona do opakowania: informacja dla użytkownika POLIORIX, roztwór do wstrzykiwań Szczepionka przeciw poliomyelitis, inaktywowana Szczepionka 1-dawkowa Należy uważnie zapoznać się z treścią ulotki
Ulotka dołączona do opakowania: informacja dla użytkownika POLIORIX, roztwór do wstrzykiwań Szczepionka przeciw poliomyelitis, inaktywowana Szczepionka 1-dawkowa Należy uważnie zapoznać się z treścią ulotki
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Priorix-Tetra, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince, różyczce
Ulotka dołączona do opakowania: informacja dla użytkownika Priorix-Tetra, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince, różyczce
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika D - Szczepionka błonicza adsorbowana zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Nie mniej niż 30 j.m. toksoidu błoniczego/0,5
Ulotka dołączona do opakowania: informacja dla użytkownika D - Szczepionka błonicza adsorbowana zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Nie mniej niż 30 j.m. toksoidu błoniczego/0,5
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Pseudovac, roztwór do wstrzykiwań Szczepionka poliwalentna przeciwko pałeczce ropy błękitnej Pseudomonas aeruginosa 1 ml szczepionki zawiera antygeny
Ulotka dołączona do opakowania: informacja dla użytkownika Pseudovac, roztwór do wstrzykiwań Szczepionka poliwalentna przeciwko pałeczce ropy błękitnej Pseudomonas aeruginosa 1 ml szczepionki zawiera antygeny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw poliomyelitis, inaktywowana Należy uważnie zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla użytkownika IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw poliomyelitis, inaktywowana Należy uważnie zapoznać się z treścią
Act-HIB 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b, skoniugowana
 Ulotka dołączona do opakowania: informacja dla użytkownika Act-HIB 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b, skoniugowana
Ulotka dołączona do opakowania: informacja dla użytkownika Act-HIB 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b, skoniugowana
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. adsorbowany na wodorotlenku glinu, uwodnionym nie więcej niż 0,7 mg Al 3+
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana
Szczepienia ochronne. Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak
 Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciwko zakażeniom haemophilus typ b, skoniugowana Należy
Ulotka dołączona do opakowania: informacja dla pacjenta Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciwko zakażeniom haemophilus typ b, skoniugowana Należy
Ulotka dołączona do opakowania: informacja dla użytkownika. Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab
 Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem
 INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fluarix, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fluarix, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TYPHIM Vi, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum febris typhoidis polysaccharidicum Szczepionka przeciw durowi brzusznemu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TYPHIM Vi, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum febris typhoidis polysaccharidicum Szczepionka przeciw durowi brzusznemu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Inflexal V Zawiesina do wstrzykiwań Szczepionka przeciw grypie (antygen powierzchniowy), inaktywowana, wirosomalna Sezon 2012/2013 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Inflexal V Zawiesina do wstrzykiwań Szczepionka przeciw grypie (antygen powierzchniowy), inaktywowana, wirosomalna Sezon 2012/2013 2.
Silny niepożądany odczyn poszczepienny u rocznego dziecka. Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, r.
 Silny niepożądany odczyn poszczepienny u rocznego dziecka Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, 18.11.2016 r. 2 Co to jest niepożądany odczyn poszczepienny Niepożądany odczyn poszczepienny
Silny niepożądany odczyn poszczepienny u rocznego dziecka Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, 18.11.2016 r. 2 Co to jest niepożądany odczyn poszczepienny Niepożądany odczyn poszczepienny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta
 Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
ULOTKA DLA PACJENTA. nie mniej niż 2 j.m.
 ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem szczepionki. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać - Należy zwrócić się do lekarza lub
ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem szczepionki. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać - Należy zwrócić się do lekarza lub
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Proszek i rozpuszczalnik do sporządzania roztworu do stosowania miejscowego, 400 j.m., 200 j.m.
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA BioTrombina 400 Thrombinum bovine Proszek i rozpuszczalnik do sporządzania roztworu do stosowania miejscowego, 400 j.m., 200 j.m./ml Należy zapoznać się
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA BioTrombina 400 Thrombinum bovine Proszek i rozpuszczalnik do sporządzania roztworu do stosowania miejscowego, 400 j.m., 200 j.m./ml Należy zapoznać się
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Encepur Adults, zawiesina do wstrzykiwań Vaccinum encephalitidis ixodibus advectae inactivatum Szczepionka przeciw kleszczowemu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Encepur Adults, zawiesina do wstrzykiwań Vaccinum encephalitidis ixodibus advectae inactivatum Szczepionka przeciw kleszczowemu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix L., folium) (4-8:1). Ekstrahent: etanol 30% (m/m).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-d 50 Roztwór do wstrzykiwań Immunoglobulinum humanum anti-d Immunoglobulina ludzka anty-d Należy zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-d 50 Roztwór do wstrzykiwań Immunoglobulinum humanum anti-d Immunoglobulina ludzka anty-d Należy zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA GALENA, 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
Jedna dawka (0,5 ml) po rekonstytucji, zawiera: Polisacharyd otoczkowy Haemophilus influenzae typ b.. 10 mikrogramów
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Act-HIB, 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum haemophili stirpi b coniugatum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Act-HIB, 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum haemophili stirpi b coniugatum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
Ulotka dołączona do opakowania: informacja dla pacjenta Oscillococcinum, granulki w pojemniku jednodawkowym
 Ulotka dołączona do opakowania: informacja dla pacjenta Oscillococcinum, granulki w pojemniku jednodawkowym Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Oscillococcinum, granulki w pojemniku jednodawkowym Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Encepur K Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana Dawka dla dzieci.
 Ulotka dołączona do opakowania: informacja dla użytkownika Encepur K Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana Dawka dla dzieci. Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Encepur K Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana Dawka dla dzieci. Należy uważnie zapoznać się
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH
 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH BUTELKA Z POLIETYLENU Z DOZOWNIKIEM I NAKRĘTKĄ 1. NAZWA PRODUKTU LECZNICZEGO (9,8 mg + 9,8 mg + 245 mg)/g (Benzocainum + Mentholum + Zinci oxidum),
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH BUTELKA Z POLIETYLENU Z DOZOWNIKIEM I NAKRĘTKĄ 1. NAZWA PRODUKTU LECZNICZEGO (9,8 mg + 9,8 mg + 245 mg)/g (Benzocainum + Mentholum + Zinci oxidum),
Tak jak w przypadku wszystkich szczepionek, szczepionka Encepur Adults może nie zapewnić pełnej ochrony u wszystkich zaszczepionych osób.
 Ulotka dołączona do opakowania: informacja dla użytkownika Encepur Adults Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana. Dawka dla dorosłych Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla użytkownika Encepur Adults Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana. Dawka dla dorosłych Należy uważnie zapoznać
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH
 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH {Tuba} 1. NAZWA PRODUKTU LECZNICZEGO PUDER PŁYNNY Z ANESTEZYNĄ (240 mg + 20 mg)/g, zawiesina na skórę (Zinci oxidum + Benzocainum) 2. ZAWARTOŚĆ SUBSTANCJI
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH {Tuba} 1. NAZWA PRODUKTU LECZNICZEGO PUDER PŁYNNY Z ANESTEZYNĄ (240 mg + 20 mg)/g, zawiesina na skórę (Zinci oxidum + Benzocainum) 2. ZAWARTOŚĆ SUBSTANCJI
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 1000 Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Roztwór do wstrzykiwań Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 1000 Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Roztwór do wstrzykiwań Należy
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH (etykieto-ulotka) butelka ze szkła brunatnego
 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH (etykieto-ulotka) butelka ze szkła brunatnego 1. NAZWA PRODUKTU LECZNICZEGO 648 mg/5 ml, syrop Plantaginis lanceolatae folii extractum fluidum 2. ZAWARTOŚĆ
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH (etykieto-ulotka) butelka ze szkła brunatnego 1. NAZWA PRODUKTU LECZNICZEGO 648 mg/5 ml, syrop Plantaginis lanceolatae folii extractum fluidum 2. ZAWARTOŚĆ
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla użytkownika Supremin MAX, 1,5 mg/ml, syrop Butamirati citras Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla użytkownika Supremin MAX, 1,5 mg/ml, syrop Butamirati citras Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta tabletki powlekane 100 mg Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Ulotka dołączona do opakowania: informacja dla pacjenta tabletki powlekane 100 mg Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Ulotka dołączona do opakowania: informacja dla użytkownika. VARILRIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
 Ulotka dołączona do opakowania: informacja dla użytkownika VARILRIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw ospie wietrznej, żywa Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika VARILRIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw ospie wietrznej, żywa Należy uważnie zapoznać się
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Sprawdzono pod względem meryiory 2013-04- 2 3 DT - Szczepionka błoniczo-tężcowa adsorbowana zawiesina do wstrzykiwań Szczepionka przeciw błonicy
Ulotka dołączona do opakowania: informacja dla użytkownika Sprawdzono pod względem meryiory 2013-04- 2 3 DT - Szczepionka błoniczo-tężcowa adsorbowana zawiesina do wstrzykiwań Szczepionka przeciw błonicy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AVAXIM 160 U, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum hepatitidis A inactivatum adsorbatum Szczepionka przeciw wirusowemu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AVAXIM 160 U, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum hepatitidis A inactivatum adsorbatum Szczepionka przeciw wirusowemu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Polio Sabin oral, zawiesina doustna Vaccinum poliomyelitidis perorale Szczepionka przeciwko poliomyelitis, doustna Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Polio Sabin oral, zawiesina doustna Vaccinum poliomyelitidis perorale Szczepionka przeciwko poliomyelitis, doustna Należy uważnie zapoznać się
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
B. ULOTKA INFORMACYJNA
 B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VERTIX, 24 MG, TABLETKI (BETAHISTINI DIHYDROCHLORIDUM)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VERTIX, 24 MG, TABLETKI (BETAHISTINI DIHYDROCHLORIDUM) Należy zapoznać się z treścią ulotki przez zastosowaniem leku. - Należy zachować tę ulotkę, aby w
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VERTIX, 24 MG, TABLETKI (BETAHISTINI DIHYDROCHLORIDUM) Należy zapoznać się z treścią ulotki przez zastosowaniem leku. - Należy zachować tę ulotkę, aby w
Encepur K Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana Dawka dla dzieci.
 Ulotka dołączona do opakowania: informacja dla użytkownika Encepur K Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana Dawka dla dzieci. Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Encepur K Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana Dawka dla dzieci. Należy uważnie zapoznać się
ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas
 Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
SPGZOZ O F E R T A ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO PUBLICZNEGO GMINNEGO ZAKŁADU OPIEKI ZDROWOTNEJ W NADARZYNIE
 ... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Igantet j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Igantet 250 250 j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Igantet 250 250 j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta
 Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta: Informacja dla użytkownika Medivitan iv ampułki 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny chlorowodorek
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta: Informacja dla użytkownika Medivitan iv ampułki 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny chlorowodorek
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
Tradycyjny produkt leczniczy roślinny przeznaczony do stosowania w określonych wskazaniach wynikających wyłącznie z jego długotrwałego stosowania.
 1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO Infanrix-IPV, zawiesina do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona) i poliomyelitis (inaktywowana), adsorbowana
1. NAZWA PRODUKTU LECZNICZEGO Infanrix-IPV, zawiesina do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona) i poliomyelitis (inaktywowana), adsorbowana
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ERYSIN SINGLE SHOT, emulsja do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ERYSIN SINGLE SHOT, emulsja do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
Ulotka dla pacjenta: informacja dla użytkownika. Priorix-Tetra, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce
 Ulotka dla pacjenta: informacja dla użytkownika Priorix-Tetra, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej,
Ulotka dla pacjenta: informacja dla użytkownika Priorix-Tetra, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej,
Ulotka dołączona do opakowania: informacja dla użytkownika. Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Charakterystyka produktu leczniczego. 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce.
 Charakterystyka produktu leczniczego 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona),
Charakterystyka produktu leczniczego 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona),
Ulotka dołączona do opakowania: informacja dla pacjenta. Terbilum 10 mg/g krem Terbinafini hydrochloridum
 Ulotka dołączona do opakowania: informacja dla pacjenta Terbilum 10 mg/g krem Terbinafini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Terbilum 10 mg/g krem Terbinafini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. MUCOANGIN, 20 mg, tabletki do ssania Ambroxoli hydrochloridum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA MUCOANGIN, 20 mg, tabletki do ssania Ambroxoli hydrochloridum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta.
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA MUCOANGIN, 20 mg, tabletki do ssania Ambroxoli hydrochloridum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta.
Encepur Adults Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana. Dawka dla dorosłych
 Ulotka dołączona do opakowania: informacja dla użytkownika Encepur Adults Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana. Dawka dla dorosłych Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla użytkownika Encepur Adults Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana. Dawka dla dorosłych Należy uważnie zapoznać
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk
 Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO - 1 - 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-DTPa, zawiesina do wstrzykiwań Vaccinum diphtheriae, tetani, pertussis sine cellulis ex elementis praeparatum adsorbatum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO - 1 - 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-DTPa, zawiesina do wstrzykiwań Vaccinum diphtheriae, tetani, pertussis sine cellulis ex elementis praeparatum adsorbatum
Ulotka dołączona do opakowania: informacja dla użytkownika. ZYX, 5 mg, tabletki powlekane. Levocetirizini dihydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika ZYX, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika ZYX, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Encepur Adults Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana. Dawka dla dorosłych Należy zapoznać się z treścią
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Encepur Adults Zawiesina do wstrzykiwań Szczepionka przeciw kleszczowemu zapaleniu mózgu, inaktywowana. Dawka dla dorosłych Należy zapoznać się z treścią
FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania
 Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. nie mniej niż 30 j.m. nie mniej niż 40 j.m.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DT - Szczepionka błoniczo - tężcowa adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy i tężcowi, adsorbowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DT - Szczepionka błoniczo - tężcowa adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy i tężcowi, adsorbowana 2. SKŁAD
ODRA, ŚWINKA, RÓŻYCZKA (MMR)
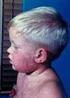 ODRA, ŚWINKA, RÓŻYCZKA (MMR) CO POWINIENEŚ WIEDZIEĆ NA TEN TEMAT? CZY JESTEŚ PEWIEN, ŻE JESTEŚ CHRONIONY PRZED MMR? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ! szczepionka przeciw MMR CZY WIESZ,
ODRA, ŚWINKA, RÓŻYCZKA (MMR) CO POWINIENEŚ WIEDZIEĆ NA TEN TEMAT? CZY JESTEŚ PEWIEN, ŻE JESTEŚ CHRONIONY PRZED MMR? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ! szczepionka przeciw MMR CZY WIESZ,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Rimantin, 50 mg, tabletki. Rymantadyny chlorowodorek
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Rimantin, 50 mg, tabletki Rymantadyny chlorowodorek Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Należy zachować
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Rimantin, 50 mg, tabletki Rymantadyny chlorowodorek Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Należy zachować
Ulotka dołączona do opakowania: informacja dla użytkownika. Mucofluid, 50 mg/ml, aerozol do nosa, roztwór. Mesnum
 Ulotka dołączona do opakowania: informacja dla użytkownika Mucofluid, 50 mg/ml, aerozol do nosa, roztwór Mesnum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla użytkownika Mucofluid, 50 mg/ml, aerozol do nosa, roztwór Mesnum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta /5000 GP PL. Należy uważnie zapoznać się z treścią ulotki przed
 Ulotka dołączona do opakowania: informacja dla pacjenta 077794/5000 GP PL Viburcol plus, krople doustne, roztwór Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta 077794/5000 GP PL Viburcol plus, krople doustne, roztwór Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Klimakt-HeelT. tabletki
 Ulotka dołączona do opakowania: informacja dla pacjenta Klimakt-HeelT tabletki Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne dla pacjenta. Lek
Ulotka dołączona do opakowania: informacja dla pacjenta Klimakt-HeelT tabletki Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne dla pacjenta. Lek
