ROLA WEWNĄTRZKOMÓRKOWEGO WAPNIA W RUCHU AMEBO ID ALNYM I W ZJAWISKACH Z NIM ZWIĄZANYCH
|
|
|
- Sylwester Nowakowski
- 6 lat temu
- Przeglądów:
Transkrypt
1 Polskie 1995, 44 (1): ^Towarzystwo rzyslwo KOSMOS PL ISSN S? Ei S W a n d a K ł o p o c k a Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Pasteura 3, Warszawa ROLA WEWNĄTRZKOMÓRKOWEGO WAPNIA W RUCHU AMEBO ID ALNYM I W ZJAWISKACH Z NIM ZWIĄZANYCH M ECHANIZM I R EG U LA C JA L O K O M O C JI W świecie żywym występują różne rodzaje ruchu. Jednym z nich jest bardzo rozpowszechniony ruch ameboidalny. Poruszają się nim nie tylko organizmy jednokomórkowe, takie jak ameby, ale również zwierzęce komórki tkankowe. Pomiędzy tymi komórkami występują olbrzymie różnice biologiczne i morfologiczne. Jednak podczas migracji wszystkie wykazują polaryzację ruchową, to znaczy mają morfologicznie i funkcjonalnie zróżnicowany przedni i tylny rejon komórki, są przytwierdzone do podłoża, rozwijają przejściowe organy lokomotoryczne, zwane nibynóżkami (pseudopodia) i wytwarzają siłę motoryczną dzięki aktywności kurczliwej aktomiozynowego cytoszkieletu, zwanego korteksem. Tworzy on ciągłą warstwę podścielającą wewnętrzną powierzchnię błony komórkowej i ma strukturę trójwymiarowej sieci o konsystencji półsztywnego żelu, utworzonej z filamentów F-aktyny powiązanych przez białka sieciujące. W aktynowej sieci nierównomiernie są rozmieszczone krótkie, grube filamenty miozynowe oraz miozyna oligomeryczna, która również może reagować z F-aktyną. W czasie lokomocji w tylnej strefie komórki, a u ameb również w wycofywanych pseudopodiach, proces skurczu jest połączony z zolifikacją, to jest fragmentowaniem sieci (T a y l o r i współaut. 1979, T a y l o r i F e c h h e i m e r 1982). Materiał powstały w wyniku dezorganizacji aparatu kurczliwego, a więc: nisko oligomeryczna aktyna, G-aktyna, cząsteczki miozyny oraz białka regulujące, jest przenoszony w postaci strumienia endoplazmatycznego do strefy frontalnej, gdzie ulega ponownej żelifikacji (iys. 1) (G r ę b e - c k i 1986, S t o c k e m i H o f f m a n n 1986). Procesy degradacji i rekonstrukcji warstwy kurczliwej są więc rozdzielone pomiędzy dwa bieguny komórki. Aktywność kurczli-, ^,,,, i.,.. Rys. 1. Schemat migracii Amoeba prowa warstwy kortykalnej pom.ędzy mm. ^ Urold (u) fron* (F)JJądr0 ko^ ór. jest odpowiedzialna za generowanie siły kowe ektoplazma (ek). endoplazma motorycznej ( G r ę b e c k i 1981, 1982). Aby (en), hialoplazma (h). Strzałki wskazują mo fy powstać mechaniczne efekty działa- kierunek przepływu endoplazmy.
2 100 W and a K łopocka nia takiej siły aktomiozynowa sieć musi być połączona z błoną plazmatyczną bezpośrednio bądź poprzez białka łączące. W komórkach poruszających się ruchem ameboidalnym połączenia aktyny z błoną są krótkotrwałe, równie szybko się tworzą, jak i rozpadają (B ershad sky i V asilie v 1988). Dzięki swej dynamice umożliwiają zmiany kształtu komórki, wysuwanie i wycofywanie pseudopodiów. Kurczenie się peryferyjnego cylindra stowarzyszone z jego stopniową zolifikacją to jeden z dwu najważniejszych aspektów ruchu ameboidalnego. Drugim jest rytmiczne odklejanie się warstwy mikrofrlamentów od błony komórkowej, zachodzące w wierzchołkach wysuwanych nibynóżek. Skurcz całej peryferyjnej sieci aktynowej przyczepionej do błony podnosi ciśnienie hydrostatyczne wewnątrz komórki. W miejscach, w których cytoszkielet jest oderwany od błony występuje lokalny spadek ciśnienia. W tym kierunku, zgodnie z prawami hydrodynamiki, płynie endoplazma i tam tworzy się nowy front. Rytmiczne odklejanie się zrekonstruowanej warstwy mikrofilamentów od błony w wierzchołkach wysuwanych pseudopodiów powoduje więc oscylacje gradientu ciśnienia hydrostatycznego w komórce. Odbudowa sieci aktynowej połączonej z błoną, a następnie jej skurcz prowadzi do zmniejszenia tego gradientu i zwolnienia lub zatrzymania przepływu endoplazmy oraz posuwania się krawędzi czołowej. Następne rozdzielenie kompleksu błona-cytoszkielet wywołuje kolejny lokalny spadek ciśnienia i przywrócenie albo przyspieszenie przepływu endoplazmy oraz progresji strefy wiodącej (rys. 2) (G rębecki 1990). U Amoeba proteus cykl ten powtarza się średnio co 2 sekundy (G rębecki 1990, 1991, 1994). Rozdzielenie kompleksu błona-cytoszkielet zachodzi również u Dictyostelium discoideum (Spudich 1989), a także w komórkach tkankowych: frbroblastach (H eath 1983), keratynocytach (Th e r io t i M itchison 1991) i makrofagach (Ha r tw ig i Y in 1988). Sugeruje się, ż e właśnie strefa frontalna kontroluje zarówno szybkość, jak i kierunek lokomocji (Grębecki i współaut. 1981, G rębecki 1987). Ruch amebowy wymaga niezwykle precyzyjnej kontroli, zarówno transformacji zol-żel-zol, jak i cyklicznych zmian zachodzących w wierzchołkach wysuwanych nibynóżek. Regulacja interakcji miozyny z aktyną, Teologicznych właściwości cytoplazmy oraz zjawisk zachodzących w strefach frontalnych jest zależna od [Ca2+]i. Omówiony więc zostanie kolejno wpływ wapnia na funkcjo- Rys. 2. Schemat funkcjonowania frontu ameby. A obkurczanie cylindra kortykalnego połączonego z błoną: zatrzymanie przepływu endoplazmy. B odklejenie warstwy kurczliwej od błony plazmatycznej: progresja strefy wiodącej. Ektoplaznra (ek), endoplazma (en), front (F). Według A. G r ę b e c k i 1990.
3 Rola wapnia w ruchu ameboidalnym 101 nowanie samego cytoszkieletu, a następnie rola jaką Ca pełni w cyklicznych zjawiskach obserwowanych w strefach czołowych migrujących komórek. W procesach żelifikacji biorą udział białka sieciujące F-aktynę. Zolifikacja natomiast jest konsekwencją dysocjacji tych białek i działania białek redukujących długość mikrofilamentów. Wykazano, że białka te przeprowadzają odwracalną transformację zol-żel w sposób zależny od stężenia w [Ca2+]i. W warunkach względnie wysokiego [Ca2+]i, to jest w uroidzie ameb działają białka rozluźniające strukturę żelu. Jedne z nich mogą ciąć mikrofilamenty, powodując rozpadanie się trójwymiarowej sieci na małe agregaty, inne wiążą się z jednym z końców filamentu aktywnego, zwanym po angielsku barbed-end czy monomerami aktynowymi determinując stopień polimeryzacji aktyny. Z komórek tkankowych wyizolowano bardzo wiele takich białek (S c h l i w a 1981, C r a ig i P o l l a r d 1982). U ameb zidentyfikowano dotychczas białka hamujące polimeryzację G-aktyny. S ą to profilina i cytoplazmatyczna kinaza (R e i c h s t e i n i K o r n 1979, M o.c k r i n i K o r n 1980, S o n o b e i współaut. 1986). Jednocześnie, w warunkach wysokiego [Ca2+]i, które aktywuje kinazę i umożliwia fosfoiylację lekkiego łańcucha miozyny, formuje ona krótkie, grube filamenty i wchodzi w interakcje z aktyną (C r a i g i współaut. 1983, T a y l o r 1986). Proces zolifikacji połączonej ze skurczem w tylnej strefie komórki jest stowarzyszony z przechodzeniem frakcji cytoszkieletalnej i białek regulujących do puli płynnej endoplazmy. W strefie frontalnej, gdzie [Ca2+]i jest niższe, zdepolimeryzowana aktyna, która dociera tu wraz ze strumieniem endoplazmy, ulega repolimeryzacji (K o r n 1982). Jest to możliwe dzięki uwalnianiu białek hamujących polimeryzację. Jednocześnie białka sieciujące, które nie wymagają obecności jonów wapnia formują z mikrofilamentów ektoplazmatyczny żel (rys. 3). Grube filamenty miozyny ulegają dysocjacji. W komórkach niemięśniowych, w przeciwieństwie do komórek mięśni, białka biorące udział w skurczu zmieniają miejsce w komórce. Podczas lokomocji stale przemieszczają się w strumieniu endoplazmy w kierunku frontu i wraz z warstwą kortykalną ku strefie uroidalnej (G r ę b e c k i 1984, 1994). U Dictyostelium discoideum stwierdzono, że zmiana miejsca filamentów miozyny II w komórce jest kontrolowana przez poziom cytoplazmatycznego wapnia oraz wewnątrzkomórkowe ph. W migrującej amebie filamenty te są skoncentrowane w tylnym rejonie komórki (Y u m u - RA i współaut. 1984), gdzie [Ca2+]i jest stale podwyższone, a w czasie podziału znajduje się je w rejonie bruzdy (K i t a n i s h i- Y u m u r a i F u k u i 1989, Y u m u r a i F u k u i 1985). Gromadzą się także w ograniczonych rejonach korteksu pod skupieniami receptorów powierzchniowych ( C o n d e e l i s 1979). Ostatnio wykazano, że uwalnianie miozyny II z korteksu Dictyosteliwn do endoplazmy jest hamowane przez jony wapnia i kalmodulinę (Y u m u r a i K i t a n i s h i- Y u m u r a o, Rys. 3. S c h em at zależności pom iędzy stężeniem C a2+i w różnych strefach k o m órki a stopniem polim eryzacji aktyny i o d w ra c a ln ą tran sfo rm a cją zol żel. Front (F), G ak tyna (a), F ak ty n a (fa), b ia łk a sieciujące (bs). W e d łu g I. H. Hartw ig i H. L. Y in 1988.
4 102 W and a K łopocka 1993). Podczas chemotaktycznej stymulacji camp, to jest w stadium agregacji komórek amebowych, wzrasta czasowo poziom cytoplazmatycznego wapnia (M a lc h o w i współaut. 1987), a filamenty miozyny II przechodzą z endoplazmy do rejonu kortykalnego. Liu i N e w ell (1991) sugerują, że cgmp reguluje fosforylację miozyny, a tym samym jej asocjację z cytoszkieletem poprzez regulację napływu Ca2+ do komórki. Wzrost stężenia Ca2+ zaczyna się w 6 sek. pó rozpoczęciu stymulacji i maksimum osiąga po 30 sek. (B um ann i współaut. 1984). Przemieszczenie miozyny II z endoplazmy do korteksu zachodzi po około 30 sek. od momentu zadziałania camp (Nach m ias i współaut. 1989), co ściśle odpowiada maksimum wzrost u [Ca2+]i. W tym samym czasie ma miejsce kurczenie i zaokrąglanie się komórek (Futrelle i współaut. 1982). Pierwsze badania dotyczące roli wapnia w regulacji struktury cytoplazmy były prowadzone w latach siedemdziesiątych i osiemdziesiątych na modelach glicerynowych wielkich ameb, takich jak Chaos carolinensis czy Amoeba proteus, izolowanej cytoplazmie tych ameb (lit. zob. Sto ckem i Kło po c k a 1988), a także ekstrakcie z Dictyostelium discoideum (Condeelis i T aylo r 1977). Wykazano, że dla reaktywacji modeli glicerynowych oraz indukcji strumienia endoplazmatycznego w izolowanej cytoplazmie jest niezbędne stężenie Ca2+ równe temu, które powoduje skurcz mięśni, to jest około 1CF6M (E bashi i E ndo 1968). Manipulując stężeniem Ca2+ i MgATP można zmieniać stan izolowanej cytoplazmy lub ekstraktu komórkowego. Stężeniem progowym dla skurczu połączonego z dezorganizacją cy to szkieletu, a przy braku miozyny dla przejścia ze stanu żelu w zol, jest 7,0 x 10-7M. Optimum żelifikacji jest osiągane przy stężeniu około 3,0 x 10~8M (rys. 4) (Ta ylo r i współaut. 1973, T aylo r i współaut. 1976, H e lle w e ll i T aylo r 1979, T a ylo r i Cond eelis 1979, S onobe i współaut. 1985). Przypuszcza się, że jednym z mechanizmów kontrolujących transformację zol żel jest fosforylacja kompleksu profilina/g-aktyna, katalizowana przez kinazę przy wysokim [Ca2+]i i umożliwiająca tworzenie F-aktyny (Sonobe i współaut. 1986). Badania prowadzone na dużych amebach (Chaos carolinensis i Amoeba proteus) z utyciem fluorescencyjnych wskaźników Ca takich jak ekworyna, czy fura-2 wykazały przestrzenne zróżnicowanie [Ca2+]i w migrujących komórkach i potwierdziły znaczenie tego jonu w ruchu ameboidalnym i niektórych zjawiskach z nim związanych (Ta y lo r i współaut. 1980, Kuro d a i współaut. 1988, G o lln ic k i współaut. 1991). Podczas lokomocji komórek Amoeba proteus [Ca2+]i w rejonie uroidalnym utrzymuje się zawsze na poziomie około 10" M, podczas gdy w strefie Rys. 4. Schemat pokazujący związek pomiędzy skurczem i zolifikacją żelu aktynowego: A żel aktynowy: brak interakcji aktyny z miozyną, [Ca2+h równe 3,0 x 10~8M; B zolifikacja żelu aktynowego, interakcja białek biorących udział w skurczu, [Ca2+]i równe 7,0 x 10_7M. Filamenty aktynowe (fa), miozyna (m), białka sieciujące (bs). Według S. B. H e l l e w e l l i D. L. T a y l o r 1979.
5 Rola wapnia w ruchu ameboidalnym 103 frontalnej wynosi około 10"8M. Ten stale utrzymujący się gradient wapniowy jest skorelowany z rozkładem przepływu strumienia cytoplazmy i kierunkiem lokomocji. Uważa się, że źródłem Ca2+ kontrolującego funkcjonowanie warstwy kortykalnej (C o h e n i D e V r i e s 1973, S t o c k e m i K l e i n 1979) mogą być złogi wapniowe związane z błoną plazmatyczną. Wykryto je u Amoeba proteus (S t o c k e m i K l e i n 1979), Acanthamoeba castellanii (S o b o t a 1985, S o b o t a i współaut. 1977,1978), a także u Dictyostelium discoideum ( D e C h a s t e l l i e r i R y t e r 1981, 1982). U Dictyostelium te lokalnie ograniczone miejsca wiązania Ca2+ są szczególnie liczne w rejonach komórki, w których błona podścielona jest siecią mikrofilamentów, a więc w filopodiach i kubkach fagocytarnych ( D e C h a s t e l l i e r i R y t e r 1981). U Amoeba proteus są obecne w tylnym rejonie komórki, a więc tam gdzie poziom wolnego wapnia jest stale podwyższony. Sugeruje się, że magazyny te są formowane w rejonach ze zwiększoną przepuszczalnością błony komórkowej dla Ca2+ (S t o c k e m i K l e i n 1979). Być może są one związane z domenami błony plazmatycznej, w których zbierają się kanały wapniowe. Badania elektrofizjologiczne wykazały ciągły napływ jonów Ca2+ w tylnej strefie komórki i ich usuwanie w rejonie przednim (K O h t r e i b e r i J a f f e 1990, N u c c it e l l i i współaut. 1977). Oprócz utrzymującego się stale przestrzennego zróżnicowania stężenia wolnego wapnia, w migrujących komórkach obserwuje się również lokalne, spontaniczne zmiany poziomu tego jonu. Wykazano, że podczas ruchu dużych ameb [Ca2+]i w ich strefach czołowych wzrasta rytmicznie co 1-4 sek. (T a y l o r i współaut. 1980). Ponieważ odrywanie się kolejnych warstw aktynowych spod błony powtarza się co około 2 sek., sugeruje się, że wzrost [Ca2+]i bezpośrednio pod błoną frontalną powoduje rozdzielenie kompleksu błona-cytoszkielet ( G r ę - b e c k i 1994). Powstaje w ten sposób gradient ciśnienia hydrostatycznego, kontrolujący zarówno kierunek, jak i tempo lokomocji. Gdy stężenie wapnia spada jest możliwa reorganizacja cytoszkieletu pod błoną frontu. Różnice ciśnienia zmniejszają się wówczas lub zanikają, endoplazma płynie wolniej lub zatrzymuje się, front przestaje się posuwać i może rozpocząć się jego wycofywanie (rys. 2). Na lokomocję ameb mogą mieć wpływ rozmaite bodźce zarówno fizyczne, jak i chemiczne. Za pomocą pozytywnych bodźców chemicznych (K o r o h o d a 1977) czy świetlnych ( G r ę b e c k i 1981), działających lokalnie na powierzchnię Amoeba proteus możliwe jest formowanie nowych frontów w dowolnym rejonie komórki. Czynniki te powodują bowiem destabilizację połączeń błona-cytoszkielet, poprzez wzrost [Ca2+]i ograniczony do strefy stymulacji i formowanie w tym miejscu nowego frontu. Powstanie nowego frontu z kolei reorientuje polaryzację ameby, a tym samym zmienia kierunek jej migracji (Grębecka 1988). Wzrost [Ca2+li obserwowano również pod wpływem chemotaktycznie pozytywnych bodźców przy krawędzi lamellipodiów komórek nabłonkowych (S t r o h m e i e r i B e r e i t e r - H a h n 1984, M it t a l i B e r e i t e r - H a h n 1985) oraz w strefach czołowych granulocytów (Sewyer i współaut. 1985, T r u e t t i współaut. 1988) i fibroblastów ( O n u m a i Hui 1988). Pozytywny bodziec chemiczny powoduje wzrost poziomu cytoplazmatycznego wapnia u amebowych form Dictyostelium (W i c k i współaut. 1978, M a l c h o w i współaut. 1982, F u k u i i Y u m u r a 1986). Sugeruje się, że kontrola ruchu u ameb bazuje właśnie na lokalnych zmianach [Ca2+]i i związanej z nimi cyklicznej dezintegracji połączeń błona-cytoszkielet ( G r ę b e c k i 1992).
6 104 W and a K łopocka W A P Ń J A K O W T Ó R N Y P R Z E K A Ź N IK W R E A K C J A C H A M E B N A B O D Ź C E Z E W N Ę T R Z N E Nie tylko migracja ameb jest kontrolowana w sposób zależny od stężenia wolnego wapnia. Jest on zaangażowany w regulację wszystkich zjawisk związanych z aktywnością kurczliwą cytoszkieletu ameb, to jest endo- i egzocytozy, cytokinezy, transportu receptorów powierzchniowych, czy kontaktów międzykomórkowych. Wapń jest również wtórnym przekaźnikiem w reakcjach ameb wywoływanych przez rozmaite bodźce, zarówno czynniki chemotaktyczne, jak światło (UVj, czy induktoiy pinocy to tyczne. Dla tych komórek bowiem reakcją jest zwykle zmiana kierunku lub szybkości ruchu, zahamowanie lub podjęcie lokomocji, czy pinocytoza. Związane z Ca2+ reakcje na bodźce są badane od ponad stu lat. Wyniki dotyczące biochemicznej strony tych zjawisk pochodzą głównie z badań na komórkach tkankowych. Ameby pozostają przede wszystkim obiektem eksperymentów fizjologicznych. Działanie bodźca powoduje zwykle przejściowy wzrost poziomu cytoplazmatycznego wapnia. Jest on wynikiem uwalniania Ca2+ z wewnątrzkomórkowych magazynów do cytoplazmy oraz napływu tego jonu do komórki przez kanały wapniowe w błonie plazmatycznej. Mobilizacja wapnia we wszystkich typach komórek jest związana z działaniem trisfosfoinozytolu (inozytolo (l,4,5)trisfosforan, w skrócie InsP3) będącego produktem rozpadu fosfolipidów inozytolowych (według B a r a ń s k a 1992, P u t n e y 1993). Ten wtórny przekaźnik informacji pojawia się w cytoplazmie w wyniku aktywacji określonej grupy receptorów powierzchniowych. Wzrostowi stężenia trisfosfoinozytolu towarzyszy zawsze wzrost poziomu wolnych jonów wapnia w cytoplazmie ponieważ InsP3 uwalnia wapń z cystern endoplazmatycznego retikulum (ER) poprzez wiązanie się do specyficznych receptorów w błonie tej organelli (według K w i a t k o w s k a 1986, B e r r i d g e i Ir v i n e 1989, P o d d a n a i B a r a ń s k a 1991). Receptor InsPß jest jednocześnie kanałem wapniowym (F e r r i s 1989, P o d d a n a i B a r a ń s k a 1991). W wyniku konformacyjnych zmian, powodowanych przyłączeniem cząsteczki przekaźnika ( G il l 1989), otwiera się i uwalnia Ca + do cytosolu (rys. 5). Opróżnianie organelli magazynujących wapń jest sygnałem, który inicjuje napływ zewnątrzkomórkowego Ca2+ do cytoplazmy. W komórkach pobudliwych wapń napływa zarówno przez kanały napięciowo-zależne, jak i receptorowe; w komórkach niepobudliwych, które nie posiadają kanałów wapniowych, regulowanych przez zmiany potencjału błonowego przez jonowe kanały receptorowe (T s i e n i T s i e n 1990). Mechanizm kontrolowania przepuszczalności błony plazmatycznej dla jonów wapnia pozostaje nadal kontrowersyjny. Badania prowadzone na limfocytach (K h a n i współaut. 1992) i zakończeniach nerwowych komórek węchowych (R e s t r e p o i współaut. 1990, K a l i n o s k i i współaut. 1992) wykazały, że InsPß stymuluje napływ Ca2+ do komórki przez interakcję ze specyficznymi receptorami zlokalizowanymi w błonie plazmatycznej. W 1990 roku P u t n e y sugerował istnienie dyfundującego przekaźnika, uwalnianego z opróżnionych magazynów wapniowych, który inicjowałby napływ Ca2+ do komórki. Taki przekaźnik wyizo
7 Rola wapnia w ruchu ameboidalnym 105 lowano ostatnio z limfocytów (R a n d r i a m a m p i t a i T s i e n 1993). Jest on uwalniany do cytoplazmy i w mniejszym stopniu do środowiska (rys. 5). Ponieważ powoduje napływ Ca2+ nie tylko do komórek, w których jest produkowany, ale również do nieaktywowanych makrofagów i flbroblastów, nazwano go Ca2+-influx factor (CIF). 2 + Rys. 5. Schemat mobilizacji Ca w komórce spowodowany aktywacją receptora powierzchniowego (R). Działanie agonisty prowadzi do powstania InsP3. Łączy się on z receptorem kanałem (R InsP3) w błonie endoplazmatycznego retikulum (ER) i powoduje uwolnienie Ca2+ z cystern ER do cytoplazmy (C). Opróżniony magazyn uwalnia przekaźnik (CIF), który inicjuje napływ Ca2+ do komórki przez kanały wapniowe (K). Cytoplazmatyczny wapń jest ponownie transportowany do ER przez pompę wapniową (P). Błona plazmatyczna (BP). Według J. W. P u t n e y O, U Dictyostelium disco ideum stymulowanego camp {Ca ]i wzrasta 2,6x (S a r a n i współaut. 1994). Ze stymulacją cyklicznym AMP jest związane przechodzenie komórek ze stanu wegetatywnego do stanu agregacji, wapń jest więc zaangażowany prawdopodobnie zarówno w adhezję, jak i lokomocję małych ameb, konieczną dla uformowania pseudoplazmodium. Ponieważ opisane doświadczenia prowadzono w środowisku pozbawionym Ca2+, wzrost poziomu tego jonu w cytoplazmie musiał odbywać się dzięki uwalnianiu go z magazynów wewnątrzkomórkowych (S a r a n i współaut. 1994). Jednocześnie wykazano, że wzrost [Ca2+]i rozpoczyna się wcześniej niż napływ tego jonu do komórek. U Amoeba proteus gwałtowny, przejściowy wzrost poziomu cytoplazmatycznego Ca2+ wywołują induktory pinocytotyczne, takie jak jony sodu (rys. 6) i potasu oraz czynniki powodujące powstawanie rozet: acetylcholina i chlorek choliny (K ł o p o c k a i P o m o r s k i w przygotowaniu). Wzrost {Ca2+]t jest zawsze skorelowany w czasie z zahamowaniem lokomocji, utratą adhezji i stopniowym zaokrąglaniem się komórki (rys. 7). Zmiany te są spowodowane silnym kurczeniem się całej warstwy kortykalnej. Ponieważ pinocytoza u wielkich ameb może zachodzić w środowisku bezwapniowym (J o h a n s s o n i J o s e f s s o n 1978, S t o c k e m i K l e i n 1988, K ł o p o c k a i Grębecka 1985), wydaje się, że podobnie jak u stymulowanego camp Dictyostelium i tutaj sygnał wapniowy jest wynikiem uwalniania Ca2+ z wewnątrzkomórkowych magazynów. Sugeruje się, że spadek [Ca2+]i do poziomu sprzed stymulacji jest wynikiem ponownej sekwestracji wapnia. W wielu typach komórek niepobudliwych wykazano, że przejściowy wzrost [Ca2+] } może zachodzić niezależnie od napływu Ca2+ (R o o n e y i współaut. 1990, L e c h l e i t e r i współaut. 1991, M iy a z a k i 1991, D e L i s l e i W e l s h 1992). Natomiast przy braku InsP3, sam napływ Ca2+ do cytoplazmy nie generuje
8 106 W and a K łopocka sygnału wapniowego (G ir a r d i C l a p h a m 1993). Okazało się jednak, że wewnątrzkomórkowe sygnały wapniowe, które trwają dłużej niż kilka minut od momentu stymulacji zależą właśnie od napływu Ca + (R a n d r l a m a m p it a i T s i e n 1993). Rys. 6. Wykres zmian stężenia cytoplazmatycznego wapnia w komórce Amoeba proteus wywołanych 125mM NaCl. Grot strzałki pokazuje moment podania induktora. Klasyczną reakcją komórek niepobudliwych na wiele bodźców jest czasowy, gwałtowny wzrost [Ca2+]i, po którym przez czas jakiś utrzymuje się podwyższony nieco poziom cytoplazmatycznego wapnia. Reakcja jest więc dwufazowa za pik są odpowiedzialne jony wapnia, uwalniane z magazynów wewnątrzkomórkowych, utrzymujące się plateau to wynik napływu Ca2+ do komórki (J a c o b 1990a) spowodowany wzrostem przepuszczalności błony plazmatycznej dla tego jonu. Taki przebieg ma reakcja Amoeba proteus na induktory pinocytotyczne (Na+ i K+) (rys. 6). Utrzymujący się bardzo długo po indukcji podwyższony poziom wolnego wapnia w amebie jest prawdopodobnie odpowiedzialny za formowanie pinocytotycznych pseudopodiów. W niektórych komórkach efektem działania pewnych agonistów na receptory powierzchniowe jest lokalny wzrost [Ca2+]i, falowo rozprzestrzeniający się w komórce. Uważa się, że lokalne zmiany poziomu wolnego Ca są ograniczone do obszarów cytoplazmy sąsiadujących z kanałami wapniowymi w błonie plazmatycznej i ER (J a c o b 1990a, T s i e n i T s i e n 1990). Zjawisko falowego rozprzestrzeniania się sygnału wapniowego obserwowano po raz pierwszy w komórkach jajowych szkarłupni (J a f f e 1983). Występuje również w komórkach tkankowych (T s i e n i P o e n i e 1986, J a c o b 1990b), a także u Amoeba proteus (K ł o p o c k a i P o m o r s k i w przygotowaniu) jako efekt działania jonów sodu (rys. 7) i chlorku choliny. Fale wapniowe mogą być poprzedzane przez lokalny wzrost [Ca2+]i w jednym lub kilku miejscach inicjacji (R o o n e y i Thomas 1993). Obecnie wiadomo, że rozprzestrzenianie się fal wapniowych nie jest wynikiem dyfuzji Ca2+ w cytoplazmie (współczynnik dyfuzji tego jonu jest zbyt niski). Ich przenoszenie jest raczej wynikiem dyfuzji InsP3 (A l l b r i t t o n i M e y e r 1993). Wydaje się, że najbardziej prawdopodobnym mechanizmem propagowania fal jest indukowane przez Ca2+ uwalnianie wapnia ( W il l i a m s 1993, J a f f e 1993).
9 Rola wapnia w ruchu ameboidalnyrn 107 Wiele agonistów może w komórkach niepobudliwych, takich jak: hepatocyty (W o o ds i współaut. 1986, 1987), komórki endotelialne (Ja c o b i współaut. 1988), makrofagi (Kru s k al i M axfield 1987), czy oocyty (C uth berso n i C o bb o ld 1985, M iyazaki i współaut. 1987) indukować oscylacje wapniowe. Są one w tym przypadku konsekwencją zjawisk zachodzących w samej komórce, a nie jak w komórkach pobudliwych wynikiem periodycznych depolaryzacji błony plazmatycznej. Spontaniczne pulsacje wapniowe występują w strefach czołowych migrujących ameb (Taylo r i współaut. 1980). Uważa się, że są one wynikiem cyklicznego uwalniania związanego z błoną wapnia. Rys. 7. Ilustracje pokazujące zmiany w rozmieszczeniu cy toplazmatycznego Ca u Amoeba proteus po podaniu 125mM NaCl. Widoczne falowe rozprzestrzenianie się sygnału wapniowego (c i d). Wzrost [Ca2+h skorelowany w czasie ze zmianą kształtu komórki. Mechanizmy związane z powrotem poziomu Ca do stanu sprzed zadziałania bodźca są automatycznie uruchamiane przez podwyższenie [Ca2+]i. Obejmują one usuwanie Ca2+ przez błonę plazmatyczną na zewnątrz i zamykanie tego jonu w magazynach wewnątrzkomórkowych. Transport wapnia do wnętrza magazynów i na zewnątrz komórek jest regulowany przez zależną od jonów Mg ATP-azę (Ca2+-Mg2+-ATPazę), zwaną pompą wapniową. U ameb wapń jest akumulowany w gładkim E R przy [Ca2+]e równym 1CT6M (R e in o l d i S t o c k e m 1972) oraz w magazynach zlokalizowanych na cytoplazmatycznej stronie błony komórkowej. Odebranie sygnału wapniowego i uruchomienie procesów odpowiedzialnych za reakcję komórki jest funkcją wiążących wapń białek regulujących. Wykryto około 200 rodzajów takich białek (H eizm ann 1991). Podzielono je na grupy w zależności od struktury i funkcjonowania (Kuźnicki i K o r d o w s k a 1992). Wszystkie one wiążą Ca2+ w granicach stężeń fizjologicznych i inicjują różnorodne reakcje komórek. Czytelników zainteresowanych działaniem tych białek odsyłam do książki A. T r etyn a (1994). Reakcje komórek, których podstawą jest skurcz, są związane zawsze z aktywnością aktyny i miozyny. Znane są dwa mechanizmy, za pośrednictwem których Ca2+ reguluje interakcję tych białek. W mięśniach szkieletowych i komórkach mięśnia serca Ca2+ inicjuje skurcz przez wiązanie się do białka regulującego tropomiozyny C, znosząc hamujący wpływ kompleksu troponina-tropomiozyna na interakcję aktyny z miozyną (G reaser i G er g e ly 1971). W komórkach mięśni gładkich i komórkach niemięśniowych regulacja ta jest związana z odwracalną fosforylacją lekkiego łańcucha miozyny (Sze n t-gyo r g yi i współaut. 1973), katalizowaną przez specyficzne enzymy: kinazę i fosfatazę lekkiego łańcucha (Ad elstein i C onti 1976). Niezależnie od mechanizmu regu
10 108 W and a Kłopocka lacji, interakcja aktyny z miozyną jest inicjowana przez [Ca2+]i w granicach od 1CT7 do 10_6M w obecności MgATP (A delstein i współaut. 1977). Od około 25 lat są identyfikowane i badane białka, które pośredniczą w zależnej od Ca2+ regulacji interakcji aktyny z miozyną. Grupę takich białek, bardzo podobnych w strukturze i funkcjonowaniu, określa się wspólną nazwą kalmoduliny (CaM). Kalmodulina jest najpowszechniej występującym białkiem wiążącym wapń. Zidentyfikowano ją w wielu zwierzęcych komórkach tkankowych i komórkach roślinnych (według T retyn 1994). Od lat prowadzi się badania nad specyfiką działania tego białka w komórkach różnych gatunków pierwotniaków. Są wśród nich zarówno wiciowce, orzęski, jak i zarodziowe (K uźnicki 1986). Obecność CaM stwierdzono również u śluzowca Physarum polycephalum (K uźn ic ki i współaut. 1977, 1979). Kompleks kalmodulina-wapń (CaM.Ca) aktywuje w sposób zależny od Ca2+, bezpośrednio albo pośrednio wiele enzymatycznych białek. Moduluje więc różnorodne funkcje komórkowe: skurcz mięśni gładkich, ruchy wici i rzęsek, endocytozę, egzocytozę i kariokinezę; odgrywa też ważną rolę w migracji komórek poruszających się ruchem ameboidalnym (patrz u H in r ic h sen 1993). Kalmodulina jest włączona w zależną od Ca2+ regulację ruchliwości polimorfonuklearnych neutrofili (Marks i współaut. 1991, C h atila i współaut. 1989) i fibroblastów (Hahn i współaut. 1992). Jest białkowym pośrednikiem włączonym w regulację interakcji aktyny z miozyną u Amoeba proteus (K uźn ic ki i współaut. 1977, 1979) i Acanthamoeba castellanii (B r ze ska i współaut. 1992) co sugeruje, że ma wpływ na zjawiska ruchowe w tych komórkach. U Dietyostelium discoideum wykazano jednak ostatnio, że obniżenie poziomu CaM powoduje zaburzenia w cytokinezie, ale nie hamuje lokomocji (Liu i współaut. 1992). Może to oznaczać, że w tych komórkach kalmodulina nie jest bezpośrednio włączona w procesy związane z migracją. Z drugiej strony jednak wiadomo, że w komórkach Dictyostelium, podobnie jak w zwierzęcych komórkach tkankowych, znajdują się liczne białka, które wchodzą w interakcję z CaM (M a r u ta i współaut. 1983, B ennett i C ondeelis 1988, Fukui i współaut. 1989, St u l l 1988). Obecnie uważa się, że CaM.Ca reguluje aktywność każdej komórki eukariotycznej. Sugeruje się również, że najwcześniejszą funkcją kalmoduliny w ewolucji Eukaryota była. regulacja ruchliwości (M eans i współaut. 1982). Ta z kolei jest, jak wiadomo, integrującym komponentem wielu zjawisk biologicznych od rozwoju do onkogenezy. T H E R O L E O F INTRACELLULAR CALCIUM IN A M EBO ID M O V EM EN T AND R ELA TED PH EN O M EN A S u m m a ry It is generally accepted that calcium is an essential factor in complicated movement phenomena in amoebae, and that it controls sol-gel-sol transformations and triggers contraction. The internal concentration of Ca2+ above 10 7M induces contraction and transformation of ectoplasmic gel into endoplasmic sol at the uroid and in retracting pseudopodia. In the frontal aera where [Ca2+]i is below 10 8 M the reconstruction of the rigid gel occurs. The intracellular [Ca2+]i gradients always correspond to the direction of cytoplasmic streaming and to the characteristic pattern of ameboid movement. In large amoebae, calcium ions are involved in controlling the reversible equilibrium between G- and F-actin via profilin and cytoplasmic kinase. External application of different stimuli abolishes the intracellular Ca2+ gradients existing previously and, in consequence, influences the motor behaviour of amoeba. The stimulation usually
11 Rola wapnia w ruchu ameboidalnyrn 109 leads to a transient increase in cytoplasmic calcium level which triggers different responses of amoebae. Elevation of [Ca2+]i automatically actuates the mechanisms that pump Ca2+ out of the cytosol, either out of the cell across the plasma membrane or into intracellular stores. In giant amnebae two Ca2+ stores have been descried: internal plasma membrane-attached binding sites and elements of the smooth endoplasmic reticulum. LITERATURA A d e ls t e in R. S., ChACKO S., S ty lia n o s P., S c o r d ilis P., B a r y łk o B., C o n ti M. A., T r o t t e r J. A., The role of Ca2+ and myosin phosphorylation in regulating actomyosin in smooth muscle and non-muscle cells. [W :] Calcium-binding Proteins and Calcium Function. W a sserm a n R. H., C o r r a - d in o R. A.. C a r a fo li E., K r e t s in g e r R. H., M a clen n a n D. H., S ie g e lf. L. (red.). North-Holland-New York, New York-Amsterdam-Oxford, A d e ls t e in R. S., C o n ti M. A., The effect of phosphorylation on platelet myosin and studies on substrates for platelet myosin light-chain kinase. [W:] Cell Motility. G o ld m a n R., P o l l a r d T., R osen bau m J. (red.). Cold Spring Harbor Laboratory, Cold Spring Harbor-N. Y., A l l b r i t t o n N. L., M e y e r T., Localized calcium spikes and propagating calcium waves. Cell Calcium 14, B a ra ń s k a J., Rozpad fosfolipidów a przekazywanie informacji w komórce. Polskie Towarzystwo Biochemiczne, Warszawa. B e n n e it H., C o n d e e lis J., Isolation of an immunoreaclive analogue of brain fodrin that is associated with the cell cortex of Dictyostelium amoebae. Cell Motil. Cytoskeleton 11, B e r r id g e M.J., Irvin e R.F., Inositol phosphates and cell signalling. Nature 341, B ersh ad sk y A. D., V a s ilie v J. M., Cytoskeleton. Plenum Press., New York-London. B r z e s k a H., K u le s za -L ip k a D., K o r n E., Inhibüionof Acanthamoeba myosini heavy chain kinase by Cci2+- calmodulin. J. Biol. Chem. 267, Bum ann J., W u r s t e r B., M a lc h o w D., Attractant-induced changes and oscillations of the extracellular Ca2+ concentration in suspensions of differentiating Dictyostelium cells. J. Cell Biol. 98, C h a tila T., G e h a R., A r n a o u t M., Constitutive and stimulus-induced phosphorylation of CDI 1/CD18 leukocyte adhesion molecules. J. Cell Biol. 109, C oh en I., D e V r ie s A., Platelet contractile regulation in an isometric system. Nature 246, C o n d e e lis J., Isolation of concanavalin A caps during various stages of formation and their association with actin and myosin. J. Cell Biol. 80, C o n d e e lis J. S., T a y lo r D. L., The contractile basis of ameboid movement. V. The control of solation, gelation, and contraction in extracts from Dictyostelium discoideum. J. Cell Biol. 74, C ra ig S. W., P o lla r d T. D., Actin binding proteins. Trends Biochem. Sei. 7, C r a ig R., S m ith R., K e n d r ic k -J o n e s J., Light-chain phosphorylation controls the conformation o f vertebrate non-muscle and smooth muscle myosin molecules. Nature (London) 302, C u th b e r s o n K. S. R., C o b b o ld P. H., Phorbol ester and sperm activate mouse oocytes by inducing sustained oscillations in cell Coi2+. Nature 316, D e C h a s t e llie r C., R y t e r A., Calcium-dependent deposits at the plasma membrane of Dictyostelium discoideum and their possible relation wüh contractile proteins. Biol. Cell 40, D e C h a s t e llie r C., R y t e r A., Calcium deposits at the plasma membrane of Dictyostelium discoideum during phagocytosis and cell motility. Biol. Cell 43, D e L is le S., W e ls h M. J., Inositol trisphosphate is required for the propagation of calcium waves inxenopus oocytes. J. Biol. Chem. 267, Ebashi S., E n do M., Calcium ion and muscle contraction. Prog. Biophys. Mol. Biol. 18, F e r r is D. C., H u g a n ir R. L., S u p a tta p on e S., S n y d e r S. H., Purified inositol 1,4,5-trisphosphate receptor mediates calciumßux in reconstituted lipid vesicles. Nature 342, Fukui Y., L y n ch T., B r z e s k a H., K o r n E., Myosin I is located at the leading edges oflocomoting Dictyostelium amoebae. Nature 341, Fukui Y., Y u m u r a S., Actomyosin dynamics in chemotactic amoeboid movement o f Dictyostelium. Cell Motil. Cytosk. 6,
12 110 W and a K lopocka F u t r e l l e R. P.,T r a u t J., M c K e e W. G., Cell behavior in Dictyosteliwn discoideum: Preaggregation response to localized cyclic AMP pulses. J. Cell Biol. 92, G ill D. L., Receptor kinships revealed. Nature 342, G ir a r d S., C lapham D., Acceleration of intracellular calcium waves inxenopus oocytes by calcium inßux. Science 260, G o lln ic k F., M e y e r R., S to c k e m W., Visualization and measurement of calcium transients in Amoeba proteus byfura-2ßuorescence. Eur. J. Cell Biol. 55, G r e a s e r M. L., G e r g e l y J., Reconstitution of troponin activity from three protein components. J. Biol. Chem. 246, G r ę b e c k a L., Polarity of the motor functions in Amoeba proteus. I. Locomotory behaviour. Acta Protozool. 27, G r ę b e c k i A., Effects of localized photic stimulation on amoeboid movement and their theoretical implications. Eur. J. Cell Biol. 24, G ręb eck i A., Supramolecular aspects of amoeboid movement. Progress in Protozoology. Proceedings of the VI International Congress on Protozoology, part 1, G r ę b e c k i A., Relative motion in Amoeba proteus in respect to the adhesion sites. I. Behaviour of monotactic forms and the mechanism offountain phenomenon. Protoplasma 123, G ręb eck i A., Relationship between cytoskeleton and motility. Insect Sei. Applic. 7, G r ę b e c k i A., Organizacja przestrzenna mechanizmów napędowych i sterujących w ruchu amebowym. Postępy Biologii Komórki 13, G r ę b e c k i A., Mechanizmy ruchów amebowych. [W:] Komórka je j budowa i ruch. K u źn ick i L. (red.). Wszechnica Polskiej Akademii Nauk (Ossolineum), Wroclaw-Warszawa, G r ę b e c k i A., Dynamics of the contractile system in the pseudopodial tips of normally locomoting amoebae, demonstrated in vivo by video-enhancement. Protoplasma 154, G r ę b e c k i A., Participation of the contractile system in endocytosis demonstrated in vivo by video-enhancement in heat-pretreated amoebae. Protoplasma 160, G ręb eck i A., Ruchy błony i cytoszkieletu w komórkach ameboidalnych. Kosmos,41, G r ę b e c k i A., Membrane and cytoskeletonß ow in motile cells with emphasis on the contribution of free-living amoebae. Int. Rev. Cytol. 148, G r ę b e c k i A., G r ę b e c k a L., K lo p o c k a W., Testing steering functions of the frontal zone in the locomotion of Amoeba proteus. Cell Biol. Int. Rep. 5, H ahn K., D e B ia s io R., T a y lo r D. L., Patterns of elevated free calcium and calmodulin in living cells. Nature 359, H a r t w ig J. H., Y in H. L., The organization and regulation of the macrophage actin skeleton. Cell Mo til. Cytosk. 10, H e a th J.P., Behaviour and structure of the leading lamella in moving fibroblasts. I. Occurrence and centripetal movement of arc-shape microfilament bundkes beneath the dorsal cell surface. J. Cell Sei. 60, H eizm ann C. W., Calcium-binding proteins of the EF-hand-type and of the annexin family: a survey. [W:j Novel Calcium-Binding Proteins. Heizm ann C. W. (red.). Springer-Verlag, Berlin, H e l l e w e l l S. B., T a y lo r D. L., The contractile basis of ameboid movement. J. Cell Biol. 83, H in r ic h s e n R. D., Calcium and calmodulin in the control of cellular behavior and motilüy. Biochem. Biophys. Acta 1155, J a c o b R., 1990a. Calcium oscillations in electrically non-excitable cells. Biochem. Biophys. Acta 1052, J a c o b R., 1990b. Imaging cytoplasmic free calciwn in histamine stimulated endothelial cells and in JMet-Leu-Phe stimulated neutrophils. Cell Calcium 11, J a c o b R., M e r r i t t J. E., H a lla m T. J., R in K T. J., Repetitive spikes in cytoplasmic calcium evoked by histamine in human endothelial cells. Nature 335, J a f f e L. F., Source of calcium in egg activation: A review and hypothesis. Dev. Biol. 99, J a f f e L.F., Classes and mechanisms of calcium waves. Cell Calcium 14, J o h a n s s o n P., J o s e fs s o n J.-O., Evidence for a dual effect of intracellular Ca++ on pinocytosis. Acta Physiol. Scand. 102, 71A-72A. K a lin o s k i D. L., A ld in g e r S. B., B o y le A. G. i współaut., Characterization of a novel inositol 1,4,5-trisphosphate receptor in isolated olfactory cilia. Biochem. J. 281, K h an A. A., S t e in e r J. P., K le in M. G., S c h n e id e r M. F., S n y d e r S. H., IP3 receptor: localization to plasma membrane of T cells and cocapping wüh the T cell receptor. Science 257,
13 Rola wapnia w ruchu ameboidalnym 111 K itanishi-yum ura T., Fukui Y., A ctomyosin organization during cytokinesis: reversible translocation and differential redistribution in Dictyostelium. Cell Motil. Cytoskel. 12, K lo p o c k a W., G r ę b e c k a L., Effects of bivalent cations on the initiation ofna-induced pinocytosis in Amoeba proteus. Protoplasma 126, K lo p o c k a W. T., P o m o rs k i P., Cytoplasmic calcium transients in Amoeba proteus during induction of pinocytotic and non-pinocytotic rosettes. Eur. J. Cell Biol. K o r n E. D., Actin polymerization and its regulation by proteins from nonmuscle cells. Physiol. Rev. 62, K o r o h o d a W., Experimental induction of locomotion in enucleated fragments ofamoeba proteus and its bearing on the theories of amoeboid movement. Cytobiologie 14, K r u s k a l B. A., M a x f ie ld F. R., Cytosolic free calcium increases before and oscillates during frustrated phagocytosis in macrophages. J. Cell Biol. 105, KOHTREIBER M. JAFFE L. F., Detection of extracellular calcium gradients with a calcium-specific vibrating electrode. J. Cell. Biol. 110, K u r o d a K., Y o s h im o to Y., H ir a m o to Y., Temporal and spatial localization of Ca2+ in moving Amoeba proteus visualized with aequorin. Protoplasma 144, K u źn ick i L., Calmodulin regulated processes inprotistan motility. Acta Protozool. 25, K u żn ick i J., K o r d o w s k a J., Białka wiążące wapńjako markery stanów patologicznych. Kosmos 41, K u żn ick i J., K u źn ick i L., D ra b ik o w sk I W., Cc?*-regulation of motility and troponin C-like proteins in Protozoa and Myxomycete. Proceedings of the 6th Meeting of the European Muscle Club, Saclay, September, K u źn ick i J., K u żn ick i L., D ra b ik o w sk i W., Ca2+ -binding modulator protein in Protozoa and Myxomycete. Cell Biol. Int. Rep. 3, K w ia tk o w s k a J., Fosfolipidy inozytolowe w przetwarzaniu informacji w komórkach. Post. Biochem. 32, L e c h l e i t e r J., G ir a r d S., PERAura E., Clapham D., Spiral calcium wave propagation and annihilation inxenopus laevis oocytes. Science 252, Liu G., N e w e l l P. C., Evidence that cyclic GMP may regulate the association of myosin II heavy chain with the cytoskeleton by inhibiting its phosphorylation. J. Cell Sei. 98, Liu T., W illia m s J., C la r k e M., Inducible express ion of calmodulin antisense RNA in Dictyostelium cells inhibits the completion of cytokinesis. Mol. Biol. Cell 3, M a lc h o w D., B o iim e R., G r a s U., On the role of calcium in chemotaxis and oscillations of Dictyostelium cells. Biophys. Struct. Mech. 9, M a lc h o w D., N an ju n d iah V., W u r s t e r B., E c k s te in F., G e r is h G., Cyclic AMP-induced ph changes in Dictyostelium discoideum and their control by calcium. Biochim. Biophys. Acta 538, M a r k s P., H e n d e y B., M a x fie ld F., Attachment to ßbronectin or vitronectin makes human neutrophil migration sensitive to alterations in cytosolic free calcium concentration. J. Cell Biol. 112, M a r u t a H., B a lt e s W., D ie t e r P., M a rm e D., G e r is c ii G Myosin heavy chain kinase inactivated by Ca2*/calmodulin from aggregating cells of Dictyostelium discoideum. EMBO J. 2, M e a n s A.R., T a s h J. S., C h a fo u le a s J. G., Physiological implications of the presence, distribution and regulation of calmodulin in eukaryotic cells. Physiol. Rev. 62, M i t t a l A. K., B e r e it e r - H ahn J., Ionic control of locomotion and shape o f ephhelial cells. Cell Motil. 5, M iyazaki S., Repetitive calcium transients in hamster oocytes. Cell Calcium 12, M iyazaki S-L, H a sh im o to N., Y o s h im o to Y., K is h im o to T., Ig u s a Y., H ira m o to Y., Temporal and spatial dynamics of the periodic increase in intracellular free calcium at fertilization o f golden hamster eggs. Dev. Biol. 118, M o c k r in S. C., K o r n E. D., Acanthamoebaprofllin interacts with G-actin to increase the rate of exchange of actin-bound adenosine 5'-Triphosphate. Boichemistry 19, N ach m ias V. T., Fukui Y., S p u d ich J. A., Chemoattractant-elicited translocation of myosin in motile Dictyostelium. Cell Motil. Cytoskel. 13, N u c c it e lli R., P o o M-M., J a f f e L. F., Relations between ameboid movement and membranecontrolled electrical currents. J. Gen. Physiol. 69, O num a E. K., H u i S. W., Electricfield-directed cell shape changes, displacement and cytoskeletal reorganization are calcium dependent. J. Cell Biol. 106, P o d d a n a H., B a ra ń s k a J., Udział polifosfoinozytoli w przetwarzaniu informacji w komórkach. Post. Biochem. 37, 2-5.
14 112 W and a K łopocka P o lla r d T. D., K o rn T. D., Acanthamoeba myosin. J. Biol. Chem. 248, Pu tn ey J. W. (Jr), Capacitalive calcium entry revisited. Cell Calcium 11, Pu tn ey J. W. (Jr.), Excitement about calcium signaling in inexcitable cells. Science 262, R andriam am pita C., T s ie n R. Y., Emptying of intracellular Ca2+ stores releases a novel small messenger that stimulates Ca2+ influx. Nature 364, R e ic h s te in E., K o r n E. D., Acanthamoeba profilin: protein of low molecular weight from Acanthamoeba castellanii that inhibits actin nucleation. J. Biol. Chem. 254, R e in o ld M., S tock em W., Darstellung eines ATP-sensitiven Membransystems mit Ca2+-transportierender Funktion bei Amöben. Cytobiologie 6, R e s t r e p o D., M iy a m o to T., B r y a n t B.P., T e e t e r J. H., Odor stimulus tigger influx o f calcium into olfactory neurons of the channel catfish. Science 249, R o o n e y T. A., S a s s E., Th om as A. P., Agonist-induced cytosolic calcium oscillations originate from a specific locus in single hepatocytes. J. Biol. Chem. 265, R o o n e y T. A., T h om as A. P., Intracellular calcium waves generated by Ins(l,4,5)P3-dependent mechanisms. Cell Calcium 14, S a ra n S., N a k a o H., T a sa k a M., Iid a H., Tsuji F.I., N an ju n d iah V., T a k e u c h i I., Intracellular free calcium level and its response to camp stimulation in developing Dictyostelium cells transformed with jellyfish apoaequorin cdna. FEBS Letters 337, S ch liw a M., Proteins associated wäll cytoplasmic actin. Cell 25, S e w y e r D.W., S u lliv a n J. A., M a n d e ll G. L., Intracellularfree calcium localization in neutrophils during phagocytosis. Science 230, S o b o t a A., Subplasmalemmal calcium-binding microregions in Acanthamoeba J. Cell Sei. 79, S o b o t a A., H r e b e n d a B., P r z e łę c k a A., Formation of calcium-dependent deposits at the plasma membrane of Acanthamoeba castellanii. Cytobiol. 15, S o b o t a A., P r z e ł ę c k a A., J a n o s s y A. G. S., X-ray microanalysis of calcium-dependent deposists at the plasma membrane of Acanthamoeba castellanii. Cytobiol. 17, S o n o b e S., H a ta n o S., K u r o d a K., Cytoplasmic movement in a glycerinated model of Amoeba proteus. [W:] Cell motility: Mechanism and Regulation. Ishikaw a H., H a ta n o S., S a t o H. (red.). University of Tokyo Press, Tokyo, S o n o b e S.,T a k a h a s h is., H a ta n o S., K u r o d a K., Phosphorylation ofamoeba G-actin and its effect on actin polymerization. J. Biol. Chem. 261, S p u d ich J. A., In pursuit of myosinfunction. Cell Regln. 1, S to c k e m W., H o ffm a n n H. U., Microfllament organization and function in Amoeba proteus. Acta Protozool. 25, S to c k e m W., K le in H-P., Pinocytosis and locomotion in amoebae. XV. Demonstration of Ca++-binding sites during induced pinocytosis in Amoeba proteus. Protoplasma 100, S to c k e m W., K le in H. P., Pinocytosis and Locomotion of Amoebae XVII. Influence of different cations on induced pinocytosis in Amoeba proteus. Europ. J. Protisol. 23, S to c k e m W., K ło p o c k a W., Ameboid movement and related phenomena Int. Rev. Cyt. 112, S t r o h m e ie r R., B e r e it e r - H a h n J., Controlof cell shape and locomotion by external calcium. Exp. Cell Res. 154, S t u l l J., Myosin light chain kinase and caldesmon: biochemical properties arid roles in skeletal and smooth muscle. [W:] Calmodulin. C oh en P, K le e C. (red.). Elsevier, New York, S z e n t - G y o r g y i A. G., S z e n t k ir a le y E. M., K e n d r ic k -J o n e s J., The light chains of scallop myosin as regulatory subunits. J. Mol. Biol. 74, T a y l o r D. L., B lin k s J. R., R e y n o ld s G., Contractile basis of ameboid movement. VIII. Aequorin luminescence during ameboid movement, endocytosis, and capping. J. Cell Biol. 86, T a y l o r D. L., C o n d e e lis J. S., Cytoplasmic structure and contractility in amoeboid cells. Int. Rev. Cytol. 56, T a y lo r D. L., C o n d e e lis J. S., M o o r e P. L., A lle n R. D., The contractile basis o f ameboid movement. I. The chemical control of motility in isolated cytoplasm. J. Cell Biol. 59, T a y lo r D. L., F e c h h e im e r M., Cytoplasmic structure and contractility: the solation-contraction coupling hypothesis. Ohil. Trans. R. Soc. Lond. B299, T a y lo r D. L., H e l l e w e l l S. B., V ir g in H. W., H e ip le J., The solation-contraction coupling hypothesis of cell movement. [W:] Cell Motility: Molecules and Organization. H atano S., Ishikawa H., Sato H., (red.). University of Tokyo Press, Tokyo,
15 Rola wapnia w ruchu ameboidalnym 113 T a y l o r D. L., M o o r e P. L., C o n d e e lis J. S., A l l e n R. D., The mechanochemical basis o f amoeboid movement I. Ionic requirements for maintaining viscoelasticity and contractility of ameba cytoplasm. Exp. Cell Res. 101, T a y lo r E.W., Cell motüity. J. Cell Sci. Suppl. 4, T h e r i o t J. A., M e tc h is o n T. J., Actin microfilament dynamics in locomoting cells. Nature 352, T re ty n A., Wapń w komórkach eukariotycznych występowanie, transport i komórkowy mechanizm działania Skupińska M. (red). Wydawnictwo Naukowe PWN, Warszawa. T r u e t t A. P., VERGHESE M. V., D illo n R. B., S nyd erm an R., Calcium influx stimulates a second pathway for sustained diacylglycerol production in leukocytes activated by chemoattractants. Proc. Natl. Acad. Sei. USA 85, T s ie n R. W., T s ie n R. Y., Calcium channels, stores, and oscillations. Annu. Rev. Cell Biol. 6, T s ie n R. Y., P o e n ie M., Fluorescence ratio imaging: a new window into intracellular ionic signaling. Trends Biochem. Sei. 11, W ic k U., M a lc h o w D., G e r is c h G., Cyclic-AMP stimulated calcium influx into aggregating cells of Dictyostelium discoideum. Cell Biol. Int. Rep. 2, W illia m s D. A., Mechanisms of calcium release and propagation in cardiac cells. Do studies with confocal microscopy add to our understanding? Cell Calcium 14, W o o d s N. M., C u th b e r s o n K. S. R., C o b b o ld P. H., Agonist-induced oscillations in cytoplasmic free calcium concentration in single rat hepatocytes. Cell Calcium 8, W o o d s N. M., C u th b e r s o n K. S. R., C o b b o ld P. H., Repetitive transient rises in cytoplasmic free calcium in hormone-stimulated hepatocytes. Nature 319, Y u m u ra S., Fukui Y., Reversible cyclic AMP-dependent change in distribution of myosin thick filaments in Dictyostelium. Nature 314, Y u m u ra S., K ita n ish i-y u m u ra T., A mechanism for the intracellular localization of myosin II filaments in the Dictyostelium amoeba J. Cell Sei. 105, Y u m u ra S., M o r i H., Fukui Y., Localization of actin and myosin for the study of amoeboid movement in Dictyostelium using improved immunofluorescence. J. Cell Biol. 99, Kosmos
ROLA WAPNIA W FIZJOLOGII KOMÓRKI
 ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
Tom 50, 2001 Numer 3 (252) Strony reoblemy NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika
 Kosm os Tom 50, 2001 Numer 3 (252) Strony 233-241 reoblemy NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika WANDA KŁOPOCKA Zakład Biologii Komórki Instytut Biologii Doświadczalnej im.
Kosm os Tom 50, 2001 Numer 3 (252) Strony 233-241 reoblemy NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika WANDA KŁOPOCKA Zakład Biologii Komórki Instytut Biologii Doświadczalnej im.
o d ro z m ia r u /p o w y ż e j 1 0 c m d ł c m śr e d n ic y 5 a ) o ś r e d n ic y 2,5 5 c m 5 b ) o śr e d n ic y 5 c m 1 0 c m 8
 T A B E L A O C E N Y P R O C E N T O W E J T R W A Ł E G O U S Z C Z E R B K U N A Z D R O W IU R o d z a j u s z k o d z e ń c ia ła P r o c e n t t r w a łe g o u s z c z e r b k u n a z d r o w iu
T A B E L A O C E N Y P R O C E N T O W E J T R W A Ł E G O U S Z C Z E R B K U N A Z D R O W IU R o d z a j u s z k o d z e ń c ia ła P r o c e n t t r w a łe g o u s z c z e r b k u n a z d r o w iu
Transport przez błony
 Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Potencjał spoczynkowy i czynnościowy
 Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Kosm os. PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika
 Kosm os Tom 49, 2000 Numer 4 (249) Strony 571-581 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika A n d r z e j G r ę b e c k i Zakład Biologii Komórki Instytut Biologii Doświadczalnej
Kosm os Tom 49, 2000 Numer 4 (249) Strony 571-581 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika A n d r z e j G r ę b e c k i Zakład Biologii Komórki Instytut Biologii Doświadczalnej
Kosmos PROBLEMY NAUK BIOLOGICZNYCH. POJEMNOŚCIOWA TEORIA WNIKANIA JONOW WAPNIA DO KOMÓREK NIEPOBUDLIWYCH. FAKTY i HIPOTEZY
 Kosmos PROBLEMY NAUK BIOLOGICZNYCH Tom 46, 1997 Numer 4 (237) Strony 483-489 Polskie Towarzystwo Przyrodników im. Kopernika K r z y s z t o f P r z y b y t e k, R a f a ł C z a j k o w s k i, Pa w e ł
Kosmos PROBLEMY NAUK BIOLOGICZNYCH Tom 46, 1997 Numer 4 (237) Strony 483-489 Polskie Towarzystwo Przyrodników im. Kopernika K r z y s z t o f P r z y b y t e k, R a f a ł C z a j k o w s k i, Pa w e ł
Nukleotydy w układach biologicznych
 Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski. Instytut Farmakologii Polskiej Akademii Nauk, ul.
 Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski Instytut Farmakologii Polskiej Akademii Nauk, ul. Smętna 12, Kraków Plan prezentacji: Cel naukowy Podstawy teoretyczne Przyjęta metodyka
Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski Instytut Farmakologii Polskiej Akademii Nauk, ul. Smętna 12, Kraków Plan prezentacji: Cel naukowy Podstawy teoretyczne Przyjęta metodyka
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu
 Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
Przemiana materii i energii - Biologia.net.pl
 Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
CYTOSZKIELET CYTOSZKIELET
 CYTOSZKIELET Sieć włókienek białkowych; struktura wysoce dynamiczna Filamenty aktynowe Filamenty pośrednie Mikrotubule Fibroblast CYTOSZKIELET 1 CYTOSZKIELET 7nm 10nm 25nm Filamenty pośrednie ich średnica
CYTOSZKIELET Sieć włókienek białkowych; struktura wysoce dynamiczna Filamenty aktynowe Filamenty pośrednie Mikrotubule Fibroblast CYTOSZKIELET 1 CYTOSZKIELET 7nm 10nm 25nm Filamenty pośrednie ich średnica
Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH
 Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą na temat pomiarów elektrofizjologicznych żywych komórek metodą Patch
Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą na temat pomiarów elektrofizjologicznych żywych komórek metodą Patch
Filamenty aktynowe ORGANIZACJA CYTOPLAZMY. komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe
 Filamenty aktynowe ORGANIZACJA CYTOPLAZMY komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe Cytoszkielet aktynowy G-aktyna 370 aminokwasów 42 43 kda izoformy:
Filamenty aktynowe ORGANIZACJA CYTOPLAZMY komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe Cytoszkielet aktynowy G-aktyna 370 aminokwasów 42 43 kda izoformy:
Polskie Towarzystwo Przyrodników Im. KOPERNIKA ROLA CYTOSZKIELETU W ENDOCYTOZIE W KOMÓRKACH TKANKOWYCH I PINOCYTOZIE U AMEB
 1996, 45 (1): 43-56 PL ISSN 0023-4249 Polskie Towarzystwo Przyrodników Im. KOPERNIKA KOSMOS W a n d a K ł o p o c k a Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Zakład Biologii Komórki Pasteura
1996, 45 (1): 43-56 PL ISSN 0023-4249 Polskie Towarzystwo Przyrodników Im. KOPERNIKA KOSMOS W a n d a K ł o p o c k a Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Zakład Biologii Komórki Pasteura
Tkanka nerwowa. neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające)
 Tkanka nerwowa neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające) Sygnalizacja w komórkach nerwowych 100 tys. wejść informacyjnych przyjmowanie sygnału przewodzenie
Tkanka nerwowa neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające) Sygnalizacja w komórkach nerwowych 100 tys. wejść informacyjnych przyjmowanie sygnału przewodzenie
MECHANIZMY RUCHÓW KOMÓRKOWYCH - DZIAŁANIE ANESTETYKÓW NA KOMÓRKI
 MECHANIZMY RUCHÓW KOMÓRKOWYCH - DZIAŁANIE ANESTETYKÓW NA KOMÓRKI Zakres materiału, który naleŝy przygotować do ćwiczeń: 1) Budowa błony komórkowej 2) Mechanizm działania anestetyków 3) Aktywność ruchowa
MECHANIZMY RUCHÓW KOMÓRKOWYCH - DZIAŁANIE ANESTETYKÓW NA KOMÓRKI Zakres materiału, który naleŝy przygotować do ćwiczeń: 1) Budowa błony komórkowej 2) Mechanizm działania anestetyków 3) Aktywność ruchowa
Rola białek z rodziny Rho w kontroli migracji komórek pełzających
 Rola białek z rodziny Rho w kontroli migracji komórek pełzających Wanda Kłopocka * Jolanta Barańska Pracownia Przekaźników Sygnałów, Instytut Biologii Doświadczalnej im. M. Nenckiego, Warszawa * Pracownia
Rola białek z rodziny Rho w kontroli migracji komórek pełzających Wanda Kłopocka * Jolanta Barańska Pracownia Przekaźników Sygnałów, Instytut Biologii Doświadczalnej im. M. Nenckiego, Warszawa * Pracownia
Właściwości błony komórkowej
 płynność asymetria Właściwości błony komórkowej selektywna przepuszczalność Płynność i stan fazowy - ruchy rotacyjne: obrotowe wokół długiej osi cząsteczki - ruchy fleksyjne zginanie łańcucha alifatycznego
płynność asymetria Właściwości błony komórkowej selektywna przepuszczalność Płynność i stan fazowy - ruchy rotacyjne: obrotowe wokół długiej osi cząsteczki - ruchy fleksyjne zginanie łańcucha alifatycznego
BIOLOGIA KOMÓRKI. Mechanizmy ruchów komórkowych wpływ anestetyków na komórki.
 BIOLOGIA KOMÓRKI Mechanizmy ruchów komórkowych wpływ anestetyków na komórki. Wstęp 1. Migracja komórek Aktywna migracja komórek jest procesem mającym fundamentalne znaczenie dla całego świata Ŝywego. Począwszy
BIOLOGIA KOMÓRKI Mechanizmy ruchów komórkowych wpływ anestetyków na komórki. Wstęp 1. Migracja komórek Aktywna migracja komórek jest procesem mającym fundamentalne znaczenie dla całego świata Ŝywego. Począwszy
Echa Przeszłości 11,
 Irena Makarczyk Międzynarodowa Konferencja: "Dzieje wyznaniowe obu części Prus w epoce nowożytnej: region Europy Wschodniej jako obszar komunikacji międzywyznaniowej", Elbląg 20-23 września 2009 roku Echa
Irena Makarczyk Międzynarodowa Konferencja: "Dzieje wyznaniowe obu części Prus w epoce nowożytnej: region Europy Wschodniej jako obszar komunikacji międzywyznaniowej", Elbląg 20-23 września 2009 roku Echa
Mięśnie. dr Magdalena Markowska
 Mięśnie dr Magdalena Markowska Zjawisko ruchu 1) Jako możliwość przemieszczania przestrzennego mięśnie poprzecznie prążkowane 2) Pompa serce 3) Jako podstawa do utrzymywania czynności życiowych mięśnie
Mięśnie dr Magdalena Markowska Zjawisko ruchu 1) Jako możliwość przemieszczania przestrzennego mięśnie poprzecznie prążkowane 2) Pompa serce 3) Jako podstawa do utrzymywania czynności życiowych mięśnie
Składniki cytoszkieletu. Szkielet komórki
 Składniki cytoszkieletu. Szkielet komórki aktynowe pośrednie aktynowe pośrednie 1 Elementy cytoszkieletu aktynowe pośrednie aktynowe filamenty aktynowe inaczej mikrofilamenty filamenty utworzone z aktyny
Składniki cytoszkieletu. Szkielet komórki aktynowe pośrednie aktynowe pośrednie 1 Elementy cytoszkieletu aktynowe pośrednie aktynowe filamenty aktynowe inaczej mikrofilamenty filamenty utworzone z aktyny
Kosm os PROBLEMY NAUK BIOLOGICZNYCH. KANAŁY UWALNIAJĄCE JONY WAPNIA Z BŁON WEWNĘTRZNYCH. Tom 46, 1997 Numer 4 (237) Strony
 Kosm os PROBLEMY NAUK BIOLOGICZNYCH. Tom 46, 1997 Numer 4 (237) Strony 515-522 Polskie Towarzystwo Przyrodników im. Kopernika W ie s ł a w a L e ś n ia k Zakład Neurobiologii Molekularnej i Komórkowej
Kosm os PROBLEMY NAUK BIOLOGICZNYCH. Tom 46, 1997 Numer 4 (237) Strony 515-522 Polskie Towarzystwo Przyrodników im. Kopernika W ie s ł a w a L e ś n ia k Zakład Neurobiologii Molekularnej i Komórkowej
Droga impulsu nerwowego w organizmie człowieka
 Droga impulsu nerwowego w organizmie człowieka Impuls nerwowy Impuls nerwowy jest zjawiskiem elektrycznym zachodzącym na powierzchni komórki nerwowej i pełni podstawową rolę w przekazywaniu informacji
Droga impulsu nerwowego w organizmie człowieka Impuls nerwowy Impuls nerwowy jest zjawiskiem elektrycznym zachodzącym na powierzchni komórki nerwowej i pełni podstawową rolę w przekazywaniu informacji
Gdyńskim Ośrodkiem Sportu i Rekreacji jednostka budżetowa
 Z a ł» c z n i k n r 5 d o S p e c y f i k a c j i I s t o t n y c h W a r u n k Zó aw m ó w i e n i a Z n a k s p r a w y G O S I R D Z P I 2 7 1 0 1 1 2 0 14 W Z Ó R U M O W Y z a w a r t a w Gd y n
Z a ł» c z n i k n r 5 d o S p e c y f i k a c j i I s t o t n y c h W a r u n k Zó aw m ó w i e n i a Z n a k s p r a w y G O S I R D Z P I 2 7 1 0 1 1 2 0 14 W Z Ó R U M O W Y z a w a r t a w Gd y n
PIERWOTNIAKI W BADANIACH BIOCHEMICZNYCH I GENETYCZNYCH. b o n s 1963, 1965) doprowadziły do ustalenia, że
 Kosm os Tom 49, 2000 Numer 4 (249) Strony 583-587 PROBLEMY NAUKBIÓLOGICZNYĆH Polskie Towarzystwo Przyrodników im. Kopernika Ma r ia J o l a n t a R ę d o w ic z Zakład Biochemii Mięśni Instytut Biologii
Kosm os Tom 49, 2000 Numer 4 (249) Strony 583-587 PROBLEMY NAUKBIÓLOGICZNYĆH Polskie Towarzystwo Przyrodników im. Kopernika Ma r ia J o l a n t a R ę d o w ic z Zakład Biochemii Mięśni Instytut Biologii
Błona komórkowa grubość od 50 do 100 A. Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne
 Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Dywergencja/konwergencja połączeń między neuronami
 OD NEURONU DO SIECI: MODELOWANIE UKŁADU NERWOWEGO Własności sieci, plastyczność synaps Stefan KASICKI SWPS, SPIK wiosna 2007 s.kasicki@nencki.gov.pl Dywergencja/konwergencja połączeń między neuronami 1
OD NEURONU DO SIECI: MODELOWANIE UKŁADU NERWOWEGO Własności sieci, plastyczność synaps Stefan KASICKI SWPS, SPIK wiosna 2007 s.kasicki@nencki.gov.pl Dywergencja/konwergencja połączeń między neuronami 1
Tkanka mięśniowa. Bogdan Walkowiak. Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka. 7 listopada 2014 Biofizyka 1
 Wykład 5 Tkanka mięśniowa Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka 7 listopada 2014 Biofizyka 1 Trzy typy mięśni Mięśnie szkieletowe (Poprzecznie prążkowane)
Wykład 5 Tkanka mięśniowa Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka 7 listopada 2014 Biofizyka 1 Trzy typy mięśni Mięśnie szkieletowe (Poprzecznie prążkowane)
Transport pęcherzykowy
 Transport pęcherzykowy sortowanie przenoszonego materiału zachowanie asymetrii zachowanie odrębności organelli precyzyjne oznakowanie Transport pęcherzykowy etapy transportu Transport pęcherzykowy przemieszczanie
Transport pęcherzykowy sortowanie przenoszonego materiału zachowanie asymetrii zachowanie odrębności organelli precyzyjne oznakowanie Transport pęcherzykowy etapy transportu Transport pęcherzykowy przemieszczanie
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Współczynnik przepuszczalności [cm/s] RóŜnice składu jonowego między wnętrzem komórki ssaka a otoczeniem
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Współczynnik przepuszczalności [cm/s] RóŜnice składu jonowego między wnętrzem komórki ssaka a otoczeniem
Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie
 Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI. Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
Błona komórkowa grubość od 50 do 100 A. Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne
 Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Ca2+ JAKO WTÓRNY PRZEKAŹNIK INFORMACJI
 KOSMOS 1993,42(3/4): str 557-564 JOLANTA BARAŃSKA Instytut Biologii Doświadczalnej im. M. Nenckiego PAN, Zakład Biochemii Komórki Warszawa Ca2+ JAKO WTÓRNY PRZEKAŹNIK INFORMACJI Badania ostatnich dwudziestu
KOSMOS 1993,42(3/4): str 557-564 JOLANTA BARAŃSKA Instytut Biologii Doświadczalnej im. M. Nenckiego PAN, Zakład Biochemii Komórki Warszawa Ca2+ JAKO WTÓRNY PRZEKAŹNIK INFORMACJI Badania ostatnich dwudziestu
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski
 biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
Komórka eukariotyczna organizacja
 Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma podstawowa (cytozol) organelle cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma podstawowa (cytozol) organelle cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja
 Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma organelle podstawowa (cytozol) cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma organelle podstawowa (cytozol) cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Gdyńskim Ośrodkiem Sportu i Rekreacji jednostka budżetowa
 W Z Ó R U M O W Y z a w a r t a w G d y n i w d n i u 2 0 1 4 r po m i d z y G d y s k i m O r o d k i e m S p o r t u i R e k r e a c j i j e d n o s t k a b u d e t o w a ( 8 1-5 3 8 G d y n i a ), l
W Z Ó R U M O W Y z a w a r t a w G d y n i w d n i u 2 0 1 4 r po m i d z y G d y s k i m O r o d k i e m S p o r t u i R e k r e a c j i j e d n o s t k a b u d e t o w a ( 8 1-5 3 8 G d y n i a ), l
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Ruch i mięśnie. dr Magdalena Markowska
 Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Rozdział 1. Nazwa i adres Zamawiającego Gdyński Ośrodek Sportu i Rekreacji jednostka budżetowa Rozdział 2.
 Z n a k s p r a w y G O S I R D Z P I 2 7 1 0 3 12 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A f O b s ł u g a o p e r a t o r s k aw r a z z d o s t a w» s p r
Z n a k s p r a w y G O S I R D Z P I 2 7 1 0 3 12 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A f O b s ł u g a o p e r a t o r s k aw r a z z d o s t a w» s p r
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej)
 PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej) Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt do wykładu
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej) Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt do wykładu
ENDOCYTOZA U PIERWOTNIAKÓW I W KOMÓRKACH TKANKOWYCH WPROWADZENIE ENDOCYTOZA KLATRYNOWA. s o n 1994). Endocytoza receptorowa polega na
 Kosm os PROBLEMY NAUK BIOLOGICZNYCH Tom 49, 2000 Numer 4 (249) Strony 589-602 Polskie Towarzystwo Przyrodników im. Kopernika W a n d a K ł o p o c k a Zakład. Biologii Komórki Instytut Biologii Doświadczalnej
Kosm os PROBLEMY NAUK BIOLOGICZNYCH Tom 49, 2000 Numer 4 (249) Strony 589-602 Polskie Towarzystwo Przyrodników im. Kopernika W a n d a K ł o p o c k a Zakład. Biologii Komórki Instytut Biologii Doświadczalnej
Transportowane cząsteczki CO O, 2, NO, H O, etanol, mocznik... Zgodnie z gradientem: stężenia elektrochemicznym gradient stężeń
 Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
Budowa i funkcje komórek nerwowych
 Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Opis i zakres czynności sprzątania obiektów Gdyńskiego Centrum Sportu
 O p i s i z a k r e s c z y n n o c is p r z» t a n i a o b i e k t ó w G d y s k i e g o C e n t r u m S p o r t u I S t a d i o n p i ł k a r s k i w G d y n i I A S p r z» t a n i e p r z e d m e c
O p i s i z a k r e s c z y n n o c is p r z» t a n i a o b i e k t ó w G d y s k i e g o C e n t r u m S p o r t u I S t a d i o n p i ł k a r s k i w G d y n i I A S p r z» t a n i e p r z e d m e c
M AKRO FAGI M IG RU JĄCE I FAGOCYTUJĄCE KOM ÓRKI UKŁADU OBRONNEGO
 KOSMOS 1992, 41(1): 51 62 JO AN N A K O ŁO D ZIEJC ZYK Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Warszawa M AKRO FAGI M IG RU JĄCE I FAGOCYTUJĄCE KOM ÓRKI UKŁADU OBRONNEGO Makrofagi, należące
KOSMOS 1992, 41(1): 51 62 JO AN N A K O ŁO D ZIEJC ZYK Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Warszawa M AKRO FAGI M IG RU JĄCE I FAGOCYTUJĄCE KOM ÓRKI UKŁADU OBRONNEGO Makrofagi, należące
CYTOSZKIELET CYTOSZKIELET Cytoplazma podstawowa (macierz cytoplazmatyczna) Komórka eukariotyczna. cytoplazma + jądro komórkowe.
 Komórka eukariotyczna cytoplazma + jądro komórkowe (układ wykonawczy) cytoplazma podstawowa (cytozol) Cytoplazma złożony koloid wodny cząsteczek i makrocząsteczek (centrum informacyjne) organelle i kompleksy
Komórka eukariotyczna cytoplazma + jądro komórkowe (układ wykonawczy) cytoplazma podstawowa (cytozol) Cytoplazma złożony koloid wodny cząsteczek i makrocząsteczek (centrum informacyjne) organelle i kompleksy
Fizjologia nauka o czynności żywego organizmu
 nauka o czynności żywego organizmu Stanowi zbiór praw, jakim podlega cały organizm oraz poszczególne jego układy, narządy, tkanki i komórki prawa rządzące żywym organizmem są wykrywane doświadczalnie określają
nauka o czynności żywego organizmu Stanowi zbiór praw, jakim podlega cały organizm oraz poszczególne jego układy, narządy, tkanki i komórki prawa rządzące żywym organizmem są wykrywane doświadczalnie określają
Układ ruchu, skóra Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka.
 Układ ruchu, skóra Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
Układ ruchu, skóra Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
z d n i a 2 3. 0 4.2 0 1 5 r.
 C h o r ą g i e w D o l n o l ą s k a Z H P I. P o s t a n o w i e n i a p o c z ą t k o w e U c h w a ł a n r 1 5 / I X / 2 0 1 5 K o m e n d y C h o r ą g w i D o l n o l ą s k i e j Z H P z d n i a
C h o r ą g i e w D o l n o l ą s k a Z H P I. P o s t a n o w i e n i a p o c z ą t k o w e U c h w a ł a n r 1 5 / I X / 2 0 1 5 K o m e n d y C h o r ą g w i D o l n o l ą s k i e j Z H P z d n i a
SPECYFIKACJA ISTOTNYCH WARUNKÓW ZAMÓWIENIA
 Z a m a w i a j» c y G D Y S K I O R O D E K S P O R T U I R E K R E A C J I J E D N O S T K A B U D E T O W A 8 1 5 3 8 G d y n i a, u l O l i m p i j s k a 5k 9 Z n a k s p r a w y G O S I R D Z P I
Z a m a w i a j» c y G D Y S K I O R O D E K S P O R T U I R E K R E A C J I J E D N O S T K A B U D E T O W A 8 1 5 3 8 G d y n i a, u l O l i m p i j s k a 5k 9 Z n a k s p r a w y G O S I R D Z P I
I n f o r m a c j e n a t e m a t p o d m i o t u k t ó r e m u z a m a w i a j» c y p o w i e r z y łk p o w i e r z y l i p r o w a d z e p o s t p
 A d r e s s t r o n y i n t e r n e t o w e j, n a k t ó r e j z a m i e s z c z o n a b d z i e s p e c y f i k a c j a i s t o t n y c h w a r u n k ó w z a m ó w i e n i a ( j e e ld io t y c z y )
A d r e s s t r o n y i n t e r n e t o w e j, n a k t ó r e j z a m i e s z c z o n a b d z i e s p e c y f i k a c j a i s t o t n y c h w a r u n k ó w z a m ó w i e n i a ( j e e ld io t y c z y )
biologia w gimnazjum OBWODOWY UKŁAD NERWOWY
 biologia w gimnazjum 2 OBWODOWY UKŁAD NERWOWY BUDOWA KOMÓRKI NERWOWEJ KIERUNEK PRZEWODZENIA IMPULSU NEROWEGO DENDRYT ZAKOŃCZENIA AKSONU CIAŁO KOMÓRKI JĄDRO KOMÓRKOWE AKSON OSŁONKA MIELINOWA Komórka nerwowa
biologia w gimnazjum 2 OBWODOWY UKŁAD NERWOWY BUDOWA KOMÓRKI NERWOWEJ KIERUNEK PRZEWODZENIA IMPULSU NEROWEGO DENDRYT ZAKOŃCZENIA AKSONU CIAŁO KOMÓRKI JĄDRO KOMÓRKOWE AKSON OSŁONKA MIELINOWA Komórka nerwowa
THE UNFOLDED PROTEIN RESPONSE
 THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
Cezary Michalski, Larysa Głazyrina, Dorota Zarzeczna Wykorzystanie walorów turystycznych i rekreacyjnych gminy Olsztyn
 Cezary Michalski, Larysa Głazyrina, Dorota Zarzeczna Wykorzystanie walorów turystycznych i rekreacyjnych gminy Olsztyn Prace Naukowe Akademii im. Jana Długosza w Częstochowie. Kultura Fizyczna 7, 215-223
Cezary Michalski, Larysa Głazyrina, Dorota Zarzeczna Wykorzystanie walorów turystycznych i rekreacyjnych gminy Olsztyn Prace Naukowe Akademii im. Jana Długosza w Częstochowie. Kultura Fizyczna 7, 215-223
Organizacja tkanek - narządy
 Organizacja tkanek - narządy Architektura skóry tkanki kręgowców zbiór wielu typów komórek danej tkanki i spoza tej tkanki (wnikają podczas rozwoju lub stale, w trakcie Ŝycia ) neurony komórki glejowe,
Organizacja tkanek - narządy Architektura skóry tkanki kręgowców zbiór wielu typów komórek danej tkanki i spoza tej tkanki (wnikają podczas rozwoju lub stale, w trakcie Ŝycia ) neurony komórki glejowe,
Rozdział 1. Nazwa i adres Zamawiającego Gdyński Ośrodek Sportu i Rekreacji jednostka budżetowa Rozdział 2.
 Z n a k s p r a w y G O S I R D Z P I 2 7 1 03 3 2 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A f U d o s t p n i e n i e t e l e b i m ó w i n a g ł o n i e n i
Z n a k s p r a w y G O S I R D Z P I 2 7 1 03 3 2 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A f U d o s t p n i e n i e t e l e b i m ó w i n a g ł o n i e n i
Homeostaza wapnia w komórce zwierzęcej w zarysie
 Homeostaza wapnia w komórce zwierzęcej w zarysie Streszczenie Jony wapnia są wszechstronnym i uniwersalnym przekaźnikiem sygnału uczestniczącym w regulacji niemal wszystkich procesów życiowych komórki.
Homeostaza wapnia w komórce zwierzęcej w zarysie Streszczenie Jony wapnia są wszechstronnym i uniwersalnym przekaźnikiem sygnału uczestniczącym w regulacji niemal wszystkich procesów życiowych komórki.
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej
 Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Podział komórkowy u bakterii
 Mitoza Podział komórkowy u bakterii Najprostszy i najszybszy podział komórkowy występuje u bakterii, które nie mają jądra komórkowego, lecz jedynie pojedynczy chromosom tzw. chromosom bakteryjny. Podczas
Mitoza Podział komórkowy u bakterii Najprostszy i najszybszy podział komórkowy występuje u bakterii, które nie mają jądra komórkowego, lecz jedynie pojedynczy chromosom tzw. chromosom bakteryjny. Podczas
Biorytmy, sen i czuwanie
 Biorytmy, sen i czuwanie Rytmika zjawisk biologicznych określana jako biorytm przyporządkowuje zmiany stanu organizmu do okresowych zmian otaczającego środowiska. Gdy rytmy biologiczne mają charakter wewnątrzustrojowy
Biorytmy, sen i czuwanie Rytmika zjawisk biologicznych określana jako biorytm przyporządkowuje zmiany stanu organizmu do okresowych zmian otaczającego środowiska. Gdy rytmy biologiczne mają charakter wewnątrzustrojowy
Krwiobieg duży. Krwiobieg mały
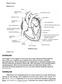 Mięsień sercowy Budowa serca Krązenie krwi Krwiobieg duży Krew (bogata w tlen) wypływa z lewej komory serca przez zastawkę aortalną do głównej tętnicy ciała, aorty, rozgałęzia się na mniejsze tętnice,
Mięsień sercowy Budowa serca Krązenie krwi Krwiobieg duży Krew (bogata w tlen) wypływa z lewej komory serca przez zastawkę aortalną do głównej tętnicy ciała, aorty, rozgałęzia się na mniejsze tętnice,
9 6 6 0, 4 m 2 ), S t r o n a 1 z 1 1
 O p i s p r z e d m i o t u z a m ó w i e n i a - z a k r e s c z y n n o c i f U s ł u g i s p r z» t a n i a o b i e k t ó w G d y s k i e g o O r o d k a S p o r t u i R e ks r e a c j i I S t a d i
O p i s p r z e d m i o t u z a m ó w i e n i a - z a k r e s c z y n n o c i f U s ł u g i s p r z» t a n i a o b i e k t ó w G d y s k i e g o O r o d k a S p o r t u i R e ks r e a c j i I S t a d i
Układ ruchu Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka.
 Układ ruchu Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
Układ ruchu Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
Rozdział 1. Nazwa i adres Zamawiającego Gdyński Ośrodek Sportu i Rekreacji jednostka budżetowa Rozdział 2.
 Z n a k s p r a w y G O S i R D Z P I 2 7 1 0 3 62 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A Z a p e w n i e n i e z a s i l a n i ea n e r g e t y c z ne g o
Z n a k s p r a w y G O S i R D Z P I 2 7 1 0 3 62 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A Z a p e w n i e n i e z a s i l a n i ea n e r g e t y c z ne g o
Dr. habil. Anna Salek International Bio-Consulting 1 Germany
 1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
BIOLOGIA KOMÓRKI. Ocena końcowa z kursu będzie liczona jako: 20% oceny z ćwiczeń 80% oceny z egzaminu
 BIOLOGIA KOMÓRKI Ocena końcowa z kursu będzie liczona jako: 20% oceny z ćwiczeń 80% oceny z egzaminu Charakterystyka kursu: 30 godzin wykładów 60 godzin ćwiczeń Ćwiczenia - zasady zaliczenia: uczestniczenie
BIOLOGIA KOMÓRKI Ocena końcowa z kursu będzie liczona jako: 20% oceny z ćwiczeń 80% oceny z egzaminu Charakterystyka kursu: 30 godzin wykładów 60 godzin ćwiczeń Ćwiczenia - zasady zaliczenia: uczestniczenie
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN
 MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
Í ń ę ń Í ę ź ę ń ľ ń ć ę ę ľ ń ę ľ ć
 ń Í ń ę ń Í ę ź ę ń ľ ń ć ę ę ľ ń ę ľ ć Í ń Ó Ń Ń Ń Ó ľ ęż Ń Á ęż Ń Ą ę Ż ć ę ę Ż ć ę ć Ś ę ę Ś Ż Ż Ż Ż ę ę Ż ń Ż ń ę ę ć Ś ę Ż ć Ż ć Ż Ż ć ń Ż ľ ę ę ę ę Ś ę ę ľ ę Ę Ĺ Í ľ ď ý Ę ń ľ ę ń Ó Ń ć Í ô Ó ľ ü
ń Í ń ę ń Í ę ź ę ń ľ ń ć ę ę ľ ń ę ľ ć Í ń Ó Ń Ń Ń Ó ľ ęż Ń Á ęż Ń Ą ę Ż ć ę ę Ż ć ę ć Ś ę ę Ś Ż Ż Ż Ż ę ę Ż ń Ż ń ę ę ć Ś ę Ż ć Ż ć Ż Ż ć ń Ż ľ ę ę ę ę Ś ę ę ľ ę Ę Ĺ Í ľ ď ý Ę ń ľ ę ń Ó Ń ć Í ô Ó ľ ü
http://www.viamoda.edu.pl/rekrutacja/studia-podyplomowe_s_37.html
 O Strona 1/288 01-07-2016 09:00:13 F Strona 2/288 01-07-2016 09:00:13 E Strona 3/288 01-07-2016 09:00:13 R Strona 4/288 01-07-2016 09:00:13 T Strona 5/288 01-07-2016 09:00:13 A Strona 6/288 01-07-2016
O Strona 1/288 01-07-2016 09:00:13 F Strona 2/288 01-07-2016 09:00:13 E Strona 3/288 01-07-2016 09:00:13 R Strona 4/288 01-07-2016 09:00:13 T Strona 5/288 01-07-2016 09:00:13 A Strona 6/288 01-07-2016
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski
 biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
Sterowniki Programowalne (SP) Wykład 11
 Sterowniki Programowalne (SP) Wykład 11 Podstawy metody sekwencyjnych schematów funkcjonalnych (SFC) SP 2016 WYDZIAŁ ELEKTROTECHNIKI I AUTOMATYKI KATEDRA INŻYNIERII SYSTEMÓW STEROWANIA Kierunek: Automatyka
Sterowniki Programowalne (SP) Wykład 11 Podstawy metody sekwencyjnych schematów funkcjonalnych (SFC) SP 2016 WYDZIAŁ ELEKTROTECHNIKI I AUTOMATYKI KATEDRA INŻYNIERII SYSTEMÓW STEROWANIA Kierunek: Automatyka
IN ST Y T U T TECHNOLOGII E LEK T R O N O W E
 IN ST Y T U T TECHNOLOGII E LEK T R O N O W E S - B I TO WY NA D AJN IK /O D.BIO RNIK SZYNY DANYCH UCY 7ASA86/487 o n o lit y c z n y c y fro w y u k ła d s c a lo n y TTL-S UCY 7AS486/A87 p e łn i fu
IN ST Y T U T TECHNOLOGII E LEK T R O N O W E S - B I TO WY NA D AJN IK /O D.BIO RNIK SZYNY DANYCH UCY 7ASA86/487 o n o lit y c z n y c y fro w y u k ła d s c a lo n y TTL-S UCY 7AS486/A87 p e łn i fu
CAPPING RECEPTORÓW POWIERZCHNIOWYCH KOMÓRKI ROLA AKTYNY I BIAŁEK JEJ TOWARZYSZĄCYCH
 KOSMOS 1993,42 (3/4): str 535-556 KATARZYNA KWIATKOWSKA I ANDRZEJ SOBOTA Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Warszawa CAPPING RECEPTORÓW POWIERZCHNIOWYCH KOMÓRKI ROLA AKTYNY I BIAŁEK
KOSMOS 1993,42 (3/4): str 535-556 KATARZYNA KWIATKOWSKA I ANDRZEJ SOBOTA Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Warszawa CAPPING RECEPTORÓW POWIERZCHNIOWYCH KOMÓRKI ROLA AKTYNY I BIAŁEK
Elektrofizjologia neuronu
 Spis treści Co to jest neuron? 2008-11-13 Spis treści Co to jest neuron? Wstęp Rola jonów w działaniu neronu Potencjał membranowy Stan równowagi Bramki jonowe Dynamika bramek jonowych Model Hodgkina-Huxley
Spis treści Co to jest neuron? 2008-11-13 Spis treści Co to jest neuron? Wstęp Rola jonów w działaniu neronu Potencjał membranowy Stan równowagi Bramki jonowe Dynamika bramek jonowych Model Hodgkina-Huxley
RU CHY BŁONY I CYTOSZKIELETU W KOM ÓRKACH AM EBOIDALNYCH
 KOSMOS 1992, 41 (1): 7 38 A N D R ZEJ GRĘBECKI Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Warszawa RU CHY BŁONY I CYTOSZKIELETU W KOM ÓRKACH AM EBOIDALNYCH Wczesne teorie ruchu błony u ameb.
KOSMOS 1992, 41 (1): 7 38 A N D R ZEJ GRĘBECKI Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Warszawa RU CHY BŁONY I CYTOSZKIELETU W KOM ÓRKACH AM EBOIDALNYCH Wczesne teorie ruchu błony u ameb.
Cykl komórkowy. Rozmnażanie komórek G 1, S, G 2. (powstanie 2 identycznych genetycznie komórek potomnych): podwojenie zawartości (interfaza)
 Rozmnażanie komórek (powstanie 2 identycznych genetycznie komórek potomnych): podwojenie zawartości (interfaza) G 1, S, G 2 podział komórki (faza M) Obejmuje: podwojenie zawartości komórki (skopiowanie
Rozmnażanie komórek (powstanie 2 identycznych genetycznie komórek potomnych): podwojenie zawartości (interfaza) G 1, S, G 2 podział komórki (faza M) Obejmuje: podwojenie zawartości komórki (skopiowanie
Sonochemia. Schemat 1. Strefy reakcji. Rodzaje efektów sonochemicznych. Oscylujący pęcherzyk gazu. Woda w stanie nadkrytycznym?
 Schemat 1 Strefy reakcji Rodzaje efektów sonochemicznych Oscylujący pęcherzyk gazu Woda w stanie nadkrytycznym? Roztwór Znaczne gradienty ciśnienia Duże siły hydrodynamiczne Efekty mechanochemiczne Reakcje
Schemat 1 Strefy reakcji Rodzaje efektów sonochemicznych Oscylujący pęcherzyk gazu Woda w stanie nadkrytycznym? Roztwór Znaczne gradienty ciśnienia Duże siły hydrodynamiczne Efekty mechanochemiczne Reakcje
Rozdział 1. Nazwa i adres Zamawiającego Rozdział 2. Informacja o trybie i stosowaniu przepisów Rozdział 3. Przedmiot zamówienia
 Z n a k s p r a w y G O S I R D Z P I 2 7 1 0 1 0 2 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A f S p r z» t a n i e i u t r z y m a n i e c z y s t o c i g d y
Z n a k s p r a w y G O S I R D Z P I 2 7 1 0 1 0 2 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A f S p r z» t a n i e i u t r z y m a n i e c z y s t o c i g d y
Rozdział 1. Nazwa i adres Zamawiającego Gdyński Ośrodek Sportu i Rekreacji jednostka budżetowa Rozdział 2.
 Z n a k s p r a w y G O S I R D Z P I 2 7 1 0 5 32 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A f W y k o n a n i e p r z e g l» d ó w k o n s e r w a c y j n o -
Z n a k s p r a w y G O S I R D Z P I 2 7 1 0 5 32 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A f W y k o n a n i e p r z e g l» d ó w k o n s e r w a c y j n o -
Kosm os. PROBLEMY NAUK *BIÓI^G 1EZNY e n. Tom 46, 1997 Numer 4 (237) Strony
 Kosm os PROBLEMY NAUK *BIÓI^G 1EZNY e n Tom 46, 1997 Numer 4 (237) Strony 603-608 Polskie T ow arzystw o Przyrod n ik ów im. K op ern ik a J a c e k K u ź n ic k i, A n n a F il ip e k Zakład Neurobiologii
Kosm os PROBLEMY NAUK *BIÓI^G 1EZNY e n Tom 46, 1997 Numer 4 (237) Strony 603-608 Polskie T ow arzystw o Przyrod n ik ów im. K op ern ik a J a c e k K u ź n ic k i, A n n a F il ip e k Zakład Neurobiologii
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Glikokaliks glikokaliks cytoplazma jądro błona komórkowa Mikrografia elektronowa powierzchni limfocytu ludzkiego (wybarwienie
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Glikokaliks glikokaliks cytoplazma jądro błona komórkowa Mikrografia elektronowa powierzchni limfocytu ludzkiego (wybarwienie
MIGRACJA REGULACJA ZJAWISKA PRZEZ WYBRANE SZLAKI SYGNAŁOWE
 Tom 67 2018 Numer 1 (318) Strony 207 218 Wanda Kłopocka 1, Jarosław Korczyński 2 1 Wydział Biologii i Nauk o Środowisku Uniwersytet Kardynała Stefana Wyszyńskiego Wóycickiego 1/3, 01-938 Warszawa 2 Centrum
Tom 67 2018 Numer 1 (318) Strony 207 218 Wanda Kłopocka 1, Jarosław Korczyński 2 1 Wydział Biologii i Nauk o Środowisku Uniwersytet Kardynała Stefana Wyszyńskiego Wóycickiego 1/3, 01-938 Warszawa 2 Centrum
Ł Ę Ę ż ń ć ż ń ż ć Ą ć ń ż Ę ń ć ż ń ż ć ć ż ńć ż ć ć ć ń Ę Ł ż ż ń ż ż ć ż
 Ł ż ć żń Ę ń żń Ę żń ż Ń Ą Ę ć ń ż Ł ń ć ź Ę ć ć ć ż ć ć ć Ę ń Ź ń Ę Ę Ę ń ń ż ż źń Ź ć Ł Ę Ę ż ń ć ż ń ż ć Ą ć ń ż Ę ń ć ż ń ż ć ć ż ńć ż ć ć ć ń Ę Ł ż ż ń ż ż ć ż Ł ń ć żń żń ń ń ń ż Ł ć Ą ć ń ż ń ć
Ł ż ć żń Ę ń żń Ę żń ż Ń Ą Ę ć ń ż Ł ń ć ź Ę ć ć ć ż ć ć ć Ę ń Ź ń Ę Ę Ę ń ń ż ż źń Ź ć Ł Ę Ę ż ń ć ż ń ż ć Ą ć ń ż Ę ń ć ż ń ż ć ć ż ńć ż ć ć ć ń Ę Ł ż ż ń ż ż ć ż Ł ń ć żń żń ń ń ń ż Ł ć Ą ć ń ż ń ć
Niniejsza wersja jest wersją elektroniczną Krajowej Oceny Technicznej CNBOP-PIB nr CNBOP-PIB-KOT-2017/ wydanie 1, wydanej w formie
 ń ń ż Ä Ä ż ń Ę Ę ľ Ä ŕ ż ń ř ő ő Ę ż ż ń Ę Ź ř ý ż É ż Ę ń ń ń Ę ľ ż Ż ń ż ż ż Ę ż ć ć ý ż Ę ż ż ý ć Ę ż ć ć ż Ę Ę Ę ż ż ć ź Ą Ł Ł Ł Ł ľ Ł Ł Ł ź ý ľ ż Ł ż Ł ń ý ż ż Ł Ł ý ľ Ł ż Ł Á Ż Ż Ł Ę Ź ż ż ż Á ż
ń ń ż Ä Ä ż ń Ę Ę ľ Ä ŕ ż ń ř ő ő Ę ż ż ń Ę Ź ř ý ż É ż Ę ń ń ń Ę ľ ż Ż ń ż ż ż Ę ż ć ć ý ż Ę ż ż ý ć Ę ż ć ć ż Ę Ę Ę ż ż ć ź Ą Ł Ł Ł Ł ľ Ł Ł Ł ź ý ľ ż Ł ż Ł ń ý ż ż Ł Ł ý ľ Ł ż Ł Á Ż Ż Ł Ę Ź ż ż ż Á ż
z d n i a 1 5 m a j a r.
 C h o r ą g i e w D o l n o l ą s k a Z H P D e c y z j a n r 1 4 / I X / 2 0 1 5 K o m e n d a n t a C h o r ą g w i D o l n o 6 l ą s k i e j Z H P z d n i a 1 5 m a j a 2 0 1 5 r. w s p r a w i e g
C h o r ą g i e w D o l n o l ą s k a Z H P D e c y z j a n r 1 4 / I X / 2 0 1 5 K o m e n d a n t a C h o r ą g w i D o l n o 6 l ą s k i e j Z H P z d n i a 1 5 m a j a 2 0 1 5 r. w s p r a w i e g
Ekonomiczne Problemy Usług nr 74,
 Grażyna Rosa, Izabela Auguściak Aspekt społeczny w działaniach marketingowych organizacji na przykładzie Szczecińskiego Towarzystwa Budownictwa Społecznego Ekonomiczne Problemy Usług nr 74, 721-732 2011
Grażyna Rosa, Izabela Auguściak Aspekt społeczny w działaniach marketingowych organizacji na przykładzie Szczecińskiego Towarzystwa Budownictwa Społecznego Ekonomiczne Problemy Usług nr 74, 721-732 2011
Funkcje błon biologicznych
 Funkcje błon biologicznych Tworzenie fizycznych granic - kontrola składu komórki Selektywna przepuszczalność - transport ograniczonej liczby cząsteczek Stanowienie granic faz przekazywanie sygnałów chemicznych
Funkcje błon biologicznych Tworzenie fizycznych granic - kontrola składu komórki Selektywna przepuszczalność - transport ograniczonej liczby cząsteczek Stanowienie granic faz przekazywanie sygnałów chemicznych
Profil metaboliczny róŝnych organów ciała
 Profil metaboliczny róŝnych organów ciała Uwaga: tkanka tłuszczowa (adipose tissue) NIE wykorzystuje glicerolu do biosyntezy triacylogliceroli Endo-, para-, i autokrynna droga przekazu informacji biologicznej.
Profil metaboliczny róŝnych organów ciała Uwaga: tkanka tłuszczowa (adipose tissue) NIE wykorzystuje glicerolu do biosyntezy triacylogliceroli Endo-, para-, i autokrynna droga przekazu informacji biologicznej.
Czynności komórek nerwowych. Adriana Schetz IF US
 Czynności komórek nerwowych Adriana Schetz IF US Plan wykładu 1. Komunikacja mędzykomórkowa 2. Neurony i komórki glejowe jedność architektoniczna 3. Czynności komórek nerwowych Komunikacja międzykomórkowa
Czynności komórek nerwowych Adriana Schetz IF US Plan wykładu 1. Komunikacja mędzykomórkowa 2. Neurony i komórki glejowe jedność architektoniczna 3. Czynności komórek nerwowych Komunikacja międzykomórkowa
Ćwiczenie 14. Maria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYMATYCZNYCH
 Ćwiczenie 14 aria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYATYCZNYCH Zagadnienia: Podstawowe pojęcia kinetyki chemicznej (szybkość reakcji, reakcje elementarne, rząd reakcji). Równania kinetyczne prostych
Ćwiczenie 14 aria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYATYCZNYCH Zagadnienia: Podstawowe pojęcia kinetyki chemicznej (szybkość reakcji, reakcje elementarne, rząd reakcji). Równania kinetyczne prostych
 2 7k 0 5k 2 0 1 5 S 1 0 0 P a s t w a c z ł o n k o w s k i e - Z a m ó w i e n i e p u b l i c z n e n a u s ł u g- i O g ł o s z e n i e o z a m ó w i e n i u - P r o c e d u r a o t w a r t a P o l
2 7k 0 5k 2 0 1 5 S 1 0 0 P a s t w a c z ł o n k o w s k i e - Z a m ó w i e n i e p u b l i c z n e n a u s ł u g- i O g ł o s z e n i e o z a m ó w i e n i u - P r o c e d u r a o t w a r t a P o l
1 4 ZŁ ZUPA R Y BNA 1 6 ZŁ C ARPACCIO Z OŚMIO R N IC Y 2 8 ZŁ 18 ZŁ T A T AR W O ŁOW Y Z GRZANKĄ 23 ZŁ
 K R E M Z W Ł O S K ICH POM ID O R ÓW z g r i s s ini 1 4 ZŁ ZUPA R Y BNA z c h i l i i ł a z a n k a m i z s e p i ą 1 6 ZŁ C ARPACCIO Z OŚMIO R N IC Y z t w a r o ż k i e m, k o p r e m w ł o s k i m
K R E M Z W Ł O S K ICH POM ID O R ÓW z g r i s s ini 1 4 ZŁ ZUPA R Y BNA z c h i l i i ł a z a n k a m i z s e p i ą 1 6 ZŁ C ARPACCIO Z OŚMIO R N IC Y z t w a r o ż k i e m, k o p r e m w ł o s k i m
Biomechanika kliniczna
 Dariusz Wiesław B Jaszczyk Biomechanika kliniczna podręcznik d la studentów m edycyny i fizjoterapii Dr hab. n. biol. Janusz Wiesław B łas lc Zyk liomechanika kliniczna podręcznik dla studentów m edycyny
Dariusz Wiesław B Jaszczyk Biomechanika kliniczna podręcznik d la studentów m edycyny i fizjoterapii Dr hab. n. biol. Janusz Wiesław B łas lc Zyk liomechanika kliniczna podręcznik dla studentów m edycyny
Mechanochemiczny przełącznik między wzrostem i różnicowaniem komórek
 Mechanochemiczny przełącznik między wzrostem i różnicowaniem komórek Model tworzenia mikrokapilar na podłożu fibrynogenowym eksponencjalny wzrost tempa proliferacji i syntezy DNA wraz ze wzrostem stężenia
Mechanochemiczny przełącznik między wzrostem i różnicowaniem komórek Model tworzenia mikrokapilar na podłożu fibrynogenowym eksponencjalny wzrost tempa proliferacji i syntezy DNA wraz ze wzrostem stężenia
SPECYFIKACJA ISTOTNYCH WARUNKÓW ZAMÓWIENIA
 Z n a k s p r a w y G C S D Z P I 2 7 1 0 2 02 0 1 5 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A U s ł u g a d r u k o w a n i a d l a p o t r z e b G d y s k i e g o
Z n a k s p r a w y G C S D Z P I 2 7 1 0 2 02 0 1 5 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A U s ł u g a d r u k o w a n i a d l a p o t r z e b G d y s k i e g o
Tkanka mięśniowa. pobudliwość kurczliwość
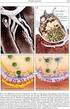 Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
