Receptory nukleotydowe budowa i funkcje, historia i perspektywy
|
|
|
- Wacław Murawski
- 8 lat temu
- Przeglądów:
Transkrypt
1 Receptory nukleotydowe budowa i funkcje historia i perspektywy Jolanta Barańska * Instytut Biologii Doświadczalnej im. Marcelego Nenckiego PAN Warszawa * Instytut Biologii Doświadczalnej im. Marcelego Nenckiego PAN ul. Pasteura Warszawa; tel. (22) j.baranska@nencki.gov.pl Artykuł otrzymano 12 września 2014 r. Artykuł zaakceptowano 16 września 2014 r. Słowa kluczowe: receptory nukleotydowe P1 P2X P2Y Wykaz skrótów: αβmeatp αβ-metyleno- ATP; AC cyklaza adenylanowa; Akt kinaza białkowa B/kinaza Akt; Ap 4 A diadenozyno-55-p 1 P 4 -tetrafosforan; BzATP O-(4-benzoilobenzoil)-ATP; camp cykliczny AMP; DAG diacyloglicerol; ERK1/ ERK2 (ang. extracellular signal regulated kinases) kinazy regulowane sygnałem zewnątrzkomórkowym; GPCR (ang. G-protein-coupled-receptors) receptory metabotropowe sprzężone z białkiem G; IP 3 trisfosfoinozytol; MAP (ang. mitogen activated protein) białko aktywowane przez czynniki mitogenne; IUPHAR (ang. International Union of Basic and Clinical Pharmacology) Międzynarodowa Unia Farmakologiczna; 2MeSADP 2-methylotio- -ADP; 2MeSATP 2-methylotio-ATP; PI3K kinaza 3-fosfatydyloinozytolu; PIP 2 fosfatydyloinozytolo-(45)-bisfosforan; PLC fosfolipaza C; PKA PKC kinazy białkowe; PPADS 6-azofenylo-2 4 -disulfonowy fosforan pirydoksalu STRESZCZENIE Receptory nukleotydowe zostały odkryte w latach 70. ubiegłego wieku przez brytyjskiego badacza Geoffreya Burnstocka. Pierwotnie nosiły one nazwę receptorów purynergicznych. Kiedy wykazano że w ich aktywacji biorą udział zarówno nukleotydy purynowe jak i piramidynowe nazwę zmieniono na receptory nukleotydowe i podzielono na dwie grupy: P1 i P2. Receptory P1 to receptory których agonistą jest nukleozyd adenozyna podczas gdy receptory P2 dalej podzielone na podgrupy P2X i P2Y są aktywowane przez nukleotydy. Receptory P2X to receptory jonotropowe tworzące kanał w błonie komórkowej aktywowane przez ATP. Receptory P2Y to receptory metabotropowe związane z białkami G (podobnie jak P1) aktywowane przez ATP ADP UTP UDP i cukrowe pochodne UDP. W artykule opisano historię odkrycia i omówiono strukturę i funkcje poszczególnych receptorów nukleotydowych. Zwrócono uwagę na ich znaczącą rolę w regulacji rozlicznych procesów zachodzących w organizmie i związane z tym możliwości terapeutyczne. Zaproponowano kierunki perspektywiczne przyszłych badań którymi byłaby charakterystyka dotychczas nierozpoznanych receptorów sierocych oraz terapia wybiórcza celowana na określony narząd i receptor. WPROWADZENIE Nukleotydy są związkami powszechnie występującymi w świecie żywym. Odgrywają kluczową rolę we wszystkich podstawowych procesach zachodzących wewnątrz komórek regulują aktywność wielu enzymów biorą udział w syntezie kwasów nukleinowych. Najwszechstronniej przebadany nukleotyd ATP jest obecny w stężeniu 1 10 mm we wszystkich komórkach zwierząt roślin i mikroorganizmów. Nukleotyd ten jest stale produkowany i zużywany. Człowiek w ciągu doby zużywa mniej więcej tyle ATP ile sam waży. W całym świecie żywym ATP służy jako paliwo uniwersalny nośnik energii napędzający reakcje biologiczne komórek a przez to umożliwiający funkcjonowanie i życie organizmów. Jednak ATP i inne nukleotydy i nukleozydy pełnią jeszcze inną również bardzo ważną funkcję. Mianowicie są cząsteczkami sygnałowymi używanymi w przekazywaniu informacji ze środowiska zewnętrznego do wnętrza komórki służą również w komunikacji międzykomórkowej [12]. Teza o podwójnej roli ATP i innych nukleotydów początkowo spotykała się z ogromnym niedowierzaniem. Sądzono że ATP pełni wyłącznie funkcje wewnątrzkomórkowego źródła i nośnika energii. Jednak poczynając od lat 70. ubiegłego wieku dokonano wielu odkryć wyjaśniających w jaki sposób nukleotyd ten jest uwalniany do środowiska zewnątrzkomórkowego i jak pod wpływem ektoenzymów ulega degradacji prowadzącej kolejno do powstania ostatecznego produktu tych przemian adenozyny. Wykazano że ATP i inne związki adeninowe znajdując się poza komórką oddziałują ze specyficznymi receptorami usytuowanymi podobnie jak ektoenzymy na zewnętrznej powierzchni błony plazmatycznej komórek [2-4]. Receptory te zostały początkowo nazwane receptorami purynergicznymi i podzielone na te na które działa adenozyna i te które rozpoznają ATP i ADP. Gdy wykazano że na receptory te działają również nukleotydy pirymidynowe takie jak UTP i UDP dokonano weryfikacji nazwy całej klasy. Obecnie noszą one nazwę receptorów nukleotydowych [56] choć ich pierwotna nazwa jest stale spotykana w literaturze. Receptory nukleotydowe są wszechobecne oddziałują z nukleotydami uwalnianymi aktywnie do środowiska zarówno w warunkach normy jak i w procesach patologicznych. To oddziaływanie powoduje aktywację receptorów i przekazanie określonych sygnałów do wnętrza komórki modulując i regulując rozliczne funkcje organizmu jak skurcze mięśni czynności serca czy przekaźnictwo nerwowe [7]. Porównując sygnały staramy się je poznać i wpływać na ich 424
2 zmianę zmierzając w celach terapeutycznych do poprawy ludzkiego zdrowia [8-10]. HISTORIA BADAŃ RECEPTORÓW NUKLEOTYDOWYCH Historia badań receptorów nukleotydowych rozpoczęła się ponad 80 lat temu. Za jej początek należy uznać odkrycie ATP które przypadło na rok Było ono udziałem dwóch grup badawczych niemieckiej i amerykańskiej. Niemiecki chemik Lohmann pracujący w Heidelbergu oraz Fiske i jego student Subbarow pracujący w Harvard Medical School niemal jednocześnie pokazali że skurcz komórek mięśniowych zależy od dostępności cząsteczki występującej w ekstraktach mięśni. Wykazali że cząsteczka ta składa się z łańcucha trzech grup fosforanowych połączonych z adenozyną czyli purynową zasadą adeniny związaną z cukrem rybozą [1112]. Badania z lat późniejszych potwierdziły budowę tej cząsteczki jako adenozynotrifosforanu (ATP) i w połowie lat czterdziestych ostatecznie ustaliły jego strukturę. W tym samym czasie w którym nastąpiło odkrycie ATP Drury i Szent-Gyȍrgyi przedstawili wyniki swoich badań pokazujące działanie adenozyny i AMP otrzymanych z mięśnia sercowego na pracę tego organu [13]. Wykazali że podanie dożylne śwince morskiej tych związków wywołuje rozszerzenie naczyń krwionośnych i obniżenie ciśnienia krwi [13]. Kontynuując powyższą tematykę w 1934 r. Gillespie zwrócił uwagę na rolę struktury związków adeninowych w wywoływanych przez nie efektach fizjologicznych [14]. Gillespie pokazał że kolejne usuwanie grup fosforanowych z podawanych królikowi czy kotu związków adeninowych wywołuje coraz bardziej postępujące obniżanie ciśnienia krwi. Zgodnie z tą obserwacją podanie ATP podwyższało ciśnienie podczas gdy adenozyna i AMP takich efektów nie wywoływały. Ponadto ATP powodowało wielokrotnie silniejszy niż adenozyna skurcz jelit [14]. Wyniki te były pierwszymi wskazującymi że ATP i adenozyna wywołują odmienne efekty fizjologiczne i sugerowały istnienie specyficznych receptorów różnych dla różnych nukleotydów. W owym czasie nikt jednak nie przypuszczał że ATP może odgrywać jakąś rolę poza komórką. Musiało upłynąć wiele lat aby okazało się że ATP może działać na zewnątrz komórki pełniąc funkcje zewnątrzkomórkowego przekaźnika informacji. Aż do lat 70. zeszłego wieku uważano bowiem że ATP pełni wyłącznie rolę cząsteczki przenoszącej energię wewnątrz komórki nośnika energii w procesach wewnątrzkomórkowych wymagających i zużywających energię. Taką funkcję ATP w układach biologicznych przedstawił w 1941 r. Lippman [15] i za to odkrycie został 12 lat później uhonorowany Nagrodą Nobla. ATP uznano za najważniejszą uniwersalną cząsteczkę źródło łatwo dostępnej chemicznej energii we wszystkich żywych komórkach [1617]. W wyniku tych odkryć badania nukleotydów w ciągu wielu lat koncentrowały się jedynie na ich wewnątrzkomórkowych funkcjach energetycznych. Jak powszechnie wiadomo ATP jest syntetyzowany w komórkach eukariotycznych w procesie glikolizy oraz oksydacyjnej fosforylacji. Tak otrzymany ATP ulega hydrolizie do ADP i fosforanu w wielu reakcjach biochemicznych wymagających energii. Toteż stężenie ATP wewnątrz komórki jest wypadkową szybkości syntezy i hydrolizy tego nukleotydu i jest ściśle związane ze stanem metabolicznym danej komórki. Może zatem być różne w różnych komórkach ale też i w tej samej komórce. Jest jednak zawsze wysokie w cytoplazmie komórek ssaków wartość ta wynosi około 3 5 mm. W odróżnieniu stężenie ATP w środowisku zewnętrznym komórek w stanie spoczynku jest bardzo niskie i utrzymuje się na poziomie 1 10 nm [1819]. Tak niskie stężenie wydawało się racjonalne bowiem wielkość i ładunek cząsteczki ATP nie pozwala jej na przekroczenie dwuwarstwy lipidowej błony plazmatycznej w procesie prostej dyfuzji [2021]. Sądzono że jedynie w wyniku mechanicznego uszkodzenia tkanek i komórek ATP i inne nukleotydy wydostają się z cytoplazmy i pojawiają w strumieniu krwi [22]. Istotnie nagły wzrost stężenia zewnątrzkomórkowego ATP obserwowano we krwi rannych żołnierzy zabieranych z pól bitwy w czasie II wojny światowej [2223]. Bardzo niskie stężenie zewnątrzkomórkowego ATP stanowiło argument popierający tezę że nukleotyd ten działa jedynie wewnątrz komórek. Dane literaturowe wskazujące na jego uwalnianie traktowano sceptycznie. Jednak w ciągu ostatnich lat dokonano wielu odkryć wskazujących że ATP może i jest uwalniany do środowiska zewnątrzkomórkowego zarówno przez komórki o typowych właściwościach wydzielniczych jak i komórki niesekrecyjne. I tak wykazano że w neuronach komórkach chromochłonnych i groniastych komórkach trzustki ATP jest pakowane do pęcherzyków wydzielniczych: pęcherzyków synaptycznych czy granul chromochłonnych i w takiej postaci transportowane poza komórkę [23-26]. ATP odkryto również w środowisku zewnątrzkomórkowym komórek niesekrecyjnych takich jak komórki nabłonkowe [2728] śródbłonkowe [2930] mięśni gładkich fibroblastów i limfocytów [31] hepatocytów [32] czy wielu transformowanych linii komórkowych. Wydzielanie ATP z tego typu komórek było wywoływane przez stymulację mechaniczną (stres mechaniczny) działanie związków farmakologicznych (np. trypsyny trombiny epinefryny) czy stres fizjologiczny (np. niedotlenienie) [233031]. W neuronach obwodowego i ośrodkowego układu nerwowego ATP zmagazynowany w pęcherzykach synaptycznych jest uwalniany w wyniku depolaryzacji błony [23]. Wiele rodzajów komórek uwalnia ATP oraz adenozynę za pośrednictwem specyficznych białek transportujących. Wydaje się że taką rolę w uwalnianiu nukleotydów z komórek śródbłonka w procesie regulującym światło naczyń krwionośnych mogą odgrywać ATPazy z rodziny ABC (ang. ATP-binding casette proteins) [2330]. W komórkach astrocytów hodowanych in vitro Coco i wsp. [33] opisali mechanizm wydzielania ATP jako proces zależnej od jonów wapnia egzocytozy. Uważa się że nie tylko ATP lecz również inne nukleotydy (np. UTP) oraz cukrowe pochodne nukleotydów (np. UDP-glukoza) są uwalniane z komórek na drodze transportu pęcherzykowego w podobnym procesie [34]. Należy dodać że wydzielane z komórek do środowiska zewnątrzkomórkowego nukleotydy ulegają szybko degradacji jak również fosforylacji przez specyficzne ektoenzymy obecne na zewnętrznej powierzchni błon plazmatycznych [ ]. W ten sposób uwolniony do przestrzeni zewnątrzkomórkowej ATP jest hydrolizowany kolejno do ADP AMP i adenozyny a UDP fosforylowany Postępy Biochemii 60 (4)
3 do UTP [34]. Powstałe związki mogą teraz oddziaływać ze specyficznymi błonowymi receptorami obecnymi na powierzchni tej samej lub sąsiedniej komórki. Podwyższone stężenie zewnątrzkomórkowych nukleotydów jest więc zjawiskiem przejściowym ma miejsce po zadziałaniu określonych czynników stymulujących i jest niezwykle precyzyjnie regulowane. Obecność receptorów dla ATP została po raz pierwszy zasugerowana przez Burnstocka na początku lat 70. ubiegłego wieku [37]. Była ona wynikiem jego wcześniejszych badań prowadzonych w latach 60. na Uniwersytecie w Melbourne w których stwierdził że skurcz jelit czy pęcherza moczowego zachodzi w procesie w którym nie biorą udziału przekaźniki nerwowe acetylocholina i noradrenalina a bierze udział ATP. Wynik ten był zgodny z wcześniejszymi obserwacjami Holton [38] która wykazała uwalnianie cząsteczek ATP z nerwów czuciowych. W środowisku naukowym istniało jednak tak silne przekonanie o nadrzędnej wewnątrzkomórkowej funkcji ATP jako nośnika energii że uzyskanie pewności i opublikowanie wyników świadczących o ATP jako działającym zewnątrzkomórkowo przekaźniku nerwowym zajęło Burnstockowi około dziesięciu lat. I tak wreszcie w 1972 r. Burnstock w Pharmacological Review [37] przedstawił rezultaty swoich 10-letnich doświadczeń z których niezbicie wynikało że istotnie ATP jest wydzielany z nerwów które nazwał purynergicznymi. Wnioskował że skoro ATP jest uwalniany do szczeliny synaptycznej to należy przypuszczać że komórki postsynaptyczne odbierające taki sygnał powinny posiadać receptory dla tego nukleotydu znajdujące się na powierzchni komórki [37]. Założenie to zostało poparte dowodami farmakologicznymi; w 1976 r. Burnstock zdefiniował białka pełniące taką funkcję i nazwał je receptorami purynergicznymi [39]. Dwa lata później opierając się na danych farmakologicznych i biochemicznych dokonał podziału tych receptorów na dwie klasy: P1 odpowiadające na adenozynę i P2 odpowiadające na ATP i ADP [40]. Dalsze badania prowadzone w latach 80. również w pracowni Burnstocka doprowadziły do aktualnego do dziś podziału receptorów P2 na dwa podtypy: P2X i P2Y [41]. Następnie w latach 90. ubiegłego wieku dzięki wprowadzeniu metod burzliwie rozwijającej się biologii molekularnej w tym analizy sekwencji klonowanych receptorów wyizolowano i określono strukturę molekularną receptorów P2X i P2Y i poznano szlaki przekazywanych przez nie wewnątrzkomórkowych sygnałów [122442]. Badania lat 90. wykazały również że nie tylko nukleotydy purynowe lecz także pirymidynowe takie jak UTP i UDP posiadają swoje receptory w wielu komórkach [5643]. Stwierdzono że receptory te mają podobną charakterystykę farmakologiczną i molekularną jak receptory P2. Z tego powodu zgodnie z zaleceniem Komitetu do Spraw Nazewnictwa Receptorów i Klasyfikacji Leków Międzynarodowej Unii Farmakologicznej (IUPHAR ang. International Union of Basic and Clinical Pharmacology) dokonano zmiany nazwy receptory purynergiczne na receptory nukleotydowe [4445]. Jednak podana przez Burnstocka pierwotna nazwa receptory purynergiczne jest stale obecna w literaturze. W latach następnych już w XXI wieku nastąpił lawinowy rozwój tej dziedziny wiedzy [2]. Identyfikacja receptorów nukleotydowych pozwoliła ustalić ich lokalizację na komórkach różnych tkanek i organizmów i dostarczyła dowodów wskazujących że reprezentują one wielką rodzinę szeroko rozpowszechnioną w całym świecie żywym [7]. Obecnie nikt już nie wątpi że ATP inne nukleotydy a także adenozyna pełnią istotną rolę jako zewnątrzkomórkowe przekaźniki informacji oddziałujące ze specyficznymi receptorami a Burnstock jest słusznie uważany nie tylko za odkrywcę lecz także duchowego ojca tych receptorów. EKTOENZYMY I PODZIAŁ RECEPTORÓW NUKLEOTYDOWYCH Jak już wspomniano wydzielane nukleotydy nie są stabilne w środowisku zewnątrzkomórkowym i ulegają degradacji katalizowanej przez ektoenzymy związane z błoną komórkową. Nazwą ektoenzymy nukleotydowe określamy enzymy błony plazmatycznej które po zewnętrznej stronie błony specyficznie metabolizują nukleotydy docierające do nich z przestrzeni zewnątrzkomórkowej [34]. Do najbardziej znanych grup ektoenzymów należą: E- -NTPDazy (ang. ecto-nucleotidase 5 -triphosphate diphosphohydrolases) E-NPPazy (ang. ecto-phosphodiesterase/nucleotide pyrophosphatase) ekto-5 -nukleotydaza oraz alkaliczna fosfataza [183536]. Rodzina E-NTPDaz (klasyfikowana poprzednio jako rodzina E-ATPaz) charakteryzuje się zdolnością do hydrolizy tri- i dinukleotydów. U ssaków wyróżniamy co najmniej 8 sklonowanych i scharakteryzowanych enzymów należących do tej grupy (NTPDazy1-8). Enzymy te to integralne białka błony plazmatycznej składające się z dwóch domen transbłonowych o krótkich odpowiednio N- i C-końcach znajdujących się od strony cytosolowej. Po stronie zewnątrzkomórkowej domeny transbłonowe połączone są dużą pętlą utworzoną przez łańcuch aminokwasów zawierający zachowane w ewolucji regiony wrażliwe na apyrazę [336]. Wśród NTPDaz należy wyróżnić NTPDazę1 (znaną również jako ekto-apyraza i ekto-atp-difosfohydrolaza). Enzym ten przeprowadza dwie reakcje hydrolizuje tri- i difosforany nukleozydów prowadząc do powstania monofosforanów nukleozydów. NTPDaza1 działa zatem zarówno na ATP jak i na ADP przeprowadzając reakcję: ATP AMP + 2P i oraz reakcję: ADP AMP + P i w obu przypadkach prowadząc do powstania AMP. Natomiast NTPDaza2 selektywnie hydrolizuje trifosforany nukleozydów do difosforanów nukleozydów (ATP ADP + P i ) [35]. Z kolei NTPDaza3 hydrolizuje zarówno trifosforany nukleozydów jak i difosforany nukleozydów (ATP ADP + P i ADP AMP + P i ) z preferencją 3:1 dla trifosforanów a NTPDaza8 charakteryzuje się szerokim spektrum działania [183436]. Rodzina ekto-pirofosfataz/fosfodiesteraz (E-NPP) zawiera trzy białka (E-NPP1 E-NPP2 oraz E-NPP3) kodowane przez różne geny. W budowie ich można wyróżnić krótki koniec aminowy od strony cytosolowej błony jedną domenę transbłonową oraz długą zewnątrzkomórkową domenę zawierającą miejsce katalityczne enzymu. Enzymy te charakteryzują się szeroką specyficznością substratową. Mogą hydrolizować zarówno tri- i difosforany nukleozydów do monofosforanów nukleozydów używając jako sub
4 stratów nie tylko ATP lecz również UTP GTP ADP i UDP a także hydrolizować cykliczny AMP (camp) do AMP jak i kwasy nukleinowe oraz cukrowe pochodne nukleotydów (UDP-glukoza) [3436]. Ekto-5 -nukleotydaza to enzym który konwertuje monofosforany nukleozydów do nukleozydów i ortofosforanu (AMP Adenozyna + P i ). A więc w wyniku degradacji AMP (powstającego w przestrzeni zewnątrzkomórkowej w wyniku hydrolizy ATP i ADP) enzym ten ma udział w akumulacji zewnątrzkomórkowej adenozyny. Natomiast alkaliczna fosfataza hydrolizuje niespecyficznie każdy z powyższych etapów działając zarówno na ATP jak i ADP i AMP prowadząc również do powstania adenozyny [ ]. Znane są także interkonwertujące właściwości enzymów takich jak mono- i di-kinazy nukleozydów. Zewnątrzkomórkowe difosfokinazy nukleozydowe NPDK (ang. nucleoside diphosphokinase) katalizują bowiem dwukierunkową reakcję transfosforylacji zachodzącą według wzoru: ATP + UDP ADP + UTP. W komórkach nowotworów pochodzenia glejowego (gwiaździaka 1321N1 oraz glejaka C6) NDPK bardzo szybko tworzą ATP z endogennego ADP w obecności odpowiedniego stężenia UTP w środowisku zewnątrzkomórkowym [1834]. Zgodnie z tymi kryteriami receptory nukleotydowe dzielimy na dwie duże klasy: receptory P1 aktywowane przez adenozynę i receptory P2 wykazujące powinowactwo do ATP ADP UTP UDP oraz do cukrowych pochodnych UDP. Ze względu na różnice w budowie oraz charakterystykę farmakologiczną i molekularną receptory P2 dzielimy dalej na receptory P2X i P2Y. Receptory P2X są receptorami jonotropowymi błonowymi kanałami jonowymi natomiast receptory P2Y podobnie jak P1 to receptory metabotropowe związane z trójpodjednostkowymi białkami G [ ]. Rycina 1 przedstawia podział receptorów nukleotydowych. Opierając się na danych farmakologicznych i biochemicznych jak również na analizie sekwencji klonowanych receptorów receptory P1 podzielono na 4 podtypy (A 1 A 2A A 2B A 3 ) a receptory P2Y na 8 podtypów (P2Y 1 P2Y 2 P2Y 4 P2Y 6 P2Y 11 P2Y 13 P2Y 14 ). Konsekwencją pobudzenia tych receptorów jest aktywacja różnych szlaków sygnałowych przebiegających wewnątrz komórki. Mechanizm ich działania przedstawia schematycznie rycina 1. Natomiast wśród jonotropowych receptorów P2X wyróżniamy 7 podtypów (P2X 1-7 ) a ich charakterystyka i mechanizm działania zostaną omówione w dalszych częściach tekstu. Tak więc w krótszym lub dłuższym cyklu przemian enzymatycznych z uwolnionego do przestrzeni zewnątrzkomórkowej ATP może w wyniku hydrolizy powstać zarówno ADP jak i adenozyna oraz w wyniku reakcji transfosforylacji nie tylko UTP lecz również ATP [183436]. Tak powstałe związki mogą teraz specyficznie oddziaływać z błonowymi receptorami wrażliwymi na zewnątrzkomórkowe nukleotydy: ATP ADP UTP UDP cukrowe pochodne UDP oraz adenozynę. Zasadniczy podział receptorów nukleotydowych opiera się właśnie na tych kryteriach specyficzności receptorów wobec określonych działających na nie agonistów. Rycina 1. Schematyczny podział receptorów nukleotydowych z zaznaczeniem ich głównych funkcji. Rycina pokazuje podtypy receptorów P1 (A 1 A 2A A 2B A 3 ) aktywowanych przez adenozynę. Receptory P2 dzielimy na P2X i P2Y. Podtypy receptorów P2Y (P2Y 1 P2Y 2 P2Y 4 P2Y 6 P2Y 11 P2Y 13 P2Y 14 ) są aktywowane przez ATP ADP UTP UDP i cukrowe pochodne UDP a podtypy receptorów P2X 1-7 (niepokazane na rycinie omówione w tekście) są aktywowane przez ATP. Podtypy receptorów P1 i P2Y współdziałają z trójpodjednostkowymi białkami G i indukują różne szlaki sygnalizacyjne wewnątrz komórki. AC cyklaza adenylanowa; camp cykliczny- AMP; [Ca 2+ ] stężenie jonów wapnia; PLC fosfolipaza C; wzrost ilości; spadek ilości. RECEPTORY P1 METABOTROPOWE AKTYWOWANE PRZEZ ADENOZYNĘ Adenozyna stanowi podstawową cegiełkę budulcową wielu biologicznie czynnych związków takich jak ATP dinukleotyd nikotynoamidoadeninowy (NAD + ) czy kwasy nukleinowe. Powstając w komórce w wyniku przekształceń S-adenozylometioniny i S-adenozylohomocysteiny może jednak nie ulegać dalszym przekształceniom a jako taka być transportowana poza komórkę przez działające dwukierunkowo białko transportujące (ENT ang. equilibrative nucleoside transporter) za pośrednictwem którego wewnątrz- i zewnątrzkomórkowe stężenia tej substancji są ze sobą ściśle powiązane [46-48]. Należy dodać że adenozyna może nie tylko być transportowana z powrotem do komórki poprzez owe specyficzne białko transportujące lecz także wnikać do niej przez prostą dyfuzję procesy które nie mają miejsca w przypadku ATP i ADP [202146]. A więc pierwszy ze sposobów dzięki któremu adenozyna może pojawić się na zewnątrz komórki to transport. Drugi to jej powstanie w wyniku omówionej już uprzednio degradacji uwolnionego z komórki ATP w procesie: ATP ADP AMP adenozyna katalizowanym przez ektonukleotydazy znajdujące się na zewnętrznej powierzchni błony plazmatycznej [41836]. Uwolniona z komórki czy też utworzona pozakomórkowo adenozyna może teraz oddziaływać ze specyficznymi receptorami błony plazmatycznej wywierając wpływ na wiele procesów związanych z funkcjonowaniem układu krążenia układu wewnątrzwydzielniczego odpornościowego czy wreszcie nerwowego [48-51]. W płynach ustrojowych stężenie adenozyny w warunkach spoczynkowych wynosi nm i Postępy Biochemii 60 (4)
5 tak jak w przypadku ATP jest ono zbyt niskie aby aktywować receptory błony plazmatycznej [52]. Jednak po pobudzeniu stężenie adenozyny gwałtownie wzrasta. W sytuacji stresowej np. przy niedokrwistości (ischemii) wartości te mogą wzrastać nawet stukrotnie. Po pobudzeniu komórki i uwolnieniu ATP moment pojawienia się wzrostu zewnątrzkomórkowego stężenia adenozyny jest zawsze wtórny opóźniony w stosunku do obserwowanego na początku skoku wzrostu stężenia ATP [4853]. Przy tej wzajemnej relacji: ATP adenozyna pobudzające działanie ATP jest zazwyczaj kompensowane przeciwstawnym działaniem adenozyny. W układzie nerwowym adenozyna nie będąc magazynowana w pęcherzykach synaptycznych ani uwalniana w wyniku depolaryzacji nie jest traktowana jako prawdziwy neuroprzekaźnik. Natomiast ze względu na wspomnianą powyżej relację z ATP jest uważana za istotny neuromodulator [4850]. Biologiczne efekty pozakomórkowego działania adenozyny związane są z aktywacją specyficznych receptorów błonowych nazwanych przez Bunstocka receptorami P1 [40]. Należą one podobnie jak receptory P2Y do największej najbardziej różnorodnej rodziny receptorów występujących w przyrodzie receptorów metabotropowych sprzężonych z trójpodjednostkowymi białkami G (GPCR) (ang. G-protein coupled receptors) [ ]. Receptory GPCR niezależnie od pełnionych funkcji mają ten sam plan budowy (Ryc. 2). Wszystkie są długimi pojedynczymi łańcuchami białkowymi złożonymi z paruset reszt aminokwasów siedmiokrotnie przechodzącymi przez błonę plazmatyczną. Obecność siedmiu domen transbłonowych jest cechą charakterystyczną receptorów GPCR (Ryc. 2). Domeny te mają budowę α-helisy i składają się z reszt hydrofobowych aminokwasów. W wiązaniu liganda biorą udział domeny transbłonowe tworzące tzw. kieszeń w błonie plazmatycznej. Do kieszeni wiąże się ligand docierający do komórki od strony zewnętrznej a reszty aminokwasów należące do helis domen transbłonowych odpowiadają za Rycina 2. Schemat budowy receptorów metabotropowych. Receptory metabotropowe zawierają 7 domen transbłonowych (TM1-7) trzy pętle zewnątrzkomórkowe (e1-3) oraz trzy pętle wewnątrzkomórkowe (i1-3). W pętli e2 na niebiesko zaznaczono możliwość glikozylacji a na pomarańczowo fragment odpowiedzialny za rozpoznawanie agonisty lub antagonisty. N-koniec białka receptorowego znajduje się od strony zewnątrzkomórkowej a C-koniec od strony wewnątrzkomórkowej. Zmodyfikowano wg [7]. specyficzność wiązania a więc specyficzność danego receptora. Połączenia pomiędzy domenami stanowią trzy pętle zewnątrzkomórkowe i trzy cytoplazmatyczne różnej wielkości. N-koniec białka receptorowego jest umieszczony po stronie zewnętrznej komórki i może zawierać miejsca ulegające glikozylacji natomiast C-koniec znajduje się od strony cytoplazmy i zawiera sekwencje będące miejscami ulegającymi fosforylacji. Białko G wiąże się z receptorem od strony wewnętrznej błony w obrębie jego trzeciej pętli znajdującej się w cytoplazmie (Ryc. 2). Białka G tworzą rodzinę zbudowanych z trzech podjednostek homologicznych białek wiążących nukleotydy guanylowe i przekazujących sygnał od błony plazmatycznej. Przepływ sygnału od receptora przez białko G do określonego efektora odbywa się zazwyczaj według jednego schematu [55]. Białka G składają się z podjednostek α β i γ. Podjednostka α ma domenę wiążącą GTP ma też właściwości enzymu stałą i wysoką aktywność GTPazową dzięki której hydrolizuje GTP do GDP. Z przyłączonym GDP przylega ściśle do podjednostek β/γ i cały kompleks α/β/γ stanowi formę nieaktywną związaną z receptorem. Agonista działając na receptor wywołuje zmianę konformacyjną zarówno receptora jak i białka G. Powoduje to że z podjednostki α uwalnia się GDP a przyłącza GTP. Białko G staje się aktywne i jego podjednostka α odłącza się od kompleksu β/γ. Aktywne podjednostki: α a także niejednokrotnie β/γ mogą teraz aktywować określone efektory białka enzymatyczne co rozpoczyna kaskadę reakcji w komórce. Aktywność białka G utrzymuje się tak długo jak długo do podjednostki α przyłączony jest GTP. Kiedy w wyniku hydrolizy z GTP powstaje GDP wszystkie trzy podjednostki łączą się z powrotem i białko G staje się znowu nieaktywne. Klasyfikacja białek G opiera się na właściwościach i podobieństwie składu reszt aminokwasowych podjednostki α (masa cząsteczkowa kda). Zgodnie z tą klasyfikacją wyróżnia się 4 główne typy białek G: G s G i/o G q/11 i G 12/13. Znanych jest 20 podjednostek α 5 podjednostek β i 12 podjednostek γ. Poznano też strukturę krystaliczną pewnych kompleksów białek G np. G α1/β1/γ2. Pozwala to znacznie dokładniej zrozumieć strukturę tych białek i ich działanie. Należy dodać że prowadzone w laboratoriach amerykańskich badania nad białkami G i receptorami GPCR doczekały się dwukrotnie uhonorowania Nagrodą Nobla. W 1994 roku Rodbell i Gilman uzyskali tę zaszczytną nagrodę za odkrycie białek G i wytłumaczenie ich roli w procesie przekazywania informacji w komórce a w 2012 roku Lefkowitz i Kobilka za badania nad receptorami związanymi z białkami G GPCR. Wydaje się że nagrody te miały głęboki sens bowiem receptory GPCR współdziałają z większością hormonów neuroprzekaźników i neuromodulatorów i badania nad ich funkcją w komórce mają istotne znaczenie terapeutyczne [55-58]. Podział receptorów P1 na 4 podtypy: A 1 A 2A A 2B A 3 jest związany z pełnionymi przez te receptory określonymi funkcjami. Homologia w sekwencji reszt aminokwasowych między poszczególnymi podtypami jest mała i nie przekracza 50%. Wszystkie jednak jak przedstawiono powyżej mają podobną strukturę i działają według jednego ogólnego mechanizmu włączającego udział białek G (Ryc. 1). I tak receptory A 1 i A 3 są związane z białkiem G i wrażliwym na toksynę krztuśca podczas gdy receptory A 2A i A 2B są zwią
6 zane z białkiem G s wrażliwym na toksynę cholery [52]. Białka G i hamują a białka G s stymulują (w obu przypadkach ich podjednostki α) aktywność cyklazy adenylanowej (AC). A więc w wyniku aktywacji przez adenozynę receptory przekazują sygnał na określone białka G które działając na dany efektor w tym przypadku cyklazę adenylanową powodują albo wzrost albo zmniejszenie poziomu cyklicznego AMP (camp) w komórce (Ryc. 1). Ponadto receptory A 1 i A 3 są również związane z białkiem Gq/G 11 którego aktywacja prowadzi do stymulacji aktywności fosfolipazy C i w efekcie kaskady następujących po sobie reakcji do zwiększenia stężenia wolnych jonów wapnia w komórce [59]. Ponadto receptor A 1 dominujący w sercu i w centralnym układzie nerwowym może przez włączenie białka G o (również hamującego cyklazę adenylanową) oddziaływać bezpośrednio na kanał K + w błonie plazmatycznej i przez jego otwarcie i wypływ K + z komórki prowadzić do hiperpolaryzacji błony stanowiąc podstawę antyepileptycznego działania adenozyny [4860]. Z kolei receptor A 3 może również aktywować kaskadę kinaz MAP a także z udziałem białka G 12/13 aktywować małe jednopodjednostkowe białko G białko RhoA (nie pokazano na Ryc. 1) [48]. Receptory A 1 i A 2A charakteryzuje wysokie powinowactwo do adenozyny co powoduje możliwość ich aktywacji przez jej fizjologiczne stężenia występujące po pobudzeniu komórki w warunkach normalnych. Natomiast receptory A 2B i A 3 charakteryzują się niskim powinowactwem toteż jedynie wysokie stężenia adenozyny są zdolne do ich aktywacji. W warunkach niedotlenienia (hipoksji) występujących w ischemii stanach zapalnych czy wnętrzu litych guzów nowotworowych następuje znaczne zwiększenie stężenia adenozyny jej akumulacja. Jest to spowodowane zatrzymaniem syntezy ATP przez nieaktywną w tych warunkach cytosolową kinazę adenozyny i wskazuje na rolę receptorów P1 w powyższych stanach patologicznych [48]. Receptory adenozyny są szeroko rozpowszechnione w świecie żywym często w jednej komórce występuje więcej niż jeden ich podtyp. Wytłumaczeniem tego zjawiska może być właśnie odpowiedź na różne stężenia adenozyny. I tak w płodowych komórkach miocytów serca kurczaka występują wspólnie receptory A 2A i A 2B. Oba będąc związane z białkiem G s generują zwiększenie poziomu camp i odgrywają rolę w procesie skurczu. Za proces ten w warunkach fizjologicznych odpowiada jednak jedynie receptor A 2A natomiast przy niedokrwistości (ischemii) za proces ten odpowiada receptor A 2B [52]. Z kolei w neutrofilach niskie stężenia adenozyny aktywują receptor A 1 związany z białkiem G i podczas gdy wysokie działają na receptor A 2B związany z białkiem G s niwelując efekty wywołane przez receptor A 1 [61]. W układzie limfatycznym receptory adenozynowe P1 odgrywają istotną rolę w mechanizmie selekcji limfocytów T w trakcie ich dojrzewania w grasicy. Likwidacja autoreaktywnych klonów odbywa się na drodze apoptozy indukowanej przez adenozynę [51]. W układzie limfatycznym występuje szeroko rozpowszechniony receptor A 2A. Występuje on także w mózgu w obszarach charakteryzujących się wysoką reprezentacją receptorów dopaminowych. Takim obszarem bogatym w receptory D2 jest prążkowie (striatum). W prążkowiu wzajemne działanie receptorów A 2A i D2 jest antagonistyczne bowiem A 2A poprzez białko G s pozytywnie oddziałuje na cyklazę adenylanową a D2 są związane z białkiem G i i hamują aktywność tego enzymu. Uważa się że zmiany w funkcjonalnym współdziałaniu tych receptorów mogą odgrywać rolę w rozwoju choroby Parkinsona. W chorobie tej następuje drastyczne obniżenie poziomu dopaminy. Wydaje się że zastosowanie selektywnych antagonistów receptora A 2A mogłoby stanowić pewną nową formę terapii powstrzymującą rozwój choroby Parkinsona [62]. Receptor A 3 poznano stosunkowo najpóźniej. Jest on pierwszym podtypem receptora P1 który został sklonowany przed charakterystyką farmakologiczną [48]. Choć obecnie struktura jego jest już poznana to właściwości tego receptora są stale trudne do dokładnego określenia ze względu na niską homologię międzygatunkową i różny profil farmaceutyczny np. różną odpowiedź na działanie antagonistów a nawet różne rozmieszczenie tkankowe [63]. Wysoka ekspresja mrna białka receptorowego A 3 występuje w płucach mózgu sercu czy wątrobie a bardzo wysoka jest charakterystyczna dla różnych linii komórek nowotworowych. Poziom białka receptorowego A 3 jest w tych komórkach tak wysoki że Gessi i wsp. [63] zaproponowali nawet uznanie go za marker nowotworzenia. Receptor A 3 jest związany z białkiem G i i G q a więc zmniejsza poziom camp i powoduje wzrost stężenia Ca 2+ w komórce (Ryc. 1). Ponadto przez podjednostkę β/γ białka G i stymuluje kaskadę MAP kinaz co w efekcie końcowym prowadzi do indukcji czynników transkrypcyjnych w jądrze i wpływa na ekspresję genów. W liniach komórkowych czerniaka chłoniaka i komórek raka prostaty in vitro receptor A 3 działa na białko G i. Wynikiem zahamowania syntezy camp jest redukcja aktywności kinazy białkowej A i kinazy białkowej B zwanej także Akt [48]. Z drugiej strony aktywacja białka G q prowadzi do stymulacji aktywności fosfolipazy C (PLC) i wzrostu stężenia Ca 2+. Wydłużony w czasie sygnał wapniowy i zahamowanie aktywności powyższych kinaz prowadzi do zahamowania proliferacji komórek i włączenia szlaku prowadzącego do apoptozy. To proapoptotyczne działanie receptora A 3 sugeruje możliwość używania agonistów tego receptora w chemioterapii przeciwko nowotworowym liniom komórkowym [63]. Natomiast w przypadku litych guzów nowotworowych działanie receptora A 3 jest odmienne bowiem stymulując kaskadę szlaku MAP kinaz działa w kierunku wzmożenia proliferacji; w tym przypadku użyteczni w terapii mogliby być antagoniści tego receptora [4863]. Konkludując receptor A 3 może zarówno stymulować jak i hamować proliferację nowotworów a jego wielostronne działanie jest od kilku lat przedmiotem intensywnych badań [48]. RECEPTORY P2Y METABOTROPOWE AKTYWOWANE PRZEZ NUKLEOTYDY Receptory P2Y reprezentują najliczniejszą grupę wśród wszystkich receptorów nukleotydowych. Należy do nich 8 podtypów: P2Y 1 P2Y 2 P2Y 4 P2Y 6 P2Y 11 P2Y 13 i P2Y 14 aktywowanych przez nukleotydy purynowe i pirymidynowe: ATP ADP UTP UDP i cukrowe pochodne UDP. Brakujące numery receptorów P2Y odpowiadają receptorom nie w pełni scharakteryzowanym tzw. sierocym czy znalezionym u kręgowców ale niemającym jak dotąd odpowied- Postępy Biochemii 60 (4)
7 ników u ssaków [64]. Wszystkie należą do wielkiej rodziny receptorów metabotropowych GPCR a więc charakteryzują się obecnością 7 domen transbłonowych i przekazywaniem sygnałów do wnętrza komórki przez współdziałające z receptorami trójpodjednostkowe (α/β/γ) białka G. Wiązanie liganda ma miejsce w utworzonej przez domeny TM3 TM6 i TM7 kieszeni w błonie plazmatycznej. Za ten proces odpowiadają dodatnio naładowane reszty aminokwasów obecne w domenach tworzących kieszeń oddziałujące elektrostatycznie z grupami fosforanowymi nukleotydów docierającymi do komórki od strony zewnętrznej. Regiony te są zachowane w ewolucji mimo że homologia między poszczególnymi podtypami receptorów P2Y wynosi od 21% do 57% wskazując na ich różnorodność [ ]. Filogenetycznie i strukturalnie podtypy receptorów P2Y dzielimy na dwie grupy co znajduje swoje odbicie w drzewie filogenetycznym [64]. Do pierwszej należą receptory P2Y 1 P2Y 2 P2Y 4 P2Y 6 i P2Y 11 do drugiej P2Y 13 i P2Y 14. O ich rozróżnieniu decydują reszty aminokwasów w domenie TM6 i TM7. Dla wiązania agonistów istotny jest występujący w domenie TM6 u wszystkich receptorów P2Y motyw: H-X-X-R/K. Natomiast w domenie TM7 u podtypów receptorów P2Y należących do pierwszej grupy występuje motyw: Y-Q/K-X-X-R. Receptory drugiej grupy receptory P2Y 13 i P2Y 14 takiego motywu nie posiadają charakteryzuje je natomiast występujący w domenie TM7 motyw: K-E-X-X-L [64]. Ponadto funkcjonalnie receptory pierwszej grupy współpracują z białkami G typu G q/11 (pewien wyjątek stanowi receptor P2Y 11 o czym szerzej będzie mowa później) a drugiej z białkami typu G i/o (Ryc. 1). Przedstawiony powyżej podział ma charakter filogenetyczno-strukturalno-funkcjonalny. Natomiast od strony farmakologicznej receptory P2Y 1 -P2Y 13 charakteryzują się różną wrażliwością na nukleotydy adeninowe i urydynowe i możemy je podzielić na te które odpowiadają na ATP i ADP te które odpowiadają na UTP i UDP oraz te które charakteryzują się tzw. selektywnością mieszaną [64]. Receptor P2Y 14 to stosunkowo niedawno sklonowane białko receptorowe uważane do 2003 r. za tzw. receptor sierocy [64]. Receptor P2Y 14 należy do drugiej grupy receptorów P2Y i farmakologicznie odpowiada na cukrowe pochodne UDP [64]. Wszystkie receptory zakwalifikowane do pierwszej grupy: P2Y 1 P2Y 2 P2Y 4 P2Y 6 i P2Y 11 są związane z białkami G q/11 [5157]. Ich stymulacja poprzez białko G q powoduje aktywację PLC (Ryc. 1). Jest to fosfolipaza C typu β działająca specyficznie na znajdujący się w błonie plazmatycznej fosfolipid inozytolowy fosfatydyloinozytolo-(45)-bisfosforan (PIP 2 ) [65]. W związku z tym w powyższym szlaku sygnalizacyjnym sekwencja zdarzeń jest następująca: agonista działa na receptor sprzężony z białkiem G q. Podjednostka α tego białka aktywuje fosfolipazę C typu β. Zaktywowany enzym działa hydrolitycznie na fosfolipid PIP 2. W wyniku hydrolizy powstają dwa wtórne przekaźniki informacji: trisfosfoinozytol (IP 3 ) i diacyloglicerol (DAG). DAG pozostaje w błonie plazmatycznej i aktywuje kinazę białkową C (PKC); DAG jest uważany za naturalny aktywator tej kinazy [57]. Aktywna PKC może wywierać hamujący efekt na receptor oraz na PLC hamując hydrolizę PIP 2 i wygaszając sygnał wapniowy [66]. Aktywacja PKC prowadzi też do zwiększenia aktywności fosfolipazy D (PLD) oraz szlaku kinaz MAP [65]. Natomiast IP 3 cząsteczka inozytolu z 3 resztami fosforanowymi w pozycji 145 pierścienia inozytolowego jest dobrze rozpuszczalna w wodzie i dyfunduje z błony plazmatycznej do siateczki śródplazmatycznej. Siateczka śródplazmatyczna jest głównym magazynem jonów wapnia w komórce zwierzęcej. IP 3 łączy się w błonie siateczki ze specyficznym receptorem IP 3 będącym kanałem jonowym. Po związaniu IP 3 kanał otwiera się i zmagazynowane jony Ca 2+ zostają uwolnione do cytosolu [67]. Opróżnienie magazynów siateczki śródplazmatycznej stanowi sygnał do otwarcia specyficznego niezależnego od napięcia kanału w błonie plazmatycznej i napływu dodatkowej porcji Ca 2+ z przestrzeni międzykomórkowej w tzw. procesie pojemnościowego napływu jonów wapnia (ang. capacitative calcium entry) [6768]. A więc efektem końcowym aktywacji receptora związanego z białkiem G q jest zwiększenie poziomu wolnych jonów wapnia w cytosolu co schematycznie przedstawia rycina 1 i rycina 3. Stężenie Ca 2+ w cytosolu jest niskie i w komórce niepobudzonej wynosi około nm podczas gdy w płynach ustrojowych jest to wartość dziesięć tysięcy razy większa (1-2 mm). Po pobudzeniu komórki poziom Ca 2+ wzrasta dziesięciokrotnie (1 µm) i dlatego zmiana stężenia tego jonu jest tak ważna kontrolująca wiele życiowych procesów jak wzrost podział różnicowanie procesy apoptozy zapłodnienie i śmierć [68]. Należy dodać że PIP 2 może ulegać nie tylko hydrolizie lecz także fosforylacji prowadzącej do powstania fosfatydyloinozytolo-(345)-trisfosforanu (PIP 3 ). Ten fosfolipid nie ulega hydrolizie przez PLCβ a rekrutuje do błony plazmatycznej kinazę białkową B zwaną także Akt i wiążąc się z nią powoduje jej aktywację [5765]. Kinaza ta pełni istotne funkcje prożyciowe zapobiegające apoptozie; zahamowanie jej aktywności ma działanie przeciwne Rycina 3. Działanie nukleotydów na wybrane receptory P2 i generowane przez nie szlaki sygnalizacyjne. ATP działa na receptory P2X (składające się z 3 podjednostek tworzących kanał) i razem z UTP aktywuje receptor P2Y 2. Ektoenzymy hydrolizują ATP do ADP i adenozyny która działa na receptory P1. ADP stymuluje zarówno receptor P2Y 1 jak i receptor. Receptory P2Y 1 i P2Y 2 poprzez białko G q aktywują PLC która hydrolizuje PIP 2 do DAG i IP 3. DAG aktywuje PKC a IP 3 dyfunduje do siateczki śródplazmatycznej (ER ang. endoplasmic reticulum) i wiążąc się ze specyficznym receptorem uwalnia jony Ca 2+ do cytosolu. Receptor poprzez białko G i hamuje aktywność AC i zmniejsza poziom camp w komórce hamując aktywność PKA. Objaśnienie używanych skrótów w tekście zmodyfikowano wg [65]
8 Tabela 1. Wybrane właściwości receptorów P2Y. Liczba Podtyp aminokwasów Agoniści Antagoniści Oddziaływanie efekt P2Y MeSADP > 2MeSATP = ADP > ATP MRS 2279 MRS 2179 PPADS suramina G q ð Ca 2+ P2Y UTP = ATP Suramina G q ð Ca 2+ P2Y UTP ATP Reactive Blue 2 PPADS G q ð Ca 2+ P2Y UDP > UTP >> ATP Reactive Blue 2 PPADS suramina G q ð Ca 2+ P2Y AR-C67085MX > BzATP ATPγS > ATP Suramina Reactive Blue 2 G q ð Ca 2+; ; G s ð camp 342 ADP = 2MeSADP> Ap 4 A AR-C67085MX Cangrelor G i ð camp P2Y * ADP = 2MeSADP>> ATP oraz 2MeSATP AR-C67085MX Cangrelor PPADS Ap 4 A G i ð camp P2Y UDP-glukoza = UDP-galaktoza G i ð camp ; Ca 2+ Oznaczenia: 2MeSADP 2-metylotio-ADP; 2MeSATP 2-metylotio-ATP; Ap 4 A diadenozyno-55-p 1 P 4 tetrafosforan; ATPgS 3-tio-ATP; AR- C67085MX 2-propylotio-D-βγ-dichlorometyleno ATP; Cangrelor znany również jako AR-C69931MX (dwuwodzian metylowy [(2R3S4R5R)- 34-dihydroksy-5-[6-(2-metylosulfanyletylamino)-2-(333-trifluoropropylosulfonylo)puryno-9-yl]oksolan-2-yl] metylofosforanu); BzATP 2 3 -O-(4-benzoilobenzoil)-ATP; MRS deoksy-n6-metylo-adp; MRS 2279 dwuwodzian (1R2S4S5S)-4-[2-Chloro-6-(metyloamino)- 9H-puryno-9-yl ]-2-(fosfonooksy)bicyklo[3.1.0]heksano-1-metanolu; PPADS 6-azofenylo-2 4 -disulfonowy fosforan pirydoksalu (ang. pyridoxal phosphate-6-azo(benzene-24-disulfonate)); wzrost stężenia; spadek stężenia. *49% identyczność sekwencji aminokwasowej z receptorem pro-apoptotyczne co już sygnalizowano poprzednio omawiając działanie receptora A 3. Szlak sygnałowy prowadzący do mobilizacji Ca 2+ w komórce jest typowy dla receptorów P2Y 1 P2Y 2 P2Y 4 i P2Y 6. Do pierwszej grupy należy jednak również receptor P2Y 11. Ten receptor stanowi wyjątek bowiem może być związany nie tylko z białkiem G q/11 lecz także z białkiem G s (Ryc. 1). W konsekwencji oddziałuje pozytywnie na dwa szlaki sygnałowe aktywując zarówno PLCβ jak i cyklazę adenylanową (AC) prowadząc do mobilizacji Ca 2+ i powodując zwiększenie poziomu camp w komórce [5]. Z kolei receptory P2Y 13 i P2Y 14 należące do drugiej grupy zmniejszają poziom camp w komórce hamując aktywność AC. Te receptory są związane z białkiem G i/o (Ryc. 1). Tabela 1 przedstawia właściwości receptorów P2Y. W przypadku receptora P2Y 1 we wszystkich badanych komórkach ssaków naturalnym i najsilniej działającym agonistą jest ADP. ATP jest znacznie mniej aktywny natomiast stabilny analog ADP 2-methylotio-ADP (2MeSADP) działa nawet silniej niż ADP. Nukleotydy pirymidynowe UTP i UDP na receptor ten nie działają w ogóle. Specyficznymi antagonistami tego receptora są związki MRS2197 i MRS2279 a także suramina i PPADS [9] (Tab. 1). Receptor ten jest szeroko rozpowszechniony występuje w tkance nerwowej łącznej układzie immunologicznym i naczyniowym. Receptor P2Y 1 jest związany z białkiem G q którego podjednostka α aktywuje PLCβ a kompleks β/γ może bezpośrednio aktywować kanały potasowe w błonie plazmatycznej [679]. Receptor P2Y 2 występujący zarówno u ludzi jak i w organizmach gryzoni jest w równym stopniu wrażliwy na ATP jak na UTP; pozostałe nukleotydy działają na niego w stopniu minimalnym. Występuje równie powszechnie jak P2Y 1 i podobnie jego aktywacja prowadzi poprzez białko G q do stymulacji PLCβ mobilizacji Ca 2+ i aktywacji PKC. Receptor ten może także stymulować PLCβ z udziałem kompleksu β/γ białka G i co w konsekwencji prowadzi również do mobilizacji Ca 2+ w komórce [9]. Toteż efekty działania P2Y 2 są często wywołane zwiększeniem stężenia Ca 2+ w cytosolu i dotyczą np. aktywacji kanałów potasowych czy chlorkowych czy hamowania aktywności cyklazy adenylanowej [6965]. Receptor P2Y 4 w organizmach gryzoni jest podobnie jak P2Y 2 w tym samym stopniu wrażliwy na ATP jak i na UTP. Receptory te w inny jednak sposób odpowiadają na antagonistów bowiem aktywność P2Y 2 hamuje suramina a aktywność P2Y 4 hamuje Reactive blue 2 i PPADS (Tab. 1). Natomiast w organizmie człowieka receptor P2Y 4 charakteryzuje się inną wrażliwością jest aktywowany przez nukleotydy pirymidynowe UTP i UDP przy czym działanie UTP jest silniejsze. Podobnie receptor P2Y 6 ; jest on selektywnie wrażliwy na UDP słabiej na UTP a na ATP i ADP odpowiada bardzo słabo jeśli w ogóle (Tab. 1). Receptory P2Y 4 i P2Y 6 różni w organizmie człowieka rozmieszczenie tkankowe. P2Y 4 występuje niemal wyłącznie w łożysku a P2Y 6 jest znajdowany w mózgu mięśniach gładkich naczyń krwionośnych śródbłonku naczyniowym czy makrofagach. Dlatego należy przypuszczać że to receptor P2Y 6 odpowiada w organizmie ludzkim za przekazywanie informacji z udziałem nukleotydów pirymidynowych [67965]. Stosunkowo niedawno odkryty w łożysku receptor P2Y 11 charakteryzuje się selektywnością dla ATP odpowiada także na pochodne tego nukleotydu (silniej niż na ATP) i nie reaguje na UTP czy UDP [65] (Tab. 1). Jak już powiedziano powyżej receptor ten jest związany zarówno z białkiem G q jak i G s. Receptory należące do drugiej grupy to receptory P2Y 13 i P2Y 14. Receptor występował uprzednio pod nazwą P2Y ADP. Wiadomym było że występuje w błonie komórkowej płytek krwi i że zewnątrzkomórkowy ADP działając na płytki powoduje widoczną zmianę ich kształtu w wyniku następującej agregacji. Taki efekt działania ADP obserwowano od ponad 50 lat. Wiadomym też było że zmiany te związane są ze spadkiem aktywności cyklazy adenylanowej i zmniejszeniem poziomu camp w cytosolu wraz z jednoczesnym wzrostem stężenia Ca 2+. Przez lata nie udało się jednak sklonować tego receptora i sugerowano że być może powyższe efekty są wywoływane przez receptor P2Y 1 [69]. Dopiero rok 2001 przyniósł przełom receptor występujący w płytkach krwi został wreszcie sklonowany i nazwany [70]. Jednocześnie stwierdzono jego bardzo ni- Postępy Biochemii 60 (4)
9 ską wynoszącą jedynie 24% homologię z receptorem P2Y 1 co automatycznie wykluczało poprzednie przypuszczenia choć dalsze badania wykazały daleko idącą zbieżność lokalizacji obu tych receptorów. Dalsze badania potwierdziły także wyłączny udział receptora w hamowaniu pod wpływem ADP aktywności cyklazy adenylanowej w płytkach krwi [70] oraz w komórkach glejaka C6 [71]. Natomiast za proces mobilizacji Ca 2+ obserwowany podczas agregacji płytek krwi odpowiada receptor P2Y 1 [70]. Odkrycie receptora ułatwiło sklonowanie jego bliskiego homologa (48% identyczności) receptora P2Y 13. Te dwa receptory są podobne filogenetycznie i strukturalnie obydwa są związane z białkiem G i/o wrażliwym na toksynę krztuśca (PTX ang. pertusis toxin) są selektywnie wrażliwe na ADP i 2Me- SADP blokowane przez pochodne ARC a do ich rozróżnienia mogą służyć określone syntetyczne związki pełniące rolę agonistów i antagonistów (Tab. 1). I tak PPADS jest antagonistą P2Y 13 ale nie działa na a z kolei Ap 4 A działa jako agonista receptora ale jest antagonistą receptora P2Y 13 [65] (Tab. 1). Należy dodać że receptor prowadzi także szlak sygnałowy którym jest aktywacja szlaku MAP kinaz (ERK1/ERK2) oraz kinaz PI3K/Akt przy czym procesy te są niezależne od Ca 2+ i PKC [72]. Z białkiem G i/o jak powiedziano powyżej jest również związany receptor P2Y 14 (Ryc. 1). Receptor ten został sklonowany w 2000 r. ale jego dokładniejsza charakterystyka i nadanie nazwy miało miejsce ostatecznie w roku 2003 [64]. Receptor ten wykazuje 45% homologii z receptorem i jest aktywowany przez monosacharydowe pochodne nukleotydów UDP-glukozę UDP-galaktozę UDP-glukoronian i UDP-N-acetyl-glukozaminę podczas gdy ATP ADP i UTP nie wywierają na niego wpływu [65] (Tab. 1). Receptor ten przez podjednostkę α białka G i/o hamuje aktywność AC ale ponadto przez kompleks podjednostek β/γ może dodatkowo w pewnych komórkach aktywować PLCβ i powodować mobilizację Ca 2+ w komórce [6573]. Podobna aktywacja PLCβ przez podjednostki β/γ białka G i/o występuje też w przypadku innych receptorów P2Y a wśród nich jak już wspomniano receptora P2Y 2 [9]. Obecność receptora P2Y 14 stwierdzono w łożysku tkance tłuszczowej sercu mózgu a także komórkach gleju (astrocytach i mikrogleju) i komórkach glejaka C6 [73]. W komórkach astrocytów i mikrogleju jego poziom jest regulowany przez czynniki prozapalne co może sugerować udział receptora P2Y 14 w przekazywaniu sygnału między układem immunologicznym a nerwowym. Ostatnio wykazano że UDP może być także aktywnym agonistą receptora P2Y 14 przy czym daleko posunięta zbieżność występowania tego receptora wraz z receptorem P2Y 6 w tkankach organizmów ludzi i gryzoni sugeruje możliwość wspólnej odpowiedzi obu receptorów na UDP [74]. W takim przypadku P2Y 14 hamowałby zależną od białka G i cyklazę adenylanową a P2Y 6 stymulowałby poprzez białko G q aktywność fosfolipazy C zwiększając poziom Ca 2+ w komórce [74]. Należy dodać że receptory P2Y mogą także aktywować małe białka G a także oddziaływać z integrynami biorąc aktywny udział w migracji komórek [65]. Natomiast uwalniany do przestrzeni zewnątrzkomórkowej ATP może brać udział w komunikacji międzykomórkowej typu: astrocyt-astrocyt czy astrocyt-neuron [75]. Rycina 3 częściowo obrazuje przekazane dotychczas informacje dotyczące receptorów P2Y. Zewnątrzkomórkowe ATP i UTP działają równocennie na receptor P2Y 2. W wyniku działania ektoenzymów ADP powstający z ATP działa zarówno na receptor P2Y 1 jak i. Receptory P2Y 1 i P2Y 2 są związane z białkiem G q i ich aktywacja powoduje mobilizację Ca 2+ w komórce podczas gdy zmniejsza poziom camp. A więc receptory P2Y 1 i P2Y 2 aktywowane odpowiednio przez ADP i ATP lub UTP współdziałają ze sobą w kierunku zwiększenia stężenia jonów Ca 2+ w komórce. Natomiast w przypadku ADP działającego jednocześnie na P2Y 1 i odpowiedzi różnych komórek są różne. W płytkach krwi aktywacja obu tych receptorów przez ADP wywołuje wspólnie proces agregacji jest to więc przykład pozytywnej współpracy. W komórkach glejaka C6 odpowiedź jest inna. Należy dodać że w zdrowych komórkach astrocytów czy neuronów receptor P2Y 1 dominuje podczas gdy w komórkach nowotworowych pochodzenia neuronalnego nie jest znajdowany [76]. Komórki glejaka C6 są komórkami nowotworowymi pochodzenia glejowego. Charakteryzują się zwiększoną ekspresją mrna białka receptorowego a receptor P2Y 1 choć jest w nich obecny jest wysoce niestabilny. W niesprzyjających warunkach fizjologicznych np. przy długotrwałej hodowli komórek w środowisku niezawierającym surowicy ekspresja mrna białka receptorowego P2Y 1 zanika i na ADP odpowiada wyłącznie receptor. Można sądzić że powodem tego jest tendencja komórek nowotworowych do wzmożonej proliferacji bowiem w komórkach glejaka C6 receptor moduluje aktywność szlaku MAP kinaz (ERK1/ERK2) i szlaku kinaz PI3K/Akt działających stymulująco na proliferację i zwiększających inwazyjność podczas gdy P2Y 1 działa hamująco na aktywność kinaz PI3K/Akt [1972]. W warunkach fizjologicznie niesprzyjających niska ekspresja mrna białka receptorowego P2Y 1 a wysoka sprzyja zatem procesom przeżywania a więc w przypadku komórek glejaka C6 działanie receptorów P2Y 1 i jest przeciwstawne [196572]. Reasumując różnorodność szlaków sygnałowych uruchamianych przez receptory P2Y i ich wzajemne współzależności generują w różnych komórkach różne odpowiedzi zależne od różnych stanów fizjologicznych co wskazuje na bogactwo wywoływanych przez nie efektów biologicznych. RECEPTORY P2X JONOTROPOWE AKTYWOWANE PRZEZ ATP Receptory P2X są błonowymi kanałami jonowymi otwieranymi przez przyłączenie ATP lub jego syntetycznych pochodnych. A więc otwieranie kanału następuje przez wiązanie liganda a nie przez zmianę napięcia błony. Dlatego kanały te zostały zakwalifikowane jako receptory receptory jonotropowe. Jak już sama nazwa wskazuje są one odmienne od receptorów metabotropowych których przedstawicielami były opisane poprzednio receptory P1 i P2Y. Przede wszystkim nie są monomerami występują jako wielkocząsteczkowe oligomeryczne białka w skład których wchodzi kilka podjednostek otaczających centralnie zlokalizowany kanał. Receptory jonotropowe są zarówno homo- jak i heterooligomerami. Funkcjonalny receptor P2X składa się zazwyczaj z trzech podjednostek okalających i tworzących 432
10 mórkowej. Te dwa parametry są miarą aktywności danego receptora P2X [ ]. Receptory jonotropowe bezpośrednio związane z kanałem jonowym to receptory dla szybkich neuroprzekaźników biorące udział w szybkiej transmisji sygnałowej. Toteż głównym miejscem ich lokalizacji jest błona komórek neuronalnych ale też komórek mięśni a więc komórek pobudliwych. Zasada ta dotyczy także receptorów P2X choć występują również w komórkach niepobudliwych takich jak np. komórki tuczne granulocyty limfocyty monocyty komórki skóry trzustki a także komórki glejowe czy glejaki w tym komórki glejaka C6 [ ]. Rycina 4. Schemat budowy receptorów P2X. Podjednostka receptora zawiera dwie domeny transbłonowe (TM12). Duża pętla zewnątrzkomórkowa zawiera mostki dwusiarczkowe zaznaczone jako S-S miejsca glikozylacji zaznaczone niebieskim gwiazdkami i hydrofobowy region H5 modulujący kanał przez wiązanie kationów. Końce N- i C- znajdują się od strony cytosolowej błony komórkowej (zmodyfikowano wg. [5]). kanał (Ryc. 3). Dotychczas sklonowano siedem podtypów receptorów P2X: P2X 1-7 a homologia sekwencji ich reszt aminokwasowych mieści się w granicach 30-50% [67778]. Schemat budowy monomeru/podjednostki receptora P2X przedstawia rycina 4. Jak widać monomer zawiera w swojej cząsteczce dwie domeny transbłonowe a końce C- i N- białka receptorowego są zlokalizowane po stronie cytosolowej. Bardzo duża część zewnątrzkomórkowa tworząca pętlę łączącą domeny składa się z 280 reszt hydrofilowych aminokwasów podczas gdy białko receptorowe zawiera od 379 do 595 reszt aminokwasów. W skład pętli wchodzą liczne miejsca glikozylacji a także 10 reszt cysteinowych tworzących mostki dwusiarczkowe; jest to cecha charakterystyczna receptorów P2X. Sekwencja aminokwasów w pętli jest zachowana ewolucyjnie podczas gdy domeny transbłonowe o strukturze α-helisy mogą się od siebie znacznie różnić. W tworzenie części kanałowej receptora otwierającej i zamykającej kanał jonowy jest zaangażowana domena TM1. ATP wiąże się do regionu pętli zewnątrzkomórkowej przyległej do domen w bliskim sąsiedztwie z błoną plazmatyczną. Hydrofobowy region H5 pętli moduluje kanał przez przyłączenie kationów Mg 2+ Zn 2+ Ca 2+ i Cu 2+ (Ryc. 4) [67778]. Związanie liganda i aktywacja receptora przez ATP (ale nie przez UTP) prowadzi do otwarcia kanału przepuszczalnego selektywnie dla jonów Ca 2+ Na + i K +. Jony Ca 2+ i Na + napływają do komórki ze środowiska zewnątrzkomórkowego a jony K + wypływają z komórki zgodnie z gradientem stężeń. Przepływ tych jonów powoduje depolaryzację błony i może dodatkowo prowadzić do otwarcia zależnych od napięcia kanałów wapniowych i powodować dalszy napływ Ca 2+ do komórki. Zatem w wyniku aktywacji receptorów P2X otwarcie kanałów tych receptorów powoduje wzrost stężenia cytosolowego Ca 2+ i redukcję potencjału błony ko- ATP jest selektywnym ligandem jonotropowych receptorów P2X ale jak wiadomo oddziałuje również z receptorami metabotropowymi P2Y powodując w obu przypadkach wzrost stężenia jonów Ca 2+ w cytosolu komórki. Rozróżnienie obu typów receptorów jest możliwe dzięki różnej szybkości działania receptorów i odpowiedzi komórki po ich stymulacji. W receptorach jonotropowych efekt działania agonisty osiąga szczyt w ciągu kilku milisekund i równie szybko zanika podczas gdy receptory metabotropowe są wielokrotnie wolniejsze działają przez aktywację białek G i generowanie wtórnych przekaźników informacji toteż odpowiedź komórki na ich stymulację jest obserwowana w minutach. Podobnie jest w przypadku receptorów P2Y związanych z białkiem G q. Takim przykładem może być aktywowany przez ATP czy UTP receptor P2Y 2 gdzie po stosunkowo szybkim wyrzucie jonów Ca 2+ z siateczki śródplazmatycznej podwyższony poziom Ca 2+ w komórce utrzymuje się przez kilka minut. Dla doświadczonego badacza odpowiedzi tego typu nie sposób pomylić z nagłą przemijającą odpowiedzią wapniową obserwowaną po pobudzeniu przez ATP receptorów jonotropowych P2X [657980]. Aktywność receptora jonotropowego można także mierzyć przez pomiar prądu jonowego przewodzonego przez pojedynczy kanał stosując metodę patch-clamp [7778]. Podtypy receptorów P2X występują dość powszechnie w układzie nerwowym gdzie odpowiadają za transmisję sygnałową i w mięśniach gładkich szczególnie w układzie naczyniowym oraz pęcherzu moczowym gdzie odpowiadają za skurcz. Jednak w kilku przypadkach można mówić o ich dużej specyficzności. Receptor P2X 1 jest jedynym receptorem P2X występującym w komórkach mięśni gładkich naczyń krwionośnym a P2X 3 występuje w niektórych nerwach czuciowych. Receptor P2X 3 znajdujący się na zakończeniach nerwów czuciowych w skórze uczestniczy w reakcji na ból i dotyk. Bierze też udział w indukcji przewlekłego bólu [89]. Receptor P2X 5 jest znajdowany w obwodowym układzie nerwowym i rdzeniu kręgowym a nie występuje w mózgu [7778]. Receptor ten odgrywa istotną rolę w procesie różnicowania mioblastów w komórkach satelitarnych C2C12 [80]. Z kolei receptor P2X 7 występuje zarówno w komórkach neuronalnych i komórkach mięśni szkieletowych jak i w niektórych komórkach układu immunologicznego komórkach tucznych granulocytach monocytach i limfocytach a także komórkach nabłonka śródbłonka czy w komórkach glejowych [657778]. Postępy Biochemii 60 (4)
11 Poszczególne podtypy receptorów P2X różnią się między sobą nie tylko rozmieszczeniem tkankowym lecz także wrażliwością na agonistów antagonistów oraz podatnością na desensytyzację. Jak już powiedziano naturalnym agonistą wszystkich receptorów P2X jest ATP różni je jednak wrażliwość na syntetyczne analogi ATP takie jak αβmetyleno-atp (αβmeatp) oraz 2-metylotio-ATP (2Me- SATP) [ ]. Z różną też wrażliwością reagują na antagonistów którymi dla wszystkich podtypów za wyjątkiem receptora P2X 7 jest PPADS i suramina jednak należy przypomnieć że zarówno suramina jak i PPADS są także antagonistami receptorów P2Y (Tab. 1). Specyficznym antagonistą receptora P2X 7 jest Briliant blue G [7879]. Receptor P2X 7 różni się od pozostałych podtypów także odpowiedzią na agonistów. Receptor P2X 7 jest receptorem atypowym jego właściwości odbiegają od pozostałych receptorów P2X. Główną różnicę stanowi stosunkowo niskie powinowactwo do ATP; receptor P2X 7 do swojej aktywacji wymaga milimolowych stężeń tego nukleotydu o rząd wielkości większych niż inne receptory. Dopiero tak wysokie stężenie otwiera kanał i powoduje szybki napływ Ca 2+ i Na + do komórki i wypływ K + tak jak ma to miejsce w przypadku pozostałych receptorów P2X. Następną różnicą jest odpowiedź receptora P2X 7 na syntetycznego agonistę którym dla tego receptora jest analog ATP 2 3 -O-(4-benzoilobenzoil)-ATP (BzATP). Receptor P2X 7 jest od 10 do 30 razy bardziej czuły na BzATP niż na ATP. Należy dodać że wysokie 1mM stężenie ATP wymagane do aktywacji receptora P2X 7 może zmieniać warunki pomiaru poziomu jonów Ca 2+ w cytosolu komórki obniżając ph środowiska zewnątrzkomórkowego przez silnie ujemny ładunek tego nukleotydu. Dlatego do badań zazwyczaj używa się BzATP w odpowiednio 10-krotnie niższych stężeniach. Jednak ten syntetyczny analog ATP do niedawna stosowany jako selektywny agonista receptora P2X 7 okazał się skuteczny w aktywacji innych receptorów P2X mianowicie receptorów P2X 1 i P2X 3 [7778]. Co więcej także receptorów P2Y [79]. Badania prowadzone na komórkach glejaka C6 wykazały wbrew poprzednim danym literaturowym że odpowiedzi wapniowe generowane przez działanie BzATP były wywołane przez aktywację receptora P2Y 2 a nie P2X 7 wskazując wraz z innymi danymi doświadczalnymi że w tych komórkach receptor P2X 7 nie występuje lub jest niefunkcjonalny [79]. Kolejną wyjątkową właściwością receptora P2X 7 (przy powtarzającej się czy przedłużonej ekspozycji komórek na wysokie milimolowe stężenia ATP) jest zamiana kanałów jonowych specyficznych dla kationów na duże nieselektywne transbłonowe pory. Stosunkowo niedawno pojawiły się sugestie że przy otwieraniu błonowych porów generowanych przez aktywację receptora P2X 7 biorą także udział inne białka panneksyny-1 (ang. pannexin-1) [81]. Pory te odpowiadają za masowy napływ jonów Ca 2+ do komórki ale też są zdolne do przepuszczania większych kationów organicznych cząsteczek naładowanych dodatnio o masie nawet do 1 kda a także niektórych barwników fluoroscencyjnych [ ]. W komórkach układu immunologicznego aktywacja i tworzenie porów przez receptor P2X 7 powoduje zwiększenie wydzielania z komórek makrofagów interleukiny IL-1β [81]. Przy różnych rodzajach uszkodzeń centralnego układu nerwowego wysoki poziom uwalnianego ATP aktywując receptory P2X 7 powoduje śmierć neuronów. Właściwości receptorów P2X 7 powodują że w określonych warunkach receptor P2X 7 może być także odpowiedzialny za apoptotyczną śmierć komórki w tym komórki nowotworowej [ ]. Sygnałem włączającym proces programowanej śmierci jest zwiększenie wewnątrzkomórkowego poziomu jonów Ca 2+ dzięki otwarciu kanałów receptorowych czy utworzeniu porów. Te właściwości receptorów P2X a w szczególności receptora P2X 7 powodują że receptory te mogą pełnić istotną funkcję w procesie zwalczania nowotworów. KONKLUZJE I PERSPEKTYWY ATP i inne nukleotydy są w świecie żywym wszechobecne. Także szeroko rozpowszechnione są aktywowane przez nie receptory. Receptory nukleotydowe występują nie tylko u kręgowców; receptory ATP są znajdywane w organizmach prostych bezkręgowców takich jak pierwotniaki ameby czy śluzowce. Znaleziono je również u roślin. U śluzowca Dictostelium discoideum receptory aktywowane przez ATP są podobne do ludzkich receptorów P2X. W tych organizmach regulują one napływ i wypływ wody do komórki. Wskazuje to na pojawienie się informacyjnych funkcji nukleotydów już na wczesnych etapach ewolucji [82]. To szerokie rozpowszechnienie nukleotydów musi poniekąd powodować że znaczna liczba receptorów na które działają te związki jest stale niedostatecznie opisana. Receptory te to tzw. receptory sieroce (ang. orphan receptors). Zespół który ma największe osiągnięcia w badaniach nad takimi receptorami to zespół kierowany przez Marię Pia Abbracchio z Uniwersytetu w Mediolanie we Włoszech. Między innymi dzięki pracom tego zespołu udała się pełna charakterystyka i poznanie właściwości receptora P2Y 14 który przed zatwierdzeniem przez IUPHAR nosił nazwy GPR105 czy KIAA0001 [64]. Jak już wspomniano także receptor został stosunkowo niedawno poznany i opisany co pozwoliło następnie na identyfikację receptora P2Y 13 który jako receptor sierocy nosił uprzednio nazwy GPR86 GPR94 czy SP174 [64]. W pracowni Abbracchio zakończono prace nad charakterystyką następnego sierocego receptora receptora GPR17 wiążącego nie tylko cukrowe pochodne UDP lecz również leukotrieny. Stosunkowo niedawno opisano również receptory sieroce GPR91 i GPR99 pokrewne receptorom nukleotydowym. Receptory te choć homologiczne z receptorem P2Y 1 nie rozpoznają jednak nukleotydów a współdziałają z intermediatami cyklu Krebsa [83]. Należy dodać że w spisach IUPHAR znajdują się wszystkie receptory w tym sieroce. Badania nad receptorami sierocymi to najprawdopodobniej jeden z dwóch głównych kierunków perspektywicznych jakie będą się rozwijać w tej dziedzinie wiedzy w okresie najbliższych lat. Drugim takim kierunkiem perspektywicznym są badania o implikacjach klinicznych. Stosowane obecnie i nieustannie udoskonalane leki są ukierunkowane na etap odbierania przez receptory sygnałów i przekazywanie ich dalej na określone enzymy generujące biologicznie czynne cząsteczki wewnątrz komórki. Dlatego poznanie właści
12 wości receptorów ma ważne znaczenie terapeutyczne. Dobrym przykładem działań tego typu są badania dotyczące receptora. Określenie jego właściwości okazało się mieć istotne znaczenie kliniczne w leczeniu chorób sercowo-naczyniowych. I tak przy uszkodzeniu komórek lub po podaniu ich stresowi uwolniony z nich czynnie czy biernie ATP degradowany do ADP rozpoczyna proces gojenia ran aktywując receptory znajdujące się na płytkach krwi. Zaktywowany receptor wywołuje agregację płytek tworząc tzw. czop płytkowy zatykający uszkodzenie. Jednak ten sam mechanizm prowadzi do powstania zakrzepów w naczyniach krwionośnych powodując zawały lub udary groźne dla życia. Okazało się że stosowany w tego typu zaburzeniach lek klopidogrel zatrzymuje ten proces hamując działanie receptora uniemożliwiając tworzenie zakrzepów [787082]. Trwają badania nad poznaniem szeregu innych lekarstw które modulując aktywności receptorów działałyby terapeutycznie na rozmaite funkcje fizjologiczne narządów i tkanek [57]. Dla tego typu działań konieczne jest poznanie i porównanie funkcji receptorów w tym receptorów nukleotydowych w normie i patologii. Takie właśnie podejście reprezentują autorzy licznych artykułów publikowanych w obecnym zeszycie Postępów Biochemii. Należy dodać że także wydany w bieżącym roku numer pierwszy czasopisma Purinergic Signalling jest poświęcony w całości porównaniu receptorów nukleotydowych działających w zdrowiu i w chorobie w układzie trawiennym moczowym rozrodczym endokrynnym a także wątrobie [84]. Wszystkie artykuły przeglądowe w tym numerze Purinergic Signalling są autorstwa lub współautorstwa odkrywcy receptorów nukleotydowych Geoffreya Burnstocka. Konkludując odkryte w końcu lat siedemdziesiątych ubiegłego wieku receptory nukleotydowe są stale w centrum zainteresowań badaczy. Jest to między innymi związane z powszechnością ich występowania i coraz większą wiedzą wskazująca na ich istotną rolę w regulacji licznych procesów fizjologicznych. Dwa wymienione powyżej perspektywiczne kierunki badań w jakich prawdopodobnie będzie dalej rozwijać się ta gałąź wiedzy wzajemnie się przenikają. Badania nad sierocymi receptorami mają bowiem w zamyśle znalezienie takich których właściwości pozwolą na ściśle ukierunkowane i selektywne działania kliniczne. Działania te ograniczając lub stymulując funkcje określonych receptorów nie powinny wpływać na funkcje innych receptorów na inne komórki i inne narządy. Badania takie są już prowadzone. Można mieć nadzieję że w najbliższej przyszłości nowe generacje leków oparte na wiedzy o molekularnych właściwościach receptorów pozwolą na ograniczenie wielu chorób dręczących dziś ludzkość. PIŚMIENNICTWO 1. Burnstock G (1990) Overview purinergic mechanisms W: Dubyak GR Fedan JA (red) Biological actions of extracellular ATP. New York Academy of Sciences New York 603: Burnstock G (2006) Purinegic signalling an overview. Novartis Found Symp 276: 20-48; discussion Zimmermann H Braun N (1999) Ecto-nucleotidases molecular structures catalytic properties and functional roles in the nervous system. Prog Brain Res 120: Ziganshin AU Hoyle C Burnstock G (1994) Ecto-enzymes and metabolism of extracellular ATP. Drug Dev Res 32: Ralevic V Burnstock G (1998) Receptors for purines and pyrimidines. Pharmacol Rev 50: Burnstock G (2007) Purine and pyrimidine receptors. Cell and Mol Life Sci 64: Burnstock G Knight GE (2004) Cellular distribution and functions of P2 receptor subtypes in different systems. Int Rev Cytol 240: Burnstock G (2006) Pathophysiology and therapeutic potential of purinergic signaling. Pharmacol Rev 58: Burnstock G (2007) Physiology and pathophysiology of purinergic neurotransmission. Physiol Rev 87: Deli T Csernoch L (2008) Extracellular ATP and cancer: an overview with special reference to P2 purinergic receptors. Pathol Oncol Res 14: Lohmann K (1929) Ȕber die Pyrophosphatfraction in Muskel. Naturwissenschaften 17: Fiske CH Subbarow Y (1929) Phosphorus compounds of muscle and liver. Science 70: Drury AN Szent-Gyȍrgyi A (1929) The physiological activity of adenine compounds with special reference to their action upon the mammalian heart. J Physiol 68: Gillespie JH (1934) The biological significance of the linkages in adenosine triphosphoric acid. J Physiol 80: Lippman F (1941) Metabolic generation and utilization of phosphate bond energy. Enzymology 1: Kalckar HM (1969) Biological phosphorylations: Development of concepts. Englewood Cliffs NJ: Prentice-Hall 17. Kalckar HM (1991) 50 years of biological research from oxidative phosphorylation to energy requiring transport regulation. Ann Rev Biochem 60: Lazarowski ER Boucher RC Harden TK (2000) Constitutive release of ATP and evidence for major contribution of ecto-nucleotide pyrophosphatase and nucleoside diphosphokinase to extracellular nucleotide concentration. J Biol Chem 275: Krzemiński P Supłat D Czajkowski R Pomorski P Barańska J (2007) Expression and functional characterization of P2Y 1 and nucleotide receptors in long-term serum-deprived glioma C6 cells. FEBS J 274: Glynn IM (1968) Membrane adenosine triphosphate and cation transport. Br Med Bull 24: Chaudry IH (1982) Does ATP cross the plasma membrane. Yale J Biol Med 55: Green HN Stoner HB (1950) Biological actions of the adenine nucleotides. Lewis London 23. Bodin P Burnstock G (2001) Purinergic signalling: ATP release. Neurochem Res 26: Burnstock G (1997) The past present and future of purine nucleotides as signalling molecules. Neuropharmacol 36: Evans RJ Derkach V Surprenant A (1992) ATP mediates fast synaptic transmission in mammalian neurons. Nature 357: Sorensen CE Novak I (2001) Visualization of ATP release in pancreatic acini in response to cholinergic stimulus. Use of fluorescent probes and confocal microscopy. J Biol Chem 276: Grygorczyk R Hanrahan JW (1997) CFTR-independent ATP release from epithelial cells triggered by mechanical stimuli. Am J Physiol 272: C Guyot A Hanrahan JW (2002) ATP release from human airway epithelial cells studied using a capillary cell culture system. J Physiol 545: Milner P Bodin P Loesch A Burnstock G (1990) Rapid release of endothelin and ATP from isolated aortic endothelial cells exposed to increased flow. Biochem Biophys Res Commun 170: Burnstock G (1999) Release of vasoactive substances from endothelial cells by shear stress and purinegic mechanosensory transduction. J Anat 194: Postępy Biochemii 60 (4)
13 31. Lazarowski ER Boucher RC Harden TK (2003) Mechanisms of release of nucleotides and integration of their action as P2X- and P2Y-receptor activating molecules. Mol Pharmacol 64: Frenchak AP Lewis MA Kresge C Sathe M Bugde A Luby-Phelps K Antich PP Fitz JG (2010) Initiation of purinergic signaling by exocytosis of ATP-containing vesicles in liver epithelium. J Biol Chem 285: Coco S Calegari F Pravettoni E Pozzi D Taverna E Rosa P Matteoli M Verderio C (2003) Storage and release of ATP from astrocytes in culture. J Biol Chem 278: Lazarowski E (2006) Regulated release of nucleotides and UDP sugars from astrocytoma cells. Novartis Found Symp 276: 76-84; discussion: Zimmermann H (2000) Extracellular metabolism of ATP and other nucleotides. Naunyn Schmiedebergs Arch Pharmacol 362: Zimmermann H (2006) Ectonucleotidases in the nervous system. Novartis Found Symp 276: ; discussion: Bunstock G (1972) Purinergic nerves. Pharmacol Rev 24: Holton P (1959) The liberation of adenosine triphosphate on antidromic stimulation of sensory nerves. J Physiol 145: Bunstock G (1976) Purinergic receptors. J Theor Biol 62: Burnstock G (1978) A basis for distinguishing two types of purynergic receptor W: Straub RW Boils L (red) Cell membrane receptors for drugs and hormones: a multidisciplinary approach. Raven Press New York str Burnstock G Kennedy C (1985) Is there a basis for distinguishing two types of P2-purinoceptor? Gen Phamacol 16: Abbracchio MP Burnstock G (1994) Purinoceptors: are there families of P2X and P2Y purinoceptors? Pharmacol Ther 64: O Connor SE Dainty IA Leff P (1991) Further subclassification of ATP receptors based on agonist studies. Tends Pharmacol Sci 12: Fredholm BB Abbracchio MP Burnstock G Daly JW Harden TK Jacobson KA Leff P Williams M (1994) International Union of Pharmacology. VI. Nomenclature and classification of purinoceptors. Pharmacol Rev 46: Fredholm BB Abbracchio MP Burnstock G Dubyak GR Harden TK Jacobson KA Schwabe U Williams M (1997) Towards a revised nomenclature for P1 and P2 receptors. Trends Pharmacol Sci 18: Stiles GL (1992) Adenosine receptors. J Biol Chem 267: Khakh BS Kennedy C (1998) Adenosine and ATP: progress in their receptors structures and functions. Trends Pharmacol Sci 19: Ceruti S Abbracchio MP (2013) Adenosine signaling in glioma cells W: Barańska J (red) Glioma signaling. Adv Exp Med Biol 986: Springer Dordrecht Heidelbeg New York London 49. Belardinelli L (1993) Adenosine system in heart. Drug Dev Res 28: Romanowska M Komoszyński M (2002) Adenozyna neuroprzekaźnik i neuromodulator w centralnym układzie nerwowym. Postepy Biochem 48: Czajkowski R Sabała P Barańska J (2004) Receptory nukleotydowe W: Nowak JZ Zawilska JB (red) Receptory i mechanizmy przekazywania sygnału. PWN Warszawa str Fredholm BB Ijzerman AP Jacobson KA Linden J Mȕller CE (2011) International Union of Basic and Clinical Pharmacology. LXXXI. Nomenclature and classification of adenosine receptors - an update. Pharmacol Rev 63: Lazarowski ER Sesma JI Seminario-Vidal L Kreda SM (2011) Molecular mechanisms of purine and pyrimidine nucleotide release. Adv Pharmacol 61: Klotz KN (2000) Adenosine receptors and their ligands. Naunyn Schmiedebergs Arch Pharmacol 362: Barańska J (1994) Białka G - nagroda Nobla Post Biol Kom 21: Kobilka BK Deupl X (2007) Conformation complexity of G-protein-coupled receptors. Trends Pharmacol Sci 28: Barańska J Nalepa I (2010) Wewnątrzkomórkowe szlaki sygnalizacyjne wczoraj i dziś: zaburzenia w sygnalizacji a stany chorobowe W: Koroniak H Barciszewski J (red) Na pograniczu chemii i biologii. Wyd Nauk UAM Poznań str Latek D Modzelewska A Traskowski B Palczewski K Filipek S (2012) G protein-coupled receptors - recent advances. Acta Biochim Polon 59: Abbracchio NP Brambilla R Ceruti S Kim HO von Lubitz DKJE Jacobson KA Cattabeni F (1995) G protein-dependent activation of phospholipase C by adenosine A 3 receptor in at brain. Mol Pharmacol 48: Fredholm BB (2010) Adenosine receptors as drug targets. Exp Cell Res 316: Fields RD Burnstock G (2006) Purinergic signalling in neuron-glia interactions. Nat Rev Neurosci 7: Jacobson KA Gao ZG (2006) Adenosine receptors as therapeutic targets. Nature Rev Drug Discov 5: Gessi S Merighi S Varani K Leung E Mac Lennan S Borea PA (2008) The A 3 adenosine receptors: an enigmatic player in cell biology. Pharmacol Ther 117: Abbracchio MP Boeynaems J-M Barnard EA Boyer JL Kennedy C Miras-Portugal MT King BF Gachet C Jacobson KA Weisman GA Burnstock G (2003) Characterization of the UDP-glucose receptor (re- -named here the P2Y 14 receptor) adds diversity to the P2Y receptor family. Trends Pharmacol Sci 24: Wypych D Barańska J (2013) Cross-talk in nucleotide signaling in glioma C6 cells W: Barańska J (red) Glioma signaling. Adv Exp Med Biol 986: Czajkowski R Barańska J (1999) Sphingosine and phorbol ester modulate protein kinase C activity and modify ATP-evoked calcium mobilization in glioma C6 cells. Biochem Biophys Res Commun 260: Berridge MJ (1993) Inositol trisphosphate and calcium signaling. Nature 361: Barańska J Przybyłek K Sabała P (1999) Capacitative calcium entry. Glioma C6 as a model of nonexcitable cells. Pol J Pharmacol 51: Sabała P Czajkowski R Przybyłek K Kalita K Kaczmarek L Barańska J (2001) Two subtypes of G protein-coupled nucleotides receptors P2Y(1) and P2Y(2) are involved in calcium signaling in glioma C6 cells. Br J Pharmacol 132: Hollopeter J Jantzen HM Vincent D Li G England L Ramakrishnan V Yang RB Nurden P Nurden A Julius D Conley PB (2001) Identification of the platelet ADP receptor targeted by antithrombotic drugs. Nature 409: Czajkowski R Lei L Sabała P Barańska J (2002) ADP-evoked phospholipase C stimulation and adenylyl cyclase inhibition in glioma C6 cells occur through two didtinct nucleotide receptors P2Y(1) and P2Y(12). FEBS Lett 513: Czajkowski R Banachewicz W Ilnytska O Drobot LB Barańska J (2004) Differential effects of P2Y1 and P2Y12 nucleotide receptors on ERK1/ERK2 and phosphatidylinositol-3-kinase. Br J Pharmacol 141: Krzemiński P Pomorski P Barańska J (2008) The P2Y14 receptor activity in glioma C6 cells. Eur J Pharmacol 594: Harden TK Sesma JI Fricks IP Lazarowski ER (2010) Signalling and pharmacological properties of P2Y14 receptor. Acta Physiol (Oxf) 199: Bezzi P Volterra A (2001) A neuron-glia signaling network in the active brain. Curr Opin Neurobiol 11: Sak K Illes P (2005) Neuronal and glial cell lines as model systems for studying P2Y receptor pharmacology. Neurochem Int 47: North RA Surprenant A (2000) Pharmacology of cloned jonotropic P2X receptors. Annu Rev Pharmacol Toxicol 40: North RA (2002) Molecular physiology of P2X receptors. Physiol Rev 82: Supłat-Wypych D Dygas A Barańska J (2010) (4-Benzoylbenzoyl)-ATP-mediated calcium signaling in rat glioma C6: role of the P2Y(2) nucleotide receptor. Purinergic Signal 6:
14 80. Banachewicz W Supłat D Krzemiński P Pomorski P Barańska J (2005) P2 nucleotide receptors on C2C12 satellite cells. Purinergic Signal 1: Pelegrin P Surprenant A (2006) Pannexin-1 mediates large pore formation and interleukin-1β release by the ATP-gated P2X 7 receptor. EMBO J 25: Khakh BS Burnstock G (2010) Podwójne życie ATP. Świat Nauki 1: He W Miao FJ-P Lin DC-H Schwandner RT Wang Z Gao J Chen J-L Tian H Ling L (2004) Citric acid cycle intermediates as ligands for orphan G-protein-coupled receptors. Nature 429: Special Issue: Purinergic signalling in visceral organs in health and disease (2014) Purinergic Signal 10: Nucleotide receptors structure and function history and perspectives Jolanta Barańska * Nencki Institute of Experimental Biology 3 Pasteur St Warsaw Poland * j.baranska@nencki.gov.pl Key words: P1 receptors P2X and P2Y receptors ABSTRACT First nucleotide receptors were discovered by Geoffrey Burnstock in 70ties of the last century as a purinoreceptors activated by ATP. It was further found that they may be activated both by purine and pyrimidine nucleotides and their name was changed to nucleotide receptors. They are divided into two fsamilies: P1 activated by adenosine and P2 activated by nucleotides which are further divided into P2X and P2Y subfamilies. P2X are ionotropic receptors activated by ATP P2Y (as the P1) are metabotropic receptors coupled with protein G. P2Y receptors are activated by ATP ADP UTP UDP and UDP-sugar derivatives. This review describes early history of extracellular nucleotide signaling studies and presents current knowledge of the particular nucleotide receptors subtypes. The article also describes the structure and functional roles of these receptors and speculates about future research and therapeutic directions in this field. Postępy Biochemii 60 (4)
ROLA WAPNIA W FIZJOLOGII KOMÓRKI
 ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
Nukleotydy w układach biologicznych
 Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN
 MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
Sygnalizacja międzykomórkowa i wewnątrzkomórkowa
 Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem informacji odebranej przez komórkę. Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Receptor cząsteczka chemiczna ( peptyd
Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem informacji odebranej przez komórkę. Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Receptor cząsteczka chemiczna ( peptyd
Sygnalizacja międzykomórkowa i wewnątrzkomórkowa
 Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem
Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem
Sygnalizacja międzykomórkowa i wewnątrzkomórkowa
 Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem
Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem
Transport przez błony
 Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski
 biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
Przemiana materii i energii - Biologia.net.pl
 Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Transportowane cząsteczki CO O, 2, NO, H O, etanol, mocznik... Zgodnie z gradientem: stężenia elektrochemicznym gradient stężeń
 Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
THE UNFOLDED PROTEIN RESPONSE
 THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
Profil metaboliczny róŝnych organów ciała
 Profil metaboliczny róŝnych organów ciała Uwaga: tkanka tłuszczowa (adipose tissue) NIE wykorzystuje glicerolu do biosyntezy triacylogliceroli Endo-, para-, i autokrynna droga przekazu informacji biologicznej.
Profil metaboliczny róŝnych organów ciała Uwaga: tkanka tłuszczowa (adipose tissue) NIE wykorzystuje glicerolu do biosyntezy triacylogliceroli Endo-, para-, i autokrynna droga przekazu informacji biologicznej.
Organizacja tkanek - narządy
 Organizacja tkanek - narządy Architektura skóry tkanki kręgowców zbiór wielu typów komórek danej tkanki i spoza tej tkanki (wnikają podczas rozwoju lub stale, w trakcie Ŝycia ) neurony komórki glejowe,
Organizacja tkanek - narządy Architektura skóry tkanki kręgowców zbiór wielu typów komórek danej tkanki i spoza tej tkanki (wnikają podczas rozwoju lub stale, w trakcie Ŝycia ) neurony komórki glejowe,
Droga impulsu nerwowego w organizmie człowieka
 Droga impulsu nerwowego w organizmie człowieka Impuls nerwowy Impuls nerwowy jest zjawiskiem elektrycznym zachodzącym na powierzchni komórki nerwowej i pełni podstawową rolę w przekazywaniu informacji
Droga impulsu nerwowego w organizmie człowieka Impuls nerwowy Impuls nerwowy jest zjawiskiem elektrycznym zachodzącym na powierzchni komórki nerwowej i pełni podstawową rolę w przekazywaniu informacji
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Współczynnik przepuszczalności [cm/s] RóŜnice składu jonowego między wnętrzem komórki ssaka a otoczeniem
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Współczynnik przepuszczalności [cm/s] RóŜnice składu jonowego między wnętrzem komórki ssaka a otoczeniem
Przekazywanie sygnałów w komórce
 Rozdział 6 Przekazywanie sygnałów w komórce 1 Jolanta Barańska, 2 Irena Nalepa 1 Instytut Biologii Doświadczalnej im. Marcelego Nenckiego, PAN, ul. Pasteura 3, 02-093 Warszawa, email: j.baranska@nencki.gov.pl
Rozdział 6 Przekazywanie sygnałów w komórce 1 Jolanta Barańska, 2 Irena Nalepa 1 Instytut Biologii Doświadczalnej im. Marcelego Nenckiego, PAN, ul. Pasteura 3, 02-093 Warszawa, email: j.baranska@nencki.gov.pl
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Cząsteczki < 150Da Błony - selektywnie przepuszczalne RóŜnice składu jonowego między wnętrzem komórki ssaka
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Cząsteczki < 150Da Błony - selektywnie przepuszczalne RóŜnice składu jonowego między wnętrzem komórki ssaka
Tkanka nerwowa. neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające)
 Tkanka nerwowa neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające) Sygnalizacja w komórkach nerwowych 100 tys. wejść informacyjnych przyjmowanie sygnału przewodzenie
Tkanka nerwowa neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające) Sygnalizacja w komórkach nerwowych 100 tys. wejść informacyjnych przyjmowanie sygnału przewodzenie
Bliskie spotkania z biologią METABOLIZM. dr hab. Joanna Moraczewska, prof. UKW. Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki
 Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność szybka dyfuzja: O 2, CO 2, N 2, benzen Dwuwarstwa lipidowa - przepuszczalność Współczynnik przepuszczalności [cm/s] 1 Transport
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność szybka dyfuzja: O 2, CO 2, N 2, benzen Dwuwarstwa lipidowa - przepuszczalność Współczynnik przepuszczalności [cm/s] 1 Transport
Fizjologia człowieka
 Fizjologia człowieka Wykład 2, część A CZYNNIKI WZROSTU CYTOKINY 2 1 Przykłady czynników wzrostu pobudzających proliferację: PDGF - cz.wzrostu z płytek krwi działa na proliferację i migrację fibroblastów,
Fizjologia człowieka Wykład 2, część A CZYNNIKI WZROSTU CYTOKINY 2 1 Przykłady czynników wzrostu pobudzających proliferację: PDGF - cz.wzrostu z płytek krwi działa na proliferację i migrację fibroblastów,
Regulacja komunikacji międzykomórkowej poprzez zewnątrzkomórkowy ATP w układzie nerwowym*
 N e u r o k o g n i t y w i s t y k a w p a t o l o g i i i z d r o w i u, 2 0 1 1 2 0 1 3 P o m o r s k i U n i w e r s y t e t M e d y c z n y w S z c z e c i n i e 119 123 Irena Baranowska Bosiacka
N e u r o k o g n i t y w i s t y k a w p a t o l o g i i i z d r o w i u, 2 0 1 1 2 0 1 3 P o m o r s k i U n i w e r s y t e t M e d y c z n y w S z c z e c i n i e 119 123 Irena Baranowska Bosiacka
Część V: Przekazywanie sygnałów. DO WYKŁADÓW Z PODSTAW BIOFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski
 MATERIAŁY PMCNICZE D WYKŁADÓW Z PDSTAW BIFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski PRZEKAZYWANIE SYGNAŁÓW Cechą charakterystyczną układów żywych jest zdolność do zachowywania wewnętrznej
MATERIAŁY PMCNICZE D WYKŁADÓW Z PDSTAW BIFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski PRZEKAZYWANIE SYGNAŁÓW Cechą charakterystyczną układów żywych jest zdolność do zachowywania wewnętrznej
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu
 Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
Biologiczne mechanizmy zachowania
 Biologiczne mechanizmy zachowania Przekaźnictwo chemiczne w mózgu mgr Monika Mazurek IPs UJ Odkrycie synaps Ramon y Cajal (koniec XIX wieku) neurony nie łączą się między sobą, między nimi jest drobna szczelina.
Biologiczne mechanizmy zachowania Przekaźnictwo chemiczne w mózgu mgr Monika Mazurek IPs UJ Odkrycie synaps Ramon y Cajal (koniec XIX wieku) neurony nie łączą się między sobą, między nimi jest drobna szczelina.
Źródła energii dla mięśni. mgr. Joanna Misiorowska
 Źródła energii dla mięśni mgr. Joanna Misiorowska Skąd ta energia? Skurcz włókna mięśniowego wymaga nakładu energii w postaci ATP W zależności od czasu pracy mięśni, ATP może być uzyskiwany z różnych źródeł
Źródła energii dla mięśni mgr. Joanna Misiorowska Skąd ta energia? Skurcz włókna mięśniowego wymaga nakładu energii w postaci ATP W zależności od czasu pracy mięśni, ATP może być uzyskiwany z różnych źródeł
(przekaźniki II-go rzędu)
 (przekaźniki II-go rzędu) Gabriel Nowak, Małgorzata Dybała Receptory i mechanizmy przekazywania sygnału (J.Z. Nowak, J.B. Zawilska, red.) Wyd. Nauk. PWN, Warszawa, 2004 Zakład Cytobiologii i Histochemii,
(przekaźniki II-go rzędu) Gabriel Nowak, Małgorzata Dybała Receptory i mechanizmy przekazywania sygnału (J.Z. Nowak, J.B. Zawilska, red.) Wyd. Nauk. PWN, Warszawa, 2004 Zakład Cytobiologii i Histochemii,
biologia w gimnazjum OBWODOWY UKŁAD NERWOWY
 biologia w gimnazjum 2 OBWODOWY UKŁAD NERWOWY BUDOWA KOMÓRKI NERWOWEJ KIERUNEK PRZEWODZENIA IMPULSU NEROWEGO DENDRYT ZAKOŃCZENIA AKSONU CIAŁO KOMÓRKI JĄDRO KOMÓRKOWE AKSON OSŁONKA MIELINOWA Komórka nerwowa
biologia w gimnazjum 2 OBWODOWY UKŁAD NERWOWY BUDOWA KOMÓRKI NERWOWEJ KIERUNEK PRZEWODZENIA IMPULSU NEROWEGO DENDRYT ZAKOŃCZENIA AKSONU CIAŁO KOMÓRKI JĄDRO KOMÓRKOWE AKSON OSŁONKA MIELINOWA Komórka nerwowa
UKŁAD DOKREWNY cz. 2. Wysepki trzustkowe (Langerhansa): grupy komórek dokrewnych produkujących hormony białkowe
 Wysepki trzustkowe (Langerhansa): grupy komórek dokrewnych produkujących hormony białkowe UKŁAD DOKREWNY cz. 2 Elementy składowe: komórki dokrewne kapilary okienkowe włókna nerwowe Typy komórek dokrewnych
Wysepki trzustkowe (Langerhansa): grupy komórek dokrewnych produkujących hormony białkowe UKŁAD DOKREWNY cz. 2 Elementy składowe: komórki dokrewne kapilary okienkowe włókna nerwowe Typy komórek dokrewnych
ROZPORZĄDZENIE KOMISJI (UE) / z dnia r.
 KOMISJA EUROPEJSKA Bruksela, dnia 29.5.2018 C(2018) 3193 final ROZPORZĄDZENIE KOMISJI (UE) / z dnia 29.5.2018 r. zmieniające rozporządzenie (WE) nr 847/2000 w odniesieniu do definicji pojęcia podobnego
KOMISJA EUROPEJSKA Bruksela, dnia 29.5.2018 C(2018) 3193 final ROZPORZĄDZENIE KOMISJI (UE) / z dnia 29.5.2018 r. zmieniające rozporządzenie (WE) nr 847/2000 w odniesieniu do definicji pojęcia podobnego
STRESZCZENIE PRACY DOKTORSKIEJ
 mgr Bartłomiej Rospond POSZUKIWANIE NEUROBIOLOGICZNEGO MECHANIZMU UZALEŻNIENIA OD POKARMU - WPŁYW CUKRÓW I TŁUSZCZÓW NA EKSPRESJĘ RECEPTORÓW DOPAMINOWYCH D 2 W GRZBIETOWYM PRĄŻKOWIU U SZCZURÓW STRESZCZENIE
mgr Bartłomiej Rospond POSZUKIWANIE NEUROBIOLOGICZNEGO MECHANIZMU UZALEŻNIENIA OD POKARMU - WPŁYW CUKRÓW I TŁUSZCZÓW NA EKSPRESJĘ RECEPTORÓW DOPAMINOWYCH D 2 W GRZBIETOWYM PRĄŻKOWIU U SZCZURÓW STRESZCZENIE
Czy żywność GMO jest bezpieczna?
 Instytut Żywności i Żywienia dr n. med. Lucjan Szponar Czy żywność GMO jest bezpieczna? Warszawa, 21 marca 2005 r. Od ponad połowy ubiegłego wieku, jedną z rozpoznanych tajemnic życia biologicznego wszystkich
Instytut Żywności i Żywienia dr n. med. Lucjan Szponar Czy żywność GMO jest bezpieczna? Warszawa, 21 marca 2005 r. Od ponad połowy ubiegłego wieku, jedną z rozpoznanych tajemnic życia biologicznego wszystkich
Czynności komórek nerwowych. Adriana Schetz IF US
 Czynności komórek nerwowych Adriana Schetz IF US Plan wykładu 1. Komunikacja mędzykomórkowa 2. Neurony i komórki glejowe jedność architektoniczna 3. Czynności komórek nerwowych Komunikacja międzykomórkowa
Czynności komórek nerwowych Adriana Schetz IF US Plan wykładu 1. Komunikacja mędzykomórkowa 2. Neurony i komórki glejowe jedność architektoniczna 3. Czynności komórek nerwowych Komunikacja międzykomórkowa
Błona komórkowa grubość od 50 do 100 A. Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne
 Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Do moich badań wybrałam przede wszystkim linię kostniakomięsaka 143B ze względu na jej wysoki potencjał przerzutowania. Do wykonania pracy
 Streszczenie Choroby nowotworowe stanowią bardzo ważny problem zdrowotny na świecie. Dlatego, medycyna dąży do znalezienia nowych skutecznych leków, ale również rozwiązań do walki z nowotworami. Głównym
Streszczenie Choroby nowotworowe stanowią bardzo ważny problem zdrowotny na świecie. Dlatego, medycyna dąży do znalezienia nowych skutecznych leków, ale również rozwiązań do walki z nowotworami. Głównym
Błona komórkowa grubość od 50 do 100 A. Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne
 Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Dr. habil. Anna Salek International Bio-Consulting 1 Germany
 1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Ocena ekspresji genu ABCG2 i białka oporności raka piersi (BCRP) jako potencjalnych czynników prognostycznych w raku jelita grubego
 Aleksandra Sałagacka Ocena ekspresji genu ABCG2 i białka oporności raka piersi (BCRP) jako potencjalnych czynników prognostycznych w raku jelita grubego Pracownia Biologii Molekularnej i Farmakogenomiki
Aleksandra Sałagacka Ocena ekspresji genu ABCG2 i białka oporności raka piersi (BCRP) jako potencjalnych czynników prognostycznych w raku jelita grubego Pracownia Biologii Molekularnej i Farmakogenomiki
Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH
 Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą na temat pomiarów elektrofizjologicznych żywych komórek metodą Patch
Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą na temat pomiarów elektrofizjologicznych żywych komórek metodą Patch
Chemiczne składniki komórek
 Chemiczne składniki komórek Pierwiastki chemiczne w komórkach: - makroelementy (pierwiastki biogenne) H, O, C, N, S, P Ca, Mg, K, Na, Cl >1% suchej masy - mikroelementy Fe, Cu, Mn, Mo, B, Zn, Co, J, F
Chemiczne składniki komórek Pierwiastki chemiczne w komórkach: - makroelementy (pierwiastki biogenne) H, O, C, N, S, P Ca, Mg, K, Na, Cl >1% suchej masy - mikroelementy Fe, Cu, Mn, Mo, B, Zn, Co, J, F
Antyoksydanty pokarmowe a korzyści zdrowotne. dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW
 Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
SEMINARIUM 8:
 SEMINARIUM 8: 24.11. 2016 Mikroelementy i pierwiastki śladowe, definicje, udział w metabolizmie ustroju reakcje biochemiczne zależne od aktywacji/inhibicji przy udziale mikroelementów i pierwiastków śladowych,
SEMINARIUM 8: 24.11. 2016 Mikroelementy i pierwiastki śladowe, definicje, udział w metabolizmie ustroju reakcje biochemiczne zależne od aktywacji/inhibicji przy udziale mikroelementów i pierwiastków śladowych,
października 2013: Elementarz biologii molekularnej. Wykład nr 2 BIOINFORMATYKA rok II
 10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
Rok akad. 2015/2016 Semestr zimowy, czwartek,
 PROWADZĄCY: Prof. Nadzieja Drela - koordynator Dr Magdalena Markowska - koordynator Dr Paweł Majewski Prof. Krystyna Skwarło-Sońta Rok akad. 2015/2016 Semestr zimowy, czwartek, 8.30-10 Receptory wolne
PROWADZĄCY: Prof. Nadzieja Drela - koordynator Dr Magdalena Markowska - koordynator Dr Paweł Majewski Prof. Krystyna Skwarło-Sońta Rok akad. 2015/2016 Semestr zimowy, czwartek, 8.30-10 Receptory wolne
Biochemia widzenia. Polega na zamianie energii świetlnej na ruch atomów a następnie na sygnał nerwowy
 Biochemia widzenia Polega na zamianie energii świetlnej na ruch atomów a następnie na sygnał nerwowy W siatkówce oka kręgowców występują komórki fotoreceptorowe: czopki (silne światło, barwy) pręciki (słabe
Biochemia widzenia Polega na zamianie energii świetlnej na ruch atomów a następnie na sygnał nerwowy W siatkówce oka kręgowców występują komórki fotoreceptorowe: czopki (silne światło, barwy) pręciki (słabe
UKŁAD DOKREWNY cz. 2. beta. delta. alfa
 Wysepki trzustkowe (Langerhansa): grupy komórek dokrewnych produkujących hormony białkowe, zlokalizowane na terenie zrazików, otoczone przez struktury części zewnątrzwydzielniczej UKŁAD DOKREWNY cz. 2
Wysepki trzustkowe (Langerhansa): grupy komórek dokrewnych produkujących hormony białkowe, zlokalizowane na terenie zrazików, otoczone przez struktury części zewnątrzwydzielniczej UKŁAD DOKREWNY cz. 2
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI. Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Glikokaliks glikokaliks cytoplazma jądro błona komórkowa Mikrografia elektronowa powierzchni limfocytu ludzkiego (wybarwienie
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Glikokaliks glikokaliks cytoplazma jądro błona komórkowa Mikrografia elektronowa powierzchni limfocytu ludzkiego (wybarwienie
Joanna Bereta, Aleksander Ko j Zarys biochemii. Seria Wydawnicza Wydziału Bio chemii, Biofizyki i Biotechnologii Uniwersytetu Jagiellońskiego
 Joanna Bereta, Aleksander Ko j Zarys biochemii Seria Wydawnicza Wydziału Bio chemii, Biofizyki i Biotechnologii Uniwersytetu Jagiellońskiego Copyright by Wydział Bio chemii, Biofizyki i Biotechnologii
Joanna Bereta, Aleksander Ko j Zarys biochemii Seria Wydawnicza Wydziału Bio chemii, Biofizyki i Biotechnologii Uniwersytetu Jagiellońskiego Copyright by Wydział Bio chemii, Biofizyki i Biotechnologii
Potencjał spoczynkowy i czynnościowy
 Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
OPTYMALNY POZIOM SPOŻYCIA BIAŁKA ZALECANY CZŁOWIEKOWI JANUSZ KELLER STUDIUM PODYPLOMOWE 2011
 OPTYMALNY POZIOM SPOŻYCIA BIAŁKA ZALECANY CZŁOWIEKOWI JANUSZ KELLER STUDIUM PODYPLOMOWE 2011 DLACZEGO DOROSŁY CZŁOWIEK (O STAŁEJ MASIE BIAŁKOWEJ CIAŁA) MUSI SPOŻYWAĆ BIAŁKO? NIEUSTAJĄCA WYMIANA BIAŁEK
OPTYMALNY POZIOM SPOŻYCIA BIAŁKA ZALECANY CZŁOWIEKOWI JANUSZ KELLER STUDIUM PODYPLOMOWE 2011 DLACZEGO DOROSŁY CZŁOWIEK (O STAŁEJ MASIE BIAŁKOWEJ CIAŁA) MUSI SPOŻYWAĆ BIAŁKO? NIEUSTAJĄCA WYMIANA BIAŁEK
Wybrane techniki badania białek -proteomika funkcjonalna
 Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A. imię i nazwisko :. klasa :.. ilość punktów :.
 CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A imię i nazwisko :. klasa :.. ilość punktów :. Zadanie 1 Przeanalizuj schemat i wykonaj polecenia. a. Wymień cztery struktury występujące zarówno w komórce roślinnej,
CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A imię i nazwisko :. klasa :.. ilość punktów :. Zadanie 1 Przeanalizuj schemat i wykonaj polecenia. a. Wymień cztery struktury występujące zarówno w komórce roślinnej,
Temat: Komórka jako podstawowa jednostka strukturalna i funkcjonalna organizmu utrwalenie wiadomości.
 SCENARIUSZ LEKCJI BIOLOGII DLA KLASY I GIMNAZJUM Temat: Komórka jako podstawowa jednostka strukturalna i funkcjonalna organizmu utrwalenie wiadomości. Cele: Utrwalenie pojęć związanych z budową komórki;
SCENARIUSZ LEKCJI BIOLOGII DLA KLASY I GIMNAZJUM Temat: Komórka jako podstawowa jednostka strukturalna i funkcjonalna organizmu utrwalenie wiadomości. Cele: Utrwalenie pojęć związanych z budową komórki;
TATA box. Enhancery. CGCG ekson intron ekson intron ekson CZĘŚĆ KODUJĄCA GENU TERMINATOR. Elementy regulatorowe
 Promotory genu Promotor bliski leży w odległości do 40 pz od miejsca startu transkrypcji, zawiera kasetę TATA. Kaseta TATA to silnie konserwowana sekwencja TATAAAA, występująca w większości promotorów
Promotory genu Promotor bliski leży w odległości do 40 pz od miejsca startu transkrypcji, zawiera kasetę TATA. Kaseta TATA to silnie konserwowana sekwencja TATAAAA, występująca w większości promotorów
System błon w komórkach eukariotycznych. Transport przez błony plazmatyczne. Błona komórkowa - model płynnej mozaiki
 System błon w komórkach eukariotycznych. Transport przez błony plazmatyczne. Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Błona komórkowa - model płynnej mozaiki 1 Błona komórkowa
System błon w komórkach eukariotycznych. Transport przez błony plazmatyczne. Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Błona komórkowa - model płynnej mozaiki 1 Błona komórkowa
Błona komórkowa - model płynnej mozaiki
 System błon w komórkach eukariotycznych Transport przez błony plazmatyczne dr n. biol. Ewa Kilańczyk Zakład Biologii Medycznej Pomorskiego Uniwersytetu Medycznego Błona komórkowa - model płynnej mozaiki
System błon w komórkach eukariotycznych Transport przez błony plazmatyczne dr n. biol. Ewa Kilańczyk Zakład Biologii Medycznej Pomorskiego Uniwersytetu Medycznego Błona komórkowa - model płynnej mozaiki
1. Model lipidowy - W roku 1895 Overton opierając się na fakcie, że substancje rozpuszczalne w tłuszczach wnikały do komórki bardziej efektywnie niż
 1. Model lipidowy - W roku 1895 Overton opierając się na fakcie, że substancje rozpuszczalne w tłuszczach wnikały do komórki bardziej efektywnie niż nierozpuszczalne - wydedukował, że lipidy muszą stanowić
1. Model lipidowy - W roku 1895 Overton opierając się na fakcie, że substancje rozpuszczalne w tłuszczach wnikały do komórki bardziej efektywnie niż nierozpuszczalne - wydedukował, że lipidy muszą stanowić
Lek od pomysłu do wdrożenia
 Lek od pomysłu do wdrożenia Lek od pomysłu do wdrożenia KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU
Lek od pomysłu do wdrożenia Lek od pomysłu do wdrożenia KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU KRÓTKA HISTORIA LEKU
MECHANIZMY RUCHÓW KOMÓRKOWYCH - DZIAŁANIE ANESTETYKÓW NA KOMÓRKI
 MECHANIZMY RUCHÓW KOMÓRKOWYCH - DZIAŁANIE ANESTETYKÓW NA KOMÓRKI Zakres materiału, który naleŝy przygotować do ćwiczeń: 1) Budowa błony komórkowej 2) Mechanizm działania anestetyków 3) Aktywność ruchowa
MECHANIZMY RUCHÓW KOMÓRKOWYCH - DZIAŁANIE ANESTETYKÓW NA KOMÓRKI Zakres materiału, który naleŝy przygotować do ćwiczeń: 1) Budowa błony komórkowej 2) Mechanizm działania anestetyków 3) Aktywność ruchowa
Transmisja informacji (powtórzenie)
 Transmisja informacji (powtórzenie) Gabriel Nowak Definicje Ŝycia śycie jako ciągły przepływ informacji Zakład Cytobiologii i Histochemii, Collegium Medicum Uniwersytet Jagielloński Przepływ informacji
Transmisja informacji (powtórzenie) Gabriel Nowak Definicje Ŝycia śycie jako ciągły przepływ informacji Zakład Cytobiologii i Histochemii, Collegium Medicum Uniwersytet Jagielloński Przepływ informacji
Proteomika: umożliwia badanie zestawu wszystkich lub prawie wszystkich białek komórkowych
 Proteomika: umożliwia badanie zestawu wszystkich lub prawie wszystkich białek komórkowych Zalety w porównaniu z analizą trankryptomu: analiza transkryptomu komórki identyfikacja mrna nie musi jeszcze oznaczać
Proteomika: umożliwia badanie zestawu wszystkich lub prawie wszystkich białek komórkowych Zalety w porównaniu z analizą trankryptomu: analiza transkryptomu komórki identyfikacja mrna nie musi jeszcze oznaczać
Receptory nukleotydowe w komórkach nowotworowych
 Receptory nukleotydowe w komórkach nowotworowych Patryk Krzeminski * Centro de Investigación del Cáncer, Salamanca, España * Centro de Investigación del Cáncer, Av. Universidad de Coimbra s/n, 37007, Salamanca,
Receptory nukleotydowe w komórkach nowotworowych Patryk Krzeminski * Centro de Investigación del Cáncer, Salamanca, España * Centro de Investigación del Cáncer, Av. Universidad de Coimbra s/n, 37007, Salamanca,
Wybrane techniki badania białek -proteomika funkcjonalna
 Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu w porównaniu z analizą trankryptomu:
Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu w porównaniu z analizą trankryptomu:
Budowa i funkcje komórek nerwowych
 Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Fizjologia nauka o czynności żywego organizmu
 nauka o czynności żywego organizmu Stanowi zbiór praw, jakim podlega cały organizm oraz poszczególne jego układy, narządy, tkanki i komórki prawa rządzące żywym organizmem są wykrywane doświadczalnie określają
nauka o czynności żywego organizmu Stanowi zbiór praw, jakim podlega cały organizm oraz poszczególne jego układy, narządy, tkanki i komórki prawa rządzące żywym organizmem są wykrywane doświadczalnie określają
Tkanka nerwowa. Komórki: komórki nerwowe (neurony) sygnalizacja komórki neurogleju (glejowe) ochrona, wspomaganie
 Komórki: komórki nerwowe (neurony) sygnalizacja komórki neurogleju (glejowe) ochrona, wspomaganie Tkanka nerwowa Substancja międzykomórkowa: prawie nieobecna (blaszki podstawne) pobudliwość przewodnictwo
Komórki: komórki nerwowe (neurony) sygnalizacja komórki neurogleju (glejowe) ochrona, wspomaganie Tkanka nerwowa Substancja międzykomórkowa: prawie nieobecna (blaszki podstawne) pobudliwość przewodnictwo
Wykład 14 Biosynteza białek
 BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
Krwiobieg duży. Krwiobieg mały
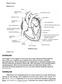 Mięsień sercowy Budowa serca Krązenie krwi Krwiobieg duży Krew (bogata w tlen) wypływa z lewej komory serca przez zastawkę aortalną do głównej tętnicy ciała, aorty, rozgałęzia się na mniejsze tętnice,
Mięsień sercowy Budowa serca Krązenie krwi Krwiobieg duży Krew (bogata w tlen) wypływa z lewej komory serca przez zastawkę aortalną do głównej tętnicy ciała, aorty, rozgałęzia się na mniejsze tętnice,
prof. dr hab. Maciej Ugorski Efekty kształcenia 2 Posiada podstawowe wiadomości z zakresu enzymologii BC_1A_W04
 BIOCHEMIA (BC) Kod przedmiotu Nazwa przedmiotu Kierunek Poziom studiów Profil Rodzaj przedmiotu Semestr studiów 2 ECTS 5 Formy zajęć Osoba odpowiedzialna za przedmiot Język Wymagania wstępne Skrócony opis
BIOCHEMIA (BC) Kod przedmiotu Nazwa przedmiotu Kierunek Poziom studiów Profil Rodzaj przedmiotu Semestr studiów 2 ECTS 5 Formy zajęć Osoba odpowiedzialna za przedmiot Język Wymagania wstępne Skrócony opis
Bliskie spotkania z biologią. METABOLIZM część II. dr hab. Joanna Moraczewska, prof. UKW
 Bliskie spotkania z biologią METABOLIZM część II dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki METABOLIZM KATABOLIZM - rozkład związków chemicznych
Bliskie spotkania z biologią METABOLIZM część II dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki METABOLIZM KATABOLIZM - rozkład związków chemicznych
Reakcje zachodzące w komórkach
 Reakcje zachodzące w komórkach W każdej sekundzie we wszystkich organizmach żywych zachodzi niezliczona ilość reakcji metabolicznych. Metabolizm (gr. metabole - przemiana) to przemiany materii i energii
Reakcje zachodzące w komórkach W każdej sekundzie we wszystkich organizmach żywych zachodzi niezliczona ilość reakcji metabolicznych. Metabolizm (gr. metabole - przemiana) to przemiany materii i energii
TRANSKRYPCJA - I etap ekspresji genów
 Eksparesja genów TRANSKRYPCJA - I etap ekspresji genów Przepisywanie informacji genetycznej z makrocząsteczki DNA na mniejsze i bardziej funkcjonalne cząsteczki pre-mrna Polimeraza RNA ETAP I Inicjacja
Eksparesja genów TRANSKRYPCJA - I etap ekspresji genów Przepisywanie informacji genetycznej z makrocząsteczki DNA na mniejsze i bardziej funkcjonalne cząsteczki pre-mrna Polimeraza RNA ETAP I Inicjacja
Nukleozydy, Nukleotydy i Kwasy Nukleinowe
 Nukleozydy, Nukleotydy i Kwasy Nukleinowe Materiały pomocnicze do wykładu Kwasy Nukleinowe dla studentów kierunku Chemia, specjalność: Chemia Bioorganiczna: Opracował: Krzysztof Walczak Gliwice 2011 Materiały
Nukleozydy, Nukleotydy i Kwasy Nukleinowe Materiały pomocnicze do wykładu Kwasy Nukleinowe dla studentów kierunku Chemia, specjalność: Chemia Bioorganiczna: Opracował: Krzysztof Walczak Gliwice 2011 Materiały
Funkcje błon biologicznych
 Funkcje błon biologicznych Tworzenie fizycznych granic - kontrola składu komórki Selektywna przepuszczalność - transport ograniczonej liczby cząsteczek Stanowienie granic faz przekazywanie sygnałów chemicznych
Funkcje błon biologicznych Tworzenie fizycznych granic - kontrola składu komórki Selektywna przepuszczalność - transport ograniczonej liczby cząsteczek Stanowienie granic faz przekazywanie sygnałów chemicznych
Metody fosforylacji. Schemat 1. Powstawanie trifosforanu nukleozydu
 Metody fosforylacji Fosforylacja jest procesem przenoszenia reszty fosforanowej do nukleofilowego atomu dowolnego związku chemicznego. Najczęściej fosforylację przeprowadza się na atomie tlenu grupy hydroksylowej
Metody fosforylacji Fosforylacja jest procesem przenoszenia reszty fosforanowej do nukleofilowego atomu dowolnego związku chemicznego. Najczęściej fosforylację przeprowadza się na atomie tlenu grupy hydroksylowej
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski
 biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
Geny, a funkcjonowanie organizmu
 Geny, a funkcjonowanie organizmu Wprowadzenie do genów letalnych Geny kodują Białka Kwasy rybonukleinowe 1 Geny Występują zwykle w 2 kopiach Kopia pochodząca od matki Kopia pochodząca od ojca Ekspresji
Geny, a funkcjonowanie organizmu Wprowadzenie do genów letalnych Geny kodują Białka Kwasy rybonukleinowe 1 Geny Występują zwykle w 2 kopiach Kopia pochodząca od matki Kopia pochodząca od ojca Ekspresji
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 5 Droga od genu do
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 5 Droga od genu do
CHOROBY NOWOTWOROWE. Twór składający się z patologicznych komórek
 CHOROBY NOWOTWOROWE Twór składający się z patologicznych komórek Powstały w wyniku wielostopniowej przemiany zwanej onkogenezą lub karcinogenezą Morfologicznie ma strukturę zbliżoną do tkanki prawidłowej,
CHOROBY NOWOTWOROWE Twór składający się z patologicznych komórek Powstały w wyniku wielostopniowej przemiany zwanej onkogenezą lub karcinogenezą Morfologicznie ma strukturę zbliżoną do tkanki prawidłowej,
Układ wewnątrzwydzielniczy
 Układ wewnątrzwydzielniczy 1. Gruczoły dokrewne właściwe: przysadka mózgowa, szyszynka, gruczoł tarczowy, gruczoły przytarczyczne, nadnercza 2. Gruczoły dokrewne mieszane: trzustka, jajniki, jądra 3. Inne
Układ wewnątrzwydzielniczy 1. Gruczoły dokrewne właściwe: przysadka mózgowa, szyszynka, gruczoł tarczowy, gruczoły przytarczyczne, nadnercza 2. Gruczoły dokrewne mieszane: trzustka, jajniki, jądra 3. Inne
Rozmnażanie i wzrost komórek sąściśle kontrolowane. Genetyczne podłoże nowotworzenia
 Rozmnażanie i wzrost komórek sąściśle kontrolowane Genetyczne podłoże nowotworzenia Rozmnażanie i wzrost komórek sąściśle kontrolowane Rozmnażanie i wzrost komórek sąściśle kontrolowane Połączenia komórek
Rozmnażanie i wzrost komórek sąściśle kontrolowane Genetyczne podłoże nowotworzenia Rozmnażanie i wzrost komórek sąściśle kontrolowane Rozmnażanie i wzrost komórek sąściśle kontrolowane Połączenia komórek
Cytokiny jako nośniki informacji
 Wykład 2 15.10.2014 Cytokiny jako nośniki informacji Termin cytokiny (z greckiego: cyto = komórka i kinos = ruch) określa dużą grupę związków o różnym pochodzeniu i budowie, będących peptydami, białkami
Wykład 2 15.10.2014 Cytokiny jako nośniki informacji Termin cytokiny (z greckiego: cyto = komórka i kinos = ruch) określa dużą grupę związków o różnym pochodzeniu i budowie, będących peptydami, białkami
Ruch zwiększa recykling komórkowy Natura i wychowanie
 Wiadomości naukowe o chorobie Huntingtona. Prostym językiem. Napisane przez naukowców. Dla globalnej społeczności HD. Ruch zwiększa recykling komórkowy Ćwiczenia potęgują recykling komórkowy u myszy. Czy
Wiadomości naukowe o chorobie Huntingtona. Prostym językiem. Napisane przez naukowców. Dla globalnej społeczności HD. Ruch zwiększa recykling komórkowy Ćwiczenia potęgują recykling komórkowy u myszy. Czy
Akademia Wychowania Fizycznego i Sportu WYDZIAŁ WYCHOWANIA FIZYCZNEGO w Gdańsku ĆWICZENIE III. AKTYWNOŚĆ FIZYCZNA, A METABOLIZM WYSIŁKOWY tlenowy
 Akademia Wychowania Fizycznego i Sportu WYDZIAŁ WYCHOWANIA FIZYCZNEGO w Gdańsku ĆWICZENIE III AKTYWNOŚĆ FIZYCZNA, A METABOLIZM WYSIŁKOWY tlenowy AKTYWNOŚĆ FIZYCZNA W ujęciu fizjologicznym jest to: każda
Akademia Wychowania Fizycznego i Sportu WYDZIAŁ WYCHOWANIA FIZYCZNEGO w Gdańsku ĆWICZENIE III AKTYWNOŚĆ FIZYCZNA, A METABOLIZM WYSIŁKOWY tlenowy AKTYWNOŚĆ FIZYCZNA W ujęciu fizjologicznym jest to: każda
Układ wydalniczy (moczowy) Osmoregulacja to aktywne regulowanie ciśnienia osmotycznego płynów ustrojowych w celu utrzymania homeostazy.
 Układ wydalniczy (moczowy) Osmoregulacja to aktywne regulowanie ciśnienia osmotycznego płynów ustrojowych w celu utrzymania homeostazy. Wydalanie pozbywanie się z organizmu zbędnych produktów przemiany
Układ wydalniczy (moczowy) Osmoregulacja to aktywne regulowanie ciśnienia osmotycznego płynów ustrojowych w celu utrzymania homeostazy. Wydalanie pozbywanie się z organizmu zbędnych produktów przemiany
Substancje o Znaczeniu Biologicznym
 Substancje o Znaczeniu Biologicznym Tłuszcze Jadalne są to tłuszcze, które może spożywać człowiek. Stanowią ważny, wysokoenergetyczny składnik diety. Z chemicznego punktu widzenia głównym składnikiem tłuszczów
Substancje o Znaczeniu Biologicznym Tłuszcze Jadalne są to tłuszcze, które może spożywać człowiek. Stanowią ważny, wysokoenergetyczny składnik diety. Z chemicznego punktu widzenia głównym składnikiem tłuszczów
Badanie oddziaływania polihistydynowych cyklopeptydów z jonami Cu 2+ i Zn 2+ w aspekcie projektowania mimetyków SOD
 Wydział Farmaceutyczny z Oddziałem Analityki Medycznej Badanie oddziaływania polihistydynowych cyklopeptydów z jonami Cu 2+ i Zn 2+ w aspekcie projektowania mimetyków SOD Aleksandra Kotynia PRACA DOKTORSKA
Wydział Farmaceutyczny z Oddziałem Analityki Medycznej Badanie oddziaływania polihistydynowych cyklopeptydów z jonami Cu 2+ i Zn 2+ w aspekcie projektowania mimetyków SOD Aleksandra Kotynia PRACA DOKTORSKA
Spis treści. 1. Wiadomości wstępne Skład chemiczny i funkcje komórki Przedmowa do wydania czternastego... 13
 Przedmowa do wydania czternastego... 13 Częściej stosowane skróty... 15 1. Wiadomości wstępne... 19 1.1. Rys historyczny i pojęcia podstawowe... 19 1.2. Znaczenie biochemii w naukach rolniczych... 22 2.
Przedmowa do wydania czternastego... 13 Częściej stosowane skróty... 15 1. Wiadomości wstępne... 19 1.1. Rys historyczny i pojęcia podstawowe... 19 1.2. Znaczenie biochemii w naukach rolniczych... 22 2.
Mechanizmy działania i regulacji enzymów
 Mechanizmy działania i regulacji enzymów Enzymy: są katalizatorami, które zmieniają szybkość reakcji, same nie ulegając zmianie są wysoce specyficzne ich aktywność może być regulowana m.in. przez modyfikacje
Mechanizmy działania i regulacji enzymów Enzymy: są katalizatorami, które zmieniają szybkość reakcji, same nie ulegając zmianie są wysoce specyficzne ich aktywność może być regulowana m.in. przez modyfikacje
Witaminy rozpuszczalne w tłuszczach
 Jaką rolę pełnią witaminy w organizmie? I dlaczego są niezbędnymi składnikami w żywieniu świń? Dowiedz się o roli poszczególnych witamin w żywieniu trzody chlewnej. Witaminy są niezbędne do prawidłowego
Jaką rolę pełnią witaminy w organizmie? I dlaczego są niezbędnymi składnikami w żywieniu świń? Dowiedz się o roli poszczególnych witamin w żywieniu trzody chlewnej. Witaminy są niezbędne do prawidłowego
HORMONY STERYDOWE I PODOBNIE DZIAŁAJĄCE
 HORMONY STERYDOWE I PODOBNIE DZIAŁAJĄCE Są to związki należące do grupy steroidów, które charakteryzują się wykazywaniem istotnych aktywności biologicznych typu hormonalnego. Docierając do komórki docelowej,
HORMONY STERYDOWE I PODOBNIE DZIAŁAJĄCE Są to związki należące do grupy steroidów, które charakteryzują się wykazywaniem istotnych aktywności biologicznych typu hormonalnego. Docierając do komórki docelowej,
Kanały jonowe i pompy błonowe
 Kanały jonowe i pompy błonowe Jak badad przepływ jonów? Patch-clamp -zassanie powoduje ścisłe połączenie błony komórkowej z kapilarą (opornośd miedzy wnętrzem pipety a otaczającym roztworem = 10^9 omów)
Kanały jonowe i pompy błonowe Jak badad przepływ jonów? Patch-clamp -zassanie powoduje ścisłe połączenie błony komórkowej z kapilarą (opornośd miedzy wnętrzem pipety a otaczającym roztworem = 10^9 omów)
TEST - BIOLOGIA WERONIKA GMURCZYK
 TEST - BIOLOGIA WERONIKA GMURCZYK Temat: Układ nerwowy i hormonalny Zadanie 1. Zaznacz poprawną odpowiedź. Co to są hormony? a) związki chemiczne wytwarzane w gruczołach łojowych, które regulują pracę
TEST - BIOLOGIA WERONIKA GMURCZYK Temat: Układ nerwowy i hormonalny Zadanie 1. Zaznacz poprawną odpowiedź. Co to są hormony? a) związki chemiczne wytwarzane w gruczołach łojowych, które regulują pracę
The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna
 Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Scenariusz lekcji przyrody/biologii (2 jednostki lekcyjne)
 Joanna Wieczorek Scenariusz lekcji przyrody/biologii (2 jednostki lekcyjne) Strona 1 Temat: Budowa i funkcje kwasów nukleinowych Cel ogólny lekcji: Poznanie budowy i funkcji: DNA i RNA Cele szczegółowe:
Joanna Wieczorek Scenariusz lekcji przyrody/biologii (2 jednostki lekcyjne) Strona 1 Temat: Budowa i funkcje kwasów nukleinowych Cel ogólny lekcji: Poznanie budowy i funkcji: DNA i RNA Cele szczegółowe:
Dr hab. Janusz Matuszyk. Ocena rozprawy doktorskiej. Pani mgr Hanny Baurskiej
 Dr hab. Janusz Matuszyk INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ im. Ludwika Hirszfelda P OLSKIEJ A K A D E M I I N AUK Centrum Doskonałości: IMMUNE ul. Rudolfa Weigla 12, 53-114 Wrocław tel. (+48-71)
Dr hab. Janusz Matuszyk INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ im. Ludwika Hirszfelda P OLSKIEJ A K A D E M I I N AUK Centrum Doskonałości: IMMUNE ul. Rudolfa Weigla 12, 53-114 Wrocław tel. (+48-71)
Instytut Sportu. Biochemiczne wskaźniki przetrenowania. Zakład Biochemii. mgr Konrad Witek
 Instytut Sportu Zakład Biochemii Biochemiczne wskaźniki przetrenowania Przetrenowanie (overtraining)- długotrwałe pogorszenie się dyspozycji sportowej zawodnika, na skutek kumulowania się skutków stosowania
Instytut Sportu Zakład Biochemii Biochemiczne wskaźniki przetrenowania Przetrenowanie (overtraining)- długotrwałe pogorszenie się dyspozycji sportowej zawodnika, na skutek kumulowania się skutków stosowania
Uniwersytet Łódzki, Instytut Biochemii
 Życie jest procesem chemicznym. Jego podstawą są dwa rodzaje cząsteczek kwasy nukleinowe, jako nośniki informacji oraz białka, które tę informację wyrażają w postaci struktury i funkcji komórek. http://www.nobelprize.org/nobel_prizes/medicine/laureates/1959/press.html?print=1
Życie jest procesem chemicznym. Jego podstawą są dwa rodzaje cząsteczek kwasy nukleinowe, jako nośniki informacji oraz białka, które tę informację wyrażają w postaci struktury i funkcji komórek. http://www.nobelprize.org/nobel_prizes/medicine/laureates/1959/press.html?print=1
