CHARAKTERYSTYKA PRODUKTU LECZNICZEGO pod wz9r~dem merytorycznym
|
|
|
- Stanisława Pluta
- 8 lat temu
- Przeglądów:
Transkrypt
1 ~ Sprawdzono CHARAKTERYSTYKA PRODUKTU LECZNICZEGO pod wz9r~dem merytorycznym NAZW A PRODUKTU LECZNICZEGO Sumamigren, 100 mg, tabletki powlekane 2. SKLAD JAKOSCIOWY I ILOSCIOWY 1 tabletka powlekana zawiera 100 mg sumatryptanu (Sumatriptanum) w postaci 140 mg bursztynianu sumatryptanu oraz substancje pomocnicze, w tyrn: laktozajednowodna (247 mg). Pelny wykaz substancji pomocniczych, patrz punk! POSTAC FARMACEUTYCZNA Tabletka powlekana Tabletki powlekane, podluzne, obustronnie wypulde, barwy bialej. 4. SZCZEGOLOWE DANE KLINICZNE 4.1 Wskazania do stosowania Dorame zwalczanie napad6w migreny. 4.2 Dawkowanie i spos6b podawania Sumamigren jest dost«pny w postaci tabletek powlekanych 50 mg i 100 mg. Sumatryptanu nie nalezy stosowac profilaktycznie (patrz punkt 4.3). Sumatryptanjest wskazany do leczenia napadu migreny jako jedyny lek i nie nalezy go podawac jednoczesnie z ergotamin~ lub pochodnyrni ergotaminy (wl~cznie z metyzergidem) (patrz pnnk! 4.3). Lek nalezy stosowac jak najszybciej po wyst~ieniu napadu migreny. Jest on r6wniez sknteczny po zastosowaniu w dowolnyrn stadium napadu b6lu. Dorosli Zalecan~ doustn~ dawk~ sumatryptanu jest 50 mg. U niekt6rych pacjent6w wymagane jest podanie dawki 100 mg. W przypadkn nie ust~ienia objaw6w po podaniu j ednorazowej dawki lekn, nie nalezy przyjmowac kolejnej dawki lekn podczas trwania tego samego napadu migreny. Nast"pn~ tabletk" moma przyj~c podczas kolejnego napadu. J ezeli zastosowanie j ednorazowej dawld leku spowodowalo ust~ienie objaw6w, jednak napad migreny powr6cil, drug~ dawk" lekn mozna przyj~c w ci~ kolejnych 24 godzin, pami"taj~c, ze nie nalezy stosowac dawki wi"kszej niz 300 mg na dob". Tabletki nalezy polykac w calosci popijaj~c wod~. U pacjent6w z zaburzeniami czynnosci w~troby, maksymalna dawka dobowa wynosi 50 mg. 1
2 Dzieci i mlodziez (w wielm ponizej 18 lat) Sumatryptanu nie nalezy stosowac u dzieci i mlodziezy ze wzgl«du na brak wystarczaj'lcych danych dotycz'lcych skutecznosci i bezpieczenstwa stosowania. Pacjenci w podeszlym wiekn (powyzej 65 lat) Dane na temat stosowania sumatryptanu w postaci tabletek u pacjent6w w wieku powyzej 65 lat S'l ograniczone. Nie wykazano znacz'lcych r6znic w farmakokinetyce mi«dzy til grup'l badanych, a osobami mlodszymi. Do czasu zebrania szczeg610wych danych Idinicznych stosowanie sumatryptanu w tej grupie pacjent6w nie jest zalecane. 4.3 Przeciwwskazania NadwrazliwoS6 na sumatryptan lub kt6r'lkolwiek substancj«pomocnicz'l produktu. Nie stosowae w zapobieganiu napadom migrenowym. Nie stosowac u pacjent6w w wieku ponizej 18 lub powyzej 65 lat Choroba niedokrwienna serca lub objawy z ni'lzwi'lzane, skurcz naczyll wiencowych (dusznica Prinzmetala), przebyty zawal mi«snia sercowego. Przebyty udar m6zgu lub przemijqj'lcy m6zgowy napad niedokrwienny. Choroby naczyll obwodowych. Umiarkowane i ci«zkie nadcisnienie oraz niedostatecznie kontrolowane nadcisnienie. Stosowanie r6wnoczesnie z inhibitorami monoaminoksydazy (Sumatryptanu nie moma stosowae przez 2 tygodnie od zakonczenia leczenia inhibitorami monoaminooksydazy). R6wnoczesne stosowanie z lekami zawieraj'lcymi ergotamin«lub jej pochodne, jak np. metyzergid lub innymi lekami z grupy agonist6w receptor6w 5-HT t (patrz punlet 4.5). Ci«zka niewydolnose w'ltroby. 4.4 Specjalne ostrzezenia i srodld ostroznosci dotycz!lce stosowania Sumatryptan nalezy stosowae tylko u pacjentow po dokladnym rozpoznaniu migreny. Sumatryptan nie jest wskazany u pacjent6w z migren'lhemiplegicznl\, podstawn'llub okoporazn'l. Sumatryptanu nie nalezy stosowac u pacjent6w z grupy ryzyka wystqpienia choroby niedokrwiennej serca, w tym pacjent6w pal'lcych tytonlub stosuj'lcych substytuty nikotyny bez uprzedniej oceny stanu uldadu kr'lzenia (patrz punkt 4.3). Szczeg6ln'lostromose nalezy zachowae u kobiet po menopauzie oraz u m«zczyzn w wieku powyzej 40 lat, kt6rych takze zalicza si«do grupy ryzyka. Nalezy jednak wzi'le pod uwag", ze nie w kazdym przypadku przeprowadzone badania pozwalaj'lprawidlowo zdiagnozowac istniej'lc'l chorob«serca, oraz to, ze w bardzo rzadkich przypadkach ci«zkie objawy sercowe mog'l wystqpie bez wsp6listniej'lcego schorzenia ukladu sercowo-naczyniowego. Po podaniu sumatryptanu moze wystqpie przemijqj'lcy b61 oraz uczucie ucisku w klatce piersiowej i gardle (patrz punkt 4.8), czasami 0 znacznym nasileniu. Objawy te mog'l sugerowae ehorob«niedokrwienn'l serea. W razie ich wystqpienia, zaleca si«odstawienie leku i wykonanie odpowiednich badan. Sumatryptan moze wywolac kr6tkotrwale zwi«kszenie cisnienia krwi i obwodowego oporu naczyniowego. Sumamigren nalezy stosowae bardzo ostroznie u pacjent6w z leczon'l chorob'l nadcisnieniow'l. U pacjent6w z b6lem glowy typu migrenowego, u kt6rych wczesniej nie rozpoznano migreny oraz u pacjent6w z uprzednio rozpoznan'lmigrenl\, ale z nietypowym obrazem danego napadu bolu glowy, naldy brae pod uwag«inn'l przyczyn«dolegliwosci - pochodzenia neurologicznego. Naleiy pamiqtae, ze pacjenci, u ktorych wyst«puje migrena, mog'lnalezec do os6b z grupy ryzyka wystllpienia naczyniopochodnego uszkodzenia m6zgu, jak np. przemijaj'lcy mozgowy napad niedokrwienny czy udar m6zgu. 2
3 Podczas j ednoczesnego stosowania sumatryptanu i selektywnych inhibitorow wychwytu zwrotnego serotoniny (SSRI) odnotowano wyst!\pienie zespolu serotoninowego (w tym zmiany stanu psychicznego, niestabilnosc ukladu wegetatywnego oraz zaburzenia nerwowomi«sniowe). Wyst!\pienie zespohl serotoninowego odnotowano takze po jednoczesnym stosowanin tryptan6w z inhibitorami wychwytu zwrotnego serotoniny i noradrenaliny (SNRI). Iezeli rownoczesne leczenie sumatryptanem i lekami z grupy SSRIlSNRI jest klinicznie uzasadnione zaleca si«odpowiedni~ obserwacj" pacj enta. Sumatryptan nalezy podawac ostroznie pacj entom, u ktorych mozna spodziewac si«zmian we wchlanianiu, metabolizmie lub wydalaniu leku np. w niewydolnosci w~troby lub nerek. Sumatryptan nalezy stosowac z duz~ ostroznosci~ u pacjentow, u ktorych stwierdzano napady drgawek lub czynniki obnizaj~ce prog drgawkowy (patrz punk! 4.8). U pacjentow uczulonych na sulfonamidy po podaniu sumatryptanu mog~ wyst!\pic objawy alergii 0 roznym nasileniu, od zmian skomych do wstrz~su anafilaktycznego. Informacje na ten temat s~ ograniczone, niemniej jednak nalezy zachowac ostroznosc u tych pacjentow. Dlugotrwale stosowanie j akichkolwiek lek6w przeciwb6lowych moze spowodowac nasilenie b6lu glowy. Iesli u pacjenta wyst"puje lub jest podejrzewana taka przyczyna b6lu g!owy, powinien on odstawiclek i zasi«gn'lc porady lekarza. U pacjent6w, u kt6rych wyst'<puj'l cz«ste lub codzie1111e b6le glowy pomimo (lub z powodu) regularnego stosowania lek6w przeciw tym bolom, nalezy rozwazyc rozpoznanie b6lu glowy zalemego od ci'\glego stosowania lek6w. Podczas jednoczesnego stosowania sumatryptanu i preparat6w zawieraj~cych ziele dziurawca (Hypericum perforatum) dzialania niepoz'ldane mog~ wyst'<p0wac cz«sciej. Nie naldy stosowac dawki wi«kszej niz zalecana. Ze wzgl«du na zawarlosc laktozy prodnktu nie nalezy stosowac u pacj ent6w z rzadko wyst«puj'lc~ dziedziczn~nietolerancj~ galaktozy, niedoborem laktazy typu "Lapp" lub zespolem zlego wchlaniania glukozy-galaktozy. 4.5 Interakcje z innymi produktami leczniczymi i iune rodzaje interal{cji Badania nie wykazaly interakcji sumatryptanu z alkoholem etylowym oraz takimi lekami jak propranolol, flunaryzyna i pizotyfen. Dost'<Pne s~ ograniczone dane na temat interakcji produkt6w zawieraj'lcych ergotamin" z tryptanami i i1111ymi agonistami receptora 5-HT\. Rownoczesne stosowanie ergotaminy i sumatryptanujest przeciwwskazane, gdyz teoretycznie istnieje mozliwosc zwi«kszonego ryzyka wyst!\pienia skurczu naczyniowego (patrz punk! 4.3). Nie jest znany czas jaki musi uplyn~c pomi«dzy zastosowaniem sumatryptauu a produktami zawieraj'lcymi ergotamin«lub i1111ymi tryptauami i innymi agonistami receptora 5-HTI. Uzaleznione jest to takze od zastosowauej dawki oraz rodzaju produktu. Ieh dzia!ania mog~si«sumowac. Wskazane jest, aby przed przyj«ciem sumatryptauu odczekac przynajmniej 24 godziny po zastosowaniu jakiegokolwiek produktu zawieraj~cego ergotamin«lub inne tryptany i i1111ych agonist6w receptora 5-I-IT\. Natomiast produkty zawieraj'lce ergotamin«mozna stosowac ju;; po 6 godzinach, zas produkty zawieraj'lce inne tryptany i innych agonist6w receptora 5-HT, po 24 godzinaeh od zastosowania sumatryptanu. Nie nalezy przyjmowac sumatryptanujednoczesnie z inhibitorami MAO i przez 2 tygodnie od zakonczenia leczenia nimi ze wzgl"du na spodziewau'l interakcj«(patrz punkt 4.3). 3
4 I Podczas jednoczesnego stosowania sumatryptanu i selektywnych inhibitor6w wychwytu zwrotnego serotoniny (SSRI) oduotowano wyst'l]jienie ZeSpOhl serotoninowego (w tym zmiany stanu psychicznego, niestabilnosc ukladu wegetatywnego oraz zaburzenia koordynacji ruchowej). Wyst'l]Jienie zesporu serotoninowego oduotowano taicie po jeduoczesnym stosowaniu tryptan6w z inhibitorami wychwytu zwrotnego serotoniny i noradrenaliny (SNRI) (patrz punkt 4.4). 4.6 Wplyw na plod nose, cill:i~ i laktacj~ Ciaza Na podstawie danych uzyskanych po wprowadzeniu prodnktu leczniczego do obrotu, u ponad 1000 kobiet, kt6re przyjmowaly sumatryptan w pierwszym trymestrze ci~zy nie stwierdzono zwi((kszenia cz((stosci wyst((powania wad wrodzonych u dzieci,jednak dane te s~niewystarczaj~ce do wyci!\lini((cia koncowych wniosk6w. Natomiast ograniczone s~ dane na temat stosowania sumatryptanu w drugim i trzecim trymestrze ci!(zy. Ocena badan przeprowadzonych na zwierz((tach nie wykazala dzialania teratoge1l1lego ani szkodliwego wplywu na rozw6j przed i pourodzeniowy. JednaIcie u kr6lik6w przezywalnosc zarodka i (lub) plodu byla zaburzona. Surnamigren moze bye stosowany w ci~zy tylko wtedy, kiedy potencjalne korzysci dla matla przewyzszaj~ryzyko szkodliwego wplywu na pl6d. Laktacja Wykazano, ze po podaniu podsk6rnym sumatryptan przenika do mleka. Dlatego, aby zminimalizowac wplyw leku na niemowl((, w okresie do 12 godzin od przyj((cia sumatryptanu nalezy unikae karmienia piersill, a odci!\linh,te w tym czasie mleko wyrzucie. 4.7 Wplyw na zdolnosc prowadzenia pojazd6w i obslngiwania maszyn Nie przeprowadzono badan dotycz~cych wplywu na zdolnorc prowadzenia pojazd6w i obslugiwania maszyn. W czasie leczenia sunmtryptanem moze wyst'l]ji6 se1l1losc. Moze miee to wplyw na zdolnosc prowadzenia pojazd6w i obsrugt; maszyn. 4.8 Dzialania niepozlidane Dzialania niepoz~dane zostaly pogrupowane wedrug cz((stosci wyst((powania, okreslonej w nast((puj~cy spos6b: bardzo CZt;sto (2:1110); cz'l.sto (2:11100 do <1110); niezbyt CZt;sto (2: do <11100); rzadko (2: do <1/1000); bardzo rzadko « ), nieznana (cz,<stosc nie moze bye okreslona na podstawie dost((pnych danych). Niekt6re z wymienionych dzialan niepoz~danych mog~ bye objawem migreny. Zaburzenia ukladu immunologicznego Nieznana: objawy nadwrazliwosci od zmian sk6mych Gak pokrzywka) do rzadkich przypadlc6w wstrz!(su anafilaktycznego. Zaburzenia ukladu nerwowego Cz,<sto: zawroty glowy, se1l1losc, zaburzenia czucia, w tym parestezje i niedoczulica. Nieznana: napady drgawelc, kt6re wyst'l]jily u os6b z napadami drgawek stwierdzanymi w przesz.!osci lub wsp6listniej~cyrni czynnikami predysponuj~cymi do ich wyst'l]jienia, jak i u os6b bez czynnik6w ryzyka. Drzenie, dystonia, oczopl!(s, mroczek. Zaburzenia oka Nieznana: migotanie swiatla, podw6jne widzenie, zmiany w polu widzenia, utrata widzenia, w tym stale ubytki widzenia. Zaburzenia widzenia mog~ bye skladow~ napadu migreny. Zaburzenia serca 4
5 Nieznana: bradykardia, taehykardia, kolatanie serea, zaburzenia rytmu serea, przemijaj1tee zmiany niedokrwietule w zapisie EKG, skurez naezyft wiefteowyeh, duszniea bolesna, zawal mi<;l nia sereowego (patrz punk! 4.3 i punlct 4.4). Zaburzenia naezyft CZ<;lsto: przemijaj1tey wzrost ei nienia Wniczego krwi wkr6tee po podaniu leku, nagle zaezerwienienie, zwlaszeza twarzy. Nieznana: niedoci nienie, zesp61 Raynauda. Zaburzenia ukladu oddeehowego. k:latld piersiowej i sr6dpiersia CZ<;lsto: duszno e. Zaburzenia zoladka i jelit Cz"sto: u niekt6ryeh paejent6w wyst@uj1tnudno ci i wymioty, ale ieh zwi1tzek z podawaniem surnatryptanu nie jest j asny. Nieznana: niedokrwienne zapalenie okr<;lzniey, biegunka. Zaburzenia miesniowo-szldeletowe i tkanki laeznej CZ<;lsto: uezucie ci"zko ci (objaw zazwyezaj przemijaj1tey, moze bye silny i wyst@owa6 w r6znyeh ez"sciaeh ciala, w tym w klatee piersiowej i gardle). B61e mi<;lsni. Nieznana: sztywno 6 karku, b61e staw6w. Zaburzenia og61ne i stany w miejseu podania CZ<;lsto: b61, uezueie gor1tea lub zimna, napi<;leia lub ucisku (objawy te zazwyezaj s1tprzemijaj1tee, mog1t by6 silne i wyst@owa6w r6znyeh ez<;lseiaeh ciala, w tym w k:latee piersiowej i gardle). Uezucie slabosei, zm"ezenie (objawy te najez,, ciej maj1tnasilenie lagodne do umiarkowanego i s1t przemijaj1tee). Badania Bardzo rzadko: niewielkie zmiany wartosci parametr6w ezynnosci W1ttroby. Zaburzenia psyehiezne Nieznana: I"k. Zaburzenia sk6ry i tkanki podsk6mej Nieznana: nadmieme poeenie si". 4.9 Przcdawkowanie Dawld wi"ksze niz 400 mg podane doustnie i 16 mg podane podsk6mie, nie wywolywaly zadnyeh ilmyeh dzialaft niepoz'ldanych niz te wymienione. U paejent6w, kt6rzy otrzymali podsk6rnie pojedynez'l dawk" 12 mg nie obserwowano znaezqeyeh dzialall niepoz'ldanyeh. W przypadku przedawkowania sulnatryptanu, paejenta nalezy podda6 obserwaeji przez eo najul11iej 10 godzin. Odpowiednio do okolicznosci nalezy podjq6 standardowe leezenie objawowe. Nie jest znany wplyw hemodializy lub dializy otrzewnowej na st<;lzenie suulatryptanu w osoczu. 5. WLASCIWOSCI FARMAKOLOGICZNE 5.1 Wlasciwosci farmako(lynamiczne Grupajarmakoterapeutyczna: Leki przeeiwmigrenowe; selektywni agonisei reeeptora 5-I-IT r Kod ATe: N02CCOI Sumatryptan j est swoistym i wybi6rezym agonist1treeeptor6w serotoninowyeh 5-HT ID Nie wplywa na iune podtypy reeeptor6w serotoninowyeh (5-HT2 do 5-I-IT7)' Reeeptory te wyst<;lpuj'l g16wnie w 5
6 naczyniach krwionosnych obszaru ukrwienia t"tnicy szyjnej. Sumatryptan dzialaj~c na receptory 5- HT ID, wybi6rczo zw"za te naczynia krwionosne, nie wplywaj~c na przeplyw m6zgowy. Wyniki badan doswiadczalnych wskazujq, ze hamuje on takze aktywnosc nerwu tr6jdzielnego. Obydwa lllechanizmy lez~ u podstaw przeciwmigrenowego dzialania sumatryptanu. Dzialanie leku w postaci tabletek powlekanych rozpoczyna si" po ok. 30 minutach od momentu przyj"cia. Zalecanq, doustn~ dawk~jest 50 mg sumatryptanu. Nalezy jednak pami"tac, ze napady migreny mog~ si" r6znic co do nat"zenia objaw6w zar6wno u tego samego pacjentajak i r6znych pacjent6w. Badania kliniczne wykazaly, ze skutecznosc dawek od 25 do 100 mg jest wyraznie wi"ksza niz placebo, a takze, ze skutecznos6 dawld 25 mgjest wyraznie 1ll11iejsza od 50 i loa mg. 5.2 Wlasciwosci farmakoldnetyczne W chlanianie sumatryptanu po podaniu doustnylll jest szyblde; 70% maksymalnego st"zenia w osoczu wyst@ujepo 45 minutach, ajego srednia wartosc po podaniu dawld loa mg wynosi 54 nglml. Srednia biodost'djnosc sumatryptanu w postaci doustnej wynosi 14%, cz«sciowo ze wzgl"du na llletabolizm, a cz«sciowo ze wzgl"du na niepelne wchlanianie. Sumatryptan wi~ze si" z bialkami osocza w malym stopniu (14-21 %). Srednia obj«tosc dystrybucji wynosi Gl6wny produkt przemiany - analog kwasu indolooctowego jest wydalany z moczem, gdzie wyst'djuje w postaci wolnego kwasu oraz glulcuronian6w. Nie stwierdzono jego dzialania na receptory 5-HT, i 5- HT 2 Metabolity wyst@uj~ce w mniejszych ilosciach nie zostaly zidentyfikowane. Okres p6ltrwania sumatryptanu w osoczu wynosi w przyblizeniu 2 godziny. Calkowity sredni klirens osocza wynosi 1160 ml/min, a sredni klirens nerkowy osocza - okolo 260 m1/min. Wydalanie pozanerkowe leku stanowi okolo 80% calkowitego klirensu. Sumatryptanjest gl6wnie metabolizowany z udzialem monoarninooksydazy A. Farmakoldnetyka sumatryptanu po podaniu doustnym nie jest istotnie zak16cana przez napady migreny. 5.3 Przedldiniczne dane 0 bezpieczeitstwie W badaniach in vitro i w badaniach na zwierz«tach sumatryptan nie wykazywal dzialania teratogennego, rakotw6rczego ani genotoksycznego. W badaniach plodnosci przeprowadzonych na szczurach po doustnym podaniu sumatryptanu w dawce powoduj~cej okolo 200 razy wi"ksze st«zenie leku w osoczu niz wyst@uj~ce u ludzi po doustnym podaniu 100 mg surnatryptanu, obserwowano z1ll11iejszenie zdolnosci do inseminacji. Tald efekt nie wyst@owal po podaniu podsk6rnym sumatryptanu, Idedy st"zenie leku w osoczu bylo okolo 150 razy wi"ksze ni;; u ludzi po doustnym podaniu sulllatryptanu. W badaniach na kr6likach rzadko wyst@owala smiertelnos6 plod6w, jednak nie obserwowano dzialania teratogennego. 6. DANE FARMACEUTYCZNE 6.1 Wykaz snbstancji pomocniczych Rdzen: laktoza jednowodna, celuloza mikrokrystaliczna, kroskarmeloza sodowa, magnezu stearynian, 6
7 talk, krzemionka koloidalna bezwodna Otoczka: hypromeloza, makrogol6000, talk, tytanu dwutlenek (EI71), trietylu cytrynian. 6.2 Niezgodnosci farmacentyczne Nie obserwowano. 6.3 Okres waznosci 4 lata 6.4 Specjalne srodld ostroznosci przy przechowywaniu Brak szczeg61nych srodk6w ostroznosci dotycz!lcych przechowywania produktu leczniczego. 6.5 Rodzaj i zawartosc opakowania Blistry z folii Aluminium! Aluminium w tekturowym pudelku. 2 tabletki powlekane 6 tabletek powlekanych 6.6 Szczeg61ne srodki ostroznosci dotycz'lcc usuwania i przygotowania leku do stosowania Nie dotyczy. 7. PODMIOT ODPOWIEDZIALNY POSIADAJl\CY POZWOLENIE NA DOPUSZCZENIE DOOBROTU Zaklady Farmaceutyczne POLPHARMA SA u1. Pelplinska 19, Starogard Gdailski 8. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU Pozwolenie Nr DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU f DATA PRZEDLUZENIA POZWOLENIA f DATA ZATWIERDZENIA LUB CZE/SCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO 20ft
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 tabletka powlekana zawiera 100 mg sumatryptanu (Sumatriptanum) w postaci 140 mg bursztynianu sumatryptanu
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sumamigren, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera 100 mg sumatryptanu (Sumatriptanum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sumamigren, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera 100 mg sumatryptanu (Sumatriptanum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Imigran, 25 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 25 mg Sumatriptanum (sumatryptanu). Pełny wykaz substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Imigran, 25 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 25 mg Sumatriptanum (sumatryptanu). Pełny wykaz substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka powlekana zawiera 100 mg sumatryptanu (Sumatriptanum) w postaci 140 mg
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sumamigren, 50 mg, tabletki powlekane Sumamigren, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Sumamigren, 50 mg: Każda
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sumamigren, 50 mg, tabletki powlekane Sumamigren, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Sumamigren, 50 mg: Każda
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka powlekana zawiera 50 mg sumatryptanu (Sumatriptanum) w postaci 70 mg sumatryptanu bursztynianu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sumamigren Control, 50 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 50 mg sumatryptanu (Sumatriptanum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sumamigren Control, 50 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 50 mg sumatryptanu (Sumatriptanum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AMIGRENEX, 50 mg, tabletki AMIGRENEX, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY AMIGRENEX, 50 mg: 1 tabletka zawiera 50 mg sumatryptanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AMIGRENEX, 50 mg, tabletki AMIGRENEX, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY AMIGRENEX, 50 mg: 1 tabletka zawiera 50 mg sumatryptanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka zawiera 50 mg Sumatriptanum (sumatryptanu) w postaci bursztynianu sumatryptanu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Imigran FDT, 50 mg, tabletki powlekane / tabletki do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Imigran FDT, 50 mg, tabletki powlekane / tabletki do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta. AMIGRENEX, tabletki, 100 mg Sumatriptanum
 Ulotka dołączona do opakowania: informacja dla pacjenta AMIGRENEX, tabletki, 100 mg Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta AMIGRENEX, tabletki, 100 mg Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Gl. '8X O ~~24 72 83, II, 817 40~ ~:;;, Pawia" 3418, te124 71 32. . Glaxo Sp. z 0.0..
 Glaxo 111 N Gl.. Glaxo Sp. z 0.0.. Oddzial W warszaw\e Jana Pawia II 34/6 141 Warszawa, A. W PL fax 247129 '8X O ~~24 72 83, II, 817 40~ ~:;;, Pawia" 3418, te124 71 32 OZla. IInformacji.. Naukowej 00-141
Glaxo 111 N Gl.. Glaxo Sp. z 0.0.. Oddzial W warszaw\e Jana Pawia II 34/6 141 Warszawa, A. W PL fax 247129 '8X O ~~24 72 83, II, 817 40~ ~:;;, Pawia" 3418, te124 71 32 OZla. IInformacji.. Naukowej 00-141
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2010-07- 3 SPRAWD.! 0 POD WZGL~DEM ""R'~YM 1. NAZW A PRODUKTU LECZNICZEGO Ranigast 0,5 mglml roztwor do infuzji 2. SKLAD JAKOSCIOWY I ILOSCIOWY 100 mi roztworu zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2010-07- 3 SPRAWD.! 0 POD WZGL~DEM ""R'~YM 1. NAZW A PRODUKTU LECZNICZEGO Ranigast 0,5 mglml roztwor do infuzji 2. SKLAD JAKOSCIOWY I ILOSCIOWY 100 mi roztworu zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Imigran, 20 mg/0,1 ml, aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Dozownik (pojemnik z końcówką do podania aerozolu do nosa)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Imigran, 20 mg/0,1 ml, aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Dozownik (pojemnik z końcówką do podania aerozolu do nosa)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AMIGRENEX, 50 mg, tabletki AMIGRENEX, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY AMIGRENEX, 50 mg: 1 tabletka zawiera 50 mg sumatryptanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AMIGRENEX, 50 mg, tabletki AMIGRENEX, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY AMIGRENEX, 50 mg: 1 tabletka zawiera 50 mg sumatryptanu
Ulotka dołączona do opakowania: informacja dla pacjenta. AMIGRENEX, tabletki, 50 mg Sumatriptanum
 Ulotka dołączona do opakowania: informacja dla pacjenta AMIGRENEX, tabletki, 50 mg Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta AMIGRENEX, tabletki, 50 mg Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinie 50, 50 mg, tabletki Cinie 100, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Cinie 50: Jedna tabletka zawiera bursztynian sumatryptanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinie 50, 50 mg, tabletki Cinie 100, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Cinie 50: Jedna tabletka zawiera bursztynian sumatryptanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Imigran, 25 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 25 mg Sumatriptanum (sumatryptanu). Pełny wykaz substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Imigran, 25 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 25 mg Sumatriptanum (sumatryptanu). Pełny wykaz substancji pomocniczych,
MERYTORVCZNYM., B HAR.2OO!l (
 ItJNAWDZONO POD WZO~DEM MERYTORVCZNYM., B HAR.2OO!l ( Nalei}' przeczytac uwainie calli ulotk~, poniewai zawiera ona informacje waine dla pacjenta. Lek ten jest dost~pny bez recepty, aby moma bylo leczye
ItJNAWDZONO POD WZO~DEM MERYTORVCZNYM., B HAR.2OO!l ( Nalei}' przeczytac uwainie calli ulotk~, poniewai zawiera ona informacje waine dla pacjenta. Lek ten jest dost~pny bez recepty, aby moma bylo leczye
8PRAWDZONO POD WZGUiDEM IlERYTORYCZNYM
 8PRAWDZONO POD WZGUiDEM IlERYTORYCZNYM 1 B 1tAJl. zoog d1 NaieZy zapoznac si~ z tresci~ ulotki przed zastosowaniem leku. Nalezy zachowae t~ ulotk~, aby w razie potrzeby m6c jl\.ponownie przeczytae. NaleZy
8PRAWDZONO POD WZGUiDEM IlERYTORYCZNYM 1 B 1tAJl. zoog d1 NaieZy zapoznac si~ z tresci~ ulotki przed zastosowaniem leku. Nalezy zachowae t~ ulotk~, aby w razie potrzeby m6c jl\.ponownie przeczytae. NaleZy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Sumagen 50 mg, tabletki powlekane Sumagen 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Sumagen 50 mg, tabletki powlekane Sumagen 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda
Ulotka dołączona do opakowania: informacja dla pacjenta. Sumamigren, 50 mg, tabletki powlekane Sumamigren, 100 mg, tabletki powlekane.
 Ulotka dołączona do opakowania: informacja dla pacjenta Sumamigren, 50 mg, tabletki powlekane Sumamigren, 100 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta Sumamigren, 50 mg, tabletki powlekane Sumamigren, 100 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika. Sumamigren Control, 50 mg, tabletki powlekane. Sumatriptanum
 Ulotka dołączona do opakowania: informacja dla użytkownika Sumamigren Control, 50 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika Sumamigren Control, 50 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Naramig, 2,5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera jako substancję czynną 2,5 mg naratryptanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Naramig, 2,5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera jako substancję czynną 2,5 mg naratryptanu
Ulotka dołączona do opakowania: informacja dla pacjenta. TRYMIGA 2,5 mg, tabletki powlekane. Naratriptanum
 Ulotka dołączona do opakowania: informacja dla pacjenta TRYMIGA 2,5 mg, tabletki powlekane Naratriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta TRYMIGA 2,5 mg, tabletki powlekane Naratriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ApoMigra, 50 mg, tabletki powlekane ApoMigra, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ApoMigra, 50 mg: każda tabletka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ApoMigra, 50 mg, tabletki powlekane ApoMigra, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ApoMigra, 50 mg: każda tabletka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna tabletka powlekana zawiera 50 mg sumatryptanu (Sumatriptanum) w postaci sumatryptanu bursztynianu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ApoMigra, 50 mg, tabletki powlekane ApoMigra, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ApoMigra, 50 mg, tabletki powlekane ApoMigra, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Frimig, 50 mg, tabletki powlekane Frimig, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Frimig, 50 mg, tabletki powlekane Frimig, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika. Imigran, 50 mg, tabletki powlekane Imigran, 100 mg, tabletki powlekane.
 Ulotka dołączona do opakowania: informacja dla użytkownika Imigran, 50 mg, tabletki powlekane Imigran, 100 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Imigran, 50 mg, tabletki powlekane Imigran, 100 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna tabletka drażowana zawiera 50 mg lub 100 mg sumatryptanu (w postaci sumatryptanu bursztynianu).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Triptagram, 50 mg, tabletki drażowane Triptagram, 100 mg, tabletki drażowane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka drażowana
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Triptagram, 50 mg, tabletki drażowane Triptagram, 100 mg, tabletki drażowane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka drażowana
B. ULOTKA DLA PACJENTA
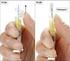 B. ULOTKA DLA PACJENTA 17 SPRAWDZONO POD WZGl~DEM, ULOTKA DLA PACJENTA: INFORMACJA DLA UZYTKOWNlKA MERYTORYCZNYl\'1~ \.. 2013-04- 0 5\j\J\r, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Nalezy
B. ULOTKA DLA PACJENTA 17 SPRAWDZONO POD WZGl~DEM, ULOTKA DLA PACJENTA: INFORMACJA DLA UZYTKOWNlKA MERYTORYCZNYl\'1~ \.. 2013-04- 0 5\j\J\r, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Nalezy
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Imigran FDT, 50 mg, tabletki powlekane / tabletki do sporządzania zawiesiny doustnej Imigran FDT, 100 mg, tabletki powlekane / tabletki do sporządzania
Ulotka dołączona do opakowania: informacja dla użytkownika Imigran FDT, 50 mg, tabletki powlekane / tabletki do sporządzania zawiesiny doustnej Imigran FDT, 100 mg, tabletki powlekane / tabletki do sporządzania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sumigra 50, 50 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 70 mg sumatryptanu bursztynianu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sumigra 50, 50 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 70 mg sumatryptanu bursztynianu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TRYMIGA, 2,5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 2,5 mg naratryptanu (Naratriptanum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TRYMIGA, 2,5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 2,5 mg naratryptanu (Naratriptanum)
Ulotka dołączona do opakowania: informacja dla użytkownika. Naramig, 2,5 mg, tabletki powlekane. Naratriptanum
 Ulotka dołączona do opakowania: informacja dla użytkownika Naramig, 2,5 mg, tabletki powlekane Naratriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla użytkownika Naramig, 2,5 mg, tabletki powlekane Naratriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla użytkownika. ApoMigra, 50 mg, tabletki powlekane ApoMigra, 100 mg, tabletki powlekane Sumatriptanum
 Ulotka dołączona do opakowania: informacja dla użytkownika ApoMigra, 50 mg, tabletki powlekane ApoMigra, 100 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zażyciem
Ulotka dołączona do opakowania: informacja dla użytkownika ApoMigra, 50 mg, tabletki powlekane ApoMigra, 100 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zażyciem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka zawiera 2,5 mg naratryptanu w postaci naratryptanu chlorowodorku.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nacralid, 2,5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg naratryptanu w postaci naratryptanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nacralid, 2,5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg naratryptanu w postaci naratryptanu
Cinie 50, 50 mg, tabletki Cinie 100, 100 mg, tabletki Sumatriptanum
 Ulotka dołączona do opakowania: informacja dla użytkownika Cinie 50, 50 mg, tabletki Cinie 100, 100 mg, tabletki Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika Cinie 50, 50 mg, tabletki Cinie 100, 100 mg, tabletki Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tussal Antitussicum, 15 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 15 mg dekstrometorfanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tussal Antitussicum, 15 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 15 mg dekstrometorfanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sumatriptan Ipca, 50 mg, tabletki powlekane Sumatriptan Ipca, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Tabletki o mocy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sumatriptan Ipca, 50 mg, tabletki powlekane Sumatriptan Ipca, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Tabletki o mocy
SPRAWDZONO MERYTORYCZNYM 1 B MAR. 2009. POD WZGLf;DEM. MlNISTERSTWO ZDROWIA Departement PoIityki lekowej ifannacji 00-952 Warszawa ul.
 SPRAWDZONO POD WZGLf;DEM MERYTORYCZNYM 1 B MAR. 2009 2. SKLAD JAKOSCIOWY I ILO~SCIOWv Cetyryzyna jest wskazana w lagodzeniu objawow dotyc~cych nosa i oczu, zwi~ych z sezonowym i przewleklym alergicznym
SPRAWDZONO POD WZGLf;DEM MERYTORYCZNYM 1 B MAR. 2009 2. SKLAD JAKOSCIOWY I ILO~SCIOWv Cetyryzyna jest wskazana w lagodzeniu objawow dotyc~cych nosa i oczu, zwi~ych z sezonowym i przewleklym alergicznym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AFLAVIC, 600 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg zmikronizowanej diosminy (Diosminum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AFLAVIC, 600 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg zmikronizowanej diosminy (Diosminum).
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alerzina, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje
ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alerzina, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Leczenie epizod6w depresyjnych, Tianeptyn" mozna stosowac w lekkiej, umiarkowanej i ci"zkiej depresji,
 Sprawdzono pod wzgl~dem ftlpiytory ny' CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2012-0 - 0 1. NAZW A PRODUKTU LECZNICZEGO Atinepte, 12,5 mg, tabletki powlekane 2. SKLAD JAKOSCIOWY I ILOSCIOWY Kazda tabletka
Sprawdzono pod wzgl~dem ftlpiytory ny' CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2012-0 - 0 1. NAZW A PRODUKTU LECZNICZEGO Atinepte, 12,5 mg, tabletki powlekane 2. SKLAD JAKOSCIOWY I ILOSCIOWY Kazda tabletka
Ulotka dołączona do opakowania: informacja dla użytkownika Frimig, 50 mg, tabletki powlekane Frimig, 100 mg, tabletki powlekane Sumatriptanum
 Ulotka dołączona do opakowania: informacja dla użytkownika Frimig, 50 mg, tabletki powlekane Frimig, 100 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Frimig, 50 mg, tabletki powlekane Frimig, 100 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
>30 ml/min) dostosowanie dawki nie jest wymagane. U pacjentów
 1. NAZWA PRODUKTU LECZNICZEGO Vimpat 150 mg, tabletki powlekane 2. iera 150 mg lakozamidu. 3. Tabletka powlekana ososiowe, owalne tabletki powlekane oznakowane po drugiej. 4. E KLINICZNE 4.1 Wskazania
1. NAZWA PRODUKTU LECZNICZEGO Vimpat 150 mg, tabletki powlekane 2. iera 150 mg lakozamidu. 3. Tabletka powlekana ososiowe, owalne tabletki powlekane oznakowane po drugiej. 4. E KLINICZNE 4.1 Wskazania
1. NAZWA PRODUKTU LECZNICZEGO. Vimpat 200 mg, tabletki powlekane. 2. mg lakozamidu. 3. FARMACEUTYCZNA
 1. NAZWA PRODUKTU LECZNICZEGO Vimpat 200 mg, tabletki powlekane 2. mg lakozamidu. 3. FARMACEUTYCZNA Tabletka powlekana Niebieskie, owalne tabletki powlekane oznakowane po drugiej. 4. 4.1 Wskazania do stosowania
1. NAZWA PRODUKTU LECZNICZEGO Vimpat 200 mg, tabletki powlekane 2. mg lakozamidu. 3. FARMACEUTYCZNA Tabletka powlekana Niebieskie, owalne tabletki powlekane oznakowane po drugiej. 4. 4.1 Wskazania do stosowania
Elicea, 5 mg, tabletki powlekane Elicea, 10 mg, tabletki powlekane Elicea, 20 mg, tabletki powlekane Escitalopramum
 Elicea, 5 mg, tabletki powlekane Elicea, 10 mg, tabletki powlekane Elicea, 20 mg, tabletki powlekane Escitalopramum wiera ona - - - - lub farmaceucie. Patrz punkt 4. 1. 2. 3. 4. 5. 6. 1. Lek Elicea zawiera
Elicea, 5 mg, tabletki powlekane Elicea, 10 mg, tabletki powlekane Elicea, 20 mg, tabletki powlekane Escitalopramum wiera ona - - - - lub farmaceucie. Patrz punkt 4. 1. 2. 3. 4. 5. 6. 1. Lek Elicea zawiera
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO Vimpat 50 mg, tabletki powlekane Vimpat 100 mg, tabletki powlekane Vimpat 150 mg, tabletki powlekane Vimpat 200 mg, tabletki powlekane 2. mg lakozamidu. mg lakozamidu. mg
1. NAZWA PRODUKTU LECZNICZEGO Vimpat 50 mg, tabletki powlekane Vimpat 100 mg, tabletki powlekane Vimpat 150 mg, tabletki powlekane Vimpat 200 mg, tabletki powlekane 2. mg lakozamidu. mg lakozamidu. mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinnarizinum Aflofarm, 25 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 25 mg cynaryzyny (Cinnarizinum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinnarizinum Aflofarm, 25 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 25 mg cynaryzyny (Cinnarizinum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO MIGRENOXIN, 50 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera sumatryptanu bursztynian w ilości
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO MIGRENOXIN, 50 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera sumatryptanu bursztynian w ilości
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alermed, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy zapoznać się z treścią ulotki przed zażyciem leku. - Należy
ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alermed, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy zapoznać się z treścią ulotki przed zażyciem leku. - Należy
Ulotka dołączona do opakowania: informacja dla pacjenta. Sumigra 50, 50 mg, tabletki powlekane Sumigra 100, 100 mg, tabletki powlekane Sumatriptanum
 Ulotka dołączona do opakowania: informacja dla pacjenta Sumigra 50, 50 mg, tabletki powlekane Sumigra 100, 100 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta Sumigra 50, 50 mg, tabletki powlekane Sumigra 100, 100 mg, tabletki powlekane Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO Vimpat 50 mg, tabletki powlekane Vimpat 100 mg, tabletki powlekane Vimpat 150 mg, tabletki powlekane Vimpat 200 mg, tabletki powlekane 2. mg lakozamidu. abletka powlekana
1. NAZWA PRODUKTU LECZNICZEGO Vimpat 50 mg, tabletki powlekane Vimpat 100 mg, tabletki powlekane Vimpat 150 mg, tabletki powlekane Vimpat 200 mg, tabletki powlekane 2. mg lakozamidu. abletka powlekana
MERYTORYCZNYM '18 MAR.2009 ~
 ULOTKA DLA PACJENTA: INFORMACJA DLA UZYTKOWNIKA SPRAWDZONO POD WZGll;DEM MERYTORYCZNYM '18 MAR.2009 ~ Nalety zapoznac si~ z tresci~ ulotki przed zastosowaniem leku. Nalezy zaehowae t~ ulotk~, aby w razie
ULOTKA DLA PACJENTA: INFORMACJA DLA UZYTKOWNIKA SPRAWDZONO POD WZGll;DEM MERYTORYCZNYM '18 MAR.2009 ~ Nalety zapoznac si~ z tresci~ ulotki przed zastosowaniem leku. Nalezy zaehowae t~ ulotk~, aby w razie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Thiogamma, 600 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Thiogamma, 600 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO ALERIC, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jedna tabletka zawiera 10 mg Loratadinum (loratadyny).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO ALERIC, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jedna tabletka zawiera 10 mg Loratadinum (loratadyny).
1. NAZWA PRODUKTU LECZNICZEGO. Vimpat 100 mg, tabletki powlekane. 2. mg lakozamidu. 3. CEUTYCZNA
 1. NAZWA PRODUKTU LECZNICZEGO Vimpat 100 mg, tabletki powlekane 2. mg lakozamidu. 3. CEUTYCZNA Tabletka powlekana C e, owalne tabletki powlekane oznakowane 100 po drugiej. 4. 4.1 Wskazania do stosowania
1. NAZWA PRODUKTU LECZNICZEGO Vimpat 100 mg, tabletki powlekane 2. mg lakozamidu. 3. CEUTYCZNA Tabletka powlekana C e, owalne tabletki powlekane oznakowane 100 po drugiej. 4. 4.1 Wskazania do stosowania
1. NAZWA PRODUKTU LECZNICZEGO. Vimpat 100 mg, tabletki powlekane. 2. mg lakozamidu. niczych, patrz punkt
 1. NAZWA PRODUKTU LECZNICZEGO Vimpat 100 mg, tabletki powlekane 2. mg lakozamidu. niczych, patrz punkt 6.1. 3. Tabletka powlekana C e, owalne tabletki powlekane oznakowane 100 po drugiej. 4. 4.1 Wskazania
1. NAZWA PRODUKTU LECZNICZEGO Vimpat 100 mg, tabletki powlekane 2. mg lakozamidu. niczych, patrz punkt 6.1. 3. Tabletka powlekana C e, owalne tabletki powlekane oznakowane 100 po drugiej. 4. 4.1 Wskazania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TANAKAN, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: Każda tabletka zawiera 40 mg suchego wyciągu z miłorzębu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TANAKAN, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: Każda tabletka zawiera 40 mg suchego wyciągu z miłorzębu,
BIONORICA Polska Sp z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Cyclodynon 1
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika ZYX Bio 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika ZYX Bio 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 kapsułka twarda VENOTREX 300 mg kapsułki twarde zawiera 300 mg trokserutyny (o-βhydroksyetylorutozydy).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
Ulotka dołączona do opakowania: informacja dla pacjenta. Almozen, 12,5 mg, tabletki powlekane Almotriptani malas
 Ulotka dołączona do opakowania: informacja dla pacjenta Almozen, 12,5 mg, tabletki powlekane Almotriptani malas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Almozen, 12,5 mg, tabletki powlekane Almotriptani malas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna tabletka powlekana zawiera 80 mg fenspirydu chlorowodorku (Fenspiridi hydrochloridum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EURESPAL 80 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 80 mg fenspirydu chlorowodorku (Fenspiridi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EURESPAL 80 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 80 mg fenspirydu chlorowodorku (Fenspiridi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Spamilan 5 mg, tabletki 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jedna tabletka zawiera 5 mg lub 10
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Spamilan 5 mg, tabletki 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jedna tabletka zawiera 5 mg lub 10
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tribux Forte, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 200 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tribux Forte, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 200 mg trimebutyny maleinianu (Trimebutini maleas).
Ulotka dołączona do opakowania: informacja dla użytkownika. Triptagram, 50 mg, tabletki drażowane Triptagram, 100 mg, tabletki drażowane
 Ulotka dołączona do opakowania: informacja dla użytkownika Triptagram, 50 mg, tabletki drażowane Triptagram, 100 mg, tabletki drażowane Sumatriptanum Należy zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Triptagram, 50 mg, tabletki drażowane Triptagram, 100 mg, tabletki drażowane Sumatriptanum Należy zapoznać się z treścią ulotki przed zastosowaniem
INFORMACJA O LEKU 1. NAZWA PRODUKTU LECZNICZEGO Donepex, 10 mg, tabletki powlekane
 INFORMACJA O LEKU 1. NAZWA PRODUKTU LECZNICZEGO Donepex, 5 mg, tabletki powlekane Donepex, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Donepezili hydrochloridum Każda tabletka powlekana 5
INFORMACJA O LEKU 1. NAZWA PRODUKTU LECZNICZEGO Donepex, 5 mg, tabletki powlekane Donepex, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Donepezili hydrochloridum Każda tabletka powlekana 5
Ulotka dołączona do opakowania: informacja dla pacjenta. VALDIXEXTRAKT Valerianae extractum hydroalcoholicum siccum 355 mg tabletka powlekana
 Ulotka dołączona do opakowania: informacja dla pacjenta VALDIXEXTRAKT Valerianae extractum hydroalcoholicum siccum 355 mg tabletka powlekana Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta VALDIXEXTRAKT Valerianae extractum hydroalcoholicum siccum 355 mg tabletka powlekana Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Folacid, 5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 5 mg kwasu foliowego (Acidum folicum). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Folacid, 5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 5 mg kwasu foliowego (Acidum folicum). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 tabletka zawiera 250 mg wapnia dobezylanu jednowodnego (Calcii dobesilas monohydricus).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DOBENOX, 250 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 250 mg wapnia dobezylanu jednowodnego (Calcii dobesilas
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DOBENOX, 250 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 250 mg wapnia dobezylanu jednowodnego (Calcii dobesilas
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJE DLA UŻYTKOWNIKA MIGRENOXIN, 50 mg, tabletki powlekane Sumatryptan
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJE DLA UŻYTKOWNIKA MIGRENOXIN, 50 mg, tabletki powlekane Sumatryptan Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJE DLA UŻYTKOWNIKA MIGRENOXIN, 50 mg, tabletki powlekane Sumatryptan Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika. Imigran, 25 mg, czopki. Sumatriptanum
 Ulotka dołączona do opakowania: informacja dla użytkownika Imigran, 25 mg, czopki Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla użytkownika Imigran, 25 mg, czopki Sumatriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika. Zomig, 2,5 mg, tabletki powlekane. Zolmitriptanum
 Ulotka dołączona do opakowania: informacja dla użytkownika Zomig, 2,5 mg, tabletki powlekane Zolmitriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika Zomig, 2,5 mg, tabletki powlekane Zolmitriptanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancja pomocnicza o znanym działaniu: jedna tabletka zawiera 71,3 mg laktozy jednowodnej.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flonidan, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flonidan, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rostil, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg wapnia dobezylanu jednowodnego (Calcii dobesilas
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rostil, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg wapnia dobezylanu jednowodnego (Calcii dobesilas
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Tabletki powlekane: żółte, okrągłe, dwuwypukłe, oznakowane literą Z po jednej stronie tabletki.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zomig, 2,5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Zolmitriptanum Jedna tabletka powlekana zawiera 2,5 mg zolmitryptanu.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zomig, 2,5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Zolmitriptanum Jedna tabletka powlekana zawiera 2,5 mg zolmitryptanu.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka zawiera 12,5 mg almotryptanu w postaci almotryptanu jabłczanu (Almotriptani malas).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Almozen, 12,5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 12,5 mg almotryptanu w postaci almotryptanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Almozen, 12,5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 12,5 mg almotryptanu w postaci almotryptanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Loratadyna EGIS, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg loratadyny. Substancje pomocnicze: Każda
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Loratadyna EGIS, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg loratadyny. Substancje pomocnicze: Każda
BIONORICA Polska Sp z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Lunapret 1
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Lunapret 1 1. NAZWA PRODUKTU LECZNICZEGO Lunapret Valerianae radicis extractum siccum + Lupuli strobili extractum siccum tabletki powlekane, 250 mg + 60 mg 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Lunapret 1 1. NAZWA PRODUKTU LECZNICZEGO Lunapret Valerianae radicis extractum siccum + Lupuli strobili extractum siccum tabletki powlekane, 250 mg + 60 mg 2. SKŁAD
Ulotka dołączona do opakowania: informacja dla użytkownika. Sumatriptan Ipca, 50 mg, tabletki powlekane Sumatriptan Ipca, 100 mg, tabletki powlekane
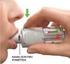 Ulotka dołączona do opakowania: informacja dla użytkownika, 50 mg, tabletki powlekane, 100 mg, tabletki powlekane Sumatriptanum Należy zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika, 50 mg, tabletki powlekane, 100 mg, tabletki powlekane Sumatriptanum Należy zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Amertil, 10 mg, tabletki powlekane. Cetirizini dihydrochloridum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Amertil, 10 mg, tabletki powlekane Cetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Amertil, 10 mg, tabletki powlekane Cetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka powlekana zawiera 120 mg feksofenadyny chlorowodorku, co odpowiada 112 mg feksofenadyny.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FEXOFAST 120 mg, 120 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 120 mg feksofenadyny chlorowodorku,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FEXOFAST 120 mg, 120 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 120 mg feksofenadyny chlorowodorku,
Tabletki powlekane. Okrągłe, wypukłe, pomarańczowe tabletki z wytłoczeniem REP 20 albo REP 40 na jednej stronie oraz Pfizer na drugiej stronie.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Relpax, 20 mg, tabletki powlekane Relpax, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 20
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Relpax, 20 mg, tabletki powlekane Relpax, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 20
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO CLARITINE ALLERGY 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg Loratadinum (loratadyny). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO CLARITINE ALLERGY 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg Loratadinum (loratadyny). Substancja
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Irprestan, 75 mg, tabletki powlekane Irprestan, 150 mg, tabletki powlekane Irprestan, 300 mg, tabletki powlekane (Irbesartanum) Należy zapoznać się z treścią
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Irprestan, 75 mg, tabletki powlekane Irprestan, 150 mg, tabletki powlekane Irprestan, 300 mg, tabletki powlekane (Irbesartanum) Należy zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla użytkownika. ZYX, 5 mg, tabletki powlekane. Levocetirizini dihydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika ZYX, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika ZYX, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dla pacjenta. Alerton (Cetirizini dihydrochloridum) 10 mg, tabletki powlekane
 Ulotka dla pacjenta ależy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest dostępny bez recepty, aby można było leczyć niektóre schorzenia bez pomocy lekarza.
Ulotka dla pacjenta ależy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest dostępny bez recepty, aby można było leczyć niektóre schorzenia bez pomocy lekarza.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vinpotaxer, 5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 5 mg winpocetyny (Vinpocetinum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vinpotaxer, 5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 5 mg winpocetyny (Vinpocetinum). Substancje pomocnicze
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. VICEBROL FORTE; 10 mg, tabletki Vinpocetinum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL FORTE; 10 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL FORTE; 10 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan max, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan max, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flonidan Control, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flonidan Control, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna tabletka zawiera 60 mg pseudoefedryny chlorowodorku (Pseudoephedrini hydrochloridum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sudafed, 60 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 60 mg pseudoefedryny chlorowodorku (Pseudoephedrini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sudafed, 60 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 60 mg pseudoefedryny chlorowodorku (Pseudoephedrini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka do ssania zawiera 20 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mucoangin, 20 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do ssania zawiera 20 mg ambroksolu chlorowodorku (Ambroxoli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mucoangin, 20 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do ssania zawiera 20 mg ambroksolu chlorowodorku (Ambroxoli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
Charakterystyka Produktu Leczniczego
 Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO Duspatalin, 135 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 135 mg mebeweryny chlorowodorku (Mebeverini hydrochloridum).
Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO Duspatalin, 135 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 135 mg mebeweryny chlorowodorku (Mebeverini hydrochloridum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
