Niepożądane działanie leku (ndl) każde niekorzystne i niezamierzone działanie produktu leczniczego. Niepożądane działanie leku (ndl)
|
|
|
- Beata Sikora
- 9 lat temu
- Przeglądów:
Transkrypt
1 Zdarzenie niepożądane adverse event Farmakologia ogólna Anna Wiela-Hojeńska każda niepożądana reakcja, występująca u pacjenta w czasie lub po leczeniu, niezależnie czy jest uznana za związaną z danym produktem leczniczym, czy nie Katedra i Zakład Farmakologii Klinicznej Uniwersytetu Medycznego we Wrocławiu przyczyną nie musi być (chociaż może) zastosowany lek Niepożądane działanie leku (ndl) Adverse Drug Reaction (ADR) (definicja przyjęta przez WHO w 1972 r.) Ustawa z dnia 6 września 2001 r. Prawo farmaceutyczne (zm. 2007, 2011) każde szkodliwe i niezamierzone działanie leku, które występuje podczas stosowania dawek zalecanych u ludzi w celach profilaktycznych, diagnostycznych, terapeutycznych lub dla modyfikacji funkcji fizjologicznych nie można wykluczyć związku przyczynowego między zastosowanym lekiem a powikłaniem Niepożądane działanie leku (ndl) Adverse Drug Reaction (ADR) Dyrektywa 2010/84/UE każde niekorzystne i niezamierzone działanie produktu leczniczego Niepożądane działanie leku (ndl) Adverse Drug Reaction (ADR) Dyrektywa 2010/84/UE szkodliwe i niezamierzone skutki stosowania produktu leczniczego, które wynikają z jego stosowania w sposób dozwolony, jak również stosowania: błędnego, poza warunkami określonymi w pozwoleniu na dopuszczenie do obrotu, niezgodnego z przeznaczeniem, przedawkowania, błędu medycznego Ciężkie niepożądane działanie leku serious adverse drug reaction zgon pacjenta zagrożenie życia (krwotok śródmózgowy, wstrząs anafilaktyczny) konieczność leczenia szpitalnego lub jego przedłużenie (>24 h) trwały lub znaczny uszczerbek na zdrowiu (upośledzenie zdolności do wykonywania prawidłowych czynności życiowych FDA) choroba, wada wrodzona, uszkodzenie płodu inne, które lekarz według swojego stanu wiedzy uzna za ciężkie ( Current Challenges in Pharmacovigilance: Pragmatic Approach Report of CIOMS Working Group V, Geneva 2001)
2 Czy reakcja ciężka = poważna? NIE! Poważne niepożądane działanie leku severe adverse drug reaction określa stopień nasilenia reakcji reakcja łagodna, o średnim stopniu nasilenia, o dużym nasileniu nasilenie reakcji może decydować o tym czy jest ona ciężka Niespodziewane niepożądane działanie leku unexpected adverse reaction każde działanie niepożądane, którego charakter lub stopień nasilenia nie jest zgodny z informacjami zawartymi w: - Charakterystyce Produktu Leczniczego (Summary of Product Characteristics, SPC) - zatwierdzonych drukach informacyjnych dla produktów leczniczych dopuszczonych do obrotu - Broszurze Badacza dla produktów leczniczych nie dopuszczonych do obrotu Niepożądane działania leków typu A (drug actions) reakcje zależne od właściwości farmakologicznych leku, podanej dawki, obserwowane w czasie prowadzenia badań klinicznych, możliwe do przewidzenia - hipotonia po zastosowaniu dużej dawki inhibitora konwertazy angiotensyny - hipoglikemia podczas terapii lekami przeciwcukrzycowymi Niepożądane działania leków typu A Rozbieżność pomiędzy zakładanym a uzyskanym efektem leczenia farmakologicznego Pierwotne i wtórne powikłania terapii związane z farmakologicznym działaniem leku IKA przewlekły, męczący, suchy kaszel, uczucie podrażnienia w gardle, zmiana barwy głosu stymulacja przez bradykininę syntezy metabolitów kaskady kwasu arachidonowego, nasilenie syntezy NO; skutkiem działania prostaglandyn i NO jest stan zapalny, wywołujący kaszel Interakcje lek lek lek pożywienie lek używki lek badania laboratoryjne Czynniki ryzyka ototoksyczności antybiotyków aminoglikozydowych starszy wiek upośledzona czynność nerek odwodnienie zwiększone stężenie antybiotyku w surowicy (C maxss > µg/ml dla gentamycyny, tobramycyny, netylmycyny; >35-40 µg/ml dla amikacyny) równoczesne stosowanie innych ototoksycznych leków wcześniejsza terapia antybiotykami aminoglikozydowymi dializa długi czas leczenia
3 Czynniki ryzyka nefrotoksyczności antybiotyków aminoglikozydowych neomycyna>paromomycyna>gentamycyna>amikacyna= kanamycyna>tobramycyna>netylmycyna starszy wiek niewydolność nerek hipotonia posocznica kwasica zmniejszenie objętości płynów ustrojowych współistniejące uszkodzenie wątroby długi czas trwania leczenia (10 dni) zwiększone stężenie antybiotyku w surowicy (C minss > 2-3 µg/ml dla tobramycyny, gentamycyny, netylmycyny; >10 µg/ml dla amikacyny) równoczesne stosowanie innych nefrotoksycznych antybiotyków uprzednia terapia antybiotykami aminoglikozydowymi Antybiotyki aminoglikozydowe czynniki ryzyka: miastenia gravis blokada przekaźnictwa nerwowo-mięśniowego równoczesne stosowanie leków blokujących przekaźnictwo nerwowo-mięśniowe (galamina, pankuronium, tubokuraryna, sukcynylocholina) - nasilenie działania zwiotczającego mięśnie, przedłużenie okresu porażenia mięśniowego, niebezpieczeństwo bezdechu Niepożądane interakcje antybiotyków aminoglikozydowych z innymi lekami Inne leki Cisplatyna, furosemid, kwas etakrynowy Acyklowir, amfoterycyna, cefalotyna, cefradyna, cisplatyna, cyklosporyna, furosemid, kapreomycyna, karboplatyna, kwas etakrynowy, metoksyfluran, wankomycyna Rodzaj i następstwo interakcji Nasilenie działania ototoksycznego Nasilenie działania nefrotoksycznego Niepożądane działania wankomycyny wykwity skórne, stany zapalne błon śluzowych, świąd zespoły: Stevensa i Johnsona, Lyella bolesny skurcz mięśni zespół czerwonego człowieka odczyn anafilaktoidalny: świąd, zaczerwienienie skóry, silny spadek ciśnienia krwi, wstrząs, sporadycznie zatrzymanie akcji serca szybki wlew antybiotyku nefrotoksyczność: >28, >20-30 mg/ml: C minss ototoksyczność: > μg/ml: C max neutropenia: zależna od D i czasu stosowania >14 dni Niepożądane interakcje wankomycyny z innymi lekami Inne leki i substancje Antybiotyki aminoglikozydowe, cyklosporyna, cisplatyna, furosemid Środki znieczulenia ogólnego Leki zmniejszające napięcie mięśni np. sukcynylocholina Rodzaj i następstwo interakcji Nasilenie działania nefrotoksycznego, ototoksycznego Zwiększone ryzyko wystąpienia: rumienia, pokrzywki, świądu Nasilenie i wydłużenie działania zwiotczającego mięśnie Wpływ leków przeciwbólowych na izoformy cyklooksygenazy preferencyjne inhibitory COX-1 indometacyna, ketoprofen, Aspiryna leki o podobnym działaniu na COX-1 i COX-2 naproksen, ibuprofen, piroksykam, diklofenak, nabumeton preferencyjne inhibitory COX-2 nimesulid, meloksykam selektywne inhibitory COX-2 celekoksyb, etorikoksyb, parekoksyb leki pozbawione działania przeciwzapalnego metamizol, paracetamol, nefopam
4 Niepożądane działania NLPZ Im bardziej lek hamuje aktywność COX-1, tym większe jest ryzyko wystąpienia niepożądanych działań dotyczących zwłaszcza przewodu pokarmowego, układu oddechowego, nerek przewód pokarmowy: objawy dyspeptyczne krwawienia owrzodzenia i perforacja żołądka enteropatia z towarzyszącą utratą białka i następową hipoproteinemią owrzodzenie jelita grubego przypominające wrzodziejące zapalenie jelita Czynniki ryzyka uszkodzenia przewodu pokarmowego przez NLPZ starszy wiek pacjenta choroba wrzodowa w wywiadzie stosowanie dużych dawek leku unieruchomienie niewydolność krążenia równoczesne stosowanie innych leków o działaniu ulcerogennym palenie papierosów spożywanie nadmiernych ilości alkoholu Leki nasilajace gastrotoksyczność NLPZ równoczesne stosowanie 2 lub większej liczby NLPZ błąd, brak synergizmu terapeutycznego, synergizm działań niepożądanych glikokortykosteroidy bifosfoniany stosowane doustnie doustne leki przeciwzakrzepowe wzrost ryzyka krwawień z górnego odcinka przewodu pokarmowego inhibitory wychwytu zwrotnego serotoniny spironolakton Optymalizacja terapii niesteroidowymi lekami przeciwzapalnymi Optymalizacja terapii niesteroidowymi lekami przeciwzapalnymi nie łączyć NLPZ! dobór leku dostosować do potrzeb chorego, uwzględniając dobowy rytm dolegliwości chorzy na reumatoidalne zapalenie stawów, zesztywniające zapalenie stawów cierpią najbardziej w nocy i nad ranem chorzy na chorobę zwyrodnieniową stawów cierpią najbardziej w godzinach popołudniowych i wieczornych
5 Optymalizacja terapii niesteroidowymi lekami przeciwzapalnymi wybierać leki o krótkim biologicznym okresie półtrwania, gdyż utrzymują one dłużej większe stężenia w jamie stawowej niż w surowicy, dawkowanie ich może być rzadsze, terapia bezpieczniejsza Optymalizacja terapii niesteroidowymi lekami przeciwzapalnymi pamiętać o możliwości powikłań dotyczących zwłaszcza przewodu pokarmowego, nerek koksyby nie zastępują kwasu acetylosalicylowego w profilaktyce zatorowo-zakrzepowej! pamiętać, że zwiększenie dawki NLPZ nie powoduje nasilenia działania przeciwbólowego (efekt pułapowy) pamiętać o dużym ryzyku wystąpienia niepożądanych interakcji podczas równoczesnego stosowania NLPZ z innymi lekami Leki zastosowane jednocześnie z NLPZ Leki obniżające ciśnienie tętnicze krwi (betaadrenolityki, inhibitory konwertazy angiotenzyny, diuretyki) Interakcje NLPZ Rodzaj i następstwo interakcji Osłabienie hipotensyjnego działania tych leków na skutek zmniejszenia przez NLPZ syntezy prostaglandyn rozszerzających naczynia Leki zastosowane jednocześnie z NLPZ Pochodne kumaryny Pochodne kumaryny Interakcje NLPZ Wzrost ryzyka wystąpienia krwawień z przewodu pokarmowego na skutek hamującego wpływu NLPZ na czynność płytek krwi i na wytwarzanie protrombiny Wzrost ryzyka wystąpienia krwawień z przewodu pokarmowego na skutek wypierania pochodnych kumaryny z połączeń z białkami krwi Interakcje NLPZ Interakcje NLPZ Leki zastosowane jednocześnie z NLPZ Leki zastosowane jednocześnie z NLPZ Rodzaj i następstwo interakcji Leki przeciwcukrzycowe Pochodne sulfonylomocznika Nasilenie hipoglikemizującego działania przez własne działanie hipoglikemiczne niektórych NLPZ Nasilenie działania hipoglikemicznego na skutek wypierania leków przeciwcukrzycowych z połączeń z białkami krwi oraz hamowania ich metabolizmu Fluorochinolony Cyklosporyna, takrolimus, inhibitory konwertazy angiotensyny Sole litu Nasilenie toksycznego działania na OUN Nasilenie przez NLPZ nefrotoksyczności Nasilenie przez NLPZ toksyczności
6 Interakcje NLPZ Interakcje NLPZ Leki zastosowane jednocześnie z NLPZ Metotreksat Nasilenie toksyczności metotreksatu na skutek wypierania z połączeń z białkami i zmniejszenia przesączania kłębkowego tego leku Leki zastosowane jednocześnie z NLPZ Kortykosteroidy Wzrost stężenia kortykosteroidów na skutek zmniejszenia wydalania przez nerki, wystąpienie gastropatii, krwawienia z przewodu pokarmowego Digoksyna Wzrost stężenia digoksyny na skutek wypierania z połączeń z białkami i zmniejszenia wydalania przez nerki Trójpierścieniowe leki przeciwdepresyjne, neuroleptyki, leki przeciwarytmiczne Nasilenie działania obok wymienionych leków przez zahamowanie ich metabolizmu Grupy zwiększonego ryzyka wystąpienia niepożądanych interakcji NLPZ osoby starsze osoby cierpiące z powodu niewydolności wątroby i nerek osoby z zaburzeniami metabolicznymi (niedoczynność tarczycy) ciężko chorzy (niewydolność krążenia, zapalenie płuc) chorzy z zaostrzeniem chorób, takich jak: zaburzenia rytmu serca, padaczka, cukrzyca, astma pacjenci cierpiący z powodu przewlekłych schorzeń, wymagający długotrwałej farmakoterapii osoby o genetycznie uwarunkowanej zmniejszonej aktywności izoenzymu CYP2C9, odpowiedzialnego za metabolizm diklofenaku, ibuprofenu, naproksenu, piroksykamu, celekoksybu Niepożądane działania leków typu B (bizarre, patient reactions) reakcje niezależne od zastosowanej dawki leku, zagrażające życiu chorego (reakcje alergiczne i pseudoalergiczne) - reakcja anafilaktyczna + pseudoalergiczny zespół czerwonego człowieka związany z terapią wankomycyną Polekowe reakcje uczuleniowe (7% populacji, 10-20% hospitalizowanych chorych, odpowiadają za>15% wszystkich niepożądanych działań) Typy według podziału Gella i Coombsa (1963) I zależy od IgE (pokrzywka, astma, kolka jelitowa, anafilaksja) II cytotoksyczny (niedokrwistość hemolityczna, granulocytopenia, małopłytkowość) III kompleksów immunologicznych (zapalenie naczyń) IV reakcje opóźnione (wyprysk kontaktowy, rumień toksyczny, zespół toksycznej nekrolizy naskórka) reakcje fotoalergiczne choroby autoimmunologiczne (układowy toczeń rumieniowaty) alergiczne polekowe uszkodzenie wątroby alergiczna polekowa nefropatia płucne reakcje nadwrażliwości na leki gorączka polekowa reakcje niealergiczne tzw. reakcje rzekomoalergiczne lub anafilaktoidalne wywołane przez rentgenowskie środki cieniujące, narkotyczne leki przeciwbólowe idiosynkrazja obrzęk naczynioruchowy, gwałtowne napady astmy, wstrząs po kwasie acetylosalicylowym, agranulocytoza po podaniu metamizolu ( :61 zgonów wg WHO) reakcje nietolerancji dzwonienie w uszach po małej, pojedynczej dawce kwasu acetylosalicylowego
7 Różnice między niepożądanymi działaniami leków typu A i B Typ A możliwe do przewidzenia zależne od dawki występują często rzadko są przyczyną zgonu wymagają indywidualizacji dawkowania obserwowane w trakcie badań klinicznych Typ B nieprzewidywalne nie zależą od dawki występują rzadko większa niż dla typu A przyczyna zgonów wymagają przerwania stosowania bardzo rzadko zgłaszane w badaniach klinicznych Niepożądane działania leków typu C (not true drug reactions, chronic use) reakcje obserwowane z większą częstością u osób poddanych terapii danym lekiem, ale dla konkretnego pacjenta trudno wykazać czy zastosowany lek był przyczyną ich wystąpienia - choroba zakrzepowa u kobiet stosujących doustne środki antykoncepcyjne (chronic use) - reakcje zależne od przewlekłego stosowania leku - osteoporoza związana z długotrwałym stosowaniem glikokortykosteroidów - lipodystrofia podskórnej tkanki tłuszczowej po insulinie - uzależnienie od opioidowych leków przeciwbólowych - tolerancja na stosowanie leków przeczyszczających, prowadząca do ich nadużywania Niepożądane działania leków typ D (retarded actions, delayed) - reakcje ujawniające się po długim czasie od zastosowania leku, tzw. reakcje opóźnione - kardiotoksyczność antybiotyków antracyklinowych - późne dyskinezy po neuroleptykach typ E (end of use) reakcje wywołane odstawieniem leku - nasilenie objawów choroby niedokrwiennej serca po nagłym przerwaniu terapii beta-adrenolitykiem typ F (failure of therapy) - brak skuteczności terapii (głównie z powodu oporności) Czynniki powodujące różnice w działaniu leków poprzez zmianę ich właściwości farmakodynamicznych i farmakokinetycznych cechy osobnicze chorego wiek (dzieci, osoby starsze) płeć (kobiety) masa ciała uwarunkowania genetyczne ciąża Wartości parametrów farmakokinetycznych antybiotyków aminoglikozydowych u dzieci Wartości parametrów farmakokinetycznych wankomycyny u dzieci Applied Clinical Pharmacokinetics, 2008 Pacjent wcześniaki (<34 tygodnia) noworodki (ok. 40 tygodnia) dzieci 6-miesięczne Applied Clinical Pharmacokinetics, 2008 Biologiczny okres półtrwania (h) Współczynnik dystrybucji (l/kg) ,5-0, ,4-0, ,3-0,4 Pacjenci wcześniaki (32 tydzień) noworodki (ok. 40 tygodnia) dzieci 3-miesięczne dzieci 4-8-letnie Biologiczny okres półtrwania (h) Współczynnik dystrybucji (l/kg) Klirens (ml/min) 10 0, , ,
8 Wpływ starszego wieku na występowanie niepożądanych działań leków zmiany morfologiczne i czynnościowe powodujące zmiany farmakokinetyki i ostatecznego działania leków wielochorobowość i wielolekowość maskowanie objawów ndl przez współistniejące procesy chorobowe lub zmiany związane z wiekiem kaskada zapisywania leków (prescribing cascade) np. terapia inhibitorami konwertazy angiotenzyny kaszel nierozpoznanie przyczyny włączenie leków przeciwkaszlowych np. kodeiny dz.niepożądane zaparcia lub ich nasilenie stosowanie leków przeczyszczających stosowanie średnio od 3 do 8 leków dziennie ryzyko wystąpienia niepożądanych interakcji mała podatność chorych na zalecenia ingerencja chorych w schematy leczenia -błędy w przyjmowaniu leków zapominanie o wzięciu leków, omyłkowe pobranie podwójne Czynniki warunkujące większą częstość występowania ndl u kobiet w porównaniu z mężczyznami różnice fizjologiczne przyjmowanie większej liczby leków stosowanie doustnych środków antykoncepcyjnych Interakcje doustnych środków antykoncepcyjnych (A) z równocześnie stosowanymi lekami (B) Leki (B) stosowane równocześnie z doustnymi środkami antykoncepcyjnymi (A) Amoksycylina, ampicylina, cefalosporyny, erytromycyna, penicylina G, karbenicylina, klarytromycyna, kloksacylina, kotrymoksazol, duże dawki witaminy C, sole żelaza, sukralfat, tetracykliny (B) zmniejszają wchłanianie i krążenie wątrobowo-jelitowe (A) zmniejszenie skuteczności (A) Interakcje doustnych środków antykoncepcyjnych (A) z równocześnie stosowanymi lekami (B) Leki (B) stosowane równocześnie z doustnymi środkami antykoncepcyjnymi (A) Efawirenez, felbamat, fenobarbital, fenytoina, karbamazepina, newirapina, okskarbazepina, prednizon, preparaty dziurawca, topiramat, ryfampicyna (B) pobudzają metabolizm (A) osłabienie działania, zmniejszenie skuteczności Interakcje doustnych środków antykoncepcyjnych (A) z równocześnie stosowanymi lekami (B) Leki (B) stosowane równocześnie z doustnymi środkami antykoncepcyjnymi (A) Trójpierścieniowe leki przeciwdepresyjne Rodzaj i następstwo interakcji (A) zwiększają wchłanianie i hamują metabolizm (B) nasilenie działania (B), zwiększenie toksyczności Cyklosporyna, teofilina (A) hamują metabolizm (B) nasilenie działania (B), zwiększenie toksyczności Interakcje doustnych środków antykoncepcyjnych (A) z równocześnie stosowanymi lekami (B) Leki (B) stosowane równocześnie z doustnymi środkami antykoncepcyjnymi (A) Pochodne kumaryny, leki przeciwcukrzycowe (A) działają antagonistycznie z (B) osłabienie działania (B)
9 Stosowanie leków w czasie ciąży wymaga szczególnej ostrożności z powodu zmian czynności narządów kobiety ciężarnej w różnych okresach ciąży oraz bezpośredniego wpływu leków na płód zaburzenia kinetyki leków czego następstwem mogą być zniekształcenia narządów nieprawidłowy rozwój zarodka we wczesnym okresie ciąży różne niepożądane działania leków na organizm płodu w następnych okresach ciąży Genetycznie uwarunkowany polimorfizm metylotransferazy tiopuryny (TPMTthiopurine S-methyltransferase), której substratem jest m.in. azatiopryna częstość występowania fenotypów TPMT w populacji kaukaskiej: ekstensywnych metabolizerów (EM) 89% pośrednich metabolizerów (IM) 11% słabych metabolizerów (PM) 0,3% mielosupresja u PM po podaniu standardowych dawek azatiopryny Wartości parametrów farmakokinetycznych antybiotyków aminoglikozydowych u dorosłych Pacjenci z prawidłową czynnością nerek z upośledzoną czynnością nerek Applied Clinical Pharmacokinetics, 2008 Biologiczny okres półtrwania (h) Współczynnik dystrybucji (l/kg) 2 (1,5-3) 0,26 (0,2-0,3) 50 (36-72) 0,26 otyli (>30 IBW) oparzeni 1,5 0,26 poddawani hemodializie poddawani dializie otrzewnowej 3-4 0, ,26 Wartości parametrów farmakokinetycznych wankomycyny u dorosłych Applied Clinical Pharmacokinetics, 2008 Pacjenci Dorośli z prawidłową czynnością nerek Dorośli z upośledzoną czynnością nerek Dorośli otyli (>30% IBW) Biologiczny okres półtrwania (h) Współczynnik dystrybucji (l/kg) 8 (7-9) 0,7 (0,5-1) 130 ( ) 0,7 (0,5-1) Dorośli z oparzeniami 4 0,7 Przykłady modyfikacji działania leków pod wpływem zwiększającego się zanieczyszczenia biosfery Osłabienie działania leków pobudzenie metabolizmu - indukcja enzymów mikrosomalnych wątroby pod wpływem policyklicznych węglowodorów zawartych w powietrzu, w dymie papierosów, niektórych insektycydów, herbicydów Nasilenie działania leków kumulacja leków w organizmie hamowanie aktywności enzymów mikrosomalnych wątroby pod wpływem przemysłowego zatrucia ołowiem, tlenkiem węgla Przyczyna wystąpienia niepożądanych działań leków stosowanie leków poza wskazaniami rejestracyjnymi (off-label) wymienionymi w Charakterystyce Produktu Leczniczego
10 inna: Stosowanie leków off label jednostka chorobowa dawka droga podania (np. doustnie postać przeznaczoną do iniekcji) forma leku (np. z tabletki sporządzenie zawiesiny celem podania noworodkowi) populacja (np. podanie dziecku leku przeznaczonego do stosowania u dorosłych) Metody zapobiegania i zmniejszania częstości występowania niepożądanych działań leków Indywidualizacja farmakoterapii unikanie niepotrzebnej polifarmakoterapii i zbytecznego przedłużania terapii wnikliwa obserwacja chorego w trakcie leczenia zbieranie dokładnego wywiadu uwzględnianie czynników ryzyka występowania niepożądanych działań leków przestrzeganie przeciwwskazań i ograniczeń stosowania leków Metody zapobiegania i zmniejszania częstości występowania niepożądanych działań leków Metody zapobiegania i zmniejszania częstości występowania niepożądanych działań leków Indywidualizacja farmakoterapii unikanie stosowania leków o podobnych niepożądanych działaniach farmakoterapia szyta na miarę Indywidualizacja farmakoterapii kontrola stanu klinicznego chorych badanie wydolności narządów odpowiedzialnych za eliminację leków z organizmu monitorowanie stężeń leków w płynach biologicznych Metody zapobiegania i zmniejszania częstości występowania niepożądanych działań leków Ocena profilu bezpieczeństwa leku określenie związku przyczynowoskutkowego pomiędzy stosowanym lekiem a obserwowaną reakcją obliczanie współczynnika korzyści do ryzyka związanego ze stosowaniem danej substancji leczniczej Nadzór nad bezpieczeństwem farmakoterapii pharmacovigilance (pharmacon lek, vigilare zachować czujność)
11 Dlaczego potrzebny jest nadzór nad bezpieczeństwem farmakoterapii? Nie można zapewnić bezpieczeństwa stosowania nowych leków u ludzi na podstawie braku obserwacji ndl u zwierząt doświadczalnych Mała grupa osób uczestnicząca w badaniach klinicznych (średnio 1500 osób) Szczególne warunki prowadzenia badań klinicznych, odbiegające od codziennej praktyki lekarskiej Zbyt krótki czas trwania badań dla obserwacji odległych skutków wpływu substancji leczniczej na organizm Droga informacji o niepożądanym działaniu leku wypełnienie formularza i przesłanie do: Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Warszawa ul. Ząbkowska 41 Ośrodki regionalne monitorujące niepożądane działania leków w Polsce Regionalny Ośrodek Monitorowania Niepożądanych Działań Leków przy Zakładzie Farmakologii Klinicznej Instytutu Kardiologii UM im. K. Marcinkowskiego w Poznaniu Regionalny Ośrodek Monitorowania Niepożądanych Działań Leków przy Katedrze Farmakologii PUM w Szczecinie Uniwersytecki Ośrodek Monitorowania i Badania Niepożądanych Działań Leków, Zakład Farmakologii Klinicznej Katedry i Zakładu Farmakologii Collegium Medicum Uniwersytetu Jagiellońskiego w Krakowie Regionalny Ośrodek Monitorowania Niepożądanych Działań Leków przy Katedrze i Zakładzie Farmakologii Klinicznej UM im. Piastów Śląskich we Wrocławiu Pracownia Monitorowania Działań Niepożądanych Leków i Poprawy Bezpieczeństwa Farmakoterapii Katedry i Zakładu Farmakologii Gdańskiego Uniwersytetu Medycznego w Gdańsku Droga informacji o niepożądanym działaniu leku ocena raportu pod względem formalnym, nadanie numeru ocena związku przyczynowo-skutkowego przesłanie raportu przez WMNDPL do centralnej bazy danych Światowej Organizacji Zdrowia w Uppsali i do Europejskiej Agencji Leków (European Medicines Agency) w Londynie Droga informacji o niepożądanym działaniu leku uaktualnienie informacji o leku ograniczenie wskazań, dodanie informacji o nowych ndl, zmiana dawkowania, ostrzeżenia, przeciwwskazaniach do stosowania dla poszczególnych grup pacjentów skierowanie komunikatu do fachowych pracowników ochrony zdrowia Co powinien zawierać raport o niepożądanym działaniu leku? dane o produkcie leczniczym, który podejrzewa się o wywołanie ndl (ważna jest informacja o drodze podania) dane o reakcji niepożądanej (diagnoza, ocena reakcji i jej wynik) dane pacjenta (wiek, płeć, masa ciała, inicjały imienia i nazwiska) dane osoby zgłaszającej (imię, nazwisko, pełny adres, numer telefonu)
12 Niepożądane działania jakich produktów leczniczych powinny być zgłaszane w sposób priorytetowy? zawierających nową substancję czynną, dopuszczonych po raz pierwszy do obrotu w dowolnym państwie w okresie 5 lat poprzedzającym zgłoszenie złożonych, zawierających nowe połączenie substancji czynnych zawierających znaną substancję czynną, ale podawaną nową drogą nowych postaci farmaceutycznych które uzyskały nowe wskazanie obserwowanych w trakcie ciąży lub bezpośrednio po porodzie Dyrektywa 84/2010/WE Dotyczy ona produktów leczniczych, których profil bezpieczeństwa jest szczególnie wnikliwie oceniany. Obejmuje przede wszystkim leki od niedawna stosowane. Nie oznacza to, że są to leki, których używanie obarczone jest większym ryzykiem. W procedurze dopuszczania do obrotu dane na ich temat oceniane były według obowiązujących przepisów i standardów naukowych, jednakże ze względu na krótki okres obserwacji wiedza o tych lekach jest niepełna. W ulotce i charakterystyce produktu leczniczego każdego leku dodatkowo monitorowanego, obok symbolu czarnego odwróconego trójkąta znajduje się apel o zgłaszanie działań niepożądanych związanych z jego stosowaniem. Standardowy okres takiej obserwacji to 5 lat. Lista leków dodatkowo monitorowanych dostępna jest pod adresem: Kto może dokonywać zgłoszenia ndl? lekarze medycyny lekarze stomatologii farmaceuci pielęgniarki i położne diagności laboratoryjni technicy farmaceutyczni, którzy uzyskali uprawnienie do wykonywania czynności fachowych w aptece ratownicy medyczni felczerzy pacjenci, ich przedstawiciele ustawowi lub opiekunowie
Monitorowanie niepożądanych działań leków
 Monitorowanie niepożądanych działań leków Anna Wiela-Hojeńska Katedra i Zakład Farmakologii Klinicznej Uniwersytet Medyczny we Wrocławiu Niepożądane działanie leku (ndl) Adverse Drug Reaction (ADR) (definicja
Monitorowanie niepożądanych działań leków Anna Wiela-Hojeńska Katedra i Zakład Farmakologii Klinicznej Uniwersytet Medyczny we Wrocławiu Niepożądane działanie leku (ndl) Adverse Drug Reaction (ADR) (definicja
Zdarzenie niepożądane adverse event. Monitorowanie niepożądanych działań leków
 Monitorowanie Anna Wiela-Hojeńska Katedra i Zakład Farmakologii Klinicznej Uniwersytetu Medycznego we Wrocławiu Niepożądane działanie leku (ndl) Adverse Drug Reaction (ADR) (definicja przyjęta przez WHO
Monitorowanie Anna Wiela-Hojeńska Katedra i Zakład Farmakologii Klinicznej Uniwersytetu Medycznego we Wrocławiu Niepożądane działanie leku (ndl) Adverse Drug Reaction (ADR) (definicja przyjęta przez WHO
Konieczność monitorowania działań niepożądanych leków elementem bezpiecznej farmakoterapii
 Konieczność monitorowania działań niepożądanych leków elementem bezpiecznej farmakoterapii dr hab. Anna Machoy-Mokrzyńska, prof. PUM Katedra Farmakologii Regionalny Ośrodek Monitorujący Działania Niepożądane
Konieczność monitorowania działań niepożądanych leków elementem bezpiecznej farmakoterapii dr hab. Anna Machoy-Mokrzyńska, prof. PUM Katedra Farmakologii Regionalny Ośrodek Monitorujący Działania Niepożądane
Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
 18 października 2012 EMA/653433/2012 EMEA/H/A-5(3)/1319 Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
18 października 2012 EMA/653433/2012 EMEA/H/A-5(3)/1319 Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
FARMAKOKINETYKA KLINICZNA
 FARMAKOKINETYKA KLINICZNA FARMAKOKINETYKA wpływ organizmu na lek nauka o szybkości procesów wchłaniania, dystrybucji, metabolizmu i wydalania leków z organizmu Procesy farmakokinetyczne LADME UWALNIANIE
FARMAKOKINETYKA KLINICZNA FARMAKOKINETYKA wpływ organizmu na lek nauka o szybkości procesów wchłaniania, dystrybucji, metabolizmu i wydalania leków z organizmu Procesy farmakokinetyczne LADME UWALNIANIE
Dr Jarosław Woroń. BEZPIECZEŃSTWO STOSOWANIA LEKÓW PRZECIWBÓLOWYCH Krynica 11.XII.2009
 Dr Jarosław Woroń BEZPIECZEŃSTWO STOSOWANIA LEKÓW PRZECIWBÓLOWYCH Krynica 11.XII.2009 Zakład Farmakologii Klinicznej Katedry Farmakologii CM UJ Kraków Uniwersytecki Ośrodek Monitorowania i Badania Niepożądanych
Dr Jarosław Woroń BEZPIECZEŃSTWO STOSOWANIA LEKÓW PRZECIWBÓLOWYCH Krynica 11.XII.2009 Zakład Farmakologii Klinicznej Katedry Farmakologii CM UJ Kraków Uniwersytecki Ośrodek Monitorowania i Badania Niepożądanych
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje
Harmonogram zajęć dla kierunku: Dietetyka, studia stacjonarne, II rok, semestr IV
 Harmonogram zajęć dla kierunku: Dietetyka, studia stacjonarne, II rok, semestr IV Przedmiot: Podstawy farmakologii i farmakoterapii żywieniowej oraz interakcji leków z żywnością Wykłady (5 wykładów, każdy
Harmonogram zajęć dla kierunku: Dietetyka, studia stacjonarne, II rok, semestr IV Przedmiot: Podstawy farmakologii i farmakoterapii żywieniowej oraz interakcji leków z żywnością Wykłady (5 wykładów, każdy
6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej
 6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej 6.2.1. Podsumowanie korzyści wynikających z leczenia Co to jest T2488? T2488
6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej 6.2.1. Podsumowanie korzyści wynikających z leczenia Co to jest T2488? T2488
ANEKS III ODPOWIEDNIE CZĘŚCI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA
 ANEKS III ODPOWIEDNIE CZĘŚCI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA Uwaga: Niniejsze zmiany do streszczenia charakterystyki produktu leczniczego i ulotki dla pacjenta są wersją obowiązującą
ANEKS III ODPOWIEDNIE CZĘŚCI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA Uwaga: Niniejsze zmiany do streszczenia charakterystyki produktu leczniczego i ulotki dla pacjenta są wersją obowiązującą
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ETYKIETO-ULOTKA OZNAKOWANIE OPAKOWANIA BEZPOŚREDNIEGO PRODUKTU LECZNICZEGO
 ETYKIETO-ULOTKA OZNAKOWANIE OPAKOWANIA BEZPOŚREDNIEGO PRODUKTU LECZNICZEGO RUTINOSAL C Salicis cortex + Rutosidum + Vitaminum C tabletka, 300 mg + 20 mg + 40 mg Skład tabletki: kora wierzby - 300 mg rutozyd
ETYKIETO-ULOTKA OZNAKOWANIE OPAKOWANIA BEZPOŚREDNIEGO PRODUKTU LECZNICZEGO RUTINOSAL C Salicis cortex + Rutosidum + Vitaminum C tabletka, 300 mg + 20 mg + 40 mg Skład tabletki: kora wierzby - 300 mg rutozyd
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Polibiotic, (5 mg + 5000 j.m. + 400 j.m.)/g, maść (Neomycini sulfas + Polymyxini B sulfas + Bacitracinum zincum) Należy uważnie zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla pacjenta Polibiotic, (5 mg + 5000 j.m. + 400 j.m.)/g, maść (Neomycini sulfas + Polymyxini B sulfas + Bacitracinum zincum) Należy uważnie zapoznać się z treścią
ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas
 Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Aneks III. Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta.
 Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Ból uważany jest za jeden z potencjalnie istotnych czynników ryzyka dotyczących śmiertelności (Sokka).
 VI. 2 Elementy do podsumowania podawanego do publicznej wiadomości. VI. 2.1 Przegląd epidemiologii choroby Odczuwanie bólu jest powszechnym zjawiskiem wśród dzieci. Szacuje się, że ta dolegliwość może
VI. 2 Elementy do podsumowania podawanego do publicznej wiadomości. VI. 2.1 Przegląd epidemiologii choroby Odczuwanie bólu jest powszechnym zjawiskiem wśród dzieci. Szacuje się, że ta dolegliwość może
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DIKLONAT P, 10 mg/g, żel (Diclofenacum natricum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DIKLONAT P, 10 mg/g, żel (Diclofenacum natricum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest
Aneks III. Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta.
 Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Codipar 250, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 250 mg paracetamolu (Paracetamolum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Codipar 250, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 250 mg paracetamolu (Paracetamolum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1. NAZWA PRODUKTU LECZNICZEGO 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO. Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1
 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rheumocam 1 mg tabletki do żucia dla psów Rheumocam 2, mg tabletki do żucia dla psów 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO Każda tabletka zawiera:
1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rheumocam 1 mg tabletki do żucia dla psów Rheumocam 2, mg tabletki do żucia dla psów 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO Każda tabletka zawiera:
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO PARACETAMOL HASCO, 80 mg, czopki PARACETAMOL HASCO, 125 mg, czopki PARACETAMOL HASCO, 250 mg, czopki PARACETAMOL HASCO, 500 mg,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO PARACETAMOL HASCO, 80 mg, czopki PARACETAMOL HASCO, 125 mg, czopki PARACETAMOL HASCO, 250 mg, czopki PARACETAMOL HASCO, 500 mg,
Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę.
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
2
 1 2 3 4 5 6 7 8 9 10 Wzajemne oddziaływanie substancji leczniczych, suplementów diety i pożywienia może decydować o skuteczności i bezpieczeństwie terapii. Nawet przyprawy kuchenne mogą w istotny sposób
1 2 3 4 5 6 7 8 9 10 Wzajemne oddziaływanie substancji leczniczych, suplementów diety i pożywienia może decydować o skuteczności i bezpieczeństwie terapii. Nawet przyprawy kuchenne mogą w istotny sposób
Paracetamol Biofarm Paracetamolum 500 mg, tabletki
 Ulotka dołączona do opakowania: informacja dla pacjenta Paracetamol Biofarm Paracetamolum 500 mg, tabletki Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Paracetamol Biofarm Paracetamolum 500 mg, tabletki Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
ASMAG B 20 mg jonów magnezu + 0,25 mg pirydoksyny chlorowodorku, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG B 20 mg jonów magnezu + 0,25 mg pirydoksyny chlorowodorku, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG B 20 mg jonów magnezu + 0,25 mg pirydoksyny chlorowodorku, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla pacjenta. OPOKAN ACTIGEL, 100 mg/g, żel Naproxenum
 Ulotka dołączona do opakowania: informacja dla pacjenta OPOKAN ACTIGEL, 100 mg/g, żel Naproxenum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta OPOKAN ACTIGEL, 100 mg/g, żel Naproxenum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Aneks II. Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione przez EMA
 Aneks II Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione przez EMA 41 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych
Aneks II Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione przez EMA 41 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych
NADZÓR NAD BEZPIECZEŃSTWEM FARMAKOTERAPII PHARMACOVIGILANCE
 NADZÓR NAD BEZPIECZEŃSTWEM FARMAKOTERAPII PHARMACOVIGILANCE WZZ HERBAPOL S.A. LEK. MED. ANETTA WARZOCHA, QPPV CEL SZKOLENIA Omówienie tematu Pharmacovigilance Omówienie zasad zgłaszania podejrzenia o wystąpieniu
NADZÓR NAD BEZPIECZEŃSTWEM FARMAKOTERAPII PHARMACOVIGILANCE WZZ HERBAPOL S.A. LEK. MED. ANETTA WARZOCHA, QPPV CEL SZKOLENIA Omówienie tematu Pharmacovigilance Omówienie zasad zgłaszania podejrzenia o wystąpieniu
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Ulotka dołączona do opakowania: informacja dla pacjenta. Metafen żel Forte, 100 mg/g (10%), żel Ibuprofenum lysinum
 Ulotka dołączona do opakowania: informacja dla pacjenta Metafen żel Forte, 100 mg/g (10%), żel Ibuprofenum lysinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Metafen żel Forte, 100 mg/g (10%), żel Ibuprofenum lysinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika. Butapirazol, 250 mg, czopki. Phenylobutazonum
 Ulotka dołączona do opakowania: informacja dla użytkownika Butapirazol, 250 mg, czopki Phenylobutazonum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika Butapirazol, 250 mg, czopki Phenylobutazonum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Aneks III. Zmiany w odnośnych punktach druków informacyjnych do produktów
 Aneks III Zmiany w odnośnych punktach druków informacyjnych do produktów Uwaga: Zmiany wprowadzone w odnośnych punktach druków informacyjnych do produktów są efektem przeprowadzenia procedury przekazania
Aneks III Zmiany w odnośnych punktach druków informacyjnych do produktów Uwaga: Zmiany wprowadzone w odnośnych punktach druków informacyjnych do produktów są efektem przeprowadzenia procedury przekazania
Cele farmakologii klinicznej
 Cele farmakologii klinicznej 1. Dążenie do zwiększenia bezpieczeństwa i skuteczności leczenia farmakologicznego, poprawa opieki nad pacjentem - maksymalizacja skuteczności i bezpieczeństwa (farmakoterapia
Cele farmakologii klinicznej 1. Dążenie do zwiększenia bezpieczeństwa i skuteczności leczenia farmakologicznego, poprawa opieki nad pacjentem - maksymalizacja skuteczności i bezpieczeństwa (farmakoterapia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
Ulotka dołączona do opakowania: informacja dla użytkownika. TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dla pacjenta: Informacja dla użytkownika Neuro-Medivitan tabletki powlekane
 Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta: Informacja dla użytkownika Neuro-Medivitan tabletki powlekane Substancje czynne: tiaminy chlorku chlorowodorek / pirydoksyny
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta: Informacja dla użytkownika Neuro-Medivitan tabletki powlekane Substancje czynne: tiaminy chlorku chlorowodorek / pirydoksyny
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. FILOMAG B 6 40 mg jonów magnezu + 5 mg, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA FILOMAG B 6 40 mg jonów magnezu + 5 mg, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA FILOMAG B 6 40 mg jonów magnezu + 5 mg, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CIBA-GEIGY Sintrom 4
 CIBA-GEIGY Sintrom 4 Sintrom 4 Substancja czynna: 3-[a-(4-nitrofenylo-)-0- -acetyloetylo]-4-hydroksykumaryna /=acenocoumarol/. Tabletki 4 mg. Sintrom działa szybko i jest wydalany w krótkim okresie czasu.
CIBA-GEIGY Sintrom 4 Sintrom 4 Substancja czynna: 3-[a-(4-nitrofenylo-)-0- -acetyloetylo]-4-hydroksykumaryna /=acenocoumarol/. Tabletki 4 mg. Sintrom działa szybko i jest wydalany w krótkim okresie czasu.
Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny: hematologia.
 Załącznik nr 10 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny:
Załącznik nr 10 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny:
Formularz pojedynczego zgłoszenia zdarzenia niepożądanego i sytuacji specjalnej (ICSR Adverse Event and Special Situation Form)
 Instrukcja: Ten formularz może być użyty do zgłaszania zdarzeń niepożądanych i/lub sytuacji specjalnych z okresu po wprowadzeniu do obrotu wliczając, ale nie ograniczając się do raportów spontanicznych
Instrukcja: Ten formularz może być użyty do zgłaszania zdarzeń niepożądanych i/lub sytuacji specjalnych z okresu po wprowadzeniu do obrotu wliczając, ale nie ograniczając się do raportów spontanicznych
Desogestrel SUBSTANCJE CZYNNE. Grupa farmakoterapeutyczna: progestageny i estrogeny, produkty złożone. GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC)
 SUBSTANCJE CZYNNE Desogestrel GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) Grupa farmakoterapeutyczna: progestageny i estrogeny, produkty złożone. Kod ATC: G03AC09 PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU
SUBSTANCJE CZYNNE Desogestrel GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) Grupa farmakoterapeutyczna: progestageny i estrogeny, produkty złożone. Kod ATC: G03AC09 PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU
FARMAKOTERAPIA W GERIATRII
 Interdyscyplinarne Spotkania Geriatryczne FARMAKOTERAPIA W GERIATRII mgr Teresa Niechwiadowicz-Czapka Instytut Pielęgniarstwa Zakład Podstaw Opieki Pielęgniarskiej Wchłanianie środków farmakologicznych
Interdyscyplinarne Spotkania Geriatryczne FARMAKOTERAPIA W GERIATRII mgr Teresa Niechwiadowicz-Czapka Instytut Pielęgniarstwa Zakład Podstaw Opieki Pielęgniarskiej Wchłanianie środków farmakologicznych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NAPROXEN EMO, 100 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 100 mg naproksenu (Naproxenum) Zawiera również etylu parahydroksybenzoesan.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NAPROXEN EMO, 100 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 100 mg naproksenu (Naproxenum) Zawiera również etylu parahydroksybenzoesan.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IBUPROM ŻEL, 50 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g żelu IBUPROM ŻEL zawiera: 5 g ibuprofenu (Ibuprofenum) Pełen wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IBUPROM ŻEL, 50 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g żelu IBUPROM ŻEL zawiera: 5 g ibuprofenu (Ibuprofenum) Pełen wykaz substancji
VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel
 VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel Wskazania do stosowania Voltaren MAX jest wskazany do stosowania u dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie
VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel Wskazania do stosowania Voltaren MAX jest wskazany do stosowania u dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA GALENA, 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Codipar, 500 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 500 mg paracetamolu (Paracetamolum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Codipar, 500 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 500 mg paracetamolu (Paracetamolum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
w sprawie sposobu prowadzenia badań klinicznych z udziałem małoletnich
 ROZPORZĄDZENIE MINISTRA ZDROWIA z dnia 30 kwietnia 2004 r. w sprawie sposobu prowadzenia badań klinicznych z udziałem małoletnich (Dz. U. z dnia 1 maja 2004 r.) Na podstawie art. 37h ust. 2 ustawy z dnia
ROZPORZĄDZENIE MINISTRA ZDROWIA z dnia 30 kwietnia 2004 r. w sprawie sposobu prowadzenia badań klinicznych z udziałem małoletnich (Dz. U. z dnia 1 maja 2004 r.) Na podstawie art. 37h ust. 2 ustawy z dnia
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Etrixenal przeznaczone do wiadomości publicznej
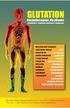 VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Etrixenal przeznaczone do wiadomości publicznej VI.2.1 Omówienie rozpowszechnienia choroby Ból stanowi sygnał, który uczy by unikać
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Etrixenal przeznaczone do wiadomości publicznej VI.2.1 Omówienie rozpowszechnienia choroby Ból stanowi sygnał, który uczy by unikać
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dolgit, 50 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g kremu Dolgit zawiera 5 g ibuprofenu (Ibuprofenum) Pełen wykaz substancji pomocniczych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dolgit, 50 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g kremu Dolgit zawiera 5 g ibuprofenu (Ibuprofenum) Pełen wykaz substancji pomocniczych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Crohnax, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 250 mg mesalazyny (Mesalazinum) Pełny wykaz substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Crohnax, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 250 mg mesalazyny (Mesalazinum) Pełny wykaz substancji pomocniczych,
2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Metacam 1 mg tabletki do żucia dla psów Metacam 2,5 mg tabletki do żucia dla psów 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO Jedna tabletka do żucia
1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Metacam 1 mg tabletki do żucia dla psów Metacam 2,5 mg tabletki do żucia dla psów 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO Jedna tabletka do żucia
Annex I. Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia
 Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Vancomycin Actavis przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Vancomycin Actavis przeznaczone do publicznej wiadomości VI.2.1. Omówienie rozpowszechnienia choroby Zakażenia takie jak: zapalenie
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Vancomycin Actavis przeznaczone do publicznej wiadomości VI.2.1. Omówienie rozpowszechnienia choroby Zakażenia takie jak: zapalenie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA BIODACYNA, 125 mg/ml, roztwór do wstrzykiwań i infuzji BIODACYNA, 250 mg/ml, roztwór do wstrzykiwań i infuzji Amikacinum Należy zapoznać się z treścią ulotki
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA BIODACYNA, 125 mg/ml, roztwór do wstrzykiwań i infuzji BIODACYNA, 250 mg/ml, roztwór do wstrzykiwań i infuzji Amikacinum Należy zapoznać się z treścią ulotki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
WARUNKI LUB OGRANICZENIA DOTYCZĄCE BEZPIECZNEGO I SKUTECZNEGO STOSOWANIA PRODUKTU LECZNICZEGO DO WDROŻENIA PRZEZ KRAJE CZŁONKOWSKIE
 ANEKS 1 WARUNKI LUB OGRANICZENIA DOTYCZĄCE BEZPIECZNEGO I SKUTECZNEGO STOSOWANIA PRODUKTU LECZNICZEGO DO WDROŻENIA PRZEZ KRAJE CZŁONKOWSKIE Kraj członkowski musi upewnić się ze wszystkie warunki lub ograniczenia
ANEKS 1 WARUNKI LUB OGRANICZENIA DOTYCZĄCE BEZPIECZNEGO I SKUTECZNEGO STOSOWANIA PRODUKTU LECZNICZEGO DO WDROŻENIA PRZEZ KRAJE CZŁONKOWSKIE Kraj członkowski musi upewnić się ze wszystkie warunki lub ograniczenia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
Ulotka dołączona do opakowania: informacja dla pacjenta. ALTABACTIN, (250 IU + 5 mg)/g, maść Bacitracinum + Neomycinum
 Ulotka dołączona do opakowania: informacja dla pacjenta ALTABACTIN, (250 IU + 5 mg)/g, maść Bacitracinum + Neomycinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta ALTABACTIN, (250 IU + 5 mg)/g, maść Bacitracinum + Neomycinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta. Codipar, 500 mg, tabletki Paracetamolum
 Ulotka dołączona do opakowania: informacja dla pacjenta Codipar, 500 mg, tabletki Paracetamolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta Codipar, 500 mg, tabletki Paracetamolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
KOFERINA TABLETKI OD BÓLU GŁOWY Acidum acetylsalicylicum + Ethenzamidum + Coffeinum 400 mg + 100 mg + 50 mg, tabletki
 Ulotka dołączona do opakowania: informacja dla pacjenta KOFERINA TABLETKI OD BÓLU GŁOWY Acidum acetylsalicylicum + Ethenzamidum + Coffeinum 400 mg + 100 mg + 50 mg, tabletki Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla pacjenta KOFERINA TABLETKI OD BÓLU GŁOWY Acidum acetylsalicylicum + Ethenzamidum + Coffeinum 400 mg + 100 mg + 50 mg, tabletki Należy uważnie zapoznać się
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO OPOKAN-KETO, 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg ketoprofenu (Ketoprofenum). Pełny wykaz substancji pomocniczych:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO OPOKAN-KETO, 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg ketoprofenu (Ketoprofenum). Pełny wykaz substancji pomocniczych:
Ulotka dołączona do opakowania: informacja dla pacjenta. Paracetamol APTEO MED, 500 mg, tabletki Paracetamolum
 Ulotka dołączona do opakowania: informacja dla pacjenta Paracetamol APTEO MED, 500 mg, tabletki Paracetamolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Paracetamol APTEO MED, 500 mg, tabletki Paracetamolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
30 saszetek po 2,3 g Kod kreskowy EAN UCC: Działanie: Przeciwzapalne, słabe działanie moczopędne.
 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH PUDEŁKO TEKTUROWE Zioła przeciwreumatyczne Species antirheumaticae Skład leku: kora wierzby (Salicis cortex) - 575 mg, liść pokrzywy (Urticae folium)
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH PUDEŁKO TEKTUROWE Zioła przeciwreumatyczne Species antirheumaticae Skład leku: kora wierzby (Salicis cortex) - 575 mg, liść pokrzywy (Urticae folium)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum) - witaminy K 1.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej wiadomości.
 VI.2 Plan Zarządzania Ryzykiem dla produktów kwalifikowanych jako "Well established use" zawierających Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej
VI.2 Plan Zarządzania Ryzykiem dla produktów kwalifikowanych jako "Well established use" zawierających Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO PIMAFUCORT (10 mg + 10 mg + 3500 I.U.)/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jeden gram maści zawiera 10
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO PIMAFUCORT (10 mg + 10 mg + 3500 I.U.)/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jeden gram maści zawiera 10
LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2
 załącznik nr 11 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny: hematologia.
załącznik nr 11 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny: hematologia.
Aneks III. Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta
 Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Aneks II. Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC
 Aneks II Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC 70 Wnioski naukowe CMDh rozpatrzył poniższe zalecenia PRAC
Aneks II Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC 70 Wnioski naukowe CMDh rozpatrzył poniższe zalecenia PRAC
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NABUMETONE POLFARMEX 500 mg tabletki powlekane (Nabumetonum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NABUMETONE POLFARMEX 500 mg tabletki powlekane (Nabumetonum) Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NABUMETONE POLFARMEX 500 mg tabletki powlekane (Nabumetonum) Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
Dietetyka, studia stacjonarne licencjackie, II rok, semestr IV
 Dietetyka, studia stacjonarne licencjackie, II rok, semestr IV Przedmiot: Podstawy farmakologii i farmakoterapii żywieniowej oraz interakcji leków z żywnością Seminaria (10 seminariów, każde trwające 3
Dietetyka, studia stacjonarne licencjackie, II rok, semestr IV Przedmiot: Podstawy farmakologii i farmakoterapii żywieniowej oraz interakcji leków z żywnością Seminaria (10 seminariów, każde trwające 3
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla pacjenta PENTASA, 1 g, czopki Mesalazinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla pacjenta PENTASA, 1 g, czopki Mesalazinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Aneks I. Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe oraz podstawy zmian warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu.
 Aneks I Wnioski naukowe oraz podstawy zmian warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu. 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe oraz podstawy zmian warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu. 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Ulotka dołączona do opakowania: informacja dla pacjenta. PENTASA, 1 g, granulat o przedłużonym uwalnianiu. Mesalazinum
 Ulotka dołączona do opakowania: informacja dla pacjenta PENTASA, 1 g, granulat o przedłużonym uwalnianiu Mesalazinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta PENTASA, 1 g, granulat o przedłużonym uwalnianiu Mesalazinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika. ZYX, 5 mg, tabletki powlekane. Levocetirizini dihydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika ZYX, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika ZYX, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ULTRAFASTIN, 25 mg (2,5%) żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg (2,5%) soli lizynowej ketoprofenu (Ketoprofenum lysinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ULTRAFASTIN, 25 mg (2,5%) żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg (2,5%) soli lizynowej ketoprofenu (Ketoprofenum lysinum).
Ulotka dołączona do opakowania: informacja dla pacjenta. Minesulin, 100 mg, proszek do sporządzania zawiesiny doustnej (Nimesulidum)
 ULOTKA DLA PACJENTA Ulotka dołączona do opakowania: informacja dla pacjenta Minesulin, 100 mg, proszek do sporządzania zawiesiny doustnej (Nimesulidum) Należy zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA Ulotka dołączona do opakowania: informacja dla pacjenta Minesulin, 100 mg, proszek do sporządzania zawiesiny doustnej (Nimesulidum) Należy zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta Gelatum Aluminii Phosphorici, 45 mg/g zawiesina doustna (Aluminii phosphas)
 Ulotka dołączona do opakowania: informacja dla pacjenta Gelatum Aluminii Phosphorici, 45 mg/g zawiesina doustna (Aluminii phosphas) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla pacjenta Gelatum Aluminii Phosphorici, 45 mg/g zawiesina doustna (Aluminii phosphas) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ketofen, 100 mg/ml, roztwór do wstrzykiwań dla koni, bydła i świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ketofen, 100 mg/ml, roztwór do wstrzykiwań dla koni, bydła i świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
Zaobserwowano częstsze przypadki stosowania produktu leczniczego Vistide w niezatwierdzonych wskazaniach i (lub) drogach podawania.
 Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
