MOLEKULARNE PODSTAWY KONTROLI SKURCZU MIĘŚNI PRZEZ JONY WAPNIA WSTĘP. (EBASHI i END O 1968). Tak małe zmiany stężenia
|
|
|
- Aneta Skiba
- 6 lat temu
- Przeglądów:
Transkrypt
1 Kosm os PROBLEMY NAU KIbIOI^GICZNYCH Tom 46, 1997 Numer 4 (237) Strony Polskie Tow arzystw o P rzyrod n ik ów im. K op ern ik a R e n a t a D ą b r o w s k a, A n t o n i W r z o s e k Zakład. Biochemii Mięśni Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Pasteura 3, Warszawa renata@nencki.gov.pl MOLEKULARNE PODSTAWY KONTROLI SKURCZU MIĘŚNI PRZEZ JONY WAPNIA WSTĘP Włókna różnych typów mięśni charakteryzują się bardziej (mięśnie prążkowane) lub mniej (mięśnie gładkie) zorganizowaną siecią filamentów tworzonych przez polimery białek, aktyny i miozyny (D ĄBRO W SKA 1987). Siła w mięśniach jest generowana dzięki sprzężonemu z hydrolizą A T P, cyklicznemu tworzeniu słabo i silnie związanych mostków między globularnymi fragmentami cząsteczek miozyny (zwanymi główkami), wysuniętymi na zewnątrz filamentów miozynowych, i filamentami aktynowymi (H U X LE Y 1969, TAYLO R 1992). Oddziaływanie aktyny z miozyną in vivo określa poziom wolnych jonów wapnia w sarkoplazmie; w stężeniu M Ca białka te nie oddziałują ze sobą, a stężenie M pobudza ich oddziaływanie, powodując przejście od stanu rozkurczu do stanu skurczu mięśni (EBASHI i END O 1968). Tak małe zmiany stężenia wolnych jonów wapnia, kontrolujące cykl skurczowo-rozkurczowy mięśni sprawiają, że poziom tych jonów w sarkoplazmie wymaga precyzyjnego mechanizmu regulacji, tym bardziej, że całkowite stężenie wapnia w komórce jest kilku milimolowe. REGULACJA WEWNĄTRZKOMÓRKOWEGO STĘŻENIA JONÓW WAPNIA W KOMÓRCE MIĘŚNIOWEJ Jony wapnia, aktywujące skurcz mięśni, pochodzą z przestrzeni pozakomórkowej lub z wewnętrznego magazynu Ca siateczki sarkoplazmatycznej. W zależności od typu mięśni wykorzystanie poszczególnych dróg napływu jonów wapnia do sarkoplazmy jest różne. Rysunek 1 przedstawia w schematyczny sposób główne drogi napływu jonów wapnia do sarkoplazmy komórek mięśni szkieletowych (A), sercowego (B) i mięśni gładkich (C). Spośród dotychczas poznanych kanałów wapniowych sarkolemmy, zależnych od potencjału błonowego, w komórkach wszystkich typów mięśni zidentyfikowano kanały klasy L (ang. long lasting) i T (ang. transient). Kanały klasy L mięśni szkieletowych stanowią główny szlak napływu jonów wapnia do wnętrza komórki i są najlepiej poznane (MCDONALD i współaut. 1994, GLOSSMANN i STRIESSING 1990). Zbudowane są one z pięciu podjednostek oą, oc2, P, Y i 8, o masach cząsteczkowych odpowiednio kda, kda, kda, kda i kda (Ste a i współaut. 1995). Podjednostka oą wykazuje wszystkie cechy kanału wapniowego, pozostałe podjednostki, z wyjątkiem podjednostki (3, są białkami błonowymi i pełnią funkcje regulatorowe. Działanie kanału modulowane jest ponadto przez fosforylację podjednostki oą, katalizowaną przez kinazy zależne od camp i cgmp oraz kinazę białkową C (XIONG I SPERELAKIS 1995), a także przez wiązanie z podjednostką oą inhibitorów, takich jak dihydropiridyna (DHP). W mięśniach szkieletowych depolaryzacja sarkolemmy, indukująca zmiany konformacyjne kanału L, powoduje otwarcie kanału znajdującego się w siateczce sarkoplazmatycznej, określanego jako receptor rianodynowy (RyR) (DULHUNTY 1992). Poznane izoformy RyR tworzą rodzinę białek charakterystycznych dla poszczególnych typów mięśni, występujących w postaci homotetramerów o masie podjednostek kda (FUTATSUGI i współaut. 1995). Wypływ jonów wapnia z cy-
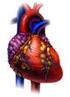
2 556 R e n a t a Dą b r o w s k a, A n t o n i W r z o s e k CICR agonista Rys. 1. Schemat ilustrujący główne drogi napływu wolnych jonów wapnia do komórek mięśni szkieletowych (A), mięśni sercowych (B), mięśni gładkich (C) oraz ich usuwania (D) (wg Bersa 1991, zmodyfikowany). VD zależne od potencjału błonowego uwalnianie jonów wapnia, V-R D kanał wapniowy otwierany przez potencjał lub regulowany wiązaniem ligandu do receptora (voltage or receptor gated Ca2+ channel), CICR pobudzany jonami wapnia wypływ wapnia, RyR receptor rianodynowy, IP3 inozytolo-l,4,5-trisfosforan, PIP2 fosfatydyloinozytolo- 4,5-bisfosforan, DAG 1,2-diacylglicerol, PLC fosfolipaza C, PKC kinaza białkowa C, CR-Ca kalretikulina, CSQ- Ca kalsekwestryna. stern terminalnych siateczki sarkoplazmatycznej nie jest jednak regulowany napływem jonów wapnia z przestrzeni pozakomórkowej, ale oddziaływaniem RyR siateczki z receptorem DHP podjednostki oą kanału L w kanalikach poprzecznych sarkolemmy (BERS 1991) (rys. 1A). Obydwie te struktury błonowe łączy triadyna, glikoproteina o masie cząsteczkowej 95 kda (FLUCHER i współaut. 1993, KNUDSON i współaut. 1993). W mięśniu sercowym zmiany konformacyjne kanału L, wywołane depolaryzacją sarkolemmy, nie są bezpośrednio przenoszone na kanał RyR siateczki sarkoplazmatycznej. Niewielka ilość jonów wapnia wpływa do sarkoplazmy przez kanał L, powodując aktywację RyR i wypływ jonów wapnia z siateczki sarkoplazmatycznej w procesie zwanym pobudzeniem jonami wapnia wypływu wapnia (CICR, ang. calcium induced calcium release) (TANA- BE i współaut. 1990) (rys. IB). W mięśniach gładkich napływ jonów wapnia do sarkoplazmy odbywa się również przez kanały L zależne od potencjału błonowego, za pomocą mechanizmu CICR oraz przez kanały niezależne od potencjału błonowego, których przykładem jest kanał zależny od ATP. Jednakże jony wapnia napływające przez te kanały tylko w nieznacznym stopniu uczestniczą w pobudzeniu skurczu mięśni gładkich. Podstawową rolę w tym procesie odgrywają jony wapnia, które są uwalniane z siateczki sarkoplazmatycznej przez inozytolo-l,4,5-trisfosforan (IP3), wytwarzany w kaskadzie reakcji zapoczątkowanej wiązaniem agonisty ze specyficznym receptorem błonowym, a następnie aktywacją fosfolipazy C poprzez białko G i hydrolizą fosfatydyloinozytolo-4,5-bisfosforanu (PIP2) (HORO WITZ i współaut. 1996) (rys. 1C). W procesie tym obok IP3 powstaje 1,2-diacylglycerol, który bierze udział w aktywacji kinazy C. Receptor IP3 siateczki sarkoplazmatycznej jest białkiem o masie monomeru 310 kda występującym, podobnie jak receptor RyR, w postaci homotetrameru. Indukowany IP3 mechanizm uwalniania jonów wapnia do sarkoplazmy odgrywa również pewną rolę w mięśniu sercowym (KIJI- MA i współaut. 1993), nie odgrywa natomiast znaczącej roli w pobudzaniu skurczu mięśni szkieletowych (SOMLYO i SOMLYO 1994).
3 Molekularne podstawy kontroli skurczu mięśni 557 Kanał wapniowy T występuje we wszystkich typach mięśni i jest odpowiedzialny za spontaniczną aktywację potencjału czynnościowego. Czas jego otwarcia jest bardzo krótki. Kanał ulega znacznie szybszej aktywacji i inaktywacji w porównaniu z kanałami typu L (McDonald i współaut. 1994). W mięśniach gładkich i sercowym występują też kanały wapniowe aktywowane poprzez mechaniczne naprężenie mięśni (ang. stretch activated calcium channels) (We lle n e r i Isenberg 1994, SADOSHIMA i IZUMO 1997). W mięśniu sercowym aktywacja kanałów zależnych od naprężenia prowadzi do hypertrofii oraz zmiany fenotypu mięśnia. Za obniżenie stężenia jonów wapnia w sarkoplazmie, prowadzące do rozkurczu mięśni, są odpowiedzialne pompy wapniowe, znajdujące siq zarówno w sarkolemmie, jak i w błonach siateczki sarkoplazmatyczne oraz wymieniacz sód/wapń (Na /Ca ) występujący w sarkolemmie (rys. ID). Aktywny transport do wnętrza siateczki sarkoplazmatycznej odbywa się z udziałem zależnej od jonów magnezu Ca +-ATPazy, wykorzystującej energię powstającą z hydrolizy ATP do pompowania jonów wapnia, wbrew gradientowi stężeń tego kationu. Enzym ten, o masie cząsteczkowej 110 kda, odznacza się wysokim powinowactwem do jonów wapnia (Km = 0,5 pm) oraz dużą szybkością maksymalną (PIKUŁA 1997). Występujące w mięśniach gładkch i sercowym izoformy ATPaz w przeciwieństwie do izoform mięśni szkieletowych, podlegają specyficznej regulacji przez niskocząsteczkowe białko, fosfolamban (6 kda), które w błonie występuje w postaci pentameru. Fosfolamban nieufosfoiylowany hamuje aktywność Ca -ATPazy, jego fosforylacja przy udziale kinaz zależnych od camp i Ca2+/kalmoduliny znosi ten efekt (COLYER 1993). Ca -ATPazy występujące w sarkolemmie (o masie 140 kda), charakteryzuje wysokie powinowactwo do jonów wapnia (Km = 0,5 pm) i niska zdolność transportowa tych jonów. Enzymy te podlegają złożonym procesom regulacji poprzez oddziaływanie z kalmoduliną, kwaśnymi fosfolipidami, fosfoiylację domeny regulatorowej przy udziale kinazy C oraz usuwanie domeny inhibitorowej przez kalpainy (MONTE- ITH i ROUFOGALIS 1995, CARAFOLI 1994). W y kazano, że ATPaza zlokalizowana w sarkolemmie w czasie rozkurczu mięśni wypompowuje na zewnątrz komórki tylko 1 % całej puli jonów wapnia (NEGRETTI i współaut. 1993). Ważną rolę w utrzymywaniu homeostazy jonów wapnia w komórkach mięśniowych w czasie cyklu skurczowo-rozkurczowego odgrywa wymieniacz Na /Ca usytuowany w sarkolemmie. Transportuje on przez błonę 3 jony sodu, a w kierunku przeciwnym 1 jon wapnia. Sprawia to, że transport jonów przez wymieniacz Na /Ca jest elektrogenny, a jego kierunek zależy od potencjału błonowego (CRESPO i współaut. 1990). Wymieniacz ten o masie cząsteczkowej 120 kda składa się z 11 domen transbłonowych i występuje w postaci trzech form polimorficznych (NlCOLL i współaut. 1996). Jego działanie jest pośrednio modulowane przez Na /K -ATPazę sarkolemmy, która reguluje stężenie jonów sodu i potasu w sarkoplazmie (MORGAN i BLINKS 1982) Oprócz wymieniacza Na /Ca homeostazę wapniową w komórkach mięśniowych utrzymują białka wiążące jony wapnia. W mięśniach szkieletowych taką rolę spełniają parwalbuminy, przyspieszające rozkurcz tych mięśni (RALL 1996). W czasie rozkurczu wapń zmagazynowany w cysternach siateczki sarkoplazmatycznej jest związany w mięśniach szkieletowych i sercowym z kalsekwestiyną, białkiem o masie 57 kda (Th arin i współaut. 1996), a w mięśniach gładkich głównie z kalretikuliną o masie 46 kda (Mich alak i współaut. 1992). Białka te mają wysoką pojemność i niską stałą wiązania jonów wapnia, charakterystyczną dla białek buforowych (kalsekwestiyna 50 moli, a kalretikulina moli na mol białka). MOLEKULARNE MECHANIZMY KONTROLI SKURCZU MIĘŚNI PRZEZ JONY WAPNIA Sensorami wewnątrzkomórkowego stężenia jonów wapnia w komórce mięśniowej są białka, w cząsteczkach których występuje charakterystyczny, czerokrotnie powtórzony motyw strukturalny helisa-pętla-helisa, zwany motywem EF-hand, służący wiązaniu tych jonów (NAKAYAMA i KRETSINGER 1994). W mięśniach gładkich kręgowców i wielu bezkręgowców jest to kalmodulina, w mięśniach prążkowanych mięczaków istotny łańcuch lekki miozyny, a w mięśniach szkieletowych i sercowym kręgowców i niektórych bezkręgowców troponina C (DĄBROW SKA 1996). We wszystkich tych białkach pary motywów strukturalnych EF-hand tworzą globularne domeny mające wspólny hydrofobowy rdzeń. Dwie globularne domeny łączy długi odcinek a-helikalny. Nie wszystkie cztery motywy EF-hand
4 558 Renata Dąb ro w ska, A ntoni W rzosek mają funkcjonalnie sprawne miejsca wiązania jonów wapnia: w istotnym lekkim łańcuchu znajduje się tylko jedno miejsce wiązania, a w troponinie C znaczenie funkcjonalne mają dwa miejsca wiązania jonów wapnia usytuowane w domenie N-końcowej. Pozostałe motywy EF-hand bądź utraciły zdolność wiązania jonów wapnia na skutek delecji lub zastąpień aminokwasowych, bądź wykazują niską specyficzność wobec jonów wapnia i mają tylko znaczenie strukturalne. Mechanizm aktywacji białek generujących skurcz po związaniu jonów wapnia przez każde z omawianych białek sensorycznych jest inny. W mięśniach gładkich i mięśniach mięczaków regulacja skurczu jest związana z modyfikacją główki miozynowej, a w mięśniach szkieletowych i sercowym ze zmianami konformacyjnymi białek związanych z filamentem aktynowym. Ten ostatni mechanizm regulacji został najlepiej scharakteryzowany ze względu na najdłuższą historię badań. Znaczny postęp uzyskano szczególnie w ciągu ostatnich kilku lat, dzięki trójwymiarowej rekonstrukcji struktury filamentów aktynowych związanych z białkami regulującymi metodą dyfrakcji optycznej obrazów mikroskopowych (LEH M AN i współaut. 1994, 1995), poznaniu metodą analizy rentgenowskiej kryształów struktury aktyny (KABSCH i współaut. 1990), troponiny C (HERZBERG i J A MES 1988) i tropomiozyny (W HITBY i współaut. 1992), a także dzięki punktowym mutacjom składników kompleksu troponinowego (FARAH i REINACH 1995). Organizację filamentu aktynowego i białek z nim związanych w mięśniach szkieletowych i sercowym ilustruje rysunek 2. W rowkach podwójnej helisy polimerów aktynowych znajdują się liniowe polimery dimerów tropomiozynowych i przyłączone do nich z okresowością 38 nm cząsteczki troponiny. W ten sposób 1 cząsteczka troponiny przypada na 1 dimer tropomiozyny i 7 monomerów aktyny. Troponina składa się z trzech podjednostek o różnej strukturze i funkcji: wspomnianej już troponiny C sensora jonów wapnia, troponiny I, wiążącej się z kompleksem aktyna-tropomiozyna i hamującej aktywność ATPazy aktomiozynowej, i troponiny T, wiążącej kompleks troponinowy z cząsteczką tropomiozyny (EBASHI 1974). Kompleks troponiny ma kształt wydłużony, w którym troponina I i troponina C tworzą część globularną, a troponina T część pałeczkowatą. Według aktualnych poglądów mechanizm kontroli wapniowej cyklu skurczowo-rozkurczowego mięśni szkieletowych i sercowego jest następujący. W niskim, submikromolowym stężeniu jonów wapnia, miejsca ich specyficznego wiązania o niskim powinowactwie (Kca = 3 x 10 M ) w N-końcowej domenie troponiny C nie są wysycone, podczas gdy miejsca o wysokim powinowactwie (Kca = 2 x 10 M ), niespecyficzne wobec wapnia, usytuowane w C-końcowej domenie białka, wysycone są jonami magnezu (KMg = 2 x 10 M ) ( G r a b a r e k i współaut. 1992, FARAH i REINACH 1995). W tych warunkach N-końcowy region troponiny I jest związany z C-końcową domeną troponiny C, a C-końcowe rejony troponiny I wiążą się z kompleksem aktyna-tropomiozyna, utrzymując tropomiozynę w pozycji zasłaniającej miejsca wiązania aktyny z główką miozynową (H ASEL- G r o y e 1972, L e h m a n i współaut. 1994). Ak Rys. 2. S ch em at p ok azu jący u sytu ow an ie b iałek regu lu jących sk u rcz m ięśn i szk ieletow ych i sercow ych, troponiny i tropom iozyny, na filam encie aktynow ym oraz głów ki m iozynow e w ysu n ięte n a zew n ątrz filam entu m iozyn ow ego i tw orzące m ostki m iędzy filam entam i. A aktyna; TM tropomiozyna; TnI, TnC i TnT składniki troponiny: troponina I, C i T; S -l subfragment 1 mio- zyny (główka miozynową); RLC, regulujący i ELC, istotny łańcuch lekki miozyny.
5 Molekularne podstawy kontroli skurczu mięśni 559 plazmie (do mikromolowego) powoduje ich związanie z miejscami o słabym powinowactwie w domenie końca N troponiny C, wynikiem czego jest przesunięcie wzgledem siebie odcinków helikalnych białka i otwarcie hydrofobowej kieszeni (GANGE i współaut. 1994) (rys. 3). tywność ATPazy aktomiozynowej jest wówczas bardzo niska, charakterystyczna dla stanu rozkurczu rżących słabo związane mostki między podjednostkami aktyny i główkami miozynowymi. mięśni (McKlLLOP i GEEVES 1993). 5. Dalszy obrót tropomiozyny (o około 5 ), Kolejność reakcji prowadzących do skurczu mięśni prążkowanych jest następująca. wymuszony w sposób kooperatywny przez główki miozynowe przyłączone do podjedno- 1. Wzrost stężenia jonów wapnia w sarko- stek aktynowych pozwala na wytworzenie silnie związanych mostków, zdolnych do szybkiej hydrolizy ATP i generacji siły (HOLMES 1995, LEHRER 1994). Przedstawiony schemat kaskady reakcji indukowanych przez jony wapnia, prowadzący do aktywacji skurczu mięśni prążkowanych, R ys. 3. Z m ia n y k on form acyjn e w cząsteczce trop on in y C pod w p ływ em jo n ó w w a p n ia i in d u k ow an e w ią zan iem jo n ó w w a p n ia zm ia n y w oddziaływ an iu trop on in y C z trop on in ą I. TnC troponiną C, Tn I troponiną I. 2. Z hydrofobowymi resztami wiąże się fragment C-końcowy oraz fragment wiążący aktynę i hamujący ATPazę aktomiozynową troponiny I (rys. 3). 3. Wzmocnienie w ten sposób wiązania między troponiną C i troponiną I (wzrost stałej wiązania o trzy rzędy wielkości) powoduje przerwanie połączenia troponiny I z kompleksem aktyna-tropomiozyna, pozostawiąjąc troponinę związaną z filamentem aktynowym wyłącznie poprzez wiązanie troponiny T z tropomiozyną. 4. Te przegrupowania w kompleksie troponinowym pociągają za sobą obrót polimerów tropomiozynowych wokół osi filamentu aktynowego o około 25 i odsłonięcie miejsc twojest znacznie uproszczony i opisuje tylko zmiany w oddziaływaniu białek, mających kluczowe znaczenie dla tego kooperatywnego procesu. Mnogość form polimorficznych białek regulujących, charakterystycznych dla mięśni szkieletowych wolnych i szybkich, a także mięśni sercowych, nie ma znaczenia dla mechanizmu regulacji, ale może modyfikować wrażliwość aktywności ATPazy aktomiozynowej na jony wapnia. Tak się dzieje w przypadku mięśnia sercowego, którego troponiną I i troponin a T są fosfoproteinami (TOBACMAN 1996). Fosforylacji troponiny I pod wpływem stymulacji receptorów p-adrenergicznych towarzyszy spadek wrażliwości ATPazy aktomiozynowej na jo ny wapnia. Jest to skutek zdolności ufosfory-
6 560 Renata Dąb ro w ska, A ntoni W rzosek lowanej troponiny I do zmiejszania powinowactwa troponiny C do jonów wapnia. Rola fosforylacji troponiny T w mięśniach sercowych pozostaje dotąd nie wyjaśniona, chociaż wiadomo, że białko to ufosforylylowane in vitro przez kinazę białkową C ma mniejsze powinowactwo do kompleksu tropomiozyna-aktyna, co w konsekwencji prowadzi do obniżenia stymulowanej jonami wapnia aktywności ATPazy aktomiozynowej (NOLAND i KU O 1992). W stanach patologicznych mięśnia sercowego występują zmiany w ekspresji isoform troponiny (szczególnie jej podjednostek I i T) (M ALH O R TA 1994, V a n D e W e r e 1996). Troponina nie występuje w mięśniach gładkich kręgowców i wielu bezkręgowców, a także w mięśniach prążkowanych mięczaków, a mechanizm zależnej od jonów wapnia regulacji aktywności skurczowej tych mięśni jest związany bezpośrednio z główkami miozynowymi (TRYBUS 1994, DĄBROWSKA i STĘPKOW SKI 1997). W każdej z dwóch główek cząsteczki miozyny można wyróżnić reagującą z aktyną i hydrolizującą ATP domenę motoryczną oraz domenę regulatorową, w której z fragmentem łańcucha ciężkiego wiążą się w sposób niekowalencyjny łańcuchy lekkie: regulujący i istotny (rys. 2). Rozmieszczenie tych domen i ich wzajemne oddziaływanie zostało poznane dzięki krystalografii główki miozyny z mięśni szkieletowych kury (RAYMENT i współaut. 1993) i domeny regulatorowej miozyny z mięśni mięczaka, przegrzebka (XIE i współaut. 1994), a także dzięki wykorzystaniu metod genetyki molekularnej (TRYBUS 1994). W stanie rozkurczu zarówno mięśni gładkich kręgowców, jak i mięśni prążkowanych mięczaków (przy niskim poziomie jonów wapnia) zahamowanie oddziaływania między miozyną i aktyną jest spowodowane prawdopodobnie dimeryzacją główek i blokowaniem w ten sposób uwalniania produktów hydrolizy ATP z miejsca katalitycznego (domeny motorycznej) (CREMO i współaut. 1995, Kalabokis i współaut. 1996). Nieco odmienne są natomiast mechanizmy prowadzące do skurczu tych dwóch typów mięśni. Cykl reakcji prowadzących do skurczu mięśni gładkich jest następujący. 1. Związanie czterech jonów wapnia z cząsteczką kalmoduliny (Kca~ M J) powoduje zmianę jej konformacji, uwidaczniając hydrofobowe regiony wiążące kinazę lekkich łańcuchów miozyny, i tworzenie w ten sposób aktywnego kompleksu tego enzymu. 2. Aktywna kinaza katalizuje reakcję fosforylacji seryny w N-końcowym fragmencie regulującego łańcucha lekkiego w każdej z dwu główek miozynowych indukując jego zmiany konfor macyj ne. 3. Informacje o zmianach konformacyjnych w końcach N regulujących łańcuchów są transmitowane poprzez ich C-końcową domenę do łańcuchów ciężkich, z którymi się wiążą. 4. Ciężke łańcuchy propagują zmiany w domenie regulatorowej do odległej o około 100 A domeny motorycznej w każdej z dwu główek miozynowych, powodując dysocjację główek, ich oddziaływanie z aktyną i skurcz mięśni. W mięśniach mięczaków miozyna nie ulega fosforylacji, a zmiany konformacyjne domeny regulatorowej główek miozynowych są indukowane bezpośrednim wiązaniem jonów wapnia z istotnymi łańcuchami lekkimi (XIE 1994). W stabilizacji tego wiązania uczestniczy szereg reszt aminokwasowych łańcuchów regulujących i ciężkich, usztywniając w ten sposób całą domenę regulatorową (HOUDUSSE i COHEN 1996). Tak jak w przypadku miozyny z mięśni gładkich, w mechanizmie przekazywania informacji o kolejnych zmianach konformacyjnych, wywołanych wiązaniem jonów wapnia z domeną regulatorową do domeny motorycznej, bierze udział C-końcowa połowa łańcucha regulującego i łańcuch ciężki każdej z główek miozyny (Dąbrow ska i Stępkow ski 1997). MOLECULAR BASIS FOR CALCIUM CONTROL OF MUSCLE CONTRACTION Summary and then to present the current state of understanding of the molecular mechanisms by which calcium sensory pro teins transmit the effect of calcium binding to the actomy- osin system generating force in these muscles, It is well established that contraction of all muscle types is controlled by intracellular free calcium level. The aim of this article is to review first the current knowledge of the main pathways of intracellular free calcium regułation in skeletal, cardiac and smooth muscle sarcoplasm,
7 Molekularne podstawy kontroli skurczu mięśni 561 LITERATURA B e r s d. M., Excitation-contraction coupling and cardiac contractile force. Dorechet, Kluwer. Ca r a f o l i E., Biogenesis: plasma membrane calcium ATPase: 15 years o f work on the purified enzyme. FA- S E B J. 8, C o l y e r J., Control o f calcium pump o f cardiac sarcoplasmic reticulum. A specific role fo r pentameric structure o f phospholamban? Cardiovasc. Res. 27, C r e m o C. R., S e l l e r s J. R., F a c e m y e r K. C., Two heads are required fo r phosphorylation-dependent regulation o f smooth muscle myosin. J. Biol. Chem. 270, C r e s p o L. M., G r a n t h a m C. J., Ca n n e l l M. B., Kine tics, stoichiometry and role o f Na / Ca exchange mechanism in isolated cardiac myocytes. Nature 345, Dą b r o w sk a R., Budowa i działanie aparatu kurczliwego mięśni. [W:] Komórka je j budowa i ruch. Kuź n ic k i L. (red.) Ossolineum, Wrocław str D ą b r o w s k a R., Molekularne mechanizmy zależnej 2+ od Ca regulacji skurczu różnych typów mięśni, Post. Biochem.42, DąBROwsKA R., S t ę p k o w s k i D., Wpływ łańcuchów lekkich miozyny na je j funkcjonowanie. Post. Biochem. 43, D u l i iu n t y A. F., The voltage-activation o f contraction in skeletal muscle. Prog. Biophys. Mol. Biol. 57, E basiti S., E n d o M., Ca ion and muscle contraction. Progr. Biophys. Mol. Biol. 18, E b a s h i S., Regulatory mechanism o f muscle contraction with special reference to the Ca-troponin-tropomyosin system. [W:] Essays in Biochemistry. Ca m p b e l l P. N., D ic k e n s F. (red.), Academic Press, London, vol. 10, str Fa r ali C. S., R e in a c h F. C., The troponin complex and regulation o f muscle contraction. F a s e b J. 9, F l u c p ie r B. E., A n d r e w s S. B., F l e is c h e r s., M a r k s a. R., C a s w e l l A., Triad f ormation: organization and function o f the sarcoplasmic reticulum calcium released channel and triadin in normal and dysgenic muscle in vitro. J. Cell Biol. 123, F u t a t s u g i A., K u w a ij m a A. G.,M ik o s h ib a K., Tissuespecific and developmentally regulated alternative splicing in mouse skeletal ryanodine mrna. Biochem. J. 305, G a n g e s. M., T s u d a S., L i M. X., C h a n d r a M., S m il l ie L.B., S yke s B.D., Quantfication o f the calcium-induced secondary structural changes in the regulatory domain o f troponin-c. Protein Sci. 3, G l o s s m a n n H., S t r ie s s in g j., Molecular properties o f calcium channels. Rev. Physiol. Biochem. Pharmacol. 114, G rab arek Z., Tao T., G erg ely J., Molecular mechanism o f troponin-c function. J. Muscle Res. Cell Motil. 13, H aselg ro ve J. C., X-ray evidence fo r a conformational change in the actin containing filaments o f vertebrate striated muscle. Cold Spring Harbor Symp. Quant. Biol. 37, H erzberg O., J am es m. N. G Refined crystal structure o f troponin C from turkey skeletal muscle at 2.0 A resolution. J. Mol. Biol. 203, H o l m e s K. C., The actomyosin interaction and its control by tropomyosin. Biophys. J. 68, 2s-6s. H o u d u s s e A., C o h e n C., Structure o f the regulatory domain o f scallop myosin at 2 A resolution: implications fo r regulation. Structure 4, H o r o w it z A., M e n ic E C. B., L a p o r t e R., M o r g a n K. G., Mechanisms o f smooth muscle contraction. P h y siol. Rev. 76, HUXLEY H. E., The mechanism o f muscular contraction. Science 164, K a b s c h w. M a n n h e r z H. G., S u c k D., Pa i e. f., h o l m e s K.C., Atomic structure o f actin: DNase I complex. Nature 347, KALABOKIS V. N., VlBERT P., YORK M. L., SZENT-Gy ORGYI A. G., Single-headed scallop myosin and regulation. J. Biol. Chem. 271, Kijim a Y., Saito A., J etton T. L., M ag nu so n M. a., Fleis c h e r S., Different intracellular localization o f inositol 1,4,5-triphosphate and rianodine receptor in cardiomyocytes. J. Biol. Chem. 268, K n u d s o n C. M., St a n g K. K., J o r g e n s e n A. O., C a m b e l l K. P., Biochemical characterization and ultrastructural localization o f a major junctional sarcoplasmic reticulum glycoprotein (triadin). J. Biol. Chem. 268, L e h m a n W., CRAIG R., V ib e r t P., Ca + -induced tropomyosin movement in Limulus thin filaments revealed by three-dimensional reconstruction. Nature 368, L e h m a n W., V ib e r t P., U m a n P., C r a ig R., Stericblocking by tropomyosin visualized in relaxed vertebrate muscle thin filaments. J. Mol. Biol. 251, Leh rer S.S., The regulatory switch o f the muscle 2+ thin filament: Ca or myosin heads? J. Muscle Res. Cell Motil. 15, M a l h o r t a A., 1994, Role o f regulatory proteins (troponintropomyosin) in pathologic states. Mol. Cell.Biochem. 135, M cd o n a ld T. F., P e l z e r S., T r a u t w e in W., P e l z e r D. J., Regulation and modulation o f calcium channels in cardiac, skeletal, and smoot h muscle cells. Physiol. Rev. 74, M c K il l o p D. F. A., G e e v e s M. A., Regulation o f the interaction between actin and myosin subfragment 1: evidence fo r three states o f the thin filament. Biophys. J. 65, M ic h a l a k M., M il n e r R. E., B u r n s K., O p a s m., Calreticulin. Biochem. J. 285, M o n t e it h G. R., R o u f o g a l is B. D., The plasma membrane calcium pump a physiological perspective on its regulation. Cell Calcium 18, M o r g a n J. P., B l in k s J. R., Intracellular Ca transients in the cat papillary muscle. Can J. Physiol. Pharmacol. 60, N a k a y a m a S., K r e t s in g e r R.H., Evolution o f the EFhand family o f proteins. Annu. Rev. Biomol. Struc. 23, NEGRETH N O'NEILL S. C., E isne r D. A., The relative contribution o f different intracellular and sarcolemmal systems to relaxation in rat ventricular myocytes. C a rd iovascu la r Res. 27, n ic o l l d. a., q u e d n a u b. d., Q u i z., x i a y -r., l u s is a. j.,
8 562 Renata Dą b ro w ska, A ntoni W rzosek P h il ip s o n K. D., 1996, Cloning o f a third mammalian N a -C a + exchanger, NCX3. J. Biol. Chem. 271, Noland T. A., Kuo J. F., Protein kinase C phospho- 2+ rglation o f cardiac troponin T decreases Ca -dependent actomyosin MgATPase activity and troponin T binding to tropomyosin F-actin complex. Biochem. J. 288, Pikula S., ATPaza z błon sarkoplazmatycznego retikulum, transportująca jon y wapnia. Kosmos 46, Ra y m e n t Y., Ry p n ie w s k iw.r., S c h m it -BAs e K., S m it h R, T o m o c h ic k D. R., B e n n in g M. M., W in k e l m a n n D. A., W esenb erg G., H olden H. M., Three-dimensional structure od myosin subfragment-1: a molecular motor. Science 261, R a ll J. A., Role o f parvalbumin in skeletal muscle relaxation. News in Physiol. Sciences 11, S a d o s h im a J., Iz u m o S., The cellular and molecular response o f cardiac myocytes to mechanical stress. Annu. Rev. Physiol. 59, S o m l y o P. A., S o m l y o A. V., Signal transduction and regulation in smooth muscle. Nature 372, St e a A., SOONG T. W., S n u t a c h T. P., Voltage-gated calcium channels. IW:] Handbook o f Receptors and Channels Series. Ligand- and voltage-gated ion channels, R. A. N o r t h (red.), CRC Press, Inc T a n a b e T., B e a m K. G., A d a m s B. A., N iid o m e T., N u m a S., Regions o f the skeletal muscle dihydropirydyne receptor critical fo r excitation-contraction coupling. Nature 346, Taylo r E. W., Mechanism and energetics o f actomyosin ATPase. [W:] The Heart and Cardiovascular System II wyd. Fo z z a r H.A. i współred, Raven Press Ltd, New York str T h a r in S., H a m e l P. A., C o n w a y E. M., M ic h a l a k M., O p a s M., Regulation o f calcium binding proteins calre- ticulin and calsquestrin during differentiation in the myogenic cell line L6. J. Cell. Physiol. 166, TOBACMAN L. S., Thin-filament-mediated regulation o f cardiac contraction. Annu. Rev. Physiol. 58, T r y b u s K. M., Role o f myosin light chains. J. Muscle Res. Cell Motil. 15, V a n D e W er f F., Cardiac troponins in acute coronary syndromes. New Eng. J. Med. 335, W e l l e n e r M. C., Is e n b e r g G., Stretch effects on whole-cell current o f guinea-pig urinary bladder myocytes. J. Physiol. Lond. 480, Whitby F. G., Kent H., S tew art F., S tew a rt M., Xie X., Hatch V., Phillips G. N., Structure o f tropomyosin at 9 Angstroms resolution. J. Mol. Biol. 227, X ie X., H a r r is o n D. H., S c h l ic h t in g I., S w e e t R. M., KA- LABOKIS V. N., SZENT-GYORGYI A. G., COHEN C., Structure o f regulatory domain o f scallop myosin at 2.8 A resolution. Nature, 368, X io ng Z., S perelakis N., Regulation o f L-type calcium channels o f vascular smooth muscle cells. J. Mol. Cardiol. 27,
ROLA WAPNIA W FIZJOLOGII KOMÓRKI
 ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski
 biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
Udział jonów wapnia w regulacji oddziaływań aktyny z miozyną
 Udział jonów wapnia w regulacji oddziaływań aktyny z miozyną STRESZCZENIE Skurcz komórek mięśniowych oraz różnorodne formy ruchliwości komórek niemięśniowych są uzależnione od cyklicznych oddziaływań pomiędzy
Udział jonów wapnia w regulacji oddziaływań aktyny z miozyną STRESZCZENIE Skurcz komórek mięśniowych oraz różnorodne formy ruchliwości komórek niemięśniowych są uzależnione od cyklicznych oddziaływań pomiędzy
Kosm os. PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika
 Kosm os Tom 50, 2001 Numer 4 (253) Strony 349-358 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Z e n o n G r a b a r e k Boston Biomedical Research Institute Watertown. MA
Kosm os Tom 50, 2001 Numer 4 (253) Strony 349-358 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Z e n o n G r a b a r e k Boston Biomedical Research Institute Watertown. MA
Mięśnie. dr Magdalena Markowska
 Mięśnie dr Magdalena Markowska Zjawisko ruchu 1) Jako możliwość przemieszczania przestrzennego mięśnie poprzecznie prążkowane 2) Pompa serce 3) Jako podstawa do utrzymywania czynności życiowych mięśnie
Mięśnie dr Magdalena Markowska Zjawisko ruchu 1) Jako możliwość przemieszczania przestrzennego mięśnie poprzecznie prążkowane 2) Pompa serce 3) Jako podstawa do utrzymywania czynności życiowych mięśnie
CYTOSZKIELET CYTOSZKIELET
 CYTOSZKIELET Sieć włókienek białkowych; struktura wysoce dynamiczna Filamenty aktynowe Filamenty pośrednie Mikrotubule Fibroblast CYTOSZKIELET 1 CYTOSZKIELET 7nm 10nm 25nm Filamenty pośrednie ich średnica
CYTOSZKIELET Sieć włókienek białkowych; struktura wysoce dynamiczna Filamenty aktynowe Filamenty pośrednie Mikrotubule Fibroblast CYTOSZKIELET 1 CYTOSZKIELET 7nm 10nm 25nm Filamenty pośrednie ich średnica
CH ARAKTERYSTYKA I REGULACJA W YM IENIACZA Na+/Ca2+ W KOM ÓRKACH M IĘŚNIA SERCOW EGO SSAKÓW WSTĘP. (D H ALLA i współaut. 1996).
 Kosm os PROBLEMY NAUK BIOLOGICZNYCH. Tom 46, 1997 Numer 4 (237) Strony 573-578 Polskie Towarzystwo Przyrodników im. Kopernika A n t o n i W r z o s e k Zakład. Biochemii Mięśni Instytut Biologii Doświadczalnej
Kosm os PROBLEMY NAUK BIOLOGICZNYCH. Tom 46, 1997 Numer 4 (237) Strony 573-578 Polskie Towarzystwo Przyrodników im. Kopernika A n t o n i W r z o s e k Zakład. Biochemii Mięśni Instytut Biologii Doświadczalnej
Kosm os PROBLEMY NAUK BIOLOGICZNYCH. KANAŁY UWALNIAJĄCE JONY WAPNIA Z BŁON WEWNĘTRZNYCH. Tom 46, 1997 Numer 4 (237) Strony
 Kosm os PROBLEMY NAUK BIOLOGICZNYCH. Tom 46, 1997 Numer 4 (237) Strony 515-522 Polskie Towarzystwo Przyrodników im. Kopernika W ie s ł a w a L e ś n ia k Zakład Neurobiologii Molekularnej i Komórkowej
Kosm os PROBLEMY NAUK BIOLOGICZNYCH. Tom 46, 1997 Numer 4 (237) Strony 515-522 Polskie Towarzystwo Przyrodników im. Kopernika W ie s ł a w a L e ś n ia k Zakład Neurobiologii Molekularnej i Komórkowej
Transport przez błony
 Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Filamenty aktynowe ORGANIZACJA CYTOPLAZMY. komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe
 Filamenty aktynowe ORGANIZACJA CYTOPLAZMY komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe Cytoszkielet aktynowy G-aktyna 370 aminokwasów 42 43 kda izoformy:
Filamenty aktynowe ORGANIZACJA CYTOPLAZMY komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe Cytoszkielet aktynowy G-aktyna 370 aminokwasów 42 43 kda izoformy:
Podział tkanki mięśniowej. Tkanka mięśniowa. Poprzecznie prążkowana
 Tkanka mięśniowa Podział tkanki mięśniowej Włókna mięśniowe Tkanka mięśniowa Komórki Komórki Poprzecznie prążkowana Gładka Szkieletowa Sercowa Szkieletowe Mięsień sercowy Mięśnie gładkie Cytoplazma z miofibryllami
Tkanka mięśniowa Podział tkanki mięśniowej Włókna mięśniowe Tkanka mięśniowa Komórki Komórki Poprzecznie prążkowana Gładka Szkieletowa Sercowa Szkieletowe Mięsień sercowy Mięśnie gładkie Cytoplazma z miofibryllami
6.1. MI ånie POPRZECZNIE PR ØKOWANE SZKIELETOWE
 TKANKA MI åniowa 6 Wywodzi się z mezodermy zorganizowanej w miotomy. Proces różnicowania polega przede wszystkim na tworzeniu wydłużonych komórek zdolnych do wytwarzania białek kurczliwych. Na podstawie
TKANKA MI åniowa 6 Wywodzi się z mezodermy zorganizowanej w miotomy. Proces różnicowania polega przede wszystkim na tworzeniu wydłużonych komórek zdolnych do wytwarzania białek kurczliwych. Na podstawie
SPEKTROSKOPIA MRJ BIAŁEK MIĘŚNIOWYCH
 SPEKTROSKOPIA MRJ BIAŁEK MIĘŚNIOWYCH Genowefa Ślósarek Zakład Biofizyki Molekularnej, Instytut Fizyki Uniwersytet im. A Mickiewicza ul Umultowska 85, 61-614 Poznań Badania podstawowe nad mięśniami prowadzone
SPEKTROSKOPIA MRJ BIAŁEK MIĘŚNIOWYCH Genowefa Ślósarek Zakład Biofizyki Molekularnej, Instytut Fizyki Uniwersytet im. A Mickiewicza ul Umultowska 85, 61-614 Poznań Badania podstawowe nad mięśniami prowadzone
Transportowane cząsteczki CO O, 2, NO, H O, etanol, mocznik... Zgodnie z gradientem: stężenia elektrochemicznym gradient stężeń
 Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
Numer 4 (253) Strony PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika
 Tom 50, 2001 Kosm os Numer 4 (253) Strony 359-374 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Re n a t a Dą b r o w s k a i R o b e r t m a k u c h Zakład. Biochemii Mięśni
Tom 50, 2001 Kosm os Numer 4 (253) Strony 359-374 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Re n a t a Dą b r o w s k a i R o b e r t m a k u c h Zakład. Biochemii Mięśni
Tkanka nerwowa. neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające)
 Tkanka nerwowa neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające) Sygnalizacja w komórkach nerwowych 100 tys. wejść informacyjnych przyjmowanie sygnału przewodzenie
Tkanka nerwowa neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające) Sygnalizacja w komórkach nerwowych 100 tys. wejść informacyjnych przyjmowanie sygnału przewodzenie
Podział tkanki mięśniowej. Tkanka mięśniowa. Poprzecznie prążkowana
 Tkanka mięśniowa Podział tkanki mięśniowej Tkanka mięśniowa Poprzecznie prążkowana Gładka Szkieletowa Sercowa Szkieletowe Mięsień sercowy Mięśnie gładkie Cytoplazma z miofibryllami sarkoplazma SER siateczka
Tkanka mięśniowa Podział tkanki mięśniowej Tkanka mięśniowa Poprzecznie prążkowana Gładka Szkieletowa Sercowa Szkieletowe Mięsień sercowy Mięśnie gładkie Cytoplazma z miofibryllami sarkoplazma SER siateczka
Ruch i mięśnie. dr Magdalena Markowska
 Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Nukleotydy w układach biologicznych
 Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN
 MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
Tkanka mięśniowa. Bogdan Walkowiak. Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka. 7 listopada 2014 Biofizyka 1
 Wykład 5 Tkanka mięśniowa Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka 7 listopada 2014 Biofizyka 1 Trzy typy mięśni Mięśnie szkieletowe (Poprzecznie prążkowane)
Wykład 5 Tkanka mięśniowa Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka 7 listopada 2014 Biofizyka 1 Trzy typy mięśni Mięśnie szkieletowe (Poprzecznie prążkowane)
Kosm os PROBLEMY NAUK BIOLOGICZNYCH. PODWÓJNE OBLICZE Ca2+-ATPazy. Tom 46, 1997 Numer 4 (237) Strony
 Kosm os PROBLEMY NAUK BIOLOGICZNYCH. Tom 46, 1997 Numer 4 (237) Strony 507-514 Polskie Towarzystwo Przyrodników im. Kopernika S ł a w o m ir P ik u ł a Zakład Biochemii Komórki Instytut Biologii Doświadczalnej
Kosm os PROBLEMY NAUK BIOLOGICZNYCH. Tom 46, 1997 Numer 4 (237) Strony 507-514 Polskie Towarzystwo Przyrodników im. Kopernika S ł a w o m ir P ik u ł a Zakład Biochemii Komórki Instytut Biologii Doświadczalnej
CYTOSZKIELET CYTOSZKIELET Cytoplazma podstawowa (macierz cytoplazmatyczna) Komórka eukariotyczna. cytoplazma + jądro komórkowe.
 Komórka eukariotyczna cytoplazma + jądro komórkowe (układ wykonawczy) cytoplazma podstawowa (cytozol) Cytoplazma złożony koloid wodny cząsteczek i makrocząsteczek (centrum informacyjne) organelle i kompleksy
Komórka eukariotyczna cytoplazma + jądro komórkowe (układ wykonawczy) cytoplazma podstawowa (cytozol) Cytoplazma złożony koloid wodny cząsteczek i makrocząsteczek (centrum informacyjne) organelle i kompleksy
Kosm os. PROBLEMY NAUK *BIÓI^G 1EZNY e n. Tom 46, 1997 Numer 4 (237) Strony
 Kosm os PROBLEMY NAUK *BIÓI^G 1EZNY e n Tom 46, 1997 Numer 4 (237) Strony 603-608 Polskie T ow arzystw o Przyrod n ik ów im. K op ern ik a J a c e k K u ź n ic k i, A n n a F il ip e k Zakład Neurobiologii
Kosm os PROBLEMY NAUK *BIÓI^G 1EZNY e n Tom 46, 1997 Numer 4 (237) Strony 603-608 Polskie T ow arzystw o Przyrod n ik ów im. K op ern ik a J a c e k K u ź n ic k i, A n n a F il ip e k Zakład Neurobiologii
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Kosm os PROBLEMY NAUK BIOLOGICZNYCH. Tom 46, 1997 Numer 4 (237) Strony
 Kosm os PROBLEMY NAUK BIOLOGICZNYCH. Tom 46, 1997 Numer 4 (237) Strony 563-572 Polskie Tow arzystw o Przyrodników im. K opernika B o h d a n L e w a r t o w s k i Zakład Fizjologii Klinicznej Centnim Medycznego
Kosm os PROBLEMY NAUK BIOLOGICZNYCH. Tom 46, 1997 Numer 4 (237) Strony 563-572 Polskie Tow arzystw o Przyrodników im. K opernika B o h d a n L e w a r t o w s k i Zakład Fizjologii Klinicznej Centnim Medycznego
Ruch i mięśnie. dr Magdalena Markowska
 Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Homeostaza wapnia w komórce zwierzęcej w zarysie
 Homeostaza wapnia w komórce zwierzęcej w zarysie Streszczenie Jony wapnia są wszechstronnym i uniwersalnym przekaźnikiem sygnału uczestniczącym w regulacji niemal wszystkich procesów życiowych komórki.
Homeostaza wapnia w komórce zwierzęcej w zarysie Streszczenie Jony wapnia są wszechstronnym i uniwersalnym przekaźnikiem sygnału uczestniczącym w regulacji niemal wszystkich procesów życiowych komórki.
POWSTAWANIE KOMÓREK M. SZKIELETOWEGO ORAZ KOMÓREK SATELITOWYCH
 Tkanka mięśniowa Pre-mioblasty POWSTAWANIE KOMÓREK M. SZKIELETOWEGO ORAZ KOMÓREK SATELITOWYCH 1. Komórki mezenchymalne miotomów różnicują się w wydłużone pre-mioblasty. - powstają miotubule 5. Różnicują
Tkanka mięśniowa Pre-mioblasty POWSTAWANIE KOMÓREK M. SZKIELETOWEGO ORAZ KOMÓREK SATELITOWYCH 1. Komórki mezenchymalne miotomów różnicują się w wydłużone pre-mioblasty. - powstają miotubule 5. Różnicują
Zakład Biochemii Mięśni, Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Pasteura 3, Warszawa
 Kosm os Tom 46, 1997 Numer 1 (234) Strony 25-32 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Panu Profesorowi Lechowi Wojtczakowi za poświęcony mi czas A n t o n i W r z o
Kosm os Tom 46, 1997 Numer 1 (234) Strony 25-32 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Panu Profesorowi Lechowi Wojtczakowi za poświęcony mi czas A n t o n i W r z o
Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski. Instytut Farmakologii Polskiej Akademii Nauk, ul.
 Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski Instytut Farmakologii Polskiej Akademii Nauk, ul. Smętna 12, Kraków Plan prezentacji: Cel naukowy Podstawy teoretyczne Przyjęta metodyka
Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski Instytut Farmakologii Polskiej Akademii Nauk, ul. Smętna 12, Kraków Plan prezentacji: Cel naukowy Podstawy teoretyczne Przyjęta metodyka
Ca2+ JAKO WTÓRNY PRZEKAŹNIK INFORMACJI
 KOSMOS 1993,42(3/4): str 557-564 JOLANTA BARAŃSKA Instytut Biologii Doświadczalnej im. M. Nenckiego PAN, Zakład Biochemii Komórki Warszawa Ca2+ JAKO WTÓRNY PRZEKAŹNIK INFORMACJI Badania ostatnich dwudziestu
KOSMOS 1993,42(3/4): str 557-564 JOLANTA BARAŃSKA Instytut Biologii Doświadczalnej im. M. Nenckiego PAN, Zakład Biochemii Komórki Warszawa Ca2+ JAKO WTÓRNY PRZEKAŹNIK INFORMACJI Badania ostatnich dwudziestu
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Współczynnik przepuszczalności [cm/s] RóŜnice składu jonowego między wnętrzem komórki ssaka a otoczeniem
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Współczynnik przepuszczalności [cm/s] RóŜnice składu jonowego między wnętrzem komórki ssaka a otoczeniem
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski
 biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
Tom 50, 2001 Numer 4 (253) Strony PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika
 Kosm os Tom 50, 2001 Numer 4 (253) Strony 339-348 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Ba r b a r a P l is z k a Zakład Biochemii Mięśni Instytut Biologii Doświadczalnej
Kosm os Tom 50, 2001 Numer 4 (253) Strony 339-348 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Ba r b a r a P l is z k a Zakład Biochemii Mięśni Instytut Biologii Doświadczalnej
Dr. habil. Anna Salek International Bio-Consulting 1 Germany
 1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
TOM 8-NR 1981 ( )
 PL ISSN 0324-833X POLSKIE TOWARZYSTWO ANATOMICZNE TOM 8-NR 1981 (227-386) PWN-WARSZAWA PO STĘPY BIOLOGII KOMÓRKI TOM 8, NR 4, 1981 Kwartalnik Polskiego Towarzystwa Anatomicznego wydawany z pomocą finansową
PL ISSN 0324-833X POLSKIE TOWARZYSTWO ANATOMICZNE TOM 8-NR 1981 (227-386) PWN-WARSZAWA PO STĘPY BIOLOGII KOMÓRKI TOM 8, NR 4, 1981 Kwartalnik Polskiego Towarzystwa Anatomicznego wydawany z pomocą finansową
Komórka eukariotyczna organizacja
 Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma podstawowa (cytozol) organelle cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma podstawowa (cytozol) organelle cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja
 Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma organelle podstawowa (cytozol) cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma organelle podstawowa (cytozol) cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Tkanka mięśniowa. pobudliwość kurczliwość
 Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Rozdział 1. Nazwa i adres Zamawiającego Rozdział 2. Informacja o trybie i stosowaniu przepisów Rozdział 3. Przedmiot zamówienia
 Z n a k s p r a w y G O S I R D Z P I 2 7 1 0 1 0 2 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A f S p r z» t a n i e i u t r z y m a n i e c z y s t o c i g d y
Z n a k s p r a w y G O S I R D Z P I 2 7 1 0 1 0 2 0 1 4 S P E C Y F I K A C J A I S T O T N Y C H W A R U N K Ó W Z A M Ó W I E N I A f S p r z» t a n i e i u t r z y m a n i e c z y s t o c i g d y
CZY ANEKSYNY BIO RĄ UDZIAŁ W REGULACJI HOM EOSTAZY W APNIA W KOM ÓRCE? WPROWADZENIE. P o l l a r d 1994, Moss 1997). Niektóre z aneksyn
 Kosm os PROBLEMY NAUK BIOLOGICZNYCH Tom 46, 1997 Numer 4 (237) Strony 625-633 Polskie T ow arzystw o Przyrodników im. K opernika J o a n n a Ba n d o r o w ic z -P ik u ł a Zakład Biochemii Komórki Instytut
Kosm os PROBLEMY NAUK BIOLOGICZNYCH Tom 46, 1997 Numer 4 (237) Strony 625-633 Polskie T ow arzystw o Przyrodników im. K opernika J o a n n a Ba n d o r o w ic z -P ik u ł a Zakład Biochemii Komórki Instytut
Budowa i funkcje komórek nerwowych
 Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Układ ruchu Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka.
 Układ ruchu Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
Układ ruchu Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
Dywergencja/konwergencja połączeń między neuronami
 OD NEURONU DO SIECI: MODELOWANIE UKŁADU NERWOWEGO Własności sieci, plastyczność synaps Stefan KASICKI SWPS, SPIK wiosna 2007 s.kasicki@nencki.gov.pl Dywergencja/konwergencja połączeń między neuronami 1
OD NEURONU DO SIECI: MODELOWANIE UKŁADU NERWOWEGO Własności sieci, plastyczność synaps Stefan KASICKI SWPS, SPIK wiosna 2007 s.kasicki@nencki.gov.pl Dywergencja/konwergencja połączeń między neuronami 1
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Cząsteczki < 150Da Błony - selektywnie przepuszczalne RóŜnice składu jonowego między wnętrzem komórki ssaka
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Cząsteczki < 150Da Błony - selektywnie przepuszczalne RóŜnice składu jonowego między wnętrzem komórki ssaka
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność szybka dyfuzja: O 2, CO 2, N 2, benzen Dwuwarstwa lipidowa - przepuszczalność Współczynnik przepuszczalności [cm/s] 1 Transport
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność szybka dyfuzja: O 2, CO 2, N 2, benzen Dwuwarstwa lipidowa - przepuszczalność Współczynnik przepuszczalności [cm/s] 1 Transport
Biologiczne mechanizmy zachowania - fizjologia. zajecia 2 :
 Biologiczne mechanizmy zachowania - fizjologia zajecia 2 : 15.10.15 Kontakt: michaladammichalowski@gmail.com https://mmichalowskiuwr.wordpress.com/ I gr 08:30 10:00 II gr 10:15 11:45 III gr 12:00 13:30
Biologiczne mechanizmy zachowania - fizjologia zajecia 2 : 15.10.15 Kontakt: michaladammichalowski@gmail.com https://mmichalowskiuwr.wordpress.com/ I gr 08:30 10:00 II gr 10:15 11:45 III gr 12:00 13:30
MIĘŚNIE Czynności i fizjologia mięśni
 Biomechanika sportu MIĘŚNIE Czynności i fizjologia mięśni CZYNNOŚCI MIĘŚNIA W opisie czynności mięśnia i siły przez niego wyzwolonej odwołujemy się do towarzyszącej temu zmianie jego długości. Zmiana długości
Biomechanika sportu MIĘŚNIE Czynności i fizjologia mięśni CZYNNOŚCI MIĘŚNIA W opisie czynności mięśnia i siły przez niego wyzwolonej odwołujemy się do towarzyszącej temu zmianie jego długości. Zmiana długości
Kosm os. PROBLEMY NAUK Ti i ó LOGICZNYCH KALRETIKULINA BIAŁKO O WIELU OBLICZACH. Tom 46, 1997 Numer 4 (237) Strony
 Kosm os PROBLEMY NAUK Ti i ó LOGICZNYCH Tom 46, 1997 Numer 4 (237) Strony 635-640 Polskie Tow arzystw o P rzyrodników im. K opernika K o n r a d S. F a m u l s k i Molecular Oncology Program, Cross Cancer
Kosm os PROBLEMY NAUK Ti i ó LOGICZNYCH Tom 46, 1997 Numer 4 (237) Strony 635-640 Polskie Tow arzystw o P rzyrodników im. K opernika K o n r a d S. F a m u l s k i Molecular Oncology Program, Cross Cancer
Sygnalizacja międzykomórkowa i wewnątrzkomórkowa
 Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem
Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem
Tkanka mięśniowa. pobudliwość kurczliwość
 Tkanka mięśniowa troponina tropomiozyna Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) białka pomocnicze łańcuchy lekkie miozyna 2 miozyna 2 pobudliwość kurczliwość
Tkanka mięśniowa troponina tropomiozyna Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) białka pomocnicze łańcuchy lekkie miozyna 2 miozyna 2 pobudliwość kurczliwość
Układ ruchu, skóra Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka.
 Układ ruchu, skóra Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
Układ ruchu, skóra Zadanie 1. (1 pkt) Schemat przedstawia fragment szkieletu człowieka. Podaj nazwy odcinków kręgosłupa oznaczonych na schemacie literami A, B, C i D. Zadanie 2. (1 pkt) Na rysunku przedstawiono
Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie
 Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
Część V: Przekazywanie sygnałów. DO WYKŁADÓW Z PODSTAW BIOFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski
 MATERIAŁY PMCNICZE D WYKŁADÓW Z PDSTAW BIFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski PRZEKAZYWANIE SYGNAŁÓW Cechą charakterystyczną układów żywych jest zdolność do zachowywania wewnętrznej
MATERIAŁY PMCNICZE D WYKŁADÓW Z PDSTAW BIFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski PRZEKAZYWANIE SYGNAŁÓW Cechą charakterystyczną układów żywych jest zdolność do zachowywania wewnętrznej
października 2013: Elementarz biologii molekularnej. Wykład nr 2 BIOINFORMATYKA rok II
 10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
Kosm os PROBLEMY NAUK BIOLOGICZNYCH
 Kosm os PROBLEMY NAUK BIOLOGICZNYCH Tom 50, 2001 Numer 4 (253) Strony 405-410 Polskie Towarzystwo Przyrodników im. Kopernika A n d r z e j a. K a s p r z a k Zakład Biochemii Mięśni Instytut Biologii Doświadczalnej
Kosm os PROBLEMY NAUK BIOLOGICZNYCH Tom 50, 2001 Numer 4 (253) Strony 405-410 Polskie Towarzystwo Przyrodników im. Kopernika A n d r z e j a. K a s p r z a k Zakład Biochemii Mięśni Instytut Biologii Doświadczalnej
Rok akad. 2015/2016 Semestr zimowy, czwartek,
 PROWADZĄCY: Prof. Nadzieja Drela - koordynator Dr Magdalena Markowska - koordynator Dr Paweł Majewski Prof. Krystyna Skwarło-Sońta Rok akad. 2015/2016 Semestr zimowy, czwartek, 8.30-10 Receptory wolne
PROWADZĄCY: Prof. Nadzieja Drela - koordynator Dr Magdalena Markowska - koordynator Dr Paweł Majewski Prof. Krystyna Skwarło-Sońta Rok akad. 2015/2016 Semestr zimowy, czwartek, 8.30-10 Receptory wolne
Kanały jonowe i pompy błonowe
 Kanały jonowe i pompy błonowe Jak badad przepływ jonów? Patch-clamp -zassanie powoduje ścisłe połączenie błony komórkowej z kapilarą (opornośd miedzy wnętrzem pipety a otaczającym roztworem = 10^9 omów)
Kanały jonowe i pompy błonowe Jak badad przepływ jonów? Patch-clamp -zassanie powoduje ścisłe połączenie błony komórkowej z kapilarą (opornośd miedzy wnętrzem pipety a otaczającym roztworem = 10^9 omów)
Bioinformatyka wykład 9
 Bioinformatyka wykład 9 14.XII.21 białkowa bioinformatyka strukturalna krzysztof_pawlowski@sggw.pl 211-1-17 1 Plan wykładu struktury białek dlaczego? struktury białek geometria i fizyka modyfikacje kowalencyjne
Bioinformatyka wykład 9 14.XII.21 białkowa bioinformatyka strukturalna krzysztof_pawlowski@sggw.pl 211-1-17 1 Plan wykładu struktury białek dlaczego? struktury białek geometria i fizyka modyfikacje kowalencyjne
fizjologia zwierząt - GIBE 2. mięśnie, równowaga, odruchy seminarium + laboratorium M.Eng. Michal Adam Michalowski
 fizjologia zwierząt - GIBE 2. mięśnie, równowaga, odruchy seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl
fizjologia zwierząt - GIBE 2. mięśnie, równowaga, odruchy seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl
etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
 Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu
 Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
Tkanka mięśniowa. pobudliwość kurczliwość
 Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Potencjał spoczynkowy i czynnościowy
 Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Biologiczne mechanizmy zachowania
 Biologiczne mechanizmy zachowania Przekaźnictwo chemiczne w mózgu mgr Monika Mazurek IPs UJ Odkrycie synaps Ramon y Cajal (koniec XIX wieku) neurony nie łączą się między sobą, między nimi jest drobna szczelina.
Biologiczne mechanizmy zachowania Przekaźnictwo chemiczne w mózgu mgr Monika Mazurek IPs UJ Odkrycie synaps Ramon y Cajal (koniec XIX wieku) neurony nie łączą się między sobą, między nimi jest drobna szczelina.
Kosm os. PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika. Tom 50, 2001 Numer 3 (252) Strony
 Kosm os Tom 50, 2001 Numer 3 (252) Strony 263-270 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika JOANNA MORACZEWSKA Akademia Bydgoska im. K. Wielkiego, Instytut Biologii i Ochrony
Kosm os Tom 50, 2001 Numer 3 (252) Strony 263-270 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika JOANNA MORACZEWSKA Akademia Bydgoska im. K. Wielkiego, Instytut Biologii i Ochrony
SEMINARIUM 8:
 SEMINARIUM 8: 24.11. 2016 Mikroelementy i pierwiastki śladowe, definicje, udział w metabolizmie ustroju reakcje biochemiczne zależne od aktywacji/inhibicji przy udziale mikroelementów i pierwiastków śladowych,
SEMINARIUM 8: 24.11. 2016 Mikroelementy i pierwiastki śladowe, definicje, udział w metabolizmie ustroju reakcje biochemiczne zależne od aktywacji/inhibicji przy udziale mikroelementów i pierwiastków śladowych,
Kosmos. PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika
 Kosmos Tom 50, 2001 Numer 4 (253) Strony 391-404 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Anna Moczarska Zakład Biochemii Mięśni Instytut Biologii Doświadczalnej im. M.
Kosmos Tom 50, 2001 Numer 4 (253) Strony 391-404 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Anna Moczarska Zakład Biochemii Mięśni Instytut Biologii Doświadczalnej im. M.
Część II: Ruch w układach biologicznych. Biofizyka II przedmiot obieralny Materiały pomocnicze do wykładów prof. dr hab. inż.
 Biofizyka II przedmiot obieralny Materiały pomocnicze do wykładów prof. dr hab. inż. Jan Mazerski C Z ĘŚĆ II: RUCH W U K Ł ADACH B IOLOGICZNYCH 1. CYTOSZKIELET Zastosowania mikroskopu świetlnego do badania
Biofizyka II przedmiot obieralny Materiały pomocnicze do wykładów prof. dr hab. inż. Jan Mazerski C Z ĘŚĆ II: RUCH W U K Ł ADACH B IOLOGICZNYCH 1. CYTOSZKIELET Zastosowania mikroskopu świetlnego do badania
Kosmos PROBLEMY NAUK BIOLOGICZNYCH. POJEMNOŚCIOWA TEORIA WNIKANIA JONOW WAPNIA DO KOMÓREK NIEPOBUDLIWYCH. FAKTY i HIPOTEZY
 Kosmos PROBLEMY NAUK BIOLOGICZNYCH Tom 46, 1997 Numer 4 (237) Strony 483-489 Polskie Towarzystwo Przyrodników im. Kopernika K r z y s z t o f P r z y b y t e k, R a f a ł C z a j k o w s k i, Pa w e ł
Kosmos PROBLEMY NAUK BIOLOGICZNYCH Tom 46, 1997 Numer 4 (237) Strony 483-489 Polskie Towarzystwo Przyrodników im. Kopernika K r z y s z t o f P r z y b y t e k, R a f a ł C z a j k o w s k i, Pa w e ł
Przemiana materii i energii - Biologia.net.pl
 Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Structure and Charge Density Studies of Pharmaceutical Substances in the Solid State
 Maura Malińska Wydział Chemii, Uniwersytet Warszawski Promotorzy: prof. dr hab. Krzysztof Woźniak, prof. dr hab. Andrzej Kutner Structure and Charge Density Studies of Pharmaceutical Substances in the
Maura Malińska Wydział Chemii, Uniwersytet Warszawski Promotorzy: prof. dr hab. Krzysztof Woźniak, prof. dr hab. Andrzej Kutner Structure and Charge Density Studies of Pharmaceutical Substances in the
MECHANIZMY RUCHÓW KOMÓRKOWYCH - DZIAŁANIE ANESTETYKÓW NA KOMÓRKI
 MECHANIZMY RUCHÓW KOMÓRKOWYCH - DZIAŁANIE ANESTETYKÓW NA KOMÓRKI Zakres materiału, który naleŝy przygotować do ćwiczeń: 1) Budowa błony komórkowej 2) Mechanizm działania anestetyków 3) Aktywność ruchowa
MECHANIZMY RUCHÓW KOMÓRKOWYCH - DZIAŁANIE ANESTETYKÓW NA KOMÓRKI Zakres materiału, który naleŝy przygotować do ćwiczeń: 1) Budowa błony komórkowej 2) Mechanizm działania anestetyków 3) Aktywność ruchowa
THE UNFOLDED PROTEIN RESPONSE
 THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
1 3. N i e u W y w a ć w o d y d o d o g a s z a n i a g r i l l a! R e k o m e n d o w a n y j e s t p i a s e k Z a w s z e u p e w n i ć s i
 M G 4 2 7 v.1 2 0 1 6 G R I L L P R O S T O K Ą T N Y R U C H O M Y 5 2 x 6 0 c m z p o k r y w ą M G 4 2 7 I N S T R U K C J A M O N T A 7 U I B E Z P I E C Z N E G O U 7 Y T K O W A N I A S z a n o w
M G 4 2 7 v.1 2 0 1 6 G R I L L P R O S T O K Ą T N Y R U C H O M Y 5 2 x 6 0 c m z p o k r y w ą M G 4 2 7 I N S T R U K C J A M O N T A 7 U I B E Z P I E C Z N E G O U 7 Y T K O W A N I A S z a n o w
POLSKIE TOWARZYSTWO BIOCHEMICZNE BIOCHEMII tom 19 nr 3 KWARTALNIK PSTBAH 19(3) (1973)
 POLSKIE TOWARZYSTWO BIOCHEMICZNE P O S T Ę P Y BIOCHEMII 1973 tom 19 nr 3 KWARTALNIK PSTBAH 19(3) 341.496 (1973) WSKAZÓWKI DLA AUTORÓW K w artalnik Postępy Biochemii publikuje artykuły przeglądowe z biochemii
POLSKIE TOWARZYSTWO BIOCHEMICZNE P O S T Ę P Y BIOCHEMII 1973 tom 19 nr 3 KWARTALNIK PSTBAH 19(3) 341.496 (1973) WSKAZÓWKI DLA AUTORÓW K w artalnik Postępy Biochemii publikuje artykuły przeglądowe z biochemii
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej)
 PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej) Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt do wykładu
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej) Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt do wykładu
z d n i a 2 3. 0 4.2 0 1 5 r.
 C h o r ą g i e w D o l n o l ą s k a Z H P I. P o s t a n o w i e n i a p o c z ą t k o w e U c h w a ł a n r 1 5 / I X / 2 0 1 5 K o m e n d y C h o r ą g w i D o l n o l ą s k i e j Z H P z d n i a
C h o r ą g i e w D o l n o l ą s k a Z H P I. P o s t a n o w i e n i a p o c z ą t k o w e U c h w a ł a n r 1 5 / I X / 2 0 1 5 K o m e n d y C h o r ą g w i D o l n o l ą s k i e j Z H P z d n i a
Reakcje enzymatyczne. Co to jest enzym? Grupy katalityczne enzymu. Model Michaelisa-Mentena. Hamowanie reakcji enzymatycznych. Reakcje enzymatyczne
 Reakcje enzymatyczne Enzym białko katalizujące reakcje chemiczne w układach biologicznych (przyśpieszają reakcje przynajmniej 0 6 raza) 878, Wilhelm uehne, użył po raz pierwszy określenia enzym (w zaczynie)
Reakcje enzymatyczne Enzym białko katalizujące reakcje chemiczne w układach biologicznych (przyśpieszają reakcje przynajmniej 0 6 raza) 878, Wilhelm uehne, użył po raz pierwszy określenia enzym (w zaczynie)
Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH
 Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą na temat pomiarów elektrofizjologicznych żywych komórek metodą Patch
Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą na temat pomiarów elektrofizjologicznych żywych komórek metodą Patch
Biologiczne mechanizmy zachowania - fizjologia. zajecia 8 :
 Biologiczne mechanizmy zachowania - fizjologia zajecia 8 : 19.11.15 Kontakt: michaladammichalowski@gmail.com https://mmichalowskiuwr.wordpress.com/ I gr 08:30 10:00 II gr 10:15 11:45 III gr 12:00 13:30
Biologiczne mechanizmy zachowania - fizjologia zajecia 8 : 19.11.15 Kontakt: michaladammichalowski@gmail.com https://mmichalowskiuwr.wordpress.com/ I gr 08:30 10:00 II gr 10:15 11:45 III gr 12:00 13:30
Fizjologia czlowieka seminarium + laboratorium. M.Eng. Michal Adam Michalowski
 Fizjologia czlowieka seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
Fizjologia czlowieka seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
Sygnalizacja międzykomórkowa i wewnątrzkomórkowa
 Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem informacji odebranej przez komórkę. Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Receptor cząsteczka chemiczna ( peptyd
Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem informacji odebranej przez komórkę. Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Receptor cząsteczka chemiczna ( peptyd
Fizjologiczne podstawy badań elektrofizjologicznych obwodowego układu nerwowego
 neuroelektrofizjologia Fizjologiczne podstawy badań elektrofizjologicznych obwodowego układu nerwowego Rafał Rola I Klinika Neurologiczna, Instytut Psychiatrii i Neurologii, Warszawa Adres do korespondencji:
neuroelektrofizjologia Fizjologiczne podstawy badań elektrofizjologicznych obwodowego układu nerwowego Rafał Rola I Klinika Neurologiczna, Instytut Psychiatrii i Neurologii, Warszawa Adres do korespondencji:
Sygnalizacja międzykomórkowa i wewnątrzkomórkowa
 Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem
Sygnalizacja międzykomórkowa i wewnątrzkomórkowa Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Informator (przekaźnik) pierwotny czynnik fizyczny lub chemiczny będący nośnikiem
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej
 Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Budowa i rola części czynnej układu ruchu
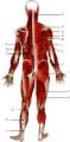 Budowa i rola części czynnej układu ruchu Układ ruchu Ze względu na budowę i właściwości układ ruchu można podzielić na: część czynną układ mięśniowy część bierną układ szkieletowy Dzięki współdziałaniu
Budowa i rola części czynnej układu ruchu Układ ruchu Ze względu na budowę i właściwości układ ruchu można podzielić na: część czynną układ mięśniowy część bierną układ szkieletowy Dzięki współdziałaniu
ATPaza Z BŁON SARKOPLAZMATYCZNEGO RETIKULUM, TRANSPORTUJĄCA JONY WAPNIA AKTYWNY TRANSPORT JONOW. (F illin g a m e 1996), enzymów przypominających
 Kosm os Tom 46, 1997 Numer 1 (234) Strony 105-114 PROBLEMY NAUKBIO LO G ICZNYĆH Polskie Towarzystwo Przyrodników im. Kopernika Panu Profesorowi Lechowi Wojtczakowi z wdzięcznością za wieloletnią współpracę,
Kosm os Tom 46, 1997 Numer 1 (234) Strony 105-114 PROBLEMY NAUKBIO LO G ICZNYĆH Polskie Towarzystwo Przyrodników im. Kopernika Panu Profesorowi Lechowi Wojtczakowi z wdzięcznością za wieloletnią współpracę,
Making the impossible possible: the metamorphosis of Polish Biology Olympiad
 Making the impossible possible: the metamorphosis of Polish Biology Olympiad Takao Ishikawa Faculty of Biology, University of Warsaw, Poland Performance of Polish students at IBO Gold Silver Bronze Merit
Making the impossible possible: the metamorphosis of Polish Biology Olympiad Takao Ishikawa Faculty of Biology, University of Warsaw, Poland Performance of Polish students at IBO Gold Silver Bronze Merit
Gdyńskim Ośrodkiem Sportu i Rekreacji jednostka budżetowa
 W Z Ó R U M O W Y z a w a r t a w G d y n i w d n i u 2 0 1 4 r po m i d z y G d y s k i m O r o d k i e m S p o r t u i R e k r e a c j i j e d n o s t k a b u d e t o w a ( 8 1-5 3 8 G d y n i a ), l
W Z Ó R U M O W Y z a w a r t a w G d y n i w d n i u 2 0 1 4 r po m i d z y G d y s k i m O r o d k i e m S p o r t u i R e k r e a c j i j e d n o s t k a b u d e t o w a ( 8 1-5 3 8 G d y n i a ), l
z d n i a 1 5 m a j a r.
 C h o r ą g i e w D o l n o l ą s k a Z H P D e c y z j a n r 1 4 / I X / 2 0 1 5 K o m e n d a n t a C h o r ą g w i D o l n o 6 l ą s k i e j Z H P z d n i a 1 5 m a j a 2 0 1 5 r. w s p r a w i e g
C h o r ą g i e w D o l n o l ą s k a Z H P D e c y z j a n r 1 4 / I X / 2 0 1 5 K o m e n d a n t a C h o r ą g w i D o l n o 6 l ą s k i e j Z H P z d n i a 1 5 m a j a 2 0 1 5 r. w s p r a w i e g
INHIBICJA KANAŁÓW JONOWYCH POSZUKIWANIE NOWYCH LEKÓW.
 INHIBICJA KANAŁÓW JONOWYCH POSZUKIWANIE NOWYCH LEKÓW. Dariusz Matosiuk Katedra i Zakład Syntezy i Technologii Chemicznej Środków Leczniczych, Wydział Farmaceutyczny z Oddziałem Analityki Medycznej Uniwersytet
INHIBICJA KANAŁÓW JONOWYCH POSZUKIWANIE NOWYCH LEKÓW. Dariusz Matosiuk Katedra i Zakład Syntezy i Technologii Chemicznej Środków Leczniczych, Wydział Farmaceutyczny z Oddziałem Analityki Medycznej Uniwersytet
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI. Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Glikokaliks glikokaliks cytoplazma jądro błona komórkowa Mikrografia elektronowa powierzchni limfocytu ludzkiego (wybarwienie
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Glikokaliks glikokaliks cytoplazma jądro błona komórkowa Mikrografia elektronowa powierzchni limfocytu ludzkiego (wybarwienie
 7 4 / m S t a n d a r d w y m a g a ± û e g z a m i n m i s t r z o w s k i dla zawodu K U C H A R Z * * (dla absolwent¾w szk¾ ponadzasadniczych) K o d z k l a s y f i k a c j i z a w o d ¾ w i s p e c
7 4 / m S t a n d a r d w y m a g a ± û e g z a m i n m i s t r z o w s k i dla zawodu K U C H A R Z * * (dla absolwent¾w szk¾ ponadzasadniczych) K o d z k l a s y f i k a c j i z a w o d ¾ w i s p e c
 2 7k 0 5k 2 0 1 5 S 1 0 0 P a s t w a c z ł o n k o w s k i e - Z a m ó w i e n i e p u b l i c z n e n a u s ł u g- i O g ł o s z e n i e o z a m ó w i e n i u - P r o c e d u r a o t w a r t a P o l
2 7k 0 5k 2 0 1 5 S 1 0 0 P a s t w a c z ł o n k o w s k i e - Z a m ó w i e n i e p u b l i c z n e n a u s ł u g- i O g ł o s z e n i e o z a m ó w i e n i u - P r o c e d u r a o t w a r t a P o l
Organizacja tkanek - narządy
 Organizacja tkanek - narządy Architektura skóry tkanki kręgowców zbiór wielu typów komórek danej tkanki i spoza tej tkanki (wnikają podczas rozwoju lub stale, w trakcie Ŝycia ) neurony komórki glejowe,
Organizacja tkanek - narządy Architektura skóry tkanki kręgowców zbiór wielu typów komórek danej tkanki i spoza tej tkanki (wnikają podczas rozwoju lub stale, w trakcie Ŝycia ) neurony komórki glejowe,
o d ro z m ia r u /p o w y ż e j 1 0 c m d ł c m śr e d n ic y 5 a ) o ś r e d n ic y 2,5 5 c m 5 b ) o śr e d n ic y 5 c m 1 0 c m 8
 T A B E L A O C E N Y P R O C E N T O W E J T R W A Ł E G O U S Z C Z E R B K U N A Z D R O W IU R o d z a j u s z k o d z e ń c ia ła P r o c e n t t r w a łe g o u s z c z e r b k u n a z d r o w iu
T A B E L A O C E N Y P R O C E N T O W E J T R W A Ł E G O U S Z C Z E R B K U N A Z D R O W IU R o d z a j u s z k o d z e ń c ia ła P r o c e n t t r w a łe g o u s z c z e r b k u n a z d r o w iu
