INSTRUKCJA. Badanie i uzdatnianie wody pitnej
|
|
|
- Leszek Mazur
- 7 lat temu
- Przeglądów:
Transkrypt
1 INSTRUKCJA Badanie i uzdatnianie wody pitnej W ramach oferty przedstawionej dla szkół gimnazjalnych oraz ponadgimnazjalnych, zaproponowano wykonanie następujących ćwiczeń z zakresu badania i uzdatniania wody pitnej: Oznaczanie twardości wody przez miareczkowanie i przy pomocy pasków ćwiczenie 1 Usuwanie twardości wody poprzez destylację ćwiczenie 2 Usuwanie twardości wody poprzez zastosowanie wymieniaczy jonowych ćwiczenie 3 Usuwanie (zmniejszanie) twardości wody poprzez stosowanie torfu - ćwiczenie 4 Usuwanie twardości wody metodą chemiczną ćwiczenie 5 Badanie zawartości związków azotu i siarki ćwiczenie 6 Uzdatnianie wody metodami fizycznymi i chemicznymi ćwiczenie 7 Analiza mikrobiolgiczna wody pitnej ćwiczenie 8 Podstawy teoretyczne Rodzaje twardości wody Twardość wody powodują rozpuszczone w niej sole wapnia, magnezu i metali wielowartościowych. Rozróżnia się następujące rodzaje twardości wody twardość węglanowa (T w ) twardość niewęglanowa zwana stałą (T s ) twardość ogólna lub całkowita (T o ) Twardość węglanowa (T w ) zwana też przemijającą spowodowana jest obecnością kwaśnych węglanów wapnia i magnezu. Twardość tę można usunąć przez zagotowanie wody. Ca(HCO 3 ) 2 CaCO 3 + H 2 O + CO 2 Mg(HCO 3 ) 2 MgCO 3 + H 2 O + CO 2 Twardość niewęglanowa (T s ) spowodowana jest zawartością w wodzie chlorków, azotanów, siarczanów, krzemianów i innych rozpuszczalnych soli wapnia i magnezu. Twardość ogólna (T o ) jest sumą twardości węglanowej i niewęglanowej (T o ) = (T w ) + (T s ) Twardość wody wyraża się w następujących jednostkach;
2 w stopniach twardości niemieckich ( o n) i w stopniach francuskich ( o f). Jeden stopień twardości niemiecki ( o n) oznacza ilość jonów wapnia i magnezu równoważną zawartości 10 mg CaO w 1 dm 3 wody. Jeden stopień twardości francuski ( o f) odpowiada ilości jonówa wapnia i magnezu równoważnej zawartości 10 mg CaCO 3 w 1 dm 3 wody. Za pomocą miligramorównoważników wapnia i magnezu w 1000 cm 3 wody: mval/dm 3 lub val/m 3 Twardość wód naturalnych, w zależności od ich pochodzenia, zawiera się w granicach od 8 do 30 stopni niemieckich. Nadmierna twardość wody jest zjawiskiem niepożądanym zarówno w procesach przemysłowych (kotły parowe, układy chłodnicze, przemysł włókienniczy), jak i dla celów konsumcyjnych. Podczas ogrzewania na ściankach garnków, kotłów itp. powstaje kamień kotłowy, który pogarsza przewodnictwo cieplne, co w konsekwencji powoduje straty energetyczne, jak również może być przyczyną poważnych awarii. W gospodarstwie domowym nadmierna twardość wody powoduje większe zużycie środków piorących. W tym wypadku jony wapnia i magnezu wiążą się z resztą kwasu tłuszczowego i wytrącają się w postaci trudno rozpuszczalnych soli wyższych kwasów tłuszczowych. Sposoby obniżania twardości wody 2(C 15 H 31 COO - ) + Ca 2+ (C 15 H 31 COO) 2 Ca(osad) Rozróżniamy cztery podstawowe metody obniżania twardości wody: destylacja metody termiczne metody chemiczne metody fizykochemiczne Destylacja daje pełne odmineralizowanie wody, jednak w przemyśle ze względu na wysokie koszty energii cieplnej rzadko znajduje zastosowanie. Metody termiczne. Pod wpływem ogrzewania powyżej 37 o C następuje termiczny rozpad kwaśnych węglanów wapnia i magnezu. Ca(HCO 3 ) 2 CaCO 3 + H 2 O + CO 2 2Mg(HCO 3 ) 2 Mg 2 CO 3 (OH) 2 + H 2 O + 3CO 2 Mg 2 CO 3 (OH) 2 + H 2 O 2Mg(OH) 2 + CO 2 Metodą tą można usunąć wyłącznie twardość węglanową. Nawet w przypadku braku twardości niewęglanowej pozostaje twardość resztkowa (ok. 2 o n) wskutek częściowej rozpuszczalności wytrąconych węglanów wapnia i magnezu. Metoda termiczna nadaje się do wstępnego zmiękczania wody przed zastosowaniem innych metod. Metody chemiczne polegają na wytrącaniu nierozpuszczalnych osadów lub na wiązaniu w związki kompleksowe jonów wapnia i magnezu: metoda sodowo-wapienna. Wodę zadaje się wapnem gaszonym i sodą. Wapno obniża twardość węglanową (przemijającą). Ca(HCO 3 ) 2 + Ca(OH) 2 2 CaCO 3 (osad) + 2H 2 O Ca(HCO 3 ) 2 + Ca(OH) 2 MgCO 3 (osad) + CaCO 3 (osad) + 2H 2 O MgCO 3 + Ca(OH) 2 Mg(OH) 2 (osad) + CaCO 3 (osad) Powstające podczas zmiękczania nierozpuszczalne węglany wapnia i magnezu w postaci osadów zostają odfiltrowane lub osiadają na dnie zbiornika. Zmiękczanie sodowo-wapienne jest stosunkowo tanie, ale wymaga dużych zbiorników ze względu na powolne opadanie osadów CaCO 3 i MgCO 3. Stosując tę metodę można zmiękczyć wodę do twardości około 2 o n.
3 Metoda fosforanowa. Fosforan trójsodowy reaguje z jonami wapnia i magnezu tworząc nierozpuszczalne fosforany Metody fizykochemiczne. 3Ca Na 3 PO 4 Ca 3 (PO 4 ) 2 (osad) + 6Na + 3Mg Na 3 PO 4 Mg 3 (PO 4 ) 2 (osad) + 6Na + Są to metody oparte głównie na zastosowaniu jonitów. Jonity albo wymieniacze jonowe są to ciała stałe nieorganiczne lub organiczne nierozpuszczalne w wodzie, które mają zdolność wymiany własnych jonów z jonami otaczającego je roztworu. Reakcja przebiega na powierzchni ziaren jonitu. Jonity zdolne do wymiany kationów nazywamy kationitami, a jonity zdolne do wymiany anionów nazywamy anionitami. Kationity wymieniają swe jony wodorowe na kationy metali znajdujące się w wodzie, według reakcji R-A - H + + Me + R-A - Me + + H + gdzie: R - szkielet polimeru, A - - grupa anionowa związana z polimerem (-SO 3 -, -COO - ) W procesie wymiany jonowej rozpuszczone w wodzie jony metali wypierają z kationu jony wodorowe. Jony metali są zatrzymywane na powierzchni ziaren kationitu, a jony wodorowe przechodzą do wody powodując wzrost jej kwasowości. Woda po przejściu przez kationit zostaje wprowadzona na anionit, na którym związane zostają aniony, zgodnie z reakcją; R-B + OH - + A - R-B + A - + OH - gdzie: R - szkielet polimeru, B + - grupa kationowa atomowo związana z polimerem (- NH 3 + ), =NH 2 + ) Znajdujące się w wodzie aniony zatrzymywane są na powierzchni anionitu, a równoważna ilość jonów wodortlenowych OH - przechodzi do wody. Jony te reagują z jonami wodorowymi H +, pochodzącymi z wymiany kationów tworząc cząsteczki wody. Jonity regeneruje się przepuszczając przez kationity dostatecznie stężony roztwór kwasu, a przez anionity roztwór zasady. procesy regeneracji jonitów można opisać równaniami: - kationit R-A - Me + + H + R-A - H + + Me + - anionit R-B + A - + OH - R-A -+ OH - + A - Badanie i zmniejszanie twardości wody Część praktyczna ćwiczeń Ćwiczenie 1 - Oznaczanie twardości wody przez miareczkowanie Otrzymaną do analizy próbkę o objętości 100 ml przenosimy do kolby stożkowej, dodajemy 1 cm 3 buforu amonowego i szczyptę wskaźnika czerni eriochromowej T. Następnie miareczkujemy wersenianem sodu (0,02 molowy roztwór EDTA), aż do zmiany zabarwienia roztworu na niebieską. Zmiana zabarwienia z winno czerwonego na niebieską świadczy o końcu miareczkowania. Pożądane jest posługiwanie się przy miareczkowaniu roztworem porównawczym zawierającym próbkę analizowanej wody o objętości 100 ml, 1 cm 3 buforu amonowego i szczyptę wskaźnika czerni eriochromowej T. Podczas miareczkowania obydwie kolby należy ustawić obok siebie na białej kartce. Pierwszy roztwór jest wzorcem koloru, natomiast drugi roztwór miareczkujemy 0,02 molowym roztworem EDTA do momentu zmiany zabarwienia. Odczytać na biurecie objętość zużytego roztworu wersenianu. Miareczkowanie powtarzamy dwa razy. Następnie należy obliczyć twardość wody wg wzoru Tc = 56 x C m x V, gdzie: V liczba cm 3 roztworu EDTA zużyta podczas miareczkowania, C m stężenie molowe roztworu EDTA.
4 1. Szkło i sprzęt: a. Kolba stożkowa 200 ml, b. Cylinder miarowy c. Biureta, d. Pipety kalibrowane, e. Dozownik. 2. Odczynniki i roztwory: a) wersenian dwusodowy EDTA roztwór 0,02 M, b) bufor amoniakalny, c) czerń eriochromowa T, 3. Kolejność wykonywanych czynności: a. Odmierzyć 100 cm 3 badanej wody. b. Przenieść odmierzoną ilość wody do kolby stożkowej nr 1. c. Dodać 1 cm 3 buforu amonowego i szczyptę wskaźnika czerni eriochromowej T. d. Odmierzyć 100 cm 3 badanej wody. e. Przenieść odmierzoną ilość wody do kolby stożkowej nr 2.
5 f. Dodać 1 cm 3 buforu amonowego i szczyptę wskaźnika czerni eriochromowej T. g. Obydwie kolby stożkowe ustawiamy obok siebie na białej kartce. h. Badaną wodę z kolby stożkowej nr 1 miareczkujemy do momentu zmiany zabarwienia z czerwonego na niebieskie. i. Odczytać na biurecie objętość zużytego roztworu wersenianu. j. Miareczkowanie powtórzyć. k. Obliczyć twardość wody Tc = 56 x C m x V, gdzie: V liczba cm 3 roztworu EDTA zużyta podczas miareczkowania, C m stężenie molowe roztworu EDTA. Oprócz opisanej wyżej metody oznaczania twardości wody przez miareczkowanie, alternatywnie można użyć pasków do oznaczania twardości wody Aquadur. Ćwiczenie 2 - Obniżenie twardości wody przez destylację Demineralizacja wody przez destylację jest najskuteczniejszą metodą. Są to jednak procesy energochłonne i przez to kosztowne. W celu wykonania ćwiczenia budujemy układ do destylacji zgodnie ze schematem zamieszczonym niżej. Przebieg ćwiczenia: Destylujemy 100 ml wody przez minimum 15 min. Następnie w skondensowanym produkcie destylacji wody badamy twardość wody jedną z wyżej podanych metod.
6 Ćwiczenie 3 - Obniżenie twardości wody przez przepuszczenie wody przez kolumnę wypełnioną wypełniaczem Amberlite IR-120 Amberlite IR120 Na - jest żelową kationową żywicą jonowymienną o silnie kwaśnym odczynie. Przeznaczona jest do zmiękczania wody, jak również do jej demineralizacji. Doskonale sprawdza się jako produkt ogólnego zastosowania w uzdatnianiu wody przemysłowej. Przebieg ćwiczenia Sprzęt: cylinder miarowy (250 ml), kolba stożkowa z poliwęglanów (250 ml), kolumna chromatograficzna wypełniona Amberlitem IRA 400, pod żywicą znajduje się warstwa waty szklanej (rys.) Odczynniki: woda z kranu, wymieniacz kationowy (np. Amberlite IR-120, Merck), zestaw odczynników do badania twardości wody ( z ćwiczenia 1). Wykonanie ćwiczenia: Około 20 ml zawiesiny zregenerowanego i neutralnie umytego wymieniacza wlewamy do kolumny. Następnie przez kolumnę przepuszczamy 25 ml wody. Odrzucamy pierwsze 10 ml eluatu i wyłapuje 10 ml. Sprawdzamy wartość ph i następnie badamy twardość wody jedną z wyżej podanych metod. Praktycznie twardość wody powinna być równa zeru. Ćwiczenie 4 - Torf jako naturalny środek obniżający twardość wody Wiele substancji naturalnych posiada właściwości wymieniaczy jonowych. Taką substancją jest torf, ponieważ zachowuje się on jak słabo kwaśny kationit. Oznacza to, że potrafi wychwytywać z wody katony metali powodujących twardość a na ich miejsce wprowadza kationy H+, które następnie reagują z anionami wodorowęglanowymi. Mechanizm działania jest więc dokładnie taki sam jak w przypadku wymieniaczy jonowych. W przypadku torfu oprócz wymiany jonowej można spodziewać się również tzw. kompleksowania. Rozpuszczone w wodzie związki humusowe mogą reagować z kationami wapnia i magnezu powodując ich wiązanie. Mimo, że nie zostają one faktycznie usunięte z wody to zostają w pewnym sensie zablokowane i nie powodują zjawiska twardości wody. Właśnie dlatego duża ilość substancji organicznych może powodować obniżenie twardości wody. Aby potwierdzić fakt, że torf posiada zdolności obniżania twardości wody, wykonamy następujące doświadczenie. Przebieg ćwiczenia Sprzęt: cylinder miarowy (100 ml), kolba stożkowa (250 ml), zlewka (1000 ml), bagietka, lejek. Odczynniki: zestaw odczynników do badania twardości wody ( z ćwiczenia 1). Wykonanie ćwiczenia: Zmieszać umyty torf z wodą z kranu, której twardość została oznaczona wcześniej. Zostawić na minimum godzinę, najlepiej na noc. Torf odfiltrować i jeszcze raz oznaczyć twardość wody.
7 Ćwiczenie 5 - Usuwanie twardości wody metodą chemiczną Zmiękczanie wody metodą chemiczną polega na wykorzystaniu do tego celu substancji zmiękczających, czyli usuwających z środowiska przede wszystkim jony wapnia i magnezu. Do tego celu wykorzystuje się głównie wodorotlenek wapnia Ca(OH) 2 oraz węglan sodu Na 2 CO 3 (soda). W naszym ćwiczeniu do obniżenia twardości wody zastosujemy sodę. Zachodzące reakcje. Przebieg ćwiczenia Ca 2+ + Na 2 CO 3 CaCO 3 (osad) + Na + Mg 2+ + Na 2 CO 3 MgCO 3 (osad) + Na + Sprzęt: cylinder miarowy (100 ml), kolba stożkowa (250 ml), lejek. Odczynniki: woda z kranu, węglan sodu, zestaw odczynników do badania twardości wody ( z ćwiczenia 1). Przebieg ćwiczenia ml wody z kranu wlać do naczynia z tworzywa sztucznego i rozpuścić w nim 2g węglanu sodu. Pozostawić na jeden dzień i przefiltrować osad przez podwójny filtr karbowany. Oznaczyć twardość wody z wykorzystaniem odczynników, jak w ćwiczeniu 1 II Uzdatnianie wody Ćwiczenie 6 - Badanie zawartości związków azotu (jon amonowy, azotany, azotyny) i siarki (siarczany) w wodzie. Jon amonowy, azotany - Badanie zawartości związków azotu ma głównie na celu wykrycie amoniaku NH 3, którego śladowe ilości w wodzie świadczą o zachodzących w niej procesach rozkładu związków organicznych, których ostatecznym produktem jest właśnie amoniak. Powstający amoniak dalej utlenia się dalej do azotanów (III) i azotanów (V) zgodnie z następującym schematem: 2NH HNO 2 + 2H 2 O i dalej 2HNO 2 + O 2 2HNO 3 Często z tego rodzaju zjawiskiem mamy do czynienia na obszarach wiejskich, kiedy do studni wiejskich przesączają się zanieczyszczone wody powierzchniowe lub wody z gnojowiska. Również obecność amoniaku może świadczyć o wypłukiwaniu z gleby nawozów sztucznych (głównie saletry amonowej NH 4 NO 3 ). Siarczany - źródła pochodzenia siarczanów bywają różne. I tak w wodach powierzchniowych głównym ich źródłem są spłukiwane opadami nie przyswojone jeszcze przez glebę i rośliny nawozy sztuczne np.: (NH 4 ) 2 SO 4. Z kolei w wodach głębinowych siarczany(vi) pochodzą zwykle z minerałów rozpuszczonych w czasie wędrówki podziemnej. II Uzdatnianie wody Woda gruntowa wydobywana z głębokiej studni jest zwykle nieszkodliwa dla naszego zdrowia, chociaż w niektórych przypadkach może zawierać niepożądane substancje jak żelazo lub mangan. Woda która zawiera żelazo ma kolor brązowy i ma nieprzyjemny smak. Takie niepożądane substancje są oddzielane w trakcie uzdatniania wody pitnej. W przypadku wód powierzchniowych, pochodzącej z rzek lub jezior musi być ona poddana obszerniejszemu uzdatnianiu. Zależnie od jakości wody stosuje się różne metody oczyszczania. Wśród stosowanych metod wyróżniamy; Mechaniczne oczyszczenie wody, poprzez przepuszczenie jej przez sita i kraty, w celu zatrzymania substancji stałych większych niż 1 milimetr.
8 Dodawanie ozonu Dodawanie ozonu niszczy algi i zabija zarazki, natomiast związki organiczne zostaną rozłożone. Napowietrzanie: Proces ten polega na rozdrobnieniu wody, tym samym poprawiając skuteczność wchłaniania tlenu. Dzięki temu gazy o brzydkim zapachu zawarte w wodzie mogą ulatniać się i proces flokulacji polepsza się. Flokulacja/koagulacja: proces ten polega na dodawaniu do wody środków flokujących (np. ałun, sole żelaza). Powstający osad wiąże zanieczyszczenia, takie jak cząstki gliny, metale ciężkie i mikroorganizmy. Z kolei powstający osad opada (sedymentuje) na dno zbiornika, lub też oddzielany jest od wody w procesie filtracji. Filtrowanie na warstwie węgla aktywnego. Filtry z węgla aktywnego działają jak gąbki i zatrzymują organiczne substancje szkodliwe dla zdrowia. Dezynfekcja: przez dodanie chloru zabijane są zarazki szkodliwe dla zdrowia zawarte w wodzie. Często wodociągi dodają do wody pitnej za dużo chloru i to w taki sposób, że po zabiciu zarazków i oksydacji zostaje trochę wolnego chloru, który zatrzymuje rozwój bakterii w rurach przy transporcie do konsumenta. Stąd przykry zapach chloru pobieranej z kranu. Ćwiczenie 7 - Dezynfekcja chlorem Materiały: pipety jednorazowego użytku, bagietka, zlewka 50 ml, papier kuchenny Odczynniki: używana woda powierzchniowa w kolbach stożkowych z doświadczenia na wietrzenie i koagulację, papier testowy na chlor, roztwór podchlorynu sodu (0,5% aktywnego chloru) Bezpieczeństwo: okulary ochronne Przebieg ćwiczenia: Wlej 30 ml używanej wody powierzchniowej z kolby stożkowej do zlewki. Dodaj 1 kroplę podchlorynu sodu i pomieszaj bagietką. Przetestuj na zawartość chloru kładąc papier testowy na chlor na papierową podkładkę i mocząc krótko bagietkę w próbce wody i wycierając ją na papier testowy. Jeżeli nie ukaże się chlor (papier nie będzie zabarwiony na niebiesko), dodaj jeszcze jedną kroplę roztworu podchlorynu sodu do wody, pomieszaj i przetestuj od nowa dając znowu kroplę na papier testowy na chlor. Zakończ dodawanie podchlorynu sodu, kiedy papier testowy pokaże zawartość chloru (zależnie od koncentracji kolor niebieski lub biały). Woda pitna jest teraz wolna od zarazków Ćwiczenie 8 - Analiza mikrobiologiczna wody pitnej Na ogół w każdym środowisku występują różne mikroorganizmy, do których zaliczamy bakterie, archeony, grzyby, glony. Jednym z takich środowisk jest woda, w której znajdować mogą wymienione mikroorganizmy, a których ilość i rodzaj decyduje o jakości wody. Dlatego koniecznością stało się opracowanie norm określających dopuszczalną zawartość mikroorganizmów w wodzie dostarczanej do celów spożywczych, szczególnie tych mikroorganizmów, które są niebezpieczne dla życia i zdrowia ludzi. W jaki sposób można badać zawartość tego rodzaju mikroorganizmów w wodzie??. Okazuje się, że takie badanie staje się możliwe dopiero wtedy, kiedy uda nam się wyizolować określony gatunek mikroorganizmu. Jest to możliwe dopiero wtedy, kiedy zastosujemy odpowiednie, sprzyjające dla danego gatunku mikroorganizmu podłoża i warunki hodowli (np. temperatura, dostęp tlenu) w których dany rodzaj mikroorganizmu może się rozwijać, a jednocześnie podłoże powinno hamować wzrost innych mikroorganizmów, prowadząc w ten sposób do selektywnego namnażania mikroorganizmu poszukiwanego. Doświadczalnie takie podłoża i warunki hodowli zostały opracowane i mają one praktyczne zastosowanie do uzyskania wzrostu; sinic, promieniowców, innych bakterii oraz grzybów mikroskopowych izolowanych z różnych środowisk naturalnych. Wysiewając ilościowo pobrane próbki na podłoża stałe, można określić liczebność danego rodzaju mikroorganizmów. Liczebność mikroorganizmów można badać, stosując metody bezpośrednie i pośrednie. W metodach bezpośrednich najczęściej liczymy mikroorganizmy pod mikroskopem. Natomiast metody pośrednie polegają na odpowiednim, ilościowym wysiewie badanego materiału na podłoże stałe i uzyskaniu takiej ilości koloni, aby można było je policzyć. Znając liczbę wyrosłych kolonii, objętość wysianej próbki i ewentualne rozcieńczenie materiału, można szacować liczbę żywych mikroorganizmów, zdolnych do
9 tworzenia kolonii przypadających na 1 mililitr czy 1 g badanego środowiska. Dla wody przyjęto następujące wielkości. Wymagania mikrobiologiczne dla wody pitnej i na potrzeby gospodarcze Wskaźniki jakości wody Liczba bakterii grupy coli typu kałowego w 100 ml Liczba bakterii grupy coli w 100 ml Liczba kolonii bakterii na agarze odżywczym po 24h, 37ºC w 1 ml Liczba kolonii bakterii na agarze odżywczym po 72h, 20 C w 1 ml Woda z wodociągów sieciowych dezynfekowana Podawana do sieci W sieci Woda z wodociągów sieciowych niedezynfekowana Podawana do sieci W sieci Woda z wodociągów lokalnych, studni publicznych i studni zakładowych Wskaźniki bakteriologiczne jakości wody do picia Rodzaj oznaczenia Objętość próbki [ml] Dopuszczalna ilość bakterii Escherichia coli lub bakterie grupy coli typu kałowego (termotolerancyjne) Bakterie grupy coli Paciorkowce kałowe Clostridium sp. redukujące siarczyny Ogólna liczba bakterii w temp. 37ºC Ogólna liczba bakterii w temp. 20ºC Do wykrywania i ilościowego oznaczania zawartości bakterii wykorzystuje się płytki Compact Dry firmy NISSUI. Są one odpowiednie do wykrywania oraz liczenia mikroorganizmów żyjących w produktach spożywczych i paszy, kosmetykach i próbkach farmaceutycznych, jak i również do kontroli higieny i kontroli zanieczyszczeń w produkcji artykułów spożywczych. Niżej charakterystyka wybranych rodzajów płytek. CompactDry TC40 - test na ogólną liczbę bakterii, czas inkubacji 48godz. lub 72godz., temperatura 30 C lub 35 C CompactDry EC-40 - test na bakterie E. coli oraz z grupy coli, czas inkubacji 24godz., temperatura 37 C CompactDry YM-40 - test na drożdże i pleśń, czas inkubacji 3-7 dni, temperatura 25 C-30 C
10 Przebieg ćwiczenia: W ćwiczeniu próbki wody pochodzą z następujących miejsc; woda powierzchniowa bez obróbki woda powierzchniowa po obróbce chlorem (doświadczenie 2.2) woda z kranu Zespoły badawcze badają; Grupa 1: Całkowita liczba bakterii (płytka TC40), Grupa 2: Test na bakterie E. coli oraz z grupy coli (płytka EC40), Grupa 3: drożdże i grzyby pleśniowe (płytka YM) Przebieg ćwiczenia; 1. Otwórzcie pokrywkę płytki i wlejcie 1 ml materiału z próbki na środek płytki compact dry. Materiał z próbki automatycznie podlega dyfuzji i równomiernie wypełnia substancję odżywczą oraz w ciągu kilku sekund i przybierają formę żelu. 2. Zamknijcie próbkę pokrywkę i opiszcie na gładkiej powierzchni (próbka, T, imię, data). 3. Odwróćcie zamkniętą płytkę i inkubujcie przy 22 C lub 37 C. Po 24 i 48 godzinach inkubacji przeanalizujcie płytki: policzcie ilość kolorowych kolonii z tylnej strony płytki. Użycie białego papieru jako podkładki ułatwia liczenie.
POLITECHNIKA POZNAŃSKA ZAKŁAD CHEMII FIZYCZNEJ ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
 UZDATNIANIE WODY DO CELÓW PRZEMYSŁOWYCH WSTĘP Woda w czystej postaci (jako H 2 O) nie występuje w przyrodzie. Jest ona zawsze roztworem soli, kwasów i zasad oraz gazów. W pewnych przypadkach ilość substancji
UZDATNIANIE WODY DO CELÓW PRZEMYSŁOWYCH WSTĘP Woda w czystej postaci (jako H 2 O) nie występuje w przyrodzie. Jest ona zawsze roztworem soli, kwasów i zasad oraz gazów. W pewnych przypadkach ilość substancji
WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY
 WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY Instrukcja przygotowana w Pracowni Dydaktyki Chemii Zakładu Fizykochemii Roztworów. 1. Zanieczyszczenie wody. Polska nie należy do krajów posiadających znaczne
WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY Instrukcja przygotowana w Pracowni Dydaktyki Chemii Zakładu Fizykochemii Roztworów. 1. Zanieczyszczenie wody. Polska nie należy do krajów posiadających znaczne
TWARDOŚĆ WODY. Ca(HCO 3 ) HCl = CaCl 2 + 2H 2 O + 2CO 2. Mg(HCO 3 ) 2 + 2HCl = MgCl 2 + 2H 2 O + 2CO 2
 TWARDOŚĆ WODY Ćwiczenie 1. Oznaczanie twardości przemijającej wody wodociągowej Oznaczenie twardości przemijającej wody polega na miareczkowaniu określonej ilości badanej wody roztworem kwasu solnego o
TWARDOŚĆ WODY Ćwiczenie 1. Oznaczanie twardości przemijającej wody wodociągowej Oznaczenie twardości przemijającej wody polega na miareczkowaniu określonej ilości badanej wody roztworem kwasu solnego o
PROCESY JEDNOSTKOWE W TECHNOLOGIACH ŚRODOWISKOWYCH WYMIANA JONOWA
 KIiChŚ PROCESY JEDNOSTKOWE W TECHNOLOGIACH ŚRODOWISKOWYCH Ćwiczenie nr 2 WYMIANA JONOWA Cel ćwiczenia Celem ćwiczenia jest określenie roboczej zdolności wymiennej jonitu na podstawie eksperymentalnie wyznaczonej
KIiChŚ PROCESY JEDNOSTKOWE W TECHNOLOGIACH ŚRODOWISKOWYCH Ćwiczenie nr 2 WYMIANA JONOWA Cel ćwiczenia Celem ćwiczenia jest określenie roboczej zdolności wymiennej jonitu na podstawie eksperymentalnie wyznaczonej
OZNACZANIE TWARDOŚCI WODY SPOSOBEM WARTHA - PFEIFERA
 OZNACZANIE TWARDOŚCI WODY SPOSOBEM WARTHA - PFEIFERA WSTĘP RODZAJE TWARDOŚCI WODY Twardość wody jest jej właściwością wynikającą z obecności rozpuszczonych w niej związków, głównie wapnia i magnezu. Pierwotnie
OZNACZANIE TWARDOŚCI WODY SPOSOBEM WARTHA - PFEIFERA WSTĘP RODZAJE TWARDOŚCI WODY Twardość wody jest jej właściwością wynikającą z obecności rozpuszczonych w niej związków, głównie wapnia i magnezu. Pierwotnie
Spis treści. Wstęp. Twardość wody
 Spis treści 1 Wstęp 1.1 Twardość wody 1.2 Oznaczanie twardości wody 1.3 Oznaczanie utlenialności 1.4 Oznaczanie jonów metali 2 Część doświadczalna 2.1 Cel ćwiczenia 2.2 Zagadnienia do przygotowania 2.3
Spis treści 1 Wstęp 1.1 Twardość wody 1.2 Oznaczanie twardości wody 1.3 Oznaczanie utlenialności 1.4 Oznaczanie jonów metali 2 Część doświadczalna 2.1 Cel ćwiczenia 2.2 Zagadnienia do przygotowania 2.3
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Wyznaczanie parametrów kolektywnych układu
 Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Wyznaczanie parametrów kolektywnych układu Oznaczanie twardości wody metodą kompleksometryczną Wstęp
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Wyznaczanie parametrów kolektywnych układu Oznaczanie twardości wody metodą kompleksometryczną Wstęp
VI. ZMIĘKCZANIE WODY METODĄ JONOWYMIENNĄ
 I. ZMIĘKCZANIE WODY METODĄ JONOWYMIENNĄ LITERATURA 1. Akty prawne: Aktualne rozporządzenie dotyczące jakości wody do picia i na potrzeby gospodarcze. 2. Chojnacki A.: Technologia wody i ścieków. PWN, Warszawa
I. ZMIĘKCZANIE WODY METODĄ JONOWYMIENNĄ LITERATURA 1. Akty prawne: Aktualne rozporządzenie dotyczące jakości wody do picia i na potrzeby gospodarcze. 2. Chojnacki A.: Technologia wody i ścieków. PWN, Warszawa
ĆWICZENIE 4. Oczyszczanie ścieków ze związków fosforu
 ĆWICZENIE 4 Oczyszczanie ścieków ze związków fosforu 1. Wprowadzenie Zbyt wysokie stężenia fosforu w wodach powierzchniowych stojących, spiętrzonych lub wolno płynących prowadzą do zwiększonego przyrostu
ĆWICZENIE 4 Oczyszczanie ścieków ze związków fosforu 1. Wprowadzenie Zbyt wysokie stężenia fosforu w wodach powierzchniowych stojących, spiętrzonych lub wolno płynących prowadzą do zwiększonego przyrostu
USUWANIE TWARDOŚCI WAPNIOWEJ W PROCESIE WYMIANY JONOWEJ
 USUWANIE TWARDOŚCI WAPNIOWEJ W PROCESIE WYMIANY JONOWEJ Aktualizacja 02.03.2012r. 1. Ogólna charakterystyka procesu. Jonity (wymieniacze jonowe, sorbenty jonowymienne) to wielkocząsteczkowe ciała stałe
USUWANIE TWARDOŚCI WAPNIOWEJ W PROCESIE WYMIANY JONOWEJ Aktualizacja 02.03.2012r. 1. Ogólna charakterystyka procesu. Jonity (wymieniacze jonowe, sorbenty jonowymienne) to wielkocząsteczkowe ciała stałe
BADANIE WŁAŚCIWOŚCI FIZYKOCHEMICZNYCH WODY
 ĆWICZENIE NR 1 BADANIE WŁAŚCIWOŚCI FIZYKOCHEMICZNYCH WODY Cel ćwiczenia Poznanie wybranych metod oznaczania własności wody. Zakres wymaganych wiadomości 1. Własności fizykochemiczne wody. 2. Równanie Nernsta,
ĆWICZENIE NR 1 BADANIE WŁAŚCIWOŚCI FIZYKOCHEMICZNYCH WODY Cel ćwiczenia Poznanie wybranych metod oznaczania własności wody. Zakres wymaganych wiadomości 1. Własności fizykochemiczne wody. 2. Równanie Nernsta,
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 5
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 5 Kompleksometryczne oznaczanie twardości wody w próbce rzeczywistej oraz mleczanu wapnia w preparacie farmaceutycznym Ćwiczenie
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 5 Kompleksometryczne oznaczanie twardości wody w próbce rzeczywistej oraz mleczanu wapnia w preparacie farmaceutycznym Ćwiczenie
1. Regulamin bezpieczeństwa i higieny pracy... 10 2. Pierwsza pomoc w nagłych wypadkach... 12 Literatura... 12
 Spis treści III. Wstęp... 9 III. Zasady porządkowe w pracowni technologicznej... 10 1. Regulamin bezpieczeństwa i higieny pracy... 10 2. Pierwsza pomoc w nagłych wypadkach... 12 Literatura... 12 III. Wskaźniki
Spis treści III. Wstęp... 9 III. Zasady porządkowe w pracowni technologicznej... 10 1. Regulamin bezpieczeństwa i higieny pracy... 10 2. Pierwsza pomoc w nagłych wypadkach... 12 Literatura... 12 III. Wskaźniki
DEZYNFEKCJA WODY CHLOROWANIE DO PUNKTU
 DEZYNFEKCJA WODY CHLOROWANIE DO PUNKTU PRZEŁAMANIA WPROWADZENIE Ostatnim etapem uzdatniania wody w procesie technologicznym dla potrzeb ludności i przemysłu jest dezynfekcja. Proces ten jest niezbędny
DEZYNFEKCJA WODY CHLOROWANIE DO PUNKTU PRZEŁAMANIA WPROWADZENIE Ostatnim etapem uzdatniania wody w procesie technologicznym dla potrzeb ludności i przemysłu jest dezynfekcja. Proces ten jest niezbędny
ZMIĘKCZANIE WODY NA KATIONICIE SODOWYM.
 ZMIĘKCZANIE WODY NA KATIONICIE SODOWYM. 1. WPROWADZENIE Jonity są to ciała stałe, nierozpuszczalne w wodzie, które wykazują zdolność wymiany jonów wchodzących w ich skład na jony zawarte w roztworze wodnym.
ZMIĘKCZANIE WODY NA KATIONICIE SODOWYM. 1. WPROWADZENIE Jonity są to ciała stałe, nierozpuszczalne w wodzie, które wykazują zdolność wymiany jonów wchodzących w ich skład na jony zawarte w roztworze wodnym.
ĆWICZENIE 7 WSPÓŁOZNACZANIE WAPNIA I MAGNEZU I OBLICZANIE TWARDOŚCI WODY. DZIAŁ: Kompleksometria
 ĆWICZENIE 7 WSPÓŁOZNACZANIE WAPNIA I MAGNEZU I OBLICZANIE TWARDOŚCI WODY DZIAŁ: Kompleksometria ZAGADNIENIA Stała trwałości i nietrwałości kompleksów. Rodzaje kompleksów i przykłady EDTA Wskaźniki w kompleksometrii
ĆWICZENIE 7 WSPÓŁOZNACZANIE WAPNIA I MAGNEZU I OBLICZANIE TWARDOŚCI WODY DZIAŁ: Kompleksometria ZAGADNIENIA Stała trwałości i nietrwałości kompleksów. Rodzaje kompleksów i przykłady EDTA Wskaźniki w kompleksometrii
Zakład Inżynierii Środowiska Wydział Chemii UG - Ćwiczenia Laboratoryjne z Inżynierii Środowiska. Ćwiczenie 6. Dekarbonizacja wody DEKARBONIZACJA WODY
 DEKARBONIZACJA WODY Dekarbonizacja jest to proces polegający na usunięciu z wody lub zmniejszeniu twardości węglanowej. Zmniejszenie twardości węglanowej uzyskuje się przez dekarbonizację: - termiczną;
DEKARBONIZACJA WODY Dekarbonizacja jest to proces polegający na usunięciu z wody lub zmniejszeniu twardości węglanowej. Zmniejszenie twardości węglanowej uzyskuje się przez dekarbonizację: - termiczną;
POLITECHNIKA WROCŁAWSKA INSTYTUT TECHNOLOGII NIEORGANICZNEJ I NAWOZÓW MINERALNYCH. Ćwiczenie nr 6. Adam Pawełczyk
 POLITECHNIKA WROCŁAWSKA INSTYTUT TECHNOLOGII NIEORGANICZNEJ I NAWOZÓW MINERALNYCH Ćwiczenie nr 6 Adam Pawełczyk Instrukcja do ćwiczeń laboratoryjnych USUWANIE SUBSTANCJI POŻYWKOWYCH ZE ŚCIEKÓW PRZEMYSŁOWYCH
POLITECHNIKA WROCŁAWSKA INSTYTUT TECHNOLOGII NIEORGANICZNEJ I NAWOZÓW MINERALNYCH Ćwiczenie nr 6 Adam Pawełczyk Instrukcja do ćwiczeń laboratoryjnych USUWANIE SUBSTANCJI POŻYWKOWYCH ZE ŚCIEKÓW PRZEMYSŁOWYCH
Inżynieria Środowiska S1. Chemia zajęcia laboratoryjne. Badanie fizykochemiczne wody
 Zasadowość wody Właściwością wody, którą określa się jako zasadowość, jest zdolność do zobojętniania kwasów mineralnych w określonych warunkach. Właściwość tę nadają wodzie obecne w niej wodorowęglany
Zasadowość wody Właściwością wody, którą określa się jako zasadowość, jest zdolność do zobojętniania kwasów mineralnych w określonych warunkach. Właściwość tę nadają wodzie obecne w niej wodorowęglany
Zrównoważony rozwój przemysłowych procesów pralniczych. Moduł 1 Zastosowanie wody. Rozdział 3b. Zmiękczanie wody
 Projekt Leonardo da Vinci Zrównoważony rozwój przemysłowych procesów pralniczych Moduł 1 Zastosowanie wody Rozdział 3b Zmiękczanie wody Moduł 1 Zastosowanie wody Rozdział 3 Zmiękczanie wody 1 Treść Twardość
Projekt Leonardo da Vinci Zrównoważony rozwój przemysłowych procesów pralniczych Moduł 1 Zastosowanie wody Rozdział 3b Zmiękczanie wody Moduł 1 Zastosowanie wody Rozdział 3 Zmiękczanie wody 1 Treść Twardość
Jerzy Masełko WODA WPROWADZENIE. 1. Właściwości fizyczne i chemiczne wody
 Jerzy Masełko WODA WPROWADZENIE 1. Właściwości fizyczne i chemiczne wody Woda jest jednym z najbardziej rozpowszechnionych związków chemicznych w przyrodzie. Woda ma interesujące anomalia o dużym znaczeniu
Jerzy Masełko WODA WPROWADZENIE 1. Właściwości fizyczne i chemiczne wody Woda jest jednym z najbardziej rozpowszechnionych związków chemicznych w przyrodzie. Woda ma interesujące anomalia o dużym znaczeniu
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 7
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
Wykaz badań prowadzonych przez laboratorium - woda
 1 Temperatura 0 50 0 C (pomiar bezpośredni) 2 Chlor wolny 0,03 2,00 mg/l 0,02 2,00 mg/l 3 Mętność 0,10-1000 NTU (metoda nefelometryczna) 4 Barwa 5-70 mg/l Pt (metoda wizualna) 5 Zapach (metoda organoleptyczna)
1 Temperatura 0 50 0 C (pomiar bezpośredni) 2 Chlor wolny 0,03 2,00 mg/l 0,02 2,00 mg/l 3 Mętność 0,10-1000 NTU (metoda nefelometryczna) 4 Barwa 5-70 mg/l Pt (metoda wizualna) 5 Zapach (metoda organoleptyczna)
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
K1. KONDUKTOMETRYCZNE MIARECZKOWANIE STRĄCENIOWE I KOMPLEKSOMETRYCZNE
 K1. KONDUKTOMETRYCZNE MIARECZKOWANIE STRĄCENIOWE I KOMPLEKSOMETRYCZNE Postępowanie analityczne, znane pod nazwą miareczkowania konduktometrycznego, polega na wyznaczeniu punktu końcowego miareczkowania
K1. KONDUKTOMETRYCZNE MIARECZKOWANIE STRĄCENIOWE I KOMPLEKSOMETRYCZNE Postępowanie analityczne, znane pod nazwą miareczkowania konduktometrycznego, polega na wyznaczeniu punktu końcowego miareczkowania
Analiza ilościowa. Kompleksometria Opracowanie: mgr inż. Przemysław Krawczyk
 Analiza ilościowa. Kompleksometria Opracowanie: mgr inż. Przemysław Krawczyk Kompleksometria to dział objętościowej analizy ilościowej, w którym wykorzystuje się reakcje tworzenia związków kompleksowych.
Analiza ilościowa. Kompleksometria Opracowanie: mgr inż. Przemysław Krawczyk Kompleksometria to dział objętościowej analizy ilościowej, w którym wykorzystuje się reakcje tworzenia związków kompleksowych.
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA
 Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
KWASY I WODOROTLENKI. 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to:
 KWASY I WODOROTLENKI 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to: 1. kwas siarkowy (IV), kwas siarkowy (VI), kwas azotowy, 2. kwas siarkowy (VI), kwas siarkowy (IV), kwas azotowy (V), 3. kwas siarkowodorowy,
KWASY I WODOROTLENKI 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to: 1. kwas siarkowy (IV), kwas siarkowy (VI), kwas azotowy, 2. kwas siarkowy (VI), kwas siarkowy (IV), kwas azotowy (V), 3. kwas siarkowodorowy,
- Chemia w kosmetologii dla liceum - Surowce kosmetyczne - Ćwiczenie 2. Temat: Woda jako surowiec kosmetyczny. Oznaczanie twardości wody.
 Ćwiczenie 2 Temat: Woda jako surowiec kosmetyczny. Oznaczanie twardości wody. Cel ćwiczenia: Poznanie wymagań przemysłu kosmetycznego w stosunku do wody oraz metod badania jej jakości. Zaznajomienie z
Ćwiczenie 2 Temat: Woda jako surowiec kosmetyczny. Oznaczanie twardości wody. Cel ćwiczenia: Poznanie wymagań przemysłu kosmetycznego w stosunku do wody oraz metod badania jej jakości. Zaznajomienie z
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
OZNACZANIE WŁAŚCIWOŚCI BUFOROWYCH WÓD
 OZNACZANIE WŁAŚCIWOŚCI BUFOROWYCH WÓD POWIERZCHNIOWYCH WPROWADZENIE Właściwości chemiczne wód występujących w przyrodzie odznaczają się dużym zróżnicowaniem. Zależą one między innymi od budowy geologicznej
OZNACZANIE WŁAŚCIWOŚCI BUFOROWYCH WÓD POWIERZCHNIOWYCH WPROWADZENIE Właściwości chemiczne wód występujących w przyrodzie odznaczają się dużym zróżnicowaniem. Zależą one między innymi od budowy geologicznej
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA
 Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA
 Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
Układ graficzny CKE 2016 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Przygotowywanie
GOSPODARKA ODPADAMI. Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów
 GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW.
 RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW. Zagadnienia: Zjawisko dysocjacji: stała i stopień dysocjacji Elektrolity słabe i mocne Efekt wspólnego jonu Reakcje strącania osadów Iloczyn rozpuszczalności Odczynnik
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW. Zagadnienia: Zjawisko dysocjacji: stała i stopień dysocjacji Elektrolity słabe i mocne Efekt wspólnego jonu Reakcje strącania osadów Iloczyn rozpuszczalności Odczynnik
ANALIZA OBJĘTOŚCIOWA
 Metoda Mohra Kolba miarowa Na Substancja podstawowa: (Na), M = 58,5 g mol 1 Pipeta Naczyńko wagowe c Na M m Na Na kolby ETAPY OZNACZENIA ARGENTOMETRYCZNEGO 1. Przygotowanie roztworu substancji podstawowej
Metoda Mohra Kolba miarowa Na Substancja podstawowa: (Na), M = 58,5 g mol 1 Pipeta Naczyńko wagowe c Na M m Na Na kolby ETAPY OZNACZENIA ARGENTOMETRYCZNEGO 1. Przygotowanie roztworu substancji podstawowej
Wapń i jego związki. -występowanie i otrzymywanie -właściwości fizyczne i chemiczne - ważniejsze związki wapnia
 Wapń i jego związki -występowanie i otrzymywanie -właściwości fizyczne i chemiczne - ważniejsze związki wapnia Wapń występowanie Występowanie: występuje wyłącznie w postaci związanej CaCO 3 w minerałachkalcyt,
Wapń i jego związki -występowanie i otrzymywanie -właściwości fizyczne i chemiczne - ważniejsze związki wapnia Wapń występowanie Występowanie: występuje wyłącznie w postaci związanej CaCO 3 w minerałachkalcyt,
WYKAZ METOD STOSOWANYCH W LABORATORIUM WODY I ŚCIEKÓW ZWIK SKAWINA
 WYKAZ METOD TOOWANYCH W LABOATOIUM WODY I ŚCIEKÓW ZWIK KAWINA BADANA CECHA, ZAKE OZNACZENIA, NOMA, INNY DOKUMENT NOMATYWNY LUB WŁANA TATU Ścieki Powietrze, ścieki Pobieranie próbek wód do badań fizycznych
WYKAZ METOD TOOWANYCH W LABOATOIUM WODY I ŚCIEKÓW ZWIK KAWINA BADANA CECHA, ZAKE OZNACZENIA, NOMA, INNY DOKUMENT NOMATYWNY LUB WŁANA TATU Ścieki Powietrze, ścieki Pobieranie próbek wód do badań fizycznych
ĆWICZENIE 2. Usuwanie chromu (VI) z zastosowaniem wymieniaczy jonowych
 ĆWICZENIE 2 Usuwanie chromu (VI) z zastosowaniem wymieniaczy jonowych Część doświadczalna 1. Metody jonowymienne Do usuwania chromu (VI) można stosować między innymi wymieniacze jonowe. W wyniku przepuszczania
ĆWICZENIE 2 Usuwanie chromu (VI) z zastosowaniem wymieniaczy jonowych Część doświadczalna 1. Metody jonowymienne Do usuwania chromu (VI) można stosować między innymi wymieniacze jonowe. W wyniku przepuszczania
Twardość wody. Tw og = Tw w + Tw n
 Twardość wody Opracowanie: dr Jadwiga Zawada, dr Urszula Lelek-Borkowska CZĘŚĆ TEORETYCZNA 1. Twardość wody. Obecność w wodzie rozpuszczalnych soli wapniowych i magnezowych powoduje tzw. twardość wody.
Twardość wody Opracowanie: dr Jadwiga Zawada, dr Urszula Lelek-Borkowska CZĘŚĆ TEORETYCZNA 1. Twardość wody. Obecność w wodzie rozpuszczalnych soli wapniowych i magnezowych powoduje tzw. twardość wody.
GOSPODARKA ODPADAMI. Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów
 GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE: Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE: Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 814
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 814 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 10 Data wydania: 17 sierpnia 2016 r. AB 814 Nazwa i adres PRZEDSIĘBIORSTWO
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 814 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 10 Data wydania: 17 sierpnia 2016 r. AB 814 Nazwa i adres PRZEDSIĘBIORSTWO
SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI
 Data.. Imię, nazwisko, kierunek, grupa SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI OCENA JAKOŚCI WODY DO PICIA Ćwiczenie 1. Badanie właściwości fizykochemicznych wody Ćwiczenie
Data.. Imię, nazwisko, kierunek, grupa SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI OCENA JAKOŚCI WODY DO PICIA Ćwiczenie 1. Badanie właściwości fizykochemicznych wody Ćwiczenie
8. MANGANOMETRIA. 8. Manganometria
 8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
INŻYNIERIA PROCESÓW CHEMICZNYCH
 INŻYNIERIA PROCESÓW CHEMICZNYCH PLAN ĆWICZEŃ LABORATORYJNYCH z CHEMII ANALITYCZNEJ 1. Alkacymetria Oznaczanie kwasowości ogólnej wody 2. Redoksymetria Redoksymetryczne oznaczania miedzi. 3. Kompleksometria
INŻYNIERIA PROCESÓW CHEMICZNYCH PLAN ĆWICZEŃ LABORATORYJNYCH z CHEMII ANALITYCZNEJ 1. Alkacymetria Oznaczanie kwasowości ogólnej wody 2. Redoksymetria Redoksymetryczne oznaczania miedzi. 3. Kompleksometria
Litowce i berylowce- lekcja powtórzeniowa, doświadczalna.
 Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
profesjonalne, kompleksowe opomiarowanie i rozliczanie mediów dostarczanych do Twojego lokalu
 BIAŁYSTOK GDAŃSK WARSZAWA ul. Świętojańska 6 ul. Fieldorfa 10/3 tel. 533 025 696 tel. /85/ 654 67 53 tel. /58/ 710 05 98 profesjonalne, kompleksowe opomiarowanie i rozliczanie mediów dostarczanych do Twojego
BIAŁYSTOK GDAŃSK WARSZAWA ul. Świętojańska 6 ul. Fieldorfa 10/3 tel. 533 025 696 tel. /85/ 654 67 53 tel. /58/ 710 05 98 profesjonalne, kompleksowe opomiarowanie i rozliczanie mediów dostarczanych do Twojego
Precypitometria przykłady zadań
 Precypitometria przykłady zadań 1. Moneta srebrna o masie 05000 g i zawartości 9000% srebra jest analizowana metodą Volharda. Jakie powinno być graniczne stężenie molowe roztworu KSCN aby w miareczkowaniu
Precypitometria przykłady zadań 1. Moneta srebrna o masie 05000 g i zawartości 9000% srebra jest analizowana metodą Volharda. Jakie powinno być graniczne stężenie molowe roztworu KSCN aby w miareczkowaniu
Właściwości wód podziemnych
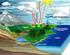 Właściwości wód podziemnych Właściwości fizyczne i organoleptyczne wód podziemnych: Temperatura Przeźroczystość. Mętność, Barwa, Radoczynność, Smak, Zapach. Skład chemiczny wód podziemnych zależy od rodzaju
Właściwości wód podziemnych Właściwości fizyczne i organoleptyczne wód podziemnych: Temperatura Przeźroczystość. Mętność, Barwa, Radoczynność, Smak, Zapach. Skład chemiczny wód podziemnych zależy od rodzaju
ZAKRES: AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1214
 ZAKRES: AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1214 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 10 Data wydania: 11 maja 2018 r. Nazwa i adres AB 1214 MIEJSKIE
ZAKRES: AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1214 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 10 Data wydania: 11 maja 2018 r. Nazwa i adres AB 1214 MIEJSKIE
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
PODSTAWY STECHIOMETRII
 PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 814
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 814 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 9 Data wydania: 20 kwietnia 2015 r. AB 814 Nazwa i adres PRZEDSIĘBIORSTWO
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 814 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 9 Data wydania: 20 kwietnia 2015 r. AB 814 Nazwa i adres PRZEDSIĘBIORSTWO
KLASA II Dział 6. WODOROTLENKI A ZASADY
 KLASA II Dział 6. WODOROTLENKI A ZASADY Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą definiuje wskaźnik; wyjaśnia pojęcie: wodorotlenek; wskazuje metale aktywne i mniej aktywne; wymienia
KLASA II Dział 6. WODOROTLENKI A ZASADY Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą definiuje wskaźnik; wyjaśnia pojęcie: wodorotlenek; wskazuje metale aktywne i mniej aktywne; wymienia
TECHNOLOGIA OCZYSZCZANIA WÓD I ŚCIEKÓW. laboratorium Wydział Chemiczny, Studia Niestacjonarne II
 TECHNOLOGIA OCZYSZCZANIA WÓD I ŚCIEKÓW. laboratorium Wydział Chemiczny, Studia Niestacjonarne II opracowała dr inż. Dorota Jermakowicz-Bartkowiak Wymiana jonowa w podstawowych procesach technologicznych
TECHNOLOGIA OCZYSZCZANIA WÓD I ŚCIEKÓW. laboratorium Wydział Chemiczny, Studia Niestacjonarne II opracowała dr inż. Dorota Jermakowicz-Bartkowiak Wymiana jonowa w podstawowych procesach technologicznych
Instrukcja laboratorium z ochrony środowiska. Temat ćwiczenia. Oznaczanie wybranych wskaźników zanieczyszczenia wód
 Instrukcja laboratorium z ochrony środowiska Temat ćwiczenia. Oznaczanie wybranych wskaźników zanieczyszczenia wód Cel ćwiczenia Ćwiczenie ma za zadanie zapoznanie się z wybranymi metodami określania wskaźników
Instrukcja laboratorium z ochrony środowiska Temat ćwiczenia. Oznaczanie wybranych wskaźników zanieczyszczenia wód Cel ćwiczenia Ćwiczenie ma za zadanie zapoznanie się z wybranymi metodami określania wskaźników
10. ALKACYMETRIA. 10. Alkacymetria
 10. ALKACYMETRIA 53 10. Alkacymetria 10.1. Ile cm 3 40 % roztworu NaOH o gęstości 1,44 g cm 3 należy zużyć w celu przygotowania 1,50 dm 3 roztworu o stężeniu 0,20 mol dm 3? Odp. 20,8 cm 3 10.2. 20,0 cm
10. ALKACYMETRIA 53 10. Alkacymetria 10.1. Ile cm 3 40 % roztworu NaOH o gęstości 1,44 g cm 3 należy zużyć w celu przygotowania 1,50 dm 3 roztworu o stężeniu 0,20 mol dm 3? Odp. 20,8 cm 3 10.2. 20,0 cm
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1651
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1651 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 2 Data wydania: 30 lipca 2018 r. Nazwa i adres LABSTAR MATEUSZ
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1651 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 2 Data wydania: 30 lipca 2018 r. Nazwa i adres LABSTAR MATEUSZ
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Zakres badań wykonywanych w Laboratorium Środowiskowym.
 Zakres badań wykonywanych w Laboratorium Środowiskowym. L.p. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Badany obiekt woda woda do spożycia przez ludzi Badana cecha / metoda badawcza Barwa rzeczywista Zakres:
Zakres badań wykonywanych w Laboratorium Środowiskowym. L.p. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Badany obiekt woda woda do spożycia przez ludzi Badana cecha / metoda badawcza Barwa rzeczywista Zakres:
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
Opracowały: Pod kierunkiem
 PROGRAM ZAJĘĆ POZALEKCYJNYCH Z CHEMII Opracowały: Monika Górska - PG 31 Marzanna Rutkowska - PG 7 Barbara Wawrusiewicz - PG 20 Pod kierunkiem P. Izabeli Popławskiej Białystok, maj 2007 r. Program zajęć
PROGRAM ZAJĘĆ POZALEKCYJNYCH Z CHEMII Opracowały: Monika Górska - PG 31 Marzanna Rutkowska - PG 7 Barbara Wawrusiewicz - PG 20 Pod kierunkiem P. Izabeli Popławskiej Białystok, maj 2007 r. Program zajęć
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1099
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1099 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 11 Data wydania: 7 września 2018 r. AB 1099 Kod identyfikacji
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1099 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 11 Data wydania: 7 września 2018 r. AB 1099 Kod identyfikacji
2.4. ZADANIA STECHIOMETRIA. 1. Ile moli stanowi:
 2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana. Argentometryczne oznaczanie chlorków w mydłach
 Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Argentometryczne oznaczanie chlorków w mydłach Ćwiczenie obejmuje: 1. Oznaczenie miana roztworu AgNO
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Argentometryczne oznaczanie chlorków w mydłach Ćwiczenie obejmuje: 1. Oznaczenie miana roztworu AgNO
WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE II gimnazjum
 WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE II gimnazjum Program nauczania chemii w gimnazjum autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy
WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE II gimnazjum Program nauczania chemii w gimnazjum autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy
Spis treści. Wstęp... 9
 Spis treści Wstęp... 9 1. Szkło i sprzęt laboratoryjny 1.1. Szkła laboratoryjne własności, skład chemiczny, podział, zastosowanie.. 11 1.2. Wybrane szkło laboratoryjne... 13 1.3. Szkło miarowe... 14 1.4.
Spis treści Wstęp... 9 1. Szkło i sprzęt laboratoryjny 1.1. Szkła laboratoryjne własności, skład chemiczny, podział, zastosowanie.. 11 1.2. Wybrane szkło laboratoryjne... 13 1.3. Szkło miarowe... 14 1.4.
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1006
 PCA Zakres akredytacji Nr AB 908 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1006 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 5 Data wydania: 26 lutego
PCA Zakres akredytacji Nr AB 908 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1006 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 5 Data wydania: 26 lutego
OBLICZANIE WYNIKÓW ANALIZ I
 OBLICZANIE WYNIKÓW ANALIZ I 1. Ile gramów zasady sodowej zawiera próbka roztworu, jeżeli na jej zmiareczkowanie zużywa się średnio 53,24ml roztworu HCl o stężeniu 0,1015mol/l? M (NaOH) - 40,00 2. Ile gramów
OBLICZANIE WYNIKÓW ANALIZ I 1. Ile gramów zasady sodowej zawiera próbka roztworu, jeżeli na jej zmiareczkowanie zużywa się średnio 53,24ml roztworu HCl o stężeniu 0,1015mol/l? M (NaOH) - 40,00 2. Ile gramów
- Metody analityczne w przemyśle kosmetycznym -
 - Metody analityczne w przemyśle kosmetycznym - Ćwiczenie 1 Temat: Związki powierzchniowo czynne. Oznaczanie trwałości w twardej wodzie. Cel ćwiczenia: Zapoznanie ze sposobami oceny trwałości łatwo rozpuszczalnych
- Metody analityczne w przemyśle kosmetycznym - Ćwiczenie 1 Temat: Związki powierzchniowo czynne. Oznaczanie trwałości w twardej wodzie. Cel ćwiczenia: Zapoznanie ze sposobami oceny trwałości łatwo rozpuszczalnych
Technologia Wody. Zmiękczanie wody. Wykład 12(6) Politechnika Koszalińska Wydział Budownictwa i Inżynierii Środowiska Studia Zaoczne, 4 rok
 Technologia Wody Wykład 12(6) Zmiękczanie wody Politechnika Koszalińska Wydział Budownictwa i Inżynierii Środowiska Studia Zaoczne, 4 rok Zużycie Wody w Polsce Przeznaczenie Zużycie w latach (hm 3 ) 1988
Technologia Wody Wykład 12(6) Zmiękczanie wody Politechnika Koszalińska Wydział Budownictwa i Inżynierii Środowiska Studia Zaoczne, 4 rok Zużycie Wody w Polsce Przeznaczenie Zużycie w latach (hm 3 ) 1988
CHEMIA KLASA II I PÓŁROCZE
 CHEMIA KLASA II I PÓŁROCZE wymienia zasady bhp dotyczące obchodzenia się z kwasami definiuje pojęcia: elektrolit i nieelektrolit wyjaśnia, co to jest wskaźnik i wymienia trzy przykłady odróżnia kwasy od
CHEMIA KLASA II I PÓŁROCZE wymienia zasady bhp dotyczące obchodzenia się z kwasami definiuje pojęcia: elektrolit i nieelektrolit wyjaśnia, co to jest wskaźnik i wymienia trzy przykłady odróżnia kwasy od
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 814
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 814 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 11 Data wydania: 26 lipca 2017 r. AB 814 Nazwa i adres PRZEDSIĘBIORSTWO
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 814 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 11 Data wydania: 26 lipca 2017 r. AB 814 Nazwa i adres PRZEDSIĘBIORSTWO
KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI
 6 KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z zagadnieniami katalizy homogenicznej i wykorzystanie reakcji tego typu do oznaczania śladowych ilości jonów Cu 2+. Zakres obowiązującego
6 KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z zagadnieniami katalizy homogenicznej i wykorzystanie reakcji tego typu do oznaczania śladowych ilości jonów Cu 2+. Zakres obowiązującego
Zakres działalności Laboratorium Środowiskowego dla którego spełnione jest wymaganie normy PN-EN ISO/IEC 17025:
 Zakres działalności Laboratorium Środowiskowego dla którego spełnione jest wymaganie normy PNEN IO/IEC 17025:201802 L.p. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. Badany obiekt woda woda do spożycia przez
Zakres działalności Laboratorium Środowiskowego dla którego spełnione jest wymaganie normy PNEN IO/IEC 17025:201802 L.p. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. Badany obiekt woda woda do spożycia przez
Piotr Chojnacki 1. Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą reakcji charakterystycznych.
 SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
OZNACZANIE UTLENIALNOŚCI WÓD NATURALNYCH
 OZNACZANIE UTLENIALNOŚCI WÓD NATURALNYCH WPROWADZENIE Utlenialność wody jest to umowny wskaźnik określający zdolność wody do pobierania tlenu z nadmanganianu potasowego (KMnO4) w roztworze kwaśnym lub
OZNACZANIE UTLENIALNOŚCI WÓD NATURALNYCH WPROWADZENIE Utlenialność wody jest to umowny wskaźnik określający zdolność wody do pobierania tlenu z nadmanganianu potasowego (KMnO4) w roztworze kwaśnym lub
L.p. Powietrzeemisja. Powietrzeimisja. ścieki
 L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny Powietrzeimisja Powietrzeemisja 1 Pobieranie próbek wody powierzchniowej i ścieków do badań fiz.-chem. i biologicznych 2 Pobieranie
L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny Powietrzeimisja Powietrzeemisja 1 Pobieranie próbek wody powierzchniowej i ścieków do badań fiz.-chem. i biologicznych 2 Pobieranie
Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii
 Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii Dopuszczający (K) Dostateczny(P) Dobry(R) Bardzo dobry (D) Celujący (W) Uczeń : - wie,
Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii Dopuszczający (K) Dostateczny(P) Dobry(R) Bardzo dobry (D) Celujący (W) Uczeń : - wie,
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1448
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1448 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 2 Data wydania: 8 lipca 2014 r. Nazwa i adres: ZAKŁAD WODOCIĄGÓW
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1448 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 2 Data wydania: 8 lipca 2014 r. Nazwa i adres: ZAKŁAD WODOCIĄGÓW
Wymagania programowe na poszczególne oceny. IV. Kwasy. Ocena bardzo dobra. Ocena dostateczna. Ocena dopuszczająca. Ocena dobra [1] [ ]
![Wymagania programowe na poszczególne oceny. IV. Kwasy. Ocena bardzo dobra. Ocena dostateczna. Ocena dopuszczająca. Ocena dobra [1] [ ] Wymagania programowe na poszczególne oceny. IV. Kwasy. Ocena bardzo dobra. Ocena dostateczna. Ocena dopuszczająca. Ocena dobra [1] [ ]](/thumbs/59/43143309.jpg) Wymagania programowe na poszczególne oceny IV. Kwasy Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra [1] [1 + 2] [1 + 2 + 3] [1 + 2 + 3 + 4] wymienia zasady bhp dotyczące obchodzenia
Wymagania programowe na poszczególne oceny IV. Kwasy Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra [1] [1 + 2] [1 + 2 + 3] [1 + 2 + 3 + 4] wymienia zasady bhp dotyczące obchodzenia
Skąd bierze się woda w kranie?
 Skąd bierze się woda w kranie? Stacje uzdatniania wody pobierają wodę z rzek, aby następnie dostarczyć do naszych domów. Woda wcześniej trafia do stawów infiltracyjnych z których przesiąka do studni. W
Skąd bierze się woda w kranie? Stacje uzdatniania wody pobierają wodę z rzek, aby następnie dostarczyć do naszych domów. Woda wcześniej trafia do stawów infiltracyjnych z których przesiąka do studni. W
CHLOROWANIE WODY DO PUNKTU PRZEŁAMANIA
 CHLOROWANIE WODY DO PUNKTU PRZEŁAMANIA WYKREŚLANIE KRZYWYCH PRZEBIEGU CHLOROWANIA DLA WODY ZAWIERAJĄCEJ AZOT AMONOWY. 1. WPROWADZENIE Chlor i niektóre jego związki po wprowadzeniu do wody działają silnie
CHLOROWANIE WODY DO PUNKTU PRZEŁAMANIA WYKREŚLANIE KRZYWYCH PRZEBIEGU CHLOROWANIA DLA WODY ZAWIERAJĄCEJ AZOT AMONOWY. 1. WPROWADZENIE Chlor i niektóre jego związki po wprowadzeniu do wody działają silnie
ĆWICZENIA LABORATORYJNE WYKRYWANIE WYBRANYCH ANIONÓW I KATIONÓW.
 ĆWICZENIA LABORATORYJNE WYKRYWANIE WYBRANYCH ANIONÓW I KATIONÓW. Chemia analityczna jest działem chemii zajmującym się ustalaniem składu jakościowego i ilościowego badanych substancji chemicznych. Analiza
ĆWICZENIA LABORATORYJNE WYKRYWANIE WYBRANYCH ANIONÓW I KATIONÓW. Chemia analityczna jest działem chemii zajmującym się ustalaniem składu jakościowego i ilościowego badanych substancji chemicznych. Analiza
Powiatowa Stacja Sanitarno-Epidemiologiczna w Olecku
 Powiatowa Stacja Sanitarno-Epidemiologiczna w Olecku Zaopatrzenie ludności w wodę W 2010 roku Powiatowa Stacja Sanitarno - Epidemiologiczna w Olecku objęła nadzorem 17 urządzeń służących do zaopatrzenia
Powiatowa Stacja Sanitarno-Epidemiologiczna w Olecku Zaopatrzenie ludności w wodę W 2010 roku Powiatowa Stacja Sanitarno - Epidemiologiczna w Olecku objęła nadzorem 17 urządzeń służących do zaopatrzenia
Współczynniki kalkulacyjne, ceny poboru próbek i wykonania badań. 6,0 458,82 zł. 2,0 152,94 zł. 2,5 191,18 zł. 2,0 152,94 zł
 Współczynniki kalkulacyjne, ceny poboru próbek i wykonania badań L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny cena jednostkowa Powietrze- imisja Powietrze- emisja cena jednostkowa
Współczynniki kalkulacyjne, ceny poboru próbek i wykonania badań L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny cena jednostkowa Powietrze- imisja Powietrze- emisja cena jednostkowa
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 610
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 610 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 11 Data wydania: 11 maja 2015 r. Nazwa i adres AQUA Spółka Akcyjna
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 610 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 11 Data wydania: 11 maja 2015 r. Nazwa i adres AQUA Spółka Akcyjna
DEMINERALIZACJA WODY NATURALNEJ ZA POMOCĄ WYMIENIACZY JONOWYCH
 CHEMIA DYDAKTYKA EKOLOGIA METROLOGIA 20, R. 6, NR -2 97 Andrzej Łach Technikum Ochrony Środowiska Zespół Szkół nr 2 im. Grzegorza z Sanoka ul. Stróżowska 5, 38-500 Sanok tel. 3 46 40 428 email: andrzejlach@poczta.onet.pl
CHEMIA DYDAKTYKA EKOLOGIA METROLOGIA 20, R. 6, NR -2 97 Andrzej Łach Technikum Ochrony Środowiska Zespół Szkół nr 2 im. Grzegorza z Sanoka ul. Stróżowska 5, 38-500 Sanok tel. 3 46 40 428 email: andrzejlach@poczta.onet.pl
Współczynniki kalkulacyjne, ceny poboru próbek i wykonania badań Wykaz czynności Woda lub ścieki Gleby, odpady, Powietrze- imisja Powietrze- emisja
 Lp 1 Pobór próbek wody powierzchniowej i ścieków do badań fiz-chem i biologicznych 2 Pobór w okresie 24 godzin próbek ścieków do badań fiz-chem 3 Pobór próbek wody powierzchniowej do badań fitobentosu
Lp 1 Pobór próbek wody powierzchniowej i ścieków do badań fiz-chem i biologicznych 2 Pobór w okresie 24 godzin próbek ścieków do badań fiz-chem 3 Pobór próbek wody powierzchniowej do badań fitobentosu
Oczyszczanie wody - A. L. Kowal, M. Świderska-BróŜ
 Oczyszczanie wody - A. L. Kowal, M. Świderska-BróŜ Spis treści Przedmowa 1. Woda w przyrodzie 1.1. Wprowadzenie 1.2. Fizyczne właściwości wody 1.3. Ogólna charakterystyka roztworów wodnych 1.3.1. Roztwory
Oczyszczanie wody - A. L. Kowal, M. Świderska-BróŜ Spis treści Przedmowa 1. Woda w przyrodzie 1.1. Wprowadzenie 1.2. Fizyczne właściwości wody 1.3. Ogólna charakterystyka roztworów wodnych 1.3.1. Roztwory
Ocena obszarowa jakości wody na terenie miasta Mszana Dolna za rok 2015.
 PAŃSTWOWY POWIATOWY INSPEKTOR SANITARNY w LIMANOWEJ 34-600 Limanowa, ul. M.B.Bolesnej 16 B TEL: 18 33-72-101, FAX: 18 33-72-438 e-mail: limanowa@psse.malopolska.pl NHK-071-5/16 Limanowa, dnia Burmistrz
PAŃSTWOWY POWIATOWY INSPEKTOR SANITARNY w LIMANOWEJ 34-600 Limanowa, ul. M.B.Bolesnej 16 B TEL: 18 33-72-101, FAX: 18 33-72-438 e-mail: limanowa@psse.malopolska.pl NHK-071-5/16 Limanowa, dnia Burmistrz
Obliczanie stężeń roztworów
 Obliczanie stężeń roztworów 1. Ile mililitrów stężonego, ok. 2,2mol/l (M) roztworu NaOH należy pobrać, aby przygotować 800ml roztworu o stężeniu ok. 0,20 mol/l [ M ]? {ok. 72,7ml 73ml } 2. Oblicz, jaką
Obliczanie stężeń roztworów 1. Ile mililitrów stężonego, ok. 2,2mol/l (M) roztworu NaOH należy pobrać, aby przygotować 800ml roztworu o stężeniu ok. 0,20 mol/l [ M ]? {ok. 72,7ml 73ml } 2. Oblicz, jaką
Oznaczanie SO 2 w powietrzu atmosferycznym
 Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II
 Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II Szczegółowe kryteria oceniania po pierwszym półroczu klasy II: III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących
Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II Szczegółowe kryteria oceniania po pierwszym półroczu klasy II: III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących
L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny wk. Powietrzeimisja. Powietrzeemisja
 Załącznik 1 do zarządzenia nr 15/18 Podlaskiego Wojewódzkiego Inspektora Ochrony Środowiska z dnia 26 marca 2018r. L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny Powietrzeimisja
Załącznik 1 do zarządzenia nr 15/18 Podlaskiego Wojewódzkiego Inspektora Ochrony Środowiska z dnia 26 marca 2018r. L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny Powietrzeimisja
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 610
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 610 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 12 Data wydania: 16 maja 2016 r. Nazwa i adres AQUA Spółka Akcyjna
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 610 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 12 Data wydania: 16 maja 2016 r. Nazwa i adres AQUA Spółka Akcyjna
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 9
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 9 Zastosowanie metod miareczkowania strąceniowego do oznaczania chlorków w mydłach metodą Volharda. Ćwiczenie obejmuje:
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 9 Zastosowanie metod miareczkowania strąceniowego do oznaczania chlorków w mydłach metodą Volharda. Ćwiczenie obejmuje:
