6 k. KOLOIDY. Na +, Cl - AgCl Piasek Woda Woda Woda
|
|
|
- Sławomir Barański
- 8 lat temu
- Przeglądów:
Transkrypt
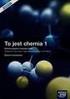
1 6 k. KOLOIDY Zagadnienia teoretyczne Układy koloidalne. Przyczyny trwałości zolu liofobowego i liofilowego. Podział zoli. Koagulacja i peptyzacja. Czynniki wpływające na koagulację i peptyzację. Reguła Hardy-Schulze a. Budowa cząstki koloidalnej (micela). Właściwości elektryczne zoli. Elektroforeza i zjawiska elektrokinetyczne. Szeregi liotropowe Hofmeistera. Koloidy ochronne. Tiksotropia. Ogólne cechy układu koloidalnego Stan koloidalny jest szczególnym stanem, w którym mogą występować substancje chemiczne. W stan koloidalny można przeprowadzić każdą substancję po rozdrobnieniu i rozproszeniu w odpowiednim ośrodku. Układy takie nazywamy układami rozproszonymi lub zdyspergowanymi ponieważ można w nich wyróżnić fazę rozproszoną i fazę rozpraszającą. Do układów dyspersyjnych, poza koloidalnymi, zalicza się emulsje i zawiesiny. Jednakże posiadają one odmienne właściwości od układów koloidalnych. Układy koloidalne są więc zawsze dwufazowe, np. kiedy wytrącamy AgCl to: - cząstki AgCl (ciało stałe) stanowią fazę rozproszoną (zdyspergowaną), natomiast - cząsteczki wody (faza ciekła) są fazą rozpraszającą. Przedstawiony układ koloidalny jest układem dwufazowym ciało stałe / ciecz. Charakterystyczną cechą takiego układu jest to, że cząstki fazy rozproszonej, a właściwie utworzone micele (w tym przypadku AgCl) są przynajmniej 10 lub więcej razy większe niż cząsteczki fazy rozpraszającej (w tym przypadku wody). Biorąc pod uwagę stosunek średnic cząsteczek fazy rozproszonej i rozpraszającej, roztwory można podzielić na trzy grupy: Na +, Cl - AgCl Piasek Woda Woda Woda Roztwory: rzeczywisty koloidalny zawiesina Rys. 1. Grupy roztworów Roztwór rzeczywisty można uzyskać rozpuszczając np. NaCl, sacharozę, etanol, kwas octowy lub NaOH w wodzie. W tych przypadkach wielkość wymienionych cząsteczek jest porównywalna (choć nie taka sama) z wielkością cząsteczek wody i nie można wyróżnić w tym przypadku fazy rozproszonej.
2 Koloidy 2 Przeciwieństwem roztworów rzeczywistych są zawiesiny, których cząstki tworzące fazę rozproszoną (np. piasek) są tysiące razy większe od cząsteczek fazy rozpraszającej i dlatego są widoczne gołym okiem. W tym przypadku wyróżnienie fazy rozproszonej i rozpraszającej nie nastręcza trudności. Między roztworami rzeczywistymi, a zawiesinami występują roztwory koloidalne, których cząstki fazy rozproszonej są przynajmniej 10 razy większe niż cząsteczki fazy rozpraszającej. W przypadku roztworów koloidalnych średnica cząstek fazy rozproszonej wynosi od 1 do 100 nm (1 nm = m). Dlatego też roztwory substancji wielkocząsteczkowych, których średnica przekracza 1 nm wykazują właściwości roztworów koloidalnych. Należą tu: peptydy, białka, skrobia, kazeina, polimery syntetyczne itp. Jeszcze innym rodzajem koloidów są zole niektórych siarczków, chlorków lub tlenków metali i niemetali. Makrocząsteczki Typowymi naturalnymi makrocząsteczkami są białka utworzone w wyniku reakcji polikondensacji -aminokwasów. Reakcja między dwoma aminokwasami, alaniną i glicyną przebiega wg schematu: COO - NH + H N + CH CH O CH 3 CH COO - CH 3 CH C - COO + H 2 O NH + 3 NH Zazwyczaj w reakcji bierze udział więcej cząsteczek aminokwasów, np. 51 w przypadku insuliny, co powoduje, że wielkość cząsteczek białka waha się w granicach od 5 do 100 nm. Inną naturalną makrocząsteczką występującą w przyrodzie jest wielocukier (polisacharyd) skrobia, utworzona z wielu cząsteczek -D-glukozy w wyniku polikondensacji: CH 2 OH H O H OH H + HO OH H OH CH 2 OH H OH OH H OH OH H OH CH 2 OH H O H HO OH H H OH O CH 2 OH O H OH H OH H OH + H 2 O Najczęściej łączy się ze sobą od 25 do 1000 cząsteczek -D-glukozy tworząc łańcuchy o długości od 10 do 500 nm.
3 Koloidy 3 Również cząsteczki substancji nieorganicznych mogą tworzyć makrocząsteczki. Typowym przykładem jest reakcja polikondensacji kwasu orto krzemowego: OH OH OH OH HO - Si - OH + HO - Si - OH HO - Si - O - Si - OH + H2O OH OH OH OH Dalsza kondensacja z udziałem cząsteczek kwasu orto krzemowego, prowadzi do uzyskania żelu krzemionkowego stosowanego jako adsorbent w chromatografii. Wspólną cechą makrocząsteczek powstałych w wyniku reakcji polikondensacji jest ich wielkość, od 1 do 100 nm, co odpowiada średnicy cząstek fazy rozproszonej w typowych układach koloidalnych. Obok omawianych makrocząsteczek powstających w wyniku reakcji polikondensacji, w roztworach rzeczywistych niektórych halogenków (AgCl, AgI), siarczków (As2, S3, CdS) lub tlenków (H2SiO3, Al2O3) mogą tworzyć się duże agregaty (skupiska) cząsteczek zwanych micelami. Można więc w pewnych warunkach przeprowadzić cząsteczki (np. AgCl) lub jony w nierozpuszczalny związek o wymiarach koloidalnych. Koloidy liofobowe i liofilowe Roztwory koloidalne składające się np. z 2 cieczy (faza rozpraszająca) i rozproszonych w niej cząstek ciała stałego o wymiarach koloidalnych nazywamy zolami. Cechą charakterystyczną wielu zoli jest ładunek elektryczny umiejscowiony na powierzchni cząstek koloidalnych. Dzięki ładunkowi cząstki koloidalne mogą poruszać się w polu elektrycznym (patrz elektroforeza), np. cząstki koloidalne As2S3 przesuwają się powoli w kierunku anody (elektroda dodatnia), co świadczy o tym, że micele As2S3 mają na powierzchni ładunek ujemny. Jeżeli powtórzymy to doświadczenie z koloidem Fe(OH)3, to micela przesunie się w kierunku katody (elektroda ujemna), co świadczy o tym, że micela Fe(OH)3 ma ładunek dodatni. Ładunek elektryczny cząstek koloidalnych powoduje ich wzajemne odpychanie, co utrudnia łączenie się miceli w jeszcze większe agregaty i wytrącanie się (koagulację) w postaci osadu. Dotyczy to szczególnie zoli nieorganicznych, które swą trwałość zawdzięczają głównie ładunkowi elektrycznemu. Trwałość zoli makrocząsteczek organicznych, np. roztworów białka, skrobi, kauczuku, żywic, garbników itd. uwarunkowana jest istnieniem otoczki solwatacyjnej, związanej z powierzchnią cząstki koloidalnej i utrzymującej ją w roztworze. Z tego punktu widzenia rozróżniamy dwa typy roztworów koloidalnych. Zole pierwszego typu nazywamy hydrofobowymi (ogólnie liofobowymi, bojącymi się rozpuszczalników), nato-
4 Koloidy 4 miast zole drugiego typu, hydrofilowymi (ogólnie liofilowymi, lubiącymi cząstki rozpuszczalnika). Budowa koloidów hydrofobowych Badania fizykochemiczne zoli hydrofobowych wykazały, że cząstki fazy rozproszonej składają się z części wewnętrznej i zewnętrznej (Rys. 2). Część wewnętrzna, w której skupiona jest prawie cała masa cząstki koloidalnej, złożona jest z trudno rozpuszczalnej substancji (np. As2S3, Fe2O3 xh2o, AgI itd.) i odznacza się strukturą krystaliczną. Ta część, stanowiąca jądro miceli, jest częścią obojętną. Na powierzchni obojętnego jądra miceli adsorbują się jony znajdujące się w roztworze i dzięki nim micela uzyskuje ładunek elektryczny. Inny rodzaj jonów, nie związanych z jądrem miceli, otacza ją w postaci rozmytej chmury jonowej. Dla przykładu rozpatrzmy otrzymywanie hydrozolu AgI, wytrącanego z roztworu w wyniku reakcji, w której stężenie AgNO3 jest dużo większe od stężenia KI: AgNO3 + KI AgI + KNO3 Rys.5. Reakcja syntezy jodku srebra. Powstałe w wyniku reakcji z rys.5 jądro miceli składa się z m obojętnych cząstek AgI i ma strukturę mikrokrystaliczną. Założyliśmy, że c c AgNO3 KI, z tego względu na powierzchni jądra tworzącej się miceli adsorbuje się z roztworu n jonów Ag +. Obowiązuje tu zasada, że pierwszą warstwę tworzą jony wchodzące w skład jądra (Ag + lub I - ) i będące w nadmiarze. W przypadku gdyby molowe stężenie KI było większe niż AgNO3 na powierzchni jądra w pierwszej warstwie adsorbowałyby się jony I -. Dodatnio naładowana warstwa jonów Ag + przyciąga z roztworu jony ujemne (NO 3- lub I - ). Strefa ta tworzy warstwę adsorpcyjną(rys. 2). Ponieważ jonów NO3 - (pochodzących z zdysocjowanych cząstek AgNO3) jest znacznie więcej niż I - (pochodzących z zdysocjowanych cząstek KI) one będą tworzyły drugą warstwę, przylegającą do warstwy adsorpcyjnej, zwaną warstwą przeciwjonów. Bardzo ważną sprawą jest to, że jony NO - 3 dyfundują w głąb roztworu - przyjmijmy, że dyfunduje x jonów NO - 3 i z tego względu nie równoważą ładunku dodatniego miceli, pochodzącego od jonów Ag +. W tej drugiej warstwie jest więc n - x jonów NO - 3, natomiast w warstwie dyfuzyjnej x jonów NO - 3, co powoduje, że cały roztwór koloidalny jest elektrycznie obojętny, ale micela ma ładunek dodatni!
5 Koloidy 5 NO3 - warstwa przeciwjonów NO3 NO3 - NO3 Ag + NO3 NO3 - Ag + Ag + warstwa dyfuzyjna NO3 - Ag + Ag + NO3 - m AgI Ag + Ag + micela NO3 Ag + Ag + - Ag + Ag + NO3 Ag + NO3 - NO3 NO3 NO3 - warstwa adsorpcyjna NO3 - Rys. 2. Budowa miceli AgI Rysunek przedstawia istotne elementy wchodzące w skład miceli nadające jej ładunek i wpływające na jej potencjał elektrokinetyczny (wyjaśnienie pojęcia patrz dalsza część). W rzeczywistości w warstwie adsorpcyjnej mogą znaleźć się także inne jony, np. I -, a w warstwie dyfuzyjnej jony ujemne, jak i pewna ilość jonów dodatnich. Nie zmienia to jednak faktu, że przedstawiona micela ma ładunek dodatni i można ją zapisać w następujący sposób: Podobnie można zapisać budowę hydrozolu As2S3 otrzymanego w wyniku reakcji z użyciem nadmiaru K2S 2 AsCl3 + 3 K2S = As2S3 + 6 KCl Uwaga! - ponieważ w pierwszej warstwie występuje jon dwuujemny S 2-, dlatego w warstwie przeciwjonów i dyfuzyjnej musi znajdować się dwukrotnie więcej jonów dodatnich K +, aby zrównoważyć ładunek jonów S 2-. Koagulacja kolodiów liofobowych Już niewielkie ilości elektrolitu mogą wywołać koagulację zoli liofobowych. Następuje ona w wyniku zmniejszenia ładunku miceli wskutek zwiększenia stężenia jonów elektrolitu w warstwie przeciwjonów i warstwie dyfuzyjnej. W przypadku miceli AgI byłyby to jony ujemne, natomiast w przypadku As2S3 - jony dodatnie.
6 Koloidy 6 Hardy i Schultz stwierdzili, że w przypadku koloidów naładowanych dodatnio, np. AgI, koagulację powodują aniony, natomiast naładowanych ujemnie (np. As2S3) - kationy. Schultz wykazał również, że zdolność jonu do wywołania koagulacji jest tym większa, im większy jest ładunek jonu (reguła Hardy-Schultz'a). Koagulację zolu AgI wywołują aniony, a ich zdolność koagulacji rośnie wraz ze wzrostem ładunku i tylko w niewielkim stopniu zależy od rodzaju oraz ładunku towarzyszących im kationów. Stosując np. roztwory KCl i K2SO4 można wyznaczyć najniższe stężenie (stężenie progowe) jonów Cl - i SO4 2- konieczne do przeprowadzenia koagulacji miceli AgI. Wynoszą one: c Cl : c SO : 0.25 mmol / dm 3 oznacza to, że aby skoagulować zol AgI należy użyć około 44 razy większego stężenia KCl niż K2SO4. Oczywiście gdyby do koagulacji użyć jonu trójwartościowego, np. PO4 3- to jego stężenie powodujące koagulację byłoby niższe niż w przypadku SO4 2-. Na rys.3 przedstawiono mechanizm koagulacji zolu AgI. a. b Rys.3. Zrównoważenie ładunku elektrycznego w cząsteczce koloidalnej naładowanej dodatnio przez ujemne jony dwuwartościowe a - początek koagulacji, b - cząsteczka koloidalna pozbawiona ładunku Budowa i koagulacja koloidów hydrofilowych W przeciwieństwie do zoli hydrofobowych zawdzięczających swą trwałość ładunkowi elektrycznemu, w przypadku zoli hydrofilowych oprócz ładunku, stabilizująco działa również otoczka solwatacyjna wokół cząstek koloidalnych. Białka stanowiące koloidy hydrofilowe posiadają w swoich cząsteczkach takie grupy funkcyjne jak: -COOH, -NH2, -OH, =NH, -SH, które są grupami hydrofilowymi i bardzo dobrze oddziałują z cząsteczkami wody. Podobnie skrobia posiada dużą ilość grup OH, które
7 Koloidy 7 silnie oddziałują z cząsteczkami wody. Oddziaływania te prowadzą do utworzenia podwójnej warstwy solwatacyjnej cząsteczek wody (Rys. 4), która osłania ładunki elektryczne. H H H H H H O O O H H H H H H H H O O O O H H O B I A Ł K O O H H O O O O H H H H H H H H O O O H H H H H H Rys. 4. Cząsteczka białka z podwójną otoczką solwatacyjną Otoczki solwatacyjne zoli hydrofilowych składają się z dwóch warstw cząsteczek wody (Rys. 4) Pierwszą warstwę tworzą cząsteczki wody o zorientowanych dipolach (oddziaływanie dipol - dipol), związane mocno z powierzchnią cząsteczek koloidalnych. Do warstwy tej przylega druga warstwa cząsteczek o orientacji zburzonej dzięki ruchom termicznym. W ten sposób powstaje warstwa dyfuzyjna, stanowiąca przejście między fazą rozproszoną (białko), a rozpraszającą (woda). Dodanie elektrolitu powoduje zniszczenie zewnętrznej warstwy, w wyniku czego zmniejsza się trwałość zolu. Większość zoli hydrofilowych nie ulega koagulacji pod wpływem niewielkich ilości elektrolitu. Koagulacja następuje dopiero po zniszczeniu otoczki solwatacyjnej, wskutek dodania nadmiaru elektrolitu, o stężeniu około 1 mol/l. Proces taki nazywamy wysalaniem. W przypadku koagulacji zoli hydrofilowych elektrolitami, mniejszą rolę odgrywa wartościowość jonu (patrz reguła Hardy-Schultz a), powodującego koagulację, a znacznie większą jego zdolność do hydratacji. Wiadomo, że w roztworach wodnych kationy i aniony występują w formie uwodnionej (np. H3O + - jon hydroniowy). Zdolność hydratacji kationów I grupy układu okresowego maleje od litu do cezu. Podobnie maleją również wartości ciepła hydratacji H o (entalpii hydratacji).
8 Koloidy 8 Hofmeister uszeregował aniony i kationy w szeregi liotropowe według ich malejącej zdolności do spowodowania koagulacji ( wysalania ) koloidów hydrofilowych. SO4 2- > CH3COO - > Cl - > Br - > J - H o kj/mol oraz Mg 2+ > Ca 2+ > Sr 2+ > Li 2+ > Na + > K + H o kj/mol Warto zaznaczyć, że zdolność jonów do wywołania koagulacji maleje podobnie jak maleją ciepła hydratacji. Ujemne wartości H o wskazują na wydzielania się ciepła do otoczenia, w czasie procesu hydratacji. Wydzielanie dużej ilości ciepła świadczy o najsilniejszej hydratacji jonu. Z porównania wartości H o dla jonów jednowartościowych lub dwuwartościowych wynika, że hydratacja tych jonów jest różna, z tego właśnie względu jony o jednakowej wartości mają różną zdolność koagulacyjną w stosunku do koloidów hydrofilowych. Wartości H o dla jonów jedno i dwuwartościowych są różne, co świadczy o tym, że i stopień hydratacji jest różny. Zdolność koagulacji koloidów hydrofilowych przez jony dwuwartościowe jest większa niż przez jony jednowartościowe, co w pewnym sensie potwierdza regułę Hardy- Schultz a. W obydwu przypadkach skutek jest taki sam ale powód różny; większy ładunek jonu powodującego koagulację koloidu hydrofobowego łatwiej kompensuje ładunek miceli, natomiast większa hydratacja jonu dwuwartościowego powoduje łatwiejsze usunięcie otoczki solwatacyjnej zolu hydrofilowego. Do koagulacji koloidów hydrofilowych stosuje się najczęściej roztwory: MgSO4, LiSO4, Na2SO4 i (NH4)2SO4. W przypadku białek dodatkowym czynnikiem zwiększającym ich trwałość jest ładunek elektryczny. Ładunek powstaje tu jednak nie w wyniku adsorpcji jonów lecz dysocjacji istniejących w cząsteczce grup funkcyjnych. W zależności od środowiska grupa COOH może dysocjować lub NH2 ulegać jonizacji do NH3 + Potencjał elektrokinetyczny Na granicy zetknięcia się dwóch faz, np. jądro miceli wraz z warstwą adsorpcyjną i warstwa dyfuzyjna lub elektroda metalowa - roztwór, powstaje różnica potencjałów wywołana istnieniem podwójnej warstwy elektrycznej.
9 Koloidy 9 Rozpatrzmy problem powstawania podwójnej warstwy elektrycznej i w konsekwencji potencjału elektrokinetycznego na przykładzie miceli AgI. Na powierzchni jądra miceli adsorbują się jony Ag + tworząc warstwę ładunków dodatnich, te przyciągają z roztworu jony o przeciwnym znaku tzn. NO3 - tworząc warstwę przeciwjonów. Warstwa jonów NO3 - nie kompensuje całkowicie ładunku dodatniego utworzonego przez jony Ag +. Ładunek dodatni jest całkowicie kompensowany dopiero przez jony ujemne znajdujące się w warstwie dyfuzyjnej. Sytuację tę można schematycznie przedstawić w sposób następujący: warstwa adsorpcyjna warstwa dyfuzyjna jądro miceli a V (wolty) b. x, cm Rys. 5. Schemat podwójnej warstwy elektrycznej; jest potencjałem elektrokinetycznym, a - rozłożenie ładunków, b - krzywa zmiany potencjału Jak wynika z Rys. 5, wartość potencjału V odpowiada całkowitej różnicy potencjałów między ładunkiem dodatnim na powierzchni jądra miceli, a wszystkimi jonami ujemnymi znajdującymi się w warstwie adsorpcyjnej i dyfuzyjnej. Potencjał elektrkinetyczny jest częścią całkowitego potencjału oznaczonego literą V i wyrażonego w woltach. Różnica potencjałów między warstwą adsorpcyjną i dyfuzyjną nazywa się potencjałem elektrokinetycznym (Rys. 5.) Ładunek cząstki koloidalnej w przypadku koloidów (np. białek) powstaje w wyniku dysocjacji lub jonizacji grup funkcyjnych (-COOH, NH3 + ) znajdujących się na powierzchni
10 Koloidy 10 ciała stałego. Te jony, -COO - lub -NH3 + przyciągają z roztworu jony przeciwnego znaku, tworząc podwójną warstwę elektryczną, która warunkuje istnienie potencjału elektrokinetycznego. W praktyce wyznaczanie wartości potencjału elektrokinetycznego dokonuje się metodą elektroforezy lub elektroosmozy, korzystając z równania: k v E gdzie k: jest stałą zależną od wielkości i kształtu cząsteczki koloidalnej (dla małych i kulistych cząstek k = 6, dla cylindrycznych k = 4), - lepkością fazy dyspersyjnej, jest przenikalnością dielektryczną, E - jest gradientem natężenia pola elektrycznego, v - jest średnią szybkością poruszania się cząstek koloidalnych. Potencjał układów koloidalnych może sięgać kilkudziesięciu miliwoltów. W miarę dodawania elektrolitu do roztworu koloidalnego potencjał maleje, tym szybciej im wyższa jest wartościowość jonu powodującego koagulację. Zol jest względnie trwały dopóki potencjał nie zmaleje poniżej wartości krytycznej i wynoszącej zazwyczaj mv. Po przekroczeniu tej wartości następuje szybka koagulacja zolu. Zastosowanie w kosmetyce Układy koloidalne zawierające bardzo małe drobinki metali szlachetnych znalazły swoje zastosowanie w kosmetyce. Metale stosowane w nich wykazują niejonowy charakter z uwagi na silną dyspersję metalu. Preparaty zawierające koloidalne metale mają działanie wymiatające wolne rodniki, czy też przeciwbakteryjne. Preparaty zawierające koloidalne złoto, srebro czy platynę wytwarzane są z metalu o czystości 99.9% zawierają również wodę o bardzo wysokim stopniu czystości. Układy koloidalne metali szlachetnych stosowane w kosmetyce to: nano koloid srebra ma działanie antybakteryjnym i antygrzybicznym nano koloid złota wykazują działanie przeciwzmarszczkowe i antybakteryjne nano koloid platyny- zmniejszają przebarwienia naskórka (np. plamy wątrobowe czy plamy starzeniowe) nano koloid miedzi- poprawia wygląd skóry czy włosów Koloidy srebra można również znaleźć w antybakteryjnych płynach czy tonikach do ciała, zaś koloid złota w kremach odmładzająco-liftingujących.
11 Koloidy 11 Inny metal w postaci koloidu- glin stosowany jest w szminkach, pastach do zębów czy dezodorantach. Jednakże nadmierne stosowanie metali w postaci koloidu może prowadzić do ich nadmiernego odkładania się w tkankach organizmu i w efekcie do rozwoju chorób. Natomiast koloidalna krzemionka doskonałym środkiem zagęszczającym, tiksotropującym i antysedymentacyjnym. Ponadto pozwala na lepsze zdyspergowanie pigmentów w kosmetyce kolorowej. Za pomocą krzemionki hydrofobowej można wytworzyć suchą wodę, składającą się z 5% krzemionki i 95% wody i pozostającą w dalszym ciągu proszkiem. Sucha woda po naniesieniu na skórę twarzy powoduje jej nawilżenie i jednocześnie przeciwdziała jej świeceniu. Naturalne hydrokoloidy takie jak np. guma ksantanowa, pektyna, karagen są składnikiem wielu kremów, lotionów, produktów do pielęgnacji włosów, żeli do golenia i wielu innych formuł kosmetycznych.
12 Koloidy 12 Wykonanie ćwiczenia 6. PREPARATYKA KOLOIDU LIOFOBOWEGO WYZNACZANIE ZDOLNOŚCI KOAGULACYJNEJ ELEKTROLITÓW Zadania: 1. Preparatyka koloidu liofobowego, jego koagulacja i wyznaczenie zdolności koagulacyjnej KCl, K2SO4, K3Fe(CN)6. a c Wzory pomocnicze: m k 1000 (milimoli / dm 3 ) (1) 20 Wykonanie ćwiczenia: 1. Do 300 cm 3 wrzącej wody destylowanej (nie przerywając wrzenia ) wkroplić powoli, ciągle mieszając, pipetą 30 cm 3 2 % roztwór chlorku żelaza FeCl3. W wyniku hydrolizy FeCl3 powstaje czerwonobrunatny zol Fe(OH)3: Fe Cl H2O Fe(OH)3 + 3 H Cl - II. Wyznaczenie zdolności koagulacyjnej KCl 1. Po ostudzeniu zolu, odmierzyć pipetą pełną o pojemności 10 cm 3 kolejno do 10 probówek po 10 cm 3 zolu. 2. Do innych pięciu probówek wlać kolejno 1, 3, 5, 7, 9 cm 3 KCl o stężeniu 4 mol dm Do tych probówek dodać taką objętość wody destylowanej aby końcowa objętość roztworu w probówce wynosiła 10 cm Zawartość probówek z elektrolitem wlać kolejno do pięciu probówek z zolem. Dla dokładniejszego wymieszania przelać ciecz kilkakrotnie z jednej probówki do drugiej. 5. Odstawić probówki z zolem i elektrolitem do stojaka na 30 minut. 6. Obserwować zawartość probówek na jasnym tle, lub patrząc z góry, dla określenia, w których probówkach zaszła koagulacja zolu, tzn. widoczne jest zmętnienie, wyraźnie różniące się od klarownej zawartości na początku.
13 7. Otrzymane wyniki zestawić w Tabeli 1 (dla I serii pomiarów) : Koloidy 13 Tabela 1. (Przykładowe dane uzyskane w pierwszej serii pomiarów) Nr probówki Objętość KCl (4 mol dm -3 ) cm Objętość wody (cm 3 ) Objętość zolu (cm 3 ) Koagulacja - oznacza, że w tych probówkach zaszła koagulacja. Na podstawie powyższych wyników, można obliczyć jedynie przybliżoną (I przybliżenie) wartość koagulacyjną KCl mieszczącą się w objętości KCl zawartej pomiędzy probówkami drugą i trzecią. 8.. Własne wyniki zestawić w Tabeli 1 (dla I serii pomiarów): Tabela 1. Wyznaczenie I przybliżenia wartości koagulacyjnej KCl Nr probówki Objętość KCl (4 mol dm -3 ) cm Objętość wody (cm 3 ) Objętość zolu (cm 3 ) Koagulacja 9. Dla dokładniejszego wyznaczenia wartości koagulacyjnej elektrolitu wykonać drugi pomiar (II przybliżenie), używając tego samego elektrolitu w objętości wynikającej z pierwszej serii pomiarów. W naszym przypadku będą to objętości pomiędzy 3 cm 3 (objętość KCl zawarta w ostatniej probówce, w której nie koagulacja nie zaszła, w naszym eksperymencie druga probówka) a 5 cm 3 (objętość KCl zawarta w pierwszej probówce, w której do koagulacji doszło, w naszym doświadczeniu jest to trzecia probówka). Czyli w II serii pomiarów, do kolejnych pięciu probówek odmierzyć należy 3,2; 3,6; 4,0; 4.4; 4,8 cm 3 KCl i dalej postępować jak w I serii (punkty 3-6).
14 10. Wyniki wpisać do Tabeli 2. Koloidy 14 Tabela 2. (Przykładowe dane uzyskane z drugiej serii pomiarów) Nr probówki Objętość KCl (4 mol dm -3 ) cm 3 3,2 3,6 4,0 4,4 4,8 Objętość wody (cm 3 ) 6,8 6,4 6,0 5,6 5,2 Objętość zolu (cm 3 ) Koagulacja oznacza, że w tych probówkach zaszła koagulacja. W II serii pomiarów stwierdzamy, że koagulacja zaszła tylko w probówkach 4 i 5. Wyliczyć średnią z dwu wyników 4,0 (ostatnia probówka, w której nie koagulacja nie zaszła) i 4,4 (pierwsza probówka, w której koagulacja zaszła), tj. 4,2 (jest to wartość a) i podstawić do wzoru (1), gdzie: mk - wartość koagulacyjna elektrolitu (KCl) w milimolach/dm 3, a - objętość elektrolitu powodującego koagulację 20 cm 3 zolu, c - stężenie elektrolitu mol dm Własne wyniki zestawić w Tabeli 2 (dla II serii pomiarów): Tabela 2. Wyznaczenie II przybliżenia wartości koagulacyjnej KCl Objętość KCl (4 mol dm -3 ) cm 3 Objętość wody (cm 3 ) Nr probówki Objętość zolu (cm 3 ) Koagulacja 12. Na podstawie II serii pomiarów (z Tabeli 2) obliczyć kolejną przybliżoną (III przybliżenie) objętość elektrolitu, która powoduje koagulację 20 cm 3 roztworu koloidalnego i tę wartość ostatecznie wstawić do wzoru (1). II. Wyznaczenie zdolności koagulacyjnej K2SO4 1. Wartość koagulacyjną dla K2SO4 wyznaczyć w analogiczny sposób, jak dla KCl. 2. Wlać do pięciu probówek kolejno 1, 2, 4, 6, 8 cm 3 roztworu K2SO4 o stężeniu mol dm -3
15 Koloidy Do tych probówek dodać taką objętość wody destylowanej aby końcowa objętość roztworu w probówce wynosiła 10 cm 3 4. Postępować dalej jak w przypadku KCl (punkty 1, 4-12) 5. wykonując I, II (na podstawie wyników z I serii pomiarów dla K2SO4) i III przybliżenie. 2. Wyniki z I serii pomiarów wstawić do Tabeli 3 a z drugiej serii do Tabeli Podstawić do wzoru (1) średnią z dwu wyników stanowiących III przybliżenie. Tabela 3. Wyznaczenie I przybliżenia wartości koagulacyjnej K2SO4 Nr probówki Objętość K2SO4 ( mol dm -3 ) cm Objętość wody (cm 3 ) Objętość zolu (cm 3 ) Koagulacja Tabela 4. Wyznaczenie II przybliżenia wartości koagulacyjnej K2SO4 Nr probówki Objętość K2SO4 ( mol dm -3 ) cm 3 Objętość wody (cm 3 ) Objętość zolu (cm 3 ) Koagulacja III. Wyznaczenie zdolności koagulacyjnej K3Fe(CN)6 1. Wartość koagulacyjną dla K3Fe(CN)6 wyznaczyć przez bezpośrednie (przy ciągłym mieszaniu) wkraplanie z mikrobiurety roztworu K3Fe(CN)6 o stężeniu mol dm -3 do 10 cm 3 zolu aż do uzyskania zmętnienia. Pomiar przeprowadzić trzykrotnie. Wartość koagulacyjną obliczyć ze wzoru: a c m k 1000 (milimoli / dm 3 ) 10 a gdzie: a - objętość elektrolitu powodująca zmętnienie 10 cm 3 zolu (średnia z trzech pomiarów), c - stężenie elektrolitu w mol dm -3. UWAGA: Naczynia laboratoryjne należy myć bardzo dokładnie.
16 Koloidy 16 KOLOIDY (schemat formularza do opracowania wyników ćwiczenia) Data wykonania ćwiczenia: Imię i nazwisko studenta: GS: Imię i nazwisko asystenta: Zadania do wykonania: Stosowane wzory: Tabela 1. Tabela 2. Tabela 3. Tabela 4. Obliczenia (przykłady stosowanych obliczeń). Omówienie wyników i wnioski: - podać wartości koagulacyjne badanych elektrolitów. Podpis studenta: Podpis opiekuna: Data
6. KOLOIDY. Na +, Cl - AgCl Piasek Woda Woda Woda
 6. KOLOIDY Zagadnienia teoretyczne Układy koloidalne. Przyczyny trwałości zolu liofobowego i liofilowego. Podział zoli. Koagulacja i peptyzacja. Czynniki wpływające na koagulację i peptyzację. Reguła Hardy-Schulze
6. KOLOIDY Zagadnienia teoretyczne Układy koloidalne. Przyczyny trwałości zolu liofobowego i liofilowego. Podział zoli. Koagulacja i peptyzacja. Czynniki wpływające na koagulację i peptyzację. Reguła Hardy-Schulze
6. KOLOIDY. Sprawdzono w roku 2017 przez B. Polak
 6. KOLOIDY Zagadnienia teoretyczne Układy koloidalne. Przyczyny trwałości zolu liofobowego i liofilowego. Podział zoli. Koagulacja i peptyzacja. Czynniki wpływające na koagulację i peptyzację. Reguła Hardy-Schulze
6. KOLOIDY Zagadnienia teoretyczne Układy koloidalne. Przyczyny trwałości zolu liofobowego i liofilowego. Podział zoli. Koagulacja i peptyzacja. Czynniki wpływające na koagulację i peptyzację. Reguła Hardy-Schulze
W rozdziale tym omówione będą reakcje związków nieorganicznych w których pierwiastki nie zmieniają stopni utlenienia. Do reakcji tego typu należą:
 221 Reakcje w roztworach Wiele reakcji chemicznych przebiega w roztworach. Jeżeli są to wodne roztwory elektrolitów wtedy faktycznie reagują między sobą jony. Wśród wielu reakcji chemicznych zachodzących
221 Reakcje w roztworach Wiele reakcji chemicznych przebiega w roztworach. Jeżeli są to wodne roztwory elektrolitów wtedy faktycznie reagują między sobą jony. Wśród wielu reakcji chemicznych zachodzących
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
Badanie wpływu elektrolitów na koagulację roztworów koloidalnych liofobowych
 Zespół 5 Lawenda Nieznana Gardenia Nołnejmowa Tulipan Bezimienny Dwiczenie nr Badanie wpływu elektrolitów na koagulację roztworów koloidalnych liofobowych Data wykonania: dawno Data oddania: kiedyś Ocena:
Zespół 5 Lawenda Nieznana Gardenia Nołnejmowa Tulipan Bezimienny Dwiczenie nr Badanie wpływu elektrolitów na koagulację roztworów koloidalnych liofobowych Data wykonania: dawno Data oddania: kiedyś Ocena:
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
WŁAŚCIWOŚCI KOLIGATYWNE ROZTWORÓW
 Ćwiczenie nr 1 WŁAŚCIWOŚCI KOLIGATYWNE ROZTWORÓW I. Pomiar ciśnienia osmotycznego ĆWICZENIA PRAKTYCZNE Ciśnienie osmotyczne - różnica ciśnień wywieranych na błonę półprzepuszczalną przez dwie ciecze, które
Ćwiczenie nr 1 WŁAŚCIWOŚCI KOLIGATYWNE ROZTWORÓW I. Pomiar ciśnienia osmotycznego ĆWICZENIA PRAKTYCZNE Ciśnienie osmotyczne - różnica ciśnień wywieranych na błonę półprzepuszczalną przez dwie ciecze, które
Obliczenia chemiczne. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
ĆWICZENIE 1. Aminokwasy
 ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
Procesy Chemiczne laboratorium część SURFAKTANTY. ćwiczenie 3 Fabrykowanie układów koloidalnych oraz wyznaczanie punktu inwersji emulsji
 Procesy Chemiczne laboratorium część SURFAKTANTY ćwiczenie 3 Fabrykowanie układów koloidalnych oraz wyznaczanie punktu inwersji emulsji UKŁADY KOLOIDALNE OTRZYMYWANIE I WŁAŚCIWOŚCI Układy koloidalne można
Procesy Chemiczne laboratorium część SURFAKTANTY ćwiczenie 3 Fabrykowanie układów koloidalnych oraz wyznaczanie punktu inwersji emulsji UKŁADY KOLOIDALNE OTRZYMYWANIE I WŁAŚCIWOŚCI Układy koloidalne można
Związki nieorganiczne
 strona 1/8 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
strona 1/8 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
ROZTWORY. Podział rozpuszczalników 1) nieorganiczne 2) organiczne ze względu na względną stałą dielektryczną (ε) 1) polarne 2) niepolarne 4,72 CN
 ROZTWORY Podział rozpuszczalników 1) nieorganiczne 2) organiczne ze względu na względną stałą dielektryczną (ε) 1) polarne 2) niepolarne Rozpuszczalnik ε Rozpuszczalnik ε Woda 78,38 Octan etylu CH 3 COOC
ROZTWORY Podział rozpuszczalników 1) nieorganiczne 2) organiczne ze względu na względną stałą dielektryczną (ε) 1) polarne 2) niepolarne Rozpuszczalnik ε Rozpuszczalnik ε Woda 78,38 Octan etylu CH 3 COOC
Wodorotlenki O O O O. I n. I. Wiadomości ogólne o wodorotlenkach.
 Wodorotlenki I. Wiadomości ogólne o wodorotlenkach. Wodorotlenki są to związki chemiczne zbudowane z atomu metalu i grupy wodorotlenowej. Wzór ogólny wodorotlenków: wartościowość metalu M n ( ) grupa wodorotlenowa
Wodorotlenki I. Wiadomości ogólne o wodorotlenkach. Wodorotlenki są to związki chemiczne zbudowane z atomu metalu i grupy wodorotlenowej. Wzór ogólny wodorotlenków: wartościowość metalu M n ( ) grupa wodorotlenowa
Ćwiczenie 2. Charakteryzacja niskotemperaturowego czujnika tlenu. (na prawach rękopisu)
 Ćwiczenie 2. Charakteryzacja niskotemperaturowego czujnika tlenu (na prawach rękopisu) W analityce procesowej istotne jest określenie stężeń rozpuszczonych w cieczach gazów. Gazy rozpuszczają się w cieczach
Ćwiczenie 2. Charakteryzacja niskotemperaturowego czujnika tlenu (na prawach rękopisu) W analityce procesowej istotne jest określenie stężeń rozpuszczonych w cieczach gazów. Gazy rozpuszczają się w cieczach
HYDROLIZA SOLI. 1. Hydroliza soli mocnej zasady i słabego kwasu. Przykładem jest octan sodu, dla którego reakcja hydrolizy przebiega następująco:
 HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
LABORATORIUM FIZYKI PAŃSTWOWEJ WYŻSZEJ SZKOŁY ZAWODOWEJ W NYSIE. Ćwiczenie nr 2 Temat: Wyznaczenie współczynnika elektrochemicznego i stałej Faradaya.
 LABOATOIUM FIZYKI PAŃSTWOWEJ WYŻSZEJ SZKOŁY ZAWODOWEJ W NYSIE Ćwiczenie nr Temat: Wyznaczenie współczynnika elektrochemicznego i stałej Faradaya.. Wprowadzenie Proces rozpadu drobin związków chemicznych
LABOATOIUM FIZYKI PAŃSTWOWEJ WYŻSZEJ SZKOŁY ZAWODOWEJ W NYSIE Ćwiczenie nr Temat: Wyznaczenie współczynnika elektrochemicznego i stałej Faradaya.. Wprowadzenie Proces rozpadu drobin związków chemicznych
ELEKTROFOREZA KOLOIDÓW
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW ELEKTROFOREZA KOLOIDÓW Opiekun ćwiczenia: Sylwia Golba Miejsce ćwiczenia: Zakład Chemii Fizycznej ul. M. Strzody 9, p.
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW ELEKTROFOREZA KOLOIDÓW Opiekun ćwiczenia: Sylwia Golba Miejsce ćwiczenia: Zakład Chemii Fizycznej ul. M. Strzody 9, p.
ĆWICZENIE I - BIAŁKA. Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi.
 ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
PODSTAWY CHEMII INŻYNIERIA BIOMEDYCZNA. Wykład 2
 PODSTAWY CEMII INŻYNIERIA BIOMEDYCZNA Wykład Plan wykładu II,III Woda jako rozpuszczalnik Zjawisko dysocjacji Równowaga w roztworach elektrolitów i co z tego wynika Bufory ydroliza soli Roztwory (wodne)-
PODSTAWY CEMII INŻYNIERIA BIOMEDYCZNA Wykład Plan wykładu II,III Woda jako rozpuszczalnik Zjawisko dysocjacji Równowaga w roztworach elektrolitów i co z tego wynika Bufory ydroliza soli Roztwory (wodne)-
Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph
 Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph Dysocjacja elektrolitów W drugiej połowie XIX wieku szwedzki chemik S.A. Arrhenius doświadczalnie udowodnił, że substancje
Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph Dysocjacja elektrolitów W drugiej połowie XIX wieku szwedzki chemik S.A. Arrhenius doświadczalnie udowodnił, że substancje
HYDROLIZA SOLI. Przykładem jest octan sodu, dla którego reakcja hydrolizy przebiega następująco:
 HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
3 k. NAPIĘCIE POWIERZCHNIO- WE
 3 k. NAPIĘCIE POWIERZCHNIO- WE Zagadnienia teoretyczne Przyczyny powstawania napięcia powierzchniowego cieczy. Jednostki napięcia powierzchniowego. Napięcie powierzchniowe roztworów i jego związek z adsorpcją.
3 k. NAPIĘCIE POWIERZCHNIO- WE Zagadnienia teoretyczne Przyczyny powstawania napięcia powierzchniowego cieczy. Jednostki napięcia powierzchniowego. Napięcie powierzchniowe roztworów i jego związek z adsorpcją.
Zadanie 1. (2 pkt) Spośród podanych niżej cech wybierz i podkreśl cztery, charakteryzujące chlor w warunkach normalnych:
 Zadanie 1. (2 pkt) Spośród podanych niżej cech wybierz i podkreśl cztery, charakteryzujące chlor w warunkach normalnych: gaz, ciecz, ciało stałe, ma gęstość mniejszą od gęstości powietrza, ma gęstość większą
Zadanie 1. (2 pkt) Spośród podanych niżej cech wybierz i podkreśl cztery, charakteryzujące chlor w warunkach normalnych: gaz, ciecz, ciało stałe, ma gęstość mniejszą od gęstości powietrza, ma gęstość większą
Układ Otoczenie Faza układu Składnik układu Układ dyspersyjny
 ROZTWORY - STĘŻENIA Chemia roztworów Układ wyodrębniony obszar materii oddzielony od otoczenia wyraźnymi granicami Otoczenie to wszystko co się znajduje poza układem Faza układu jednorodna pod względem
ROZTWORY - STĘŻENIA Chemia roztworów Układ wyodrębniony obszar materii oddzielony od otoczenia wyraźnymi granicami Otoczenie to wszystko co się znajduje poza układem Faza układu jednorodna pod względem
KONDUKTOMETRIA. Konduktometria. Przewodnictwo elektrolityczne. Przewodnictwo elektrolityczne zaleŝy od:
 KONDUKTOMETRIA Konduktometria Metoda elektroanalityczna oparta na pomiarze przewodnictwa elektrolitycznego, którego wartość ulega zmianie wraz ze zmianą stęŝenia jonów zawartych w roztworze. Przewodnictwo
KONDUKTOMETRIA Konduktometria Metoda elektroanalityczna oparta na pomiarze przewodnictwa elektrolitycznego, którego wartość ulega zmianie wraz ze zmianą stęŝenia jonów zawartych w roztworze. Przewodnictwo
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 2013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 12-617-5229 Katedra
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 2013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 12-617-5229 Katedra
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Ćwiczenie 1. Technika ważenia oraz wyznaczanie błędów pomiarowych. Ćwiczenie 2. Sprawdzanie pojemności pipety
 II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW.
 RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW. Zagadnienia: Zjawisko dysocjacji: stała i stopień dysocjacji Elektrolity słabe i mocne Efekt wspólnego jonu Reakcje strącania osadów Iloczyn rozpuszczalności Odczynnik
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW. Zagadnienia: Zjawisko dysocjacji: stała i stopień dysocjacji Elektrolity słabe i mocne Efekt wspólnego jonu Reakcje strącania osadów Iloczyn rozpuszczalności Odczynnik
STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI
 Ćwiczenie 8 Semestr 2 STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI Obowiązujące zagadnienia: Stężenie jonów wodorowych: ph, poh, iloczyn jonowy wody, obliczenia rachunkowe, wskaźniki
Ćwiczenie 8 Semestr 2 STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI Obowiązujące zagadnienia: Stężenie jonów wodorowych: ph, poh, iloczyn jonowy wody, obliczenia rachunkowe, wskaźniki
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu
 Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
Zadanie: 1 (1pkt) Zadanie: 2 (1 pkt)
 Zadanie: 1 (1pkt) Stężenie procentowe nasyconego roztworu azotanu (V) ołowiu (II) Pb(NO 3 ) 2 w temperaturze 20 0 C wynosi 37,5%. Rozpuszczalność tej soli w podanych warunkach określa wartość: a) 60g b)
Zadanie: 1 (1pkt) Stężenie procentowe nasyconego roztworu azotanu (V) ołowiu (II) Pb(NO 3 ) 2 w temperaturze 20 0 C wynosi 37,5%. Rozpuszczalność tej soli w podanych warunkach określa wartość: a) 60g b)
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 8. Argentometryczne oznaczanie chlorków metodą Fajansa
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 8 Argentometryczne oznaczanie chlorków metodą Fajansa Ćwiczenie obejmuje: 1. Oznaczenie miana roztworu AgNO 3 2. Oznaczenie
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 8 Argentometryczne oznaczanie chlorków metodą Fajansa Ćwiczenie obejmuje: 1. Oznaczenie miana roztworu AgNO 3 2. Oznaczenie
XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019. ETAP I r. Godz Zadanie 1 (10 pkt)
 XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019 ETAP I 9.11.2018 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh 27 Zadanie 1 (10 pkt) 1. W atomie glinu ( 1Al)
XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019 ETAP I 9.11.2018 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh 27 Zadanie 1 (10 pkt) 1. W atomie glinu ( 1Al)
WŁAŚCIWOŚCI KOLIGATYWNE ROZTWORÓW
 Ćwiczenie nr 1 WŁAŚCIWOŚCI KOLIGATYWNE ROZTWORÓW I. Osmoza i ciśnienie osmotyczne Zasada: Ciśnienie osmotyczne - różnica ciśnień wywieranych na błonę półprzepuszczalną przez dwie ciecze, które błona ta
Ćwiczenie nr 1 WŁAŚCIWOŚCI KOLIGATYWNE ROZTWORÓW I. Osmoza i ciśnienie osmotyczne Zasada: Ciśnienie osmotyczne - różnica ciśnień wywieranych na błonę półprzepuszczalną przez dwie ciecze, które błona ta
a) Sole kwasu chlorowodorowego (solnego) to... b) Sole kwasu siarkowego (VI) to... c) Sole kwasu azotowego (V) to... d) Sole kwasu węglowego to...
 Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
Wykład 3. Termodynamika i kinetyka procesowa - wykład 2. Anna Ptaszek. 24 kwietnia Katedra Inżynierii i Aparatury Przemysłu Spożywczego
 Wykład 3 wykład 2 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 24 kwietnia 2018 1 / 1 Konformacje łańcuchów Budowa amylozy i amylopektyny http://polysac3db.cermav.cnrs.fr/home.html 2 / 1 Konformacje
Wykład 3 wykład 2 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 24 kwietnia 2018 1 / 1 Konformacje łańcuchów Budowa amylozy i amylopektyny http://polysac3db.cermav.cnrs.fr/home.html 2 / 1 Konformacje
I BIOTECHNOLOGIA. 3-letnie studia stacjonarne I stopnia
 I BIOTECHNOLOGIA 3-letnie studia stacjonarne I stopnia PRZEDMIOT: CHEMIA OGÓLNA Z ELEMENTAMI CHEMII FIZYCZNEJ Ćwiczenia laboratoryjne semestr pierwszy 30 godz. Program ćwiczeń laboratoryjnych będzie realizowany
I BIOTECHNOLOGIA 3-letnie studia stacjonarne I stopnia PRZEDMIOT: CHEMIA OGÓLNA Z ELEMENTAMI CHEMII FIZYCZNEJ Ćwiczenia laboratoryjne semestr pierwszy 30 godz. Program ćwiczeń laboratoryjnych będzie realizowany
Spis treści. Wstęp... 9
 Spis treści Wstęp... 9 1. Szkło i sprzęt laboratoryjny 1.1. Szkła laboratoryjne własności, skład chemiczny, podział, zastosowanie.. 11 1.2. Wybrane szkło laboratoryjne... 13 1.3. Szkło miarowe... 14 1.4.
Spis treści Wstęp... 9 1. Szkło i sprzęt laboratoryjny 1.1. Szkła laboratoryjne własności, skład chemiczny, podział, zastosowanie.. 11 1.2. Wybrane szkło laboratoryjne... 13 1.3. Szkło miarowe... 14 1.4.
Badanie właściwości związków powierzchniowo czynnych
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA TECHNOLOGII CHEMICZNEJ ORGANICZNEJ I PETROCHEMII INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH: Badanie właściwości związków powierzchniowo czynnych Laboratorium z
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA TECHNOLOGII CHEMICZNEJ ORGANICZNEJ I PETROCHEMII INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH: Badanie właściwości związków powierzchniowo czynnych Laboratorium z
PRZYKŁADOWE ZADANIA ORGANICZNE ZWIĄZKI ZAWIERAJĄCE AZOT
 PRZYKŁADOWE ZADANIA ORGANICZNE ZWIĄZKI ZAWIERAJĄCE AZOT Zadanie 1127 (1 pkt) Uszereguj podane związki według rosnącego ph w roztworze wodnym. Właściwy porządek podaj zapisując go wzorami półstrukturalnymi.
PRZYKŁADOWE ZADANIA ORGANICZNE ZWIĄZKI ZAWIERAJĄCE AZOT Zadanie 1127 (1 pkt) Uszereguj podane związki według rosnącego ph w roztworze wodnym. Właściwy porządek podaj zapisując go wzorami półstrukturalnymi.
Optymalizacja warunków fizyko chemicznych w czasie procesu sporządzania mleka wapiennego z użyciem roztworów słodkich szczególnie pod względem
 Optymalizacja warunków fizyko chemicznych w czasie procesu sporządzania mleka wapiennego z użyciem roztworów słodkich szczególnie pod względem zmniejszenia lub wyeliminowania możliwości osadzania się osadów
Optymalizacja warunków fizyko chemicznych w czasie procesu sporządzania mleka wapiennego z użyciem roztworów słodkich szczególnie pod względem zmniejszenia lub wyeliminowania możliwości osadzania się osadów
pobrano z www.sqlmedia.pl
 ODPOWIEDZI Zadanie 1. (2 pkt) 1. masy atomowej, ładunku jądra atomowego 2. elektroujemności, masy atomowej, ładunku jądra atomowego Zadanie 2. (1 pkt) 1. Pierwiastek I jest aktywnym metalem. Reaguje z
ODPOWIEDZI Zadanie 1. (2 pkt) 1. masy atomowej, ładunku jądra atomowego 2. elektroujemności, masy atomowej, ładunku jądra atomowego Zadanie 2. (1 pkt) 1. Pierwiastek I jest aktywnym metalem. Reaguje z
ROZTWORY. Mieszaniny heterogeniczne homogeniczne Roztwory - jednorodne mieszaniny dwóch lub wi cej składników gazowe ciekłe stałe
 ROZTWORY Mieszaniny heterogeniczne homogeniczne Roztwory - jednorodne mieszaniny dwóch lub wi cej składników gazowe ciekłe stałe roztwór nienasycony - roztwór, w którym st enie substancji rozpuszczonej
ROZTWORY Mieszaniny heterogeniczne homogeniczne Roztwory - jednorodne mieszaniny dwóch lub wi cej składników gazowe ciekłe stałe roztwór nienasycony - roztwór, w którym st enie substancji rozpuszczonej
ĆWICZENIE 1. Aminokwasy
 ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
I. Cel ćwiczenia: wyznaczenie elektrochemicznego równoważnika miedzi oraz stałej Faraday a.
 WYZNACZANIE ELEKTROCHEICZNEGO RÓWNOWAŻNI- KA IEDZI I STAŁEJ FARADAYA I. Cel ćwiczenia: wyznaczenie elektrochemicznego równoważnika miedzi oraz stałej Faraday a. II. Przyrządy: naczynie szklane do elektrolizy,
WYZNACZANIE ELEKTROCHEICZNEGO RÓWNOWAŻNI- KA IEDZI I STAŁEJ FARADAYA I. Cel ćwiczenia: wyznaczenie elektrochemicznego równoważnika miedzi oraz stałej Faraday a. II. Przyrządy: naczynie szklane do elektrolizy,
Sporządzanie roztworów buforowych i badanie ich właściwości
 Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Wykład 6. Anna Ptaszek. 8 września Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Fizykochemia biopolimerów - wykład 6.
 Wykład 6 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 8 września 2016 1 / 27 Konformacje łańcuchów Budowa amylozy i amylopektyny http://polysac3db.cermav.cnrs.fr/home.html 2 / 27 Konformacje łańcuchów
Wykład 6 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 8 września 2016 1 / 27 Konformacje łańcuchów Budowa amylozy i amylopektyny http://polysac3db.cermav.cnrs.fr/home.html 2 / 27 Konformacje łańcuchów
Inżynieria Środowiska
 ROZTWORY BUFOROWE Roztworami buforowymi nazywamy takie roztwory, w których stężenie jonów wodorowych nie ulega większym zmianom ani pod wpływem rozcieńczania wodą, ani pod wpływem dodatku nieznacznych
ROZTWORY BUFOROWE Roztworami buforowymi nazywamy takie roztwory, w których stężenie jonów wodorowych nie ulega większym zmianom ani pod wpływem rozcieńczania wodą, ani pod wpływem dodatku nieznacznych
Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.
![Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów. Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.](/thumbs/97/131732752.jpg) 2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
Chemia - B udownictwo WS TiP
 Chemia - B udownictwo WS TiP dysocjacja elektrolityczna, reakcje w roztworach wodnych, ph wykład nr 2b Teoria dys ocjacji jonowej Elektrolity i nieelektrolity Wpływ polarnej budowy cząsteczki wody na proces
Chemia - B udownictwo WS TiP dysocjacja elektrolityczna, reakcje w roztworach wodnych, ph wykład nr 2b Teoria dys ocjacji jonowej Elektrolity i nieelektrolity Wpływ polarnej budowy cząsteczki wody na proces
Wymagania programowe na poszczególne oceny. Chemia Kl.2. I. Kwasy
 Wymagania programowe na poszczególne oceny Chemia Kl.2 I. Kwasy Ocena dopuszczająca zna zasady bhp dotyczące obchodzenia się z kwasami definiuje elektrolit, nieelektrolit wyjaśnia pojęcie wskaźnika i wymienia
Wymagania programowe na poszczególne oceny Chemia Kl.2 I. Kwasy Ocena dopuszczająca zna zasady bhp dotyczące obchodzenia się z kwasami definiuje elektrolit, nieelektrolit wyjaśnia pojęcie wskaźnika i wymienia
Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II
 Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II Szczegółowe kryteria oceniania po pierwszym półroczu klasy II: III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących
Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II Szczegółowe kryteria oceniania po pierwszym półroczu klasy II: III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K
![dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K](/thumbs/55/36391740.jpg) RÓWNOWAGI W ROZTWORACH Szwedzki chemik Svante Arrhenius w 1887 roku jako pierwszy wykazał, że procesowi rozpuszczania wielu substancji towarzyszy dysocjacja, czyli rozpad cząsteczek na jony naładowane
RÓWNOWAGI W ROZTWORACH Szwedzki chemik Svante Arrhenius w 1887 roku jako pierwszy wykazał, że procesowi rozpuszczania wielu substancji towarzyszy dysocjacja, czyli rozpad cząsteczek na jony naładowane
Reakcje chemiczne. Typ reakcji Schemat Przykłady Reakcja syntezy
 Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
1 Hydroliza soli. Hydroliza soli 1
 Hydroliza soli 1 1 Hydroliza soli Niektóre sole, rozpuszczone w wodzie, reagują z cząsteczkami rozpuszczalnika. Reakcja ta nosi miano hydrolizy. Reakcję hydrolizy soli o wzorze BA, można schematycznie
Hydroliza soli 1 1 Hydroliza soli Niektóre sole, rozpuszczone w wodzie, reagują z cząsteczkami rozpuszczalnika. Reakcja ta nosi miano hydrolizy. Reakcję hydrolizy soli o wzorze BA, można schematycznie
Powstawanie żelazianu(vi) sodu przebiega zgodnie z równaniem: Ponieważ termiczny rozkład kwasu borowego(iii) zachodzi zgodnie z równaniem:
 Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
STAłA I STOPIEŃ DYSOCJACJI; ph MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia!
 STAłA I STOPIEŃ DYSOCJACJI; ph MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Obliczyć stężenie molowe jonów Ca 2+ w roztworze zawierającym 2,22g CaCl2 w 100 ml roztworu, przyjmując a = 100%. 002
STAłA I STOPIEŃ DYSOCJACJI; ph MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Obliczyć stężenie molowe jonów Ca 2+ w roztworze zawierającym 2,22g CaCl2 w 100 ml roztworu, przyjmując a = 100%. 002
Sole. 2. Zaznacz reszty kwasowe w poniższych solach oraz wartościowości reszt kwasowych: CaBr 2 Na 2 SO 4
 Sole 1. Podkreśl poprawne uzupełnienia zdań: Sole to związki, które dysocjują w wodzie na kationy/aniony metali oraz kationy/ aniony reszt kwasowych. W temperaturze pokojowej mają stały/ ciekły stan skupienia
Sole 1. Podkreśl poprawne uzupełnienia zdań: Sole to związki, które dysocjują w wodzie na kationy/aniony metali oraz kationy/ aniony reszt kwasowych. W temperaturze pokojowej mają stały/ ciekły stan skupienia
Wodorotlenki. n to liczba grup wodorotlenowych w cząsteczce wodorotlenku (równa wartościowości M)
 Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
Materiał powtórzeniowy do sprawdzianu - roztwory i sposoby wyrażania stężeń roztworów, rozcieńczanie i zatężanie roztworów, zadania z rozwiązaniami
 Materiał powtórzeniowy do sprawdzianu - roztwory i sposoby wyrażania stężeń roztworów, rozcieńczanie i zatężanie roztworów, zadania z rozwiązaniami I. Mieszaniny Mieszanina to układ przynajmniej dwuskładnikowy
Materiał powtórzeniowy do sprawdzianu - roztwory i sposoby wyrażania stężeń roztworów, rozcieńczanie i zatężanie roztworów, zadania z rozwiązaniami I. Mieszaniny Mieszanina to układ przynajmniej dwuskładnikowy
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018. Eliminacje szkolne
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
Odwracalność przemiany chemicznej
 Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
USUWANIE ZWIĄZKÓW FOSFORU W PROCESIE KOAGULACJI OBJĘTOŚCIOWEJ
 1 Aktualizacja 14.02.2012r. USUWANIE ZWIĄZKÓW FOSFORU W PROCESIE KOAGULACJI OBJĘTOŚCIOWEJ 1. Wprowadzenie Zanieczyszczenia zawarte w wodzie i ściekach występują w różnej postaci. W zależności od rozmiarów
1 Aktualizacja 14.02.2012r. USUWANIE ZWIĄZKÓW FOSFORU W PROCESIE KOAGULACJI OBJĘTOŚCIOWEJ 1. Wprowadzenie Zanieczyszczenia zawarte w wodzie i ściekach występują w różnej postaci. W zależności od rozmiarów
UKŁADY DYSPERSYJNE GLEB KOLOIDY GLEBOWE
 25 25 5 50 UKŁADY DYSPERSYJNE GLEB KOLOIDY GLEBOWE Faza stała związki mineralne, minerały pierwotne - minerały wtórne Faza płynna wodne roztwory rzeczywiste i koloidalne o zmiennym składzie jakościowym
25 25 5 50 UKŁADY DYSPERSYJNE GLEB KOLOIDY GLEBOWE Faza stała związki mineralne, minerały pierwotne - minerały wtórne Faza płynna wodne roztwory rzeczywiste i koloidalne o zmiennym składzie jakościowym
4. Równowagi w układach heterogenicznych.
 Do doświadczeń stosować suche szkło i sprzęt laboratoryjny. Po użyciu szkło i sprzęt laboratoryjny należy wstępnie opłukać, a po zakończonych eksperymentach dokładnie umyć (przy użyciu detergentów) i pozostawić
Do doświadczeń stosować suche szkło i sprzęt laboratoryjny. Po użyciu szkło i sprzęt laboratoryjny należy wstępnie opłukać, a po zakończonych eksperymentach dokładnie umyć (przy użyciu detergentów) i pozostawić
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak)
 Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak) 1. Właściwości roztworów buforowych Dodatek nieznacznej ilości mocnego kwasu lub mocnej zasady do czystej wody powoduje stosunkowo dużą
Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak) 1. Właściwości roztworów buforowych Dodatek nieznacznej ilości mocnego kwasu lub mocnej zasady do czystej wody powoduje stosunkowo dużą
UNIWERSYTET W BIAŁYMSTOKU. WYDZIAŁ BIOLOGICZNO-CHEMICZNY Instytut Chemii Zakład Elektrochemii. r. ak. 2017/2018
 UNIWERSYTET W BIAŁYMSTOKU WYDZIAŁ BIOLOGICZNO-CHEMICZNY Instytut Chemii Zakład Elektrochemii r. ak. 2017/2018 INSTRUKCJE DO ĆWICZEŃ WODA I KOLOIDY W CHEMII ŻYWNOŚCI CHEMIA II st. 1 rok WYMAGANIA: ĆWICZENIE
UNIWERSYTET W BIAŁYMSTOKU WYDZIAŁ BIOLOGICZNO-CHEMICZNY Instytut Chemii Zakład Elektrochemii r. ak. 2017/2018 INSTRUKCJE DO ĆWICZEŃ WODA I KOLOIDY W CHEMII ŻYWNOŚCI CHEMIA II st. 1 rok WYMAGANIA: ĆWICZENIE
MAŁOPOLSKI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW
 MAŁOPOLSKI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW Etap I (szkolny) 22 października 2013 roku Materiały dla nauczycieli Rozwiązania zadań wraz z punktacją Uwagi ogólne: - Za prawidłowe rozwiązanie zadań rachunkowych
MAŁOPOLSKI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW Etap I (szkolny) 22 października 2013 roku Materiały dla nauczycieli Rozwiązania zadań wraz z punktacją Uwagi ogólne: - Za prawidłowe rozwiązanie zadań rachunkowych
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego. II Etap - 18 stycznia 2016
 XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap szkolny rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap szkolny rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
Scenariusz lekcji w technikum zakres podstawowy 2 godziny
 Scenariusz lekcji w technikum zakres podstawowy 2 godziny Temat : Hydroliza soli. Cele dydaktyczno wychowawcze: Wyjaśnienie przyczyn różnych odczynów soli Uświadomienie różnej roli wody w procesach dysocjacji
Scenariusz lekcji w technikum zakres podstawowy 2 godziny Temat : Hydroliza soli. Cele dydaktyczno wychowawcze: Wyjaśnienie przyczyn różnych odczynów soli Uświadomienie różnej roli wody w procesach dysocjacji
Ćwiczenie 1: Wyznaczanie warunków odporności, korozji i pasywności metali
 Ćwiczenie 1: Wyznaczanie warunków odporności, korozji i pasywności metali Wymagane wiadomości Podstawy korozji elektrochemicznej, wykresy E-pH. Wprowadzenie Główną przyczyną zniszczeń materiałów metalicznych
Ćwiczenie 1: Wyznaczanie warunków odporności, korozji i pasywności metali Wymagane wiadomości Podstawy korozji elektrochemicznej, wykresy E-pH. Wprowadzenie Główną przyczyną zniszczeń materiałów metalicznych
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
PROCESY JEDNOSTKOWE W TECHNOLOGIACH ŚRODOWISKOWYCH WYMIANA JONOWA
 KIiChŚ PROCESY JEDNOSTKOWE W TECHNOLOGIACH ŚRODOWISKOWYCH Ćwiczenie nr 2 WYMIANA JONOWA Cel ćwiczenia Celem ćwiczenia jest określenie roboczej zdolności wymiennej jonitu na podstawie eksperymentalnie wyznaczonej
KIiChŚ PROCESY JEDNOSTKOWE W TECHNOLOGIACH ŚRODOWISKOWYCH Ćwiczenie nr 2 WYMIANA JONOWA Cel ćwiczenia Celem ćwiczenia jest określenie roboczej zdolności wymiennej jonitu na podstawie eksperymentalnie wyznaczonej
Wymagania programowe na poszczególne oceny. III. Woda i roztwory wodne. Ocena dopuszczająca [1] Uczeń: Ocena dostateczna [1 + 2]
![Wymagania programowe na poszczególne oceny. III. Woda i roztwory wodne. Ocena dopuszczająca [1] Uczeń: Ocena dostateczna [1 + 2] Wymagania programowe na poszczególne oceny. III. Woda i roztwory wodne. Ocena dopuszczająca [1] Uczeń: Ocena dostateczna [1 + 2]](/thumbs/97/134409727.jpg) Wymagania programowe na poszczególne oceny III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących podaje, na czym polega obieg wody wymienia stany skupienia wody nazywa przemiany stanów skupienia
Wymagania programowe na poszczególne oceny III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących podaje, na czym polega obieg wody wymienia stany skupienia wody nazywa przemiany stanów skupienia
WYZNACZANIE ROZMIARÓW
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 6 WYZNACZANIE ROZMIARÓW MAKROCZĄSTECZEK I. WSTĘP TEORETYCZNY Procesy zachodzące między atomami lub cząsteczkami w skali molekularnej
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 6 WYZNACZANIE ROZMIARÓW MAKROCZĄSTECZEK I. WSTĘP TEORETYCZNY Procesy zachodzące między atomami lub cząsteczkami w skali molekularnej
Reakcje hydrolizy soli
 Literka.pl Reakcje hydrolizy soli Data dodania: 2006-05-18 12:40:00 Scenariusz leckji chemi dla uczniów klasy 1 liceum ogólnokształcącego przeprowadzonej w ramach zewnętrznego mierzenia jakości pracy szkoły.
Literka.pl Reakcje hydrolizy soli Data dodania: 2006-05-18 12:40:00 Scenariusz leckji chemi dla uczniów klasy 1 liceum ogólnokształcącego przeprowadzonej w ramach zewnętrznego mierzenia jakości pracy szkoły.
STAN KOLOIDALNY MATERII
 Barbara Wróbel STAN KOLOIDALNY MATERII 1. Pojęcie i klasyfikacja koloidów Stan koloidalny jest stanem skupienia materii równie powszechnym jak stan gazowy, ciekły lub stały. Cechą charakterystyczną stanu
Barbara Wróbel STAN KOLOIDALNY MATERII 1. Pojęcie i klasyfikacja koloidów Stan koloidalny jest stanem skupienia materii równie powszechnym jak stan gazowy, ciekły lub stały. Cechą charakterystyczną stanu
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 7
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
K05 Instrukcja wykonania ćwiczenia
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego K05 Instrukcja wykonania ćwiczenia Wyznaczanie punktu izoelektrycznego żelatyny metodą wiskozymetryczną Zakres zagadnień obowiązujących do ćwiczenia 1. Układy
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego K05 Instrukcja wykonania ćwiczenia Wyznaczanie punktu izoelektrycznego żelatyny metodą wiskozymetryczną Zakres zagadnień obowiązujących do ćwiczenia 1. Układy
Zadanie 2. Przeprowadzono następujące doświadczenie: Wyjaśnij przebieg tego doświadczenia. Zadanie: 3. Zadanie: 4
 Zadanie: 1 Do niebieskiego, wodnego roztworu soli miedzi wrzucono żelazny gwóźdź i odstawiono na pewien czas. Opisz zmiany zachodzące w wyglądzie: roztworu żelaznego gwoździa Zadanie 2. Przeprowadzono
Zadanie: 1 Do niebieskiego, wodnego roztworu soli miedzi wrzucono żelazny gwóźdź i odstawiono na pewien czas. Opisz zmiany zachodzące w wyglądzie: roztworu żelaznego gwoździa Zadanie 2. Przeprowadzono
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów. 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań Maksymalna liczba punktów 40. 90% 36 pkt. Uwaga! 1. Wszystkie
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań Maksymalna liczba punktów 40. 90% 36 pkt. Uwaga! 1. Wszystkie
Reakcje utleniania i redukcji Reakcje metali z wodorotlenkiem sodu (6 mol/dm 3 )
 Imię i nazwisko.. data.. Reakcje utleniania i redukcji 7.1 Reaktywność metali 7.1.1 Reakcje metali z wodą Lp Metal Warunki oczyszczania metalu Warunki reakcji Obserwacje 7.1.2 Reakcje metali z wodorotlenkiem
Imię i nazwisko.. data.. Reakcje utleniania i redukcji 7.1 Reaktywność metali 7.1.1 Reakcje metali z wodą Lp Metal Warunki oczyszczania metalu Warunki reakcji Obserwacje 7.1.2 Reakcje metali z wodorotlenkiem
CHEMIA KLASA II I PÓŁROCZE
 CHEMIA KLASA II I PÓŁROCZE wymienia zasady bhp dotyczące obchodzenia się z kwasami definiuje pojęcia: elektrolit i nieelektrolit wyjaśnia, co to jest wskaźnik i wymienia trzy przykłady odróżnia kwasy od
CHEMIA KLASA II I PÓŁROCZE wymienia zasady bhp dotyczące obchodzenia się z kwasami definiuje pojęcia: elektrolit i nieelektrolit wyjaśnia, co to jest wskaźnik i wymienia trzy przykłady odróżnia kwasy od
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
KLUCZ ODPOWIEDZI KONKURS PRZEDMIOTOWY DLA UCZNIÓW SZKÓŁ GIMNAZJALNYCH WOJEWÓDZTWA PODKARPACKIEGO Przedmiot: CHEMIA C A C C B A B B D B C D A A
 KLUCZ ODPOWIEDZI KONKURS PRZEDMIOTOWY DLA UCZNIÓW SZKÓŁ GIMNAZJALNYCH WOJEWÓDZTWA PODKARPACKIEGO Przedmiot: CHEMIA /etap wojewódzki/ Możliwa do uzyskania liczba punktów: 74 pkt Zadania zamknięte: 1 2 3
KLUCZ ODPOWIEDZI KONKURS PRZEDMIOTOWY DLA UCZNIÓW SZKÓŁ GIMNAZJALNYCH WOJEWÓDZTWA PODKARPACKIEGO Przedmiot: CHEMIA /etap wojewódzki/ Możliwa do uzyskania liczba punktów: 74 pkt Zadania zamknięte: 1 2 3
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Politechnika Gdańska Wydział Chemiczny. Katedra Technologii Chemicznej
 Politechnika Gdańska Wydział Chemiczny Katedra Technologii Chemicznej Bezpieczeństwo środowiskowe Sorpcyjne właściwości gleb Przygotował: dr inż. Andrzej P. Nowak Gleba, czyli pedosfera, jest naturalnym
Politechnika Gdańska Wydział Chemiczny Katedra Technologii Chemicznej Bezpieczeństwo środowiskowe Sorpcyjne właściwości gleb Przygotował: dr inż. Andrzej P. Nowak Gleba, czyli pedosfera, jest naturalnym
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab
 SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
Wymagania programowe na poszczególne oceny. IV. Kwasy. Ocena bardzo dobra. Ocena dostateczna. Ocena dopuszczająca. Ocena dobra [1] [ ]
![Wymagania programowe na poszczególne oceny. IV. Kwasy. Ocena bardzo dobra. Ocena dostateczna. Ocena dopuszczająca. Ocena dobra [1] [ ] Wymagania programowe na poszczególne oceny. IV. Kwasy. Ocena bardzo dobra. Ocena dostateczna. Ocena dopuszczająca. Ocena dobra [1] [ ]](/thumbs/59/43143309.jpg) Wymagania programowe na poszczególne oceny IV. Kwasy Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra [1] [1 + 2] [1 + 2 + 3] [1 + 2 + 3 + 4] wymienia zasady bhp dotyczące obchodzenia
Wymagania programowe na poszczególne oceny IV. Kwasy Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra [1] [1 + 2] [1 + 2 + 3] [1 + 2 + 3 + 4] wymienia zasady bhp dotyczące obchodzenia
ĆWICZENIE 2 KONDUKTOMETRIA
 ĆWICZENIE 2 KONDUKTOMETRIA 1. Oznaczanie słabych kwasów w sokach i syropach owocowych metodą miareczkowania konduktometrycznego Celem ćwiczenia jest ilościowe oznaczenie zawartości słabych kwasów w sokach
ĆWICZENIE 2 KONDUKTOMETRIA 1. Oznaczanie słabych kwasów w sokach i syropach owocowych metodą miareczkowania konduktometrycznego Celem ćwiczenia jest ilościowe oznaczenie zawartości słabych kwasów w sokach
ĆWICZENIE 4. Roztwory i ich właściwości
 I. Roztwory rzeczywiste ĆWICZENIE 4 Roztwory i ich właściwości 1. Sporządzanie roztworu CuSO 4 o określonym stężeniu procentowym - wykonać w zespołach 2-osobowych W celu sporządzenia 25 lub 50 ml 10% m/v
I. Roztwory rzeczywiste ĆWICZENIE 4 Roztwory i ich właściwości 1. Sporządzanie roztworu CuSO 4 o określonym stężeniu procentowym - wykonać w zespołach 2-osobowych W celu sporządzenia 25 lub 50 ml 10% m/v
g % ,3%
 PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
