Aneks II. Wnioski naukowe
|
|
|
- Ryszard Niemiec
- 7 lat temu
- Przeglądów:
Transkrypt
1 Aneks II Wnioski naukowe 11
2 Wnioski naukowe Po rozważeniu zmienionego ostatecznego zalecenia PRAC z dnia 10 lipca 2014 r. dotyczącego produktów leczniczych zawierających diacereinę CMDh zgadza się z tym zaleceniem, co opisano poniżej: Ogólne podsumowanie oceny naukowej dotyczącej produktów leczniczych zawierających diacereinę (patrz aneks I) Diacereina jest lekiem objawowym o spowolnionym działaniu, stosowanym w chorobie zwyrodnieniowej stawów (SYSADOA). Mimo że mechanizm jego działania nie jest do końca znany, różni się on od niesteroidowych leków przeciwzapalnych (NLPZ) tym, że nie hamuje syntezy prostaglandyn ani nie wpływa na ich stężenie. Diacereina i jej aktywny metabolit, reina, są pochodnymi antrachinonu. Uważa się, że diacereina działa poprzez blokowanie/ograniczanie działania interleukiny-1β, białka biorącego udział w procesie niszczenia chrząstki stawowej i zapalenia mazi stawowej (Yaron M i wsp., 1999; Alvarez Soria i wsp., 2008; Legendre F i wsp., 2009). Diacereina była głównie wskazana do stosowania doustnego w leczeniu choroby zwyrodnieniowej stawów (ang. osteoarthritis, OA) przewlekłej choroby uszkadzającej stawy, często występującej w starzejącej się populacji. Ból i niepełnosprawność funkcjonalna dotkniętych chorobą stawów to główne objawy choroby zwyrodnieniowej stawów. Prawidłowe rozpoznanie obejmuje kryteria kliniczne i radiologiczne. Zasadniczo leczenie obejmuje metody niefarmakologiczne, takie jak kontrolowanie wagi, fizjoterapia, ćwiczenia fizyczne i edukacja pacjentów, jak również interwencje farmakologiczne. Nie osiągnięto konsensusu w sprawie udziału SYSADOA w leczeniu farmakologicznym OA. Ich rola w leczeniu jest uważana za uzupełniającą w stosunku do leków przeciwbólowych i przeciwzapalnych. W 2012 roku właściwy organ narodowy Francji (fr. Agence nationale de sécurité du médicament et des produits de santé, ANSM) wszczął procedurę ponownej oceny stosunku korzyści do ryzyka stosowania produktów leczniczych zawierających diacereinę, w której podkreślono występowanie bardzo częstych zaburzeń trawiennych, przypadków zapalenia wątroby i ciężkich reakcji skórnych u pacjentów leczonych diacereiną. Dodatkowo i zgodnie z badaniami klinicznymi oraz danymi literaturowymi skuteczność leku w leczeniu objawowym choroby zwyrodnieniowej stawów okazała się słaba, z niewielkim wpływem na ból i objawy funkcjonalne oraz bez wyraźnego zmniejszenia przyjmowania NLPZ w grupie leczonej diacereiną. W związku z powyższym ANSM zwrócił się do PRAC z prośbą o wydanie zalecenia dotyczącego stosunku korzyści do ryzyka stosowania produktów leczniczych zawierających diacereinę w zatwierdzonych wskazaniach oraz kwestii, czy przyznane pozwolenia na dopuszczenie tych leków do obrotu powinny być utrzymane, zmienione, zawieszone lub wycofane. Kwestie skuteczności W ramach tej procedury arbitrażowej PRAC dokonał przeglądu wszystkich dostępnych danych dotyczących skuteczności produktów leczniczych zawierających diacereinę. Działanie diacereiny na ból i sprawność fizyczną stawów poddano ocenie w szeregu badań jako pierwszorzędowe punkty końcowe. W kilku badaniach dokonano również oceny działania diacereiny modyfikującego strukturę chrząstki oraz jej wpływu na ograniczenie przyjmowania NLPZ (drugorzędowy punkt końcowy). Badania kliniczne prowadzone metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo z ostatnich 20 lat wykazały zróżnicowane wyniki, co można wytłumaczyć zwykle silnym efektem placebo w tego typu wskazaniach. Ogólnie badania te wykazały niewielki, ale istotny statystycznie wpływ 12
3 diacereiny na ból i sprawność fizyczną. Jednak mimo że metoda podwójnie ślepej próby była założeniem metodologicznym badań klinicznych z użyciem diacereiny, uznano za wątpliwe, by udało się osiągnąć zaślepienie w praktyce, biorąc pod uwagę bardzo wyraźne objawy działania (zabarwienie moczu, biegunka) diacereiny. W żadnym z badań nie odniesiono się do tej kwestii. Ponadto brakujące dane oraz sposób ich opracowania uznano za problematyczne ze statystycznego punktu widzenia. Dowody uzyskane z różnych metaanaliz badań klinicznych z użyciem diacereiny wykazały niewielkie korzystne działanie diacereiny w leczeniu OA stawu kolanowego i biodrowego z zastosowaniem różnych kryteriów włączenia badań klinicznych do metaanalizy. Niemniej jednak jakość badań była zróżnicowana i nie można wykluczyć stronniczości publikacji, ponieważ do systematycznego przeglądu włączano tylko publikowane i niepublikowane badania sponsorowane przez firmy. Główne badania oceniające progresję strukturalną lub właściwości modyfikujące przebieg OA ((i) badanie Echodiah (Dougados i wsp., 2001) z udziałem 255 pacjentów w grupie przyjmującej diacereinę i 252 pacjentów w grupie przyjmującej placebo oraz (ii) badanie Pham (2004) z udziałem 85 pacjentów w grupie przyjmującej diacereinę i 85 pacjentów w grupie przyjmującej placebo przez okres jednego roku) nie przedstawiły przekonujących dowodów na wpływ diacereiny na ból lub sprawność fizyczną. Dodatkowo w obu przypadkach autorzy badań zgłosili brak różnic między grupami pod względem zużycia środków przeciwbólowych. Tylko badanie autorstwa Dougados i wsp. wykazało skuteczność względem zmiennych związanych z korzystnym wpływem diacereiny na progresję strukturalną lub właściwościami modyfikującymi przebieg OA. W drugim badaniu klinicznym diacereina została użyta w jednej z grup kontrolnych w celu wykazania działania kwasu hialuronowego w postaci wstrzyknięć dostawowych na progresję OA, co nie zostało osiągnięte. Dostępne dane nie były zatem wystarczające do wyciągnięcia wniosków na temat działania diacereiny związanego z modyfikacją struktury chrząstki w przebiegu choroby zwyrodnieniowej stawów, a dane dotyczące potencjalnego wpływu diacereiny na opóźnienie zabiegu nie są dostępne. W końcu w kilku randomizowanych badaniach klinicznych przeprowadzonych metodą podwójnie ślepej próby analizowano ograniczenie przyjmowania NLPZ związane z działaniem diacereiny jako drugorzędowy punkt końcowy. Ograniczenie przyjmowania NLPZ wykazano tylko w jednym badaniu, w związku z czym to działanie diacereiny nie zostało potwierdzone. Jednak wzięto pod uwagę wpływ diacereiny na ograniczenie przyjmowania paracetamolu wykazany w czterech z ośmiu badań klinicznych. Kwestie bezpieczeństwa PRAC dokonał przeglądu wszystkich dostępnych danych z badań klinicznych, opublikowanego piśmiennictwa oraz informacji zebranych po wprowadzeniu produktów do obrotu dotyczących bezpieczeństwa stosowania produktów zawierających diacereinę, w szczególności w odniesieniu do ryzyka wystąpienia hepatotoksyczności, a także zaburzeń żołądkowo-jelitowych i skórnych. Diacereina, podobnie jak i inne pochodne antrachinonu, wykazuje działanie hepatotoksyczne, którego mechanizm jest nieznany. Choć zauważono, że dane z badań klinicznych nie wykazały istotnych różnic w odniesieniu do zaburzeń czynności wątroby między grupami przyjmującymi diacereinę i placebo, to w większości przypadków zaburzenia te występowały w grupie przyjmującej diacereinę. Ponadto przedstawiono dowody na występowanie reakcji ze strony wątroby, w tym objawowej ostrej niewydolności wątroby. Około 10% zgłoszonych niepożądanych działań leku (ang. adverse drug reactions, ADR) stanowiły zaburzenia czynności wątroby i w ponad 68% tych przypadków diacereina była jedynym lekiem podejrzanym. Ponadto dwa przypadki budziły poważne wątpliwości: jeden śmiertelny przypadek zapalenia wątroby, w którym nie znaleziono żadnych innych przyczyn zapalenia 13
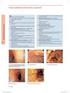
4 wątroby z wyjątkiem diacereiny, i jeden przypadek ostrego zapalenia wątroby z chronologią wskazującą na działanie leku i bez innego wyjaśnienia. W odniesieniu do ryzyka wystąpienia zaburzeń żołądkowo-jelitowych biegunka była najczęstszą i oczekiwaną reakcją na diacereinę. Działanie przeczyszczające diacereiny zaobserwowano u maksymalnie 50% pacjentów przyjmujących ten lek w badaniach klinicznych. Niektóre badania wskazały, że u 25% pacjentów z biegunką podczas leczenia diacereiną wystąpiła przewlekła biegunka, definiowana jako biegunka utrzymująca się dłużej niż 4 tygodnie. Wysoki odsetek pacjentów przerywających leczenie w badaniach klinicznych z powodu biegunki wykazał, że tolerancja leczenia była mniejsza w grupie przyjmującej diacereinę w porównaniu z grupą przyjmującą placebo. Ze spontanicznych doniesień wynika, że jedna czwarta ciężkich przypadków zaburzeń żołądkowojelitowych była związana z występowaniem biegunki. PRAC zauważył również, że w spontanicznych powiadomieniach zgłoszono ciężkie przypadki biegunki z odwodnieniem i zaburzeń poziomu elektrolitów. Przedstawiono również niektóre przypadki hospitalizacji w celu dalszego zbadania występowania biegunki. Wywołało to obawy PRAC i należy zauważyć, że przypadki te naraziły pacjentów na badania inwazyjne (tj. kolonoskopię z biopsją). Dodatkowo kontrolowanie biegunki może również narazić pacjentów na leczenie objawowe. W końcu, w odniesieniu do ryzyka występowania schorzeń skórnych, zwrócono uwagę na problemy dotyczące bezpieczeństwa stosowania diacereiny po opublikowaniu śmiertelnego przypadku toksycznej nekrolizy naskórka, w którym diacereina była lekiem najbardziej podejrzanym. Bieżąca ocena wykazała, że najczęściej występującymi reakcjami skórnymi zgłaszanymi w badaniach klinicznych były wysypka, świąd i egzema, ale dostępne dane uzyskane po wprowadzeniu produktów do obrotu ujawniły przypadki występowania rumienia wielopostaciowego, zespołu Stevensa-Johnsona (SJS) i toksycznej nekrolizy naskórka (TEN). Ze względu na ograniczoną ilość dostępnych informacji na temat tych przypadków PRAC nie był w stanie ocenić ryzyka, ale nie można wykluczyć toksyczności skórnej diacereiny. Podsumowując, stwierdzono, że najczęściej zgłaszanymi reakcjami związanymi ze stosowaniem diacereiny, zgodnie z oczekiwaniami, były zaburzenia żołądkowo-jelitowe, zwłaszcza biegunka, które często miały ciężkie nasilenie i prowadziły do powstania powikłań takich jak odwodnienie oraz zaburzenia równowagi płynów i elektrolitów. Ponadto zgłoszono przypadki zwiększonego stężenia enzymów wątrobowych oraz ciężkie przypadki obejmujące śmiertelną reakcję ze strony wątroby u pacjenta leczonego diacereiną. Stosunek korzyści do ryzyka Po uwzględnieniu ogółu danych przedłożonych przez podmioty odpowiedzialne na piśmie oraz w formie wyjaśnień ustnych PRAC stwierdził, że stosunek korzyści do ryzyka stosowania produktów zawierających diacereinę jest niekorzystny w zatwierdzonych obecnie wskazaniach. Procedura ponownej oceny Po posiedzeniu CHMP w listopadzie 2013 r. i wydaniu zalecenia przez PRAC dwa podmioty odpowiedzialne nie zgodziły się z początkowym zaleceniem dotyczącym zawieszenia pozwolenia na dopuszczenie do obrotu. Podmioty te uznały, że istnieją wystarczające dane potwierdzające skuteczność diacereiny w leczeniu objawowym choroby zwyrodnieniowej stawu biodrowego i kolanowego oraz zaproponowały kolejne środki służące zminimalizowaniu ryzyka wystąpienia biegunki i potencjalnego ryzyka wystąpienia reakcji ze strony wątroby w związku ze stosowaniem diacereiny. 14
5 PRAC potwierdził, że rozważono całość danych przedłożonych przez podmioty odpowiedzialne w kontekście pierwszej procedury arbitrażowej. Mimo to, biorąc pod uwagę nowe propozycje podmiotów odpowiedzialnych dotyczące możliwych środków służących zminimalizowaniu ryzyka, w ramach ponownej oceny PRAC od nowa przeprowadził ocenę dostępnych danych. PRAC przyznał, że mimo wad dostępnych randomizowanych badań klinicznych i metaanaliz, badania kliniczne wykazały niewielkie i statystycznie istotne działanie diacereiny w punktach końcowych obejmujących łagodzenie bólu i niepełnosprawności funkcjonalnej. Dodatkowo metaanalizy potwierdziły niewielkie, ale stałe korzystne działanie diacereiny na objawy OA. Diacereina wykazuje opóźniony początek działania i nie powinna być zalecana u pacjentów z szybko postępującą chorobą zwyrodnieniową stawu biodrowego, ponieważ może u nich wystąpić słabsza odpowiedź na leczenie. Ponownie stwierdzono, że w prezentowanych badaniach nie wykazano działania diacereiny modyfikującego strukturę chrząstki w przebiegu OA ani długoterminowej skuteczności leku, jednak w trzech badaniach potwierdzono wystąpienie efektu przeniesienia. Ponadto, jak oceniono wcześniej, wykazano wpływ leku na ograniczenie przyjmowania paracetamolu (w ośmiu badaniach) i NLPZ (w jednym badaniu), ale konieczne byłyby dalsze badania w celu potwierdzenia tych wyników. W odniesieniu do profilu bezpieczeństwa diacereiny zauważono, że najczęściej zgłaszane zdarzenia związane ze stosowaniem diacereiny zgodnie z zaleceniami (100 mg/dzień) w badaniach klinicznych to luźne stolce i biegunka, w tym ciężka jej postać. Zwrócono również uwagę na fakt, że w większości przypadków początek biegunki wywołanej stosowaniem diacereiny miał miejsce wkrótce po rozpoczęciu leczenia i biegunka ta wydawała się odwracalna po przerwaniu leczenia. Zgłoszono reakcje ze strony wątroby, w tym objawową ostrą niewydolność wątroby i jeden śmiertelny przypadek piorunującego zapalenia wątroby. W celu zminimalizowania tego ryzyka zaproponowano szereg środków. Należą do nich zmniejszenie zalecanego dawkowania na początku leczenia i nowe środki, takie jak przeciwwskazanie do stosowania u pacjentów z chorobą wątroby, wyraźne zalecenie dla pacjentów, aby przerwać leczenie w momencie pojawienia się biegunki, oraz ograniczenie stosowania u pacjentów w wieku 65 lat i starszych. Ponadto ze względu na ryzyko wystąpienia zaburzeń żołądkowo-jelitowych i potencjalne ryzyko wystąpienia reakcji ze strony wątroby PRAC rozważył ograniczenie przepisywania leku do specjalistów z doświadczeniem w leczeniu choroby zwyrodnieniowej stawów. W odniesieniu do dawkowania, ponieważ u niektórych pacjentów mogą wystąpić luźne stolce lub biegunka po przyjmowaniu dwóch kapsułek na dobę w ciągu kilku pierwszych tygodni leczenia, zaleca się rozpoczęcie leczenia z zastosowaniem połowy zalecanej dobowej dawki, t.j. jednej kapsułki zawierającej 50 mg diacereiny na dobę. Większość przejściowych biegunek jest zgłaszana w pierwszych 2 4 tygodniach, a przeczyszczające właściwości diacereiny wydają się zależne od dawki. Zauważono, że korzystne wyniki w przypadku pierwszorzędowego kryterium, wizualnej skali analogowej (VAS) oceny bólu podczas ruchu, zostały wykazane u pacjentów leczonych dawką 50 mg/dobę. Dodatkowo w badaniu porównawczym dotyczącym skuteczności i tolerancji dwóch sposobów leczenia diacereiną [zwykłe leczenie (50 mg dwa razy na dobę) przez 3 miesiące oraz leczenie progresywne (50 mg raz na dobę przez miesiąc, następnie 50 mg dwa razy na dobę przez dwa miesiące] odsetek pacjentów, u których wystąpiła biegunka, zmniejszył się o około 10% w grupie leczonej 50 mg diacereiny raz na dobę, a następnie 50 mg dwa razy na dobę, w porównaniu z grupą bez miareczkowania. PRAC podkreślił konieczność przerwania przez pacjentów leczenia diacereiną w momencie pojawienia się biegunki w celu uniknięcia jej powikłań, takich jak odwodnienie i hipokaliemia. Dodatkowo za niezbędne uznano ostrzeżenia dla pacjentów otrzymujących równocześnie leki moczopędne, glikozydy nasercowe lub środki przeczyszczające. Stwierdzono również, że diacereina nie powinna być już zalecana u pacjentów w wieku 65 lat i starszych, ponieważ ta grupa pacjentów jest bardziej narażona na powikłania biegunki. Należy przyznać, że OA stawu biodrowego i kolanowego obserwuje się częściej w populacji osób starszych. Dlatego diacereina nadal jest odpowiednią opcją leczenia dla niektórych 15
6 pacjentów w leczeniu objawowym OA stawu biodrowego i kolanowego. Zaleca się jednak ostrożność, a pacjenci muszą przerwać leczenie, jeśli wystąpi u nich biegunka. W związku z potencjalnym ryzykiem wystąpienia reakcji ze strony wątroby zgłoszono kilka przypadków wątrobowych zdarzeń niepożądanych i jeden śmiertelny przypadek zapalenia wątroby. PRAC był zdania, że stosowanie diacereiny powinno być przeciwwskazane u pacjentów z występującą obecnie i/lub w przeszłości chorobą wątroby oraz że przed rozpoczęciem leczenia pacjent powinien zostać poddany badaniom przesiewowym pod kątem głównych przyczyn czynnej choroby wątroby. Informacja o produkcie powinna odzwierciedlać zalecenia dotyczące kontrolowania objawów niewydolności wątroby, należy też zachować ostrożność podczas stosowania diacereiny równocześnie z innymi produktami leczniczymi związanymi z niewydolnością wątroby. W trakcie leczenia diacereiną pacjentom należy zalecić ograniczenie spożycia alkoholu. Dodatkowo leczenie diacereiną należy przerwać w przypadku wykrycia zwiększonego stężenia enzymów wątrobowych lub podejrzenia wystąpienia oznak i objawów niewydolności wątroby. Aby dopilnować przeprowadzenia odpowiednich badań przesiewowych pacjentów w chwili rozpoczęcia leczenia, PRAC zalecił również rozpoczęcie podawania diacereiny wyłącznie pod nadzorem specjalistów z doświadczeniem w leczeniu choroby zwyrodnieniowej stawów. Ponadto PRAC uznał, że corocznie należy przedkładać okresowe raporty o bezpieczeństwie (ang. Periodic Safety Update Reports, PSUR). Nie uznano za konieczne zastosowania dodatkowych środków minimalizacji ryzyka w ramach planu zarządzania ryzykiem. Ogólny stosunek korzyści do ryzyka Na podstawie wszystkich dostępnych danych dotyczących bezpieczeństwa stosowania i skuteczności diacereiny oraz biorąc pod uwagę wszystkie środki służące zminimalizowaniu ryzyka zaproponowane podczas procedur pierwotnej i ponownej oceny PRAC stwierdził, że stosunek korzyści do ryzyka stosowania produktów leczniczych zawierających diacereinę jest w dalszym ciągu korzystny w leczeniu objawowym choroby zwyrodnieniowej stawów pod warunkiem wprowadzenia zmian do informacji o produkcie i spełnienia określonych warunków. Podstawy do zalecenia PRAC Zważywszy, że PRAC rozważył procedurę zgodną z art. 31 dyrektywy 2001/83/WE dotyczącą produktów leczniczych zawierających diacereinę w oparciu o dane uzyskane w ramach nadzoru nad bezpieczeństwem farmakoterapii; PRAC dokonał przeglądu wszystkich dostępnych danych dotyczących skuteczności i bezpieczeństwa stosowania leków zawierających diacereinę, a w szczególności danych dotyczących ryzyka wystąpienia hepatotoksyczności, zaburzeń żołądkowo-jelitowych i reakcji skórnych, dostarczonych przez podmioty odpowiedzialne na piśmie oraz w formie wyjaśnień ustnych; PRAC uwzględnił podstawy do ponownej oceny dostarczone przez podmioty odpowiedzialne na piśmie oraz w formie wyjaśnień ustnych; PRAC uznał, że dostępne dane uzasadniające stosowanie diacereiny wykazały jej niewielkie, ale istotne statystycznie działanie z opóźnionym początkiem w leczeniu choroby zwyrodnieniowej stawu kolanowego i biodrowego. Niemniej jednak leczenie diacereiną nie jest zalecane w przypadku pacjentów z szybko postępującą chorobą zwyrodnieniową stawu biodrowego, ponieważ może u nich wystąpić słabsza odpowiedź na lek; 16
7 PRAC uznał, że dostępne dane z badań przedklinicznych, badań klinicznych, spontanicznych zgłoszeń po wprowadzeniu produktu do obrotu i opublikowanego piśmiennictwa wykazały, że stosowanie produktów zawierających diacereinę jest związane z obawami dotyczącymi bezpieczeństwa, takimi jak częste przypadki ciężkiej biegunki i przypadki potencjalnie ciężkiej hepatotoksyczności. Nie można też wykluczyć ryzyka wystąpienia reakcji skórnych; PRAC uznał, że należy wprowadzić szereg nowych środków mających na celu zminimalizowanie tego ryzyka. Wśród nich znalazło się zalecenie, aby rozpoczynać leczenie z użyciem połowy standardowej dawki dobowej, przeciwwskazanie do stosowania u pacjentów z występującą w przeszłości i/lub obecnie chorobą wątroby oraz wyraźne zalecenie przerwania leczenia w momencie wystąpienia biegunki. Ponadto stosowanie diacereiny nie jest już zalecane u pacjentów w wieku 65 lat lub starszych. Dodatkowo ze względu na ryzyko wystąpienia zaburzeń żołądkowo-jelitowych i potencjalne ryzyko wystąpienia reakcji ze strony wątroby PRAC uznał za konieczne ograniczenie w przepisywaniu leku do specjalistów z doświadczeniem w leczeniu choroby zwyrodnieniowej stawów. Ostatnim wymogiem jest wprowadzenie do charakterystyki produktu leczniczego (ChPL) informacji dotyczących ryzyka wystąpienia reakcji skórnych; PRAC stwierdził, że ryzyko wystąpienia ciężkiej biegunki związane ze stosowaniem produktów leczniczych zawierających diacereinę oraz występowanie potencjalnie ciężkich reakcji ze strony wątroby mogą być zminimalizowane dzięki wyżej opisanym środkom służącym zminimalizowaniu ryzyka, które powinny zostać zawarte w ChPL oraz właściwie kontrolowane poprzez coroczne przedkładanie raportów PSUR, w rezultacie PRAC stwierdził, że stosunek korzyści do ryzyka stosowania produktów leczniczych zawierających diacereinę określonych w aneksie I pozostaje korzystny, pod warunkiem wprowadzenia zmian do informacji o produkcie i warunków pozwolenia na dopuszczenie do obrotu przedstawionych w aneksie IV. Opinia CMDh Po dokonaniu przeglądu ostatecznego zalecenia PRAC z dnia 6 marca 2014 r. i zmienionego ostatecznego zalecenia PRAC CMDh zgodziła się z ogółem wniosków naukowych i podstaw do wydanego zalecenia. Jednak CMDh uznała, że niezbędne są pewne zmiany w ChPL i ulotce dla pacjenta w celu lepszego odzwierciedlenia zaleceń PRAC oraz skorygowania drobnych nieścisłości. PRAC nie zalecił stosowania produktów leczniczych zawierających diacereinę u pacjentów starszych niż 65 lat, ale nie uznał tego za przeciwwskazanie. W związku z tym CMDh uznała, że nie należy usuwać informacji dotyczących zalecanej dawki w tej grupie pacjentów z punktu 4.2 ChPL i punktu 3 ulotki dla pacjenta. CMDh zgodziła się również z PRAC w kwestii raportów PSUR, które mają być przedkładane corocznie. Uzgodniona nowa data zamknięcia zbierania danych (DLP) 31 grudnia 2014 r. dla wszystkich produktów leczniczych zawierających diacereinę znajdzie się w wykazie unijnych dat referencyjnych (ang. EURD list). Po rozważeniu zmienionego ostatecznego zalecenia PRAC z dnia 10 lipca 2014 r. zgodnie z art. 107k ust. 1 i 2 dyrektywy 2001/83/WE CMDh podjęła decyzję o zmianie warunków pozwoleń na dopuszczenie do obrotu dla produktów leczniczych zawierających diacereinę, w przypadku których zmiany w informacji o produkcie przedstawiono w aneksie III, pod warunkiem przedstawionym w aneksie IV. 17
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks II. Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione przez EMA
 Aneks II Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione przez EMA 41 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych
Aneks II Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione przez EMA 41 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków
 Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości
 Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o przypadku zabójczej niewydolności wątroby u pacjenta po zastosowaniu leczenia daklizumabem
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o przypadku zabójczej niewydolności wątroby u pacjenta po zastosowaniu leczenia daklizumabem
Aneks II. Niniejsza Charakterystyka Produktu Leczniczego oraz ulotka dla pacjenta stanowią wynik procedury arbitrażowej.
 Aneks II Zmiany dotyczące odpowiednich punktów Charakterystyki Produktu Leczniczego oraz ulotki dla pacjenta przedstawione przez Europejską Agencję Leków (EMA) Niniejsza Charakterystyka Produktu Leczniczego
Aneks II Zmiany dotyczące odpowiednich punktów Charakterystyki Produktu Leczniczego oraz ulotki dla pacjenta przedstawione przez Europejską Agencję Leków (EMA) Niniejsza Charakterystyka Produktu Leczniczego
ANEKS I. Strona 1 z 5
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC WETERYNARYJNYCH PRODUKTÓW LECZNICZYCH, GATUNKI ZWIERZĄT, DROGA PODANIA, PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC WETERYNARYJNYCH PRODUKTÓW LECZNICZYCH, GATUNKI ZWIERZĄT, DROGA PODANIA, PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH
Lipophoral Tablets 150mg. Mediator 150 mg Tabletka Podanie doustne. Benfluorex Qualimed. Mediator 150mg Tabletka Podanie doustne
 ANEKS I WYKAZ NAZW WŁASNYCH, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH (EOG) 1
ANEKS I WYKAZ NAZW WŁASNYCH, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH (EOG) 1
Annex I. Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia
 Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Ogólne podsumowanie oceny naukowej produktu leczniczego Mifepristone Linepharma i nazw produktów związanych (patrz aneks I)
 Aneks II Wnioski naukowe i podstawy pozytywnej opinii zgodnie z warunkiem pozwolenia na dopuszczenie do obrotu i warunkiem zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione
Aneks II Wnioski naukowe i podstawy pozytywnej opinii zgodnie z warunkiem pozwolenia na dopuszczenie do obrotu i warunkiem zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 205 Wnioski naukowe W następstwie rozpoczętej w styczniu 2012 r. oceny tworzonego w ramach procedury podziału pracy okresowego raportu o bezpieczeństwie dotyczącego produktów leczniczych
Aneks II Wnioski naukowe 205 Wnioski naukowe W następstwie rozpoczętej w styczniu 2012 r. oceny tworzonego w ramach procedury podziału pracy okresowego raportu o bezpieczeństwie dotyczącego produktów leczniczych
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS WNIOSKI NAUKOWE I PODSTAWY DO ODMOWY PRZEDSTAWIONE PRZEZ EMEA
 ANEKS WNIOSKI NAUKOWE I PODSTAWY DO ODMOWY PRZEDSTAWIONE PRZEZ EMEA PONOWNE ZBADANIE OPINII CHMP Z 19 LIPCA 2007 R. NA TEMAT PREPARATU NATALIZUMAB ELAN PHARMA Podczas posiedzenia w lipcu 2007 r. CHMP przyjął
ANEKS WNIOSKI NAUKOWE I PODSTAWY DO ODMOWY PRZEDSTAWIONE PRZEZ EMEA PONOWNE ZBADANIE OPINII CHMP Z 19 LIPCA 2007 R. NA TEMAT PREPARATU NATALIZUMAB ELAN PHARMA Podczas posiedzenia w lipcu 2007 r. CHMP przyjął
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Aneks II. Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC
 Aneks II Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC 70 Wnioski naukowe CMDh rozpatrzył poniższe zalecenia PRAC
Aneks II Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC 70 Wnioski naukowe CMDh rozpatrzył poniższe zalecenia PRAC
ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYK PRODUKTU LECZNICZEGO I ULOTEK DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW
 ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYK PRODUKTU LECZNICZEGO I ULOTEK DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 108 WNIOSKI NAUKOWE OGÓLNE PODSUMOWANIE OCENY NAUKOWEJ
ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYK PRODUKTU LECZNICZEGO I ULOTEK DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 108 WNIOSKI NAUKOWE OGÓLNE PODSUMOWANIE OCENY NAUKOWEJ
Aneks II. Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu przedstawione przez EMA
 Aneks II Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu przedstawione przez EMA 5 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych zawierających meprobamat
Aneks II Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu przedstawione przez EMA 5 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych zawierających meprobamat
Wnioski naukowe i podstawy do tych wniosków
 Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu oraz szczegółowe wyjaśnienie różnic w stosunku do zalecenia PRAC 296 Wnioski naukowe i podstawy do tych wniosków CHMP
Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu oraz szczegółowe wyjaśnienie różnic w stosunku do zalecenia PRAC 296 Wnioski naukowe i podstawy do tych wniosków CHMP
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego, droga podania, wnioskodawcy / podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Podmiot
Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego, droga podania, wnioskodawcy / podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Podmiot
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Moc Gatunki zwierząt. Postać farmaceutyczna. Samice psów. Enurace 50 Tabletki 50 mg
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks II. Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu 410 Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Ibuprofen to niesteroidowy lek przeciwzapalny
Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu 410 Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Ibuprofen to niesteroidowy lek przeciwzapalny
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks II. Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu 11 Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Po rozważeniu zalecenia PRAC z dnia
Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu 11 Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Po rozważeniu zalecenia PRAC z dnia
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA
 ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
 18 października 2012 EMA/653433/2012 EMEA/H/A-5(3)/1319 Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
18 października 2012 EMA/653433/2012 EMEA/H/A-5(3)/1319 Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Aneks IV. Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks IV Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu 137 Wnioski naukowe CHMP rozważył poniższe zalecenie PRAC z dnia 5 grudnia 2013 r. odnoszące się do procedury zgodnej
Aneks IV Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu 137 Wnioski naukowe CHMP rozważył poniższe zalecenie PRAC z dnia 5 grudnia 2013 r. odnoszące się do procedury zgodnej
Symago (agomelatyna)
 Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 60 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o śmiertelnym przypadku piorunującej niewydolności wątroby u pacjenta po zastosowaniu leczenia
Aneks IV Wnioski naukowe 60 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o śmiertelnym przypadku piorunującej niewydolności wątroby u pacjenta po zastosowaniu leczenia
Podmiot odpowiedzialny Nazwa Moc Postać farmaceutyczna. Leflunomide Actavis 10 mg, filmomhulde tabletten
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, droga podania, podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Państwo Członkowskie
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, droga podania, podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Państwo Członkowskie
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 5 Wnioski naukowe W dniu 27 marca 2015 r. firma Vale Pharmaceuticals przedłożyła w Zjednoczonym Królestwie wniosek o przeprowadzenie procedury zdecentralizowanej dotyczącej skojarzenia
Aneks II Wnioski naukowe 5 Wnioski naukowe W dniu 27 marca 2015 r. firma Vale Pharmaceuticals przedłożyła w Zjednoczonym Królestwie wniosek o przeprowadzenie procedury zdecentralizowanej dotyczącej skojarzenia
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Produkty lecznicze zawierające dekstropropoksyfen posiadające pozwolenie na dopuszczenie do obrotu na terenie Unii Europejskiej
 ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Produkty lecznicze
ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Produkty lecznicze
Aneks I. Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, wnioskodawcy w państwach członkowskich
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, wnioskodawcy w państwach członkowskich 1 Państwo Członkowskie UE/EOG wnioskodawca nazwa firmy, adres Nazwa (własna)
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, wnioskodawcy w państwach członkowskich 1 Państwo Członkowskie UE/EOG wnioskodawca nazwa firmy, adres Nazwa (własna)
Aneks II. Wnioski naukowe i podstawy zawieszenia sprzedaży i stosowania produktów przedstawione przez EMA
 Aneks II Wnioski naukowe i podstawy zawieszenia sprzedaży i stosowania produktów przedstawione przez EMA 14 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych zawierających buflomedyl
Aneks II Wnioski naukowe i podstawy zawieszenia sprzedaży i stosowania produktów przedstawione przez EMA 14 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych zawierających buflomedyl
ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE
 ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE 1/5 WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO
ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE 1/5 WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Wnioski naukowe Uwzględniając sprawozdanie oceniające PRAC w sprawie okresowych raportów o bezpieczeństwie (PSUR) dotyczących
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Wnioski naukowe Uwzględniając sprawozdanie oceniające PRAC w sprawie okresowych raportów o bezpieczeństwie (PSUR) dotyczących
Ze względu na brak potwierdzenia w badaniu przeprowadzonym wśród młodzieży (opisanym poniżej) wyniki zostały uznane za niedostatecznie przekonujące.
 ZAŁĄCZNIK II WNIOSKI NAUKOWE I PODSTAWY DO WYDANIA POZYTYWNEJ OPINII ORAZ ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ
ZAŁĄCZNIK II WNIOSKI NAUKOWE I PODSTAWY DO WYDANIA POZYTYWNEJ OPINII ORAZ ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Podmiot odpowiedzialny Wnioskodawca Nazwa własna Moc Postać farmaceutyczna Droga podania Zawartość (stężenie) Vantas 50 mg Implant Podskórne 50 mg
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, WNIOSKODAWCA, PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH Państwo
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, WNIOSKODAWCA, PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH Państwo
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks III. Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta
 Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks III Zmiany w charakterystyce produktu leczniczego oraz w ulotce dla pacjenta
 Aneks III Zmiany w charakterystyce produktu leczniczego oraz w ulotce dla pacjenta Uwaga: Niniejsze zmiany do streszczenia charakterystyki produktu leczniczego i ulotki dla pacjenta są wersją obowiązującą
Aneks III Zmiany w charakterystyce produktu leczniczego oraz w ulotce dla pacjenta Uwaga: Niniejsze zmiany do streszczenia charakterystyki produktu leczniczego i ulotki dla pacjenta są wersją obowiązującą
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Państwo Członkowskie Podmiot odpowiedzialny Nazwa własna Moc Postać farmaceutyczna Droga podania
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 16 Wnioski naukowe Haldol, który zawiera substancję czynną haloperydol, jest lekiem przeciwpsychotycznym należącym do grupy pochodnych butyrofenonu. Jest silnym antagonistą ośrodkowych
Aneks II Wnioski naukowe 16 Wnioski naukowe Haldol, który zawiera substancję czynną haloperydol, jest lekiem przeciwpsychotycznym należącym do grupy pochodnych butyrofenonu. Jest silnym antagonistą ośrodkowych
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
Podmiot odpowiedzialny Nazwa Moc Postać farmaceutyczna. FENOFIBRATO PENSA 160 mg comprimidos recubiertos con película EFG
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, droga podania, podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Państwo Członkowskie
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, droga podania, podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Państwo Członkowskie
Aneks II. Wnioski naukowe i podstawy do cofnięcia pozwoleń na dopuszczenie do obrotu
 Aneks II Wnioski naukowe i podstawy do cofnięcia pozwoleń na dopuszczenie do obrotu 4 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej produktów Caustinerf arsenical, Yranicid arsenical i
Aneks II Wnioski naukowe i podstawy do cofnięcia pozwoleń na dopuszczenie do obrotu 4 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej produktów Caustinerf arsenical, Yranicid arsenical i
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r.
 Dziennik Ustaw Nr 269 15687 Poz. 1597 1597 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na
Dziennik Ustaw Nr 269 15687 Poz. 1597 1597 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Lek BI w porównaniu z lekiem Humira u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą
 Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Mefelor 50/5 mg Tabletka o przedłużonym uwalnianiu. Metoprololtartrat/Felodipi n AbZ 50 mg/5 mg Retardtabletten
 ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCÓW, POSIADACZY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH Państwo członkowskie Podmiot
ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCÓW, POSIADACZY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH Państwo członkowskie Podmiot
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę.
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Pradaxa jest lekiem zawierającym substancję czynną eteksylan dabigatranu. Lek jest dostępny w postaci kapsułek (75, 110 i 150 mg).
 EMA/47517/2015 EMEA/H/C/000829 Streszczenie EPAR dla ogółu społeczeństwa eteksylan dabigatranu Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego
EMA/47517/2015 EMEA/H/C/000829 Streszczenie EPAR dla ogółu społeczeństwa eteksylan dabigatranu Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Aneks III. Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i ulotki dla pacjenta
 Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i ulotki dla pacjenta Uwaga: Może wyniknąć potrzeba dokonania kolejnych aktualizacji Charakterystyki Produktu Leczniczego i
Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i ulotki dla pacjenta Uwaga: Może wyniknąć potrzeba dokonania kolejnych aktualizacji Charakterystyki Produktu Leczniczego i
Aneks III. Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta.
 Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Zaobserwowano częstsze przypadki stosowania produktu leczniczego Vistide w niezatwierdzonych wskazaniach i (lub) drogach podawania.
 Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego LoperamideDr.Max przeznaczone do publicznej wiadomości
 VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego LoperamideDr.Max przeznaczone do publicznej wiadomości VI.2.1.Omówienie rozpowszechnienia choroby 1. Ostra biegunka: Biegunka to zwiększona
VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego LoperamideDr.Max przeznaczone do publicznej wiadomości VI.2.1.Omówienie rozpowszechnienia choroby 1. Ostra biegunka: Biegunka to zwiększona
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Nazwa własna Moc Postać farmaceutyczna
 Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego weterynaryjnego, gatunki zwierząt i podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich
Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego weterynaryjnego, gatunki zwierząt i podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich
12 SQ-HDM Grupa farmakoterapeutyczna: Wyciągi alergenowe, kurz domowy; Kod ATC: V01AA03
 SUBSTANCJA CZYNNA (INN) GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU LECZNICZEGO, KTÓREGO DOTYCZY PLAN ZARZĄDZANIA RYZYKIEM 12 SQ-HDM Grupa farmakoterapeutyczna:
SUBSTANCJA CZYNNA (INN) GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU LECZNICZEGO, KTÓREGO DOTYCZY PLAN ZARZĄDZANIA RYZYKIEM 12 SQ-HDM Grupa farmakoterapeutyczna:
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 7 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej produktów zawierających metadon z dodatkiem powidonu do stosowania doustnego Metadon jest syntetycznym opioidem.
Aneks II Wnioski naukowe 7 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej produktów zawierających metadon z dodatkiem powidonu do stosowania doustnego Metadon jest syntetycznym opioidem.
Ogólne podsumowanie oceny naukowej produktów leczniczych zawierających dihydroergokryptynę/kofeinę (patrz Aneks I)
 Aneks II Wnioski naukowe oraz podstawy zmian warunków pozwoleń na dopuszczenie do obrotu lub zawieszenia pozwoleń na dopuszczenie do obrotu, o ile ma to zastosowanie, z uwzględnieniem zatwierdzonych wskazań
Aneks II Wnioski naukowe oraz podstawy zmian warunków pozwoleń na dopuszczenie do obrotu lub zawieszenia pozwoleń na dopuszczenie do obrotu, o ile ma to zastosowanie, z uwzględnieniem zatwierdzonych wskazań
ANEKS I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 ANEKS I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
Actocalcio D3 35 mg mg/880 IU. Acrelcombi 35 mg mg/880 IU. Fortipan Combi D 35 mg mg/880 IU
 ANEKS I WYKAZ NAZW, POSTAĆ(CI) FARMACEUTYCZNA(YCH), MOC(Y), PRODUKTÓW LECZNICZYCH, DROGA(DRÓG) PODANIA, WNIOSKODAWCA(Y), PODMIOT(Y) ODPOWIEDZIALNY(E) POSIADAJĄCY(E) POZWOLENIE NA DOPUSZCZENIE DO OBROTU
ANEKS I WYKAZ NAZW, POSTAĆ(CI) FARMACEUTYCZNA(YCH), MOC(Y), PRODUKTÓW LECZNICZYCH, DROGA(DRÓG) PODANIA, WNIOSKODAWCA(Y), PODMIOT(Y) ODPOWIEDZIALNY(E) POSIADAJĄCY(E) POZWOLENIE NA DOPUSZCZENIE DO OBROTU
Aneks I. Wykaz nazw, postaci farmaceutycznej, dawki produktów leczniczych, sposobu podawania, podmiotów odpowiedzialnych w państwach członkowskich
 Aneks I Wykaz nazw, postaci farmaceutycznej, dawki produktów leczniczych, sposobu podawania, podmiotów odpowiedzialnych w państwach członkowskich 1 Państwo członkowskie (w EOG) Podmiot odpowiedzialny Międzynarodowa
Aneks I Wykaz nazw, postaci farmaceutycznej, dawki produktów leczniczych, sposobu podawania, podmiotów odpowiedzialnych w państwach członkowskich 1 Państwo członkowskie (w EOG) Podmiot odpowiedzialny Międzynarodowa
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Simponi jest lekiem o działaniu przeciwzapalnym. Preparat stosuje się w leczeniu następujących chorób u osób dorosłych:
 EMA/411054/2015 EMEA/H/C/000992 Streszczenie EPAR dla ogółu społeczeństwa golimumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego produktu.
EMA/411054/2015 EMEA/H/C/000992 Streszczenie EPAR dla ogółu społeczeństwa golimumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego produktu.
Ból uważany jest za jeden z potencjalnie istotnych czynników ryzyka dotyczących śmiertelności (Sokka).
 VI. 2 Elementy do podsumowania podawanego do publicznej wiadomości. VI. 2.1 Przegląd epidemiologii choroby Odczuwanie bólu jest powszechnym zjawiskiem wśród dzieci. Szacuje się, że ta dolegliwość może
VI. 2 Elementy do podsumowania podawanego do publicznej wiadomości. VI. 2.1 Przegląd epidemiologii choroby Odczuwanie bólu jest powszechnym zjawiskiem wśród dzieci. Szacuje się, że ta dolegliwość może
