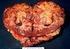
LECZENIE RAKA NERKI (ICD-10 C 64)
|
|
|
- Kinga Wróbel
- 6 lat temu
- Przeglądów:
Transkrypt
1 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU Leczenie raka nerki przy wykorzystaniu substancji czynnej sunitynib 1.1. Kryteria kwalifikacji 1) histologicznie potwierdzone rozpoznanie jasnokomórkowego raka nerki lub mieszanego raka nerkowokomórkowego z przeważającym (powyżej 60% utkania) komponentem jasnokomórkowym; 2) nowotwór w stadium zaawansowanym (pierwotne uogólnienie lub nawrót po pierwotnym leczeniu chirurgicznym); 3) brak wcześniejszego leczenia farmakologicznego raka nerki; 4) uprzednie wykonanie nefrektomii (radykalnej lub oszczędzającej); 5) udokumentowana obecność przerzutów narządowych; 6) zmiany możliwe do obiektywnej oceny w badaniach obrazowych metodą komputerowej tomografii (KT) lub magnetycznego rezonansu (MR) z zastrzeżeniem konieczności potwierdzenia zmian w układzie kostnym przy użyciu konwencjonalnej rentgenografii (RTG) lub MR; 7) nieobecność przerzutów w ośrodkowym układzie nerwowym (dopuszczalne wcześniejsze wycięcie przerzutów i /lub radioterapia, o ile po leczeniu utrzymuje się stan bezobjawowy); 8) stan sprawności wg skali Karnofsky'ego; 1. Sunitynib 1.1. Zalecana dawka sunitynibu wynosi 50 mg doustnie raz na dobę przez 4 kolejne tygodnie, po czym następuje 14-dniowa przerwa, co stanowi pełny 6-tygodniowy cykl leczenia W przypadku wystąpienia istotnych klinicznie lub ciężkich działań niepożądanych należy przerwać stosowanie leku aż do zmniejszenia się nasilenia wspomnianych objawów oraz w trakcie dalszego leczenia należy rozważyć redukcję dawki do 37,5 mg na dobę podawanej przez 4 kolejne tygodnie z następującą po tym okresie 14-dniową przerwą Jeżeli ciężkie objawy niepożądane nie zmniejszą swojego nasilenia w ciągu 4 tygodni mimo przerwania podawania leku, to należy definitywnie zakończyć leczenie Jeżeli pomimo redukcji dawki do 37,5 mg na dobę istotne klinicznie lub ciężkie działania niepożądane ponownie wystąpią, to należy zmniejszyć dawkę leku do 25 mg na dobę podawanej przez 4 kolejne tygodnie z następującą po tym okresie 14-dniową przerwą. 1. Badania przy kwalifikacji do leczenia sunitynibem, sorafenibem, pazopanibem, aksytynibem, ewerolimusem, kabozantynibem i niwolumabem 1) histologiczne potwierdzenie jasnokomórkowego raka nerki lub mieszanego raka nerkowokomórkowego z przeważającym komponentem jasnokomórkowym; 2) morfologia krwi z rozmazem; 3) oznaczenie stężenia hemoglobiny; 4) oznaczenie stężenia mocznika (nie dotyczy kabozantynibu); 5) oznaczenia stężenia kreatyniny; 6) oznaczenie stężenia bilirubiny; 7) oznaczenie aktywności aminotransferazy alaninowej; 8) oznaczenie aktywności aminotransferazy asparaginianowej; 9) oznaczenie aktywności dehydrogenazy mleczanowej (LDH) (nie dotyczy kabozantynibu i niwolumabu); 10) oznaczenie aktywności hormonu tyreotropowego (TSH) (nie dotyczy ewerolimusu i temsyrolimusu); 11) oznaczenie skorygowanego stężenia wapnia w surowicy; 12) oznaczenie białka w moczu dla aksytynibu i kabozantynibu; 13) oznaczenie aktywności fosfatazy alkalicznej dla niwolumabu; 14) oznaczenie antygenu HBs (HbsAg) dla niwolumabu;
2 9) korzystne lub pośrednie rokowanie według skali MSKCC (Memorial Sloan-Kettering Cancer Center); 10) wykluczenie ciąży i okresu karmienia piersią; 11) nieobecność innych nowotworów złośliwych z wyjątkiem przedinwazyjnego raka szyjki macicy oraz raka podstawnokomórkowego skóry; 12) adekwatna wydolność narządowa określona na podstawie badań laboratoryjnych krwi: a) wyniki badań czynności wątroby: - stężenie bilirubiny całkowitej nieprzekraczające 2-krotnie górnej granicy normy (z wyjątkiem pacjentów z zespołem Gilberta), - aktywność transaminaz (alaninowej i asparaginowej) w surowicy nieprzekraczające 5-krotnie górnej granicy normy, b) stężenie kreatyniny nieprzekraczające 2-krotnie górnej granicy normy, c) wyniki badania morfologii krwi z rozmazem: - liczba płytek krwi większa lub równa 10 5 /mm 3, - bezwzględna liczba granulocytów obojętnochłonnych większa lub równa 1500/mm 3, - poziom hemoglobiny większy lub równy 9,5 g/dl; 13) czynność tarczycy prawidłowa lub wyrównana farmakologicznie; 14) nieobecność niekontrolowanych chorób układu sercowonaczyniowego. Kryteria kwalifikacji muszą być spełnione łącznie Określenie czasu leczenia w programie Leczenie trwa do czasu podjęcia przez lekarza prowadzącego decyzji o wyłączeniu świadczeniobiorcy z programu, zgodnie z kryteriami wyłączenia Kryteria wyłączenia z programu 1.5. Ponowne pojawienie się istotnych klinicznie lub ciężkich działań niepożądanych nakazuje zakończenie leczenia. 2. Sorafenib 2.1. Sorafenib jest stosowany w dobowej dawce 800 mg (2 razy dziennie po 2 tabletki zawierające 200 mg) bez przerw W przypadku wystąpienia istotnych klinicznie lub ciężkich działań niepożądanych należy przerwać stosowanie leku aż do zmniejszenia się ich nasilenia oraz należy rozważyć zmniejszenie dobowej dawki sorafenibu do 400 mg dziennie (2 tabletki po 200 mg 1 raz dziennie) Jeżeli ciężkie działania niepożądane nie zmniejszą swojego nasilenia w ciągu 4 tygodni mimo przerwania podawania leku, należy zakończyć leczenie Jeżeli pomimo redukcji dawki do 400 mg dziennie istotne klinicznie lub ciężkie działania niepożądane ponownie wystąpią, należy zredukować dawkę leku do 400 mg podawanych co drugi dzień Ponowne pojawienie się istotnych klinicznie lub ciężkich działań niepożądanych nakazuje zakończenie leczenia. 3. Pazopanib 3.1. Zalecana dawka pazopanibu wynosi 800 mg doustnie raz na dobę 3.2. Modyfikacje dawki: w zależności od indywidualnej tolerancji leczenia, w celu opanowania działań niepożądanych, dawkę należy dostosowywać, zmieniając ją stopniowo, za każdym razem o 200 mg. 15) oznaczenie przeciwciał anty HCV dla niwolumabu; 16) inne badania laboratoryjne w razie wskazań klinicznych; 17) test ciążowy u kobiet w wieku rozrodczym; 18) badanie KT klatki piersiowej i jamy brzusznej; 19) badanie RTG klatki piersiowej wyłącznie w przypadkach możliwości przeprowadzenia pomiaru zmian chorobowych oraz oceny odpowiedzi na leczenie; 20) badanie KT lub MR mózgu w przypadku osób z podejrzeniem przerzutów do ośrodkowego układu nerwowego (tj. w przypadku objawów ze strony ośrodkowego układu nerwowego oraz u osób po wcześniejszej resekcji przerzutów); 21) elektrokardiogram (EKG); 19) pomiar ciśnienia tętniczego; 22) inne badania obrazowe w razie wskazań klinicznych. Wstępne badania obrazowe muszą umożliwić późniejszą obiektywną ocenę odpowiedzi na leczenie. 2. Badania przy kwalifikacji do leczenia temsyrolimusem 1) histologiczne potwierdzenia raka nerkowokomórkowego; 2) morfologia krwi z rozmazem; 3) oznaczenie liczby płytek krwi; 4) oznaczenie stężenia hemoglobiny; 5) oznaczenie stężenia kreatyniny; 6) oznaczenie stężenia bilirubiny; 7) oznaczenie aktywności aminotransferazy asparaginowej i alaninowej; 8) oznaczenie aktywności dehydrogenazy mleczanowej (LDH); 9) oznaczenie skorygowanego stężenia wapnia w surowicy; 10) oznaczenie poziomu glukozy; 11) oznaczenie poziomu fosfatazy alkalicznej; 12) oznaczenie poziomu cholesterolu; 13) oznaczenie poziomu trójglicerydów; 14) test ciążowy u kobiet w wieku rozrodczym;
3 1) udokumentowana progresja w trakcie stosowania leku; 2) wystąpienie objawów nadwrażliwości na sunitynib lub na którąkolwiek substancję pomocniczą; 3) nawracająca lub nieakceptowalna toksyczność powyżej 3 stopnia według skali WHO; 4) utrzymujący się stan sprawności 70 lub niższy według skali Karnofsky'ego; 5) wystąpienie objawów zastoinowej niewydolności serca, ostrych incydentów niewydolności wieńcowej, niekontrolowanego nadciśnienia tętniczego oraz niestabilnych zaburzeń rytmu serca wymagających leczenia; 6) istotne pogorszenie jakości życia w trakcie stosowania leku. 2. Leczenie raka nerki przy wykorzystaniu substancji czynnej sorafenib 2.1. Kryteria kwalifikacji 1) rozpoznanie jasnokomórkowego raka nerki lub mieszanego raka nerkowokomórkowego z przeważającym (powyżej 60% utkania) komponentem jasnokomórkowym potwierdzone badaniem histopatologicznym z materiału operacyjnego, biopsji guza nerki lub ogniska przerzutowego; 2) nowotwór w stadium zaawansowanym (pierwotne uogólnienie lub nawrót po pierwotnym leczeniu chirurgicznym); 3) udokumentowane niepowodzenie wcześniejszej immunoterapii z zastosowaniem interferonu alfa lub udokumentowane przeciwwskazania do dalszego stosowania interferonu alfa; 4) uprzednie wykonanie nefrektomii (radykalnej lub oszczędzającej); 5) udokumentowana obecność przerzutów narządowych; 6) zmiany możliwe do obiektywnej oceny w badaniach obrazowych metodą KT lub MR z zastrzeżeniem konieczności Dawka pazopanibu nie powinna być większa niż 800 mg 3.3. Zaleca się, aby pacjenci z łagodnymi nieprawidłowościami parametrów czynności wątroby byli leczeni na początku dawką 800 mg pazopanibu raz na dobę. U pacjentów z umiarkowanymi zaburzeniami czynności wątroby zalecane jest stosowanie zmniejszonej dawki 200 mg pazopanibu. Stosowanie pazopanibu nie jest zalecane u pacjentów z ciężkimi zaburzeniami czynności wątroby. 4. Aksytynib 4.1. Zalecana początkowa dawka aksytynibu wynosi 5 mg dwa razy na dobę U pacjentów tolerujących początkową dawkę aksytynibu 5 mg dwa razy na dobę, u których przez dwa kolejne tygodnie nie wystąpiły działania niepożądane > stopnia 2. (tj. nie wystąpiły ciężkie działania niepożądane zgodnie z kryteriami opisującymi działania niepożądane CTCAE) można zwiększyć dawkę leku do 7 mg dwa razy na dobę z wyjątkiem pacjentów, u których ciśnienie tętnicze krwi wynosi > 150/90 mmhg lub którzy otrzymują leczenie obniżające ciśnienie krwi. Następnie, stosując te same kryteria, u pacjentów tolerujących aksytynib w dawce 7 mg dwa razy na dobę, można zwiększyć dawkę do maksymalnej dawki 10 mg dwa razy na dobę W przypadku wystąpienia istotnych klinicznie lub ciężkich działań niepożądanych należy przerwać stosowanie leku aż do zmniejszenia się ich nasilenia oraz należy rozważyć zmniejszenie dobowej dawki 15) badanie KT klatki piersiowej i jamy brzusznej; 16) badanie RTG klatki piersiowej, gdy zmiany w klatce piersiowej są możliwe do oceny tą metodą; 17) badanie KT lub MR mózgu w przypadku osób z podejrzeniem przerzutów do ośrodkowego układu nerwowego (tj. w przypadku objawów ze strony ośrodkowego układu nerwowego oraz u osób po wcześniejszej resekcji przerzutów). Wstępne badania obrazowe muszą umożliwić późniejszą obiektywną ocenę odpowiedzi na leczenie. 3. Monitorowanie bezpieczeństwa leczenia 1) morfologia krwi z rozmazem; 2) oznaczenie stężenia hemoglobiny; 3) oznaczenia stężenia kreatyniny; 4) oznaczenie stężenia bilirubiny; 5) oznaczenie liczby płytek krwi dla temsyrolimusu; 6) oznaczenie aktywności aminotransferazy alaninowej; 7) oznaczenie aktywności aminotransferazy asparaginianowej; 8) oznaczenie aktywności dehydrogenazy mleczanowej (LDH) (nie dotyczy kabozantynibu i niwolumabu); 9) oznaczenie aktywności fosfatazy alkalicznej; 10) oznaczenie aktywności hormonu tyreotropowego (TSH) dla aksytynibu, kabozantynibu i niwolumabu; 11) oznaczenie białka w moczu dla aksytynibu i kabozantynibu; 12) oznaczenie poziomu cholesterolu i trójglicerydów dla temsyrolimusu; 13) elektrokardiogram (EKG) dla aksytynibu, temsyrolimusu i kabozantynibu. Badania wykonuje się: 1) co 6 tygodni - w przypadku leczenia sunitynibem; 2) co 4 tygodnie - w przypadku leczenia sorafenibem, aksytynibem, ewerolimusem, temsyrolimusem, kabozantynibem i niwolumabem;
4 potwierdzenia zmian w układzie kostnym przy użyciu konwencjonalnej RTG lub MR; 7) nieobecność przerzutów w ośrodkowym układzie nerwowym (dopuszczalne wcześniejsze wycięcie przerzutów i /lub radioterapia, o ile po leczeniu utrzymuje się stan bezobjawowy); 8) stan sprawności wg skali Karnofsky'ego; 9) korzystne lub pośrednie rokowanie według skali MSKCC (Memorial Sloan-Kettering Cancer Center); 10) wykluczenie ciąży i okresu karmienia piersią; 11) nieobecność innych nowotworów złośliwych z wyjątkiem przedinwazyjnego raka szyjki macicy oraz raka podstawnokomórkowego skóry; 12) adekwatna wydolność narządowa określona na podstawie badań laboratoryjnych krwi: a) wyniki badań czynności wątroby: - stężenie bilirubiny całkowitej nieprzekraczające 2-krotnie górnej granicy normy (z wyjątkiem pacjentów z zespołem Gilberta), - aktywność transaminaz (alaninowej i asparaginowej) w surowicy nieprzekraczające 5-krotnie górnej granicy normy, b) stężenie kreatyniny nieprzekraczające 2-krotnie górnej granicy normy, c) wyniki badania morfologii krwi z rozmazem: - liczba płytek krwi większa lub równa 10 5 /mm 3, - bezwzględna liczba granulocytów obojętnochłonnych większa lub równa 1500/mm 3, - poziom hemoglobiny większy lub równy 9,5 g/dl; 13) czynność tarczycy prawidłowa lub wyrównana farmakologicznie; 14) nieobecność niekontrolowanych chorób układu sercowonaczyniowego. Kryteria kwalifikacji muszą być spełnione łącznie. aksytynibu do 3 mg dwa razy na dobę, a następnie do 2 mg dwa razy na dobę Jeżeli ciężkie działania niepożądane nie zmniejszą swojego nasilenia w ciągu 4 tygodni mimo przerwania podawania leku, należy zakończyć leczenie Jeżeli pomimo redukcji dawki do 3 mg dwa razy na dobę, a następnie do 2 mg dwa razy na dobę istotne klinicznie lub ciężkie działania niepożądane ponownie wystąpią, należy zakończyć leczenie. 5. Ewerolimus 5.1. Ewerolimus jest stosowany w dobowej dawce 10 mg (1 raz dziennie 2 tabletki zawierające 5 mg albo 1 raz dziennie 1 tabletka zawierająca 10 mg) bez przerw W przypadku wystąpienia istotnych klinicznie lub ciężkich działań niepożądanych należy przerwać stosowanie leku aż do zmniejszenia się ich nasilenia oraz należy rozważyć zmniejszenie dobowej dawki ewerolimusu do 5 mg dziennie (1 tabletka po 5 mg 1 raz dziennie) Jeżeli ciężkie działania niepożądane nie zmniejszą swojego nasilenia w ciągu 4 tygodni mimo przerwania podawania leku, należy zakończyć leczenie Jeżeli pomimo redukcji dawki do 5 mg dziennie istotne klinicznie lub ciężkie działania niepożądane ponownie wystąpią, należy zakończyć leczenie. 6. Temsyrolimus 3) w 5 i 9 tygodniu a następnie co cztery tygodnie w przypadku leczenia pazopanibem; 4) dodatkowo w 3 i 7 tygodniu w przypadku leczenia pazopanibem dla oznaczeń określonych w punktach 4, 6, Monitorowanie skuteczności leczenia 1) badanie KT lub MR odpowiedniego obszaru; 2) badanie RTG klatki piersiowej - jeżeli nie jest wykonywane badanie KT; 3) elektrokardiogram (EKG) - w przypadku sorafenibu, pazopanibu, aksytynibu, ewerolimusu i sunitynibu; 4) inne badania obrazowe w razie wskazań klinicznych. Badania wykonuje się: 1) nie rzadziej niż co 12 tygodni; 2) przed zakończeniem: a) co drugiego kursu leczenia - w przypadku sunitynibu, b) co trzeciego kursu leczenia - w przypadku sorafenibu, pazopanibu, aksytynibu i ewerolimusu; 3) w chwili wyłączenia z programu, o ile nie nastąpiło z powodu udokumentowanej progresji choroby. Wykonane badania obrazowe muszą umożliwić obiektywną ocenę odpowiedzi na leczenie. Ocena odpowiedzi na leczenie powinna być przeprowadzana zgodnie z kryteriami RECIST lub CHOI. Monitorowanie skuteczności i bezpieczeństwa leczenia pacjentów, o których mowa w sekcji Świadczeniobiorcy ust. 9 pkt 1, powinno być prowadzone jednakowo jak w przypadku pozostałych pacjentów. 5. Monitorowanie programu 1) przekazywanie do NFZ zakresu informacji sprawozdawczo rozliczeniowych w formie papierowej
5 2.2. Określenie czasu leczenia w programie Leczenie trwa do czasu podjęcia przez lekarza prowadzącego decyzji o wyłączeniu świadczeniobiorcy z programu, zgodnie z kryteriami wyłączenia Kryteria wyłączenia z programu 1) udokumentowana progresja w trakcie stosowania leku; 2) wystąpienie objawów nadwrażliwości na sorefenib lub na którąkolwiek substancję pomocniczą; 3) nawracająca lub nieakceptowalna toksyczność powyżej 3 stopnia według skali WHO; 4) utrzymujący się stan sprawności 70 lub niższy według skali Karnofsky'ego; 5) wystąpienie objawów zastoinowej niewydolności serca, ostrych incydentów niewydolności wieńcowej, niekontrolowanego nadciśnienia tętniczego oraz niestabilnych zaburzeń rytmu serca wymagających leczenia; 6) istotne pogorszenie jakości życia w trakcie stosowania leku. 3. Leczenie raka nerki przy wykorzystaniu substancji czynnej pazopanib 3.1. Kryteria kwalifikacji 1) histologicznie potwierdzone rozpoznanie jasnokomórkowego raka nerki lub mieszanego raka nerkowokomórkowego z przeważającym (powyżej 60% utkania) komponentem jasnokomórkowym; 2) nowotwór w stadium zaawansowanym (pierwotne uogólnienie lub nawrót po pierwotnym leczeniu chirurgicznym); 3) brak wcześniejszego leczenia farmakologicznego raka nerki lub wcześniejsze leczenie z zastosowaniem cytokin (udokumentowane niepowodzenie wcześniejszej immunoterapii 6.1. Temsyrolimus powinien być podawany dożylnie w dawce 25 mg we wlewie trwającym minut w odstępach 7-dniowych W ramach premedykacji 30 minut przed rozpoczęciem podania temsyrolimusu należy stosować dożylnie difenhydraminę w dawce mg lub podobny lek o działaniu przeciwhistaminowym Nie występuje konieczność modyfikowania dawki w zależności od płci lub wieku. 7. Kabozantynib 7.1 Dawkowanie kabozantynibu oraz kryteria i sposób modyfikacji dawkowania (w tym okresowe wstrzymanie leczenia) - zgodnie z aktualną Charakterystyką Produktu Leczniczego. 8. Niwolumab 8.1. Dawkowanie, sposób podawania oraz modyfikacja leczenia - zgodnie z aktualną Charakterystyką Produktu Leczniczego Przerwę w podawaniu niwolumabu należy zastosować m.in. kiedy wystąpi następująca toksyczność pochodzenia immunologicznego (stopnie toksyczności zgodnie z NCI-CTCAE v4): 1) zapalenie płuc stopnia 2.; 2) biegunka lub zapalenie jelita grubego stopnia 2. lub 3.; 3) zapalenie wątroby - zwiększenie aktywności AspAT, AlAT lub zapalenie nerek, lub zaburzenia czynności nerek zwiększenie stężenia kreatyniny stopnia 2. lub 3.: wzrost lub w formie elektronicznej, zgodnie z wymaganiami opublikowanymi przez Narodowy Fundusz Zdrowia; 2) uzupełnianie danych zawartych w rejestrze SMPT, dostępnym za pomocą aplikacji internetowej udostępnionej przez OW NFZ, z częstotliwością zgodną z opisem programu oraz na zakończenie leczenia. Dane dotyczące monitorowania leczenia należy gromadzić w dokumentacji pacjenta i każdorazowo przedstawiać na żądanie kontrolerom NFZ. W przypadku pacjentów, o których mowa w sekcji Świadczeniobiorcy ust. 9 pkt 1, nie jest wymagane uzupełnianie danych i informacji w elektronicznym systemie monitorowania programów lekowych.
6 z zastosowaniem interferonu-α (IFN-α) lub przeciwwskazania do dalszego stosowania IFN-α) 4) uprzednie wykonanie nefrektomii (radykalnej lub oszczędzającej); 5) udokumentowana obecność przerzutów narządowych; 6) możliwa obiektywna ocena w badaniach obrazowych metodą komputerowej tomografii (KT) lub magnetycznego rezonansu (MR) z zastrzeżeniem konieczności potwierdzenia zmian w układzie kostnym przy użyciu konwencjonalnej rentgenografii (RTG) lub MR; 7) nieobecność przerzutów w ośrodkowym układzie nerwowym (dopuszczalne wcześniejsze wycięcie przerzutów i /lub radioterapia, o ile po leczeniu utrzymuje się stan bezobjawowy); 8) stan sprawności wg skali Karnofsky ego; 9) korzystne lub pośrednie rokowanie według skali MSKCC (Memorial Sloan-Kettering Cancer Center); 10) wykluczenie ciąży i okresu karmienia piersią; 11) nieobecność innych nowotworów złośliwych z wyjątkiem przedinwazyjnego raka szyjki macicy oraz raka podstawnokomórkowego skóry; 12) adekwatna wydolność narządowa określona na podstawie badań laboratoryjnych krwi: a) wyniki badań czynności wątroby: - stężenie bilirubiny całkowitej nieprzekraczające 2-krotnie górnej granicy normy (z wyjątkiem pacjentów z zespołem Gilberta), - aktywność transaminaz (alaninowej i asparaginowej) w surowicy nieprzekraczające 5-krotnie górnej granicy normy, b) wyniki badania morfologii krwi z rozmazem: - liczba płytek krwi większa lub równa 10 5 /mm 3, - bezwzględna liczba granulocytów obojętnochłonnych większa lub równa 1500/mm 3, - poziom hemoglobiny większy lub równy 9,5 g/dl; stężenia kreatyniny więcej niż 1,5-krotnie, ale nie więcej niż 6-krotnie w stosunku do górnej granicy normy; 4) endokrynopatie pochodzenia immunologicznego: objawowa niedoczynność tarczycy, nadczynność tarczycy, niedoczynność przysadki stopnia 2. lub 3., niewydolność kory nadnerczy stopnia 2., cukrzyca stopnia 3.; 5) wysypka stopnia 3. Podawanie niwolumabu można wznowić po uzyskaniu poprawy i zredukowaniu dobowej dawki kortykosteroidów do dawki 10 mg prednizonu lub równoważnej dawki innego leku steroidowego, o ile ich podawanie było konieczne Przerwa w leczeniu niwolumabem nie może przekraczać 3 miesięcy.
7 13) czynność tarczycy prawidłowa lub wyrównana farmakologicznie; 14) nieobecność chorób układu sercowo-naczyniowego, które nie mogą być opanowane przy użyciu dostępnych metod leczenia. Kryteria włączenia muszą być spełnione łącznie Określenie czasu leczenia w programie Leczenie trwa do czasu podjęcia przez lekarza prowadzącego decyzji o wyłączeniu świadczeniobiorcy z programu, zgodnie z kryteriami wyłączenia Kryteria wyłączenia z programu 1) udokumentowana progresja w trakcie stosowania leku; 2) wystąpienie objawów nadwrażliwości na pazopanib lub na którąkolwiek substancję pomocniczą; 3) nawracająca lub nieakceptowana toksyczność powyżej 3 stopnia według skali WHO; 4) utrzymujący się stan sprawności 70 lub niższy według skali Karnofsky ego; 5) wystąpienie objawów zastoinowej niewydolności serca, ostrych incydentów niewydolności wieńcowej, niekontrolowanego nadciśnienia tętniczego, niestabilnych zaburzeń rytmu serca wymagających leczenia oraz wystąpienia objawów toksyczności ze strony wątroby 3 stopnia; 6) istotne pogorszenie jakości życia w trakcie stosowania leku. 4. Leczenie raka nerki przy wykorzystaniu substancji czynnej aksytynib 4.1. Kryteria kwalifikacji: 1) histologicznie potwierdzone rozpoznanie jasnokomórkowego raka nerki lub mieszanego raka nerkowokomórkowego z przeważającym (powyżej 50% utkania) komponentem jasnokomórkowym; 2) nowotwór w stadium zaawansowanym (pierwotne uogólnienie lub nawrót po pierwotnym leczeniu chirurgicznym);
8 3) udokumentowane niepowodzenie wcześniejszego leczenia z zastosowaniem wielokinazowych inhibitorów (sunitynib, pazopanib - w I linii leczenia) stosowanych jako leczenie poprzedzające lub po niepowodzeniu wcześniejszego leczenia cytokiną; 4) uprzednie wykonanie nefrektomii (radykalnej lub oszczędzającej); 5) udokumentowana obecność przerzutów narządowych; 6) zmiany możliwe do obiektywnej oceny w badaniach obrazowych metodą KT lub MR z zastrzeżeniem konieczności potwierdzenia zmian w układzie kostnym przy użyciu konwencjonalnej rentgenografii (RTG) lub MR; 7) nieobecność przerzutów w ośrodkowym układzie nerwowym (dopuszczalne wcześniejsze usunięcie przerzutów i /lub radioterapia, o ile po leczeniu utrzymuje się stan bezobjawowy); 8) stan sprawności wg skali Karnofsky ego; 9) korzystne lub pośrednie rokowanie według skali MSKCC (Memorial Sloan-Kettering Cancer Center); 10) wykluczenie ciąży i okresu karmienia piersią; 11) nieobecność niekontrolowanych chorób układu sercowonaczyniowego; 12) adekwatna wydolność narządowa określona na podstawie badań laboratoryjnych krwi: a) wyniki badań czynności wątroby: - stężenie bilirubiny całkowitej nieprzekraczające 2-krotnie górną granicę normy (z wyjątkiem pacjentów z zespołem Gilberta), - aktywność transaminaz (alaninowej i asparaginowej) w surowicy nieprzekraczające 5-krotnie górną granicę normy, b) stężenie kreatyniny nieprzekraczające 2-krotnie górną granicę normy, c) wyniki badania morfologii krwi z rozmazem: - liczba płytek krwi większa lub równa 10 5 /mm 3,
9 - bezwzględna liczba granulocytów obojętnochłonnych większa lub równa 1500/mm 3, - poziom hemoglobiny większy lub równy 9,5 g/dl; 13) czynność tarczycy prawidłowa lub wyrównana farmakologicznie. Kryteria kwalifikacji muszą być spełnione łącznie Do programu, w okresie nieprzekraczającym 6 miesięcy od daty wejścia w życie pierwszej decyzji o objęciu refundacją leku zawierającego substancję czynną aksytynib, kwalifikowani są również pacjenci uprzednio leczeni tą substancją czynną w ramach innego sposobu finansowania terapii (za wyjątkiem badań klinicznych) w celu zapewnienia kontynuacji terapii Określenie czasu leczenia w programie Leczenie trwa do czasu podjęcia przez lekarza prowadzącego decyzji o wyłączeniu świadczeniobiorcy z programu, zgodnie z kryteriami wyłączenia Kryteria wyłączenia z programu: 1) udokumentowana progresja w trakcie stosowania leku; 2) wystąpienie objawów nadwrażliwości na aksytynib lub na którąkolwiek substancję pomocniczą; 3) nawracająca lub nieakceptowana toksyczność powyżej 3 stopnia według skali WHO; 4) utrzymujący się stan sprawności 70 lub niższy według skali Karnofsky ego; 5) wystąpienie objawów zastoinowej niewydolności serca, ostrych incydentów niewydolności wieńcowej, niekontrolowanego nadciśnienia tętniczego oraz niestabilnych zaburzeń rytmu serca wymagających leczenia; 6) istotne pogorszenie jakości życia w trakcie stosowania leku. 5. Leczenie raka nerki przy wykorzystaniu substancji czynnej ewerolimus 5.1. Kryteria kwalifikacji
10 1) histologicznie potwierdzone rozpoznanie jasnokomórkowego raka nerki lub mieszanego raka nerkowokomórkowego z przeważającym (powyżej 60% utkania) komponentem jasnokomórkowym; 2) nowotwór w stadium zaawansowanym (pierwotne uogólnienie lub nawrót po pierwotnym leczeniu chirurgicznym); 3) udokumentowane niepowodzenie wcześniejszego leczenia z zastosowaniem wielokinazowych inhibitorów (sunitynib, sorafenib, pazopanib) stosowanych jako jedyne leczenie poprzedzające lub po wcześniejszej immunoterapii; 4) uprzednie wykonanie nefrektomii (radykalnej lub oszczędzającej); 5) udokumentowana obecność przerzutów narządowych; 6) zmiany możliwe do obiektywnej oceny w badaniach obrazowych metodą KT lub MR z zastrzeżeniem konieczności potwierdzenia zmian w układzie kostnym przy użyciu konwencjonalnej RTG lub MR; 7) nieobecność przerzutów w ośrodkowym układzie nerwowym (dopuszczalne wcześniejsze usunięcie przerzutów); 8) stan sprawności wg skali Karnofsky'ego; 9) korzystne lub pośrednie rokowanie według skali MSKCC (Memorial Sloan-Kettering Cancer Center); 10) wykluczenie ciąży i okresu karmienia piersią; 11) nieobecność innych nowotworów złośliwych z wyjątkiem przedinwazyjnego raka szyjki macicy oraz raka podstawnokomórkowego skóry; 12) wykluczenie czynnych zakażeń miejscowych lub ogólnoustrojowych; 13) nieobecność niekontrolowanych chorób układu sercowonaczyniowego; 14) adekwatna wydolność narządowa określona na podstawie badań laboratoryjnych krwi: a) wyniki badań czynności wątroby:
11 - stężenie bilirubiny całkowitej nieprzekraczające 2-krotnie górnej granicy normy (z wyjątkiem pacjentów z zespołem Gilberta), - aktywność transaminaz (alaninowej i asparaginowej) w surowicy nieprzekraczające 5-krotnie górnej granicy normy, b) stężenie kreatyniny nieprzekraczające 2-krotnie górnej granicy normy, c) wyniki badania morfologii krwi z rozmazem: - liczba płytek krwi większa lub równa 10 5 /mm 3, - bezwzględna liczba granulocytów obojętnochłonnych większa lub równa 1500/mm 3, - poziom hemoglobiny większy lub równy 9,5 g/dl; 15) prawidłowe stężenie glukozy we krwi; 16) niestosowanie leków z grupy silnych i umiarkowanych inhibitorów CYP3A4 (w szczególności ketokonazol, itrakonazol, worikonazol, klarytromycyna, telitromycyna, erytromycyna, werapamil, flukonazol, diltiazem, cyklosporyna). Kryteria kwalifikacji muszą być spełnione łącznie Określenie czasu leczenia w programie Leczenie trwa do czasu podjęcia przez lekarza prowadzącego decyzji o wyłączeniu świadczeniobiorcy z programu, zgodnie z kryteriami wyłączenia Kryteria wyłączenia z programu 1) udokumentowana progresja w trakcie stosowania leku; 2) wystąpienie objawów nadwrażliwości na ewerolimus lub na którąkolwiek substancję pomocniczą; 3) nawracająca lub nieakceptowalna toksyczność powyżej 3 stopnia według skali WHO; 4) utrzymujący się stan sprawności 70 lub niższy według skali Karnofsky'ego;
12 5) wystąpienie objawów zastoinowej niewydolności serca, ostrych incydentów niewydolności wieńcowej, niekontrolowanego nadciśnienia tętniczego oraz niestabilnych zaburzeń rytmu serca wymagających leczenia; 6) istotne pogorszenie jakości życia w trakcie stosowania leku. 6. Leczenie raka nerki przy wykorzystaniu substancji czynnej temsyrolimus 6.1. Kryteria kwalifikacji 1. Do programu mogą być zakwalifikowani pacjenci spełniający następujące kryteria: 1) histologicznie potwierdzone rozpoznanie raka nerkowokomórkowego; 2) nowotwór w stadium zaawansowanym (pierwotne uogólnienie lub nawrót po pierwotnym leczeniu chirurgicznym); 3) brak wcześniejszego leczenia farmakologicznego raka nerki; 4) stan sprawności 60 lub wyższy wg skali Karnofsky ego; 5) niekorzystne rokowanie według skali MSKCC (Memorial Sloan-Kettering Cancer Center); 6) wykluczenie ciąży i okresu karmienia piersią; 7) zmiany możliwe do obiektywnej oceny w badaniach obrazowych metodą komputerowej tomografii (KT) lub magnetycznego rezonansu (MR) z zastrzeżeniem konieczności potwierdzenia zmian w układzie kostnym przy użyciu konwencjonalnej rentgenografii (RTG) lub MR; 8) adekwatna wydolność narządowa określona na podstawie badań laboratoryjnych krwi: a) wyniki badań czynności wątroby: - aktywność transaminaz (alaninowej i asparaginowej) w surowicy nie wyższy niż 3-krotność górnej granicy określającej normę (w przypadku przerzutów do wątroby nie wyższy niż 5- krotność),
13 - stężenie bilirubiny całkowitej nieprzekraczające 1,5-krotnie górnej granicy normy (z wyjątkiem pacjentów z zespołem Gilberta), b) stężenie kreatyniny nieprzekraczające 1,5-krotnie górnej granicy normy, c) wyniki badań morfologii krwi z rozmazem: - liczba płytek krwi większa lub równa /mm 3, - bezwzględna liczba granulocytów obojętnochłonnych większa lub równa 1500/mm 3, - poziom hemoglobiny większy lub równy 8 mg/dl; 9) poziom cholesterolu, badanego na czczo, nie wyższy niż 350 mg/dl (9,1 mmol na litr); 10) poziom trójglicerydów badanych na czczo nie wyższy niż 400 mg/dl (4,5 mmol na litr); 11) potwierdzona obecność przynajmniej 3 z 6 poniżej wymienionych czynników ryzyka: - aktywność dehydrogenazy mleczanowej przekraczająca ponad 1,5-krotnie górną granicę normy, - stężenie hemoglobiny poniżej dolnej granicy normy, - stężenie skorygowane wapnia w surowicy > 10 mg/dl (2,5 mmol/l), - krótszy niż 12 miesięcy czas od ustalenia rozpoznania do chwili włączenia do leczenia, - stopień sprawności według skali Karnofsky go poniżej 80 (60 lub 70), - potwierdzenie obecności przerzutów w więcej niż jednym narządzie; 12) nieobecne przerzuty w OUN lub sytuacje po leczeniu chirurgicznym lub/i radioterapii (chorzy po wcześniejszym leczeniu z powodu przerzutów w OUN mogą być kwalifikowani do programu jedynie w przypadku stabilnego stanu neurologicznego i braku konieczności stosowania kortykosteroidów).
14 Kryteria kwalifikacji muszą być spełnione łącznie. 2. Do programu kwalifikowani są również pacjenci uprzednio leczeni temsyrolimusem w ramach innego sposobu finansowania terapii (za wyjątkiem badań klinicznych) w celu zapewnienia kontynuacji terapii Określenie czasu leczenia w programie Chorzy na zaawansowanego raka nerkowokomórkowego z grupy wysokiego ryzyka powinni kontynuować leczenie temsyrolimusem do wystąpienia progresji choroby lub działań niepożądanych, które uniemożliwiają dalsze stosowanie leku Kryteria wyłączenia z programu 1) udokumentowana progresja w trakcie stosowania leku; 2) wystąpienie objawów nadwrażliwości na temsyrolimus lub na którąkolwiek substancję pomocniczą; 3) nawracająca lub nieakceptowana toksyczność powyżej 3 stopnia według skali WHO; 4) utrzymujący się stan sprawności 60 lub niższy według skali Karnofsky ego; 5) istotne pogorszenie jakości życia w trakcie stosowania leku. 7. Leczenie raka nerki przy wykorzystaniu substancji czynnej kabozantynib 7.1. Kryteria kwalifikacji 1) wiek 18 lat i powyżej; 2) histologicznie potwierdzone rozpoznanie raka nerkowokomórkowego z przeważającym (powyżej 50% utkania) komponentem jasnokomórkowym; 3) nowotwór w stadium zaawansowanym (miejscowy nawrót lub przerzuty odległe), który nie kwalifikuje się do leczenia miejscowego;
15 4) udokumentowane niepowodzenie wcześniejszego leczenia z zastosowaniem terapii celowanej na czynnik wzrostu śródbłonka naczyniowego (VEGF) stosowanej jako jedyne leczenie albo jako leczenie poprzedzone wcześniejszą immunoterapią cytokiną; 5) uprzednie wykonanie nefrektomii (radykalnej lub oszczędzającej); 6) zmiany możliwe do obiektywnej oceny w badaniach obrazowych metodą KT lub MR z zastrzeżeniem konieczności potwierdzenia zmian w układzie kostnym przy użyciu badań obrazowych i według RECIST; 7) nieobecność przerzutów w ośrodkowym układzie nerwowym (dopuszczalne wcześniejsze wycięcie przerzutów lub radioterapia, o ile po leczeniu utrzymuje się stan bezobjawowy); 8) stan sprawności wg skali Karnofsky'ego; 9) korzystne lub pośrednie rokowanie według skali MSKCC (Memorial Sloan-Kettering Cancer Center); 10) wykluczenie ciąży i okresu karmienia piersią; 11) nieobecność niekontrolowanych chorób układu sercowo-naczyniowego; 12) zadowalająca wydolność narządowa określona na podstawie badań laboratoryjnych krwi: a) wyniki badań czynności wątroby: - stężenie bilirubiny całkowitej nieprzekraczające 1.5-krotnie górnej granicy normy (z wyjątkiem pacjentów z zespołem Gilberta), - aktywność transaminaz (alaninowej i asparaginianowej) w surowicy nieprzekraczające 3-krotnie górnej granicy normy, b) klirens kreatyniny 30 ml/min., c) wyniki badania morfologii krwi z rozmazem: - liczba płytek krwi większa lub równa 10 5 /mm 3,
16 - bezwzględna liczba granulocytów obojętnochłonnych większa lub równa 1500/mm 3, - poziom hemoglobiny większy lub równy 9,5 g/dl; 13) czynność tarczycy prawidłowa lub wyrównana farmakologicznie; 14) niewystępowanie stanów klinicznych, które w opinii lekarza prowadzącego uniemożliwiają włączenie terapii. Kryteria kwalifikacji muszą być spełnione łącznie. Ponadto do programu lekowego kwalifikowani są również pacjenci, którzy byli leczeni kabozantynibem w ramach innego sposobu finansowania terapii, pod warunkiem, że w chwili rozpoczęcia leczenia spełniali kryteria kwalifikacji do programu lekowego Określenie czasu leczenia w programie Leczenie trwa do czasu podjęcia przez lekarza prowadzącego decyzji o wyłączeniu świadczeniobiorcy z programu, zgodnie z kryteriami wyłączenia Kryteria wyłączenia z programu 1) udokumentowana progresja w trakcie stosowania leku; 2) wystąpienie objawów nadwrażliwości na kabozantynib lub na którąkolwiek substancję pomocniczą; 3) nawracająca lub nieakceptowalna toksyczność powyżej 3 stopnia według skali WHO; 4) utrzymujący się stan sprawności 70 lub niższy według skali Karnofsky ego; 5) konieczność stosowania leków z grupy silnych inhibitorów CYP3A4; 6) wystąpienie chorób lub stanów, które w opinii lekarza prowadzącego uniemożliwiają prowadzenie leczenia;
17 7) istotne pogorszenie jakości życia w trakcie stosowania leku. 8. Leczenie raka nerki przy wykorzystaniu substancji czynnej niwolumab 8.1. Kryteria kwalifikacji 1) histologicznie potwierdzone rozpoznanie raka nerkowokomórkowego z przeważającym komponentem jasnokomórkowym; 2) nowotwór w stadium zaawansowanym (miejscowy nawrót lub przerzuty odległe), który nie kwalifikuje się do leczenia miejscowego; 3) udokumentowane niepowodzenie wcześniejszego leczenia antyangiogennego z wykorzystaniem wielokinazowych inhibitorów (sunitynib, pazopanib, sorafenib) stosowanego jako jedyne leczenie albo jako leczenie poprzedzone wcześniejszą immunoterapią cytokiną; 4) uprzednie wykonanie nefrektomii (radykalnej lub oszczędzającej); 5) zmiany możliwe do oceny według systemu odpowiedzi RECIST 1.1; 6) nieobecność przerzutów w ośrodkowym układzie nerwowym (dopuszczalne wcześniejsze radykalne leczenie, o ile utrzymuje się stan bezobjawowy); 7) stan sprawności wg skali Karnofsky'ego; 8) wykluczenie ciąży i okresu karmienia piersią; 9) nieobecność aktywnych chorób autoimmunologicznych z wyłączeniem bielactwa, cukrzycy typu 1, niedoczynności tarczycy (leczonej wyłącznie suplementacją hormonalną), łuszczycy niewymagającej leczenia systemowego, 10) niestosowanie systemowe leków steroidowych (w dawce przekraczającej 10 mg prednizonu na dobę lub równoważnej dawki innego leku steroidowego) lub leków
18 immunosupresyjnych w ciągu ostatnich 14 dni przed rozpoczęciem leczenia niwolumabem (steroidy wziewne są dozwolone); 11) wykluczenie współwystępowania innych nowotworów złośliwych leczonych z założeniem paliatywnym (niezależnie od uzyskanej odpowiedzi) oraz nieuzyskanie całkowitej odpowiedzi w przypadku nowotworów leczonych z założeniem radykalnym; 12) negatywny wywiad w kierunku HIV lub AIDS; 13) nieobecność ostrych stanów zapalnych wątroby; 14) nieobecność przewlekłych stanów zapalnych wątroby, które w opinii lekarza mogą zagrażać bezpieczeństwu terapii niwolumabem; 15) nieobecność innych aktywnych schorzeń, które w opinii lekarza mogłyby maskować działania niepożądane niwolumabu, jak np. przewlekłe biegunki, ostre zapalenie uchyłków, przewlekłe zapalenie uchyłków w wywiadzie; 16) nieobecność istotnych klinicznie objawów toksyczności związanych z uprzednio stosowaną terapią przeciwnowotworową; 17) adekwatna wydolność narządowa określona na podstawie badań laboratoryjnych krwi: a) wyniki badań czynności wątroby: - stężenie bilirubiny całkowitej nieprzekraczające 1,5- krotnie górnej granicy normy (z wyjątkiem pacjentów z zespołem Gilberta), - aktywność aminotransferaz: alaninowej (AlAT) i asparaginianowej (AspAT) w surowicy, nieprzekraczające 3-krotnie górnej granicy normy, b) wartość klirensu kreatyniny 30ml/min, c) wyniki badania morfologii krwi z rozmazem: - liczba płytek krwi 10 5 /mm 3, - liczba leukocytów 2000/mm 3,
19 - bezwzględna liczba granulocytów obojętnochłonnych 1500/mm 3, - stężenie hemoglobiny 9,5 g/dl; 18) nieobecność nadwrażliwości na przeciwciała monoklonalne w wywiadzie; 19) nieobecność stanów, które w opinii lekarza stanowią udokumentowane przeciwwskazanie do terapii niwolumabem; 20) wiek powyżej 18 roku życia. Kryteria kwalifikacji muszą być spełnione łącznie Określenie czasu leczenia w programie Leczenie trwa do czasu podjęcia przez lekarza prowadzącego decyzji o wyłączeniu świadczeniobiorcy z programu, zgodnie z kryteriami wyłączenia Kryteria wyłączenia z programu 1) udokumentowana progresja w trakcie stosowania leku wg kryteriów RECIST 1.1; 2) wystąpienie objawów nadwrażliwości na niwolumab lub na którąkolwiek substancję pomocniczą; 3) ciąża i karmienie piersią; 4) wystąpienie toksyczności na tle immunologicznym zależnej od leczenia, m.in. (stopnie toksyczności zgodnie z NCI- CTCAE v4): a) zapalenie płuc stopnia 3. lub 4., b) biegunka lub zapalenie jelita grubego stopnia 4., c) zapalenie wątroby: zwiększenie aktywności AspAT, AlAT lub bilirubiny całkowitej stopnia 3. lub 4. (wzrost stężenia AspAT lub AlAT więcej niż 5 x w stosunku do górnej granicy normy lub wzrost stężenia całkowitej bilirubiny więcej niż 3 x w stosunku do górnej granicy normy),
20 d) zapalenie nerek lub zaburzenia czynności nerek - wzrost stężenia kreatyniny stopnia 4.: więcej niż 6 x w stosunku do górnej granicy normy, e) endokrynopatie pochodzenia immunologicznego: niedoczynność tarczycy stopnia 4., nadczynność tarczycy stopnia 4., niedoczynność przysadki stopnia 4., niewydolność kory nadnerczy stopnia 3. lub 4., cukrzyca stopnia 4., f) wysypka stopnia 4., g) działania niepożądane pochodzenia immunologicznego stopnia 2. lub 3., które utrzymują się pomimo modyfikacji leczenia lub w przypadku braku możliwości zredukowania dawki kortykosteroidów do 10 mg prednizonu na dobę lub równoważnej dawki innego leku; 5) utrzymujące się pogorszenie stanu sprawności 70 lub niższy według skali Karnofsky'ego; 6) istotne pogorszenie jakości życia w trakcie stosowania leku. 9. Kontynuacja leczenia pacjentów po zakończeniu finansowania w ramach chemioterapii niestandardowej 1) Z dniem 1 kwietnia 2018 r. do programu kwalifikowani mogą być pacjenci, których leczenie było finansowane do tego dnia w ramach programu chemioterapii niestandardowej. 2) Kwalifikacja, o której mowa w pkt 1, dotyczy leczenia tą samą substancją czynną, która była finansowana w ramach programu chemioterapii niestandardowej. 3) Pacjenci, o których mowa w pkt 1, nie muszą spełniać w chwili kwalifikacji innych kryteriów wymaganych do włączenia do programu. 4) Pacjenci, o których mowa w pkt 1, kontynuują leczenie w ramach programu do momentu podjęcia decyzji przez
21 lekarza prowadzącego o zakończeniu leczenia danym lekiem.
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Dziennik Urzędowy Ministra Zdrowia 538 Poz. 86 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
Dziennik Urzędowy Ministra Zdrowia 538 Poz. 86 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Dziennik Urzędowy Ministra Zdrowia 671 Poz. 17 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
Dziennik Urzędowy Ministra Zdrowia 671 Poz. 17 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
LECZENIE RAKA NERKI (ICD-10 C 64)
 Dziennik Urzędowy Ministra Zdrowia 607 Poz. 71 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
Dziennik Urzędowy Ministra Zdrowia 607 Poz. 71 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4)
 Załącznik B.53. LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
Załącznik B.53. LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4)
 Załącznik B.53..docx LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
Załącznik B.53..docx LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
Terapeutyczne Programy Zdrowotne 2012 Leczenie raka nerki
 Załącznik nr 39 do zarządzenia nr 59/2011/DGL Prezesa NFZ Załącznik nr 8 do zarządzenia nr 10/2012/DGL Prezesa NFZ z dnia 15 lutego 2012 r. Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny:
Załącznik nr 39 do zarządzenia nr 59/2011/DGL Prezesa NFZ Załącznik nr 8 do zarządzenia nr 10/2012/DGL Prezesa NFZ z dnia 15 lutego 2012 r. Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny:
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
Terapeutyczne Programy Zdrowotne 2010 Leczenie raka nerki Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku
 Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r.
 Dziennik Ustaw Nr 269 15678 Poz. 1593 1593 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na podstawie
Dziennik Ustaw Nr 269 15678 Poz. 1593 1593 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na podstawie
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Nazwa programu: LECZENIE RAKA WĄTROBOKOMÓRKOWEGO
 Załącznik nr 48 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE RAKA WĄTROBOKOMÓRKOWEGO ICD-10 C 22.0 Rak komórek wątroby Dziedzina medycyny: Onkologia
Załącznik nr 48 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE RAKA WĄTROBOKOMÓRKOWEGO ICD-10 C 22.0 Rak komórek wątroby Dziedzina medycyny: Onkologia
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Leczenie zaawansowanego raka jelita grubego przy wykorzystaniu substancji
Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Leczenie zaawansowanego raka jelita grubego przy wykorzystaniu substancji
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY I. Leczenie pierwszej linii chorych na zaawansowanego raka jelita grubego
Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY I. Leczenie pierwszej linii chorych na zaawansowanego raka jelita grubego
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r.
 Dziennik Ustaw Nr 244 14447 Poz. 1455 1455 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych
Dziennik Ustaw Nr 244 14447 Poz. 1455 1455 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34)
 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne
Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Dziennik Urzędowy Ministra Zdrowia 552 Poz. 71 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY I. Leczenie pierwszej linii
Dziennik Urzędowy Ministra Zdrowia 552 Poz. 71 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY I. Leczenie pierwszej linii
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r.
 Dziennik Ustaw Nr 244 14447 Poz. 1455 1455 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych
Dziennik Ustaw Nr 244 14447 Poz. 1455 1455 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Dziennik Urzędowy Ministra Zdrowia 862 Poz. 71 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji:
Dziennik Urzędowy Ministra Zdrowia 862 Poz. 71 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji:
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51)
 Załącznik B.55. LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51) ZAKRES ŚWIADCZENIA GWARANTOWANEGO 1. Kryteria włączenia ŚWIADCZENIOBIORCY Do leczenia infliksymabem mogą
Załącznik B.55. LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51) ZAKRES ŚWIADCZENIA GWARANTOWANEGO 1. Kryteria włączenia ŚWIADCZENIOBIORCY Do leczenia infliksymabem mogą
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32.a. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE
Załącznik B.32.a. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 519 Poz. 42 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
Dziennik Urzędowy Ministra Zdrowia 519 Poz. 42 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43)
 Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKU W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKU W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43)
 Dziennik Urzędowy Ministra Zdrowia 858 Poz. 133 Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKU W PROGRAMIE
Dziennik Urzędowy Ministra Zdrowia 858 Poz. 133 Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKU W PROGRAMIE
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik do rozporządzenia Ministra Zdrowia z dnia 28 października 2011 r.
 Załącznik do rozporządzenia Ministra Zdrowia z dnia 28 października 2011 r. ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu substancji czynnej pemetreksed:
Załącznik do rozporządzenia Ministra Zdrowia z dnia 28 października 2011 r. ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu substancji czynnej pemetreksed:
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W BADANIA DIAGNOSTYCZNE WYKONYWANE W ŚWIADCZENIOBIORCY PROGRAMIE RAMACH
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W BADANIA DIAGNOSTYCZNE WYKONYWANE W ŚWIADCZENIOBIORCY PROGRAMIE RAMACH
LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD-10 C43)
 Dziennik Urzędowy Ministra Zdrowia 832 Poz. 79 Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD-10 C43) ŚWIADCZENIOBIORCY A. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH IPILIMUMABEM 1.
Dziennik Urzędowy Ministra Zdrowia 832 Poz. 79 Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD-10 C43) ŚWIADCZENIOBIORCY A. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH IPILIMUMABEM 1.
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0)
 Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0) ŚWIADCZENIOBIORCY Kwalifikacja do programu A. Kryteria kwalifikacji do leczenia ustekinumabem w ramach programu 1.Do programu
Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0) ŚWIADCZENIOBIORCY Kwalifikacja do programu A. Kryteria kwalifikacji do leczenia ustekinumabem w ramach programu 1.Do programu
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 610 Poz. 79 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
Dziennik Urzędowy Ministra Zdrowia 610 Poz. 79 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
LECZENIE CIĘŻKIEJ, AKTYWNEJ POSTACI ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45)
 Załącznik B.36. LECZENIE CIĘŻKIEJ, AKTYWNEJ POSTACI ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45) ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW ŚWIADCZENIOBIORCY W PROGRAMIE
Załącznik B.36. LECZENIE CIĘŻKIEJ, AKTYWNEJ POSTACI ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45) ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW ŚWIADCZENIOBIORCY W PROGRAMIE
LECZENIE RAKA PIERSI (ICD-10 C 50)
 Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Leczenie
Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Leczenie
LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45)
 Dziennik Urzędowy Ministra Zdrowia 732 Poz. 71 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
Dziennik Urzędowy Ministra Zdrowia 732 Poz. 71 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0)
 Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 566 Poz. 71 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
Dziennik Urzędowy Ministra Zdrowia 566 Poz. 71 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
INNOWACJE W LECZENIU RAKA NERKI- OCENA DOSTĘPNOŚCI W POLSCE. Prof. Cezary Szczylik Lek. Przemysław Langiewicz CSK WIM
 INNOWACJE W LECZENIU RAKA NERKI- OCENA DOSTĘPNOŚCI W POLSCE Prof. Cezary Szczylik Lek. Przemysław Langiewicz CSK WIM I/II linia leczenia rozsianego raka nerki Pazopanib - Produkt Votrient jest wskazany
INNOWACJE W LECZENIU RAKA NERKI- OCENA DOSTĘPNOŚCI W POLSCE Prof. Cezary Szczylik Lek. Przemysław Langiewicz CSK WIM I/II linia leczenia rozsianego raka nerki Pazopanib - Produkt Votrient jest wskazany
LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0)
 Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0)
 Załącznik B.22. LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0) WIADCZENIOBIORCY Kwalifikacji świadczeniobiorców do terapii dokonuje Zespół Koordynacyjny ds. Chorób Ultrarzadkich powoływany przez Prezesa Narodowego
Załącznik B.22. LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0) WIADCZENIOBIORCY Kwalifikacji świadczeniobiorców do terapii dokonuje Zespół Koordynacyjny ds. Chorób Ultrarzadkich powoływany przez Prezesa Narodowego
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
LECZENIE MIĘSAKÓW TKANEK MIĘKKICH (ICD-10 C48, C49)
 Dziennik Urzędowy Ministra Zdrowia 525 Poz. 86 Załącznik B.8. LECZENIE MIĘSAKÓW TKANEK MIĘKKICH (ICD-10 C48, C49) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie mięsaków tkanek miękkich
Dziennik Urzędowy Ministra Zdrowia 525 Poz. 86 Załącznik B.8. LECZENIE MIĘSAKÓW TKANEK MIĘKKICH (ICD-10 C48, C49) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie mięsaków tkanek miękkich
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1. Podczas pierwszej kwalifikacji do programu oraz gdy jest to
Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1. Podczas pierwszej kwalifikacji do programu oraz gdy jest to
Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny: hematologia.
 Załącznik nr 10 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny:
Załącznik nr 10 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny:
Terapeutyczne Programy Zdrowotne 2012 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 8
 Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE 1. Dawkowanie oraz sposób modyfikacji dawkowania w programie:
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45)
 Dziennik Urzędowy Ministra Zdrowia 615 Poz. 27 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
Dziennik Urzędowy Ministra Zdrowia 615 Poz. 27 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
Terapeutyczne Programy Zdrowotne 2009 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 9
 Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008.
 załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Dziennik Urzędowy Ministra Zdrowia 875 Poz. 129 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji:
Dziennik Urzędowy Ministra Zdrowia 875 Poz. 129 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji:
LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM, EPOPROSTENOLEM I MACYTENTANEM (TNP) (ICD-10 I27, I27.0)
 Dziennik Urzędowy Ministra Zdrowia 731 Poz. 66 Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM, EPOPROSTENOLEM I MACYTENTANEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia
Dziennik Urzędowy Ministra Zdrowia 731 Poz. 66 Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM, EPOPROSTENOLEM I MACYTENTANEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
LECZENIE RAKA PIERSI ICD-10 C
 załącznik nr 5 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE RAKA PIERSI ICD-10 C 50 nowotwór złośliwy sutka Dziedzina medycyny: onkologia kliniczna I. Cel
załącznik nr 5 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE RAKA PIERSI ICD-10 C 50 nowotwór złośliwy sutka Dziedzina medycyny: onkologia kliniczna I. Cel
LECZENIE RAKA PIERSI (ICD-10 C 50)
 Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe raka piersi trastuzumabem 1.1 Kryteria kwalifikacji 1) histologiczne rozpoznanie raka piersi; 2) nadekspresja
Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe raka piersi trastuzumabem 1.1 Kryteria kwalifikacji 1) histologiczne rozpoznanie raka piersi; 2) nadekspresja
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA W TROBY TYPU B (ICD-10 B 18.1)
 Załącznik B.1. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA W TROBY TYPU B (ICD-10 B 18.1) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1. Do programu są kwalifikowani świadczeniobiorcy
Załącznik B.1. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA W TROBY TYPU B (ICD-10 B 18.1) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1. Do programu są kwalifikowani świadczeniobiorcy
LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM, EPOPROSTENOLEM I MACYTENTANEM (TNP) (ICD-10 I27, I27.0)
 Dziennik Urzędowy Ministra Zdrowia 738 Poz. 42 Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM, EPOPROSTENOLEM I MACYTENTANEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia
Dziennik Urzędowy Ministra Zdrowia 738 Poz. 42 Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM, EPOPROSTENOLEM I MACYTENTANEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia
LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61)
 Załącznik B.56. LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie opornego na kastrację raka gruczołu krokowego octanem
Załącznik B.56. LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie opornego na kastrację raka gruczołu krokowego octanem
LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM, EPOPROSTENOLEM I MACYTENTANEM (TNP) (ICD-10 I27, I27.0)
 Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM, EPOPROSTENOLEM I MACYTENTANEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia sildenafilem A. Leczenie sildenafilem pacjentów
Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM, EPOPROSTENOLEM I MACYTENTANEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia sildenafilem A. Leczenie sildenafilem pacjentów
LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61)
 Załącznik B.56. LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie opornego na kastrację raka gruczołu krokowego octanem
Załącznik B.56. LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie opornego na kastrację raka gruczołu krokowego octanem
LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
LECZENIE NEOWASKULARNEJ (WYSIĘKOWEJ) POSTACI ZWYRODNIENIA PLAMKI ZWIĄZANEGO Z WIEKIEM (AMD) (ICD-10 H35.3)
 Dziennik Urzędowy Ministra Zdrowia 761 Poz. 48 Załącznik B.70. LECZENIE NEOWASKULARNEJ (WYSIĘKOWEJ) POSTACI ZWYRODNIENIA PLAMKI ZWIĄZANEGO Z WIEKIEM (AMD) (ICD-10 H35.3) ŚWIADCZENIOBIORCY afliberceptem
Dziennik Urzędowy Ministra Zdrowia 761 Poz. 48 Załącznik B.70. LECZENIE NEOWASKULARNEJ (WYSIĘKOWEJ) POSTACI ZWYRODNIENIA PLAMKI ZWIĄZANEGO Z WIEKIEM (AMD) (ICD-10 H35.3) ŚWIADCZENIOBIORCY afliberceptem
LECZENIE NEOWASKULARNEJ (WYSIĘKOWEJ) POSTACI ZWYRODNIENIA PLAMKI ZWIĄZANEGO Z WIEKIEM (AMD) (ICD-10 H35.3)
 Dziennik Urzędowy Ministra Zdrowia 882 Poz. 79 Załącznik B.70. LECZENIE NEOWASKULARNEJ (WYSIĘKOWEJ) POSTACI ZWYRODNIENIA PLAMKI ZWIĄZANEGO Z WIEKIEM (AMD) (ICD-10 H35.3) ŚWIADCZENIOBIORCY 1. Leczenie neowaskularnej
Dziennik Urzędowy Ministra Zdrowia 882 Poz. 79 Załącznik B.70. LECZENIE NEOWASKULARNEJ (WYSIĘKOWEJ) POSTACI ZWYRODNIENIA PLAMKI ZWIĄZANEGO Z WIEKIEM (AMD) (ICD-10 H35.3) ŚWIADCZENIOBIORCY 1. Leczenie neowaskularnej
LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM I EPOPROSTENOLEM (TNP) (ICD-10 I27, I27.0)
 Dziennik Urzędowy Ministra Zdrowia 719 Poz. 27 Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM I EPOPROSTENOLEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia sildenafilem
Dziennik Urzędowy Ministra Zdrowia 719 Poz. 27 Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM I EPOPROSTENOLEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia sildenafilem
LECZENIE CHOROBY LE NIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LE NIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.32. LECZENIE CHOROBY LE NIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
LECZENIE RAKA PIERSI (ICD-10 C 50)
 Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Leczenie
Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Leczenie
