Valsamix Amlodipine + Valsartan, 5 mg + 80 mg, 5 mg mg, 10 mg mg, tabletki powlekane
|
|
|
- Bronisław Łuczak
- 8 lat temu
- Przeglądów:
Transkrypt
1 Plan zarządzania ryzykiem dla produktu leczniczego Valsamix Amlodipine + Valsartan, 5 mg + 80 mg, 5 mg mg, 10 mg mg, tabletki powlekane Nr procedury NL/H/3460/ /DC Tłumaczenie na język polski
2 VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Valsamix, przygotowane do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Nadciśnienie jest definiowane jako obecność uporczywie utrzymującego się podwyższonego ciśnienia tętniczego krwi, większego niż 140/90 mm Hg (1). Może wystąpić nadciśnienie pierwotne, które może rozwijać się na skutek przyczyn środowiskowych lub genetycznych, lub nadciśnienie wtórne, które może mieć wieloraką etiologię, włączając przyczyny nerkowe, naczyniowe, i endokrynologiczne. U osób dorosłych nadciśnienie pierwotne występuje w 90 95% przypadkach, wtórne stanowi 2 10% przypadków (2). Wskaźniki rozpowszechnienia nadciśnienia różnią się znacznie w różnych krajach, prezentując wyższe wartości w Europie (44%) niż w Stanach Zjednoczonych (28%) (3). Na podstawie światowych zdrowotnych danych statystycznych z roku 2012 oszacowano, że 29,2% mężczyzn oraz 24.8% kobiet ma nadciśnienie (4). Częstość jego występowania znacznie zwiększa się u pacjentów powyżej 60 roku życia. Nadciśnienie jest związane ze znacznie zwiększoną zachorowalnością i umieralnością z powodu choroby naczyń mózgowych, zawału mięśnia sercowego, zastoinowej niewydolności serca i niewydolności nerek (3). VI.2.2 Podsumowanie korzyści wynikających z leczenia Wieloośrodkowe, międzynarodowe badanie postmarketingowe (przeprowadzane po rejestracji leku) (ang. postmarketing surveillance-pms) przeprowadzono w 298 ośrodkach klinicznych w Azji, Egipcie i Rosji. W badaniu oceniano zmiany rytmu serca oraz ciśnienie tętnicze (ang. blood pressure - BP) u pacjentów z nadciśnieniem (BP>140/90 mmhg) po 12 tygodniach stosowania produktu złożonego zawierającego 5/10 mg amlodypiny i 80/160 mg walsartanu. W sumie, do badania włączono 2785 pacjentów, którym lekarze przepisali złożony produkt amlodypiny i walsartanu. Spośród tych pacjentów 52 osoby (1,9%) nie ukończyły badania a dane 4 pacjentów zaginęły/ były nieprawidłowe. W sumie, 2729 pacjentów ukończyło badanie: średni wiek uczestników to 57,9 lat, 54,5% to mężczyźni, 54,2% pochodzenia azjatyckiego, 44,6% kaukaskiego; u 86,5% uczestników nadciśnienie było wcześniej leczone (ale zostało przerwane), początkowa wartość ciśnienia krwi wynosiła 163,1/96,2 mm Hg. Znaczne zmniejszenie ciśnienia krwi ( 33,2/ 16,9 mm Hg) uzyskano stosując złożony produkt amlodypiny i walsartanu, osiągając końcową wartość ciśnienia krwi 129,9/79,3 mm Hg. Optymalne obniżenie ciśnienia krwi osiągnięto we wszystkich stadiach nadciśnienia, dostarczając dowód, ze większość pacjentów z nadciśnieniem może odnieść korzyść z leczenia produktem złożonym amlodypiny i walsartanu (5). VI.2.3 Niewiadome związane z korzyściami z leczenia Bezpieczeństwo i skuteczność stosowania preparatu złożonego amlodypiny i walsartanu u pacjentek karmiących piersią nie zostały ustalone.
3 VI.2.4 Podsumowanie informacji dotyczących bezpieczeństwa stosowania Istotne rozpoznane zagrożenia Fetotoksyczność lub Wiadomo, że narażenie na leki Nie należy rozpoczynać leczenia toksyczność dla płodu (związana będące antagonistami receptora antagonistami receptora ze stosowaniem w drugim lub trzecim trymestrze ciąży) angiotensyny II (AIIRAs) (leki, które działają poprzez blokowanie wpływu hormonu angiotensyny II, naturalnej substancji w organizmie, która zwęża naczynia krwionośne) w angiotensyny II (AIIRAs) w czasie ciąży. Należy rozważyć zastosowanie innego leczenia przeciwnadciśnieniowego, które ma ustalony profil bezpieczeństwa stosowania w drugim i trzecim trymestrze ciąży ciąży. wywołuje działanie toksyczne na płód [pogorszenie czynności nerek, małowodzie (stan w ciąży, charakteryzujący się niedoborem płynu owodniowego), opóźnienie w procesie kostnienia czaszki (opóźniony proces odkładania materiału kostnego przez komórki kostne)], działanie toksyczne na noworodka [niewydolność nerek, niedociśnienie (niskie ciśnienie krwi), hiperkaliemię (wyższe niż prawidłowe stężenie potasu we krwi krążącej)]. Hipotensja (niskie ciśnienie krwi) W badaniu kontrolowanym placebo (stosując leczenie obojętne), u pacjentów leczonych produktem złożonym amlodypiny z walsartanem obserwowano nasilone Na początku leczenia zalecana jest ścisła kontrola lekarska. Wprowadzenie zmian mających wpływ na stan pacjenta, zmniejszających podatność na niedociśnienie przed niedociśnienie u 0,4% pacjentów rozpoczęciem leczenia z niepowikłanym nadciśnieniem tętniczym (ciśnienie tętnicze produktem złożonym amlodypiny i walsartanu. krwi, które występuje bez towarzyszących stanów chorobowych, takich jak cukrzyca, niewydolność serca lub choroba wieńcowa). Objawowe niedociśnienie tętnicze może wystąpić u pacjentów z pobudzonym układem renina-angiotensyna [(pacjentów odwodnionych i/(lub) z niedoborem soli w wyniku przyjmowania dużych dawek leków moczopędnych (leki powodujące zwiększone oddawanie moczu)], którzy stosują inhibitory receptora angiotensyny.
4 Hiperkaliemia (wyższe niż prawidłowe stężenie potasu we krwi krążącej) Należy zachować ostrożność i często kontrolować stężenie potasu podczas jednoczesnego stosowania z suplementami potasu, lekami moczopędnymi oszczędzającymi potas (lekami, które nie sprzyjają wydzielaniu potasu z moczem), substytutami soli zawierającymi potas lub innymi lekami, które mogą zwiększać stężenie potasu (np. heparyna, itp.). Na początku oraz podczas leczenia zalecana jest ścisła kontrola lekarska. Zmniejszona czynność nerek Można przewidywać, że u osób podatnych, w wyniku hamowania układu reninaangiotensyna-aldosteron wystąpi niewydolność nerek. U pacjentów z ciężką niewydolnością serca, u których czynność nerek może zależeć od działania układu reninaangiotensyna, leczenie inhibitorami ACE i antagonistami receptora angiotensyny II jest związane ze skąpomoczem (wytwarzaniem wyjątkowo małych ilości moczu) i/(lub) postępującą azotemią [stanem chorobowym charakteryzującym się niespotykanie wysokimi stężeniami związków zawierających azot (takimi jak mocznik, kreatynina, różne produkty przemiany materii i inne związki bogate w azot) we krwi] i (rzadko) z ostrą niewydolnością nerek i/(lub) śmiercią. Podobne zdarzenia raportowano podczas stosowania walsartanu. Ocena stanu pacjentów z niewydolnością serca lub po zawale mięśnia sercowego powinna zawsze obejmować sprawdzenie czynności nerek. Pacjentom z ciężką chorobą nerek lub dializowanym należy zalecić, aby nie stosowali produktu złożonego amlodypiny z walsartanem. Należy zalecić pacjentom z zaburzeniami czynności wątroby lub nerek lub po przeszczepieniu nerki, lub których poinformowano, że mają zwężenie naczyń nerkowych, że powinni skonsultować się z lekarzem przed rozpoczęciem leczenia produktem złożonym amlodypiny z walsartanem. Na początku oraz podczas leczenia zalecana jest ścisła kontrola lekarska.
5 Istotne możliwe zagrożenia Zagrożenie Teratogenność lub wady rozwojowe płodu (podczas stosowania produktu leczniczego w pierwszym trymestrze ciąży) Co wiadomo (łącznie z przyczyną, dlaczego jest to uważane za potencjalne zagrożenie) Dane epidemiologiczne dotyczące ryzyka działania teratogennego w przypadku narażenia na inhibitory ACE w pierwszym trymestrze ciąży nie są ostateczne; nie można jednak wykluczyć niewielkiego zwiększenia ryzyka. Mimo że nie ma danych z kontrolowanych badań epidemiologicznych dotyczących ryzyka związanego z antagonistami receptora angiotensyny II, z tą grupą leków mogą wiązać się podobne zagrożenia. O ile kontynuacja leczenia za pomocą antagonisty receptora angiotensyny II nie jest niezbędna, u pacjentek planujących ciążę należy zastosować inne leki przeciwnadciśnieniowe, które mają ustalony profil bezpieczeństwa stosowania w ciąży. Po stwierdzeniu ciąży leczenie antagonistami receptora angiotensyny II należy natychmiast przerwać i w razie potrzeby rozpocząć leczenie alternatywne. Istotne brakujące dane Zagrożenie Stosowanie podczas karmienia piersią Co wiadomo Brak informacji dotyczących stosowania produktu złożonego amlodypiny z walsartanem w okresie karmienia piersią, dlatego nie zaleca się stosowania produktu złożonego amlodypiny z walsartanem w tym okresie. W czasie karmienia piersią, w szczególności noworodków i niemowląt urodzonych przedwcześnie, zaleca się stosowanie innych produktów posiadających lepszy profil bezpieczeństwa. VI.2.5 Podsumowanie dodatkowych aktywności minimalizujących ryzyko w odniesieniu do określonych zagrożeń Dodatkowe aktywności minimalizujące ryzyko w odniesieniu do następujących zagrożeń: Nie zaproponowano dodatkowych aktywności minimalizujących ryzyko. VI.2.6 Przewidywany plan nadzoru nad bezpieczeństwem stosowania produktu po uzyskaniu pozwolenia na dopuszczenie do obrotu (jeśli dotyczy) Nie dotyczy. VI.2.7 Podsumowanie zmian wprowadzonych w planie zarządzania ryzykiem w porządku chronologicznym Nie dotyczy.
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Karbis, 4 mg, tabletki Karbis, 8 mg, tabletki Karbis, 16 mg, tabletki Karbis, 32 mg, tabletki Candesartanum cilexetilum Należy zapoznać się z treścią ulotki
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Karbis, 4 mg, tabletki Karbis, 8 mg, tabletki Karbis, 16 mg, tabletki Karbis, 32 mg, tabletki Candesartanum cilexetilum Należy zapoznać się z treścią ulotki
Aneks III. Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta.
 Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
Aneks II. Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
 Aneks II Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta 7 Dla produktów zawierających inhibitory enzymu konwertującego angiotensynę (inhibitory ACE) benazepryl,
Aneks II Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta 7 Dla produktów zawierających inhibitory enzymu konwertującego angiotensynę (inhibitory ACE) benazepryl,
Rejestr codziennej praktyki lekarskiej dotyczący cy leczenia nadciśnienia nienia tętniczego t tniczego. czynnikami ryzyka sercowo- naczyniowego
 Rejestr codziennej praktyki lekarskiej dotyczący cy leczenia nadciśnienia nienia tętniczego t tniczego współwyst występującego z innymi czynnikami ryzyka sercowo- naczyniowego Nr rejestru: HOE 498_9004
Rejestr codziennej praktyki lekarskiej dotyczący cy leczenia nadciśnienia nienia tętniczego t tniczego współwyst występującego z innymi czynnikami ryzyka sercowo- naczyniowego Nr rejestru: HOE 498_9004
VI.2 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Co-Amlessa. VI 2.1 Omówienie rozpowszechnienia choroby
 VI.2 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Co-Amlessa VI 2.1 Omówienie rozpowszechnienia choroby Ten lek o ustalonej dawce stosuje się w leczeniu wysokiego ciśnienia tętniczego
VI.2 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Co-Amlessa VI 2.1 Omówienie rozpowszechnienia choroby Ten lek o ustalonej dawce stosuje się w leczeniu wysokiego ciśnienia tętniczego
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej
 6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej 6.2.1. Podsumowanie korzyści wynikających z leczenia Co to jest T2488? T2488
6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej 6.2.1. Podsumowanie korzyści wynikających z leczenia Co to jest T2488? T2488
Carzap, tabletki, 4 mg, 8 mg, 16 mg, 32 mg. Każda tabletka zawiera odpowiednio: 4 mg, 8 mg, 16 mg lub 32 mg kandesartanu cyleksetylu.
 Carzap, tabletki, 4 mg, 8 mg, 16 mg, 32 mg. Każda tabletka zawiera odpowiednio: 4 mg, 8 mg, 16 mg lub 32 mg kandesartanu cyleksetylu. Substancja pomocnicza o znanym działaniu: Carzap, 4 mg: 127,1 mg laktozy,
Carzap, tabletki, 4 mg, 8 mg, 16 mg, 32 mg. Każda tabletka zawiera odpowiednio: 4 mg, 8 mg, 16 mg lub 32 mg kandesartanu cyleksetylu. Substancja pomocnicza o znanym działaniu: Carzap, 4 mg: 127,1 mg laktozy,
12 SQ-HDM Grupa farmakoterapeutyczna: Wyciągi alergenowe, kurz domowy; Kod ATC: V01AA03
 SUBSTANCJA CZYNNA (INN) GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU LECZNICZEGO, KTÓREGO DOTYCZY PLAN ZARZĄDZANIA RYZYKIEM 12 SQ-HDM Grupa farmakoterapeutyczna:
SUBSTANCJA CZYNNA (INN) GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU LECZNICZEGO, KTÓREGO DOTYCZY PLAN ZARZĄDZANIA RYZYKIEM 12 SQ-HDM Grupa farmakoterapeutyczna:
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA
 ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Irprestan, 75 mg, tabletki powlekane Irprestan, 150 mg, tabletki powlekane Irprestan, 300 mg, tabletki powlekane (Irbesartanum) Należy zapoznać się z treścią
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Irprestan, 75 mg, tabletki powlekane Irprestan, 150 mg, tabletki powlekane Irprestan, 300 mg, tabletki powlekane (Irbesartanum) Należy zapoznać się z treścią
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości
 Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Annex I. Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia
 Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Ulotka dołączona do opakowania: informacja dla pacjenta. Teveten 600 mg, tabletki powlekane Eprosartanum
 Ulotka dołączona do opakowania: informacja dla pacjenta Teveten 600 mg, tabletki powlekane Eprosartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Teveten 600 mg, tabletki powlekane Eprosartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
NADCIŚNIENIE ZESPÓŁ METABOLICZNY
 NADCIŚNIENIE ZESPÓŁ METABOLICZNY Poradnik dla pacjenta i jego rodziny Konsultacja: prof. dr hab. med. Zbigniew Gaciong CO TO JEST ZESPÓŁ METABOLICZNY Nadciśnienie tętnicze (inaczej podwyższone ciśnienie
NADCIŚNIENIE ZESPÓŁ METABOLICZNY Poradnik dla pacjenta i jego rodziny Konsultacja: prof. dr hab. med. Zbigniew Gaciong CO TO JEST ZESPÓŁ METABOLICZNY Nadciśnienie tętnicze (inaczej podwyższone ciśnienie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Kamiren (Doxazosinum) 1 mg, 2 mg, 4 mg tabletki
 Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty, gdy potrzebna
Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty, gdy potrzebna
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Edarbi 20 mg tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 20 mg medoksomilu azylsartanu (w postaci soli potasowej).
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Edarbi 20 mg tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 20 mg medoksomilu azylsartanu (w postaci soli potasowej).
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon
 VI.2 VI.2.1 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon Omówienie rozpowszechnienia choroby Deksametazonu sodu fosforan w postaci roztworu do wstrzykiwań stosowany jest
VI.2 VI.2.1 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon Omówienie rozpowszechnienia choroby Deksametazonu sodu fosforan w postaci roztworu do wstrzykiwań stosowany jest
Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej wiadomości.
 VI.2 Plan Zarządzania Ryzykiem dla produktów kwalifikowanych jako "Well established use" zawierających Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej
VI.2 Plan Zarządzania Ryzykiem dla produktów kwalifikowanych jako "Well established use" zawierających Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej
2 Porady w zakresie obrazu chorobowego
 Rozdział 2 2 Porady w zakresie obrazu chorobowego W niniejszym rozdziale przedstawiona jest choroba nadciśnieniowa, choroba wieńcowa serca i niewydolność mięśnia sercowego. Dodatkowe ryzyko wystąpienia
Rozdział 2 2 Porady w zakresie obrazu chorobowego W niniejszym rozdziale przedstawiona jest choroba nadciśnieniowa, choroba wieńcowa serca i niewydolność mięśnia sercowego. Dodatkowe ryzyko wystąpienia
Spis treści. 1. Przyczyny nadciśnienia tętniczego Bogdan Wyrzykowski... 13
 Spis treści 1. Przyczyny nadciśnienia tętniczego Bogdan Wyrzykowski........ 13 Genetyczne uwarunkowania pierwotnego nadciśnienia tętniczego..... 14 Nadciśnienie monogeniczne..................................
Spis treści 1. Przyczyny nadciśnienia tętniczego Bogdan Wyrzykowski........ 13 Genetyczne uwarunkowania pierwotnego nadciśnienia tętniczego..... 14 Nadciśnienie monogeniczne..................................
SKRÓCONA INFORMACJA O LEKU VALTAP,
 1. Charakterystyka produktu leczniczego Valtap, Valtap HCT 2. A. Niklas, A. Tykarski, Terapia nadciśnienia tętniczego. Leki hipotensyjne.sartany. Walsartan. Biblioteka czasopisma nadciśnnienie tętnicze
1. Charakterystyka produktu leczniczego Valtap, Valtap HCT 2. A. Niklas, A. Tykarski, Terapia nadciśnienia tętniczego. Leki hipotensyjne.sartany. Walsartan. Biblioteka czasopisma nadciśnnienie tętnicze
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA KAMAGRA 100 mg, tabletki powlekane Sildenafil w postaci cytrynianu Należy zapoznać się z treścią ulotki przed zastosowaniem leku. 1- Należy zachować tę ulotkę,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA KAMAGRA 100 mg, tabletki powlekane Sildenafil w postaci cytrynianu Należy zapoznać się z treścią ulotki przed zastosowaniem leku. 1- Należy zachować tę ulotkę,
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA
 ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Valsacor 40 mg tabletki powlekane Valsacor 80 mg tabletki powlekane Valsacor 160 mg tabletki powlekane Valsacor 320 mg tabletki powlekane Valsartanum Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Valsacor 40 mg tabletki powlekane Valsacor 80 mg tabletki powlekane Valsacor 160 mg tabletki powlekane Valsacor 320 mg tabletki powlekane Valsartanum Należy
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Irprestan, 75 mg, tabletki powlekane Irprestan, 150 mg, tabletki powlekane Irprestan, 300 mg, tabletki powlekane Irbesartanum Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla użytkownika Irprestan, 75 mg, tabletki powlekane Irprestan, 150 mg, tabletki powlekane Irprestan, 300 mg, tabletki powlekane Irbesartanum Należy uważnie zapoznać
Ogólne podsumowanie oceny naukowej preparatu Atacand Plus i nazwy produktów związanych (patrz Aneks I)
 ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 15 Wnioski naukowe Ogólne podsumowanie
ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 15 Wnioski naukowe Ogólne podsumowanie
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bimican przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bimican przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby jest stosowany w celu zmniejszenia
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bimican przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby jest stosowany w celu zmniejszenia
CMC/2015/03/WJ/03. Dzienniczek pomiarów ciśnienia tętniczego i częstości akcji serca
 CMC/2015/03/WJ/03 Dzienniczek pomiarów ciśnienia tętniczego i częstości akcji serca Dane pacjenta Imię:... Nazwisko:... PESEL:... Rozpoznane choroby: Nadciśnienie tętnicze Choroba wieńcowa Przebyty zawał
CMC/2015/03/WJ/03 Dzienniczek pomiarów ciśnienia tętniczego i częstości akcji serca Dane pacjenta Imię:... Nazwisko:... PESEL:... Rozpoznane choroby: Nadciśnienie tętnicze Choroba wieńcowa Przebyty zawał
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancja pomocnicza o znanym działaniu: każda tabletka zawiera 25,36 mg jednowodnej laktozy.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Irbesartan Accord, 75 mg, tabletki powlekane Irbesartan Accord, 150 mg, tabletki powlekane Irbesartan Accord, 300 mg, tabletki powlekane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Irbesartan Accord, 75 mg, tabletki powlekane Irbesartan Accord, 150 mg, tabletki powlekane Irbesartan Accord, 300 mg, tabletki powlekane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka powlekana zawiera 600 mg eprosartanu (Eprosartanum) w postaci eprosartanu mezylanu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Teveten, 600 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 600 mg eprosartanu (Eprosartanum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Teveten, 600 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 600 mg eprosartanu (Eprosartanum)
LISIPROL 5mg, 10 mg, 20 mg (Lisinoprilum) Skład jakościowy i ilościowy: Lisiprol, 5 mg - każda tabletka zawiera 5 mg lizynoprylu w postaci
 LISIPROL 5mg, 10 mg, 20 mg (Lisinoprilum) Skład jakościowy i ilościowy: Lisiprol, 5 mg - każda tabletka zawiera 5 mg lizynoprylu w postaci lizynoprylu dwuwodnego. Lisiprol, 10 mg - każda tabletka zawiera
LISIPROL 5mg, 10 mg, 20 mg (Lisinoprilum) Skład jakościowy i ilościowy: Lisiprol, 5 mg - każda tabletka zawiera 5 mg lizynoprylu w postaci lizynoprylu dwuwodnego. Lisiprol, 10 mg - każda tabletka zawiera
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Walsartan Krka 320 mg tabletki powlekane Valsartanum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Walsartan Krka 320 mg tabletki powlekane Valsartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Walsartan Krka 320 mg tabletki powlekane Valsartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Produkt leczniczy bez ważnego pozwolenia na dopuszczenie do obrotu
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
Ulotka dołączona do opakowania: informacja dla użytkownika. IKARIUM, 4 mg, tabletki IKARIUM FORTE, 8 mg, tabletki tert-butylamini perindoprilum
 Ulotka dołączona do opakowania: informacja dla użytkownika IKARIUM, 4 mg, tabletki IKARIUM FORTE, 8 mg, tabletki tert-butylamini perindoprilum Należy zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla użytkownika IKARIUM, 4 mg, tabletki IKARIUM FORTE, 8 mg, tabletki tert-butylamini perindoprilum Należy zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla pacjenta. Vanatex, 80 mg, tabletki powlekane Vanatex, 160 mg, tabletki powlekane.
 Ulotka dołączona do opakowania: informacja dla pacjenta Vanatex, 80 mg, tabletki powlekane Vanatex, 160 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta Vanatex, 80 mg, tabletki powlekane Vanatex, 160 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Symago (agomelatyna)
 Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Apo-Valsart, 80 mg, tabletki powlekane Valsartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Apo-Valsart, 80 mg, tabletki powlekane Valsartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Aneks III Zmiany w charakterystyce produktu leczniczego oraz w ulotce dla pacjenta
 Aneks III Zmiany w charakterystyce produktu leczniczego oraz w ulotce dla pacjenta Uwaga: Niniejsze zmiany do streszczenia charakterystyki produktu leczniczego i ulotki dla pacjenta są wersją obowiązującą
Aneks III Zmiany w charakterystyce produktu leczniczego oraz w ulotce dla pacjenta Uwaga: Niniejsze zmiany do streszczenia charakterystyki produktu leczniczego i ulotki dla pacjenta są wersją obowiązującą
Bezpośredni komunikat do fachowych pracowników ochrony zdrowia
 Bezpośredni komunikat do fachowych pracowników ochrony zdrowia Wersja 2, data zatwierdzenia przez URPL: 07.11.2016 Strona 1/7 Acytretyna (Neotigason): poważne ryzyko działania teratogennego oraz ryzyko
Bezpośredni komunikat do fachowych pracowników ochrony zdrowia Wersja 2, data zatwierdzenia przez URPL: 07.11.2016 Strona 1/7 Acytretyna (Neotigason): poważne ryzyko działania teratogennego oraz ryzyko
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Walsartan Krka 160 mg tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Walsartan Krka 160 mg tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
VI.2 Podsumowanie Planu Zarządzania Ryzykiem przeznaczone do wiadomości publicznej
 VI.2 Podsumowanie Planu Zarządzania Ryzykiem przeznaczone do wiadomości publicznej VI.2.1 Omówienie rozpowszechnienia choroby Nie dotyczy ogólnych zastosowań. VI.2.2 Podsumowanie korzyści wynikających
VI.2 Podsumowanie Planu Zarządzania Ryzykiem przeznaczone do wiadomości publicznej VI.2.1 Omówienie rozpowszechnienia choroby Nie dotyczy ogólnych zastosowań. VI.2.2 Podsumowanie korzyści wynikających
VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Sophamet przeznaczone do publicznej wiadomości
 VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Sophamet przeznaczone do publicznej wiadomości VI.2.1. Omówienie rozpowszechnienia choroby Cukrzyca staje się współcześnie jedną z
VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Sophamet przeznaczone do publicznej wiadomości VI.2.1. Omówienie rozpowszechnienia choroby Cukrzyca staje się współcześnie jedną z
Desogestrel SUBSTANCJE CZYNNE. Grupa farmakoterapeutyczna: progestageny i estrogeny, produkty złożone. GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC)
 SUBSTANCJE CZYNNE Desogestrel GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) Grupa farmakoterapeutyczna: progestageny i estrogeny, produkty złożone. Kod ATC: G03AC09 PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU
SUBSTANCJE CZYNNE Desogestrel GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) Grupa farmakoterapeutyczna: progestageny i estrogeny, produkty złożone. Kod ATC: G03AC09 PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka powlekana produktu Zelvartan, 80 mg zawiera 80 mg walsartanu (Valsartanum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zelvartan, 80 mg, tabletki powlekane Zelvartan, 160 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana produktu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zelvartan, 80 mg, tabletki powlekane Zelvartan, 160 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana produktu
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Diovan 80 mg tabletki powlekane Diovan 160 mg tabletki powlekane Valsartanum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Diovan 80 mg tabletki powlekane Diovan 160 mg tabletki powlekane Valsartanum Należy zapoznać się z treścią ulotki przed zażyciem leku ponieważ zawiera ona
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Diovan 80 mg tabletki powlekane Diovan 160 mg tabletki powlekane Valsartanum Należy zapoznać się z treścią ulotki przed zażyciem leku ponieważ zawiera ona
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Vancomycin Actavis przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Vancomycin Actavis przeznaczone do publicznej wiadomości VI.2.1. Omówienie rozpowszechnienia choroby Zakażenia takie jak: zapalenie
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Vancomycin Actavis przeznaczone do publicznej wiadomości VI.2.1. Omówienie rozpowszechnienia choroby Zakażenia takie jak: zapalenie
Ulotka dołączona do opakowania: informacja dla pacjenta. Valsacor 80 mg tabletki powlekane Valsartanum
 Ulotka dołączona do opakowania: informacja dla pacjenta Valsacor 80 mg tabletki powlekane Valsartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie
Ulotka dołączona do opakowania: informacja dla pacjenta Valsacor 80 mg tabletki powlekane Valsartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie
Ulotka dołączona do opakowania: informacja dla pacjenta. MOLSIDOMINA WZF, 2 mg, tabletki MOLSIDOMINA WZF, 4 mg, tabletki.
 Ulotka dołączona do opakowania: informacja dla pacjenta MOLSIDOMINA WZF, 2 mg, tabletki MOLSIDOMINA WZF, 4 mg, tabletki Molsidominum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla pacjenta MOLSIDOMINA WZF, 2 mg, tabletki MOLSIDOMINA WZF, 4 mg, tabletki Molsidominum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Lista rzeczy, które należy sprawdzić przepisując Isoderm ( ) (Kursywą przedstawione są informacje dotyczące wyłącznie kobiet)
 Broszura dokumentacyjna z wykazem czynności kontrolnych opracowana na podstawie zaleceń Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych dla produktu leczniczego Isoderm
Broszura dokumentacyjna z wykazem czynności kontrolnych opracowana na podstawie zaleceń Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych dla produktu leczniczego Isoderm
6.2 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Mupirocin InfectoPharm przeznaczone do publicznej wiadomości
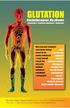 6.2 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Mupirocin InfectoPharm przeznaczone do publicznej wiadomości 6.2.1 Omówienie rozpowszechnienia choroby Infectopharm posiada pozwolenie
6.2 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Mupirocin InfectoPharm przeznaczone do publicznej wiadomości 6.2.1 Omówienie rozpowszechnienia choroby Infectopharm posiada pozwolenie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Axudan, 320 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 320 mg walsartanu (Valsartanum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Axudan, 320 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 320 mg walsartanu (Valsartanum). Pełny
Ulotka dołączona do opakowania: informacja dla pacjenta. Telmix 20 mg, tabletki 40 mg, tabletki 80 mg, tabletki. Telmisartanum
 Ulotka dołączona do opakowania: informacja dla pacjenta Telmix 20 mg, tabletki 40 mg, tabletki 80 mg, tabletki Telmisartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Telmix 20 mg, tabletki 40 mg, tabletki 80 mg, tabletki Telmisartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika CILAN, 0,5 mg, tabletki powlekane CILAN, 1 mg, tabletki powlekane CILAN, 2,5 mg, tabletki powlekane CILAN, 5 mg, tabletki powlekane Cilazaprilum
Ulotka dołączona do opakowania: informacja dla użytkownika CILAN, 0,5 mg, tabletki powlekane CILAN, 1 mg, tabletki powlekane CILAN, 2,5 mg, tabletki powlekane CILAN, 5 mg, tabletki powlekane Cilazaprilum
PODSUMOWANIE PLANU ZARZĄDZANIA RYZYKIEM DLA PRODUKTU NIQUITIN MINI CITRUS PRZEZNACZONE DO PUBLICZNEJ WIADOMOŚCI
 PODSUMOWANIE PLANU ZARZĄDZANIA RYZYKIEM DLA PRODUKTU NIQUITIN MINI CITRUS PRZEZNACZONE DO PUBLICZNEJ WIADOMOŚCI Omówienie rozpowszechnienia choroby W skali świata użycie tytoniu przyczynia się do śmierci
PODSUMOWANIE PLANU ZARZĄDZANIA RYZYKIEM DLA PRODUKTU NIQUITIN MINI CITRUS PRZEZNACZONE DO PUBLICZNEJ WIADOMOŚCI Omówienie rozpowszechnienia choroby W skali świata użycie tytoniu przyczynia się do śmierci
Ulotka dołączona do opakowania: informacja dla pacjenta. Axudan, 320 mg, tabletki powlekane Valsartanum
 Ulotka dołączona do opakowania: informacja dla pacjenta Axudan, 320 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Axudan, 320 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Nortivan Neo, 40 mg, tabletki powlekane. Walsartan (Valsartanum)
 Ulotka dołączona do opakowania: informacja dla użytkownika Nortivan Neo, 40 mg, tabletki powlekane Walsartan (Valsartanum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika Nortivan Neo, 40 mg, tabletki powlekane Walsartan (Valsartanum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Valsanorm, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 40 mg walsartanu. Substancja pomocnicza:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Valsanorm, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 40 mg walsartanu. Substancja pomocnicza:
Nitraty -nitrogliceryna
 Nitraty -nitrogliceryna Poniżej wpis dotyczący nitrogliceryny. - jest trójazotanem glicerolu. Nitrogliceryna podawana w dożylnym wlewie: - zaczyna działać po 1-2 minutach od rozpoczęcia jej podawania,
Nitraty -nitrogliceryna Poniżej wpis dotyczący nitrogliceryny. - jest trójazotanem glicerolu. Nitrogliceryna podawana w dożylnym wlewie: - zaczyna działać po 1-2 minutach od rozpoczęcia jej podawania,
www.polfawarszawa.pl ul. Karolkowa 22/24, 01-207 Warszawa, tel. (0-22) 691 39 00, fax (0-22) 691 38 27
 Polfa Warszawa S.A. dziękuje Pani doc. dr hab. Idalii Cybulskiej wieloletniemu lekarzowi Instytutu Kardiologii w Aninie za pomoc w opracowaniu niniejszego materiału. ul. Karolkowa 22/24, 01-207 Warszawa,
Polfa Warszawa S.A. dziękuje Pani doc. dr hab. Idalii Cybulskiej wieloletniemu lekarzowi Instytutu Kardiologii w Aninie za pomoc w opracowaniu niniejszego materiału. ul. Karolkowa 22/24, 01-207 Warszawa,
Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie
 brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
Ulotka dołączona do opakowania: informacja dla pacjenta. Valsacor 320 mg tabletki powlekane Valsartanum
 Ulotka dołączona do opakowania: informacja dla pacjenta Valsacor 320 mg tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Valsacor 320 mg tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta. Axudan, 80 mg, tabletki powlekane Valsartanum
 Ulotka dołączona do opakowania: informacja dla pacjenta Axudan, 80 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Axudan, 80 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vanatex, 160 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana 160 mg zawiera 160 mg walsartanu. Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vanatex, 160 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana 160 mg zawiera 160 mg walsartanu. Substancja
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Dulsevia przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Dulsevia przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Częstość i rozpowszechnienie (prewalencja)
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Dulsevia przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Częstość i rozpowszechnienie (prewalencja)
Należy rozważyć opóźnienie podania regadenozonu u pacjentów z niewyrównanym nadciśnieniem.
 grudzień 2014 r. Rapiscan (regadenozon) Nowe ważne wskazówki mające na celu zminimalizowanie ryzyka incydentu mózgowo-naczyniowego i wydłużenia napadów drgawkowych wywołanych przez Rapiscan po podaniu
grudzień 2014 r. Rapiscan (regadenozon) Nowe ważne wskazówki mające na celu zminimalizowanie ryzyka incydentu mózgowo-naczyniowego i wydłużenia napadów drgawkowych wywołanych przez Rapiscan po podaniu
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. 160 mg, tabletki powlekane. Valsartanum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA AVASART AVASART 80 mg, tabletki powlekane 160 mg, tabletki powlekane Valsartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA AVASART AVASART 80 mg, tabletki powlekane 160 mg, tabletki powlekane Valsartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA. Ivisart, 80 mg, tabletki powlekane Ivisart, 160 mg, tabletki powlekane.
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Ivisart, 80 mg, tabletki powlekane Ivisart, 160 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Ivisart, 80 mg, tabletki powlekane Ivisart, 160 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA INFORMACYJNA 1
 ULOTKA INFORMACYJNA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Valsartan Orion, 40 mg, tabletki powlekane Valsartan Orion, 80 mg, tabletki powlekane Valsartan Orion, 160 mg, tabletki powlekane Valsartan
ULOTKA INFORMACYJNA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Valsartan Orion, 40 mg, tabletki powlekane Valsartan Orion, 80 mg, tabletki powlekane Valsartan Orion, 160 mg, tabletki powlekane Valsartan
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Valorion, 80 mg, tabletki powlekane Valorion, 160 mg, tabletki powlekane Valorion, 320 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla pacjenta Valorion, 80 mg, tabletki powlekane Valorion, 160 mg, tabletki powlekane Valorion, 320 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla użytkownika. Sarve 50 mg, 50 mg, tabletki powlekane Losartan potasowy
 Ulotka dołączona do opakowania: informacja dla użytkownika Sarve 50 mg, 50 mg, tabletki powlekane Losartan potasowy Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika Sarve 50 mg, 50 mg, tabletki powlekane Losartan potasowy Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika. VALZEK, 80 mg, tabletki VALZEK, 160 mg, tabletki Valsartanum
 Ulotka dołączona do opakowania: informacja dla użytkownika VALZEK, 80 mg, tabletki VALZEK, 160 mg, tabletki Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika VALZEK, 80 mg, tabletki VALZEK, 160 mg, tabletki Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancje pomocnicze: każda tabletka powlekana zawiera 52 mg laktozy jednowodnej.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ybersigax, 300 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 300 mg irbesartanu. Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ybersigax, 300 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 300 mg irbesartanu. Substancje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Telmizek, 40 mg, tabletki Telmizek, 80 mg, tabletki. Telmisartanum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Telmizek, 40 mg, tabletki Telmizek, 80 mg, tabletki Telmisartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Telmizek, 40 mg, tabletki Telmizek, 80 mg, tabletki Telmisartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
FARMAKOTERAPIA NADCIŚNIENIA TĘTNICZEGO. Prof. dr hab. Jan J. Braszko Zakład Farmakologii Klinicznej UMB
 FARMAKOTERAPIA NADCIŚNIENIA TĘTNICZEGO Prof. dr hab. Jan J. Braszko Zakład Farmakologii Klinicznej UMB Oparte na dowodach zalecenia w leczeniu nadciśnienia tętniczego wg. Joint National Committee (JNC
FARMAKOTERAPIA NADCIŚNIENIA TĘTNICZEGO Prof. dr hab. Jan J. Braszko Zakład Farmakologii Klinicznej UMB Oparte na dowodach zalecenia w leczeniu nadciśnienia tętniczego wg. Joint National Committee (JNC
Materiały edukacyjne. Diagnostyka i leczenie nadciśnienia tętniczego
 Materiały edukacyjne Diagnostyka i leczenie nadciśnienia tętniczego Klasyfikacja ciśnienia tętniczego (mmhg) (wg. ESH/ESC )
Materiały edukacyjne Diagnostyka i leczenie nadciśnienia tętniczego Klasyfikacja ciśnienia tętniczego (mmhg) (wg. ESH/ESC )
Ulotka dołączona do opakowania: informacja dla użytkownika. VALTAP, 80 mg, tabletki powlekane VALTAP, 160 mg, tabletki powlekane Valsartanum
 Ulotka dołączona do opakowania: informacja dla użytkownika VALTAP, 80 mg, tabletki powlekane VALTAP, 160 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika VALTAP, 80 mg, tabletki powlekane VALTAP, 160 mg, tabletki powlekane Valsartanum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diovan 3 mg/ml roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 3 mg walsartanu (Valsartanum). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diovan 3 mg/ml roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 3 mg walsartanu (Valsartanum). Substancje pomocnicze:
LISIPROL, 5 mg, tabletki Każda tabletka zawiera 5 mg lizynoprylu w postaci lizynoprylu dwuwodnego.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LISIPROL, 5 mg, tabletki LISIPROL, 10 mg, tabletki LISIPROL, 20 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY LISIPROL, 5 mg, tabletki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LISIPROL, 5 mg, tabletki LISIPROL, 10 mg, tabletki LISIPROL, 20 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY LISIPROL, 5 mg, tabletki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Axudan, 160 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 160 mg walsartanu (Valsartanum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Axudan, 160 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 160 mg walsartanu (Valsartanum). Pełny
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Losacor, 50 mg, tabletki powlekane. Losartanum kalicum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Losacor, 50 mg, tabletki powlekane Losartanum kalicum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Losacor, 50 mg, tabletki powlekane Losartanum kalicum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
LECZENIE WTÓRNEJ NADCZYNNOŚCI PRZYTARCZYC U PACJENTÓW HEMODIALIZOWANYCH ICD-10 N
 Załącznik nr 42 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE WTÓRNEJ NADCZYNNOŚCI PRZYTARCZYC U PACJENTÓW HEMODIALIZOWANYCH ICD-10 N 25.8 Inne zaburzenia
Załącznik nr 42 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE WTÓRNEJ NADCZYNNOŚCI PRZYTARCZYC U PACJENTÓW HEMODIALIZOWANYCH ICD-10 N 25.8 Inne zaburzenia
Inne rutynowe środki ograniczania ryzyka: lek dostępny wyłącznie na receptę
 Problem dotyczący bezpieczeństwa Zespół Stevensa-Johnsona, rumień wielopostaciowy, złuszczające zapalenie skóry Omdlenie Zaburzenia wątroby i dróg żółciowych Interakcje lekowe z lekami antyarytmicznymi
Problem dotyczący bezpieczeństwa Zespół Stevensa-Johnsona, rumień wielopostaciowy, złuszczające zapalenie skóry Omdlenie Zaburzenia wątroby i dróg żółciowych Interakcje lekowe z lekami antyarytmicznymi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Olmesartan Polpharma, 10 mg, tabletki powlekane Olmesartan Polpharma, 20 mg, tabletki powlekane Olmesartan Polpharma, 40 mg, tabletki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Olmesartan Polpharma, 10 mg, tabletki powlekane Olmesartan Polpharma, 20 mg, tabletki powlekane Olmesartan Polpharma, 40 mg, tabletki
Aneks III. Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
 Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego LoperamideDr.Max przeznaczone do publicznej wiadomości
 VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego LoperamideDr.Max przeznaczone do publicznej wiadomości VI.2.1.Omówienie rozpowszechnienia choroby 1. Ostra biegunka: Biegunka to zwiększona
VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego LoperamideDr.Max przeznaczone do publicznej wiadomości VI.2.1.Omówienie rozpowszechnienia choroby 1. Ostra biegunka: Biegunka to zwiększona
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Irprestan, 75 mg, tabletki powlekane Irprestan, 150 mg, tabletki powlekane Irprestan, 300 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Irprestan, 75 mg, tabletki powlekane Irprestan, 150 mg, tabletki powlekane Irprestan, 300 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VALZEK, 80 mg, tabletki VALZEK, 160 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 80 mg lub 160 mg walsartanu (Valsartanum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VALZEK, 80 mg, tabletki VALZEK, 160 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 80 mg lub 160 mg walsartanu (Valsartanum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SARVE 25 mg, tabletki powlekane SARVE 50 mg, tabletki powlekane SARVE 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SARVE 25 mg, tabletki powlekane SARVE 50 mg, tabletki powlekane SARVE 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta PENTAERYTHRITOL COMPOSITUM 20 mg + 0,5 mg, tabletki Pentaerythrityli tetranitras + Glyceroli trinitras Należy uważnie zapoznać się z treścią ulotki
Ulotka dołączona do opakowania: informacja dla pacjenta PENTAERYTHRITOL COMPOSITUM 20 mg + 0,5 mg, tabletki Pentaerythrityli tetranitras + Glyceroli trinitras Należy uważnie zapoznać się z treścią ulotki
Mefelor 50/5 mg Tabletka o przedłużonym uwalnianiu. Metoprololtartrat/Felodipi n AbZ 50 mg/5 mg Retardtabletten
 ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCÓW, POSIADACZY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH Państwo członkowskie Podmiot
ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCÓW, POSIADACZY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH Państwo członkowskie Podmiot
Aneks II. Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu 11 Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Po rozważeniu zalecenia PRAC z dnia
Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu 11 Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Po rozważeniu zalecenia PRAC z dnia
