OCHRONA RADIOLOGICZNA W MEDYCYNIE
|
|
|
- Angelika Rudnicka
- 9 lat temu
- Przeglądów:
Transkrypt
1 OCHRONA RADIOLOGICZNA W MEDYCYNIE Materiał dydaktyczny dla Wydziału Fizyki Politechniki Warszawskiej w ramach bloku wykładów pt.: Podstawy Bezpieczeństwa Jądrowego i Ochrony Radiologicznej Zadanie nr 33 Modyfikacja kształcenia na Wydziale Fizyki w zakresie wykorzystywania technik i technologii jądrowych w gospodarce narodowej Projekt Program Rozwojowy Politechniki Warszawskiej współfinansowanego przez Unię Europejską w ramach Europejskiego Funduszu Społecznego (Program Operacyjny Kapitał Ludzki) Opracował Dr Paweł Krajewski Centralne Laboratorium Ochrony Radiologicznej Warszawa grudzień
2 Spis treści 1 Procedury radiodiagnostyczne Procedury w teleradioterapii i brachyterapii Zasady planowania teleradioterapii Radioterapia 3D Radioterapia konformalna Kolejne etapy przygotowania planu leczenia Radioterapia stereotaktyczna Radioterapia IMRT Radioterapia IGRT Napromienianie całego ciała Brachyterapia Radionuklidy w medycynie nuklearnej Specyfika medycyny nuklearnej Radiofarmaceutyki i ich właściwości farmakologiczne Radiofarmaceutyki diagnostyczne Radiofarmaceutyki terapeutyczne Radionuklidy stosowane w radiofarmacji Właściwości i rodzaje radiofarmaceutyków Mechanizmy lokalizacji radiofarmaceutyków w organizmach żywych Charakterystyka radionuklidów najczęściej stosowanych w medycynie nuklearnej Ogólne zasady ochrony przed promieniowaniem w zakładach medycyny nuklearnej Ochrona przed narażeniem zewnętrznym Ochrona przed narażeniem wewnętrznym Ochrona radiologiczna pacjenta i osób stykających się z pacjentem Wymagania dotyczące pomieszczeń i organizacji pracy Odpady promieniotwórcze w zakładach medycyny nuklearnej Zadania inspektorów ochrony radiologicznej w placówkach służby zdrowia Ustawodawstwo w zakresie ochrony radiologicznej przy stosowaniu promieniowania jonizującego dla celów medycznych Podstawy prawne Zasady ochrony radiologicznej w odniesieniu do zastosowań medycznych Strategia ochrony pacjenta... 31
3 5.4 Specyficzne wymagania prawne Koncepcja poziomów referencyjnych przy badaniach radiologicznych Poziomy referencyjne (wskaźnikowe) Zasady kontroli jakości aparatury Dozymetria pacjenta w diagnostyce rentgenowskiej i radiologii zabiegowej Dozymetria dawek Dozymetria dawek terapeutycznych Rodzaje detektorów stosowanych w dozymetrii dawek terapeutycznych Dozymetria in vivo Audyty dozymetryczne Audyt wysyłkowy TLD Detektory filmowe Dozymetry termoluminescencyjne (TLD ThermoLuminescent Dosemeter) Dozymetry półprzewodnikowe Rodzaje fantomów Matryce detektorów 2wymiarowe i 3wymiarowe Wypadki i zdarzenia radiacyjne w postępowaniu medycznymi Przepisy dotyczące wypadków związanych ze stosowaniem promieniowania jonizującego w radioterapii oraz szczegółowe zasady zapobiegania tym wypadkom Przyczyny wypadków radiacyjnych w radioterapii Braki w wykształceniu i przygotowaniu specjalistycznym Braki w procedurach i protokołach Usterki aparatury Niewłaściwa komunikacja brak przekazywania informacji Brak niezależnych kontroli Nieuwaga i bezmyślność
4 1 Procedury radiodiagnostyczne Najbardziej rozpowszechnioną w diagnostyce techniką rentgenowska jest nadal radiografia z obrazowaniem na błonie rentgenowskiej. Jednym z pierwszych odkryć, które znacznie obniżyło dawki, było zastosowanie pierwiastków z grupy ziem rzadkich do wytworzenia fluorescencyjnych okładek wzmacniających, umieszczanych w kasecie rentgenowskiej. Pierwsze okładki zastosowano w latach 1970 i obecnie stanowią one standard w radiografii. Rozwijająca się radiologia zabiegowa wymagała obrazowania dynamicznego. Do tego celu również wykorzystano ekrany fluorescencyjne, na których powstawał i mógł być obserwowany obraz w czasie rzeczywistym. Obecnie coraz częściej stosowana jest technika video, a ostatnio również techniki cyfrowe. Niektóre tkanki miękkie można obrazować wprowadzając do organizmu człowieka środki kontrastujące, np. bar do przewodu pokarmowo trawiennego, czy jod do układu moczowego. Prawdziwą rewolucję wywołało w ostatnim czasie wprowadzenie technik tomograficznych, opartych na komputerowej analizie i przetwarzaniu danych cyfrowych. Znaczenie tomografii komputerowej wynika z faktu, że jest ona w stanie dostarczyć obrazy przekrojów przez ciało pacjenta. Obrazy pojedynczych warstw (skanów) uzyskuje się poprzez napromienianie pacjenta wąską, wachlarzową wiązką promieniowania z obracającej się wokół ciała pacjenta lampy rentgenowskiej. Tomografia komputerowa może zapewnić bardzo dobrą jakość obrazów, ale jednocześnie dawka pochłonięta jest istotnie wyższa niż przy klasycznej radiografii. Ze względu na wysoką użyteczność kliniczną tomografia komputerowa rozwija się bardzo szybko i w wielu krajach europejskich stanowi obecnie prawie 10% wszystkich badań radiodiagnostycznych, a jej udział w dawce zbiorowej może przekraczać 50%. W diagnostyce rentgenowskiej wykorzystuje się promieniowanie X z zakresu energii od 15 do 160 kev. Wartości energii dla poszczególnych technik obrazowania dobierane są do właściwości tkanek będących obiektem obrazowania oraz typu zastosowanego detektora promieniowania. Cały powyższy obszar energii promieniowania wykorzystywany jest tylko w rentgenowskiej tomografii komputerowej. Inne techniki radiodiagnostyczne korzystają zwęższych zakresów energii. Na przykład w mammografii korzysta się z zakresu od 18 do 23 kev, wykorzystując promieniowanie charakterystyczne molibdenu o energii 17,4 kev i 19,6 kev. Mimo stosowania zabezpieczeń, w medycynie zdarzają się wypadki radiologiczne. Podwyższone ryzyko występuje tam, gdzie stosowane są wysokie dawki, a więc w radiologii zabiegowej i w radioterapii. Do większości tych wypadków doszło wskutek braku wiedzy, lub typowych błędów systemowych. Wypadki w radiologii zabiegowej były przede wszystkim skutkiem ograniczonej wiedzy, co do możliwości oferowanych przez aparaturę radiologiczną. Analiza około 100 poważnych wypadków uszkodzenia skóry i ciała pacjentów wykazała, że większości z tych uszkodzeń, a w szczególności wszystkich ciężkich uszkodzeń, można było uniknąć, bez negatywnych skutków z punktu widzenia osiągnięcia celu przeprowadzanego zabiegu medycznego. Narażenie personelu medycznego wynika z wykonywanych czynności w ramach procedur radiologicznych. Pod pojęciem źródło narażenia rozumie się tu daną sytuację powodującą narażenie, a nie tylko konkretne źródło promieniowania (lampę rentgenowską, izotop). Pracownik powinien być poinformowany o istocie narażenia i musi rozumieć zasady ochrony odpowiednie dla jego stanowiska pracy. Narażenie pracowników powinno być monitorowane poprzez środowiskowe lub/i indywidualne dozymetry, na ogólnych zasadach stosowanych wobec osób pracujących w warunkach narażenia na promieniowanie jonizujące. 2 Procedury w teleradioterapii i brachyterapii 2.1 Zasady planowania teleradioterapii Współczesna teleradioterapia wykorzystuje do napromieniania pacjentów liniowe akceleratory medyczne. Zastosowanie aparatów z źródłami izotopowymi Co 60 jest cora z rzadsze, w niektórych krajach jest już zabronione. Powstaje natomiast coraz więcej ośrodków stosujących w radioterapii wiązki protonów, a także 4
5 cięższych jonów, jednak jest to liczba marginalna. Akceleratory generują wiązki fotonów (energie 4 20 MV) i elektronów (energie 6 22 MeV). Wiązki elektronów, których zasięg w tkankach jest krótki (w przybliżeniu zasięg w cm równy jest liczbowo połowie energii elektronów w MeV) i służą do napromieniania zmian położonych blisko powierzchni ciała. Wiązki fotonów o wysokiej energii mają zdolność penetracji tym większą im większa jest ich energia. Wiązka 4 MV ma podobną zdolność penetracyjną co wiązka aparatu kobaltowego Co 60. Maksimum dawki pochłoniętej od wiązki fotonów znajduje się blisko powierzchni obiektu napromienianego. Dla energii 4 MV jest to około 0,5 cm, dla energii 15 MV to około 2,5 cm. Rysunek Spadek dawki wraz z głębokością w ośrodku dla wiązek fotonów o różnych energiach. Rysunek Rozkład dawki w poprzek wiązek fotonowych o różnych energiach na głębokości 10 cm. Widać gwałtowny spadek dawki na krawędziach wiązki i wysoką jednorodność dawki w obszarze pola promieniowania. Dlatego też, aby napromienić obiekt znajdujący się głębiej należy posłużyć się układem kilku wiązek skierowanych na obszar do napromieniania z kilku kierunków. Proste plany leczenia to układy 3 wiązek 2 promieniowania, plany bardziej złożone to układ 3 5 wiązek. W niektórych, bardziej skomplikowanych przypadkach, liczba wiązek może być większa. Jeżeli rozmiary obiektu napromienianego są niewielkie, tak jak to jest w przypadku głowy i szyi, to stosuje się wiązki o niższych energiach, gdyż w przypadku wiązek o bardzo wysokiej energii dawki pochłonięte przy wyjściu wiązki mogą okazać się za wysokie. 5
6 W przypadku pacjentów o dużych wymiarach w obszarze klatki piersiowej lub miednicy stosuje się wysokie energie wiązek fotonów. Należy tutaj zauważyć, że wiązki fotonowe używane są znacznie częściej niż wiązki elektronów, w stosunku około 1:10. Rysunek Spadek dawki wraz z głębokością wośrodku dla wiązek elektronów o różnych energiach. 2.2 Radioterapia 3D Przez wiele lat rozwoju metod radioterapii planowanie leczenia opierało się jedynie na konwencjonalnych zdjęciach rentgenowskich i innych badaniach klinicznych. Obrys pacjenta uzyskiwano bardzo niedokładnymi metodami, a pozycję narządów pacjenta wrysowywano wewnątrz tego obrysu na podstawie obrazów z atlasów anatomicznych. Dokonywano tego tylko w jednym przekroju poprzecznym pacjenta. Uzyskiwane obrazy były niedokładne, a oparcie się na jednym przekroju pacjenta prowadziło do napromieniania dużych obszarów tkanek zdrowych. Obliczanie dawek pochłoniętych wykonywano ręcznie w niewielu punktach obszaru napromienianego przy założeniu, że tkanki są jednorodne. Dopiero gwałtowny rozwój techniki komputerowej zmienił tę sytuację. Pojawiły się tomograficzne skanery komputerowe, które dostarczały dane o anatomii pacjenta oraz niejednorodnościach tkanek. Powstały komputerowe systemy obliczenia rozkładów dawek, początkowo w jednej płaszczyźnie przekroju pacjenta, a następne w płaszczyznach do niej równoległych. Systemy takie określa się skrótem TPS (Treatment Planning System). Obecnie każdy nowoczesny ośrodek radioterapii wyposażony jest w tomograficzny skaner CT dostarczający obraz przekrojów poprzecznych pacjenta w dowolnych odstępach 10 mm. 2 Nowoczesne systemy TPS potrafią na ich podstawie odtworzyć anatomię pacjenta w trzech wymiarach. Potrafią one także obliczać rozkłady dawek od dowolnie ułożonych wiązek, uwzględniając niejednorodności tkanek, kąt padania wiązek, etc. Rozkłady takie obliczane są w całym obszarze napromienianym w trzech wymiarach. Z tego powodu tak realizowana radioterapia nazywana jest radioterapią trójwymiarową 3 D (Three Dimensional). 6
7 Rysunek Rozkład dawki w przekroju poprzecznym pacjenta wygenerowany przez system planowania leczenia. Widoczny jest plan leczenia składający się z pięciu wiązek w układzie izocentrycznym 2.3 Radioterapia konformalna Zmiany nowotworowe to struktury o nieregularnych kształtach, zaś konwencjonalne kolimatory akceleratorów formują wiązki o przekrojach prostokątnych. Liczne obrazy CT uzyskane w odstępach ok. 5 mm wymagają od radioterapeuty wrysowania kształtu zmiany nowotworowej na kolejnych przekrojach tomograficznych, na ogół ok. 40. Na podstawie tych obrysów w systemie planowania leczenia TPS zostaje odtworzony trójwymiarowy kształt obszaru do napromieniania. Planujący leczenie wybiera kierunki padania i kształt wiązek tak, aby napromienić jak najmniejszą objętość tkanek zdrowych. Współczesne systemy TPS mogą obliczać rozkłady dawek od wiązek o dowolnym kształcie. Pola takie można ukształtować albo za pomocą bloków ze stopu ołowiu odlewanych dla indywidualnych pacjentów, albo za pomocą kolimatorów wielolistkowych. Większość współczesnych akceleratorów jest już wyposażona w takie kolimatory. Prowadzona w ten sposób radioterapia określana jest mianem trójwymiarowej radioterapii konformalnej. Ze względu na to, że w jej przypadku napromieniana jest minimalna objętość tkanek zdrowych, można zwiększyć dawkę podawaną na guz, zwiększając szansę zniszczenia nowotworu bez zwiększenia ryzyka spowodowania komplikacji wśród tkanek zdrowych. 2.4 Kolejne etapy przygotowania planu leczenia Od momentu, kiedy zostanie podjęta lekarska decyzja o poddaniu pacjenta teleradioterapii rozpoczyna się procedura planowania leczenia. Na podstawie badań diagnostycznych, zdjęć radiologicznych, określony zostaje w przybliżeniu obszar do napromieniania obejmujący zmianę nowotworową. Obszar ten zostaje poddany badaniu tomograficznemu na przystosowanym do tego skanerze CT. Stół do badania CT musi być płaski, a pacjent umieszczony jest na nim w pozycji, w jakiej ma być napromieniany. Akcesoria służące do unieruchamiania pacjenta muszą być identyczne z tymi, które będą użyte przy napromienianiu. W szczególności dotyczy to takich akcesoriów jak maski indywidualne do unieruchamiania głowy i ramion pacjenta. Maski takie 7
8 przygotowywane są w modelarni wyposażonej w stół terapeutyczny, identyczny jak stół służący do napromieniania. Badanie CT wykonuje się w odstępach 2 10 mm w zależności od umiejscowienia i rodzaju nowotworu. Obrazy CT przesyłane są siecią komputerową do sytemu planowania leczenia TPS. W systemie tym wykonywane jest tzw. konturowanie. W każdym z przekrojów CT wrysowywane są kontury zewnętrzne pacjenta, kontury narządów wewnętrznych (np. płuca) oraz kontur zmiany nowotworowej. Kontury zmiany nowotworowej, tzn. obszaru do napromieniania wrysowywany jest przez radioterapeutę na podstawie wszystkich badań diagnostycznych i klinicznych, oraz na podstawie znajomości dynamiki rozwoju nowotworu. Obszar do napromieniania to objętość nowotworu wraz z marginesem otaczających tkanek, w których mogą się już znajdować komórki nowotworowe. Wszystkie kontury wprowadzone do TPS pozwalają odtworzyć w trzech wymiarach kształt pacjenta oraz pozycję i kształt nowotworów, czyli tzw. pacjenta wirtualnego. Wzajemne położenie zmiany nowotworowej i promienioczułych narządów wewnętrznych pozwala planującemu leczenie wybrać kierunki padania wiązek, których jest na ogół 2 8, tak, aby uzyskać korzystny rozkład dawki w całym obszarze napromienianym. Dawka pochłonięta jest obliczana jest w trójwymiarowej siatce punktów, oddalonych od siebie o ok. 5 mm, z uwzględnieniem różnic pochłaniania promieniowania w tkankach o różnej gęstości (np. kości i płuca). Dane dotyczące gęstości tkanek dostarczane są przez obrazy tomograficzne CT. Plan napromieniania, wykonywany przez fizyków medycznych, jest oceniany przez radioterapeutę z medycznego punktu widzenia, na podstawie wyrysowanych rozkładów izodoz w poszczególnych przekrojach pacjenta oraz na podstawie histogramów dawka objętość. Histogramy takie pozwalają ocenić sumaryczne rozkłady w każdy poszczególnym narządzie oraz w obrębie zmiany nowotworowej. Jeśli plan nie jest zaakceptowany próbuje się uzyskać plan lepszy przy innym układzie wiązek. Wiązki dobierane są na ogół w układzie izocentrycznym, tzn. ramię akceleratora jest ustawiane pod różnymi kątami wokół pacjenta, a punkt izocentryczny akceleratora znajduje się w obrębie zmiany napromienianej. W ogromnej większości przypadków osie wiązek są ułożone współpłaszczyznowo. Planujący ma do dyspozycji wiązki fotonów oraz wiązki elektronów o różnych energiach. Po zaakceptowaniu planu wykonywana jest jego weryfikacja za pomocą symulatora. Pacjent układany jest na stole symulatora w ten sam sposób i w tej samej pozycji jak na stole skanera CT oraz na stole terapeutycznym. Oglądając obrazy rentgenowski uzyskane przez skierowanie wiązek promieniowania rentgenowskiego pod kątami zaplanowanymi w systemie TPS można zweryfikować dobór tych kierunków, wielkości pola i punktu wejścia wiązki i ewentualnie je skorygować. Po takiej korekcie rozkłady dawek muszą być obliczone powtórnie. Po przeprowadzeniu weryfikacji można rozpocząć cykl napromieniania terapeutycznego. Wielkości dawek sumarycznych w teleradioterapii wynoszą na ogół od 45 Gy do 75 Gy w zależności od typu, wielkości i umiejscowienia nowotworu. Dawki podawane są w frakcjach dziennych po ok. 1,8 Gy do 2,5 Gy. Liczba frakcji waha się na ogół od 20 do 35. Trzeba tu wspomnieć, że stosowane są również inne, niekonwencjonalne tryby napromieniania, np. hiperfrakcjonacja po dwie małe frakcje dziennie, lub hipofrakcjonacja niewielka liczba frakcji o wysokiej dawce frakcyjnej rzędu4 Gy. W czasie pierwszej frakcji napromieniania wykonywane są obrazy portalowe, pozwalające stwierdzić zgodność pozycji wiązek terapeutycznych z zaplanowanymi wiązkami symulatora. Obrazy portalowe, wykonane na akceleratorze, porównywane są z obrazami z symulatora i położenie pacjenta do napromieniania jest korygowane przez zmianę ustawienia stołu terapeutycznego. 2.5 Radioterapia stereotaktyczna Szczególnym rodzajem radioterapii jest napromienianie stereotaktyczne. Stosuje się ją przy napromienianiu niewielkich, dobrze zlokalizowanych zmian nowotworowych. Zmiany te są napromieniane układem wiązek nie współpłaszczyznowych skierowanych na nowotwór z wielu kierunków w układzie izocentrycznym. Mogą to być wiązki stacjonarne lub ruchome. Aparatura do radioterapii stereotaktycznej została opisana w innym paragrafie. Szczególnym rodzajem radioterapii stereotaktycznej jest tzw. radiochirurgia. Stosuje się ją w przypadku nowotworów mózgu. Guzy takie napromieniane są wąskimi wiązkami skierowanymi koncentrycznie z wielu kierunków. Pozwala to na podanie wysokiej dawki na guz przy jednoczesnym oszczędzeniu takich struktur promienioczułych w obrębie czaszki jak gałki oczne, nerwy wzrokowe, rdzeń kręgowy, etc. Wysoka dawka promieniowania, rzędu Gy, podawana jest jednorazowo, powodując zniszczenie obszaru guza, a skutek napromieniania jest taki jak po wycięciu zmiany. 8
9 Napromienianie takie wymaga bardzo wysokie precyzji oraz uprzedniego, bardzo dokładnego sprawdzenia dokładności ruchów ramienia akceleratora oraz stołu terapeutycznego. Obecnie, w szeregu ośrodków na świecie stosuje się radioterapię stereotaktyczną dla zmian nowotworowych umiejscowionych poza czaszką. 2.6 Radioterapia IMRT Nowoczesne kolimatory wielolistkowe pozwoliły na wprowadzenie nowej metody napromieniania nowotworów z wykorzystaniem modulacji intensywności wiązki promieniowania (Intensity Modulated RadioTherapy IMRT). Aparatura do radioterapii IMRT została opisana w innym paragrafie. Radioterapia IMRT pozwala uzyskiwać rozkłady dawki niemożliwe do uzyskania za pomocą prostych wiązek promieniowania. Jest to szczególnie istotne w sytuacji, gdy zmiana nowotworowa znajduje się w bezpośrednim sąsiedztwie, lub też otacza takie struktury promieniowrażliwe jak rdzeń kręgowy. Jednakże, ze względu na to, że w tej metodzie napromieniania uzyskuje się rozkłady dawki o dużych gradientach dawki. W związku tym przed napromienianiem pacjenta rozkład dawki jest weryfikowany przez pomiary w fantomie tkankopodobnym przy użyciu detektorów filmowych. Obliczone rozkłady dawki porównywane są z rozkładami zmierzonymi. Jeśli porównanie takie wypadnie pozytywnie to pacjent zostaje napromieniany, w przeciwnym przypadku przygotowywany jest nowy plan napromieniania i nowa weryfikacja. Im większe gradienty dawki występują w planie leczenia tym bardziej precyzyjne i powtarzalne musi być ułożenie pacjenta w czasie każdego seansu napromieniania. Radioterapię IMRT stosuje się najczęściej do nowotworów w rejonie głowy i szyi, a w tych lokalizacjach pacjenci są bardzo dobrze unieruchamiani przez maski indywidualne, mocujące pacjenta do stołu, a struktury wewnętrzne mają bardzo niewielką ruchomość. Inna jest sytuacja w przypadku nowotworów prostaty, której położenie zmienia się w pewnym stopniu z dnia na dzień. Jej pozycja powinna być skontrolowana przed każdym sensem napromieniania za pomocą obrazowania portalowego pozycja stołu i pacjenta odpowiednio dostosowana. 2.7 Radioterapia IGRT Techniką napromieniania rozwijającą się obecnie bardzo dynamicznie jest radioterapia sterowana przez obrazowanie IGRT (Image Guided RadioTherapy). Polega ona na tym, że działanie akceleratora jest sterowane przez systemy obrazowania pacjenta tuż przed lub w trakcie napromieniania. Ten pierwszy przypadek może być zobrazowany przez przykład napromieniania prostaty, której położenie może by wyznaczone przed każdym seansem napromieniania. Jednak najbardziej złożone metody IGRT dotyczą sytuacji, kiedy zmiana nowotworowa porusza się w trakcie seansu napromieniania. Dotyczy to ruchów fizjologicznych struktur wewnętrznych pacjenta związanych z oddychaniem lub z biciem serca. Opracowano szereg metod obserwacji ruchów pacjenta. Są to stereoskopowe metody przy użyciu układu dwóch aparatów rentgenowskich lub układu dwóch kamer na podczerwień. Pozwalają one monitorować ruch oddechowy klatki piersiowej i w rytm tego oddechu włączać i wyłączać wiązkę promieniowania. W ten sposób można napromieniać zmianę nowotworową tylko wtedy, gdy znajduje się ona w wiązce promieniowania. Takie metody napromieniania stosowane są obecnie tylko w bardzo nielicznych ośrodkach ze względu na stopień złożoności, kosztów i wydłużenie czasu dla seansu napromieniania. 2.8 Napromienianie całego ciała Szczególną techniką radioterapii jest napromieniania całego ciała. Stosuje się je u pacjentów chorych na nowotwory układu krwiotwórczego przed zabiegiem przeszczepienia szpiku kostnego. Dawki na całe ciało wynoszą ok. 10 Gy w 5 6 frakcjach, po dwie frakcje dziennie. Taki tryb napromieniania wymaga pól promieniowania o bardzo dużych wymiarach, lub też łączenia pól mniejszych. Aby uzyskać jednorodną dawkę w całym obszarze ciała stosuje się układ pól bocznych i przednio tylnych. Jeśli wymiary bunkra na to pozwalają stosuje się pola boczne z odległości rzędu4 m co pozwala uzyskać pola o długości 160 cm. Pola przedni tylne o dużych wymiarach uzyskuje się układając pacjenta na poziomie podłogi i napromieniając z odległości ponad 2 m. W przypadku pól przednio tylnych należy osłonić organy promieniowrażliwe, w tym przypadku płuca i gałki oczne. 9
10 2.9 Brachyterapia Brachyterapia jest techniką radioterapii, realizowaną za pomocą izotopowych źródeł radioaktywnych umieszczanych w bezpośrednim sąsiedztwie napromienianych tkanek lub wewnątrz tych tkanek. Przedrostek brachy, pochodzący z greki, oznacza z bliska, w przeciwieństwie do przedrostka tele (z daleka), występującego w pojęciu teleradioterapia, oznaczającym napromienianie ze źródeł umieszczonych w pewnej odległości od pacjenta, na ogół cm. Brachyterapia ma bardzo długą historię sięgającą początku XX wieku. Wkrótce po odkryciu promieniotwórczości w 1896 roku i po wyodrębnieniu radu przez małżonków Curie w 1898, specjalnie przygotowane aplikatory zawierające rad 226 znalazły praktyczne zastosowanie w radioterapii. Te pierwsze, najwcześniejsze próby leczenia nowotworów dotyczyły zmian na powierzchni skóry, a źródła radowe, umieszczone w specjalnych aplikatorach, wykonanych najczęściej z wosku, znajdowały się w odległości 0,5 1 cm od powierzchni skóry. Była to tzw. Brachyterapia kontaktowa. Wkrótce jednak podjęto próby umieszczania źródeł radowych w obrębie tkanek, które miały być napromienione. Ta technika napromieniania, polegająca na wkłuwaniu aplikatorów promieniotwórczych w obręb tkanek, określana jest terminem brachyterapia śródtkankowa. Jednocześnie rozwinięto techniki aplikacji źródeł radowych w leczeniu raka szyjki macicy oraz trzonu macicy. Technika, polegająca na umieszczeniu źródeł promieniotwórczych wewnątrz jam ciała, nosi nazwę brachyterapii śródjamowej. Przez wiele lat, od odkrycia radu do rozpoczęcia przemysłowej produkcji innych źródeł promieniotwórczych w latach pięćdziesiątych, brachyterapia ograniczała się do wyżej wymienionych technik. W okresie tym leczono głównie nowotwory ginekologiczne oraz nowotwory skóry. W okresie tym zebrano ogromną ilość informacji dotyczących zależności reakcji napromienianych tkanek od wielkości dawki promieniowania, od mocy dawki i czasu napromieniania oraz zasad frakcjonowania. Opracowano także zasady planowania leczenia polegające na odpowiednim doborze liczby i rozmieszczenia źródeł o określonej radioaktywności w zależności od wielkości i kształtu zmiany nowotworowej. Opracowano także metody dozymetrii, określania aktywności źródeł, mocy dawki oraz wprowadzono szereg jednostek dozymetrycznych. Należy pamiętać, że wszelkie aplikacje z zastosowaniem radu wykonywano manualnie. Powodowało to napromienienie zarówno pacjentów jak i personelu lekarskiego dawkami, które obecnie byłyby niedopuszczalne z punktu widzenia ochrony radiologicznej. Dopiero po drugiej wojnie podjęto próby skonstruowania urządzenia, które pozwoliłoby stosować brachyterapię z tzw. Następowym ładowaniem źródeł. Technika taka polegała na umieszczeniu w jamach ciała, w tkankach lub na powierzchni skóry, aplikatorów bez źródeł radioaktywnych, tylko z odpowiednimi prowadnicami, tzw. Rurkami z metalu lub plastiku, do których następnie wprowadza się zdalnie źródła radioaktywne. Zdalne załadowanie może być wykonane manualnie lub automatycznie. Taką metodę następowego ładowania jeden z jej twórców, Henschke, określił, terminem afterloading. Termin ten, podobnie jak termin komputer, przyjął się w piśmiennictwie międzynarodowym w każdym prawie języku. Opracowanie techniki afterloading spowodowało dalszy, gwałtowny rozwój brachyterapii, który nastąpił po wprowadzeniu nowych izotopów promieniotwórczych: kobaltu 60, cezu 137 i irydu192. Technika ta pozwoliła na zastosowanie źródeł o znacznie większej aktywności. Pozwoliła również na lepszą radiograficzną lokalizację umieszczonych w ciele pacjenta prowadnic, z wprowadzonymi do nich nieaktywnymi markerami źródeł. Największym jednak osiągnięciem, powodującym przełom w dziedzinie brachyterapii, było prawie całkowite wyeliminowanie narażenia personelu na napromienianie. Technika afterloading, w połączeniu z udostępnieniem źródeł o wysokiej aktywności, pozwoliła także na rozszerzenie zastosowań brachyterapii do takich lokalizacji nowotworów jak przełyk, oskrzela, drogi żółciowe, oraz na wprowadzenie brachyterapii śródoperacyjnej. W ostatnich latach bardzo intensywnie rozwija się brachyteapia śródnaczyniowa, jako czynnik zapobiegający restenozie naczyń krwionośnych po angioplastyce. Brachyterapię można też skategoryzować na podstawie stosowanych wielkości mocy dawki, a co za tym idzie czasu aplikacji. Wyróżniamy tu niskie moce dawki (Low Dose Rate LDR), średnie moce dawki (Medium Dose Rate MDR) oraz wysokie moce dawki (High Dose Rate HDR). 10
11 Zakres tych mocy dawek są następujące: 1. LDR 0,4 2 Gy/godz. czas aplikacji rzędu kilku dni; 2. MDR 2 12 Gy/godz. czas aplikacji rzędu kilku lub kilkunastu godzin; 3. HDR ponad 12 Gy/godz. czas aplikacji rzędu minut Są to aplikacje ciągłe, lub odbywające się w kilku frakcjach. Promieniowanie o tak różnych mocach dawki powoduje różne skutki radiobiologiczne, które są przedmiotem badań laboratoryjnych i klinicznych, mających wyznaczyć optymalne wielkości dawek całkowitych i całkowitego czasu napromieniania dla różnych mocy dawek i trybu funkcjonowania. Dane kliniczne, zgromadzone w ciągu całego stulecia, dotyczą w większości niskich mocy dawek. Jest to powód, dla którego wprowadzono pewną szczególną technikę zużyciem aparatów HDR, nazywaną pulsującą mocą dawki (Pulsed Dose Rate PDR) polegającą na napromienianiu mocą dawki 1 3 Gy/godz. przez kilka minut w odstępach godzinnych. Innymi słowy jest to napromienianie frakcjonowane (o wielu frakcjach w krótkich odstępach), które upodobnia tryb napromieniania do ciągłego napromieniania LDR. Rysunek Widok ogólny aparatu HDR do brachyterapii Szczególną formą brachyterapii są aplikacje permanentne. Polegają one na wprowadzeniu do tkanek ciała, w obręb guza, źródeł promieniotwórczych, które pozostawiane są tam na stałe. Są to krótkożyciowe izotopy promieniotwórcze, najczęściej złoto (Au 198), jod (I 125) lub pal lad (Pd 103), w formie maleńkich ziaren lub tubek o długości 4 5 mm i średnicy poniżej 1 mm. Obecnie stosowane one są szeroko w leczeniu guzów prostaty. Jest to brachyterapia typu LDR o zmieniającej się mocy dawki w ciągu aplikacji. Brachyterapia może być użyta, jako samodzielna metoda radykalnego leczenia lub w połączeniu z radioterapią wiązkami zewnętrznymi. W tym drugim przypadku zadaniem brachyterapii jest dostarczenie dodatkowej dawki w obszarze zmniejszonego po teleradioterapii guza, czyli tzw. boost dose. Brachyterapia może być też stosowana w połączeniu z zabiegiem chirurgicznym. Pozwala ona na napromienienie podstawy usuniętego guza wysoką dawką w otwartym polu operacyjnym, lub też na umieszczenie tam kateterów, których otwarte końce wychodzą na zewnątrz przez bliznę pooperacyjną, a które służą do następowego napromieniania metodą afterloadingu. Ponieważ w brachyterapii radioaktywny materiał jest wprowadzony wprost w obręb tkanek nowotworowych to maksimum dawki koncentruje się w obszarze przewidzianym do napromieniania (Planned Teatment Volume PTV). Moc dawki spada gwałtownie wraz z kwadratem odległości od źródeł radioaktywnych, co pozwala na oszczędzenie otaczających zdrowych tkanek, które otrzymują dawkę znacznie niższą niż nowotwór. 11
12 Ze względu na powyższe prawa fizyczne oraz ze względów radiobiologicznych brachyterapia powinna być stosowana w przypadku zlokalizowanych obszarów zmian nowotworowych o niewielkich rozmiarach. Leczenie takie nie powinno być stosowane w przypadkach, gdy granice guza są trudne do ustalenia, oraz gdy w obszarze do napromieniania występuje aktywna infekcja. Istnieje wiele technik brachyterapii w zależności od lokalizacji guza i stosowanych rodzajów źródeł. Większość współcześnie przeprowadzanych zabiegów brachyterapii wykonywana jest przy pomocy specjalnych aparatów do następowego ładowania źródeł (afterloadingu) zarówno o niskiej mocy dawki, LDR, jaki i wysokiej mocy dawki, HDR. Urządzenia te składają się z ochronnego pojemnika zawierającego źródła promieniotwórcze oraz z systemu zdalnego sterowania tymi źródłami, które są wprowadzane do aplikatorów umieszczonych uprzednio w obrębie guza na określony czas. Inaczej wygląda sytuacja w przypadku napromieniania wysoką mocą dawki, HDR. Aparat do takiego napromieniania jest wyposażony w jedno źródło promieniotwórcze o znacznej aktywności. Jest to źródło Ir 192 o wymiarach 3,5 mm długości części aktywnej i 1,1 mm średnicy i o aktywności początkowej 10 Ci, które wymieniane jest co 3 miesiące. Ze względu na tak wysoką aktywność napromienianie pacjentów odbywa się w ochronnym bunkrze, podobnym do tych, w jakich instalowane są bomby kobaltowe. Aparat wyposażony jest w 24 kanały do wyprowadzania źródła. W zależności od typu zabiegu można wykorzystać od 1 do 24 kanałów, do których przyłącza się katetery, w formie rurek plastikowych, w których może poruszać się źródło. Katetery te umieszczane są w obrębie napromienianej zmiany. Źródło wyprowadzane jest z kanału aparatu HDR do kateterów mechanicznie, na metalowej prowadnicy, szybkim, jednostajnym ruchem do zamkniętego końca kateteru. Właściwie napromienianie odbywa się w czasie powrotu źródła do aparatu. Źródło porusza się wtedy krokowo, z krokiem 5 mm, do kolejnych punktów postoju. Procedura ta powtarzana jest dla kolejnych użytych kanałów. Planowanie leczenia polega na ustaleniu, jaki powinien być czas przebywania źródła w poszczególnych miejscach postoju, tak, aby uzyskać zadowalający rozkład dawki. Napromienianie, w zależności od liczby kateterów, aktualnej aktywności źródła i założonej dawki odbywa się w czasie od kilku do kilkudziesięciu minut. Brachyterapia HDR stosowana jest w bardzo wielu lokalizacjach nowotworów. Istnieje wiele typów aplikatorów i kateterów dostosowanych do różnych lokalizacji i różnych technik napromieniania. Najczęstsze lokalizacje to: nowotwory ginekologiczne, nowotwory w obrębie oskrzeli, nowotwory przełyku. Są to tzw. aplikacje śródjamowe. Przykładem aplikacji śródtkankowej jest napromienianie nowotworów piersi. Katetery umieszczane są wówczas w metalowych igłach, które przebijają pierś. Układ takich igieł jest stabilizowany przez dwie płytki z pleksi, w których wykonany jest układ otworów w odstępie 1 cm, przez które przechodzą igły. Gwarantuje to równoległość igieł i równomierność rozkładu dawki. Ponieważ napromienianie metodą HDR odbywa się w ciągu krótkiego czasu możliwe jest stosowanie metod inwazyjnych napromieniania śródoperacyjnego lub okołooperacyjnego, lub też stereotaktycznego napromieniania nowotworów mózgu. Brachyterapia śródoperacyjna bywa stosowana w przypadku nowotworów, które nie mogą zostać całkowicie usunięte w czasie zabiegu operacyjnego. Można wtedy napromienić tkanki, które są dostępne w otwartym polu operacyjnym. Sama procedura zaplanowania ułożenia kateterów, w specjalnym elastycznym plastikowym aplikatorze, oraz zaplanowanie i obliczenie czasów postoju musi być wykonane bardzo szybko, gdyż pacjent tylko na krótko może być przewieziony z sali operacyjnej do bunkra HDR, po czym operacja jest kontynuowana. Brachyterapia okołooperacyjna polega na tym, że w czasie zabiegu operacyjnego katetery umieszczane są w obrębie guza, umocowane przy pomocy szwów chirurgicznych, a otwarte końce kateterów wyprowadzone są na zewnątrz przez bliznę pooperacyjną. Napromienianie odbywa się w kilka dni po operacji i na ogół jest to napromienianie dokonywane w kilku frakcjach. Stosowane ono bywa na przykład w przypadku nowotworów trzustki. Aparaty HDR mogą być zainstalowane w salach operacyjnych, które mają ochronność radiologiczną taką jak bunkry. Na takich salach można wykonywać zabiegi implantacji kateterów, a następnie przeprowadzić napromienianie. Na salach takich można również zainstalować aparaturę do obrazowania, np. skaner CT lub aparat ultrasonograficzny i prowadzić implantacje pod kontrolą radiologiczną, a więc radioterapię IGRT. Przykładem takiej procedury może być brachyterapia nowotworów prostaty, gdy metalowe katetery wkłuwane są w obręb narządu pod kontrolą ultrasonograficznej sondy rektalnej, ich pozycja może być kontrolowana, rozkład dawki może być zaplanowany i obliczony w czasie rzeczywistym, co pozwala na optymalizację napromieniania. 12
13 Rysunek Aparat HDR do brachyterapii i skaner CT zainstalowane w sali operacyjnej o pełnej ochronności radiologicznej. Rysunek Aparat HDR i ultrasonograf z sondą rektalną do brachyterapii raka prostaty zainstalowane w sali operacyjnej o pełnej ochronności radiologicznej 13
14 3 Radionuklidy w medycynie nuklearnej Radiofarmaceutyki są to związki chemiczne o cząsteczkach zawierających jeden lub więcej atomów promieniotwórczych. W medycynie nuklearnej stosuje się radiofarmaceutyki w postaci znakowanych radionuklidami związków chemicznych, które w swojej stabilnej postaci są naturalnie przyswajane i przetwarzane przez organizm człowieka. Zamiana jednego lub kilku atomów związku na atom lub atomy radionuklidu umożliwia śledzenie jego przemieszczenia się w organizmie a także ocenę stężenia w wybranych miejscach. Radiofarmaceutyki wykorzystuje się przede wszystkim w celach diagnostycznych, a w niektórych przypadkach również w celach terapeutycznych. Radiofarmaceutyk podany pacjentowi doustnie lub dożylnie gromadzi się w charakterystycznych dla danego związku chemicznego narządach wewnętrznych lub w guzach nowotworowych. Jeśli atom lub atomy radiofarmaceutyku są emiterami promieniowania gamma, można za pomocą przyrządów dozymetrycznych zobrazować oraz ocenić liczbowo jego rozkład w ciele człowieka. W zastosowaniach terapeutycznych wykorzystuje się emitery promieniowania alfa lub beta, które niszczy komórki nowotworowe w sąsiedztwie miejsca nagromadzenia radiofarmaceutyku. 3.1 Specyfika medycyny nuklearnej Największą zaletą diagnostycznych metod medycyny nuklearnej, wyróżniającą je wśród wszystkich innych medycznych metod diagnostycznych i stanowiącą o ich zupełnej unikalności, jest obrazowanie badanego narządu lub tkanki w aspekcie czynnościowym, a nie morfologicznym [2,5]. Umożliwia to bardzo wczesne wykrycie zmian chorobowych, zanim jeszcze doprowadzą one do wykrywalnych zmian morfologicznych. Jest to bardzo ważna właściwość, bo często właśnie czas rozpoczęcia terapii decyduje o skuteczności dalszego leczenia. Szeroko opisywany był przykład wykrycia metodą PET (badanie metabolizmu fluorodeoksyglukozy znakowanej 18 F) neurodegeneracyjnej choroby Huntingtona na siedem lat przed wystąpieniem objawów morfologicznych możliwych do zdiagnozowania metodami rezonansu magnetycznego (MRI) lub tomografii komputerowej (CT) [5]. Szczególną cechą farmakologiczną medycyny nuklearnej są znikome ilości wagowe stosowanych radiofarmaceutyków (zarówno diagnostycznych, jak i terapeutycznych); tak małe że nie zakłócają normalnego funkcjonowania organizmu. Na przykład jedno badanie diagnostyczne z użyciem typowego radiofarmaceutyku znakowanego 99m Tc wymaga wprowadzenia do organizmu kilku ml roztworu o stężeniu radiofarmaceutyku rzędu mol dm 3, co odpowiada zaledwie kilku nanogramom preparatu. A przecież 99m Tc nie jest radionuklidem beznośnikowym, bo jego preparaty zawsze zawierają pewną ilość długożyciowego (T1/2 = lat) izotopu 99 Tc, który odgrywa rolę nośnika 1. Preparaty takie nazywamy radionuklidami bez dodanego nośnika, w skrócie n.c.a. (nocarrier added). Jeżeli do znakowania radiofarmaceutyków stosujemy radionuklidy beznośnikowe, to do organizmu wprowadzamy jeszcze dużo mniejsze ilości leku. Podanie tak małych dawek diagnostycznych jest dla organizmu zupełnie bez znaczenia z punktu widzenia chemicznego i nie prowadzi do zaburzeń czynnościowych badanego narządu. 2 Fakt ten wyjaśnia, dlaczego niejednokrotnie jako radiofarmaceutyki stosuje się preparaty, które w zwykłych warunkach (ilości mikro i miligramowe) są silnie toksyczne chemicznie, np. organiczne związki rtęci, czy jony talu. W przypadku związków szczególnie toksycznych chemicznie preparaty muszą mieć bardzo wysokie aktywności właściwe (każdorazowo normowane). Jeżeli radionuklidy diagnostyczne są krótkożyciowe (T1/2 rzędu minut lub godzin) i nie emitują wysokoenergetycznego promieniowania β, to nawet bardzo duże aktywności promieniotwórcze radiofarmaceutyku 3 dają pacjentowi 1 Obecność długożyciowego izotopu 99Tc w preparatach 99mTc wynika z dwóch przyczyn: (1) 99Mo, macierzysty radionuklid 99mTc, rozpada się w 13% bezpośrednio do 99Tc; (2) sam 99mTc rozpada się też do 99Tc. W przypadku elucji z generatora 99Mo/ 99mTc po 12 h nagromadzania się 99mTc i zastosowania preparatu 6 godzin po elucji zawartość 99mTc w technecie wynosi tylko kilkanaście procent. Jest to jednak i tak bardzo dużo w porównaniu z większością typowych radionuklidów nośnikowych. 2 W przeciwieństwie do kontrastów stosowanych w innych technikach medycznych. 3 Aktywności promieniotwórcze preparatów znakowanych 99m Tc są rzędu 10 8 Bq na jeden zabieg [7], a w przypadku bardzo krótkożyciowych nuklidów PET, 13 N i 82 Rb, przekraczają nawet 10 9 Bq [8]. 14
15 dawkę promieniowania zbliżoną do dawki, jaką powodują klasyczne badania radiologiczne. Trzeba przy tym pamiętać, że tylko część energii przenikliwego promieniowania gamma jest pochłaniana przez organizm. Wszystko to sprawia, że metody diagnostyczne medycyny nuklearnej zaliczane są do najbezpieczniejszych w medycynie [2]. W przypadku terapii radiofarmaceutycznej dawki promieniowania otrzymywane przez pacjenta są znacznie większe, bo radionuklidy terapeutyczne mają dłuższe okresy połowicznego zaniku (dni, tygodnie), a cała energia ich promieniowania jest lokalnie pochłaniana głównie przez tkankę patologiczną. W przypadku terapii tarczycy jodem 131 dawka lokalna może sięgać setek Sv, nie powodując jednak znaczących szkód dla całego organizmu [6]. Wysoka dawka nie jest jednak wygórowaną ceną, jaką czasem trzeba zapłacić za tak skuteczną, często praktycznie jedyną terapię ratującą życie człowieka. 3.2 Radiofarmaceutyki i ich właściwości farmakologiczne Już na początku XX wieku odkryto, że promieniowanie radu i produktów jego rozpadu powoduje w organizmie człowieka korzystne bądź szkodliwe skutki fizjologiczne. Fakt ten wywołał zainteresowanie biologicznymi efektami promieniowania jonizującego. Udane próby stosowania do celów terapeutycznych radu (igły radowe) doprowadziły do powstania współczesnej radioterapii, stosującej zewnętrzne źródła promieniowania gamma ( bomby kobaltowe), akceleratorowe wiązki przyspieszonych elektronów lub hadronów i aplikatory radionuklidowe (brachyterapia) [1]. Zagadnienia te zostały omówione w wykładzie Radioterapia, która wykorzystuje zewnętrzne źródła promieniowania jonizującego nie jest jednak działem medycyny nuklearnej. Medycyna nuklearna nowa gałąź medycyny, która zrodziła się w II połowie XX wieku, 1 wykorzystuje nie zewnętrzne, lecz wewnętrzne, otwarte źródła promieniowania jonizującego. Co więcej, stosowane są one nie tylko w celach terapeutycznych (endoradioterapia), lecz przede wszystkim diagnostycznych [1 4]. Do organizmu pacjenta wprowadza się śladowe ilości związków chemicznych znakowanych radionuklidami krótkożyciowymi, zwanych radiofarmaceutykami. Właściwości chemiczne lub biologiczne tych związków powodują, że lokują się one wybiórczo w określonych tkankach lub narządach organizmu. Selektywność lokowania się radiofarmaceutyków w wybranych miejscach organizmu jest wynikiem działania różnych mechanizmów, decydującą rolę odgrywa jednak swoistość preparatu w stosunku do danej tkanki lub narządu. Jeżeli promieniowanie jonizujące radiofarmaceutyków jest przenikliwe, może być ono rejestrowane na zewnątrz organizmu, a specjalne systemy detekcji pozwalają na określenie przestrzennego rozkładu (lokalizacji) radiofarmaceutyku w organizmie. Taki sposób badania wykorzystuje się do celów diagnostycznych. Jeżeli natomiast promieniowanie jonizujące radiofarmaceutyków ma krótki zasięg, to jego głównym zadaniem jest terapeutyczne (radiacyjne) oddziaływanie na okoliczną tkankę. Diagnostyka i terapia dwa różne kierunki medycyny nuklearnej stawiają przed sobą odmienne zadania i stosują odmienne (z punktu widzenia charakteru oddziaływania biologicznego) narzędzia ich realizacji. Narzędziami tymi są radiofarmaceutyki diagnostyczne i terapeutyczne, a różnica między nimi polega na różnym charakterze i różnym efekcie promieniowania jonizującego, jakie emitują radionuklidy wchodzące w skład cząsteczki radiofarmaceutyku Radiofarmaceutyki diagnostyczne Radiofarmaceutyki diagnostyczne stosowane są jako znaczniki promieniotwórcze in vivo. Żeby móc spełniać tę rolę i z wnętrza organizmu przesyłać sygnały do detektorów zewnętrznych, muszą być one wyznakowane radionuklidami emitującymi promieniowanie przenikające tkankę 1 Pionierem badań, które doprowadziły do powstania medycyny nuklearnej, był György Hevesy (George de Hevesy), węgierski fizykochemik pracujący w Niemczech. Za rozpoczęte jeszcze w latach 20. ubiegłego wieku prace radioznacznikowe w układach biologicznych otrzymał on w roku 1943 nagrodę Nobla [3]. promieniowanie gamma lub twarde promieniowanie rentgenowskie. Współczesna diagnostyczna medycyna nuklearna została zdominowana przez dwa radionuklidy, 99m Tc i 18 F (p. wykład ). Stosowane są one w dwóch odmiennych pod względem techniki detekcji scyntygraficznych 2 metodach obrazowania molekularnego, wykorzystujących komputerową obróbkę danych pomiarowych: tomografii emisyjnej pojedynczych fotonów, SPECT (single photon emission computerised tomography) i tomografii pozytonowej, PET (positron emission tomography). W obu przypadkach mierzona jest intensywność promieniowania gamma emitowanego z wnętrza ciała człowieka, 3 co umożliwia precyzyjną lokalizację źródła promieniowania wewnątrz organizmu, a wymienione 15
16 dwa radionuklidy są wykorzystywane aż w około 90% wszystkich badań klinicznych wykonywanych zarówno techniką SPECT ( 99m Tc), jak i PET ( 18 F). Do detekcji promieniowania gamma służą specjalne gamma kamery (SPECT) i skanery PET, które składają się z dużej liczby detektorów odpowiednio rozmieszczonych w przestrzeni. Sygnały ze wszystkich detektorów są na bieżąco przetwarzane za pomocą odpowiednich programów komputerowych, co pozwala uzyskać dokładny dwu lub trójwymiarowy obraz rozmieszczenia radiofarmaceutyku w ciele pacjenta a potem, w wyniku analizy tego obrazu, zdiagnozować prawidłowość funkcjonowania badanego narządu lub zlokalizować w organizmie tkankę patologiczną. Wykład przynosi więcej informacji na temat radiofarmaceutyków, radionuklidów, technik i urządzeń pomiarowych stosowanych w diagnostycznej medycynie nuklearnej Radiofarmaceutyki terapeutyczne Radiofarmaceutyki terapeutyczne stosuje się do zwalczania nowotworów złośliwych i ich przerzutów, do leczenia reumatoidalnego zapalenia stawów i do terapii paliatywnej 4]. [1Tkanka patologiczna zajmuje w organizmie zwykle niewielki obszar, z tego więc powodu radiofarmaceutyki terapeutyczne znakuje się radionuklidami emitującymi promieniowanie korpuskularne, którego zasięg w tkance biologicznej jest krótki. W zależności od typu i energii rozpadu zasięg ten wynosi od ułamków milimetra do nieco ponad 10 mm, a więc promieniowanie to jest całkowicie pochłaniane przez najbliżej leżącą tkankę. Wszystkie zarejestrowane na świecie radiofarmaceutyki terapeutyczne wykorzystują emitery β, ale od dłuższego już czasu prowadzone są szerokie badania nad wykorzystaniem w terapii również radionuklidów o jeszcze krótszym zasięgu promieniowania, t.j. emiterów cząstek α i emiterów elektronów Augera. Radiofarmaceutyki zawierające takie egzotyczne radionuklidy są już na małą skalę stosowane w praktyce klinicznej. Jeżeli radiofarmaceutyk terapeutyczny jest selektywnie absorbowany w tkance patologicznej, a radionuklid, który emituje promieniowanie o określonym zasięgu, jest dobrany odpowiednio do wymiarów guza lub przerzutu nowotworowego, to prawie cała energia promieniowania jest absorbowana przez obcą tkankę. Jeżeli dawka promieniowania jest wystarczająco duża, to ta patologiczna tkanka zostaje skutecznie zniszczona, a szkodliwy wpływ promieniowania na zdrową tkankę i na cały organizm jest niewielki. Dlatego też, w przeciwieństwie do radiodiagnostyki 2 Termin scyntygrafia w medycynie nuklearnej oznacza nieinwazyjną metodę obrazowania ilościowego rozmieszczenia w organizmie wprowadzonego do niego radiofarmaceutyku, polegającą na cyfrowej rejestracji jego promieniowania gamma mierzonego za pomocą detektorów scyntylacyjnych, oraz przedstawienia tego rozmieszczenia metodą graficzną. 3 Do celów badawczych obrazuje się w specjalnych urządzeniach (np. mikropet) także zwierzęta laboratoryjne. zdominowanej przez dwa najważniejsze radionuklidy, endoradioterapia stosuje szeroką gamę radionuklidów, charakteryzujących się różnym zasięgiem promieniowania korpuskularnego w tkance (od kilku μm do kilkunastu mm; p. wykład ). 3.3 Radionuklidy stosowane w radiofarmacji Właściwości fizykochemiczne i biologiczne radiofarmaceutyku decydujące o jego przydatności dla medycyny nuklearnej zależą zarówno od radionuklidu wchodzącego w skład cząsteczki radiofarmaceutyku, jak i od budowy oraz właściwości całej cząsteczki wektora, która transportuje radionuklid w określone miejsce w organizmie [2]. Wybór odpowiedniego radionuklidu radiofarmaceutycznego zależy od postawionego celu medycznego, a do tego należy wziąć pod uwagę następujące cechy charakteryzujące wybrany radionuklid: określony typ i energia promieniowania (inne dla radiofarmaceutyków diagnostycznych, inne dla terapeutycznych) oraz krótki lub niezbyt długi okres połowicznego zaniku; możliwość uzyskania wysokich aktywności właściwych, najlepiej formy beznośnikowej; określone właściwości chemiczne umożliwiające trwałe (zwłaszcza w sensie kinetycznym) związanie radionuklidu z cząsteczką wektora; łatwa dostępność i niewygórowany koszt preparatu. 16
17 Radionuklidy diagnostyczne wykorzystywane w technice SPECT powinny mieć energię promieniowania gamma w zakresie od 100 do 250 kev. Promieniowanie takie jest optymalnie rejestrowane przez scyntylacyjne detektory promieniowania gamma z kryształem NaI(Tl) a jednocześnie bez zakłóceń przenika przez tkankę. Natomiast radionuklidy PET są emiterami pozytonów, a energia promieniowania gamma emitowana w wyniku anihilacji pozytonów jest zawsze równa 511 kev. Ponieważ wartość ta znacznie wykracza poza zakres optymalny dla detektorów SPECT, skanery PET są specjalnie dostosowywane do tej wysokiej energii. Dążenie do zminimalizowania dawki otrzymanej przez pacjenta (i personel szpitala) narzuca konieczność stosowania radionuklidów maksymalnie krótkożyciowych. W miarę możności powinny to być czyste emitery gamma, gdyż dodatkowe promieniowanie beta niepotrzebnie zwiększa dawkę. Wybór radionuklidu o krótszym lub dłuższym okresie połowicznego zaniku zależy od postawionego zadania diagnostycznego. Niekiedy wystarczają radionuklidy o T1/2 rzędu minut ( 15 O) lub dziesiątek sekund ( 81m Kr), ale gdy trzeba śledzić przebieg procesów biologicznych i rejestrować zmiany zachodzące w czasie, potrzebne są radionuklidy o T1/2 rzędu godzin, a nawet dni. Z punktu widzenia potrzeby ograniczania dawki od dłużej żyjących radionuklidów istotny jest nie tylko okres ich połowicznego zaniku, lecz również czas biologicznego półtrwania w organizmie cząsteczki zawierającej taki radionuklid. Czas ten zależy od właściwości cząsteczki radiofarmaceutyku, a wypadkową tych dwóch wielkości jest tzw. czas półtrwania efektywnego, który określa szybkość zanikania aktywności radiofarmaceutyku w organizmie. Bezpieczeństwo chorego wymaga stosowania radiofarmaceutyków w ilościach, które nie są toksyczne chemicznie, a więc aktywność właściwa radionuklidu musi być bardzo wysoka. Najlepiej, gdy radionuklid, zwłaszcza terapeutyczny, ale i diagnostyczny, można otrzymać w formie beznośnikowej lub n.c.a. 7 Wymagania tego nie spełnia większość radionuklidów reaktorowych, otrzymywanych w reakcji (n,γ). Każdy taki ra dionuklid zawiera duże, wagowe ilości radionuklidu macierzystego, który jest dla niego nośnikiem izotopowym i od którego nie można go oddzielić konwencjonalnymi metodami chemicznymi. Jeżeli jednak radionuklidy reaktorowe są emiterami cząstek β, to do celów radiofarmaceutycznych można wykorzystać produkty ich rozpadu, które jako beznośnikowe izotopy innych pierwiastków stosunkowo łatwo oddziela się od nuklidu macierzystego metodami chemicznymi, a niekiedy fizycznymi (np. sublimacja jodu z tarcz tellurowych). Zasadę chemicznego oddzielania radionuklidu pochodnego od macierzystego wykorzystuje się w generatorach radionuklidów. Generatory te zwłaszcza generator 99 Mo/ 99m Tc stanowią dla klinik podstawowe źródło radionuklidów diagnostycznych (p. wykład ). Niektóre radionuklidy beznośnikowe można otrzymać wykorzystując efekt Szilarda Chalmersa (p. wykład ). Najczęściej radionuklidy beznośnikowe otrzymuje się w reakcjach cząstek naładowanych w cyklotronach (p. wykład ). Jednak wysoki koszt radionuklidów cyklotronowych ogranicza w jakimś stopniu ich dostępność. Stosunkowo długożyciowy, β /γ promieniotwórczy radionuklid 131 I (Eγ = 364 kev, Eβ = 606 kev, T1/2 = 8,0 dni), który odegrał ogromną rolę w rozwoju medycyny nuklearnej i wciąż jest stosowany w celach terapeutycznych, nie jest dobrym radionuklidem diagnostycznym, gdyż daje bardzo dużą dawkę na tarczycę (do 0,5 1 Sv w jednej procedurze [1]). Podobnie jon 201 Tl +, od dziesiątków lat stosowany do badań serca, został w wielu krajach wycofany z użytkowania i zastąpiony metaloorganicznymi kationowymi związkami 99m Tc(I) lub kationem 82 Rb nie ze względu na toksyczność chemiczną talu, ale z powodu niekorzystnych właściwości jądrowych radionuklidu 201 Tl, w wyniku których pacjent niepotrzebnie otrzymuje stosunkowo wysoką dawkę promieniowania jonizującego [7]. Nie jest to przykład odosobniony, gdyż radiofarmaceutyki znakowane technetem99m radionuklidem o idealnych wręcz właściwościach jądrowych i bogatej chemii koordynacyjnej, a 7 Aktywność właściwa radiofarmaceutyków receptorowych, immunokoniugatów i radiofarmaceutyków terapeutycznych jest normowana. Nie dotyczy to prostych radiofarmaceutyków diagnostycznych stosowanych do badań przepływowych, np. gazów szlachetnych, NH3, H2 O, C octan, Na F, F FDG i wielu innych. przede wszystkim łatwo dostępnym i tanim, od wielu już lat odgrywają główną rolę w rozwoju diagnostycznej medycyny nuklearnej [4,7,9]. 17
FIZYCZNE PODSTAWY RADIOTERAPII ZASADY RADIOTERAPII ŹRÓDŁA PROMIENIOWANIA TERAPEUTYCZNEGO ENERGIA PROMIENIOWANIA RODZAJE PROMIENIOWANIA
 FIZYCZNE PODSTAWY RADIOTERAPII ZASADY RADIOTERAPII WILHELM CONRAD ROENTGEN PROMIENIE X 1895 ROK PROMIENIOWANIE JEST ENERGIĄ OBEJMUJE WYSYŁANIE, PRZENOSZENIE I ABSORPCJĘ ENERGII POPRZEZ ŚRODOWISKO MATERIALNE
FIZYCZNE PODSTAWY RADIOTERAPII ZASADY RADIOTERAPII WILHELM CONRAD ROENTGEN PROMIENIE X 1895 ROK PROMIENIOWANIE JEST ENERGIĄ OBEJMUJE WYSYŁANIE, PRZENOSZENIE I ABSORPCJĘ ENERGII POPRZEZ ŚRODOWISKO MATERIALNE
Warszawa, dnia 1 sierpnia 2013 r. Poz. 874
 Warszawa, dnia 1 sierpnia 2013 r. Poz. 874 OBWIESZCZENIE MINISTRA ZDROWIA z dnia 26 kwietnia 2013 r. w sprawie ogłoszenia jednolitego tekstu rozporządzenia Ministra Zdrowia w sprawie minimalnych wymagań
Warszawa, dnia 1 sierpnia 2013 r. Poz. 874 OBWIESZCZENIE MINISTRA ZDROWIA z dnia 26 kwietnia 2013 r. w sprawie ogłoszenia jednolitego tekstu rozporządzenia Ministra Zdrowia w sprawie minimalnych wymagań
CHARAKTERYSTYKA, KRYTETRIA I WARUNKI WYKONYWANIA PROCEDUR WYSOKOSPECJALISTYCZNYCH RADIOTERAPII
 CHARAKTERYSTYKA, KRYTETRIA I WARUNKI WYKONYWANIA PROCEDUR WYSOKOSPECJALISTYCZNYCH RADIOTERAPII 12.1 Radioterapia z zastosowaniem techniki konformalnej, niekoplanarnej, stereotaktycznej lub śródoperacyjnej
CHARAKTERYSTYKA, KRYTETRIA I WARUNKI WYKONYWANIA PROCEDUR WYSOKOSPECJALISTYCZNYCH RADIOTERAPII 12.1 Radioterapia z zastosowaniem techniki konformalnej, niekoplanarnej, stereotaktycznej lub śródoperacyjnej
OCENA OCHRONY RADIOLOGICZNEJ PACJENTA W RADIOTERAPII ONKOLOGICZNEJ
 OCENA OCHRONY RADIOLOGICZNEJ PACJENTA W RADIOTERAPII ONKOLOGICZNEJ Kontrolowane zagadnienia Podstawa prawna INFORMACJE O DOKUMENTACJI Jednostka posiada inspektora ochrony radiologicznej Art. 7 ust. 3 (Dz.U.
OCENA OCHRONY RADIOLOGICZNEJ PACJENTA W RADIOTERAPII ONKOLOGICZNEJ Kontrolowane zagadnienia Podstawa prawna INFORMACJE O DOKUMENTACJI Jednostka posiada inspektora ochrony radiologicznej Art. 7 ust. 3 (Dz.U.
OD ROZPOZNANIA DO NAPROMIENIANIA. Edyta Dąbrowska
 OD ROZPOZNANIA DO NAPROMIENIANIA Edyta Dąbrowska METODY LECZENIA NOWOTWORÓW - chirurgia - chemioterapia - radioterapia CEL RADIOTERAPII dostarczenie wysokiej dawki promieniowania do objętości tarczowej
OD ROZPOZNANIA DO NAPROMIENIANIA Edyta Dąbrowska METODY LECZENIA NOWOTWORÓW - chirurgia - chemioterapia - radioterapia CEL RADIOTERAPII dostarczenie wysokiej dawki promieniowania do objętości tarczowej
SYMULACJA GAMMA KAMERY MATERIAŁ DLA STUDENTÓW. Szacowanie pochłoniętej energii promieniowania jonizującego
 SYMULACJA GAMMA KAMERY MATERIAŁ DLA STUDENTÓW Szacowanie pochłoniętej energii promieniowania jonizującego W celu analizy narażenia na promieniowanie osoby, której podano radiofarmaceutyk, posłużymy się
SYMULACJA GAMMA KAMERY MATERIAŁ DLA STUDENTÓW Szacowanie pochłoniętej energii promieniowania jonizującego W celu analizy narażenia na promieniowanie osoby, której podano radiofarmaceutyk, posłużymy się
WSTĘP Medycyna nuklearna radiofarmaceutyków,
 I. WSTĘP Medycyna nuklearna jest specjalnością medyczną zajmującą się bezpiecznymi i względnie tanimi technikami izotopowymi zarówno obrazowania stanu narządów wewnętrznych, jak i terapii. Pozwala ona
I. WSTĘP Medycyna nuklearna jest specjalnością medyczną zajmującą się bezpiecznymi i względnie tanimi technikami izotopowymi zarówno obrazowania stanu narządów wewnętrznych, jak i terapii. Pozwala ona
FIZYKA III MEL Fizyka jądrowa i cząstek elementarnych
 FIZYKA III MEL Fizyka jądrowa i cząstek elementarnych Wykład 11 Zastosowania fizyki jądrowej w medycynie Medycyna nuklearna Medycyna nuklearna - dział medycyny zajmujący się bezpiecznym zastosowaniem izotopów
FIZYKA III MEL Fizyka jądrowa i cząstek elementarnych Wykład 11 Zastosowania fizyki jądrowej w medycynie Medycyna nuklearna Medycyna nuklearna - dział medycyny zajmujący się bezpiecznym zastosowaniem izotopów
Szczegółowy zakres szkolenia wymagany dla osób ubiegających się o nadanie uprawnień inspektora ochrony radiologicznej
 Załącznik nr 1 Szczegółowy zakres szkolenia wymagany dla osób ubiegających się o nadanie uprawnień inspektora ochrony radiologicznej Lp. Zakres tematyczny (forma zajęć: wykład W / ćwiczenia obliczeniowe
Załącznik nr 1 Szczegółowy zakres szkolenia wymagany dla osób ubiegających się o nadanie uprawnień inspektora ochrony radiologicznej Lp. Zakres tematyczny (forma zajęć: wykład W / ćwiczenia obliczeniowe
VII. ŚWIADCZENIA MEDYCYNY NUKLEARNEJ. LP. Nazwa świadczenia gwarantowanego Warunki realizacji świadczeń
 VII. ŚWIADCZENIA MEDYCYNY NUKLEARNEJ LP. Nazwa świadczenia gwarantowanego Warunki realizacji świadczeń 1. Scyntygrafia i radioizotopowe badanie czynnościowe tarczycy 1) gamma kamera planarna lub scyntygraf;
VII. ŚWIADCZENIA MEDYCYNY NUKLEARNEJ LP. Nazwa świadczenia gwarantowanego Warunki realizacji świadczeń 1. Scyntygrafia i radioizotopowe badanie czynnościowe tarczycy 1) gamma kamera planarna lub scyntygraf;
Niskie dawki poza obszarem napromieniania: symulacje Monte Carlo, pomiar i odpowiedź radiobiologiczna in vitro komórek
 Niskie dawki poza obszarem napromieniania: symulacje Monte Carlo, pomiar i odpowiedź radiobiologiczna in vitro komórek M. Kruszyna-Mochalska 1,2, A. Skrobala 1,2, W. Suchorska 1,3, K. Zaleska 3, A. Konefal
Niskie dawki poza obszarem napromieniania: symulacje Monte Carlo, pomiar i odpowiedź radiobiologiczna in vitro komórek M. Kruszyna-Mochalska 1,2, A. Skrobala 1,2, W. Suchorska 1,3, K. Zaleska 3, A. Konefal
Narodowe Centrum Radioterapii Hadronowej. Centrum Cyklotronowe Bronowice
 1 Narodowe Centrum Radioterapii Hadronowej Centrum Cyklotronowe Bronowice Instytut Fizyki Jądrowej im. Henryka Niewodniczańskiego Polskiej Akademii Nauk ul. Radzikowskiego 152, 31-342 Kraków www.ifj.edu.pl
1 Narodowe Centrum Radioterapii Hadronowej Centrum Cyklotronowe Bronowice Instytut Fizyki Jądrowej im. Henryka Niewodniczańskiego Polskiej Akademii Nauk ul. Radzikowskiego 152, 31-342 Kraków www.ifj.edu.pl
J E Z I E R S K A K A R O L I N A
 Warunki bezpiecznego stosowania promieniowania jonizującego dla wszystkich rodzajów ekspozycji medycznej: Zapobieganie i postępowanie w sytuacjach awaryjnych. J E Z I E R S K A K A R O L I N A Wypadek
Warunki bezpiecznego stosowania promieniowania jonizującego dla wszystkich rodzajów ekspozycji medycznej: Zapobieganie i postępowanie w sytuacjach awaryjnych. J E Z I E R S K A K A R O L I N A Wypadek
RADIO TERA PIA. informacje dla lekarzy. Opracowanie: dr hab. n. med. Iwona Gisterek prof. nadzw.
 RADIO TERA PIA RT informacje dla lekarzy Opracowanie: dr hab. n. med. Iwona Gisterek prof. nadzw. Spis treści 4 Radioterapia zasada działania 5 Rodzaje radioterapii 6 Wskazania do radioterapii 7 Przygotowanie
RADIO TERA PIA RT informacje dla lekarzy Opracowanie: dr hab. n. med. Iwona Gisterek prof. nadzw. Spis treści 4 Radioterapia zasada działania 5 Rodzaje radioterapii 6 Wskazania do radioterapii 7 Przygotowanie
Październik 2013 Grupa Voxel
 Październik 2013 Grupa Voxel GRUPA VOXEL Usługi medyczne Produkcja Usługi komplementarne ie mózgowia - traktografia DTI RTG TK (CT) od 1 do 60 obrazów/badanie do1500 obrazów/badanie TELE PACS Stacje diagnostyczne
Październik 2013 Grupa Voxel GRUPA VOXEL Usługi medyczne Produkcja Usługi komplementarne ie mózgowia - traktografia DTI RTG TK (CT) od 1 do 60 obrazów/badanie do1500 obrazów/badanie TELE PACS Stacje diagnostyczne
RADIOTERAPIA NOWOTWORÓW UKŁADU MOCZOWO PŁCIOWEGO U MĘŻCZYZN DOSTĘPNOŚĆ W POLSCE
 RADIOTERAPIA NOWOTWORÓW UKŁADU MOCZOWO PŁCIOWEGO U MĘŻCZYZN DOSTĘPNOŚĆ W POLSCE Marcin Hetnał Centrum Onkologii Instytut im. MSC; Kraków Ośrodek Radioterapii Amethyst RTCP w Krakowie Radioterapia Radioterapia
RADIOTERAPIA NOWOTWORÓW UKŁADU MOCZOWO PŁCIOWEGO U MĘŻCZYZN DOSTĘPNOŚĆ W POLSCE Marcin Hetnał Centrum Onkologii Instytut im. MSC; Kraków Ośrodek Radioterapii Amethyst RTCP w Krakowie Radioterapia Radioterapia
Radioizotopowa diagnostyka nowotworów Szczególne możliwości badania PET/CT z użyciem znakowanej glukozy
 Radioizotopowa diagnostyka nowotworów Szczególne możliwości badania PET/CT z użyciem znakowanej glukozy Katarzyna Fronczewska-Wieniawska Małgorzata Kobylecka Leszek Królicki Zakład Medycyny Nuklearnej
Radioizotopowa diagnostyka nowotworów Szczególne możliwości badania PET/CT z użyciem znakowanej glukozy Katarzyna Fronczewska-Wieniawska Małgorzata Kobylecka Leszek Królicki Zakład Medycyny Nuklearnej
Przyczyny i czynniki powodujące wypadki w radioterapii.
 Przyczyny i czynniki powodujące wypadki w radioterapii. Na podstawie raportów opracowanych przez US Nuclear Regulary Commision i MAEA. (Poniższe tabele przedstawiają klasy i częstotliwość wypadków w radioterapii
Przyczyny i czynniki powodujące wypadki w radioterapii. Na podstawie raportów opracowanych przez US Nuclear Regulary Commision i MAEA. (Poniższe tabele przedstawiają klasy i częstotliwość wypadków w radioterapii
S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma c j e ogólne. Diagnostyka izotopowa
 Załącznik Nr 3 do Uchwały Senatu PUM 14/2012 Kod modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Nazwa modułu S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma c j e ogólne Diagnostyka
Załącznik Nr 3 do Uchwały Senatu PUM 14/2012 Kod modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Nazwa modułu S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma c j e ogólne Diagnostyka
Wydział Fizyki Uniwersytet w Białymstoku. ul. Lipowa 41, Białystok. tel. (+48 85) fax ( ) EFEKTY KSZTAŁCENIA
 Wydział Fizyki Uniwersytet w Białymstoku ul. Lipowa 41, 15-424 Białystok tel. (+48 85) 745 72 22 fax (+ 48 85) 745 72 23 EFEKTY KSZTAŁCENIA dla kierunku poziom kształcenia profil Fizyka studia 2 stopnia
Wydział Fizyki Uniwersytet w Białymstoku ul. Lipowa 41, 15-424 Białystok tel. (+48 85) 745 72 22 fax (+ 48 85) 745 72 23 EFEKTY KSZTAŁCENIA dla kierunku poziom kształcenia profil Fizyka studia 2 stopnia
Program szkolenia dla osób ubiegających się o nadanie uprawnień Inspektora Ochrony Radiologicznej
 Program szkolenia dla osób ubiegających się o nadanie uprawnień Inspektora Ochrony Radiologicznej - RMZ z dnia 21 grudnia 2012 r. (DZ. U. z 2012 r. poz. 1534) Lp. Zakres tematyczny 1. Podstawowe pojęcia
Program szkolenia dla osób ubiegających się o nadanie uprawnień Inspektora Ochrony Radiologicznej - RMZ z dnia 21 grudnia 2012 r. (DZ. U. z 2012 r. poz. 1534) Lp. Zakres tematyczny 1. Podstawowe pojęcia
Ochrona przed promieniowaniem jonizującym. Źródła promieniowania jonizującego. Naturalne promieniowanie tła. dr n. med.
 Ochrona przed promieniowaniem jonizującym dr n. med. Jolanta Meller Źródła promieniowania jonizującego Promieniowanie stosowane w celach medycznych Zastosowania w przemyśle Promieniowanie związane z badaniami
Ochrona przed promieniowaniem jonizującym dr n. med. Jolanta Meller Źródła promieniowania jonizującego Promieniowanie stosowane w celach medycznych Zastosowania w przemyśle Promieniowanie związane z badaniami
AKCELERATORY I DETEKTORY WOKÓŁ NAS
 AKCELERATORY I DETEKTORY WOKÓŁ NAS AKCELERATOR W CERN Chociaż akceleratory zostały wynalezione dla fizyki cząstek elementarnych, to tysięcy z nich używa się w innych gałęziach nauki, a także w przemyśle
AKCELERATORY I DETEKTORY WOKÓŁ NAS AKCELERATOR W CERN Chociaż akceleratory zostały wynalezione dla fizyki cząstek elementarnych, to tysięcy z nich używa się w innych gałęziach nauki, a także w przemyśle
CYBERKNIFE. Broszura informacyjna. Centrum Onkologii Instytut im. Marii Skłodowskiej-Curie. Dawid Bodusz
 Centrum Onkologii Instytut im. Marii Skłodowskiej-Curie Oddział w Gliwicach CYBERKNIFE Broszura informacyjna dla chorych w trakcie leczenia promieniami i ich opiekunów Dawid Bodusz Zakład Radioterapii
Centrum Onkologii Instytut im. Marii Skłodowskiej-Curie Oddział w Gliwicach CYBERKNIFE Broszura informacyjna dla chorych w trakcie leczenia promieniami i ich opiekunów Dawid Bodusz Zakład Radioterapii
Wykaz kodów dotyczących urządzeń radiologicznych w radiologii i diagnostyce obrazowej, medycynie nuklearnej i radioterapii
 Załącznik do rozporządzenia Ministra Zdrowia Wykaz kodów dotyczących urządzeń radiologicznych w radiologii i diagnostyce obrazowej, medycynie nuklearnej i radioterapii I. Ogólne zasady kodowania i określenie
Załącznik do rozporządzenia Ministra Zdrowia Wykaz kodów dotyczących urządzeń radiologicznych w radiologii i diagnostyce obrazowej, medycynie nuklearnej i radioterapii I. Ogólne zasady kodowania i określenie
Med-fizykadla nie-fizyków. mgr inż. Anna Kozłowska Zakład Dydaktyki Fizyki UMK
 Med-fizykadla nie-fizyków mgr inż. Anna Kozłowska Zakład Dydaktyki Fizyki UMK 1 Plan prezentacji Pozytonowa tomografia emisyjna (PET) Tomografia komputerowa (CT) Scyntygrafia Radioterapia 2 Pozytonowa
Med-fizykadla nie-fizyków mgr inż. Anna Kozłowska Zakład Dydaktyki Fizyki UMK 1 Plan prezentacji Pozytonowa tomografia emisyjna (PET) Tomografia komputerowa (CT) Scyntygrafia Radioterapia 2 Pozytonowa
EFEKTY KSZTAŁCENIA DLA KIERUNKU STUDIÓW ELEKTRORADIOLOGIA
 EFEKTY KSZTAŁCENIA DLA KIERUNKU STUDIÓW ELEKTRORADIOLOGIA Poziom kształcenia Profil kształcenia Tytuł zawodowy absolwenta studia I stopnia praktyczny licencjat I. Umiejscowienie kierunku w obszarze/obszarach
EFEKTY KSZTAŁCENIA DLA KIERUNKU STUDIÓW ELEKTRORADIOLOGIA Poziom kształcenia Profil kształcenia Tytuł zawodowy absolwenta studia I stopnia praktyczny licencjat I. Umiejscowienie kierunku w obszarze/obszarach
TERAPIA PROTONOWA. Proseminarium magisterskie 18 X 2005 1/36. Marta Giżyńska
 TERAPIA PROTONOWA Proseminarium magisterskie 18 X 2005 1/36 W skrócie... Cele terapii Słownictwo Własności wiązki protonowej Cele strategiczne Technika wielopolowa Technika rozpraszania Porównanie z techniką
TERAPIA PROTONOWA Proseminarium magisterskie 18 X 2005 1/36 W skrócie... Cele terapii Słownictwo Własności wiązki protonowej Cele strategiczne Technika wielopolowa Technika rozpraszania Porównanie z techniką
EFEKTY KSZTAŁCENIA DLA KIERUNKU STUDIÓW ELEKTRORADIOLOGIA
 EFEKTY KSZTAŁCENIA DLA KIERUNKU STUDIÓW ELEKTRORADIOLOGIA Poziom kształcenia Profil kształcenia Tytuł zawodowy absolwenta studia I stopnia praktyczny licencjat I. Umiejscowienie kierunku w obszarze/obszarach
EFEKTY KSZTAŁCENIA DLA KIERUNKU STUDIÓW ELEKTRORADIOLOGIA Poziom kształcenia Profil kształcenia Tytuł zawodowy absolwenta studia I stopnia praktyczny licencjat I. Umiejscowienie kierunku w obszarze/obszarach
BRACHYTERAPIA Grzegorz Knor Proseminarium magisterskie 15 XI 2007
 BRACHYTERAPIA Grzegorz Knor Proseminarium magisterskie 15 XI 2007 Plan seminarium: 1. Krótka historia brachyterapii 2. Podział brachyterapii 3. Sprzęt 4. Stosowane źródła 5. Dwa przykłady zastosowania
BRACHYTERAPIA Grzegorz Knor Proseminarium magisterskie 15 XI 2007 Plan seminarium: 1. Krótka historia brachyterapii 2. Podział brachyterapii 3. Sprzęt 4. Stosowane źródła 5. Dwa przykłady zastosowania
Wymagany zakres szkolenia dla osób ubiegających się o nadanie uprawnień
 Dziennik Ustaw 5 Poz. 1534 Załącznik do rozporządzenia Ministra Zdrowia z dnia 21 grudnia 2012 r. (poz. 1534) Wymagany zakres szkolenia dla osób ubiegających się o nadanie uprawnień inspektora ochrony
Dziennik Ustaw 5 Poz. 1534 Załącznik do rozporządzenia Ministra Zdrowia z dnia 21 grudnia 2012 r. (poz. 1534) Wymagany zakres szkolenia dla osób ubiegających się o nadanie uprawnień inspektora ochrony
Wyznaczanie profilu wiązki promieniowania używanego do cechowania tomografu PET
 18 Wyznaczanie profilu wiązki promieniowania używanego do cechowania tomografu PET Ines Moskal Studentka, Instytut Fizyki UJ Na Uniwersytecie Jagiellońskim prowadzone są badania dotyczące usprawnienia
18 Wyznaczanie profilu wiązki promieniowania używanego do cechowania tomografu PET Ines Moskal Studentka, Instytut Fizyki UJ Na Uniwersytecie Jagiellońskim prowadzone są badania dotyczące usprawnienia
Promieniowanie w naszych domach. I. Skwira-Chalot
 Promieniowanie w naszych domach I. Skwira-Chalot Co to jest promieniowanie jonizujące? + jądro elektron Rodzaje promieniowania jonizującego Przenikalność promieniowania L. Dobrzyński, E. Droste, W. Trojanowski,
Promieniowanie w naszych domach I. Skwira-Chalot Co to jest promieniowanie jonizujące? + jądro elektron Rodzaje promieniowania jonizującego Przenikalność promieniowania L. Dobrzyński, E. Droste, W. Trojanowski,
Zakres testów eksploatacyjnych urządzeń radiologicznych radioterapia, propozycja zmian
 Zakres testów eksploatacyjnych urządzeń radiologicznych radioterapia, propozycja zmian mgr inż. Przemysław Janiak mgr inż. Joanna Gaweł Dział Kontroli Jakości Testy eksploatacyjne w radioterapii stan obecny
Zakres testów eksploatacyjnych urządzeń radiologicznych radioterapia, propozycja zmian mgr inż. Przemysław Janiak mgr inż. Joanna Gaweł Dział Kontroli Jakości Testy eksploatacyjne w radioterapii stan obecny
Radioizotopowa diagnostyka nowotworów Szczególne możliwości badania PET/CT z użyciem znakowanej glukozy
 Radioizotopowa diagnostyka nowotworów Szczególne możliwości badania PET/CT z użyciem znakowanej glukozy Katarzyna Fronczewska-Wieniawska Małgorzata Kobylecka Leszek Królicki Zakład Medycyny Nuklearnej
Radioizotopowa diagnostyka nowotworów Szczególne możliwości badania PET/CT z użyciem znakowanej glukozy Katarzyna Fronczewska-Wieniawska Małgorzata Kobylecka Leszek Królicki Zakład Medycyny Nuklearnej
MATERIAŁ SZKOLENIOWY SZKOLENIE WSTĘPNE PRACOWNIKA ZATRUDNIONEGO W NARAŻENIU NA PROMIENIOWANIE JONIZUJĄCE. Ochrona Radiologiczna - szkolenie wstępne 1
 MATERIAŁ SZKOLENIOWY SZKOLENIE WSTĘPNE PRACOWNIKA ZATRUDNIONEGO W NARAŻENIU NA PROMIENIOWANIE JONIZUJĄCE Ochrona Radiologiczna - szkolenie wstępne 1 Cel szkolenia wstępnego: Zgodnie z Ustawą Prawo Atomowe
MATERIAŁ SZKOLENIOWY SZKOLENIE WSTĘPNE PRACOWNIKA ZATRUDNIONEGO W NARAŻENIU NA PROMIENIOWANIE JONIZUJĄCE Ochrona Radiologiczna - szkolenie wstępne 1 Cel szkolenia wstępnego: Zgodnie z Ustawą Prawo Atomowe
Promieniowanie jonizujące
 Ergonomia przemysłowa Promieniowanie jonizujące Wykonali: Katarzyna Bogdańska Rafał Pećka Maciej Nowak Krzysztof Sankiewicz Promieniowanie jonizujące Promieniowanie jonizujące to promieniowanie korpuskularne
Ergonomia przemysłowa Promieniowanie jonizujące Wykonali: Katarzyna Bogdańska Rafał Pećka Maciej Nowak Krzysztof Sankiewicz Promieniowanie jonizujące Promieniowanie jonizujące to promieniowanie korpuskularne
DZIENNIK PRAKTYKI KIERUNEK: ELEKTRORADIOLOGIA CZĘŚĆ I ZAKRES: DIAGNOSTYKA OBRAZOWA
 DZIENNIK PRAKTYKI KIERUNEK: ELEKTRORADIOLOGIA CZĘŚĆ I ZAKRES: DIAGNOSTYKA OBRAZOWA Imię i nazwisko studenta.... Numer albumu.. Rok/sem. studiów... Specjalność Opiekun w instytucji Opiekun z ramienia uczelni.
DZIENNIK PRAKTYKI KIERUNEK: ELEKTRORADIOLOGIA CZĘŚĆ I ZAKRES: DIAGNOSTYKA OBRAZOWA Imię i nazwisko studenta.... Numer albumu.. Rok/sem. studiów... Specjalność Opiekun w instytucji Opiekun z ramienia uczelni.
P O L I T E C H N I K A W R O C Ł A W S K A
 P O L I T E C H N I K A W R O C Ł A W S K A Wydział Chemiczny, Zakład Metalurgii Chemicznej Chemia Środowiska Laboratorium RADIOAKTYWNOŚĆ W BUDYNKACH CEL ĆWICZENIA : Wyznaczanie pola promieniowania jonizującego
P O L I T E C H N I K A W R O C Ł A W S K A Wydział Chemiczny, Zakład Metalurgii Chemicznej Chemia Środowiska Laboratorium RADIOAKTYWNOŚĆ W BUDYNKACH CEL ĆWICZENIA : Wyznaczanie pola promieniowania jonizującego
Obrazowanie MRI Skopia rtg Scyntygrafia PET
 Wyzwania wynikające z rozwoju metod obrazowania Technika i technologia Konferencja w ramach projektu Wykorzystywanie nowych metod i narzędzi w kształceniu studentów UMB w zakresie ochrony radiologicznej
Wyzwania wynikające z rozwoju metod obrazowania Technika i technologia Konferencja w ramach projektu Wykorzystywanie nowych metod i narzędzi w kształceniu studentów UMB w zakresie ochrony radiologicznej
EFEKTY UCZENIA SIĘ DLA KIERUNKU STUDIÓW ELEKTRORADIOLOGIA STUDIA PIERWSZEGO STOPNIA - PROFIL PRAKTYCZNY
 EFEKTY UCZENIA SIĘ DLA KIERUNKU STUDIÓW ELEKTRORADIOLOGIA STUDIA PIERWSZEGO STOPNIA - PROFIL PRAKTYCZNY Umiejscowienie kierunku w obszarze kształcenia Elektroradiologia jest umiejscowiona w dziedzinie
EFEKTY UCZENIA SIĘ DLA KIERUNKU STUDIÓW ELEKTRORADIOLOGIA STUDIA PIERWSZEGO STOPNIA - PROFIL PRAKTYCZNY Umiejscowienie kierunku w obszarze kształcenia Elektroradiologia jest umiejscowiona w dziedzinie
RADIO TERA PIA. informacje dla lekarzy. Opracowanie: dr n. med. Andrzej Radkowski
 RADIO TERA PIA RT informacje dla lekarzy Opracowanie: dr n. med. Andrzej Radkowski Spis treści 4 Radioterapia zasada działania 5 Rodzaje radioterapii 8 Cel radioterapii 10 Przygotowanie leczenia 10 Przebieg
RADIO TERA PIA RT informacje dla lekarzy Opracowanie: dr n. med. Andrzej Radkowski Spis treści 4 Radioterapia zasada działania 5 Rodzaje radioterapii 8 Cel radioterapii 10 Przygotowanie leczenia 10 Przebieg
Promieniotwórczość i promieniowanie jonizujące w diagnostyce i terapii nowotworów złośliwych
 Promieniotwórczość i promieniowanie jonizujące w diagnostyce i terapii nowotworów złośliwych Mirosław Lewocki Zachodniopomorskie Centrum Onkologii w Szczecinie Instytut Fizyki Uniwersytetu Szczecińskiego
Promieniotwórczość i promieniowanie jonizujące w diagnostyce i terapii nowotworów złośliwych Mirosław Lewocki Zachodniopomorskie Centrum Onkologii w Szczecinie Instytut Fizyki Uniwersytetu Szczecińskiego
S T R E S Z C Z E N I E
 STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
Radiologia. Obrazowanie diagnostyczne
 WN Radiologia. Obrazowanie diagnostyczne Klasyfikuj materiały dotyczące wykorzystania promieniowania jonizującego w diagnostyce i leczeniu określonej choroby, narządu, układu z chorobą, narządem, lub układem.
WN Radiologia. Obrazowanie diagnostyczne Klasyfikuj materiały dotyczące wykorzystania promieniowania jonizującego w diagnostyce i leczeniu określonej choroby, narządu, układu z chorobą, narządem, lub układem.
DZIENNIK PRAKTYKI III część zakres Radioterapia KIERUNEK: ELEKTRORADIOLOGIA
 DZIENNIK PRAKTYKI III część zakres Radioterapia KIERUNEK: ELEKTRORADIOLOGIA Imię i nazwisko studenta. Numer albumu.. Rok/sem.... Specjalność Opiekun w instytucji Opiekun z ramienia uczelni. Nazwa zakładu
DZIENNIK PRAKTYKI III część zakres Radioterapia KIERUNEK: ELEKTRORADIOLOGIA Imię i nazwisko studenta. Numer albumu.. Rok/sem.... Specjalność Opiekun w instytucji Opiekun z ramienia uczelni. Nazwa zakładu
RADIO TERA PIA. informacje dla lekarzy. Opracowanie: dr n. med. Andrzej Radkowski
 RADIO TERA PIA RT informacje dla lekarzy Opracowanie: dr n. med. Andrzej Radkowski Spis treści 4 Radioterapia zasada działania 5 Rodzaje radioterapii 6 Cel radioterapii 7 Przygotowanie leczenia 7 Przebieg
RADIO TERA PIA RT informacje dla lekarzy Opracowanie: dr n. med. Andrzej Radkowski Spis treści 4 Radioterapia zasada działania 5 Rodzaje radioterapii 6 Cel radioterapii 7 Przygotowanie leczenia 7 Przebieg
Dziennik Urzędowy Unii Europejskiej. Komunikat Komisji w sprawie implementacji dyrektywy Rady 93/42/EWG (2006/C 173/02)
 C 173/2 26.7.2006 Komunikat Komisji w sprawie implementacji dyrektywy Rady 93/42/EWG (2006/C 173/02) (Tekst dotyczący EOG) (Wykaz tytułów i numerów norm zharmonizowanych z dyrektywą) normy CEN/CENELEC
C 173/2 26.7.2006 Komunikat Komisji w sprawie implementacji dyrektywy Rady 93/42/EWG (2006/C 173/02) (Tekst dotyczący EOG) (Wykaz tytułów i numerów norm zharmonizowanych z dyrektywą) normy CEN/CENELEC
Dziennik Urzędowy Unii Europejskiej. Komunikat Komisji w sprawie implementacji dyrektywy Rady 93/42/EWG (2005/C 103/02)
 C 103/2 Komunikat Komisji w sprawie implementacji dyrektywy Rady 93/42/EWG (2005/C 103/02) (Tekst dotyczący EOG) (Wykaz tytułów i numerów norm zharmonizowanych z dyrektywą) CEN/ CENELEC EN 46003:1999 Systemy
C 103/2 Komunikat Komisji w sprawie implementacji dyrektywy Rady 93/42/EWG (2005/C 103/02) (Tekst dotyczący EOG) (Wykaz tytułów i numerów norm zharmonizowanych z dyrektywą) CEN/ CENELEC EN 46003:1999 Systemy
KONTROLA DAWEK INDYWIDUALNYCH I ŚRODOWISKA PRACY. Magdalena Łukowiak
 KONTROLA DAWEK INDYWIDUALNYCH I ŚRODOWISKA PRACY Magdalena Łukowiak Narażenie zawodowe Narażenie proces, w którym organizm ludzki podlega działaniu promieniowania jonizującego. Wykonywanie obowiązków zawodowych,
KONTROLA DAWEK INDYWIDUALNYCH I ŚRODOWISKA PRACY Magdalena Łukowiak Narażenie zawodowe Narażenie proces, w którym organizm ludzki podlega działaniu promieniowania jonizującego. Wykonywanie obowiązków zawodowych,
II. Promieniowanie jonizujące
 I. Wstęp Zgodnie z obowiązującym prawem osoba przystępująca do pracy w warunkach narażenia na promieniowanie jonizujące powinna być do tego odpowiednio przygotowana, czyli posiadać, miedzy innymi, niezbędną
I. Wstęp Zgodnie z obowiązującym prawem osoba przystępująca do pracy w warunkach narażenia na promieniowanie jonizujące powinna być do tego odpowiednio przygotowana, czyli posiadać, miedzy innymi, niezbędną
OPIS PRZEDMIOTU UMOWY Część L - Opis świadczenia POZYTONOWA TOMOGRAFIA EMISYJNA (PET)
 Załącznik nr 4 do zarządzenia Nr 88/2013/DSOZ Prezesa Narodowego Funduszu Zdrowia z dnia 18 grudnia 2013 r. OPIS PRZEDMIOTU UMOWY Część L - Opis świadczenia POZYTONOWA TOMOGRAFIA EMISYJNA (PET) 1. Charakterystyka
Załącznik nr 4 do zarządzenia Nr 88/2013/DSOZ Prezesa Narodowego Funduszu Zdrowia z dnia 18 grudnia 2013 r. OPIS PRZEDMIOTU UMOWY Część L - Opis świadczenia POZYTONOWA TOMOGRAFIA EMISYJNA (PET) 1. Charakterystyka
Zagrożenia naturalnymi źródłami promieniowania jonizującego w przemyśle wydobywczym. Praca zbiorowa pod redakcją Jana Skowronka
 Zagrożenia naturalnymi źródłami promieniowania jonizującego w przemyśle wydobywczym Praca zbiorowa pod redakcją Jana Skowronka GŁÓWNY INSTYTUT GÓRNICTWA Katowice 2007 SPIS TREŚCI WPROWADZENIE (J. SKOWRONEK)...
Zagrożenia naturalnymi źródłami promieniowania jonizującego w przemyśle wydobywczym Praca zbiorowa pod redakcją Jana Skowronka GŁÓWNY INSTYTUT GÓRNICTWA Katowice 2007 SPIS TREŚCI WPROWADZENIE (J. SKOWRONEK)...
Optymalizacja w radiologii zabiegowej
 8 czerwca 2013, godzina 9:00 10:00; Sesja Inżynierska Optymalizacja w radiologii zabiegowej Łódzki Ośrodek Szkoleniowo-Konsultacyjny ŁOŚ Centrum Medyczne Kształcenia Podyplomowego PTIK PLTR PTFM OPTYMALIZACJA
8 czerwca 2013, godzina 9:00 10:00; Sesja Inżynierska Optymalizacja w radiologii zabiegowej Łódzki Ośrodek Szkoleniowo-Konsultacyjny ŁOŚ Centrum Medyczne Kształcenia Podyplomowego PTIK PLTR PTFM OPTYMALIZACJA
Sprzęt stosowany w pozytonowej tomografii emisyjnej
 Sprzęt stosowany w pozytonowej tomografii emisyjnej Skaner PET-CT stanowi połączony w jedno urządzenie zespół dwóch tomografów, tomografu rentgenowskiego oraz tomografu PET. W artykule przedstawiono opis
Sprzęt stosowany w pozytonowej tomografii emisyjnej Skaner PET-CT stanowi połączony w jedno urządzenie zespół dwóch tomografów, tomografu rentgenowskiego oraz tomografu PET. W artykule przedstawiono opis
TOMOGRAFIA KOMPUTEROWA DO PLANOWANIA LECZENIA
 TOMOGRAFIA KOMPUTEROWA DO PLANOWANIA LECZENIA Wizyta w gabinecie tomografii komputerowej (TK) jest pierwszym etapem w procesie radioterapii. Polega ona na wykonaniu badania tomograficznego, które nie jest
TOMOGRAFIA KOMPUTEROWA DO PLANOWANIA LECZENIA Wizyta w gabinecie tomografii komputerowej (TK) jest pierwszym etapem w procesie radioterapii. Polega ona na wykonaniu badania tomograficznego, które nie jest
Fizyczne podstawy radioterapii
 Fizyczne podstawy radioterapii odkrycie promieniu X, promieniotwórczości i swobodnego elektronu stworzyły podstawy nowych działów medycyny: diagnostyki rentgenowskiej i radioterapii pierwsze próby zastosowania
Fizyczne podstawy radioterapii odkrycie promieniu X, promieniotwórczości i swobodnego elektronu stworzyły podstawy nowych działów medycyny: diagnostyki rentgenowskiej i radioterapii pierwsze próby zastosowania
Opis programu Leczenie radioizotopowe
 Opis programu Leczenie radioizotopowe I. Leczenie radioizotopowe z zastosowaniem 131-I Leczenie dotyczy schorzeń tarczycy (choroby Graves-Basedowa, wola guzowatego, guzów autonomicznych). Polega ono na
Opis programu Leczenie radioizotopowe I. Leczenie radioizotopowe z zastosowaniem 131-I Leczenie dotyczy schorzeń tarczycy (choroby Graves-Basedowa, wola guzowatego, guzów autonomicznych). Polega ono na
TELERADIOTERAPIA wykorzystanie promieniowania w medycynie. Anna Buszko Centrum Onkologii-Instytut im. M. Skłodowskiej-Curie
 TELERADIOTERAPIA wykorzystanie promieniowania w medycynie Anna Buszko Centrum Onkologii-Instytut im. M. Skłodowskiej-Curie Radiobiologia Nadrzędny cel radioterapii: zniszczenie nowotworu maksymalne oszczędzenie
TELERADIOTERAPIA wykorzystanie promieniowania w medycynie Anna Buszko Centrum Onkologii-Instytut im. M. Skłodowskiej-Curie Radiobiologia Nadrzędny cel radioterapii: zniszczenie nowotworu maksymalne oszczędzenie
Radiobiologia, ochrona radiologiczna i dozymetria
 Radiobiologia, ochrona radiologiczna i dozymetria 1. Metryczka Nazwa Wydziału: Program kształcenia (kierunek studiów, poziom i profil kształcenia, forma studiów, np. Zdrowie publiczne I stopnia profil
Radiobiologia, ochrona radiologiczna i dozymetria 1. Metryczka Nazwa Wydziału: Program kształcenia (kierunek studiów, poziom i profil kształcenia, forma studiów, np. Zdrowie publiczne I stopnia profil
IBM. Fizyka Medyczna. Brygida Mielewska, specjalność: Fizyka Medyczna
 Fizyka Medyczna Brygida Mielewska, specjalność: Fizyka Medyczna Kierunek: Inżynieria Biomedyczna Wiedza i doświadczenie lekarza to wypadkowa wielu dziedzin: Specjalność: Fizyka Medyczna Czego możecie się
Fizyka Medyczna Brygida Mielewska, specjalność: Fizyka Medyczna Kierunek: Inżynieria Biomedyczna Wiedza i doświadczenie lekarza to wypadkowa wielu dziedzin: Specjalność: Fizyka Medyczna Czego możecie się
lek. wet. Joanna Głodek Katedra Chirurgii i Rentgenologii z Kliniką Wydział Medycyny Weterynaryjnej Uniwersytet Warmińsko Mazurski w Olsztynie
 lek. wet. Joanna Głodek Katedra Chirurgii i Rentgenologii z Kliniką Wydział Medycyny Weterynaryjnej Uniwersytet Warmińsko Mazurski w Olsztynie W medycynie ludzkiej rezonans magnetyczny (RM) jest jedną
lek. wet. Joanna Głodek Katedra Chirurgii i Rentgenologii z Kliniką Wydział Medycyny Weterynaryjnej Uniwersytet Warmińsko Mazurski w Olsztynie W medycynie ludzkiej rezonans magnetyczny (RM) jest jedną
1. Co to jest promieniowanie jonizujące 2. Źródła promieniowania jonizującego 3. Najczęściej spotykane rodzaje promieniowania jonizującego 4.
 1. Co to jest promieniowanie jonizujące 2. Źródła promieniowania jonizującego 3. Najczęściej spotykane rodzaje promieniowania jonizującego 4. Przenikanie promieniowania α, β, γ, X i neutrony 5. Krótka
1. Co to jest promieniowanie jonizujące 2. Źródła promieniowania jonizującego 3. Najczęściej spotykane rodzaje promieniowania jonizującego 4. Przenikanie promieniowania α, β, γ, X i neutrony 5. Krótka
Zastosowanie radioizotopów w diagnostyce i terapii układu kostno-stawowego
 Zastosowanie radioizotopów w diagnostyce i terapii układu kostno-stawowego Marek Chojnowski II Letnia Szkoła Energetyki i Chemii Jądrowej Zastosowanie radioizotopów w diagnostyce i terapii układu kostnostawowego
Zastosowanie radioizotopów w diagnostyce i terapii układu kostno-stawowego Marek Chojnowski II Letnia Szkoła Energetyki i Chemii Jądrowej Zastosowanie radioizotopów w diagnostyce i terapii układu kostnostawowego
pierwiastek promieniotwórczy jest umieszczany wewnątrz zmiany nowotworowej z dużą dokładnością
 Dr n. med. Dariusz Kieszko lek. med. Justyna Podlodowska Brachyterapia Poradnik dla Pacjenta Centrum Onkologii Ziemi Lubelskiej im. św. Jana z Dukli Lublin, 2011 Brachyterapia jest to metoda radioterapii
Dr n. med. Dariusz Kieszko lek. med. Justyna Podlodowska Brachyterapia Poradnik dla Pacjenta Centrum Onkologii Ziemi Lubelskiej im. św. Jana z Dukli Lublin, 2011 Brachyterapia jest to metoda radioterapii
PROGRAM STAŻU SZKOLENIOWEGO DLA NAUCZYCIELI W ZAWODZIE TECHNIK ELEKTRORADIOLOG
 PROGRAM STAŻU SZKOLENIOWEGO DLA NAUCZYCIELI W ZAWODZIE TECHNIK ELEKTRORADIOLOG Symbol cyfrowy [19] Spis treści Wprowadzenie I. Założenia programowo-organizacyjne stażu. 1. Charakterystyka zawodu - elektroradiolog..
PROGRAM STAŻU SZKOLENIOWEGO DLA NAUCZYCIELI W ZAWODZIE TECHNIK ELEKTRORADIOLOG Symbol cyfrowy [19] Spis treści Wprowadzenie I. Założenia programowo-organizacyjne stażu. 1. Charakterystyka zawodu - elektroradiolog..
Rola fizyki w medycynie na przykładzie radioterapii. Autor: Marcin Grabowski
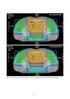 Rola fizyki w medycynie na przykładzie radioterapii Autor: Marcin Grabowski Fizyka w medycynie Dział fizyki wykorzystujący metody fizyczne w zastosowaniach medycznych (diagnostyka, terapia, rehabilitacja),
Rola fizyki w medycynie na przykładzie radioterapii Autor: Marcin Grabowski Fizyka w medycynie Dział fizyki wykorzystujący metody fizyczne w zastosowaniach medycznych (diagnostyka, terapia, rehabilitacja),
PODSTAWY DOZYMETRII. Fot. M.Budzanowski. Fot. M.Budzanowski
 PODSTAWY DOZYMETRII Fot. M.Budzanowski Fot. M.Budzanowski NARAŻENIE CZŁOWIEKA Napromieniowanie zewnętrzne /γ,x,β,n,p/ (ważne: rodzaj promieniowania, cząstki i energia,) Wchłonięcie przez oddychanie i/lub
PODSTAWY DOZYMETRII Fot. M.Budzanowski Fot. M.Budzanowski NARAŻENIE CZŁOWIEKA Napromieniowanie zewnętrzne /γ,x,β,n,p/ (ważne: rodzaj promieniowania, cząstki i energia,) Wchłonięcie przez oddychanie i/lub
OPIS PROGRAMU. dostosowanie rozmieszczenia pozostałych ośrodków do już istniejącego, łatwość dotarcia pacjenta na badanie (struktura komunikacyjna),
 Załącznik 1 OPIS PROGRAMU CELE PROGRAMU: - podniesienie jakości diagnostycznej w zakresie schorzeń onkologicznych, kardiologicznych i neurologicznych; - ograniczenie o 20 30% operacji onkologicznych; -
Załącznik 1 OPIS PROGRAMU CELE PROGRAMU: - podniesienie jakości diagnostycznej w zakresie schorzeń onkologicznych, kardiologicznych i neurologicznych; - ograniczenie o 20 30% operacji onkologicznych; -
Czym jest badanie czynnościowe rezonansu magnetycznego? Oraz jaki ma związek z neuronawigacją?
 Czym jest badanie czynnościowe rezonansu magnetycznego? Oraz jaki ma związek z neuronawigacją? Dolnośląski Szpital Specjalistyczny im. T. Marciniaka Centrum Medycyny Ratunkowej stale podnosi jakość prowadzonego
Czym jest badanie czynnościowe rezonansu magnetycznego? Oraz jaki ma związek z neuronawigacją? Dolnośląski Szpital Specjalistyczny im. T. Marciniaka Centrum Medycyny Ratunkowej stale podnosi jakość prowadzonego
Lekarz : lek. Grażyna Kucharska, specjalista radiolog. Telefon:
 Lekarz : Telefon: 032 331 99 61 lek. Grażyna Kucharska, specjalista radiolog W Pracowni RTG wykonywane są badania dla pacjentów hospitalizowanych w Szpitalu, pacjentów Poradni Przyszpitalnej, pacjentów
Lekarz : Telefon: 032 331 99 61 lek. Grażyna Kucharska, specjalista radiolog W Pracowni RTG wykonywane są badania dla pacjentów hospitalizowanych w Szpitalu, pacjentów Poradni Przyszpitalnej, pacjentów
PET. Positron Emission Tomography. Tomograf PET. Wytwórnia radiofarmaceutyków linia technologiczna. Wytwórnia radiofarmaceutyków centrum sterowania
 PET Positron Emission Tomography Technika PET zastępuje obecnie starszą i gorszą technikę SPECT (Single Photon Emission Computed Tomography). PET oferuje znacznie lepszą rozdzielczość przestrzenną niż
PET Positron Emission Tomography Technika PET zastępuje obecnie starszą i gorszą technikę SPECT (Single Photon Emission Computed Tomography). PET oferuje znacznie lepszą rozdzielczość przestrzenną niż
Cele, zadania i metody radioterapii
 Cele, zadania i metody radioterapii na przykładzie Centrum Onkologii Instytutu Marii Skłodowskiej Curie w Warszawie przy ul. Wawelskiej 15 Anna Buszko Spis treści 1 Cele, zadania i metody radioterapii...2
Cele, zadania i metody radioterapii na przykładzie Centrum Onkologii Instytutu Marii Skłodowskiej Curie w Warszawie przy ul. Wawelskiej 15 Anna Buszko Spis treści 1 Cele, zadania i metody radioterapii...2
Współczesne metody obrazowania w medycynie nuklearnej
 Współczesne metody obrazowania w medycynie nuklearnej prof. Jacek Kuśmierek Zakład Medycyny Nuklearnej Uniwersytetu Medycznego w Łodzi Kamera Scyntylacyjna 2013r. 1958r. Kamery scyntylacyjne SPECT (2 głowice)
Współczesne metody obrazowania w medycynie nuklearnej prof. Jacek Kuśmierek Zakład Medycyny Nuklearnej Uniwersytetu Medycznego w Łodzi Kamera Scyntylacyjna 2013r. 1958r. Kamery scyntylacyjne SPECT (2 głowice)
Rok akademicki: 2014/2015 Kod: JFM s Punkty ECTS: 2. Poziom studiów: Studia I stopnia Forma i tryb studiów: -
 Nazwa modułu: Podstawy radiofarmakologii i medycyny nuklearnej Rok akademicki: 2014/2015 Kod: JFM-1-601-s Punkty ECTS: 2 Wydział: Fizyki i Informatyki Stosowanej Kierunek: Fizyka Medyczna Specjalność:
Nazwa modułu: Podstawy radiofarmakologii i medycyny nuklearnej Rok akademicki: 2014/2015 Kod: JFM-1-601-s Punkty ECTS: 2 Wydział: Fizyki i Informatyki Stosowanej Kierunek: Fizyka Medyczna Specjalność:
Dr hab. n. med. JANUSZ SKOWRONEK Zakład Brachyterapii, Wielkopolskie Centrum Onkologii, Poznań, Polska
 Brachyterapia Dr hab. n. med. JANUSZ SKOWRONEK Zakład Brachyterapii, Wielkopolskie Centrum Onkologii, Poznań, Polska 1 Brachyterapia 1. Brachyterapia, curietherapia ( brachy, z greckiego - z bliska) jest
Brachyterapia Dr hab. n. med. JANUSZ SKOWRONEK Zakład Brachyterapii, Wielkopolskie Centrum Onkologii, Poznań, Polska 1 Brachyterapia 1. Brachyterapia, curietherapia ( brachy, z greckiego - z bliska) jest
GRUPA VOXEL. FDG SteriPET. Systemy RIS/PACS/HIS. Diagnostyka obrazowa 14 pracowni TK 15 pracowni MR TELE PACS WEB RIS HIS. Systemy zewnętrzne
 Czerwiec 2013 GRUPA VOXEL Usługi medyczne e mózgowia - traktografia DTI Produkcja Usługi komplementarne RTG TK (CT) od 1 do 60 obrazów/badanie do1500 obrazów/badanie TELE PACS Stacje diagnostyczne WEB
Czerwiec 2013 GRUPA VOXEL Usługi medyczne e mózgowia - traktografia DTI Produkcja Usługi komplementarne RTG TK (CT) od 1 do 60 obrazów/badanie do1500 obrazów/badanie TELE PACS Stacje diagnostyczne WEB
KARTA PRAKTYK STUDENCKICH. Kierunek: Elektroradiologia Uniwersytetu Medycznego w Lublinie
 Ramowy Program Praktyk pracownia radiografii cyfrowej KARTA PRAKTYK STUDENCKICH imię i nazwisko studenta... Kierunek: Elektroradiologia Uniwersytetu Medycznego w Lublinie Rok studiów...semestr studiów...
Ramowy Program Praktyk pracownia radiografii cyfrowej KARTA PRAKTYK STUDENCKICH imię i nazwisko studenta... Kierunek: Elektroradiologia Uniwersytetu Medycznego w Lublinie Rok studiów...semestr studiów...
Uchwała nr 96/IX/2012 Senatu Uniwersytetu Jagiellońskiego z dnia 26 września 2012 r.
 Uchwała nr 96/IX/2012 Senatu Uniwersytetu Jagiellońskiego z dnia 26 września 2012 r. w sprawie: zmiany załącznika nr 35 do uchwały Senatu UJ nr 34/III/2012 z dnia 28 marca 2012 roku w sprawie wprowadzenia
Uchwała nr 96/IX/2012 Senatu Uniwersytetu Jagiellońskiego z dnia 26 września 2012 r. w sprawie: zmiany załącznika nr 35 do uchwały Senatu UJ nr 34/III/2012 z dnia 28 marca 2012 roku w sprawie wprowadzenia
System zarządzania jakością
 System zarządzania jakością mgr inż. Wioletta Korycka-Sawińska Zachodniopomorskie Centrum Onkologii Szczecin czerwiec 2013 System zarządzania jakością Zespół systematycznie planowanych i wykonywanych działań,
System zarządzania jakością mgr inż. Wioletta Korycka-Sawińska Zachodniopomorskie Centrum Onkologii Szczecin czerwiec 2013 System zarządzania jakością Zespół systematycznie planowanych i wykonywanych działań,
Grzegorz Bielęda Zakład Fizyki Medycznej Wielkopolskie Centrum Onkologii
 Grzegorz Bielęda Zakład Fizyki Medycznej Wielkopolskie Centrum Onkologii Historia implanty stałe 1911 Pasteau -pierwsze doniesienie na temat brachyterapii w leczeniu raka prostaty. Leczenie polegało na
Grzegorz Bielęda Zakład Fizyki Medycznej Wielkopolskie Centrum Onkologii Historia implanty stałe 1911 Pasteau -pierwsze doniesienie na temat brachyterapii w leczeniu raka prostaty. Leczenie polegało na
Aneks III. Zmiany do odpowiednich punktów druków informacyjnych
 Aneks III Zmiany do odpowiednich punktów druków informacyjnych Uwaga: Zmiany do odpowiednich punktów druków informacyjnych są rezultatem postępowania arbitrażowego. Druki informacyjne mogą zostać zaktualizowane
Aneks III Zmiany do odpowiednich punktów druków informacyjnych Uwaga: Zmiany do odpowiednich punktów druków informacyjnych są rezultatem postępowania arbitrażowego. Druki informacyjne mogą zostać zaktualizowane
Spis treści. Trwałość jądra atomowego. Okres połowicznego rozpadu
 Spis treści 1 Trwałość jądra atomowego 2 Okres połowicznego rozpadu 3 Typy przemian jądrowych 4 Reguła przesunięć Fajansa-Soddy ego 5 Szeregi promieniotwórcze 6 Typy reakcji jądrowych 7 Przykłady prostych
Spis treści 1 Trwałość jądra atomowego 2 Okres połowicznego rozpadu 3 Typy przemian jądrowych 4 Reguła przesunięć Fajansa-Soddy ego 5 Szeregi promieniotwórcze 6 Typy reakcji jądrowych 7 Przykłady prostych
Zalecenia PTFM dotyczące prowadzenia kontroli ułożenia pacjentów leczonych wiązkami zewnętrznymi. Część III - Struktury anatomiczne
 Polish Journal of Medical Physics and Engineering 2015;21(1):27-31 doi: 10.1515/pjmpe-2015-0003 Zalecenia Polskiego Towarzystwa Fizyki Medycznej Zalecenia PTFM dotyczące prowadzenia kontroli ułożenia pacjentów
Polish Journal of Medical Physics and Engineering 2015;21(1):27-31 doi: 10.1515/pjmpe-2015-0003 Zalecenia Polskiego Towarzystwa Fizyki Medycznej Zalecenia PTFM dotyczące prowadzenia kontroli ułożenia pacjentów
Dawki indywidualne. środowiskowe zmierzone w zakładach. adach przemysłowych objętych kontrolą dozymetryczną w LADIS IFJ PAN w Krakowie w latach 2006.
 A. Woźniak, M. Budzanowski, A. Nowak, B. DzieŜa, K. Włodek Dawki indywidualne na całe e ciało o i dawki środowiskowe zmierzone w zakładach adach przemysłowych objętych kontrolą dozymetryczną w LADIS IFJ
A. Woźniak, M. Budzanowski, A. Nowak, B. DzieŜa, K. Włodek Dawki indywidualne na całe e ciało o i dawki środowiskowe zmierzone w zakładach adach przemysłowych objętych kontrolą dozymetryczną w LADIS IFJ
EFEKTY KSZTAŁCENIA WIEDZA
 EFEKTY KSZTAŁCENIA Kierunek Poziom i forma kształcenia Profil Elektroradiologia Studia stacjonarne drugiego stopnia Praktyczny OPIS KIERUNKOWYCH EFEKTÓW KSZTAŁCENIA Symbol Po ukończeniu studiów absolwent:
EFEKTY KSZTAŁCENIA Kierunek Poziom i forma kształcenia Profil Elektroradiologia Studia stacjonarne drugiego stopnia Praktyczny OPIS KIERUNKOWYCH EFEKTÓW KSZTAŁCENIA Symbol Po ukończeniu studiów absolwent:
Podstawy medycyny nuklearnej
 Podstawy medycyny nuklearnej Obrazowanie w medycynie Rtg CT Promieniowanie rentgenowskie Ultradźwięki Magnetyczny rezonans jądrowy MR usg Medycyna nuklearna SPECT PET Promieniowanie X Jonizujące Obraz
Podstawy medycyny nuklearnej Obrazowanie w medycynie Rtg CT Promieniowanie rentgenowskie Ultradźwięki Magnetyczny rezonans jądrowy MR usg Medycyna nuklearna SPECT PET Promieniowanie X Jonizujące Obraz
Paulina Majczak-Ziarno, Paulina Janowska, Maciej Budzanowski, Renata Kopeć, Izabela Milcewicz- Mika, Tomasz Nowak
 Pomiar rozkładu dawki od rozproszonego promieniowania wokół stanowiska gantry, w gabinecie stomatologicznym i stanowiska pomiarowego do defektoskopii przy użyciu detektorów MTS-N i MCP-N Paulina Majczak-Ziarno,
Pomiar rozkładu dawki od rozproszonego promieniowania wokół stanowiska gantry, w gabinecie stomatologicznym i stanowiska pomiarowego do defektoskopii przy użyciu detektorów MTS-N i MCP-N Paulina Majczak-Ziarno,
EFEKTY KSZTAŁCENIA kierunek elektroradiologia poziom kształcenia studia pierwszego stopnia profil ogólnoakademicki / praktyczny
 EFEKTY KSZTAŁCENIA kierunek elektroradiologia poziom kształcenia studia pierwszego stopnia profil ogólnoakademicki / praktyczny II. KIERUNKOWE EFEKTY KSZTAŁCENIA Symbol K_W01 K_W02 K_W03 K_W04 K_W05 K_W06
EFEKTY KSZTAŁCENIA kierunek elektroradiologia poziom kształcenia studia pierwszego stopnia profil ogólnoakademicki / praktyczny II. KIERUNKOWE EFEKTY KSZTAŁCENIA Symbol K_W01 K_W02 K_W03 K_W04 K_W05 K_W06
Radioterapia protonowa w leczeniu nowotworów oka. Klinika Okulistyki i Onkologii Okulistycznej Katedra Okulistyki UJ CM
 Radioterapia protonowa w leczeniu nowotworów oka Klinika Okulistyki i Onkologii Okulistycznej Katedra Okulistyki UJ CM Epidemiologia czerniaka błony naczyniowej Częstość występowania zależy od rasy (u
Radioterapia protonowa w leczeniu nowotworów oka Klinika Okulistyki i Onkologii Okulistycznej Katedra Okulistyki UJ CM Epidemiologia czerniaka błony naczyniowej Częstość występowania zależy od rasy (u
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia
 Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
( F ) I. Zagadnienia. II. Zadania
 ( F ) I. Zagadnienia 1. Rozchodzenie się fal akustycznych w układach biologicznych. 2. Wytwarzanie i detekcja fal akustycznych w ultrasonografii. 3. Budowa aparatu ultrasonograficznego metody obrazowania.
( F ) I. Zagadnienia 1. Rozchodzenie się fal akustycznych w układach biologicznych. 2. Wytwarzanie i detekcja fal akustycznych w ultrasonografii. 3. Budowa aparatu ultrasonograficznego metody obrazowania.
Brachyterapia w Europie. Wielkopolskie Centrum Onkologii Poznań 2010
 Brachyterapia w Europie Wielkopolskie Centrum Onkologii Poznań 2010 Brachyterapia nazywana terapią kontaktową; jedna z technik leczenia w radioterapii; polega na bezpośrednim napromienianiu zmian chorobowych,
Brachyterapia w Europie Wielkopolskie Centrum Onkologii Poznań 2010 Brachyterapia nazywana terapią kontaktową; jedna z technik leczenia w radioterapii; polega na bezpośrednim napromienianiu zmian chorobowych,
Energetyka konwencjonalna odnawialna i jądrowa
 Energetyka konwencjonalna odnawialna i jądrowa Wykład 8-27.XI.2018 Zygmunt Szefliński Środowiskowe Laboratorium Ciężkich Jonów szef@fuw.edu.pl http://www.fuw.edu.pl/~szef/ Wykład 8 Energia atomowa i jądrowa
Energetyka konwencjonalna odnawialna i jądrowa Wykład 8-27.XI.2018 Zygmunt Szefliński Środowiskowe Laboratorium Ciężkich Jonów szef@fuw.edu.pl http://www.fuw.edu.pl/~szef/ Wykład 8 Energia atomowa i jądrowa
Pacjent SOR w aspekcie ochrony radiologicznej - kobiety w ciąży. dr Piotr Pankowski
 Pacjent SOR w aspekcie ochrony radiologicznej - kobiety w ciąży dr Piotr Pankowski Ustawa z dnia 29 listopada 2000 r. Prawo atomowe (Dz. U. 2012.264) Art. 33c 6. Dzieci, kobiety w wieku rozrodczym, kobiety
Pacjent SOR w aspekcie ochrony radiologicznej - kobiety w ciąży dr Piotr Pankowski Ustawa z dnia 29 listopada 2000 r. Prawo atomowe (Dz. U. 2012.264) Art. 33c 6. Dzieci, kobiety w wieku rozrodczym, kobiety
Obrazowanie w radioterapii
 Obrazowanie w radioterapii Witold Skrzyński Centrum Onkologii Instytut im. Marii Skłodowskiej-Curie Zakład Fizyki Medycznej Rola obrazowania w radioterapii Diagnoza, decyzja o terapii Planowanie leczenia
Obrazowanie w radioterapii Witold Skrzyński Centrum Onkologii Instytut im. Marii Skłodowskiej-Curie Zakład Fizyki Medycznej Rola obrazowania w radioterapii Diagnoza, decyzja o terapii Planowanie leczenia
Ciąża - radiofarmaceityki
 Warunki bezpiecznego stosowania promieniowania jonizującego dla wszystkich rodzajów ekspozycji medycznej: Ekspozycje medyczne dzieci, kobiet w ciąży i kobiet karmiących Jezierska Karolina Ciąża - radiofarmaceityki
Warunki bezpiecznego stosowania promieniowania jonizującego dla wszystkich rodzajów ekspozycji medycznej: Ekspozycje medyczne dzieci, kobiet w ciąży i kobiet karmiących Jezierska Karolina Ciąża - radiofarmaceityki
Testy kontroli fizycznych parametrów aparatury rentgenowskiej. Waldemar Kot Zachodniopomorskie Centrum Onkologii Szczecin 26.04.2014 r.
 Testy kontroli fizycznych parametrów aparatury rentgenowskiej Waldemar Kot Zachodniopomorskie Centrum Onkologii Szczecin 26.04.2014 r. ROZPORZĄDZENIE MINISTRA ZDROWIA z dnia 18 lutego 2011 r. w sprawie
Testy kontroli fizycznych parametrów aparatury rentgenowskiej Waldemar Kot Zachodniopomorskie Centrum Onkologii Szczecin 26.04.2014 r. ROZPORZĄDZENIE MINISTRA ZDROWIA z dnia 18 lutego 2011 r. w sprawie
Brachyterapia - seminarium
 Brachyterapia - seminarium Prof. dr hab. n. med. Janusz Skowronek Zakład Brachyterapii, Wielkopolskie Centrum Onkologii, Poznań, Polska www.wco.pl/zb 1 Brachyterapia 1. Brachyterapia, curietherapia ( brachy,
Brachyterapia - seminarium Prof. dr hab. n. med. Janusz Skowronek Zakład Brachyterapii, Wielkopolskie Centrum Onkologii, Poznań, Polska www.wco.pl/zb 1 Brachyterapia 1. Brachyterapia, curietherapia ( brachy,
