Aneks III. Zmiany do odpowiednich punktów druków informacyjnych
|
|
|
- Rafał Zieliński
- 7 lat temu
- Przeglądów:
Transkrypt
1 Aneks III Zmiany do odpowiednich punktów druków informacyjnych Uwaga: Zmiany do odpowiednich punktów druków informacyjnych są rezultatem postępowania arbitrażowego. Druki informacyjne mogą zostać zaktualizowane odpowiednio przez właściwe organy państw członkowskich we współpracy z państwem referencyjnym, jeśli dotyczy, zgodnie z procedurami określonymi w rozdziale 4, tytule III Dyrektywy 2001/83/WE. 55
2 Zmiany do odpowiednich punktów druków informacyjnych Istniejące druki informacyjne zostaną zmienione (poprzez, odpowiednio, wstawienie, zastąpienie lub usunięcie tekstu) zgodnie z zatwierdzonym tekstem poniżej. Dożylny kwas gadoterynowy, gadobutrol, gadoteridol Punkt 4.1 Wskazania do stosowania imaging, MRI) bez wzmocnienia kontrastowego. Punkt 4.2 Dawkowanie i sposób podawania Należy stosować najmniejszą dawkę zapewniającą wzmocnienie kontrastowe wystarczające dla celów diagnostycznych. Dawkę należy obliczyć w oparciu o masę ciała pacjenta. Nie powinna ona przekraczać zalecanej dawki na kilogram masy ciała określonej w tym punkcie. Dostawowy kwas gadoterynowy Punkt 4.1 Wskazania do stosowania imaging, MRI) bez wzmocnienia kontrastowego. Punkt 4.2 Dawkowanie i sposób podawania Należy stosować najmniejszą dawkę zapewniającą wzmocnienie kontrastowe wystarczające dla celów diagnostycznych. Dostawowy kwas gadopentetowy Punkt 4.1 Wskazania do stosowania imaging, MRI) bez wzmocnienia kontrastowego oraz gdy nie można zastosować innego, dopuszczonego do obrotu produktu. 56
3 Punkt 4.2 Dawkowanie i sposób podawania Należy stosować najmniejszą dawkę zapewniającą wzmocnienie kontrastowe wystarczające dla celów diagnostycznych. Punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Po podaniu dożylnym produktu <nazwa substancji czynnej (INN)> gadolin może odkładać się w mózgu i innych tkankach organizmu (kościach, wątrobie, nerkach, skórze) oraz może powodować zależne od dawki wzmocnienie intensywności sygnału w mózgu widoczne w obrazie T1-zależnym, szczególnie w jądrze zębatym, gałce bladej i wzgórzu. Konsekwencje kliniczne nie są znane. W przypadku podania dostawowego nie wykryto odkładania się gadolinu w mózgu. Należy rozważyć możliwe korzyści diagnostyczne wynikające ze stosowania produktu <nazwa substancji czynnej (INN)> u pacjentów, którzy wymagają wielokrotnego przeprowadzania badań obrazowych, względem potencjalnego odkładania się gadolinu w mózgu i innych tkankach. 5.2 Właściwości farmakokinetyczne <Nazwa substancji czynnej (INN)> jest gadolinowym środkiem kontrastowym (GdCA) o budowie liniowej. Badania wykazały, że po dożylnym podaniu GdCA w dawkach znacznie większych niż w przypadku podań dostawowych, gadolin odkłada się w organizmie, w tym w mózgu oraz w innych tkankach i narządach. W przypadku GdCA o budowie liniowej może to prowadzić do zależnego od dawki zwiększenia intensywności sygnału w mózgu widocznego w obrazie T1-zależnym, szczególnie w jądrze zębatym, gałce bladej i wzgórzu. Intensywność sygnału zwiększa się, a dane niekliniczne wykazały, że gadolin jest uwalniany z GdCA o budowie liniowej. Ulotka dla pacjenta Punkt 2: Informacje ważne przed zastosowaniem leku <nazwa produktu> o Odkładanie się w organizmie <Nazwa produktu> działa, ponieważ zawiera metal o nazwie gadolin. Badania wykazały, że niewielkie ilości gadolinu mogą odkładać się w organizmie, w tym w mózgu. Nie obserwowano tego zjawiska w przypadku podawania niewielkich ilości we wstrzyknięciu do stawu. Dożylny kwas gadoksetowy Punkt 4.1 Wskazania do stosowania <Nazwa produktu>, użyty w obrazowaniu metodą rezonansu magnetycznego (ang. magnetic resonance imaging, MRI) w obrazach T-zależnych, jest wskazany do stosowania w celu wykrycia zmian ogniskowych w wątrobie i dostarcza informacji o charakterze tych zmian. imaging, MRI) bez wzmocnienia kontrastowego oraz gdy wymagane jest obrazowanie w fazie opóźnionej. Produkt leczniczy jest przeznaczony wyłącznie do celów diagnostycznych po podaniu dożylnym. 57
4 Punkt 4.2 Dawkowanie i sposób podawania Należy stosować najmniejszą dawkę zapewniającą wzmocnienie kontrastowe wystarczające dla celów diagnostycznych. Dawkę należy obliczyć w oparciu o masę ciała pacjenta. Nie powinna ona przekraczać zalecanej dawki na kilogram masy ciała określonej w tym punkcie. Punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Po podaniu produktu <nazwa substancji czynnej (INN)> gadolin może odkładać się w mózgu i innych tkankach organizmu (kościach, wątrobie, nerkach, skórze) oraz może powodować zależne od dawki wzmocnienie intensywności sygnału w mózgu widoczne w obrazie T1-zależnym, szczególnie w jądrze zębatym, gałce bladej i wzgórzu. Konsekwencje kliniczne nie są znane. Należy rozważyć możliwe korzyści diagnostyczne wynikające ze stosowania produktu <nazwa substancji czynnej (INN)> u pacjentów, którzy wymagają wielokrotnego przeprowadzania badań obrazowych, wobec potencjalnego odkładania się gadolinu w mózgu i innych tkankach. 5.2 Właściwości farmakokinetyczne <Nazwa substancji czynnej (INN)> jest gadolinowym środkiem kontrastowym (GdCA) o budowie liniowej. Badania wykazały, że po dożylnym podaniu GdCA gadolin odkłada się w organizmie, w tym w mózgu oraz w innych tkankach i narządach. W przypadku GdCA o budowie liniowej może to prowadzić do zależnego od dawki wzmocnienia intensywności sygnału w mózgu widocznego w obrazie T1-zależnym, szczególnie w jądrze zębatym, gałce bladej i wzgórzu. Intensywność sygnału zwiększa się, a dane niekliniczne wykazały, że gadolin jest uwalniany z GdCA o budowie liniowej. Ulotka dla pacjenta Punkt 2: Informacje ważne przed zastosowaniem leku <nazwa produktu> o Odkładanie się w organizmie <Nazwa produktu> działa, ponieważ zawiera metal o nazwie gadolin. Badania wykazały, że niewielkie ilości gadolinu mogą odkładać się w organizmie, w tym w mózgu. Nie obserwowano działań niepożądanych związanych z odkładaniem się gadolinu w mózgu. Dożylny kwas gadobenowy (ograniczenie wskazania z druków informacyjnych należy usunąć wszystkie odniesienia do innych wskazań) Punkt 4.1 Wskazania do stosowania Produkt leczniczy przeznaczony wyłącznie do diagnostyki. <Nazwa produktu> jest paramagnetycznym środkiem kontrastowym wykorzystywanym w diagnostyce obrazowej metodą rezonansu magnetycznego (ang. magnetic resonance imaging, MRI) w następujących wskazaniach: wątroby u dorosłych i dzieci (w wieku powyżej 2 lat). badanie metodą MRI mózgu i rdzenia kręgowego u dorosłych i dzieci powyżej 2 lat, w celu poprawy wykrywalności zmian patologicznych i dostarczenia dodatkowych informacji diagnostycznych, nieosiągalnych przy wykonaniu badania MRI bez zastosowania środka kontrastowego (patrz punkt 5.1). 58
5 badanie metodą MRI całego ciała u dorosłych i dzieci (powyżej 2 lat) w tym głowy, okolic szyi, klatki piersiowej (w tym serca i piersi u kobiet), brzucha (trzustki i wątroby), brzucha (przewodu pokarmowego), przestrzeni zaotrzewnowej (nerek, nadnerczy), miednicy (gruczołu krokowego, pęcherza moczowego i macicy) i układu mięśniowo-szkieletowego w celu ułatwienia wykrycia nieprawidłowych struktur lub zmian i pomocy w różnicowaniu tkanek prawidłowych od patologicznych (patrz punkt 4.2 i 5.1). w angiografii przy użyciu rezonansu magnetycznego (Magnetic Resonance Angiography MRA) w celu oceny zwężeń, okluzji u dorosłych I dzieci (powyżej 2 lat). w szczególnym zastosowaniu w badaniu serca obejmującym pomiar perfuzji mięśnia sercowego w warunkach stresu farmakologicznego i diagnostyki żywotności ("wzmocnienie opóźnione ). imaging, MRI) bez wzmocnienia kontrastowego oraz gdy wymagane jest obrazowanie w fazie opóźnionej. Punkt 4.2 Dawkowanie i sposób podawania Narząd docelowy Mózg i rdzeń kręgowy Wątroba, nerki, układ moczowy, nadnercza Angiografia przy użyciu rezonansu magnetycznego Głowa i okolice szyi, klatki piersiowej (w tym serca i piersi u kobiet), brzucha (przewodu pokarmowego w tym trzustki), miednicy (gruczołu krokowego, pęcherza moczowego) i układu mięśniowo-szkieletowego Rezonans magnetyczny serca Pomiar mas sercowych lub żywotności mięśnia sercowego Pomiar obejmujący perfuzję mięśnia sercowego Zalecana dawka 0,1 mmol/kg wagi ciała (0,2 ml/kg roztworu 0,5 M) 0,05 mmol/kg wagi ciała (0,1 ml/kg roztworu 0,5 M) 0,1 mmol/kg wagi ciała (0,2 ml/kg roztworu 0,5 M) 0,1 mmol/kg wagi ciała (0,2 ml/kg roztworu 0,5 M) 0,1 mmol/kg wagi ciała, podawana w postaci pojedynczego bolusa 0,2 ml/kg roztworu 0,5 M Dwa oddzielne wstrzyknięcia 0,05 mmol/kg masy ciała (każde odpowiadające 0,1 ml/kg roztworu 0,5 M) w warunkach odpoczynku i stresu. Zalecana dawka <nazwa substancji czynnej (INN)> u dorosłych pacjentów i dzieci wynosi 0,05 mmol/kg masy ciała (0,1 ml/kg roztworu 0,5 M). Należy stosować najmniejszą dawkę zapewniającą wzmocnienie kontrastowe wystarczające dla celów diagnostycznych. Dawkę należy obliczyć w oparciu o masę ciała pacjenta i nie powinna ona przekraczać zalecanej dawki na kilogram masy ciała określonej w tym punkcie. ( ) 59
6 Uzyskiwanie obrazów po podaniu środka kontrastowego: Wątroba Mózg i rdzeń kręgowy MRA Piersi Inne części ciała Obrazowanie dynamiczne: Bezpośrednio po wstrzyknięciu bolusa. Obrazowanie opóźnione: W okresie od 40 do 120 minut po wstrzyknięciu, w zależności od indywidualnych potrzeb obrazowych. W ciągu 60 minut po podaniu. Bezpośrednio po podaniu, z opóźnieniem obrazowania wyliczonym w oparciu o bolus próbny lub metodę automatycznego śledzenia bolusa. Jeżeli nie stosuje się automatycznej sekwencji wykrywania środka kontrastowego w celu synchronizacji z wstrzyknięciem, należy zastosować próbne wstrzyknięcie środka w bolusie o objętości 2 ml w celu wyliczenia odpowiedniego opóźnienia obrazowania. T1-zależna, sekwencja echa gradientowego z rozdzielczością czasową 2 minut lub mniej powinna być uzyskana przed wstrzyknięciem kontrastu i powtórzona kilka razy przez okres 5-8 minut po szybkim wstrzyknięciu dożylnym bolusu kontrastowego. T1-zależna, sekwencja aby osiągnąć albo dynamiczne albo statyczne obrazowanie opóźnione. Specjalne grupy pacjentów Zaburzenia czynności wątroby ( ) Jeśli nie można uniknąć zastosowania produktu leczniczego <nazwa produktu>, wówczas dawka nie powinna być większa niż 0,1 mmol/kg masy ciała dla MR mózgu i kręgosłupa, MRA, MRI piersi lub MRI całego ciała i nie powinna być większa niż 0,05 mmol/kg masy ciała. dla badania MR wątroby, nerek, dróg moczowych lub nadnerczy. Nie należy stosować więcej niż jednej dawki podczas obrazowania z wyjątkiem obrazowania perfuzji mięśnia sercowego, w którym mogą być podane dwie oddzielne dawki 0,05 mmol/kg na masy ciała w trakcie pojedynczego badania. Ze względu na brak danych dotyczących podań wielokrotnych, wstrzyknięć produktu <nazwa produktu> nie powinno się powtarzać, chyba że przerwy pomiędzy wstrzyknięciami wynoszą co najmniej 7 dni. Punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Po podaniu produktu <nazwa substancji czynnej (INN)> gadolin może odkładać się w mózgu i innych tkankach organizmu (kościach, wątrobie, nerkach, skórze) oraz może powodować zależne od dawki wzmocnienie intensywności sygnału w mózgu widoczne w obrazie T1-zależnym, szczególnie w jądrze zębatym, gałce bladej i wzgórzu. Konsekwencje kliniczne nie są znane. Należy rozważyć możliwe korzyści diagnostyczne wynikające ze stosowania produktu <nazwa substancji czynnej (INN)> u pacjentów, którzy wymagają wielokrotnego przeprowadzania badań obrazowych, wobec potencjalnego odkładania się gadolinu w mózgu i innych tkankach. 5.2 Właściwości farmakokinetyczne <Nazwa substancji czynnej (INN)> jest gadolinowym środkiem kontrastowym (GdCA) o budowie liniowej. Badania wykazały, że po narażeniu na GdCA gadolin odkłada się w organizmie, w tym w mózgu oraz w innych tkankach i narządach. W przypadku GdCA o budowie liniowej może to prowadzić do zależnego od dawki wzmocnienia intensywności sygnału w mózgu widocznego w obrazie T1-zależnym, szczególnie w jądrze zębatym, gałce bladej i wzgórzu. Intensywność sygnału zwiększa się, a dane niekliniczne wykazały, że gadolin jest uwalniany z GdCA o budowie liniowej. 60
7 Ulotka dla pacjenta Punkt 1 Co to jest <Nazwa produktu> i w jakim celu się go stosuje <Nazwa produktu> jest specjalnym środkiem cieniującym (kontrastowym), który zawiera rzadki pierwiastek, gadolin, i którego działanie polega na poprawie jakości obrazowania wątroby mózgu/rdzenia kręgowego, tętnic i innych części ciała podczas badania metodą rezonansu magnetycznego (ang. magnetic resonance imaging, MRI). Ułatwia to lekarzom wykrycie wszelkich nieprawidłowości w wątrobie mózgu/rdzeniu kręgowym, tętnicach i innych częściach ciała pacjenta. Produkt przeznaczony wyłącznie do diagnostyki. <Nazwa produktu> jest dopuszczony do stosowania u dzieci powyżej 2. roku życia. Punkt 2: Informacje ważne przed zastosowaniem leku <nazwa produktu> o Odkładanie się w organizmie <Nazwa produktu> działa, ponieważ zawiera metal o nazwie gadolin. Badania wykazały, że niewielkie ilości gadolinu mogą odkładać się w organizmie, w tym w mózgu. Nie obserwowano działań niepożądanych związanych z odkładaniem się gadolinu w mózgu. Punkt 3 Jak stosować lek <nazwa produktu> <Nazwa produktu> jest wstrzykiwany do żyły, zwykle do żyły w ramieniu, bezpośrednio przed badaniem MRI. Ilość roztworu (ml) wstrzyknięta do żyły zależy od masy ciała pacjenta (wyrażonej w kilogramach). Zalecana dawka to: MRI mózgu/rdzenia kręgowego: 0,2 ml na kilogram masy ciała MRI tętnic: 0,2 ml na kilogram masy ciała MRI wątroby, nerek, dróg moczowych lub nadnerczy: 0,1 ml na kilogram masy ciała MRI piersi, serca lub innych części ciała: 0,2 ml na kilogram masy ciała informacje dla fachowego personelu medycznego: Uzyskiwanie obrazów po podaniu środka kontrastowego: Wątroba Obrazowanie dynamiczne: Obrazowanie opóźnione: Bezpośrednio po wstrzyknięciu bolusa. W okresie od 40 do 120 minut po wstrzyknięciu, zależnie od indywidualnych potrzeb obrazowych. Mózg MRA Piersi W ciągu 60 minut po podaniu. Bezpośrednio po podaniu, z opóźnieniem obrazowania wyliczonym w oparciu o bolus próbny lub metodę automatycznego śledzenia bolusa. Jeżeli nie stosuje się automatycznej sekwencji wykrywania kontrastu w celu synchronizacji z wstrzyknięciem, należy zastosować próbne wstrzyknięcie środka w bolusie o objętości 2 ml w celu wyliczenia odpowiedniego opóźnienia obrazowania. T1-zależna, sekwencja echa gradientowego z rozdzielczością czasową 2 minut lub mniej powinna być uzyskana przed wstrzyknięciem kontrastu i powtórzona kilka razy przez okres 5-8 minut po szybkim wstrzyknięciu dożylnym bolusu kontrastowego. 61
8 Inne części ciała T1-zależna, sekwencja aby osiągnąć albo dynamiczne albo statyczne obrazowanie opóźnione. Przed podaniem <nazwa produktu> zalecane jest objęcie wszystkich pacjentów badaniem w zakresie zaburzeń czynności nerek, obejmującym testy laboratoryjne. Zgłaszano przypadki nerkopochodnego zwłóknienia układowego (ang. Nephrogenic Systemic Fibrosis, NSF) związanego ze stosowaniem niektórych produktów leczniczych zawierających gadolin u pacjentów, u których występuje ostre lub przewlekłe ciężkie zaburzenie czynności nerek (GFR<30 ml/min/1,73 m 2 ). Szczególnie narażeni są pacjenci poddani zabiegowi przeszczepienia wątroby, ponieważ ryzyko wystąpienia ostrej niewydolności nerek w tej grupie jest wysokie. Ze względu na możliwość wystąpienia NSF podczas stosowania produktu leczniczego <nazwa produktu>, należy unikać stosowania tego produktu u pacjentów z ciężkimi zaburzeniami czynności nerek oraz u pacjentów w okołooperacyjnym okresie po przeszczepieniu wątroby, chyba że informacja diagnostyczna jest niezbędna i niedostępna dla badania MRI bez wzmocnienia środkiem kontrastowym. Jeżeli nie można uniknąć zastosowania produktu leczniczego <nazwa produktu>, wówczas dawka nie powinna być większa niż 0,1 mmol/kg masy ciała dla badania MR ośrodkowego układu nerwowego, MRA lub MRI piersi lub MRI całego ciała i nie powinna być większa niż 0,05 mmol/kg masy ciała dla badania MR wątroby, nerek, dróg moczowych lub nadnerczy. Nie należy stosować więcej niż jednej dawki podczas obrazowania z wyjątkiem obrazowania perfuzji mięśnia sercowego, w którym mogą być podane dwie oddzielne dawki 0,05 mmol/kg na masy ciała w trakcie pojedynczego badania. Ze względu na brak danych dotyczących podań wielokrotnych, wstrzyknięć produktu <nazwa produktu> nie powinno się powtarzać, chyba że przerwy pomiędzy wstrzyknięciami wynoszą co najmniej 7 dni. 62
Ulotka dla pacjenta: informacja dla użytkownika. MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych. Dimeglumini gadobenas
 Ulotka dla pacjenta: informacja dla użytkownika MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych Dimeglumini gadobenas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dla pacjenta: informacja dla użytkownika MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych Dimeglumini gadobenas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Aneks III. Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta.
 Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych (Dimeglumini gadobenas)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych (Dimeglumini gadobenas) Należy zapoznać się z treścią ulotki przed zastosowaniem produktu.
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych (Dimeglumini gadobenas) Należy zapoznać się z treścią ulotki przed zastosowaniem produktu.
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
10. DIAGNOSTYKA OBRAZOWA RADIOLOGIA
 10. DIAGNOSTYKA OBRAZOWA 10.1. RADIOLOGIA 1 87.094 RTG nosogardzieli bez kontrastu (1 projekcja) 25,00 zw 25,00 2 87.164 Rtg zatok nosa (1 projekcja) 25,00 zw 25,00 3 87.165 Rtg nosa (1 projekcja) 25,00
10. DIAGNOSTYKA OBRAZOWA 10.1. RADIOLOGIA 1 87.094 RTG nosogardzieli bez kontrastu (1 projekcja) 25,00 zw 25,00 2 87.164 Rtg zatok nosa (1 projekcja) 25,00 zw 25,00 3 87.165 Rtg nosa (1 projekcja) 25,00
Aneks III. Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta.
 Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
Ulotka dołączona do opakowania: informacja dla pacjenta. Omniscan, 0,5 mmol/ml, roztwór do wstrzykiwań. Gadodiamidum
 1 Ulotka dołączona do opakowania: informacja dla pacjenta Omniscan, 0,5 mmol/ml, roztwór do wstrzykiwań Gadodiamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
1 Ulotka dołączona do opakowania: informacja dla pacjenta Omniscan, 0,5 mmol/ml, roztwór do wstrzykiwań Gadodiamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. ProHance, 279,3 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań (Gadoteridolum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA ProHance, 279,3 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań (Gadoteridolum) Należy zapoznać się z treścią ulotki przed zastosowaniem produktu. - Należy zachować
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA ProHance, 279,3 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań (Gadoteridolum) Należy zapoznać się z treścią ulotki przed zastosowaniem produktu. - Należy zachować
Rodzaj działalności leczniczej oraz zakres udzielanych świadczeń zdrowotnych
 Rodzaj działalności leczniczej oraz zakres udzielanych świadczeń zdrowotnych 1. Centrum Medyczne Magnetica prowadzi działalność leczniczą w rodzaju ambulatoryjne świadczenia zdrowotne. 2. Zakres udzielanych
Rodzaj działalności leczniczej oraz zakres udzielanych świadczeń zdrowotnych 1. Centrum Medyczne Magnetica prowadzi działalność leczniczą w rodzaju ambulatoryjne świadczenia zdrowotne. 2. Zakres udzielanych
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. ProHance, 279,3 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań (Gadoteridolum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA ProHance, 279,3 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań (Gadoteridolum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA ProHance, 279,3 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań (Gadoteridolum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks II. Niniejsza Charakterystyka Produktu Leczniczego oraz ulotka dla pacjenta stanowią wynik procedury arbitrażowej.
 Aneks II Zmiany dotyczące odpowiednich punktów Charakterystyki Produktu Leczniczego oraz ulotki dla pacjenta przedstawione przez Europejską Agencję Leków (EMA) Niniejsza Charakterystyka Produktu Leczniczego
Aneks II Zmiany dotyczące odpowiednich punktów Charakterystyki Produktu Leczniczego oraz ulotki dla pacjenta przedstawione przez Europejską Agencję Leków (EMA) Niniejsza Charakterystyka Produktu Leczniczego
JAK BEZPIECZNIE WYKONAĆ? BADANIE PRZY POMOCY REZONANSU MAGNETYCZNEGO
 JAK BEZPIECZNIE WYKONAĆ? BADANIE PRZY POMOCY REZONANSU MAGNETYCZNEGO WSKAZANIA I PRZECIWSKAZANIA KATARZYNA KATULSKA Pracownia Rezonansu Magnetycznego Katedry i Kliniki Kardiologii UM w Poznaniu Zalety
JAK BEZPIECZNIE WYKONAĆ? BADANIE PRZY POMOCY REZONANSU MAGNETYCZNEGO WSKAZANIA I PRZECIWSKAZANIA KATARZYNA KATULSKA Pracownia Rezonansu Magnetycznego Katedry i Kliniki Kardiologii UM w Poznaniu Zalety
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Gadovist 1,0, 1,0 mmol/ml, roztwór do wstrzykiwań. Gadobutrolum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Gadovist 1,0, 1,0 mmol/ml, roztwór do wstrzykiwań Gadobutrolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Gadovist 1,0, 1,0 mmol/ml, roztwór do wstrzykiwań Gadobutrolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Annex I. Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia
 Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie
 22 stycznia 2015 r. EMA/PRAC/63315/2015 Komitet ds. Oceny Ryzyka w ramach Nadzoru nad Bezpieczeństwem Farmakoterapii Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie Przyjęte
22 stycznia 2015 r. EMA/PRAC/63315/2015 Komitet ds. Oceny Ryzyka w ramach Nadzoru nad Bezpieczeństwem Farmakoterapii Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie Przyjęte
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 33 Wnioski naukowe Zgodnie z artykułem 107k dyrektywy 2001/83/WE Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP) uwzględnił zalecenie Komitetu ds. Oceny Ryzyka w Ramach
Aneks II Wnioski naukowe 33 Wnioski naukowe Zgodnie z artykułem 107k dyrektywy 2001/83/WE Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP) uwzględnił zalecenie Komitetu ds. Oceny Ryzyka w Ramach
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań dożylnych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań dożylnych
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA
 ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
Ulotka dołączona do opakowania: informacja dla użytkownika. DOTAREM, 0,5 mmol/ml roztwór do wstrzykiwań w ampułko-strzykawce. Acidum gadotericum
 Ulotka dołączona do opakowania: informacja dla użytkownika DOTAREM, 0,5 mmol/ml roztwór do wstrzykiwań w ampułko-strzykawce Acidum gadotericum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika DOTAREM, 0,5 mmol/ml roztwór do wstrzykiwań w ampułko-strzykawce Acidum gadotericum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy mililitr zawiera 1,0 mmol gadobutrolu (równoważnik 604,72 mg gadobutrolu), który jest substancją czynną.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gadovist 1,0, 1,0 mmol/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy mililitr zawiera 1,0 mmol gadobutrolu (równoważnik
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gadovist 1,0, 1,0 mmol/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy mililitr zawiera 1,0 mmol gadobutrolu (równoważnik
Ulotka dołączona do opakowania: informacja dla użytkownika. DOTAREM, 0,5 mmol/ml roztwór do wstrzykiwań w fiolce Acidum gadotericum
 Ulotka dołączona do opakowania: informacja dla użytkownika DOTAREM, 0,5 mmol/ml roztwór do wstrzykiwań w fiolce Acidum gadotericum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla użytkownika DOTAREM, 0,5 mmol/ml roztwór do wstrzykiwań w fiolce Acidum gadotericum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Cennik Badań Obrazowych Zakład Diagnostyki Obrazowej z Pracownią PET-CT
 Cennik Badań Obrazowych Zakład Diagnostyki Obrazowej z Pracownią PET-CT Mammografia Mammografia jednej piersi 50 Mammografia obu piersi 100 Pozytonowa tomografia emisyjna (PET) Pozytonowa Tomografia Emisyjna
Cennik Badań Obrazowych Zakład Diagnostyki Obrazowej z Pracownią PET-CT Mammografia Mammografia jednej piersi 50 Mammografia obu piersi 100 Pozytonowa tomografia emisyjna (PET) Pozytonowa Tomografia Emisyjna
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omniscan, 0,5 mmol/ml, roztwór do wstrzykiwań 2. SKLAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera gadodiamid 287 mg (0,5 mmol) 5 ml zawiera gadodiamid
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omniscan, 0,5 mmol/ml, roztwór do wstrzykiwań 2. SKLAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera gadodiamid 287 mg (0,5 mmol) 5 ml zawiera gadodiamid
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Ulotka dołączona do opakowania: informacja dla użytkownika. Cyclolux, 0,5 mmol/ml, roztwór do wstrzykiwań. Acidum gadotericum
 Ulotka dołączona do opakowania: informacja dla użytkownika Cyclolux, 0,5 mmol/ml, roztwór do wstrzykiwań Acidum gadotericum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika Cyclolux, 0,5 mmol/ml, roztwór do wstrzykiwań Acidum gadotericum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Ulotka dołączona do opakowania: informacja dla użytkownika. DOTAREM, 0,5 mmol/ml roztwór do wstrzykiwań w fiolce. Acidum gadotericum
 Ulotka dołączona do opakowania: informacja dla użytkownika DOTAREM, 0,5 mmol/ml roztwór do wstrzykiwań w fiolce Acidum gadotericum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla użytkownika DOTAREM, 0,5 mmol/ml roztwór do wstrzykiwań w fiolce Acidum gadotericum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
Badanie piersi metodą rezonansu magnetycznego
 Badanie piersi metodą rezonansu magnetycznego MR Polska Badanie MR piersi, czyli mammografia metodą rezonansu magnetycznego Jest to jedna z podstawowych metod obrazowych stosowanych w diagnostyce gruczołu
Badanie piersi metodą rezonansu magnetycznego MR Polska Badanie MR piersi, czyli mammografia metodą rezonansu magnetycznego Jest to jedna z podstawowych metod obrazowych stosowanych w diagnostyce gruczołu
rezonans magnetyczny informacje dla pacjentów
 rezonans magnetyczny informacje dla pacjentów MR 1 najważniejsze jest zdrowie Dla wygody naszych pacjentów stworzyliśmy portal Wyniki Online, gdzie, bez wychodzenia z domu, można odebrać wyniki badania
rezonans magnetyczny informacje dla pacjentów MR 1 najważniejsze jest zdrowie Dla wygody naszych pacjentów stworzyliśmy portal Wyniki Online, gdzie, bez wychodzenia z domu, można odebrać wyniki badania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omniscan, 0,5 mmol/ml, roztwór do wstrzykiwań 2. SKLAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera gadodiamid 287 mg (0,5 mmol) 5 ml zawiera gadodiamid
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omniscan, 0,5 mmol/ml, roztwór do wstrzykiwań 2. SKLAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera gadodiamid 287 mg (0,5 mmol) 5 ml zawiera gadodiamid
Aneks III. Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i ulotki dla pacjenta
 Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i ulotki dla pacjenta Uwaga: Może wyniknąć potrzeba dokonania kolejnych aktualizacji Charakterystyki Produktu Leczniczego i
Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i ulotki dla pacjenta Uwaga: Może wyniknąć potrzeba dokonania kolejnych aktualizacji Charakterystyki Produktu Leczniczego i
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
Moc Gatunki zwierząt. Postać farmaceutyczna. Samice psów. Enurace 50 Tabletki 50 mg
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę.
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy mililitr zawiera 1,0 mmol gadobutrolu (równoważnik 604,72 mg gadobutrolu ), który jest substancją czynną.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gadovist 1,0, 1,0 mmol/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy mililitr zawiera 1,0 mmol gadobutrolu (równoważnik
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gadovist 1,0, 1,0 mmol/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy mililitr zawiera 1,0 mmol gadobutrolu (równoważnik
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Pacjent SOR w aspekcie ochrony radiologicznej - kobiety w ciąży. dr Piotr Pankowski
 Pacjent SOR w aspekcie ochrony radiologicznej - kobiety w ciąży dr Piotr Pankowski Ustawa z dnia 29 listopada 2000 r. Prawo atomowe (Dz. U. 2012.264) Art. 33c 6. Dzieci, kobiety w wieku rozrodczym, kobiety
Pacjent SOR w aspekcie ochrony radiologicznej - kobiety w ciąży dr Piotr Pankowski Ustawa z dnia 29 listopada 2000 r. Prawo atomowe (Dz. U. 2012.264) Art. 33c 6. Dzieci, kobiety w wieku rozrodczym, kobiety
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ProHance, 279,3 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera: 279,3 mg/ml gadoteridolu.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ProHance, 279,3 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera: 279,3 mg/ml gadoteridolu.
Zaobserwowano częstsze przypadki stosowania produktu leczniczego Vistide w niezatwierdzonych wskazaniach i (lub) drogach podawania.
 Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
Aneks III. Zmiany w odnośnych punktach druków informacyjnych do produktów
 Aneks III Zmiany w odnośnych punktach druków informacyjnych do produktów Uwaga: Zmiany wprowadzone w odnośnych punktach druków informacyjnych do produktów są efektem przeprowadzenia procedury przekazania
Aneks III Zmiany w odnośnych punktach druków informacyjnych do produktów Uwaga: Zmiany wprowadzone w odnośnych punktach druków informacyjnych do produktów są efektem przeprowadzenia procedury przekazania
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. DOTAREM multidose, 0,5 mmol/ml, roztwór do wstrzykiwań w fiolce (do wielokrotnego użycia)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DOTAREM multidose, 0,5 mmol/ml, roztwór do wstrzykiwań w fiolce (do wielokrotnego użycia) 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DOTAREM multidose, 0,5 mmol/ml, roztwór do wstrzykiwań w fiolce (do wielokrotnego użycia) 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych (Dimeglumini gadobenas) 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych (Dimeglumini gadobenas) 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dotagraf multidose, 0,5 mmol/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 279,32 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dotagraf multidose, 0,5 mmol/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 279,32 mg
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA
 ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DOTAREM, 0,5 mmol/ml, roztwór do wstrzykiwań w fiolce 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 279,32 mg kwasu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DOTAREM, 0,5 mmol/ml, roztwór do wstrzykiwań w fiolce 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 279,32 mg kwasu
tomografia komputerowa informacje dla pacjentów
 tomografia komputerowa informacje dla pacjentów TK najważniejsze jest zdrowie W placówkach Affidea sukcesywnie wdrażamy program Dose Excellence. Pozwala to na gromadzenie i analizę danych wszystkich badań,
tomografia komputerowa informacje dla pacjentów TK najważniejsze jest zdrowie W placówkach Affidea sukcesywnie wdrażamy program Dose Excellence. Pozwala to na gromadzenie i analizę danych wszystkich badań,
CENNIK PROCEDUR MEDYCZNYCH WYKONYWANYCH W PRACOWNI ULTRASONOGRAFII ŚWIĘTOKRZYSKIEGO CENTRUM ONKOLOGII W KIELCACH NA 2019 ROK
 1 USG tarczycy 60,00 2 USG piersi 90,00 3 USG worka mosznowego 70,00 4 USG dołów pachowych, nad i podobojczykowych 60,00 5 USG jam opłucnych i worka osierdziowego 60,00 6 USG blizn pooperacyjnych 60,00
1 USG tarczycy 60,00 2 USG piersi 90,00 3 USG worka mosznowego 70,00 4 USG dołów pachowych, nad i podobojczykowych 60,00 5 USG jam opłucnych i worka osierdziowego 60,00 6 USG blizn pooperacyjnych 60,00
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych (Dimeglumini gadobenas)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych (Dimeglumini gadobenas) 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MultiHance, 529 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań dożylnych (Dimeglumini gadobenas) 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu
Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego
 C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
Wykorzystanie zjawiska rezonansu magnetycznego w medycynie. Mariusz Grocki
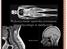 Wykorzystanie zjawiska rezonansu magnetycznego w medycynie. Mariusz Grocki [1] WYŚCIG DO TYTUŁU ODKRYWCY. JĄDRO ATOMU W ZEWNĘTRZNYM POLU MAGNETYCZNYM. Porównanie do pola grawitacyjnego. CZYM JEST ZJAWISKO
Wykorzystanie zjawiska rezonansu magnetycznego w medycynie. Mariusz Grocki [1] WYŚCIG DO TYTUŁU ODKRYWCY. JĄDRO ATOMU W ZEWNĘTRZNYM POLU MAGNETYCZNYM. Porównanie do pola grawitacyjnego. CZYM JEST ZJAWISKO
Cena brutto w zł RTG nosogardzieli bez kontrastu (1 projekcja) Rtg nosa (1 projekcja) Rodzaj usługi
 Zarz. Dyr. SP ZOZ MSWiA z W-M CO w Olsztynie nr 9 z dnia 15 stycznia 2019 roku 4. DIAGNOSTYKA OBRAZOWA 4.1. RADIOLOGIA 1 87.094 RTG nosogardzieli bez kontrastu (1 projekcja) 2 87.164 Rtg zatok nosa (1
Zarz. Dyr. SP ZOZ MSWiA z W-M CO w Olsztynie nr 9 z dnia 15 stycznia 2019 roku 4. DIAGNOSTYKA OBRAZOWA 4.1. RADIOLOGIA 1 87.094 RTG nosogardzieli bez kontrastu (1 projekcja) 2 87.164 Rtg zatok nosa (1
Badanie piersi metodą rezonansu magnetycznego
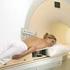 Badanie piersi metodą rezonansu magnetycznego MR Polska Badanie MR piersi, czyli mammografia metodą rezonansu magnetycznego Jest to jedna z podstawowych metod obrazowych stosowanych w diagnostyce gruczołu
Badanie piersi metodą rezonansu magnetycznego MR Polska Badanie MR piersi, czyli mammografia metodą rezonansu magnetycznego Jest to jedna z podstawowych metod obrazowych stosowanych w diagnostyce gruczołu
LP. NAZWA BADANIA CENA W PLN
 SZPITAL UNIWERSYTECKI NR 2 IM. DR JANA BIZIELA W BYDGOSZCZY ZAKŁAD RADIOLOGII I DIAGNOSTYKI OBRAZOWEJ CENNIK ZEWNĘTRZNY BADAŃ DIAGNOSTYCZNYCH I KONSULTACJI SPECJALISTYCZNYCH NA ROK 2018 Załącznik nr 1
SZPITAL UNIWERSYTECKI NR 2 IM. DR JANA BIZIELA W BYDGOSZCZY ZAKŁAD RADIOLOGII I DIAGNOSTYKI OBRAZOWEJ CENNIK ZEWNĘTRZNY BADAŃ DIAGNOSTYCZNYCH I KONSULTACJI SPECJALISTYCZNYCH NA ROK 2018 Załącznik nr 1
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Gadopentetate Dimeglumine Sanochemia, 469 mg/ml, roztwór do wstrzykiwań Gadopentetate dimeglumine
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Gadopentetate Dimeglumine Sanochemia, 469 mg/ml, roztwór do wstrzykiwań Gadopentetate dimeglumine Należy zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Gadopentetate Dimeglumine Sanochemia, 469 mg/ml, roztwór do wstrzykiwań Gadopentetate dimeglumine Należy zapoznać się z treścią ulotki przed zastosowaniem
Aneks III. Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
 Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
ZAKŁAD DIAGNOSTYKI OBRAZOWEJ
 ZAKŁAD DIAGNOSTYKI OBRAZOWEJ PRACOWNIA RTG 1. Czaszka twarzoczaszka 70,00 2. Czaszka oczodoły 70,00 3. Czaszka zatoki 70,00 4. Czaszka żuchwa PA boczna 100,00 5. Czaszka PA i prawoboczne 100,00 6. Czaszka
ZAKŁAD DIAGNOSTYKI OBRAZOWEJ PRACOWNIA RTG 1. Czaszka twarzoczaszka 70,00 2. Czaszka oczodoły 70,00 3. Czaszka zatoki 70,00 4. Czaszka żuchwa PA boczna 100,00 5. Czaszka PA i prawoboczne 100,00 6. Czaszka
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA
 ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 25 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 25 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
CIBA-GEIGY Sintrom 4
 CIBA-GEIGY Sintrom 4 Sintrom 4 Substancja czynna: 3-[a-(4-nitrofenylo-)-0- -acetyloetylo]-4-hydroksykumaryna /=acenocoumarol/. Tabletki 4 mg. Sintrom działa szybko i jest wydalany w krótkim okresie czasu.
CIBA-GEIGY Sintrom 4 Sintrom 4 Substancja czynna: 3-[a-(4-nitrofenylo-)-0- -acetyloetylo]-4-hydroksykumaryna /=acenocoumarol/. Tabletki 4 mg. Sintrom działa szybko i jest wydalany w krótkim okresie czasu.
REGULAMIN ORGANIZACYJNY
 REGULAMIN ORGANIZACYJNY Centrum Medycznego Magnetica sp. z o.o. podmiotu leczniczego wykonującego działalność leczniczą w Zakładzie Leczniczym Centrum Medycznym Magnetica Na podstawie art. 23 i 24 ustawy
REGULAMIN ORGANIZACYJNY Centrum Medycznego Magnetica sp. z o.o. podmiotu leczniczego wykonującego działalność leczniczą w Zakładzie Leczniczym Centrum Medycznym Magnetica Na podstawie art. 23 i 24 ustawy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Clariscan, 0,5 mmol/ml, roztwór do wstrzykiwań Clariscan, 0,5 mmol/ml, roztwór do wstrzykiwań w ampułko-strzykawce 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Clariscan, 0,5 mmol/ml, roztwór do wstrzykiwań Clariscan, 0,5 mmol/ml, roztwór do wstrzykiwań w ampułko-strzykawce 2. SKŁAD JAKOŚCIOWY
ZDJĘCIA KONWENCJONALNE. Rtg całego kręgosłupa (ap) 35,00. Rtg czaszki (ap+bok) 40,00. Rtg jamy brzusznej (ap) 40,00. Rtg klatki piersiowej (pa) 35,00
 Obowiązuje od 02.01.2018 r. CENNIK USŁUG MEDYCZNYCH ZAKŁADU DIAGNOSTYKI OBRAZOWEJ I RADIOLOGII INTERWENCYJNEJ Lp. Nazwa usługi ZDJĘCIA KONWENCJONALNE Cena w PLN 1. 2. 3. 4. 5. 6. 7. Rtg całego kręgosłupa
Obowiązuje od 02.01.2018 r. CENNIK USŁUG MEDYCZNYCH ZAKŁADU DIAGNOSTYKI OBRAZOWEJ I RADIOLOGII INTERWENCYJNEJ Lp. Nazwa usługi ZDJĘCIA KONWENCJONALNE Cena w PLN 1. 2. 3. 4. 5. 6. 7. Rtg całego kręgosłupa
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Magnevist, 469 mg/ml, roztwór do wstrzykiwań. Dimeglumini gadopentetas
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Magnevist, 469 mg/ml, roztwór do wstrzykiwań Dimeglumini gadopentetas Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Magnevist, 469 mg/ml, roztwór do wstrzykiwań Dimeglumini gadopentetas Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę,
Międzynarodowa nazwa. niezastrzeżona (INN) Ferri hydroxidum dextranum
 Aneks I 1 Państwo członkowskie Podmiot odpowiedzialny posiadający pozwolenie Kontakt z lokalnym Międzynarodowa nazwa Nazwa własna Moc Postać farmaceutyczna Droga podania (w EOG) na dopuszczenie do obrotu
Aneks I 1 Państwo członkowskie Podmiot odpowiedzialny posiadający pozwolenie Kontakt z lokalnym Międzynarodowa nazwa Nazwa własna Moc Postać farmaceutyczna Droga podania (w EOG) na dopuszczenie do obrotu
Katowice r. Do wszystkich Oferentów
 0-752 Katowice, ul. Medyków 6 tel. 0-2-207-8-00, fax. 0-2- 207-5-6 REGON: 5000; NIP: 6-2-6-590 WYDANIE: 20 Obowiązuje od 2.0.2009 Katowice.05.20r. Do wszystkich Oferentów Jednocześnie Organizator wyjaśnia,
0-752 Katowice, ul. Medyków 6 tel. 0-2-207-8-00, fax. 0-2- 207-5-6 REGON: 5000; NIP: 6-2-6-590 WYDANIE: 20 Obowiązuje od 2.0.2009 Katowice.05.20r. Do wszystkich Oferentów Jednocześnie Organizator wyjaśnia,
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
CENNIK BADAŃ DIAGNOSTYCZNYCH ZAKŁAD RADIOLOGII
 CENNIK BADAŃ DIAGNOSTYCZNYCH ZAKŁAD RADIOLOGII LP KOD ICD-9 Nazwa procedury Cena badania w zł Pracownia radiologii (rtg) 1 87.04.1 Tomografia siodła tureckiego 64,00 2 87.092 RTG krtani bez kontrastu (zdjęcia
CENNIK BADAŃ DIAGNOSTYCZNYCH ZAKŁAD RADIOLOGII LP KOD ICD-9 Nazwa procedury Cena badania w zł Pracownia radiologii (rtg) 1 87.04.1 Tomografia siodła tureckiego 64,00 2 87.092 RTG krtani bez kontrastu (zdjęcia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO 0,9% Sodium Chloride Braun, 9 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera Chlorek sodu Stężenia elektrolitów:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO 0,9% Sodium Chloride Braun, 9 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera Chlorek sodu Stężenia elektrolitów:
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 16 Wnioski naukowe Haldol, który zawiera substancję czynną haloperydol, jest lekiem przeciwpsychotycznym należącym do grupy pochodnych butyrofenonu. Jest silnym antagonistą ośrodkowych
Aneks II Wnioski naukowe 16 Wnioski naukowe Haldol, który zawiera substancję czynną haloperydol, jest lekiem przeciwpsychotycznym należącym do grupy pochodnych butyrofenonu. Jest silnym antagonistą ośrodkowych
Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania
 Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania Uwaga: Poniższe zmiany należy dodać do ważnej Charakterystyki Produktu Leczniczego, oznakowania i ulotki dla pacjenta,
Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania Uwaga: Poniższe zmiany należy dodać do ważnej Charakterystyki Produktu Leczniczego, oznakowania i ulotki dla pacjenta,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ProHance, 279,3 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera: 279,3 mg/ml gadoteridolu.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ProHance, 279,3 mg/ml (0,5 mmol/ml), roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera: 279,3 mg/ml gadoteridolu.
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH
 WOREK 10 KG 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY proszek do sporządzania roztworu na skórę produkt złożony 2. ZAWARTOŚĆ SUBSTANCJI CZYNNYCH Co zawiera Ciechociński szlam leczniczy
WOREK 10 KG 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY proszek do sporządzania roztworu na skórę produkt złożony 2. ZAWARTOŚĆ SUBSTANCJI CZYNNYCH Co zawiera Ciechociński szlam leczniczy
1. MR głowy bez kontrastu 420,00zł. 2. MR głowy z kontrastem 600,00zł. 3. MR przysadki mózgowej z kontrastem badanie dynamiczne 500,00zł
 V. CENNIK USŁUG PRACOWNI REZONANSU MAGNETYCZNEGO (CENY OBOWIĄZUJĄCE DLA PACJENTÓW NIEUPRAWNIONYCH DO BEZPŁATNYCH ŚWIADCZEŃ ZDROWOTNYCH) LP. WYSZCZEGÓLNIENIE RODZAJ BADANIA CENA NETTO BADANIA* 1. MR głowy
V. CENNIK USŁUG PRACOWNI REZONANSU MAGNETYCZNEGO (CENY OBOWIĄZUJĄCE DLA PACJENTÓW NIEUPRAWNIONYCH DO BEZPŁATNYCH ŚWIADCZEŃ ZDROWOTNYCH) LP. WYSZCZEGÓLNIENIE RODZAJ BADANIA CENA NETTO BADANIA* 1. MR głowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
ŚWIADCZENIA TOMOGRAFII KOMPUTEROWEJ. Kod. Lp. ICD TK głowy bez środka kontrastującego 1. Personel:
 ZALECENIA POLSKIEGO LEKARSKIEGO TOWARZYSTWA RADIOLOGICZNEGO DOTYCZĄCE MIMINAMLNYCH WYMAGAŃ DLA PRACOWNI TOMOGRAFII KOMUPTEROWEJ (TK) I REZONANSU MAGNETYCZNEGO (MR) DO WYKONYWANIA POSZCZEGÓLNYCH TYPÓW BADAŃ
ZALECENIA POLSKIEGO LEKARSKIEGO TOWARZYSTWA RADIOLOGICZNEGO DOTYCZĄCE MIMINAMLNYCH WYMAGAŃ DLA PRACOWNI TOMOGRAFII KOMUPTEROWEJ (TK) I REZONANSU MAGNETYCZNEGO (MR) DO WYKONYWANIA POSZCZEGÓLNYCH TYPÓW BADAŃ
Ulotka dołączona do opakowania: informacja dla pacjenta. EXACYL, 100 mg/ml, roztwór do wstrzykiwań Acidum tranexamicum
 Ulotka dołączona do opakowania: informacja dla pacjenta EXACYL, 100 mg/ml, roztwór do wstrzykiwań Acidum tranexamicum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta EXACYL, 100 mg/ml, roztwór do wstrzykiwań Acidum tranexamicum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
ZAKŁAD DIAGNOSTYKI OBRAZOWEJ Cennik badań
 ZAKŁAD DIAGNOSTYKI OBRAZOWEJ Cennik badań Badania RTG 1 Zdjęcia klatki piersiowej ( p-a lub boczne) 2 40,00 2 Zdjęcie przeglądowe jamy brzusznej - 30,00 3 Zdjęcie czaszki 2 40,00 4 Zdjęcie celowane siodełka
ZAKŁAD DIAGNOSTYKI OBRAZOWEJ Cennik badań Badania RTG 1 Zdjęcia klatki piersiowej ( p-a lub boczne) 2 40,00 2 Zdjęcie przeglądowe jamy brzusznej - 30,00 3 Zdjęcie czaszki 2 40,00 4 Zdjęcie celowane siodełka
ZAKŁAD RADIOLOGII. Nazwa procedury
 CENNIK BADAŃ DIAGNOSTYCZNYCH ZAKŁAD RADIOLOGII (Obowiązuje od 1.08.2014r.) Pracownie Radiologii Nazwa procedury jednostkowa 1 87.04.1 Tomografia siodła tureckiego 68,00 2 87.092 RTG krtani bez kontrastu
CENNIK BADAŃ DIAGNOSTYCZNYCH ZAKŁAD RADIOLOGII (Obowiązuje od 1.08.2014r.) Pracownie Radiologii Nazwa procedury jednostkowa 1 87.04.1 Tomografia siodła tureckiego 68,00 2 87.092 RTG krtani bez kontrastu
Aneks III. Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta
 Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
ABC tomografii komputerowej
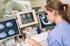 ABC tomografii komputerowej Tomografia (od gr.: tome cięcie i grafein pisanie) metoda pozwalająca na uzyskiwanie obrazów przekrojów badanej okolicy ciała. Określenie o szerokim znaczeniu, najczęściej kojarzone
ABC tomografii komputerowej Tomografia (od gr.: tome cięcie i grafein pisanie) metoda pozwalająca na uzyskiwanie obrazów przekrojów badanej okolicy ciała. Określenie o szerokim znaczeniu, najczęściej kojarzone
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
RADIOLOGIA KONWENCJONALNA
 Powrót do ZDO INFORMACJE DLA PACJENTÓW ZDO SPIS TREŚCI RADIOLOGIA KONWENCJONALNA... 1 NAJCZĘSTSZE BADANIA RADIOLOGICZNE... 2 Badania kości... 2 Badania narządów klatki piersiowej... 2 PRZYGOTOWANIE DO
Powrót do ZDO INFORMACJE DLA PACJENTÓW ZDO SPIS TREŚCI RADIOLOGIA KONWENCJONALNA... 1 NAJCZĘSTSZE BADANIA RADIOLOGICZNE... 2 Badania kości... 2 Badania narządów klatki piersiowej... 2 PRZYGOTOWANIE DO
lek. wet. Joanna Głodek Katedra Chirurgii i Rentgenologii z Kliniką Wydział Medycyny Weterynaryjnej Uniwersytet Warmińsko Mazurski w Olsztynie
 lek. wet. Joanna Głodek Katedra Chirurgii i Rentgenologii z Kliniką Wydział Medycyny Weterynaryjnej Uniwersytet Warmińsko Mazurski w Olsztynie W medycynie ludzkiej rezonans magnetyczny (RM) jest jedną
lek. wet. Joanna Głodek Katedra Chirurgii i Rentgenologii z Kliniką Wydział Medycyny Weterynaryjnej Uniwersytet Warmińsko Mazurski w Olsztynie W medycynie ludzkiej rezonans magnetyczny (RM) jest jedną
CENNIK USŁUG MEDYCZNYCH ZAKŁADU DIAGNOSTYKI OBRAZOWEJ I RADIOLOGII INTERWENCYJNEJ NA ROK 2017
 Lp. CENNIK USŁUG MEDYCZNYCH ZAKŁADU DIAGNOSTYKI OBRAZOWEJ I RADIOLOGII INTERWENCYJNEJ NA ROK 2017 Nazwa usługi ZDJĘCIA KONWENCJONALNE Cena w PLN 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17.
Lp. CENNIK USŁUG MEDYCZNYCH ZAKŁADU DIAGNOSTYKI OBRAZOWEJ I RADIOLOGII INTERWENCYJNEJ NA ROK 2017 Nazwa usługi ZDJĘCIA KONWENCJONALNE Cena w PLN 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17.
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta
 Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
