(86) Data i numer zgłoszenia międzynarodowego: , PCT/US02/ (87) Data i numer publikacji zgłoszenia międzynarodowego:
|
|
|
- Martyna Wróblewska
- 7 lat temu
- Przeglądów:
Transkrypt
1 PL B1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) (21) Numer zgłoszenia: (22) Data zgłoszenia: (86) Data i numer zgłoszenia międzynarodowego: , PCT/US02/ (87) Data i numer publikacji zgłoszenia międzynarodowego: , WO02/ (13) B1 (51) Int.Cl. A61K 39/285 ( ) C12N 7/00 ( ) Opis patentowy przedrukowano ze względu na zauważone błędy (54) Kompozycje farmaceutyczne (30) Pierwszeństwo: , US, 09/840,751 (73) Uprawniony z patentu: Sanofi Pasteur Biologics Co., Cambridge, US (43) Zgłoszenie ogłoszono: BUP 19/05 (72) Twórca(y) wynalazku: RICHARD A. WELTZIN, Lunenburg, US THOMAS P. MONATH, Harvard, US (45) O udzieleniu patentu ogłoszono: WUP 08/12 (74) Pełnomocnik: rzecz. pat. Marta Kawczyńska
2 2 PL B1 Opis wynalazku Przedmiotem niniejszego wynalazku są kompozycje farmaceutyczne, zawierające klonalny szczep atenuowanego wirusa krowianki lub jego wirusa potomnego, do stosowania przy szczepieniu przeciwko ospie prawdziwej. Stan techniki Wirus ospy, wywołujący ospę prawdziwą (ang. smallpox virus), należy do rodzaju Orthopoxvirus, do którego należą również wirusy ospy małpiej, ospy krowiej i krowianki. Choroba wywoływana przez główne szczepy wirusa ospy wielkiej (ang. viariola major) cechuje się małą dawką zakaźną ( wirionów), długim okresem inkubacji (średnio 12 dni), gorączką, objawami konstytucjonalnymi, wysypką postępującą do stadium krost, zejściem śmiertelnym niemal 30% osób zakażonych, zaś u osób, które przeżyją pozostawia blizny na twarzy. Choroba szerzy się z człowieka na człowieka drogą oddechową przez kontakt (drogą kropelkową) i ewentualnie przez aerozol. Ospa prawdziwa była jedną z najważniejszych przyczyn chorobowości i umieralności na całym świecie w pierwszej połowie XX wieku. Jednakże, po części z uwagi na brak zwierzęcego rezerwuaru wirusa, systematyczne stosowanie szczepień (żywym, atenuowanym wirusem krowianki) okazało się bardzo skuteczne w zwalczaniu tej choroby. I tak, wdrożony w latach globalny program eradykacji ospy prawdziwej spowodował wyeliminowanie choroby ze źródeł naturalnych (Fenner i wsp., WHO, Genewa, str. 1460, 1988). Ze względu na nieobecność ospy prawdziwej i ryzyko wystąpienia zdarzeń niepożądanych przy stosowaniu szczepionki zaprzestano rutynowego szczepienia dzieci, personelu szpitalnego i wojskowego, i obecnie immunizacji poddaje się tylko osoby pracujące z wirusami krowianki i wirusami pokrewnymi w laboratoriach. Znaczna część populacji świata nie ma zatem odporności na ospę prawdziwą. Pozostała część populacji ma niewielką odporność resztkową, ponieważ odporność przeciwko ospie utrzymuje się jedynie przez 5 lat po pierwszym szczepieniu i mniej niż przez 20 lat po szczepieniu ponownym. Eradykacja ospy prawdziwej i zaprzestanie szczepień spowodowały więc podatność populacji na skryty atak lub użycie broni biologicznej wykorzystującej wirusa ospy. W przypadku, gdyby wystąpiło takie zdarzenie, bariera immunologiczna populacji byłaby niewystarczająca do opanowania szerzenia się epidemii (Anon. (artykuł redakcyjny), Lancet 353:1539, 1999; Henderson, Science 283: , 1999, Henderson i wsp., J.A.M.A. 281: , 1999). Ze względu na niepewność w zakresie eradykacji ospy prawdziwej pozostawiono zapasy szczepionki do zastosowania w sytuacji zagrożenia. W Stanach Zjednoczonych, na przykład, początkowo zmagazynowano fiolek szczepionki (nominalnie 15,5 miliona dawek) produkcji Wyeth Laboratories, pod kontrolą Ośrodków kontroli i profilaktyki chorób (Centers for Disease Control and Prevention - CDC) w Atlancie w stanie Georgia (Stany Zjednoczone). Na spotkaniu Narodowej Komisji Doradczej ds. Szczepionek (National Vaccines Advisory Commitee) w styczniu 1999, CDC przedstawił raport ze stanu narodowego depozytu szczepionki przeciwko ospie prawdziwej. W tym czasie spośród 15,5 miliona dawek, przechowywanych przez firmę Wyeth, 3,4 miliona dawek nie przeszło testów kontroli jakości, natomiast 10,3 miliona przekroczyło termin ważności wyznaczony w ostatnim teście kontrolnym, służącym przedłużeniu terminu ważności, zaś pozostałe 1,7 miliona dawek spełniało wymogi specyfikacji produktu (LeDuc, prezentacja dla Narodowej Komisji Doradczej ds. Szczepionek, Waszyngton D.C., stycznia 1999). Oprócz niedostatecznej podaży szczepionek, problemem jest to, że szczepionka pakowana jest w fiolki po 100 dawek, co ogranicza dystrybucję i zwiększa prawdopodobieństwo zmarnowania znacznej ilości produktu w sytuacji nagłej. Oprócz zasobów Stanów Zjednoczonych, pewien zapas szczepionki (Lister, szczep Elstree) przechowywany jest w Narodowym Instytucie Zdrowia Publicznego (National Institute of Public Health), w Bilthoven, w Holandii; również niektóre inne kraje mają zapasy szczepionki przeciwko ospie prawdziwej - w momencie eredykacji ospy zapasy te sięgały 300 milionów dawek. Jednakże problemy podobnej natury, związane ze stabilnością przy przechowywaniu, ograniczyły te zapasy do niespełna 50 milionów dawek (Henderson, Science 283: , 1999). Krótki opis wynalazku Przedmiotem niniejszego wynalazku jest kompozycja farmaceutyczna, charakteryzująca się tym, że zawiera: (i) klonalny szczep atenuowanego wirusa krowianki, który wyizolowany jest z hodowli komórek, w której hodowano ACAM 1000 (nr depozytu ATCC PTA-3321) lub jego wirusa potomnego, i po podaniu człowiekowi w ilości skutecznej do wywoływania ochronnej lub terapeutycznej odpowiedzi
3 PL B1 3 immunologicznej przeciwko wirusowi ospy prawdziwej u tego człowieka, wykazuje u tego człowieka odpowiednią atenuację, oraz (ii) farmaceutycznie dopuszczalny nośnik lub rozcieńczalnik, przy czym: - wspomniany wirus krowianki ma taką samą zjadliwość, jak szczep wirusa krowianki ACAM1000 (nr depozytu ATCC PTA-3321), - wspomniany wirus krowianki ma taką samą immunogenność, jak szczep wirusa krowianki ACAM1000 (nr depozytu ATCC PTA-3321), i - wspomniany wirus krowianki ma taki sam wzorzec trawienia jak szczep wirusa krowianki ACAM1000 (nr depozytu ATCC PTA-3321) po trawieniu endonukleazą restrykacyjną. Korzystnie wspomniany szczep wirusa krowianki ma taką samą zjadliwość jak Dryvax. Korzystnie wspomniany szczep wirusa krowianki ma taką samą immunogenność jak Dryvax. Korzystnie wspomniany szczep wirusa krowianki wytwarzany jest w ilości takiej samej lub większej niż Dryvax po inokulacji do hodowli komórkowych. Korzystnie wspomniany szczep wirusa krowianki ma taki sam wzorzec trawienia jak Dryvax po trawieniu endonukleazą restrykcyjną. Korzystnie wspomniany szczep wirusa krowianki wytwarzany jest w ilości takiej samej lub większej niż ACAM1000 (nr depozytu ATCC PTA-3321) po inokulacji do hodowli komórkowych Korzystnie wspomniany szczep wirusa krowianki stanowi ACAM 1000 (nr depozytu ATCC PTA-3321). Korzystnie kompozycja ta przeznaczona jest do leczenia zakażenia wirusem ospy prawdziwej u pacjenta. Przedmiotem wynalazku jest ponadto kompozycja farmaceutyczna, charakteryzująca się tym, że zawiera: (i) klonalny szczep atenuowanego wirusa krowianki, który wyizolowany jest z hodowli komórek, w której hodowano Dryvax albo ACAM 1000 (nr depozytu ATCC PTA-3321) lub jego wirusa potomnego i, po podaniu człowiekowi w ilości skutecznej do wywoływania ochronnej lub terapeutycznej odpowiedzi immunologicznej przeciwko wirusowi ospy prawdziwej u tego człowieka, wykazuje u tego człowieka odpowiednią atenuację, oraz, (ii) farmaceutycznie dopuszczalny nośnik lub rozcieńczalnik, przy czym wspomniana kompozycja przeznaczona jest do zastosowania w leczeniu lub profilaktyce zakażenia wirusem ospy prawdziwej u pacjenta, i przy czym - wspomniany wirus krowianki ma taką samą zjadliwość, jak szczep wirusa krowianki ACAM 1000 (nr depozytu ATCC PTA-3321), - wspomniany wirus krowianki ma taką samą immunogenność, jak szczep wirusa krowianki ACAM1000 (nr depozytu ATCC PTA-3321), i - wspomniany wirus krowianki ma taki sam wzorzec trawienia jak szczep wirusa krowianki ACAM1000 (nr depozytu ATCC PTA-3321) po trawieniu endonukleazą restrykacyjną. Korzystnie wspomniana kompozycja przeznaczona jest do podawania wspomnianemu pacjentowi przez skaryfikację. Korzystnie wspomniana kompozycja przeznaczona jest do podawania wspomnianemu pacjentowi w ilości w zakresie od 1x10 4 do 1x10 6 jednostek tworzących łysinki. Zgodnie z wynalazkiem dostarczono stabilne szczepy wirusa krowianki, izolowane z pochodzących z hodowli komórek, w których hodowano Dryvax, które to szczepy mają cechy umożliwiające ich zastosowanie, jako szczepionki przeciwko ospie prawdziwej do stosowania u człowieka. Zgodnie z niniejszym wynalazkiem opisano również sposoby wytwarzania tych szczepów oraz sposoby ich zastosowania do zapobiegania zakażeniom ospą prawdziwą i zachorowaniom na ospę prawdziwą. Zgodnie z tym, w pierwszym aspekcie dostarczono klonalny szczep atenuowanego wirusa krowianki, izolowany z komórek pochodzących z hodowli, w której hodowano Dryvax, i który po podaniu człowiekowi w ilości skutecznej do wywołania ochronnej lub terapeutycznej odpowiedzi immunologicznej przeciwko wirusowi ospy prawdziwej u człowieka, wykazuje dostateczną atenuację w organizmie człowieka. Szczepy klonalne mogą mieć, na przykład, w zasadzie taką samą zjadliwość (wirulencję) i/lub immunogenność jak Dryvax. Wirusa krowianki dogodnie wytwarza się w zasadzie w takiej samej lub większej ilości niż Dryvax po inokulacji do hodowli komórek i/lub wykazuje on w zasadzie taki sam wzorzec trawienia jak Dryvax po trawieniu endonukleazą restrykcyjną. Klonalny szczep może również wykazywać, na przykład, w zasadzie taką samą zjadliwość i/lub immunogenność, jak szczep wirusa krowianki ACAM 1000 (zdeponowany pod numerem ATCC
4 4 PL B1 PTA kwietnia 2001; zob. klon 2, poniżej), przy badaniu w odpowiednich modelach zwierzęcych lub u człowieka. Korzystniej, taki wirus krowianki wytwarza się w zasadzie w takiej samej lub większej ilości niż szczep wirusa krowianki ACAM 1000 po inokulacji do hodowli komórek i/lub wykazuje w zasadzie taki sam wzorzec trawienia, jak szczep wirusa krowianki ACAM 1000 po trawieniu endonukleazą restrykcyjną. Jednym z przykładów opisanego tu wirusa krowianki jest ACAM 1000 (numer depozytu ATCC PTA-3321). W drugim aspekcie przedmiotem niniejszego wynalazku jest kompozycja farmaceutyczna zawierająca klonalny szczep wirusa krowianki, jak to opisano powyżej i w dalszej części niniejszego opisu, i farmaceutycznie dopuszczalny nośnik lub rozcieńczalnik. W trzecim aspekcie opisano tu sposób zapobiegania zakażeniu wirusem ospy prawdziwej lub leczenia zakażenia wirusem ospy prawdziwej u pacjenta poprzez podawanie pacjentowi takiej kompozycji farmaceutycznej, jak również zastosowanie takiej kompozycji do tego celu oraz zastosowanie takiej kompozycji do wytwarzania leku do tego celu. Kompozycję farmaceutyczną można podawać pacjentowi, na przykład, poprzez skaryfikację w ilości wynoszącej, na przykład, od 1x10 4 do 1x10 6 jednostek tworzących łysinki. W czwartym aspekcie opisano tu sposób wytwarzania klonalnego szczepu atenuowanego wirusa krowianki do zastosowania jako szczepionka. Sposób ten obejmuje: (i) namnażanie Dryvax w układzie hodowli komórkowej i, (ii) izolowanie z układu hodowli komórkowej klonalnego szczepu wirusa krowianki, wykazującego w zasadzie taką samą zjadliwość, immunogenność, charakterystykę wzrostu w hodowli lub wzorzec trawienia endonukleazą restrykcyjną jak Dryvax lub szczep wirusa krowianki ACAM Zjadliwość wirusa krowianki można badać tym sposobem, na przykład w teście na skórze królika lub w teście neurowirulencji osesków mysich. Charakterystykę wzrostu w hodowli można oznaczyć stosując, na przykład, ludzkie komórki diploidalne (MRC-5). Zidentyfikowany tym sposobem wirus krowianki po podaniu człowiekowi w ilości skutecznej do wywołania ochronnej lub terapeutycznej odpowiedzi immunologicznej przeciwko wirusowi ospy prawdziwej u człowieka, wykazuje dopuszczalną awirulencję (brak zjadliwości) u człowieka. Wynalazek ma kilka zalet. Na przykład, uprzednio szczepionkę przeciwko ospie prawdziwej wytwarzano poprzez inokulację wirusa krowianki do skóry cieląt i następnie przez zdrapywanie skóry cieląt, w celu zebrania żywego wirusa. Wytworzony nieoczyszczony preparat wirusa był poddawany minimalnemu oczyszczaniu przed zastosowaniem u szczepionych ludzi, przez co powstawała możliwość zanieczyszczenia patogenami. Opisane tu szczepionki wytwarza się w układzie hodowli komórkowej, który jest do przyjęcia według współczesnych standardów wytwarzania szczepionek, przez co szczepionki te są wysoko oczyszczone, co eliminuje ten problem. Dodatkową zaletą zastosowania klonalnych wirusów, takich jak opisane tu wirusy, jest to, że mało prawdopodobna jest zmiana charakterystyki takich wirusów w czasie ich namnażania i wytwarzania szczepionki, w porównaniu z mieszanymi populacjami wirusów. Istotnie twórcy niniejszego wynalazku wykazali, że opisany tu wirus utrzymuje swój fenotyp po wielokrotnych pasażach i namnażaniu w hodowli komórkowej, jest wolny od zanieczyszczeń i można go produkować w hodowlach komórkowych w ilościach odpowiednich do wytwarzania szczepionek na dużą skalę. Inne cechy i zalety niniejszego wynalazku staną się oczywiste po zapoznaniu się z poniższym szczegółowym opisem, rysunkami i zastrzeżeniami. Krótki opis rysunków Fig. 1A-1D, to seria wykresów przedstawiających wyniki doświadczeń, w których oseski mysie poddawano ekspozycji na działanie wskazanych klonów wirusa krowianki, preparatu poliklonalnego wirusa krowianki lub Dryvax. Przedstawiono liczbę myszy, które przeżyły i średni czas przeżycia po takiej ekspozycji. Fig. 2 przedstawia analizę trawienia enzymem restrykcyjnym Hindlll opisanych tu klonów szczepionkowych w porównaniu z poliklonalnym preparatem wirusa i Dryvax. Szczegółowy opis wynalazku Zgodnie z wynalazkiem dostarczono klonalne szczepy atenuowanych wirusów krowianki, które można stosować w sposobach szczepienia przeciwko ospie prawdziwej (to znaczy zakażeniu wirusem variola). Jak to opisano bardziej szczegółowo poniżej, opisane tu atenuowane szczepy wirusa krowianki wytwarza się poprzez izolowanie klonów krowianki z hodowli komórkowych, w których namnażano
5 PL B1 5 Dryvax. Zgodnie z niniejszym wynalazkiem opisano również sposoby zastosowania szczepionek zawierających te wirusy krowianki w zapobieganiu ospie prawdziwej, jak również sposoby wytwarzania takich klonalnych szczepów wirusów krowianki. Opisane tu szczepionki pochodzą z Dryvax (szczep New York City Board of Health, Wyeth Laboratories), który obecnie uzyskał rejestrację w Agencji do Spraw Żywności i Leków Stanów Zjednoczonych (FDA) i składa się z mieszanej populacji wirusów krowianki, wytwarzanych w skórze cieląt i szczepionki te wykazują podobną charakterystykę co Dryvax. Szczepionki muszą wykazywać dostatecznie atenuowaną zjadliwość wobec organizmów ludzi, których szczepi się tymi szczepionkami. Odpowiedni poziom atenuacji może być na przykład poziomem podobnym do obserwowanego w przypadku Dryvax (na przykład takim, który nie różni się od niego w sposób statystycznie istotny), i można go oznaczać dowolnym opisanym poniżej testem in vitro lub in vivo. Cechą wirusa krowianki są jego właściwości neurotropowe lub zdolność do replikacji w komórkach ośrodkowego układu nerwowego i wywoływania stanu zapalnego (na przykład zapalenia mózgu). Opisane tu szczepionki dogodnie nie mają właściwości neurotropowych większych niż Dryvax i nie powodują poszczepiennego zapalenia mózgu u pacjentów, którzy je otrzymują. Takie szczepionki i sposoby opisano bardziej szczegółowo poniżej. Wskazania do zastosowania Podstawowym wskazaniem do zastosowania opisanych tu szczepionek jest zapobieganie ospie prawdziwej w populacjach narażonych lub potencjalnie narażonych na ospę prawdziwą po ataku bioterrorystycznym lub zastosowaniu broni biologicznej. Skuteczność opisanych tu szczepionek jest dogodnie duża (powyżej 95%) i szczepionki te chronią zarówno przed rozprzestrzenianiem się wirusa z człowieka na człowieka, jak i przed pierwotną ekspozycją na dużą dawkę w postaci aerozolu z broni biologicznej. Biorąc pod uwagę to podstawowe wskazanie, opisane tu szczepionki można stosować na przykład do stworzenia nowego narodowego depozytu szczepionki przeciwko ospie prawdziwej (wytworzonej z krowianki), przy czym produkcję można kontynuować co roku, w celu utrzymania ciągłego zapasu ważnej szczepionki przez długi czas. Szczepionki te nie są przeznaczone do rutynowego stosowania, z wyjątkiem pracowników laboratoryjnych poddanych ekspozycji na wirusa krowianki, ospy krowiej, ospy małpiej, ospy prawdziwej lub inne wirusy z rodzaju Orthopoxvirus. Poza tymi sytuacjami szczepionki są przeznaczone do wydania w warunkach nagłych, na polecenie władz właściwych do spraw bezpieczeństwa narodowego i zdrowia publicznego. W takich nagłych warunkach ryzyko wystąpienia zdarzeń niepożądanych związanych z zastosowaniem wirusa krowianki będzie mniej istotne niż potencjalne korzyści z ochrony ludzi przed ospą prawdziwą i ochrony społeczeństwa przed rozprzestrzenianiem się tej choroby. Należy rozumieć, że zastosowanie szczepionek w sytuacjach nagłych może być trudne do skontrolowania, że szczepionkę otrzymają niemowlęta, które narażone są na większe ryzyko poszczepiennego zapalenia mózgu i że może dojść do zignorowania środków ostrożności i przeciwwskazań do zastosowania szczepionki u osób z niektórymi chorobami (takimi jak na przykład wyprysk, ciąża i immunosupresja w wywiadzie). Dlatego też istotne jest, aby opisane tu szczepionki wytwarzane z hodowli komórkowej nie wykazywały zjadliwości większej niż produkt obecnie zarejestrowany. W zależności od wydarzeń, których nie można dokładnie przewidzieć, może zostać podjęta decyzja o rozpoczęciu działań profilaktycznych uprzedzających ewentualną ekspozycję pewnych grup, takich jak personel wojskowy, cywilny personel medyczny i tak zwane osoby pierwszej reakcji. Profil bezpieczeństwa szczepionek w tych grupach, jakkolwiek ma duże znaczenie, jest poprawiony poprzez to, że produkt podaje się rozmyślnie i unika się zastosowania go u osób narażonych na zdarzenia niepożądane. W takich warunkach głównym ryzykiem jest: autoinokulacja, krowianka oczu i przypadkowe zakażenie - wszystkie te zdarzenia niepożądane wykazują tendencję do samoograniczania się. Istnieje niewielkie ryzyko przypadkowego zakażenia innych osób, u których występują czynniki ryzyka. Oczywiście, jeżeli warunki w kraju lub na świecie zmienią się w taki sposób, że za pożądane uzna się rutynowe szczepienie dodatkowych członków populacji (na przykład dzieci) lub nawet całej populacji, opisane tu szczepionki mogą być stosowane również do tego celu. Sposoby podawania i podawane ilości Opisane tu szczepionki wytwarza się poprzez namnażanie pożądanego szczepu wirusa krowianki (na przykład szczepu ACAM 1000, nr depozytu ATCC PTA 3321, zob. niżej) w układzie hodowli komórkowej i oczyszczenie hodowanego szczepu z układu z zastosowaniem standardowych metod. Szczep taki można na przykład hodować w diploidalnych ludzkich komórkach fibroblastów płuc, takich jak komórki MRC-5, w pierwotnych komórkach fibroblastów zarodków kurzych lub dowolnym innym
6 6 PL B1 odpowiednim typie komórek, który może określić specjalista. Hodowlę można prowadzić w dowolnym odpowiednim układzie, takim jak na przykład Nunc Celi Factory. Oczyszczonego wirusa można liofilizować do późniejszego zastosowania lub można wytwarzać z niego bezpośrednio preparat w roztworze farmaceutycznym. Ze stanu techniki znane są liczne farmaceutycznie dopuszczalne roztwory do zastosowania w wytwarzaniu szczepionek, które specjalista może łatwo zaadaptować do zastosowania w niniejszym wynalazku (zob. na przykład Remington's Pharmaceutical Sciences, wydanie 18, pod red. A. Gennaro, 1990, Mack Publishing Co., Easton, PA, Stany Zjednoczone). Wirusy można jednak po prostu rozcieńczać w fizjologicznie dopuszczalnym roztworze, takim jak jałowy roztwór soli fizjologicznej lub jałowy zbuforowany roztwór soli fizjologicznej, ewentualnie z dodatkiem adiuwantu lub nośnika. Roztwór farmaceutyczny może ewentualnie zawierać składnik zapewniający lepkość (glicerol) i/lub składnik o właściwościach bakteriobójczych (na przykład fenol). Szczepionki można przechowywać w stężeniu wynoszącym jednostek tworzących łysinki (PFU)/ml, na przykład 10 8 PFU/ml. Opisane tu szczepionki, można podawać pacjentom, na przykład, poprzez skaryfikację standardowymi sposobami. W tej metodzie, można na przykład stosować rozdwojoną igłę. Zamiast tego szczepionkę można podawać dowolną inną standardową drogą, którą specjalista uzna za dopuszczalną. Na przykład szczepionkę można podawać poprzez wstrzyknięcie podskórne lub śródskórne lub inną drogą pozajelitową, na przykład przez wstrzyknięcie domięśniowe. Dorosłemu, o przeciętnych wymiarach ciała, szczepionkę można podawać w ilości na przykład 1x10 4-1x10 6 jednostek tworzących łysinki jako swoisty przykład można podać zastosowanie 2,5x10 5 jednostek tworzących łysinki. Szczepienie dogodnie prowadzi się przed ewentualną ekspozycją na ospę prawdziwą, lecz szczepienie można również przeprowadzić u pacjentów, którzy zostali już poddani ekspozycji na ospę prawdziwą, dogodnie w ciągu kilku dni od ekspozycji. Szczepienie można przeprowadzić tylko jeden raz w życiu danej osoby lub można powtarzać po pewnym czasie, takim jak kilka lat (na przykład po 5, 10 latach), według zaleceń specjalisty. Identyfikacja potencjalnych szczepów szczepionkowych Zgodnie z niniejszym wynalazkiem opisano również sposoby identyfikacji potencjalnych szczepów wirusa krowianki nadających się do wytwarzania szczepionki. Szczepy takie można identyfikować poprzez izolowanie szczepów klonalnych z hodowli komórkowych inokulowanych Dryvax i poprzez określenie charakterystyki tych klonów dowolną z opisanych poniżej metod in vivo lub in vitro. Potencjalny szczep można na przykład porównać z Dryvax pod względem wielkości łysinek, wydajności otrzymywania w hodowli komórkowej (na przykład z zastosowaniem komórek MRC-5), zjadliwości skórnej u królika, neurowirulencji u osesków mysich, neurowirulencji u małp lub ochrony w mysim modelu ekspozycji. Zalecanymi potencjalnymi szczepami są szczepy, których zjadliwość jest podobna lub mniejsza od zjadliwości Dryvax, i które wywołują ochronną odpowiedź immunologiczną podobną lub większą niż Dryvax i wykazują charakterystykę wzrostu podobną lub przewyższającą charakterystykę dla Dryvax. Przed dokonaniem niniejszego wynalazku izolowanie klonalnego szczepu o odpowiedniej charakterystyce, w przypadku oceny szczepu pod kątem możliwości wytwarzania z niego szczepionek, było nieprzewidywalne, ponieważ długa historia pasaży krowianki spowodowała wytworzenie wielu subpopulacji odmian (to znaczy rój (ang. swarm) genetyczny), o potencjalnie różnych właściwościach biologicznych. Nie było również pewne czy dana pojedyncza odmiana izolowana poprzez oczyszczenie z łysinki (to znaczy klonowanie biologiczne) będzie miała taką charakterystykę fenotypową, jak suma wielu odmian w oryginalnej, mieszanej populacji wirusa. Istotnie, przed dokonaniem niniejszego wynalazku byłoby nawet zadziwiające, gdyby tak właśnie było. Opracowanie i charakterystykę przedkliniczną opisanych tu szczepionek przedstawiono poniżej. Opracowanie i przedkliniczna charakterystyka szczepionek krowianki Jak to omówiono powyżej, Dryvax jest szczepionką krowianki, obecnie zarejestrowaną przez FDA, pochodzącą ze szczepu New York City Board of Health (NYCBH), która była produkowana przed rokiem 1982 przez Wyeth-Lederle metodą limfatyczną u cieląt (zob. również depozyt ATCC nr VR-325). Dryvax składa się z żywego, atenuowanego wirusa krowianki i nie występuje, jako produkt hodowli komórkowej. Twórcy niniejszego wynalazku zaadaptowali wykorzystywanego do szczepień przeciwko ospie prawdziwej wirusa krowianki do namnażania w kontrolowanych warunkach, w laboratoryjnych hodowlach ludzkich fibroblastów płuc tak, aby do wytwarzania szczepionki można było wykorzystać nowoczesne techniki. W celu opracowania szczepionki z hodowli komórkowej musieli oni oddzielić Dryvax od potencjalnych zanieczyszczeń wirusowych, poprzez pasaż
7 PL B1 7 w ostatecznym rozcieńczeniu i przeprowadzili to z klonowaniem i bez klonowania, jak to omówiono bardziej szczegółowo poniżej. Z mieszaniny odmian ( roju genetycznego) w Dryvax, wybrali oni potencjalne szczepionki o podobnej charakterystyce biologicznej u zwierząt i wykazujące podobieństwo genomowe do szczepionki zarejestrowanej, co zapewniało w dużym stopniu pewność, że będą one wykazywały skuteczność kliniczną podobną jak oryginalny produkt z węzłów chłonnych cieląt. W jednym ze sposobów stosowanych do adaptacji, wirusa krowianki klonowano w celu oddzielenia wirusa od ewentualnych zanieczyszczających go drobnoustrojów pochodzących ze skóry cieląt. Tym sposobem wyizolowano 6 klonów. Sklonowane wirusy wykazywały wiele cech mniejszej lub większej zjadliwości w porównaniu z Dryvax. Niespodziewanie, biorąc pod uwagę oczekiwaną mieszaninę odmian w Dryvax stwierdzono, że 3 klony były podobne do Dryvax w testach zjadliwości u zwierząt i różniły się głównie szybkością wzrostu w hodowli komórkowej. W opisanym tu sposobie szczepienia przeciwko ospie prawdziwej można wykorzystać dowolny z tych szczepów, jak również inne szczepy o podobnej charakterystyce. W innym sposobie wirusa nie klonowano, oczekując, że wirus wytworzony tym sposobem będzie z większym prawdopodobieństwem zachowywać się tak jak szczep, z którego pochodzi. Niespodziewanie jednak stwierdzono, że szczep wyprodukowany bez klonowania, choć zachowywał się podobnie do Dryvax w testach in vitro, nie wykazywał charakterystyki szczepu szczepionkowego, jednak w istocie był bardziej zjadliwy w testach na zwierzętach laboratoryjnych. Skupiono zatem wysiłki w zakresie opracowania szczepionki na wirusach sklonowanych o charakterystyce podobnej do szczepu szczepionkowego Dryvax. Szczegółową charakterystykę przedstawiono poniżej. Dryvax inokulowano do hodowli komórek MRC-5 i uzyskano 6 klonów wirusa krowianki poprzez oczyszczenie z łysinek. Każdy klon ponownie klonowano - dwukrotnie - dla zapewnienia klonalności i braku zanieczyszczeń. Dryvax inokulowano również do hodowli komórek MRC-5 przy wielokrotności zakażania (MOI) 0,001 PFU na komórkę, w celu uzyskania nieklonowanego (poliklonalnego) preparatu wirusa. Wirus ten następnie pasażowano dwukrotnie jeszcze w komórkach MRC-5 przy niskim MOI. Wszystkie 6 klonów i preparat poliklonalny badano w szeroko zakrojonej serii analiz porównawczych wraz z Dryvax, w celu ustalenia charakterystyki in vitro i in vivo. W szczególności, każdy klon i preparat poliklonalny analizowano pod kątem morfologii łysinek, wydajności otrzymywania w komórkach MRC-5, wzorca mapowania endonukleazą restrykcyjną, tworzenia blizn skórnych u królików i neurowirulencji u myszy. Podgrupę klonów badano jeszcze pod kątem wywoływania ochronnej odpowiedzi immunologicznej u myszy. Celem było wybranie z puli Dryvax szczepu szczepionkowego wykazującego biologiczne podobieństwo do Dryvax. W tabeli 1 podsumowano wyniki tych badań. T a b e l a 1 Charakterystyka 7 wirusów krowianki potencjalnie nadających się do wytworzenia szczepionki Test Wyniki (w stosunku do testów jakościowych Dryvax ) Dryvax Klon 1 Klon 2 Klon 3 Klon 4 Klon 5 Klon 6 Preparat poliklonalny Wielkość płytki (średnia-mm) Wydajność w MRC-5* 0,42 0,43 0,49 0,36 0,65 0,25 0,27 0,46 4,0 13,5 7,0 10,6 15,6 4,7 1,5 7,0 Analiza RE Test skórny u królika Wysoka Wysoka Wysoka Wysoka Neurowirulencja u osesków mysich Wysoka Wysoka Wysoka Wysoka Immunogenność u myszy Nie badano Nie badano Nie badano Nie badano * pfu/ml x 10 6
8 8 PL B1 Na podstawie tych badań stwierdzono, że klony 2 i 4 wykazują charakterystykę umożliwiającą ich wykorzystanie do wytwarzania nowej szczepionki przeciwko ospie prawdziwej. Klon 6 również wykazuje odpowiednią charakterystykę, jednak nie wykazuje tak dobrego wzrostu w hodowli jak klony 2 i 4. Neurowirulencja u osesków mysich Stwierdzono, że dorosłe myszy są niepodatne na wewnątrzczaszkową (IC) inokulację niezmodyfikowanego Dryvax. Opracowano zatem test u osesków mysich. Oseskom mysim (w wieku 3-4 dni) wstrzykiwano dziesięciokrotne rozcieńczenie wirusa i oznaczano czas przeżycia. Przeprowadzono 3 doświadczenia, przy czym w każdym z nich jako wzorzec testowano Dryvax. Stwierdzono, że u osesków mysich inokulowanych IC z użyciem Dryvax zawsze rozwijało się śmiertelne zapalenie mózgu, przy czym LD 50 wynosiło 1,0 log 10 PFU, natomiast średni czas do zgonu wynosił 7 dni. Test ten uznano zatem za użyteczny do porównywania neurowirulencji potencjalnych szczepionek z macierzystym Dryvax. Wyniki tych doświadczeń podsumowano w tabeli 2, natomiast liczbę myszy, które przeżyły i średni czas przeżycia, jakie stwierdzono w tej analizie przedstawiono na Fig. 1A-1D. T a b e l a 2 Neurowirulencja u osesków mysich, potencjalne szczepionkowe szczepy krowianki Parametr Doświadczenie Wirus LD 50 1 LD 90 1 AST 2 (SD) 1 Dryvax 1,68 3,03 7,78 (4,19) Preparat poliklonalny <1,3 1,94 6,09 (1,14) Klon 1 <2,3 <2,3 4,20 (1,03) 2 Dryvax 1,3 2,1 6,67 (0,71) Klon 2 1,55 2,25 6,80 (2,74) Klon 3 <1,3 <1,3 5,00 (1,16) Klon 4 2,59 3,16 6,11 (1,36) 3 Dryvax 2,4 4,15 8,64 (3,42) Klon 5 <1,3 <1,3 4,08 (1,08) Klon 6 1,57 2,47 7,73 (4,63) % domózgowej dawki letalnej na jedno wstrzyknięcie 0,02 ml w dniu 10 zakażeniu 90% domózgowej dawki letalnej na jedno wstrzyknięcie 0,02 ml w dniu 10 zakażeniu średni czas przeżycia w dniach (odchylenie standardowe) przy LD 50 W celu zbadania zjadliwości potencjalnych szczepionek można zastosować dodatkowe testy. Twórcy niniejszego wynalazku opracowali sposób badania zjadliwości w teście skórnym u królików. Test ten udało się opracować z zastosowaniem śródskórnej inokulacji niepasażowanego Dryvax, co spowodowało wystąpienie zależnych od dawek zmian o typie blizn po ospie, cechujących się zaczerwienieniem, stwardnieniem i w niektórych przypadkach zmianą na środku. Jako inny przykład można wymienić test neurowirulencji u małp. W tym teście pochodzący ze sklonowanego Dryvax potencjalny szczep testuje się w porównaniu z Dryvax poprzez inokulację IC, stopniowanymi dawkami wirusa. Twórcy niniejszego wynalazku opracowali również mysi model ekspozycji do testów ochronnych. W tym modelu szczep WR krowianki zastosowano do ekspozycji myszy w wieku 6-8 tygodni drogą donosową (IN). LD 50 wynosi 4,5 log 10 PFU, natomiast średni czas do zgonu wynosi 6-7 dni po ekspozycji. Test ten ma dostatecznie dużą moc do zastosowania w badaniach przedklinicznych działania ochronnego potencjalnej nowej szczepionki. Można również stosować podobne modele z zastosowaniem innych wirusów z grupy Orthopoxvirus, takich jak na przykład wirus ospy krowiej. Badano zdolność Dryvax oraz klonów 2 i 4 do wywoływania ochronnej odpowiedzi immunologicznej przeciwko szczepowi WR krowianki. Badano również klon 3 w celu ustalenia, czy klon o większej zjadliwości, również wywołuje większą odpowiedź immunologiczną. Myszy w wieku 4 tygodni
9 PL B1 9 uodparniano stopniowanymi dawkami każdego szczepu wirusa. Wirus wszczepiano do skóry poprzez skaryfikację rozdwojoną igłą, to znaczy taką samą metodą jak stosowana do szczepienia ludzi preparatem Dryvax. Trzy tygodnie po immunizacji myszy eksponowano na działanie 6,5 log10 PFU (100 LD 50 ) szczepu WR krowianki drogą IN. Ustalano współczynnik przeżycia po 14 dniach od ekspozycji. W przypadku wszystkich szczepów wirusa obserwowano zależne od dawki działanie ochronne i wszystkie klony chroniły myszy co najmniej równie dobrze jak Dryvax. Nie stwierdzono różnic w zakresie aktywności ochronnej pomiędzy poszczególnymi klonami. Średni czas przeżycia przy różnej dawce uodparniającej podano w tabeli 3, natomiast 50% dawki ochronne (PD 50 ) przedstawiono w tabeli 4. T a b e l a 3 Czas przeżycia myszy immunizowanych po ekspozycji na 100 LD 50 szczepu WR krowianki Dawka immunizująca (log 10 pfu/ml) Średni czas przeżycia w dniach Dryvax Klon 3 Klon 2 Klon ,0 NT 14,0 NT 7 14,0 14,0 14,0 14,0 6 12,0 14,0 12,4 12,4 5 7,6 8,8 7,2 7,0 4 5,2 5,2 7,8 5,4 3 5,6 5,4 5,4 4,8 2 5,2 5,8 5,2 NT T a b e l a 4 50% dawki ochronne Dryvax i potencjalnych szczepionek PD 50 (log 10 pfu) Dryvax Klon 3 Klon 2 Klon 4 5,5 5,2 5,4 5,5 Analiza endonukleazami restrykcyjnymi Oczyszczono DNA z Dryvax oraz z każdej potencjalnej szczepionki i poddawano trawieniu endonukleazą restrykcyjną z użyciem Hindlll, w celu stwierdzenia czy istnieją genetyczne różnice między szczepami. Nie stwierdzono żadnych różnic, jak to wykazuje analiza elektroforetyczna strawionego genomowego DNA na Fig. 2. Dobór substratu komórkowego Podjęto badania nad replikacją Dryvax oraz wydajnością otrzymywania w komórkach MRC-5 oraz w pierwotnych fibroblastach zarodków kurzych (CEF) i wykazano, że wydajność otrzymywania jest mniejsza w komórkach CEF niż w komórkach MRC-5. Zatem jako substrat do produkcji szczepionki wybrano komórki MRC-5. Potencjalne szczepy szczepionkowe można badać w CEF lub innych komórkach w celu porównania wydajności otrzymywania szczepionki. Porównano również pożywki wzrostowe do namnażania komórek MRC-5. Uzyskano jednakowe wyniki dla pożywek Williams E, Minimal Essential Medium (MEM) i MEM w modyfikacji Dulbecco. Wzbogacanie pożywek dodatkiem płodowej surowicy bydlęcej (FBS), nie niezbędnych aminokwasów, witamin i pirogronianu sodu nie dostarczyło żadnych korzyści w stosunku do stosowania pożywki z 10% FBS, w odniesieniu do żywotności lub wzrostu komórek. Kinetyka wzrostu MRC-5 przy odpowiedniej gęstości posiewu komórek była dostateczna. Ustalono, że gęstość posiewu komórek powinna wynosić 2x10 4 komórek/cm 2. Stwierdzono, że czas do podziału wynosi 3-5 dni, natomiast stosunek podwojenia populacji do podziału wynosi 1-1,5. Zdefiniowano sposób wytwarzania banków komórek i namnażania komórek w celu uzyskania wzrostu wirusa. Wykazano, że do dysocjacji komórek nadaje się standardowa metoda trypsynizacji. Wykazano użyteczność metody alternatywnej z zastosowaniem pronazy bakteryjnej, która może mieć tę zaletę, że pozwoli na uniknięcie w produkcji produktów pochodzenia zwierzęcego. Inne wykonania wynalazku opisane są w załączonych zastrzeżeniach.
10 10 PL B1 Zastrzeżenia patentowe 1. Kompozycja farmaceutyczna, znamienna tym, że zawiera klonalny szczep atenuowanego wirusa krowianki, który wyizolowany jest z hodowli komórek, w której hodowano ACAM 1000 (nr depozytu ATCC PTA-3321) lub jego wirusa potomnego, i, po podaniu człowiekowi w ilości skutecznej do wywoływania ochronnej lub terapeutycznej odpowiedzi immunologicznej przeciwko wirusowi ospy prawdziwej u tego człowieka, wykazuje u tego człowieka odpowiednią atenuację, oraz farmaceutycznie dopuszczalny nośnik lub rozcieńczalnik, przy czym: - wspomniany wirus krowianki ma taką samą zjadliwość jak szczep wirusa krowianki ACAM1000 (nr depozytu ATCC PTA-3321), - wspomniany wirus krowianki ma taką samą immunogenność jak szczep wirusa krowianki ACAM 1000 (nr depozytu ATCC PTA-3321) i, - wspomniany wirus krowianki ma taki sam wzorzec trawienia jak szczep wirusa krowianki ACAM 1000 (nr depozytu ATCC PTA-3321) po trawieniu endonukleazą restrykacyjną. 2. Kompozycja według zastrz. 1, znamienna tym, że wspomniany szczep wirusa krowianki ma taką samą zjadliwość jak Dryvax. 3. Kompozycja według zastrz. 1, znamienna tym, że wspomniany szczep wirusa krowianki ma taką samą immunogenność jak Dryvax. 4. Kompozycja według zastrz. 1, znamienna tym, że wspomniany szczep wirusa krowianki wytwarzany jest w ilości takiej samej lub większej niż Dryvax po inokulacji do hodowli komórkowych. 5. Kompozycja według zastrz. 1, znamienna tym, że wspomniany szczep wirusa krowianki ma taki sam wzorzec trawienia jak Dryvax po trawieniu endonukleazą restrykcyjną. 6. Kompozycja według zastrz. 1, znamienna tym, że wspomniany szczep wirusa krowianki wytwarzany jest w ilości takiej samej lub większej niż ACAM1000 (nr depozytu ATCC PTA-3321) po inokulacji do hodowli komórkowych 7. Kompozycja według zastrz. 1, znamienna tym, że wspomniany szczep wirusa krowianki stanowi ACAM 1000 (nr depozytu ATCC PTA-3321). 8. Kompozycja według jednego z zastrz. 1-7, znamienna tym, że przeznaczona jest do leczenia zakażenia wirusem ospy prawdziwej u pacjenta. 9. Kompozycja farmaceutyczna, znamienna tym, że zawiera: (i) klonalny szczep atenuowanego wirusa krowianki, który wyizolowany jest z hodowli komórek, w której hodowano Drywax albo ACAM 1000 (nr depozytu ATCC PTA-3321) lub jego wirusa potomnego, i po podaniu człowiekowi w ilości skutecznej do wywoływania ochronnej lub terapeutycznej odpowiedzi immunologicznej przeciwko wirusowi ospy prawdziwej u tego człowieka, w y- kazuje u tego człowieka odpowiednią atenuację, oraz (ii) farmaceutycznie dopuszczalny nośnik lub rozcieńczalnik, przy czym wspomniana kompozycja przeznaczona jest do zastosowania w leczeniu lub profilaktyce zakażenia wirusem ospy prawdziwej u pacjenta, i przy czym: - wspomniany wirus krowianki ma taką samą zjadliwość jak szczep wirusa krowianki ACAM 1000 (nr depozytu ATCC PTA-3321), - wspomniany wirus krowianki ma taką samą immunogenność jak szczep wirusa krowianki ACAM 1000 (nr depozytu ATCC PTA-3321) i, - wspomniany wirus krowianki ma taki sam wzorzec trawienia jak szczep wirusa krowianki ACAM 1000 (nr depozytu ATCC PTA-3321) po trawieniu endonukleazą restrykacyjną. 10. Kompozycja według zastrz 8 albo 9, znamienna tym, że wspomniana kompozycja przeznaczona jest do podawania wspomnianemu pacjentowi przez skaryfikację. 11. Kompozycja według zastrz 8 albo 9, znamienna tym, że wspomniana kompozycja przeznaczona jest do podawania wspomnianemu pacjentowi w ilości w zakresie od 1x10 4 do 1x10 6 jednostek tworzących łysinki.
11 PL B1 11 Rysunki
12 12 PL B1
13 PL B1 13
14 14 PL B1
15 PL B1 15
16 16 PL B1 Departament Wydawnictw UP RP Cena 4,92 zł (w tym 23% VAT)
PL 204536 B1. Szczepanik Marian,Kraków,PL Selmaj Krzysztof,Łódź,PL 29.12.2003 BUP 26/03 29.01.2010 WUP 01/10
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204536 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 354698 (22) Data zgłoszenia: 24.06.2002 (51) Int.Cl. A61K 38/38 (2006.01)
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204536 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 354698 (22) Data zgłoszenia: 24.06.2002 (51) Int.Cl. A61K 38/38 (2006.01)
Historia i przyszłość szczepień
 IV Europejski Tydzień Szczepień 20-26 kwietnia 2009 Historia i przyszłość szczepień Prof. dr hab. Andrzej Zieliński Zakład Epidemiologii Narodowego Instytutu Zdrowia Publicznego Błonica Zapadalność i umieralność
IV Europejski Tydzień Szczepień 20-26 kwietnia 2009 Historia i przyszłość szczepień Prof. dr hab. Andrzej Zieliński Zakład Epidemiologii Narodowego Instytutu Zdrowia Publicznego Błonica Zapadalność i umieralność
Anna Skop. Zachęcam do zapoznania się z prezentacja na temat szczepień.
 W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
Szczepienia ochronne. Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak
 Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
Celem Tygodnia Szczepień w Polsce jest podkreślanie roli szczepień powszechnych i indywidualnych poprzez:
 W dniach 22-26 kwietnia obchodzimy, już po raz IX, Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia (WHO), realizowana i koordynowana na poziomie lokalnym przez poszczególne
W dniach 22-26 kwietnia obchodzimy, już po raz IX, Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia (WHO), realizowana i koordynowana na poziomie lokalnym przez poszczególne
 SZCZEPIENIA OCHRONNE U DOROSŁYCH lek. Kamil Chudziński Klinika Anestezjologii i Intensywnej Terapii CSK MSW w Warszawie 10.11.2015 Szczepionki Zabite lub żywe, ale odzjadliwione drobnoustroje/toksyny +
SZCZEPIENIA OCHRONNE U DOROSŁYCH lek. Kamil Chudziński Klinika Anestezjologii i Intensywnej Terapii CSK MSW w Warszawie 10.11.2015 Szczepionki Zabite lub żywe, ale odzjadliwione drobnoustroje/toksyny +
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1773451 (96) Data i numer zgłoszenia patentu europejskiego: 08.06.2005 05761294.7 (13) (51) T3 Int.Cl. A61K 31/4745 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1773451 (96) Data i numer zgłoszenia patentu europejskiego: 08.06.2005 05761294.7 (13) (51) T3 Int.Cl. A61K 31/4745 (2006.01)
Wirusologia 2019 XII EDYCJA DOBRO INDYWIDUALNE CZY PUBLICZNE? PSO 2019
 Wirusologia 2019 XII EDYCJA 21.05.2019 SZCZEPIENIA OCHRONNE DOBRO INDYWIDUALNE CZY PUBLICZNE? PSO 2019 Izabela Kucharska _ Zastępca Głównego Inspektora Sanitarnego Podstawy prawne szczepień Art. 17 ustawy
Wirusologia 2019 XII EDYCJA 21.05.2019 SZCZEPIENIA OCHRONNE DOBRO INDYWIDUALNE CZY PUBLICZNE? PSO 2019 Izabela Kucharska _ Zastępca Głównego Inspektora Sanitarnego Podstawy prawne szczepień Art. 17 ustawy
Raport z badania Działanie wirusobójcze środka dezynfekującego wobec Feline calicivirus. 25 października 2006
 Raport z badania Działanie wirusobójcze środka dezynfekującego wobec Feline calicivirus 25 października 2006 Dr Tobias J. Tuthill Wydział Nauk Biologicznych Uniwersytet Leeds Leeds LS2 9JT www.fbs.leeds.ac.uk
Raport z badania Działanie wirusobójcze środka dezynfekującego wobec Feline calicivirus 25 października 2006 Dr Tobias J. Tuthill Wydział Nauk Biologicznych Uniwersytet Leeds Leeds LS2 9JT www.fbs.leeds.ac.uk
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval 3 BRSV PI3 BVD Liofilizat i zawiesina do sporządzania zawiesiny do wstrzykiwań dla bydła. 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval 3 BRSV PI3 BVD Liofilizat i zawiesina do sporządzania zawiesiny do wstrzykiwań dla bydła. 2.
ROZPORZĄDZENIE MINISTRA ZDROWIA z dnia 22 kwietnia 2005 r.
 ROZPORZĄDZENIE MINISTRA ZDROWIA z dnia 22 kwietnia 2005 r. w sprawie szkodliwych czynników biologicznych dla zdrowia w środowisku pracy oraz ochrony zdrowia pracowników zawodowo narażonych na te czynniki
ROZPORZĄDZENIE MINISTRA ZDROWIA z dnia 22 kwietnia 2005 r. w sprawie szkodliwych czynników biologicznych dla zdrowia w środowisku pracy oraz ochrony zdrowia pracowników zawodowo narażonych na te czynniki
CZYM JEST SZCZEPIONKA?
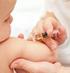 CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana)
 EMA/90006/2015 EMEA/H/C/001104 Streszczenie EPAR dla ogółu społeczeństwa szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana) Niniejszy dokument jest streszczeniem
EMA/90006/2015 EMEA/H/C/001104 Streszczenie EPAR dla ogółu społeczeństwa szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana) Niniejszy dokument jest streszczeniem
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Pseudovac, roztwór do wstrzykiwań Szczepionka poliwalentna przeciwko pałeczce ropy błękitnej Pseudomonas aeruginosa 1 ml szczepionki zawiera antygeny
Ulotka dołączona do opakowania: informacja dla użytkownika Pseudovac, roztwór do wstrzykiwań Szczepionka poliwalentna przeciwko pałeczce ropy błękitnej Pseudomonas aeruginosa 1 ml szczepionki zawiera antygeny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO CEVAC MASS L liofilizat do sporządzania zawiesiny do podania na oczy i nozdrza dla kur 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO CEVAC MASS L liofilizat do sporządzania zawiesiny do podania na oczy i nozdrza dla kur 2. SKŁAD JAKOŚCIOWY
PL B1. AKADEMIA GÓRNICZO-HUTNICZA IM. STANISŁAWA STASZICA W KRAKOWIE, Kraków, PL BUP 15/15
 PL 226438 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 226438 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 406862 (22) Data zgłoszenia: 16.01.2014 (51) Int.Cl.
PL 226438 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 226438 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 406862 (22) Data zgłoszenia: 16.01.2014 (51) Int.Cl.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO BioBos Respi 4, zawiesina do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO BioBos Respi 4, zawiesina do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
PL B1 (12) O P I S P A T E N T O W Y (19) P L (11) (13) B 1 A61K 9/20. (22) Data zgłoszenia:
 R Z E C Z PO SPO L IT A PO LSK A (12) O P I S P A T E N T O W Y (19) P L (11) 1 7 7 6 0 7 (21) Numer zgłoszenia: 316196 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.03.1995
R Z E C Z PO SPO L IT A PO LSK A (12) O P I S P A T E N T O W Y (19) P L (11) 1 7 7 6 0 7 (21) Numer zgłoszenia: 316196 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.03.1995
Uchwała Nr XIX/169/2008 Rady Miasta Marki z dnia 18 czerwca 2008 roku
 Uchwała Nr XIX/169/2008 Rady Miasta Marki z dnia 18 czerwca 2008 roku w sprawie wyrażenia zgody na realizację programu zdrowotnego w zakresie szczepień ochronnych przeciwko grypie, dla mieszkańców Miasta
Uchwała Nr XIX/169/2008 Rady Miasta Marki z dnia 18 czerwca 2008 roku w sprawie wyrażenia zgody na realizację programu zdrowotnego w zakresie szczepień ochronnych przeciwko grypie, dla mieszkańców Miasta
LEKI CHEMICZNE A LEKI BIOLOGICZNE
 LEKI CHEMICZNE A LEKI BIOLOGICZNE PRODUKT LECZNICZY - DEFINICJA Art. 2 pkt.32 Ustawy - Prawo farmaceutyczne Substancja lub mieszanina substancji, przedstawiana jako posiadająca właściwości: zapobiegania
LEKI CHEMICZNE A LEKI BIOLOGICZNE PRODUKT LECZNICZY - DEFINICJA Art. 2 pkt.32 Ustawy - Prawo farmaceutyczne Substancja lub mieszanina substancji, przedstawiana jako posiadająca właściwości: zapobiegania
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
(86) Data i numer zgłoszenia międzynarodowego: 13.12.1999,PCT/EP99/09864 (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 202483 (21) Numer zgłoszenia: 349335 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.12.1999 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 202483 (21) Numer zgłoszenia: 349335 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.12.1999 (86) Data i numer zgłoszenia
Ulotka dołączona do opakowania: informacja dla użytkownika. Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab
 Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
PL B1. Sposób otrzymywania mieszanki spożywczej z kiełków roślin zawierającej organiczne związki selenu
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 228134 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 406353 (22) Data zgłoszenia: 03.12.2013 (51) Int.Cl. A23L 33/00 (2016.01)
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 228134 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 406353 (22) Data zgłoszenia: 03.12.2013 (51) Int.Cl. A23L 33/00 (2016.01)
ZASZCZEP SIĘ PRZED PODRÓŻĄ WOJEWÓDZKA STACJA SANITARNO EPIDEMIOLOGICZNA W POZNANIU
 INFORMACJA NA TEMAT SZCZEPIEŃ OCHRONNYCH PRZED WYJAZDEM ZA GRANICĘ W ciągu ostatnich lat zauważa się wzrost liczby osób wyjeżdżających poza granice Polski. Szczepienia dla osób wyjeżdżających wiążą się
INFORMACJA NA TEMAT SZCZEPIEŃ OCHRONNYCH PRZED WYJAZDEM ZA GRANICĘ W ciągu ostatnich lat zauważa się wzrost liczby osób wyjeżdżających poza granice Polski. Szczepienia dla osób wyjeżdżających wiążą się
Czy grozi mi wirusowe zapalenie wątroby typu B?
 Czy grozi mi wirusowe zapalenie wątroby typu B? Co to jest? Wirus zapalenia wątroby typu B (HBW) powoduje zakażenie wątroby mogące prowadzić do poważnej choroby tego organu. Wątroba jest bardzo ważnym
Czy grozi mi wirusowe zapalenie wątroby typu B? Co to jest? Wirus zapalenia wątroby typu B (HBW) powoduje zakażenie wątroby mogące prowadzić do poważnej choroby tego organu. Wątroba jest bardzo ważnym
Diagnostyka wirusologiczna w praktyce klinicznej
 Diagnostyka wirusologiczna w praktyce klinicznej Ponad 60% zakażeń w praktyce klinicznej jest wywołana przez wirusy. Rodzaj i jakość materiału diagnostycznego (transport!) oraz interpretacja wyników badań
Diagnostyka wirusologiczna w praktyce klinicznej Ponad 60% zakażeń w praktyce klinicznej jest wywołana przez wirusy. Rodzaj i jakość materiału diagnostycznego (transport!) oraz interpretacja wyników badań
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków
 Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
B. ULOTKA INFORMACYJNA
 B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
Warszawa, dnia 19 czerwca 2013 r. Poz. 696 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 6 czerwca 2013 r.
 DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 19 czerwca 2013 r. Poz. 696 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 6 czerwca 2013 r. w sprawie bezpieczeństwa i higieny pracy przy wykonywaniu
DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 19 czerwca 2013 r. Poz. 696 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 6 czerwca 2013 r. w sprawie bezpieczeństwa i higieny pracy przy wykonywaniu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac MycoFLEX zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Inaktywowana Mycoplasma
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac MycoFLEX zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Inaktywowana Mycoplasma
(86) Data i numer zgłoszenia międzynarodowego: , PCT/EP96/05837
 RZECZPOSPOLITA POLSKA (12)OPIS PATENTOWY (19)PL (11)186469 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 327637 (22) Data zgłoszenia: 24.12.1996 (86) Data i numer zgłoszenia międzynarodowego:
RZECZPOSPOLITA POLSKA (12)OPIS PATENTOWY (19)PL (11)186469 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 327637 (22) Data zgłoszenia: 24.12.1996 (86) Data i numer zgłoszenia międzynarodowego:
ROZPORZĄDZENIE MINISTRA ZDROWIA 1)
 Bezpieczeństwo i higiena pracy przy wykonywaniu prac związanych z narażeniem na zranienie ostrymi narzędziami używanymi przy udzielaniu świadczeń zdrowotnych. Dz.U.2013.696 z dnia 2013.06.19 Status: Akt
Bezpieczeństwo i higiena pracy przy wykonywaniu prac związanych z narażeniem na zranienie ostrymi narzędziami używanymi przy udzielaniu świadczeń zdrowotnych. Dz.U.2013.696 z dnia 2013.06.19 Status: Akt
Czy każdy NOP jest NOP-em? Dr med. Iwona Paradowska-Stankiewicz Konsultant Krajowy w dziedzinie Epidemiologii Zakład Epidemiologii NIZP-PZH, Warszawa
 Czy każdy NOP jest NOP-em? Dr med. Iwona Paradowska-Stankiewicz Konsultant Krajowy w dziedzinie Epidemiologii Zakład Epidemiologii NIZP-PZH, Warszawa Niepożądany odczyn poszczepienny 1. KAŻDY się obawia,
Czy każdy NOP jest NOP-em? Dr med. Iwona Paradowska-Stankiewicz Konsultant Krajowy w dziedzinie Epidemiologii Zakład Epidemiologii NIZP-PZH, Warszawa Niepożądany odczyn poszczepienny 1. KAŻDY się obawia,
Aneks II. Niniejsza Charakterystyka Produktu Leczniczego oraz ulotka dla pacjenta stanowią wynik procedury arbitrażowej.
 Aneks II Zmiany dotyczące odpowiednich punktów Charakterystyki Produktu Leczniczego oraz ulotki dla pacjenta przedstawione przez Europejską Agencję Leków (EMA) Niniejsza Charakterystyka Produktu Leczniczego
Aneks II Zmiany dotyczące odpowiednich punktów Charakterystyki Produktu Leczniczego oraz ulotki dla pacjenta przedstawione przez Europejską Agencję Leków (EMA) Niniejsza Charakterystyka Produktu Leczniczego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ERYSIN SINGLE SHOT, emulsja do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ERYSIN SINGLE SHOT, emulsja do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gletvax 6 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH) Subastancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gletvax 6 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH) Subastancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AVAXIM 160 U, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum hepatitidis A inactivatum adsorbatum Szczepionka przeciw wirusowemu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AVAXIM 160 U, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum hepatitidis A inactivatum adsorbatum Szczepionka przeciw wirusowemu
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości
 Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
(86) Data i numer zgłoszenia międzynarodowego: , PCT/DE03/ (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 207732 (21) Numer zgłoszenia: 378818 (22) Data zgłoszenia: 18.12.2003 (86) Data i numer zgłoszenia międzynarodowego:
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 207732 (21) Numer zgłoszenia: 378818 (22) Data zgłoszenia: 18.12.2003 (86) Data i numer zgłoszenia międzynarodowego:
Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
NAUKOWE WNIOSKI I PODSTAWY DO ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU PREPARATU PROCOMVAX, PRZEDSTAWIONE PRZEZ EMEA
 NAUKOWE WNIOSKI I PODSTAWY DO ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU PREPARATU PROCOMVAX, PRZEDSTAWIONE PRZEZ EMEA WSTĘP Zaaprobowane wskazania do stosowania preparatu Procomvax to szczepienie przeciw
NAUKOWE WNIOSKI I PODSTAWY DO ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU PREPARATU PROCOMVAX, PRZEDSTAWIONE PRZEZ EMEA WSTĘP Zaaprobowane wskazania do stosowania preparatu Procomvax to szczepienie przeciw
Badania mikrobiologiczne wg PN-EN ISO 11737
 Badania mikrobiologiczne wg PN-EN ISO 11737 mgr Agnieszka Wąsowska Specjalistyczne Laboratorium Badawcze ITA-TEST Z-ca Dyrektora ds. Badań Kierownik Zespołu Badań Mikrobiologicznych i Chemicznych Tel.022
Badania mikrobiologiczne wg PN-EN ISO 11737 mgr Agnieszka Wąsowska Specjalistyczne Laboratorium Badawcze ITA-TEST Z-ca Dyrektora ds. Badań Kierownik Zespołu Badań Mikrobiologicznych i Chemicznych Tel.022
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 1000 Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Roztwór do wstrzykiwań Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 1000 Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Roztwór do wstrzykiwań Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac CircoFLEX zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka (1 ml)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac CircoFLEX zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka (1 ml)
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem
 INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
POLIOMYELITIS. (choroba Heinego Medina, nagminne porażenie dziecięce, porażenie rogów przednich rdzenia, polio)
 W latach 50. na chorobę Heinego-Medina chorowało w Europie i USA jedno na 5000 dzieci. Po wdrożeniu w Polsce masowych szczepień przeciw poliomyelitis, już w 1960 roku zarejestrowano mniej zachorowań. W
W latach 50. na chorobę Heinego-Medina chorowało w Europie i USA jedno na 5000 dzieci. Po wdrożeniu w Polsce masowych szczepień przeciw poliomyelitis, już w 1960 roku zarejestrowano mniej zachorowań. W
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 197092 (96) Data i numer zgłoszenia patentu europejskiego: 22.11.06 06824279.1 (13) (1) T3 Int.Cl. A61K 3/36 (06.01) A61P
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 197092 (96) Data i numer zgłoszenia patentu europejskiego: 22.11.06 06824279.1 (13) (1) T3 Int.Cl. A61K 3/36 (06.01) A61P
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac PRRS MLV liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla świń 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac PRRS MLV liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla świń 2. SKŁAD
PROFIALKTYKA GRYPY W GMINIE CZAPLINEK W LATACH
 PROFIALKTYKA GRYPY W GMINIE CZAPLINEK W LATACH 2010-2016 CO WARTO WIEDZIEĆ O GRYPIE Każdego roku na całym świecie zaraża się 5-10% populacji osób dorosłych i 20-30%dzieci Wirusy grypy ludzkiej łatwiej
PROFIALKTYKA GRYPY W GMINIE CZAPLINEK W LATACH 2010-2016 CO WARTO WIEDZIEĆ O GRYPIE Każdego roku na całym świecie zaraża się 5-10% populacji osób dorosłych i 20-30%dzieci Wirusy grypy ludzkiej łatwiej
PROFILAKTYKA PRZECIW GRYPIE
 PROFILAKTYKA PRZECIW GRYPIE Koordynator profilaktyki : mgr piel. Anna Karczewska CELE: zwiększanie świadomości pacjenta na temat szczepionek przeciwko grypie zapobieganie zachorowań na grypę zapobieganie
PROFILAKTYKA PRZECIW GRYPIE Koordynator profilaktyki : mgr piel. Anna Karczewska CELE: zwiększanie świadomości pacjenta na temat szczepionek przeciwko grypie zapobieganie zachorowań na grypę zapobieganie
KOMUNIKAT GŁÓWNEGO INSPEKTORATU SANITARNEGO W ZWIĄZKU Z WYSTĄPIENIEM PRZYPADKÓW ZAKAŻENIA WIRUSEM GRYPY ŚWIŃ TYPU A/H1N1 U LUDZI W USA I MEKSYKU
 KOMUNIKAT GŁÓWNEGO INSPEKTORATU SANITARNEGO W ZWIĄZKU Z WYSTĄPIENIEM PRZYPADKÓW ZAKAŻENIA WIRUSEM GRYPY ŚWIŃ TYPU A/H1N1 U LUDZI W USA I MEKSYKU z dnia 26 kwietnia 2009 r. (godz. 19.00 ) (Źródło: WHO,
KOMUNIKAT GŁÓWNEGO INSPEKTORATU SANITARNEGO W ZWIĄZKU Z WYSTĄPIENIEM PRZYPADKÓW ZAKAŻENIA WIRUSEM GRYPY ŚWIŃ TYPU A/H1N1 U LUDZI W USA I MEKSYKU z dnia 26 kwietnia 2009 r. (godz. 19.00 ) (Źródło: WHO,
PL B1. Preparat o właściwościach przeciwutleniających oraz sposób otrzymywania tego preparatu. POLITECHNIKA ŁÓDZKA, Łódź, PL
 PL 217050 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 217050 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 388203 (22) Data zgłoszenia: 08.06.2009 (51) Int.Cl.
PL 217050 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 217050 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 388203 (22) Data zgłoszenia: 08.06.2009 (51) Int.Cl.
Dobierając optymalny program szczepień, jesteśmy w stanie zapobiec chorobom, które mogą być zagrożeniem dla zdrowia Państwa pupila.
 SZCZEPIENIA KOTÓW Działamy według zasady: Lepiej zapobiegać niż leczyć Wychodząc naprzeciw Państwa oczekiwaniom oraz dbając o dobro Waszych pupili opisaliśmy program profilaktyczny chorób zakaźnych psów,
SZCZEPIENIA KOTÓW Działamy według zasady: Lepiej zapobiegać niż leczyć Wychodząc naprzeciw Państwa oczekiwaniom oraz dbając o dobro Waszych pupili opisaliśmy program profilaktyczny chorób zakaźnych psów,
Informacja nt. sytuacji epidemiologicznej odry
 Łódź, dnia 28.01.2019 r. Informacja nt. sytuacji epidemiologicznej odry 23.01.2019 Rocznie rejestrowanych było w Polsce średnio 100 przypadków odry. W 2017 r. zarejestrowano 63 przypadki, zaś w 2018 r.
Łódź, dnia 28.01.2019 r. Informacja nt. sytuacji epidemiologicznej odry 23.01.2019 Rocznie rejestrowanych było w Polsce średnio 100 przypadków odry. W 2017 r. zarejestrowano 63 przypadki, zaś w 2018 r.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval IBR-Marker Vivum Liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval IBR-Marker Vivum Liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła.
PL B1. Sposób i układ do modyfikacji widma sygnału ultraszerokopasmowego radia impulsowego. POLITECHNIKA GDAŃSKA, Gdańsk, PL
 PL 219313 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 219313 (13) B1 (21) Numer zgłoszenia: 391153 (51) Int.Cl. H04B 7/00 (2006.01) H04B 7/005 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej
PL 219313 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 219313 (13) B1 (21) Numer zgłoszenia: 391153 (51) Int.Cl. H04B 7/00 (2006.01) H04B 7/005 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej
Silny niepożądany odczyn poszczepienny u rocznego dziecka. Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, r.
 Silny niepożądany odczyn poszczepienny u rocznego dziecka Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, 18.11.2016 r. 2 Co to jest niepożądany odczyn poszczepienny Niepożądany odczyn poszczepienny
Silny niepożądany odczyn poszczepienny u rocznego dziecka Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, 18.11.2016 r. 2 Co to jest niepożądany odczyn poszczepienny Niepożądany odczyn poszczepienny
Aspekty prawne w kontekście zagrożenia funkcjonariuszy i pracowników SW ekspozycją na wirusa HIV
 Aspekty prawne w kontekście zagrożenia funkcjonariuszy i pracowników SW ekspozycją na wirusa HIV Zespół Służby Medycyny Pracy i Bezpieczeństwa i Higieny Pracy Centralny Zarząd Służby Więziennej Ustawa
Aspekty prawne w kontekście zagrożenia funkcjonariuszy i pracowników SW ekspozycją na wirusa HIV Zespół Służby Medycyny Pracy i Bezpieczeństwa i Higieny Pracy Centralny Zarząd Służby Więziennej Ustawa
UWAGA: W składzie szczepionki podano minimalne miana wirusów odry, świnki i różyczki oznaczane pod koniec terminu ważności preparatu.
 ULOTKA DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem PRIORIX (Vaccinum morbillorum, parotitidis et rubellae vivum) Liofilizat i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
ULOTKA DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem PRIORIX (Vaccinum morbillorum, parotitidis et rubellae vivum) Liofilizat i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum mite, krople do nosa, zawiesina. Nieswoista szczepionka bakteryjna.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml szczepionki zawiera inaktywowane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum mite, krople do nosa, zawiesina. Nieswoista szczepionka bakteryjna.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml szczepionki zawiera inaktywowane
21.04.2016 r., OZiPZ PSSE Opole Lubelskie
 24-30 kwietnia 2016 r. ph DOMKNIJMY LUKĘ W SZCZEPIENIACH! Główny cel inicjatywy: zwiększenie liczby osób zaszczepionych poprzez podniesienie wiedzy i świadomości społeczeństwa na temat znaczenia szczepień
24-30 kwietnia 2016 r. ph DOMKNIJMY LUKĘ W SZCZEPIENIACH! Główny cel inicjatywy: zwiększenie liczby osób zaszczepionych poprzez podniesienie wiedzy i świadomości społeczeństwa na temat znaczenia szczepień
PL B1. Ośrodek Badawczo-Rozwojowy Izotopów POLATOM,Świerk,PL BUP 12/05
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 201238 (13) B1 (21) Numer zgłoszenia: 363932 (51) Int.Cl. G21G 4/08 (2006.01) C01F 17/00 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej (22)
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 201238 (13) B1 (21) Numer zgłoszenia: 363932 (51) Int.Cl. G21G 4/08 (2006.01) C01F 17/00 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej (22)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO RESPIPORC FLU3 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO RESPIPORC FLU3 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon
 VI.2 VI.2.1 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon Omówienie rozpowszechnienia choroby Deksametazonu sodu fosforan w postaci roztworu do wstrzykiwań stosowany jest
VI.2 VI.2.1 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon Omówienie rozpowszechnienia choroby Deksametazonu sodu fosforan w postaci roztworu do wstrzykiwań stosowany jest
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1/18
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1/18 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Nobivac Piro 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO W dawce 1 ml: Substancja
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1/18 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Nobivac Piro 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO W dawce 1 ml: Substancja
Uchwala nr. Rada Miasta Katowice. z dnia. w sprawie przyjęcia "Programu szczepień profilaktycznych oraz meningokokom".
 PROJEKTUCHWALY Uchwala nr. Rady Miasta Katowice z dnia. BIURO RADY MIASTA KATOWICE Wpl. 2012-09-., 2 BRM...... w sprawie przyjęcia "Programu szczepień profilaktycznych oraz meningokokom". przeciwko pneumokokom
PROJEKTUCHWALY Uchwala nr. Rady Miasta Katowice z dnia. BIURO RADY MIASTA KATOWICE Wpl. 2012-09-., 2 BRM...... w sprawie przyjęcia "Programu szczepień profilaktycznych oraz meningokokom". przeciwko pneumokokom
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
MenB Information - Polish
 Meningokoki grupy B Na tej stronie można znaleźć krótkie podsumowanie informacji o zapobieganiu chorobie i szczepionce, która jest dostępna. Łącza do bardziej szczegółowych informacji można znaleźć u dołu
Meningokoki grupy B Na tej stronie można znaleźć krótkie podsumowanie informacji o zapobieganiu chorobie i szczepionce, która jest dostępna. Łącza do bardziej szczegółowych informacji można znaleźć u dołu
WNIOSKI NAUKOWE I PODSTAWY ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU DLA HBVAXPRO PRZEDSTAWIONE PRZEZ EMEA
 WNIOSKI NAUKOWE I PODSTAWY ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU DLA HBVAXPRO PRZEDSTAWIONE PRZEZ EMEA WPROWADZENIE HBVAXPRO jest monowalentną szczepionką opracowaną w celu czynnego uodporniania
WNIOSKI NAUKOWE I PODSTAWY ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU DLA HBVAXPRO PRZEDSTAWIONE PRZEZ EMEA WPROWADZENIE HBVAXPRO jest monowalentną szczepionką opracowaną w celu czynnego uodporniania
Ulotka dołączona do opakowania: informacja dla użytkownika. Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych
 Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
VARILRIX (Vaccinum varicellae vivum) Liofilizat i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań podskórnych.
 INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem VARILRIX (Vaccinum varicellae vivum) Liofilizat i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań podskórnych.
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem VARILRIX (Vaccinum varicellae vivum) Liofilizat i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań podskórnych.
Moc. Żywy wirus zakaźnego zapalenia torby Fabrycjusza, szczep V EID 50 na dawkę Żywy wirus zakaźnego zapalenia torby Fabrycjusza,
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC WETERYNARYJNEGO PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA, ZALECANA DAWKA, OKRES KARENCJI, WNIOSKODAWCA/PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC WETERYNARYJNEGO PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA, ZALECANA DAWKA, OKRES KARENCJI, WNIOSKODAWCA/PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE
PL 213904 B1. Elektrolityczna, nanostrukturalna powłoka kompozytowa o małym współczynniku tarcia, zużyciu ściernym i korozji
 PL 213904 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 213904 (13) B1 (21) Numer zgłoszenia: 390004 (51) Int.Cl. C25D 3/12 (2006.01) C25D 15/00 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej
PL 213904 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 213904 (13) B1 (21) Numer zgłoszenia: 390004 (51) Int.Cl. C25D 3/12 (2006.01) C25D 15/00 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej
PROKALCYTONINA infekcje bakteryjne i sepsa. wprowadzenie
 PROKALCYTONINA infekcje bakteryjne i sepsa wprowadzenie CZĘŚĆ PIERWSZA: Czym jest prokalcytonina? PCT w diagnostyce i monitowaniu sepsy PCT w diagnostyce zapalenia dolnych dróg oddechowych Interpretacje
PROKALCYTONINA infekcje bakteryjne i sepsa wprowadzenie CZĘŚĆ PIERWSZA: Czym jest prokalcytonina? PCT w diagnostyce i monitowaniu sepsy PCT w diagnostyce zapalenia dolnych dróg oddechowych Interpretacje
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Bovela liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Bovela liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD
Aktualne problemy systemu szczepień w Polsce
 Warszawa, 9 grudnia 2016 r. Aktualne problemy systemu szczepień w Polsce Zakażenia wirusowe, możliwości współczesnej wakcynologii Głównym zadaniem wszystkich szczepień jest indukowanie odporności na zakażenie.
Warszawa, 9 grudnia 2016 r. Aktualne problemy systemu szczepień w Polsce Zakażenia wirusowe, możliwości współczesnej wakcynologii Głównym zadaniem wszystkich szczepień jest indukowanie odporności na zakażenie.
Ulotka dołączona do opakowania: informacja dla użytkownika. Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab
 Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Equip EHV 1,4 zawiesina do wstrzykiwań dla koni 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ (-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Equip EHV 1,4 zawiesina do wstrzykiwań dla koni 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ (-YCH)
PL B1. POLITECHNIKA ŁÓDZKA, Łódź, PL BUP 17/11. RADOSŁAW ROSIK, Łódź, PL WUP 08/12. rzecz. pat. Ewa Kaczur-Kaczyńska
 PL 212206 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 212206 (13) B1 (21) Numer zgłoszenia: 390424 (51) Int.Cl. C07C 31/20 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia:
PL 212206 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 212206 (13) B1 (21) Numer zgłoszenia: 390424 (51) Int.Cl. C07C 31/20 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia:
WZW TYPU B CO POWINIENEŚ WIEDZIEĆ? CZY WYKORZYSTAŁEŚ WSZYSTKIE DOSTĘPNE ŚRODKI ABY USTRZEC SIĘ PRZED WIRUSOWYM ZAPALENIEM WĄTROBY TYPU B?
 SZCZEPIONKA WZW TYPU B CO POWINIENEŚ WIEDZIEĆ? CZY WYKORZYSTAŁEŚ WSZYSTKIE DOSTĘPNE ŚRODKI ABY USTRZEC SIĘ PRZED WIRUSOWYM ZAPALENIEM WĄTROBY TYPU B? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ!
SZCZEPIONKA WZW TYPU B CO POWINIENEŚ WIEDZIEĆ? CZY WYKORZYSTAŁEŚ WSZYSTKIE DOSTĘPNE ŚRODKI ABY USTRZEC SIĘ PRZED WIRUSOWYM ZAPALENIEM WĄTROBY TYPU B? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ!
Iwona Budrewicz Promocja Zdrowia Powiatowa Stacja Sanitarno-Epidemiologiczna w Kamieniu Pomorskim
 Iwona Budrewicz Promocja Zdrowia Powiatowa Stacja Sanitarno-Epidemiologiczna w Kamieniu Pomorskim Gruźlica jest przewlekłą chorobą zakaźną. W większości przypadków zakażenie zlokalizowane jest w płucach
Iwona Budrewicz Promocja Zdrowia Powiatowa Stacja Sanitarno-Epidemiologiczna w Kamieniu Pomorskim Gruźlica jest przewlekłą chorobą zakaźną. W większości przypadków zakażenie zlokalizowane jest w płucach
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoruvax, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoruvax, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
Kiedy lekarz powinien decydować o wyborze terapii oraz klinicznej ocenie korzyści do ryzyka stosowania leków biologicznych lub biopodobnych?
 Kiedy lekarz powinien decydować o wyborze terapii oraz klinicznej ocenie korzyści do ryzyka stosowania leków biologicznych lub biopodobnych? prof. dr hab. med.. Piotr Fiedor Warszawski Uniwersytet Medyczny
Kiedy lekarz powinien decydować o wyborze terapii oraz klinicznej ocenie korzyści do ryzyka stosowania leków biologicznych lub biopodobnych? prof. dr hab. med.. Piotr Fiedor Warszawski Uniwersytet Medyczny
(86) Data i numer zgłoszenia międzynarodowego: , PCT/EP02/ (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 205926 (21) Numer zgłoszenia: 366897 (22) Data zgłoszenia: 02.07.2002 (86) Data i numer zgłoszenia międzynarodowego:
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 205926 (21) Numer zgłoszenia: 366897 (22) Data zgłoszenia: 02.07.2002 (86) Data i numer zgłoszenia międzynarodowego:
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE
 WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
Badania. przesiewowe stosowane w celu wczesnego wykrycia raka szyjki macicy. zalecenia National Comprehensive Cancer Network (NCCN)
 Badania przesiewowe stosowane w celu wczesnego wykrycia raka szyjki macicy zalecenia National Comprehensive Cancer Network (NCCN) Zalecenia dotyczące badań przesiewowych stosowanych w celu wczesnego wykrycia
Badania przesiewowe stosowane w celu wczesnego wykrycia raka szyjki macicy zalecenia National Comprehensive Cancer Network (NCCN) Zalecenia dotyczące badań przesiewowych stosowanych w celu wczesnego wykrycia
(96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1529464 (96) Data i numer zgłoszenia patentu europejskiego: 18.10.2004 04105133.5 (13) T3 (51) Int. Cl. A47B91/06 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1529464 (96) Data i numer zgłoszenia patentu europejskiego: 18.10.2004 04105133.5 (13) T3 (51) Int. Cl. A47B91/06 (2006.01)
PL B1. UNIWERSYTET EKONOMICZNY W POZNANIU, Poznań, PL BUP 21/09. DARIA WIECZOREK, Poznań, PL RYSZARD ZIELIŃSKI, Poznań, PL
 PL 215965 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 215965 (13) B1 (21) Numer zgłoszenia: 384841 (51) Int.Cl. C07D 265/30 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia:
PL 215965 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 215965 (13) B1 (21) Numer zgłoszenia: 384841 (51) Int.Cl. C07D 265/30 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia:
III. INFORMACJE UZUPEŁNIAJĄCE. A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B)
 III. INFORMACJE UZUPEŁNIAJĄCE A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B) 1. Szczepienia podstawowe noworodków i niemowląt wykonywane są trzema dawkami szczepionki w cyklu zbliżonym
III. INFORMACJE UZUPEŁNIAJĄCE A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B) 1. Szczepienia podstawowe noworodków i niemowląt wykonywane są trzema dawkami szczepionki w cyklu zbliżonym
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk
 Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Cevac Meta L liofilizat do sporządzania zawiesiny dla kur 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Cevac Meta L liofilizat do sporządzania zawiesiny dla kur 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval RS+PI3 IntraNasal 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO 1 dawka (2 ml) zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval RS+PI3 IntraNasal 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO 1 dawka (2 ml) zawiera:
