TYPY REAKCJI CHEMICZNYCH
|
|
|
- Agata Pawlik
- 8 lat temu
- Przeglądów:
Transkrypt
1 CHEMIA SPALANIA
2 TYPY REAKCJI CHEMICZNYCH Jednocząsteczkowe (I rzędu): A C+D (np. C 2 H 6 CH 3 + CH 3 ) Dwucząsteczkowe (II- rzędu) (np. H + O 2 OH + O) A + B C + D Trójcząsteczkowe (III rzędu) A + B + M C + M (np. H+O 2 + M HO 2 + M)
3 SKŁADNIKI REAKCJI CHEMICZNYCH (reagenty) Cząstki stabilne: O 2, H 2, N 2, CH 4... Cząstki wzbudzone: O 2*, CO *, 2 N 2*,... Rodniki: O, H, N, C, OH, HO 2, CH, CH 3, C 2 H 5,...
4 RODNIKI Rodniki są to wolne atomy i fragmenty cząstek o nieparzystej liczbie elektronów lub dwóch elektronach niesparowanych. StęŜenie rodników w płomieniu jest niewielkie: mol/m 3 ale ich rola we wszystkich reakcjach jest bardzo waŝna poniewaŝ są bardzo reaktywne i niosą duŝą energię.
5 Skąd się biorą RODNIKI 1. Reakcje dysocjacji: Dysocjacja termiczna O 2 + M O + O + M Dysocjacja foto NO 2 + νh NO + O 2. Reakcje rozgałęzienia: H + O 2 O + OH O + H 2 H + OH
6 WPŁYW WYBRANYCH CZYNNIKÓW NA SZYBKOŚĆ REAKCJI
7 SZYBKOŚĆ REAKCJI dα A /dt WPŁYW STĘśEŃ SKŁADNIKÓW I rzędu (A B + C) II rzędu (A+B C+D) dα A /dt = -k α A III- rzędu (A+B+M CD+M) dα A /dt = -k α A α B dα A /dt = - k α A α B α M k stała szybkości reakcji,α A stęŝenie A [mol/m 3 ]
8 SZYBKOŚĆ REAKCJI WPŁYW CIŚNIENIA StęŜenie składnika α A określa się w mol/m 3, co jest proporcjonalne do gęstości (kg/m 3 ), a gęstość z równania stanu gazu jest proporcjonalna do ciśnienia p: ρ = prt, więc szybkość reakcji zaleŝy od ciśnienia i rzędu reakcji: n rząd reakcji. dα A /dt - p n
9 WPŁYW TEMPERATURY NA STAŁĄ SZYBKOŚCI REAKCJI Prawo Arrheniusa: k = k o e -E/(RT) k stała szybkości reakcji k o współczynnik przedeksponencjalny E energia aktywacji (J/mol) T temperatura (K) R uniwersalna stała gazowa (J/(mol*K))
10 REAKCJE ELEMENTARNE Reakcje elementarne zachodzą jako pojedyncze akty między reagentami, np.: H + O 2 O + OH Są to przede wszystkim reakcje rodnikowe, jak wyŝej. Rząd ich reakcji odpowiada liczbie składników w reakcji.
11 REAKCJE ZŁOśONE Reakcje złoŝone to zapis reakcji między stabilnymi substratami, dającymi stabilne produkty, np.: CH 4 + 2O 2 CO 2 + 2H 2 O Takiej reakcji nie ma, jest to tylko zapis związku substraty-produkty. dc A /dt = -k C Aα C B β gdzie: α i β są współczynnikami doświadczalnymi. Naprawdę reakcje złoŝone składają się z wielu reakcji elementarnych (rodnikowych).
12 TYPY REAKCJI RODNIKOWYCH 1. Reakcje rozgałęzienia (rodników R): R + A R 1 + R 2 2. Reakcje propagacji: R + A 1 R 2 + B 3. Reakcje rekombinacji: R + A + M AB + M
13 ZNACZENIE TRZECIEGO CIAŁA W REAKCJI REKOMBINACJI Reakcje trójcząsteczkowe (rekombinacji): A + B + M C + M M trzecie ciało (O 2, N 2, H 2, H 2 O,...) pochłaniające energię przebudowy związku. Np. H + O 2 + M HO 2 + M H + OH + M H 2 O + M
14 MECHANIZMY SPALANIA
15 UKŁAD H 2 +O 2 Znaczenie układu H 2 +O 2 : reakcje z tego układu występują w reakcjach wszystkich paliw kopalnych Inicjacja spalania: mechanizm propagacji płomienia H + O 2 O + OH O + H 2 H + OH OH + H 2 H + H 2 O H + O 2 + M HO 2 + M (r. rozgałęzienia) (r. rozgałęzienia) (r. propagacji) (r. rekombinacji)
16 UKŁAD H 2 +O 2 Rekombinacja rodników wnosi największy wkład do energii wewnętrznej spalin w strefie popłomiennej. Strefa popłomienna H + H + M H 2 + M H + OH + M H 2 O + M OH + HO 2 + M H 2 O + O 2 + M Reakcje rekombinacji w strefie popłomiennej
17 MECH. SPALANIA: UTLENIANIE CO Znaczenie CO wynika stąd, Ŝe jest CO jest półproduktem spalania wszystkich paliw kopalnych i utlenia się powoli. W płomieniu CO utlenia się prawie wyłącznie w reakcji: CO + OH CO 2 + H (1) Dlatego dla utleniania CO w płomieniu potrzebna jest w układzie woda. Dodatkowo występuje trójmolekularna reakcja utleniania CO: CO + O + M CO 2 + M ale ma ona marginalne znaczenie w porównaniu z reakcją (1).
18 MECH. SPALANIA: UTLENIANIE WĘGLOWODORÓW Znaczenie utleniania węglowodorów wynika z faktu, Ŝe paliwa kopalne składają się z węglowodorów. Utlenianie węglowodorów obejmuje bardzo złoŝone mechanizmy. Generalnie moŝna wyróŝnić mechanizmy utleniania węglowodorów: niskotemperaturowy (zimne płomienie, silniki Diesla), wysokotemperaturowy(spalanie wysoko temperat.).
19 NISKOTEMPERATUROWE UTLENIANIE WĘGLOWODRÓW 1. Powstają i gromadzą się wodoronadtlenki (ROOH): RH+O 2 = HO 2 +R R+O 2 = ROO ROO + RH = ROOH + R 2. Następuje ich rozpad (zimne płomienie) i powstanie formaldehydu: CH 3 +HO 2 = HCHO * + H 2 O 3. Rozpad formaldehydu (niebieskie płomienie): HCHO + O 2 = HCO * + HO 2 4. Gorący zapłon i utlenianie wysokotemperaturowe (spalanie) RH + OH R + H 2 O, RH + O R + OH, RH + H R + H 2
20 WYSOKOTEMPERATUROWE UTLENIANIE WĘGLOWODORÓW W płomieniach waŝny jest mechanizm wysokotemperaturowy utleniania węglowodorów (RH, R -rodnik). Utlenianie węglowodorów zaczyna się atakiem rodników: RH + H R + H 2 RH + OH R + H 2 O RH + O R + OH W dalszym ciągu następuje rozbicie rodników R na mniejsze rodniki, które w kolejnych reakcjach przekształcają się do półproduktów spalania CHO i CO, utlenianych w końcu do CO 2 i H 2 O.
21 UTLENIANIE WĘGLOWODORÓW LICZBA REAKCJI Liczba reakcji elementarnych utleniania węglowodorów zaleŝy od ich budowy i zawiera się w zakresie od kilkuset do kilku tysięcy.
22 POWSTAWANIE TERMICZNYCH NO x Mechanizm termiczny polega na tworzeniu NO x przez reagowanie O 2 i N 2 w powietrze w wysokiej temperaturze. Pogrzewając powietrze otrzymuje się tlenek azotu! Decydującym czynnikiem w tym mechanizmie jest temperatura.
23 MECHANIZM TERMICZNY NO x Decydujące znaczenie ma reakcja dysocjacji tlenu: O 2 + M O + O + M Dostarcza ona rodników do ataku atomów O na cząstki N 2 O + N 2 NO + N N + O 2 NO + O W płomieniu dodatkowo naleŝy uwzględnić jeszcze: OH + N NO + H
TERMOCHEMIA SPALANIA
 TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
TERMOCHEMIA SPALANIA
 TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
STECHIOMETRIA SPALANIA
 STECHIOMETRIA SPALANIA Mole i kilomole Masa atomowa pierwiastka to średnia waŝona mas wszystkich jego naturalnych izotopów w stosunku do 1/12 masy izotopu węgla: 1/12 126 C ~ 1,66 10-27 kg Liczba Avogadra
STECHIOMETRIA SPALANIA Mole i kilomole Masa atomowa pierwiastka to średnia waŝona mas wszystkich jego naturalnych izotopów w stosunku do 1/12 masy izotopu węgla: 1/12 126 C ~ 1,66 10-27 kg Liczba Avogadra
4. ODAZOTOWANIE SPALIN
 4. DAZTWANIE SPALIN 4.1. Pochodzenie tlenków azotu w spalinach 4.2. Metody ograniczenia emisji tlenków azotu systematyka metod 4.3. Techniki ograniczania emisji tlenków azotu 4.4. Analiza porównawcza 1
4. DAZTWANIE SPALIN 4.1. Pochodzenie tlenków azotu w spalinach 4.2. Metody ograniczenia emisji tlenków azotu systematyka metod 4.3. Techniki ograniczania emisji tlenków azotu 4.4. Analiza porównawcza 1
KI + Pb(NO 3 ) 2 PbI 2 + KNO 3. fermentacja alkoholowa
 Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
KI + Pb(NO 3 ) 2 PbI 2 + KNO 3. fermentacja alkoholowa
 Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka. Kinetyka. Stawia dwa pytania: 1)Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? energia swobodna, G. postęp reakcji.
 Kinetyka energia swobodna, G termodynamika stan 1 kinetyka termodynamika stan 2 postęp reakcji 1 Kinetyka Stawia dwa pytania: 1)Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 2 Jak szybko
Kinetyka energia swobodna, G termodynamika stan 1 kinetyka termodynamika stan 2 postęp reakcji 1 Kinetyka Stawia dwa pytania: 1)Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 2 Jak szybko
Kinetyka. energia swobodna, G. postęp reakcji. stan 1 stan 2. kinetyka
 Kinetyka postęp reakcji energia swobodna, G termodynamika kinetyka termodynamika stan 1 stan 2 Kinetyka Stawia dwa pytania: 1) Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 1) Jak szybko
Kinetyka postęp reakcji energia swobodna, G termodynamika kinetyka termodynamika stan 1 stan 2 Kinetyka Stawia dwa pytania: 1) Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 1) Jak szybko
STECHIOMETRIA SPALANIA
 STECHIOMETRIA SPALANIA Mole i kilomole Masa atomowa pierwiastka to średnia ważona mas wszystkich jego naturalnych izotopów w stosunku do 1/12 masy izotopu węgla: 1/12 126 C ~ 1,66 10-27 kg Liczba Avogadra
STECHIOMETRIA SPALANIA Mole i kilomole Masa atomowa pierwiastka to średnia ważona mas wszystkich jego naturalnych izotopów w stosunku do 1/12 masy izotopu węgla: 1/12 126 C ~ 1,66 10-27 kg Liczba Avogadra
Inżynieria Biomedyczna
 1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
ZADANIE 1 W temperaturze 700 K gazowa mieszanina dwutlenku węgla i wodoru reaguje z wytworzeniem pary wodnej i tlenku węgla. Stała równowagi reakcji
 ZADANIE 1 W temperaturze 700 K gazowa mieszanina dwutlenku węgla i wodoru reaguje z wytworzeniem pary wodnej i tlenku węgla. Stała równowagi reakcji w tej temperaturze wynosi K p = 0,11. Reaktor został
ZADANIE 1 W temperaturze 700 K gazowa mieszanina dwutlenku węgla i wodoru reaguje z wytworzeniem pary wodnej i tlenku węgla. Stała równowagi reakcji w tej temperaturze wynosi K p = 0,11. Reaktor został
KONKURS CHEMICZNY ROK PRZED MATURĄ
 Wydział Chemii UMCS Polskie Towarzystwo Chemiczne Doradca metodyczny ds. nauczania chemii KONKURS CHEMICZNY ROK PRZED MATURĄ ROK SZKOLNY 2006/2007 ETAP SZKOLNY Numer kodowy Suma punktów Podpisy Komisji:
Wydział Chemii UMCS Polskie Towarzystwo Chemiczne Doradca metodyczny ds. nauczania chemii KONKURS CHEMICZNY ROK PRZED MATURĄ ROK SZKOLNY 2006/2007 ETAP SZKOLNY Numer kodowy Suma punktów Podpisy Komisji:
Wyznaczanie stałej szybkości reakcji wymiany jonowej
 Wyznaczanie stałej szybkości reakcji wymiany jonowej Ćwiczenie laboratoryjne nr 4 Elementy termodynamiki i kinetyki procesowej Anna Ptaszek Elementy kinetyki chemicznej Pojęcie szybkości reakcji Pojęcie
Wyznaczanie stałej szybkości reakcji wymiany jonowej Ćwiczenie laboratoryjne nr 4 Elementy termodynamiki i kinetyki procesowej Anna Ptaszek Elementy kinetyki chemicznej Pojęcie szybkości reakcji Pojęcie
Inżynieria Biomedyczna
 1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. a RT.
 Ćwiczenie 12, 13. Kinetyka chemiczna. Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. Szybkość reakcji chemicznej jest związana
Ćwiczenie 12, 13. Kinetyka chemiczna. Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. Szybkość reakcji chemicznej jest związana
Nazwisko...Imię...Nr albumu... ZGAZOWANIE PALIW V ME/E, Test 11 (dn )
 Nazwisko...Imię...Nr albumu... ZGAZOWANIE PALIW V ME/E, Test 11 (dn. 2008.01.25) 1. Co jest pozostałością stałą z węgla po procesie: a) odgazowania:... b) zgazowania... 2. Który w wymienionych rodzajów
Nazwisko...Imię...Nr albumu... ZGAZOWANIE PALIW V ME/E, Test 11 (dn. 2008.01.25) 1. Co jest pozostałością stałą z węgla po procesie: a) odgazowania:... b) zgazowania... 2. Który w wymienionych rodzajów
Wykład 4. Anna Ptaszek. 27 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 4. Anna Ptaszek 1 / 31
 Wykład 4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 27 października 2015 1 / 31 Podstawy kinetyki chemicznej pochodna funkcji i jej interpretacja, pojęcie szybkości i prędkości, stechiometria
Wykład 4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 27 października 2015 1 / 31 Podstawy kinetyki chemicznej pochodna funkcji i jej interpretacja, pojęcie szybkości i prędkości, stechiometria
Dysocjacja kwasów i zasad. ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to:
 Stała równowagi dysocjacji: Dysocjacja kwasów i zasad HX H 2 O H 3 O X - K a [ H 3O [ X [ HX [ H O 2 ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to: K a [ H 3 O [ X [ HX Dla słabych kwasów
Stała równowagi dysocjacji: Dysocjacja kwasów i zasad HX H 2 O H 3 O X - K a [ H 3O [ X [ HX [ H O 2 ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to: K a [ H 3 O [ X [ HX Dla słabych kwasów
SPALANIE PALIW GAZOWYCH
 SPALANIE PALIW GAZOWYCH MIESZANKA PALNA Mieszanka palna to mieszanina powietrza z paliwem, w której: po zniknięciu źródła zapłonu proces spalania rozwija się w niej samorzutnie. RODZAJE MIESZANEK PALNYCH
SPALANIE PALIW GAZOWYCH MIESZANKA PALNA Mieszanka palna to mieszanina powietrza z paliwem, w której: po zniknięciu źródła zapłonu proces spalania rozwija się w niej samorzutnie. RODZAJE MIESZANEK PALNYCH
Samopropagująca synteza spaleniowa
 Samopropagująca synteza spaleniowa Inne zastosowania nauki o spalaniu Dyfuzja gazów w płomieniu Zachowanie płynnych paliw i aerozoli; Rozprzestrzenianie się płomieni wzdłuż powierzchni Synteza spaleniowa
Samopropagująca synteza spaleniowa Inne zastosowania nauki o spalaniu Dyfuzja gazów w płomieniu Zachowanie płynnych paliw i aerozoli; Rozprzestrzenianie się płomieni wzdłuż powierzchni Synteza spaleniowa
Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ
 Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
REDUXCO. Katalizator spalania. Leszek Borkowski DAGAS sp z.o.o. D/LB/6/13 GreenEvo
 Katalizator spalania DAGAS sp z.o.o Katalizator REDUXCO - wpływa na poprawę efektywności procesu spalania paliw stałych, ciekłych i gazowych w różnego rodzaju kotłach instalacji wytwarzających energie
Katalizator spalania DAGAS sp z.o.o Katalizator REDUXCO - wpływa na poprawę efektywności procesu spalania paliw stałych, ciekłych i gazowych w różnego rodzaju kotłach instalacji wytwarzających energie
fermentacja alkoholowa erozja skał lata dni KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 min Karkonosze Pielgrzymy (1204 m n.p.m.)
 Kinetyka chemiczna lata erozja skał Karkonosze Pielgrzymy (1204 m n.p.m.) fermentacja alkoholowa dni min KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 s ms fs http://www2.warwick.ac.uk/fac/sci/chemistry/research/stavros/stavrosgroup/overview/
Kinetyka chemiczna lata erozja skał Karkonosze Pielgrzymy (1204 m n.p.m.) fermentacja alkoholowa dni min KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 s ms fs http://www2.warwick.ac.uk/fac/sci/chemistry/research/stavros/stavrosgroup/overview/
Ćwiczenie 14. Maria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYMATYCZNYCH
 Ćwiczenie 14 aria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYATYCZNYCH Zagadnienia: Podstawowe pojęcia kinetyki chemicznej (szybkość reakcji, reakcje elementarne, rząd reakcji). Równania kinetyczne prostych
Ćwiczenie 14 aria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYATYCZNYCH Zagadnienia: Podstawowe pojęcia kinetyki chemicznej (szybkość reakcji, reakcje elementarne, rząd reakcji). Równania kinetyczne prostych
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 01/1 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 01/1 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
LABORATORIUM SPALANIA I PALIW
 1. Wprowadzenie 1.1.Podstawowe definicje Spalanie egzotermiczna reakcja chemiczna przebiegająca między paliwem a utleniaczem. Mieszanina palna mieszanina paliwa i utleniacza w której płomień rozprzestrzenia
1. Wprowadzenie 1.1.Podstawowe definicje Spalanie egzotermiczna reakcja chemiczna przebiegająca między paliwem a utleniaczem. Mieszanina palna mieszanina paliwa i utleniacza w której płomień rozprzestrzenia
Sonochemia. Schemat 1. Strefy reakcji. Rodzaje efektów sonochemicznych. Oscylujący pęcherzyk gazu. Woda w stanie nadkrytycznym?
 Schemat 1 Strefy reakcji Rodzaje efektów sonochemicznych Oscylujący pęcherzyk gazu Woda w stanie nadkrytycznym? Roztwór Znaczne gradienty ciśnienia Duże siły hydrodynamiczne Efekty mechanochemiczne Reakcje
Schemat 1 Strefy reakcji Rodzaje efektów sonochemicznych Oscylujący pęcherzyk gazu Woda w stanie nadkrytycznym? Roztwór Znaczne gradienty ciśnienia Duże siły hydrodynamiczne Efekty mechanochemiczne Reakcje
A B. Modelowanie reakcji chemicznych: numeryczne rozwiązywanie równań na szybkość reakcji chemicznych B: 1. da dt. A v. v t
 B: 1 Modelowanie reakcji chemicznych: numeryczne rozwiązywanie równań na szybkość reakcji chemicznych 1. ZałóŜmy, Ŝe zmienna A oznacza stęŝenie substratu, a zmienna B stęŝenie produktu reakcji chemicznej
B: 1 Modelowanie reakcji chemicznych: numeryczne rozwiązywanie równań na szybkość reakcji chemicznych 1. ZałóŜmy, Ŝe zmienna A oznacza stęŝenie substratu, a zmienna B stęŝenie produktu reakcji chemicznej
Przy prawidłowej pracy silnika zapłon mieszaniny paliwowo-powietrznej następuje od iskry pomiędzy elektrodami świecy zapłonowej.
 TEMAT: TEORIA SPALANIA Spalanie reakcja chemiczna przebiegająca między materiałem palnym lub paliwem a utleniaczem, z wydzieleniem ciepła i światła. Jeżeli w procesie spalania wszystkie składniki palne
TEMAT: TEORIA SPALANIA Spalanie reakcja chemiczna przebiegająca między materiałem palnym lub paliwem a utleniaczem, z wydzieleniem ciepła i światła. Jeżeli w procesie spalania wszystkie składniki palne
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych
 Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
erozja skał lata KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 min Karkonosze Pielgrzymy (1204 m n.p.m.)
 Kinetyka chemiczna erozja skał Karkonosze Pielgrzymy (1204 m n.p.m.) fermentacja alkoholowa lata min KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 s ms fs http://www2.warwick.ac.uk/fac/sci/chemistry/research/stavros/stavrosgroup/overview/
Kinetyka chemiczna erozja skał Karkonosze Pielgrzymy (1204 m n.p.m.) fermentacja alkoholowa lata min KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 s ms fs http://www2.warwick.ac.uk/fac/sci/chemistry/research/stavros/stavrosgroup/overview/
podstawami stechiometrii, czyli działu chemii zajmującymi są obliczeniami jest prawo zachowania masy oraz prawo stałości składu
 Podstawy obliczeń chemicznych podstawami stechiometrii, czyli działu chemii zajmującymi są obliczeniami jest prawo zachowania masy oraz prawo stałości składu prawo zachowania masy mówi, że w reakcji chemicznej
Podstawy obliczeń chemicznych podstawami stechiometrii, czyli działu chemii zajmującymi są obliczeniami jest prawo zachowania masy oraz prawo stałości składu prawo zachowania masy mówi, że w reakcji chemicznej
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
Inżynieria procesów przetwórstwa węgla, zima 15/16
 Inżynieria procesów przetwórstwa węgla, zima 15/16 Ćwiczenia 1 7.10.2015 1. Załóżmy, że balon ma kształt sfery o promieniu 3m. a. Jaka ilość wodoru potrzebna jest do jego wypełnienia, aby na poziomie morza
Inżynieria procesów przetwórstwa węgla, zima 15/16 Ćwiczenia 1 7.10.2015 1. Załóżmy, że balon ma kształt sfery o promieniu 3m. a. Jaka ilość wodoru potrzebna jest do jego wypełnienia, aby na poziomie morza
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
CHEMIA. Wymagania szczegółowe. Wymagania ogólne
 CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA
 MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Zadanie Odpowiedzi Uwagi a) za uzupełnienie tabeli: Symbol pierwiastka Konfiguracja elektronowa w stanie podstawowym Liczba elektronów walencyjnych S b) za uzupełnienie
MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Zadanie Odpowiedzi Uwagi a) za uzupełnienie tabeli: Symbol pierwiastka Konfiguracja elektronowa w stanie podstawowym Liczba elektronów walencyjnych S b) za uzupełnienie
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych
 Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
PRACOWNIA CHEMII. Kinetyka reakcji chemicznych (Fiz1)
 PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Kinetyka reakcji chemicznych
PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Kinetyka reakcji chemicznych
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Kinetyka reakcji chemicznych. Dr Mariola Samsonowicz
 Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
Wykład 4. Anna Ptaszek. 9 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 4. Anna Ptaszek 1 / 29
 Wykład 4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 9 października 2015 1 / 29 Podstawy kinetyki chemicznej pochodna funkcji i jej interpretacja, pojęcie szybkości i prędkości, stechiometria
Wykład 4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 9 października 2015 1 / 29 Podstawy kinetyki chemicznej pochodna funkcji i jej interpretacja, pojęcie szybkości i prędkości, stechiometria
KONKURS PRZEDMIOTOWY Z CHEMII
 Pieczęć KONKURS PRZEDMIOTOWY Z CHEMII dla uczniów gimnazjów województwa lubuskiego 26 stycznia 2012 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem
Pieczęć KONKURS PRZEDMIOTOWY Z CHEMII dla uczniów gimnazjów województwa lubuskiego 26 stycznia 2012 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem
Kryteria oceniania z chemii kl VII
 Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
PRACOWNIA CHEMII. Reakcje fotochemiczne (Fiz3)
 PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Reakcje fotochemiczne
PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Reakcje fotochemiczne
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu
 Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
Zadanie 2. (1 pkt) Uzupełnij tabelę, wpisując wzory sumaryczne tlenków w odpowiednie kolumny. CrO CO 2 Fe 2 O 3 BaO SO 3 NO Cu 2 O
 Test maturalny Chemia ogólna i nieorganiczna Zadanie 1. (1 pkt) Uzupełnij zdania. Pierwiastek chemiczny o liczbie atomowej 16 znajduje się w.... grupie i. okresie układu okresowego pierwiastków chemicznych,
Test maturalny Chemia ogólna i nieorganiczna Zadanie 1. (1 pkt) Uzupełnij zdania. Pierwiastek chemiczny o liczbie atomowej 16 znajduje się w.... grupie i. okresie układu okresowego pierwiastków chemicznych,
Zagadnienia. Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I
 Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Antyoksydanty pokarmowe a korzyści zdrowotne. dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW
 Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
Wstęp do astrofizyki I
 Wstęp do astrofizyki I Wykład 13 Tomasz Kwiatkowski Uniwersytet im. Adama Mickiewicza w Poznaniu Wydział Fizyki Instytut Obserwatorium Astronomiczne Tomasz Kwiatkowski, OA UAM Wstęp do astrofizyki I, Wykład
Wstęp do astrofizyki I Wykład 13 Tomasz Kwiatkowski Uniwersytet im. Adama Mickiewicza w Poznaniu Wydział Fizyki Instytut Obserwatorium Astronomiczne Tomasz Kwiatkowski, OA UAM Wstęp do astrofizyki I, Wykład
Materiały pomocnicze do laboratorium z przedmiotu Metody i Narzędzia Symulacji Komputerowej
 Materiały pomocnicze do laboratorium z przedmiotu Metody i Narzędzia Symulacji Komputerowej w Systemach Technicznych Symulacja prosta dyszy pomiarowej Bendemanna Opracował: dr inż. Andrzej J. Zmysłowski
Materiały pomocnicze do laboratorium z przedmiotu Metody i Narzędzia Symulacji Komputerowej w Systemach Technicznych Symulacja prosta dyszy pomiarowej Bendemanna Opracował: dr inż. Andrzej J. Zmysłowski
Chemia ogólna nieorganiczna Wykład XII Kinetyka i statyka chemiczna
 Chemia ogólna nieorganiczna Wykład 10 14 XII 2016 Kinetyka i statyka chemiczna Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od
Chemia ogólna nieorganiczna Wykład 10 14 XII 2016 Kinetyka i statyka chemiczna Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od
Wykład 21 XI 2018 Żywienie
 Wykład 21 XI 2018 Żywienie Witold Bekas SGGW Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od warunków przebiegu reakcji pomaga
Wykład 21 XI 2018 Żywienie Witold Bekas SGGW Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od warunków przebiegu reakcji pomaga
POLITECHNIKA WARSZAWSKA Wydział Budownictwa, Mechaniki i Petrochemii Instytut Inżynierii Mechanicznej
 PITECHNIKA WARSZAWSKA Wydział Budownictwa, Mechaniki i Petochemii Instytut Inżynieii Mechanicznej w Płocku Zakład Apaatuy Pzemysłowej ABRATRIUM TERMDYNAMIKI Instukcja stanowiskowa Temat: Analiza spalin
PITECHNIKA WARSZAWSKA Wydział Budownictwa, Mechaniki i Petochemii Instytut Inżynieii Mechanicznej w Płocku Zakład Apaatuy Pzemysłowej ABRATRIUM TERMDYNAMIKI Instukcja stanowiskowa Temat: Analiza spalin
Cz. I Stechiometria - Zadania do samodzielnego wykonania
 Cz. I Stechiometria - Zadania do samodzielnego wykonania A. Ustalenie wzoru rzeczywistego związku chemicznego na podstawie składu procentowego. Zadanie i metoda rozwiązania Ustal wzór rzeczywisty związku
Cz. I Stechiometria - Zadania do samodzielnego wykonania A. Ustalenie wzoru rzeczywistego związku chemicznego na podstawie składu procentowego. Zadanie i metoda rozwiązania Ustal wzór rzeczywisty związku
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7
 Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Otrzymywanie wodoru M
 Otrzymywanie wodoru M Własności wodoru Wodór to najlżejszy pierwiastek świata, składa się on tylko z 1 protonu i krążącego wokół niego elektronu. W stanie wolnym występuje jako cząsteczka dwuatomowa H2.
Otrzymywanie wodoru M Własności wodoru Wodór to najlżejszy pierwiastek świata, składa się on tylko z 1 protonu i krążącego wokół niego elektronu. W stanie wolnym występuje jako cząsteczka dwuatomowa H2.
A. 3-bromo-3,4-dimetyloheks-5-yn B. 4-bromo-4-etylo-3-metylopent-1-yn C. 4-bromo-3,4-dimetyloheks-1-yn D. 2-etylo-2-bromo-3-metylopent-4-yn
 Zadanie 1. (1 pkt) Wskaż poprawną nazwę poniższego związku. A. 3-bromo-3,4-dimetyloheks-5-yn B. 4-bromo-4-etylo-3-metylopent-1-yn C. 4-bromo-3,4-dimetyloheks-1-yn D. 2-etylo-2-bromo-3-metylopent-4-yn Zadanie
Zadanie 1. (1 pkt) Wskaż poprawną nazwę poniższego związku. A. 3-bromo-3,4-dimetyloheks-5-yn B. 4-bromo-4-etylo-3-metylopent-1-yn C. 4-bromo-3,4-dimetyloheks-1-yn D. 2-etylo-2-bromo-3-metylopent-4-yn Zadanie
WYMAGANIA NA POSZCZEGÓLNE STOPNIE SZKOLNE Z CHEMII klasa I
 WYMAGANIA NA POSZCZEGÓLNE STOPNIE SZKOLNE Z CHEMII klasa I Aby uzyskać ocenę wyższą niż dana ocena, uczeń musi opanować wiadomości i umiejętności dotyczące danej oceny oraz ocen od niej niższych. Dział:
WYMAGANIA NA POSZCZEGÓLNE STOPNIE SZKOLNE Z CHEMII klasa I Aby uzyskać ocenę wyższą niż dana ocena, uczeń musi opanować wiadomości i umiejętności dotyczące danej oceny oraz ocen od niej niższych. Dział:
Przemiany substancji
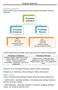 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
uczeń opanował wszystkie wymagania podstawowe i ponadpodstawowe
 1 Agnieszka Wróbel nauczyciel biologii i chemii Plan pracy dydaktycznej na chemii w klasach pierwszych w roku szkolnym 2015/2016 Poziom wymagań Ocena Opis wymagań podstawowe niedostateczna uczeń nie opanował
1 Agnieszka Wróbel nauczyciel biologii i chemii Plan pracy dydaktycznej na chemii w klasach pierwszych w roku szkolnym 2015/2016 Poziom wymagań Ocena Opis wymagań podstawowe niedostateczna uczeń nie opanował
... Nazwisko, imię zawodnika; Klasa Liczba punktów. ... Nazwa szkoły, miejscowość. I Podkarpacki Konkurs Chemiczny 2008/09
 ......... Nazwisko, imię zawodnika; Klasa Liczba punktów KOPKCh... Nazwa szkoły, miejscowość I Podkarpacki Konkurs Chemiczny 2008/09 ETAP III 28.02.2009 r. Godz. 10.00-13.00 Zadanie 1 (10 pkt.) ( postaw
......... Nazwisko, imię zawodnika; Klasa Liczba punktów KOPKCh... Nazwa szkoły, miejscowość I Podkarpacki Konkurs Chemiczny 2008/09 ETAP III 28.02.2009 r. Godz. 10.00-13.00 Zadanie 1 (10 pkt.) ( postaw
WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI I ENERGII AKTYWACJI
 Ćwiczenie nr 4 WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI I ENERGII AKTYWACJI I. Cel ćwiczenia Celem ćwiczenia jest wyznaczenie stałej szybkości reakcji zmydlania estru etylowego w dwóch różnych temperaturach,
Ćwiczenie nr 4 WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI I ENERGII AKTYWACJI I. Cel ćwiczenia Celem ćwiczenia jest wyznaczenie stałej szybkości reakcji zmydlania estru etylowego w dwóch różnych temperaturach,
Wpływ motoryzacji na jakość powietrza
 Instytut Pojazdów Samochodowych i Silników Spalinowych Marek Brzeżański Wpływ motoryzacji na jakość powietrza Spotkanie Grupy Roboczej ds. Ochrony Powietrza i Energetyki Urząd Marszałkowski Województwa
Instytut Pojazdów Samochodowych i Silników Spalinowych Marek Brzeżański Wpływ motoryzacji na jakość powietrza Spotkanie Grupy Roboczej ds. Ochrony Powietrza i Energetyki Urząd Marszałkowski Województwa
Odwracalność przemiany chemicznej
 Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Maksymalna liczba punktów: 40. Czas rozwiązywania zadań: 90 minut.
 Pieczęć KONKURS CHEMICZNY dla uczniów gimnazjów województwa lubuskiego 20 stycznia 2011 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem do rozwiązywania
Pieczęć KONKURS CHEMICZNY dla uczniów gimnazjów województwa lubuskiego 20 stycznia 2011 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem do rozwiązywania
Podstawy kinetyki i termodynamiki chemicznej. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Podstawy kinetyki i termodynamiki chemicznej Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Układ i otoczenie Układem - część środowiska, która stanowi przedmiot naszych badań pojęcie abstrakcyjne,
Podstawy kinetyki i termodynamiki chemicznej Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Układ i otoczenie Układem - część środowiska, która stanowi przedmiot naszych badań pojęcie abstrakcyjne,
CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego
 CIEPŁO, PALIWA, SPALANIE CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego WYMIANA CIEPŁA. Zmiana energii wewnętrznej
CIEPŁO, PALIWA, SPALANIE CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego WYMIANA CIEPŁA. Zmiana energii wewnętrznej
Otrzymywanie halogenków alkilów
 Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
Podstawowe własności jąder atomowych
 Podstawowe własności jąder atomowych 1. Ilość protonów i neutronów Z, N 2. Masa jądra M j = M p + M n - B 2 2 Q ( M c ) ( M c ) 3. Energia rozpadu p 0 k 0 Rozpad zachodzi jeżeli Q > 0, ta nadwyżka energii
Podstawowe własności jąder atomowych 1. Ilość protonów i neutronów Z, N 2. Masa jądra M j = M p + M n - B 2 2 Q ( M c ) ( M c ) 3. Energia rozpadu p 0 k 0 Rozpad zachodzi jeżeli Q > 0, ta nadwyżka energii
Spis treści. Trwałość jądra atomowego. Okres połowicznego rozpadu
 Spis treści 1 Trwałość jądra atomowego 2 Okres połowicznego rozpadu 3 Typy przemian jądrowych 4 Reguła przesunięć Fajansa-Soddy ego 5 Szeregi promieniotwórcze 6 Typy reakcji jądrowych 7 Przykłady prostych
Spis treści 1 Trwałość jądra atomowego 2 Okres połowicznego rozpadu 3 Typy przemian jądrowych 4 Reguła przesunięć Fajansa-Soddy ego 5 Szeregi promieniotwórcze 6 Typy reakcji jądrowych 7 Przykłady prostych
Urządzenie do rozkładu termicznego odpadów organicznych WGW-8 EU
 GREEN ENERGY POLAND Sp. z o.o. Urządzenie do rozkładu termicznego odpadów organicznych WGW-8 EU dr hab. inż. Andrzej Wojciechowski e-mail: andrzej.wojciechowski@imp.edu.pl www.imp.edu.pl Ochrony Środowiska
GREEN ENERGY POLAND Sp. z o.o. Urządzenie do rozkładu termicznego odpadów organicznych WGW-8 EU dr hab. inż. Andrzej Wojciechowski e-mail: andrzej.wojciechowski@imp.edu.pl www.imp.edu.pl Ochrony Środowiska
KONKURS CHEMICZNY,,ROK PRZED MATURĄ
 KONKURS CHEMICZNY,,ROK PRZED MATURĄ ROK SZKOLNY 2007/2008 ETAP SZKOLNY Numer kodowy Suma punktów: Podpisy Komisji: 1.... 2.... 3.... Informacje dla ucznia: 1. Arkusz zawiera 12 zadań. 2. Pisemnych odpowiedzi
KONKURS CHEMICZNY,,ROK PRZED MATURĄ ROK SZKOLNY 2007/2008 ETAP SZKOLNY Numer kodowy Suma punktów: Podpisy Komisji: 1.... 2.... 3.... Informacje dla ucznia: 1. Arkusz zawiera 12 zadań. 2. Pisemnych odpowiedzi
Politechnika Warszawska. Wydział Budownictwa Mechaniki i Petrochemii w Płocku Laboratorium Chemii Budowlanej
 Politechnika Warszawska Wydział Budownictwa Mechaniki i Petrochemii w Płocku Laboratorium Chemii Budowlanej Instrukcja do ćwiczenia: SZYBKOŚĆ PRZEMIAN CHEMICZNYCH Opracowała: dr inŝ. Maria Bukowska Płock,
Politechnika Warszawska Wydział Budownictwa Mechaniki i Petrochemii w Płocku Laboratorium Chemii Budowlanej Instrukcja do ćwiczenia: SZYBKOŚĆ PRZEMIAN CHEMICZNYCH Opracowała: dr inŝ. Maria Bukowska Płock,
CHEMIA I GIMNAZJUM WYMAGANIA PODSTAWOWE
 WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020
 Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020 Ocenę niedostateczną otrzymuje uczeń, który nie opanował wymagań na ocenę dopuszczającą.
Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020 Ocenę niedostateczną otrzymuje uczeń, który nie opanował wymagań na ocenę dopuszczającą.
... kod ucznia Małopolski Konkurs Chemiczny dla Gimnazjalistów
 ... kod ucznia Małopolski Konkurs Chemiczny dla Gimnazjalistów Etap I (szkolny) 21 listopada 2008 roku PoniŜej podano treść pięciu zadań, za rozwiązanie których moŝesz uzyskać 50 punktów. Rozwiązania i
... kod ucznia Małopolski Konkurs Chemiczny dla Gimnazjalistów Etap I (szkolny) 21 listopada 2008 roku PoniŜej podano treść pięciu zadań, za rozwiązanie których moŝesz uzyskać 50 punktów. Rozwiązania i
Chemia fizyczna 2 - wykład
 Chemia fizyczna 2 - wykład Dr hab. inż. Aneta Pobudkowska-Mirecka Konsultacje: środa 12.15 14.00 (p.149) Chemia Fizyczna 2 - wykład Chemia kwantowa (prof. dr hab. Andrzej Sporzyński) Procesy (dr hab. inż.
Chemia fizyczna 2 - wykład Dr hab. inż. Aneta Pobudkowska-Mirecka Konsultacje: środa 12.15 14.00 (p.149) Chemia Fizyczna 2 - wykład Chemia kwantowa (prof. dr hab. Andrzej Sporzyński) Procesy (dr hab. inż.
LABORATORIUM PRZEMIAN ENERGII
 LABORATORIUM PRZEMIAN ENERGII BADANIE OGNIWA PALIWOWEGO TYPU PEM I. Wstęp Ćwiczenie polega na badaniu ogniwa paliwowego typu PEM. Urządzenia tego typy są obecnie rozwijane i przystosowywane do takich aplikacji
LABORATORIUM PRZEMIAN ENERGII BADANIE OGNIWA PALIWOWEGO TYPU PEM I. Wstęp Ćwiczenie polega na badaniu ogniwa paliwowego typu PEM. Urządzenia tego typy są obecnie rozwijane i przystosowywane do takich aplikacji
Chemia fizyczna (2013/2014) kinetyka chemiczna
 Chemia fizyczna (01/014) kinetyka chemiczna Zadanie 1. Dla reakcji rozkładu N O 5 4NO +O w roztworze CCl 4, w warunkach T,V=const w temperaturze 45 o C otrzymano następującą zależność stężenia N O 5 (A)
Chemia fizyczna (01/014) kinetyka chemiczna Zadanie 1. Dla reakcji rozkładu N O 5 4NO +O w roztworze CCl 4, w warunkach T,V=const w temperaturze 45 o C otrzymano następującą zależność stężenia N O 5 (A)
TERMODYNAMIKA FENOMENOLOGICZNA
 TERMODYNAMIKA FENOMENOLOGICZNA Przedmiotem badań są własności układów makroskopowych w zaleŝności od temperatury. Układ makroskopowy Np. 1 mol substancji - tyle składników ile w 12 gramach węgla C 12 N
TERMODYNAMIKA FENOMENOLOGICZNA Przedmiotem badań są własności układów makroskopowych w zaleŝności od temperatury. Układ makroskopowy Np. 1 mol substancji - tyle składników ile w 12 gramach węgla C 12 N
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego:
 1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
Wymagania programowe na poszczególne oceny chemia kl. I
 I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
Spalanie detonacyjne - czy to się opłaca?
 Spalanie detonacyjne - czy to się opłaca? Mgr inż. Dariusz Ejmocki Spalanie Spalanie jest egzotermiczną reakcją chemiczną syntezy, zdolną do samoczynnego przemieszczania się w przestrzeni wypełnionej substratami.
Spalanie detonacyjne - czy to się opłaca? Mgr inż. Dariusz Ejmocki Spalanie Spalanie jest egzotermiczną reakcją chemiczną syntezy, zdolną do samoczynnego przemieszczania się w przestrzeni wypełnionej substratami.
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym
 1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru
 1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru 2. Na podstawie struktury cząsteczek wyjaśnij dlaczego N 2 jest bierny a Cl 2 aktywny chemicznie? 3. Które substancje posiadają budowę
1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru 2. Na podstawie struktury cząsteczek wyjaśnij dlaczego N 2 jest bierny a Cl 2 aktywny chemicznie? 3. Które substancje posiadają budowę
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 2002 BYŁA DZISIAJ CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY ARKUSZ EGZAMINACYJNY I
 MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY I 1. Przy każdym zadaniu podano
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY I 1. Przy każdym zadaniu podano
Synteza Nanoproszków Metody Chemiczne II
 Synteza Nanoproszków Metody Chemiczne II Bottom Up Metody chemiczne Wytrącanie, współstrącanie, Mikroemulsja, Metoda hydrotermalna, Metoda solwotermalna, Zol-żel, Synteza fotochemiczna, Synteza sonochemiczna,
Synteza Nanoproszków Metody Chemiczne II Bottom Up Metody chemiczne Wytrącanie, współstrącanie, Mikroemulsja, Metoda hydrotermalna, Metoda solwotermalna, Zol-żel, Synteza fotochemiczna, Synteza sonochemiczna,
NOWOCZESNE KOMORY SPALANIA BIOMASY - DREWNA DREWNO POLSKIE OZE 2016
 NOWOCZESNE KOMORY SPALANIA BIOMASY - DREWNA 2016 OPAŁ STAŁY 2 08-09.12.2017 OPAŁ STAŁY 3 08-09.12.2017 Palenisko to przestrzeń, w której spalane jest paliwo. Jego kształt, konstrukcja i sposób przeprowadzania
NOWOCZESNE KOMORY SPALANIA BIOMASY - DREWNA 2016 OPAŁ STAŁY 2 08-09.12.2017 OPAŁ STAŁY 3 08-09.12.2017 Palenisko to przestrzeń, w której spalane jest paliwo. Jego kształt, konstrukcja i sposób przeprowadzania
POLITECHNIKA WARSZAWSKA WYDZIAŁ ELEKTRYCZNY. PRACOWNIA MATERIAŁOZNAWSTWA ELEKTROTECHNICZNEGO KWNiAE
 POLITECHNIK WRSZWSK WYDZIŁ ELEKTRYCZNY PRCOWNI MTERIŁOZNWSTW ELEKTROTECHNICZNEGO KWNiE ĆWICZENIE 11 WYZNCZNIE ELEKTROCHEMICZNEGO RÓWNOWśNIK MIEDZI ORZ STŁEJ FRDY 1. Elektrolity i przewodnictwo jonowe Ogólnie
POLITECHNIK WRSZWSK WYDZIŁ ELEKTRYCZNY PRCOWNI MTERIŁOZNWSTW ELEKTROTECHNICZNEGO KWNiE ĆWICZENIE 11 WYZNCZNIE ELEKTROCHEMICZNEGO RÓWNOWśNIK MIEDZI ORZ STŁEJ FRDY 1. Elektrolity i przewodnictwo jonowe Ogólnie
WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej
 Lucyna Krupa Rok szkolny 2017/2018 WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej Wyróżnia się wymagania na: ocenę dopuszczającą ocenę dostateczną (obejmują wymagania na ocenę dopuszczającą) ocenę dobrą
Lucyna Krupa Rok szkolny 2017/2018 WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej Wyróżnia się wymagania na: ocenę dopuszczającą ocenę dostateczną (obejmują wymagania na ocenę dopuszczającą) ocenę dobrą
BIOTECHNOLOGIA OGÓLNA
 BIOTECHNOLOGIA OGÓLNA 1. 2. 3. 4. 5. Ogólne podstawy biologicznych metod oczyszczania ścieków. Ścieki i ich rodzaje. Stosowane metody analityczne. Substancje biogenne w ściekach. Tlenowe procesy przemiany
BIOTECHNOLOGIA OGÓLNA 1. 2. 3. 4. 5. Ogólne podstawy biologicznych metod oczyszczania ścieków. Ścieki i ich rodzaje. Stosowane metody analityczne. Substancje biogenne w ściekach. Tlenowe procesy przemiany
Małopolski Konkurs Chemiczny dla Gimnazjalistów
 ... kod ucznia Małopolski Konkurs Chemiczny dla Gimnazjalistów Etap I (szkolny) 16 października 2009 roku Wypełnia szkolna komisja konkursowa Zadanie 1. 2. 3. 4. 5. Suma Liczba punktów PoniŜej podano treść
... kod ucznia Małopolski Konkurs Chemiczny dla Gimnazjalistów Etap I (szkolny) 16 października 2009 roku Wypełnia szkolna komisja konkursowa Zadanie 1. 2. 3. 4. 5. Suma Liczba punktów PoniŜej podano treść
Terminy. Omówienie kolokwium I. Poprawa kolokwium I. Poprawa kolokwium II g. 15, s g. 15, s g. 15, s.
 Tomasz Lubera Omówienie kolokwium I 14.05 g. 15, s. 402 Poprawa kolokwium I 21.05 g. 15, s. 402 Poprawa kolokwium II 28.05 g. 15, s. 402 Terminy Ćwiczenia rachunkowe z chemii fizycznej - Kolokwium II 2
Tomasz Lubera Omówienie kolokwium I 14.05 g. 15, s. 402 Poprawa kolokwium I 21.05 g. 15, s. 402 Poprawa kolokwium II 28.05 g. 15, s. 402 Terminy Ćwiczenia rachunkowe z chemii fizycznej - Kolokwium II 2

 Pracownia Ä2'3$'
Pracownia Ä2'3$'