OLSZTYŃSKIE PLANETARIUM I OBSERWATORIUM ASTRONOMICZNE POLSKIE TOWARZYSTWO METEORYTOWE II SEMINARIUM METEORYTOWE
|
|
|
- Nina Sowa
- 9 lat temu
- Przeglądów:
Transkrypt
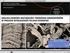
1 OLSZTYŃSKIE PLANETARIUM I OBSERWATORIUM ASTRONOMICZNE POLSKIE TOWARZYSTWO METEORYTOWE II SEMINARIUM METEORYTOWE OLSZTYN Łukasz KARWOWSKI 1, Stanisław JACHYMEK 2, Anna LUDWIG 3, Agnieszka GURDZIEL 4 SKORUPA WIETRZENIOWA I OBTOPIENIOWA METEORYTÓW W WARUNKACH KLIMATU UMIARKOWANEGO NA PRZYKŁADZIE ZAKŁODZIA I MORASKA-PRZEŁAZÓW WSTĘP Odnajdywane meteoryty świeżo po upadku mają ładnie wykształconą skorupę obtopieniową i dobrze zachowaną strefę oddziaływań termicznych. Swoisty problem stanowią meteoryty występujące w warunkach klimatu umiarkowanego, które przeleżały w glebie okres rzędu setek czy tysięcy lat. Procesy wietrzenia przebiegają tu zupełnie inaczej niż w przypadku meteorytów arktycznych i z terenów pustynnych. Znane dwa polskie meteoryty Zakłodzie i Morasko-Przełazy są przykładem okazów, które przebywały w glebie dłuższy czas i pokryły się dosyć grubą żelazistą skorupą. Powstaje pytanie, co dzieje się z tymi meteorytami, jakie procesy i jak szybko w nich zachodzą? STREFY OBTAPIANIA METEORYTÓW W trakcie przelotu przez atmosferę meteoryty ulegają obtopieniu. Zewnętrzna strefa obtopienia (skorupa obtopieniowa) nie przekracza na ogół 1-2 mm grubości. Wewnątrz meteorytu zmiany zachodzą na niewielkiej przestrzeni powodując nadtopienie łatwo topliwych minerałów oraz wyraźne spękanie ziaren powstanie tzw. czarnych żyłek wypełnionych drobnodyspersyjnymi siarczkami i fazą metalu (Judin et al., 1987). Prezentowane meteoryty Zakłodzie oraz Morasko leżały długi czas w ziemi pokrywając się skorupą wietrzeniową złożoną głównie z materiału klastycznego otaczającego meteoryt, spojonego wtórnymi minerałami żelaza. Wydawać by się mogło, że skorupa obtopieniowa uległa całkowitemu zwietrzeniu. W obydwu przypadkach skorupa wietrzeniowa ma znaczną grubość rzędu 1 cm i czasem więcej. Badając mikroskopowo próby pochodzące z Zakłodzia posiadające warstwę zwietrzeliny stwierdzono, ponad wszelką wątpliwość, obecność skorupy obtopieniowej wykształconej podobnie jak w meteorytach zebranych zaraz po upadku. Na fot. 1 przedstawiono strefę zwietrzeliny (skorupę wietrzeniową C) oddzieloną od 1,4 Wydział Nauk o Ziemi, Uniwersytet Śląski, ul. Będzinska 60, Sosnowiec, lkarwows@wnoz.us.edu.pl, 4 v.agnieszka@interia.pl 2 Guciów 19, Zwierzyniec, guciow@guciow.pl 3 Instytut Fizyki im. Augusta Chełkowskiego, Uniwersytet Śląski, ul. Uniwersytecka 4, Katowice, lanna@interia.pl 48
2 skorupy obtopieniowej (A), która przechodzi stopniowo w strefę wewnętrzną (B) tzw. strefę czarnych żyłek. Ta ostatnia jest także strefą oddziaływania wysokich temperatur. Strefa zewnętrzna jest w znacznej mierze zeszkliwiona. W jej obrębie występują liczne pęcherzyki oraz ziarna magnetytu i wűstytu. W strefie czarnych żyłek większość krzemianów jest spękana i pocięta żyłkami wypełnionymi minerałami rudnymi. W obrębie tej strefy blisko strefy zewnętrznej dochodzi także do wielu zmian w obrębie minerałów siarczkowych. Faza troilitowa ulega częściowemu rozkładowi. Wydziela się z niej łatwo lotna siarka a pozostają w obrębie troilitu drobne wrostki żelaza nisko-niklowego. Podobne zjawisko obserwowano w przypadku keilitu. W tej strefie kamacyt silnie ogrzany, a następnie szybko ochłodzony wydziela w swym obrębie martenzyt nisko-niklowy (fot. 2). Fot. 1. Strefa termicznego oddziaływania w meteorycie Zakłodzie: (A) zewnętrzna strefa obtopieniowa, (B) strefa czarnych żyłek, (C) skorupa wietrzeniowa. Fotografia (BSE) wykonana na mikroskopie elektronowym CAMECA SX 100. Fot. 2. W strefie podgrzanej na skutek gwałtownego chłodzenia wydzieliły się nisko-niklowe fazy martenzytowe o wrzecionowatych kształtach. Fotografia (BSE) wykonan na mikroskopie elektronowym CAMECA SX 100. Fot. 3. Fragmenty strefy obtopieniowej Fot. 4. Strefa zmian uderzeniowych w metemeteorytu Morasko: (A) zwietrzała partia orycie Morasko (światło odbite, 1 nikol). meteorytu, (B) fragmenty skorupy obtopie- Okaz Krzysztofa Sochy. niowej, (C) skorupa wietrzeniowa. Światło odbite, 1nikol. 49
3 Fot. 5. Zmiany w obrębie ziarna schreibersytu w pobliżu strefy uderzeniowej z wydzieleniami wysoko-niklowego taenitu. Fotografia (BSE) wykonana na mikroskopie elektronowym CAMECA SX 100. Fot. 6. Wydzielenia wysoko-niklowego martenzytu w taenicie ze strefy oddziaływania termicznego w meteorycie Morasko. Fotografia (BSE) wykonana na mikroskopie elektronowym CAMECA SX 100. W meteorytach z Moraska i Przełazów także bardzo często zachowały się ślady po strefie topienia (Fot. 3). Wyznacza je głównie wąska strefa złożona z magnetytu. Ciekawostką są zmiany przedstawione na fot. 4. Okazy wcześniej zostały oczyszczone ze skorupy wietrzeniowej. Prezentowany na fotografii fragment jest najprawdopodobniej efektem impaktu. W jej obrębie zanikają fazy taenitu, schreibersytu i cohenitu. Pojawia się wiele ciemnych przestrzeni Fot. 7. Wydzielenia wtórnych siarczków Ni, wypełnionych magnetytem, akaganeitem Co i Fe (białe) w strefie cementacji w obrę(chlorowym), wűstytem i bliżej nie- bie skorupy wietrzeniowej i w pobliżu strefy określonym minerałem o składzie Fe, obtopieniowej; Zakłodzie. Fotografi (BSE) wykonan na mikroskopie elektronowym Cl, O. Najbardziej zastanawiająca jest CAMECA SX 100. obecność znacznych ilości chloru. Poniżej tej strefy obserwuje się niekiedy silną mylonityzację ziaren schreibersytu, cohenitu i kamacytu. W obrębie ziaren schreibersytu zachodzą zmiany powodujące wydzielanie się kulistego taenitu (fot. 5). W taenicie ze stref przegrzanych obserwowano także wydzielenia wysoko-niklowego martenzytu (fot. 6). SKORUPY WIETRZENIOWE Skład mineralny skorup wietrzeniowych tak Zakłodzia, jak i Moraska jest podobny. Poza materiałem klastycznym (kwarc, skalenie, cyrkon, apatyt, granaty itp.) zawierają one znaczne ilości wodorotlenków żelaza reprezentowanych przez goethyt, lapidokrokit bądź akaganeit (patrz Tab.1). Skorupa wietrzeniowa Moraska zawiera także nieznaczną domieszkę minerałów ilastych. Badania rentgenowskie 50
4 nie ujawniają innych faz mineralnych. Badania chemiczne wskazują na domieszki niklu i ślady kobaltu (Tab. 1). Badania mikroskopowe oraz w mikroobszarze pozwoliły na stwierdzenie obecności wtórnych siarczków w niewielkiej odległości od zewnętrznej skorupy obtopieniowej (Fot. 7). Mamy zatem do czynienia ze swoistą strefą cementacji, w której dochodzi do powstania wtórnych siarczków zasobnych w Ni i Co (Ni: 44,3 17,3% wag., Co: 10,1 3,2% wag.). Procesy te można w pewnym uproszczeniu przedstawić następująco: Skład wyjściowy: Skorupa obtopieniowa: magnetyt, Fe 3 O 4 ; wűstyt, FeO; strefa zewnętrzna meteorytu: kamacyt, (Fe, Ni, Co); troilit, FeS; keilit, (Fe, Mg, Mn)S; oldhamit, CaS; schreibersit, (Fe, Ni, Co)P oraz krzemiany nie ulegające wtórnym przemianom. Czynniki zewnętrzne: wolny tlen, woda, CO 2. Faza monosiarczku żelaza (troilit, pirotyn) w wyniku reakcji z tlenem przechodzi w następujący sposób w dwusiarczek żelaza (piryt) z wydzieleniem kwasu siarkowego. FeS + 2O 2 FeSO 4 FeSO 4 + 2H 2 O Fe(OH) 2 + H 2 SO 4 2FeSO 4 + 2H 2 SO 4 2FeS 2 + 7O 2 + 2H 2 O Kwas siarkowy reaguje z wydzielonym wcześniej siarczanem żelaza (II). W efekcie powstaje siarczan żelaza (III). 4 FeSO 4 + 2H 2 SO 4 2Fe 2 (SO 4 ) 3 + H 2 O W środowisku kwaśnym nikiel i kobalt pod wpływem jonów Fe 3+ przechodzą w stan jonowy i są zdolne do migracji. SO 4 2- Ni 0 + 2Fe 3+ Ni Fe 2+ 2e - e - SO 4 2- Co 0 + 2Fe 3+ Co Fe 2+ 2e - e - Jony Fe 2+ reagując z jonami siarczanowymi powodują reakcję redukcji siarki do S
5 8Fe 2+ + SO H + S Fe H 2 O Przy granicy strefy obtopieniowej, przy zmianie środowiska na zasadowe (możliwy wpływ węglanów obecnych w lessie) następuje wytrącanie wtórnych siarczków niklu, kobaltu i żelaza zbliżonych do pentlandytu kobaltowego. OH - Co 2+, Ni 2+, Fe 2+ + S 2- (Ni, Co, Fe) n S n n ~ jedności Siarczany żelaza (II i III) w środowisku wodnym ulegają hydrolizie z wydzieleniem odpowiednich wodorotlenków. FeSO 4 + H 2 O Fe(OH) 2 + 2H + + SO 4 2-2Fe(SO 4 ) 3 + 6H 2 O 2 Fe(OH) 3 + 3H 2 SO 4 Wodorotlenek Fe 2+ jest związkiem nietrwałym w warunkach powierzchniowych i ulega utlenieniu do wodorotlenku Fe 3+. W końcowym efekcie powstaje mieszanina goethytu, lapidokrokitu i akaganeitu. Siarczki powstałe w bardzo wąskiej strefie cementacji, ulegają w miarę upływu czasu utlenieniu, przechodząc w wodorotlenki żelaza i dając w efekcie bardzo zwięzłą skorupę wietrzeniową. W trakcie tych procesów podkoncentrowane pierwiastki (Ni i Co) zostają rozproszone w otaczającym środowisku. Pozostaje jedynie goethyt i akaganeit z niewielką domieszką niklu. W przypadku okazu meteorytu Morasko znalezionego na głębokości około 1m przez K. Sochę stwierdzono, że w odległości kilku cm od skorupy pierwiastki Ni i Co ulegają rozcieńczeniu, a ich zawartość spada do 0.29% wag. w przypadku Ni oraz 0.03 % wag. w przypadku Co. Meteoryty żelazne ulegają procesom podobnym do korozji przedmiotów żelaznych powoli przechodząc w wodorotlenki żelaza. Skorupa wietrzeniowa wraz z skorupą obtopieniową stanowią doskonały ekran chroniący przed rozwojem dalszej korozji. Procesy wietrzeniowe rozprzestrzeniają się w obrębie meteorytów zgodnie z ułożeniem spękań i mikrospękań. W meteorycie Zakłodzie procesy te sięgają bardzo głęboko objawiając się wyraźnie zażelazieniem pierwotnie jasnego meteorytu. Sprzyja temu niewątpliwie łatwo rozpuszczalny siarczek oldchamit (CaS) dostarczający, jako pierwszy, pod wpływem migrującej wilgoci i tlenu - porcji kwasu siarkowego. W obrębie meteorytu, głównie przy brzegach, następuje w pierwszym rzędzie przejście troilitu (FeS) w dwusiarczek żelaza (FeS 2 ). Kolejnym procesem jest zastępowanie dwusiarczku żelaza wodorotlenkami Fe. Faza keilitu ulega także przejściu w wodorotlenki Fe. Fazy metaliczne zostają w pierwszym stadium rozkładu otoczone warstewką wtórnego siarczku (FeS 2 lub pentlandytu), a następnie ulegają przemianie w wodorotlenki żelaza. W meteorycie Morasko w wielu miejscach nie obserwuje się wyraźnych zmian. W miejscach spękań i uszkodzeń skorupy obtopieniowej procesy wietrzenia prowadzą do zastępowania taenitu i kamacytu przez wodorotlenki Fe. Drobne rhabdy- 52
6 ty pozostają niezmienione tkwiąc w masie wodorotlenków. W niektórych rejonach szybciej ulegają wietrzeniu lamelki taenitowe (fot. 8), w innych taenit jest bardziej odporny od kamacytu (fot. 9). Fot. 8. Lamelka taenitowa zastępowana, w odróżnieniu od kamacytu, wodorotlenkami żelaza na brzegu meteorytu Morasko (światło odbite, 1 nikol). 53 Fot. 9. Zastępowanie kamacytu wodorotlenkami żelaza. Lamelki taenitu nie ulegają wtórnym zmianom. Fotografi (BSE) wykonana na mikroskopie elektronowym CAMECA SX 100. Poddano także badaniom produkty wietrzenia meteorytu Morasko, który przebywał w warunkach pokojowych ok. 7 lat ulegając praktycznie całkowitemu zwietrzeniu, dawał się pokruszyć w rękach itd. (Tab. 1). WNIOSKI 1. Skorupa wietrzeniowa wraz ze skorupą obtopieniową stanowią doskonały ekran powstrzymujący szybkie wietrzenie meteorytów w klimacie umiarkowanym pod warunkiem, że meteoryty przykryte są warstwą ziemi. 2. Szczególnie chronione są meteoryty żelazne znajdujące się pod powierzchnią ziemi. 3. Meteoryty kamienne wietrzeją szybciej, chociaż w okresie około 200 lat proces ten nie powoduje istotnych zmian. 4. Meteoryty żelazne jak i kamienne zawierające kamacyt oraz siarczki działają redukcyjnie. Zapoczątkowany proces wietrzenia jest powstrzymywany przez powstającą na granicy skorupy obtopieniowej strefę cementacji wtórnych siarczków wzbogaconych w nikiel i kobalt. Przy meteorytach żelaznych strefa cementacji powstaje jedynie przy odsłoniętych na powierzchni meteorytu skupieniach troilitowych. 5. Meteoryty żelazne są chronione przed dalszą degradacją zwięzłą skorupą wietrzeniową złożoną z wodorotlenków żelaza. 6. Meteoryty żelazne pozbawione ochronnej skorupy wietrzeniowej ulegają bardzo szybkiemu wietrzeniu w warunkach temperatury i wilgotności pokojowej. Rozpoczęty proces może doprowadzić do całkowitego rozkładu meteorytu w ciągu kilku lat jeżeli nie zostanie on odpowiednio zabezpieczony. 7. Niewątpliwie, jednym z najważniejszych czynników powstrzymujących
7 wietrzenie meteorytów pogrzebanych w warunkach naszego klimatu jest duża stabilność temperatury i wilgotności otoczenia. METEORYT Morasko-Przełazy skorupa wietrzeniowa Morasko-Przełazy siedmioletnia zwietrzelina w warunkach pokojowych Zakłodzie skorupa wietrzeniowa Zakłodzie strefa cementacji SKŁAD FAZOWY kwarc, skalenie, cyrkon, granat, goethyt, lepidokrokit, akaganeit, magnetyt, trevoryt goethyt, akaganeit, ślady kamacytu i schreibersytu kwarc, skalenie, cyrkon, goethyt, ankeryt siarczki niklu, kobaltu i żelaza. SKŁAD CHEMICZNY FAZ ROZPUSZCZALNYCH W KWASACH (%WAG.) Fe: 4-50% Ni: 0,23 4,25% Co: 0,13 0,21% Fe 49,7% Ni 5,08% Co 0,26% Fe: 15,7-16,9% Ni: 0,12-0,53% Co: 0,02-0,03% Mn: 0,09-0,13% Fe: 39,6 12,2%, Ni: 44,3 17,3%, Co: 10,1 3,2%, S: 39,6 32,6%. Tabela 1. Skład fazowy i chemiczny produktów wietrzenia meteorytów Moraska i Zakłodzia. Podziękowania: Autorzy serdecznie dziękują Panu Krzysztofowi Sosze za udostępnienie licznych meteorytów z Moraska do badań jak i zwietrzeliny meteorytowej. LITERATURA YUDIN I. A., KOLOMENSKY V. D., 1987: Mineralogia meteoritov. A. N. Svirdlovsk. 54
ACTA SOCIETATIS METHEORITCAE POLONORUM Rocznik Polskiego Towarzystwa Meteorytowego Vol. 1, 2009
 ACTA SOCIETATIS METHEORITCAE POLONORUM Rocznik Polskiego Towarzystwa Meteorytowego Vol. 1, 2009 Agnieszka GURDZIEL 1, Łukasz KARWOWSKI 2 PROCESY WIETRZENIA W METEORYCIE PUŁTUSK (WSTĘPNE WYNIKI BADAŃ) WEATHERING
ACTA SOCIETATIS METHEORITCAE POLONORUM Rocznik Polskiego Towarzystwa Meteorytowego Vol. 1, 2009 Agnieszka GURDZIEL 1, Łukasz KARWOWSKI 2 PROCESY WIETRZENIA W METEORYCIE PUŁTUSK (WSTĘPNE WYNIKI BADAŃ) WEATHERING
OLSZTYŃSKIE PLANETARIUM I OBSERWATORIUM ASTRONOMICZNE POLSKIE TOWARZYSTWO METEORYTOWE II SEMINARIUM METEORYTOWE 24-26.04.
 OLSZTYŃSKIE PLANETARIUM I OBSERWATORIUM ASTRONOMICZNE POLSKIE TOWARZYSTWO METEORYTOWE II SEMINARIUM METEORYTOWE 24-26.4.23 OLSZTYN Marian SZURGOT 1, Krzysztof POLAŃSKI 2 BADANIA MIKROSKOPOWE CHONDRYTÓW
OLSZTYŃSKIE PLANETARIUM I OBSERWATORIUM ASTRONOMICZNE POLSKIE TOWARZYSTWO METEORYTOWE II SEMINARIUM METEORYTOWE 24-26.4.23 OLSZTYN Marian SZURGOT 1, Krzysztof POLAŃSKI 2 BADANIA MIKROSKOPOWE CHONDRYTÓW
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego. II Etap - 18 stycznia 2016
 XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
WIETRZENIE. Rozpuszczanie polega na łączeniu się minerałów z wodą i doprowadzeniu ich do roztworu. Tego typu wietrzeniu ulegają głównie sole.
 WIETRZENIE Wietrzenie to proces prowadzący do rozpadu lub rozkładu skały RODZAJE WIETRZENIA WIETRZENIE FIZYCZNE = MECHANICZNE v INSOLACJA v ZAMRÓZ (MROZOWE) v SKAŁ ILASTYCH v SOLNE WIETRZENIE CHEMICZNE
WIETRZENIE Wietrzenie to proces prowadzący do rozpadu lub rozkładu skały RODZAJE WIETRZENIA WIETRZENIE FIZYCZNE = MECHANICZNE v INSOLACJA v ZAMRÓZ (MROZOWE) v SKAŁ ILASTYCH v SOLNE WIETRZENIE CHEMICZNE
2.4. ZADANIA STECHIOMETRIA. 1. Ile moli stanowi:
 2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
Akademia Sztuk Pięknych w Warszawie, Wydział Konserwacji i Restauracji Dzieł Sztuki, Zakład Badań Specjalistycznych i Technik Dokumentacyjnych
 SPRAWOZDANIE Z REALIZACJI pierwszego etapu UMOWY o DZIEŁO p.t.: Wykonanie szlifów i analiza produktów korozji próbek metali konstrukcyjnych parowozów metodami mikro-chemicznymi i laserowej spektrometrii
SPRAWOZDANIE Z REALIZACJI pierwszego etapu UMOWY o DZIEŁO p.t.: Wykonanie szlifów i analiza produktów korozji próbek metali konstrukcyjnych parowozów metodami mikro-chemicznymi i laserowej spektrometrii
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
Reevesyt i jarosyt nowe wtórne fazy w meteorycie Morasko
 ACTA SOCIETATIS METHEORITICAE POLONORUM Rocznik Polskiego Towarzystwa Meteorytowego Vol. 7, 2016 Agnieszka GURDZIEL 1, Łukasz KARWOWSKI 2 Reevesyt i jarosyt nowe wtórne fazy w meteorycie Morasko Reevesite
ACTA SOCIETATIS METHEORITICAE POLONORUM Rocznik Polskiego Towarzystwa Meteorytowego Vol. 7, 2016 Agnieszka GURDZIEL 1, Łukasz KARWOWSKI 2 Reevesyt i jarosyt nowe wtórne fazy w meteorycie Morasko Reevesite
Wietrzenie w meteorycie Nantan (porównanie wybranych wtórnych faz mineralnych z meteorytów Nantan i Morasko)
 ACTA SOCIETATIS METHEORITICAE POLONORUM Rocznik Polskiego Towarzystwa Meteorytowego Vol. 6, 2015 Agnieszka GURDZIEL 1 Wietrzenie w meteorycie Nantan (porównanie wybranych wtórnych faz mineralnych z meteorytów
ACTA SOCIETATIS METHEORITICAE POLONORUM Rocznik Polskiego Towarzystwa Meteorytowego Vol. 6, 2015 Agnieszka GURDZIEL 1 Wietrzenie w meteorycie Nantan (porównanie wybranych wtórnych faz mineralnych z meteorytów
Chemiczne oddziaływanie składowisk odpadów górnictwa węgla kamiennego na środowisko
 Chemiczne oddziaływanie składowisk odpadów górnictwa węgla kamiennego na środowisko Prof. nadzw. dr hab. Andrzej Misiołek Wydział Nauk Technicznych Wyższa Szkoła Zarządzania Ochroną Pracy w Katowicach
Chemiczne oddziaływanie składowisk odpadów górnictwa węgla kamiennego na środowisko Prof. nadzw. dr hab. Andrzej Misiołek Wydział Nauk Technicznych Wyższa Szkoła Zarządzania Ochroną Pracy w Katowicach
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
Procesy biotransformacji
 Biohydrometalurgia jest to dział techniki zajmujący się otrzymywaniem metali przy użyciu mikroorganizmów i wody. Ma ona charakter interdyscyplinarny obejmujący wiedzę z zakresu biochemii, geomikrobiologii,
Biohydrometalurgia jest to dział techniki zajmujący się otrzymywaniem metali przy użyciu mikroorganizmów i wody. Ma ona charakter interdyscyplinarny obejmujący wiedzę z zakresu biochemii, geomikrobiologii,
Powstawanie żelazianu(vi) sodu przebiega zgodnie z równaniem: Ponieważ termiczny rozkład kwasu borowego(iii) zachodzi zgodnie z równaniem:
 Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY
 WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY Instrukcja przygotowana w Pracowni Dydaktyki Chemii Zakładu Fizykochemii Roztworów. 1. Zanieczyszczenie wody. Polska nie należy do krajów posiadających znaczne
WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY Instrukcja przygotowana w Pracowni Dydaktyki Chemii Zakładu Fizykochemii Roztworów. 1. Zanieczyszczenie wody. Polska nie należy do krajów posiadających znaczne
GLEBOZNAWSTWO = pedologia - nauka o glebach
 GLEBY GLEBA - biologicznie czynna, powierzchniowa warstwa litosfery, powstała ze skał pod wpływem abiotycznych i biotycznych czynników środowiska, zdolna zapewnić roślinom wyższym warunki wzrostu i rozwoju.
GLEBY GLEBA - biologicznie czynna, powierzchniowa warstwa litosfery, powstała ze skał pod wpływem abiotycznych i biotycznych czynników środowiska, zdolna zapewnić roślinom wyższym warunki wzrostu i rozwoju.
Identyfikacja wybranych kationów i anionów
 Identyfikacja wybranych kationów i anionów ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ NIE ZATYKAĆ PROBÓWKI PALCEM Zadanie 1 Celem zadania jest wykrycie jonów Ca 2+ a. Próba z jonami C 2 O 4 ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ
Identyfikacja wybranych kationów i anionów ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ NIE ZATYKAĆ PROBÓWKI PALCEM Zadanie 1 Celem zadania jest wykrycie jonów Ca 2+ a. Próba z jonami C 2 O 4 ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ
8. MANGANOMETRIA. 8. Manganometria
 8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.
![Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów. Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.](/thumbs/97/131732752.jpg) 2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
TYPY REAKCJI CHEMICZNYCH
 TYPY REAKCJI CHEMICZNYCH Ćwiczenie 1. Reakcja rozkładu KMnO 4 - suche! probówki w statywie - palnik gazowy - łuczywo - uchwyt na probówkę - krystaliczny KMnO 4 (manganian(vii) potasu) Do suchej probówki
TYPY REAKCJI CHEMICZNYCH Ćwiczenie 1. Reakcja rozkładu KMnO 4 - suche! probówki w statywie - palnik gazowy - łuczywo - uchwyt na probówkę - krystaliczny KMnO 4 (manganian(vii) potasu) Do suchej probówki
OLSZTYŃSKIE PLANETARIUM I OBSERWATORIUM ASTRONOMICZNE POLSKIE TOWARZYSTWO METEORYTOWE II SEMINARIUM METEORYTOWE
 OLSZTYŃSKIE PLANETARIUM I OBSERWATORIUM ASTRONOMICZNE POLSKIE TOWARZYSTWO METEORYTOWE II SEMINARIUM METEORYTOWE 24-26.04.2003 OLSZTYN Łukasz KARWOWSKI 1 METEORYT ŁOWICZ - CO NOWEGO? O CZYM WIADOMO DOTYCHCZAS?
OLSZTYŃSKIE PLANETARIUM I OBSERWATORIUM ASTRONOMICZNE POLSKIE TOWARZYSTWO METEORYTOWE II SEMINARIUM METEORYTOWE 24-26.04.2003 OLSZTYN Łukasz KARWOWSKI 1 METEORYT ŁOWICZ - CO NOWEGO? O CZYM WIADOMO DOTYCHCZAS?
ĆWICZENIA LABORATORYJNE WYKRYWANIE WYBRANYCH ANIONÓW I KATIONÓW.
 ĆWICZENIA LABORATORYJNE WYKRYWANIE WYBRANYCH ANIONÓW I KATIONÓW. Chemia analityczna jest działem chemii zajmującym się ustalaniem składu jakościowego i ilościowego badanych substancji chemicznych. Analiza
ĆWICZENIA LABORATORYJNE WYKRYWANIE WYBRANYCH ANIONÓW I KATIONÓW. Chemia analityczna jest działem chemii zajmującym się ustalaniem składu jakościowego i ilościowego badanych substancji chemicznych. Analiza
HYDROLIZA SOLI. 1. Hydroliza soli mocnej zasady i słabego kwasu. Przykładem jest octan sodu, dla którego reakcja hydrolizy przebiega następująco:
 HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
Zn + S ZnS Utleniacz:... Reduktor:...
 Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
SUROWCE MINERALNE. Wykład 5
 SUROWCE MINERALNE Wykład 5 PROCESY POMAGMOWE Etap pegmatytowy (800-600 0 C) w resztkach pomagmowych składniki krzemianowe przewaŝają jeszcze nad składnikami łatwolotnymi. Obfitość tych ostatnich nadaje
SUROWCE MINERALNE Wykład 5 PROCESY POMAGMOWE Etap pegmatytowy (800-600 0 C) w resztkach pomagmowych składniki krzemianowe przewaŝają jeszcze nad składnikami łatwolotnymi. Obfitość tych ostatnich nadaje
Procentowa zawartość sodu (w molu tej soli są dwa mole sodu) wynosi:
 Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
************************************************************
 As 2 S 3 + HNO 3 + H 2 O = H 3 AsO 4 + H 2 SO 4 + NO Zn + HNO 3 = Zn(NO 3 ) 2 + NH 4 NO 3 + H 2 O HClO 3 = ClO 2 + HClO 4 + H 2 O KNO 2 + KMnO 4 +? = KNO 3 + MnSO 4 +? Bi 2 S 3 + NO 3 = Bi 3+ + NO + S
As 2 S 3 + HNO 3 + H 2 O = H 3 AsO 4 + H 2 SO 4 + NO Zn + HNO 3 = Zn(NO 3 ) 2 + NH 4 NO 3 + H 2 O HClO 3 = ClO 2 + HClO 4 + H 2 O KNO 2 + KMnO 4 +? = KNO 3 + MnSO 4 +? Bi 2 S 3 + NO 3 = Bi 3+ + NO + S
Wrocław dn. 18 listopada 2005 roku
 Piotr Chojnacki IV rok, informatyka chemiczna Liceum Ogólnokształcące Nr I we Wrocławiu Wrocław dn. 18 listopada 2005 roku Temat lekcji: Zjawisko korozji elektrochemicznej. Cel ogólny lekcji: Wprowadzenie
Piotr Chojnacki IV rok, informatyka chemiczna Liceum Ogólnokształcące Nr I we Wrocławiu Wrocław dn. 18 listopada 2005 roku Temat lekcji: Zjawisko korozji elektrochemicznej. Cel ogólny lekcji: Wprowadzenie
Piława Górna, osiedle Kośmin / osiedle Kopanica Koordynaty przedstawiają przybliżone współrzędne miejsc Opis lokalizacji i dostępności
 Opis geostanowiska Grzegorz Gil Informacje ogólne (weryfikacja) Numer obiektu 177 Nazwa obiektu (oficjalna, obiegowa lub Miejsca upadku fragmentów meteorytu "Gnadenfrei" ("Piława nadana) Górna") Współrzędne
Opis geostanowiska Grzegorz Gil Informacje ogólne (weryfikacja) Numer obiektu 177 Nazwa obiektu (oficjalna, obiegowa lub Miejsca upadku fragmentów meteorytu "Gnadenfrei" ("Piława nadana) Górna") Współrzędne
Reakcje chemiczne. Typ reakcji Schemat Przykłady Reakcja syntezy
 Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Zadanie 2. (1 pkt) Uzupełnij tabelę, wpisując wzory sumaryczne tlenków w odpowiednie kolumny. CrO CO 2 Fe 2 O 3 BaO SO 3 NO Cu 2 O
 Test maturalny Chemia ogólna i nieorganiczna Zadanie 1. (1 pkt) Uzupełnij zdania. Pierwiastek chemiczny o liczbie atomowej 16 znajduje się w.... grupie i. okresie układu okresowego pierwiastków chemicznych,
Test maturalny Chemia ogólna i nieorganiczna Zadanie 1. (1 pkt) Uzupełnij zdania. Pierwiastek chemiczny o liczbie atomowej 16 znajduje się w.... grupie i. okresie układu okresowego pierwiastków chemicznych,
MARATON WIEDZY CHEMIA CZ. II
 MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
asfaltowych warstw ścieralnych Dr inż. Bartłomiej Grzesik
 Przeobrażenia P b ż i mineralne i l w kruszywach k h naturalnych w kwaśnym środowisku asfaltowych warstw ścieralnych Dr inż. Bartłomiej Grzesik Geneza podjętej problematyki Darłowo Zieluń Żuromin Siemiątkowo
Przeobrażenia P b ż i mineralne i l w kruszywach k h naturalnych w kwaśnym środowisku asfaltowych warstw ścieralnych Dr inż. Bartłomiej Grzesik Geneza podjętej problematyki Darłowo Zieluń Żuromin Siemiątkowo
XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019. ETAP I r. Godz Zadanie 1 (10 pkt)
 XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019 ETAP I 9.11.2018 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh 27 Zadanie 1 (10 pkt) 1. W atomie glinu ( 1Al)
XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019 ETAP I 9.11.2018 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh 27 Zadanie 1 (10 pkt) 1. W atomie glinu ( 1Al)
Elektrochemia - szereg elektrochemiczny metali. Zadania
 Elektrochemia - szereg elektrochemiczny metali Zadania Czym jest szereg elektrochemiczny metali? Szereg elektrochemiczny metali jest to zestawienie metali według wzrastających potencjałów normalnych. Wartości
Elektrochemia - szereg elektrochemiczny metali Zadania Czym jest szereg elektrochemiczny metali? Szereg elektrochemiczny metali jest to zestawienie metali według wzrastających potencjałów normalnych. Wartości
PROCESY BIOGEOCHEMICZNE NA LĄDACH
 PROCESY BIOGEOCHEMICZNE NA LĄDACH Ekosystemy lądowe Ekosystemy wodne Ekosystemy lądowe Ekosystemy wilgotne Ekosystemy wodne Ekosystemy lądowe Ekosystemy wilgotne Ekosystemy wodne skała macierzysta Wietrzenie
PROCESY BIOGEOCHEMICZNE NA LĄDACH Ekosystemy lądowe Ekosystemy wodne Ekosystemy lądowe Ekosystemy wilgotne Ekosystemy wodne Ekosystemy lądowe Ekosystemy wilgotne Ekosystemy wodne skała macierzysta Wietrzenie
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
Pierwiastki bloku d. Zadanie 1.
 Zadanie 1. Zapisz równania reakcji tlenków chromu (II), (III), (VI) z kwasem solnym i zasadą sodową lub zaznacz, że reakcja nie zachodzi. Określ charakter chemiczny tlenków. Charakter chemiczny tlenków:
Zadanie 1. Zapisz równania reakcji tlenków chromu (II), (III), (VI) z kwasem solnym i zasadą sodową lub zaznacz, że reakcja nie zachodzi. Określ charakter chemiczny tlenków. Charakter chemiczny tlenków:
SUROWCE I RECYKLING. Wykład 8
 SUROWCE I RECYKLING Wykład 8 WYBRANE NIEMETALICZNE SUROWCE MINERALNE surowce krzemionkowe, tj. zasobne w SiO 2, surowce ilaste, surowce glinowe, glinokrzemianowe i zawierające alkalia, surowce wapniowe,
SUROWCE I RECYKLING Wykład 8 WYBRANE NIEMETALICZNE SUROWCE MINERALNE surowce krzemionkowe, tj. zasobne w SiO 2, surowce ilaste, surowce glinowe, glinokrzemianowe i zawierające alkalia, surowce wapniowe,
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
g % ,3%
 PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
XV Wojewódzki Konkurs z Chemii
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
TYPY REAKCJI CHEMICZNYCH
 TYPY REAKCJI CHEMICZNYCH Opracowanie: dr inż Krystyna Moskwa, dr hab. Barbara Stypuła, mgr Agnieszka Tąta Reakcje chemiczne to procesy, w czasie których substancje ulegają przemianom, prowadzącym do powstawania
TYPY REAKCJI CHEMICZNYCH Opracowanie: dr inż Krystyna Moskwa, dr hab. Barbara Stypuła, mgr Agnieszka Tąta Reakcje chemiczne to procesy, w czasie których substancje ulegają przemianom, prowadzącym do powstawania
zakres pt dla metamorfizmu: od t ~ 200 C i p ~ 2 kbar do t ~ 700 C
 METAMORFIZM Metamorfizm procesy powodujące mineralne, strukturalne i teksturalne przeobrażenie skał w stanie stałym, bez większego ilościowego udziału fazy ciekłej, w głębszych warstwach skorupy ziemskiej,
METAMORFIZM Metamorfizm procesy powodujące mineralne, strukturalne i teksturalne przeobrażenie skał w stanie stałym, bez większego ilościowego udziału fazy ciekłej, w głębszych warstwach skorupy ziemskiej,
REAKCJE CHARAKTERYSTYCZNE WYBRANYCH KATIONÓW
 REAKCJE CHARAKTERYSTYCZNE WYBRANYCH KATIONÓW Chemia analityczna jest działem chemii zajmującym się ustalaniem składu jakościowego i ilościowego badanych substancji chemicznych. Analiza jakościowa bada
REAKCJE CHARAKTERYSTYCZNE WYBRANYCH KATIONÓW Chemia analityczna jest działem chemii zajmującym się ustalaniem składu jakościowego i ilościowego badanych substancji chemicznych. Analiza jakościowa bada
GLOBALNE CYKLE BIOGEOCHEMICZNE obieg siarki
 GLOBALNE CYKLE BIOGEOCHEMICZNE oieg siarki W organizmie ludzkim: mięśnie: 5000-11000 ppm, kości: 500-2400 ppm, krew 1,8 g/l Całkowita zawartość (70 kg): 140 g. Rozpowszechnienie siarki (wagowo) Ziemia
GLOBALNE CYKLE BIOGEOCHEMICZNE oieg siarki W organizmie ludzkim: mięśnie: 5000-11000 ppm, kości: 500-2400 ppm, krew 1,8 g/l Całkowita zawartość (70 kg): 140 g. Rozpowszechnienie siarki (wagowo) Ziemia
XXIV Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych. Etap II rozwiązania zadań
 XXIV Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II rozwiązania zadań Zadanie 1 Na podstawie informacji o pierwiastku X i jego solach (B-E) możemy stwierdzić, że jest to żelazo. Najbardziej
XXIV Konkurs Chemiczny dla Uczniów Szkół Ponadgimnazjalnych Etap II rozwiązania zadań Zadanie 1 Na podstawie informacji o pierwiastku X i jego solach (B-E) możemy stwierdzić, że jest to żelazo. Najbardziej
PODSTAWY KOROZJI ELEKTROCHEMICZNEJ
 PODSTAWY KOROZJI ELEKTROCHEMICZNEJ PODZIAŁ KOROZJI ZE WZGLĘDU NA MECHANIZM Korozja elektrochemiczna zachodzi w środowiskach wilgotnych, w wodzie i roztworach wodnych, w glebie, w wilgotnej atmosferze oraz
PODSTAWY KOROZJI ELEKTROCHEMICZNEJ PODZIAŁ KOROZJI ZE WZGLĘDU NA MECHANIZM Korozja elektrochemiczna zachodzi w środowiskach wilgotnych, w wodzie i roztworach wodnych, w glebie, w wilgotnej atmosferze oraz
Obliczenia chemiczne
 strona 1/8 Obliczenia chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Wagowe stosunki stechiometryczne w związkach chemicznych i reakcjach chemicznych masa atomowa
strona 1/8 Obliczenia chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Wagowe stosunki stechiometryczne w związkach chemicznych i reakcjach chemicznych masa atomowa
Auxiliary sciences in archaeology, preservation of relicts and environmental engineering. CD -no 17 Ed. M. Pawlikowski
 Auxiliary sciences in archaeology, preservation of relicts and environmental engineering. CD -no 17 Ed. M. Pawlikowski METEORYT ŻELAZNY Z KRATERU KAMIL. PUSTYNIA ZACHODNIA. EGIPT Iron meteorite from Kamil
Auxiliary sciences in archaeology, preservation of relicts and environmental engineering. CD -no 17 Ed. M. Pawlikowski METEORYT ŻELAZNY Z KRATERU KAMIL. PUSTYNIA ZACHODNIA. EGIPT Iron meteorite from Kamil
Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne)
 Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne) Zadanie 7 (1 pkt) Uporządkuj podane ilości moli związków chemicznych według rosnącej liczby
Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne) Zadanie 7 (1 pkt) Uporządkuj podane ilości moli związków chemicznych według rosnącej liczby
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
OBRÓBKA CIEPLNA STOPÓW ŻELAZA. Cz. II. Przemiany austenitu przechłodzonego
 OBRÓBKA CIEPLNA STOPÓW ŻELAZA Cz. II. Przemiany austenitu przechłodzonego WPŁYW CHŁODZENIA NA PRZEMIANY AUSTENITU Ar 3, Ar cm, Ar 1 temperatury przy chłodzeniu, niższe od równowagowych A 3, A cm, A 1 A
OBRÓBKA CIEPLNA STOPÓW ŻELAZA Cz. II. Przemiany austenitu przechłodzonego WPŁYW CHŁODZENIA NA PRZEMIANY AUSTENITU Ar 3, Ar cm, Ar 1 temperatury przy chłodzeniu, niższe od równowagowych A 3, A cm, A 1 A
Fascynujący świat chemii
 Opracowanie pochodzi ze strony www.materiaienergia.pisz.pl Zeskakuj telefonem kod QR i odwiedź nas w Internecie Fascynujący świat chemii Szybkość reakcji chemicznych i katalizatory Wstęp Celem prowadzenia
Opracowanie pochodzi ze strony www.materiaienergia.pisz.pl Zeskakuj telefonem kod QR i odwiedź nas w Internecie Fascynujący świat chemii Szybkość reakcji chemicznych i katalizatory Wstęp Celem prowadzenia
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks
 Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Innowacyjne warstwy azotowane nowej generacji o podwyższonej odporności korozyjnej wytwarzane na elementach maszyn
 Tytuł projektu: Innowacyjne warstwy azotowane nowej generacji o podwyższonej odporności korozyjnej wytwarzane na elementach maszyn Umowa nr: TANGO1/268920/NCBR/15 Akronim: NITROCOR Planowany okres realizacji
Tytuł projektu: Innowacyjne warstwy azotowane nowej generacji o podwyższonej odporności korozyjnej wytwarzane na elementach maszyn Umowa nr: TANGO1/268920/NCBR/15 Akronim: NITROCOR Planowany okres realizacji
Ćwiczenie 1: Wyznaczanie warunków odporności, korozji i pasywności metali
 Ćwiczenie 1: Wyznaczanie warunków odporności, korozji i pasywności metali Wymagane wiadomości Podstawy korozji elektrochemicznej, wykresy E-pH. Wprowadzenie Główną przyczyną zniszczeń materiałów metalicznych
Ćwiczenie 1: Wyznaczanie warunków odporności, korozji i pasywności metali Wymagane wiadomości Podstawy korozji elektrochemicznej, wykresy E-pH. Wprowadzenie Główną przyczyną zniszczeń materiałów metalicznych
Instrukcja do ćwiczenia WŁAŚCIWOŚCI WYBRANYCH ANIONÓW.
 Instrukcja do ćwiczenia WŁAŚCIWOŚCI WYBRANYCH ANIONÓW. CHEMIA ANIONÓW W ROZTWORACH WODNYCH Celem ćwiczenia jest zapoznanie się z właściwościami chemicznymi wybranych anionów pierwiastków I oraz II okresu
Instrukcja do ćwiczenia WŁAŚCIWOŚCI WYBRANYCH ANIONÓW. CHEMIA ANIONÓW W ROZTWORACH WODNYCH Celem ćwiczenia jest zapoznanie się z właściwościami chemicznymi wybranych anionów pierwiastków I oraz II okresu
Elektrochemia elektroliza. Wykład z Chemii Fizycznej str. 4.3 / 1
 Elektrochemia elektroliza Wykład z Chemii Fizycznej str. 4.3 / 1 ELEKTROLIZA POLARYZACJA ELEKTROD Charakterystyka prądowo-napięciowa elektrolizy i sposób określenia napięcia rozkładu Wykład z Chemii Fizycznej
Elektrochemia elektroliza Wykład z Chemii Fizycznej str. 4.3 / 1 ELEKTROLIZA POLARYZACJA ELEKTROD Charakterystyka prądowo-napięciowa elektrolizy i sposób określenia napięcia rozkładu Wykład z Chemii Fizycznej
Geopolimery z tufu wulkanicznego. dr hab. inż. Janusz Mikuła prof. PK mgr inż. Michał Łach
 Geopolimery z tufu wulkanicznego dr hab. inż. Janusz Mikuła prof. PK mgr inż. Michał Łach Tuf wulkaniczny skład i właściwości Tuf wulkaniczny jest to porowata skała należąca do skał okruchowych, składająca
Geopolimery z tufu wulkanicznego dr hab. inż. Janusz Mikuła prof. PK mgr inż. Michał Łach Tuf wulkaniczny skład i właściwości Tuf wulkaniczny jest to porowata skała należąca do skał okruchowych, składająca
Zadanie 2. Przeprowadzono następujące doświadczenie: Wyjaśnij przebieg tego doświadczenia. Zadanie: 3. Zadanie: 4
 Zadanie: 1 Do niebieskiego, wodnego roztworu soli miedzi wrzucono żelazny gwóźdź i odstawiono na pewien czas. Opisz zmiany zachodzące w wyglądzie: roztworu żelaznego gwoździa Zadanie 2. Przeprowadzono
Zadanie: 1 Do niebieskiego, wodnego roztworu soli miedzi wrzucono żelazny gwóźdź i odstawiono na pewien czas. Opisz zmiany zachodzące w wyglądzie: roztworu żelaznego gwoździa Zadanie 2. Przeprowadzono
E dec. Obwód zastępczy. Napięcie rozkładowe
 Obwód zastępczy Obwód zastępczy schematyczny obwód elektryczny, ilustrujący zachowanie się badanego obiektu w polu elektrycznym. Elementy obwodu zastępczego (oporniki, kondensatory, indukcyjności,...)
Obwód zastępczy Obwód zastępczy schematyczny obwód elektryczny, ilustrujący zachowanie się badanego obiektu w polu elektrycznym. Elementy obwodu zastępczego (oporniki, kondensatory, indukcyjności,...)
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH
 WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
imię i nazwisko, nazwa szkoły, miejscowość Zadania I etapu Konkursu Chemicznego Trzech Wydziałów PŁ V edycja
 Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI
 Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI Zadanie 726 (1 pkt.) V/2006/A1 Konfigurację elektronową atomu glinu w stanie podstawowym można przedstawić następująco: 1s 2 2s 2 2p 6 3s 2 3p
Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI Zadanie 726 (1 pkt.) V/2006/A1 Konfigurację elektronową atomu glinu w stanie podstawowym można przedstawić następująco: 1s 2 2s 2 2p 6 3s 2 3p
Rozdział 28 - Inne galeny
 Rozdział 28 - Inne galeny Okaz 1 - MCh/P/11403 - Galena druzowa - 2-6-2: Próbka z II horyzontu rudnego, Trzebionka, rejon szybiku 18. Galena druzowa narastająca na dnie dużej kawerny w dolomitach kruszconośnych.
Rozdział 28 - Inne galeny Okaz 1 - MCh/P/11403 - Galena druzowa - 2-6-2: Próbka z II horyzontu rudnego, Trzebionka, rejon szybiku 18. Galena druzowa narastająca na dnie dużej kawerny w dolomitach kruszconośnych.
580,10 581,42 581,42 581,70 Węgiel humusowy. Bardzo liczne siarczki żelaza w różnych formach.
 1 2 4 3 Zdj.28. Pokład węgla humusowego nr205/1 (579,10-580,10m) -1, następnie iłowiec (580,10-581,42m) -2; pokład węgla humusowego nr205/2 (581,42-581,70m) -3 oraz mułowiec (581,70-587,15m) -4. Zdj.29.
1 2 4 3 Zdj.28. Pokład węgla humusowego nr205/1 (579,10-580,10m) -1, następnie iłowiec (580,10-581,42m) -2; pokład węgla humusowego nr205/2 (581,42-581,70m) -3 oraz mułowiec (581,70-587,15m) -4. Zdj.29.
Instrukcja dla uczestnika
 II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
a) Sole kwasu chlorowodorowego (solnego) to... b) Sole kwasu siarkowego (VI) to... c) Sole kwasu azotowego (V) to... d) Sole kwasu węglowego to...
 Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
Ćwiczenia laboratoryjne 2
 Ćwiczenia laboratoryjne 2 Ćwiczenie 5: Wytrącanie siarczków grupy II Uwaga: Ćwiczenie wykonać w dwóch zespołach (grupach). A. Przygotuj w oddzielnych probówkach niewielką ilość roztworów zawierających
Ćwiczenia laboratoryjne 2 Ćwiczenie 5: Wytrącanie siarczków grupy II Uwaga: Ćwiczenie wykonać w dwóch zespołach (grupach). A. Przygotuj w oddzielnych probówkach niewielką ilość roztworów zawierających
-wszystkie substancje (pierwiastki lub zw chem) które biorą udział w reakcji chemicznej nazywamy reagentami
 Zapis reakcji chemicznej co to są przemiany chemiczne oraz w jaki sposób możemy opisać zachodzące reakcje? wokół nas bezustannie zachodzą rozmaite przemiany przemiany podczas których powstaje nowa substancja,
Zapis reakcji chemicznej co to są przemiany chemiczne oraz w jaki sposób możemy opisać zachodzące reakcje? wokół nas bezustannie zachodzą rozmaite przemiany przemiany podczas których powstaje nowa substancja,
Fragmenty Działu 8 z Tomu 1 PODSTAWY ELEKTROCHEMII
 Fragmenty Działu 8 z Tomu 1 PODSTAWY ELEKTROCHEMII O G N I W A Zadanie 867 (2 pkt.) Wskaż procesy, jakie zachodzą podczas pracy ogniwa niklowo-srebrowego. Katoda Anoda Zadanie 868* (4 pkt.) W wodnym roztworze
Fragmenty Działu 8 z Tomu 1 PODSTAWY ELEKTROCHEMII O G N I W A Zadanie 867 (2 pkt.) Wskaż procesy, jakie zachodzą podczas pracy ogniwa niklowo-srebrowego. Katoda Anoda Zadanie 868* (4 pkt.) W wodnym roztworze
CHEMIA. Wymagania szczegółowe. Wymagania ogólne
 CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
VII Podkarpacki Konkurs Chemiczny 2014/2015
 II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 2014/2015. Etap wojewódzki
 Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 04/05 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 04/05 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 STOPIEŃ WOJEWÓDZKI 9 MARCA 2018 R.
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Geopolimery z tufu wulkanicznego. dr hab. inż. Janusz Mikuła prof. PK mgr inż. Michał Łach
 Geopolimery z tufu wulkanicznego dr hab. inż. Janusz Mikuła prof. PK mgr inż. Michał Łach Tuf wulkaniczny skład i właściwości Tuf wulkaniczny jest to porowata skała należąca do skał okruchowych, składająca
Geopolimery z tufu wulkanicznego dr hab. inż. Janusz Mikuła prof. PK mgr inż. Michał Łach Tuf wulkaniczny skład i właściwości Tuf wulkaniczny jest to porowata skała należąca do skał okruchowych, składająca
REAKCJE CHEMICZNE I ICH PRZEBIEG
 REAKCJE CHEMICZNE I ICH PRZEBIEG WSTĘP TEORETYCZNY Reakcja chemiczna proces, w którym jedna lub kilka substancji chemicznych ulega przemianie tworząc nową lub nowe substancje, w wyniku zerwania jednych,
REAKCJE CHEMICZNE I ICH PRZEBIEG WSTĘP TEORETYCZNY Reakcja chemiczna proces, w którym jedna lub kilka substancji chemicznych ulega przemianie tworząc nową lub nowe substancje, w wyniku zerwania jednych,
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru
 1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
X Jubileuszowy Podkarpacki Konkurs Chemiczny 2017/2018. ETAP II r. Godz
 KOPKCh X Jubileuszowy Podkarpacki Konkurs Chemiczny 17/18 ETAP II 16.1.17 r. Godz. 11.-1. Uwaga! Masy owe pierwiastków i związków podano na końcu zestawu. Zadanie 1 () 1. Próbka CuSO 5HO o masie 1 g zawiera:
KOPKCh X Jubileuszowy Podkarpacki Konkurs Chemiczny 17/18 ETAP II 16.1.17 r. Godz. 11.-1. Uwaga! Masy owe pierwiastków i związków podano na końcu zestawu. Zadanie 1 () 1. Próbka CuSO 5HO o masie 1 g zawiera:
Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014 Imię i nazwisko uczestnika Szkoła Klasa Nauczyciel Imię
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014 Imię i nazwisko uczestnika Szkoła Klasa Nauczyciel Imię
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
Wietrzenie meteorytów Saint-Aubin i Zegdou w kolekcjach
 ACTA SOCIETATIS METHEORITICAE POLONORUM Rocznik Polskiego Towarzystwa Meteorytowego Vol. 7, 2016 Agnieszka GURDZIEL 1, Łukasz KARWOWSKI 2 Wietrzenie meteorytów Saint-Aubin i Zegdou w kolekcjach Weathering
ACTA SOCIETATIS METHEORITICAE POLONORUM Rocznik Polskiego Towarzystwa Meteorytowego Vol. 7, 2016 Agnieszka GURDZIEL 1, Łukasz KARWOWSKI 2 Wietrzenie meteorytów Saint-Aubin i Zegdou w kolekcjach Weathering
Rozdział 4 - Blendy warstwowane
 Rozdział 4 - Blendy warstwowane Okaz 1 - MCh/P/11302 - Blenda warstwowana z galeną - 1-1-3: Próbka z II horyzontu rudnego, Trzebionka, rejon szybiku nr 29, część południowa. Blenda warstwowana ze skupieniami
Rozdział 4 - Blendy warstwowane Okaz 1 - MCh/P/11302 - Blenda warstwowana z galeną - 1-1-3: Próbka z II horyzontu rudnego, Trzebionka, rejon szybiku nr 29, część południowa. Blenda warstwowana ze skupieniami
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE
 PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
Część I. TEST WYBORU 18 punktów
 Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018. Eliminacje szkolne
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
Analiza anionów nieorganicznych (Cl, Br, I, F, S 2 O 3, PO 4,CO 3
 ĆWICZENIE 12 Analiza anionów nieorganicznych (Cl, Br, I, F, S 2 O 3, PO 4 3,CO 3, SCN, CH 3 COO, C 2 O 4 ) 1. Zakres materiału Pojęcia: Podział anionów na grupy analityczne, sposoby wykrywania anionów;
ĆWICZENIE 12 Analiza anionów nieorganicznych (Cl, Br, I, F, S 2 O 3, PO 4 3,CO 3, SCN, CH 3 COO, C 2 O 4 ) 1. Zakres materiału Pojęcia: Podział anionów na grupy analityczne, sposoby wykrywania anionów;
KWASY. HCN Nazwa kwasu kwas cyjanowodorowy Wzór elektronowy kreskowy:
 www.3echedukacja.pl Proponowane odpowiedzi Kwasy Zadanie 1 KWASY Cl 4 Nazwa kwasu Kwas chlorowodorowy (VII) 3 P 4 Nazwa kwasu kwa ortofosforowy (V) Cl P Typ hybrydyzacji:sp 3 Typ hybrydyzacji: sp 3 CN
www.3echedukacja.pl Proponowane odpowiedzi Kwasy Zadanie 1 KWASY Cl 4 Nazwa kwasu Kwas chlorowodorowy (VII) 3 P 4 Nazwa kwasu kwa ortofosforowy (V) Cl P Typ hybrydyzacji:sp 3 Typ hybrydyzacji: sp 3 CN
ANALIZA ZJAWISKA NIECIĄGŁOŚCI TWORZENIA MIKROWIÓRÓW W PROCESIE WYGŁADZANIA FOLIAMI ŚCIERNYMI
 NIECIĄGŁOŚĆ TWORZENIA MIKROWIÓRÓW prof. dr hab. inż. Wojciech Kacalak, dr inż. Katarzyna Tandecka, dr inż. Łukasz Rypina Politechnika Koszalińska XXXIII Szkoła Naukowa Obróbki Ściernej Łódź 2015 ANALIZA
NIECIĄGŁOŚĆ TWORZENIA MIKROWIÓRÓW prof. dr hab. inż. Wojciech Kacalak, dr inż. Katarzyna Tandecka, dr inż. Łukasz Rypina Politechnika Koszalińska XXXIII Szkoła Naukowa Obróbki Ściernej Łódź 2015 ANALIZA
Piotr Chojnacki 1. Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą reakcji charakterystycznych.
 SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
Wojewódzki Konkurs Przedmiotowy. dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014 KOD UCZNIA Etap: Data: Czas pracy: Wojewódzki 11 marca 2014 90 minut Informacje dla ucznia
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014 KOD UCZNIA Etap: Data: Czas pracy: Wojewódzki 11 marca 2014 90 minut Informacje dla ucznia
Tlen. Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki
 Tlen Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki Ogólna charakterystyka tlenowców Tlenowce: obejmują pierwiastki
Tlen Występowanie i odmiany alotropowe Otrzymywanie tlenu Właściwości fizyczne i chemiczne Związki tlenu tlenki, nadtlenki i ponadtlenki Ogólna charakterystyka tlenowców Tlenowce: obejmują pierwiastki
Ć W I C Z E N I E. Analiza jakościowa
 Ć W I C Z E N I E 5a Analiza jakościowa Podział kationów na grupy analityczne Podstawą podziału kationów na grupy analityczne jest wielkość iloczynu rozpuszczalności poszczególnych soli metali. Jak wiadomo
Ć W I C Z E N I E 5a Analiza jakościowa Podział kationów na grupy analityczne Podstawą podziału kationów na grupy analityczne jest wielkość iloczynu rozpuszczalności poszczególnych soli metali. Jak wiadomo
