Kosm os PROBLEMY NAUK BIOLOGICZNYCH
|
|
|
- Daniel Majewski
- 5 lat temu
- Przeglądów:
Transkrypt
1 Kosm os PROBLEMY NAUK BIOLOGICZNYCH Tom 50, 2001 Numer 4 (253) Strony Polskie Towarzystwo Przyrodników im. Kopernika M a r ia J o l a n t a R ę d o w ic z Zakład Biochemii Mięśni Instytut Biologii Doświadczalnej im. M. Nenckiego PAN Pasteura 3, Warszawa jolanta@nencki.gov.pl MIOZYNY NIEKONWENCJONALNE BUDOWA A POTENCJALNE FUNKCJE W KOMÓRCE WSTĘP Znalezienie blisko 30 lat temu przez Pollarda i Korna w małej, słodkowodnej, wolnożyjącej amebie Acanthamoeba castellanii nowej miozyny, znacznie różniącej się od znanych wówczas tylko izoform mięśniowych, zapoczątkowało nowy etap w badaniach nad białkami motoiycznymi (Pollard i K orn 1973). Rozwój metod biologii molekularnej oraz technik biochemicznych i immunologicznych przyczynił się do poznania i scharakteryzowania sekwencji aminokwasowych ponad 150 izoform miozyny (Berg i współaut. 2001). Różnice w sekwencji aminokwasowej domeny motoiycznej stały się podstawą klasyfikacji izoform miozyny. Nadrodzina miozyn składa się obecnie z co najmniej 18 rodzin (Berg i współaut. 2001) (Ryc. 1). Ta nowa miozyna, traktowana początkowo jako curiosum obecne tylko w amebach i nazwana przez jej odkrywców (jak się potem okazało, słusznie) miozyną I (patrz: B rzeska 2001), uważana jest obecnie za protoplastę miozyn niekonwencjonalnych. Z kolei miozyny mięśniowe i podobne do nich strukturalnie miozyny pochodzące z komórek niemięśniowych noszą miano miozyn konwencjonalnych i tworzą rodzinę II. Dotychczas tylko kilkanaście miozyn niekonwencjonalnych udało się wyizolować z komórek i zbadać metodami biochemicznymi. Są to przedstawiciele rodziny I, stanowiącej najbardziej różnorodną i najlepiej scharakteryzowaną rodzinę miozyn niekonwencjonalnych, oraz rodziny V i IX. Informacje o pozostałych rodzinach, poza danymi uzyskanymi wyłącznie przez analizę ich sekwencji aminokwasowych, pochodzą z badań wykorzystujących rekombinowane fragmenty miozyn i przeciwciała skierowane przeciw określonym rejonom cząsteczki oraz z doświadczeń, w których in aktywowano w komórkach gen danej miozyny (patrz: Sellers 1999, S okac i B e m e n t 2000). Niektórzy badacze zastanawiają się więc, czy dawnej definicji miozyny jako białka zdolnego do wiązania aktyny i hydrolizowania ATP nie należałoby zastąpić taką, iż jest to białko zawierające sekwencje podobne do sekwencji występujących w domenie motorycznej miozyn mięśniowych. Miozyny niekonwencjonalne są obecne we wszystkich komórkach eukariotycznych, od ameb i roślin po ssaki. Podczas gdy u drożdży zidentyfikowano 5 genów kodujących izoformy miozyny będące przedstawicielami 3 rodzin, to u człowieka znaleziono 40 genów kodujących miozyny należące do 12 rodzin (I, II, III, V, VI, VII, IX, X, XV, XVI, XVIII oraz nowej, nie scharakteryzowanej jeszcze rodziny). Tak duża liczba różnorodnych izoform miozyny implikuje zróżnicowanie funkcji, jakie miozyny mogą pełnić w danym organizmie/komórce (Ryc. 2). Wiadomo, że niektóre miozyny niekonwencjonalne uczestniczą w procesach transportu wewnątrzkomórkowego (zademonstrowano to dla izoform miozyny I, V, VI i VII). Miozyny I biorą udział w lokomocji komórek, miozyna III jest istotna w procesie widzenia, zaś miozyny VI, VII i XV uczestniczą w procesie słyszenia. Wydaje się więc, że podczas ewolucji coraz większa złożoność organizmów powodowała ewoluowanie miozyn, które, aby sprostać nowym zadaniom, stawały się coraz bardziej zróżnicowane. Próbie wyjaśnienia, w jaki sposób struktura cząsteczki miozyny może determinować jej funkcje in vivo poświęcony jest niniejszy artykuł.
2 376 M a r ia J o l a n t a R ę d o w ic z Rye. 1. Drzewo filogenetyczne poznanych dotychczas izoform miozyny (wg H o d g e a i Cope a 2000). #, punkt węzłowy; - sekwencja częściowa, ; przynależność do rodziny niepewna. Skróty: Ac Acanthamoeba castellanii, Acl Acetabularia cliftonii, Ai Aequipecten irradians, At Arabidopsis thaliana, Brn Brugia malayi, Bt Bos taurus, Cc Chara corallina, Ce Caenorhabditis elegans, Cr Chlamydomonas reinhardtii, Dd Dictyostelium discoidium, Dm Drosophila melanogaster, En Emiricella nidulans (Aspergillus), Eh Entamoeba histolytica, Gg Gallus gallus, Ha Helianthus annus, Hs Homo sapiens, Lp Limulus polyphemus, Ma Mesocricetus auratus, Mm Mus musculus, Ms Morone saxatilis, Oc Oryctolagus cuniculus, Ov Onchocerca volvulus, Pf Plasmodium falciparum, Pg Pyricularia grisea, Rc Rana catesbeiana, Rn Rattus nowegicus, Sc Saccharomyces cerevisiae, Sm Schistosoma mansoni, Ss Sus scrota domestica, Tg Toxoplasma gondii, Tt Tetrahymena thermophila, XI Xenopus laevis, Zm Zea mays. Adren rdzeń nadnerczy krowy (miozyna I), Ank sekwencje podobne do ankyryny, Bb miozyna I z mikrokosmków jelitowych, CaA łańcuch ciężki miozyny sercowej typu a (myosin II), CaB łańcuch ciężki miozyny sercowej typu (3, Chs syntaza chitynowa typu V, Csm miozyna zawierająca syntazę chitynową, FSk miozyna z szybkich mięśni szkieletowych, FskE miozyna II embrionalna, HMWMI miozyna IV, Kin domena kinazowa, Neur miozyna neuronalna, Nm miozyna II niemięśniowa, PDZ miozyna zawierająca domenę PDZ, Peri miozyna okołoporodowa, Sm miozyna z mięśni gładkich. BUDOWA CZĄSTECZKI MIOZYN NIEKONWENCJONALNYCH Cząsteczka miozyn niekonwencjonalnych składa się, podobnie jak cząsteczka miozyn mięśniowych, z dwóch zasadniczych składowych łańcucha ciężkiego i łańcucha lekkiego (Rye. 1, Tabela 1). W łańcuchu ciężkim, którego masa cząsteczkowa wynosi, w zależności od izoformy, od ok. 93 kda (miozyna XTVj aż do ok. 365 kda (miozyna XV), można wyróżnić trzy zasadnicze domeny (Sellers 1999, B erg i współaut. 2001). Są to; domena motoryczna, będąca najbardziej konserwatywną częścią wszystkich izoform miozyny; domena zawierająca motywy IQ, stanowiąca miejsce wiązania łańcuchów lekkich, zwana również szyjką (do
3 Miozyny niekonwencjonalne 377 mena motoryczna i szyjka tworzą główkę miozyny); domena C-końcowa, najbardziej zróżnicowana część cząsteczki, zwana pałeczką. W pałeczkach miozyn niekonwencjonalnych, poza obecnością w wielu z nich typowej dla miozyn mięśniowych sekwencji umożliwiającej tworzenie superhelisy (ang. coiled-coil), zidentyfikowano szereg motywów/domen, które albo są zycji N-końcowej, jeszcze przed domeną motoryczną, unikalne, specyficzne tylko dla danej izoformy sekwencje. Na przykład miozyna III zawiera domenę kinazy podobnej do kinaz STE (aktywowanych przez białka z rodziny Rho patrz: Fa bczak 2001), miozyna X V posiada olbrzymią domenę (m. cz. ok. 140 kda), która nie wykazuje homologii do dotychczas poznanych Ryc. 2. Schemat przedstawiający funkcje pełnione przez miozyny niekonwencjonalne w wyimaginowanej omnipotencjalnej komórce (wg M er m all i współaut. 1998, za zgodą The American Association for the Advancement of Science). charakterystyczne tylko dla miozyny (np. ang. myosin tail homology MyTHl), albo występują również i w innych białkach, jak np. domeny homologiczne do plekstryny domeny PH - (ang. pleckstrin homology domain), domeny SH3 (ang. Src homology domain 3), domeny homologiczne do taliny, domena RhoGAP czy też domena syntazy chitynowej (Tabela 1). Interesujące jest, iż analiza sekwencji aminokwasowych szyjki i pałeczki doprowadziła do niemal identycznej klasyfikacji miozyn, jaką uzyskano w wyniku analizy sekwencji domeny motorycznej poznanych dotychczas izoform miozyny (k o r n 2000). Niektóre miozyny zawierają w pobiałek, zaś w miozynie XVI zidentyfikowano sekwencje homologiczne do ankiryny, białka cytoszkieletu podbłonowego. Łańcuchami lekkimi są albo łańcuchy specyficzne dla danej izoformy miozyny albo, najczęściej, cząsteczki kalmoduliny. W przeciwieństwie do innych białek wiążących kalmodulinę, wiązanie kalmoduliny z łańcuchami ciężkimi miozyny zachodzi również w nieobecności jo nów wapnia. Uważa się, że liczba motywów IQ w szyjce miozyny jest równoznacza z liczbą wiązanych łańcuchów lekkich. Poza miozyną XIV z Toxoplasma gondii, w sekwencji której nie stwierdzono obecności motywu IQ, łańcuchy
4 378 M aria J olanta R ędow icz Tabela 1. Charakterystyka miozyn niekonwencjonalnych Rodzina miozyn M. cz. ciężkiego łańcucha (kda) Ilość motywów IQ/ilość łańcuchów lekkich Dodatkowe sekwencje w końcu N łańcucha ciężkiego Charakterystyczne sekwencje w pałeczce Miozyny I podrodzina 1 ( ameboidalne) podrodzina 2 podrodzina 3 podrodzina (trzecia cz. kalmoduliny w pałeczce) brak; domena motoryczna we wszystkich podrodzinach pozbawiona jest ok. 80 N-końcowych reszt aminokwasowych MyTHl, MyTH2 SH3 MyTHl MyTHl MyTHl Miozyny III Domena kinazowa, podobna do kinaz PAK sekwencje niespecyficzne Miozyna* IV ok brak MyTH4, SH3 Miozyny V ok. 212 (dimer) 6/2x6 (4 cz. kalmoduliny i 2 łańcuchy miozyny mięśniowej (17, 25 kda) brak sekwencje umożliwiające tworzenie superhelisy, domeny canoe/af6 i globularna Miozyny VI (dimer) 1/2x1? brak; dodatkowe 53 reszty na pograniczu domeny motorycznej i szyjki sekwencje umożliwiające tworzenie superhelisy, domena globularna Miozyny VII ok. 250 (dimer) 5/5x2? brak 2 domeny MyTH4, sekwencje umożliwiające tworzenie superhelisy, domeny homologiczne do taliny Miozyny VII1 (tylko w roślinach) ok. 131 (dimer?) 3/3x2 brak sekwencje umożliwiające tworzenie superhelisy Miozyny IX ok. 150 reszt aminokwasowych, homologia do domen wiążących Ras w białku Rai domena Rho-GAP oraz domena wiążąca jony cynku Miozyny X ok. 230 (dimer?) 3/3x2? brak sekwencje umożliwiające tworzenie superhelisy, domena MyTH4, domena homologiczna do taliny i kilka domen PH Miozyny XI (tylko w roślinach) ok. 170 (dimer) Miozyna* XII ok. 307 (dimer) Miozyny XIII (tylko w roślinach) 6/6x2 brak 2/2x2? ok. 150 reszt, brak homologii do znanych białek sekwencje umożliwiające tworzenie superhelisy sekwencje umożliwiające tworzenie superhelisy, 2 domeny MyTH4 ok brak sekwencje niespecyficzne Miozyny XIV brak brak Miozyny XV ok duża domena ok. 140 Da, brak homologii do znanych białek i sekwencje bogate w reszty prolinowe domena MyTH4, domeny homologiczna do taliny oraz do domeny regulatorowej kinazy C Miozyna* XVI ok domena podobna do ankiryny brak Miozyny XVII ok. 195?? brak domena homologiczna do syntazy chitynowej typu 5 MiozynyXVlII ok. 200 (dimer) 1/1x2? domena PDZ domena homologiczna do taliny, sekwencje umożliwiające tworzenie superhelisy?? * oznacza, że dotychczas został poznany tylko jeden przedstawiciel danej rodziny,? oznacza prawdopodobieństwo tworzenia dimerów;?? oznacza brak danych w literaturze; pozostałe wyjaśnienia w tekście
5 Miozyny niekonwencjonalne 379 ciężkie m iozyn zaw ierają od 1 do 7 takich m o tyw ów (Sellers 1999). Część miozyn niekonwencjonalnych występuje w postaci monomeiycznej, co oznacza, że składają się one z jednego tylko łańcucha ciężkiego i pewnej liczby łańcuchów lekkich, lub w postaci dimerów, składających się z dwóch łańcuchów ciężkich i związanych z nimi łańcuchów lekkich. Dimeryzacja następuje poprzez część pałeczki zawierającą sekwencje umożliwiające tworzenie superhelisy. Żadna z dotychczas poznanych miozyn niekonwencjonalnych nie wydaje się mieć zdolności do tworzenia filamentów, cechy charakterystycznej dla miozyn należących do rodziny II (patrz: S ellers 1999, Sokac i B em e n t 2000). STRUKTURALNE DETERMINANTY FUNKCJI MIOZYN NIEKONWENCJONALNYCH Uważa się, że na wielość i różnorodność funkcji pełnionych przez miozyny niekonwoncjonalne wpływa olbrzymie zróżnicowanie ich struktury. Początkowo wydawało się, że to pałeczka jest rejonem determinującym przeznaczenie danej izoformy. Jednakże coraz więcej jest doniesień wskazujących, że i inne rejony miozyny mogą decydować o funkcji tych białek. ZRÓŻNICOWANIE DOMEN MOTORYCZNYCH MIOZYN NIEKONWENCJONALNYCH Domeny motoryczne, mimo iż są najbardziej konserwatywną częścią cząsteczki miozyn, wykazują jednocześnie ogromne zróżnicowanie, które jak już wspomniano jest podstawą podziału poznanych sekwencji aminokwasowych miozyn na rodziny. Różnice te polegają głównie na braku w ciężkich łańcuchach miozyn niekonwencjonalnych rejonów, które występują w miozynach konwencjonalnych, a także na obecności w nich dodatkowych odcinków 0 różnej długości w miejscach, o których wiadomo, że są szczególnie istotne dla aktywności miozyn konwencjonalnych. Jak się okazuje, u wszystkich dotychczas zsekwencjonowanych przedstawicieli rodziny miozyny I brak jest N-końcowego fragmentu składającego się z ok. 80 reszt aminokwasowych, obecnego w pozostałych izoformach miozyny. Miozyna ta jednak, podobnie do miozyn mięśniowych, wiąże aktynę i hydrolizuje ATP, aczkolwiek w sposób odmienny od miozyn konwencjonalnych. Okazuje się bowiem, iż w niektórych izoformach z tej rodziny na generowany przez nie przesuw filamentu aktynowego w trakcie hydrolizy jednej cząsteczki ATP składają się dwa kroki robocze, o długościach ok. 6 i ok. 5,5 nm (patrz: S ellers 1999). Dla przypomnienia, krok roboczy to odległość, na jaką względem filamentu miozynowego przesuwany jest filament aktynowy w jednym cyklu wytworzenia 1dysocjacji połączenia główki miozyny z aktyną. Odległość ta dla miozyny z szybkich mięśni szkieletowych królika wynosi, jak wskazuje większość badań, ok. 10 nm. Ponadto, w miejscu odpowiadającym reszcie kwasu glutaminowego lub asparaginowego w pozycji 408 ciężkiego łańcucha miozyn z mięśni szkieletowych, znajdującego się w miejscu oddziaływania aktyny z miozyną (Raym ent i współaut. 1993), w wielu miozynach I należących do podrodziny 1 (Tabela 1) występują fosforylowalne reszty sery nowe lub treoninowe (patrz: literatura B r ze ska 2001, r ęd ow icz 200la). Fosforylacja tych reszt w ameboidalnych miozynach I przez kinazy należące do rodziny PAK (kinazy aktywowane przez GTPazy z rodziny Rho) powoduje aktywację tych miozyn. Również badania, w których mutowano te reszty tak, aby in vivo odzwierciedlały one stan konstytutywnego ufosforylowania lub zdefosforylowania miozyny, potwierdzają funkcjonalną rolę tej fosforylacji w domenie motorycznej miozyn I (patrz: B rze sk a 2001). Podobne zastąpienie występuje również w ciężkim łańcuchu miozyny VI (Bem ent i M ooseker 1995). W tym przypadku udało się wykazać, że obecna w tej miozynie reszta treoninowa, odpowiadająca miejscu fosforylacji w miozynach ameboidalnych, może być fosforylowana przez kinazę PAK w warunkach in vitro (patrz: Rę d o w icz 2001a). Fosforylacja, podobnie jak w przypadku ameboidalnych izoform miozyny I, powoduje wzrost aktywności rekombinowanej główki miozyny VI (De la Cruz i współaut. 2000). Porównanie sekwencji domeny motorycznej samych tylko izoform miozyny II wykazało zróżnicowanie składu aminokwasowego w rejonach zwanych pętlą 1 (miejsce podziału trypsyną ciężkiego łańcucha główki miozyny z szybkich mięśni szkieletowych królika na fragment N- końcowy o m. cz. 25 kda i centralny o m. cz. 50 kda) i pętlą 2 (miejsca trawienia trypsyną ciężkiego łańcucha główki powyżej zdefiniowanej miozyny na fragment centralny o m. cz. 50 kda i C-końcowy o m. cz. 20 kda). Badania z zastosowaniem mutantów ze zmienionymi tylko punktowo resztami aminokwasowymi położonymi w pętlach, czy też hybryd złożonych z fragmentów różnych miozyn (patrz: Sokac i B em ent 2000), wykazały, że te rejony cząsteczki pełnią ważne funkcje w pracy, jaką wykonuje miozyna.
6 380 M a r ia J o l a n t a R ę d o w ic z Okazuje się bowiem, że im dłuższa i bardziej giętka jest pętla 1, tym szybciej miozyna uwalnia ADP, produkt hydrolizy ATP. Z kolei ładunek elektrostatyczny w pętli 2 wydaje się mieć istotny wpływ na wiązanie miozyny z aktyną (patrz: S okac i Be m ent 2000). Jeszcze większe zróżnicowanie sekwencji aminokwasowych tych rejonów występuje w miozynach niekonwencjonalnych, aczkolwiek w większości z nich pętla 1 nie przekracza długości pętli w izoformach miozyny II. Wyjątkiem jest MyoJ, przedstawiciel miozyny XI w Dictyostelium discoideum, zawierająca wstawkę składajacą się z ok. 30 reszt aminokwasowych (Ha m m e r i J ung 1996). Brak na razie doniesień dotyczących funkcjonalnego znaczenia tak długiej wstawki. W przypadku miozyn IX, w rejonie odpowiadającym pętli 2, obecna jest olbrzymia wstawka o silnie dodatnim ładunku (pl 11,6), zbudowana z ok. 150 reszt aminokwasowych (patrz: S okac i B em e n t 2000). Badania nad białkiem wyizolowanym z ludzkiego mózgu wykazały, iż jest to jeden z najwolniejszych motorów, aczkolwiek zdolny do nieprzerwanej pracy przez dużo dłuższy czas niż inne poznane dotychczas miozyny. Okazało się również, iż miozyna ta wiąże aktynę w sposób niezależny od ATP. Mimo że nie zdefiniowano dotychczas tego drugiego miejsca wiązania aktyny przypuszcza się, iż za odmienne właściwości miozyny IX odpowiedzialna jest właśnie dodatkowa wstawka w pętli 2 (Post i współaut. 1998). Na pograniczu domeny motorycznej i szyjki miozyny VI zidentyfikowano dodatkowe 53 reszty aminokwasowe odpowiedzialne, jak sugerowano, za unikalną zdolność tej miozyny do poruszania filamentów aktynowych w przeciwnym kierunku niż inne badane dotychczas miozyny (Wells i współaut. 1999). Jednak wyniki doświadczenia, w którym hybryda złożona z domeny motorycznej miozyny V i szyjki miozyny VI (zawierającej tę wstawkę) poruszała aktynę w kierunku ustalonym dla miozyny V, kwestionują to przypuszczenie (H o m m a i współaut. 2001). REJON SZYJKI MIOZYN NIEKONWENCJONALNYCH Istotnym zagadnieniem jest rola cząsteczek kalmoduliny związanych z łańcuchem ciężkim. Niewątpliwie jedną z ich funkcji jest, podobnie jak w przypadku lekkich łańcuchów miozyn mięśniowych, stabilizacja a-helisy ciężkiego łańcucha w rejonie szyjki miozyny (patrz art. P liszki w tym numerze KOSMOSU). Wykazano że, w przypadku miozyny I z kosmków jelitowych i miozyny IX, spowodowanie zaburzenia oddziaływania łańcucha ciężkiego z cząsteczkami kalmoduliny obniża aktywność enzymatyczną tych miozyn oraz hamuje ich zdolność do przesuwania filamentów aktynowych w teście ruchliwości in vitro (Wolenski i współaut. 1993, POST i współaut. 1998). Badania nad miozyną III, występującą wyłącznie w komórkach fotorecep torowy eh oka (zarówno u owadów, jak i u człowieka), zdają się wskazywać, że miozyna ta może być odpowiedzialna za zapewnianie obecności kalmoduliny w określonych rejonach rabdomeru w oku Drosophila (Po rter i współaut. 1993). Podobne wyniki uzyskano dla miozyny V, której cząsteczka zawiera co najmniej 8 kalmodulin. Okazało się, że in vitro może ona użyczać swoich kalmodulinowych podjednostek kinazie zależnej od kalmoduliny, z którą, poprzez rejon pałeczki, wydaje się być związana w neuronach (C o sta i współaut. 1999). Być może i inne miozyny posiadające dużą liczbę motywów IQ (np. niektóre miozyny I, miozyna VII, miozyna XI czy też miozyna XIII) mogą pełnić podobną rolę w komórkach. Liczba motywów IQ determinuje długość szyjki miozyny. Badania miozyny V wskazywały, że długość szyjki wpływa na sposób jej oddziaływania z aktyną i długość jej kroku roboczego. W przeciwieństwie do miozyn konwencjonalnych, ale podobnie jak kinezyny (patrz art. Ka sprzaka w tym numerze KOSMOSU), izoforma miozyny V występująca u kręgowców jest motorem procesywnym, wykonującym krok roboczy o długości ok. 36 nm (M eh ta i współaut. 1999, W a lk e r i współaut. 2000), czyli dłuższy niż krok miozyn konwencj onalnych (ok. 10 nm), których łańcuch ciężki zawiera dwa motywy IQ. Badając mutanty drożdży ekspresjonujących miozynę Myo2 (jedną z dwóch drożdżowych izoform miozyny V), pozbawioną całej szyjki wykazano jednak, że komórki te praktycznie nie różniły się od fenotypu dzikiego, ekspresjonującego niezmienioną izoformę tej miozyny (Ste vens i Davis 1998). Te, oraz wyniki uzyskane w badaniach in vitro nad mutantami miozyny V, któiych łańcuchy ciężkie zawierały tylko po jednym motywie IQ (Tanaka i współaut. 2001), podważają koncepcję, że długość szyjki determinuje długość kroku roboczego miozyny i wskazują że, być może za unikalne właściwości tej rodziny miozyn odpowiedzialna jest domena motoryczna. ZRÓŻNICOWANIE PAŁECZEK MIOZYN NIEKONWENCJONALNYCH Analizy sekwencji aminokwasowych pałeczek nowych miozyn wykazały obecność w ich ciężkich łańuchach motywów/domen wskazujących na możliwość bezpośredniego oddziaływania z lipidami. Do takich z pewnością należy
7 Miozyny niekonwencjonalne 381 MyTHl, rejon pałeczki zawierający dużą liczbę naładowanych dodatnio reszt aminokwasowych, występujący we wszystkich dotąd poznanych izoformach miozyny I. Inną domeną, znalezioną w pałeczkach miozyn VII, X, XV i XVIII (Tabela 1), która potencjalnie uczestniczy w wiązaniu lipidów jest domena homologiczna do taliny (ostatnio nazywana też domeną FERM ang. band four point one/ezrin/radixin/moesin), należącej do nadrodziny białek prążka 4.1. Białka te stanowią integralny składnik cytoszkieletu podbłonowego. Uważa się, że domena FERM determinuje lokalizowanie się różnych białek w błonie plazmatycznej (Sokac i B em ent 2000, B erg i współaut. 2001). Coraz to nowe miozyny ujawniają obecność w ich pałeczkach motywów/domen, które wskazują na możliwość oddziaływania tych potencjalnych motorów z innymi białkami. Implikuje to zaangażowanie wielu miozyn niekonwencjonalnych w interakcję z białkami z różnych szlaków metabolicznych. Do takich domen należy z pewnością domena SH3 znaleziona, poza miozynami I i IV, w wielu białkach cytoszkieletu podbłonowego, takich jak Grb2, fosfoslipaza C, kinaza tyrozynowa Src, czy też a-spektryna, które oddziałują z białkami bogatymi w reszty prolinowe (patrz: S ellers 1999). W miozynach ameboidalnych występuje domena zwana MyTH2, która stanowi drugie, niezależne od nukleotydu, miejsce wiązania aktyny. Rejon ten jest bogaty w reszty glicynowe, prolinowe i alaninowe lub glutaminowe. Z kolei domena plekstrynowa (PH), obecna w miozynach X, występuje w wielu białkach takich jak dynamina, Sos 1i (3-spektryna, uczestniczących w szlakach przekazywania sygnałów (B erg i współaut. 2000). Domena zwana canoe/af6, zidentyfikowana niedawno w C-końcowej części pałeczki miozyn V (Sokac i B e m e n t 2000), występuje również w wielu białkach należących do tzw. małych GTPaz z nadrodziny Ras (patrz: Fabczak 2001). Sugeruje to, że izoformy tej rodziny mogą uczestniczyć w regulacji szlaków związanych z tymi GTPazami. Co ciekawe, w miozynach IX znaleziono funkcjonalnie aktywną domenę Rho-GAP, obecną w białkach GAP (ang. guanidine activator protein), odpowiedzialnych za aktywację rodziny Rho, również należącej do małych GTPaz (POST i współaut. 1998). Miozyny te zawierają także motywy wskazujące na zdolność wiązania jonów cynku (ang. Zn2+-binding domain), obecne w czynnikach transkrypcyjnych, oraz domenę homologiczną do domeny regulatorowej kinazy C (Po st i współaut. 1998). Sekwencja miozyn znalezionych w grzybach i tworzących rodzinę XVII dowodzi, że jest to hybryda zawierająca, obok domeny motorycznej, pałeczkę składającą się z syntazy chitynowej typu V, co wskazuje na możliwość ich transbłonowej lokalizacji (Fu jiw ara i współaut. 1997). Inną ciekawą domeną jest tzw. domena MyTH4, znaleziona po raz pierwszy w miozynie IV z Acanthamoeba castellanii i występująca także w miozynach VII, X, XII i XV, oraz w dwóch produktach nie w pełni jeszcze scharakteryzowanych genów Drosophila melanogaster (H o row itz i Ham m e r 1990, S ellers 1999, B erg i współaut. 2001). Brak jeszcze danych o funkcjonalnej roli tej domeny. Niektóre miozyny, jak np. miozyny V i VI zawierają w końcu C swoich ciężkich łańcuchów domeny globularne, charakterystyczne tylko dla każdej z tych rodzin. Wiadomo, że z tą częścią miozyny V wiąże się łańcuch lekki (o m.cz. ok. 8 kda) dyneiny cytoplazmatycznej (Espin d o la i współaut. 1996); tu także może się wiązać, poprzez swoją część C-końcową, inne białko motoryczne kinezyna (Huang i współaut. 1999). Doniesienia te wskazują na możliwość oddziaływania ze sobą motorów współpracujących zarówno z filamentami aktynowymi, jak i z mikrotubulami (o tym szerzej w dalszej części artykułu). DODATKOWE s e k w e n c j e n -k o ń c o w e Sugeruje się, że również dodatkowe domeny położone na końcu N ciężkiego łańcucha, jeszcze przed domeną motoryczną, obecne w miozynach III, IX, XII, XV, XVI i XVIII, mogą pełnić szczególne funkcje w komórkach. Miozyny III zawierają sekwencję podobną do domeny katalitycznej kinaz PAK, aktywowanych przez małe GTPazy z rodziny Rho (patrz: R ęd o w ic z 200la). Badania z wykorzystaniem rekombinowanej domeny katalitycznej miozyny III z Drosophila wykazały, że może ona in vitro fosoforylować lekkie łańcuchy regulatorowe miozyny z mięśni gładkich, kaldesmon, a także łańcuch ciężki jednej z izoform miozyny III. Nie wiadomo jednak, czy miozyna III pełni rolę kinazy in vivo, a także czy może autofosforylować się w komórkach (patrz Rędow icz 200la). Wiadomo natomiast, że domena ta jest niezbędna dla prawidłowego przebiegu procesów fototransdukcji (Porte r i M ontell 1993, Li i współaut. 1998). W ssaczych izoformach miozyny IX występują sekwencje o długości reszt aminokwasowych. Są one podobne do domen obecnych w białkach z rodziny Raf (nadrodzina Ras) i Ral-GEF (stymuluje aktywność GTPazową białka Rai), które to domeny wiążą białko Ras. Doświadczenia z użyciem rekombinowanych białek nie wykazałyjednak, aby sekwencje obecne w miozynie IX były zdolne do wiązania Ras (Ch iereg atti i współaut. 1998). Również w
8 382 M aria J olanta R ędow icz miozynie XII z Caenorhabditis elegans znaleziono dodatkowy odcinek składający się z ok. 150 reszt aminokwasowych, aczkolwiek nie wykazuje on homologii do znanych białek (Ba k e r i T itus 1997). Także olbrzymia N-końcowa, dodatkowa domena obecna w miozynie XV nie jest podobna do innych białek (Liang i współaut ), natomiast jej wielkość (ponad 140 kda) sugeruje, że może ona pełnić funkcjonalną rolę. W miozynie XVI zidentyfikowano sekwencje homologiczne do ankiryny, co wskazuje na możliwość jej oddziaływania z białkami cytoszkieletu podbłonowego (Pa te l i współaut. 1998)). Z kolei miozyna XVIII zawiera domenę PDZ, odcinek zbudowany z ok. 90 aminokwasów, znaleziony początkowo w białkach: PSD-95 (występuje w połączeniach synaptycznych), DlgA (prekursor rodziny kinaz guaninowych związanych z błonami w Drosophila) i ZO-1 (wiążący filamenty aktynowe składnik połączeń międzykomórkowych). Domenę PDZ znaleziono również w wielu białkach biorących udział w asocjacji kanałów jonowych i receptorów błonowych oraz w wiązaniu tych receptorów z enzymami efektorowymi (Furusawa i współaut. 2000). Dotychczas brak jest doniesień potwierdzających udział miozyny XVIII w tego rodzaju procesach. TRANSPORTOWE FUNKCJE MIOZYN? Transport wewnętrzkomórkowy jest niezbędny dla prawidłowego funkcjonowania wszystkich komórek eukariotycznych, bowiem organelle, pęcherzyki lipidowe, kompleksy białkowe i kwasy nukleinowe muszą dotrzeć do miejsca ich przeznaczenia. Transport w komórkach można, w olbrzymim uproszczeniu, porównać do transportu kolejowego. Biologicznymi szynami są mikrotubule i filamenty aktynowe, zaś lokomotywą (motorem) białka uzyskujące energię z rozkładu paliwa jakim jest ATP i przetwarzające ją w ruch, a więc dyneina, kinezyna i, jak wiadomo od ponad 10 lat, niektóre niekonwencjonalne miozyny, głównie izoformy miozyny I, V i VI. Ładunek, czyli np. organelle lub mrna, przymocowywany jest z reguły do C-końcowej części białka motorycznego, przy czym wiązanie to zachodzi bezpośrednio lub pośrednio, poprzez inne białka lub kompleksy białkowe, nazywane też receptorami. Drugi koniec cząsteczki, główka, wiąże się i z szynami i z ATP. Hydroliza nukleotydu i sprzężone z nią zmiany konformacyjne w główce białka motorycznego, powodujące cykliczne powstawanie i dysocjację jego połączeń z mikrotubulami lub filamentami aktynowymi, prowadzą do ruchu białka po szynie, a w konsekwencji do przemieszczania związanego z nim ładunku (Ryc.3). Na powierzchni organelli może znajdować się wiele cząsteczek białka motorycznego, co odpowiada sytuacji w mięśniach, gdzie końcowy efekt jest wzmocniony przez wielość główek na filamencie miozyny reagujących z jednym fil amentem aktynowym. Faktycznie, badania obu izoform miozyny V u drożdży wykazały, że aby zaistniał ukierunkowany ruch pęcherzyka lipidowego, na jego powierzchni musi znajdować się co najmniej pięć cząsteczek miozyny (Re c k-pete r son i współaut. 2001). Odmiennie niż w przypadku aparatu skurczu w mięśniach, większość białek motoiycznych to motory procesywne, a więc pozostające w kontakcie z szyną podczas kilku cykli hydrolizy ATP. Ryc. 3. Schemat przedstawiający przypuszczalne funkcje miozyn niekonwencjonalnych (na przykładzie miozyny I). 1. Miozyna związana z organellum przemieszcza je wzdłuż filamentu aktynowego; 2. Miozyna zakotwiczona w błonie komórkowej (bezpośrednio poprzez domenę MyTHl, za pośred-nictwem innych białek błonowych lub poprzez drugi filament aktynowy-wiązany przez domenę MyTH2) powoduje przesuwanie się filamentów aktynowych; 3. Miozyna powoduje przesuw błony komórkowej w stosunku do filamentów aktynowych. Kierunek ruchu jest zdeterminowany przez polarność filamentów aktynowych. 4. Miozyna i związane z nią lipidy mogą dyfundować w płaszczyźnie błony. Oddziaływanie takiej miozyny z zakotwiczonymi w błonie filamentami aktynowymi korteksu może służyć do jej przesuwania wzdłuż filamentów aktynowych, powodując nagromadzanie się miozyny i lipidów w rejonach aktywnych komórki. 5. Miozyna zwiazana trwale z jednym filamentem aktynowym (przez domenę MyTH2) i reagująca z drugim w sposób zależny od ATP przesuwa te filamenty względem siebie. Może to prowadzić do kurczenia się całej sieci filamentów aktynowych (wg A d am sa i P o llarda 1989, zmodyfikowane). Impulsem do wysunięcia hipotezy o udziale izoform miozyny w transporcie wewnątrz
9 Miozyny niekonwencjonalne 383 komórkowym było odkiycie w końcu lat 80., że w pałeczce miozyny I z Acanthamoeba cas tellami znajduje się drugie, niezależne od nukleotydu, miejsce wiązania aktyny (domena MyTH2), a także rejon wskazujący na zdolność tej izoformy do wiązania lipidów (domena MyTH 1) (patrz: B r z e s k a 2001). Nieco później miozynę I z mikrokosków jelitowych (ang. brush border myosin I) zlokalizowano na pęcherzykach lipidowych produkowanych przez aparat Golgiego (F a th i B u r g e s s 1993). Wykazano również, że mutacje w genach różnych izoform miozyny I, np. z Aspergillus, Dictyostelium czy S. cerevisiae, powodowały dramatyczne zmiany w procesach wewnątrzkomórkowego transportu organelli, prowadząc m. in. do zaburzeń w endocytozie i egzocytozie (patrz S o k a c i B e m e n t 2000). Dwa odkrycia dotyczące nowej rodziny, miozyny V, zdawały się rozszerzać hipotezę o udziale miozyn w transporcie wewnątrzkomórkowym o inne rodziny miozyn niekonwencjonalnych (M e r m a ll i współaut. 1998). Po pierwsze, okazało się, że produktem genu dilute, którego mutacje prowadza do zaburzenia transportu melanosomów w mysich melanocytach, jest nowo odkryta wówczas miozyna V ( M e r c e r i współaut. 1991). Po drugie, pokazano, że w drożdżach, Saccharomyces cerevisiae, istnieją dwie izoformy miozyny V: Myo2p, która jest zaangażowana w proces transportu pęcherzyków sekrecyjnych (J o h n s t o n i współaut. 1991) oraz Myo4p, biorąca udział w transporcie mrna czynnika transkrypcyjnego ASH1 (Bob o la i współaut. 1996). Potwierdzono, że miozyna V jest zaangażowana w transport melanosomów w melanocytach i melanoforach, pęcherzyków synaptycznych w neuronach, a także mitochondriów w drożdżach. Wykazano także, iż miozyna VI z Drosophila bierze aktywny udział w transporcie organelli w cytoplazmie żywych komórek embrionalnych (M e r m a l l i współaut. 1994). Istnieją również doniesienia wskazujące, że miozyna VII może być zaangażowana w transport opsyny i rodopsyny w komórkach fotoreceptorowych (W o l f r u m i S c h m it t 2000, Liu i W illia m s 2001). Szereg innych badań (patrz: S o k a c i B e m e n t 2000) zdawało się także potwierdzać słuszność hipotezy o udziale miozyn niekonwencjonalnych w transporcie wewnątrzkomórkowym. Zdaniem Sokac i Bementa, aby uznać, że dana miozyna jest aktywnym motorem transportującym określony ładunek (organelle, pęcherzyki lipidowe i związane z nimi białka, a także kompleksy białkowe oraz mrna) muszą być spełnione przynajmniej czteiy kryteria. Po piewsze, należy udokumentować, że transport po szynach aktynowych zachodzi in vivo w nieuszkodzonych komórkach. Po drugie, należy potwierdzić tożsamość przenoszonego ładunku. Po trzecie, należy wykazać, że ładunek ten jest połączony z motorem miozynowym; ideałem byłaby identyfikacja tego motoru. Po czwarte i najważniejsze, należy udowodnić, że inhibicja, inaktywacja lub też usunięcie danej izoformy miozyny powoduje zaprzestanie transportowania ładunku. Dotychczas tylko nieliczne z proponowanych modeli transportu zależnego, jak się wydaje, od miozyny spełniają jednocześnie wszytkie cztery kryteria (patrz: S o k a c i B e m e n t 2000). Czasami jednak trudności natury technicznej uniemożliwiają sprawdzenie wszystkich tych wymogów. Spróbujmy prześledzić dokładniej kilkaprzykładów. W przypadku transportu mrna czynnika transkrypcyjnego przez Myo4p, jedną z dwóch drożdżowych izoform miozyny V, udało się wykazać spełniępie wszystkich czterech kryteriów. Szczególnie istotne było udokumentowanie, że mutacja in vivo w genie tej miozyny powoduje zablokowanie transportu (patrz: S o k a c i B e m e n t ). Istnieje szereg badań wskazujących, że w transport mitochondriów w drożdżach zaangażowane są motory miozynowe. Organelle te kolokalizują z wiązkami F-aktyny i ulegają ukierunkowanym przemieszczeniom, które nie są zależne od integralności mikrotubul. Przemieszczanie jest zahamowane w mutantach z zaburzonym genem aktyny lub pod wpływem czynników depolimeryzujących filamenty aktynowe (takich jak latrunkulina A lub cytochalazyna D). Jednakże mutacje w genach miozyny I lub V nie zaburzały tego transportu, a jednoczesna inaktywacja obu genów powodowała jedynie niewielkie zmiany tak w lokomocji mitochondriów, jak i organizacji cytoszkieletu aktynowego. Wykluczona jest możliwość zaangażowania innej izoformy miozyny niekonwencjonalnej, gdyż w genomie drożdży ich nie znaleziono. A więc nie jest spełnione kryterium czwarte. Można wobec tego przypuszczać, że właściwa organizacja struktury cytoszkieletu aktynowego jest niezbędna do przemieszczania mitochondriów, aczkolwiek nie jest to równoznaczne z aktywnym udziałem miozyny w tym procesie (patrz: S o k a c i B e m e n t 2000). Szereg doniesień łączyło transport pęcherzyków synaptycznych i retikulum endoplazmatycznego w neuronach z miozyną V (patrz: S o k a c i B e m e n t 2000). W obu przypadkach wykazano, że wyizolowane pęcherzyki są w stanie przemieszczać się in vitro po kablach aktynowych. Wykazanie, że defekty w genie miozyny V powodowały zaburzenia neurologiczne u myszy (patrz: R ę d o w ic z 200 lb) wskazywało na
10 384 M aria J olanta R ędow icz aktywny udział tego motoru w transporcie wewnątrzneuronalnym. Wykazano, że depolimeryzacja mikrotubuli w aksonach powoduje zahamowanie transportu pęcherzyków, a także stwierdzono in vivo, że bliżej nieokreślone pęcherzyki lipidowe przemieszczają się po kablach aktynowych. Jednakże wzdłuż filamentów aktynowych pęcherzyki te poruszają się dużo wolniej i tylko ku środkowi komórki. Oznacza to więc, że zależny od aktyny transport nie jest transportem efektywnym. Ponieważ pęcherzyków tych nie udało się scharakteiyzować, nie zostało spełnione kryterium drugie Niektórzy badacze sugerują, że miozyna V, obecna na pęcherzykach, może być tam pasażerem biernie transportowanym po szynach mikrotubularnych ku peryferiom aksonów (patrz: S okac i B em ent 2000). Podobna sytuacja jest w melanocytach, gdzie wprawdzie scharakteryzowany jest ładunek, jednakże przyżyciowe obserwacje ziarnistości zawierających pigment wskazują raczej na to, iż miozyna po prostu zakotwicza je w cytoszkielecie aktynowym, wiążąc się z jednej strony z mikrofrlamentami, a z drugiej z melanosomami (patrz S okac I B e m e n t 2000). Otwartą więc pozostaje kwestia, czy miozyna V działa jako aktywny motor czy też pełni funkcję czynnika stabilizującego organizację cytoszkieletu aktynowego. Wydaje się, że miozyna VI spełnia wszystkie kryteria, aby być uznaną za aktywny motor transportujący pęcherzyki Golgiego w embrionach Drosophila. Udało się wykonać doświadczenia w żyjących komórkach i wykazać, że w sień wskazujących, że miozyny niekonwencjonalne mogą być czynnikami sieciującymi organelle ze strukturami cytoszkieletu aktynowego, bądź też zakotwiczających elementy cytoszkieletu w błonie plazmatycznej (Ryc. 3). Uważa się wręcz, że energia pochodząca z hydrolizy ATP może być zużywana na sieciowanie aktyny (patrz: S okac i B e m ent 2000). Na to, że miozyny pełnią funkcję czynników sieciujących zdaje się też wskazywać ich lokalizacja w wysoce uporządkowanych strukturach zawierających filamenty aktynowe, takich jak np. kosmki jelitowe czy stereocilia zmysłowych komórek włoskowatych (patrz: Sokac i B em e n t 2000, Ręd o w ic z 200 lb). Miozyna wiążąc się z aktyną może uczestniczyć w przekazywaniu bodźców wywieranych na filamenty aktynowe i odwrotnie, bodźce wywierane na białka wiążące się z różnorodnymi domenami miozyny mogą być przekazywane na filamenty aktynowe. Przykładem takiego czynnika sieciującego może być miozyna IX. Z badań in vitro wiemy, że jest to najwolniejszy ze scharakteryzowanych dotychczas motorów, pozostający w połączeniu z aktyną przez długi czas podczas cyklu hydrolizy ATP. W swojej pałeczce zawiera on aktywną domenę Rho-GAP, która jest zdolna do inaktywacji białka Rho. W komórkach ok. 25% tego białka związane jest z błoną cytoplazmatyczną. Można więc przypuszczać, że miozyna IX, zlokalizowana właśnie w strefie przybłonowej, może być tam zakotwiczona poprzez filamenty aktynowe, aby pełnić funkcję regulatora GTPaz z rodziny Rho (Ryc. 4) (patrz: Bah ler 2000). Wykazano, że z kolei miozyna III Fig. 4. Miozyna IX jako czynnik sieciujący filamenty aktynowe z obecnym w błonie komórkowej białkiem RhoA (wg Ba h lera 2000, zmodyfikowane). transporcie uczestniczy motor związany z aktyną, potwierdzić tożsamość i motoru i pęcherzyków lipidowych, a także wykazać, że przeciwciało skierowane przeciw miozynie VI hamuje ten transport (Merm all i współaut. 1994). Obok prac dotyczących transportowej funkcji miozyn, coraz więcej pojawia się też donie- poprzez swoją pałeczkę może wiązać sie in vivo z białkiem INAD (z ang. inactivation no afterpotential D), zawierającym domeny PDZ i oddziałującym bezpośrednio z wieloma białkami podbłonowymi (Ba h le r 2000). Wydaje się, że to oddziaływanie miozyny III z białkami podbłonowymi może być istotne dla utrzymywania upo
11 Miozyny niekonwencjonalne 385 rządkowanej struktury rabdomeru. Udział izoform miozyny I, wskutek oddziaływania poprzez jej domenę SH3 z białkami efektorowymi dla małych GTPaz, w regulacji polimeryzacji aktyny stymulowanej przez białka Rac i Rho w komórkach niemięśniowych wskazuje na uczestnictwo miozyn w przekazywaniu sygnałów szlaku tzw. małych GTPaz (patrz: Fabczak 2001). Innym interesującym, aczkolwiek dla niektórych badaczy kontrowersyjnym przykładem odmiennej od transportowych funkcji miozyn niekonwencjonalnych wydaje się być zaangażowanie specyficznej dla jądra izoformy miozyny I w procesie transkrypcji genów. Wykazano jej kolokalizację z polimerazą II RNA, a przeciwciało skierowane przeciw unikalnej dla tej miozyny wstawce w domenie motorycznej immunoprecypitowało polimerazę II RNA i blokowało in vitro syntezę RNA (Pe stic-d ragovich i współaut. 2000). Autorzy sądzą, że miozyna ta może w jądrze stanowić funkcjonalny kompleks z polimerazą. Jak więc wynika z przytoczonych powyżej przykładów, miozyny mogą być zaangażowane w wielu istotnych dla życia komórki procesach pełniąc rolę aktywnego motoru, umożliwiającego przemieszczanie wielu cząstek i organelli lipidowych, białek oraz kwasów nukleinowych, bądź też pełnić funkcję czynników sieciujących lipidy i błony plazmatyczne z cytoszkieletem aktynowym (Ryc. 3). Mogą także pełnić, o czym poniżej, rolę czynników wiążących cytoszkielet aktynowy z mikrotubulami. O D D ZIAŁYW AN IE M IO ZYN N IE K O N W E N C JO N A LN YC H Z SYSTE M E M M IK R O TU B U LI Pierwsze doniesienia o możliwości oddziaływania motorów współdziałających z filamentami aktynowymi również z systemem mikrotubuli pochodzą z początku lat 90., kiedy to pokazano, że w aksoplazmie mątwy ta sama organella może poruszać się i po F-aktynie i po mikrotubulach (Kuzn e tso v i współaut. 1992). Późniejsze badania wykazały, że organelle zawierają na swojej powierzchni zarówno miozynę V, jak i konwencjonalną kinezynę, co sugerowało, że oba typy motorów mogą współdziałać w wewnątrzkomórkowym transporcie organelli (G oode i współaut. 2000). Stosując czynniki depolimeryzujące filamenty aktynowe (latrunkulinę A) oraz zaburzające strukturę mikrotubuli (nokodazol) wykazano in vivo, że w transporcie ziarnistości zawierających pigment w melanoforach ropuchy Xenopus oraz ryby zebrafish mogą uczestniczyć zarówno motory używające szyn aktynowych, jak i motory wykorzystujące mikrotubule (R o d io no v i współaut. 1998, R o gers igelfand 1998). Uważa się jednak, iż zarówno w przypadku melanoforów melanocytów, jak i neuronów (patrz: Sokac i B e m e n t 2000), podstawą transportu organelli jest system mikrotubuli, natomiast miozyna V uczestniczy co najwyżej w ruchu lokalnym na peryferiach komórki oraz/lub utrzymywaniu organelli w strefie przybłonowej (patrz: S okac i B em ent 2000). Doświadczenia na drożdżach Saccharomyces cerevisiae wykazały obecność białka Smyl (z ang. suppressor of myosin) które, jak się później okazało, zawiera domenę homologiczną do domeny motorycznej kinezyny, aczkolwiek nie wykazano, że jest to aktywny motor. Wprowadzenie genu Smyl do mutantów, w których zinaktywowano gen Myo2 kodujący miozynę V (nieaktywna była domena motoryczna lub pałeczka) i które, mimo produkowania pęcherzyków sekrecyjnych, nie były zdolne do pączkowania, powodowało odzyskanie fenotypu Myo2. Eliminacja genu Smyl nie powodowała ewidentnych skutków, natomiast podwójna mutacja -Myo2/- Smyl była dla drożdży letalna. Stwierdzono, że białka te kolokalizują i mogą ze sobą bezpośrednio oddziaływać poprzez rejon w C-końcowej części Smyl i globularnej, również C-końcowej części Myo2. Podejrzewa się, że Smyl może indukować zmiany konformacyjne w miozynie, wzmagające jej interakcję z aktyną (patrz: G o ode i współaut. 2000). Sugerowano, że oddziaływania pomiędzy miozyną V i Smyl mogą odgrywać niezmiernie istotną rolę w tworzeniu pączka i ukierunowanej migracji jądra podczas pączkowania drożdży (patrz: G o o de i współaut. 2000). U ludzi konwencjonalna kinezyna (Khcu) kolokalizuje w melanocytach z miozyną V. Białka te wiążą się ze sobą poprzez globularną C-końcową część pałeczki miozyny i C-końcowy odcinek pałeczki kinezyny, tuż przed miejscem, gdzie wiążą się jej łańcuchy lekkie (Huang i współaut. 1999). Autorzy postulują, że motory związane ze sobą swoimi końcami C przymocowują się do tego samego ładunku. W takim heteromotorze tylko jeden ze składników może być w danym momencie aktywny, w zależności od rodzaju aktualnie używanych szyn. Kinezyna mogłaby więc wzdłuż aksonu, na długim dystansie, szybko przenosić np. pęcherzyk Golgiego, zaś miozyna V dostarczałaby go używając filamentów aktynowych, już wolniej, do korteksu przybłonowego, kolbek synaptycz
12 386 M a r ia J o l a n t a R ę d o w ic z nych, czy stożków wzrostu neuiytów, tam gdzie w zasadzie nie ma juz mikrotubuli (patrz Ryc. 2), a lipidy są niezbędne do budowania błony plazmatycznej (H u a n g i współaut 1999). W procesie tym kinezyna dostarczałaby zarówno pęcherzyki, jak i nowo zsyntetyzowaną miozynę do rejonów, w których są one potrzebne. Być może, bezpośrednie oddziaływanie kinezyny i miozyny jest też konieczne do ukierunkowanego ruchu komórki, w którym następuje przesuwanie mikrotubuli ku krawędziom wiodącym. W tym przypadku miozyna pełniłaby funkcję aktywnego motoru wspomagającego kinezynę w przesuwaniu mikrotubuli, mogłaby też być czynnikiem sieciującym mikro tubule z filamentami aktynowymi przyłączonymi do błony komórkowej poprzez białka cytoszkieletu podbłonowego (patrz: G oode i współaut. 2000). Wykazanie, że przedstawiciel innej rodziny miozyn, miozyna VI w Drosophila, oddziałuje z izoformą białka CLIP 170 (ang. cytoplasmic linker protein), które wiąże się do mikrotubuli i cytoplazmatycznych struktur peryferyjnych, zdaje się potwierdzać tę ostatnią możliwość (Lantz i M ille r 1998). B IA ŁK A W IĄ Ż Ą C E SIĘ Z M IO ZYN AM I N IE K O N W E N C JO N A LN YM I O oddziaływaniu niektórych z tych białek z różnymi izoformami miozyny wspomniano pokrótce już wyżej. Dotychczas wykryto ich znacznie mniej niż samych miozyn niekonwencjonalnych. Poza aktyną, wiążącą się głównie z domeną motoryczną, oraz kalmoduliną i specyficznymi dla niektórych miozyn łańcuchami lekkimi, które wiążą się z łańcuchem ciężkim w rejonie szyjki, wszystkie inne dotąd wykryte białka wiążą się z pałeczką miozyny. Dotychczas zidentyfikowano białka oddziałujące z przedstawicielami rodzin: I, III, V, VI, VII i IX. Jednym z takich białek jest Acan-125, białko o m. cz. ok. 125 kda, występujące w Acanthamoeba castellanii, które wiąże się z domeną SH3 miozyny IC poprzez rejony cząsteczki zawierające zgrupowania reszt prolinowych. Oba te białka występują na wewnątrzkomórkowych organellach (Xu i współaut. 1997). Z kolei domena SH3 Myo5p, jednej z dwóch izoform miozyny I w Saccharomyces cerevisiae, wiąże się z werproliną, białkiem również bogatym w reszty prolinowe, które przypuszczalnie jest cytoplazmatycznym receptorem dla tej izoformy miozyny (Anderso n i współaut. 1998). INAD to białko składające się z 674 reszt aminokwasowych, które wiąże się z pałeczką NINAC, izoformą miozyny III z Drosophila o m. cz. ok. 174 kda. Zawiera ono 5 domen PDZ, którymi, poza miozyną, wiąże się z kalmoduliną, fosfolipazą C, kinazą białkową C oraz białkami transbłonowymi, takimi jak rodopsyna czy białko receptorowe chwilowego potencjału TRP (ang. transient receptor potential protein). Wykazano, że zaburzenia w interakcji INAD z NINAC powodowały opóźnienie w odpowiedzi na bodźce świetlne (patrz: Bah ler 2000). Udało się zidentyfikować kilka białek oddziałujących z izoformami miozyny V. Zaobserwowano, że pałeczka neuronalnej izoformy miozyny V tworzy stabilne kompleksy z synaptofizyną i synaptobrewiną, białkami związanymi z błoną pęcherzyków synaptycznych (Prekeris i T errian 1997). Globularna część pałeczki miozyny V wiąże się również z kinezyną KhcU (ang. kinesin heavy chain ubiquitous). Wydaje się, że wiązanie to jest specyficzne dla tej kinezyny, gdyż izoforma neuronalna kinezyny (KhcN) nie wykazuje zdolności wiązania miozyny V. Smyl to białko o m. cz. ok. 75 kda występujące w drożdżach, wykazujące podobieństwo do kinezyny, które wiąże się i oddziałuje z drożdżową izoformą miozyny V, Myo2. Wykazano, że do domeny Myo2, która bierze udział w tworzeniu superhelisy, wiąże się Rho3, jeden z czterech przedstawicieli białek Rho w drożdżach. Przypuszcza się, że ta interakcja może być ważna dla utrzymania polaryzacji komórek podczas pączkowania (patrz: Sokac i B em ent 2000). Innymi białkami z nadrodziny Ras oddziałującymi z pałeczką miozyny V są przedstawiciele rodziny Rab: Rab27a i Rab 1la. Rab27a wiąże się z obecną w melanocytach miozyną Va, podczas gdy Rab 1la wiąże się i kolokalizuje z obecną w mózgu miozyną Vb. Postuluje się, że białka te, o masie ok. 27 kda, w swojej aktywnej formie (ze związanym GTP) pełnią funkcję receptorów umożliwiających wiązanie tych izoform miozyny z powierzchnią organelli (Wu i współaut. 2001). Potwierdza to również fakt, że mutacje w genie kodującym Rab27a są odpowiedzialne za chorobę Griscelliego, schorzenie autosomalne związane z zaburzeniami w transporcie melanosomów (patrz: Rędow icz 200 lb). Kolejnym białkiem oddziałującym z globularnym rejonem pałeczki miozyny V, jest BERP, białko zawierające motywy zwane ring finger (odmiana domen wiążących j ony cynku), które występuj ą w wielu białkach biorących udział w regulacji ekspresji genów i proliferacji komórek. Nadekspresja w neuronach białka BERP pozbawionego domeny wiążącej miozynę V powodowała zaburzenia w
13 Miozyny niekonwencjonalne 387 tworzeniu wypustek po stymulacji komórek przez czynnik wzrostu nerwów NGF (ang. nerve growth factor) (patrz: S okac i B em e n t 2000). Innym białkiem wiążącym się do globularnej części pałeczki jest lekki łańcuch dyneiny o m. cz. ok. 8 kda, białko oddziałujące, poza dyneiną i miozyną, również z wieloma innymi białkami, takimi jak syntaza tlenku azotu czy cytoplazmatyczny inhibitor transkrypcji IB. Podejrzewa się, że łańcuch ten, wiążąc się z miozyną w stosunku molowym 2:1, pełni funkcję stabilizatora oddziaływań pomiędzy dwoma ciężkimi łańcuchami miozyny w dimerze lub odgrywa rolę w umocowaniu ładunku do pałeczki (patrz: S okac i Be m ent 2000). Białkiem, które oddziałuje z pałeczką miozyny VI jest CLIP-190, homolog ssaczego CLIP- 170 w Drosophila. Białka CLIP, tworzące w komórkach dimery o m.cz. ok. 310 kda, po ufosforylowaniu przez np. kinazę białkową C wiążą się poprzez ich koniec N z mikrotubulami. Koniec C uczestniczy w wiązaniu z peryferyjnymi strukturami cytoplazmatycznymi. W wiązaniu miozyny uczestniczy prawdopodobnie część cząsteczki CLIP zdolna do tworzenia superhelisy (Lantz i M ille r 1998). Oba te białka wiążą się do cząstek lipidowych, pełniąc rolę łacznika między systemem mikrotubuli i filamentów aktynowych (Lantz i M ille r 1998). Wezatyna (ang. vezatin) to białko błonowe (m.cz. ok. 65 kda) oddziałujące, zarówno in vitro jak i in vivo, końcem C z domeną FERM miozyny VIIA (Ku ssel-anderm an i współaut. 2000). Występuje ona w połączeniach międzykomórkowych typu stref przylegania wielu typów komórek, gdzie jest jednym z elementów kompleksu kateninowo-kadherynowego. Sugeruje sie, że miozyna VII zakotwiczona w błonie komórkowej poprzez związanie wezatyny, może być odpowiedzialna za wytwarzanie napięcia pomiędzy strefą przylegania a cytoszkieletem aktynowym, co jest istotne dla wzmocnienia przylegania między komórkami (Ku sse l-anderm an i współaut 2000). W przypadku miozyny IX udało się pokazać, że z jej domeną Rho-GAP oddziałuje kilka izoform białka Rho: RhoA, Rho B i RhoC (Ryc. 4). Miozyna IX stymuluje ich aktywność GTPazową, co prowadzi jednak w konsekwencji do przyjmowania przez te białka formy nieaktywnej, ze związanym GDP (patrz: Fab c z a k 2001). Nadekspresja miozyny IX w komórkach powoduje utratę włókien naprężeniowych i miejsc przyczepu komórek nabłonkowych do podłoża, podobnie jak w przypadku innych GAP i czynników hamujących endogenne białka Rho (patrz: Bah ler 2000). Z miozynami wiąże się także szereg kinaz, mniej lub bardziej specyficznych, które w przypadku miozyn niekonwencjonalnych fosforylują ich reszty seiynowe lub treoninowe położone bądź w domenie motorycznej (ameboidalne miozyny I i miozyna VI), bądź w pałeczce (miozyna III i Vj. Osoby zainteresowane tym zagadnieniem odsyłam do artykułów B rzeskiej (2001) i Rędow icz (200la). M IO Z Y N Y N IE K O N W E N C JO N A LN E W R O ŚLIN AC H Pierwsze doniesienia o obecności systemu aktomiozynowego w roślinach pochodzą z połowy lat 60., kiedy to udało się wykazać, że ekstrakty z liści tytoniu (Nicotiana) mają aktywność ATPazową i ich konsystencja (lepkość) zmienia się po dodaniu ATP (Yen i Shih i 965). Zademonstrowano również, że charakterystyczne zwijanie się liści mimozy także zależy od obecności ATP (Lyu bim o va i współaut. 1964). Pierwsze doniesienia o izolacji i biochemicznej charakterystyce roślinnych izoform miozyny zaczęły pojawiać się w końcu lat 80., a lata 90. to okres rozwoju badań nad genetyką miozyn w systemach roślinnych od glonów po rośliny wyższe (patrz: V olkm ann i Ba lu s k a 1999, Re d d y i Day 2001). Opóźnienie w stosunku do badań nad motorami w innych organizmach wynika z mniejszego zainteresowania modelami roślinnymi i z trudności technicznych, a mianowicie braku odpowiednich metod identyfikacji cytoszkieletu aktynowego w systemach roślinnych. Obecnie znanych jest w roślinach ok. 30 genów kodujących miozyny należące do trzech rodzin VIII, XI i XIII. Co ciekawe, rodziny te zawierają jedynie izoformy roślinne (patrz: Tabela 1, Ryc.l). Należy tu jednak przypomnieć, że do rodziny XI niektórzy badacze zaliczają także MyoJ z Dictyostelium discoideum. Dotychczas udało sie poznać sekwencje miozyn z Acetabularia cliftonii, Arabidopsis thaliana (model do badań genetycznych roślin dwuliściennych, należy do rodziny kapustowatych), Chara corallina, słonecznika i kukurydzy. Tylko niektóre natywne miozyny udało się scharakteryzować, np. wyizolowano je z liści tytoniu, pyłku i ziaren traw, lilii, Arabidopsis, rzeżuchy, kukurydzy czy też z glonów z rodzaju Chara i Acetabularia (patrz: R ed d y i Day 2001). W danej roślinie występują przedstawiciele tylko dwóch rodzin z reguły VIII i XI, a więc mniej niż w innych komórkach eukariotycznych. Natomiast w samym tylko Arabidopsis wykryto aż 17 genów
14 388 M arla J olanta R ędow icz kodujących miozyny, z czego tylko 4 należą do rodziny VIII, a reszta do rodziny XI. RodzinaXIII ma tylko dwóch przedstawicieli, znalezionych w genomie Acetabularia. Poza wydedukowaną sekwencją aminokwasową brak jest informacji o przedstawicielach tej grupy miozyn. Łańcuchy ciężkie miozyn VIII mają m.cz. ok. 130 kda i zawierają od 3 do 4 motywów IQ. Ich pałeczki, poza sekwencjami umożliwiającymi powstawanie superhelisy, nie zawierają charakterystycznych domen. Z kolei rodzinaxi to białka złożone z łańuchów ciężkich o m. cz. ok. 170 kda, zawierających od 5 do 6 motywów IQ, tworzące dimeiy dzięki obecności w pałeczce sekwencji umożliwiającej tworzenie superhelisy. Pododnie jak miozyny VIII, przedstawiciele rodziny XI również nie wykazują charakterystycznych domen w pałeczce. Rodzinę XIII stanowią dwie monomeryczne miozyny o m.cz. ciężkiego łańucha ok. 125 kda, mające aż 7 motywów IQ. W miozynach XI z Arabidopsis, w rejonie odpowiadającym miejscu fosforylacji ameboidalnych izoform miozyny I i miozyny VI lub reszcie glutaminowej w pozycji 408 w łańcuchu ciężkim miozyny z mięśni szkieletowych, obok reszt glutaminowych lub asparaginianowych obecna jest także reszta treoninowa (patrz; Re d d y i Da y 2001). Brak dotąd doniesień o możliwości fosforylacji tej reszty treoninowej przez kinazy z rodziny PAK, jak to ma miejsce w miozynie I i miozynie VI. Możliwości tej nie można wykluczyć, zwłaszcza iż w roślinach obecny jest system białek z rodziny Rho. W przypadku miozyn XI z pyłku lilii i liści tytoniu udało się wykazać, że białka te wiążą kalmodulinę w nieobecności jonów Ca +. Miozyna XI z glonu Chara jest najszybszą izoformą wśród dotąd poznanych miozyn, porusza ona bowiem filamenty aktynowe, w teście ruchliwości in vitro, z prędkością ok. 100 ąm/s, a więc kilkunastokrotnie szybciej niż miozyny mięśniowe. Przyjmuje się, że to właśnie miozyny XI odpowiedzialne są za szybki przepływ cytoplazmy (ang. cytoplasmic streaming) w roślinach. Zlokalizowano je w pęcherzykach lipidowych, organellach i komórkach rozrodczych. Przyjmuje się, że są one aktywnie zaangażowane w procesy transportu wewnątrzkomórkowego, co w przypadku roślin ma szczególne znaczenie, gdyż mikrotubule nie uczestniczą tam w transporcie organelli generowanych w endoplazmatycznym retikulum i cysternach aparatu Golgiego (patrz: Re d d y i Da y 2001, V olkm ann i Ba lu sk a 1999). Z kolei miozyny VIII, dużo słabiej scharakteryzowane, występują w ścianie komórkowej, głównie w połączeniach pomiędzy sąsiednimi komórkami umożliwiającymi bezpośredni przepływ jonów i białek. Struktury te zwane są plazmodesmami. Podczas podziału komórkowego miozyny VIII są związane ze ścianą komórkową, także nowo powstałych komórek. Mikroskopia elektronowa wykazała, że miozyna ta występuje w przestrzeni pomiędzy błoną komórkową a plazmodesmami. Przypuszcza się zatem, że miozyny te biorą udział w transporcie plazmodesmalnym oraz w tworzeniu ściany komórkowej poprzez dostarczanie materiału do miejsca syntezy ściany. Nie wyklucza się również możliwości uczestniczenia tych miozyn w utrzymywaniu organizacji cytoszkieletu aktynowego (patrz: R e d d y i Da y 2001, V o lkm ann i Balu ska 1999). PODSUMOWANIE Miozyny stanowią olbrzymią nadrodzinę zależnych od aktyny białek motorycznych, które są obecne we wszystkich komórkach eukariotycznych. Na podstawie różnic w sekwencji domeny motorycznej podzielono miozyny na 18 rodzin. Miozyny występujące w mięśniach tworzą rodzinę II i noszą też miano miozyn konwencjonalnych, podczas gdy pozostałe miozyny nazywa się miozynami niekonwencjonalnymi. Miozyny niekonwencjonalne wykazują ogromne zróżnicowanie w swojej strukturze pierwszorzędowej, zwłaszcza w rejonie pałeczki. Budowa miozyn ma znaczący wpływ na funkcje, jakie miozyny mogą pełnić w komórkach. Wiele miozyn niekonwencjonalnych wiąże się z szeregiem innych białek, w tym z przedstawicielami kinezyny, grupy białek motorycznych współdziałających z systemem mikrotubuli. Miozyny zaangażowane są we wszystkie procesy związane z organizacją cytoszkieletu aktynowego i/lub transportu wewnątrzkomórkowego, takie jak endo- i egzocytoza, cytokineza lub migracja komórek. Defekty w genach kilku miozyn niekonwencjonalnych są odpowiedzialne za zaburzenia m. in. słuchu, wzroku czy neurologiczne (patrz literatura: Rędow icz 200 lb). Trawestując znane powiedzenie, że w jedności siła, to w przypadku miozyn siła tkwi w ich różnorodności.
15 Miozyny niekonwencjonalne 389 U N C O N V E N TIO N A L M YO S IN S S TR U C TU R E A N D PO SSIB LE F U N C TIO N S IN T H E C E LL S u m m a r y Myosins are the actin based-motors that are expressed in all eukaryotic cells as multiple isoforms. They form a diverse superfamily consisting of at least 18 different families. The classification has been made on the basis of differences in the amino acid sequence of the myosin motor domain. Muscle myosins (and those structurally resembling them) are called conventional myosins and form family II whereas other isoforms are called unconventional myosins. There is a huge diversity in the primary structure of unconventional myosins, particularly in the rod portion constituting the C-terminal part of the myosin heavy chain. The structure of myosin effects its in vivo function. There are several proteins that bind to some unconventional myosins. For example, kinesin, the microtubule-based motor, interacts with myosin V suggesting cooperation between the actin and microtubule systems. Unconventional myosins participate in all processes involving the reorganization of the actin cytoskeleton and/or intracellular transport such as endo- and exocytosis, cytokinesis and cell migration. Mutations within the genes encoding some myosins caused some diseases, for example, neurological disorders (myosinv) and hearing impairment (myosin VI, VII and XV). Thinking about myosins, one should reconsider the saying unity is strength and think instead that strength comes from diversity. LITERATU RA A d a m s R. J., P o l l a r d T. D., Binding o f myosin I to membrane lipids. Nature 340, A n d e r s o n B. L., B o ld o g h I., E v a n g e l is t a M., B o o n e C., G r e e n e L. A., P o n L. A., The Src homology domain 3 (SH3) o f a yeast type myosin I, Myo5p, binds to verprolin and is required fo r targeting to sites of actin polarization. J. Cell Biol. 141, B ah ler M., Are class III and class IX myosins motorized signalling molecules? Biochim. Biophys. Acta 1496, B a k e r J. P., T it u s M. A., A family o f unconventional myosins from the nematode Caenorhabditis elegans. J. M o l. B io l , B e m e n t W. M., M o o s e k e r M. S., TEDS rule: a molecular rationale fo r differential regulation o f myosins by phosphorylation o f the heavy chain head. Cell Motil. Cytoskeleton. 31, B e r g J. S., D e r f l e r B. H., P e n n is i C. M., C o r e y D. P., C h e n e y R. E., Myosin X, a novel myosin with pleckstrin homology domains associates with region of dynamic actin. J. Cell Sci. 113, B e rg J. S., P o w e l l B. C., C h e n e y R. E., A millenial myosin census. Mol. Biol. Cell 12, B o b o l a N., J a n s e n R. P., S h in T. H., N a s m y t h K Assymetric accumulation o f A sh lp in post-anaphase nuclei depends on a myosin and restricts yeast matingtype switching to mother cells. Cell 84, B r z e s k a H., Przygoda z amebą: dziwaczne miozyny i kinaza. Kosmos 50, C h ie r e g a tti E., G a r t n e r A., S t o f f l e r H. E., B a h l e r M., M y r 7 is a novel myosin IX-RhoGAP expressed in rat brain. J. Cell Sci. I l l, C o s t a M. C., M a n i F., S a n t o r o W, E s p r e a f ic o E. M.,L a r s o n R. E., Brain myosin V, a calmodulin carrying myosin, binds to calmodulin-dependent kinase II and activates its activity. J. Biol. Chem. 274, D e l a C r u z E. M., W e l l s A. L., M o r r is C. A., O s t a p E. M., S w e e n e y H. L., Mechanism o f myosin VI regulation by phosphorylation. Mol. Biol. Cell 11, E s p in d o l a F. S., C h e n e y R. E., K in g S. M., S u t e r D. M., M o o s e k e r M. S., Myosin V and dynein share a similar light chain. Mol. Biol. Cell 7, 372a. F a b c z a k H., Rodzina białek Rho a cytoszkielet. Kosmos 50, F a t h K. R., B u r g e s s D. R., Golgi-derived vesicles from developing epithelial cells bind actin filaments and posses myosin-i as a cytoplasmically oriented peripheral membrane protein. J. Cell Biol. 120, F u j iw a r a M., H o r iu c h i H., O h t a A., T a k a g i M., A novel fungal gene encoding chitin synthase with a motor-like domain. Biochem. Biophys. Res. Comm. 236, F u r u s a w a T, Ik a w a S., Y a n a i N., O b in a t a M., Isolation o f a novel PDZ-containing myosin from hematopoetic supportive bone marrow stromal cell lines. Biochem. Biophys. Res. Comm. 270, G o o d e B. L., D r u b in D. G., B a r n e s G., Functional cooperation between the microtubule and actin cytoskeletons. Curr. Opinion Cell Biol. 12, H a m m e r J. A. I l l, J u n g G., The sequence ofdictyostelium myoj heavy chain gene predicts a novel, dimeric, unconventional myosin with a heavy chain molecular mass o f 258 kda. J. Biol. Chem. 271, H o d g e T., C o pe M. J. T. V., A myosin family tree. J. Cell Sci. 113, H o m m a K., Y o s h im u r a M., S a it o J., I k e b e R., I k e b e M., The core o f motor domain determines the direction of myosin movement. Nature 412, H o r o w it z J. A., H a m m e r J. A. Ill, A new Acanthamoeba myosin heavy chain: cloning o f the gene and immunological identification of the polypeptide. J. Biol. Chem. 265, H u a n g J. D., B r a d y S. T., R ic h a r d s B. W., S t e n o ie n D., R e s a u J. H., C o p e l a n d N. G., Direct interaction of microtubule- and actin-based transport motors. Nature 397, J o h n s t o n G. C., P r e n d e r g a s t J. A., S in g e r, R. A., The Saccharomyces cerevisiae MY02 gene encodes an essential my osin fo r vectorial transport o f vesicles. J. Cell Biol. 113, K o r n E. D., Co-evolution o f head, neck and tail domains of myosin heavy chains. Proc. Natl. Acad. Sci. USA 97, K u s s e l -A n d e r m a n n P., E l-a m r a o u i A., S a f ie d d in e S., N o u a il l e S., P e r f e t t in ii., L e c u it M. C o s s a r t P., W o lf r u m U., P e t it C., Vezatin, a novel transmembrane protein, bridges myosin VIIA to the cadherin-catenins complex. EMBO J. 19, K u z n e t s o v S. A., L a n g f o r d G. M., W e is s D. G., Actindependent organelle movement in squid axoplasm. Nature 356, L a n t z V. A., M il l e r K. G., A class VI unconventional myosin I is associated with a homologue o f a microtubule-binding protein, cytoplasmic linker protein-170, in neurons and at the posterior pole ofdrosophila embryos. J. Cell Biol. 140,
16 390 M aria J olanta R ędow icz L i H. S., P o r t e r J. A., M o n t e l l C., Requirements fo r the NINAC kinase/myosin fo r stable termination o f the visual cascade. J. Neurosci. 18, L ia n g Y., W a n g A., B e l y a n t s e v a I. A., A n d e r s o n D. W., P r o b s t F. J., B a r b e r T. D., M il l e r W., T o c h m a n J. W., J in L., S u ll iv a n S. L., S e l l e r s J. R., C a m p e r S. A., L l o y d R. V., K a c h a r B., F r ie d m a n T. B., F r i d e l l R. A., Characterization o f the human and mouse unconventional myosin X V genes responsible fo r hereditary deafness DFNB3 and shaker-2. Genomics 61, L iu X., W il l ia m s D. S., Coincident onset o f expression o f myosin VILA and opsin in the cilium o f the developing photoreceptor cell. Exp. Eye Res. 72, L y u b im o v a M. N., D e m y a n o v s k a y a I. B., F e d o r o v ic h I. B., It o m l e n s k it e I. V., Participation o f ATP in the motor function o f the Mimosa pudica leaf. Biokhimiya 29, M e h t a A. D., R o c k R. S., R id f M., S p u d ic h J. A., M o o s e k e r M. S., C h e n e y, R. E., Myosin-V is a processive actin-based motor. Nature 400, M e r m a l l V., M c n a l l y J. G., M il l e r K. G., Transportof cytoplamic particles catalysed by an unconventional myosin in living Drosophila embryos. Nature 369, M e r m a l l V., P o s t P. L., M o o s e k e r M. S., Unconventional myosins in cell movement, membrane traffic, and signal transduction. Science 279, M e r c e r J. A., S e p e r a c k P. K., S t r o b e l M. C., C o p e l a n d N. G., J e n k in s N. A., Novel myosin heavy chain encoded by murine dilute colour locus. Nature 349, P a t e l K., Ca m e r o n P. L., C a m e r o n R., Identification of a unconventional myosin present in mammalian brain development. Mol. Biol. Cell 9s, 387a. P e s t ic - D r a g o v ic h L., S t o j il j k o v ic L., P h il im o n e n k o A. A., N o w a k G., Y u n b o KE, S e t t l a g e R. E., S h a b a n o w it z J., H u n t D. F., H o z a k P., D e L a n e r o l l e P., A myosin I isoform in the nucleus. Science 290, P o llard T. D., D o b e r s t e in S. K. Z o t H. G., Myosin-I. Annu. Rev. Physiol. 53, P o ll a r d T. D., K o r n, E. D., Acanthamoeba myosin. I. Isolation from Acanthamoeba castellanii o f an enzyme similar to muscle myosin. J. Biol. Chem. 248, P o r t e r J. A., M o n t e l l C., Distinct roles o f the Drosophila ninac kinase and myosin domains revealed by systematic mutagenesis. J. Cell Biol. 122, P o r t e r J. A., YuM., D o b e r s t e in S. K., P o l l a r d T. D., M o n t e l l C., Dependence o f calmodulin localization in the retina on the NINAC unconventional myosin. Science 262, P o s t P. L., B o k o c h G. M., M o o s e k e r M. S., Human myosin IXb is a mechanochemicallly active motor and a GAP fo r rho. J. Cell Sci. I l l, P r e k e r is R., T e r r ia n D. M., Brain myosin V is a synaptic vesicle-associated motor protein: evidence fo r a Ca2+-dependent interaction with synaptobrevin-synaptophysin complex. J. Cell Biol. 137, R a y m e n t I., H o l d e n H. M., W h it t a k e r, Y o h n C. B., L o r e n z M., H o lm e s K. C., M il l ig a n R. A., Structure o f the actin-based complex and and its implications fo r muscle contraction. Science 261, R e c k -P e t e r s o n S. L., T y s k a M. J., N o v ic k P. J., M o o s e k e r M. S., The yeast class V myosins, Myo2p andmyo4p, are nonprocessive actin-based motors. J. Cell. Biol R e d d y A. S. N D a y, I. S., Analysis o f the myosins encoded in the recently completed Arabidopsis thaliana genome sequence. Genbiol. 2, R ę d o w ic z M. J., 2001a. Regulation o f nonmuscle myosins by heavy chain phosphorylation. J. Muscle Res. Cell Motil. 22, R ę d o w ic z M. J., 2001b. Miozyna a patologia. Kosmos 50, R o d io n o v V. I., H o pe A. J., S v it k in a T. M., B o r i s y G. G., Functional coordination o f microtubule-based and actinbased motility in melanophores. Curr. Biol. 8, R o g e r s S. L., G e l f a n d V. I., Myosin cooperates with microtubule motors during organelle transport in melanophores. Curr. Biol. 8, S e l l e r s J. R., Myosin, 2nd edition. Protein Profile, Oxford University Press, Oxford. S o k a c A. M., B e m e n t W. M., Regulation and expression o f metazoan unconventional myosins. Int. Rev. Cytol. 200, S t e v e n s R. C., D a v is T. N., M lclp is a light chain fo r the unconventional myosin Myo2p in Saccharomyces cerevisiae. J. Cell Biol. 142, T a n a k a H., H o m m a K., Iw a n e A. H., K a t a y a m a E., Ik e b e R., S a it o J.,Y a n a g id a T., I k e b e M., The motor domain, not a long neck domain, determines the large step of myosin V. Biophys. J. 80, 361a. V o l k m a n n D., B a l u s k a F., Actin cytoskeleton in plants: from transport networks to signaling networks. Microsc. Res. Techn. 47, W a l k e r M. L., B u r g e s s S. A., S e l l e r s J. R., W a n g F., H a m m e r J. A. Ill, T r in ic k J., K n ig h t P. J., Two-headed binding o f a processive myosin to actin. Nature 405, W e l l s A. L., L in A. W., C h e n L. Q., S a f e r D., C a in S. M., H a s s o n T., C a r r a g h e r B. O., M il l ig a n R. A., S w e e n e y H. L., Myosin VI is an actin-based motor that moves backwards. Nature 401, W o le n s k i J. S., H a y d e n S. M., F o r s c h e r P., M o o s e k e r M. S., Calcium-calmodulin and regulation o f brush border myosin I MgATPase and mechanochemistry. J. Cell Biol. 122, W o l f r u m U., S c h m it t A., Rhodopsin transport in the membrane o f the connecting cilium o f mammalian photoreceptor cells. Cell Motil. Cytoskel. 46, Wu X., R a o K., B o w e r s M. B., C o p e l a n d N. G., J e n k in s N. A., H a m m e r J. A., Rab27a enables myosin Va-dependent melanosome capture by recruiting the myosin to the organelle. J. Cell Science 114, Xu P., M it c h e l h il l K. I., K o b e B., K e m p B. E., Z o t H. G The myosin-i-binding protein Acan 125 binds the SH3 domain and belongs to the superfamily of leucine-rich repeat proteins. Proc. Natl Acad, Sci. USA 94, Y e n L. F., S h ih t. c., The presence o f contractile protein in higher plants. Scientia Sinica 14,
CYTOSZKIELET CYTOSZKIELET Cytoplazma podstawowa (macierz cytoplazmatyczna) Komórka eukariotyczna. cytoplazma + jądro komórkowe.
 Komórka eukariotyczna cytoplazma + jądro komórkowe (układ wykonawczy) cytoplazma podstawowa (cytozol) Cytoplazma złożony koloid wodny cząsteczek i makrocząsteczek (centrum informacyjne) organelle i kompleksy
Komórka eukariotyczna cytoplazma + jądro komórkowe (układ wykonawczy) cytoplazma podstawowa (cytozol) Cytoplazma złożony koloid wodny cząsteczek i makrocząsteczek (centrum informacyjne) organelle i kompleksy
CYTOSZKIELET CYTOSZKIELET
 CYTOSZKIELET Sieć włókienek białkowych; struktura wysoce dynamiczna Filamenty aktynowe Filamenty pośrednie Mikrotubule Fibroblast CYTOSZKIELET 1 CYTOSZKIELET 7nm 10nm 25nm Filamenty pośrednie ich średnica
CYTOSZKIELET Sieć włókienek białkowych; struktura wysoce dynamiczna Filamenty aktynowe Filamenty pośrednie Mikrotubule Fibroblast CYTOSZKIELET 1 CYTOSZKIELET 7nm 10nm 25nm Filamenty pośrednie ich średnica
Dr. habil. Anna Salek International Bio-Consulting 1 Germany
 1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
Komórka eukariotyczna organizacja
 Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma podstawowa (cytozol) organelle cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma podstawowa (cytozol) organelle cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja
 Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma organelle podstawowa (cytozol) cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma organelle podstawowa (cytozol) cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Filamenty aktynowe ORGANIZACJA CYTOPLAZMY. komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe
 Filamenty aktynowe ORGANIZACJA CYTOPLAZMY komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe Cytoszkielet aktynowy G-aktyna 370 aminokwasów 42 43 kda izoformy:
Filamenty aktynowe ORGANIZACJA CYTOPLAZMY komórki CHO (Chinese hamster ovary cells ) Hoechst jądra, BOPIPY TR-X phallacidin filamenty aktynowe Cytoszkielet aktynowy G-aktyna 370 aminokwasów 42 43 kda izoformy:
Składniki cytoszkieletu. Szkielet komórki
 Składniki cytoszkieletu. Szkielet komórki aktynowe pośrednie aktynowe pośrednie 1 Elementy cytoszkieletu aktynowe pośrednie aktynowe filamenty aktynowe inaczej mikrofilamenty filamenty utworzone z aktyny
Składniki cytoszkieletu. Szkielet komórki aktynowe pośrednie aktynowe pośrednie 1 Elementy cytoszkieletu aktynowe pośrednie aktynowe filamenty aktynowe inaczej mikrofilamenty filamenty utworzone z aktyny
CYTOSZKIELET. Mikrotubule. podjednostki strukturalne. 450 aminokwasów. 13 (11-16) 55kDa i 53kDa strukturalna polarność
 CYTOSZKIELET Mikrotubule podjednostki strukturalne 13 (11-16) 55kDa i 53kDa strukturalna polarność 450 aminokwasów Mikrotubule wydłuŝanie / /skracanie Mikrotubule elongacja + - in vitro in vivo - dodawanie
CYTOSZKIELET Mikrotubule podjednostki strukturalne 13 (11-16) 55kDa i 53kDa strukturalna polarność 450 aminokwasów Mikrotubule wydłuŝanie / /skracanie Mikrotubule elongacja + - in vitro in vivo - dodawanie
Transport przez błony
 Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Udział jonów wapnia w regulacji oddziaływań aktyny z miozyną
 Udział jonów wapnia w regulacji oddziaływań aktyny z miozyną STRESZCZENIE Skurcz komórek mięśniowych oraz różnorodne formy ruchliwości komórek niemięśniowych są uzależnione od cyklicznych oddziaływań pomiędzy
Udział jonów wapnia w regulacji oddziaływań aktyny z miozyną STRESZCZENIE Skurcz komórek mięśniowych oraz różnorodne formy ruchliwości komórek niemięśniowych są uzależnione od cyklicznych oddziaływań pomiędzy
Wybrane techniki badania białek -proteomika funkcjonalna
 Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
Kosm os. PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika. Tom 50, 2001 Numer 3 (252) Strony
 Kosm os Tom 50, 2001 Numer 3 (252) Strony 223-232 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Ha n n a B r z e s k a Laboratory of Cell Biology National Heart, Lung and Blood
Kosm os Tom 50, 2001 Numer 3 (252) Strony 223-232 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Ha n n a B r z e s k a Laboratory of Cell Biology National Heart, Lung and Blood
października 2013: Elementarz biologii molekularnej. Wykład nr 2 BIOINFORMATYKA rok II
 10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
Komórka eukariotyczna
 Komórka eukariotyczna http://pl.wikipedia.org/w/index.php?title=plik:hela_cells_stained_with_hoechst_33258.jpg cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii,
Komórka eukariotyczna http://pl.wikipedia.org/w/index.php?title=plik:hela_cells_stained_with_hoechst_33258.jpg cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii,
THE UNFOLDED PROTEIN RESPONSE
 THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
Nukleotydy w układach biologicznych
 Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
ROLA WAPNIA W FIZJOLOGII KOMÓRKI
 ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
Przemiana materii i energii - Biologia.net.pl
 Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN
 MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
Wykład 14 Biosynteza białek
 BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
DNA musi współdziałać z białkami!
 DNA musi współdziałać z białkami! Specyficzność oddziaływań między DNA a białkami wiążącymi DNA zależy od: zmian konformacyjnych wzdłuż cząsteczki DNA zróżnicowania struktury DNA wynikającego z sekwencji
DNA musi współdziałać z białkami! Specyficzność oddziaływań między DNA a białkami wiążącymi DNA zależy od: zmian konformacyjnych wzdłuż cząsteczki DNA zróżnicowania struktury DNA wynikającego z sekwencji
TATA box. Enhancery. CGCG ekson intron ekson intron ekson CZĘŚĆ KODUJĄCA GENU TERMINATOR. Elementy regulatorowe
 Promotory genu Promotor bliski leży w odległości do 40 pz od miejsca startu transkrypcji, zawiera kasetę TATA. Kaseta TATA to silnie konserwowana sekwencja TATAAAA, występująca w większości promotorów
Promotory genu Promotor bliski leży w odległości do 40 pz od miejsca startu transkrypcji, zawiera kasetę TATA. Kaseta TATA to silnie konserwowana sekwencja TATAAAA, występująca w większości promotorów
Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii
 Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii 1. Technologia rekombinowanego DNA jest podstawą uzyskiwania genetycznie zmodyfikowanych organizmów 2. Medycyna i ochrona zdrowia
Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii 1. Technologia rekombinowanego DNA jest podstawą uzyskiwania genetycznie zmodyfikowanych organizmów 2. Medycyna i ochrona zdrowia
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Budowa rybosomu Translacja
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Budowa rybosomu Translacja
Proteomika: umożliwia badanie zestawu wszystkich lub prawie wszystkich białek komórkowych
 Proteomika: umożliwia badanie zestawu wszystkich lub prawie wszystkich białek komórkowych Zalety w porównaniu z analizą trankryptomu: analiza transkryptomu komórki identyfikacja mrna nie musi jeszcze oznaczać
Proteomika: umożliwia badanie zestawu wszystkich lub prawie wszystkich białek komórkowych Zalety w porównaniu z analizą trankryptomu: analiza transkryptomu komórki identyfikacja mrna nie musi jeszcze oznaczać
The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna
 Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Część II: Ruch w układach biologicznych. Biofizyka II przedmiot obieralny Materiały pomocnicze do wykładów prof. dr hab. inż.
 Biofizyka II przedmiot obieralny Materiały pomocnicze do wykładów prof. dr hab. inż. Jan Mazerski C Z ĘŚĆ II: RUCH W U K Ł ADACH B IOLOGICZNYCH 1. CYTOSZKIELET Zastosowania mikroskopu świetlnego do badania
Biofizyka II przedmiot obieralny Materiały pomocnicze do wykładów prof. dr hab. inż. Jan Mazerski C Z ĘŚĆ II: RUCH W U K Ł ADACH B IOLOGICZNYCH 1. CYTOSZKIELET Zastosowania mikroskopu świetlnego do badania
Transport makrocząsteczek
 Komórka eukariotyczna cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii, dzięki której organizm uzyskuje energię biosynteza białka i innych związków Transport
Komórka eukariotyczna cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii, dzięki której organizm uzyskuje energię biosynteza białka i innych związków Transport
MIOZYNY NIEKONWENCJONALNE I ICH ROLA W MIĘŚNIACH POPRZECZNIE PRĄŻKOWANYCH I KOMÓRKACH MIOGENNYCH
 Tom 67 2018 Numer 1 (318) Strony 57 74 Małgorzata Suszek, Jolanta Nowak, Maria Jolanta Rędowicz Pracownia Molekularnych Podstaw Ruchów Komórkowych Zakład Biochemii Instytut Biologii Doświadczalnej im.
Tom 67 2018 Numer 1 (318) Strony 57 74 Małgorzata Suszek, Jolanta Nowak, Maria Jolanta Rędowicz Pracownia Molekularnych Podstaw Ruchów Komórkowych Zakład Biochemii Instytut Biologii Doświadczalnej im.
Numer 4 (253) Strony PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika
 Tom 50, 2001 Kosm os Numer 4 (253) Strony 359-374 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Re n a t a Dą b r o w s k a i R o b e r t m a k u c h Zakład. Biochemii Mięśni
Tom 50, 2001 Kosm os Numer 4 (253) Strony 359-374 PROBLEMY NAUK BIOLOGICZNYCH Polskie Towarzystwo Przyrodników im. Kopernika Re n a t a Dą b r o w s k a i R o b e r t m a k u c h Zakład. Biochemii Mięśni
TRANSKRYPCJA - I etap ekspresji genów
 Eksparesja genów TRANSKRYPCJA - I etap ekspresji genów Przepisywanie informacji genetycznej z makrocząsteczki DNA na mniejsze i bardziej funkcjonalne cząsteczki pre-mrna Polimeraza RNA ETAP I Inicjacja
Eksparesja genów TRANSKRYPCJA - I etap ekspresji genów Przepisywanie informacji genetycznej z makrocząsteczki DNA na mniejsze i bardziej funkcjonalne cząsteczki pre-mrna Polimeraza RNA ETAP I Inicjacja
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ 1. Gen to odcinek DNA odpowiedzialny
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ 1. Gen to odcinek DNA odpowiedzialny
Translacja i proteom komórki
 Translacja i proteom komórki 1. Kod genetyczny 2. Budowa rybosomów 3. Inicjacja translacji 4. Elongacja translacji 5. Terminacja translacji 6. Potranslacyjne zmiany polipeptydów 7. Translacja a retikulum
Translacja i proteom komórki 1. Kod genetyczny 2. Budowa rybosomów 3. Inicjacja translacji 4. Elongacja translacji 5. Terminacja translacji 6. Potranslacyjne zmiany polipeptydów 7. Translacja a retikulum
Wykład 5. Remodeling chromatyny
 Wykład 5 Remodeling chromatyny 1 Plan wykładu: 1. Przebudowa chromatyny 2. Struktura, funkcje oraz mechanizm działania kompleksów remodelujących chromatynę 3. Charakterystyka kompleksów typu SWI/SNF 4.
Wykład 5 Remodeling chromatyny 1 Plan wykładu: 1. Przebudowa chromatyny 2. Struktura, funkcje oraz mechanizm działania kompleksów remodelujących chromatynę 3. Charakterystyka kompleksów typu SWI/SNF 4.
Wybrane techniki badania białek -proteomika funkcjonalna
 Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu w porównaniu z analizą trankryptomu:
Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu w porównaniu z analizą trankryptomu:
WITAMY NA KURSIE HISTOLOGII
 KOMÓRKA WITAMY NA KURSIE HISTOLOGII www.histologia.cm-uj.krakow.pl Wielkość komórek ZróŜnicowanie komórek Jednostki: 1 µm = 10-3 mm, 1 nm = 10-3 µm kształt najmniejsze komórki (komórki przytarczyc, niektóre
KOMÓRKA WITAMY NA KURSIE HISTOLOGII www.histologia.cm-uj.krakow.pl Wielkość komórek ZróŜnicowanie komórek Jednostki: 1 µm = 10-3 mm, 1 nm = 10-3 µm kształt najmniejsze komórki (komórki przytarczyc, niektóre
PIERWOTNIAKI W BADANIACH BIOCHEMICZNYCH I GENETYCZNYCH. b o n s 1963, 1965) doprowadziły do ustalenia, że
 Kosm os Tom 49, 2000 Numer 4 (249) Strony 583-587 PROBLEMY NAUKBIÓLOGICZNYĆH Polskie Towarzystwo Przyrodników im. Kopernika Ma r ia J o l a n t a R ę d o w ic z Zakład Biochemii Mięśni Instytut Biologii
Kosm os Tom 49, 2000 Numer 4 (249) Strony 583-587 PROBLEMY NAUKBIÓLOGICZNYĆH Polskie Towarzystwo Przyrodników im. Kopernika Ma r ia J o l a n t a R ę d o w ic z Zakład Biochemii Mięśni Instytut Biologii
Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie
 Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
 Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Geny, a funkcjonowanie organizmu
 Geny, a funkcjonowanie organizmu Wprowadzenie do genów letalnych Geny kodują Białka Kwasy rybonukleinowe 1 Geny Występują zwykle w 2 kopiach Kopia pochodząca od matki Kopia pochodząca od ojca Ekspresji
Geny, a funkcjonowanie organizmu Wprowadzenie do genów letalnych Geny kodują Białka Kwasy rybonukleinowe 1 Geny Występują zwykle w 2 kopiach Kopia pochodząca od matki Kopia pochodząca od ojca Ekspresji
starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg
 STRESZCZENIE Przewlekła białaczka limfocytowa (PBL) jest najczęstszą białaczką ludzi starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg kliniczny, zróżnicowane rokowanie. Etiologia
STRESZCZENIE Przewlekła białaczka limfocytowa (PBL) jest najczęstszą białaczką ludzi starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg kliniczny, zróżnicowane rokowanie. Etiologia
Wprowadzenie do biologii molekularnej.
 Wprowadzenie do biologii molekularnej. Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego. Biologia molekularna zajmuje się badaniem biologicznych
Wprowadzenie do biologii molekularnej. Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego. Biologia molekularna zajmuje się badaniem biologicznych
SEMINARIUM 8:
 SEMINARIUM 8: 24.11. 2016 Mikroelementy i pierwiastki śladowe, definicje, udział w metabolizmie ustroju reakcje biochemiczne zależne od aktywacji/inhibicji przy udziale mikroelementów i pierwiastków śladowych,
SEMINARIUM 8: 24.11. 2016 Mikroelementy i pierwiastki śladowe, definicje, udział w metabolizmie ustroju reakcje biochemiczne zależne od aktywacji/inhibicji przy udziale mikroelementów i pierwiastków śladowych,
Część V: Przekazywanie sygnałów. DO WYKŁADÓW Z PODSTAW BIOFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski
 MATERIAŁY PMCNICZE D WYKŁADÓW Z PDSTAW BIFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski PRZEKAZYWANIE SYGNAŁÓW Cechą charakterystyczną układów żywych jest zdolność do zachowywania wewnętrznej
MATERIAŁY PMCNICZE D WYKŁADÓW Z PDSTAW BIFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski PRZEKAZYWANIE SYGNAŁÓW Cechą charakterystyczną układów żywych jest zdolność do zachowywania wewnętrznej
Transport pęcherzykowy
 Transport pęcherzykowy sortowanie przenoszonego materiału zachowanie asymetrii zachowanie odrębności organelli precyzyjne oznakowanie Transport pęcherzykowy etapy transportu Transport pęcherzykowy przemieszczanie
Transport pęcherzykowy sortowanie przenoszonego materiału zachowanie asymetrii zachowanie odrębności organelli precyzyjne oznakowanie Transport pęcherzykowy etapy transportu Transport pęcherzykowy przemieszczanie
FIZJOLOGIA ORGANELLI (jak działa komórka?)
 Wstęp do biologii 3. FIZJOLOGIA ORGANELLI (jak działa komórka?) Jerzy Dzik Instytut Paleobiologii PAN Instytut Zoologii UW 2015 KOMÓRKA elementarnym osobnikiem wyodrębnienie błoną od środowiska przestrzenne
Wstęp do biologii 3. FIZJOLOGIA ORGANELLI (jak działa komórka?) Jerzy Dzik Instytut Paleobiologii PAN Instytut Zoologii UW 2015 KOMÓRKA elementarnym osobnikiem wyodrębnienie błoną od środowiska przestrzenne
SESJA 10 ODPOWIEDŹ ORGANIZMÓW NA CZYNNIKI BIOTYCZNE I ABIOTYCZNE WYKŁADY
 SESJA 10 ODPOWIEDŹ ORGANIZMÓW NA CZYNNIKI BIOTYCZNE I ABIOTYCZNE WYKŁADY 238 SESJA 10 WYKŁADY W10-01 REAKTYWNE FORMY TLENU JAKO ELEMENT REAKCJI KOMÓREK NA STRES Grzegorz Bartosz Katedra Biofizyki Molekularnej
SESJA 10 ODPOWIEDŹ ORGANIZMÓW NA CZYNNIKI BIOTYCZNE I ABIOTYCZNE WYKŁADY 238 SESJA 10 WYKŁADY W10-01 REAKTYWNE FORMY TLENU JAKO ELEMENT REAKCJI KOMÓREK NA STRES Grzegorz Bartosz Katedra Biofizyki Molekularnej
Ruch zwiększa recykling komórkowy Natura i wychowanie
 Wiadomości naukowe o chorobie Huntingtona. Prostym językiem. Napisane przez naukowców. Dla globalnej społeczności HD. Ruch zwiększa recykling komórkowy Ćwiczenia potęgują recykling komórkowy u myszy. Czy
Wiadomości naukowe o chorobie Huntingtona. Prostym językiem. Napisane przez naukowców. Dla globalnej społeczności HD. Ruch zwiększa recykling komórkowy Ćwiczenia potęgują recykling komórkowy u myszy. Czy
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski
 biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
biologiczne mechanizmy zachowania seminarium + laboratorium M.Eng. Michal Adam Michalowski michal.michalowski@uwr.edu.pl michaladamichalowski@gmail.com michal.michalowski@uwr.edu.pl https://mmichalowskiuwr.wordpress.com/
Mięśnie. dr Magdalena Markowska
 Mięśnie dr Magdalena Markowska Zjawisko ruchu 1) Jako możliwość przemieszczania przestrzennego mięśnie poprzecznie prążkowane 2) Pompa serce 3) Jako podstawa do utrzymywania czynności życiowych mięśnie
Mięśnie dr Magdalena Markowska Zjawisko ruchu 1) Jako możliwość przemieszczania przestrzennego mięśnie poprzecznie prążkowane 2) Pompa serce 3) Jako podstawa do utrzymywania czynności życiowych mięśnie
Transportowane cząsteczki CO O, 2, NO, H O, etanol, mocznik... Zgodnie z gradientem: stężenia elektrochemicznym gradient stężeń
 Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
STRESZCZENIE W JĘZYKU POLSKIM
 STRESZCZENIE W JĘZYKU POLSKIM Apikalna błona komórkowa nabłonka jelitowego (znana także pod nazwą mikrokosmków jelitowych czy rąbka szczoteczkowego/ wchłaniającego) stanowi selektywną barierę ochronną
STRESZCZENIE W JĘZYKU POLSKIM Apikalna błona komórkowa nabłonka jelitowego (znana także pod nazwą mikrokosmków jelitowych czy rąbka szczoteczkowego/ wchłaniającego) stanowi selektywną barierę ochronną
WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS
 WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS KOLOKWIA; 15% KOLOKWIA-MIN; 21% WEJŚCIÓWKI; 6% WEJŚCIÓWKI-MIN; 5% EGZAMIN; 27% EGZAMIN-MIN; 26% WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS kolokwium I 12% poprawa kolokwium
WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS KOLOKWIA; 15% KOLOKWIA-MIN; 21% WEJŚCIÓWKI; 6% WEJŚCIÓWKI-MIN; 5% EGZAMIN; 27% EGZAMIN-MIN; 26% WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS kolokwium I 12% poprawa kolokwium
Ruch i mięśnie. dr Magdalena Markowska
 Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Budowa i funkcje komórek nerwowych
 Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Fizjologia nauka o czynności żywego organizmu
 nauka o czynności żywego organizmu Stanowi zbiór praw, jakim podlega cały organizm oraz poszczególne jego układy, narządy, tkanki i komórki prawa rządzące żywym organizmem są wykrywane doświadczalnie określają
nauka o czynności żywego organizmu Stanowi zbiór praw, jakim podlega cały organizm oraz poszczególne jego układy, narządy, tkanki i komórki prawa rządzące żywym organizmem są wykrywane doświadczalnie określają
błona zewnętrzna błona wewnętrzna (tworzy grzebienie lamelarne lub tubularne) przestrzeń międzybłonowa macierz Błona wewnętrzna: Macierz:
 Mitochondria KOMÓRKA Cz. III błona zewnętrzna błona wewnętrzna (tworzy grzebienie lamelarne lub tubularne) przestrzeń międzybłonowa macierz Błona wewnętrzna: Błona zewnętrzna: białka/lipidy 1:1 poryny
Mitochondria KOMÓRKA Cz. III błona zewnętrzna błona wewnętrzna (tworzy grzebienie lamelarne lub tubularne) przestrzeń międzybłonowa macierz Błona wewnętrzna: Błona zewnętrzna: białka/lipidy 1:1 poryny
DNA superhelikalny eukariota DNA kolisty bakterie plazmidy mitochondria DNA liniowy wirusy otrzymywany in vitro
 DNA- kwas deoksyrybonukleinowy: DNA superhelikalny eukariota DNA kolisty bakterie plazmidy mitochondria DNA liniowy wirusy otrzymywany in vitro RNA- kwasy rybonukleinowe: RNA matrycowy (mrna) transkrybowany
DNA- kwas deoksyrybonukleinowy: DNA superhelikalny eukariota DNA kolisty bakterie plazmidy mitochondria DNA liniowy wirusy otrzymywany in vitro RNA- kwasy rybonukleinowe: RNA matrycowy (mrna) transkrybowany
WYNALAZKI BIOTECHNOLOGICZNE W POLSCE. Ewa Waszkowska ekspert UPRP
 WYNALAZKI BIOTECHNOLOGICZNE W POLSCE Ewa Waszkowska ekspert UPRP Źródła informacji w biotechnologii projekt SLING Warszawa, 9-10.12.2010 PLAN WYSTĄPIENIA Umocowania prawne Wynalazki biotechnologiczne Statystyka
WYNALAZKI BIOTECHNOLOGICZNE W POLSCE Ewa Waszkowska ekspert UPRP Źródła informacji w biotechnologii projekt SLING Warszawa, 9-10.12.2010 PLAN WYSTĄPIENIA Umocowania prawne Wynalazki biotechnologiczne Statystyka
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu
 Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
Bliskie spotkania z biologią METABOLIZM. dr hab. Joanna Moraczewska, prof. UKW. Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki
 Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Transport makrocząsteczek (białek)
 Transport makrocząsteczek (białek) Transport makrocząsteczek sortowanie białek - sekwencje sygnałowe lata 70-te XX w. - Günter Blobel - hipoteza sygnałowa; 1999r - nagroda Nobla Sekwencja sygnałowa: A
Transport makrocząsteczek (białek) Transport makrocząsteczek sortowanie białek - sekwencje sygnałowe lata 70-te XX w. - Günter Blobel - hipoteza sygnałowa; 1999r - nagroda Nobla Sekwencja sygnałowa: A
Budowa komórkowa organizmów Składniki plazmatyczne i nieplazmatyczne komórki - budowa i funkcje
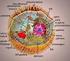 Budowa komórkowa organizmów Składniki plazmatyczne i nieplazmatyczne komórki - budowa i funkcje KOMÓRKA najmniejszy samoodtwarzający się żywy układ biologiczny ciało komórki tworzy protoplazma, którą oddziela
Budowa komórkowa organizmów Składniki plazmatyczne i nieplazmatyczne komórki - budowa i funkcje KOMÓRKA najmniejszy samoodtwarzający się żywy układ biologiczny ciało komórki tworzy protoplazma, którą oddziela
Charakterystyka izoenzymów aminotransferazy asparaginianowej z siewek pszenicy zwyczajnej (Triticum aestivum L.)
 Charakterystyka izoenzymów aminotransferazy asparaginianowej z siewek pszenicy zwyczajnej (Triticum aestivum L.) Marcin Maciąga & Andrzej Paszkowski Katedra Biochemii, Wydział Rolnictwa i Biologii, SGGW
Charakterystyka izoenzymów aminotransferazy asparaginianowej z siewek pszenicy zwyczajnej (Triticum aestivum L.) Marcin Maciąga & Andrzej Paszkowski Katedra Biochemii, Wydział Rolnictwa i Biologii, SGGW
FIZJOLOGIA ORGANELLI (jak działa komórka?)
 Wstęp do biologii 3. FIZJOLOGIA ORGANELLI (jak działa komórka?) Jerzy Dzik Instytut Paleobiologii PAN Instytut Zoologii UW 2016 KOMÓRKA elementarnym osobnikiem wyodrębnienie błoną od środowiska przestrzenne
Wstęp do biologii 3. FIZJOLOGIA ORGANELLI (jak działa komórka?) Jerzy Dzik Instytut Paleobiologii PAN Instytut Zoologii UW 2016 KOMÓRKA elementarnym osobnikiem wyodrębnienie błoną od środowiska przestrzenne
Dr hab. Anna Bębenek Warszawa,
 Dr hab. Anna Bębenek Warszawa, 14.01. 2018 Instytut Biochemii i Biofizyki PAN Ul. Pawińskiego 5a 02-106 Warszawa Recenzja pracy doktorskiej Pana mgr Michała Płachty Pod Tytułem Regulacja funkcjonowania
Dr hab. Anna Bębenek Warszawa, 14.01. 2018 Instytut Biochemii i Biofizyki PAN Ul. Pawińskiego 5a 02-106 Warszawa Recenzja pracy doktorskiej Pana mgr Michała Płachty Pod Tytułem Regulacja funkcjonowania
Właściwości błony komórkowej
 płynność asymetria Właściwości błony komórkowej selektywna przepuszczalność Płynność i stan fazowy - ruchy rotacyjne: obrotowe wokół długiej osi cząsteczki - ruchy fleksyjne zginanie łańcucha alifatycznego
płynność asymetria Właściwości błony komórkowej selektywna przepuszczalność Płynność i stan fazowy - ruchy rotacyjne: obrotowe wokół długiej osi cząsteczki - ruchy fleksyjne zginanie łańcucha alifatycznego
cytoplazma + jądro komórkowe = protoplazma Jądro komórkowe
 Komórka eukariotyczna http://pl.wikipedia.org/w/index.php?title=plik:hela_cells_stained_with_hoechst_33258.jpg cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii,
Komórka eukariotyczna http://pl.wikipedia.org/w/index.php?title=plik:hela_cells_stained_with_hoechst_33258.jpg cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii,
Rozdział 1 Komórki wprowadzenie Komórki pod mikroskopem Wynalezienie mikroskopu świetlnego doprowadziło do odkrycia komórek Pod mikroskopem można
 Rozdział 1 Komórki wprowadzenie Komórki pod mikroskopem Wynalezienie mikroskopu świetlnego doprowadziło do odkrycia komórek Pod mikroskopem można oglądać komórki, organelle, a nawet cząsteczki Komórka
Rozdział 1 Komórki wprowadzenie Komórki pod mikroskopem Wynalezienie mikroskopu świetlnego doprowadziło do odkrycia komórek Pod mikroskopem można oglądać komórki, organelle, a nawet cząsteczki Komórka
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 5 Droga od genu do
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 5 Droga od genu do
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Transkrypcja RNA
 SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Transkrypcja RNA SPIS TREŚCI: I. Wprowadzenie. II. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. III. Karty pracy. 1. Karta
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Transkrypcja RNA SPIS TREŚCI: I. Wprowadzenie. II. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. III. Karty pracy. 1. Karta
Nowoczesne systemy ekspresji genów
 Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Tkanka nerwowa. neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające)
 Tkanka nerwowa neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające) Sygnalizacja w komórkach nerwowych 100 tys. wejść informacyjnych przyjmowanie sygnału przewodzenie
Tkanka nerwowa neurony (pobudliwe) odbieranie i przekazywanie sygnałów komórki glejowe (wspomagające) Sygnalizacja w komórkach nerwowych 100 tys. wejść informacyjnych przyjmowanie sygnału przewodzenie
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI. Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
Badanie oddziaływania polihistydynowych cyklopeptydów z jonami Cu 2+ i Zn 2+ w aspekcie projektowania mimetyków SOD
 Wydział Farmaceutyczny z Oddziałem Analityki Medycznej Badanie oddziaływania polihistydynowych cyklopeptydów z jonami Cu 2+ i Zn 2+ w aspekcie projektowania mimetyków SOD Aleksandra Kotynia PRACA DOKTORSKA
Wydział Farmaceutyczny z Oddziałem Analityki Medycznej Badanie oddziaływania polihistydynowych cyklopeptydów z jonami Cu 2+ i Zn 2+ w aspekcie projektowania mimetyków SOD Aleksandra Kotynia PRACA DOKTORSKA
Cytoplazma. Cytoplazma. cytoplazma + jądro komórkowe = protoplazma. cytoplazma organelle podstawowa (cytozol) Kompleksy białkowe (+RNA)
 Cytoplazma cytoplazma + jądro komórkowe = protoplazma Cytoplazma cytoplazma organelle podstawowa (cytozol) złoŝony koloid wodny cząsteczek i makrocząsteczek Kompleksy białkowe (+RNA) Cytoplazma podstawowa
Cytoplazma cytoplazma + jądro komórkowe = protoplazma Cytoplazma cytoplazma organelle podstawowa (cytozol) złoŝony koloid wodny cząsteczek i makrocząsteczek Kompleksy białkowe (+RNA) Cytoplazma podstawowa
Historia informacji genetycznej. Jak ewolucja tworzy nową informację (z ma ą dygresją).
 Historia informacji genetycznej. Jak ewolucja tworzy nową informację (z ma ą dygresją). Czym jest życie? metabolizm + informacja (replikacja) 2 Cząsteczki organiczne mog y powstać w atmosferze pierwotnej
Historia informacji genetycznej. Jak ewolucja tworzy nową informację (z ma ą dygresją). Czym jest życie? metabolizm + informacja (replikacja) 2 Cząsteczki organiczne mog y powstać w atmosferze pierwotnej
Potencjał spoczynkowy i czynnościowy
 Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Tkanka nerwowa. Komórki: komórki nerwowe (neurony) sygnalizacja komórki neurogleju (glejowe) ochrona, wspomaganie
 Komórki: komórki nerwowe (neurony) sygnalizacja komórki neurogleju (glejowe) ochrona, wspomaganie Tkanka nerwowa Substancja międzykomórkowa: prawie nieobecna (blaszki podstawne) pobudliwość przewodnictwo
Komórki: komórki nerwowe (neurony) sygnalizacja komórki neurogleju (glejowe) ochrona, wspomaganie Tkanka nerwowa Substancja międzykomórkowa: prawie nieobecna (blaszki podstawne) pobudliwość przewodnictwo
Wybrane zagadnienia biofizyki. Maszyny molekularne Mechanika wybranych biomolekuł
 Wybrane zagadnienia biofizyki Maszyny molekularne Mechanika wybranych biomolekuł Maszyny molekularne Jakie są możliwości budowania mechanicznych maszyn w skali molekularnej?... Silnik spalinowy o wielkości
Wybrane zagadnienia biofizyki Maszyny molekularne Mechanika wybranych biomolekuł Maszyny molekularne Jakie są możliwości budowania mechanicznych maszyn w skali molekularnej?... Silnik spalinowy o wielkości
6.1. MI ånie POPRZECZNIE PR ØKOWANE SZKIELETOWE
 TKANKA MI åniowa 6 Wywodzi się z mezodermy zorganizowanej w miotomy. Proces różnicowania polega przede wszystkim na tworzeniu wydłużonych komórek zdolnych do wytwarzania białek kurczliwych. Na podstawie
TKANKA MI åniowa 6 Wywodzi się z mezodermy zorganizowanej w miotomy. Proces różnicowania polega przede wszystkim na tworzeniu wydłużonych komórek zdolnych do wytwarzania białek kurczliwych. Na podstawie
Błona komórkowa grubość od 50 do 100 A. Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne
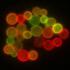 Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Podstawy biologii. Informacja, struktura i metabolizm.
 Podstawy biologii Informacja, struktura i metabolizm. Informacje Kontakt: Paweł Golik Instytut Genetyki i Biotechnologii, Pawińskiego 5A pgolik@igib.uw.edu.pl Informacje, materiały: http://www.igib.uw.edu.pl/
Podstawy biologii Informacja, struktura i metabolizm. Informacje Kontakt: Paweł Golik Instytut Genetyki i Biotechnologii, Pawińskiego 5A pgolik@igib.uw.edu.pl Informacje, materiały: http://www.igib.uw.edu.pl/
Scenariusz lekcji przyrody/biologii (2 jednostki lekcyjne)
 Joanna Wieczorek Scenariusz lekcji przyrody/biologii (2 jednostki lekcyjne) Strona 1 Temat: Budowa i funkcje kwasów nukleinowych Cel ogólny lekcji: Poznanie budowy i funkcji: DNA i RNA Cele szczegółowe:
Joanna Wieczorek Scenariusz lekcji przyrody/biologii (2 jednostki lekcyjne) Strona 1 Temat: Budowa i funkcje kwasów nukleinowych Cel ogólny lekcji: Poznanie budowy i funkcji: DNA i RNA Cele szczegółowe:
UKŁAD DOKREWNY cz. 2. Wysepki trzustkowe (Langerhansa): grupy komórek dokrewnych produkujących hormony białkowe
 Wysepki trzustkowe (Langerhansa): grupy komórek dokrewnych produkujących hormony białkowe UKŁAD DOKREWNY cz. 2 Elementy składowe: komórki dokrewne kapilary okienkowe włókna nerwowe Typy komórek dokrewnych
Wysepki trzustkowe (Langerhansa): grupy komórek dokrewnych produkujących hormony białkowe UKŁAD DOKREWNY cz. 2 Elementy składowe: komórki dokrewne kapilary okienkowe włókna nerwowe Typy komórek dokrewnych
Błona komórkowa grubość od 50 do 100 A. Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne
 Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Dominika Stelmach Gr. 10B2
 Dominika Stelmach Gr. 10B2 Czym jest DNA? Wielkocząsteczkowy organiczny związek chemiczny z grupy kwasów nukleinowych Zawiera kwas deoksyrybonukleoinowy U organizmów eukariotycznych zlokalizowany w jądrze
Dominika Stelmach Gr. 10B2 Czym jest DNA? Wielkocząsteczkowy organiczny związek chemiczny z grupy kwasów nukleinowych Zawiera kwas deoksyrybonukleoinowy U organizmów eukariotycznych zlokalizowany w jądrze
Komórka - budowa i funkcje
 Komórka - budowa i funkcje Komórka - definicja Komórka to najmniejsza strukturalna i funkcjonalna jednostka organizmów żywych zdolna do przeprowadzania wszystkich podstawowych procesów życiowych (takich
Komórka - budowa i funkcje Komórka - definicja Komórka to najmniejsza strukturalna i funkcjonalna jednostka organizmów żywych zdolna do przeprowadzania wszystkich podstawowych procesów życiowych (takich
Kamila Muraszkowska Znaczenie wąskich gardeł w sieciach białkowych. źródło: (3)
 Kamila Muraszkowska Znaczenie wąskich gardeł w sieciach białkowych źródło: (3) Interakcje białko-białko Ze względu na zadanie: strukturalne lub funkcjonalne. Ze względu na właściwości fizyczne: stałe lub
Kamila Muraszkowska Znaczenie wąskich gardeł w sieciach białkowych źródło: (3) Interakcje białko-białko Ze względu na zadanie: strukturalne lub funkcjonalne. Ze względu na właściwości fizyczne: stałe lub
(MIKROSKOP ELEKTRONOWY, ORGANELLE KOMÓRKOWE).
 ĆWICZENIE 2. Temat: ULTRASTRUKTURA KOMÓRKI (1). (MIKROSKOP ELEKTRONOWY, ORGANELLE KOMÓRKOWE). 1. Podstawy technik mikroskopowo-elektronowych (Schemat N/2/1) 2. Budowa i działanie mikroskopu elektronowego
ĆWICZENIE 2. Temat: ULTRASTRUKTURA KOMÓRKI (1). (MIKROSKOP ELEKTRONOWY, ORGANELLE KOMÓRKOWE). 1. Podstawy technik mikroskopowo-elektronowych (Schemat N/2/1) 2. Budowa i działanie mikroskopu elektronowego
WYKŁAD: Klasyczny przepływ informacji ( Dogmat) Klasyczny przepływ informacji. Ekspresja genów realizacja informacji zawartej w genach
 WYKŁAD: Ekspresja genów realizacja informacji zawartej w genach Prof. hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Klasyczny przepływ informacji ( Dogmat) Białka Retrowirusy Białka Klasyczny
WYKŁAD: Ekspresja genów realizacja informacji zawartej w genach Prof. hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Klasyczny przepływ informacji ( Dogmat) Białka Retrowirusy Białka Klasyczny
dr hab. Mikołaj Olejniczak, prof. UAM Zakład Biochemii 16 grudnia 2018, Poznań
 dr hab. Mikołaj Olejniczak, prof. UAM Zakład Biochemii 16 grudnia 2018, Poznań Recenzja rozprawy doktorskiej mgr Michała Rażewa zatytułowanej Badania strukturalne drożdżowego degradosomu mitochondrialnego
dr hab. Mikołaj Olejniczak, prof. UAM Zakład Biochemii 16 grudnia 2018, Poznań Recenzja rozprawy doktorskiej mgr Michała Rażewa zatytułowanej Badania strukturalne drożdżowego degradosomu mitochondrialnego
Tkanka mięśniowa. pobudliwość kurczliwość
 Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Aparat kurczliwy: miofilamenty cienkie ( i białka pomocnicze) miofilamenty grube (miozyna 2) Tkanka mięśniowa troponina tropomiozyna troponina lub kaldesmon i kalponina łańcuchy lekkie miozyna 2 pobudliwość
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Współczynnik przepuszczalności [cm/s] RóŜnice składu jonowego między wnętrzem komórki ssaka a otoczeniem
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Współczynnik przepuszczalności [cm/s] RóŜnice składu jonowego między wnętrzem komórki ssaka a otoczeniem
Cytoplazma. podstawowa (cytozol) Cytoplazma podstawowa (macierz cytoplazmatyczna)
 Cytoplazma złoŝony koloid wodny cząsteczek i makrocząsteczek Cytoplazma cytoplazma podstawowa (cytozol) organelle Cytoplazma podstawowa (macierz cytoplazmatyczna) ok. 55% objętości komórki złoŝony koloid
Cytoplazma złoŝony koloid wodny cząsteczek i makrocząsteczek Cytoplazma cytoplazma podstawowa (cytozol) organelle Cytoplazma podstawowa (macierz cytoplazmatyczna) ok. 55% objętości komórki złoŝony koloid
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej)
 PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej) Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt do wykładu
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej) Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt do wykładu
Zawartość. Wstęp 1. Historia wirusologii. 2. Klasyfikacja wirusów
 Zawartość 139585 Wstęp 1. Historia wirusologii 2. Klasyfikacja wirusów 3. Struktura cząstek wirusowych 3.1. Metody określania struktury cząstek wirusowych 3.2. Budowa cząstek wirusowych o strukturze helikalnej
Zawartość 139585 Wstęp 1. Historia wirusologii 2. Klasyfikacja wirusów 3. Struktura cząstek wirusowych 3.1. Metody określania struktury cząstek wirusowych 3.2. Budowa cząstek wirusowych o strukturze helikalnej
Badanie oddziaływań związków biologicznie aktywnych z modelowymi membranami lipidowymi
 UNIWERSYTET JAGIELLOŃSKI W KRAKOWIE WYDZIAŁ CHEMII STRESZCZENIE ROZPRAWY DOKTORSKIEJ Badanie oddziaływań związków biologicznie aktywnych z modelowymi membranami lipidowymi Marcelina Gorczyca Promotorzy:
UNIWERSYTET JAGIELLOŃSKI W KRAKOWIE WYDZIAŁ CHEMII STRESZCZENIE ROZPRAWY DOKTORSKIEJ Badanie oddziaływań związków biologicznie aktywnych z modelowymi membranami lipidowymi Marcelina Gorczyca Promotorzy:
Informacje dotyczące pracy kontrolnej
 Informacje dotyczące pracy kontrolnej Słuchacze, którzy z przyczyn usprawiedliwionych nie przystąpili do pracy kontrolnej lub otrzymali z niej ocenę negatywną zobowiązani są do dnia 06 grudnia 2015 r.
Informacje dotyczące pracy kontrolnej Słuchacze, którzy z przyczyn usprawiedliwionych nie przystąpili do pracy kontrolnej lub otrzymali z niej ocenę negatywną zobowiązani są do dnia 06 grudnia 2015 r.
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 4 Jak działają geny?
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 4 Jak działają geny?
