Po rozpuszczeniu w 10 ml wody do wstrzykiwań w zależności od wielkości opakowania produkt zawiera około:
|
|
|
- Renata Wolska
- 8 lat temu
- Przeglądów:
Transkrypt
1 1. NAZWA PRODUKTU LECZNICZEGO FANHDI 25 j.m./ml; Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. FANHDI 50 j.m./ml; Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. FANHDI 100 j.m./ml; Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY FANHDI, występuje w postaci proszku do wstrzykiwań i infuzji w fiolkach zawierających nominalnie 250 j.m., 500 j.m. lub 1000 j.m. ludzkiego VIII czynnika krzepnięcia krwi (FVIII) i odpowiednio 300, 600 lub 1200 j.m. ludzkiego czynnika von Willebranda (VWF). Po rozpuszczeniu w 10 ml wody do wstrzykiwań w zależności od wielkości opakowania produkt zawiera około: FANHDI 25 j.m./ml; 250 j.m.: 25 j.m.ludzkiego FVIII i 30 j.m. VWF w jednym ml FANHDI 50 j.m./ml; 500 j.m.: 50 j.m.ludzkiego FVIII i 60 j.m. VWF w jednym ml FANHDI 100 j.m./ml; 1000 j.m.: 100 j.m.ludzkiego FVIII i 120 j.m.vwf w jednym ml Aktywność czynnika FVIII (FVIII:C) (w j.m.) jest oznaczana metodą chromogenną, zgodną z Farmakopeą Europejską. Aktywność specyficzna Fanhdi wynosi co najmniej 2,5 do 10 j.m. FVIII:C/mg białka w zależności od wielkości opakowania (250, 500 i 1000 j.m.) Aktywność czynnika von Willebranda (w j.m.) jest oznaczana na podstawie aktywności kofaktora rystocetyny (VWF:RCo) według Międzynarodowego Standardu dla koncentratów czynnika von Willebranda (WHO). Substancje pomocnicze, patrz punkt POSTAĆ FARMACEUTYCZNA Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. Fiolka z białym lub jasno-żółtym proszkiem oraz ampułko-strzykawka z wodą do wstrzykiwań (rozpuszczalnik). 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania FANHDI stosuje się w zapobieganiu i opanowywaniu krwawień u chorych na hemofilię A (wrodzony niedobór ludzkiegoviii czynnika krzepnięcia). Stosowanie FANHDI jest również wskazane w zapobieganiu i opanowywaniu krwawień (w tym krwawień podczas zabiegów chirurgicznych) u chorych z chorobą von Willebranda (VWD), gdy leczenie desmopresyną (DDAVP) jest nieskuteczne lub przeciwwskazane.
2 Produkt może być stosowany w leczeniu nabytego niedoboru ludzkiego VIII czynnika krzepnięcia. 4.2 Dawkowanie i sposób podawania Rozpoczęcie leczenia powinno odbywać się pod nadzorem lekarza mającego doświadczenie w leczeniu zaburzeń hemostazy. Dawkowanie Niedobór VIII czynnika krzepnięcia Dawkowanie oraz czas leczenia substytucyjnego zależą od stopnia niedoboru czynnika VIII, umiejscowienia i rozległości krwawienia oraz stanu klinicznego pacjenta. Podawaną dawkę VIII czynnika krzepnięcia wyraża się w jednostkach międzynarodowych (j.m.) zgodnie z aktualnymi normami WHO obowiązującymi dla produktów zawierających ludzki VIII czynnik krzepnięcia. Aktywność VIII czynnika krzepnięcia w osoczu może być podana w procentach (w stosunku do aktywności w normalnym osoczu) lub w jednostkach międzynarodowych (zgodnie z międzynarodowym standardem dla VIII czynnika krzepnięcia w osoczu). Jedna jednostka międzynarodowa (j.m.) aktywności VIII czynnika krzepnięcia odpowiada ilości VIII czynnika krzepnięcia w jednym ml normalnego osocza ludzkiego. Obliczanie potrzebnej dawki, opiera się na obserwacji empirycznej, że podanie 1 j.m. na kg masy ciała powoduje wzrost aktywności VIII czynnika krzepnięcia w osoczu o około 2,1% ± 0,4%. Dawkę oblicza się na podstawie następującego wzoru: Wymagana liczba jednostek = masa ciała (kg) x pożądany wzrost aktywności VIII czynnika krzepnięcia (%) (j.m./dl) x 0,5 Wielkość dawek i częstotliwość ich podawania należy zawsze dostosować indywidualnie dla każdego przypadku w zależności od efektów klinicznych. W leczeniu krwawień, w zależności od ich przyczyny i umiejscowienia, należy utrzymywać przez zalecany okres leczenia odpowiedni poziom aktywności VIII czynnika krzepnięcia (w % normy lub j.m./dl). Przy ustalaniu dawki w zależności od rodzaju krwawienia i zabiegu chirurgicznego można posłużyć się następującą tabelą: Nasilenie krwawienia/rodzaj zabiegu chirurgicznego Krwawienie Wymagany poziom czynnika VIII (%) (j.m./dl) Częstotliwość dawkowania (godziny)/okres leczenia Świeże krwawienie do stawów, mięśni lub krwawienie z jamy ustnej Powtarzać co godz. Co najmniej przez 1 dzień, aż do ustąpienia krwawienia, ustapienia bólu lub zagojenia się rany.
3 Bardziej nasilone krwawienie do stawów, mięśni lub krwiak. Krwawienia zagrażające życiu. Zabiegi chirurgiczne Drobne Łącznie z ekstrakcją zęba Duże (w okresie przed i pooperacyjnym) Powtarzać infuzje co godz. przez 3-4 dni lub dłużej, aż do ustąpienia bólu lub upośledzenia funcji. Powtarzać infuzje co 8-24 godz. aż do ustąpienia zagrożenia Co 24 godz., co najmniej przez 1 dzień, aż do wygojenia rany. Powtarzać infuzje co 8-24 godz. aż do uzyskania odpowiedniego zagojenia rany, następnie kontynuować leczenie przez kolejne 7 dni, utrzymując aktywność czynnika VIII na poziomie od 30% do 60% (j.m./dl) Podczas leczenia, w celu ustalenia dawki i częstotliwości podawania infuzji, zaleca się odpowiednie oznaczanie poziomów czynnika VIII w osoczu. Szczególnie w przypadkach dużych zabiegów chirurgicznych niezbędne jest dokładne monitorowanie leczenia substytucyjnego za pomocą badań układu krzepnięcia (aktywność czynnika VIII w osoczu). Pacjenci mogą indywidualnie reagować na leczenie czynnikiem VIII co znajduje odzwierciedlenie w różnych poziomach odzysku in vivo i w różnych okresach półtrwania u poszczególnych pacjentów. W długoterminowej profilaktyce krwawień u chorych na ciężką postać hemofilii A preparat FANHDI powinien być wstrzykiwany co 2 3 dni, w dawce od 20 do 40 j.m./kg m.c. W niektórych przypadkach, szczególnie u młodszych chorych, może być wskazane skrócenie odstępów czasowych między wstrzyknięciami, bądź zwiększenie dawki. Pacjentów należy monitorować pod kątem wytwarzania inhibitorów czynnika VIII. Jeżeli nie udaje się osiągnąć spodziewanych poziomów aktywności czynnika VIII w osoczu lub w sytuacji, gdy przy właściwie dobranej dawce nie udaje się opanować krwawienia, należy wykonać badanie w celu sprawdzenia obecności inhibitora czynnika VIII. U pacjentów z wysokim mianem inhibitora leczenie z użyciem czynnika VIII może być nieskuteczne i należy rozważyć inne możliwości terapii. Leczenie takich pacjentów winno być prowadzone przez lekarzy doświadczonych w opiece nad pacjentami z hemofilią A, patrz punkt 4.4. Choroba von Willebranda Ogólnie przyjmuje się, że podanie 1 j.m.vwf:rco/kg masy ciała powoduje wzrost poziomu VWF:RCo o 2% w krążeniu. Celem leczenia jest uzyskanie poziomu VWF:RCo >0,6 j.m./ml (60%) oraz FVIII:C >0,4 j.m./ml (40%) w osoczu. W większości przypadków, w celu uzyskania hemostazy, zaleca się dawkę j.m./kg czynnika von Willebranda oraz j.m./kg czynnika FVIII:C.
4 Pacjenci z chorobą von Willebranda typu 3, u których w celu utrzymanie odpowiednich poziomów czynnika może być konieczne podawanie wyższych dawek, mogą wymagać podania początkowej dawki czynnika von Willebranda 80 j.m./kg Dobraną dawkę należy podawać co godziny. Dawkowanie oraz czas leczenia zależą od stanu klinicznego pacjenta, umiejscowienia i rozległości krwawienia oraz poziomu zarówno VWF:RCo jak i FVIII:C. W okresie stosowania czynnika VIII zawierającego czynnik von Willebranda, lekarz leczący pacjenta powinien brać pod uwagę możliwość nadmiernego wzrostu poziomu FVIII:C. Po godzinach leczenia należy rozważyć obniżenie dawki lub wydłużenie okresu pomiędzy kolejnymi dawkami produktów zwierających VWF i czynnik VIII. W powyższym wskazaniu dostępne są tylko ograniczone dane z badań klinicznych u dzieci poniżej 6 roku życia i z tego powodu nie ma zaleceń do stosowania produktu w tej grupie wiekowej. Sposób podawania Rozpuścić preparat zgodnie z zaleceniami zamieszczonymi w punkcie 6.6. Produkt podawać powoli dożylnie. Szybkość podawania nie powinna przekraczać 10 ml/min. 4.3 Przeciwwskazania Znana nadwrażliwość na substancję aktywną lub substancje pomocnicze. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Tak jak w przypadku innych produktów podawanych dożylnie, możliwe jest wystąpienie reakcji nadwrażliwości typu alergicznego. Produkt zawiera również śladowe ilości ludzkich białek innych niż czynnik krzepnięcia VIII. Pacjent powinien być poinformowany o wczesnych objawach reakcji nadwrażliwości, włączając w to wysypkę, uogólnioną pokrzywkę, uczucie ucisku w klatce piersiowej, świstów, podciśnienia i objawów anafilaksji. W przypadku wystąpienia tych objawów, należy powiadomić o tym lekarza. W przypadku wystąpienia wstrząsu należy zastosować aktualnie zalecane leczenie przeciwwstrząsowe. W przypadku podawania produktów pochodzących z ludzkiej krwi lub osocza, nie można całkowicie wykluczyć możliwości chorób wywołanych przeniesieniem czynników zakaźnych, w tym również o nieznanej dotychczas etiologii. Ryzyko przeniesienia czynników zakaźnych jest zmniejszane przez: - selekcję dawców poprzez wywiad medyczny oraz badanie przesiewowe poszczególnych donacji krwi i pul osocza w kierunku HBsAg oraz przeciwciał anty-hiv i anty-hcv, - badanie puli osocza w kierunku obecności genomu HCV, - stosowanie procedur inaktywacji/usuwania wirusów w procesie wytwarzania, które zostały zwalidowane z zastosowaniem wirusów modelowych. Procedury te uważane są za skuteczne wobec wirusów HIV, HCV, HAV oraz HBV.
5 Proces usuwania/inaktywacji wirusów może mieć ograniczoną wartość wobec wirusów bezotoczkowych takich jak parvowirus B19. Zakażenie parwowirusem B19 może być szczególnie groźne u kobiet w ciąży (zakażenie płodu) oraz u osób z obniżoną odpornością lub zwiększoną erytropoezą (np. w anemii hemolitycznej). Wytwarzanie neutralizujących przeciwciał (inhibitorów) przeciw czynnikowi VIII jest znanym powikłaniem w leczeniu pacjentów z hemofilią typu A. Inhibitory te są zazwyczaj immunoglobulinami G skierowanymi przeciwko aktywności prokoagulacyjnej czynnika VIII, którą oznacza się w jednostkach Bethesda (Bethesda Units (BU)) na mililitr osocza z użyciem zmodyfikowanego oznaczenia Nijmegen s. Ryzyko wytworzenia inhibitorów jest zależne od okresu ekspozycji na czynnik VIII, przy czym ryzyko jest najwyższe podczas pierwszych 20 dni ekspozycji. W rzadkich przypadkach inhibitory mogą wytworzyć się także po pierwszych 100 dniach ekspozycji. Pacjenci leczeni ludzkim czynnikiem krzepnięcia VIII muszą być dokładnie monitorowani pod kątem wytwarzania inhibitorów - poprzez obserwacje stanu klinicznego i ocenę badań laboratoryjnych. Patrz również punkt 4.8. Działania niepożądane. Podczas leczenia pacjentów z chorobą von Willebranda ze znanymi klinicznymi lub laboratoryjnymi czynnikami ryzyka występuje zagrożenie powstania zakrzepów. Z tego powodu, konieczna jest obserwacja chorych w celu wczesnego wykrycia objawów nimi spowodowanych. Ponadto, należy zastosować aktualnie zalecane postępowanie zapobiegające wystąpieniu powikłań zakrzepowozatorowych. W okresie stosowania czynnika VIII zawierającego czynnik von Willebranda, lekarz powinien brać pod uwagę możliwość nadmiernego wzrostu poziomu FVIII:C. W celu zmniejszenia ryzyka wystąpienia powikłań zakrzepowych wskutek utrzymywania się nadmiernie wysokiego poziomu F VIII:C, u pacjentów leczonych produktami czynnika VIII zwierającymi VWF, należy monitorować jego poziom. W chorobie von Willebranda, w szczególności typu 3-go, mogą wytworzyć się przeciwciała neutralizujące (inhibitory) czynnik von Willebranda. W tych przypadkach, w których w leczeniu nie osiąga się spodziewanych poziomów VWF:RCo lub nie udaje się opanować krwawień pomimo stosowania odpowiednich dawek, należy wykonać badania mające na celu wykrycie obecności inhibitora. U pacjentów z wysokim poziomem inhibitora leczenie czynnikiem von Willbranda może nie być skuteczne. Należy wtedy rozważyć wprowadzenie innego sposobu leczenia. U pacjentów otrzymujących regularnie osoczopochodny VIII czynnik krzepnięcia, należy rozważyć zastosowanie odpowiednich szczepień (przeciwko wirusowi zapalenia wątroby A i B). Dla dobra pacjentów, zdecydowanie zaleca się, aby po każdym podaniu pacjentowi leku FANHDI odnotować nazwisko pacjenta i numer serii produktu, aby móc powiązać pacjenta z serią leku. 4.5 Interakcje z innymi lekami i inne rodzaje interakcji Nie są znane reakcje zespołu FVIII/VWF z innymi produktami leczniczymi.
6 4.6 Ciąża i laktacja Nie przeprowadzano badań wpływu zespołu FVIII/VWF na reprodukcję zwierząt. Ze względu na rzadkie występowanie hemofilii A u kobiet, brak jest doświadczeń dotyczących stosowania zespołu FVIII/VWF w okresie ciąży i karmienia piersią. Z tego powodu zespół FVIII/VWF powinien być stosowany podczas ciąży i w okresie laktacji tylko wtedy, gdy jest to jednoznacznie wskazane. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie obserwowano wpływu na zdolność do prowadzenia pojazdów i obsługiwania urządzeń mechanicznych w ruchu. 4.8 Działania niepożądane Nadwrażliwość lub reakcje alergiczne (obrzęk naczynioruchowy, pieczenie lub uczucie kłucia w miejscu wstrzyknięcia, dreszcze, zaczerwienienie twarzy, uogólniona pokrzywka, ból głowy, wysypka, spadek ciśnienia krwi, letarg, nudności, niepokój, tachykardia, uczucie ucisku w klatce piersiowej, świąd, wymioty, świsty) były obserwowane rzadko i tylko w niektórych przypadkach prowadziły do rozwoju ciężkiej reakcji anafilaksji (włączając w to wstrząs). W rzadkich przypadkach obserwowano wzrost temperatury ciała. Chorzy na hemofilię A mogą wytworzyć przeciwciała neutralizujące (inhibitory) przeciw czynnikowi VIII. Jeżeli pojawią się tego typu inhibitory, leczenie stanie się klinicznie mało skuteczne. W chorobie von Willebranda, w szczególności typu 3-go, mogą wytworzyć się przeciwciała neutralizujące (inhibitory) czynnik von Willebranda. Objawia się to, niedostateczną skutecznością kliniczną. Obecność przeciwciał kojarzy się często z występowaniem reakcji anafilaktycznych. Z tego powodu pacjenci, u których wystąpiły reakcje anafilaktyczne powinni być przebadani w kierunku występowania inhibitorów. W takich przypadkach zaleca się kontakt z wyspecjalizowanym ośrodkiem leczenia zaburzeń hemostazy. Podczas leczenia produktem pacjentów z chorobą von Willebranda ze znanymi klinicznymi lub laboratoryjnymi czynnikami ryzyka występuje zagrożenie powstania zakrzepów. Utrzymywanie się nadmiernie wysokiego poziomu F:VIII podczas leczenia czynnikiem VIII zawierającym czynnik von Willebranda zwiększa ryzyko wystąpienia powikłań zakrzepowych. Podczas kilku badań klinicznych przeprowadzonych z udziałem 164 chorych podano ogółem 7000 infuzji Fanhdi. Uzyskane wyniki z obu badań wskazują na dobrą tolerancje preparatu i małą częstość występowania działań niepożądanych. Obserwowane jedynie 2 przypadki, w
7 których wystąpiły działania niepożądane związane z podawanym produktem leczniczym. W obydwu przypadkach odnotowano wystąpienie podwyższonej temperatury ciała. Działania niepożądane zostały ocenione i podzielone na kategorie zgodnie z klasyfikacją układów narządowych MedDRA poczynając od objawów najcięższych do najlżejszych. Częstość występowania oceniano stosując następujące kryteria: - bardzo często (> 1/10), - często (> 1/100, < 1/10), - niezbyt często (> 1/1000, < 1/100), - rzadko (> 1/10 000, < 1/1000) - bardzo rzadko (< 1/10 000) i nie znanej częstości występowania. Układ narządowy Preferowana nazwa objawu Częstość występowania działań niepożądanych Objawy ogólne i występujące w miejscu po wstrzyknięciu Podwyższone temperatura ciała. Rzadko Informacje dotyczące zabezpieczeń przed przeniesieniem czynników zakaźnych, patrz punkt Przedawkowanie Nie obserwowano objawów przedawkowania ludzkiego zespołu FVIII/VWF. Po znacznym przedawkowaniu mogą wystapić powikłania zakrzepowozatorowe. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwkrwotoczne, połączenie czynnika krzepnięcia krwi VIII i czynnika von Willebranda, kod ATC - B02BD06 W FANHDI, czynnik VIII:C występuje w zespole z czynnikiem von Willebranda. Kompleks czynnik VIII/czynnik von Willebranda składa się z dwóch cząsteczek (czynnika VIII i czynnika von Willebranda) o różnych funkcjach fizjologicznych. Niedobór czynnika VIII Po podaniu, w krążeniu chorego na hemofilię, czynnik VIII wiąże czynnik von Willebranda Aktywowany czynnik VIII działa jako kofaktor wobec aktywowanego czynnika IX, przyśpieszając przemianę czynnika X w aktywowany czynnik X. Aktywowany czynnik X przekształca protrombinę w trombinę. Następnie trombina przekształca fibrynogen w fibrynę i umożliwia utworzenie się skrzepu.
8 Hemofilia A jest związanym z płcią, dziedzicznym zaburzeniem krzepnięcia krwi, które jest spowodowane obniżeniem aktywności czynnika VIII:C i objawia się obfitym krwawieniem do stawów, mięśni i organów wewnętrznych, występującym samoistnie lub w następstwie urazów powypadkowych lub po zabiegach chirurgicznych. Poziom FVIII w osoczu podwyższa się przez zastosowanie leczenia zastępczego. W ten sposób umożliwia się tymczasową korektę niedoboru czynnika oraz zmniejsza się skłonność do występowania krwawień. Choroba von Willebranda Wchodzący w skład FANHDI czynnik von Willebranda działa w ten sam sposób jak endogenny czynnik von Willebranda Podanie czynnika von Willebranda zgodnie z jego funkcjami fizjologicznymi koryguje zaburzenia hemostazy występujące u chorych z niedoborem czynnika von Willebranda (choroba von Willebranda ) w dwóch etapach: Czynnik von Willebranda przywraca adhezję płytek krwi do podśródbłonkowej tkanki łącznej w uszkodzonych naczyniach krwionośnych (wskutek jednoczesnego łączenia się z podśródbłonkową tkanką łączną i płytkami krwi), zapewniając wstępny etap hemostazy, co objawia się skróceniem czasu krwawienia. Jest to efekt natychmiastowy powstający w wyniku polimeryzacji białek. Z pewnym opóźnieniem koryguje również współistniejący niedobór czynnika VIII. Po podaniu dożylnym czynnik von Willebranda tworzy w krwiobiegu kompleks z endogennym czynnikiem VIII, stabilizuje go i ochrania przed szybką degradacją. Poziom FVIII:C powraca do normy natychmiast po podaniu zespołu FVIII /VWF. Dostępne są tylko ograniczone dane z badań klinicznych u dzieci poniżej 6 roku życia i z tego powodu nie ma zaleceń do stosowania produktu w zarejestrowanych wskazaniach w tej grupie wiekowej. 5.2 Właściwości farmakokinetyczne Po podaniu aktywność czynnika VIII w osoczu maleje się zgodnie z krzywą dwuwykładniczą. Badania kliniczne z zastosowaniem FANHDI wykazały, że okres półtrwania wynosi 14,18 ± 2,55 godzin, a odzysk in vivo 105,5 ± 18,5% co odpowiada podanej dawce w wysokości około 2,1 ± 0,4 j.m./dl na 1 j.m./kg masy ciała (badania wykonano metodą chromogenną). Inne otrzymane dane to MRT 20,6 ± 4,8 h, AUC 19,3 ± 3,7 j.m.h/dl oraz klirens 2,6 ± 0,5 ml/h/kg. Badania kliniczne w chorobie von Willebranda z zastosowaniem FANHDI wykazały, że okres półtrwania ludzkiego czynnika von Willebranda wynosi 14,4 ± 10,5 godz. a VIII czynnika krzepnięcia wynosi 33,4 ± 16,4 godzin, odzysk in vivo 1,9 ± 0,6 j.m./dl na każdą podaną 1 j.m./kg masy ciała czynnika von Willebranda i 2,6 ± 0,6 j.m. na każdą 1 j.m./kg czynnika VIII. Aktywność czynnika von Willebranda (j.m.) oznaczono na podstawie aktywności kofaktora rystocetyny (VWF:RCo) a aktywność czynika VIII (FVIII:C) metodą chromogenną). Inne otrzymane dane to: AUC dla VWF:RCo 15,29 ± 10,03 i dla FVIII:C 49,41 ± 37,74 j.m. h/ml oraz klirens dla VWF:RCo 5,6 ± 3,3 i dla FVIII:C 1,4 ± 1,1 ml/h/kg.
9 Poziom szczytowy czynnika von Willebranda w osoczu pojawia się po 30 min od podania. 5.3 Przedkliniczne dane o bezpieczeństwie Ludzki VIII czynnik krzepnięcia i czynnik von Willebranda (które zawiera FANHDI) są normalnymi składnikami ludzkiego osocza i spełniają taką samą funkcję jak czynniki endogenne. Badanie toksyczności po jednorazowej dawce nie ma znaczenia, gdyż podanie wyższych dawek powoduje przeciążenie łożyska naczyniowego. Badanie toksyczności przewlekłej u zwierząt nie jest możliwe ze względu na tworzenie się przeciwciał przeciwko obcemu białku. Nawet kilkakrotnie większe od stosowanych u ludzi dawki nie wywierają działania toksycznego na zwierzęta laboratoryjne. Doświadczenie kliniczne w stosowaniu zespołu ludzkiego VIII czynnika krzepnięcia i czynnika von Willebranda nie wskazuje na jego działanie rakotwórcze lub mutagenne i dlatego badania, w szczególności na gatunkach heterologicznych, nie mają uzasadnienia. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Proszek: Histydyna Albumina ludzka Arginina Rozpuszczalnik Woda do wstrzykiwań (rozpuszczalnik) 6.2 Niezgodności farmaceutyczne Leku nie należy mieszać z innymi lekami. Aby uniknąć niepowodzeń w leczeniu z powodu adsorpcji zespołu FVIII/VWF do ścianek niektórych zestawów infuzyjnych, należy używać wyłącznie zestawów do infuzji załączonych do opakowania. 6.3 Okres trwałości 3 lata Po odtworzeniu, trwałość chemiczna i fizyczna produktu utrzymuje się do 12 godzin w temperaturze 25 C. Z mikrobiologicznego punktu widzenia, produkt powinien zostać zużyty natychmiast. Jeśli po odtworzeniu produkt nie został zużyty, może być przechowywany nie dłużej niż przez 24 godziny w temperaturze 2 o C - 8 o C, ale tylko wtedy, gdy
10 odpowiedzialność za to weźmie użytkownik a przygotowanie roztworu odbyło się zgodnie z zasadami jałowości. 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 30 o C. Nie zamrażać. 6.5 Rodzaj i zawartość opakowania FANHDI występuje w fiolkach ze szkła typu I/II z korkiem z gumy chlorobutylowej z proszkiem po 250, 500 i po 1000 j.m. ludzkiego VIII czynnika krzepnięcia wraz z ampułkostrzykawką ze szkła typu I z zatyczką tłoka z gumy bromobutylowej po 10 ml wody do wstrzykiwań (rozpuszczalnik) w tekturowym pudełku. Zestaw do sporządzania roztworu i podawania załączony do opakowania FANHDI: łącznik mocujący do fiolki, mikrofiltr i zestaw do infuzji. Nie wszystkie wielkości opakowania mogą znajdować się w obrocie. Opakowanie zawiera: 1 fiolka z proszkiem, 1 ampułko-strzykawka z rozpuszczalnikiem, zestaw do sporządzania roztworu i podania. 6.6 Instrukcja dotycząca produktu leczniczego do stosowania i usuwania jego pozostałości Nie należy stosować leku po upływie jego ważności podanym na opakowaniu. Nie pozostawiać nawet w lodówce niezużytego produktu do późniejszego użycia. Przygotowanie roztworu: 1. Ogrzać fiolki do temperatury nie wyższej niż 30 o C (rycina Nr 1). 2. Umocować tłok w ampułko-strzykawce z rozpuszczalnikiem (rycina Nr 2). 3. Wyjąć filtr z opakowania. Zdjąć plastikową osłonę z końca ampułko-strzykawki i umocować filtr (rycina Nr 3). 4. Wyjąć łącznik mocujący do fiolki i połączyć ampułko-strzykawkę z filtrem (rycina Nr 4). 5. Zdjąć plastikowy kapturek z fiolki i odsłonięty gumowy korek odkazić środkiem dezynfekującym (rycina Nr 5). 6. Przebić korek w fiolce igłą łącznika (rycina Nr 6). 7. Wstrzyknąć cały rozpuszczalnik do fiolki (rycina Nr 7).
11 8. Delikatnie wstrząsać fiolką aż do rozpuszczenia proszku (rycina Nr 8). Tak jak w przypadku innych produktów podawanych dożylnie nie stosować, gdy produkt jest nie rozpuszczony lub widoczne są cząsteczki. 9. Rozłączyć na chwilę ampułko-strzykawkę z filtrem od fiolki aby wpuścić powietrze. (rycina Nr 9). 10. Odwrócić do góry dnem fiolkę i aspirować roztwór do ampułko-strzykawki (rycina Nr 10). 11. Przygotować miejsce do iniekcji, odłączyć strzykawkę i wstrzyknąć produkt przez załączoną igłę motylkową lub inną sterylną igłę. Podawać dożylnie z szybkością 3 ml/min i nigdy nie przekraczać 10 ml/min aby uniknąć reakcji naczynioruchowych (rycina Nr 11). Nie używać ponownie zestawu do podawania. Wszelkie pozostałości niezużytego produktu i inne odpady należy usunąć zgodnie z lokalnymi przepisami. Roztwór powinien być przezroczysty i lekko opalizujący. Nie stosować roztworów, w których występują kłaczki lub osad. Przed podaniem sprawdzić wzrokowo, czy roztwór nie zawiera cząsteczek stałych i czy nie doszło do zmiany jego zabarwienia. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU INSTITUTO GRIFOLS, S.A. Poligono Levante, c/can Guasch, Parets del Vallés, Barcelona, Hiszpania. 8. NUMERY POZWOLENIA NA DOPUSZCZENIE DO OBROTU FANHDI 25 j.m./ml; 250 j.m FANHDI 50 j.m./ml; 500 j.m FANHDI 100 j.m./ml;1000 j.m DATA WYDANIA POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA JEGO PRZEDŁUŻENIA r. / r. 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
12
13 1. NAZWA PRODUKTU LECZNICZEGO FANHDI 25 j.m./ml; Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. FANHDI 50 j.m./ml; Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. FANHDI 100 j.m./ml; Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY FANHDI, występuje w postaci proszku do wstrzykiwań i infuzji w fiolkach zawierających nominalnie 250 j.m., 500 j.m. lub 1000 j.m. ludzkiego VIII czynnika krzepnięcia krwi (FVIII) i odpowiednio 300, 600 lub 1200 j.m. ludzkiego czynnika von Willebranda (VWF). Po rozpuszczeniu w 10 ml wody do wstrzykiwań w zależności od wielkości opakowania produkt zawiera około: FANHDI 25 j.m./ml; 250 j.m.: 25 j.m.ludzkiego FVIII i 30 j.m. VWF w jednym ml FANHDI 50 j.m./ml; 500 j.m.: 50 j.m.ludzkiego FVIII i 60 j.m. VWF w jednym ml FANHDI 100 j.m./ml; 1000 j.m.: 100 j.m.ludzkiego FVIII i 120 j.m.vwf w jednym ml Aktywność czynnika FVIII (FVIII:C) (w j.m.) jest oznaczana metodą chromogenną, zgodną z Farmakopeą Europejską. Aktywność specyficzna Fanhdi wynosi co najmniej 2,5 do 10 j.m. FVIII:C/mg białka w zależności od wielkości opakowania (250, 500 i 1000 j.m.) Aktywność czynnika von Willebranda (w j.m.) jest oznaczana na podstawie aktywności kofaktora rystocetyny (VWF:RCo) według Międzynarodowego Standardu dla koncentratów czynnika von Willebranda (WHO). Substancje pomocnicze, patrz punkt POSTAĆ FARMACEUTYCZNA Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. Fiolka z białym lub jasno-żółtym proszkiem oraz ampułko-strzykawka z wodą do wstrzykiwań (rozpuszczalnik). 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania FANHDI stosuje się w zapobieganiu i opanowywaniu krwawień u chorych na hemofilię A (wrodzony niedobór ludzkiegoviii czynnika krzepnięcia). Stosowanie FANHDI jest również wskazane w zapobieganiu i opanowywaniu krwawień (w tym krwawień podczas zabiegów chirurgicznych) u chorych z chorobą von Willebranda (VWD), gdy leczenie desmopresyną (DDAVP) jest nieskuteczne lub przeciwwskazane.
14 Produkt może być stosowany w leczeniu nabytego niedoboru ludzkiego VIII czynnika krzepnięcia. 4.2 Dawkowanie i sposób podawania Rozpoczęcie leczenia powinno odbywać się pod nadzorem lekarza mającego doświadczenie w leczeniu zaburzeń hemostazy. Dawkowanie Niedobór VIII czynnika krzepnięcia Dawkowanie oraz czas leczenia substytucyjnego zależą od stopnia niedoboru czynnika VIII, umiejscowienia i rozległości krwawienia oraz stanu klinicznego pacjenta. Podawaną dawkę VIII czynnika krzepnięcia wyraża się w jednostkach międzynarodowych (j.m.) zgodnie z aktualnymi normami WHO obowiązującymi dla produktów zawierających ludzki VIII czynnik krzepnięcia. Aktywność VIII czynnika krzepnięcia w osoczu może być podana w procentach (w stosunku do aktywności w normalnym osoczu) lub w jednostkach międzynarodowych (zgodnie z międzynarodowym standardem dla VIII czynnika krzepnięcia w osoczu). Jedna jednostka międzynarodowa (j.m.) aktywności VIII czynnika krzepnięcia odpowiada ilości VIII czynnika krzepnięcia w jednym ml normalnego osocza ludzkiego. Obliczanie potrzebnej dawki, opiera się na obserwacji empirycznej, że podanie 1 j.m. na kg masy ciała powoduje wzrost aktywności VIII czynnika krzepnięcia w osoczu o około 2,1% ± 0,4%. Dawkę oblicza się na podstawie następującego wzoru: Wymagana liczba jednostek = masa ciała (kg) x pożądany wzrost aktywności VIII czynnika krzepnięcia (%) (j.m./dl) x 0,5 Wielkość dawek i częstotliwość ich podawania należy zawsze dostosować indywidualnie dla każdego przypadku w zależności od efektów klinicznych. W leczeniu krwawień, w zależności od ich przyczyny i umiejscowienia, należy utrzymywać przez zalecany okres leczenia odpowiedni poziom aktywności VIII czynnika krzepnięcia (w % normy lub j.m./dl). Przy ustalaniu dawki w zależności od rodzaju krwawienia i zabiegu chirurgicznego można posłużyć się następującą tabelą: Nasilenie krwawienia/rodzaj zabiegu chirurgicznego Krwawienie Wymagany poziom czynnika VIII (%) (j.m./dl) Częstotliwość dawkowania (godziny)/okres leczenia Świeże krwawienie do stawów, mięśni lub krwawienie z jamy ustnej Powtarzać co godz. Co najmniej przez 1 dzień, aż do ustąpienia krwawienia, ustapienia bólu lub zagojenia się rany.
15 Bardziej nasilone krwawienie do stawów, mięśni lub krwiak. Krwawienia zagrażające życiu. Zabiegi chirurgiczne Drobne Łącznie z ekstrakcją zęba Duże (w okresie przed i pooperacyjnym) Powtarzać infuzje co godz. przez 3-4 dni lub dłużej, aż do ustąpienia bólu lub upośledzenia funcji. Powtarzać infuzje co 8-24 godz. aż do ustąpienia zagrożenia Co 24 godz., co najmniej przez 1 dzień, aż do wygojenia rany. Powtarzać infuzje co 8-24 godz. aż do uzyskania odpowiedniego zagojenia rany, następnie kontynuować leczenie przez kolejne 7 dni, utrzymując aktywność czynnika VIII na poziomie od 30% do 60% (j.m./dl) Podczas leczenia, w celu ustalenia dawki i częstotliwości podawania infuzji, zaleca się odpowiednie oznaczanie poziomów czynnika VIII w osoczu. Szczególnie w przypadkach dużych zabiegów chirurgicznych niezbędne jest dokładne monitorowanie leczenia substytucyjnego za pomocą badań układu krzepnięcia (aktywność czynnika VIII w osoczu). Pacjenci mogą indywidualnie reagować na leczenie czynnikiem VIII co znajduje odzwierciedlenie w różnych poziomach odzysku in vivo i w różnych okresach półtrwania u poszczególnych pacjentów. W długoterminowej profilaktyce krwawień u chorych na ciężką postać hemofilii A preparat FANHDI powinien być wstrzykiwany co 2 3 dni, w dawce od 20 do 40 j.m./kg m.c. W niektórych przypadkach, szczególnie u młodszych chorych, może być wskazane skrócenie odstępów czasowych między wstrzyknięciami, bądź zwiększenie dawki. Pacjentów należy monitorować pod kątem wytwarzania inhibitorów czynnika VIII. Jeżeli nie udaje się osiągnąć spodziewanych poziomów aktywności czynnika VIII w osoczu lub w sytuacji, gdy przy właściwie dobranej dawce nie udaje się opanować krwawienia, należy wykonać badanie w celu sprawdzenia obecności inhibitora czynnika VIII. U pacjentów z wysokim mianem inhibitora leczenie z użyciem czynnika VIII może być nieskuteczne i należy rozważyć inne możliwości terapii. Leczenie takich pacjentów winno być prowadzone przez lekarzy doświadczonych w opiece nad pacjentami z hemofilią A, patrz punkt 4.4. Choroba von Willebranda Ogólnie przyjmuje się, że podanie 1 j.m.vwf:rco/kg masy ciała powoduje wzrost poziomu VWF:RCo o 2% w krążeniu. Celem leczenia jest uzyskanie poziomu VWF:RCo >0,6 j.m./ml (60%) oraz FVIII:C >0,4 j.m./ml (40%) w osoczu. W większości przypadków, w celu uzyskania hemostazy, zaleca się dawkę j.m./kg czynnika von Willebranda oraz j.m./kg czynnika FVIII:C.
16 Pacjenci z chorobą von Willebranda typu 3, u których w celu utrzymanie odpowiednich poziomów czynnika może być konieczne podawanie wyższych dawek, mogą wymagać podania początkowej dawki czynnika von Willebranda 80 j.m./kg Dobraną dawkę należy podawać co godziny. Dawkowanie oraz czas leczenia zależą od stanu klinicznego pacjenta, umiejscowienia i rozległości krwawienia oraz poziomu zarówno VWF:RCo jak i FVIII:C. W okresie stosowania czynnika VIII zawierającego czynnik von Willebranda, lekarz leczący pacjenta powinien brać pod uwagę możliwość nadmiernego wzrostu poziomu FVIII:C. Po godzinach leczenia należy rozważyć obniżenie dawki lub wydłużenie okresu pomiędzy kolejnymi dawkami produktów zwierających VWF i czynnik VIII. W powyższym wskazaniu dostępne są tylko ograniczone dane z badań klinicznych u dzieci poniżej 6 roku życia i z tego powodu nie ma zaleceń do stosowania produktu w tej grupie wiekowej. Sposób podawania Rozpuścić preparat zgodnie z zaleceniami zamieszczonymi w punkcie 6.6. Produkt podawać powoli dożylnie. Szybkość podawania nie powinna przekraczać 10 ml/min. 4.3 Przeciwwskazania Znana nadwrażliwość na substancję aktywną lub substancje pomocnicze. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Tak jak w przypadku innych produktów podawanych dożylnie, możliwe jest wystąpienie reakcji nadwrażliwości typu alergicznego. Produkt zawiera również śladowe ilości ludzkich białek innych niż czynnik krzepnięcia VIII. Pacjent powinien być poinformowany o wczesnych objawach reakcji nadwrażliwości, włączając w to wysypkę, uogólnioną pokrzywkę, uczucie ucisku w klatce piersiowej, świstów, podciśnienia i objawów anafilaksji. W przypadku wystąpienia tych objawów, należy powiadomić o tym lekarza. W przypadku wystąpienia wstrząsu należy zastosować aktualnie zalecane leczenie przeciwwstrząsowe. W przypadku podawania produktów pochodzących z ludzkiej krwi lub osocza, nie można całkowicie wykluczyć możliwości chorób wywołanych przeniesieniem czynników zakaźnych, w tym również o nieznanej dotychczas etiologii. Ryzyko przeniesienia czynników zakaźnych jest zmniejszane przez: - selekcję dawców poprzez wywiad medyczny oraz badanie przesiewowe poszczególnych donacji krwi i pul osocza w kierunku HBsAg oraz przeciwciał anty-hiv i anty-hcv, - badanie puli osocza w kierunku obecności genomu HCV, - stosowanie procedur inaktywacji/usuwania wirusów w procesie wytwarzania, które zostały zwalidowane z zastosowaniem wirusów modelowych. Procedury te uważane są za skuteczne wobec wirusów HIV, HCV, HAV oraz HBV.
17 Proces usuwania/inaktywacji wirusów może mieć ograniczoną wartość wobec wirusów bezotoczkowych takich jak parvowirus B19. Zakażenie parwowirusem B19 może być szczególnie groźne u kobiet w ciąży (zakażenie płodu) oraz u osób z obniżoną odpornością lub zwiększoną erytropoezą (np. w anemii hemolitycznej). Wytwarzanie neutralizujących przeciwciał (inhibitorów) przeciw czynnikowi VIII jest znanym powikłaniem w leczeniu pacjentów z hemofilią typu A. Inhibitory te są zazwyczaj immunoglobulinami G skierowanymi przeciwko aktywności prokoagulacyjnej czynnika VIII, którą oznacza się w jednostkach Bethesda (Bethesda Units (BU)) na mililitr osocza z użyciem zmodyfikowanego oznaczenia Nijmegen s. Ryzyko wytworzenia inhibitorów jest zależne od okresu ekspozycji na czynnik VIII, przy czym ryzyko jest najwyższe podczas pierwszych 20 dni ekspozycji. W rzadkich przypadkach inhibitory mogą wytworzyć się także po pierwszych 100 dniach ekspozycji. Pacjenci leczeni ludzkim czynnikiem krzepnięcia VIII muszą być dokładnie monitorowani pod kątem wytwarzania inhibitorów - poprzez obserwacje stanu klinicznego i ocenę badań laboratoryjnych. Patrz również punkt 4.8. Działania niepożądane. Podczas leczenia pacjentów z chorobą von Willebranda ze znanymi klinicznymi lub laboratoryjnymi czynnikami ryzyka występuje zagrożenie powstania zakrzepów. Z tego powodu, konieczna jest obserwacja chorych w celu wczesnego wykrycia objawów nimi spowodowanych. Ponadto, należy zastosować aktualnie zalecane postępowanie zapobiegające wystąpieniu powikłań zakrzepowozatorowych. W okresie stosowania czynnika VIII zawierającego czynnik von Willebranda, lekarz powinien brać pod uwagę możliwość nadmiernego wzrostu poziomu FVIII:C. W celu zmniejszenia ryzyka wystąpienia powikłań zakrzepowych wskutek utrzymywania się nadmiernie wysokiego poziomu F VIII:C, u pacjentów leczonych produktami czynnika VIII zwierającymi VWF, należy monitorować jego poziom. W chorobie von Willebranda, w szczególności typu 3-go, mogą wytworzyć się przeciwciała neutralizujące (inhibitory) czynnik von Willebranda. W tych przypadkach, w których w leczeniu nie osiąga się spodziewanych poziomów VWF:RCo lub nie udaje się opanować krwawień pomimo stosowania odpowiednich dawek, należy wykonać badania mające na celu wykrycie obecności inhibitora. U pacjentów z wysokim poziomem inhibitora leczenie czynnikiem von Willbranda może nie być skuteczne. Należy wtedy rozważyć wprowadzenie innego sposobu leczenia. U pacjentów otrzymujących regularnie osoczopochodny VIII czynnik krzepnięcia, należy rozważyć zastosowanie odpowiednich szczepień (przeciwko wirusowi zapalenia wątroby A i B). Dla dobra pacjentów, zdecydowanie zaleca się, aby po każdym podaniu pacjentowi leku FANHDI odnotować nazwisko pacjenta i numer serii produktu, aby móc powiązać pacjenta z serią leku. 4.5 Interakcje z innymi lekami i inne rodzaje interakcji Nie są znane reakcje zespołu FVIII/VWF z innymi produktami leczniczymi.
18 4.6 Ciąża i laktacja Nie przeprowadzano badań wpływu zespołu FVIII/VWF na reprodukcję zwierząt. Ze względu na rzadkie występowanie hemofilii A u kobiet, brak jest doświadczeń dotyczących stosowania zespołu FVIII/VWF w okresie ciąży i karmienia piersią. Z tego powodu zespół FVIII/VWF powinien być stosowany podczas ciąży i w okresie laktacji tylko wtedy, gdy jest to jednoznacznie wskazane. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie obserwowano wpływu na zdolność do prowadzenia pojazdów i obsługiwania urządzeń mechanicznych w ruchu. 4.8 Działania niepożądane Nadwrażliwość lub reakcje alergiczne (obrzęk naczynioruchowy, pieczenie lub uczucie kłucia w miejscu wstrzyknięcia, dreszcze, zaczerwienienie twarzy, uogólniona pokrzywka, ból głowy, wysypka, spadek ciśnienia krwi, letarg, nudności, niepokój, tachykardia, uczucie ucisku w klatce piersiowej, świąd, wymioty, świsty) były obserwowane rzadko i tylko w niektórych przypadkach prowadziły do rozwoju ciężkiej reakcji anafilaksji (włączając w to wstrząs). W rzadkich przypadkach obserwowano wzrost temperatury ciała. Chorzy na hemofilię A mogą wytworzyć przeciwciała neutralizujące (inhibitory) przeciw czynnikowi VIII. Jeżeli pojawią się tego typu inhibitory, leczenie stanie się klinicznie mało skuteczne. W chorobie von Willebranda, w szczególności typu 3-go, mogą wytworzyć się przeciwciała neutralizujące (inhibitory) czynnik von Willebranda. Objawia się to, niedostateczną skutecznością kliniczną. Obecność przeciwciał kojarzy się często z występowaniem reakcji anafilaktycznych. Z tego powodu pacjenci, u których wystąpiły reakcje anafilaktyczne powinni być przebadani w kierunku występowania inhibitorów. W takich przypadkach zaleca się kontakt z wyspecjalizowanym ośrodkiem leczenia zaburzeń hemostazy. Podczas leczenia produktem pacjentów z chorobą von Willebranda ze znanymi klinicznymi lub laboratoryjnymi czynnikami ryzyka występuje zagrożenie powstania zakrzepów. Utrzymywanie się nadmiernie wysokiego poziomu F:VIII podczas leczenia czynnikiem VIII zawierającym czynnik von Willebranda zwiększa ryzyko wystąpienia powikłań zakrzepowych. Podczas kilku badań klinicznych przeprowadzonych z udziałem 164 chorych podano ogółem 7000 infuzji Fanhdi. Uzyskane wyniki z obu badań wskazują na dobrą tolerancje preparatu i małą częstość występowania działań niepożądanych. Obserwowane jedynie 2 przypadki, w
19 których wystąpiły działania niepożądane związane z podawanym produktem leczniczym. W obydwu przypadkach odnotowano wystąpienie podwyższonej temperatury ciała. Działania niepożądane zostały ocenione i podzielone na kategorie zgodnie z klasyfikacją układów narządowych MedDRA poczynając od objawów najcięższych do najlżejszych. Częstość występowania oceniano stosując następujące kryteria: - bardzo często (> 1/10), - często (> 1/100, < 1/10), - niezbyt często (> 1/1000, < 1/100), - rzadko (> 1/10 000, < 1/1000) - bardzo rzadko (< 1/10 000) i nie znanej częstości występowania. Układ narządowy Preferowana nazwa objawu Częstość występowania działań niepożądanych Objawy ogólne i występujące w miejscu po wstrzyknięciu Podwyższone temperatura ciała. Rzadko Informacje dotyczące zabezpieczeń przed przeniesieniem czynników zakaźnych, patrz punkt Przedawkowanie Nie obserwowano objawów przedawkowania ludzkiego zespołu FVIII/VWF. Po znacznym przedawkowaniu mogą wystapić powikłania zakrzepowozatorowe. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwkrwotoczne, połączenie czynnika krzepnięcia krwi VIII i czynnika von Willebranda, kod ATC - B02BD06 W FANHDI, czynnik VIII:C występuje w zespole z czynnikiem von Willebranda. Kompleks czynnik VIII/czynnik von Willebranda składa się z dwóch cząsteczek (czynnika VIII i czynnika von Willebranda) o różnych funkcjach fizjologicznych. Niedobór czynnika VIII Po podaniu, w krążeniu chorego na hemofilię, czynnik VIII wiąże czynnik von Willebranda Aktywowany czynnik VIII działa jako kofaktor wobec aktywowanego czynnika IX, przyśpieszając przemianę czynnika X w aktywowany czynnik X. Aktywowany czynnik X przekształca protrombinę w trombinę. Następnie trombina przekształca fibrynogen w fibrynę i umożliwia utworzenie się skrzepu.
20 Hemofilia A jest związanym z płcią, dziedzicznym zaburzeniem krzepnięcia krwi, które jest spowodowane obniżeniem aktywności czynnika VIII:C i objawia się obfitym krwawieniem do stawów, mięśni i organów wewnętrznych, występującym samoistnie lub w następstwie urazów powypadkowych lub po zabiegach chirurgicznych. Poziom FVIII w osoczu podwyższa się przez zastosowanie leczenia zastępczego. W ten sposób umożliwia się tymczasową korektę niedoboru czynnika oraz zmniejsza się skłonność do występowania krwawień. Choroba von Willebranda Wchodzący w skład FANHDI czynnik von Willebranda działa w ten sam sposób jak endogenny czynnik von Willebranda Podanie czynnika von Willebranda zgodnie z jego funkcjami fizjologicznymi koryguje zaburzenia hemostazy występujące u chorych z niedoborem czynnika von Willebranda (choroba von Willebranda ) w dwóch etapach: Czynnik von Willebranda przywraca adhezję płytek krwi do podśródbłonkowej tkanki łącznej w uszkodzonych naczyniach krwionośnych (wskutek jednoczesnego łączenia się z podśródbłonkową tkanką łączną i płytkami krwi), zapewniając wstępny etap hemostazy, co objawia się skróceniem czasu krwawienia. Jest to efekt natychmiastowy powstający w wyniku polimeryzacji białek. Z pewnym opóźnieniem koryguje również współistniejący niedobór czynnika VIII. Po podaniu dożylnym czynnik von Willebranda tworzy w krwiobiegu kompleks z endogennym czynnikiem VIII, stabilizuje go i ochrania przed szybką degradacją. Poziom FVIII:C powraca do normy natychmiast po podaniu zespołu FVIII /VWF. Dostępne są tylko ograniczone dane z badań klinicznych u dzieci poniżej 6 roku życia i z tego powodu nie ma zaleceń do stosowania produktu w zarejestrowanych wskazaniach w tej grupie wiekowej. 5.2 Właściwości farmakokinetyczne Po podaniu aktywność czynnika VIII w osoczu maleje się zgodnie z krzywą dwuwykładniczą. Badania kliniczne z zastosowaniem FANHDI wykazały, że okres półtrwania wynosi 14,18 ± 2,55 godzin, a odzysk in vivo 105,5 ± 18,5% co odpowiada podanej dawce w wysokości około 2,1 ± 0,4 j.m./dl na 1 j.m./kg masy ciała (badania wykonano metodą chromogenną). Inne otrzymane dane to MRT 20,6 ± 4,8 h, AUC 19,3 ± 3,7 j.m.h/dl oraz klirens 2,6 ± 0,5 ml/h/kg. Badania kliniczne w chorobie von Willebranda z zastosowaniem FANHDI wykazały, że okres półtrwania ludzkiego czynnika von Willebranda wynosi 14,4 ± 10,5 godz. a VIII czynnika krzepnięcia wynosi 33,4 ± 16,4 godzin, odzysk in vivo 1,9 ± 0,6 j.m./dl na każdą podaną 1 j.m./kg masy ciała czynnika von Willebranda i 2,6 ± 0,6 j.m. na każdą 1 j.m./kg czynnika VIII. Aktywność czynnika von Willebranda (j.m.) oznaczono na podstawie aktywności kofaktora rystocetyny (VWF:RCo) a aktywność czynika VIII (FVIII:C) metodą chromogenną). Inne otrzymane dane to: AUC dla VWF:RCo 15,29 ± 10,03 i dla FVIII:C 49,41 ± 37,74 j.m. h/ml oraz klirens dla VWF:RCo 5,6 ± 3,3 i dla FVIII:C 1,4 ± 1,1 ml/h/kg.
21 Poziom szczytowy czynnika von Willebranda w osoczu pojawia się po 30 min od podania. 5.3 Przedkliniczne dane o bezpieczeństwie Ludzki VIII czynnik krzepnięcia i czynnik von Willebranda (które zawiera FANHDI) są normalnymi składnikami ludzkiego osocza i spełniają taką samą funkcję jak czynniki endogenne. Badanie toksyczności po jednorazowej dawce nie ma znaczenia, gdyż podanie wyższych dawek powoduje przeciążenie łożyska naczyniowego. Badanie toksyczności przewlekłej u zwierząt nie jest możliwe ze względu na tworzenie się przeciwciał przeciwko obcemu białku. Nawet kilkakrotnie większe od stosowanych u ludzi dawki nie wywierają działania toksycznego na zwierzęta laboratoryjne. Doświadczenie kliniczne w stosowaniu zespołu ludzkiego VIII czynnika krzepnięcia i czynnika von Willebranda nie wskazuje na jego działanie rakotwórcze lub mutagenne i dlatego badania, w szczególności na gatunkach heterologicznych, nie mają uzasadnienia. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Proszek: Histydyna Albumina ludzka Arginina Rozpuszczalnik Woda do wstrzykiwań (rozpuszczalnik) 6.2 Niezgodności farmaceutyczne Leku nie należy mieszać z innymi lekami. Aby uniknąć niepowodzeń w leczeniu z powodu adsorpcji zespołu FVIII/VWF do ścianek niektórych zestawów infuzyjnych, należy używać wyłącznie zestawów do infuzji załączonych do opakowania. 6.3 Okres trwałości 3 lata Po odtworzeniu, trwałość chemiczna i fizyczna produktu utrzymuje się do 12 godzin w temperaturze 25 C. Z mikrobiologicznego punktu widzenia, produkt powinien zostać zużyty natychmiast. Jeśli po odtworzeniu produkt nie został zużyty, może być przechowywany nie dłużej niż przez 24 godziny w temperaturze 2 o C - 8 o C, ale tylko wtedy, gdy
22 odpowiedzialność za to weźmie użytkownik a przygotowanie roztworu odbyło się zgodnie z zasadami jałowości. 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 30 o C. Nie zamrażać. 6.5 Rodzaj i zawartość opakowania FANHDI występuje w fiolkach ze szkła typu I/II z korkiem z gumy chlorobutylowej z proszkiem po 250, 500 i po 1000 j.m. ludzkiego VIII czynnika krzepnięcia wraz z ampułkostrzykawką ze szkła typu I z zatyczką tłoka z gumy bromobutylowej po 10 ml wody do wstrzykiwań (rozpuszczalnik) w tekturowym pudełku. Zestaw do sporządzania roztworu i podawania załączony do opakowania FANHDI: łącznik mocujący do fiolki, mikrofiltr i zestaw do infuzji. Nie wszystkie wielkości opakowania mogą znajdować się w obrocie. Opakowanie zawiera: 1 fiolka z proszkiem, 1 ampułko-strzykawka z rozpuszczalnikiem, zestaw do sporządzania roztworu i podania. 6.6 Instrukcja dotycząca produktu leczniczego do stosowania i usuwania jego pozostałości Nie należy stosować leku po upływie jego ważności podanym na opakowaniu. Nie pozostawiać nawet w lodówce niezużytego produktu do późniejszego użycia. Przygotowanie roztworu: 1. Ogrzać fiolki do temperatury nie wyższej niż 30 o C (rycina Nr 1). 2. Umocować tłok w ampułko-strzykawce z rozpuszczalnikiem (rycina Nr 2). 3. Wyjąć filtr z opakowania. Zdjąć plastikową osłonę z końca ampułko-strzykawki i umocować filtr (rycina Nr 3). 4. Wyjąć łącznik mocujący do fiolki i połączyć ampułko-strzykawkę z filtrem (rycina Nr 4). 5. Zdjąć plastikowy kapturek z fiolki i odsłonięty gumowy korek odkazić środkiem dezynfekującym (rycina Nr 5). 6. Przebić korek w fiolce igłą łącznika (rycina Nr 6). 7. Wstrzyknąć cały rozpuszczalnik do fiolki (rycina Nr 7).
23 8. Delikatnie wstrząsać fiolką aż do rozpuszczenia proszku (rycina Nr 8). Tak jak w przypadku innych produktów podawanych dożylnie nie stosować, gdy produkt jest nie rozpuszczony lub widoczne są cząsteczki. 9. Rozłączyć na chwilę ampułko-strzykawkę z filtrem od fiolki aby wpuścić powietrze. (rycina Nr 9). 10. Odwrócić do góry dnem fiolkę i aspirować roztwór do ampułko-strzykawki (rycina Nr 10). 11. Przygotować miejsce do iniekcji, odłączyć strzykawkę i wstrzyknąć produkt przez załączoną igłę motylkową lub inną sterylną igłę. Podawać dożylnie z szybkością 3 ml/min i nigdy nie przekraczać 10 ml/min aby uniknąć reakcji naczynioruchowych (rycina Nr 11). Nie używać ponownie zestawu do podawania. Wszelkie pozostałości niezużytego produktu i inne odpady należy usunąć zgodnie z lokalnymi przepisami. Roztwór powinien być przezroczysty i lekko opalizujący. Nie stosować roztworów, w których występują kłaczki lub osad. Przed podaniem sprawdzić wzrokowo, czy roztwór nie zawiera cząsteczek stałych i czy nie doszło do zmiany jego zabarwienia. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU INSTITUTO GRIFOLS, S.A. Poligono Levante, c/can Guasch, Parets del Vallés, Barcelona, Hiszpania. 8. NUMERY POZWOLENIA NA DOPUSZCZENIE DO OBROTU FANHDI 25 j.m./ml; 250 j.m FANHDI 50 j.m./ml; 500 j.m FANHDI 100 j.m./ml;1000 j.m DATA WYDANIA POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA JEGO PRZEDŁUŻENIA r. / r. 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
24
25 1. NAZWA PRODUKTU LECZNICZEGO FANHDI 25 j.m./ml; Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. FANHDI 50 j.m./ml; Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. FANHDI 100 j.m./ml; Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY FANHDI, występuje w postaci proszku do wstrzykiwań i infuzji w fiolkach zawierających nominalnie 250 j.m., 500 j.m. lub 1000 j.m. ludzkiego VIII czynnika krzepnięcia krwi (FVIII) i odpowiednio 300, 600 lub 1200 j.m. ludzkiego czynnika von Willebranda (VWF). Po rozpuszczeniu w 10 ml wody do wstrzykiwań w zależności od wielkości opakowania produkt zawiera około: FANHDI 25 j.m./ml; 250 j.m.: 25 j.m.ludzkiego FVIII i 30 j.m. VWF w jednym ml FANHDI 50 j.m./ml; 500 j.m.: 50 j.m.ludzkiego FVIII i 60 j.m. VWF w jednym ml FANHDI 100 j.m./ml; 1000 j.m.: 100 j.m.ludzkiego FVIII i 120 j.m.vwf w jednym ml Aktywność czynnika FVIII (FVIII:C) (w j.m.) jest oznaczana metodą chromogenną, zgodną z Farmakopeą Europejską. Aktywność specyficzna Fanhdi wynosi co najmniej 2,5 do 10 j.m. FVIII:C/mg białka w zależności od wielkości opakowania (250, 500 i 1000 j.m.) Aktywność czynnika von Willebranda (w j.m.) jest oznaczana na podstawie aktywności kofaktora rystocetyny (VWF:RCo) według Międzynarodowego Standardu dla koncentratów czynnika von Willebranda (WHO). Substancje pomocnicze, patrz punkt POSTAĆ FARMACEUTYCZNA Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. Fiolka z białym lub jasno-żółtym proszkiem oraz ampułko-strzykawka z wodą do wstrzykiwań (rozpuszczalnik). 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania FANHDI stosuje się w zapobieganiu i opanowywaniu krwawień u chorych na hemofilię A (wrodzony niedobór ludzkiegoviii czynnika krzepnięcia). Stosowanie FANHDI jest również wskazane w zapobieganiu i opanowywaniu krwawień (w tym krwawień podczas zabiegów chirurgicznych) u chorych z chorobą von Willebranda (VWD), gdy leczenie desmopresyną (DDAVP) jest nieskuteczne lub przeciwwskazane.
Zespół ludzkiego czynnika krzepnięcia VIII i ludzkiego czynnika von Willebranda.
 1. NAZWA PRODUKTU LECZNICZEGO FANHDI, 250 j.m. FVIII + 300 j.m. VWF Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. FANHDI, 500 j.m.fviii + 600 j.m. VWF Proszek i rozpuszczalnik
1. NAZWA PRODUKTU LECZNICZEGO FANHDI, 250 j.m. FVIII + 300 j.m. VWF Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań i infuzji. FANHDI, 500 j.m.fviii + 600 j.m. VWF Proszek i rozpuszczalnik
Anbinex, 50 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do infuzji,
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Anbinex, 50 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do infuzji, 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Ludzka antytrombina
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Anbinex, 50 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do infuzji, 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Ludzka antytrombina
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Optivate, 250 j.m., 500 j.m., 1000 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Ludzki VIII czynnik krzepnięcia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Optivate, 250 j.m., 500 j.m., 1000 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Ludzki VIII czynnik krzepnięcia
IMMUNATE Baxter 1000 Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMMUNATE Baxter 1000 Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMMUNATE Baxter 1000 Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Willfact 500 j.m. Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt Willfact jest
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Willfact 500 j.m. Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt Willfact jest
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Willfact 1000 j.m. Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt Willfact jest
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Willfact 1000 j.m. Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt Willfact jest
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 / 11 1. NAZWA PRODUKTU LECZNICZEGO Haemoctin 250 Haemoctin 500 Haemoctin 1000 Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 / 11 1. NAZWA PRODUKTU LECZNICZEGO Haemoctin 250 Haemoctin 500 Haemoctin 1000 Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Immunate Baxter 500 Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Immunate Baxter 500 Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna:
Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. Liofilizowany proszek: biały lub jasnożółty proszek lub zbrylona masa.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Wilate 500, 500 j.m. FVIII / 500 j.m. VWF, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Wilate 1000, 1000 j.m. FVIII
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Wilate 500, 500 j.m. FVIII / 500 j.m. VWF, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Wilate 1000, 1000 j.m. FVIII
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
1. NAZWA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Igantet 250, 250 j.m./ml, roztwór do wstrzykiwań Immunoglobulinum humanum tetanicum 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Igantet 250, 250 j.m./ml, roztwór do wstrzykiwań Immunoglobulinum humanum tetanicum 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Octanate, 100 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Octanate, 100 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Octanate, 100 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Haemate P 250/500/1000 Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań lub infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Haemate
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Haemate P 250/500/1000 Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań lub infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Haemate
Ulotka dołączona do opakowania: informacja dla pacjenta. INNOVATE 1000 j.m. Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
 Ulotka dołączona do opakowania: informacja dla pacjenta INNOVATE 1000 j.m. Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Ludzki VIII czynnik krzepnięcia krwi Należy zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla pacjenta INNOVATE 1000 j.m. Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Ludzki VIII czynnik krzepnięcia krwi Należy zapoznać się z treścią
IMMUNINE 600 IU proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań lub infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMMUNINE 600 IU proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań lub infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 fiolka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMMUNINE 600 IU proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań lub infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 fiolka
Wymagany poziom czynnika VIII
 Informacja o leku ADVATE: 250 j.m., 500 j.m., 1000 j.m., 1500 j.m., 2000 j.m., 3000 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. Ludzki czynnik VIII (rdna) oktokog alfa. Skład
Informacja o leku ADVATE: 250 j.m., 500 j.m., 1000 j.m., 1500 j.m., 2000 j.m., 3000 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. Ludzki czynnik VIII (rdna) oktokog alfa. Skład
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-d 50 Roztwór do wstrzykiwań Immunoglobulinum humanum anti-d Immunoglobulina ludzka anty-d Należy zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-d 50 Roztwór do wstrzykiwań Immunoglobulinum humanum anti-d Immunoglobulina ludzka anty-d Należy zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Octanate LV, 100 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Octanate LV, 100 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Octanate LV, 100 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Proszek i rozpuszczalnik do sporządzania roztworu do stosowania miejscowego, 400 j.m., 200 j.m.
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA BioTrombina 400 Thrombinum bovine Proszek i rozpuszczalnik do sporządzania roztworu do stosowania miejscowego, 400 j.m., 200 j.m./ml Należy zapoznać się
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA BioTrombina 400 Thrombinum bovine Proszek i rozpuszczalnik do sporządzania roztworu do stosowania miejscowego, 400 j.m., 200 j.m./ml Należy zapoznać się
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 1000 Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Roztwór do wstrzykiwań Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 1000 Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Roztwór do wstrzykiwań Należy
Igantet j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Igantet 250 250 j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Igantet 250 250 j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Beriate 250, 250 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań / do infuzji Beriate 500, 500 j.m., proszek i
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Beriate 250, 250 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań / do infuzji Beriate 500, 500 j.m., proszek i
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
A NEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 A NEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
A NEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Haemate P 250 j.m FVIII/600 j.m. VWF, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań lub infuzji Haemate P 500 j.m FVIII/1200
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Haemate P 250 j.m FVIII/600 j.m. VWF, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań lub infuzji Haemate P 500 j.m FVIII/1200
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum) - witaminy K 1.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Beriate 250, 250 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań / do infuzji Beriate 500, 500 j.m., proszek i
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Beriate 250, 250 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań / do infuzji Beriate 500, 500 j.m., proszek i
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tetabulin S/D 250 j.m./ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka przeciw tężcowi Jedna dawka (1ml)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tetabulin S/D 250 j.m./ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka przeciw tężcowi Jedna dawka (1ml)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Immunate 1000 IU FVIII/ 750 IU VWF proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Substancje czynne: Ludzki czynnik krzepnięcia
Ulotka dołączona do opakowania: informacja dla użytkownika Immunate 1000 IU FVIII/ 750 IU VWF proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Substancje czynne: Ludzki czynnik krzepnięcia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Octanate, 50 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Octanate, 50 j.m./ml,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Octanate, 50 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Octanate, 50 j.m./ml,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Nonafact 100 j.m./ml proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Nonafact 100 j.m./ml proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 8 1. NAZWA PRODUKTU LECZNICZEGO, 180 j.m./ml Roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 8 1. NAZWA PRODUKTU LECZNICZEGO, 180 j.m./ml Roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-d 150 Roztwór do wstrzykiwań Immunoglobulinum humanum anti-d Immunoglobulina ludzka anty-d Należy zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-d 150 Roztwór do wstrzykiwań Immunoglobulinum humanum anti-d Immunoglobulina ludzka anty-d Należy zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO SUBCUVIA 160 g/l roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka normalna (Ig s.c./i.m.) 1 l roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO SUBCUVIA 160 g/l roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka normalna (Ig s.c./i.m.) 1 l roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Berinin P 300/600/1200 Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań lub infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Berinin
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Berinin P 300/600/1200 Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań lub infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Berinin
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Każdy worek zawiera wodę do wstrzykiwań 100% m/v 3. POSTAĆ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Każdy worek zawiera wodę do wstrzykiwań 100% m/v 3. POSTAĆ
Antithrombin III Baxter, 50 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Antithrombin III Baxter, 50 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Antithrombin III Baxter, 50 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHA RAKTERYSTYKA PRODUKTU LECZNICZEGO. Ampułko-strzykawka po 1 ml zawiera 250 j.m. immunoglobuliny ludzkiej przeciwtężcowej.
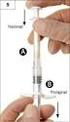 CHA RAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Igantet 250, 250j.m./ml, roztwór do wstrzykiwań Immunoglobulinum humanum tetanicum 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
CHA RAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Igantet 250, 250j.m./ml, roztwór do wstrzykiwań Immunoglobulinum humanum tetanicum 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vaminolact, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: Substancje czynne: L-alanina L-arginina L-asparaginowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vaminolact, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: Substancje czynne: L-alanina L-arginina L-asparaginowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ERYSIN SINGLE SHOT, emulsja do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ERYSIN SINGLE SHOT, emulsja do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO OCTANINE F 500, 500 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań OCTANINE F 1000, 1000 j.m., proszek i rozpuszczalnik
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO OCTANINE F 500, 500 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań OCTANINE F 1000, 1000 j.m., proszek i rozpuszczalnik
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADDAMEL N, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml koncentratu zawiera: Substancje czynne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADDAMEL N, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml koncentratu zawiera: Substancje czynne
BIONORICA Polska Sp z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Cyclodynon 1
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Recombinate 250 IU/5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Recombinate 500 IU/5 ml, proszek i rozpuszczalnik
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Recombinate 250 IU/5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Recombinate 500 IU/5 ml, proszek i rozpuszczalnik
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Riastap, 1 g, proszek do sporządzania roztworu do wstrzykiwań lub infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Riastap jest dostarczany jako
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Riastap, 1 g, proszek do sporządzania roztworu do wstrzykiwań lub infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Riastap jest dostarczany jako
Ulotka dołączona do opakowania: informacja dla użytkownika. Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab
 Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fluarix, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fluarix, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Human Albumin Grifols 20%, 200g/l, roztwór do infuzji.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Human Albumin Grifols 20%, 200g/l, roztwór do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Albumina ludzka Human Albumin
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Human Albumin Grifols 20%, 200g/l, roztwór do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Albumina ludzka Human Albumin
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ADVATE 250 IU proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda fiolka
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ADVATE 250 IU proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda fiolka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GAMMA anty-d 150 Roztwór do wstrzykiwań Immunoglobulinum humanum anti-d Immunoglobulina ludzka anty-d 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GAMMA anty-d 150 Roztwór do wstrzykiwań Immunoglobulinum humanum anti-d Immunoglobulina ludzka anty-d 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ADVATE 250 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda fiolka
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ADVATE 250 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda fiolka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoruvax, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoruvax, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Recombinate 250 IU/5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Recombinate 500 IU/5 ml, proszek i rozpuszczalnik
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Recombinate 250 IU/5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Recombinate 500 IU/5 ml, proszek i rozpuszczalnik
Prothromplex Total NF Proszek i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań i infuzji dożylnych
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Prothromplex Total NF Proszek i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań i infuzji dożylnych 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Prothromplex Total NF Proszek i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań i infuzji dożylnych 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
Octaplex 500 j.m. proszek i rozpuszczalnik do sporządzania roztworu do infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Octaplex 500 j.m. proszek i rozpuszczalnik do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Octaplex występuje w postaci
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Octaplex 500 j.m. proszek i rozpuszczalnik do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Octaplex występuje w postaci
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Atenativ, 50 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Atenativ to proszek
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Atenativ, 50 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Atenativ to proszek
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rhesonativ 1250 j.m. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Po odtworzeniu w 2 ml wody do wstrzykiwań (dołączono) produkt zawiera: w ml w fiolce
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rhesonativ 1250 j.m. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Po odtworzeniu w 2 ml wody do wstrzykiwań (dołączono) produkt zawiera: w ml w fiolce
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Catosal 10%, roztwór do wstrzykiwań dla psów, kotów i koni 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Catosal 10%, roztwór do wstrzykiwań dla psów, kotów i koni 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepatect CP 50 j.m./ml; roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepatect CP 50 j.m./ml; roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Mononine, 500 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań / infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mononine, 500 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań / infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda fiolka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mononine, 500 j.m., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań / infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda fiolka
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Nonafact 100 j.m./ml proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Nonafact 100 j.m./ml proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. adsorbowany na wodorotlenku glinu, uwodnionym nie więcej niż 0,7 mg Al 3+
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
Flexbumin 200 g/l, roztwór do infuzji Albumina ludzka
 Ulotka dołączona do opakowania: informacja dla użytkownika Flexbumin 200 g/l, roztwór do infuzji Albumina ludzka Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika Flexbumin 200 g/l, roztwór do infuzji Albumina ludzka Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
ReFacto AF 500 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce
 1. NAZWA PRODUKTU LECZNICZEGO ReFacto AF 250 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań ReFacto AF 500 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań ReFacto
1. NAZWA PRODUKTU LECZNICZEGO ReFacto AF 250 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań ReFacto AF 500 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań ReFacto
FEIBA NF 500 j. / 1000 j., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FEIBA NF 500 j. / 1000 j., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FEIBA NF 500 j. / 1000 j., proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO BeneFIX 250 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda fiolka
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO BeneFIX 250 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda fiolka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy (Lidocainum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
Miejscowe oczyszczanie skóry: Wetrzeć niewielką ilość emulsji do kąpieli w zwilżoną uprzednio skórę, a następnie spłukać wodą i osuszyć ręcznikiem.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Octaplex 500 j.m. proszek i rozpuszczalnik do sporządzania roztworu do infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Octaplex 500 j.m. proszek i rozpuszczalnik do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Octaplex występuje w postaci
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Octaplex 500 j.m. proszek i rozpuszczalnik do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Octaplex występuje w postaci
Human Albumin 50 g/l Baxter jest roztworem zawierającym 50 g/l białka całkowitego, z którego co najmniej 95% stanowi albumina ludzka.
 1. NAZWA PRODUKTU LECZNICZEGO HUMAN ALBUMIN 50 g/l BAXTER, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Human Albumin 50 g/l Baxter jest roztworem zawierającym 50 g/l białka całkowitego, z którego
1. NAZWA PRODUKTU LECZNICZEGO HUMAN ALBUMIN 50 g/l BAXTER, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Human Albumin 50 g/l Baxter jest roztworem zawierającym 50 g/l białka całkowitego, z którego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
Ulotka dołączona do opakowania: informacja dla użytkownika. Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab
 Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Pseudovac, roztwór do wstrzykiwań Szczepionka poliwalentna przeciwko pałeczce ropy błękitnej Pseudomonas aeruginosa 1 ml szczepionki zawiera antygeny
Ulotka dołączona do opakowania: informacja dla użytkownika Pseudovac, roztwór do wstrzykiwań Szczepionka poliwalentna przeciwko pałeczce ropy błękitnej Pseudomonas aeruginosa 1 ml szczepionki zawiera antygeny
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ADVATE 250 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda fiolka
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ADVATE 250 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda fiolka
