CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
|
|
|
- Kamil Olejnik
- 9 lat temu
- Przeglądów:
Transkrypt
1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dicloberl mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: diklofenak sodowy. Każdy czopek zawiera 50 mg diklofenaku sodowego (Diclofenacum natricum). Pełny wykaz substancji pomocniczych: patrz punkt POSTAĆ FARMACEUTYCZNA Czopki 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Leczenie objawowe bólu i stanu zapalnego w: - Ostrym zapaleniu stawów (w tym dnie moczanowej); - Przewlekłym zapaleniu stawów, szczególnie w reumatoidalnym zapaleniu stawów (przewlekłe zapalenie wielostawowe); - Zesztywniającym zapaleniu stawów kręgosłupa (choroba Bechtereva) i innych reumatycznych stanach zapalnych kręgosłupa; - W chorobie zwyrodnieniowej kręgosłupa i chorobie zwyrodnieniowej stawów; - Zapalnych chorobach reumatycznych tkanek miękkich; - Bolesnych obrzękach i zapaleniach pourazowych. 4.2 Dawkowanie i sposób podawania Dawkowanie Diklofenak jest dawkowany w zależności od ciężkości i rodzaju choroby. Zalecana dawka dobowa dla dorosłych wynosi od 50 mg do 150 mg diklofenaku sodowego. Całkowita dawka dobowa powinna być podzielona na 1 do 3 dawek. Wiek: Pojedyncza dawka: Całkowita dawka dobowa: Dorośli 1 czopek (50 mg diklofenaku sodowego) 1 do 3 czopków (50 mg do150 mg diklofenaku sodowego) Sposób podawania i okres leczenia: Czopki należy wprowadzić głęboko do odbytu, najlepiej po wypróżnieniu. O czasie trwania leczenia decyduje lekarz prowadzący. W zaburzeniach reumatycznych może być konieczne długotrwale stosowanie produktu Dicloberl 50. Występowanie działań niepożądanych można ograniczyć stosując produkt w najmniejszej skutecznej dawce i nie dłużej niż to konieczne do kontrolowania objawów (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Szczególne grupy pacjentów stosujące lek: 1
2 Osoby w podeszłym wieku: Nie jest wymagana zmiana dawkowania. Z powodu możliwości wystąpienia działań niepożądanych pacjentów w podeszłym wieku należy monitorować szczególnie wnikliwie. Zaburzenia czynności nerek: Nie jest wymagane zmniejszenie dawkowania u pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności nerek (pacjenci z ciężką niewydolnością nerek, patrz punkt 4.3). Zaburzenia czynności wątroby (patrz punkt 5.2): Nie jest wymagane zmniejszenie dawkowania u pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności wątroby (pacjenci z ciężką niewydolnością wątroby, patrz punkt 4.3). Dzieci i młodzież Produkt leczniczy Dicloberl 50 w postaci czopków w dawce 50 mg nie jest zalecany do stosowania u dzieci i młodzieży. 4.3 Przeciwwskazania Produktu Dicloberl 50 nie wolno stosować w następujących przypadkach: - nadwrażliwość na substancję czynną (diklofenak) lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; - w wywiadzie skurcz oskrzeli, astma, katar lub pokrzywka po podaniu kwasu acetylosalicylowego lub innego niesteroidowego leku przeciwzapalnego; - zaburzenia krwiotworzenia niewiadomego pochodzenia; - czynna lub nawracająca choroba wrzodowa żołądka i (lub) dwunastnicy jak również krwawienie (dwa lub więcej oddzielne epizody potwierdzonego owrzodzenia lub krwawienia); - krwawienia z przewodu pokarmowego lub perforacje, związane z wcześniejszym leczeniem NLPZ; - krwawienie z naczyń mózgowych lub inne czynne krwawienie; - ciężka niewydolność wątroby lub nerek; - ciężka niewydolność serca; - trzeci trymestr ciąży (patrz punkt 4.6); - stwierdzona zastoinowa niewydolność serca (klasa II-IV wg NYHA), choroba niedokrwienna serca, choroba naczyń obwodowych i (lub) choroba naczyń mózgowych. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Wpływ na przewód pokarmowy Należy unikać równoczesnego stosowania produktu leczniczego Dicloberl 50 z innymi NLPZ, w tym z selektywnymi inhibitorami cyklooksygenazy-2. Przyjmowanie leku w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz ryzyko dotyczące przewodu pokarmowego i sercowo-naczyniowego podane poniżej). Osoby w podeszłym wieku: Częstość występowania działań niepożądanych podczas leczenia NLPZ zwłaszcza krwawień z przewodu pokarmowego oraz perforacji, które mogą prowadzić do zgonu jest większa u osób w podeszłym wieku (patrz punkt 4.2). Krwawienie z przewodu pokarmowego, choroba wrzodowa i perforacja: 2
3 Opisywano krwawienia z przewodu pokarmowego, chorobę wrzodową żołądka i (lub) dwunastnicy i perforacje w przypadku stosowania wszystkich NLPZ, występujące w różnym czasie w trakcie leczenia, z i bez objawów ostrzegawczych i z lub bez występujących ciężkich działań niepożądanych dotyczących przewodu pokarmowego w wywiadzie. Ryzyko krwawienia z przewodu pokarmowego, choroby wrzodowej żołądka i (lub) dwunastnicy i perforacji zwiększa się wraz ze zwiększaniem dawek NLPZ, jest większe u pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, w szczególności, jeżeli było powikłane krwawieniem lub perforacją (patrz punkt 4.3) oraz u osób w podeszłym wieku. U takich osób leczenie należy rozpoczynać od najmniejszych skutecznych dawek. U takich pacjentów oraz u pacjentów wymagających jednoczesnego podawania kwasu acetylosalicylowego w małej dawce lub innych leków, które mogą zwiększać ryzyko zdarzeń dotyczących przewodu pokarmowego należy rozważyć jednoczesne podawanie z lekami o działaniu ochronnym na błonę śluzową żołądka (np. mizoprostolem lub inhibitorami pompy protonowej) (patrz poniżej i punkt 4.5). Pacjenci, u których występują działania niepożądane dotyczące przewodu pokarmowego w wywiadzie, w szczególności osoby w podeszłym wieku, powinni zgłaszać wszystkie nieprawidłowe objawy brzuszne (szczególnie krwawienie z przewodu pokarmowego), w szczególności na początku leczenia. Należy zalecić ostrożność u pacjentów otrzymujących jednocześnie leki, które mogą zwiększać ryzyko wystąpienia choroby wrzodowej żołądka i (lub) dwunastnicy lub krwawienia, takie jak doustne kortykosteroidy, leki przeciwzakrzepowe, takie jak warfaryna, selektywne inhibitory wychwytu zwrotnego serotoniny lub leki przeciwpłytkowe, takie jak kwas acetylosalicylowy (patrz punkt 4.5). W przypadku wystąpienia krwawienia z przewodu pokarmowego lub choroby wrzodowej żołądka i (lub) dwunastnicy u pacjenta stosującego Dicloberl 50, lek należy odstawić. Należy ostrożnie podawać NLPZ pacjentom z chorobami przewodu pokarmowego (wrzodziejące zapalenie jelita grubego, choroba Crohna) w wywiadzie, gdyż może wystąpić u nich zaostrzenie choroby (patrz punkt 4.8). Wpływ na układ krążenia i naczynia zaopatrujące mózg Pacjentów z nadciśnieniem tętniczym w wywiadzie lub zastoinową niewydolnością serca (klasa I wg NYHA), należy odpowiednio kontrolować i wydawać właściwe zalecenia, ponieważ w związku z leczeniem NLPZ zgłaszano zatrzymanie płynów i obrzęki. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg na dobę) przez długi okres czasu może być związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar). Diklofenak należy stosować bardzo ostrożnie u pacjentów z istotnymi czynnikami ryzyka zdarzeń dotyczących układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Produkt ten należy stosować możliwie jak najkrócej i w najmniejszej skutecznej dawce dobowej, ze względu na możliwość nasilenia ryzyka dotyczącego układu krążenia po zastosowaniu diklofenaku w dużych dawkach i długotrwale. Należy okresowo kontrolować konieczność kontynuacji leczenia objawowego i odpowiedź na leczenie. Reakcje skórne Bardzo rzadko, opisywano w związku ze stosowaniem NLPZ występowanie ciężkich reakcji skórnych niektórych ze skutkiem śmiertelnym, w tym złuszczającego zapalenia skóry, zespołu Stevensa-Johnsona i toksycznego martwiczego oddzielania się naskórka (patrz punkt 4.8). Wydaje się, że największe ryzyko wystąpienia tych reakcji występuje na początku leczenia: w większości przypadków początek takiej reakcji występuje w trakcie pierwszego miesiąca 3
4 leczenia. W razie wystąpienia pierwszych oznak wysypki skórnej, zmian na błonie śluzowej lub innych objawów nadwrażliwości, należy odstawić produkt leczniczy Dicloberl 50. Wpływ na wątrobę Przed podjęciem decyzji o rozpoczęciu stosowania diklofenaku u osób z zaburzeniami czynności wątroby należy zachować ostrożność gdyż może wystąpić u nich zaostrzenie choroby. Jeżeli produkt Dicloberl 50 ma być stosowany przez dłuższy czas lub wielokrotnie, zaleca się regularne kontrolowanie parametrów czynnościowych wątroby. Produkt Dicloberl 50 należy natychmiast odstawić w przypadku wystąpienia objawów zaburzeń czynności wątroby. Inne Dicloberl 50 można stosować dopiero po uważnym rozważeniu stosunku korzyści do ryzyka w: - w przypadku wrodzonych zaburzeń metabolizmu porfiryn (np. ostrej porfirii przerywanej), - w układowym toczniu rumieniowatym (SLE) i w mieszanej chorobie tkanki łącznej (patrz punkt 4.8). Dicloberl 50 można stosować tylko pod ścisłą kontrolą lekarza: - w zaburzeniach żołądka i jelit lub w przypadku zapalenia jelit (wrzodziejącego zapalenia jelita grubego, choroby Crohna) w wywiadzie; - w przypadku zwiększonego ciśnienia krwi lub łagodnej do umiarkowanej niewydolności serca; - w zaburzeniach czynności nerek; - w zaburzeniach czynności wątroby; - bezpośrednio po dużych zabiegach chirurgicznych; - u pacjentów z katarem siennym, polipami nosa lub przewlekłymi obturacyjnymi chorobami płuc, ponieważ u takich pacjentów istnieje zwiększone ryzyko wystąpienia reakcji alergicznych. Mogą one wystąpić w postaci napadów astmy (tak zwana astma aspirynowa), obrzęku naczynioruchowego (Quinckego) lub pokrzywki; - u pacjentów, u których występują reakcje alergiczne na inne substancje, gdyż istnieje u nich zwiększone ryzyko wystąpienia reakcji nadwrażliwości również po zastosowaniu produktu leczniczego Dicloberl 50. Bardzo rzadko mogą wystąpić ciężkie, ostre reakcje nadwrażliwości (np. wstrząs anafilaktyczny). Po wystąpieniu pierwszych objawów reakcji nadwrażliwości po podaniu produktu leczniczego Dicloberl 50 należy przerwać stosowanie leku. Należy wdrożyć odpowiednie leczenie objawowe. Diklofenak może okresowo hamować agregację płytek. Z tego powodu należy uważnie monitorować pacjentów z zaburzeniami krzepnięcia. Podobnie jak inne NLPZ, ze względu na swoje właściwości farmakokinetyczne, diklofenak może maskować objawy przedmiotowe i podmiotowe zakażenia. Jeśli objawy infekcji wystąpią lub ulegną nasileniu podczas stosowania produktu Dicloberl 50, pacjent powinien niezwłocznie skontaktować się z lekarzem. Należy sprawdzić, czy istnieje wskazanie do leczenia przeciwzakaźnego/przeciwbakteryjnego. Podczas długotrwałego podawania produktu leczniczego Dicloberl 50 wymagane jest regularne monitorowanie wskaźników czynności wątroby, czynności nerek i morfologii krwi. Jeśli leki przeciwbólowe są stosowane w dużych dawkach długotrwale, może wystąpić ból głowy, którego nie wolno leczyć zwiększając dawki tych leków. Nawykowe stosowanie leków przeciwbólowych, szczególnie połączeń kilku czynnych substancji o działaniu przeciwbólowym, może powodować nieodwracalne uszkodzenie nerek, związane z ryzykiem niewydolności nerek (nefropatia spowodowana lekami przeciwbólowymi). 4
5 W czasie stosowania leków z grupy NLPZ, do których należy Dicloberl 50, mogą wystąpić działania niepożądane szczególnie te dotyczące żołądka i jelit oraz ośrodkowego układu nerwowego (zmęczenie i zawroty głowy). Odnosi się to w większym stopniu do sytuacji stosowania leku i jednoczesnego spożywania alkoholu. W celu uzyskania informacji dotyczących wpływu na płodność kobiet patrz punkt Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Inne leki z grupy NLPZ, łącznie z pochodnymi kwasu salicylowego: Jednoczesne podawanie leków z grupy NLPZ z powodu działania synergistycznego może zwiększać ryzyko wystąpienia choroby wrzodowej żołądka i (lub) dwunastnicy oraz krwawienia. Z tego powodu jednoczesne stosowanie diklofenaku i innych leków z grupy NLPZ nie jest zalecane (patrz punkt 4.4). Digoksyna, fenytoina, lit: Jednoczesne stosowanie produktu leczniczego Dicloberl 50 i digoksyny, fenytoiny lub litu może zwiększać stężenie tych leków w osoczu. Konieczne jest monitorowanie stężenia litu w surowicy. Zalecane jest monitorowanie stężenia digoksyny lub fenytoiny w surowicy. Leki moczopędne, leki przeciwnadciśnieniowe łącznie z inhibitorami konwertazy angiotensyny (ACE) i antagonistami angiotensyny II: NLPZ mogą zmniejszać działanie leków moczopędnych i leków zmniejszających ciśnienie krwi. U pacjentów z zaburzeniami czynności nerek (np. pacjenci odwodnieni lub pacjenci w podeszłym wieku), jednoczesne podawanie inhibitora ACE lub antagonisty angiotensyny II z lekiem, który powoduje zahamowanie cyklooksygenazy może prowadzić do dalszego pogorszenia czynności nerek, łącznie z ciężką niewydolnością nerek, zwykle odwracalną. W związku z tym podane powyżej leki należy podawać ostrożnie, szczególnie u pacjentów w podeszłym wieku. Pacjentów należy poinformować o konieczności przyjmowania odpowiedniej ilości płynów. Należy regularnie kontrolować czynność nerek tych pacjentów po rozpoczęciu jednoczesnego stosowania tych leków. W wyniku jednoczesnego stosowania produktu leczniczego Dicloberl 50 oraz leków moczopędnych oszczędzających potas może wystąpić hiperkaliemia. Z tego powodu zaleca się monitorowanie stężenia potasu w surowicy podczas równoczesnego stosowania tych leków. Glukokortykosteroidy: Istnieje zwiększone ryzyko wystąpienia choroby wrzodowej żołądka i (lub) dwunastnicy oraz krwawienia (patrz punkt 4.4). Leki przeciwpłytkowe oraz selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI): Istnieje zwiększone ryzyko wystąpienia choroby wrzodowej żołądka i (lub) dwunastnicy oraz krwawienia (patrz punkt 4.4). Metotreksat: Podawanie produktu leczniczego Dicloberl 50 w ciągu 24 godzin przed lub po podaniu metotreksatu może zwiększać stężenie metotreksatu w surowicy i zwiększać jego działania toksyczne. Cyklosporyna: Niesteroidowe leki przeciwzapalne mogą zwiększać działanie nefrotoksyczne cyklosporyny i takrolimusu. Leki przeciwzakrzepowe: NLPZ mogą zwiększać działanie leków przeciwzakrzepowych, takich jak warfaryna (patrz punkt 4.4). 5
6 Leki z grupy sulfonylomocznika: Istnieją pojedyncze dane dotyczące zmiany stężenia glukozy we krwi po podaniu diklofenaku, która wiązała się z koniecznością modyfikacji dawki leku przeciwcukrzycowego. Dlatego w przypadku jednoczesnego leczenia tymi lekami zaleca się kontrolę stężenia glukozy we krwi jako środek ostrożności. Probenecyd i sulfinpyrazon: Produkty lecznicze, które zawierają probenecyd lub sulfinpyrazon mogą opóźniać wydalanie diklofenaku. 4.6 Wpływ na płodność, ciążę i laktację Stosowanie produktu leczniczego Dicloberl 50 może niekorzystnie wpływać na płodność kobiet i nie jest ono zalecane u kobiet, które planują zajście w ciążę. W przypadku kobiet, które mają trudności z zajściem w ciążę lub, które są poddawane badaniom w związku z niepłodnością, należy rozważyć zakończenie stosowania produktu leczniczego Dicloberl 50 (patrz również punkt 4.6). Ciąża Działanie hamujące syntezę prostaglandyn może mieć negatywny wpływ na przebieg ciąży i (lub) rozwój embrionu lub płodu. Dane z badań farmakoepidemiologicznych sugerują zwiększone ryzyko poronienia i zaburzeń budowy serca po zastosowaniu inhibitora syntezy prostaglandyn we wczesnej ciąży. Całkowite ryzyko powstania zaburzeń budowy serca zwiększa się od wartości mniejszej niż 1% do około 1,5%. Uważa się, iż ryzyko wzrasta wraz ze zwiększaniem dawki i czasu trwania leczenia. W badaniach na zwierzętach wykazano, że podawanie inhibitora syntezy prostaglandyn powodowało poronienie przed lub po zagnieżdżeniu się jaja płodowego oraz śmiertelność embrionu lub płodu. Dodatkowo u zwierząt, którym podawano inhibitory syntezy prostaglandyn w okresie organogenezy obserwowano zwiększoną częstość występowania różnych wad płodu włączając zaburzenia budowy układu sercowo-naczyniowego. Podczas pierwszego i drugiego trymestru ciąży diklofenak sodowy należy podawać tylko w przypadku zdecydowanej konieczności. Jeżeli diklofenak jest stosowany u kobiet planujących ciążę lub podczas pierwszego lub drugiego trymestru ciąży należy stosować możliwie najmniejszą dawkę przez możliwie najkrótszy okres. Podczas trzeciego trymestru ciąży inhibitory syntezy prostaglandyn mogą wywoływać u płodu: - działanie toksyczne na układ sercowo-naczyniowy i płuca (z przedwczesnym zamknięciem przewodu tętniczego i nadciśnieniem płucnym), - zaburzenia czynności nerek, które mogą prowadzić do niewydolności nerek z małowodziem, u kobiet i płodu pod koniec ciąży: - możliwość wydłużenia czasu krwawienia, działanie przeciwagregacyjne, które może wystąpić nawet po zastosowaniu małych dawek - hamowanie skurczów macicy może powodować opóźnianie lub przedłużanie porodu. W związku z powyższym przyjmowanie produktu leczniczego Dicloberl 50 w ostatnim trymestrze ciąży jest przeciwwskazane. Karmienie piersią Substancja czynna (diklofenak) i produkty jej metabolizmu w małych ilościach przenikają do mleka kobiet karmiących piersią. Ponieważ dotychczas nie stwierdzono szkodliwych skutków dla dziecka wynikających ze stosowania diklofenaku przez matkę, dlatego, podczas krótkotrwałego stosowania przerwanie karmienia piersią zazwyczaj nie jest konieczne. Jeśli zalecone jest 6
7 długotrwałe podawanie dużych dawek diklofenaku w leczeniu chorób reumatycznych, należy rozważyć wcześniejsze zakończenie karmienia piersią. Płodność Stosowanie produktu leczniczego Dicloberl 50 może niekorzystnie wpływać na płodność kobiet i nie jest ono zalecane u kobiet, które planują ciążę. W przypadku kobiet, które mają trudności z zajściem w ciążę lub, które są poddawane badaniom w związku z niepłodnością, należy rozważyć zakończenie stosowania produktu leczniczego Dicloberl Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Ponieważ w czasie stosowania dużych dawek produktu leczniczego Dicloberl 50 mogą wystąpić działania niepożądane dotyczące ośrodkowego układu nerwowego, takie jak zmęczenie i zawroty głowy, w pojedynczych przypadkach zdolność do kierowania pojazdami mechanicznymi i obsługiwania urządzeń mechanicznych w ruchu może być ograniczona. Odnosi się to zwłaszcza do sytuacji, kiedy lek jest przyjmowany w połączeniu z alkoholem. 4.8 Działania niepożądane Częstość występowania działań niepożądanych szacowano następująco: Bardzo często: Często: 10 % leczonych pacjentów < 10 %, ale 1 % leczonych pacjentów Niezbyt często: Rzadko: < 1 %, ale 0,1 % leczonych pacjentów < 0,1 %, ale 0,01 % leczonych pacjentów Bardzo rzadko: < 0,01 % leczonych pacjentów, częstość nieznana (nie może być określona na podstawie dostępnych danych). Występowanie następujących działań niepożądanych produktu leczniczego zależy przede wszystkim od zastosowanej dawki i różni się osobniczo. Najczęściej obserwowane działania niepożądane mają charakter zaburzeń żołądka i jelit. Może występować choroba wrzodowa żołądka i (lub) dwunastnicy, perforacja lub krwawienie z przewodu pokarmowego, czasami prowadzące do zgonu, szczególnie u osób w podeszłym wieku (patrz punkt 4.4). Zgłaszano występowanie nudności, wymiotów, biegunki, wzdęć, zaparć, niestrawności, bólów brzucha, smolistych stolców, krwawych wymiotów, wrzodziejącego zapalenia jamy ustnej, zaostrzenia zapalenia jelita grubego i choroby Crohna (patrz punkt 4.4) po podaniu produktu leczniczego. Rzadziej obserwowano zapalenie błony śluzowej żołądka. Szczególnie ryzyko występowania krwawienia z przewodu pokarmowego zależy od wielkości zastosowanej dawki i czasu trwania leczenia. Opisywano występowanie obrzęków, nadciśnienia i niewydolności serca związane z leczeniem NLPZ. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg na dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np. zawał serca lub udar) (patrz punkty 4.3 Przeciwwskazania i 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Zaburzenia serca Bardzo rzadko: kołatanie serca, obrzęki, niewydolność serca, zawał serca. Zaburzenia krwi i układu chłonnego Bardzo rzadko: zaburzenia krwiotworzenia (niedokrwistość, leukopenia, małopłytkowość, niedokrwistość aplastyczna, agranulocytoza,), niedokrwistość hemolityczna. Pierwszymi 7
8 objawami tych zaburzeń może być gorączka, ból gardła, nadżerki w jamie ustnej, dolegliwości grypopodobne, znaczne zmęczenie, krwawienia z nosa i krwawienia ze skóry. Podczas długotrwałego stosowania produktu leczniczego należy w regularnych odstępach czasu kontrolować wskaźniki morfologii krwi. Zaburzenia układu nerwowego Często: zaburzenia ośrodkowego układu nerwowego, takie jak ból głowy, zawroty głowy, uczucie oszołomienia, zamroczenia(pustki w głowie), pobudzenie, drażliwość lub zmęczenie. Bardzo rzadko: zaburzenia czucia, zaburzenia smaku, zaburzenia pamięci, dezorientacja, drgawki, drżenie. Zaburzenia oka Bardzo rzadko: zaburzenia widzenia (niewyraźne i podwójne widzenie). Zaburzenia ucha i błędnika Bardzo rzadko: szumy uszne, przejściowe zaburzenia słuchu. Zaburzenia żołądka i jelit Bardzo często: dolegliwości żołądkowo-jelitowe, takie jak nudności, wymioty i biegunka jak również niewielka utrata krwi z przewodu pokarmowego, która w wyjątkowych przypadkach może powodować niedokrwistość. Często: niestrawność, wzdęcia, skurcze żołądka, bóle brzucha jak również choroba wrzodowa żołądka lub dwunastnicy (z ryzykiem wystąpienia krwawienia lub perforacji). Miejscowe podrażnienia, wydalanie śluzu z krwią lub bolesna defekacja mogą często występować po podaniu czopków. Niezbyt często: krwawe wymioty, smoliste stolce lub krwawe biegunki. Bardzo rzadko: zapalenie jamy ustnej, zapalenie języka, uszkodzenie przełyku, zaostrzenia zapalenia jelita grubego lub choroby Crohna, zaparcia, zapalenie trzustki. Należy poinstruować pacjenta, aby w przypadku wystąpienia ostrego bólu w górnej części brzucha lub smołowatych stolców lub krwawych wymiotów odstawił lek i natychmiast udał się do lekarza. Zaburzenia nerek i dróg moczowych Niezbyt często: obrzęki, szczególnie u pacjentów z nadciśnieniem tętniczym lub niewydolnością nerek. Bardzo rzadko: uszkodzenie nerek (śródmiąższowe zapalenie nerek, martwica brodawek), której może towarzyszyć ostra niewydolność nerek, białkomocz i (lub) krwiomocz. Zespół nerczycowy. Z tego powodu należy w regularnych odstępach czasu kontrolować czynność nerek. Zaburzenia skóry i tkanki podskórnej Niezbyt często: łysienie Bardzo rzadko: wysypka pęcherzowa, wyprysk, rumień, nadwrażliwość na światło, plamica (także plamica alergiczna) i ciężkie postacie reakcji skórnych łącznie z zespołem Stevensa- Johnsona oraz toksycznym martwiczym oddzielaniem się naskórka. Zakażenia i zarażenia pasożytnicze Bardzo rzadko opisywano zaostrzenie zapaleń wywołanych zakażeniem (np. rozwój martwiczego zapalenia powięzi) w relacji czasowej z układowym zastosowaniem NLPZ. Istnieje możliwy związek tych zaburzeń z mechanizmem działania NLPZ. 8
9 W przypadku wystąpienia objawów zakażenia i ich nasilenia w trakcie stosowania leku Dicloberl 50, pacjent powinien niezwłocznie zgłosić się do lekarza. Należy ustalić, czy istnieją wskazania do leczenia przeciwinfekcyjnego/antybiotykoterapii. Bardzo rzadko po podaniu diklofenaku obserwowano objawy jałowego zapalenia opon mózgowych tj. sztywność karku, ból głowy, nudności, wymioty, gorączkę lub zaburzenia przytomności. Wydaje się, iż pacjenci z chorobami autoimmunologicznymi (SLE, mieszane choroby tkanki łącznej) są predysponowani. Zaburzenia naczyniowe Bardzo rzadko: nadciśnienie Zaburzenia układu immunologicznego Często: reakcje nadwrażliwości takie jak wysypka i świąd. Niezbyt często: pokrzywka. Należy poinformować pacjenta, aby w takim przypadku natychmiast skonsultował się z lekarzem i odstawił lek. Bardzo rzadko: ogólne reakcje nadwrażliwości: obrzęk twarzy, języka i krtani, ze zwężeniem dróg oddechowych, dusznością, przyspieszonym biciem serca, nagłe zmniejszenie ciśnienia krwi aż do zagrażającego życiu wstrząsu. W przypadku wystąpienia jednego z tych objawów, co może się zdarzyć nawet po jednorazowym zastosowaniu produktu leczniczego, niezbędna jest natychmiastowa pomoc lekarska. Bardzo rzadko: alergiczne zapalenie naczyń i zapalenie płuc. Zaburzenia wątroby i dróg żółciowych Często: zwiększenie aktywności aminotransferaz w surowicy. Niezbyt często: uszkodzenie wątroby, szczególnie podczas długoterminowego leczenia, ostre zapalenie wątroby z lub bez żółtaczki (bardzo rzadko mające piorunujący przebieg, nawet bez objawów prodromalnych). Z tego powodu, podczas długotrwałego stosowania, należy w regularnych odstępach czasu kontrolować parametry wątrobowe. Zaburzenia psychiczne Bardzo rzadko: reakcje psychotyczne, depresja, niepokój, koszmary nocne. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C Warszawa Tel.: Faks: ndl@urpl.gov.pl. 4.9 Przedawkowanie 9
10 Objawy przedawkowania Objawami przedawkowania mogą być zaburzenia ośrodkowego układu nerwowego np.: bóle głowy, zawroty głowy i utrata przytomności (u dzieci także drgawki miokloniczne), jak również bóle brzucha, nudności, wymioty. Dodatkowo może wystąpić krwawienie z przewodu pokarmowego oraz zaburzenia czynności wątroby i nerek. Może wystąpić nagłe zmniejszenie ciśnienia krwi, depresja oddechowa i sinica. Postępowanie lecznicze w przypadku przedawkowania Nie istnieje swoiste antidotum i wskazane jest leczenie objawowe. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Niesteroidowe leki przeciwzapalne i przeciwreumatyczne Pochodne kwasu octowego i podobne substancje, Diklofenak Kod ATC: M01AB05 Diklofenak jest niesteroidowym lekiem przeciwzapalnym, który hamuje syntezę prostaglandyn, co wykazano w standardowych modelach doświadczalnych zapalenia u zwierząt. U ludzi diklofenak zmniejsza ból związany z zapaleniem, obrzęk i gorączkę. Diklofenak hamuje także agregację płytek wywołaną ADP i kolagenem. 5.2 Właściwości farmakokinetyczne Po podaniu doustnym standardowych postaci leku opornych na działanie soku żołądkowego, diklofenak wchłania się całkowicie w dalszej części żołądka. W zależności od szybkości opróżniania żołądka, maksymalne stężenie produktu leczniczego w osoczu występuje po 1 do 16 godzinach, średnio po 2 do 3 godzinach. Po podaniu domięśniowym, maksymalne stężenie leku w osoczu występuje po 10 do 20 minut, a po około 30 minutach w przypadku podania doodbytniczego. Podany doustnie diklofenak podlega intensywnemu efektowi pierwszego przejścia i tylko 35 70% wchłoniętej substancji czynnej przechodzi do krążenia pozawątrobowego w postaci niezmienionej. Około 30% substancji czynnej jest wydalane w postaci metabolitów z kałem. Po zmetabolizowaniu w wątrobie (hydroksylacja i sprzęganie) około 70% dawki jest wydalane przez nerki w postaci farmakologicznie nieaktywnych metabolitów. Okres półtrwania w fazie eliminacji leku jest w dużym stopniu niezależny od czynności wątroby i nerek, i wynosi około 2 godziny. Wiązanie z białkami osocza wynosi około 99%. 5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne uzyskane na podstawie badań toksyczności ostrej i po podaniu wielokrotnym jak również badań genotoksyczności, mutagenności i rakotwórczości z zastosowaniem diklofenaku w dawkach terapeutycznych nie wykazały szczególnego zagrożenia dla człowieka poza ryzykiem opisanym w rozdziałach niniejszej charakterystyki. Przewlekła toksyczność diklofenaku wykazana w badaniach na zwierzętach dotyczyła głównie uszkodzeń i owrzodzeń przewodu pokarmowego. W 2-letnim badaniu toksyczności u szczurów, którym podawano diklofenak wykazano zależne od dawki nasilenie zwężenia naczyń wieńcowych w wyniku zmian zakrzepowych. W doświadczalnych badaniach na zwierzętach, diklofenak powodował hamowanie owulacji u królików, jak również zaburzenia zagnieżdżenia się i wczesnego rozwoju embrionu u szczurów. Diklofenak wydłużał czas trwania ciąży i czas trwania porodu. Embriotoksyczne działanie diklofenaku badano u trzech gatunków zwierząt (szczurów, myszy, królików). Śmierć płodu i opóźnienie wzrastania występowały po podaniu dawek toksycznych 10
11 także dla matek. Dostępne dane wskazują na brak teratogennego działania diklofenaku. Dawki mniejsze od dawek toksycznych dla matek nie miały wpływu na rozwój potomstwa po urodzeniu. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Propylu galusan (ph. Eur), etanol 96%, skrobia kukurydziana, tłuszcz stały (Witepsol H 15 ). 6.2 Niezgodności farmaceutyczne Nieznane. 6.3 Okres ważności 3 lata. Nie należy stosować produktu leczniczego po upływie terminu ważności podanego na opakowaniu. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25 C. 6.5 Rodzaj i zawartość opakowania Prawie białe do lekko żółtych, podłużne czopki w blistrach z nieprzezroczystej folii kompozytowej PCW (PE) z wytłoczonym numerem serii. Opakowanie zawiera 5 lub 10 czopków. 6.6 Szczególne środki ostrożności dotyczące usuwania Brak szczególnych wymagań. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU BERLIN-CHEMIE AG Glienicker Weg Berlin, Niemcy 8. NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU R/ DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU /DATA PRZEDŁUŻENIA POZWOLENIA / DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO 11
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS III 1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 4. SZCZEGÓŁOWE DANE KLINICZNE 4. l Wskazania do stosowania Leczenie ostrego bólu (patrz punkt 4.2) Leczenie objawowe dolegliwości bólowych w przebiegu choroby
ANEKS III 1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 4. SZCZEGÓŁOWE DANE KLINICZNE 4. l Wskazania do stosowania Leczenie ostrego bólu (patrz punkt 4.2) Leczenie objawowe dolegliwości bólowych w przebiegu choroby
Producent P.P.F. HASCO-LEK S.A nie prowadził badań klinicznych mających na celu określenie skuteczności produktów leczniczych z ambroksolem.
 VI.2 Podsumowanie danych o bezpieczeństwie stosowania produktów leczniczych z ambroksolem VI.2.1 Omówienie rozpowszechnienia choroby Wskazania do stosowania: Ostre i przewlekłe choroby płuc i oskrzeli
VI.2 Podsumowanie danych o bezpieczeństwie stosowania produktów leczniczych z ambroksolem VI.2.1 Omówienie rozpowszechnienia choroby Wskazania do stosowania: Ostre i przewlekłe choroby płuc i oskrzeli
Ulotka dla pacjenta. NUROFEN, żel, 50 mg/g (Ibuprofenum)
 Ulotka dla pacjenta Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest dostępny bez recepty, aby można było leczyć niektóre schorzenia bez pomocy lekarza.
Ulotka dla pacjenta Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest dostępny bez recepty, aby można było leczyć niektóre schorzenia bez pomocy lekarza.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diprosone, 0,64 mg/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy gram maści zawiera 0,64 mg betametazonu dipropionianu (Betamethasoni
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diprosone, 0,64 mg/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy gram maści zawiera 0,64 mg betametazonu dipropionianu (Betamethasoni
Aspicam, 7,5 mg Aspicam, 15 mg
 ULOTKA DLA PACJENTA ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Aspicam, 7,5 mg Aspicam, 15 mg Meloxicamum tabletki Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować
ULOTKA DLA PACJENTA ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Aspicam, 7,5 mg Aspicam, 15 mg Meloxicamum tabletki Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować
Ulotka dołączona do opakowania: informacja dla użytkownika. Nurofen dla dzieci, 125 mg, czopki (Ibuprofenum)
 Ulotka dołączona do opakowania: informacja dla użytkownika Nurofen dla dzieci, 125 mg, czopki (Ibuprofenum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika Nurofen dla dzieci, 125 mg, czopki (Ibuprofenum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Butamid, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu (Butamirati citras). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Butamid, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu (Butamirati citras). Substancja
Ulotka dla pacjenta. KETOTIFEN WZF (Ketotifenum) 1 mg/5 ml, syrop
 Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. Należy zwrócić się do lekarza lub farmaceuty,
Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. Należy zwrócić się do lekarza lub farmaceuty,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Theraflu Kaszel; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Theraflu Kaszel; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras).
Ulotka dla pacjenta: informacja dla użytkownika. Septolete ultra, (1,5 mg + 5 mg)/ml, aerozol do stosowania w jamie ustnej, roztwór
 Ulotka dla pacjenta: informacja dla użytkownika Septolete ultra, (1,5 mg + 5 mg)/ml, aerozol do stosowania w jamie ustnej, roztwór Benzydamini hydrochloridum + Cetylpyridinii chloridum Należy przeczytać
Ulotka dla pacjenta: informacja dla użytkownika Septolete ultra, (1,5 mg + 5 mg)/ml, aerozol do stosowania w jamie ustnej, roztwór Benzydamini hydrochloridum + Cetylpyridinii chloridum Należy przeczytać
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Mucosolvan inhalacje, 15 mg/2 ml, płyn do inhalacji z nebulizatora Ambroxoli hydrochloridum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Mucosolvan inhalacje, 15 mg/2 ml, płyn do inhalacji z nebulizatora Ambroxoli hydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Mucosolvan inhalacje, 15 mg/2 ml, płyn do inhalacji z nebulizatora Ambroxoli hydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
Ulotka dołączona do opakowania: informacja dla pacjenta. IBUM FORTE 400 mg, kapsułki miękkie. (Ibuprofenum)
 Ulotka dołączona do opakowania: informacja dla pacjenta IBUM FORTE 400 mg, kapsułki miękkie (Ibuprofenum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta IBUM FORTE 400 mg, kapsułki miękkie (Ibuprofenum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancja pomocnicza: rycynooleinian makrogologlicerolu 50 mg/ml
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DICLOABAK, 1 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Diklofenak sodowy 1 mg/ml Substancja pomocnicza: rycynooleinian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DICLOABAK, 1 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Diklofenak sodowy 1 mg/ml Substancja pomocnicza: rycynooleinian
SERACTIL, 200 mg, tabletki powlekane
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA SERACTIL, 200 mg, tabletki powlekane Dexibuprofenum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Lek ten jest
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA SERACTIL, 200 mg, tabletki powlekane Dexibuprofenum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Lek ten jest
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Pragiola przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Pragiola przeznaczone do publicznej wiadomości Ze względu na zachowanie pełnej informacji, w nawiązaniu do art. 11 Dyrektywy
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Pragiola przeznaczone do publicznej wiadomości Ze względu na zachowanie pełnej informacji, w nawiązaniu do art. 11 Dyrektywy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 5 ml syropu zawiera 4 mg bromoheksyny chlorowodorku (Bromhexini hydrochloridum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamina o smaku malinowym, 4 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 4 mg bromoheksyny chlorowodorku (Bromhexini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamina o smaku malinowym, 4 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 4 mg bromoheksyny chlorowodorku (Bromhexini
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Olfen UNO, 150 mg, tabletki o zmodyfikowanym uwalnianiu Diclofenacum natricum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Olfen UNO, 150 mg, tabletki o zmodyfikowanym uwalnianiu Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Olfen UNO, 150 mg, tabletki o zmodyfikowanym uwalnianiu Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IBUPROFEN POLFARMEX, 200 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 200 mg ibuprofenu (Ibuprofenum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IBUPROFEN POLFARMEX, 200 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 200 mg ibuprofenu (Ibuprofenum).
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Dicloratio retard 100, 100 mg, kapsułki o przedłużonym uwalnianiu. Diclofenacum natricum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Dicloratio retard 100, 100 mg, kapsułki o przedłużonym uwalnianiu Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. -
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Dicloratio retard 100, 100 mg, kapsułki o przedłużonym uwalnianiu Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. -
Ulotka dla pacjenta MEPIVASTESIN. (Mepivacaini hydrochloridum) 30 mg/ml, roztwór do wstrzykiwań.
 ULOTKA DLA PACJENTA Ulotka dla pacjenta Należy uważnie zapoznać się z treścią ulotki przed rozpoczęciem stosowania leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. -
ULOTKA DLA PACJENTA Ulotka dla pacjenta Należy uważnie zapoznać się z treścią ulotki przed rozpoczęciem stosowania leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. -
Ulotka dla pacjenta. CARDIOFIL (Acidum acetylsalicylicum + Magnesii oxidum leve) 100 mg + 11,2 mg; tabletki
 Ulotka dla pacjenta Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest dostępny bez recepty, aby można było leczyć niektóre schorzenia bez pomocy lekarza.
Ulotka dla pacjenta Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest dostępny bez recepty, aby można było leczyć niektóre schorzenia bez pomocy lekarza.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Esberitox N, 0,215 ml/tabletkę, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera: 0,215 ml alkoholowo-wodnego wyciągu (1:11)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Esberitox N, 0,215 ml/tabletkę, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera: 0,215 ml alkoholowo-wodnego wyciągu (1:11)
Część VI: Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego
 Część VI: Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego VI.1 Elementy dla tabel podsumowujących w Europejskim Publicznym Sprawozdaniu Oceniającym VI.1.1 Tabela podsumowująca
Część VI: Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego VI.1 Elementy dla tabel podsumowujących w Europejskim Publicznym Sprawozdaniu Oceniającym VI.1.1 Tabela podsumowująca
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Halidor, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Halidor, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 100 mg bencyklanu fumaranu (Bencyclani fumaras). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Halidor, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 100 mg bencyklanu fumaranu (Bencyclani fumaras). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Duspatalin, 135 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 135 mg mebeweryny chlorowodorku (Mebeverini hydrochloridum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Duspatalin, 135 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 135 mg mebeweryny chlorowodorku (Mebeverini hydrochloridum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancja pomocnicza o znanym działaniu: 81,5 mg laktozy (w postaci laktozy jednowodnej).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MeloxiLEK 15, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 15 mg meloksykamu (Meloxicamum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO MeloxiLEK 15, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 15 mg meloksykamu (Meloxicamum). Substancja pomocnicza
Milifen zaw.doust. 0,1g/5ml 100ml
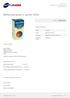 Milifen zaw.doust. 0,1g/5ml 100ml Cena: 7,90 PLN Opis słownikowy Dawka Postać Producent Substancja czynna 0,1 g/5ml zawiesina doustna PINEWOOD LABORATORIES LTD Ibuprofenum Opis produktu Nazwa: Milifen
Milifen zaw.doust. 0,1g/5ml 100ml Cena: 7,90 PLN Opis słownikowy Dawka Postać Producent Substancja czynna 0,1 g/5ml zawiesina doustna PINEWOOD LABORATORIES LTD Ibuprofenum Opis produktu Nazwa: Milifen
Grupa SuperTaniaApteka.pl Utworzono : 23 czerwiec 2016
 SERCE I UKŁAD KRĄŻENIA > Model : 8217012 Producent : - POLIXAR 10 NA WYSOKI CHOLESTEROL Preparat przeznaczony dla osób pragnących zmniejszyć ryzyko podwyższenia poziomu cholesterolu we krwi. POLIXAR 5
SERCE I UKŁAD KRĄŻENIA > Model : 8217012 Producent : - POLIXAR 10 NA WYSOKI CHOLESTEROL Preparat przeznaczony dla osób pragnących zmniejszyć ryzyko podwyższenia poziomu cholesterolu we krwi. POLIXAR 5
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lormed 15, tabletki 15 mg 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 15 mg meloksykamu (Meloxicamum). Substancja pomocnicza:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lormed 15, tabletki 15 mg 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 15 mg meloksykamu (Meloxicamum). Substancja pomocnicza:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Viru-POS, 30 mg/g, maść do oczu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g maści zawiera 30 mg acyklowiru (Aciclovirum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Viru-POS, 30 mg/g, maść do oczu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g maści zawiera 30 mg acyklowiru (Aciclovirum) Pełny wykaz substancji
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. IBUPROFEN FORTE DOZ, 400 mg, tabletki powlekane Ibuprofenum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA IBUPROFEN FORTE DOZ, 400 mg, tabletki powlekane Ibuprofenum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Lek
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA IBUPROFEN FORTE DOZ, 400 mg, tabletki powlekane Ibuprofenum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Lek
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Carbo medicinalis MF, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 250 mg węgla aktywnego (Carbo activatus). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Carbo medicinalis MF, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 250 mg węgla aktywnego (Carbo activatus). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna tabletka powlekana zawiera: 400 mg deksibuprofenu (Dexibuprofenum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO SERACTIL, 400 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera: 400 mg deksibuprofenu (Dexibuprofenum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO SERACTIL, 400 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera: 400 mg deksibuprofenu (Dexibuprofenum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DISULFIRAM WZF, 100 mg, tabletki do implantacji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do implantacji zawiera 100 mg disulfiramu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DISULFIRAM WZF, 100 mg, tabletki do implantacji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do implantacji zawiera 100 mg disulfiramu
APAp dla dzieci w zawiesinie
 APAp dla dzieci w zawiesinie Paracetamol usp to skuteczny, wysokiej jakości lek o działaniu: II II przeciwgorączkowym przeciwbólowym Walory smakowe w przypadku leku dla dzieci są równie ważne jak skuteczność
APAp dla dzieci w zawiesinie Paracetamol usp to skuteczny, wysokiej jakości lek o działaniu: II II przeciwgorączkowym przeciwbólowym Walory smakowe w przypadku leku dla dzieci są równie ważne jak skuteczność
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Ybersigax, 150 mg, tabletki powlekane Ybersigax, 300 mg, tabletki powlekane Irbesartanum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Ybersigax, 150 mg, tabletki powlekane Ybersigax, 300 mg, tabletki powlekane Irbesartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Ybersigax, 150 mg, tabletki powlekane Ybersigax, 300 mg, tabletki powlekane Irbesartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKU LECZNICZEGO Binabic, 50 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 50 mg bikalutamidu (Bicalutamidum). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKU LECZNICZEGO Binabic, 50 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 50 mg bikalutamidu (Bicalutamidum). Substancje
Ulotka dołączona do opakowania: informacja dla pacjenta. Telmix 80 mg, tabletki. Telmisartanum
 Ulotka dołączona do opakowania: informacja dla pacjenta Telmix 80 mg, tabletki Telmisartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Ulotka dołączona do opakowania: informacja dla pacjenta Telmix 80 mg, tabletki Telmisartanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
PROCEDURA OCENY RYZYKA ZAWODOWEGO. w Urzędzie Gminy Mściwojów
 I. Postanowienia ogólne 1.Cel PROCEDURA OCENY RYZYKA ZAWODOWEGO w Urzędzie Gminy Mściwojów Przeprowadzenie oceny ryzyka zawodowego ma na celu: Załącznik A Zarządzenia oceny ryzyka zawodowego monitorowanie
I. Postanowienia ogólne 1.Cel PROCEDURA OCENY RYZYKA ZAWODOWEGO w Urzędzie Gminy Mściwojów Przeprowadzenie oceny ryzyka zawodowego ma na celu: Załącznik A Zarządzenia oceny ryzyka zawodowego monitorowanie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Dicloziaja, 11,6 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram Dicloziaja zawiera 11,6 mg diklofenaku dietyloamoniowego (Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Dicloziaja, 11,6 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram Dicloziaja zawiera 11,6 mg diklofenaku dietyloamoniowego (Diclofenacum
Ulotka dołączona do opakowania: informacja dla pacjenta. Olfen 100 SR, 100 mg, kapsułki o przedłużonym uwalnianiu. Diclofenacum natricum
 Ulotka dołączona do opakowania: informacja dla pacjenta Olfen 100 SR, 100 mg, kapsułki o przedłużonym uwalnianiu Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta Olfen 100 SR, 100 mg, kapsułki o przedłużonym uwalnianiu Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta. FLUNARIZINUM WZF, 5 mg, tabletki. Flunarizinum
 Ulotka dołączona do opakowania: informacja dla pacjenta FLUNARIZINUM WZF, 5 mg, tabletki Flunarizinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta FLUNARIZINUM WZF, 5 mg, tabletki Flunarizinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta. Transpulmin S, (10 g + 3 g)/100 g, krem Eucalypti aetheroleum + Pini aetheroleum
 Ulotka dołączona do opakowania: informacja dla pacjenta Transpulmin S, (10 g + 3 g)/100 g, krem Eucalypti aetheroleum + Pini aetheroleum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta Transpulmin S, (10 g + 3 g)/100 g, krem Eucalypti aetheroleum + Pini aetheroleum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Młodzieńcze spondyloartropatie/zapalenie stawów z towarzyszącym zapaleniem przyczepów ścięgnistych (mspa-era)
 www.printo.it/pediatric-rheumatology/pl/intro Młodzieńcze spondyloartropatie/zapalenie stawów z towarzyszącym zapaleniem przyczepów ścięgnistych (mspa-era) Wersja 2016 1. CZYM SĄ MŁODZIEŃCZE SPONDYLOARTROPATIE/MŁODZIEŃCZE
www.printo.it/pediatric-rheumatology/pl/intro Młodzieńcze spondyloartropatie/zapalenie stawów z towarzyszącym zapaleniem przyczepów ścięgnistych (mspa-era) Wersja 2016 1. CZYM SĄ MŁODZIEŃCZE SPONDYLOARTROPATIE/MŁODZIEŃCZE
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Hylosept 20 mg/g, krem Acidum fusidicum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Hylosept 20 mg/g, krem Acidum fusidicum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Hylosept 20 mg/g, krem Acidum fusidicum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
Ulotka dołączona do opakowania: informacja dla pacjenta. ETOPIRYNA tabletki od bólu głowy (300 mg + 100 mg + 50 mg), tabletki
 Ulotka dołączona do opakowania: informacja dla pacjenta ETOPIRYNA tabletki od bólu głowy (300 mg + 100 mg + 50 mg), tabletki Acidum acetylsalicylicum + Ethenzamidum + Coffeinum Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla pacjenta ETOPIRYNA tabletki od bólu głowy (300 mg + 100 mg + 50 mg), tabletki Acidum acetylsalicylicum + Ethenzamidum + Coffeinum Należy uważnie zapoznać
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ranigast Fast 150 mg, tabletki musujące 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera: 150 mg ranitydyny (Ranitidinum) w postaci
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ranigast Fast 150 mg, tabletki musujące 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera: 150 mg ranitydyny (Ranitidinum) w postaci
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Ebrantil 25 5 mg/ml roztwór do wstrzykiwań (Urapidilum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Ebrantil 25 5 mg/ml roztwór do wstrzykiwań (Urapidilum) Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Ebrantil 25 5 mg/ml roztwór do wstrzykiwań (Urapidilum) Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Montespir 10 mg, tabletki powlekane Montelukastum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Montespir 10 mg, tabletki powlekane Montelukastum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Montespir 10 mg, tabletki powlekane Montelukastum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ferric polymaltose Medana, 50 mg Fe(III)/ ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml kropli zawiera 50 mg żelaza(iii)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ferric polymaltose Medana, 50 mg Fe(III)/ ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml kropli zawiera 50 mg żelaza(iii)
1. NAZWA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 3. POSTAĆ FARMACEUTYCZNA 4. SZCZEGÓLOWE DANE KLINICZNE. 4.1 Wskazania do stosowania
 1. NAZWA PRODUKTU LECZNICZEGO Xefo Rapid 8 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 8 mg lomoksykamu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
1. NAZWA PRODUKTU LECZNICZEGO Xefo Rapid 8 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 8 mg lomoksykamu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Ulotka dołączona do opakowania: informacja dla użytkownika. Gastranin Zdrovit, 150 mg, tabletki musujące Ranitidinum
 Ulotka dołączona do opakowania: informacja dla użytkownika Gastranin Zdrovit, 150 mg, tabletki musujące Ranitidinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika Gastranin Zdrovit, 150 mg, tabletki musujące Ranitidinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Ibuprofen Teva 100 mg/5 ml, syrop Ibuprofenum. Dla dzieci od 7 kg (6 miesięcy) do 29 kg (9 lat)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Ibuprofen Teva 100 mg/5 ml, syrop Ibuprofenum Dla dzieci od 7 kg (6 miesięcy) do 29 kg (9 lat) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Ibuprofen Teva 100 mg/5 ml, syrop Ibuprofenum Dla dzieci od 7 kg (6 miesięcy) do 29 kg (9 lat) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Deca-Durabolin, 50 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna ampułka z 1 ml roztworu zawiera 50 mg/ml dekanianu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Deca-Durabolin, 50 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna ampułka z 1 ml roztworu zawiera 50 mg/ml dekanianu
KWALIFIKACJA I WERYFIKACJA LECZENIA DOUSTNEGO STANÓW NADMIARU ŻELAZA W ORGANIZMIE
 Opis świadczenia KWALIFIKACJA I WERYFIKACJA LECZENIA DOUSTNEGO STANÓW NADMIARU ŻELAZA W ORGANIZMIE 1. Charakterystyka świadczenia 1.1 nazwa świadczenia Kwalifikacja i weryfikacja leczenia doustnego stanów
Opis świadczenia KWALIFIKACJA I WERYFIKACJA LECZENIA DOUSTNEGO STANÓW NADMIARU ŻELAZA W ORGANIZMIE 1. Charakterystyka świadczenia 1.1 nazwa świadczenia Kwalifikacja i weryfikacja leczenia doustnego stanów
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA. Imodium Instant, 2 mg, tabletki (liofilizat doustny) Loperamidi hydrochloridum
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Imodium Instant, 2 mg, tabletki (liofilizat doustny) Loperamidi hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Imodium Instant, 2 mg, tabletki (liofilizat doustny) Loperamidi hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Paracetamol Biofarm, 500 mg, tabletka 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 500 mg paracetamolu (Paracetamolum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Paracetamol Biofarm, 500 mg, tabletka 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 500 mg paracetamolu (Paracetamolum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aclotin, 250 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 250 mg tyklopidyny chlorowodorku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aclotin, 250 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 250 mg tyklopidyny chlorowodorku
ULOTKA DLA PACJENTA: INFORMACJA DLA UśYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UśYTKOWNIKA Montessan 4 mg, tabletki do rozgryzania i Ŝucia 5 mg, tabletki do rozgryzania i Ŝucia 10 mg, tabletki powlekane Montelukastum NaleŜy zapoznać się z treścią
ULOTKA DLA PACJENTA: INFORMACJA DLA UśYTKOWNIKA Montessan 4 mg, tabletki do rozgryzania i Ŝucia 5 mg, tabletki do rozgryzania i Ŝucia 10 mg, tabletki powlekane Montelukastum NaleŜy zapoznać się z treścią
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Mukambro, 10 mg/dawkę, roztwór doustny Ambroxoli hydrochloridum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Mukambro, 10 mg/dawkę, roztwór doustny Ambroxoli hydrochloridum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta.
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Mukambro, 10 mg/dawkę, roztwór doustny Ambroxoli hydrochloridum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta.
Ulotka dołączona do opakowania: informacja dla użytkownika. Synagis 50 mg proszek i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań Paliwizumab
 Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 50 mg proszek i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań Paliwizumab Należy uważnie zapoznać się z treścią ulotki przed
Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 50 mg proszek i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań Paliwizumab Należy uważnie zapoznać się z treścią ulotki przed
Parafina ciekła - Avena
 Oznakowanie opakowania bezpośredniego (butelka PE, 500 g) Opakowanie przeznaczone do stosowania w lecznictwie zamkniętym Parafina ciekła - Avena Paraffinum liquidum Płyn doustny i na skórę, 1g/ 1g Zawartość
Oznakowanie opakowania bezpośredniego (butelka PE, 500 g) Opakowanie przeznaczone do stosowania w lecznictwie zamkniętym Parafina ciekła - Avena Paraffinum liquidum Płyn doustny i na skórę, 1g/ 1g Zawartość
Ulotka dołączona do opakowania: informacja dla pacjenta. ACARD 150 mg tabletki dojelitowe Acidum acetylsalicylicum
 Ulotka dołączona do opakowania: informacja dla pacjenta ACARD 150 mg tabletki dojelitowe Acidum acetylsalicylicum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta ACARD 150 mg tabletki dojelitowe Acidum acetylsalicylicum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka zawiera 2 mg loperamidu chlorowodorku i symetykon w ilości odpowiadającej 125 mg dimetykonu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lositala, 2 mg + 125 mg, tabletki 2. SKŁAD JAKOŚCIOWY i LOŚCIOWY Każda tabletka zawiera 2 mg loperamidu chlorowodorku i symetykon w ilości
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lositala, 2 mg + 125 mg, tabletki 2. SKŁAD JAKOŚCIOWY i LOŚCIOWY Każda tabletka zawiera 2 mg loperamidu chlorowodorku i symetykon w ilości
Plamica Schönleina-Henocha
 www.printo.it/pediatric-rheumatology/pl/intro Plamica Schönleina-Henocha Wersja 2016 1. CO TO JEST PLAMICA SCHÖNLEINA-HENOCHA 1.1 Co to jest? Plamica Schönleina-Henocha (PSH) jest chorobą, w której występuje
www.printo.it/pediatric-rheumatology/pl/intro Plamica Schönleina-Henocha Wersja 2016 1. CO TO JEST PLAMICA SCHÖNLEINA-HENOCHA 1.1 Co to jest? Plamica Schönleina-Henocha (PSH) jest chorobą, w której występuje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 tabletka zawiera 75 mikrogramów klonidyny chlorowodorku (Clonidini hydrochloridum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IPOREL, 75 mikrogramów, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 75 mikrogramów klonidyny chlorowodorku (Clonidini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IPOREL, 75 mikrogramów, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 75 mikrogramów klonidyny chlorowodorku (Clonidini
Ulotka dołączona do opakowania: informacja dla pacjenta. AROMEK 2,5 mg, tabletki powlekane. Letrozolum
 Ulotka dołączona do opakowania: informacja dla pacjenta AROMEK 2,5 mg, tabletki powlekane Letrozolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta AROMEK 2,5 mg, tabletki powlekane Letrozolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dla pacjenta. GRIPPOKAPS 250 mg + 30 mg, kapsułki miękkie (Paracetamolum + Pseudoephedrini hydrochloridum)
 Ulotka dla pacjenta Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest dostępny bez recepty, aby można było leczyć niektóre schorzenia bez pomocy lekarza.
Ulotka dla pacjenta Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest dostępny bez recepty, aby można było leczyć niektóre schorzenia bez pomocy lekarza.
Koszty obciążenia społeczeństwa. Ewa Oćwieja Marta Ryczko Koło Naukowe Ekonomiki Zdrowia IZP UJ CM 2012
 Koszty obciążenia społeczeństwa chorobami układu krążenia. Ewa Oćwieja Marta Ryczko Koło Naukowe Ekonomiki Zdrowia IZP UJ CM 2012 Badania kosztów chorób (COI Costof illnessstudies) Ekonomiczny ciężar choroby;
Koszty obciążenia społeczeństwa chorobami układu krążenia. Ewa Oćwieja Marta Ryczko Koło Naukowe Ekonomiki Zdrowia IZP UJ CM 2012 Badania kosztów chorób (COI Costof illnessstudies) Ekonomiczny ciężar choroby;
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fluoresceine Thea 100 mg/ml (10%), roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 100 mg soli sodowej fluoresceiny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fluoresceine Thea 100 mg/ml (10%), roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 100 mg soli sodowej fluoresceiny
Groprinosin, 50 mg/ml, syrop Inosinum pranobexum
 Ulotka dołączona do opakowania: informacja dla pacjenta Groprinosin, 50 mg/ml, syrop Inosinum pranobexum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta Groprinosin, 50 mg/ml, syrop Inosinum pranobexum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FOLIK, 0,4 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 0,4 mg kwasu foliowego (Acidum folicum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FOLIK, 0,4 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 0,4 mg kwasu foliowego (Acidum folicum). Pełny wykaz substancji
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Losacor, 50 mg, tabletki powlekane. Losartanum kalicum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Losacor, 50 mg, tabletki powlekane Losartanum kalicum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Losacor, 50 mg, tabletki powlekane Losartanum kalicum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie
Diklofenak sodowy (Diclofenacum natricum) Trybenozyd (Tribenosidum) 10 mg/g Escyna (Escinum) 5 mg/g
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Venożel (12 mg + 10 mg + 5 mg)/1 g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Diklofenak sodowy (Diclofenacum natricum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Venożel (12 mg + 10 mg + 5 mg)/1 g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Diklofenak sodowy (Diclofenacum natricum)
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta ALKA-PRIM, 330 mg, tabletki musujące Acidum acetylsalicylicum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta ALKA-PRIM, 330 mg, tabletki musujące Acidum acetylsalicylicum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Isotrexin (20 mg + 0,5 mg)/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g żelu zawiera 20 mg erytromycyny (Erythromycinum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Isotrexin (20 mg + 0,5 mg)/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g żelu zawiera 20 mg erytromycyny (Erythromycinum)
TEST dla stanowisk robotniczych sprawdzający wiedzę z zakresu bhp
 TEST dla stanowisk robotniczych sprawdzający wiedzę z zakresu bhp 1. Informacja o pracownikach wyznaczonych do udzielania pierwszej pomocy oraz o pracownikach wyznaczonych do wykonywania działań w zakresie
TEST dla stanowisk robotniczych sprawdzający wiedzę z zakresu bhp 1. Informacja o pracownikach wyznaczonych do udzielania pierwszej pomocy oraz o pracownikach wyznaczonych do wykonywania działań w zakresie
Ulotka dołączona do opakowania: informacja dla pacjenta. Lanzul S, 15 mg, kapsułki Lansoprazolum
 Ulotka dołączona do opakowania: informacja dla pacjenta Lanzul S, 15 mg, kapsułki Lansoprazolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta Lanzul S, 15 mg, kapsułki Lansoprazolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Klasyfikacja i oznakowanie substancji chemicznych i ich mieszanin. Dominika Sowa
 Klasyfikacja i oznakowanie substancji chemicznych i ich mieszanin Dominika Sowa Szczecin, 8 maj 2014 Program prezentacji: 1. Definicja substancji i mieszanin chemicznych wg Ustawy o substancjach chemicznych
Klasyfikacja i oznakowanie substancji chemicznych i ich mieszanin Dominika Sowa Szczecin, 8 maj 2014 Program prezentacji: 1. Definicja substancji i mieszanin chemicznych wg Ustawy o substancjach chemicznych
USTAWA. z dnia 26 czerwca 1974 r. Kodeks pracy. 1) (tekst jednolity)
 Dz.U.98.21.94 1998.09.01 zm. Dz.U.98.113.717 art. 5 1999.01.01 zm. Dz.U.98.106.668 art. 31 2000.01.01 zm. Dz.U.99.99.1152 art. 1 2000.04.06 zm. Dz.U.00.19.239 art. 2 2001.01.01 zm. Dz.U.00.43.489 art.
Dz.U.98.21.94 1998.09.01 zm. Dz.U.98.113.717 art. 5 1999.01.01 zm. Dz.U.98.106.668 art. 31 2000.01.01 zm. Dz.U.99.99.1152 art. 1 2000.04.06 zm. Dz.U.00.19.239 art. 2 2001.01.01 zm. Dz.U.00.43.489 art.
Ulotka dołączona do opakowania: informacja dla użytkownika. Romilast, 4 mg, tabletki do rozgryzania i żucia Montelukastum
 Ulotka dołączona do opakowania: informacja dla użytkownika Romilast, 4 mg, tabletki do rozgryzania i żucia Montelukastum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika Romilast, 4 mg, tabletki do rozgryzania i żucia Montelukastum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 2 ml płynu do inhalacji zawierają 15 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mucosolvan inhalacje, 15 mg/2 ml, płyn do inhalacji z nebulizatora 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 2 ml płynu do inhalacji zawierają 15
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mucosolvan inhalacje, 15 mg/2 ml, płyn do inhalacji z nebulizatora 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 2 ml płynu do inhalacji zawierają 15
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Cetrix, 10 mg, tabletki powlekane Cetirizini dichydrochloridum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Cetrix, 10 mg, tabletki powlekane Cetirizini dichydrochloridum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta.
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Cetrix, 10 mg, tabletki powlekane Cetirizini dichydrochloridum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta.
Ulotka dołączona do opakowania: informacja dla użytkownika. Eliptus, 1000 mg, tabletki powlekane. Levetiracetamum
 Ulotka dołączona do opakowania: informacja dla użytkownika Eliptus, 1000 mg, tabletki powlekane Levetiracetamum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika Eliptus, 1000 mg, tabletki powlekane Levetiracetamum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
INSTRUKCJA BHP PRZY RECZNYCH PRACACH TRANSPORTOWYCH DLA PRACOWNIKÓW KUCHENKI ODDZIAŁOWEJ.
 INSTRUKCJA BHP PRZY RECZNYCH PRACACH TRANSPORTOWYCH DLA PRACOWNIKÓW KUCHENKI ODDZIAŁOWEJ. I. UWAGI OGÓLNE. 1. Dostarczanie posiłków, ich przechowywanie i dystrybucja musza odbywać się w warunkach zapewniających
INSTRUKCJA BHP PRZY RECZNYCH PRACACH TRANSPORTOWYCH DLA PRACOWNIKÓW KUCHENKI ODDZIAŁOWEJ. I. UWAGI OGÓLNE. 1. Dostarczanie posiłków, ich przechowywanie i dystrybucja musza odbywać się w warunkach zapewniających
Choroby alergiczne układu pokarmowego
 Choroby alergiczne układu pokarmowego Zbigniew Bartuzi Katedra i Klinika Alergologii, Immunologii Klinicznej i Chorób Wewnętrznych Collegium Medicum w Bydgoszczy UMK 4 Reakcje alergiczne na pokarmy Typy
Choroby alergiczne układu pokarmowego Zbigniew Bartuzi Katedra i Klinika Alergologii, Immunologii Klinicznej i Chorób Wewnętrznych Collegium Medicum w Bydgoszczy UMK 4 Reakcje alergiczne na pokarmy Typy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Brufen, 20 mg/ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Zawiesina zawiera 20 mg/ml ibuprofenu (Ibuprofenum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Brufen, 20 mg/ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Zawiesina zawiera 20 mg/ml ibuprofenu (Ibuprofenum). Substancje pomocnicze
ULOTKA DLA PACJENTA: INFORMACJA DLA UśYTKOWNIKA. HYDROXYZINUM TEVA (Hydroxyzini hydrochloridum) 50 mg/ml roztwór do wstrzykiwań
 ULOTKA DLA PACJENTA: INFORMACJA DLA UśYTKOWNIKA HYDROXYZINUM TEVA (Hydroxyzini hydrochloridum) 50 mg/ml roztwór do wstrzykiwań NaleŜy zapoznać się z treścią ulotki przed zastosowaniem leku. - NaleŜy zachować
ULOTKA DLA PACJENTA: INFORMACJA DLA UśYTKOWNIKA HYDROXYZINUM TEVA (Hydroxyzini hydrochloridum) 50 mg/ml roztwór do wstrzykiwań NaleŜy zapoznać się z treścią ulotki przed zastosowaniem leku. - NaleŜy zachować
Ulotka dołączona do opakowania: informacja dla pacjenta. Olfen Żel, 10 mg/g, żel. Diclofenacum natricum
 Ulotka dołączona do opakowania: informacja dla pacjenta Olfen Żel, 10 mg/g, żel Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta Olfen Żel, 10 mg/g, żel Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Nowy program terapeutyczny w RZS i MIZS na czym polega zmiana.
 Nowy program terapeutyczny w RZS i MIZS na czym polega zmiana. Brygida Kwiatkowska Narodowy Instytut Geriatrii, Reumatologii i Rehabilitacji im. prof. dr hab. med. Eleonory Reicher Programy lekowe dla
Nowy program terapeutyczny w RZS i MIZS na czym polega zmiana. Brygida Kwiatkowska Narodowy Instytut Geriatrii, Reumatologii i Rehabilitacji im. prof. dr hab. med. Eleonory Reicher Programy lekowe dla
LECZENIE NIEDOKRWISTOŚCI W PRZEBIEGU PRZEWLEKŁEJ NIEWYDOLNOŚCI
 Załącznik nr 14 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE NIEDOKRWISTOŚCI W PRZEBIEGU PRZEWLEKŁEJ NIEWYDOLNOŚCI NEREK ICD-10 N 18 przewlekła niewydolność
Załącznik nr 14 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE NIEDOKRWISTOŚCI W PRZEBIEGU PRZEWLEKŁEJ NIEWYDOLNOŚCI NEREK ICD-10 N 18 przewlekła niewydolność
Ulotka dla pacjenta. TRAMADOL SYNTEZA (Tramadoli hydrochloridum) 50 mg kapsułki twarde
 Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ancotil, 10 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg flucytozyny (Flucytosinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ancotil, 10 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg flucytozyny (Flucytosinum). Pełny wykaz
Grypa Objawy kliniczne choroby Przeziębieniem Objawy przeziębienia
 Grypa jest ostrą, bardzo zaraźliwą chorobą układu oddechowego, wywołaną przez RNA wirusy z rodziny Orthomyxoviridae. Wyróżniamy wirusy A i B tworzące jeden rodzaj i wirus C rodzajowo odmienny. Grypa występuje
Grypa jest ostrą, bardzo zaraźliwą chorobą układu oddechowego, wywołaną przez RNA wirusy z rodziny Orthomyxoviridae. Wyróżniamy wirusy A i B tworzące jeden rodzaj i wirus C rodzajowo odmienny. Grypa występuje
Ulotka dołączona do opakowania: informacja dla pacjenta. Kamiren, 1 mg, tabletki Kamiren, 2 mg, tabletki Kamiren, 4 mg, tabletki Doxazosinum
 Ulotka dołączona do opakowania: informacja dla pacjenta Kamiren, 1 mg, tabletki Kamiren, 2 mg, tabletki Kamiren, 4 mg, tabletki Doxazosinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta Kamiren, 1 mg, tabletki Kamiren, 2 mg, tabletki Kamiren, 4 mg, tabletki Doxazosinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Olopatadyna Abdi, 1 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu zawiera 1 mg olopatadyny (w postaci
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Olopatadyna Abdi, 1 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu zawiera 1 mg olopatadyny (w postaci
Charakterystyka Produktu Leczniczego
 Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO Magne B 6 forte 100 mg + 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera 100 mg jonów magnezu w
Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO Magne B 6 forte 100 mg + 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera 100 mg jonów magnezu w
Ulotka dołączona do opakowania: informacja dla pacjenta. Lexotan, 3 mg, tabletki Lexotan, 6 mg, tabletki. Bromazepamum
 Ulotka dołączona do opakowania: informacja dla pacjenta Lexotan, 3 mg, tabletki Lexotan, 6 mg, tabletki Bromazepamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Lexotan, 3 mg, tabletki Lexotan, 6 mg, tabletki Bromazepamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Adepend, 50 mg, tabletki powlekane. Naltrexoni hydrochloridum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Adepend, 50 mg, tabletki powlekane Naltrexoni hydrochloridum Należy zapoznać się z treścią ulotki przed zażyciem leku. Należy zachować tę ulotkę, aby w razie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Adepend, 50 mg, tabletki powlekane Naltrexoni hydrochloridum Należy zapoznać się z treścią ulotki przed zażyciem leku. Należy zachować tę ulotkę, aby w razie
