ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, PODMIOTÓW ODPOWIEDZIALNYCH W KRAJACH CZŁONKOWSKICH
|
|
|
- Łucja Maj
- 9 lat temu
- Przeglądów:
Transkrypt
1 ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, PODMIOTÓW ODPOWIEDZIALNYCH W KRAJACH CZŁONKOWSKICH 1
2 własna Austria Austria Belgia Belgia Sanofi-Aventis Leonard-Bernstein-Str. 10 Vienna DC A-1220 Vienna Austria MIP Pharma Kirkeler Straße 41 D Blieskastel- Niederwürzbach Will Pharma S.A. Monplaisirlaan 33 B-1030 Brussel Belgium Sanofi Aventis Belgium N.V Culliganlaan 1C 1831 Diegem Belgium Myolastan 50 mg - Filmtabletten Tetrazepam-MIP 50 mg Tabletten Epsipam Myolastan Belgia Eurogenerics NV Heizel Esplanade b Brussel Belgium Tetrazepam EG Bułgaria Chephasaar Chemisch- Pharmazeutische Fabrik Mühlstrasse 50 D Sankt Ingbert Tetrazepam-MIP 2
3 własna Czechy Sanofi-Aventis, s.r.o. Evropská 846/176a Praha 6 - Vokovice, Czech Republic MYOLASTAN Sanofi Aventis 1-13, boulevard Romain Rolland Paris MYOLASTAN 50 mg, comprimé pelliculé sécable Daiichi Sankyo SAS Immeuble le Corosa 1, rue Eugene et Armand Peugeot Rueil Malmaison PANOS 50 mg, comprimé pelliculé sécable Sandoz 49, avenue Georges Pompidou Levallois-Perret TETRAZEPAM SANDOZ 50 mg, comprimé pelliculé sécable Zydus 25, rue des Peupliers ZAC Les Hautes Pâtures - Parc d Activités des Peupliers Nanterre TETRAZEPAM ZYDUS 50 mg, comprimé enrobé sécable drażowana 3
4 własna Teva Sante 110, Esplanade du Général de Gaulle Paris La Défense Cedex TETRAZEPAM TEVA 50 mg, comprimé pelliculé sécable Cristers 22 quai Gallieni Suresnes TETRAZEPAM CRISTERS 50 mg, comprimé pelliculé sécable Ranbaxy Pharmacie Generiques Quai Dion Bouton Puteaux TETRAZEPAM RPG 50 mg, comprimé pelliculé sécable Sanofi Aventis 1-13, boulevard Romain Rolland Paris TETRAZEPAM ZENTIVA 50 mg, comprimé pelliculé sécable Mylan SAS 117, allée des Parcs Saint-Priest TETRAZEPAM MYLAN 50 mg, comprimé pelliculé sécable EG Labo - Laboratoires Eurogenerics "Le Quintet" - bâtiment A 12, rue Danjou Boulogne Billancourt Cedex TETRAZEPAM EG 50 mg, comprimé pelliculé sécable 4
5 własna ratiopharm Graf-Arco-Str Ulm Arrow Generiques 26, avenue Tony Garnier Lyon Arrow Generiques 26, avenue Tony Garnier Lyon Biogaran 15, boulevard Charles de Gaulle Colombes 1 A Pharma Keltenring Oberhaching AbZ-Pharma Graf-Arco-Str Ulm Aliud Pharma Gottlieb-Daimler-Str Laichingen TETRAZEPAM RATIOPHARM 50 mg, comprimé enrobé sécable TETRAZEPAM ALMUS 50 mg, comprimé pelliculé sécable TETRAZEPAM ARROW 50 mg, comprimé pelliculé sécable TETRAZEPAM BIOGARAN 50 mg, comprimé pelliculé sécable Tetrazepam - 1 A Pharma Tetrazepam AbZ 50 mg Filmtabletten drażowana Tetrazepam AL 50 5
6 własna Aristo Pharma Wallenroder Str Berlin Aristo Pharma Wallenroder Str Berlin Chephasaar Chemisch- Pharmazeutische Fabrik Mühlstrasse 50 D Sankt Ingbert Chephasaar Chemisch- Pharmazeutische Fabrik Mühlstrasse 50 D Sankt Ingbert Chephasaar Chemisch- Pharmazeutische Fabrik Mühlstrasse 50 D Sankt Ingbert Spasmorelax 50 mg Tabletten Tetrazepam-Aristo 50 mg Tabletten Tetra-saar 50mg Tetrazepam-MIP 100 mg Tabletten Tetrazepam-MIP 25 mg Tabletten 100 mg Tabletka 25 mg Tabletka 6
7 własna Chephasaar Chemisch- Pharmazeutische Fabrik Mühlstrasse 50 D Sankt Ingbert CT Arzneimttel - Geschäftsanschrift - Graf-Arco-Str Ulm Hexal Aktiengesellschaft Industriestr Holzkirchen Krewel Meuselbach Krewelstr Eitorf KSK-Pharma Vertriebs AG Finkenstr Pfinztal-Berghausen Tetrazepam-MIP 50 mg Tabletten Tetrazep-CT 50mg Filmtabletten Tetrazepam HEXAL Musapam Tetrazepam KSK Mylan dura Wittichstr Darmstadt Tetramdura 50mg 7
8 własna neuraxpharm Arzneimittel Elisabeth-Selbert-Str Langenfeld Tetrazepamneuraxpharm 100 mg 100 mg Tabletka neuraxpharm Arzneimittel Elisabeth-Selbert-Str Langenfeld Tetrazepamneuraxpharm 50 mg 50 mg Tablet ratiopharm Graf-Arco-Str Ulm Tetrazepamratiopharm 50 mg Filmtabletten Sandoz Pharmaceuticals Raiffeisenstr Holzkirchen Tetrazepam Sandoz 50mg Tabletten Sandoz Pharmaceuticals Raiffeisenstr Holzkirchen Tetrazepam Sandoz 50mg Tabletten Sanofi-Aventis Deutschland Industriepark Höchst, Gebäude K Frankfurt am Main Musaril, 50mg Filmtabletten 8
9 własna Stadapharm Stadastr Bad Vilbel Tetrazepam STADA 50 mg Filmtabletten Łotwa Sanofi Aventis Latvia SIA Kr. Valdemara str Riga LV 1010 Latvia Myolastan 50 mg filmcoated tablets Litwa UAB Sanofi-Aventis Lietuva A. Juozapavičiaus g. 6/2 LT Vilnius Lithuania Myolastan Luksemburg Will Pharma S.A. Monplaisirlaan 33 B-1030 Brussel Belgium Epsipam Luksemburg Sanofi Aventis Belgium N.V Culliganlaan 1C 1831 Diegem Belgium Myolastan Luksemburg Eurogenerics NV Heizel Esplanade b Brussel Belgium Tetrazepam EG Polska Przedsiębiorstwo Farmaceutyczne Jelfa S.A. Wincentego st. Pola , Jelenia Góra, Poland Miozepam 9
10 własna Polska Polska Polska Polska Sanofi Aventis 1-13, boulevard Romain Rolland Paris MIP Pharma Polska Sp. z. o.o. ul Orzechowa Gdansk Poland MIP Pharma Polska Sp. z. o.o. ul Orzechowa Gdansk Poland MIP Pharma Polska Sp. z. o.o. ul Orzechowa Gdansk Poland Myolastan Myopam mg Tabletka Myopam 50 Myopam mg Tabletka Polska ratiopharm Graf-Arco-Str Ulm Tetraratio Rumunia S.C. A.C. Helcor Pharma S.R.L. Str. Victor Babeş nr. 50, Baia Mare Jud. Maramureş România RELAXAM 50 mg, comprimate filmate 10
11 własna Słowacja Sanofi-Aventis Slovakia s.r.o. Einsteinova Bratislava Slovak Republic MYOLASTAN Hiszpania Sanofi Aventis, S.A. Josep Plá, Barcelona Spain MYOLASTAN 50 mg comprimidos recubiertos 11
12 Aneks II Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu 12
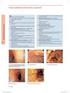
13 Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu (patrz Aneks I) Po rozważeniu zalecenia PRAC z dnia 11 kwietnia 2013 r. dotyczącego produktów leczniczych zawierających tetrazepam CMDh zgadza się z tymi zaleceniami, co opisano poniżej: Ogólne podsumowanie oceny naukowej PRAC dotyczącej produktów leczniczych zawierających tetrazepam Tetrazepam jest benzodiazepiną wskazaną do stosowania w leczeniu bolesnych przykurczów w przebiegu chorób reumatycznych i spastyczności. Benzodiazepiny (BZP) ułatwiają hamujące działanie kwasu gamma-aminomasłowego (GABA), przez co mają one właściwości uspokajające, nasenne, przeciwdrgawkowe i rozluźniające mięśnie. Produkty lecznicze zawierające tetrazepam są dopuszczone do obrotu na terenie Austrii, Belgii, Bułgarii, Czech, Francji, Niemiec, Łotwy, Litwy, Luksemburga, Polski, Rumunii, Słowacji i Hiszpanii (lista produktów leczniczych zawierających tetrazepam dopuszczonych do obrotu na terenie UE znajduje się w Aneksie I). W dniu 20 grudnia 2012 r. zgodnie z art. 107i dyrektywy 2001/83/WE poinformowała Europejską Agencję Leków o tym, że rozważa wycofanie pozwoleń na dopuszczenie do obrotu dla produktów leczniczych zawierających tetrazepam po przeprowadzeniu oceny danych uzyskanych w ramach nadzoru nad bezpieczeństwem farmakoterapii. Po otrzymaniu zgłoszeń dotyczących nowych ciężkich reakcji skórnych związanych ze stosowaniem tetrazepamu właściwy organ krajowy Francji dokonał w listopadzie 2012 r. ponownej oceny zagrożeń skórnych związanych ze stosowaniem tetrazepamu na podstawie wyników krajowego badania prowadzonego w ramach nadzoru nad bezpieczeństwem farmakoterapii. Ta ponowna ocena w ramach nadzoru nad bezpieczeństwem farmakoterapii dotyczyła niepożądanych działań leku (ang. adverse drug reactions, ADRs) w odniesieniu do skóry, zarejestrowanych w bazie danych francuskiego nadzoru nad bezpieczeństwem farmakoterapii od momentu wydania pierwszych pozwoleń na dopuszczenie do obrotu dla tetrazepamu w tym państwie członkowskim w 1967 r. Ocena ta wykazała zwiększony poziom ryzyka w odniesieniu do skóry związanego ze stosowaniem tetrazepamu i występującego obok oczekiwanych farmakologicznych działań niepożądanych benzodiazepin. Połowa zgłoszonych ADR dotyczących tetrazepamu odnosiła się do reakcji skórnych, a z 648 zgłoszonych poważnych przypadków 305 z nich zgłoszono w kategorii klasyfikacji układów i narządów (ang. System Organ Class, SOC) Zaburzenia skóry i tkanki podskórnej : wykryto 33 przypadki zespołu Stevensa Johnsona (SJS), 33 przypadki toksycznej nekrolizy naskórka (TEN), 59 przypadków rumienia wielopostaciowego (EM) oraz 15 przypadków reakcji na lek (lub wysypki) z eozynofilią i objawami układowymi (zespołu DRESS), z których 11 zakończyło się śmiercią. PRAC rozważył dostępne dane, w tym pochodzące z badania prowadzonego w ramach francuskiego nadzoru nad bezpieczeństwem farmakoterapii, dane przedłożone przez inne państwa członkowskie, zainteresowane strony i podmioty odpowiedzialne, a także dane opublikowane w piśmiennictwie. Bezpieczeństwo W trakcie krajowego badania prowadzonego w ramach francuskiego nadzoru nad bezpieczeństwem farmakoterapii przeprowadzono analizę przypadków reakcji skórnych zarejestrowanych w krajowej bazie danych nadzoru nad bezpieczeństwem farmakoterapii od momentu wydania pierwszego pozwolenia na dopuszczenie do obrotu do 30 czerwca 2012 r. Do dnia 30 czerwca 2012 r. we francuskiej bazie danych zarejestrowano 2382 przypadków związanych ze stosowaniem tetrazepamu. Spośród nich 1617 przypadków miało kategorię podejrzenie lub interakcja wg klasyfikacji WHO. Po wykluczeniu jednego podwójnego wpisu w analizie wzięto pod uwagę 1616 przypadków. Spośród nich 805 (49,80%) przypadków niepożądanego działania leku dotyczyło kategorii SOC zaburzenia skóry i tkanki podskórnej, z czego 305 (37,9%) były to poważne przypadki zagrażające życiu oraz przypadki śmiertelne. Ta ostatnia grupa obejmowała 33 przypadki SJS (w tym 1 śmiertelny), 33 przypadki zespołu Lyella (TEN) (w tym 9 śmiertelnych), 59 przypadków EM (w tym 1 śmiertelny), 15 przypadków zespołu DRESS, 3 potencjalne przypadki zespołu DRESS oraz 5 przypadków ostrej uogólnionej krostkowicy. 13
14 Tetrazepam był jedynym podejrzanym lekiem lub uzyskał wyższy wynik oceny przyczynowości niż stosowane jednocześnie inne leki w 18 z 81 przypadków SJS, TEN lub zespołu DRESS. Zgłoszono również przypadki reakcji anafilaktycznej. Dodatkowo opisano 10 przypadków obrzęku naczynioruchowego sugerującego natychmiastową reakcję nadwrażliwości i 67 przypadków wysypki polekowej, występujących obok poprzednio wspomnianych przypadków i obejmujących lub nieobejmujących przynajmniej jednego narządu. Wiele spośród skórnych zdarzeń niepożądanych było typu grudkowo-plamistego, ale niekiedy występowały też zdarzenia typu pęcherzykowego, krostkowego, wybroczynowego lub pęcherzowego. Wskazuje to, że ciężkie reakcje skórne związane ze stosowaniem tetrazepamu są prawdopodobnie powiązane z opóźnioną reakcją nadwrażliwości typu IV, na co wskazują dodatnie wyniki testu płatkowego w 79 ze 115 przypadków, w których wykonano testy alergiczne. Zgodnie z odpowiedziami na listę pytań PRAC udzielonymi na piśmie przez podmiot odpowiedzialny innowacyjnego produktu leczniczego, w oparciu o bazę danych nadzoru nad bezpieczeństwem farmakoterapii prowadzoną przez podmiot odpowiedzialny od momentu wprowadzenia leku do obrotu w 1969 r. do dnia 31 maja 2012 r. (data zamknięcia zbierania danych), zgłoszono 513 przypadków reakcji skórnych lub alergicznych spośród 748 wszystkich reakcji związanych ze stosowaniem tetrazepamu. Trzydzieści osiem (38) przypadków zostało potwierdzonych niemedycznie, a 475 przypadków uzyskało potwierdzenie medyczne. Spośród nich 180 przypadków zgłoszono bezpośrednio do firmy, 245 przypadków zgłosiły władze odpowiedzialne za ochronę zdrowia, a 50 przypadków zidentyfikowano w publikacjach naukowych na całym świecie. Ogólnie najczęściej zgłaszanymi reakcjami skórnymi są (w kolejności malejącej) różnego typu nieswoiste wysypki (162 przypadki), świąd (94 przypadki), rumień wielopostaciowy (48 przypadków), pokrzywka (47 przypadków), toksyczna nekroliza naskórka (35 przypadków), obrzęk naczynioruchowy (34 przypadki), zespół Stevensa Johnsona (31 przypadków), rumień (28 przypadków), toksyczne wykwity skórne (19 przypadków), złuszczanie skóry (16 przypadków), pęcherzowe zapalenie skóry, niewymienione gdzie indziej (ang. Not Otherwise Specified, NOS) (16 przypadków) oraz zespół DRESS (7 przypadków). W swojej odpowiedzi na listę pytań PRAC podmiot odpowiedzialny przedstawił wyniki szczególnej analizy dotyczącej najbardziej istotnych ciężkich niepożądanych reakcji skórnych zgłoszonych przez podmiot odpowiedzialny w związku z ich charakterem i ciężkością. Ogólnie ponad 40% zgłoszonych przypadków jest związanych z kategorią SOC dotyczącą zaburzeń skórnych. W następstwie leczenia tetrazepamem rozpoznano przypadki ciężkich niepożądanych reakcji skórnych (ang. Severe Cutaneous Adverse Reactions, SCAR) na lek, takich jak SJS, TEN, zespół DRESS oraz EM, wśród których było 11 przypadków śmiertelnych. W 8 przypadkach śmierć uznano za następstwo reakcji skórnej, a w 3 przypadkach za następstwo reakcji powiązanej. W kilku przypadkach przeprowadzono testy alergiczne. Ogólnie szacuje się, że wynik dodatni uzyskano w przypadku 70 80% testów alergicznych. W większości przypadków związek przyczynowo-skutkowy ze stosowaniem tetrazepamu uznano za możliwy (86% przypadków), a w niektórych przypadkach za prawdopodobny (11% przypadków). PRAC uznał, że większość zgłoszonych przypadków była związana ze stosowaniem wielu produktów leczniczych. Jednak w wielu przypadkach zasadność powiązania występujących reakcji ze stosowaniem tetrazepamu jest wysoka. Potwierdzają to wyniki testów alergicznych, gdyż w niektórych przypadkach wynik dodatni uzyskano tylko po zastosowaniu tetrazepamu. Dodatkowo zgłoszono przypadki ponownych testów prowokacji, w których wystąpiły nowe epizody zaburzeń skórnych. W odniesieniu do przypadków SJS/TEN opisanych przez podmiot odpowiedzialny zgłoszono 65 medycznie potwierdzonych poważnych przypadków wystąpienia tych reakcji. Obejmowały one 31 przypadków SJS i 35 przypadków TEN, w tym jedno wystąpienie obu tych reakcji jednocześnie. W 10 przypadkach rozpoznanie potwierdzono, wykonując biopsję skóry. Czas do wystąpienia reakcji u 14 pacjentów wyniósł od 1 do 3 tygodni, natomiast w 9 przypadkach zgłoszono czas krótszy (< 7 dni), z czego w 6 przypadkach czas ten był bardzo krótki (1 3 dni). Niemal we wszystkich przypadkach dostępna była informacja dotycząca czasu trwania leczenia z użyciem tetrazepamu i w większości z nich czas ten nie przekraczał jednego miesiąca. W 9 przypadkach czas trwania leczenia był bardzo krótki (mniej niż 4 dni). Przypadki ciężkich niepożądanych reakcji skórnych związanych ze stosowaniem tetrazepamu opisano również w opublikowanym piśmiennictwie 1,2,3,4,5,6,7,8,9,10,11. Przypadki skórnych zdarzeń 1 Sanchez I et al. Stevens-Johnson syndrome from tetrazepam. Allergol Immunopathol 1998;26: Camarasa JG et al. Tetrazepam allergy detected by patch test. Contact Dermatitis 1990;22:246 3 Quinones D et al. Photodermatitis from tetrazepam. Contact Dermatitis 1998 ;39(2):84 14
15 niepożądanych przedłożono też w odpowiedziach udzielonych przez inne podmioty odpowiedzialne i zainteresowane strony. przedstawił swoje zdanie dotyczące możliwego mechanizmu powstawania reakcji skórnych wywoływanych przez tetrazepam. Przyczyną różnych skórnych reakcji nadwrażliwości obserwowanych w związku ze stosowaniem tetrazepamu mogą być różnice strukturalne między tetrazepamem a innymi benzodiazepinami (tj. podstawiony pierścień cykloheksenylowy tetrazepamu). Potencjalny atak nukleofilowy, którego występowanie zaproponowano w piśmiennictwie (Barbaud et al, 2009), jest zgodny z mechanizmem zaproponowanym w wyniku analizy in silico i może wyjaśniać wykryty brak reaktywności krzyżowej między tetrazepamem a innymi benzodiazepinami u pacjentów ze skórnymi reakcjami nadwrażliwości. Lokalizację reakcji nadwrażliwości może wyjaśniać powinowactwo tetrazepamu do skóry. PRAC rozważył działania służące zminimalizowaniu ryzyka,w tym skrócenie leczenia do 6 dni i ograniczenie wskazania, mające na celu zmniejszenia ryzyka wystąpienia ciężkich niepożądanych reakcji skórnych. Podczas dyskusji omawiano także dalsze działania służące zminimalizowaniu ryzyka, takie jak dodatkowe poprawki w informacji o produkcie (przeciwwskazania, ostrzeżenia), materiały informacyjne (karta ostrzeżeń dla pacjenta, list do personelu medycznego) i zmniejszenie wielkości opakowań. Biorąc pod uwagę wskazania do stosowania tetrazepamu, PRAC zakwestionował skuteczność skrócenia leczenia z uwagi na potencjalne wielokrotne stosowanie leku. Dodatkowo PRAC uznał, że dane kliniczne potwierdzające korzyści z 6-dniowego okresu leczenia nie były wystarczająco przekonujące. Z uwagi na nieprzewidywalność tego typu działań niepożądanych ograniczenie wskazania nie byłoby skutecznym działaniem służącym zminimalizowaniu ryzyka. Omawiano również możliwość dołączenia karty ostrzeżeń, ale nie uznano tego za skuteczny sposób zapobiegania tego typu reakcjom SCAR. Po dokonaniu oceny wszystkich zaproponowanych działań służących zminimalizowaniu ryzyka PRAC stwierdził, że ze względu na ryzyko wystąpienia oraz nieprzewidywalność ciężkich niepożądanych reakcji skórnych związanych ze stosowaniem tetrazepamu zaproponowane środki nie są wystarczające, aby zmniejszyć to ryzyko do klinicznie akceptowalnego poziomu. W związku z powyższym PRAC uznał, że tetrazepam, w porównaniu z lekami z tej samej grupy farmakologicznej, jest związany z podwyższonym ryzykiem wystąpienia ciężkich niepożądanych reakcji skórnych, w tym zespołu Stevensa Johnsona, toksycznej nekrolizy naskórka, rumienia wielopostaciowego i zespołu DRESS, które mogą zagrażać życiu lub powodować śmierć. Skuteczność Tetrazepam jest benzodiazepiną wskazaną do stosowania w leczeniu bolesnych przykurczów w przebiegu chorób reumatycznych oraz w przebiegu zespołów spastycznych we wszystkich państwach członkowskich UE. W niektórych państwach członkowskich obowiązują oba wskazania. Od momentu wydania pozwoleń na dopuszczenie do obrotu dla tetrazepamu publikowane są wyniki badań klinicznych z użyciem tego leku w obu wskazaniach. Ogólnie skuteczność tetrazepamu w leczeniu bolesnych przykurczów potwierdzają głównie dwa niewielkie badania kliniczne 4 Bachmeyter C. Probable drug rash with eosinophilia and systemic symptoms syndrome related to tetrazepam. J Eur Acad Dermatol Venereol 2008;22(7): Cabreizo Ballesteros et al. Erythema multiforme to tetrazepam. J Investig Allergol Clin Immunol 2007;17(3): Delesalle F et la. Toxic epidermal necrolysis caused by tetrazepam. International Journal of Dermatology 2006;45(4):480 7 Del Pozo MD et al. Tetrazepam Allergy. Allergy 1999;54(11): Sanchez-Morillas L et al. Systemic dermatitis due to tetrazepam. J Investig Allergol Clin Immunol 2008;18(5): Blanco R et la. Delayed hypersensitivity to tetrazepam. Allergy 1997;52(11): LagnouiR et al. Fatal toxic epidemal necrolysis associated with tetrazepam. Therapie 2001;56(2): Thomas E et al. Acute generalised exanthematous pustulosis due to tetrazepam. J Investig Allergol Clin Immunol 2008;18(2):
16 przeprowadzone metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo (Arbus 1987 i Salzmann 1993) oraz z udziałem łącznej liczby 70 pacjentów (odpowiednio 50 i 20 pacjentów). W badaniach tych wykazano ograniczoną skuteczność leczenia. PRAC zauważył też, że w aktualnych wytycznych nie ma odniesień do stosowania tetrazepamu w leczeniu spastyczności. Skuteczność tetrazepamu porównywano również z innymi lekami w badaniach klinicznych prowadzonych metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo. Badania te nie wykazały statystycznie istotnej różnicy między badanymi grupami w przypadku obu wskazań. PRAC uznał, że dostępne dane dotyczące skuteczności, w tym dane udostępnione od momentu wydania pierwszego pozwolenia na dopuszczenie do obrotu, wykazały bardzo ograniczoną skuteczność tetrazepamu w leczeniu zatwierdzonych wskazań. Wniosek ogólny W związku z powyższym PRAC stwierdził, że tetrazepam jest związany z zagrożeniami dotyczącymi bezpieczeństwa stosowania leku w związku z ciężkimi, potencjalnie śmiertelnymi reakcjami skórnymi i wykazuje ograniczoną skuteczność kliniczną. PRAC uznał, że działania służące zminimalizowaniu ryzyka omówione podczas procedury oceny, w tym skrócenie leczenia oraz ograniczenie wskazania, nie są wystarczające do zmniejszenia ryzyka. W związku z tym PRAC stwierdził, że stosunek korzyści do ryzyka stosowania produktów leczniczych zawierających tetrazepam nie jest korzystny. Podstawy do zalecenia PRAC Zważywszy, że PRAC rozważył procedurę zgodną z art. 107i dyrektywy 2001/83/WE dotyczącą produktów leczniczych zawierających tetrazepam; PRAC rozważył wszystkie dostępne dane dotyczące produktów leczniczych zawierających tetrazepam związane z ryzykiem wystąpienia niepożądanych reakcji skórnych. Obejmowały one dane przedłożone przez państwa członkowskie i opublikowane w piśmiennictwie, które udostępniono od momentu wydania pierwszych pozwoleń na dopuszczenie do obrotu, a także odpowiedzi podmiotu odpowiedzialnego i zainteresowanych stron; PRAC zauważył, że w związku ze stosowaniem tetrazepamu zgłoszono ciężkie niepożądane reakcje skórne, w tym przypadki śmiertelne; Po dokonaniu przeglądu wszystkich dostępnych danych PRAC uznał, że w porównaniu z innymi lekami z tej samej grupy farmakologicznej tetrazepam jest związany ze zwiększonym ryzykiem wystąpienia ciężkich niepożądanych reakcji skórnych, w tym zespołu Stevensa Johnsona, toksycznej nekrolizy naskórka, rumienia wielopostaciowego i zespołu DRESS, które mogą zagrażać życiu lub powodować śmierć; PRAC uznał, że dostępne dane dotyczące skuteczności, w tym dane udostępnione od momentu wydania pierwszego pozwolenia na dopuszczenie do obrotu, wykazały bardzo ograniczoną skuteczność tetrazepamu w leczeniu zatwierdzonych wskazań; PRAC uznał, że działania służące zminimalizowaniu ryzyka omówione podczas procedury oceny, w tym skrócenie leczenia oraz ograniczenie wskazania, nie są wystarczające do zmniejszenia ryzyka wystąpienia ciężkich reakcji skórnych. Mając na uwadze zagrożenia dotyczące bezpieczeństwa stosowania leku w związku z ciężkimi, potencjalnie śmiertelnymi reakcjami skórnymi oraz ograniczoną skuteczność tetrazepamu PRAC stwierdził, że zgodnie z art. 116 dyrektywy 2001/83/WE stosunek korzyści do ryzyka stosowania leków zawierających tetrazepam nie jest już uznawany za korzystny. W związku z tym zgodnie z postanowieniami art. 107i dyrektywy 2001/83/WE PRAC zaleca zawieszenie pozwoleń na dopuszczenie do obrotu dla wszystkich produktów leczniczych wymienionych w Aneksie I. 16
17 Warunki zniesienia zawieszenia pozwoleń na dopuszczenie do obrotu przedstawiono w Aneksie III. Opinia CMDh Po rozważeniu zalecenia PRAC z dnia 11 kwietnia 2013 r. zgodnie z art.107k(1) i (2) dyrektywy 2001/83/WE oraz wyjaśnień ustnych złożonych przez podmiot odpowiedzialny w dniu 22 kwietnia 2013 r. CMDh zdecydował o zawieszeniu pozwoleń na dopuszczenie do obrotu dla produktów leczniczych zawierających tetrazepam. Warunki zniesienia zawieszenia pozwoleń na dopuszczenie do obrotu przedstawiono w Aneksie III. 17
18 Aneks III Warunki zniesienia zawieszenia pozwoleń na dopuszczenie do obrotu 18
19 Warunki zniesienia zawieszenia pozwoleń na dopuszczenie do obrotu Aby zawieszenie zostało zniesione, w gestii właściwych organów krajowych państw członkowskich leży dopilnowanie, by podmioty odpowiedzialne spełniły następujące warunki: podmioty odpowiedzialne powinny zidentyfikować populację pacjentów, u której stosunek korzyści do ryzyka stosowania produktów leczniczych zawierających tetrazepam jest korzystny na podstawie istotnych naukowo danych potwierdzających ten fakt. 19
Aneks II. Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu
 Aneks II Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu 12 Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu (patrz Aneks I) Po rozważeniu zalecenia PRAC
Aneks II Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu 12 Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu (patrz Aneks I) Po rozważeniu zalecenia PRAC
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Lipophoral Tablets 150mg. Mediator 150 mg Tabletka Podanie doustne. Benfluorex Qualimed. Mediator 150mg Tabletka Podanie doustne
 ANEKS I WYKAZ NAZW WŁASNYCH, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH (EOG) 1
ANEKS I WYKAZ NAZW WŁASNYCH, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH (EOG) 1
Podmiot odpowiedzialny Nazwa (własna) Moc Postać farmaceutyczna. Ergotop 10 mg - Tabletten. Ergotop 20 mg - Filmtabletten
 Aneks I Wykaz nazw, postać(ci) (ych), moc(y) produktów leczniczych, droga(dróg) podania, podmiot(y) odpowiedzialny(e) posiadający(e) pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Bułgaria
Aneks I Wykaz nazw, postać(ci) (ych), moc(y) produktów leczniczych, droga(dróg) podania, podmiot(y) odpowiedzialny(e) posiadający(e) pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Bułgaria
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 205 Wnioski naukowe W następstwie rozpoczętej w styczniu 2012 r. oceny tworzonego w ramach procedury podziału pracy okresowego raportu o bezpieczeństwie dotyczącego produktów leczniczych
Aneks II Wnioski naukowe 205 Wnioski naukowe W następstwie rozpoczętej w styczniu 2012 r. oceny tworzonego w ramach procedury podziału pracy okresowego raportu o bezpieczeństwie dotyczącego produktów leczniczych
Podmiot odpowiedzialny Nazwa Moc Postać farmaceutyczna. Leflunomide Actavis 10 mg, filmomhulde tabletten
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, droga podania, podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Państwo Członkowskie
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, droga podania, podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Państwo Członkowskie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Państwo Członkowskie Podmiot odpowiedzialny Nazwa własna Moc Postać farmaceutyczna Droga podania
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków
 Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
Aneks I. Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, wnioskodawcy w państwach członkowskich
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, wnioskodawcy w państwach członkowskich 1 Państwo Członkowskie UE/EOG wnioskodawca nazwa firmy, adres Nazwa (własna)
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, wnioskodawcy w państwach członkowskich 1 Państwo Członkowskie UE/EOG wnioskodawca nazwa firmy, adres Nazwa (własna)
Podmiot odpowiedzialny Nazwa Moc Postać farmaceutyczna. FENOFIBRATO PENSA 160 mg comprimidos recubiertos con película EFG
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, droga podania, podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Państwo Członkowskie
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, droga podania, podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Państwo Członkowskie
Aneks I. Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, podmiotów odpowiedzialnych w państwach członkowskich
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, podmiotów odpowiedzialnych w państwach członkowskich 1 Austria Austria Austria Belgia Belgia Belgia Sanofi-aventis
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, podmiotów odpowiedzialnych w państwach członkowskich 1 Austria Austria Austria Belgia Belgia Belgia Sanofi-aventis
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA
 ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie
ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie
Nazwa własna. BufloMed 'S.Med' 300 mg Filmtabletten. BufloMed 'S.Med' retard 600 mg Filmtabletten. 600 mg
 Aneks I Lista nazw własnych, postaci farmaceutycznych, mocy produktów leczniczych, drogi podania i podmiotów odpowiedzialnych w państwach członkowskich 1 Państwo członkowskie UE/EWG Podmiot odpowiedzialny
Aneks I Lista nazw własnych, postaci farmaceutycznych, mocy produktów leczniczych, drogi podania i podmiotów odpowiedzialnych w państwach członkowskich 1 Państwo członkowskie UE/EWG Podmiot odpowiedzialny
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego, droga podania, wnioskodawcy / podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Podmiot
Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego, droga podania, wnioskodawcy / podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Podmiot
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 ANEKS I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks II. Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu przedstawione przez EMA
 Aneks II Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu przedstawione przez EMA 5 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych zawierających meprobamat
Aneks II Wnioski naukowe i podstawy zawieszenia pozwoleń na dopuszczenie do obrotu przedstawione przez EMA 5 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych zawierających meprobamat
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
Nazwa własna Moc Postać farmaceutyczna
 Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego weterynaryjnego, gatunki zwierząt i podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich
Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego weterynaryjnego, gatunki zwierząt i podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki informacyjnej
 Aneks I Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki informacyjnej Ogólne podsumowanie oceny naukowej weterynaryjnych produktów leczniczych zawierających (fluoro)chinolony
Aneks I Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki informacyjnej Ogólne podsumowanie oceny naukowej weterynaryjnych produktów leczniczych zawierających (fluoro)chinolony
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Ogólne podsumowanie oceny naukowej produktu leczniczego Mifepristone Linepharma i nazw produktów związanych (patrz aneks I)
 Aneks II Wnioski naukowe i podstawy pozytywnej opinii zgodnie z warunkiem pozwolenia na dopuszczenie do obrotu i warunkiem zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione
Aneks II Wnioski naukowe i podstawy pozytywnej opinii zgodnie z warunkiem pozwolenia na dopuszczenie do obrotu i warunkiem zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione
Produkty lecznicze zawierające dekstropropoksyfen posiadające pozwolenie na dopuszczenie do obrotu na terenie Unii Europejskiej.
 ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Belgia Cypr
ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Belgia Cypr
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wykaz nazw, postaci farmaceutycznej, dawki produktów leczniczych, sposobu podawania, podmiotów odpowiedzialnych w państwach członkowskich
 Aneks I Wykaz nazw, postaci farmaceutycznej, dawki produktów leczniczych, sposobu podawania, podmiotów odpowiedzialnych w państwach członkowskich 1 Państwo członkowskie (w EOG) Podmiot odpowiedzialny Międzynarodowa
Aneks I Wykaz nazw, postaci farmaceutycznej, dawki produktów leczniczych, sposobu podawania, podmiotów odpowiedzialnych w państwach członkowskich 1 Państwo członkowskie (w EOG) Podmiot odpowiedzialny Międzynarodowa
Aneks II. Wnioski naukowe i podstawy do cofnięcia pozwoleń na dopuszczenie do obrotu
 Aneks II Wnioski naukowe i podstawy do cofnięcia pozwoleń na dopuszczenie do obrotu 4 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej produktów Caustinerf arsenical, Yranicid arsenical i
Aneks II Wnioski naukowe i podstawy do cofnięcia pozwoleń na dopuszczenie do obrotu 4 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej produktów Caustinerf arsenical, Yranicid arsenical i
Aneks I. Wykaz produktów leczniczych dopuszczonych do obrotu w procedurze narodowej i wniosków o dopuszczenie do obrotu
 Aneks I Wykaz produktów leczniczych dopuszczonych do obrotu w procedurze narodowej i wniosków o dopuszczenie do obrotu 1 Aneks IA: Produkty lecznicze, w przypadku których zaleca się utrzymanie pozwoleń
Aneks I Wykaz produktów leczniczych dopuszczonych do obrotu w procedurze narodowej i wniosków o dopuszczenie do obrotu 1 Aneks IA: Produkty lecznicze, w przypadku których zaleca się utrzymanie pozwoleń
SKRÓCONA INFORMACJA O LEKU
 Mucosolvan inhalacje, 15 mg/2 ml, roztwór do nebulizacji; 2 ml roztworu do nebulizacji zawierają 15 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum). Substancje pomocnicze o znanym działaniu: chlorek
Mucosolvan inhalacje, 15 mg/2 ml, roztwór do nebulizacji; 2 ml roztworu do nebulizacji zawierają 15 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum). Substancje pomocnicze o znanym działaniu: chlorek
Mydocalm 150 mg Tabletki powlekane MYDOFLEX TABLET 150MG. MYDOCALM 150 MG 150 mg Tabletki powlekane. Tolperisonhydrochlorid AL 150 mg Filmtabletten
 ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, PODMIOTÓW ODPOWIEDZIALNYCH POSIADAJĄCYCH POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Bułgaria
ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, PODMIOTÓW ODPOWIEDZIALNYCH POSIADAJĄCYCH POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1 Bułgaria
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks II. Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu 11 Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Po rozważeniu zalecenia PRAC z dnia
Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu 11 Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Po rozważeniu zalecenia PRAC z dnia
Nazwa własna. 150 mg meprobamatu. (w skojarzeniu z chininą) EQUANIL 250 mg, comprimé enrobé. EQUANIL 400 mg, comprimé enrobé sécable
 Aneks I Lista nazw własnych, postaci farmaceutycznych, mocy produktów leczniczych, drogi podania i podmiotów odpowiedzialnych w państwach członkowskich 1 Państwo członkowskie UE/EWG Podmiot odpowiedzialny
Aneks I Lista nazw własnych, postaci farmaceutycznych, mocy produktów leczniczych, drogi podania i podmiotów odpowiedzialnych w państwach członkowskich 1 Państwo członkowskie UE/EWG Podmiot odpowiedzialny
Wnioski naukowe i podstawy do tych wniosków
 Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu oraz szczegółowe wyjaśnienie różnic w stosunku do zalecenia PRAC 296 Wnioski naukowe i podstawy do tych wniosków CHMP
Aneks II Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu oraz szczegółowe wyjaśnienie różnic w stosunku do zalecenia PRAC 296 Wnioski naukowe i podstawy do tych wniosków CHMP
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks II. Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione przez EMA
 Aneks II Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione przez EMA 41 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych
Aneks II Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione przez EMA 41 Wnioski naukowe Ogólne podsumowanie oceny naukowej produktów leczniczych
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYK PRODUKTU LECZNICZEGO I ULOTEK DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW
 ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYK PRODUKTU LECZNICZEGO I ULOTEK DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 108 WNIOSKI NAUKOWE OGÓLNE PODSUMOWANIE OCENY NAUKOWEJ
ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYK PRODUKTU LECZNICZEGO I ULOTEK DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 108 WNIOSKI NAUKOWE OGÓLNE PODSUMOWANIE OCENY NAUKOWEJ
Aneks II. Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC
 Aneks II Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC 70 Wnioski naukowe CMDh rozpatrzył poniższe zalecenia PRAC
Aneks II Wnioski naukowe i podstawy cofnięcia lub zmiany warunków dopuszczenia do obrotu i szczegółowe objaśnienie różnic względem zaleceń PRAC 70 Wnioski naukowe CMDh rozpatrzył poniższe zalecenia PRAC
Wydanie, utrzymanie lub zmiana krajowego pozwolenia na dopuszczenie do obrotu. Posiadacz(-e) pozwolenia na dopuszczenie do obrotu
 PL C 53/10 Dziennik Urzędowy Unii Europejskiej 22.2.2013 Zestawienie decyzji Unii Europejskiej w sprawie pozwoleń na dopuszczenie do obrotu produktów leczniczych w okresie od dnia 1 stycznia do dnia 31
PL C 53/10 Dziennik Urzędowy Unii Europejskiej 22.2.2013 Zestawienie decyzji Unii Europejskiej w sprawie pozwoleń na dopuszczenie do obrotu produktów leczniczych w okresie od dnia 1 stycznia do dnia 31
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Podmiot odpowiedzialny Nazwa Moc Postać farmaceutyczna Droga podania. Silomat. Dragees. 40 mg/10 ml. Silomat - Hustensaft.
 ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, PODMIOTÓW ODPOWIEDZIALNYCH POSIADAJĄCYCH POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1/12 WYKAZ
ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, PODMIOTÓW ODPOWIEDZIALNYCH POSIADAJĄCYCH POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH 1/12 WYKAZ
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Postać farmaceutyczna. Moc. Clavulanic acid 10 mg. Clavulanic acid 10 mg. Clavulanic acid 10 mg. Clavulanic acid 10 mg
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktu leczniczego weterynaryjnego, gatunków zwierząt, dróg podania, wnioskodawców/podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktu leczniczego weterynaryjnego, gatunków zwierząt, dróg podania, wnioskodawców/podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości
 Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg/5 ml, syrop Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg/5 ml, syrop Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Actocalcio D3 35 mg mg/880 IU. Acrelcombi 35 mg mg/880 IU. Fortipan Combi D 35 mg mg/880 IU
 ANEKS I WYKAZ NAZW, POSTAĆ(CI) FARMACEUTYCZNA(YCH), MOC(Y), PRODUKTÓW LECZNICZYCH, DROGA(DRÓG) PODANIA, WNIOSKODAWCA(Y), PODMIOT(Y) ODPOWIEDZIALNY(E) POSIADAJĄCY(E) POZWOLENIE NA DOPUSZCZENIE DO OBROTU
ANEKS I WYKAZ NAZW, POSTAĆ(CI) FARMACEUTYCZNA(YCH), MOC(Y), PRODUKTÓW LECZNICZYCH, DROGA(DRÓG) PODANIA, WNIOSKODAWCA(Y), PODMIOT(Y) ODPOWIEDZIALNY(E) POSIADAJĄCY(E) POZWOLENIE NA DOPUSZCZENIE DO OBROTU
Aneks I. Wykaz produktów leczniczych dopuszczonych do obrotu na rynkach krajowych
 Aneks I Wykaz produktów leczniczych dopuszczonych do obrotu na rynkach krajowych 1 Austria Actavis Group Ptc Ehf. Sienima Dienogest 2mg, Austria Dermapharm Dienovel Dienogest 2mg, Austria Exeltis Germany
Aneks I Wykaz produktów leczniczych dopuszczonych do obrotu na rynkach krajowych 1 Austria Actavis Group Ptc Ehf. Sienima Dienogest 2mg, Austria Dermapharm Dienovel Dienogest 2mg, Austria Exeltis Germany
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 11 Wnioski naukowe Po rozważeniu zmienionego ostatecznego zalecenia PRAC z dnia 10 lipca 2014 r. dotyczącego produktów leczniczych zawierających diacereinę CMDh zgadza się z tym
Aneks II Wnioski naukowe 11 Wnioski naukowe Po rozważeniu zmienionego ostatecznego zalecenia PRAC z dnia 10 lipca 2014 r. dotyczącego produktów leczniczych zawierających diacereinę CMDh zgadza się z tym
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania
 Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania Uwaga: Poniższe zmiany należy dodać do ważnej Charakterystyki Produktu Leczniczego, oznakowania i ulotki dla pacjenta,
Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania Uwaga: Poniższe zmiany należy dodać do ważnej Charakterystyki Produktu Leczniczego, oznakowania i ulotki dla pacjenta,
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Podmiot odpowiedzialny Nazwa własna Moc Postać farmaceutyczna. Postinor 1500 Mikrogramm-Tablette
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie do obrotu w państwach członkowskich. 1 Doraźne
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie do obrotu w państwach członkowskich. 1 Doraźne
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o przypadku zabójczej niewydolności wątroby u pacjenta po zastosowaniu leczenia daklizumabem
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o przypadku zabójczej niewydolności wątroby u pacjenta po zastosowaniu leczenia daklizumabem
Aneks IV. Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks IV Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu 137 Wnioski naukowe CHMP rozważył poniższe zalecenie PRAC z dnia 5 grudnia 2013 r. odnoszące się do procedury zgodnej
Aneks IV Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu 137 Wnioski naukowe CHMP rozważył poniższe zalecenie PRAC z dnia 5 grudnia 2013 r. odnoszące się do procedury zgodnej
Liczba alergików rośnie z roku na rok. Na alergie cierpi prawie ¼ społeczeństwa. czyli 8,5 miliona Polaków!
 Liczba alergików rośnie z roku na rok. Na alergie cierpi prawie ¼ społeczeństwa czyli 8,5 miliona Polaków! Dlaczego tak się dzieje? Rośnie liczba dużych miast. Rośnie też ilość samochodów, bloków mieszkalnych,
Liczba alergików rośnie z roku na rok. Na alergie cierpi prawie ¼ społeczeństwa czyli 8,5 miliona Polaków! Dlaczego tak się dzieje? Rośnie liczba dużych miast. Rośnie też ilość samochodów, bloków mieszkalnych,
Nazwa własna Nazwa generyczna Postać farmaceutyczna. Wodorobursztynian metyloprednizolonu. Wodorobursztynian metyloprednizolonu
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych weterynaryjnych, gatunków zwierząt, dróg podania, wnioskodawców/podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych weterynaryjnych, gatunków zwierząt, dróg podania, wnioskodawców/podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie
Bezpośredni komunikat do fachowych pracowników ochrony zdrowia
 Bezpośredni komunikat do fachowych pracowników ochrony zdrowia Wersja 2, data zatwierdzenia przez URPL: 07.11.2016 Strona 1/7 Acytretyna (Neotigason): poważne ryzyko działania teratogennego oraz ryzyko
Bezpośredni komunikat do fachowych pracowników ochrony zdrowia Wersja 2, data zatwierdzenia przez URPL: 07.11.2016 Strona 1/7 Acytretyna (Neotigason): poważne ryzyko działania teratogennego oraz ryzyko
Zaobserwowano częstsze przypadki stosowania produktu leczniczego Vistide w niezatwierdzonych wskazaniach i (lub) drogach podawania.
 Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
Lek BI w porównaniu z lekiem Humira u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą
 Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
własna) Nazwa Actonel Combi D Norsedcombi 35 mg mg/880 IU Norsed plus Calcium D Optinate Plus Ca &D Opticalcio D3 35 mg mg/880 IU
 ANEKS I WYKAZ NAZW, POSTAĆ(CI) FARMACEUTYCZNA(YCH), MOC(Y), PRODUKTÓW LECZNICZYCH, DROGA(DRÓG) PODANIA, WNIOSKODAWCA(Y), PODMIOT(Y) ODPOWIEDZIALNY(E) POSIADAJĄCY(E) POZWOLENIE NA DOPUSZCZENIE DO OBROTU
ANEKS I WYKAZ NAZW, POSTAĆ(CI) FARMACEUTYCZNA(YCH), MOC(Y), PRODUKTÓW LECZNICZYCH, DROGA(DRÓG) PODANIA, WNIOSKODAWCA(Y), PODMIOT(Y) ODPOWIEDZIALNY(E) POSIADAJĄCY(E) POZWOLENIE NA DOPUSZCZENIE DO OBROTU
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Ulotka dołączona do opakowania: informacja dla pacjenta Flavamed, 30 mg, tabletki Ambroxoli hydrochloridum
 Ulotka dołączona do opakowania: informacja dla pacjenta Flavamed, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Flavamed, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
 18 października 2012 EMA/653433/2012 EMEA/H/A-5(3)/1319 Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
18 października 2012 EMA/653433/2012 EMEA/H/A-5(3)/1319 Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
ANEKS WNIOSKI NAUKOWE I PODSTAWY DO ODMOWY PRZEDSTAWIONE PRZEZ EMEA
 ANEKS WNIOSKI NAUKOWE I PODSTAWY DO ODMOWY PRZEDSTAWIONE PRZEZ EMEA PONOWNE ZBADANIE OPINII CHMP Z 19 LIPCA 2007 R. NA TEMAT PREPARATU NATALIZUMAB ELAN PHARMA Podczas posiedzenia w lipcu 2007 r. CHMP przyjął
ANEKS WNIOSKI NAUKOWE I PODSTAWY DO ODMOWY PRZEDSTAWIONE PRZEZ EMEA PONOWNE ZBADANIE OPINII CHMP Z 19 LIPCA 2007 R. NA TEMAT PREPARATU NATALIZUMAB ELAN PHARMA Podczas posiedzenia w lipcu 2007 r. CHMP przyjął
Moc Gatunki zwierząt. Postać farmaceutyczna. Samice psów. Enurace 50 Tabletki 50 mg
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
Wnioskodawca Nazwa własna Moc Postać farmaceutyczna
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, DROGA PODANIA, WNIOSKODAWCY/PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH Państwo
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, DROGA PODANIA, WNIOSKODAWCY/PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH Państwo
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 7 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej produktów zawierających metadon z dodatkiem powidonu do stosowania doustnego Metadon jest syntetycznym opioidem.
Aneks II Wnioski naukowe 7 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej produktów zawierających metadon z dodatkiem powidonu do stosowania doustnego Metadon jest syntetycznym opioidem.
Ulotka dołączona do opakowania: informacja dla użytkownika. Mucofluid, 50 mg/ml, aerozol do nosa, roztwór. Mesnum
 Ulotka dołączona do opakowania: informacja dla użytkownika Mucofluid, 50 mg/ml, aerozol do nosa, roztwór Mesnum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla użytkownika Mucofluid, 50 mg/ml, aerozol do nosa, roztwór Mesnum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ze względu na brak potwierdzenia w badaniu przeprowadzonym wśród młodzieży (opisanym poniżej) wyniki zostały uznane za niedostatecznie przekonujące.
 ZAŁĄCZNIK II WNIOSKI NAUKOWE I PODSTAWY DO WYDANIA POZYTYWNEJ OPINII ORAZ ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ
ZAŁĄCZNIK II WNIOSKI NAUKOWE I PODSTAWY DO WYDANIA POZYTYWNEJ OPINII ORAZ ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ
Bismuth subgallate 100 mg, Titanium dioxide 100 mg, Lidocaine hydrochloride 10 mg
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA ORAZ PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH (EOG) 1 Państwo
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA ORAZ PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH (EOG) 1 Państwo
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika MUCOSOLVAN MINI, 15 mg/5 ml, syrop Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika MUCOSOLVAN MINI, 15 mg/5 ml, syrop Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel
 VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel Wskazania do stosowania Voltaren MAX jest wskazany do stosowania u dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie
VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel Wskazania do stosowania Voltaren MAX jest wskazany do stosowania u dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie
Ulotka dołączona do opakowania: informacja dla pacjenta. Essentiale VITAL, 600 mg, pasta doustna. Phospholipidum essentiale
 Ulotka dołączona do opakowania: informacja dla pacjenta Essentiale VITAL, 600 mg, pasta doustna Phospholipidum essentiale Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta Essentiale VITAL, 600 mg, pasta doustna Phospholipidum essentiale Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika. TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
