Agencja Oceny Technologii Medycznych
|
|
|
- Leszek Karpiński
- 4 lat temu
- Przeglądów:
Transkrypt
1 Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 60/2011 z dnia 27 czerwca 2011 r. w sprawie niezasadności zakwalifikowania świadczenia opieki zdrowotnej Leczenie raka nerki przy wykorzystaniu substancji czynnej pazopanib w ramach programu zdrowotnego Narodowego Funduszu Zdrowia jako świadczenia gwarantowanego Rada Konsultacyjna uważa za niezasadne zakwalifikowanie świadczenia opieki zdrowotnej Leczenie raka nerki przy wykorzystaniu substancji czynnej pazopanib jako świadczenia gwarantowanego w ramach terapeutycznego programu zdrowotnego. Uzasadnienie W opinii Rady Konsultacyjnej nie istnieją obecnie przekonujące dowody naukowe, że leczenie pacjentów z rakiem nerkowokomórkowym pazopanibem w I linii jest co najmniej równie skuteczne, jak obecnie finansowane ze środków publicznych leczenie sunitynibem. W leczeniu II linii nie wykazano dotąd, że pazopanib wydłuża przeżycie pacjentów leczonych wcześniej cytokinami, a udowodnione wydłużenie przeżycia bez progresji nie wiązało się z poprawą jakości życia chorych. Wnioski z oceny opiniowanej technologii medycznej mogą ulec zmianie w wyniku publikacji rezultatów obecnie trwających badao, przede wszystkim badania umożliwiającego bezpośrednie porównanie skuteczności pazopanibu i sunitynibu. Tryb przygotowania stanowiska Niniejsze stanowisko opracowane zostało przez Radę Konsultacyjną na podstawie raportów: Leczenie raka nerki przy wykorzystaniu substancji czynnej pazopanib (I linia). Ocena świadczenia opieki zdrowotnej. nr AOTM-OT-0430 i Leczenie raka nerki przy wykorzystaniu substancji czynnej pazopanib (II linia). Ocena świadczenia opieki zdrowotnej. nr AOTM-OT ,2 Problem zdrowotny Zgodnie z proponowanymi kryteriami włączenia do programu, do leczenia pazopanibem mają byd kwalifikowani chorzy z rozpoznaniem raka nerkowokomórkowego (RCC renal cell carcinoma) jasnokomórkowego lub mieszanego z przeważającym (>60%) komponentem jasnokomórkowym, w stadium zaawansowania pierwotnie uogólnionym lub w nawrocie po pierwotnym leczeniu chirurgicznym, z udokumentowanymi przerzutami narządowymi (z wyłączeniem przerzutów do ośrodkowego układu nerwowego), korzystnym lub pośrednim rokowaniem wg skali MSKCC (Memorial Sloan-Kettering Cancer Center) i sprawnością ocenioną na punktów w skali Karnofsky ego. Kwalifikacji do leczenia pazopanibem w pierwszej linii mają podlegad wyłącznie chorzy Agencja Oceny Technologii Medycznych ul. I. Krasickiego 26, Warszawa tel fax sekretariat@aotm.gov.pl
2 nieleczeni uprzednio farmakologicznie, natomiast w drugiej linii pazopanib będą mogli otrzymad pacjenci z udokumentowanym niepowodzeniem wcześniejszej immunoterapii z zastosowaniem interferonu α lub u których dalsze stosowanie interferonu α jest przeciwwskazane. 3 Raki nerkowokomórkowe (rak jasnokomórkowy, rak brodawkowaty, rak chromofobny, rak z przewodów wyprowadzających) stanowią ponad 80% nowotworów nerki. RCC jest nowotworem złośliwym wywodzącym się w większości przypadków z nabłonka cewek krętych bliższych, a bardzo rzadko z innych struktur nerki. Wczesne rozpoznanie nowotworu jest trudne, gdyż klasyczna triada objawow guza nerki: guz wyczuwalny przez powłoki, ból w okolicy lędźwiowej i krwiomocz, występują tylko u <5% chorych, zwykle w stadium zaawansowanego raka z obecnością przerzutów, podczas gdy w % rozpoznanie stawiane jest przypadkowo, na podstawie badao wykonywanych z innych przyczyn. 4 RCC występuje 2 razy częściej u mężczyzn niż u kobiet, najczęściej po 40 roku życia (średni wiek w chwili rozpoznania wynosi ok. 60 lat). Etiologia nie jest znana. Na ryzyko zachorowania wpływają czynniki genetyczne, styl życia (palenie tytoniu, otyłośd z nadciśnieniem tętniczym), inne choroby nerek. Rokowanie jest niekorzystne. U ok. 21% chorych po radykalnym leczeniu chirurgicznym dochodzi do nawrotu nowotworu, przy czym średni czas do nawrotu to 17 miesięcy, a miejscem nawrotu są przeważnie płuca. Ok. 60% chorych przeżywa 5 lat, ale poniżej 20% pacjentów z przerzutami. Mediana czasu przeżycia chorych z przerzutowym rakiem nerki wynosi 6-12 miesięcy. 4,5 Nowotwory nerki stanowią ok. 3% wszystkich nowotworów złośliwych u dorosłych w Polsce. W Krajowym Rejestrze Nowotworów w 2008 r. odnotowano zachorowao (2 469 u mężczyzn, u kobiet) oraz zgonów (1 574 mężczyzn, 989 kobiet) z powodu raka nerki. 1 Obecna standardowa terapia Podstawą leczenia RCC pozostaje postępowanie chirurgiczne w postaci nefrektomii radykalnej, czyli obejmującej usunięcie nerki ze zmianą nowotworową, torebką tłuszczową, blaszkami powięzi nerkowej, nadnerczem oraz regionalnymi węzłami chłonnymi, bądź nefrektomii oszczędzającej, zarezerwowanej dla wybranych chorych. Ponadto stosuje się zabiegowe leczenie paliatywne. 4 Farmakologiczne leczenie raka nerki rozważane jest w stadium zaawansowanym, przede wszystkim w przypadkach, gdy nawrót choroby występuje po długim okresie od pierwotnego leczenia (nefrektomia), rozsiew nie ma charakteru wielonarządowego, wydolnośd ważnych układów jest zachowana, utrzymuje się przynajmniej dobry stan sprawności i gdy istnieje możliwośd oceny odpowiedzi na leczenie. Nie zaleca się stosowania rutynowej, konwencjonalnej chemioterapii (winblastyna, 5-fluorouracyl, floksurydyna), ze względu na jej nieskutecznośd. U niektórych chorych za uzasadnione uważa się podejmowanie próby immunoterapii lub chemioimmunoterapii, z udziałem interferonu α-2α lub interleukiny-2 wskazania do tej terapii występują jednak w bardzo ograniczonej grupie pacjentów. Nowe możliwości leczenia zaawansowanego RCC wiążą się z wprowadzeniem leków o działaniu uwarunkowanym molekularnie. Do wymienionej grupy należą: leki antyangiogenne - wielokinazowe inhibitory kinaz tyrozynowych (sunitynib, sorafenib i pazopanib lek będący przedmiotem niniejszej oceny), monoklonalne przeciwciało anty VEGF (bewacyzumab) oraz inhibitor szlaku przekazu sygnałowego m TOR (temsyrolimus). 6 Opis świadczenia Pazopanib (produkt leczniczy Votrient) jest podawanym doustnie silnym, o wielokierunkowym działaniu, inhibitorem kinazy tyrozynowej receptorów naczyniowego czynnika wzrostu środbłonka (VEGFR)-1, -2, i -3, płytkowopochodnego czynnika wzrostu (PDGFR)-α i -β oraz receptora czynnika komórek macierzystych (c-kit). Produkt Votrient został dopuszczony do obrotu na terytorium Unii Europejskiej w czerwcu 2010 r. 7 Pazopanib jest wskazany w leczeniu pierwszego rzutu pacjentów z zaawansowanym rakiem nerkowokomórkowym oraz w leczeniu pacjentów, u których wcześniej stosowano cytokiny z powodu zaawansowanego raka nerkowokomorkowego. 7 Zalecana dawka wynosi 800 mg raz na dobę. 7 2/5
3 Efektywnośd kliniczna Ocenę efektywności klinicznej pazopanibu w leczeniu I i II rzutu pacjentów z zaawansowanym rakiem nerkowokomórkowym przeprowadzono w oparciu o analizy przedstawione przez podmiot odpowiedzialny właściwy dla produktu leczniczego Votrient i ich krytyczną weryfikację. 1,2 Na podstawie przeglądu systematycznego stwierdzono, że dotychczas skutecznośd pazopanibu w analizowanej populacji oceniano w dwóch badaniach z randomizacją, jedynie względem placebo. Z dwóch podjętych badao (VEG105192, opublikowane przez Sternberg i wsp. w 2010 r. oraz badanie Hutsona i wsp. z 2010 r.) w drugim, ze względu na wystąpienie wyraźnej odpowiedzi na pazopanib w początkowo włączonej do badania grupie chorych, wstrzymano randomizację i u wszystkich pacjentów kontynuowano leczenie pazopanibem bez zaślepienia. 1,2 W badaniu VEG105192, w podgrupie chorych wcześniej nieleczonych systemowo (I linia), stosowanie pazopanibu wiązało się z istotnym statystycznie wydłużeniem przeżycia bez progresji [mediana: 11,1 vs 2,8 mies.; HR=0,40 (95% CI: 0,27; 0,60)]. Koocowe wyniki oceny przeżycia całkowitego dotychczas przedstawiono jedynie w doniesieniu konferencyjnym, dla populacji ogólnej badania (bez wyodrębnienia I i II linii). Zmniejszenie ryzyka zgonu u leczonych pazopanibem nie było statystycznie istotne [HR = 0,91 (95% CI: 0,71; 1,16)]. Z uwagi na możliwośd przechodzenia pacjentów z placebo do grupy pazopanibu po progresji, przeprowadzono dodatkową ocenę, wykorzystując dwie metody statystyczne: IPCW (z ang. inverse probability of censoring weighted) oraz RPSFT (z ang. rank preserving structural failure time). Analiza metodą IPCW wykazała istotny efekt leczenia pazopanibem w postaci zmniejszenia ryzyka zgonu [HR = 0,504 (95% CI: 0,315; 0,762)] natomiast metoda RPSFT nie potwierdziła statystycznej istotności tego efektu [HR = 0,43 (95% CI: 0,22; 1,39)]. W podgrupie chorych wcześniej nieleczonych (I linia) pazopanib istotnie zwiększał szansę uzyskania obiektywnej odpowiedzi w porównaniu do placebo [OR=11,56 (95% CI: 3,49; 59,66); NNT=4 (95% CI: 3; 6)]. Różnice w jakości życia, oceniane za pomocą kwestionariusza QLQ-C30, EQ-5D oraz jego wizualnej skali analogowej, nie były statystycznie istotne. 1 W tym samym badaniu, w podgrupie pacjentów wcześniej leczonych cytokinami (II linia) leczenie pazopanibem istotnie wydłużało czas przeżycia bez progresji w porównaniu z placebo *7,4 vs 4,2 mies.; HR=0,54 (95% CI: 0,35; 0,84)]. Obserwowane wydłużenie całkowitego przeżycia nie było istotne statystycznie [mediana: 22,9 vs 20,5 mies.; HR= 0,91 (95% CI: 0,71-1,16)]. Szansa uzyskania odpowiedzi na leczenie była istotnie wyższa w grupie leczonych pazopanibem [OR=13,20 (95% CI: 3,19; 115,72); NNT= 4 (95% CI: 3; 7)]. Nie wykazano statystycznie istotnej przewagi pazopanibu nad placebo pod względem jakości życia chorych. 2 Przedstawione analizy zawierały ponadto pośrednie porównanie pazopanibu z interferonem α i z sunitynibem (w leczeniu I rzutu) oraz z sorafenibem (w leczeniu II rzutu). Spośród licznych przedstawionych wariantów porównania z interferonem α jedynie oszacowania przeprowadzone z wykorzystaniem metody RPSFT (metoda rekomendowana przez NICE) wskazują na istotnie statystyczną przewagę pazopanibu pod względem czasu przeżycia bez progresji [HR=0,57 (95% CI: 0,37; 0,88)]. Przewaga pazopanibu nad sunitynibem nie została wykazana, a wyprowadzenie miarodajnego wniosku co do równoważności tych terapii nie jest możliwe na gruncie przedstawionego porównania pośredniego (jedynie pierwotne, bezpośrednie badanie w modelu noninferiority lub equivalence mogłoby dad wiarygodną odpowiedź na pytanie o porównywalnośd wyników terapii; badanie typu non-inferiority porównujące pazopanib z sunitynibem jest obecnie w toku). 1 Tylko w jednym z licznych wariantów porównania z sorafenibem (metoda IPCW, oszacowanie przeżywalności dla pazopanibu na podstawie doniesienia konferencyjnego) wykazano przewagę pazopanibu nad sorafenibem pod względem wydłużenia całkowitego przeżycia [HR=0,57 (95% CI: 0,36; 0,92)]; oszacowania uzyskane przy użyciu metody RPSFT nie potwierdzają statystycznej istotności tego efektu, ponadto postulowanemu wydłużeniu czasu przeżycia całkowitego nie towarzyszyło wydłużenie czasu wolnego od progresji choroby (otrzymane wartości HR kształtowały się w zakresie 1,00 1,23). 2 Podstawy do wnioskowania o porównywalności tych dwóch terapii są obecnie bardzo słabe. Wytyczne Polskiej Unii Onkologii (2010), National Comprehensive Cancer Network (NCCN; 2011), European Society for Medical Oncology (ESMO; 2010) i European Association of Urology (EAU; 2010) 3/5
4 wymieniają pazopanib jako jedną z opcji terapeutycznych w I linii leczenia pacjentów z jasnokomórkowym rakiem nerki, z rokowaniem korzystnym lub pośrednim oraz w II linii leczenia pacjentów z rakiem jasnokomórkowym, uprzednio leczonych cytokinami. 1,2 Bezpieczeostwo stosowania Większośd działao niepożądanych pazopanibu odnotowanych w badaniu VEG stanowiły działania niepożądane 1. lub 2. stopnia. Najczęstszymi działaniami niepożądanymi (bez względu na stopieo) w grupie chorych stosujących pazopanib były: biegunka (52%), nadciśnienie (40%), zmiana koloru włosów (38%), nudności (26%), anoreksja (22%) lub wymioty (21%). Do najczęstszych działao niepożądanych stopnia 3. lub 4. należały nadciśnienie (4%) i biegunka (4%). W wynikach badao laboratoryjnych najczęściej obserwowano zmiany na poziomie 1. lub 2. stopnia ciężkości. 1,2 W pośrednim porównaniu z sorafenibem (II linia leczenia) uzyskano wynik wskazujący na niższe ryzyko wystąpienia działania niepożądanego 3 lub 4 st. (bez względu na jego rodzaj) u leczonych pazopanibem [RR=0,44 (95% CI: 0,26; 0,74)]. 2 Koszty świadczenia i jego wpływ na budżet płatnika Podmiot odpowiedzialny przedstawił analizy ekonomiczne, w których pazopanib porównano z interferonem α (I linia leczenia), sunitynibem (I linia leczenia) oraz z konwencjonalnym leczeniem objawowym (II linia, na podstawie wyników porównania z placebo) i sorafenibem (II linia leczenia). Efekty leczenia, wyrażone jako zyskane lata życia i zyskane lata życia w pełnym zdrowiu oraz bezpośrednie koszty medyczne z perspektywy płatnika (NFZ+pacjent) modelowano w horyzoncie mającym odpowiadad dożywotniemu 10 lat dla I i 5 lat dla II linii leczenia. W przedstawionej analizie koszt uzyskania dodatkowego roku życia w pełnym zdrowiu (QALY) w wyniku zastosowania pazopanibu zamiast interferonu α w I linii leczenia oszacowano na zł, a koszt zyskania roku życia (LYG) - na zł. W porównaniu z sunitynibem przyjęto założenie o jednakowej efektywności klinicznej i przeprowadzono analizę minimalizacji kosztów. 1,2 W terapii II linii koszt uzyskania dodatkowego roku życia w pełnym zdrowiu (QALY) w wyniku zastosowania pazopanibu zamiast leczenia objawowego oszacowano na zł a koszt zyskania roku życia (LYG) - na zł. W porównaniu z sorafenibem przyjęto założenie o jednakowej efektywności klinicznej i przeprowadzono analizę minimalizacji kosztów; leczenie pazopanibem miałoby byd taosze od terapii sorafenibem o zł Wszystkie wymienione porównania, z wyjątkiem porównania z leczeniem objawowym w II linii, oparto na przeprowadzonych w ramach analizy efektywności klinicznej porównaniach pośrednich, przyjęte założenia co do równoważności lub przewagi klinicznej pazopanibu nad aktywnymi komparatorami są zatem obciążone znacznym stopniem niepewności (co związane jest z opisanymi już wątpliwościami dotyczącymi interpretacji wyników analizy efektywności klinicznej). Narodowy Fundusz Zdrowia szacuje roczną liczbę pacjentów kwalifikujących się do leczenia pazopanibem na ponad osób (w tym osób do leczenia I linii). Przyszłe wydatki na leczenie pazopanibem w ramach programu zdrowotnego, w latach po stabilizacji udziału tego leku w rynku, NFZ prognozuje na zł w leczeniu I linii i zł w leczeniu II linii ,2 4/5
5 Spośród odnalezionych rekomendacji dotyczących finansowania pazopanibu ze środków publicznych w leczeniu I rzutu, dwie agencje NICE (Wielka Brytania) i SMC (Szkocja) - wydały rekomendacje pozytywne, natomiast HAS (Francja) i PBAC (Australia) wydały rekomendacje negatywne. Finansowanie pazopanibu w II linii negatywnie zarekomendowały HAS i PBAC a NICE i SMC nie wydały dotychczas rekomendacji dotyczącej finansowania pazopanibu w II linii leczenia. Wszystkie wspomniane rekomendacje wydano w latach ,2 Biorąc pod uwagę powyższe argumenty, Rada Konsultacyjna przyjęła stanowisko jak na wstępie. Piśmiennictwo 1. Raport Leczenie raka nerki przy wykorzystaniu substancji czynnej pazopanib (I linia). Ocena świadczenia opieki zdrowotnej. nr AOTM-OT Agencja Oceny Technologii Medycznych: Warszawa, czerwiec Raport Leczenie raka nerki przy wykorzystaniu substancji czynnej pazopanib (II linia). Ocena świadczenia opieki zdrowotnej. nr AOTM-OT Agencja Oceny Technologii Medycznych: Warszawa, czerwiec Korespondencja z Ministerstwem Zdrowia (załączniki do Raportu nr AOTM-OT-0431). 4. Książek A, Załuska W. Nowotwory układu moczowego. W: Szczeklik A. (red.). Choroby wewnętrzne. Stan wiedzy na rok Medycyna praktyczna: Kraków, Szczeklik A. i wsp. Choroby wewnętrzne. Podręcznik multimedialny oparty na zasadach EBM. Medycyna Praktyczna: Kraków Stelmach A, Borówka A, Chłosta P, Demkow T, Jaszczyoski J, Łuczyoska E, Sadzikowska J, Skoneczna I, Wilk W. Nowotwory układu moczowo-płciowego. Via Medica, Gdaosk, Aktualizacja *dostęp online Charakterystyka produktu leczniczego Votrient. 5/5
INNOWACJE W LECZENIU RAKA NERKI- OCENA DOSTĘPNOŚCI W POLSCE. Prof. Cezary Szczylik Lek. Przemysław Langiewicz CSK WIM
 INNOWACJE W LECZENIU RAKA NERKI- OCENA DOSTĘPNOŚCI W POLSCE Prof. Cezary Szczylik Lek. Przemysław Langiewicz CSK WIM I/II linia leczenia rozsianego raka nerki Pazopanib - Produkt Votrient jest wskazany
INNOWACJE W LECZENIU RAKA NERKI- OCENA DOSTĘPNOŚCI W POLSCE Prof. Cezary Szczylik Lek. Przemysław Langiewicz CSK WIM I/II linia leczenia rozsianego raka nerki Pazopanib - Produkt Votrient jest wskazany
Rada Konsultacyjna. Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 59/2011 z dnia 27 czerwca 2011 r. w sprawie zakwalifikowania świadczenia opieki zdrowotnej Leczenie raka nerki
Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 59/2011 z dnia 27 czerwca 2011 r. w sprawie zakwalifikowania świadczenia opieki zdrowotnej Leczenie raka nerki
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 49/2011 w sprawie zakwalifikowania świadczenia opieki zdrowotnej Leczenie raka nerki przy wykorzystaniu substancji czynnej pazopanib
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 49/2011 w sprawie zakwalifikowania świadczenia opieki zdrowotnej Leczenie raka nerki przy wykorzystaniu substancji czynnej pazopanib
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego. Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa
 Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
Piotr Potemski. Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi
 Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Obserwowane są samoistne regresje zmian przerzutowych
Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Obserwowane są samoistne regresje zmian przerzutowych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 50/2011 w sprawie zakwalifikowania świadczenia opieki zdrowotnej Leczenie raka nerki przy wykorzystaniu substancji czynnej sorafenib
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 50/2011 w sprawie zakwalifikowania świadczenia opieki zdrowotnej Leczenie raka nerki przy wykorzystaniu substancji czynnej sorafenib
LECZENIE RAKA NERKI (ICD-10 C 64)
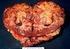 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Terapeutyczne Programy Zdrowotne 2010 Leczenie raka nerki Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku
 Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Dziennik Urzędowy Ministra Zdrowia 671 Poz. 17 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
Dziennik Urzędowy Ministra Zdrowia 671 Poz. 17 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
LECZENIE RAKA NERKI (ICD-10 C 64)
 Dziennik Urzędowy Ministra Zdrowia 607 Poz. 71 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
Dziennik Urzędowy Ministra Zdrowia 607 Poz. 71 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 48/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 27 czerwca 2011 r. w sprawie zakwalifikowania świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 48/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 27 czerwca 2011 r. w sprawie zakwalifikowania świadczenia opieki zdrowotnej
LECZENIE RAKA NERKI (ICD-10 C 64)
 Dziennik Urzędowy Ministra Zdrowia 538 Poz. 86 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
Dziennik Urzędowy Ministra Zdrowia 538 Poz. 86 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
ZBYT PÓŹNE WYKRYWANIE RAKA NERKI ROLA LEKARZA PIERWSZEGO KONTAKTU
 ZBYT PÓŹNE WYKRYWANIE RAKA NERKI ROLA LEKARZA PIERWSZEGO KONTAKTU 14 czerwca 2012 r dr n. med. Piotr Tomczak Klinika Onkologii U.M. Poznań Epidemiologia raka nerki RCC stanowi 2 3% nowotworów złośliwych
ZBYT PÓŹNE WYKRYWANIE RAKA NERKI ROLA LEKARZA PIERWSZEGO KONTAKTU 14 czerwca 2012 r dr n. med. Piotr Tomczak Klinika Onkologii U.M. Poznań Epidemiologia raka nerki RCC stanowi 2 3% nowotworów złośliwych
Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011
 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki,
Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki,
Wydłużenie życia chorych z rakiem płuca - nowe możliwości
 Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Terapeutyczne Programy Zdrowotne 2012 Leczenie raka nerki
 Załącznik nr 39 do zarządzenia nr 59/2011/DGL Prezesa NFZ Załącznik nr 8 do zarządzenia nr 10/2012/DGL Prezesa NFZ z dnia 15 lutego 2012 r. Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny:
Załącznik nr 39 do zarządzenia nr 59/2011/DGL Prezesa NFZ Załącznik nr 8 do zarządzenia nr 10/2012/DGL Prezesa NFZ z dnia 15 lutego 2012 r. Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny:
Nowotwór złośliwy oskrzela i płuca
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
Leczenie systemowe raka nie-jasnokomórkowego
 Leczenie systemowe raka nie-jasnokomórkowego Piotr Tomczak Uniwersytet Medyczny w Poznaniu Klinika Onkologii Jastrzębia Góra Nie-jasnokomórkowy rak nerki (ncc RCC) niejednorodna grupa o zróżnicowanej histologii
Leczenie systemowe raka nie-jasnokomórkowego Piotr Tomczak Uniwersytet Medyczny w Poznaniu Klinika Onkologii Jastrzębia Góra Nie-jasnokomórkowy rak nerki (ncc RCC) niejednorodna grupa o zróżnicowanej histologii
Personalizacja leczenia rozsianego raka nerki.
 RAFAŁ STEC Personalizacja leczenia rozsianego raka nerki. Warszawa, 13 października 2018 roku Opis przypadku nr 1. Rozpoznanie Data rozpoznania: 07.11.2007 r. Pacjent: 65 lat, K Dane na temat guza: - Stopień
RAFAŁ STEC Personalizacja leczenia rozsianego raka nerki. Warszawa, 13 października 2018 roku Opis przypadku nr 1. Rozpoznanie Data rozpoznania: 07.11.2007 r. Pacjent: 65 lat, K Dane na temat guza: - Stopień
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 54/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 25 lipca 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 54/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 25 lipca 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo
RAK NERKOWO-KOMÓRKOWY UOGÓLNIONE STADIUM PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA
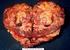 RAK NERKOWO-KOMÓRKOWY PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA Maciej Krzakowski Centrum Onkologii-Instytut im. Marii Skłodowskiej-Curie Warszawa 1 SYGNAŁOWE SZLAKI // TERAPEUTYCZNE CELE * Oudard i wsp.
RAK NERKOWO-KOMÓRKOWY PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA Maciej Krzakowski Centrum Onkologii-Instytut im. Marii Skłodowskiej-Curie Warszawa 1 SYGNAŁOWE SZLAKI // TERAPEUTYCZNE CELE * Oudard i wsp.
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
Stanowisko Rady Przejrzystości nr 262/2013 z dnia 17 grudnia 2013 r. w sprawie oceny leku Perjeta (pertuzumab) we wskazaniu zaawansowanego raka piersi
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 262/2013 z dnia 17 grudnia 2013 r. w sprawie oceny leku Perjeta (pertuzumab) we wskazaniu zaawansowanego raka
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 262/2013 z dnia 17 grudnia 2013 r. w sprawie oceny leku Perjeta (pertuzumab) we wskazaniu zaawansowanego raka
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 156/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 156/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Rak nerki. Patrycja Tudrej Biotechnologia, II rok USM
 Rak nerki Patrycja Tudrej Biotechnologia, II rok USM Budowa nerki (http://www.cancerresearchuk.org/; zmodyfikowano) 2 Charakterystyka epidemiologiczna raka nerki 3 pod względem występowania nowotwór urologiczny
Rak nerki Patrycja Tudrej Biotechnologia, II rok USM Budowa nerki (http://www.cancerresearchuk.org/; zmodyfikowano) 2 Charakterystyka epidemiologiczna raka nerki 3 pod względem występowania nowotwór urologiczny
Potencjał i dostępność leków ukierunkowanych molekularnie w leczeniu raka nerki
 Potencjał i dostępność leków ukierunkowanych molekularnie w leczeniu raka nerki Jakub Żołnierek, Centrum Onkologii-Instytut w Warszawie Seminarium edukacyjne pt.: Innowacje w leczeniu raka nerki Warszawa,
Potencjał i dostępność leków ukierunkowanych molekularnie w leczeniu raka nerki Jakub Żołnierek, Centrum Onkologii-Instytut w Warszawie Seminarium edukacyjne pt.: Innowacje w leczeniu raka nerki Warszawa,
www.aotm.gov.pl Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 84/2013 z dnia 22 czerwca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Afinitor
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 84/2013 z dnia 22 czerwca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Afinitor
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 130/2013 z dnia 22 lipca 2013 w sprawie oceny leku Afinitor (ewerolimus), tabletki, 5 mg, 30 tabl., kod EAN 5909990711567
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 130/2013 z dnia 22 lipca 2013 w sprawie oceny leku Afinitor (ewerolimus), tabletki, 5 mg, 30 tabl., kod EAN 5909990711567
Terapeutyczne Programy Zdrowotne 2009 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 9
 Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 89/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania produktu leczniczego Nexavar (sorafenib),
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 89/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania produktu leczniczego Nexavar (sorafenib),
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
S T R E S Z C Z E N I E
 STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 161/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 161/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Farmakoekonomika leczenia raka nerki w Polsce
 Rafał Zyśk Farmakoekonomika leczenia raka nerki w Polsce Uro-Onko 2012 Jastrzębia Góra, 11-12 maja 2012 Farmakoekonomika leczenia raka nerki w Polsce 1 USTAWA z dnia 12 maja 2011 r. o refundacji leków,
Rafał Zyśk Farmakoekonomika leczenia raka nerki w Polsce Uro-Onko 2012 Jastrzębia Góra, 11-12 maja 2012 Farmakoekonomika leczenia raka nerki w Polsce 1 USTAWA z dnia 12 maja 2011 r. o refundacji leków,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 43/2010 Prezesa Agencji Oceny Technologii Medycznych z dnia 20 grudnia 2010r. w sprawie usunięcia świadczenia opieki zdrowotnej z wykazu
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 43/2010 Prezesa Agencji Oceny Technologii Medycznych z dnia 20 grudnia 2010r. w sprawie usunięcia świadczenia opieki zdrowotnej z wykazu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 246/2014 z dnia 24 listopada 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 246/2014 z dnia 24 listopada 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 68/2011 z dnia 25 lipca 2011r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 68/2011 z dnia 25 lipca 2011r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
Ewerolimus (Afinitor ) w leczeniu pacjentów z rakiem nerki Raport ws. oceny świadczenia opieki zdrowotnej
 Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Ewerolimus (Afinitor ) w leczeniu pacjentów z rakiem nerki Raport ws. oceny świadczenia opieki zdrowotnej Raport Nr: Warszawa,
Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Ewerolimus (Afinitor ) w leczeniu pacjentów z rakiem nerki Raport ws. oceny świadczenia opieki zdrowotnej Raport Nr: Warszawa,
RAK NERKI, JĄDRA, PROSTATY I PĘCHERZA MOCZOWEGO
 RAK NERKI, JĄDRA, PROSTATY I PĘCHERZA MOCZOWEGO Piotr Wysocki Katedra i Klinika Onkologii Uniwersytet Jagielloński Collegium Medicum w Krakowie 2 RAK PĘCHERZA MOCZOWEGO zachorowalność 2010 r M=6,2 tys.;
RAK NERKI, JĄDRA, PROSTATY I PĘCHERZA MOCZOWEGO Piotr Wysocki Katedra i Klinika Onkologii Uniwersytet Jagielloński Collegium Medicum w Krakowie 2 RAK PĘCHERZA MOCZOWEGO zachorowalność 2010 r M=6,2 tys.;
Farmakoekonomika leczenia raka nerki w Polsce
 Rafał Zyśk Farmakoekonomika leczenia raka nerki w Polsce Uro-Onko 2012 Jastrzębia Góra, 11-12 maja 2012 Farmakoekonomika Farmakoekonomika leczenia raka nerki w HE USTAWA z dnia 12 maja 2011 r. o refundacji
Rafał Zyśk Farmakoekonomika leczenia raka nerki w Polsce Uro-Onko 2012 Jastrzębia Góra, 11-12 maja 2012 Farmakoekonomika Farmakoekonomika leczenia raka nerki w HE USTAWA z dnia 12 maja 2011 r. o refundacji
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 199/2014 z dnia 18 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 199/2014 z dnia 18 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
dr n. med. Paweł Nurzyński, prof. dr hab. n. med. Andrzej Deptała Klinika Onkologii i Hematologii, Centralny Szpital Kliniczny MSW w Warszawie
 Ewerolimus w codziennej praktyce klinicznej. Omówienie niemieckiego nieinterwencyjnego badania ewerolimusu w terapii przerzutowego raka nerki po niepowodzeniu leczenia inhibitorami kinaz tyrozynowych Everolimus
Ewerolimus w codziennej praktyce klinicznej. Omówienie niemieckiego nieinterwencyjnego badania ewerolimusu w terapii przerzutowego raka nerki po niepowodzeniu leczenia inhibitorami kinaz tyrozynowych Everolimus
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 88/2013 z dnia 29 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Halaven
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 88/2013 z dnia 29 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Halaven
Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Wniosek o objęcie refundacją leku Inlyta (aksytynib), tabl. powl. 1 mg, 56 szt., EAN 5909991004439, Inlyta (aksytynib), tabl. powl.
Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Wniosek o objęcie refundacją leku Inlyta (aksytynib), tabl. powl. 1 mg, 56 szt., EAN 5909991004439, Inlyta (aksytynib), tabl. powl.
Katarzyna Pogoda Warszawa, 23 marca 2017 roku
 Chemioterapia doustna i podskórne metody podawania leków w raku piersi. Lepsza jakość życia pacjentek Katarzyna Pogoda Warszawa, 23 marca 2017 roku Rak piersi - heterogenna choroba Stopień zaawansowania
Chemioterapia doustna i podskórne metody podawania leków w raku piersi. Lepsza jakość życia pacjentek Katarzyna Pogoda Warszawa, 23 marca 2017 roku Rak piersi - heterogenna choroba Stopień zaawansowania
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 191/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 191/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Terapeutyczne Programy Zdrowotne 2012 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 8
 Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 71/2011 z dnia 8 sierpnia 2011 r. w sprawie niezasadności zakwalifikowania świadczenia opieki zdrowotnej leczenie
Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 71/2011 z dnia 8 sierpnia 2011 r. w sprawie niezasadności zakwalifikowania świadczenia opieki zdrowotnej leczenie
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Wyniki zasadniczego badania fazy III u pacjentów z rakiem jelita grubego z przerzutami:
 Informacja prasowa Bayer HealthCare Public Relations Al.Jerozolimskie 158 02-326 Warszawa Polska Wyniki zasadniczego badania fazy III u pacjentów z rakiem jelita grubego z przerzutami: Pozytywne dane z
Informacja prasowa Bayer HealthCare Public Relations Al.Jerozolimskie 158 02-326 Warszawa Polska Wyniki zasadniczego badania fazy III u pacjentów z rakiem jelita grubego z przerzutami: Pozytywne dane z
Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008.
 załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Sunitynib [Sutent ] w programie terapeutycznym leczenia raka nerkowo-komórkowego
![Sunitynib [Sutent ] w programie terapeutycznym leczenia raka nerkowo-komórkowego Sunitynib [Sutent ] w programie terapeutycznym leczenia raka nerkowo-komórkowego](/thumbs/26/8384187.jpg) Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Sunitynib [Sutent ] w programie terapeutycznym leczenia raka nerkowo-komórkowego Raport ws. oceny świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Sunitynib [Sutent ] w programie terapeutycznym leczenia raka nerkowo-komórkowego Raport ws. oceny świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 30/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 30/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Lek Avastin stosuje się u osób dorosłych w leczeniu następujących rodzajów nowotworów w skojarzeniu z innymi lekami przeciwnowotworowymi:
 EMA/175824/2015 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/175824/2015 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH
 DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 61/2013 z dnia 15 kwietnia 2013 r. w sprawie zakwalifikowania świadczenia opieki zdrowotnej Przezcewnikowa nieoperacyjna
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 61/2013 z dnia 15 kwietnia 2013 r. w sprawie zakwalifikowania świadczenia opieki zdrowotnej Przezcewnikowa nieoperacyjna
Czy wiemy jak u chorych na raka gruczołu krokowego optymalnie stosować leczenie systemowe w skojarzeniu z leczeniem miejscowym?
 Czy wiemy jak u chorych na raka gruczołu krokowego optymalnie stosować leczenie systemowe w skojarzeniu z leczeniem miejscowym? Piotr Potemski Klinika Chemioterapii Nowotworów Katedry Onkologii Uniwersytet
Czy wiemy jak u chorych na raka gruczołu krokowego optymalnie stosować leczenie systemowe w skojarzeniu z leczeniem miejscowym? Piotr Potemski Klinika Chemioterapii Nowotworów Katedry Onkologii Uniwersytet
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 136/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 136/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Czy potrzebne jest powołanie w Polsce wyspecjalizowanych ośrodków leczenia chorych na raka jelita grubego ("colorectal units")?
 Czy potrzebne jest powołanie w Polsce wyspecjalizowanych ośrodków leczenia chorych na raka jelita grubego ("colorectal units")? Lucjan Wyrwicz Centrum Onkologii Instytut im M. Skłodowskiej-Curie w Warszawie
Czy potrzebne jest powołanie w Polsce wyspecjalizowanych ośrodków leczenia chorych na raka jelita grubego ("colorectal units")? Lucjan Wyrwicz Centrum Onkologii Instytut im M. Skłodowskiej-Curie w Warszawie
Spis treści. Przedmowa Barbara Czerska... 11 Autorzy... 17 Wykaz skrótów... 19
 Przedmowa Barbara Czerska.................................. 11 Autorzy.................................................... 17 Wykaz skrótów.............................................. 19 Rozdział I.
Przedmowa Barbara Czerska.................................. 11 Autorzy.................................................... 17 Wykaz skrótów.............................................. 19 Rozdział I.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 12/2011 z dnia 28 lutego 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu lub
Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 12/2011 z dnia 28 lutego 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu lub
Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska
 Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska Agencja Oceny Technologii Medycznych i Taryfikacji (AOTMiT) Słów kilka o HTA HTA nie jest: nauką o ochronie zdrowia nauką / analizą dot.
Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska Agencja Oceny Technologii Medycznych i Taryfikacji (AOTMiT) Słów kilka o HTA HTA nie jest: nauką o ochronie zdrowia nauką / analizą dot.
XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM
 XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM Wykonawca: MAHTA Sp z oo ul Rejtana 17/5 02-516 Warszawa Tel 22
XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM Wykonawca: MAHTA Sp z oo ul Rejtana 17/5 02-516 Warszawa Tel 22
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 85/ 2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 21 listopada 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 85/ 2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 21 listopada 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
Piotr Potemski. Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi
 Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Konferencje naukowe a praktyka kliniczna Podstawowe
Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Konferencje naukowe a praktyka kliniczna Podstawowe
Rak nerkowokomórkowy wyniki leczenia i skutki ekonomiczne wobec refundacyjnych możliwości w Polsce
 Artykuł przeglądowy Review article NOWOTWORY Journal of Oncology 2013, volume 63, number 3, 241 249 DOI: 10.5603/NJO.2013.0005 Polskie Towarzystwo Onkologiczne ISSN 0029 540X www.nowotwory.viamedica.pl
Artykuł przeglądowy Review article NOWOTWORY Journal of Oncology 2013, volume 63, number 3, 241 249 DOI: 10.5603/NJO.2013.0005 Polskie Towarzystwo Onkologiczne ISSN 0029 540X www.nowotwory.viamedica.pl
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
Leczenie chorych na przerzutowego raka nerkowokomórkowego fakty czy logika poparta faktami?
 PRACA PRZEGLĄDOWA Anna Drosik 1, Kazimierz Drosik 2 1 Klinika Onkologii Klinicznej i Doświadczalnej Centrum Onkologii Instytutu im. Marii Skłodowskiej-Curie, Oddział w Gliwicach 2 Oddział Onkologii Klinicznej
PRACA PRZEGLĄDOWA Anna Drosik 1, Kazimierz Drosik 2 1 Klinika Onkologii Klinicznej i Doświadczalnej Centrum Onkologii Instytutu im. Marii Skłodowskiej-Curie, Oddział w Gliwicach 2 Oddział Onkologii Klinicznej
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
zaawansowanym rakiem nerkowokomórkowym, rodzajem raka nerki, u pacjentów, którzy byli wcześniej leczeni lekami przeciwnowotworowymi;
 EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
czerniak (nowotwór skóry), który rozprzestrzenił się lub którego nie można usunąć chirurgicznie;
 EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 207/2014 z dnia 1 września 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 207/2014 z dnia 1 września 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 114/2014 z dnia 28 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 114/2014 z dnia 28 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Urologiczne leczenie paliatywne zaawansowanych raków nerki. Dr n. med. Roman Sosnowski Klinika Nowotworów Układu Moczowego, COI, Warszawa
 Urologiczne leczenie paliatywne zaawansowanych raków nerki Dr n. med. Roman Sosnowski Klinika Nowotworów Układu Moczowego, COI, Warszawa Nefrektomia Nefrektomia jest metodą umożliwiającą całkowite wyleczenie
Urologiczne leczenie paliatywne zaawansowanych raków nerki Dr n. med. Roman Sosnowski Klinika Nowotworów Układu Moczowego, COI, Warszawa Nefrektomia Nefrektomia jest metodą umożliwiającą całkowite wyleczenie
Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia
 Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia Analiza wpływu na system ochrony zdrowia maj 2013 Autorzy raportu:
Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia Analiza wpływu na system ochrony zdrowia maj 2013 Autorzy raportu:
Rak piersi. Doniesienia roku Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie
 Rak piersi Doniesienia roku 2014 Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie Miejscowe leczenie Skrócone napromienianie części piersi (accelerated partial breast irradiation;
Rak piersi Doniesienia roku 2014 Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie Miejscowe leczenie Skrócone napromienianie części piersi (accelerated partial breast irradiation;
Rak rdzeniasty tarczycy jako choroba rzadka. Ocenia się ze rocznie zachorowuje na raka rdzeniastego tarczycy około 100 osób w Polsce
 Rak rdzeniasty tarczycy jako choroba rzadka Ocenia się ze rocznie zachorowuje na raka rdzeniastego tarczycy około 100 osób w Polsce Rak rdzeniasty tarczycy 25% postać rodzinna - Objawowa (1/4) - Badania
Rak rdzeniasty tarczycy jako choroba rzadka Ocenia się ze rocznie zachorowuje na raka rdzeniastego tarczycy około 100 osób w Polsce Rak rdzeniasty tarczycy 25% postać rodzinna - Objawowa (1/4) - Badania
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 140/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Vectibix
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 140/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Vectibix
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia
 Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 19/2015 z dnia 23 marca 2015 r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie objęcia refundacją
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 19/2015 z dnia 23 marca 2015 r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie objęcia refundacją
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 79/2013 z dnia 1 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Esbriet
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 79/2013 z dnia 1 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Esbriet
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 34/2014 z dnia 27 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie Votubia (ewerolimus)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 34/2014 z dnia 27 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie Votubia (ewerolimus)
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Rekomendacja nr 38/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 9 czerwca 2011r.
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 38/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 9 czerwca 2011r. w sprawie zakwalifikowania świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 38/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 9 czerwca 2011r. w sprawie zakwalifikowania świadczenia opieki zdrowotnej
