zadań III etapu dotyczy właśnie złota. standardowych oceń trwałość jonów Au + i Au 3+ określając, w którą stronę
|
|
|
- Barbara Katarzyna Szewczyk
- 8 lat temu
- Przeglądów:
Transkrypt
1 L LIMPIADA CEMICZNA KMITET GŁÓWNY LIMPIADY CEMICZNEJ (Warszawa) ETAP III Zadania teoretyczne L I M P I A D A C EM I C Z N A ZADANIE 1 Złoto limpiada Chemiczna przeżywa swój złoty jubileusz. Dlatego jedno z zadań III etapu dotyczy właśnie złota. 1. Jest to pierwiastek, który może występować na 1 lub 3 stopniu utlenienia. Na podstawie podanych niżej wartości potencjałów standardowych oceń trwałość jonów Au i Au 3 określając, w którą stronę przesunięte jest położenie stanu równowagi reakcji dysproporcjonowania w temperaturze 5 o C: 3Au Au 3 Au. Złoto w przyrodzie występuje w postaci metalicznej, m.in. w skałach magmowych, a także w postaci rozdrobnionej obok innych minerałów. Jedną z metod uzyskiwania złota jest działanie natlenionym roztworem cyjanku sodu na minerał zawierający złoto. Powstaje wówczas kompleks [Au(CN) ] - (reakcja 1), który następnie jest redukowany metalicznym cynkiem, z wytworzeniem kompleksu [Zn(CN) 4 ] - (reakcja ). Zapisz jonowo równania reakcji 1 i. 3. Posługując się odpowiednimi danymi zamieszczonymi poniżej można wykazać, że termodynamicznie trwałą formą cyjankowego kompleksu złota jest kompleks Au(I), czyli: [Au(CN) ] -, a nie kompleks Au(III), czyli: [Au(CN) 4 ] - (zakładając stężenie jonów CN - równe 1 mol/dm 3 ). Potwierdź ten wniosek, wykazując, że położenie stanu równowagi reakcji dysproporcjonowania: 3[Au(CN) (CN) 4 ] - Au CN - ] - [Au
2 jest przesunięte w lewo, w temperaturze 5 o C. 4. Złoto wykazuje nietypowe właściwości chemiczne, co częściowo zawdzięcza dość dużej elektroujemności (wynoszącej,4 w skali Paulinga), porównywalnej z elektroujemnością jodu. Przykładem takich nietypowych właściwości jest wynik stapiania złota z cezem w warunkach beztlenowych, gdzie stały produkt powstały w reakcji: Cs Au CsAu nie wykazuje cech metalicznych. Spróbuj przewidzieć charakterystyczne cechy CsAu (budowa, jedna przykładowa cecha fizyczna). 5. W wyniku analogicznego procesu stapiania złota z potasem powstaje już jednak typowy stop o cechach metalicznych. Jak wytłumaczysz różnicę w przebiegu obu procesów stapiania złota z cezem i potasem? 6. Związek CsAu w kontakcie z wodą ulega rozkładowi, przy czym jednym z produktów jest metaliczne złoto. Zapisz jonowo równanie przebiegającej reakcji. 7. Wyjaśnij znaczenie terminów związanych ze złotem: purpura Kasjusza i białe złoto. Potencjały standardowe: E 0 (Au 3 /Au) = 1,60 V; E 0 (Au 3 /Au ) = 1,41 V. Stałe trwałości kompleksów: dla [Au(CN) (CN) 4 ] - β 4 = ] - β = ; dla [Au. Stała gazowa: R = 8,314 J/(mol K); stała Faraday a: F = C Zadanie Sekwencja reakcji organicznych Związek 1 o masie molowej 138 g/mol poddano ozonolizie, a po hydrolizie powstałego ozonku otrzymano cykloheksanon oraz związek, który poddano analizie metodami spektroskopowymi (widma załączone niżej). Po rozdzieleniu produktów ozonolizy,
3 3 cykloheksanon poddano reakcji z benzaldehydem w wodnym roztworze wodorotlenku sodu, otrzymując związek 3. Z kolei związku użyto do reakcji ze związkiem 4, który otrzymano z trifenylofosfiny i bromoetanu w procesie katalizowanym przez zasadę. Produktami reakcji związków i 4 są dwa izomery: 5 i 6. Jeden z tych izomerów poddano reakcji ze związkiem 7, otrzymując mieszaninę związków bicyklicznych. (jeden z nich przedstawiono na schemacie). 3 C 3 benzaldehyd, woda, Na C 3 C3 1 M = 138 g/mol 1) 3 ) Zn, 7 C C C 3 C Br (C 6 5 ) 3 P 4 Polecenia: a) narysuj wzory strukturalne związków 1, 3, 4, 5, 6, 7. b) ustal i uzasadnij strukturę związku podając wnioski jakie można wyciągnąć z poszczególnych widm. c) podaj nazwy procesów: cykloheksanon benzaldehyd
4 6 7 zw. bicykliczne. 4 d) podaj, do jakiej grupy związków organicznych należy związek 4? e) przykładem jakiej izomerii są związki 5 i 6? f) uzasadnij strukturę izomeru 6, który został użyty do reakcji ze związkiem 7. Widmo IR związku Widmo 1 NMR związku
5 5 Zadanie 3 Ustalenie struktury wybranego gangliozydu - składnika błon biologicznych Związek z grupy gangliozydów poddano ozonolizie prowadzonej bez następczej redukcji. W wyniku tej reakcji otrzymano dwa związki: A i B, które rozdzielono chromatograficznie. Związek A poddano analizie elementarnej. W wyniku spalania 8 mg (1 milimola) związku A otrzymano - jako jedyne produkty: 5 mg i 616 mg C. Badania spektroskopowe związku A wykazały, że w cząsteczce tego związku obecne są wyłącznie I- i II-rzędowe atomy węgla; jednocześnie w widmie protonowym zaobserwowano singlet przy 10,5 ppm. Związek B poddano reakcji hydrolizy enzymatycznej działając β-1,4-glikozydazą. (β-1,4-glikozydaza jest enzymem, który hydrolizuje wiązania β 1,4 glikozydowe). Produkty hydrolizy enzymatycznej rozdzielono chromatograficznie uzyskując związki: C i D. Stosunek
6 molowy C : D = :1. 6 Związek C redukuje roztwory Fehlinga i Tollensa. Skręcalność właściwa związku C okazała się identyczna ze skręcalnością właściwą substancji otrzymywanej w wyniku całkowitej hydrolizy skrobi. Związek D poddano hydrolizie chemicznej w środowisku kwaśnym. W produktach tej hydrolizy stwierdzono 3 związki: E, F i G. Związek G był również jednym z dwóch produktów reakcji hydrolizy enzymatycznej związku D, przeprowadzonej przy użyciu maltazy. Związek E okazał się podstawionym β-aminokwasem zawierającym dodatkowo grupy hydroksylowe, przyłączone do I- i II-rzędowego atomu węgla. Pik jonu pseudomolekularnego tego związku, stwierdzony za pomocą spektrometrii mas ze źródłem jonizacji typu elektrosprej, miał wartość 136 ( [M] ). Związek F okazał się identyczny ze związkiem A. Związek G okazał się identyczny ze związkiem C. Na podstawie danych zawartych w zadaniu 1. Podaj wzór sumaryczny związku A. Narysuj i uzasadnij wzór strukturalny związku A 3. Narysuj i uzasadnij wzór strukturalny związku C 4. Narysuj i uzasadnij wzór strukturalny związku E 5. Narysuj i uzasadnij wzór strukturalny związku D
7 7 6. Narysuj i uzasadnij wzór strukturalny związku B 7. Narysuj i uzasadnij wzór strukturalny związku wyjściowego, wiedząc, że zawiera on m.in. - jedno wiązanie amidowe, - 3 grupy hydroksylowe związane z I-rzędowymi atomami węgla We wzorze strukturalnym związku wyjściowego nie uwzględniaj budowy przestrzennej fragmentu aglikonu (AGLIKN to cząsteczka powiązana wiązaniem glikozydowym z cząsteczką mono lub oligosacharydu). Zadanie 4 Polskie rudy miedzi Polskie rudy miedzi mają unikatowy w skali światowej skład chemiczny i mineralogiczny. Są to praktycznie rudy polimetaliczne. Jednak wiele rzadkich pierwiastków traconych jest w procesie flotacji. Tworzące się w tym procesie pęcherzyki powietrza wynoszą minerały zawierające metale użyteczne na powierzchnię w postaci piany, natomiast odpad, tzw. skała płonna, opada na dno. W zadaniu zajmiemy się hipotetyczną obróbką skały płonnej. Dla uproszczenia zadania założymy, że składa się ona z kwarcu (Si ), siarczku rutenu(iv) i siarczku osmu(vi). a) koło 1 kg skały bardzo dokładnie zmielono, umieszczono w dużym autoklawie i zadano nadmiarem roztworu Cl. Autoklaw zamknięto, usunięto z niego powietrze, a jego zawartość ogrzano i poddano działaniu ciśnienia (argon). Całą mieszaninę intensywnie mieszano. Po
8 8 zakończeniu reakcji autoklaw ochłodzono, doprowadzono do wyrównania ciśnienia, przepłukując jednocześnie autoklaw argonem w celu usunięcia gazów poreakcyjnych. Zakładamy, że w trakcie tego procesu żaden z pierwiastków nie zmienił swojego stopnia utlenienia. b) Mieszaninę poddano filtracji, a z uzyskanego w jej wyniku roztworu X usunięto nadmiar Cl i zatężono go do objętości około 10 cm 3. Do tak otrzymanego roztworu dodano 10 cm 3 hydrazyny, cały czas roztwór intensywnie mieszając. W wyniku egzotermicznej reakcji uzyskano stały produkt, który odsączono, przemyto wodą, alkoholem etylowym i eterem i suszono na powietrzu. c) Badania uzyskanego produktu wykazały, że jest on mieszaniną dwóch kompleksowych związków K 1 i K. Pierwszy z nich jest związkiem rutenu, drugi - związkiem osmu. W obu substancjach platynowce występują w części kationowej. W skład tych kationów, poza jednym atomem rutenu lub osmu, wchodzą jako ligandy azot i amoniak. W przypadku obu kationów liczba koordynacyjna atomu centralnego (Ru, s) wynosi 6, zaś stopień utlenienia centrów koordynacji jest równy. ba ligandy, azot i amoniak, pochodzą z rozkładu hydrazyny. d) Stwierdzono, że kompleks zawierający ruten (K 1 ) ma masę molową równą 85,1g/mol, a masa molowa kompleksu zawierającego osm (K ) równa jest 385, g/mol. 1. Podaj wzory cząsteczkowe kompleksów K 1, K oraz ich nazwy. Przedstaw sposób obliczenia liczby ligandów w kompleksach K 1 i K. Napisz jonowo reakcje hydrazyny ze związkami rutenu i osmu zawartymi w rozworze X. Przedstaw sposób bilansowania, podaj odpowiednie równania połówkowe, wskaż substancje pełniące w reakcjach funkcje utleniaczy i reduktorów. 3. Narysuj budowę przestrzenną kationów wchodzących w skład związków K 1 oraz K. Podaj budowę ewentualnych izomerów. Przy rozpatrywaniu budowy przestrzennej ligandy traktuj jako punkty. 4. Podaj nazwę figury geometrycznej, jaką kreślą w przestrzeni ligandy zgromadzone wokół centrów koordynacji kationów w związkach K 1 oraz K.
9 W obliczeniach masy atomowe należy zaokrąglić do jednego miejsca po przecinku. 9 Zadanie 5 Kinetyka reakcji inwersji sacharozy Dogodną metodą badania kinetyki reakcji substancji optycznie czynnych może być pomiar skręcalności optycznej w funkcji czasu. Jednym z przykładów zastosowania tej metody jest badanie kinetyki dwuetapowej reakcji inwersji sacharozy (S), polegającej na jej hydrolizie w obecności katalizatora kwasowego, z utworzeniem cukrów prostych: fruktozy (F) i glukozy (G). Etap I: S k k 1-1 S Etap II: S k G F 1.a. Napisz wyrażenia na szybkość zmiany stężenia protonowanej formy sacharozy S (czyli na pochodną stężenia [S ] względem czasu) dla poszczególnych, uwidocznionych na schemacie trzech reakcji (o stałych szybkości: k 1, k -1, k ) dla każdej reakcji z osobna. b. Na podstawie wyrażeń otrzymanych w punkcie 1-a napisz równanie na szybkość zmiany stężenia protonowanej sacharozy S (czyli na pochodną stężenia [S ] względem czasu) w powyższym dwuetapowym procesie. c. Wykorzystując tzw. przybliżenie stanu stacjonarnego (polega ono na założeniu, że stężenie
10 10 produktu pośredniego szybko osiąga wartość stałą i nie ulega praktycznie zmianom w czasie reakcji) i zakładając, że spełnione jest ono dla produktu pośredniego powyższego procesu, zapisz matematyczny warunek stałości stężenia [S ], posługując się wyrażeniem wyprowadzonym w punkcie 1.b. d. Z równania uzyskanego w punkcie 1.c. wyprowadź wzór na stężenie [S ] w funkcji stężeń użytych do reakcji substratów.. a. W przypadku zilustrowanym powyższym schematem (gdy pierwszy etap jest etapem odwracalnym) całkowita szybkość procesu określona jest przez szybkość etapu nieodwracalnego. Napisz wyrażenie na szybkość reakcji (v) w funkcji stężeń substratów całego dwuetapowego procesu [ v = f(stęż. substratów) ] korzystając z wyników otrzymanych w punkcie 1. b. Gdy reakcja przebiega w rozcieńczonym wodnym roztworze, stężenie wody można traktować jako wartość stałą. Jaką uproszczoną postać przybierze wówczas wyrażenie z punktu.a.? Jaki będzie rząd badanej dwuetapowej reakcji? c. kreślając szybkość procesu jako pochodną stężenia [S] względem czasu i opierając się na wnioskach wyciągniętych w punkcie.b. napisz równanie różniczkowe na szybkość procesu inwersji sacharozy. 3. a. znaczając przez α S, α F, α G skręcalności molowe poszczególnych reagentów wyprowadź wzór na skręcalność mieszaniny reakcyjnej α. Wyraź tę skręcalność w funkcji [S] i [S 0 ] ([S 0 ] początkowe stężenie sacharozy) b. znaczając przez α 0 skręcalność początkową, a przez α skręcalność końcową mieszaniny reakcyjnej (po zakończeniu reakcji) oraz wiedząc, że rozwiązanie równania różniczkowego z punktu.c. (na szybkość reakcji inwersji) ma postać: [S] ln = kt k stała szybkości reakcji [S ] 0 wyprowadź ( opierając się na oznaczeniach z punktu 3.a.) równanie umożliwiające wyznaczenie
11 11 stałej szybkości reakcji na podstawie pomiaru całkowitej skręcalności roztworu α w funkcji czasu. 4. Na podstawie poniższych danych dotyczących reakcji w rozcieńczonym roztworze wodnym oblicz stałą szybkości reakcji inwersji sacharozy (dla T = 98 K). Czy uzyskane wyniki pomiarów są zgodne z przedstawionym wyżej mechanizmem reakcji? t [min] α [ ] 15,00 9,35 4,95 1,60-1,00-3,10-10,00 5. blicz czas połowicznego przereagowania t 1/
12 1 RZWIĄZANIE ZADANIA 1 1. Rozpatrując reakcje: Au 3 e Au oraz Au e Au i biorąc pod uwagę znane wartości potencjałów standardowych, można wyznaczyć potencjał standardowy układu Au /Au: E 0 (Au /Au). Dla standardowych entalpii swobodnych: ΔG 0 (Au 3 Au) = ΔG 0 (Au 3 Au ) ΔG 0 (Au Au). Wiedząc, że ΔG 0 =-nfe 0 (n: liczba elektronów wymienianych w reakcji, F: stała Faraday a), uzyskujemy po uproszczeniu: 3 E 0 (Au 3 /Au) = E 0 (Au 3 /Au ) E 0 (Au /Au). Stąd, E 0 (Au /Au) = 3 E 0 (Au 3 /Au) - E 0 (Au 3 /Au ) = 3 1,60 V - 1,41 V = 1,98 V. Położenie stanu równowagi reakcji dysproporcjonowania: 3Au Au 3 Au przesunięte jest w prawo, ponieważ E 0 (Au /Au) > E 0 (Au 3 /Au ). znacza to, że jony Au nie są formą termodynamicznie trwałą.. 4 Au 8 CN - 4 [Au(CN) ] (reakcja 1) oraz: Zn [Au(CN) ] - [Zn(CN) 4 ] - Au (reakcja ). 3. Trwałość kompleksu [Au(CN) ] - oznacza, że nie ulega on dysproporcjonowaniu do metalicznego Au i kompleksu [Au(CN) 4 ] - : 3[Au(CN) ] - [Au(CN) 4 ] - Au CN -. Postępujemy podobnie jak w punkcie 1, porównując potencjały standardowe odpowiednich układów redoks. Wyznaczamy tym razem wartości potencjałów standardowych E 0 ([Au(CN) ] - /Au) i E 0 ([Au(CN) 4 ] - / [Au(CN) ] - ). Dla reakcji połówkowej: [Au(CN) ] - e Au CN -, równanie Nernsta przybiera
13 postać: 13 E = E 0 ([Au(CN) - ]/Au) 0,059log{[Au(CN) - ]/[CN - ] } = = E 0 (Au /Au) 0,059log[Au ] = E 0 (Au /Au) 0,059log{[Au(CN) - ]/(β [CN - ] )}. (Człon logarytmiczny równania można też zapisać ogólniej w postaci (RT/F)lnX zamiast 0,059logX, gdzie T jest temperaturą w K). trzymujemy: E 0 ([Au(CN) ] - /Au) = E 0 (Au /Au) 0,059 logβ. Po podstawieniu: E 0 ([Au(CN) ] - /Au) = -0,8 V. Dla reakcji połówkowej [Au(CN) 4 ] - e [Au(CN) ] - CN -, równanie Nernsta przybiera postać: E = E 0 ([Au(CN) 4 ] - / [Au(CN) ] - ) (0,059/)log{[Au(CN) 4 - ]/([Au(CN) - ][CN - ] )} = = E 0 (Au 3 /Au ) (0,059/)log{[Au 3 ]/[Au ]} = = E 0 (Au 3 /Au ) (0,059/)log{[Au(CN) 4 - ]β / ([Au(CN) - ]β 4 [CN - ] )} i otrzymujemy: E 0 ([Au(CN) 4 ] - / [Au(CN) ] - ) = E 0 (Au 3 /Au ) (0,059/)log(β 4 /β ). Po podstawieniu: E 0 ([Au(CN) 4 ] - / [Au(CN) ] - ) = 0,89 V. Ponieważ E 0 ([Au(CN) ] - /Au) < E 0 ([Au(CN) 4 ] - / [Au(CN) ] - ), to (dla stężenia jonów cyjankowych 1 mol/dm 3 ) położenie stanu równowagi reakcji dysproporcjonowania jest przesunięte w lewo. znacza to, że kompleks [Au(CN) ] - jest formą termodynamicznie trwałą. 4. Dzięki dużej różnicy elektroujemności Au (,4) i Cs (0,7), związek CsAu jest solą o budowie jonowej, o sieci przestrzennej złożonej z kationów Cs i anionów Au -. Związek ten ma właściwości typowych soli jonowych, m.in. wykazuje niskie przewodnictwo elektryczne w stanie stałym. 5. Różnica elektroujemności złota (,4) i potasu (0,9) jest mniejsza niż dla cezu i złota, co powoduje, że sól KAu o budowie jonowej nie powstaje. 6. CsAu Au Cs - ½.
14 14 7. Purpura Kasjusza silnie rozdrobnione złoto (zol) o barwie czerwonej, które można otrzymać w wyniku redukcji AuCl 4 za pomocą SnCl. Białe złoto stop złota z takimi metalami jak nikiel, srebro, cynk, platyna, pallad, charakteryzujący się barwą srebrzystobiałą. RZWIĄZANIE ZADANIA W wyniku ozonolizy w podanych warunkach powstają związki karbonylowe. Znając masę molową związku 1 i drugi produkt ozonolizy, możemy obliczyć masę molową związku. M 1 =138 g/mol, M cykloheksanonu = 98 g/mol, przy czym ze związku 1 pochodzi 8 g/mol ( po odjęciu masy molowej tlenu), stąd M = (tlen) = 7 g/mol. W widmie IR silne pasmo absorpcji przy nieco ponad 1700 cm -1 wskazuje na obecność grupy karbonylowej, a ponieważ jest to produkt ozonolizy (w warunkach redukcyjnych), sygnał ten pochodzi od grupy karbonylowej aldehydu lub ketonu. W widmie 1 NMR obserwujemy 3 grupy sygnałów: singlet przy ok. ppm, pochodzący od izolowanej grupy równocennych magnetycznie protonów oraz układ charakterystyczny dla grupy etylowej: kwartet przy ok.,5 ppm(-c -) i tryplet przy ok. 1 ppm (-C 3 ). Biorąc pod uwagę stosunek protonów, od których pochodzą poszczególne sygnały oraz obliczoną masę molową związku, stwierdzamy, że w związku występuje jedna grupa etylowa oraz izolowana grupa metylowa. Ponieważ w widmie NMR nie ma charakterystycznego sygnału pochodzącego od protonu aldehydowego, zatem związek musi być ketonem. Na podstawie danych spektroskopowych, obliczonej masy molowej oraz faktu, że związek jest produktem ozonolizy w warunkach redukcyjnych, jednoznacznie możemy określić strukturę związku. Jest to -butanon. Znając strukturę związku można narysować wzór strukturalny związku 1. Cykloheksanon reaguje z benzaldehydem w krzyżowej kondensacji aldolowej, ulegając natychmiast dehydratacji, w wyniku czego powstaje α,β-nienasycony keton 3. Związek 4 to ylid fosforowy, który reagując z -butanonem w reakcji Wittiga tworzy
15 15 izomeryczne alkeny. Są to izomery geometryczne E i Z (związki 5 i 6). Izomer 6 poddano reakcji cykloaddycji Dielsa Aldera z -metylocyklopentadienem (związek 7). strukturze związku 7 wnioskujemy na podstawie struktury produktu w reakcji Dielsa - Aldera. Z uwagi na stereospecyficzny przebieg tej reakcji, można na podstawie struktury produktu określić, który z izomerów był substratem w tej reakcji. Wzajemne ułożenie podstawników w bicylkicznym produkcie np. grup metylowych pochodzących z alkenu wskazuje, że izomerem 6 użytym do reakcji, był izomer geometryczny E. C 3 3 C C C 3 C C C 3 C C Ph 3 P CC 3 4 C C 3 C 7 C 3 C 3 C 3 5 izomer Z 6 izomer E RZWIĄZANIE ZADANIA 3 Produktami reakcji ozonolizy bez następczej redukcji są kwasy karboksylowe (zamiast aldehydów) lub ketony. Związek A wykazuje singlet przy 10,5 ppm, a zatem jest on kwasem karboksylowym. Analiza związku A: 1 mmol, czyli 8 mg zawiera: atomy C: 1mmol 616 mg = 14 mmoli 44 mg
16 atomy : 16 mmol 5 mg 18 mg = 8 mmoli Z treści zadania wynika, że poza C i nie powstają żadne inne produkty w czasie analizy spaleniowej, stąd wniosek, że związek A oprócz węgla i wodoru może zawierać tylko tlen. Masa tlenu zawartego w jednym milimolu związku A: 8 mg 14mmoli 1mg/mmol- 8mmoli 1mg/mmol=3 mg, co stanowi mmol tlenu Wzór sumaryczny związku A jest więc następujący: C 14 8 Z treści zadania wiadomo, że związek A zawiera tylko I- i II-rzędowe atomy węgla, zatem szkielet węglowy tego związku musi mieć budowę liniową. Musi być to zatem 14-węglowy kwas karboksylowy kwas tetradekanowy Wzór strukturalny związku A: Analiza związku B: ydroliza enzymatyczna przy użyciu β-1,4-glikozydazy wskazuje, że związek B zawiera wiązanie (lub wiązania) β-glikozydowe, a w przypadku wiązań glikozydowych między cząsteczkami monosacharydów, muszą być to wiązania β-1,4-glikozydowe. Analiza produktów hydrolizy enzymatycznej związku B: Związek C: Związek C jest produktem hydrolizy enzymatycznej po działaniu β-1,4-glikozydazy, może być to zatem mono- lub oligosacharyd lub też niesacharydowy aglikon połączony z jednostką sacharydową
17 17 wiązaniem β-glikozydowym. Dane dotyczące skręcalności właściwej sugerują, że związkiem tym jest D-glukopiranoza, a informacja o redukcji roztworów Fehlinga i Tollensa potwierdza to przypuszczenie Ponieważ stosunek molowy związków C:D wynosił :1, więc w wyjściowym związku znajdują się co najmniej cząsteczki glukozy, połączone wiązaniem β-glikozydowym. Związek D: Analiza produktów hydrolizy w środowisku kwaśnym: związek E: jest to β-aminokwas, zawierający dwie grupy. masa molowa grupy N jest równa 16 g/mol, grupy C 45 g/mol, a grupy 17 g/mol, natomiast masa molowa całego związku C wynosi (z danych spektrometrii mas) g/mol pozostaje różnica: = 40 g/mol (odpowiada to łańcuchowi: C -C-C) Wartość ta sugeruje, że związek C jest najprostszym możliwym β-aminokwasem zawierającym dwie grupy hydroksylowe przyłączone do I- i II-rzędowego atomu węgla, a jego wzór strukturalny jest następujący: N związek F jest identyczny ze związkiem A (kwas tłuszczowy)
18 18 związek G jest identyczny ze związkiem C (D-glukopiranoza). Ponieważ ta cząsteczka glukozy nie jest odcinana β-1,4-glikozydazą, jest natomiast odcinana maltazą, więc jest połączona z aglikonem wiązaniem α-glikozydowym. kreślenie struktury związku wyjściowego: Na sposób połączenia pomiędzy fragmentami: E i F wskazuje obecność wiązania amidowego w wyjściowym związku. Sposób połączenia pomiędzy fragmentami C i D: 1. Dwie cząsteczki D-glukozy (związek C) są połączone ze sobą wiązaniem β-glikozydowym. Ten disacharyd musi być również połączony wiązaniem β-glikozydowym, stąd wniosek, że jest połączony z trzecią cząsteczką D-glukozy (związek G). Liczba grup hydroksylowych związanych z I-rzędowymi atomami węgla w części sacharydowej (3 grupy) wskazuje, że w części aglikonowej nie ma grupy hydroksylowej, związanej z I-rzędowym atomem węgla. Wskazuje to na miejsce połączenia sacharydu z aglikonem (wiązanie glikozydowe utworzone jest kosztem I-rzędowej grupy hydroksylowej związku D). Struktura związku D: N Struktura związku B:
19 19 N Ponieważ w wyniku ozonolizy powstają związki A i B, muszą być one połączone wiązaniem podwójnym. Miejsce wiązania podwójnego w związku wyjściowym określa położenie grup karboksylowych w produktach ozonolizy (związki A i B). Struktura wyjściowego związku jest więc następująca: N C()C=CC 13 7 RZWIĄZANIE ZADANIA 4 1. Na podstawie danych zawartych w punkcie c) łatwo stwierdzić, że związki K 1 oraz K poza rutenem lub osmem muszą zawierać po dwa atomy chloru jako aniony. Po odjęciu od masy cząsteczkowej K 1 dwóch mas atomowych chloru uzyskujemy łączną masę ligandów (N N 3 ) równą Δ 1 =113 g/mol. Analogicznie dla związku K Δ =14 g/mol. Ponieważ liczba koordynacyjna obu kationów jest równa 6, więc w otoczeniu koordynacyjnym rutenu i osmu może znajdować się: n cząsteczkek N i 6 - n cząsteczek N 3. W poniższej tabeli zaprezentowano sposób obliczenia liczby ligandów w cząsteczkach K 1 oraz K. Liczba Łączna masa Związek K 1 Związek K
20 0 ligandów N ligandów N Liczba cząst. Liczba cząst. M L Δ m= 113-M L N 3 Δ m= 14-M L N 3 Δ m /17 Δ m / , , ,71 40, ,06 1 0, <0 <0 Związek K 1 to [Ru(N 3 ) 5 (N )]Cl czyli chlorek pentaamina(diazot)rutenu(ii) Związek K to [s(n 3 ) 4 (N ) ]Cl czyli chlorek tetraaminadi(diazot)osmu(ii) dopuszczalna nazwa: chlorek tetraaminabis(diazot)osmu(ii). Reakcja Ru (IV) oraz s (VI) z hydrazyną a) Ru (IV) N 4 [Ru(N 3 ) 5 (N )] Równania połówkowe: Ru (IV) e = Ru (II) (1) N 4 e = N 3 () N 4 = N 4 4e (3) Ruten(IV) jest w tej reakcji utleniaczem ydrazyna jest w niej zarówno utleniaczem jak i reduktorem. Jeden atom rutenu wiąże 5 cząsteczek N 3 - w związku z tym, aby uzyskać całkowite współczynniki liczbowe, mnożymy równanie () przez pięć i odpowiednio równanie (1) przez dwa.
21 1 Ru (IV) 4e = Ru (II) (4) 5N e = 10N 3 (5) Sumujemy (4) (5) Ru (IV) 5N e = Ru (II) 10N 3 (6) N 4 = N 4 4e (3) statecznie po wymnożeniu równania (3) przez siedem oraz równania (6) przez dwa i zsumowaniu (6) i (3) uzyskujemy 4Ru (IV) 17N 4 0 8e = 4Ru (II) 0N 3 7N 8 8e (7) Po uproszczeniu obu stron uzyskujemy ostatecznie 4Ru (IV) 17N 4 = 4[Ru(N 3 ) 5 (N )] 3N 8 (8) b) Reakcja s (VI) z hydrazyną - sposób obliczenia i charakter reagentów analogiczny do punktu (a). Zbilansowana reakcja sumaryczna jonowo: s (VI) 4N 4 = [s(n 3 ) 4 (N ) ] 4 Analogicznie osm(vi) jest w tej reakcji utleniaczem ydrazyna jest w niej zarówno utleniaczem jak i reduktorem. 3. Budowa przestrzenna : N N N N 3 N 3 N 3 N 3 N 3 N Ru s s N 3 N 3 N 3 N 3 N 3 N 3 N 3 N N 3
22 trans- cis- [Ru(N 3 ) 5 (N )]Cl [s(n 3 ) 4 (N ) ]Cl 4. Struktura przestrzenna kationów w związkach K 1 oraz K oparta jest na bipiramidzie o podstawie kwadratowej. RZWIĄZANIE ZADANIA 5 1.a. Szybkości poszczególnych procesów można zapisać równaniami: d ] = k1[s][ [S dt ] d ] = k -1[S [S dt ] d[s dt ] = k [S ][ ] b. Wyrażenie na szybkość całego dwuetapowego procesu można zatem zapisać następująco: d[s dt ] = k1[s][ ] k -1[S ] k c. Z przybliżenia stanu stacjonarnego wynika warunek, że szybkość tworzenia produktu pośredniego [S ][ ] S (z wyjątkiem początkowego etapu reakcji) jest równa zeru, czyli: d[s ] dt = 0. ds [ ] dt = k [ S][ ] k [ S ] k [ S ][ ]= 0 d. Po przekształceniu powyższego równania otrzymujemy: 1-1 [ S ] = k[s][ 1 ] k k [ ] 1 (1).a. Całkowitą szybkość reakcji możemy utożsamić z szybkością drugiego, nieodwracalnego etapu - będzie więc ona dana wzorem: v = k [S ][ ]
23 3 Po uwzględnieniu równania (1) otrzymujemy: v = k [S ][ ] = k k1[s][ ][ ] k k [ ] 1 b. Ponieważ [ ] = const. i woda występuje w dużym nadmiarze, czyli [ ] const., możemy wprowadzić nową stałą k : k = kk1[ k k 1 ][ ] [ ] i ostatecznie: v k [S] WNISEK: Reakcja inwersji sacharozy w przypadku zastosowania dużego nadmiaru wody jest reakcją I rzędu. c. Równanie kinetyczne należy zapisać w postaci różniczkowej: d[s] = k [S] () dt 3. a. Skręcalność roztworu jest sumą skręcalności optycznie czynnych reagentów, czyli sacharozy, fruktozy i glukozy. α = α S [S] α F [F] α G [G]; α S, α F, α G skręcalności molowe reagentów ponieważ [F] = [G] = [S 0 ] [S], gdzie [S 0 ] - stężenie początkowe sacharozy, więc α = α S [S] (α F α G ){ [S 0 ] [S]} α = (α S α F α G ) [S] (α F α G ) [S 0 ] α = α [S] α [S 0 ], α = (α S α F α G ), α = (α F α G ) b. Całkowanie równania () (UWAGA! całkowanie tego równania różniczkowego nie jest od zawodników wymagane.): d[s] = k [S] dt Po rozdzieleniu zmiennych: d[s] = kdt [S]
24 4 Następnie całkujemy po d[s] w granicach S 0 -S i odpowiednio po dt w granicach 0-t: [S] d[s] [S] = k [S0 ] 0 statecznie otrzymujemy równanie podane w treści zadania: t dt [S] ln = kt (3) [S ] 0 Wykorzystując wprowadzone w poprzednim punkcie oznaczenia możemy napisać następujące zależności: α = α [S 0 ] α α = α [S] α 0 α = α [S 0 ] Po zastąpieniu stosunku stężeń odpowiednim wyrażeniem będącym funkcją skręcalności całkowitej α scałkowane równanie kinetyczne dla reakcji inwersji sacharozy ma następującą postać: [S] α α ln = ln [S ] α α 0 0 = kt 4. bliczenie stałej szybkości na postawie scałkowanego równania kinetycznego. t [min] k [min -1 ] Wartości stałych szybkości dla kolejnych punktów α(t) są bardzo zbliżone, a ich wartość średnia k śr = 0,056 min -1. Wyniki pomiarów potwierdzają zatem słuszność proponowanego mechanizmu reakcji rząd reakcji wynosi z dobrym przybliżeniem 1 (ściśle rzecz biorąc, mówimy, że reakcja jest pseudo I rzędu, ponieważ woda występowała w dużym nadmiarze i nie było w praktyce możliwe
25 zaobserwowanie wpływu zmiany jej stężenia na szybkość reakcji) bliczenie czasu połowicznego przereagowania. [S0 ]/ ln = [S ] t 1/ 0 1 ln = kt ln = 7 min k 1/
Z a d a n i a t e o r e t y c z n e
 Chemicznej L I M P I A D A 1954 50 2003 C EM I C Z N A Z a d a n i a t e o r e t y c z n e Złoto ZADANIE 1 limpiada Chemiczna przeżywa swój złoty jubileusz. Dlatego jedno z zadań III etapu dotyczy właśnie
Chemicznej L I M P I A D A 1954 50 2003 C EM I C Z N A Z a d a n i a t e o r e t y c z n e Złoto ZADANIE 1 limpiada Chemiczna przeżywa swój złoty jubileusz. Dlatego jedno z zadań III etapu dotyczy właśnie
II Podkarpacki Konkurs Chemiczny 2009/10. ETAP II r. Godz Zadanie 1 (10 pkt.)
 II Podkarpacki Konkurs Chemiczny 2009/10 ETAP II 19.12.2009 r. Godz. 10.00-12.00 KPKCh Zadanie 1 (10 pkt.) 1. Gęstość 22% roztworu kwasu chlorowodorowego o stężeniu 6,69 mol/dm 3 wynosi: a) 1,19 g/cm 3
II Podkarpacki Konkurs Chemiczny 2009/10 ETAP II 19.12.2009 r. Godz. 10.00-12.00 KPKCh Zadanie 1 (10 pkt.) 1. Gęstość 22% roztworu kwasu chlorowodorowego o stężeniu 6,69 mol/dm 3 wynosi: a) 1,19 g/cm 3
Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014 Imię i nazwisko uczestnika Szkoła Klasa Nauczyciel Imię
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014 Imię i nazwisko uczestnika Szkoła Klasa Nauczyciel Imię
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
ROZWIĄZANIA ZADAŃ Z III ETAPU 50 KRAJOWEJ OLIMPIADY
 RZWIĄZANIA ZADAŃ Z III ETAPU 50 KRAJWEJ LIMPIADY CEMICZNEJ KMITET GŁÓWNY LIMPIADY CEMICZNEJ Rozwiązania zadań teoretycznych Rozwiązanie zadania 1. 1. Rozpatrując reakcje: Au 3 e Au oraz Au e Au i biorąc
RZWIĄZANIA ZADAŃ Z III ETAPU 50 KRAJWEJ LIMPIADY CEMICZNEJ KMITET GŁÓWNY LIMPIADY CEMICZNEJ Rozwiązania zadań teoretycznych Rozwiązanie zadania 1. 1. Rozpatrując reakcje: Au 3 e Au oraz Au e Au i biorąc
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
Wskaż grupy reakcji, do których można zaliczyć proces opisany w informacji wstępnej. A. I i III B. I i IV C. II i III D. II i IV
 Informacja do zadań 1. i 2. Proces spalania pewnego węglowodoru przebiega według równania: C 4 H 8(g) + 6O 2(g) 4CO 2(g) + 4H 2 O (g) + energia cieplna Zadanie 1. (1 pkt) Procesy chemiczne można zakwalifikować
Informacja do zadań 1. i 2. Proces spalania pewnego węglowodoru przebiega według równania: C 4 H 8(g) + 6O 2(g) 4CO 2(g) + 4H 2 O (g) + energia cieplna Zadanie 1. (1 pkt) Procesy chemiczne można zakwalifikować
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.
![Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.](/thumbs/100/143872318.jpg) Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 STOPIEŃ WOJEWÓDZKI 9 MARCA 2018 R.
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
KINETYKA INWERSJI SACHAROZY
 Dorota Warmińska, Maciej Śmiechowski Katedra Chemii Fizycznej, Wydział Chemiczny, Politechnika Gdańska KINETYKA INWERSJI SACHAROZY Wstęp teoretyczny Kataliza kwasowo-zasadowa Kataliza kwasowo-zasadowa
Dorota Warmińska, Maciej Śmiechowski Katedra Chemii Fizycznej, Wydział Chemiczny, Politechnika Gdańska KINETYKA INWERSJI SACHAROZY Wstęp teoretyczny Kataliza kwasowo-zasadowa Kataliza kwasowo-zasadowa
Za poprawną metodę Za poprawne obliczenia wraz z podaniem zmiany ph
 Zadanie 1 ( pkt.) Zmieszano 80 cm roztworu CHCH o stężeniu 5% wag. i gęstości 1,006 g/cm oraz 70 cm roztworu CHCK o stężeniu 0,5 mol/dm. bliczyć ph powstałego roztworu. Jak zmieni się ph roztworu po wprowadzeniu
Zadanie 1 ( pkt.) Zmieszano 80 cm roztworu CHCH o stężeniu 5% wag. i gęstości 1,006 g/cm oraz 70 cm roztworu CHCK o stężeniu 0,5 mol/dm. bliczyć ph powstałego roztworu. Jak zmieni się ph roztworu po wprowadzeniu
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru
 1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
LCH 1 Zajęcia nr 60 Diagnoza końcowa. Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach:
 LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
Nazwy pierwiastków: A +Fe 2(SO 4) 3. Wzory związków: A B D. Równania reakcji:
 Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych
 Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
Różnorodny świat izomerów powtórzenie wiadomości przed maturą
 Różnorodny świat izomerów powtórzenie wiadomości przed maturą Maria Kluz Klasa III, profil biologiczno-chemiczny i matematyczno-chemiczny 1 godzina lekcyjna, praca w grupie 16-osobowej. Cele edukacyjne:
Różnorodny świat izomerów powtórzenie wiadomości przed maturą Maria Kluz Klasa III, profil biologiczno-chemiczny i matematyczno-chemiczny 1 godzina lekcyjna, praca w grupie 16-osobowej. Cele edukacyjne:
imię i nazwisko, nazwa szkoły, miejscowość Zadania I etapu Konkursu Chemicznego Trzech Wydziałów PŁ V edycja
 Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
Zadanie: 2 (4 pkt) Napisz, uzgodnij i opisz równania reakcji, które zaszły w probówkach:
 Zadanie: 1 (1 pkt) Aby otrzymać ester o wzorze CH 3 CH 2 COOCH 3 należy jako substratów użyć: a) Kwasu etanowego i metanolu b) Kwasu etanowego i etanolu c) Kwasu metanowego i etanolu d) Kwasu propanowego
Zadanie: 1 (1 pkt) Aby otrzymać ester o wzorze CH 3 CH 2 COOCH 3 należy jako substratów użyć: a) Kwasu etanowego i metanolu b) Kwasu etanowego i etanolu c) Kwasu metanowego i etanolu d) Kwasu propanowego
Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych
 Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych 1. Wielkości i jednostki stosowane do wyrażania ilości materii 1.1 Masa atomowa, cząsteczkowa, mol Masa atomowa Atomy mają
Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych 1. Wielkości i jednostki stosowane do wyrażania ilości materii 1.1 Masa atomowa, cząsteczkowa, mol Masa atomowa Atomy mają
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 01/1 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 01/1 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
CHEMIA. Wymagania szczegółowe. Wymagania ogólne
 CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
I KSZTAŁCENIA PRAKTYCZNEGO. Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO XV Konkurs Chemii Organicznej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1 (9 pkt) Ciekłą mieszaninę,
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO XV Konkurs Chemii Organicznej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1 (9 pkt) Ciekłą mieszaninę,
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II
 TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
PRÓBNY II ETAP OLIMPIADY CHEMICZNEJ. Gimnazjum i Liceum Akademickie w Toruniu. Toruń, 9.01.2013
 PRÓBNY II ETAP OLIMPIADY CHEMICZNEJ Gimnazjum i Liceum Akademickie w Toruniu Toruń, 9.01.2013 ZADANIE 1 Synteza fragmentu pewnego sterydu i reakcja annulacji Robinsona. W typowej kondensacji aldolowej
PRÓBNY II ETAP OLIMPIADY CHEMICZNEJ Gimnazjum i Liceum Akademickie w Toruniu Toruń, 9.01.2013 ZADANIE 1 Synteza fragmentu pewnego sterydu i reakcja annulacji Robinsona. W typowej kondensacji aldolowej
XX KONKURS CHEMICZNY KLAS TRZECICH GIMNAZJALNYCH ROK SZKOLNY 2012/2013
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 25 maja 2013 Im. Jana Kasprowicza INOWROCŁAW XX KONKURS CHEMICZNY KLAS TRZECICH GIMNAZJALNYCH ROK
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 25 maja 2013 Im. Jana Kasprowicza INOWROCŁAW XX KONKURS CHEMICZNY KLAS TRZECICH GIMNAZJALNYCH ROK
a) 1 mol b) 0,5 mola c) 1,7 mola d) potrzebna jest znajomość objętości zbiornika, aby można było przeprowadzić obliczenia
 1. Oblicz wartość stałej równowagi reakcji: 2HI H 2 + I 2 w temperaturze 600K, jeśli wiesz, że stężenia reagentów w stanie równowagi wynosiły: [HI]=0,2 mol/dm 3 ; [H 2 ]=0,02 mol/dm 3 ; [I 2 ]=0,024 mol/dm
1. Oblicz wartość stałej równowagi reakcji: 2HI H 2 + I 2 w temperaturze 600K, jeśli wiesz, że stężenia reagentów w stanie równowagi wynosiły: [HI]=0,2 mol/dm 3 ; [H 2 ]=0,02 mol/dm 3 ; [I 2 ]=0,024 mol/dm
Z a d a n i a t e o r e t y c z n e
 M P I A L I D A C 46 1954 1999 E M I C Z A N Z a d a n i a t e o r e t y c z n e ZADANIE 1 trzymywanie i własności roztworów buforowych Roztwory buforowe umożliwiające pracę przy stałym określonym p są
M P I A L I D A C 46 1954 1999 E M I C Z A N Z a d a n i a t e o r e t y c z n e ZADANIE 1 trzymywanie i własności roztworów buforowych Roztwory buforowe umożliwiające pracę przy stałym określonym p są
Zadanie 2. (1 pkt) Uzupełnij tabelę, wpisując wzory sumaryczne tlenków w odpowiednie kolumny. CrO CO 2 Fe 2 O 3 BaO SO 3 NO Cu 2 O
 Test maturalny Chemia ogólna i nieorganiczna Zadanie 1. (1 pkt) Uzupełnij zdania. Pierwiastek chemiczny o liczbie atomowej 16 znajduje się w.... grupie i. okresie układu okresowego pierwiastków chemicznych,
Test maturalny Chemia ogólna i nieorganiczna Zadanie 1. (1 pkt) Uzupełnij zdania. Pierwiastek chemiczny o liczbie atomowej 16 znajduje się w.... grupie i. okresie układu okresowego pierwiastków chemicznych,
Pierwiastki bloku d. Zadanie 1.
 Zadanie 1. Zapisz równania reakcji tlenków chromu (II), (III), (VI) z kwasem solnym i zasadą sodową lub zaznacz, że reakcja nie zachodzi. Określ charakter chemiczny tlenków. Charakter chemiczny tlenków:
Zadanie 1. Zapisz równania reakcji tlenków chromu (II), (III), (VI) z kwasem solnym i zasadą sodową lub zaznacz, że reakcja nie zachodzi. Określ charakter chemiczny tlenków. Charakter chemiczny tlenków:
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 2002 BYŁA DZISIAJ CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY ARKUSZ EGZAMINACYJNY II
 MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY II 1. Przy każdym zadaniu podano
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY II 1. Przy każdym zadaniu podano
59 Olimpiada Chemiczna I etap PRÓBA. 10 października 2012, 10:00 15:00. redagowanie treści: Kuba Skrzeczkowski
 59 Olimpiada Chemiczna I etap PRÓBA 10 października 2012, 10:00 15:00 redagowanie treści: Kuba Skrzeczkowski ZADANIE 1. Dwa problemy z kinetyki chemicznej A. W podwyższonej temperaturze izomery geometryczne
59 Olimpiada Chemiczna I etap PRÓBA 10 października 2012, 10:00 15:00 redagowanie treści: Kuba Skrzeczkowski ZADANIE 1. Dwa problemy z kinetyki chemicznej A. W podwyższonej temperaturze izomery geometryczne
Zadanie 2. (2 pkt) Roztwór kwasu solnego o ph = 5 rozcieńczono 1000 krotnie wodą. Oblicz ph roztworu po rozcieńczeniu.
 Zadanie 1. (2 pkt) Oblicz, z jakiej objętości powietrza odmierzonego w temperaturze 285K i pod ciśnieniem 1029 hpa można usunąć tlen i azot dysponując 14 g magnezu. Magnez w tych warunkach tworzy tlenek
Zadanie 1. (2 pkt) Oblicz, z jakiej objętości powietrza odmierzonego w temperaturze 285K i pod ciśnieniem 1029 hpa można usunąć tlen i azot dysponując 14 g magnezu. Magnez w tych warunkach tworzy tlenek
... imię i nazwisko,nazwa szkoły, miasto
 Zadanie 1. (3 pkt) Aspirynę czyli kwas acetylosalicylowy można otrzymać w reakcji kwasu salicylowego z bezwodnikiem kwasu etanowego (octowego). a. Zapisz równanie reakcji, o której mowa w informacji wstępnej
Zadanie 1. (3 pkt) Aspirynę czyli kwas acetylosalicylowy można otrzymać w reakcji kwasu salicylowego z bezwodnikiem kwasu etanowego (octowego). a. Zapisz równanie reakcji, o której mowa w informacji wstępnej
Podstawowe pojęcia i prawa chemiczne
 Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Chemia Grudzień Styczeń
 Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje wojewódzkie
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje wojewódzkie Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje wojewódzkie Zadanie
Kuratorium Oświaty w Lublinie
 Kuratorium Oświaty w Lublinie KOD UCZNIA ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 ETAP WOJEWÓDZKI Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
Kuratorium Oświaty w Lublinie KOD UCZNIA ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 ETAP WOJEWÓDZKI Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
Przemiany substancji
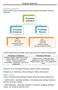 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
7. Obliczenia zapisane w brudnopisie nie bgd4 oceniane. 4. Zadanta czytaj uwazrue i ze zrozumieniem.
 Kuratorium O6wiaty w Lublinie Imie i nazwisko ucznia Pelna nazwa szkoly Liczba punkt6w ZESTAW ZADAN KONKURSU CHEMICZNEGO DLA UCZNIoW GIMNAZIUM ROK SZKOLNY 201il20r8 ETAPTRZECI Instrukcja dla ucznia 1.
Kuratorium O6wiaty w Lublinie Imie i nazwisko ucznia Pelna nazwa szkoly Liczba punkt6w ZESTAW ZADAN KONKURSU CHEMICZNEGO DLA UCZNIoW GIMNAZIUM ROK SZKOLNY 201il20r8 ETAPTRZECI Instrukcja dla ucznia 1.
EGZAMIN MATURALNY Z CHEMII
 Miejsce na naklejkę z kodem (Wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO MCH-W1D1P-021 EGZAMIN MATURALNY Z CHEMII Instrukcja dla zdającego Czas pracy 90 minut 1. Proszę sprawdzić, czy arkusz
Miejsce na naklejkę z kodem (Wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO MCH-W1D1P-021 EGZAMIN MATURALNY Z CHEMII Instrukcja dla zdającego Czas pracy 90 minut 1. Proszę sprawdzić, czy arkusz
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
Zagadnienia. Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I
 Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Rozdział 6. Odpowiedzi i rozwiązania zadań. Chemia organiczna. Zdzisław Głowacki. Zakres podstawowy i rozszerzony
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
KI + Pb(NO 3 ) 2 PbI 2 + KNO 3. fermentacja alkoholowa
 Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
VII Podkarpacki Konkurs Chemiczny 2014/2015
 II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym
 1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
Chemicznej ZADANIE 1. C HCl D
 Chemicznej L I M P I A D A 1954 50 2003 C H EM I C Z A Z a d a n i a t e o r e t y c z n e ZADAIE 1 Synteza leku Związek E, lek stosowany zewnętrznie przeciwko świerzbowi, można otrzymać ze związku A w
Chemicznej L I M P I A D A 1954 50 2003 C H EM I C Z A Z a d a n i a t e o r e t y c z n e ZADAIE 1 Synteza leku Związek E, lek stosowany zewnętrznie przeciwko świerzbowi, można otrzymać ze związku A w
Konkurs przedmiotowy z chemii dla uczniów szkół podstawowych
 Kod ucznia Konkurs przedmiotowy z chemii dla uczniów szkół podstawowych Suma punktów 13 marca 2019 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie konkursu chemicznego. Podczas rozwiązywania
Kod ucznia Konkurs przedmiotowy z chemii dla uczniów szkół podstawowych Suma punktów 13 marca 2019 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie konkursu chemicznego. Podczas rozwiązywania
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego:
 1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
IX Podkarpacki Konkurs Chemiczny 2016/2017. ETAP II r. Godz
 KOPKCh IX Podkarpacki Konkurs Chemiczny 2016/2017 ETAP II 17.12.2016 r. Godz. 10.30-12.30 Uwaga! Masy molowe pierwiastków i związków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Płytkę Zn zanurzono do
KOPKCh IX Podkarpacki Konkurs Chemiczny 2016/2017 ETAP II 17.12.2016 r. Godz. 10.30-12.30 Uwaga! Masy molowe pierwiastków i związków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Płytkę Zn zanurzono do
ZADANIE 164. Na podstawie opisanych powyżej doświadczeń określ charakter chemiczny tlenków: magnezu i glinu. Uzasadnij słownie odpowiedź.
 Informacja do zadań: 163. 166. Przeprowadzono doświadczenia opisane poniższymi schematami: ZADANIE 163. Podaj, w których probówkach (1. 6.) zaszły reakcje chemiczne. ZADANIE 164. Na podstawie opisanych
Informacja do zadań: 163. 166. Przeprowadzono doświadczenia opisane poniższymi schematami: ZADANIE 163. Podaj, w których probówkach (1. 6.) zaszły reakcje chemiczne. ZADANIE 164. Na podstawie opisanych
Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.
![Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów. Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.](/thumbs/97/131732752.jpg) 2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
Wielofunkcyjne związki organiczne poziom rozszerzony
 Wielofunkcyjne związki organiczne poziom rozszerzony Zadanie 1. (2 pkt) Źródło: KE 2010 (PR), zad. 29. Pewien dwufunkcyjny związek organiczny ma masę molową równą 90 g/mol. W jego cząsteczce stosunek liczby
Wielofunkcyjne związki organiczne poziom rozszerzony Zadanie 1. (2 pkt) Źródło: KE 2010 (PR), zad. 29. Pewien dwufunkcyjny związek organiczny ma masę molową równą 90 g/mol. W jego cząsteczce stosunek liczby
Zidentyfikuj związki A i B. w tym celu podaj ich wzory półstrukturalne Podaj nazwy grup związków organicznych, do których one należą.
 Zadanie 1. (2 pkt) Poniżej przedstawiono schemat syntezy pewnego związku. Zidentyfikuj związki A i B. w tym celu podaj ich wzory półstrukturalne Podaj nazwy grup związków organicznych, do których one należą.
Zadanie 1. (2 pkt) Poniżej przedstawiono schemat syntezy pewnego związku. Zidentyfikuj związki A i B. w tym celu podaj ich wzory półstrukturalne Podaj nazwy grup związków organicznych, do których one należą.
Wykład 10 Równowaga chemiczna
 Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII
 KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 12 marzec 2008 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III Numer zadania 1
KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 12 marzec 2008 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III Numer zadania 1
Etap I: Etap II: Etap III: Związek A zawiera pierścień benzenowy i reaguje pozytywnie w próbie Trommera. Etap I jest
 L LIMPIADA CHEMICZA KMITET GŁÓWY LIMPIADY CHEMICZEJ (Warszawa) ETAP I Zadania teoretyczne L I M P I A D A 1954 50 2003 C H EM I C Z A ZADAIE 1 Synteza leku Związek E, lek stosowany zewnętrznie przeciwko
L LIMPIADA CHEMICZA KMITET GŁÓWY LIMPIADY CHEMICZEJ (Warszawa) ETAP I Zadania teoretyczne L I M P I A D A 1954 50 2003 C H EM I C Z A ZADAIE 1 Synteza leku Związek E, lek stosowany zewnętrznie przeciwko
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab
 SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
Zadanie 2. Przeprowadzono następujące doświadczenie: Wyjaśnij przebieg tego doświadczenia. Zadanie: 3. Zadanie: 4
 Zadanie: 1 Do niebieskiego, wodnego roztworu soli miedzi wrzucono żelazny gwóźdź i odstawiono na pewien czas. Opisz zmiany zachodzące w wyglądzie: roztworu żelaznego gwoździa Zadanie 2. Przeprowadzono
Zadanie: 1 Do niebieskiego, wodnego roztworu soli miedzi wrzucono żelazny gwóźdź i odstawiono na pewien czas. Opisz zmiany zachodzące w wyglądzie: roztworu żelaznego gwoździa Zadanie 2. Przeprowadzono
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego. II Etap - 18 stycznia 2016
 XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II
 TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
Wojewódzki Konkurs Wiedzy Chemicznej dla uczniów klas maturalnych organizowany przez ZDCh UJ Etap I, zadania
 Zadanie I. [16 punktów] W zadaniach od 1 5 jedna odpowiedź jest poprawna. Zad. 1. Który z podanych pierwiastków ma najniższą pierwszą energię jonizacji (czyli minimalną energię potrzebną do oderwania elektronu
Zadanie I. [16 punktów] W zadaniach od 1 5 jedna odpowiedź jest poprawna. Zad. 1. Który z podanych pierwiastków ma najniższą pierwszą energię jonizacji (czyli minimalną energię potrzebną do oderwania elektronu
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 2002 BYŁA DZISIAJ CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY ARKUSZ EGZAMINACYJNY I
 MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY I 1. Przy każdym zadaniu podano
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY I 1. Przy każdym zadaniu podano
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
analogicznie: P g, K g, N g i Mg g.
 Zadanie 1 Obliczamy zawartość poszczególnych składników w 10 m 3 koncentratu: Ca: 46 g Ca - 1 dm 3 roztworu x g Ca - 10000 dm 3 roztworu x = 460000 g Ca analogicznie: P 170000 g, K 10000 g, N 110000 g
Zadanie 1 Obliczamy zawartość poszczególnych składników w 10 m 3 koncentratu: Ca: 46 g Ca - 1 dm 3 roztworu x g Ca - 10000 dm 3 roztworu x = 460000 g Ca analogicznie: P 170000 g, K 10000 g, N 110000 g
Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem
 Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne)
 Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne) Zadanie 7 (1 pkt) Uporządkuj podane ilości moli związków chemicznych według rosnącej liczby
Przykładowe zadania z rozdziałów 1 5 (Mol, Stechiometria wzorów i równań chemicznych, Wydajność reakcji i inne) Zadanie 7 (1 pkt) Uporządkuj podane ilości moli związków chemicznych według rosnącej liczby
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2013/2014
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 24 maja 2014 Im. Jana Kasprowicza INOWROCŁAW XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 24 maja 2014 Im. Jana Kasprowicza INOWROCŁAW XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
1 Hydroliza soli. Hydroliza soli 1
 Hydroliza soli 1 1 Hydroliza soli Niektóre sole, rozpuszczone w wodzie, reagują z cząsteczkami rozpuszczalnika. Reakcja ta nosi miano hydrolizy. Reakcję hydrolizy soli o wzorze BA, można schematycznie
Hydroliza soli 1 1 Hydroliza soli Niektóre sole, rozpuszczone w wodzie, reagują z cząsteczkami rozpuszczalnika. Reakcja ta nosi miano hydrolizy. Reakcję hydrolizy soli o wzorze BA, można schematycznie
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG
 WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG Imię i nazwisko: Klasa i szkoła*: Adres e-mail: Nr telefonu: Czy uczeń jest już uczestnikiem projektu Zdolni z Pomorza - Uniwersytet
WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG Imię i nazwisko: Klasa i szkoła*: Adres e-mail: Nr telefonu: Czy uczeń jest już uczestnikiem projektu Zdolni z Pomorza - Uniwersytet
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY
 Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa szkoły KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY Uzyskane
Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa szkoły KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY Uzyskane
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
KI + Pb(NO 3 ) 2 PbI 2 + KNO 3. fermentacja alkoholowa
 Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
TEST SPRAWDZAJĄCY Z CHEMII
 TEST SPRAWDZAJĄCY Z CHEMII Test przeznaczony jest dla uczniów szkół średnich. Zadania zawarte w teście obejmują obszerny zakres wiadomości z chemii, które ujęte są w podstawach programowych. Większa część
TEST SPRAWDZAJĄCY Z CHEMII Test przeznaczony jest dla uczniów szkół średnich. Zadania zawarte w teście obejmują obszerny zakres wiadomości z chemii, które ujęte są w podstawach programowych. Większa część
Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy. Dział Zakres treści
 Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
1. REAKCJA ZE ZWIĄZKAMI POSIADAJĄCYMI KWASOWY ATOM WODORU:
 B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
Sprawdzian 2. CHEMIA. Przed próbną maturą. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34. Imię i nazwisko ...
 CHEMIA Przed próbną maturą Sprawdzian 2. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko... Liczba punktów Procent 2 Informacja do zadań 1 i 2. Naturalny chlor występuje
CHEMIA Przed próbną maturą Sprawdzian 2. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko... Liczba punktów Procent 2 Informacja do zadań 1 i 2. Naturalny chlor występuje
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Obliczenia chemiczne
 strona 1/8 Obliczenia chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Wagowe stosunki stechiometryczne w związkach chemicznych i reakcjach chemicznych masa atomowa
strona 1/8 Obliczenia chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Wagowe stosunki stechiometryczne w związkach chemicznych i reakcjach chemicznych masa atomowa
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Obliczenia stechiometryczne, bilansowanie równań reakcji redoks
 Obliczenia stechiometryczne, bilansowanie równań reakcji redoks Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Obliczenia stechiometryczne Podstawą
Obliczenia stechiometryczne, bilansowanie równań reakcji redoks Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Obliczenia stechiometryczne Podstawą
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
Zn + S ZnS Utleniacz:... Reduktor:...
 Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG
 WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG Imię i nazwisko: Klasa i szkoła*: Adres e-mail: Nr telefonu: Czy uczeń jest już uczestnikiem projektu? (odp. otoczyć kółkiem) Ocena
WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG Imię i nazwisko: Klasa i szkoła*: Adres e-mail: Nr telefonu: Czy uczeń jest już uczestnikiem projektu? (odp. otoczyć kółkiem) Ocena
