Nazwa Moc* Postać farmaceutyczna. Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
|
|
|
- Paulina Marszałek
- 4 lat temu
- Przeglądów:
Transkrypt
1 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1
2 Kraj Członkowski EU/EEA Podmiot Odpowiedzialny Nazwa Moc* Postać farmaceutyczna Droga podania Austria GlaxoSmithKline Pharma GmbH Albert Schweitzer-Gasse 6 A-1140 Wien Austria Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Austria GlaxoSmithKline Pharma GmbH Albert Schweitzer-Gasse 6 A-1140 Wien Austria Priorix Proszek w fiolce I rozpuszczalnik w ampułko-strzykawce do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Belgia GlaxoSmithKline Biologicals s.a. Rue de l Institut, Rixensart Belgium Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Bułgaria GlaxoSmithKline Biologicals s.a. Rue de l Institut, Rixensart Belgium Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Cypr GlaxoSmithKline Biologicals s.a. Rue de l Institut, Rixensart Belgium Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe 2
3 Kraj Członkowski EU/EEA Podmiot Odpowiedzialny Nazwa Moc* Postać farmaceutyczna Droga podania Republika Czeska GlaxoSmithKline Biologicals s.a. Rue de l Institut, Rixensart Belgium Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Dania GlaxoSmithKline Pharma A/S Nykær 68 DK-2605 Brøndby Denmark Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Estonia GlaxoSmithKline Biologicals s.a. Rue de l Institut, Rixensart Belgium Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Finlandia Francja GlaxoSmithKline Biologicals SA Rue de l Institut Rixensart Belgium Laboratoire GlaxoSmithKline 100 route de Versailles Marly-le-Roi Cedex France Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Priorix Powder and solvent for solution for injection in a prefilled syringe Measles, Mumps and rubella vaccine (live) Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Podanie podskórne Podanie domięśniowe 3
4 Kraj Członkowski Podmiot Nazwa Moc* Postać Droga podania EU/EEA Odpowiedzialny farmaceutyczna Niemcy GlaxoSmithKline GmbH & Priorix Proszek i rozpuszczalnik Podanie podskórne Co. KG do sporządzania roztworu Podanie Theresienhöhe 11 do wstrzykiwań domięśniowe D München Germany Grecja GlaxoSmithKline AEBE Priorix Proszek i rozpuszczalnik Podanie podskórne 266 Kifisias avenue do sporządzania roztworu Podanie Halandri do wstrzykiwań domięśniowe Greece Węgry GlaxoSmithKline Kft. Priorix Proszek i rozpuszczalnik Podanie podskórne 1124 Budapest do sporządzania roztworu Podanie Csörsz u 43 do wstrzykiwań domięśniowe Hungary Islandia GlaxoSmithKline ehf. Priorix Proszek i rozpuszczalnik Podanie podskórne Thverholt 14 do sporządzania roztworu Podanie 105 Reykjavik do wstrzykiwań domięśniowe Iceland Irlandia GlaxoSmithKline (Ireland) Priorix Proszek i rozpuszczalnik Podanie podskórne Limited do sporządzania roztworu Podanie Stonemasons Way do wstrzykiwań domięśniowe Rathfarnham Dublin 16 Ireland Włochy GlaxoSmithKline S.p.A. Via A. Fleming, Verona Italy Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe 4
5 Kraj Członkowski EU/EEA Podmiot Odpowiedzialny Nazwa Moc* Postać farmaceutyczna Droga podania Łotwa GlaxoSmithKline Biologicals s.a. Rue de l Institut, Rixensart Belgium Priorix pulveris un šķīdinātājs injekciju šķīduma pagatavošanai Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Litwa UAB GlaxoSmithKline Lietuva Goštauto 40A LT-01112, Vilnius Lithuania Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Luxemburg GlaxoSmithKline Biologicals s.a. Rue de l Institut, Rixensart Belgium Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Malta SmithKline Beecham plc Great West Road, Brentford, Middlesex TW8 9GS Trading as GlaxoSmithKline UK Stockley Park West Uxbridge Middlesex UB11 1BT United Kingdom Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe 5
6 Kraj Członkowski EU/EEA Podmiot Odpowiedzialny Nazwa Moc* Postać farmaceutyczna Droga podania Holandia Norwegia GlaxoSmithKline BV Huis ter Heideweg LZ Zeist The Netherlands GlaxoSmithKline AS Forskningsveien 2a Postboks 180 Vinderen 0319 Oslo Norway Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Podanie podskórne Podanie domięśniowe Polska GlaxoSmithKline Biologicals s.a. Rue de l Institut, Rixensart Belgium Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Portugalia Smith Kline & French Portuguesa, Produtos Farmacêuticos, Lda. Rua Dr. António Loureiro Borges, 3 Arquiparque Miraflores Algés Portugal Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Rumunia GlaxoSmithKline Biologicals s.a. Rue de l Institut, Rixensart Belgium Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe 6
7 Kraj Członkowski Podmiot Nazwa Moc* Postać Droga podania EU/EEA Odpowiedzialny farmaceutyczna Republika Słowacka GlaxoSmithKline Priorix Proszek i rozpuszczalnik Podanie podskórne Biologicals s.a. do sporządzania roztworu Podanie Rue de l Institut, 89 do wstrzykiwań domięśniowe 1330 Rixensart Belgium Słowenia GSK d.o.o., Ljubljana, Knezov štradon 90, 1000 Ljubljana Priorix prašek in vehikel za raztopino za Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Slovenia injiciranje Hiszpania GlaxoSmithKline, S.A. C/Severo Ochoa, Tres Cantos (Madrid) Spain Priorix polvo y disolvente en jeringa precargada para solución inyectable Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie domięśniowe Szwecja GlaxoSmithKline AB, Box 516, Solna Sweden Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe 7
8 Kraj Członkowski EU/EEA Podmiot Odpowiedzialny Nazwa Moc* Postać farmaceutyczna Droga podania Wielka Brytania SmithKline Beecham plc 980 Great West Road, Brentford, Middlesex TW8 9GS United Kingdom Trading as GlaxoSmithKline UK Stockley Park West Uxbridge Middlesex UB11 1BT United Kingdom * Moc dotyczy wszystkich krajów 1 dawka (0,5 ml) szczepionki po rekonstytucji zawiera: Priorix Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Podanie podskórne Podanie domięśniowe Żywe atenuowane wirusy odry (szczep Schwarz)* nie mniej niż 10 3,0 *** CCID 50 Żywe atenuowane wirusy świnki (szczep RIT 4385)* nie mniej niż 10 3,7 *** CCID 50 Żywe atenuowane wirusy różyczki (szczep Wistar RA 27/3)** nie mniej niż 10 3,0 *** CCID 50 8
9 Aneks II Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego, oznakowania opakowań i ulotki dla pacjenta przedstawione przez Europejską Agencję Leków 9
10 Wnioski naukowe Ogólne podsumowanie oceny naukowej szczepionki Priorix i produktów z nią związanych pod różnymi nazwami(patrz aneks I) Produkt Priorix to złożona, liofilizowana szczepionka przeciwko odrze (ang. measles, M), śwince (ang. mumps, M) i różyczce (ang. rubeola, R). Postać farmaceutyczna i moc szczepionki są jednakowe we wszystkich państwach. Szczepionka występuje w postaci liofilizatu, który przed zastosowaniem jest rekonstytuowany z zastosowaniem oddzielnie dostarczanego jałowego rozpuszczalnika (woda do wstrzykiwań). Szczepionka Priorix jest zarejestrowana w drodze procedur krajowych w 20 państwach i w drodze procedury wzajemnego uznania - w 9 państwach. Charakterystyki produktu leczniczego (ChPL) zatwierdzone w państwach członkowskich podczas procedury wzajemnego uznania i podczas procedur krajowych nieznacznie się różnią. Celem tej procedury zgodnej z art. 30 jest ujednolicenie ChPL produktu Priorix i produktów z nią związanych pod różnymi nazwami w państwach członkowskich. Aspekty kliniczne Ogólnie rzecz biorąc, podmiot odpowiedzialny zaproponował ujednolicony tekst zredagowany głównie na podstawie ChPL zatwierdzonej w procedurze wzajemnego uznania z pewnymi zmianami. Ponadto informacja o produkcie została przedstawiona z wykorzystaniem najnowszej wersji wzorca QRD, wersji 2, opublikowanej 12 października 2011 r. Punkt Wskazania do stosowania Szczepionka Priorix jest wskazana w czynnym uodpornianiu przeciwko odrze, śwince i różyczce. Zatwierdzona dolna granica wieku, w którym można zastosować szczepionkę Priorix waha się od 9. do 15. miesiąca życia w różnych państwach członkowskich UE. W niektórych przypadkach jest odzwierciedleniem krajowych wytycznych dotyczących rutynowo stosowanych szczepień MMR. Immunogenność szczepionki Priorix oceniono w wielu badaniach klinicznych u dzieci w wieku od 12 do 24 miesięcy, 11 do 23 miesięcy i 9 do 12 miesięcy. Na podstawie oceny wszystkich danych podmiot odpowiedzialny zaproponował ujednolicenie wskazania do stosowania szczepionki Priorix do dzieci w wieku od 9. miesiąca życia, stosując następujące sformułowanie: Szczepionka PRIORIX jest wskazana w czynnym uodparnianiu dzieci w wieku od 9. miesiąca życia, młodzieży i osób dorosłych przeciwko odrze, śwince i różyczce. CHMP zwrócił uwagę, że najnowsze dane z epidemii we Francji wskazują, że zakażenia wirusem odry występują najczęściej u dzieci poniżej 1. roku życia, a następnie u dzieci pomiędzy 1. a 2. rokiem życia. Częstości występowania w obu tych grupach wiekowych wynosiły odpowiednio ponad 50 i 45 przypadków na W porównaniu z 2009 r. liczba przypadków w 2010 r. zwiększyła się ponad trzykrotnie u dzieci w wieku poniżej 1 roku i wzrosła pięciokrotnie u osób dorosłych w wieku lat. Wśród obserwowanych przypadków w 2010 r. prawie 30% było hospitalizowanych i cięższe nasilenie choroby obserwowano u dzieci poniżej 1. roku życia i osób dorosłych w wieku powyżej 20 lat z odsetkami przypadków wymagających hospitalizacji wynoszącymi, odpowiednio, 38% i 46%. Szczepienie dzieci w wieku od 9. miesiąca życia jest więc jednym z narzędzi opanowania takiego rodzaju epidemii. 10
11 Jednakże dane dotyczące immunogenności wyraźnie wskazują, że u dzieci w wieku 9-11 miesięcy w czasie pierwszego uodporniania obserwowano słabszą odpowiedź w postaci przeciwciał niż u dzieci starszych, co jest najprawdopodobniej wynikiem krążących przeciwciał pochodzących od matki lub niedojrzałości układu immunologicznego. Dlatego, w celu zapewnienia odpowiedniej ochrony przeciwko odrze, śwince i różyczce w tej grupie wiekowej, konieczne jest podanie drugiej dawki najlepiej po trzech miesiącach po podaniu dawki pierwszej. Podsumowując, na podstawie danych klinicznych przyjęto niższą granicę wieku, jednakże z uwagi na słabszą odpowiedź immunologiczną po podaniu pojedynczej dawki szczepionki Priorix dzieciom w wieku poniżej 12 miesięcy zamieszczono odniesienia do punktów 4.2, 4.4 i 5.1. W szczególności: W przypadku stosowania u dzieci pomiędzy 9. a 12. miesiącem życia, patrz punkty 4.2, 4.4 i 5.1. Podmiot odpowiedzialny zamieścił także w tym punkcie twierdzenie Stosowanie szczepionki PRIORIX powinno być zgodne z oficjalnymi wytycznymi, ale CHMP ustalił przeniesienie tego twierdzenia na początek punku 4.2 Dawkowanie i sposób podawania, ponieważ, zgodnie z wytycznymi dotyczącymi ChPL z września 2009 r., odniesienie do oficjalnych zaleceń powinno być zamieszczone w punkcie 4.2. Punkt Dawkowanie i sposób podawania We wszystkich państwach dawka przygotowanej do podania szczepionki Priorix wynosi 0,5 ml. Sposób podawania szczepionki Priorix to wstrzyknięcie podskórne, chociaż może być ona także podawana we wstrzyknięciu domięśniowym. Domięśniowy sposób podania jest zatwierdzony we wszystkich państwach członkowskich z wyjątkiem Holandii. Zgodnie z wytycznymi dotyczącymi ChPL podmiot odpowiedzialny zaproponował także dodanie specyficznego podpunktu dotyczącego dzieci i młodzieży. CHMP uznał, że zalecania dotyczące dawkowania są możliwe do zaakceptowania, jednakże w celu dostarczenia jasnych instrukcji dla pracowników służby zdrowia zaproponował bardziej rozbudowane sformułowanie (tzn. rozdzielenie zaleceń dla grup wiekowych). W uaktualnionej dokumentacji klinicznej nie zamieszczono informacji co do domięśniowej drogi podania, ale takie dane dostarczono we wstępnym wniosku o pozwolenie na dopuszczenie do obrotu. Domięśniowa droga podania była wstępnie zbadana u malej liczby osób (N=40) z odsetkami serokonwersji, odpowiednio, 96,7%, 97,5% i 100% przeciwko odrze, śwince i różyczce. Średnie geometryczne miana przeciwciał (GMT) u osób, u których doszło do serokonwersji, wynosiły odpowiednio: 2431,9 miu/ml, 1010,0 U/ml i 67,1 IU/ml, dla przeciwciał przeciwko odrze, śwince i różyczce i były nieco niższe niż wartości uzyskane po podaniu podskórnym (odpowiednio 2958 miu/ml, 1400 U/ml i 73 IU/ml). Chociaż dostępne są jedynie ograniczone dane, zwrócono uwagę, że podanie domięśniowe jest standardowo stosowaną praktyką w wielu państwach członkowskich. Ponadto doświadczenia dotyczące innych szczepionek MMR lub MMRV (odra, świnka, różyczka, ospa wietrzna) nie wskazują na żaden niekorzystny wpływ na odpowiedź immunologiczną lub profil bezpieczeństwa po podaniu domięśniowym. U pacjentów z trombocytopenią lub jakimkolwiek zaburzeniem krzepnięcia zaleca się podskórne podanie szczepionki, toteż zamieszczono odpowiednią uwagę. 11
12 Punkt Przeciwwskazania Osoby z niedoborem odporności Główna rozbieżność w zatwierdzonych ChPL dotyczy podawania szczepionki Priorix osobom zakażonym wirusem HIV. Przeglądy systemowe dotyczące bezpieczeństwa, immunogenności i skuteczności szczepienia przeciwko odrze u dzieci zakażonych wirusem HIV wskazały, że atenuowany wirus zawarty w szczepionce przeciwko odrze może wywołać ciężkie powikłania lub chorobę zakończoną zgonem u pacjentów z ciężkim upośledzeniem odporności zakażonych wirusem HIV. Ponadto odpowiedź w postaci wytworzenia przeciwciał po podaniu szczepionki przeciwko odrze zmniejsza się wraz ze wzrostem stopnia upośledzenia odporności. Związek pomiędzy brakiem przeciwciał przeciwko odrze po zaszczepieniu i niską liczbą limfocytów T CD4+ (<600 komórek/mm 3 ) został stwierdzony w opublikowanych badaniach (Moss i wsp., 2003). U dzieci zakażonych wirusem HIV bez zaburzeń odporności szczepionka przeciwko odrze jest bezpieczna, a ryzyko wystąpienia choroby wirusowej w wyniku podania szczepionki jest bardzo niskie. Biorąc pod uwagę ciężki przebieg zakażenia wirusem odry dzikiego typu u pacjentów z zaawansowanym zakażeniem HIV, Światowa Organizacja Zdrowia zaleca rutynowe szczepienie potencjalnie podatnych na zakażenie, bezobjawowych dzieci i dorosłych zakażonych wirusem HIV. Nie stwierdzono, aby zawarte w szczepionce wirusy świnki i różyczki wywoływały poważne powikłania u osób zakażonych wirusem HIV, ale z uwagi na niewielkie prawdopodobieństwa odniesienia korzyści ze szczepienia i możliwość wystąpienia powikłań, osoby z ciężkimi zaburzeniami odporności nie powinny być szczepione. CHMP uznał, że twierdzenie dotyczące osób z niedoborem odporności humoralnej i komórkowej jest odpowiednie i zgodne z zatwierdzonymi przeciwwskazaniami dla innych szczepionek MMR. W odniesieniu do HIV nie ma wspólnych wytycznych europejskich dotyczących klasyfikacji CD4+ pod względem %CD4+ lub liczby komórek. Opublikowana w 2006 r. klasyfikacja WHO choroby związanej z zakażeniem wirusem HIV u osób dorosłych i dzieci stanowi, co następuje: Kryteria immunologiczne rozpoznawania zaawansowanego HIV u dzieci w wieku poniżej 5 lat z ciężkim zakażeniem HIV: %CD4+ < 25 u dzieci w wieku poniżej 12 miesięcy %CD4+ <20 u dzieci w wieku miesięcy %CD4+ <15 u dzieci w wieku miesięcy Ponadto występują zgłoszenia dotyczące zapalenia mózgu z obecnymi ciałkami wtrętowymi wirusa odry po szczepieniu MMR u dzieci z pierwotnym zespołem niedoboru odporności i dysgammaglobulinemią (patrz Bitnun i wsp., 1999 Clin. Infect Dis). Podsumowując, CHMP poparł propozycję podmiotu odpowiedzialnego: Niedobór odporności humoralnej i komórkowej (pierwotny lub nabyty), w tym hipogammaglobulinemia i AIDS lub objawowe zakażenie HIV lub specyficzny dla wieku odsetek limfocytów CD4+ < 25%. Jednakże uznano, że konieczne jest włącznie specyficznego dla wieku odsetka CD4+ zgodnie z wytycznymi WHO, ponieważ zalecane jest szczepienie dzieci od wieku od 9 miesięcy. CHMP zwrócił także uwagę, że w wyniku postępu nauki i ważnych danych immunologicznych, przeciwwskazanie u osób z upośledzeniem odporności może wymagać przeredagowania w przypadku wszystkich szczepionek MMR. To może wymagać ponownej oceny wszystkich podobnych produktów. 12
13 Ciąża W okresie ciąży podawanie szczepionki Priorix jest przeciwwskazane. W czasie dyskusji w CHMP poddano pod wątpliwość, czy ciąża ma być nadal przeciwwskazaniem. W celu uzyskania dalszego wglądu w potencjalnie szkodliwy wpływ szczepienia MMR w czasie ciąży lub okresie przed poczęciem CHMP zwrócił się do podmiotu odpowiedzialnego o przedstawienie dowodów z zaawansowanych obserwacji i badań z grupą kontrolną, skupiających się na ryzyku spontanicznych poronień u kobiet podatnych na odrę, świnkę i różyczkę, ryzyku wad i zespołu różyczki wrodzonej u potomstwa tych kobiet, danych z obserwacji do ukończenia 1. roku życia dzieci urodzonych przez matki podatne na różyczkę. Ponieważ szczepionka Priorix jest przeciwwskazana u kobiet w ciąży, nie ustalono działań interwencyjnych ani aktywnych działań obserwacyjnych. Dane przedstawiony przez podmiot odpowiedzialny zawierają dane z obserwacji po wprowadzeniu do obrotu z bazy danych podmiotu odpowiedzialnego i dane z ostatnio opublikowanego piśmiennictwa dotyczącego szczepienia MMR u kobiet w ciąży. Dane ze zgłoszeń spontanicznych i rejestru ciąż nie wskazały na zastrzeżenia dotyczące bezpieczeństwa w odniesieniu do samoistnych poronień i wad wrodzonych w związku z nieumyślnym podaniem szczepionki Priorix kobietom w ciąży. Jednakże podmiot odpowiedzialny zwrócił uwagę, że dane są bardzo ograniczone, biorąc pod uwagę przeciwwskazanie zamieszczone obecnie na oznakowaniu opakowań. Naturalne zakażenie różyczką może mieć niszczący wpływ na ciążę, prowadzić do zgonu dziecka, przedwczesnego porodu i szeregu wad wrodzonych. Zakażenie wirusem różyczki w pierwszym trymestrze ciąży wywołuje niekorzystny wpływ w 85% ciąż. Zakażenie płodu wywołane przez atenuowany szczep wirusa zawarty w obecnie stosowanej szczepionce przeciwko różyczce występuje rzadko i nie ma dowodów wskazujących na to, że zakażenie płodu wirusem szczepionki jest szkodliwe. Teoretyczne maksymalne ryzyko rozwoju zespołu różyczki wrodzonej po podaniu szczepionki równe 1,6% jest o wiele niższe niż ryzyko poważnych wad wrodzonych niebędących wynikiem zespołu różyczki wrodzonej w czasie ciąży (Bozz i wsp., 2011). Chociaż dane dostępne w piśmiennictwie podkreślają wartościową perspektywę w odniesieniu do ogólnego ryzyka ekspozycji na szczepionkę w różnych stadiach ciąży z uwagi na teoretyczne ryzyko i brak możliwości udowodnienia, że ryzyko jest zerowe, podmiot odpowiedzialny zaproponował, by ciąża pozostała przeciwwskazaniem do podawania szczepionki przeciwko różyczce. CHMP zwrócił uwagę, że z uwagi na powszechne przeciwwskazanie szczepienia przeciwko odrze, śwince i różyczce u kobiet w ciąży dostępne są jedynie ograniczone dane dotyczące samoistnych poronień, wad i wrodzonego zespołu różyczki u potomstwa kobiet zaszczepionych szczepionką Priorix. Przegląd danych zebranych w ramach nadzoru nad bezpieczeństwem farmakoterapii i danych z piśmiennictwa nie wskazuje na ryzyko wystąpienia zespołu różyczki wrodzonej u dzieci kobiet zaszczepionych w ciąży lub poczętych w krótkim okresie po zaszczepieniu szczepionką Priorix. Dane z piśmiennictwa dotyczące kobiet w okresie rozrodczym, które zostały zaszczepione na terenie Ameryki Środkowej i Południowej wskazują na brak ryzyka lub nieistotne ryzyko (0-0,2%) wystąpienia zespołu różyczki wrodzonej po zaszczepieniu kobiet nieświadomych tego, że są w ciąży, szczepionką przeciwko różyczce. Teoretyczne ryzyko wpływu teratogennego po zaszczepieniu szczepionką przeciwko różyczce oceniono jako 0,5% w czasie pierwszego trymestru i sięgające 1,6% po podaniu szczepionki w okresie od 1-2 tygodni przed zapłodnieniem do 4-6 tygodni po zapłodnieniu dziecka. Z powodu tego teoretycznego ryzyka wpływu teratogennego w 2011 r. WHO zaleciła unikanie podawania szczepionki przeciwko różyczce kobiet w ciąży z zasady, a kobietom planującym ciążę doradzenie odłożenia tych planów na okres 1 miesiąca po szczepieniu przeciwko różyczce. Ponieważ nadal istnieje teoretyczne ryzyko związane ze szczepionkami 13
14 zawierającymi różyczkę, ustalono, że ta bardzo wrażliwa grupa nie powinna być narażana na ryzyko. Podsumowując, CHMP uznał, że ustanowienie ciąży jako przeciwwskazanie jest zgodne z zatwierdzonym przeciwwskazaniem dla innych szczepionek MMR. Obecnie brak jest danych, aby wnioskować, że istnieje wpływ teratogenny po podaniu szczepionek MMR, jednakże teoretyczna obawa pozostaje. Ryzyko dla szczepionki przeciwko odrze (zwiększenie samoistnych poronień martwego płodu) jest wskazane jako nieznane. CHMP zwrócił także uwagę, że istnieją obecnie pewne opublikowane dane, które mogą uzasadniać zniesienie bezwzględnego przeciwwskazania do stosowania szczepionki MMR u kobiet w ciąży, ponieważ uważa się, że chociaż szczepienie kobiety w ciąży jest niezalecane, w niektórych indywidualnych przypadkach korzyści wynikające z podania szczepionki kobiecie w ciąży mogą przewyższać ryzyko. To może wymagać ponownej oceny dla wszystkich podobnych produktów. Punkt Specjalne ostrzeżenia i środki ostrożności podczas stosowania Aby zachować zgodność z wytycznymi dotyczącymi ChPL, firma zaproponowała: skrócenie długiego ustępu dotyczącego stosowania epinefryny, zastępując go ogólnym stwierdzeniem o dostępności odpowiedniego leczenia i nadzorowania po podaniu szczepionki; wprowadzenie sformułowania dotyczącego osób zakażonych wirusem HIV i nadwrażliwości na składniki szczepionki zgodnie z punktem 4.3; usunięcie sformułowania dotyczącego wieku szczepienia (zawarte w punkcie 4.2). Firma zaproponowała także przeformułowanie fragmentu dotyczącego idiopatycznej czerwienicy trombocytopenicznej (ITP). CHMP zalecił zmianę kolejności niektórych twierdzeń i dodanie podtytułów, aby wyraźnie rozdzielić każde ostrzeżenie (tzn. trombocytopenia, pacjenci z niedoborem odporności i przenoszenie zakażenia). Ponieważ brak jest dostępnych danych dotyczących immunogenności w odniesieniu do wpływu profilaktycznego stosowania leków przeciwgorączkowych, zalecono przeredagowanie ustępu dotyczącego podawania szczepionki Priorix osobnikom z zaburzeniami ośrodkowego układu nerwowego (OUN) w następujący sposób: Należy zachować ostrożność podczas podawania szczepionki PRIORIX u osób z zaburzeniami ośrodkowego układu nerwowego (OUN), osób podatnych na występowanie drgawek gorączkowych lub w przypadku występowania drgawek w rodzinie. Należy prowadzić uważną obserwację po szczepieniu osób, u których w przeszłości występowały drgawki gorączkowe. CHMP uznał, że twierdzenie dotyczące nietolerancji fruktozy należy zmienić z: Szczepionki nie należy podawać pacjentom z rzadkim zaburzeniem wrodzonym w postaci nietolerancji fruktozy na: Szczepionka PRIORIX zawiera sorbitol, dlatego nie należy jej podawać osobom z rzadkim zaburzeniem w postaci nietolerancji fruktozy. Z punktu 4.4 postanowiono usunąć twierdzenie dotyczące ciąży, ponieważ zgodnie z wytycznymi dotyczącymi oceny ryzyka produktów leczniczych na płodność i laktację u ludzi: od danych do oznakowania (EAEA/CHMP/203927/200), odniesienie do stosowania w ciąży może być zawarte tylko w punktach 4.3 i 4.6. Z uwagi na znacznie większe prawdopodobieństwo występowania trombocytopenii po naturalnym zakażeniu, korzyści ze szczepienia najczęściej przewyższały ryzyko ciężkiej objawowej trombocytopenii wywołanej przez uodpornienie. Dlatego CHMP zasugerował dodanie informacji z ostatnio przeprowadzonego przeglądu systematycznego, że Trombocytopenia związana z podaniem szczepionki MMR występuje rzadko i w większości przypadków ulega samoograniczeniu. 14
15 Również w celu wyjaśnienia CHMP uzgodnił zastąpienie proponowanego przez firmę twierdzenia: W takich przypadkach należy dokładnie ocenić stosunek korzyści do ryzyka uodpornienia szczepionką Priorix twierdzeniem: Należy zachować ostrożność podczas uodparniania pacjentów z rozpoznaną trombocytopenią lub osób, u których w przeszłości wystąpiła trombocytopenia po szczepieniu przeciwko odrze, śwince lub różyczce. Podmiot odpowiedzialny zmodyfikował nieco proponowany tekst i ostateczne sformułowanie zatwierdzone przez CHMP to: Po szczepieniu żywą szczepionką przeciwko odrze, śwince i różyczce zgłaszano przypadki pogorszenia w przebiegu trombocytopenii i przypadki nawrotu trombocytopenii u osób, u których doszło do rozwoju trombocytopenii po podaniu pierwszej dawki. Trombocytopenia związana z MMR występuje rzadko i zasadniczo ulega samoograniczeniu. U pacjentów z obecną trombocytopenią lub u których w przeszłości wystąpiła trombocytopenia po szczepieniu przeciwko odrze, śwince lub różyczce należy dokładnie ocenić stosunek korzyści do ryzyka podania szczepionki PRIORIX. Podczas szczepienia tych pacjentów należy zachować ostrożność i raczej wybrać podskórny sposób podania. CHMP uznał, że zaproponowany przez podmiot odpowiedzialny ustęp dotyczący upośledzenia odporności jest przestarzały, i zaproponował jego przeredagowanie. Podmiot odpowiedzialny zaakceptował nowy tekst i dodał jeszcze twierdzenie dotyczące obserwacji tych pacjentów, które zostało przyjęte przez CHMP. Ostateczne uzgodnione sformułowanie jest następujące: U pacjentów z upośledzeniem odporności bez przeciwwskazań do tego szczepienia (patrz punkt 4.3) odpowiedź może być słabsza niż u pacjentów z prawidłową odpornością, dlatego niektórzy z tych pacjentów mogą zarazić się odrą, świnką lub różyczką w przypadku kontaktu, pomimo odpowiednio przeprowadzonego szczepienia. Tych pacjentów należy uważnie obserwować pod kątem objawów odry, zapalenia ślinianek przyusznych i różyczki. Po zapoznaniu się z tekstem dotyczącym przenoszenia CHMP uznał, że propozycja podmiotu odpowiedzialnego jest zasadniczo możliwa do zaakceptowania z dodaniem, że znane jest występowanie nie tylko różyczki, ale także wirusa odry w wydzielinie z gardła. Podmiot odpowiedzialny zmienił odpowiednią część tekstu zgodnie z tym i dodał także kolejne twierdzenie w celu odzwierciedlenia potwierdzonej możliwości transmisji przez łożysko. CHMP zaakceptował to twierdzenie. Ostateczne zatwierdzone sformułowanie to: Nie udowodniono dotychczas przeniesienia wirusa odry i świnki od osób zaszczepionych na podatne osoby z kontaktu. Znane jest występowanie wirusów różyczki i odry w wydzielinie z gardła w okresie od 7. do 28. dnia po szczepieniu ze szczytowym wydzielaniem około 11. dnia. Jednakże nie ma dowodów wskazujących na przeniesienie tych wydzielonych wirusów szczepionki na podatne osoby z kontaktu. Potwierdzono przeniesienie wirusa ze szczepionki przeciwko różyczce na dzieci poprzez mleko matki oraz przeniesienie przez łożysko bez obecności objawów klinicznych choroby. Punkt Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji W badaniach klinicznych wykazano, że szczepionka Priorix może być podawana jednocześnie z żywą atenuowaną szczepionką przeciwko ospie wietrznej, DTPa-IPV i złożoną szczepionką przeciwko zapaleniu wątroby typu A i B (Marshall i wsp., 2006; Stuck i wsp., 2002; Usonis i wsp., 2005; Wellington i Goa, 2003). W ostatnim czasie szczepionkę Priorix podawano jednocześnie ze szczepionką przeciwko Haemophilus influenze typu B (HiB) i skoniugowaną szczepionką przeciwko meningokokom typu C oraz jednocześnie z inaktywowaną szczepionką przeciwko zapaleniu wątroby typu A i 7-walentną skoniugowaną szczepionką przeciwko pneumokokom. Dostępne dane nie 15
16 wskazują na żadne klinicznie istotne oddziaływanie na odpowiedź w postaci wytworzenia przeciwciał przeciwko każdemu oddzielnemu antygenowi (Carmona i wsp., 2010; Pace i wsp., 2008). Niektóre szczepionki, które można podawać jednocześnie ze szczepionką Priorix, są wymienione w ChPL w Belgii, Bułgarii, na Cyprze, w Danii, Estonii, we Francji, w Holandii, w Luksemburgu, na Malcie, w Polsce, Rumunii i Wielkiej Brytanii. Podmiot odpowiedzialny zaproponował zastosowanie ogólnego twierdzenia, zamiast zamieszczanie wykazu różnych szczepionek. CHMP zwrócił uwagę, że dla większości badań klinicznych, w których oceniano jednoczesne podawanie szczepionki Priorix z innymi szczepionkami, brak jest raportów końcowych, ale dostępne są jedynie odniesienia do piśmiennictwa. Dostępne dane nie wskazują, że jednoczesne podawanie tych szczepionek ma wpływ na immunogenność i bezpieczeństwo badanych antygenów. Jednakże z uwagi na fakt, że nowe i bardzo złożone szczepionki dla dzieci są w trakcie opracowywania, zalecono sporządzenie wykazu szczepionek odpowiednich do jednoczesnego podawania zamiast dodanie ogólnego stwierdzenia dotyczącego jednoczesnego stosowania z innymi szczepionkami. Podmiot odpowiedzialny zmienił ten ustęp zgodnie z zaleceniami CHMP i dodał do wykazu 1 dodatkową szczepionkę (10-walentną skoniugowaną szczepionkę przeciw pneumokokom). Po przeglądzie i ocenie raportu badania klinicznego, który został przedstawiony na poparcie jednoczesnego podawania produktu Priorix z ta szczepionką, CHMP wyraził na to zgodę. Ostatecznie uzgodnione sformułowanie to: Szczepionkę PRIORIX może podawać jednocześnie (ale w różne miejsca) z którąkolwiek z następujących monowalentnych i złożonych szczepionek [w tym z sześciowalentnymi szczepionkami DTPa-HBV-IPV/Hib)]: acelularna szczepionka przeciwko błonicy, tężcowi i krztuścowi (DTPa), szczepionka przeciwko Haemophilus influenzae typu b (Hib), inaktywowana szczepionka przeciwko polio (IPV), szczepionka przeciwko zapaleniu wątroby typu B (HBV), szczepionka przeciwko zapaleniu wątroby typu A (HAV), szczepionka skoniugowana przeciwko meningokokom typu C (MenC), szczepionka przeciwko ospie wietrznej i półpaścowi (VZV), doustna szczepionka przeciwko polio (OPV) i 10-walentna skoniugowana szczepionka przeciwko pneumokokom zgodnie z lokalnymi wytycznymi. Jeśli szczepionki nie zostaną podane w tym samym czasie, zaleca się odstęp co najmniej 1 miesiąca pomiędzy podaniem szczepionki PRIORIX i innych żywych atenuowanych szczepionek. Brak danych na poparcie stosowania szczepionki PRIORIX z jakimikolwiek innymi szczepionkami. W odniesieniu do odłożenia szczepienia u osoby, która otrzymała gammaglobuliny ludzkie lub miała przetoczoną krew, CHMP uznał, że dłuższy odstęp pomiędzy podaniem immunoglobuliny lub innych produktów krwi i kolejnej dawki szczepionki jest zalecany w przypadku podawania dużych dawek, jak np. w przypadku leczenia stosowanego w chorobie Kawasaki (2g/kg). Ten fragment został przeredagowany w następujący sposób: U osób, które otrzymały gammaglobulinę ludzką lub miały przetoczoną krew, szczepienie należy odroczyć na okres trzech miesięcy lub dłuższy (do 11 miesięcy), w zależności od podanej dawki globulin ludzkich, z uwagi na możliwość niepowodzenia szczepienia z powodu biernie nabytych przeciwciał przeciwko odrze, śwince i różyczce. Punkt 4.6 Wpływ na płodność, ciążę i laktację Płodność Twierdzenie zostało zmodyfikowane zgodnie z zaleceniami zawartymi w wzorcu QRD Nie przeprowadzono badań do oceny wpływu szczepionki PRIORIX na rozrodczość. Ciąża 16
17 Szczepionka Priorix jest przeciwwskazana w ciąży, ale ponieważ w chwili obecnej brak jest informacji pozwalających wywnioskować, że po szczepieniu szczepionkami MMR istnieje wpływ teratogenny, uzgodniono następujące sformułowanie: Szczepionka PRIORIX jest przeciwwskazana w czasie ciąży (patrz punkt. 4.3) Jednakże dotychczas nie potwierdzono szkodliwego wpływu na płód po podaniu szczepionek przeciwko odrze, śwince i różyczce kobietom nieświadomym, że są w ciąży we wczesnym jej okresie. Kobiety w wieku rozrodczym W ChPL obowiązującej w Bułgarii, na Cyprze, w Estonii, na Malcie i w Wielkiej Brytanii podano, że należy unikać zajścia w ciążę przez miesiąc po zaszczepieniu, natomiast w ChPL państw włączonych w plan zarządzania ryzykiem i innych państw okres ten wynosi 3 miesiące. Komitet Doradczy ds. Szczepień (ang. Advisory Committee on Immunization Practices, ACIP) w 2001 r. skrócił zalecany okres unikania ciąży po otrzymaniu szczepionki zawierającej różyczkę z 3 miesięcy do 28 dni, ponieważ nie wykryto przypadków zespołu różyczki wrodzonej wśród dzieci kobiet, które zostały nieumyślnie zaszczepione przeciwko różyczce w okresie 3 miesięcy lub we wczesnej ciąży (Centrum Kontroli i Zapobiegania Chorób, 2001). Jednakże ponieważ nie przeprowadzono badań z zastosowaniem szczepionki Priorix u kobiet w ciąży, podmiot odpowiedzialny zaproponował, że należy unikać zajścia w ciążę w okresie 3 miesięcy po szczepieniu. CHMP zwrócił uwagę, że z powodu tego teoretycznego ryzyka wpływu teratogennego, WHO w 2011 r. zaleciła, że szczepienia przeciwko różyczce kobiet w ciąży należy unikać z zasady, a kobietom, które planują zajście w ciążę, należy poradzić, żeby odłożyły to do 1 miesiąca po zaszczepieniu przeciwko różyczce. Aby zachować zgodność z obecnymi zaleceniami WHO CHMP uznał, że odłożenie ciąży powinno zostać zmienione z 3 miesięcy na 1 miesiąc po zaszczepieniu. Ostatecznie zatwierdzone sformułowanie to: Kobietom, które planują zajście w ciążę, należy doradzić, aby odłożyły te plany na okres 1 miesiąca po zaszczepieniu. Chociaż należy zapytać kobietę o możliwość bycia we wczesnej ciąży przed zaszczepieniem, nie ma konieczności przeprowadzania testów przesiewowych w celu wykluczenia ciąży. Nieumyślne zaszczepienie nieświadomej ciąży kobiety szczepionką PRIORIX nie powinno być powodem przerwania ciąży. Karmienie piersią Podmiot odpowiedzialny stwierdził, że doświadczenie dotyczące stosowania szczepionki Priorix u kobiet karmiących piersią jest niedostateczne i że szczepienie kobiet karmiących piersią można rozważyć, jeśli korzyści wynikające ze szczepienia przewyższają ryzyko. CHMP zwrócił uwagę, że nie ma teoretycznych zagrożeń wynikających ze szczepienia w okresie karmienia piersią. Nawet jeśli dojdzie do przekazania wirusa zawartego w szczepionce zakażenie będzie łagodne i ustąpi samoistnie (ACIP 2011). Dlatego zaproponowano odpowiednią zmianę treści tego fragmentu. Szczepienie u kobiet karmiących piersią przeciwko odrze, śwince i różyczce nie wiązało się z żadnymi zastrzeżeniami dotyczącymi bezpieczeństwa dla kobiet i dzieci, chociaż doświadczenia w stosowaniu szczepionki Priorix w okresie karmienia piersią są ograniczone. Tylko w przypadku potwierdzenia lub podejrzenia, że u dziecka występuje niedobór odporności, należy rozważyć ryzyko i korzyści z zaszczepienia kobiety karmiącej piersią. Ponadto stwierdzono, że porada dotycząca karmienia piersią powinna wyraźnie rozróżniać zalecenia dotyczące szczepienia matek dzieci z niedoborem odporności lub z prawidłową odpornością. Podmiot odpowiedzialny wprowadził wszystkie komentarze CHMP i ostatecznie zatwierdzone sformułowanie brzmi: Doświadczenie dotyczące podawania szczepionki Priorix w czasie ciąży jest ograniczone. W badaniach wykazano, że kobiety karmiące piersią zaszczepione żywą atenuowaną szczepionką przeciwko różyczce mogą wydzielać wirus do mleka i przekazywać go dziecku karmionemu piersią bez objawów choroby. Tylko w przypadku potwierdzenia lub podejrzewania 17
18 występowania niedoboru odporności u dziecka należy ocenić korzyści i ryzyko związane z podaniem szczepionki (patrz punkt 4.3). Punkt Działania niepożądane Główne rozbieżności pomiędzy proponowaną ujednoliconą ChPL i zatwierdzonymi krajowymi informacjami o produkcie wiążą się z opisem zgłoszeń po wprowadzeniu do obrotu. Aby zachować zgodność z wytycznymi dotyczącymi ChPL podmiot odpowiedzialny zaproponował wykaz działań niepożądanych zgodnie z klasyfikacją MedDRA. Ponadto podmiot odpowiedzialny zaproponował usunięcie sformułowań dotyczących badań porównawczych, w których wykazano statystycznie istotne rzadsze występowanie bólu, zaczerwienienia i obrzęku w miejscu wstrzyknięcia po podaniu szczepionki Priorix w porównaniu z produktem referencyjnym (Ipp i wsp., 2004; Ipp i wsp., 2006; Knutsson i wsp., 2006; Taddio i wsp., 2009; Wellington i Goa, 2003). Zgodnie z wytycznymi dotyczącymi ChPL, ma ona dostarczać informacji dotyczących danego produktu leczniczego, dlatego nie powinna zawierać porównań z innymi produktami leczniczymi. CHMP uznał, że wykaz działań niepożądanych zgłaszanych w badaniach klinicznych i obserwacjach po wprowadzeniu do obrotu został w odpowiedni sposób odzwierciedlony w zaproponowanej ujednoliconej ChPL. Jednakże zwrócono się do podmiotu odpowiedzialnego o rozważenie przeredagowania punktu 4.8 zgodnie z wytycznymi dotyczącymi ChPL w celu dostarczenia wyraźnej i łatwo dostępnej informacji (podsumowanie profilu bezpieczeństwa, tabelaryczny wykaz działań niepożądanych, opis wybranych działań niepożądanych). Ponadto, ponieważ stwierdzono jedną nieścisłość z ulotką dla pacjenta, zwrócono się do podmiotu odpowiedzialnego o dodanie terminu nietypowa łagodna lub atenuowana odra w punkcie 4.8 do grupy zakażeń i zarażeń pasożytniczych. Ponadto zalecono, aby podmiot odpowiedzialny dodał informację o ryzyku zapalenia mózgu po zakażeniu wirusem świnki w uwagach dotyczących zapalenia mózgu: świnka: 2-4 na 1000 przypadków. Ponadto we wszystkich punktach termin zdarzenia niepożądane zastąpiono terminem działania niepożądane zgodnie z komentarzami zawartymi we wzorcach QRD. Podmiot odpowiedzialny wprowadził wszystkie powyżej omawiane zmiany, ale w celu zachowania zgodności z ChPL wszystkich szczepionek firmy GSK podmiot odpowiedzialny wystąpił z wnioskiem o kontynuowanie przedstawiania działań niepożądanych w postaci wykazu z zachowaniem podziału na działania niepożądane obserwowane w badaniach klinicznych i działania niepożądane zgłoszone po wprowadzeniu do obrotu. CHMP zaakceptował to uzasadnienie. Punkt Właściwości farmakodynamiczne Zgodnie z wytycznymi dotyczącymi ChPL w tekście na należy zamieszczać odniesień do innych produktów leczniczych, więc podmiot odpowiedzialny zaproponował usunięcie odniesień dotyczących wyników badań porównawczych, przedstawionych w ChPL w niektórych państwach członkowskich. CHMP zwrócił uwagę, że obecne doświadczenie kliniczne ze szczepionką Priorix jest ograniczone do stosowania u dzieci i nie przeprowadzono badań z udziałem młodzieży i osób dorosłych. Dlatego należy dodać twierdzenie dotyczące stosowania u młodzieży i osób dorosłych. Zwrócono się do podmiotu odpowiedzialnego o rozważenie dodania specyficznego przeglądu badań dotyczących immunogenności u dzieci zaszczepionych w wieku poniżej 12 miesięcy z podaniem wartości po podaniu pierwszej dawki dla poszczególnych miesięcy, jeśli są dostępne, oraz 18
19 przeglądu dotyczącego oceny wczesnego podania drugiej dawki. Z tego powodu oraz w celu odzwierciedlenia najnowszych informacji dane dotyczące immunogenności zostały rozdzielone na dwie grupy: Odpowiedź immunologiczna u dzieci w wieku 12 miesięcy i starszych i Odpowiedź immunologiczna u dzieci w wieku od 9 do 10 miesięcy. Zwrócono się do podmiotu odpowiedzialnego o rozważenie dodania przeglądu badań dotyczących immunogenności (badania kliniczne) i dodania także wartości określających skuteczność szczepionki, jeśli są dostępne lub adnotacji o ich braku. Seropozytywna odpowiedź w teście ELISA nie musi koniecznie świadczyć o zabezpieczeniu, zwłaszcza w przypadku świnki. Dana dotyczące skuteczności szczepionki powinny wskazywać różnice pomiędzy podaniem jednej lub dwóch dawek szczepionki. W ostatnim dziesięcioleciu zgłoszono wiele epidemii świnki w populacji osób zaszczepionych (dwie dawki). W wielu badaniach udokumentowano zwiększone ryzyko rozwoju świnki wzrastające w czasie po zaszczepieniu (Vandermeulen i wsp., 2004; Cortese i wsp., 2008; Castilla i wsp., 2009), a dane z Wielkiej Brytanii wskazują, że skuteczność szczepionki może zmniejszyć się z wiekiem, co prawdopodobnie także odzwierciedla czas, który upłynął od zaszczepienia (Cohen i wsp., 2007). Zasugerowano, że skuteczność szczepionki przeciwko śwince jest niższa w środowisku o wysokim stopniu przenoszenia zakażenia (Brockhoff 2004). Podmiot odpowiedzialny został poproszony o dodanie informacji dotyczących tych zagadnień. Jednakże w żadnym z badań terenowych (dotyczącym epidemii) przedstawionych przez podmiot odpowiedzialny nie podano danych dotyczących specyficznie szczepionki Priorix. Tak więc dane dotyczące skuteczności w odniesieniu do świnki nie były specyficzne dla szczepionki Priorix, toteż CHMP zatwierdził ogólny komentarz zaproponowany przez podmiot odpowiedzialny. Ponadto CHMP wystąpił o zastąpienie podanych odsetków serokonwersji nowszymi danymi zgłoszonymi dla preparatu szczepionki Priorix niewiążącej ludzkich albumin osoczowych (HSA-free) i zwrócił się do podmiotu odpowiedzialnego z zapytaniem o dostępność danych dotyczących immunogenności po podaniu szczepionki HSA-free u dzieci w wieku poniżej 12 miesięcy. Podmiot odpowiedzialny zamienił odsetek serokonwersji i oświadczył, że dane pochodzące od dzieci w wieku poniżej 12 miesięcy będą dostępne po zakończeniu obecnie prowadzonego badania. Podstawy zmiany charakterystyki produktu leczniczego, oznakowania opakowań i ulotki dla pacjenta Zważywszy, że zakres arbitrażu obejmował harmonizację charakterystyki produktu leczniczego, oznakowania opakowań i ulotki dla pacjenta na podstawie przedstawionej dokumentacji i dyskusji naukowej przeprowadzonej wewnątrz Komitetu dokonano oceny charakterystyki produktu leczniczego, oznakowania opakowań i ulotki dla pacjenta zaproponowanych przez podmioty odpowiedzialne CHMP zalecił zmianę pozwoleń na dopuszczenie do obrotu dla produktu Priorix i produktów z nim związanych pod różnymi nazwami (patrz aneks I), dla których charakterystyka produktu leczniczego, oznakowanie opakowań i ulotka dla pacjenta zostały przedstawione w aneksie III. 19
20 Aneks III Charakterystyka Produktu Leczniczego, Oznakowanie Opakowań i Ulotka dla Pacjenta Uwaga: Ta wersja Charakterystyki Produktu Leczniczego uzyskuje ważność w momencie wydania Dezycji Komisji Europejskiej. Po wydaniu Decyzji Komisji Europejskiej, odpowiednie władze Krajów Członkowskich, w porozumieniu z odpowiednim Krajem Członkowskim, zaktualizują Informację o Produkcie zgodnie z wymaganiami. W związku z tym Charakterystyki Produktu Leczniczego, Oznakowanie Opakowań i Ulotka dla Pacjenta mogą nie odzwierciedlać aktualnego tekstu. 20
21 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 21
22 1. NAZWA PRODUKTU LECZNICZEGO Patrz aneks I Do uzupełnienia na szczeblu krajowym 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje pomocnicze o znanym działaniu: Szczepionka zawiera 9 mg sorbitolu, patrz punkt 4.4. Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania PRIORIX jest przeznaczony do czynnego uodparniania przeciwko odrze, śwince i różyczce dzieci po ukończeniu 9 miesiąca życia, nastolatków oraz osób dorosłych. W celu uzyskania informacji dotyczącej stosowania u dzieci w wieku od 9 do 12 miesięcy, patrz punkty 4.2, 4.4 i Dawkowanie i sposób podawania Dawkowanie Szczepionka PRIORIX powinna być stosowana zgodnie z oficjalnymi zaleceniami. Osoby w wieku 12 miesięcy i starsze Zaleca się podanie jednej dawki (0,5 ml) szczepionki. Druga dawka powinna zostać podana zgodnie z oficjalnymi zaleceniami. Szczepionka PRIORIX może być stosowana u osób, które zostały uprzednio zaszczepione inną monowalentną lub skojarzoną szczepionką przeciw odrze, śwince i różyczce. Niemowlęta w wieku od 9 do 12 miesięcy Niemowlęta w pierwszym roku życia mogą nie wytworzyć wystarczającej odpowiedzi na składniki szczepionki. W przypadku, gdy sytuacja epidemiologiczna wymaga szczepienia niemowląt w pierwszym roku ich życia (np. wybuch epidemii lub podróż w rejony endemiczne), druga dawka szczepionki PRIORIX powinna zostać podana w drugim roku życia, najlepiej 3 miesiące od podania pierwszej dawki. W żadnym przypadku odstęp pomiędzy dawkami nie powinien być krótszy niż 4 tygodnie (patrz punkty 4.4 i 5.1). Niemowlęta w wieku poniżej 9 miesięcy 22
23 Bezpieczeństwo i skuteczność szczepionki PRIORIX stosowanej u niemowląt w wieku poniżej 9 miesięcy nie została oceniona. Sposób podawania PRIORIX podaje się podskórnie, jakkolwiek można także podać domięśniowo (patrz punkty 4.4 i 5.1). Szczepionka powinna zostać podana podskórnie u pacjentów z trombocytopenią lub u których występują zaburzenia krzepnięcia (patrz punkt 4.4).Instrukcja dotycząca rekonstytucji produktu leczniczego przed podaniem, patrz punkt Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, lub neomycynę. Stwierdzone w wywiadzie kontaktowe zapalenie skóry wywołane przez neomycynę nie jest przeciwwskazaniem do szczepienia. W celu uzyskania informacji dotyczących reakcji nadwrażliwości na białko jaja kurzego, patrz punkt 4.4. Zaburzona humoralna lub komórkowa odpowiedź immunologiczna (pierwotna lub nabyta), obejmująca hypogammaglobulinemię, dysgammaglobulinemię oraz AIDS lub objawy infekcji wirusem HIV lub specyficzny dla wieku procent komórek CD4+ u dzieci w wieku poniżej 12 miesięcy: CD4+ <25%; dzieci w wieku od 12 do 35 miesięcy: CD4+<20%; dzieci w wieku od 36 do 59 miesięcy: CD4+<15%; (patrz punkt 4.4). Ciąża (patrz punkt 4.6). Tak jak w przypadku innych szczepionek, u osób w okresie ostrych i ciężkich chorób przebiegających z gorączką podanie szczepionki powinno być odroczone. Łagodna infekcja, taka jak przeziębienie, nie jest przeciwwskazaniem do szczepienia. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podobnie jak w przypadku wszystkich szczepionek podawanych w iniekcji, istnieje możliwość wystąpienia reakcji anafilaktycznej, dlatego należy zapewnić możliwość fachowej opieki medycznej bezpośrednio po szczepieniu. Alkohol, a także inne środki dezynfekujące powinny wyparować ze skóry przed podaniem szczepionki, ponieważ mogą unieczynnić atenuowane wirusy znajdujące się w szczepionce. Niemowlęta szczepione w pierwszym roku życia mogą nie wytworzyć wystarczającej odpowiedzi immunologicznej na składniki szczepionki, w związku z możliwą obecnością przeciwciał matczynych w ich organizmie (patrz punkty 4.2 i 5.1) Szczególna ostrożność powinna zostać zachowana w przypadku podawania szczepionki PRIORIX osobom z zaburzeniami ośrodkowego układu nerwowego, u których istnieje ryzyko występowania drgawek gorączkowych lub u osób z drgawkami w wywiadzie rodzinnym. Osoby z przebytymi drgawkami gorączkowymi, powinny być ściśle monitorowane. U osób z chorobami alergicznymi w wywiadzie lub w wywiadzie rodzinnym, należy zachować ostrożność stosując szczepionkę. Zawarte w szczepionce wirusy odry i świnki są uzyskiwane z hodowli komórek zarodka kurzego i z tego powodu mogą zawierać śladowe ilości białka jaja. Osoby z reakcjami anafilaktycznymi, anafilaktoidalnymi lub innymi reakcjami typu natychmiastowego w wywiadzie (np. uogólniona pokrzywka, obrzęk jamy ustnej i gardła, trudności w oddychaniu, obniżenie ciśnienia tętniczego lub wstrząs) występującymi po spożyciu jaj mogą być bardziej narażone na wystąpienie reakcji typu 23
24 natychmiastowego po szczepieniu, chociaż jak wykazano, reakcje te są bardzo rzadkie. Podczas szczepienia tych osób, należy zachować szczególną ostrożność oraz zapewnić dostępność odpowiednich środków leczniczych na wypadek wystąpienia reakcji nadwrażliwości. Pacjenci z rzadkimi dziedzicznymi problemami dotyczącymi nietolerancji fruktozy, nie powinny być szczepione szczepionką PRIORIX, gdyż zawiera ona sorbitol. Ograniczona ochrona przeciw odrze może zostać uzyskana przez zaszczepienie w ciągu 72 godzin od momentu narażenia na zarażenie naturalnie występującą odrą. Tak jak w przypadku wszystkich szczepionek, nie wszystkie zaszczepione osoby mogą wytworzyć ochronny poziom przeciwciał. PRIORIX W ŻADNYM PRZYPADKU NIE MOŻE BYĆ PODAWANY DONACZYNIOWO. Trombocytopenia Przypadki nasilenia lub nawrotu trombocytopenii u osób chorujących na tę chorobę były zgłaszane po podaniu pierwszej dawki żywych szczepionek przeciwko odrze, śwince, różyczce. Trombocytopenia związana ze szczepieniem szczepionką MMR jest rzadka i zasadniczo samo ograniczająca. U pacjentów z istniejącą trombocytopenią lub historią trombocytopenii po szczepieniu przeciw odrze, śwince i różyczce należy dokładnie ocenić stosunek korzyści do ryzyka wynikający ze szczepienia szczepionką PRIORIX. Tych pacjentów należy szczepić z zachowaniem ostrożności i wykorzystując podskórną drogę podania. Pacjenci z upośledzoną odpornością Pacjenci z upośledzoną odpornością, u których nie ma przeciwwskazań do szczepienia (patrz punkt 4.3) mogą nie odpowiedzieć na szczepienie tak dobrze, jak pacjenci immunokompetentni, w związku z tym niektórzy z tych pacjentów mogą zachorować na odrę, świnkę lub różyczkę w przypadku kontaktu z wirusami, pomimo odpowiedniego podania szczepionki. Pacjentów tych należy ściśle monitorować pod kątem wystąpienia objawów odry, zapalenia ślinianek przyusznych oraz różyczki. Przenoszenie Przeniesienie wirusów odry i świnki ze szczepionki na osoby podatne na zachorowanie nie zostało nigdy udokumentowane. Wydalanie wirusów różyczki i odry do gardła występuje około 7 do 28 dni po szczepieniu, ze szczytową ilością wydalania około 11 dnia. Jednakże brak jest dowodów transmisji tych wydalonych wirusów na osoby podatne na zachorowanie. Przeniesienie wirusa różyczki na niemowlęta poprzez mleko matki, oraz transmisja wirusa przez łożysko zostały udokumentowane, bez żadnego dowodu na wystąpienie klinicznych objawów choroby. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Szczepionka PRIORIX może zostać podana jednocześnie (ale w inne miejsce wstrzyknięcia) z każdą z następujących monowalentnych lub skojarzonych szczepionek [w tym hexawalentnymi szczepionkami (DTPa-HBV-IPV/Hib)]: szczepionką przeciwko błonicy, tężcowi, krztuścowi (bezkomórkowa) (DTPa), szczepionką przeciw Haemophilus influenzae typu B (Hib), inaktywowaną szczepionką przeciw polio (IPV), szczepionką przeciw Hepatitis B (HBV), szczepionką przeciw Hepatitis A (HAV), szczepionką przeciw meningokokom grupy C, koniugowaną (MenC), szczepionką przeciw ospie (VZV), doustną szczepionką przeciw polio (OPV) oraz 10-walentną koniugowanąszczepionką przeciw pneumokokom, zgodnie z oficjalnymi zaleceniami. Jeżeli PRIORIX nie może być podany w tym samym czasie, co inne szczepionki zawierające żywe, atenuowane wirusy, należy zachować odstęp co najmniej jednego miesiąca pomiędzy szczepieniami. Brak danych, które mogłyby poprzeć jednoczesne podawanie szczepionki PRIORIX z jakimikolwiek innymi szczepionkami. 24
Ogólne podsumowanie oceny naukowej szczepionki Priorix i produktów z nią związanych pod różnymi nazwami(patrz aneks I)
 Aneks II Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego, oznakowania opakowań i ulotki dla pacjenta przedstawione przez Europejską Agencję Leków 9 Wnioski naukowe Ogólne podsumowanie
Aneks II Wnioski naukowe i podstawy do zmiany charakterystyki produktu leczniczego, oznakowania opakowań i ulotki dla pacjenta przedstawione przez Europejską Agencję Leków 9 Wnioski naukowe Ogólne podsumowanie
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX. 1 dawka (0,5 ml) szczepionki po rekonstytucji zawiera: CCID 50. szczepu Jeryl Lynn) hodowli komórkowej
 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, 2. 1 dawka (0,5 ml) szczepionki po rekonstytucji zawiera: 1 (szczep Schwarz) 3,0 3 CCID 50 1 3,7 3 CCID 50 szczepu Jeryl Lynn) 2 (szczep Wistar RA 27/3) 3,0 3 CCID
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, 2. 1 dawka (0,5 ml) szczepionki po rekonstytucji zawiera: 1 (szczep Schwarz) 3,0 3 CCID 50 1 3,7 3 CCID 50 szczepu Jeryl Lynn) 2 (szczep Wistar RA 27/3) 3,0 3 CCID
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum morbillorum, parotitidis et rubellae vivum Szczepionka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum morbillorum, parotitidis et rubellae vivum Szczepionka
Charakterystyka Produktu Leczniczego, Oznakowanie Opakowań i Ulotka dla Pacjenta
 Aneks III Charakterystyka Produktu Leczniczego, Oznakowanie Opakowań i Ulotka dla Pacjenta Uwaga: Ta wersja Charakterystyki Produktu Leczniczego uzyskuje ważność w momencie wydania Dezycji Komisji Europejskiej.
Aneks III Charakterystyka Produktu Leczniczego, Oznakowanie Opakowań i Ulotka dla Pacjenta Uwaga: Ta wersja Charakterystyki Produktu Leczniczego uzyskuje ważność w momencie wydania Dezycji Komisji Europejskiej.
UWAGA: W składzie szczepionki podano minimalne miana wirusów odry, świnki i różyczki oznaczane pod koniec terminu ważności preparatu.
 ULOTKA DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem PRIORIX (Vaccinum morbillorum, parotitidis et rubellae vivum) Liofilizat i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
ULOTKA DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem PRIORIX (Vaccinum morbillorum, parotitidis et rubellae vivum) Liofilizat i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
1. NAZWA PRODUKTU LECZNICZEGO ^015-08" 2 6 ^
 Sprawdzono M pc cl wgtędem merytorycznym 1. NAZWA PRODUKTU LECZNICZEGO ^015-08" 2 6 ^ PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce,
Sprawdzono M pc cl wgtędem merytorycznym 1. NAZWA PRODUKTU LECZNICZEGO ^015-08" 2 6 ^ PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce,
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
1. NAZWA PRODUKTU LECZNICZEGO PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (0,5 ml)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem
 INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
Wyniki procedur na mocy art. 20 rozporządzenia (WE) nr 726/2004 oraz art. 31 dyrektywy 2001/83/WE
 28 lutego 2013 r. EMA/136606/2013 wer.1 EMEA/H/A-31/1333 EMEA/H/C/000604/A20/45 EMEA/H/C/000622/A20/60 EMEA/H/C/000674/A20/52 Pytania i odpowiedzi dotyczące ponownej oceny monowalentnych i poliwalentnych
28 lutego 2013 r. EMA/136606/2013 wer.1 EMEA/H/A-31/1333 EMEA/H/C/000604/A20/45 EMEA/H/C/000622/A20/60 EMEA/H/C/000674/A20/52 Pytania i odpowiedzi dotyczące ponownej oceny monowalentnych i poliwalentnych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
Państwo Członkowskie UE/EOG. Podmiot odpowiedzialny Nazwa własna Moc Postać farmaceutyczna Droga podania Zawartość. (stężenie)
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktu leczniczego, dróg podania, podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Belgia Belgia
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktu leczniczego, dróg podania, podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Belgia Belgia
Silny niepożądany odczyn poszczepienny u rocznego dziecka. Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, r.
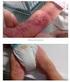
 Silny niepożądany odczyn poszczepienny u rocznego dziecka Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, 18.11.2016 r. 2 Co to jest niepożądany odczyn poszczepienny Niepożądany odczyn poszczepienny
Silny niepożądany odczyn poszczepienny u rocznego dziecka Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, 18.11.2016 r. 2 Co to jest niepożądany odczyn poszczepienny Niepożądany odczyn poszczepienny
FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania
 Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
Nazwa własna Moc Postać farmaceutyczna
 Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego weterynaryjnego, gatunki zwierząt i podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich
Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego weterynaryjnego, gatunki zwierząt i podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Polska a Europa - w drodze do nowoczesnych standardów
 Polska a Europa - w drodze do nowoczesnych standardów Programy profilaktyczne, a rzeczywistość Finansowanie szczepień ze środków publicznych Joanna Zabielska-Cieciuch Wśród 27 krajów Unii Europejskiej,
Polska a Europa - w drodze do nowoczesnych standardów Programy profilaktyczne, a rzeczywistość Finansowanie szczepień ze środków publicznych Joanna Zabielska-Cieciuch Wśród 27 krajów Unii Europejskiej,
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej, żywa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
ULOTKA DLA PACJENTA. nie mniej niż 2 j.m.
 ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem szczepionki. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać - Należy zwrócić się do lekarza lub
ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem szczepionki. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać - Należy zwrócić się do lekarza lub
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Priorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla użytkownika Priorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa Należy uważnie zapoznać
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
(2008/C 132/04) Wydanie, utrzymanie lub zmiana krajowego pozwolenia na dopuszczenie do obrotu. Posiadacz(-e) pozwolenia na dopuszczenie do obrotu
 30.5.2008 PL C 132/11 Zestawienie decyzji wspólnotowych w sprawie pozwoleń na dopuszczenie do obrotu produktów leczniczych w okresie od dnia 1 kwietnia 2008 r. do dnia 30 kwietnia 2008 r. (Decyzje podjęte
30.5.2008 PL C 132/11 Zestawienie decyzji wspólnotowych w sprawie pozwoleń na dopuszczenie do obrotu produktów leczniczych w okresie od dnia 1 kwietnia 2008 r. do dnia 30 kwietnia 2008 r. (Decyzje podjęte
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
Ulotka dołączona do opakowania: informacja dla użytkownika. POLIORIX, roztwór do wstrzykiwań
 Ulotka dołączona do opakowania: informacja dla użytkownika POLIORIX, roztwór do wstrzykiwań Szczepionka przeciw poliomyelitis, inaktywowana Szczepionka 1-dawkowa Należy uważnie zapoznać się z treścią ulotki
Ulotka dołączona do opakowania: informacja dla użytkownika POLIORIX, roztwór do wstrzykiwań Szczepionka przeciw poliomyelitis, inaktywowana Szczepionka 1-dawkowa Należy uważnie zapoznać się z treścią ulotki
SPGZOZ O F E R T A ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO PUBLICZNEGO GMINNEGO ZAKŁADU OPIEKI ZDROWOTNEJ W NADARZYNIE
 ... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Priorix-Tetra proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince,
Lipophoral Tablets 150mg. Mediator 150 mg Tabletka Podanie doustne. Benfluorex Qualimed. Mediator 150mg Tabletka Podanie doustne
 ANEKS I WYKAZ NAZW WŁASNYCH, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH (EOG) 1
ANEKS I WYKAZ NAZW WŁASNYCH, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTÓW LECZNICZYCH, DROGA PODANIA, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH (EOG) 1
(Informacje) INFORMACJE INSTYTUCJI, ORGANÓW I JEDNOSTEK ORGANIZACYJNYCH UNII EUROPEJSKIEJ KOMISJA EUROPEJSKA
 PL 30.8.2013 Dziennik Urzędowy Unii Europejskiej C 250/1 IV (Informacje) INFORMACJE INSTYTUCJI, ORGANÓW I JEDNOSTEK ORGANIZACYJNYCH UNII EUROPEJSKIEJ KOMISJA EUROPEJSKA Zestawienie decyzji Unii Europejskiej
PL 30.8.2013 Dziennik Urzędowy Unii Europejskiej C 250/1 IV (Informacje) INFORMACJE INSTYTUCJI, ORGANÓW I JEDNOSTEK ORGANIZACYJNYCH UNII EUROPEJSKIEJ KOMISJA EUROPEJSKA Zestawienie decyzji Unii Europejskiej
Ulotka dołączona do opakowania: informacja dla użytkownika. Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab
 Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Priorix-Tetra, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej,
Ulotka dołączona do opakowania: informacja dla użytkownika Priorix-Tetra, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince, różyczce i ospie wietrznej,
III. INFORMACJE UZUPEŁNIAJĄCE. A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B)
 III. INFORMACJE UZUPEŁNIAJĄCE A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B) 1. Szczepienia podstawowe noworodków i niemowląt wykonywane są trzema dawkami szczepionki w cyklu zbliżonym
III. INFORMACJE UZUPEŁNIAJĄCE A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B) 1. Szczepienia podstawowe noworodków i niemowląt wykonywane są trzema dawkami szczepionki w cyklu zbliżonym
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk
 Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
Meningokoki trzeba myśleć na zapas
 Meningokoki trzeba myśleć na zapas prof. dr hab. med. Jacek Wysocki dr n. med. Ilona Małecka Katedra i Zakład Profilaktyki Zdrowotnej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Specjalistyczny
Meningokoki trzeba myśleć na zapas prof. dr hab. med. Jacek Wysocki dr n. med. Ilona Małecka Katedra i Zakład Profilaktyki Zdrowotnej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Specjalistyczny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Vanguard Plus 5, liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla psów 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Vanguard Plus 5, liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla psów 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fluarix, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fluarix, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
Wiek Szczepienie przeciw Uwagi
 Wiek Szczepienie przeciw Uwagi 1 życia w ciągu 24 godzin po urodzeniu WZW typu B - domięśniowo (pierwsza dawka) GRUŹLICY - śródskórnie szczepionką BCG Szczepienie noworodków przeciw gruźlicy powinno być
Wiek Szczepienie przeciw Uwagi 1 życia w ciągu 24 godzin po urodzeniu WZW typu B - domięśniowo (pierwsza dawka) GRUŹLICY - śródskórnie szczepionką BCG Szczepienie noworodków przeciw gruźlicy powinno być
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
Międzynarodowa nazwa. niezastrzeżona (INN) Ferri hydroxidum dextranum
 Aneks I 1 Państwo członkowskie Podmiot odpowiedzialny posiadający pozwolenie Kontakt z lokalnym Międzynarodowa nazwa Nazwa własna Moc Postać farmaceutyczna Droga podania (w EOG) na dopuszczenie do obrotu
Aneks I 1 Państwo członkowskie Podmiot odpowiedzialny posiadający pozwolenie Kontakt z lokalnym Międzynarodowa nazwa Nazwa własna Moc Postać farmaceutyczna Droga podania (w EOG) na dopuszczenie do obrotu
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 16 Wnioski naukowe Haldol, który zawiera substancję czynną haloperydol, jest lekiem przeciwpsychotycznym należącym do grupy pochodnych butyrofenonu. Jest silnym antagonistą ośrodkowych
Aneks II Wnioski naukowe 16 Wnioski naukowe Haldol, który zawiera substancję czynną haloperydol, jest lekiem przeciwpsychotycznym należącym do grupy pochodnych butyrofenonu. Jest silnym antagonistą ośrodkowych
ZP.II.3331-01/11 Załącznik nr 5 FORMULARZ CENOWY. Pakiet nr I
 Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. Postać farmaceutyczna: proszek i rozpuszczalnik do sporządzania zawiesiny doustnej. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi,
Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. Postać farmaceutyczna: proszek i rozpuszczalnik do sporządzania zawiesiny doustnej. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi,
Ogólne podsumowanie oceny naukowej preparatu Atacand Plus i nazwy produktów związanych (patrz Aneks I)
 ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 15 Wnioski naukowe Ogólne podsumowanie
ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 15 Wnioski naukowe Ogólne podsumowanie
Anna Skop. Zachęcam do zapoznania się z prezentacja na temat szczepień.
 W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
ZP.II /13 Załącznik nr 5 FORMULARZ CENOWY. Pakiet nr I
 Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona), poliomyelitis (inaktywowana) i Haemophilus
Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona), poliomyelitis (inaktywowana) i Haemophilus
Szczepienia ochronne. Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak
 Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
System szczepień noworodków urodzonych przedwcześnie ocena dostępności
 System szczepień noworodków urodzonych przedwcześnie ocena dostępności M.K.Kornacka Klinika Neonatologii i Intensywnej Terapii Noworodka Innowacje w systemie szczepień ochronnych - czy można poprawić dostępność
System szczepień noworodków urodzonych przedwcześnie ocena dostępności M.K.Kornacka Klinika Neonatologii i Intensywnej Terapii Noworodka Innowacje w systemie szczepień ochronnych - czy można poprawić dostępność
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval 3 BRSV PI3 BVD Liofilizat i zawiesina do sporządzania zawiesiny do wstrzykiwań dla bydła. 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval 3 BRSV PI3 BVD Liofilizat i zawiesina do sporządzania zawiesiny do wstrzykiwań dla bydła. 2.
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Aneks III. Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
 Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
Postać farmaceutyczna. Moc. Clavulanic acid 10 mg. Clavulanic acid 10 mg. Clavulanic acid 10 mg. Clavulanic acid 10 mg
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktu leczniczego weterynaryjnego, gatunków zwierząt, dróg podania, wnioskodawców/podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktu leczniczego weterynaryjnego, gatunków zwierząt, dróg podania, wnioskodawców/podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie
Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 200 Roztwór do wstrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AVAXIM 160 U, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum hepatitidis A inactivatum adsorbatum Szczepionka przeciw wirusowemu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AVAXIM 160 U, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum hepatitidis A inactivatum adsorbatum Szczepionka przeciw wirusowemu
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Priorix-Tetra, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince, różyczce
Ulotka dołączona do opakowania: informacja dla użytkownika Priorix-Tetra, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw odrze, śwince, różyczce
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE
 WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Inflexal V Zawiesina do wstrzykiwań Szczepionka przeciw grypie (antygen powierzchniowy), inaktywowana, wirosomalna Sezon 2012/2013 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Inflexal V Zawiesina do wstrzykiwań Szczepionka przeciw grypie (antygen powierzchniowy), inaktywowana, wirosomalna Sezon 2012/2013 2.
Ogólne podsumowanie oceny naukowej produktu leczniczego Mifepristone Linepharma i nazw produktów związanych (patrz aneks I)
 Aneks II Wnioski naukowe i podstawy pozytywnej opinii zgodnie z warunkiem pozwolenia na dopuszczenie do obrotu i warunkiem zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione
Aneks II Wnioski naukowe i podstawy pozytywnej opinii zgodnie z warunkiem pozwolenia na dopuszczenie do obrotu i warunkiem zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione
CZYM JEST SZCZEPIONKA?
 CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
Rocephine 2 g Proszek do sporządzania roztworu do infuzji
 Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Belgia
Aneks I Wykaz nazw, postaci farmaceutycznych, mocy produktów leczniczych, dróg podania, podmiotów odpowiedzialnych posiadających pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Belgia
Informacja nt. sytuacji epidemiologicznej odry
 Łódź, dnia 28.01.2019 r. Informacja nt. sytuacji epidemiologicznej odry 23.01.2019 Rocznie rejestrowanych było w Polsce średnio 100 przypadków odry. W 2017 r. zarejestrowano 63 przypadki, zaś w 2018 r.
Łódź, dnia 28.01.2019 r. Informacja nt. sytuacji epidemiologicznej odry 23.01.2019 Rocznie rejestrowanych było w Polsce średnio 100 przypadków odry. W 2017 r. zarejestrowano 63 przypadki, zaś w 2018 r.
Moc Gatunki zwierząt. Postać farmaceutyczna. Samice psów. Enurace 50 Tabletki 50 mg
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO Infanrix-IPV, zawiesina do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona) i poliomyelitis (inaktywowana), adsorbowana
1. NAZWA PRODUKTU LECZNICZEGO Infanrix-IPV, zawiesina do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona) i poliomyelitis (inaktywowana), adsorbowana
OFERTA WYKONAWCY ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO GMINNEGO ZAKŁADU OPIEKI ZDROWOTNEJ W NADARZYNIE
 ... wykonawca (pieczęć firmowa) tel./fax:... e-mail:... Załącznik nr 1 Do:......... OFERTA WYKONAWCY W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK
... wykonawca (pieczęć firmowa) tel./fax:... e-mail:... Załącznik nr 1 Do:......... OFERTA WYKONAWCY W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK
Igantet j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Igantet 250 250 j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Igantet 250 250 j.m./ml, roztwór do wstrzykiwań, Immunoglobulina ludzka przeciwtężcowa Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
VARILRIX (Vaccinum varicellae vivum) Liofilizat i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań podskórnych.
 INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem VARILRIX (Vaccinum varicellae vivum) Liofilizat i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań podskórnych.
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem VARILRIX (Vaccinum varicellae vivum) Liofilizat i rozpuszczalnik do sporządzenia roztworu do wstrzykiwań podskórnych.
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego, droga podania, wnioskodawcy / podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Podmiot
Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego, droga podania, wnioskodawcy / podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Podmiot
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
B. ULOTKA INFORMACYJNA
 B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
WNIOSKI NAUKOWE I PODSTAWY ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU DLA HBVAXPRO PRZEDSTAWIONE PRZEZ EMEA
 WNIOSKI NAUKOWE I PODSTAWY ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU DLA HBVAXPRO PRZEDSTAWIONE PRZEZ EMEA WPROWADZENIE HBVAXPRO jest monowalentną szczepionką opracowaną w celu czynnego uodporniania
WNIOSKI NAUKOWE I PODSTAWY ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU DLA HBVAXPRO PRZEDSTAWIONE PRZEZ EMEA WPROWADZENIE HBVAXPRO jest monowalentną szczepionką opracowaną w celu czynnego uodporniania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. adsorbowany na wodorotlenku glinu, uwodnionym nie więcej niż 0,7 mg Al 3+
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
Jedna dawka (0,5 ml) po rekonstytucji, zawiera: Polisacharyd otoczkowy Haemophilus influenzae typ b.. 10 mikrogramów
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Act-HIB, 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum haemophili stirpi b coniugatum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Act-HIB, 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum haemophili stirpi b coniugatum
Większość pacjentów poddanych chemioterapii i radioterapii doświadcza nudności i wymiotów, które można sklasyfikować w następujący sposób:
 ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 11 Wnioski naukowe Ogólne podsumowanie
ANEKS II WNIOSKI NAUKOWE I PODSTAWY DO ZMIANY CHARAKTERYSTYKI PRODUKTU LECZNICZEGO, OZNAKOWANIA OPAKOWAŃ I ULOTKI DLA PACJENTA PRZEDSTAWIONE PRZEZ EUROPEJSKĄ AGENCJĘ LEKÓW 11 Wnioski naukowe Ogólne podsumowanie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TYPHIM Vi, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum febris typhoidis polysaccharidicum Szczepionka przeciw durowi brzusznemu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TYPHIM Vi, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum febris typhoidis polysaccharidicum Szczepionka przeciw durowi brzusznemu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw poliomyelitis, inaktywowana Należy uważnie zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla użytkownika IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw poliomyelitis, inaktywowana Należy uważnie zapoznać się z treścią
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Act-HIB 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b, skoniugowana
 Ulotka dołączona do opakowania: informacja dla użytkownika Act-HIB 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b, skoniugowana
Ulotka dołączona do opakowania: informacja dla użytkownika Act-HIB 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b, skoniugowana
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta
 Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Pseudovac, roztwór do wstrzykiwań Szczepionka poliwalentna przeciwko pałeczce ropy błękitnej Pseudomonas aeruginosa 1 ml szczepionki zawiera antygeny
Ulotka dołączona do opakowania: informacja dla użytkownika Pseudovac, roztwór do wstrzykiwań Szczepionka poliwalentna przeciwko pałeczce ropy błękitnej Pseudomonas aeruginosa 1 ml szczepionki zawiera antygeny
Charakterystyka produktu leczniczego. 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce.
 Charakterystyka produktu leczniczego 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona),
Charakterystyka produktu leczniczego 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona),
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval IBR-Marker Vivum Liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval IBR-Marker Vivum Liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła.
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów
 FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE
 WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE Stanowisko Zarządu Polskiego Towarzystwa Wakcynologii z dnia 10 marca 2017 roku w sprawie stosowania szczepionki Tetraxim w szczepieniu podstawowym przeciwko krztuścowi
WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE Stanowisko Zarządu Polskiego Towarzystwa Wakcynologii z dnia 10 marca 2017 roku w sprawie stosowania szczepionki Tetraxim w szczepieniu podstawowym przeciwko krztuścowi
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 1000 Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Roztwór do wstrzykiwań Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA GAMMA anty-hbs 1000 Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby typu B Roztwór do wstrzykiwań Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
Nazwa. UMAN BIG 180 I.E./ml Injektionslösung. UMAN BIG 180 IU/ml Roztwór do wstrzykiwań. Umanbig 180 NE/ml. UMAN BIG 180 IU/ml Roztwór do wstrzykiwań
 ANEKS I WYKAZ NAZW, POSTAĆ(CI) FARMACEUTYCZNA(YCH), MOC(Y) PRODUKTÓW LECZNICZYCH, DROGA(DRÓG) PODANIA, WNIOSKODAWCA(Y), PODMIOT(Y) ODPOWIEDZIALNY(E) POSIADAJĄCY(E) POZWOLENIE NA DOPUSZCZENIE DO OBROTU
ANEKS I WYKAZ NAZW, POSTAĆ(CI) FARMACEUTYCZNA(YCH), MOC(Y) PRODUKTÓW LECZNICZYCH, DROGA(DRÓG) PODANIA, WNIOSKODAWCA(Y), PODMIOT(Y) ODPOWIEDZIALNY(E) POSIADAJĄCY(E) POZWOLENIE NA DOPUSZCZENIE DO OBROTU
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika D - Szczepionka błonicza adsorbowana zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Nie mniej niż 30 j.m. toksoidu błoniczego/0,5
Ulotka dołączona do opakowania: informacja dla użytkownika D - Szczepionka błonicza adsorbowana zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Nie mniej niż 30 j.m. toksoidu błoniczego/0,5
