CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
|
|
|
- Radosław Kozłowski
- 9 lat temu
- Przeglądów:
Transkrypt
1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diclac, 25 mg/ml (75 mg/3 ml), roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 25 mg diklofenaku sodowego (Diclofenacum natricum). 1 ampułka (3 ml) roztworu do wstrzykiwań zawiera 75 mg diklofenaku sodowego. Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Leczenie objawowe ostrego bólu w przypadku: reumatoidalnego zapalenia stawów (RZS) zesztywniającego zapalenia stawów kręgosłupa (ZZSK) zapalenia stawów krzyżowo-biodrowych zapalenia kości i stawów zmian zwyrodnieniowych kręgosłupa dny moczanowej pourazowych bólów stawowych lub mięśniowych bólów pooperacyjnych związanych ze stanem zapalnym i obrzękiem stanów zapalnych mięśni, ścięgien i wiązadeł reumatyzmu pozastawowego zapalenia okołostawowego Stosowanie roztworu do wstrzykiwań jest wskazane tylko wtedy, gdy konieczny jest bardzo szybki początek działania lub gdy przyjmowanie produktu leczniczego doustnie bądź w postaci czopka nie jest możliwe. 4.2 Dawkowanie i sposób podawania Diclac przeznaczony jest do wstrzykiwań domięśniowych. Podawanie leku w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.4). Dorośli Diclac przeznaczony jest do początkowego leczenia w ostrej fazie choroby. Zazwyczaj stosowana dawka wynosi 75 mg na dobę (1 ampułka), w głębokim wstrzyknięciu domięśniowym. Wyjątkowo, w ciężkich przypadkach (np. napad bólu kolkowego), dawkę dobową można zwiększyć do 150 mg, podając 2 ampułki po 75 mg w odstępie kilku godzin (po jednym wstrzyknięciu w każdy pośladek). Można również podać 75 mg (1 ampułka) w skojarzeniu z inną postacią produktu leczniczego Diclac (tabletki, czopki). Całkowita dawka maksymalna wynosi 150 mg na dobę. 1
2 Diclac podaje się zwykle przez 1 lub 2 dni. W wyjątkowych przypadkach, gdy niemożliwe jest podawanie diklofenaku doustnie, produkt leczniczy Diclac w postaci wstrzyknięć domięśniowych może być stosowany dłużej. Diclac należy wstrzykiwać głęboko domięśniowo (mięsień pośladkowy - górny zewnętrzny kwadrant). Dzieci i młodzież Nie zaleca się stosowania produktu leczniczego Diclac u dzieci i młodzieży. 4.3 Przeciwwskazania Nadwrażliwość na diklofenak lub na którąkolwiek substancję pomocniczą. Czynna choroba wrzodowa żołądka i (lub) dwunastnicy, owrzodzenie jelit, krwawienie z przewodu pokarmowego lub perforacja. Trzeci trymestr ciąży (patrz punkt 4.6). Ciężka niewydolność wątroby, nerek lub serca (patrz punkt 4.4). Diklofenak jest przeciwwskazany u pacjentów, u których podanie kwasu acetylosalicylowego lub innych niesteroidowych leków przeciwzapalnych (NLPZ) wywołuje napady astmy, pokrzywkę lub ostre zapalenie błony śluzowej nosa. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Przyjmowanie leku w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). Ostrzeżenia Podczas stosowania niesteroidowych leków przeciwzapalnych, w tym diklofenaku, mogą wystąpić krwawienia, owrzodzenie lub perforacja przewodu pokarmowego, które mogą być śmiertelne. Działania te mogą wystąpić na dowolnym etapie leczenia, również bez objawów zwiastunowych i ciężkich zdarzeń dotyczących przewodu pokarmowego w wywiadzie. Zwykle działania niepożądane są bardziej zwiększone u pacjentów w podeszłym wieku. Jeśli u pacjentów otrzymujących diklofenak wystąpią krwawienia lub owrzodzenie przewodu pokarmowego, należy zaprzestać stosowania produktu leczniczego. Bardzo rzadko po zastosowaniu niesteroidowych leków przeciwzapalnych, w tym diklofenaku, obserwowano ciężkie reakcje skórne (niektóre zakończone zgonem), takie jak: złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie naskórka (zespół Lyella) (patrz punkt 4.8). Ryzyko wystąpienia takich reakcji jest największe w początkowym okresie leczenia. W większości przypadków objawy występowały w pierwszym miesiącu leczenia. W przypadku wystąpienia wysypki, zmian w obrębie błony śluzowej lub innych objawów nadwrażliwości należy zaprzestać stosowania diklofenaku. Podobnie jak w przypadku innych NLPZ, diklofenak może powodować reakcje alergiczne, włącznie z reakcjami anafilaktycznymi i (lub) rzekomoanafilaktycznymi, nawet jeśli nie był wcześniej stosowany. Diklofenak, podobnie jak inne NLPZ, może maskować objawy zakażenia ze względu na swoje właściwości farmakodynamiczne. Wpływ na płodność kobiet: patrz punkt
3 Środki ostrożności Ogólne Należy unikać jednoczesnego stosowania diklofenaku z innymi NLPZ o działaniu ogólnoustrojowym, w tym z selektywnymi inhibitorami cyklooksygenazy-2 (Cox-2), ze względu na brak danych potwierdzających większe korzyści ze stosowania skojarzonego i możliwość sumowania się działań niepożądanych. Zachowanie środków ostrożności u osób w podeszłym wieku wynika ze wskazań medycznych. U pacjentów w podeszłym wieku, osłabionych lub z małą masą ciała należy stosować najmniejszą skuteczną dawkę produktu leczniczego. Astma w wywiadzie U pacjentów z astmą, sezonowym alergicznym zapaleniem błony śluzowej nosa, obrzękiem błony śluzowej nosa (np. z powodu polipów nosa), przewlekłą obturacyjną chorobą płuc lub przewlekłymi zakażeniami dróg oddechowych, częściej niż u innych pacjentów występują działania niepożądane związane ze stosowaniem NLPZ, takie jak zaostrzenie objawów astmy (tzw. nietolerancja leków przeciwbólowych lub astma aspirynowa), obrzęk naczynioruchowy (obrzęk Quinckego) lub pokrzywka. Dlatego u tych pacjentów należy zachować szczególną ostrożność (gotowość do pilnej interwencji). Dotyczy to również pacjentów z uczuleniem na inne substancje, np. z reakcjami skórnymi, świądem lub pokrzywką. Wpływ na przewód pokarmowy Podobnie jak w przypadku wszystkich NLPZ, stosowanie diklofenaku u pacjentów z objawami wskazującymi na zaburzenia przewodu pokarmowego lub z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, krwawieniem lub perforacją przewodu pokarmowego (patrz punkt 4.8) wymaga szczególnej ostrożności i powinno odbywać się pod nadzorem lekarza. Ryzyko wystąpienia krwawień z przewodu pokarmowego zwiększa się po zastosowaniu większych dawek NLPZ oraz w przypadku pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, szczególnie powikłaną krwotokiem lub perforacją, a także u osób w podeszłym wieku. W celu zmniejszenia ryzyka toksycznego wpływu na przewód pokarmowy u pacjentów z przebytą chorobą wrzodową żołądka i (lub) dwunastnicy, szczególnie powikłaną krwotokiem lub perforacją, lub u osób w podeszłym wieku, należy zastosować najmniejszą skuteczną dawkę produktu leczniczego. U tych pacjentów oraz u pacjentów przyjmujących jednocześnie małe dawki kwasu acetylosalicylowego lub inne leki zwiększające ryzyko powikłań dotyczących przewodu pokarmowego należy rozważyć zastosowanie leczenia skojarzonego z lekami działającymi ochronnie (np. inhibitorami pompy protonowej lub mizoprostolem). Pacjenci z zaburzeniami przewodu pokarmowego w wywiadzie, zwłaszcza pacjenci w podeszłym wieku, powinni zgłaszać wszelkie dolegliwości dotyczące przewodu pokarmowego (zwłaszcza krwawienie). Zaleca się również zachowanie ostrożności u pacjentów otrzymujących jednocześnie leki, które mogą zwiększać ryzyko owrzodzenia lub krwawienia z przewodu pokarmowego, takie jak kortykosteroidy o działaniu ogólnym, leki przeciwzakrzepowe, przeciwpłytkowe lub selektywne inhibitory wychwytu zwrotnego serotoniny (patrz punkt 4.5). Pacjenci z wrzodziejącym zapaleniem jelita grubego lub chorobą Leśniowskiego-Crohna powinni przyjmować produkt leczniczy pod nadzorem lekarza ze względu na możliwość nasilenia objawów (patrz punkt 4.8). Wpływ na czynność wątroby Pacjenci z zaburzeniami czynności wątroby powinni przyjmować produkt leczniczy pod nadzorem lekarza ze względu na możliwość pogorszenia ogólnego stanu. Podczas stosowania NLPZ, w tym diklofenaku, może nastąpić zwiększenie aktywności jednego lub więcej enzymów wątrobowych. W przypadku długotrwałego leczenia diklofenakiem należy regularnie 3
4 kontrolować czynności wątroby. Stosowanie diklofenaku należy przerwać, jeśli nieprawidłowe wyniki badań czynnościowych wątroby utrzymują się lub ulegają pogorszeniu, jeśli występują kliniczne oznaki lub objawy sugerujące zaburzenia czynności wątroby lub występują inne objawy (np. eozynofilia, wysypka). Podczas stosowania diklofenaku zapalenie wątroby może występować bez uprzednich objawów zwiastunowych. Należy zachować ostrożność podczas stosowania diklofenaku u pacjentów z porfirią wątrobową ze względu na ryzyko wywołania napadu porfirii. Wpływ na czynność nerek Podczas leczenia NLPZ, w tym diklofenakiem, należy zachować szczególną ostrożność u pacjentów z zaburzeniami czynności serca lub nerek, przyjmujących leki moczopędne lub leki, które mogą znacząco wpływać na czynność nerek oraz u pacjentów z nadmierną utratą płynu pozakomórkowego o różnej etiologii, np. przed lub po dużych zabiegach operacyjnych (patrz punkt 4.3) ze względu na możliwość retencji płynów i wystąpienia obrzęków. Podczas stosowania diklofenaku zaleca się u tych pacjentów monitorowanie czynności nerek. Odstawienie produktu leczniczego powoduje zwykle powrót do stanu sprzed leczenia. Wpływ na parametry hematologiczne Podobnie jak w przypadku innych NLPZ, podczas długotrwałego leczenia diklofenakiem należy wykonywać badania kontrolne krwi. Podobnie jak inne NLPZ, diklofenak może przejściowo hamować agregację płytek krwi. Należy zachować ostrożność u pacjentów z zaburzeniami krzepnięcia krwi. Wpływ na układ krążenia i naczynia zaopatrujące mózg Pacjentów z nadciśnieniem tętniczym w wywiadzie lub łagodną do umiarkowanej zastoinową niewydolnością serca, z zatrzymaniem płynów i z obrzękami należy odpowiednio kontrolować i wydawać właściwe zalecenia. Zatrzymanie płynów i obrzęki były zgłaszane w związku z leczeniem NLPZ. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg na dobę) przez długi okres czasu może być związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar). Pacjenci z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca, chorobą niedokrwienną serca, chorobą tętnic obwodowych lub chorobą naczyń mózgu powinni być leczeni diklofenakiem bardzo rozważnie. Podobną rozwagę należy zachować przed rozpoczęciem długotrwałego leczenia pacjentów z czynnikami ryzyka chorób układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Wymienione poniżej interakcje uwzględniają także obserwacje dotyczące stosowania innych postaci farmaceutycznych zawierających diklofenak. Lit: diklofenak może powodować zwiększenie stężenia litu w osoczu. Należy kontrolować stężenie litu w surowicy. Digoksyna: diklofenak może powodować zwiększenie stężenia digoksyny w osoczu. Należy kontrolować stężenie digoksyny w surowicy. Leki moczopędne i zmniejszające ciśnienie tętnicze krwi: tak jak inne NLPZ, diklofenak może zmniejszać działanie leków moczopędnych lub leków zmniejszających ciśnienie tętnicze krwi (np. leków beta-adrenolitycznych, inhibitorów konwertazy angiotensyny). Dlatego należy zachować ostrożność podczas leczenia skojarzonego oraz okresowo kontrolować ciśnienie tętnicze krwi, zwłaszcza u pacjentów w podeszłym wieku. Ze względu na zwiększone ryzyko nefrotoksyczności, 4
5 pacjentów należy odpowiednio nawadniać i okresowo kontrolować czynność nerek po rozpoczęciu oraz w trakcie leczenia skojarzonego, szczególnie po zastosowaniu leków moczopędnych i inhibitorów konwertazy angiotensyny. Jednoczesne stosowanie diklofenaku i leków moczopędnych oszczędzających potas może spowodować zwiększenie stężenia potasu w surowicy, dlatego wskazane jest częste monitorowanie tego parametru (patrz punkt 4.4). Inne NLPZ i kortykosteroidy: jednoczesne stosowanie diklofenaku i innych NLPZ lub kortykosteroidów o działaniu ogólnym może zwiększać częstość występowania działań niepożądanych dotyczących przewodu pokarmowego (patrz punkt 4.4). Leki przeciwzakrzepowe i przeciwpłytkowe: należy zachować ostrożność ze względu na, zwiększone ryzyko krwawienia (patrz punkt 4.4). Wprawdzie badania kliniczne nie wykazują wpływu diklofenaku na działanie leków przeciwzakrzepowych, istnieją pojedyncze doniesienia o zwiększonym ryzyku wystąpienia krwotoku u pacjentów przyjmujących jednocześnie diklofenak i leki przeciwzakrzepowe. Pacjentów takich należy uważnie monitorować. Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI): jednoczesne stosowanie NLPZ o działaniu ogólnym (w tym diklofenaku) i leków z grupy SSRI może zwiększać ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4). Leki przeciwcukrzycowe: badania kliniczne wykazały, że diklofenak może być podawany razem z doustnymi lekami przeciwcukrzycowymi bez wpływu na ich skuteczność. W pojedynczych przypadkach obserwowano jednak występowanie zarówno hipoglikemii, jak i hiperglikemii, powodujące konieczność zmiany dawkowania leków przeciwcukrzycowych. Dlatego podczas leczenia skojarzonego należy profilatycznie kontrolować stężenie glukozy we krwi. Metotreksat: należy zachować ostrożność w przypadku stosowania NLPZ, w tym diklofenaku, w czasie krótszym niż 24 godziny przed lub po zastosowaniu metotreksatu, gdyż możliwe jest zwiększenie stężenia metotreksatu we krwi i zwiększenie jego toksyczności. Cyklosporyna: podobnie jak inne NLPZ, diklofenak może zwiększać nefrotoksyczność cyklosporyny spowodowaną wpływem na prostaglandyny nerkowe. Należy zastosować mniejsze dawki diklofenaku niż u pacjentów nie otrzymujących cyklosporyny. Leki przeciwbakteryjne z grupy chinolonów: istnieją pojedyncze doniesienia o występowaniu drgawek po jednoczesnym zastosowaniu chinolonów i leków z grupy NLPZ. Silne inhibitory CYP2C9 Należy zachować ostrożność podczas przepisywania diklofenaku wraz z silnymi inhibitorami CYP2C9 (takimi jak sulfinpirazon i worykonazol), gdyż możliwe jest znaczne zwiększenie maksymalnego stężenia w osoczu oraz ekspozycji na diklofenak na skutek zahamowania jego metabolizmu. Fenytoina Podczas stosowania fenytoiny razem z diklofenakiem należy monitorować stężenie fenytoiny w osoczu ze względu na spodziewane zwiększenie ekspozycji na fenytoinę. 4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie badano stosowania diklofenaku u kobiet w ciąży. Z tego względu w pierwszych dwóch trymestrach ciąży diklofenak można stosować tylko wtedy, gdy oczekiwane korzyści dla matki przewyższają potencjalne ryzyko dla płodu. Tak jak w przypadku innych NLPZ, stosowanie diklofenaku w trzecim trymestrze ciąży jest przeciwwskazane ze względu na możliwość zahamowania kurczliwości macicy i (lub) przedwczesnego zamknięcia przewodu tętniczego u płodu (patrz punkt 4.3). Badania na zwierzętach nie wykazały bezpośredniego lub pośredniego szkodliwego wpływu na 5
6 przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3). Karmienie piersią Podobnie jak inne NLPZ, diklofenak przenika w niewielkich ilościach do mleka kobiet karmiących piersią. Aby uniknąć działań niepożądanych u niemowlęcia, diklofenaku nie należy stosować w okresie karmienia piersią. Wpływ na płodność kobiet Podobnie, jak w przypadku innych NLPZ, stosowanie diklofenaku może niekorzystnie wpływać na płodność u kobiet i nie jest ono zalecane u pacjentek, które planują ciążę. U kobiet, które mają trudności z zajściem w ciążę lub które są w trakcie diagnozowania niepłodności należy rozważyć odstawienie diklofenaku. 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjenci, u których podczas stosowania produktu leczniczego Diclac występują zaburzenia widzenia, zawroty głowy, senność lub inne zaburzenia ośrodkowego układu nerwowego, nie powinni prowadzić pojazdów lub obsługiwać maszyn. 4.8 Działania niepożądane Reakcje niepożądane (tabela 1) zostały pogrupowane na podstawie częstości występowania, według następującej konwencji (zaczynając od najczęstszych): często ( 1/100 do <1/10); niezbyt często ( 1/1000 do <1/100); rzadko ( 1/ do <1/1000); bardzo rzadko (<1/10 000), z pojedynczymi przypadkami włącznie. Wymienione działania niepożądane obejmują doniesienia dotyczące krótko- i długotrwałego stosowania diklofenaku w postaci roztworu do wstrzykiwań i (lub) innych postaci farmaceutycznych. Tabela 1 Zakażenia i zarażenia pasożytnicze Bardzo rzadko: Ropień w miejscu wstrzyknięcia Zaburzenia krwi i układu chłonnego Bardzo rzadko: Trombocytopenia, leukopenia, niedokrwistość (w tym niedokrwistość hemolityczna i aplastyczna), agranulocytoza Zaburzenia układu immunologicznego Nadwrażliwość, reakcje anafilaktyczne i rzekomoanafilaktyczne (w tym niedociśnienie tętnicze i wstrząs) Bardzo rzadko: Obrzęk naczynioruchowy (w tym obrzęk twarzy) Zaburzenia psychiczne Bardzo rzadko: Dezorientacja, depresja, bezsenność, koszmary senne, drażliwość, zaburzenia psychotyczne Zaburzenia układu nerwowego Ból głowy, zawroty głowy Senność Bardzo rzadko: Parestezje, zaburzenia pamięci, drgawki, lęk, drżenie mięśni, jałowe zapalenie opon mózgowo-rdzeniowych, zaburzenia smaku, udar naczyniowy mózgu Zaburzenia oka Bardzo rzadko: Zaburzenia widzenia, nieostre widzenie, podwójne widzenie Zaburzenia ucha i błędnika Zawroty głowy Bardzo rzadko: Szumy uszne, zaburzenia słuchu Zaburzenia serca Bardzo rzadko: Kołatanie serca, ból w klatce piersiowej, niewydolność serca, zawał mięśnia 6
7 sercowego Zaburzenia naczyniowe Bardzo rzadko: Nadciśnienie tętnicze, zapalenie naczyń Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Astma (włącznie z dusznością) Bardzo rzadko: Zapalenie płuc Zaburzenia żołądka i jelit Nudności, wymioty, biegunka, niestrawność, ból brzucha, wzdęcie, jadłowstręt Zapalenie błony śluzowej żołądka, krwawienie z przewodu pokarmowego, krwawe wymioty, krwawa biegunka, smoliste stolce, choroba wrzodowa żołądka i (lub) dwunastnicy (ewentualnie z krwawieniem lub perforacją) Bardzo rzadko: Zapalenie okrężnicy (w tym krwotoczne zapalenie okrężnicy i zaostrzenie wrzodziejącego zapalenia okrężnicy lub choroby Leśniowskiego-Crohna), zaparcie, zapalenie błony śluzowej jamy ustnej, zapalenie języka, schorzenia przełyku, błoniaste zwężenie jelita, zapalenie trzustki Zaburzenia wątroby i dróg żółciowych Zwiększenie aktywności aminotransferaz Zapalenie wątroby, żółtaczka, zaburzenia czynności wątroby Bardzo rzadko: Piorunujące zapalenie wątroby, martwica wątroby, niewydolność wątroby Zaburzenia skóry i tkanki podskórnej Wysypka Pokrzywka Bardzo rzadko: Wykwity pęcherzowe, wyprysk, rumień, rumień wielopostaciowy, zespół Stevensa-Johnsona, toksyczne martwicze oddzielanie naskórka (zespół Lyella), złuszczające zapalenie skóry, wypadanie włosów, nadwrażliwość na światło, plamica, plamica alergiczna, świąd Zaburzenia nerek i dróg moczowych Bardzo rzadko: Ostra niewydolność nerek, krwiomocz, białkomocz, zespół nerczycowy, śródmiąższowe zapalenie nerek, martwica brodawek nerkowych Zaburzenia ogólne i stany w miejscu podania Podrażnienie, ból i stwardnienie w miejscu wstrzyknięcia Obrzęk, martwica w miejscu wstrzyknięcia. W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia i niewydolności serca. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie długotrwale w dużych dawkach, może być związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar), patrz punkt Przedawkowanie Objawy Przedawkowanie diklofenaku nie daje specyficznego obrazu klinicznego. Przedawkowanie może wywoływać takie objawy, jak wymioty, krwawienie z przewodu pokarmowego, biegunka, zawroty głowy, szumy uszne lub drgawki. W przypadku ostrego zatrucia może wystąpić ostra niewydolność nerek i uszkodzenie wątroby. Postępowanie lecznicze Postępowanie w przypadku ostrego zatrucia niesteroidowymi lekami przeciwzapalnymi, w tym diklofenakiem, polega głównie na zastosowaniu leczenia podtrzymującego i objawowego. Leczenie podtrzymujące i objawowe należy zastosować w przypadku takich powikłań, jak niedociśnienie tętnicze, niewydolność nerek, drgawki, zaburzenia żołądka i jelit, zaburzenia oddychania. Diureza wymuszona, dializa czy przetaczanie krwi nie są pomocne w usuwaniu NLPZ, w tym diklofenaku, z organizmu ze względu na dużą zdolność do wiązania z białkami i rozległy metabolizm. 7
8 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne; pochodne kwasu octowego Kod ATC: M01AB05 Diklofenak sodowy jest inhibitorem syntetazy prostaglandynowej. Jest to pochodna kwasu fenylooctowego o właściwościach przeciwzapalnych, przeciwbólowych i przeciwgorączkowych. Hamowanie biosyntezy prostaglandyn uważane jest za podstawę mechanizmu działania. Prostaglandyny odgrywają zasadniczą rolę w patogenezie procesu zapalnego, bólu i gorączki. W chorobach reumatycznych właściwości przeciwzapalne i przeciwbólowe diklofenaku sodowego powodują istotne złagodzenie objawów przedmiotowych i podmiotowych, takich jak ból spoczynkowy, ból podczas ruchu, sztywność poranna i obrzęk stawów, a także poprawę sprawności fizycznej. W pourazowych i pooperacyjnych stanach zapalnych diklofenak sodowy szybko łagodzi zarówno ból spoczynkowy, jak i ból podczas ruchu oraz zmniejsza stan zapalny i obrzęk. Badania kliniczne wykazały również, że diklofenak sodowy stosowany w bolesnym miesiączkowaniu łagodzi ból i zmniejsza intensywność krwawienia. 5.2 Właściwości farmakokinetyczne Wchłanianie: Diklofenak podany domięśniowo w dawce 75 mg wchłania się natychmiast i osiąga stężenie maksymalne (około 2,5 µg/ml (8 µmol/l) po upływie około 20 minut. Ilość wchłoniętego leku jest liniowo zależna od wielkości dawki. Pole pod krzywą zależności stężenia od czasu (AUC) po podaniu domięśniowym lub dożylnym jest około dwa razy większe niż po podaniu doustnym lub doodbytniczym identycznej dawki, gdyż około połowy substancji czynnej podanej doustnie lub doodbytniczo jest szybko metabolizowane w wątrobie (efekt pierwszego przejścia ). Podczas ponownego podania produktu leczniczego farmakokinetyka pozostaje niezmieniona. Nie dochodzi do kumulacji produktu leczniczego w organizmie, jeśli zachowane zostaną zalecane przerwy w dawkowaniu. Dystrybucja: Diklofenak wiąże się z białkami osocza w 99,7%, głównie z albuminami (99,4%). Objętość dystrybucji wynosi od 0,12 do 0,17 l/kg. Diklofenak przenika do płynu maziowego, gdzie osiąga maksymalne stężenie w 2 do 4 godzin po uzyskaniu maksymalnego stężenia w osoczu. Stężenie to jest większe niż w osoczu i pozostaje większe nawet przez 12 godzin. Okres półtrwania w fazie eliminacji z płynu maziowego wynosi od 3 do 6 godzin. Diklofenak i jego metabolity przenikają przez łożysko, a śladowe ilości diklofenaku były wykrywane w mleku kobiet karmiących piersią. Metabolizm: Metabolizm diklofenaku obejmuje częściowo glukuronidację niezmienionej cząsteczki, jednak głównym szlakiem metabolicznym jest pojedyncza i wielokrotna hydroksylacja i metoksylacja z wytworzeniem kilku metabolitów fenolowych (3 -hydroksy-, 4 -hydroksy-, 5 -hydroksy-, 4, 5 - dihydroksy-, 3 -hydroksy-4 -metoksy-diklofenak), z których większość jest przekształcana do związków sprzężonych z kwasem glukuronowym. Dwa spośród metabolitów fenolowych wykazują aktywność biologiczną, ale mniejszą niż diklofenak. 8
9 Wydalanie: Całkowity klirens ogólnoustrojowy diklofenaku wynosi 263 ± 56 ml/min (średnia ± SD). Okres półtrwania w fazie eliminacji w osoczu wynosi 1 do 2 godzin. Cztery metabolity, w tym dwa czynne, również charakteryzują się krótkim okresem półtrwania (1 do 3 godzin). Jeden metabolit (3 -hydroksy-4 -metoksydiklofenak) ma znacznie dłuższy okres półtrwania, ale jest on praktycznie nieaktywny. Około 60% podanej dawki wydalane jest w moczu w postaci metabolitów. Mniej niż 1% dawki wydala się w postaci niezmienionej, a pozostała część wydalana jest w postaci metabolitów poprzez żółć z kałem. Dane dotyczące pacjentów: Nie obserwowano istotnych różnic we wchłanianiu, metabolizmie lub wydalaniu diklofenaku, zależnych od wieku pacjenta. Badania kinetyki pojedynczej dawki u pacjentów z zaburzeniami czynności nerek mogą sugerować brak kumulacji substancji czynnej w postaci niezmienionej po zastosowaniu zalecanego schematu dawkowania. Jeśli klirens kreatyniny jest mniejszy niż 10 ml/min, teoretyczne stężenia hydroksypochodnych diklofenaku w osoczu w stanie stacjonarnym są około 4 razy większe niż u osób zdrowych. Metabolity te są ostatecznie wydalane z żółcią. U pacjentów z przewlekłym zapaleniem wątroby lub wyrównaną marskością wątroby kinetyka i metabolizm diklofenaku są takie same, jak u pacjentów bez chorób wątroby. 5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, uwzględniające wyniki badań toksyczności ostrej i po podaniu dawki wielokrotnej, badań genotoksyczności, potencjalnego działania mutagennego i rakotwórczego diklofenaku nie ujawniły występowania szczególnego zagrożenia dla człowieka po zastosowaniu zalecanych dawek terapeutycznych. Nie stwierdzono działania teratogennego diklofenaku u myszy, szczurów i królików. Diklofenak nie wpływa na płodność pokolenia rodzicielskiego u szczurów. Nie stwierdzono wpływu na rozwój przed-, około- i pourodzeniowy potomstwa. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych N-acetylocysteina Alkohol benzylowy Mannitol Sodu wodorotlenek Glikol propylenowy Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 5 lat 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze do 25ºC, chronić od światła. 6.5 Rodzaj i zawartość opakowania Ampułki z bezbarwnego szkła w tekturowym pudełku. Opakowania zawierają 5 i 10 ampułek po 3 ml. 9
10 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania. Bez szczególnych wymagań. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Sandoz GmbH Biochemiestrasse 10 A-6250 Kundl, Austria 8. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU Pozwolenie nr: DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/ DATA PRZEDŁUŻENIA POZWOLENIA / / / / DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Naklofen, 75 mg/3 ml, roztwór do wstrzykiwań. (Diclofenacum natricum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Naklofen, 75 mg/3 ml, roztwór do wstrzykiwań (Diclofenacum natricum) Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Naklofen, 75 mg/3 ml, roztwór do wstrzykiwań (Diclofenacum natricum) Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Diclac mg, czopki Diclofenacum natricum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Diclac 50 50 mg, czopki Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Diclac 50 50 mg, czopki Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1. NAZWA PRODUKTU LECZNICZEGO 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta DIFADOL 25 mg/ml, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji Diclofenacum natricum Należy uważnie zapoznać się z treścią ulotki
Ulotka dołączona do opakowania: informacja dla pacjenta DIFADOL 25 mg/ml, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji Diclofenacum natricum Należy uważnie zapoznać się z treścią ulotki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diclac 150 Duo, 150 mg, tabletki o zmodyfikowanym uwalnianiu 2. SKŁAD JAKOSCIOWY I ILOŚCIOWY 1 tabletka o zmodyfikowanym uwalnianiu zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diclac 150 Duo, 150 mg, tabletki o zmodyfikowanym uwalnianiu 2. SKŁAD JAKOSCIOWY I ILOŚCIOWY 1 tabletka o zmodyfikowanym uwalnianiu zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diclac, 25 mg/ml (75 mg/3 ml), roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 25 mg diklofenaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diclac, 25 mg/ml (75 mg/3 ml), roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 25 mg diklofenaku
Ulotka dołączona do opakowania: informacja dla użytkownika. Naklofen, 25 mg/ml, roztwór do wstrzykiwań Diclofenacum natricum
 Ulotka dołączona do opakowania: informacja dla użytkownika Naklofen, 25 mg/ml, roztwór do wstrzykiwań Diclofenacum natricum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika Naklofen, 25 mg/ml, roztwór do wstrzykiwań Diclofenacum natricum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dolgit, 50 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g kremu Dolgit zawiera 5 g ibuprofenu (Ibuprofenum) Pełen wykaz substancji pomocniczych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dolgit, 50 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g kremu Dolgit zawiera 5 g ibuprofenu (Ibuprofenum) Pełen wykaz substancji pomocniczych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diclac 50, 50 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden czopek zawiera 50 mg diklofenaku sodowego (Diclofenacum natricum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diclac 50, 50 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden czopek zawiera 50 mg diklofenaku sodowego (Diclofenacum natricum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Naklofen, 25 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 25 mg diklofenaku sodowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Naklofen, 25 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 25 mg diklofenaku sodowego
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Diclac 75 Duo 75 mg, tabletki o zmodyfikowanym uwalnianiu Diclofenacum natricum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Diclac 75 Duo 75 mg, tabletki o zmodyfikowanym uwalnianiu Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Diclac 75 Duo 75 mg, tabletki o zmodyfikowanym uwalnianiu Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IBUPROM ŻEL, 50 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g żelu IBUPROM ŻEL zawiera: 5 g ibuprofenu (Ibuprofenum) Pełen wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IBUPROM ŻEL, 50 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g żelu IBUPROM ŻEL zawiera: 5 g ibuprofenu (Ibuprofenum) Pełen wykaz substancji
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DIKLONAT P, 10 mg/g, żel (Diclofenacum natricum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DIKLONAT P, 10 mg/g, żel (Diclofenacum natricum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Diklofenak LGO, 10 mg/g żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 10 mg diklofenaku sodowego (Diclofenacum natricum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Diklofenak LGO, 10 mg/g żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 10 mg diklofenaku sodowego (Diclofenacum natricum). Pełny
VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel
 VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel Wskazania do stosowania Voltaren MAX jest wskazany do stosowania u dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie
VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel Wskazania do stosowania Voltaren MAX jest wskazany do stosowania u dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum) - witaminy K 1.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Naklofen Duo, 75 mg, kapsułki o zmodyfikowanym uwalnianiu. (Diclofenacum natricum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Naklofen Duo, 75 mg, kapsułki o zmodyfikowanym uwalnianiu (Diclofenacum natricum) Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Naklofen Duo, 75 mg, kapsułki o zmodyfikowanym uwalnianiu (Diclofenacum natricum) Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Voltaren Express, 12,5 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna kapsułka miękka produktu leczniczego Voltaren Express
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Voltaren Express, 12,5 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna kapsułka miękka produktu leczniczego Voltaren Express
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 g żelu zawiera 50 mg ibuprofenu (Ibuprofenum) Substancje pomocnicze, patrz punkt 6.1.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NUROFEN, 50 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 g żelu zawiera 50 mg ibuprofenu (Ibuprofenum) Substancje pomocnicze,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NUROFEN, 50 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 g żelu zawiera 50 mg ibuprofenu (Ibuprofenum) Substancje pomocnicze,
ULOTKA DLA PACJENTA. Olfen 75 roztwór do wstrzykiwań, (37,5 mg + 10 mg)/ml (Diclofenacum natricum+ Lidocaini hydrochloridum)
 ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. Należy zwrócić się do lekarza lub farmaceuty,
ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. Należy zwrócić się do lekarza lub farmaceuty,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna tabletka dojelitowa zawiera 50 mg diklofenaku sodowego (Diclofenacum natricum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diclac 50, 50 mg, tabletki dojelitowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka dojelitowa zawiera 50 mg diklofenaku sodowego (Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diclac 50, 50 mg, tabletki dojelitowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka dojelitowa zawiera 50 mg diklofenaku sodowego (Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian (Butamirati citras).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
Należy skontaktować się z lekarzem po 7 dniach stosowania żelu w przypadku braku poprawy lub nasilenia się objawów chorobowych.
 VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel Wskazania do stosowania Voltaren MAX jest wskazany do stosowania u dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie
VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel Wskazania do stosowania Voltaren MAX jest wskazany do stosowania u dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Olfen 75 (37,5 mg + 10 mg)/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Jedna ampułka 2 ml zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Olfen 75 (37,5 mg + 10 mg)/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Jedna ampułka 2 ml zawiera
Stosowanie u dzieci Diklofenak Omega Pharma nie jest zalecany do stosowania u dzieci poniżej 12 lat.
 1. NAZWA PRODUKTU LECZNICZEGO Diklofenak Omega Pharma, 10 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 10 mg diklofenaku sodowego (Diclofenacum natricum). Substancja pomocnicza o znanym działaniu;
1. NAZWA PRODUKTU LECZNICZEGO Diklofenak Omega Pharma, 10 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 10 mg diklofenaku sodowego (Diclofenacum natricum). Substancja pomocnicza o znanym działaniu;
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO OPOKAN-KETO, 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg ketoprofenu (Ketoprofenum). Pełny wykaz substancji pomocniczych:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO OPOKAN-KETO, 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg ketoprofenu (Ketoprofenum). Pełny wykaz substancji pomocniczych:
Żel. Jednorodny, bezbarwny, przejrzysty żel o charakterystycznym zapachu alkoholu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VERAL, 10 mg/g (1%), żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 10 mg diklofenaku sodowego (Diclofenacum natricum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VERAL, 10 mg/g (1%), żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 10 mg diklofenaku sodowego (Diclofenacum natricum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Olfen 75 SR, 75 mg, tabletki powlekane o przedłużonym uwalnianiu
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Olfen 75 SR, 75 mg, tabletki powlekane o przedłużonym uwalnianiu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Olfen 75 SR,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Olfen 75 SR, 75 mg, tabletki powlekane o przedłużonym uwalnianiu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Olfen 75 SR,
CHARAKTERYSTYKAPRODUKTU LECZNICZEGO
 CHARAKTERYSTYKAPRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nabuton VP, 500 mg, tabletki. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 500 mg nabumetonu (Nabumetonum). Pełny wykaz substancji
CHARAKTERYSTYKAPRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nabuton VP, 500 mg, tabletki. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 500 mg nabumetonu (Nabumetonum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO PARACETAMOL HASCO, 80 mg, czopki PARACETAMOL HASCO, 125 mg, czopki PARACETAMOL HASCO, 250 mg, czopki PARACETAMOL HASCO, 500 mg,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO PARACETAMOL HASCO, 80 mg, czopki PARACETAMOL HASCO, 125 mg, czopki PARACETAMOL HASCO, 250 mg, czopki PARACETAMOL HASCO, 500 mg,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden czopek produktu leczniczego Voltaren zawiera 25 mg diklofenaku sodowego (Diclofenacum natricum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Voltaren 25 mg czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Jeden czopek produktu leczniczego Voltaren zawiera 25
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Voltaren 25 mg czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Jeden czopek produktu leczniczego Voltaren zawiera 25
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ULTRAFASTIN, 25 mg (2,5%) żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg (2,5%) soli lizynowej ketoprofenu (Ketoprofenum lysinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ULTRAFASTIN, 25 mg (2,5%) żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg (2,5%) soli lizynowej ketoprofenu (Ketoprofenum lysinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy (Lidocainum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NAPROXEN EMO, 100 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 100 mg naproksenu (Naproxenum) Zawiera również etylu parahydroksybenzoesan.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NAPROXEN EMO, 100 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 100 mg naproksenu (Naproxenum) Zawiera również etylu parahydroksybenzoesan.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego. Makrogol 3350.. 5,9 g w jednej saszetce.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 kapsułka twarda VENOTREX 300 mg kapsułki twarde zawiera 300 mg trokserutyny (o-βhydroksyetylorutozydy).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Ketoprofen Ziaja, 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg ketoprofenu (Ketoprofenum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Ketoprofen Ziaja, 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg ketoprofenu (Ketoprofenum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DIFADOL 0,1% 1 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera 1 mg diklofenaku sodowego (Diclofenacum natricum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DIFADOL 0,1% 1 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera 1 mg diklofenaku sodowego (Diclofenacum natricum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO BUTAPIRAZOL, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden czopek zawiera 250 mg fenylobutazonu (Phenylobutazonum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO BUTAPIRAZOL, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden czopek zawiera 250 mg fenylobutazonu (Phenylobutazonum). Pełny wykaz
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Etrixenal przeznaczone do wiadomości publicznej
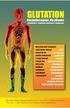 VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Etrixenal przeznaczone do wiadomości publicznej VI.2.1 Omówienie rozpowszechnienia choroby Ból stanowi sygnał, który uczy by unikać
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Etrixenal przeznaczone do wiadomości publicznej VI.2.1 Omówienie rozpowszechnienia choroby Ból stanowi sygnał, który uczy by unikać
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ketoprofen LGO, 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg ketoprofenu (Ketoprofenum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ketoprofen LGO, 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg ketoprofenu (Ketoprofenum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO BUTAPIRAZOL, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden czopek zawiera 250 mg fenylobutazonu (Phenylobutazonum.) Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO BUTAPIRAZOL, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden czopek zawiera 250 mg fenylobutazonu (Phenylobutazonum.) Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
ASPICAM 15 mg, tabletki
 Ulotka dołączona do opakowania: informacja dla użytkownika ASPICAM 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla użytkownika ASPICAM 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Voltaren 25 mg/ 1 ml roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji Diclofenacum natricum Należy uważnie zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla użytkownika Voltaren 25 mg/ 1 ml roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji Diclofenacum natricum Należy uważnie zapoznać się z treścią
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fastum 25 mg/g Żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g żelu zawiera 2,50 g ketoprofenu (Ketoprofenum) 3. POSTAĆ FARMACEUTYCZNA Żel 4.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fastum 25 mg/g Żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g żelu zawiera 2,50 g ketoprofenu (Ketoprofenum) 3. POSTAĆ FARMACEUTYCZNA Żel 4.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diclofenac GSK, 100 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 100 mg diklofenaku sodowego (Diclofenacum natricum) Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diclofenac GSK, 100 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 100 mg diklofenaku sodowego (Diclofenacum natricum) Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924 mg butamiratu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Dzieci Skuteczność i bezpieczeństwo stosowania ketoprofenu u dzieci poniżej 15 lat nie zostały ustalone.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Opokan-keto, 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg ketoprofenu (Ketoprofenum). Pełny wykaz substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Opokan-keto, 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 25 mg ketoprofenu (Ketoprofenum). Pełny wykaz substancji pomocniczych,
6,50 zł netto (7,02 zł brutto).
 Warszawa, dn. 2 kwietnia 2013 r. OFERTA SPECJALNA DLA SZPITALI NA ZAKUP LEKU: Aglan 15 mg x 60 tabl (Meloksykam) Szanowni Państwo, Z dniem 2.04.2013 r. Sanofi-Aventis Sp. z o.o. wprowadza ofertę specjalną
Warszawa, dn. 2 kwietnia 2013 r. OFERTA SPECJALNA DLA SZPITALI NA ZAKUP LEKU: Aglan 15 mg x 60 tabl (Meloksykam) Szanowni Państwo, Z dniem 2.04.2013 r. Sanofi-Aventis Sp. z o.o. wprowadza ofertę specjalną
Ulotka dołączona do opakowania: informacja dla pacjenta. Ibured żel, 50 mg/g (5%) Ibuprofenum
 Ulotka dołączona do opakowania: informacja dla pacjenta Ibured żel, 50 mg/g (5%) Ibuprofenum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta Ibured żel, 50 mg/g (5%) Ibuprofenum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancja pomocnicza o znanym działaniu: 1 ml roztworu zawiera 35 mg alkoholu benzylowego.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DIFADOL, 25 mg/ml, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DIFADOL, 25 mg/ml, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Dicloratio 50, 50 mg czopki Diclofenacum natricum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Dicloratio 50, 50 mg czopki Diclofenacum natricum Dicloratio 100, 100 mg czopki Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Dicloratio 50, 50 mg czopki Diclofenacum natricum Dicloratio 100, 100 mg czopki Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego
 C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
Występowanie działań niepożądanych można ograniczyć stosując lek w najmniejszej skutecznej dawce i nie dłużej niż to konieczne.
 ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FELOGEL NEO, 10 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 10 mg diklofenaku sodowego (Diclofenacum natricum). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FELOGEL NEO, 10 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 10 mg diklofenaku sodowego (Diclofenacum natricum). Substancje
Ibuprom RR 12 tabletek powlekanych
 Ibuprom RR 12 tabletek powlekanych cena: 8,90 PLN Opis słownikowy Czas dostawy Dawka Opakowanie Postać Producent Rejestracja Substancja czynna Zastosowanie 2-5 dni 400 mg 12 tabletek Tabletki USP lek ibuprofen
Ibuprom RR 12 tabletek powlekanych cena: 8,90 PLN Opis słownikowy Czas dostawy Dawka Opakowanie Postać Producent Rejestracja Substancja czynna Zastosowanie 2-5 dni 400 mg 12 tabletek Tabletki USP lek ibuprofen
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Crohnax, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 250 mg mesalazyny (Mesalazinum) Pełny wykaz substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Crohnax, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 250 mg mesalazyny (Mesalazinum) Pełny wykaz substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nurofen dla dzieci 60 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera: 60 mg ibuprofenu Pełny wykaz substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nurofen dla dzieci 60 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera: 60 mg ibuprofenu Pełny wykaz substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu (Butamirati citras).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu
Ulotka dla pacjenta. Olfen 25 25 mg, tabletki powlekane (Diclofenacum natricum)
 Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dicloberl 50 50 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: diklofenak sodowy. Każdy czopek zawiera 50 mg diklofenaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dicloberl 50 50 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: diklofenak sodowy. Każdy czopek zawiera 50 mg diklofenaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO LOCOID, 1 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jeden mililitr roztworu zawiera 1 mg 17-maślanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO LOCOID, 1 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jeden mililitr roztworu zawiera 1 mg 17-maślanu
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Ibufen Baby, 60 mg, czopki Ibuprofenum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Ibufen Baby, 60 mg, czopki Ibuprofenum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Ibufen Baby, 60 mg, czopki Ibuprofenum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Voltaren, 25 mg/1 ml, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Voltaren, 25 mg/1 ml, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna 3 ml ampułka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Voltaren, 25 mg/1 ml, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna 3 ml ampułka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Ketonal jest niesteroidowym lekiem przeciwzapalnym, działającym miejscowo przeciwbólowo i przeciwzapalnie.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ketonal, 25 mg/g (2,5%), żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy gram 2,5% żelu zawiera 25 mg ketoprofenu (Ketoprofenum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ketonal, 25 mg/g (2,5%), żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy gram 2,5% żelu zawiera 25 mg ketoprofenu (Ketoprofenum). Pełny wykaz
Dorośli 2 do 4 g na dobę w 2 lub 3 podzielonych dawkach (tj. od 4 do 8 tabletek na dobę).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EXACYL, 500 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera 500 mg kwasu traneksamowego (Acidum tranexamicum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EXACYL, 500 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera 500 mg kwasu traneksamowego (Acidum tranexamicum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Wyżej wymieniona tabletka zawiera 50 mg diklofenaku sodowego (Diclofenacum natricum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Majamil PPH, 50 mg, tabletki dojelitowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Wyżej wymieniona tabletka zawiera 50 mg diklofenaku sodowego (Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Majamil PPH, 50 mg, tabletki dojelitowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Wyżej wymieniona tabletka zawiera 50 mg diklofenaku sodowego (Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Paracetamol Sandoz, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 1000 mg paracetamolu (Paracetamolum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Paracetamol Sandoz, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 1000 mg paracetamolu (Paracetamolum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO CLARITINE ALLERGY 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg Loratadinum (loratadyny). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO CLARITINE ALLERGY 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg Loratadinum (loratadyny). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dicloberl retard, 100 mg, kapsułki o przedłużonym uwalnianiu, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: diklofenak sodowy.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dicloberl retard, 100 mg, kapsułki o przedłużonym uwalnianiu, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: diklofenak sodowy.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak miętowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 pastylka zawiera 3 mg benzydaminy chlorowodorku (Benzydamini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak miętowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 pastylka zawiera 3 mg benzydaminy chlorowodorku (Benzydamini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
Aneks III. Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta.
 Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
Ulotka dla pacjenta. 100 mg, kapsułki doodbytnicze. Diclofenacum natricum
 Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 090017ff80abaa4a 2.0,CURRENT Public Valid 1 5 DNO Strona 1 z 5 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO COMFORION VET 100 mgml roztwór do wstrzykiwań
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 090017ff80abaa4a 2.0,CURRENT Public Valid 1 5 DNO Strona 1 z 5 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO COMFORION VET 100 mgml roztwór do wstrzykiwań
